Хинолины и их терапевтическое применение
Номер патента: 17093
Опубликовано: 28.09.2012
Авторы: Финч Харри, Крамп Майкл Колин, Ариэнцо Роза, Маклеан Невилль, Монтана Джон Гари, Хайнд Джордж
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
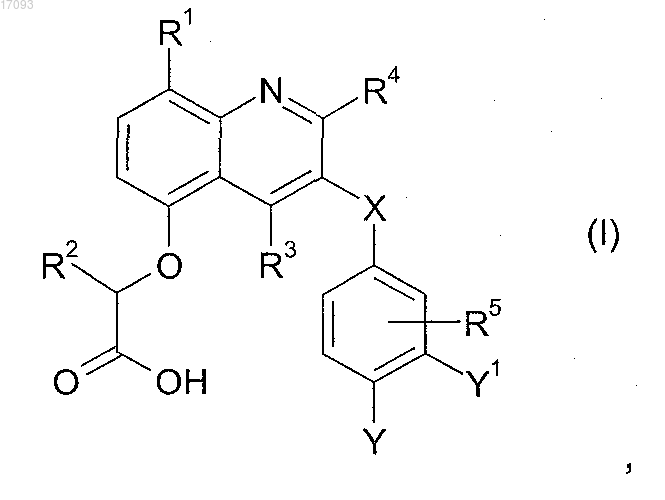
где R1 представляет собой атом фтора или хлора;
R2 представляет собой атом водорода;
R3 представляет собой метил;
R4 представляет собой этил, изопропил, метокси, дифторметокси или циклопропил;
R5 представляет собой атом водорода;
X представляет собой -СН2-;
Y1 представляет собой атом водорода и
Y представляет собой метокси; этилсульфониламино; ацетил; трет-бутилкарбонил; изопропилкарбонил; пиразолил, возможно замещенный одним радикалом, выбранным из хлора, изопропила и циклопропила; оксазол-2-ил, возможно замещенный циклопропилом; имидазолил, возможно замещенный метилом или изопропилом; тиазол-2-ил; пиримид-2-ил или 5-циклопропилизоксазол-2-ил.
2. Соединение по п.1, которое представляет собой [2-циклопропил-8-фтор-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусную кислоту или ее фармацевтически приемлемую соль.
3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 в смеси с фармацевтически приемлемым носителем или эксципиентом.
4. Применение соединения по любому из пп.1 и 2 в лечении состояний, чувствительных к модуляции активности рецептора CRTH2.
5. Применение по п.4, где указанное состояние выбрано из астмы, хронического обструктивного заболевания легких, ринита, аллергического синдрома дыхательных путей и аллергического ринобронхита.
6. Применение по п.4, где указанное состояние выбрано из псориаза, атопического и неатопического дерматитов, болезни Крона, язвенного колита и синдрома раздраженного кишечника.
7. Способ лечения состояний, чувствительных к модуляции активности рецептора CRTH2, включающий введение пациенту, имеющему такое заболевание, эффективного количества соединения по любому из пп.1 и 2.
8. Способ по п.7, где указанное состояние выбрано из астмы, хронического обструктивного заболевания легких, ринита, аллергического синдрома дыхательных путей и аллергического ринобронхита.
9. Способ по п.7, где указанное состояние выбрано из псориаза, атопического и неатопического дерматитов, болезни Крона, язвенного колита и синдрома раздраженного кишечника.
Текст
В изобретении представлены соединения формулы (I) где R1 представляет собой атом фтора или хлора; R2 представляет собой атом водорода; R3 представляет собой метил; R4 представляет собой этил, изопропил, метокси, дифторметокси или циклопропил; R5 представляет собой атом водорода; X представляет собой -СН 2-; Y1 представляет собой атом водорода и Y представляет собой метокси; этилсульфониламино; ацетил; трет-бутилкарбонил; изопропилкарбонил; пиразолил, возможно замещенный одним радикалом,выбранным из хлора, изопропила и циклопропила; оксазол-2-ил, возможно замещенный циклопропилом; имидазолил, возможно замещенный метилом или изопропилом; тиазол-2-ил; пиримид-2-ил или 5-циклопропилизоксазол-2-ил; которые являются лигандами CRTH2, полезными в лечении, например, астмы и ХОЗЛ. 017093 Область изобретения Данное изобретение относится к классу хинолиновых соединений, которые являются лигандами рецептора CRTH2 (Chemoattractant Receptor-homologous molecule expressed on T Helper cells type 2 (молекулы, гомологичной рецепторам хемоаттрактантов, экспрессируемой на Т-хелперных клетках типа 2, и их применению в лечении заболеваний, чувствительных к модуляции активности рецептора CRTH2,главным образом заболеваний, имеющих выраженный воспалительный компонент. Изобретение также относится к новым представителям этого класса лигандов и к фармацевтическим композициям, содержащим данные соединения. Предшествующий уровень техники Известно, что тучные клетки играют важную роль в аллергическом и иммунном ответах посредством высвобождения ряда медиаторов, таких как гистамин, лейкотриены, цитокины, простагландин D2 и т.д. (Воусе; Allergy Asthma Proc., 2004, 25, 27-30). Простагландин D2 (PGD2) является основным метаболитом, продуцируемым тучными клетками в ответ на стимуляцию аллергеном, где он синтезируется из арахидоновой кислоты под действием циклооксигеназы (Lewis et al. J. Immunol., 1982, 129, 1627-1631). Показано, что уровень PGD2 повышен у пациентов с системным мастоцитозом (Roberts N. Engl. J. Med.,1980, 303, 1400-1404), аллергическим ринитом (Naclerio et al. Am. Rev. Respir. Dis., 1983, 128, 597-602;Rev. Respir. Dis., 1990, 142, 126-132; Wenzel et al. J. Allergy Clin. Immunol., 1991, 87, 540-548) и крапивницей (Heavey et al. J. Allergy Clin. Immunol., 1986, 78, 458-461). Эффекты PGD2 опосредованы двумя рецепторами, рецептором PGD2 (или DP) (Boie et al. J. Biol. Chem., 1995, 270, 18910-18916) и молекулой,гомологичной рецепторам хемоаттрактантов, экспрессируемой на клетках Th2 (или CRTH2) (Nagata et al.J. Immunol., 1999, 162, 1278-1289; Powell; Prostaglandins Luekot. Essent. Fatty Acids, 2003, 69, 179-185). Поэтому было постулировано, что агенты, которые являются антагонистами рецепторов PGD2, могут оказывать благоприятное действие при некоторых болезненных состояниях. Показано, что рецептор CRTH2 экспрессируется на клетках, ассоциированных с аллергическим воспалением, таких как базофилы, эозинофилы и иммунные хелперные клетки Th2-типа (Hirai et al.; J.Exp. Med., 2001, 193, 255-261). Показано, что в этих типах клеток рецептор CRTH2 опосредует PGD2 опосредованную миграцию клеток (Hirai et al. J. Exp. Med., 2001, 193, 255-261), a также играет важную роль в рекрутинге нейтрофилов и эозинофилов согласно данным, полученным на модели контактного дерматита (Takeshita et al. Int. Immunol., 2004, 16, 947-959). Показано, что раматробан 3R)-3-[(4 фторфенил)сульфониламино]-1,2,3,4-тетрагидро-9 Н-карбазол-9-пропановая кислота), двойной антагонист рецептора CRTH2 и рецепторов тромбоксана А 2, ослабляет эти ответы (Sugimoto et al. J. Pharmacol.Exp. Ther, 2003, 305, 347-352; Takeshita et al. цитировано выше). Способность PGD2 усиливать аллергическое воспаление и вызывать воспалительную реакцию продемонстрирована в экспериментах на мышах и крысах. У трансгенных мышей со сверхэкспрессией PGD2-синтазы в ответ на стимуляцию аллергеном наблюдается усиление легочной эозинофилии и повышение уровня Th2-цитокинов (Fujitani et al. J. Immunol., 2002, 168, 443-449). Кроме того, экзогенно вводимые агонисты CRTH2 усиливают аллергическую реакцию у сенсибилизированных мышей (Spik et al. J. Immunol., 2005, 174, 3703-3708). У крыс экзогенно вводимые агонисты CRTH2 вызывают легочную эозинофилию, хотя агонист DP (BW 245C) или агонист ТР (рецептора тромбоксана) (I-ВОР) не оказывает никакого действия (Shirashi et al. J. Pharmacol. Exp.Ther., 2005, 312, 954-960). Эти наблюдения позволяют предположить, что антагонисты CRTH2 могут обладать ценными свойствами для лечения заболеваний, опосредованных PGD2. Кроме раматробана описан ряд других антагонистов CRTH2. Примеры таких антагонистов включают индолуксусные кислоты (WO 2007/065684; WO 2007/045867; WO 2006/034419; WO 2005/094816;WO 2005/018529; WO 2004/089885; WO 2004/089884) и фенилуксусные кислоты (WO 2004/058164). Хинолиновое ядро является основной частью структуры многих соединений, предлагаемых для использования в качестве лекарств. Однако соединения, к которым относится настоящее изобретение,имеют комбинацию заместителей на хинолиновом ядре, которая отличает их от конкретных известных лекарственных препаратов хинолинового ряда или известных обычно предлагаемых классов лекарственных препаратов хинолинового ряда.-1 017093 Подробное описание изобретения Соединение формулы (I) или его фармацевтически приемлем соль где R1 представляет собой атом фтора или хлора;R2 представляет собой атом водорода;R5 представляет собой атом водорода;Y1 представляет собой атом водорода иY представляет собой метокси; этилсульфониламино; ацетил; трет-бутилкарбонил; изопропилкарбонил; пиразолил, возможно замещенный одним радикалом, выбранным из хлора, изопропила и циклопропила; оксазол-2-ил, возможно замещенный циклопропилом; имидазолил, возможно замещенный метилом или изопропилом; тиазол-2-ил; пиримид-2-ил или 5-циклопропилизоксазол-2-ил, в частности [2 циклопропил-8-фтор-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота или е фармацевтически приемлемая соль. Соединения формулы (I), описанные выше, могут быть получены в форме солей, N-оксидов, гидратов и сольватов. В контексте данного описания, включая формулу изобретения, любая ссылка на "соединения, к которым относится изобретение" или на "соединения формулы (I)" и т.п. включает ссылку на соли, в особенности фармацевтически приемлемые соли, N-оксиды, гидраты и сольваты таких соединений. Соединения, к которым относится изобретение, являются антагонистами рецептора CRTH2 и обладают селективностью в отношении указанного рецептора по сравнению с рецептором DP. Второй аспект изобретения относится к (1) применению соединения формулы (I) в терапии; (2) к применению соединения формулы (I) в изготовлении лекарства для применения в лечении состояний,чувствительных к модуляции активности рецептора CRTH2, и (3) к способу лечения состояний, чувствительных к модуляции активности рецептора CRTH2, включающему введение пациенту, имеющему такое заболевание, эффективного количества соединения формулы (I), такого как определено выше. Примеры состояний, чувствительных к модуляции активности рецептора CRTH2, включают астму,ринит, аллергический синдром дыхательных путей, аллергический ринобронхит, бронхит, хроническое обструктивное заболевание легких (ХОЗЛ), полипоз носа, саркоидоз, аллергический альвеолит у сельскохозяйственных рабочих, пневмофиброз, кистозный фиброз, хронический кашель, конъюнктивит, атопический дерматит, болезнь Альцгеймера, боковой амиотрофический склероз, синдром деменции при СПИДе, болезнь Гентингтона, лобно-височную деменцию, болезнь диффузных телец Леви, сосудистую деменцию, синдром Гийена-Барре, хроническую демиелинизирующую полирадикулонейропатию, мультифокальную двигательную невропатию, плексопатию, рассеянный склероз, энцефаломиелит, панэнцефалит, дегенерацию мозжечка и энцефаломиелит, травму ЦНС (центральной нервной системы), мигрень,инсульт, ревматоидный артрит, анкилозирующий спондилоартрит, болезнь Бехчета, бурсит, синдром карпального канала, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, дерматомиозит, синдром Элерса-Данлоса, фибромиалгию, миофасциальную боль, остеоартрит (ОА), остеонекроз, псориатический артрит, синдром Рейтера (реактивный артрит), саркоидоз, склеродермию, синдром Шегрена, заболевание мягких тканей, болезнь Стилла, тендинит, узелковый полиартериит, гранулематоз Вегенера, миозит (полимиозит, дерматомиозит), подагру, атеросклероз, красную волчанку, системную эритематозную волчанку (SLE), диабет типа I, нефритический синдром, гломерулонефрит, острую и хроническую почечную недостаточность, эозинофильный фасцит, гипер-IgE-синдром, сепсис, септический шок, ишемическое реперфузионное повреждение сердца, отторжение аллотрансплантата после трансплантаций и реакцию "трансплантант против хозяина". Однако, в первую очередь, соединения, к которым относится изобретение, являются полезными в лечении астмы, хронического обструктивного заболевания легких, ринита, аллергического синдрома дыхательных путей или аллергического ринобронхита. К другим конкретным состояниям, при которых соединения по настоящему изобретению могут являться особенно полезными, относятся псориаз, атопический и неатопический дерматит, болезнь Крона, язвенный колит и синдром раздраженного кишечника. Третий аспект изобретения относится к фармацевтической композиции, содержащей соединение формулы (I) в смеси с фармацевтически приемлемым носителем или эксципиентом.-2 017093 Терминология В контексте данного описания термин "(Ca-Cb)алкил", где а и b представляют собой целые числа,относится к алкильному радикалу с нормальной или разветвленной цепью, имеющему от а до b атомов углерода. Соответственно, когда, например, а представляет собой 1 и b представляет собой 6, термин включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и нгексил. В контексте данного описания термин "карбоциклический" относится к возможно замещенному моно-, би- или трициклическому радикалу, имеющему до 16 кольцевых атомов, все из которых являются атомами углерода, и включает арил и циклоалкил. В контексте данного описания термин "циклоалкил" относится к возможно замещенному моноциклическому насыщенному карбоциклическому радикалу, имеющему 3-6 атомов углерода, и включает,например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. В контексте данного описания неуточненный термин "арил" относится к возможно замещенному моно-, би- или трициклическому карбоциклическому ароматическому радикалу и включает радикалы,имеющие два моноциклических карбоциклических ароматических кольца, которые напрямую соединены посредством ковалентной связи. Арильные радикалы могут иметь, например, от 6 до 14 кольцевых атомов углерода, предпочтительно от 6 до 10 атомов углерода. Примерами арильных радикалов являются фенил, бифенил и нафтил. В контексте данного описания неуточненный термин "гетероарил" относится к возможно замещенному моно-, би- или трициклическому ароматическому радикалу, содержащему один или более чем один гетероатом, выбранный из S, N и О, и включает радикалы, имеющие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые напрямую соединены посредством ковалентной связи. Примерами таких радикалов являются тиенил, бензтиенил,фурил, бензфурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензтиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиридазинил,триазинил, индолил и индазолил. В контексте данного описания неуточненный термин "гетероциклоалкил", или "гетероциклил", или"гетероциклический" включает "гетероарил", такой как определено выше, и, кроме того, означает возможно замещенный моно-, би- или трициклический неароматический радикал, содержащий один или более чем один гетероатом, выбранный из S, N и О, и группы, состоящие из моноциклического неароматического радикала, содержащего один или более таких гетероатомов, который ковалентно связан с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Примерами таких радикалов являются пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил,тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил,хинолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидо- и сукцинимидогруппы. Если из контекста не следует иное, термин "замещенный" применительно к любой группировке в данном описании означает имеющий до четырех совместимых заместителей, каждый из которых независимо может представлять собой, например, (С 1-С 6)алкил, циклоалкил, (С 1-С 6)алкокси, гидрокси, гидрокси(С 1-С 6)алкил, меркапто, меркапто(С 1-С 6)алкил, (С 1-С 6)алкилтио, фенил, моноциклический гетероарил,имеющий 5 или 6 кольцевых атомов, галогено (включая фтор, бром и хлор), трифторметил, трифторметокси, нитро, нитрил (-CN), оксо, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA,-SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB,-NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NRBSO2ORA, -NHCONH2, -NRACONH2,-NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (С 1-С 6)алкил, (С 3-С 6)циклоалкил, фенил или моноциклическую гетероциклическую группу,имеющую 5 или 6 кольцевых атомов, или RA и RB, когда они присоединены к одному атому азота, могут образовывать вместе с этим атомом азота кольцо, имеющее 5 или 6 кольцевых атомов, возможно содержащее дополнительный гетероатом, выбранный из N, О или S (примеры включают морфолинил, пиперидинил, пиперизинил, 4-метилпиперизинил и тетрагидропирролил). "Возможный заместитель" может представлять собой одну из вышеупомянутых замещающих групп. В контексте данного описания термин "соль" включает соли присоединения оснований, соли присоединения кислот и четвертичные соли. Соединения по изобретению, которые являются кислотами,могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов (например, гидроксиды натрия и калия), гидроксиды щелочно-земельных металлов (например, гидроксиды кальция, бария и магния); с органическими основаниями, например сN-метил-D-глюкамином, холин трис-(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином, дибензиламином и т.п. Конкретные соли с основаниями включают соли бензатина, кальция, диоламина, меглумина, оламина, калия, прокаина, натрия, трометамина и цинка. Соединения по изобретению, которые являются основаниями, могут образовывать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например с галогенводородными кислотами, такими как-3 017093 соляная или бромисто-водородная кислота, с серной кислотой, азотной кислотой или фосфорной кислотой и т.п., и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, пара-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и т.п. Если соединение содержит группу четвертичного аммония, приемлемыми противоионами могут являться, например, хлориды, бромиды, сульфаты, метансульфонаты, бензолсульфонаты, толуолсульфонаты (тозилаты), нападизилаты(2 гидроксиэтилсульфонаты), фосфаты, ацетаты, цитраты, лактаты, тартраты, мезилаты, малеаты, малаты,фумараты, сукцинаты, ксинафоаты, пара-ацетамидобензоаты и т.п.; и количество групп четвертичного аммония в данной фармацевтически приемлемой соли таково, что соединение в целом не заряжено. Соли рассматриваются в "Handbook of Pharmaceutical Salts. Properties, selection and use", P. HeinrichStahlCamille G. Wermuth, Wiley-VCH, 2002. Соединения, к которым относится изобретение, могут существовать в одной или более чем одной стереоизомерной форме из-за присутствия асимметрических атомов или ограничений на вращение вокруг связей, и в таких случаях может существовать ряд стереоизомеров с R- или S-стереохимией при каждом хиральном центре или атропоизомеров с R- или S-стереохимией при каждой хиральной оси. Изобретение включает все такие энантиомеры и диастереоизомеры и их смеси. Соединения по изобретению в подходящих случаях могут быть введены в форме пролекарств, таких как сложные эфиры соединений, к которым относится изобретение. Термин "пролекарство" означает соединение, которое превращается in vivo в результате обмена веществ (например, путем гидролиза, восстановления или окисления) в соединение формулы (I). Например, если пролекарством является сложный эфир соединения формулы (I), он может быть превращен в исходную молекулу в результате гидролиза in vivo. Подходящими сложными эфирами соединений формулы (I) являются, например, ацетаты,цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бисгидроксинафтоаты, гентизаты, изетионаты, ди-пара-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты, циклогексилсульфаматы и хинаты. Примеры использования сложных эфиров в качестве пролекарств описаны в работе F.J. Leinweber,Drug Metab. Res., 1987, 18, 379. В контексте данного описания подразумевается, что ссылки на соединения формулы (I) также включают указанные пролекарственные формы. Конкретные соединения, к которым относится изобретение, включают соединения, приведенные в данном описании в разделе "Примеры", и их фармацевтически приемлемые соли, N-оксиды, гидраты или сольваты. Композиции Как отмечалось выше, соединения, к которым относится изобретение, являются антагонистами рецептора CRTH2 и полезны в лечении заболеваний, при которых такая модуляция оказывает благоприятное действие. Примеры таких заболеваний приведены выше и включают астму, ХОЗЛ, ринит, аллергический синдром дыхательных путей и бронхит. Обычно подразумевается, что конкретный уровень дозы для каждого конкретного пациента определяется рядом факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, путь введения, скорость выведения, комбинацию лекарств и тяжесть конкретного заболевания, подлежащего лечению. Оптимальные уровни дозы и частоту введения обычно определяют в ходе клинического испытания, как это требуется в области фармацевтики. В общем случае, суточная доза при однократном или многократном введении находится в диапазоне от приблизительно 0,001 до приблизительно 100 мг на 1 кг массы тела млекопитающего, часто от 0,01 до приблизительно 50 мг на 1 кг, например от 0,1 до 10 мг на 1 кг. С другой стороны, в некоторых случаях может потребоваться использование других дозировок. Соединения по изобретению могут быть приготовлены в виде препарата для введения любым путем, соответствующим их фармакокинетическим свойствам. Композиции для перорального введения могут находиться в форме таблеток, капсул, порошков, гранул, лепешек, жидких или гелевых препаратов, таких как растворы или суспензии для перорального и местного введения или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального введения могут находиться в стандартной лекарственной форме и могут содержать стандартные эксципиенты, такие как связующие агенты, например сироп, гуммиарабик, желатин, сорбит, трагакант или поливинил-пирролидон; наполнители, например лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающие вещества для изготовления таблеток, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал, или приемлемые увлажняющие агенты,такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой с использованием методик,хорошо известных в обычной фармацевтической практике. Пероральные жидкие препараты могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут представлять собой сухой продукт, который перед использованием необходимо перерастворить в воде или другом подходящем носителе. Такие жидкие препараты могут содержать стандартные-4 017093 вспомогательные вещества, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, крахмальная патока, желатин, гидрогенизированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитанмоиоолеат или гуммиарабик; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, сложные эфиры масел(такие как сложные эфиры на основе глицерина), пропиленгликоль или этиловый спирт; консерванты,например метиловый или пропиловый эфир пара-гидроксибензойной кислоты или сорбиновая кислота, и при желании стандартные корригенты или окрашивающие агенты. Лекарство для местного введения путем нанесения на кожу может быть приготовлено в форме крема, лосьона или мази. Препараты в форме крема или мази, которые могут быть использованы в качестве лекарства, представляют собой стандартные препараты, которые хорошо известны в данной области техники, например описаны в базовых руководствах по фармацевтике, таких как Британская Фармакопея. Лекарство также может быть приготовлено в виде препарата для ингаляции, например в форме назального спрея или порошкового или аэрозольного ингалятора. Предпочтительно, чтобы при доставке путем ингаляции активное соединение находилось в форме микрочастиц, которые могут быть получены с использованием ряда методик, включая сушку распылением, лиофилизацию и микронизацию. Для генерации аэрозоля могут быть использованы, например, компрессионные струйные ингаляторы или ультразвуковые ингаляторы, предпочтительно использовать дозирующие аэрозольные ингаляторы на пропелленте или вводить микронизированные активные соединения без использования пропеллента, например из ингаляционных капсул или других систем доставки "сухого порошка". Активный ингредиент также может быть приготовлен в виде стерильного парентерального препарата. В зависимости от используемого носителя и концентрации лекарство может быть либо суспендировано, либо растворено в носителе. Предпочтительно в носителе могут быть растворены адъюванты, такие как анестезирующий агент местного действия, консервант и буферный агент. Для предупреждения и лечения заболеваний, опосредованных простагландинами, в комбинации с соединениями по изобретению формулы (I) могут быть использованы другие соединения. Соответственно настоящее изобретение также относится к фармацевтическим композициям для предупреждения и лечения PGD2-опосредованных заболеваний, содержащим терапевтически эффективное количество соединения по изобретению формулы (I) и один или более чем один другой терапевтический агент. Терапевтические агенты, подходящие для использования в комбинированной терапии вместе с соединениями формулы (I), включают (1) кортикостероиды, такие как флутиказон, циклезонид или будесонид; (2) агонисты 2-адренорецептора, такие как салметерол, индакатерол или формотерол; (3) модуляторы лейкотриенов, например антагонисты лейкотриенов, такие как монтелукаст, зафируласт (zafirulast) или пранлукаст, или ингибиторы биосинтеза лейкотриенов, такие как зилейтон или BAY-1005; (4) антихолинергические агенты, например антагонисты мускаринового рецептора М 3, такие как тиотропия бромид; (5) ингибиторы фосфодиэстеразы IV (PDE-IV), такие как рофлумиласт или циломиласт; (6) антигистаминные средства, например селективные антагонисты гистаминового рецептора Н 1, такие как фексофенадин, цитиризин (citirizin), лоратадин или астемизол; (7) противокашлевые агенты, такие как кодеин или декстраморфан (dextramorphan); (8) неселективные ингибиторы СОХ-1/СОХ-2 (циклооксигеназы 1/циклооксигеназы 2), такие как ибупрофен или кетопрофен; (9) ингибиторы СОХ-2, такие как целекоксиб и рофекоксиб; (10) антагонисты VLA-4 (очень позднего антигена-4), такие как антагонисты VLA-4,описанные в WO 97/03094 и WO 97/02289; (11) ингибиторы ТАСЕ (TNFпревращающего фермента) и ингибиторы TNF- (фактора некроза опухоли ), например моноклональные антитела против TNF, такие как Remicade и CDP-870, и рекомбинантные белки молекулы иммуноглобулина и рецептора TNF, такие как Enbrel; (12) ингибиторы матриксной металлопротеиназы, например матриксной металлопротеиназы ММР 12; (13) ингибиторы эластазы нейтрофилов человека, такие как ингибиторы, описанные в WO 2005/026124, WO 2003/053930 и WO 06/082412; (14) агонисты аденозинового рецептора А 2 а, такие как агонисты, описанные в ЕР 1052264 и ЕР 1241176; (15) антагонисты аденозинового рецептора А 2b, такие как антагонисты, описанные в WO 2002/42298; (16) модуляторы функции рецепторов хемокинов, например антагонисты рецепторов CCR3 и CCR8; (17) соединения, которые модулируют действие других простаноидных рецепторов, например антагонист рецептора DP или антагонист тромбоксана А 2; и (18) агенты, которые модулируют функцию Th2, такие как агонисты PPAR (рецепторов активатора пролиферации пероксисом), но не ограничены ими. Массовое соотношение соединения по изобретению и второго активного ингредиента может изменяться и обычно зависит от эффективной дозы каждогоингредиента. Обычно следует использовать эффективную дозу каждого из ингредиентов. Методики синтеза Настоящее изобретение также относится к способам получения соединений по данному изобретению. Соединения формулы (I) по настоящему изобретению могут быть получены в соответствии с методиками, приведенными на схемах и в примерах, с использованием подходящих веществ, и дополнительно проиллюстрированы конкретными примерами. Кроме того, с использованием методик, описанных в-5 017093 изобретении, средний специалист в данной области техники может легко получить дополнительные соединения по настоящему изобретению, заявленные в формуле изобретения. Однако соединения, приведенные в качестве примеров, не должны быть истолкованы как единственные представители класса соединений, заявляемых в настоящем изобретении. Данные примеры дополнительно иллюстрируют детали получения соединений по настоящему изобретению. Специалистам в данной области техники совершенно понятно, что для получения этих соединений в нижеприведенных методиках могут быть использованы другие известные условия и пути синтеза. Соединения по изобретению формулы [Ia] могут быть легко получены путем взаимодействия промежуточного соединения формулы [II] и подходящего алкилирующего агента формулы [III], где группаLG представляет собой подходящую уходящую группу (например, атом хлора, атом брома или метансульфонилокси) и R9 представляет собой атом водорода или алкильную группу. Обычно реакцию алкилирования проводят в присутствии основания (например, карбоната калия) в инертном растворителе (например, в ацетоне или N,N-диметилформамиде). Необходимо понимать, что если данную реакцию выполняют с использованием защищенной формы соединения [III], для получения желаемого соединения по изобретению формулы [Ia] потребуется выполнить стадию снятия соответствующей защитной группы Промежуточные соединения формулы [II] могут быть получены путем взаимодействия аминофенола формулы [IV] и 1,3-дикарбонильного соединения формулы [V]. Данная реакция может быть выполнена в присутствии подходящего дегидратирующего агента, такого как полифосфорная кислота, паратолуолсульфоновая кислота или метансульфоновая кислота, или без дегидратирующего агента. Промежуточные соединения формул [III], [IV] и [V] имеются в продаже или могут быть получены с помощью известных методик. Альтернативно, промежуточные соединения формулы [II], где R4 представляет собой алкильную группу, такую как изопропил или циклопропил, могут быть получены из промежуточных соединений формулы [VI], где Т представляет собой атом хлора, брома или йода или трифторметансульфонилоксигруппу, в результате взаимодействия с металлоорганическим реагентом формулы [VII], где В представляет собой подходящую замещенную атомом бора, цинка или олова группу (схема 2). Данная реакция может быть легко осуществлена в присутствии подходящего катализатора, такого как тетракис(трифенилфосфин)палладий. Соединения формулы [VII] имеются в продаже или могут быть получены с помощью известных методик. Промежуточные соединения формулы [VI], где Т представляет собой атом хлора, могут быть получены путем обработки соединений формулы [VIII] оксихлоридом фосфора. Промежуточные соединения формулы [VIII] могут быть получены из соединений формулы [IX]. Данная реакция может быть выполнена в присутствии подходящего дегидратирующего агента, например метансульфоновой кислоты или пара-толуолсульфоновой кислоты. Промежуточные соединения формулы [IX] могут быть получены путем взаимодействия аминофенолов формулы [IV] с -кетотиоэфирами формулы [X] в присутствии трифторацетата серебра. Соединения формулы [X] известны или могут быть получены из известных соединений в соответствии с методиками, известными специалистам в данной области техники. Соединения формулы [Ia], где R4 представляет собой алкоксигруппу, такую как дифторметокси, могут быть легко получены из промежуточных соединений формулы [XI] путем алкилирования хлордифторметаном (схема 3). Необходимо понимать, что если данную реакцию выполняют с использованием защищенной формы промежуточного соединения [XI], для получения желаемого соединения [Ia] потребуется выполнить стадию снятия соответствующей защитной группы. Схема 3 Промежуточные соединения формулы [XI] могут быть получены из соединений формулы [III] и[VIII] с использованием описанных выше методик получения соединений формулы [Ia] из промежуточных соединений формулы [II] (схема 1). Соединения формулы [Ia], где R3 представляет собой алкоксигруппу, такую как дифторметокси, могут быть легко получены путем взаимодействия анилина формулы [XIV] и -кетоэфира формулы [XIII],где R10 представляет собой подходящую алкильную группу, такую как метил и этил, с последующим алкилированием хлордифторметаном (схема 4). Необходимо понимать, что если данную реакцию выполняют с использованием защищенной формы промежуточного соединения [XIV], для получения желаемого соединения [Ia] потребуется выполнить стадию снятия соответствующей защитной группы. Промежуточные соединения формулы [XIV] могут быть получены из соединений формулы [IV] с использованием описанных выше методик получения соединений формулы [Ia] из промежуточных соединений формулы [II] (схема 1). Кетоэфиры формулы [XIII] известны или могут быть получены из известных соединений в соответствии с методиками, известными специалистам в данной области техники. Схема 5 Альтернативно, соединение формулы [Ia], где Y или Y1 представляет собой гетероциклическую группу, могут быть легко получены из соединений формулы [Ia], где Y или Y1 представляет собой атом хлора, брома или йода или трифторметансульфонилоксигруппу, в результате взаимодействия с металлоорганическим реагентом формулы [XV], где Het представляет собой 5- или 6-членное гетероарильное кольцо и М представляет собой подходящую замещенную атомом бора, цинка, олова, меда или кремния группу (схема 5). Данная реакция может быть легко осуществлена в присутствии подходящего катализатора, такого как палладиевое соединение (например, тетракис(трифенилфосфин)палладий или [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий). Примеры Далее изобретение описано с помощью примеров. Следует понимать, что приведенные примеры только иллюстрируют изобретение и могут быть сделаны различные модификации, не выходя за пределы объема изобретения. Спектры 1 Н ЯМР записывали при температуре окружающей среды с использованием спектрометраVarian Unity Inova (400 МГц), оснащенного 5-мм датчиком тройного резонанса. Химические сдвиги выражены в млн-1 относительно тетраметилсилана. Использованы следующие сокращения: br s = широкий синглет, s = синглет, d = дублет, dd = двойной дуплет, t = триплет, q = квартет, m = мультиплет. Эксперименты по определению время удержания и значения массы/заряд соответствующего иона выполняли с использованием масс-спектрометрии (ЖХ/МС) в соответствии со следующими методиками. Методика А: эксперименты выполняли на спектрометре Micromass Platform LCT с электрораспылением в режиме положительных ионов и регистрацией на одной длине волны 254 нм (УФ-диапазон) с использованием колонки Higgins Clipeus C18 (5 мкм, 1003,0 мм) и скорости потока 2 мл/мин. Исходная система растворителей: 95% воды, содержащей 0,1% муравьиную кислоту (растворитель А), и 5% ацетонитрила, содержащего 0,1% муравьиную кислоту (растворитель Б), в течение 1 мин, затем градиент до 5% растворителя А и 95% растворителя Б в течение 14 мин. Конечную концентрацию растворителей поддерживали постоянной еще в течение 2 мин. Методика Б: эксперименты выполняли на спектрометре Micromass Platform LC с электрораспылением в режиме положительных и отрицательных ионов и регистрацией на ELS (испарительном детекторе светорассеяния)/диодно-матричном детекторе, с использованием колонки Phenomenex Luna C18(2)(304,6 мм) и скорости потока 2 мл/мин. Система растворителей: 95% растворителя А и 5% растворителя Б в течение 0,50 мин, затем градиент до 5% растворителя А и 95% растворителя Б в течение 4 мин. Конечную концентрацию растворителей поддерживали постоянной еще в течение 0,50 мин. Эксперименты, включающие микроволновый нагрев, выполняли с использованием Personal Chemis-8 017093try Smith Synthesizer, в котором использованы технологии Single-Mode Resonator и Dynamic Field Tuning, обеспечивающие воспроизводимость результатов и контроль. Данный прибор позволяет использовать температуру в диапазоне 40-250C и давление до 20 бар. Для данного процессора имеется два типа пробирок 0,5-2,0 и 2,0-5,0 мл. Очистку путем обратнофазовой препаративной ЖХВД (жидкостной хроматографии высокого давления) выполняли на колонках длиной 10 см и внутренним диаметром 2 см, где в качестве стационарной фазы использовали С 18-связанный силикагель Genesis с диаметром частиц 7 мкм. В качестве подвижной фазы использовали смесь ацетонитрила и воды (забуференных 0,1% об./об. трифторуксусной кислотой или муравьиной кислотой) при скорости потока 10 мл в 1 мин, типичные градиенты концентрации органического компонента составляли (40-90%) в течение 30-40 мин. Фракции, содержащие желаемый продукт (идентифицируемый путем ЖХ-МС-анализа), объединяли, органическую фракцию удаляли путем выпаривания и оставшуюся водную фракцию лиофилизировали с получением конечного продукта. Пример 1. [4-Дифторметокси-2-этил-8-фтор-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 1 а. (3-Амино-4-фторфенокси)уксусной кислоты метиловый эфир. К перемешиваемой суспензии гидрида натрия (60% в масле, 0,94 г) в N,N-диметилформамиде (30 мл) при 0 С добавляли 3-амино-4-фторфенол (3,0 г) и полученную смесь нагревали до комнатной температуры в течение 15 мин. Смесь охлаждали до 0 С, обрабатывали бромуксусной кислоты метиловым эфиром (3,3 г) и затем перемешивали при комнатной температуре в течение 2 ч. Данную смесь обрабатывали разбавленным водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и удаляли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь толуола, дихлорметана и этилацетата (2:1:0,0:1:0-0:20:1 по объему), с получением указанного в заголовке соединения (2,7 г). 1 Н ЯМР (ДМСО-d6):3.70 (s, 3H), 4.65 (s, 2H), 5.15 (br s, 2H), 6.00 (dt, J=3.1, 8.8 Гц, 1 Н), 6.30 (dd,J=3.1, 7.6 Гц, 1 Н), 6.85 (dd, J=8.8, 11.2 Гц, 1 Н). МС: ИЭР (+ve) (масс-спектрометрия с ионизацией электрораспылением в режиме положительных ионов) (методика Б): 200 (М+Н)+. Время удержания 2,5 мин. Подготовительный пример 1 б. 3-Оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этиловый эфир. Суспензию трет-бутилата калия (0,57 г) в тетрагидрофуране (40 мл) при 0 С обрабатывали смесью трет-бутанола (2,0 мл) и 3-оксопентановой кислоты этилового эфира (0,73 мл) и полученную смесь перемешивали при 0 С в течение 45 мин. Затем смесь обрабатывали раствором 1-(4-бромметилфенил)-1 Нпиразола (1,0 г) в тетрагидрофуране (10 мл) и перемешивали при 0 С в течение 2 ч. Данную смесь разбавляли водой, концентрировали до минимального объема при пониженном давлении и остаток экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата, с получением указанного в заголовке соединения в виде бледно-желтого масла (0,63 г). МС: ИЭР (+ve) (методика Б): 301 (М+Н)+. Время удержания 3,3 мин. Подготовительный пример 1 в.[2-Этил-8-фтор-4-оксо-3-(4-пиразол-1-илбензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. К полифосфорной кислоте (3 г) при 100 С добавляли раствор (3-амино-4-фторфенокси)уксусной кислоты метилового эфира (0,42 г) и 3-оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этилового эфира (0,63 г) в 1,4-диоксане (20 мл) и полученную смесь перемешивали при 120 С в течение 18 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата, с получением указанного в заголовке соединения (0,39 г). МС: ИЭР (+ve) (методика Б): 435 (М+Н)+. Время удержания 2,9 мин. Подготовительный пример 1 г. [4-Дифторметокси-2-этил-8-фтор-3-(4-пиразол-1-илбензил)хинолин 5-илокси]уксусной кислоты метиловый эфир. Смесь [2-этил-8-фтор-4-оксо-3-(4-пиразол-1-илбензил)-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,37 г), N,N-диметилформамида (10 мл), карбоната калия (0,18 г) и уксусной-9 017093 кислоты хлордифторметилового эфира (0,27 мл) перемешивали при 80C в течение 6 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата, с получением указанного в заголовке соединения (0,19 г). МС: ИЭР (+ve) (методика Б): 486 (М+Н)+. Время удержания 3,7 мин. Подготовительный пример 1 д. [4-Дифторметокси-2-этил-8-фтор-3-(4-пиразол-1-илбензил)хинолин 5-илокси]уксусная кислота. Раствор [4-дифторметокси-2-этил-8-фтор-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,19 г) в тетрагидрофуране (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида литая (0,78 мл) и полученный раствор перемешивали при комнатной температуре в течение 1 ч. Тетрагидрофуран удаляли при пониженном давлении и остаток подкисляли путем добавления 0,1 М водного раствора соляной кислоты. Данную смесь экстрагировали этилацетатом, объединенные экстракты промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (0,18 г). 1 Н ЯМР (CDCl3):1.25 (t, J=7.5 Гц, 3 Н), 2.90 (q, J=7.5 Гц, 2 Н), 4.40 (s, 2H), 4.80 (s, 2 Н), 6.40 (m, 1 Н),6.75 (dd, J=3.5, 8.8 Гц, 1 Н), 6.85 (t, J=75 Гц, 1 Н), 7.15 (d, J=8.6 Гц, 2 Н), 7.25 (t, J=8.8 Гц, 1 Н), 7.50 (d, J=8.6 Гц, 2 Н), 7.70 (d, J=2.0 Гц, 1 Н), 7.85 (d, J=2.0 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 472 (М+Н)+. Время удержания 11,1 мин. МС: ИЭР (+ve) (методика Б): 472 (М+Н)+. Время удержания 3,3 мин. Пример 2. [4-Дифторметокси-2-этил-8-фтор-3-(4-оксазол-2-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 2 а. 2-(4-Бромбензил)-3-оксопентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 б, с использованием 3-оксопентановой кислоты этилового эфира и 1-бром-4 бромметилбензола. 1 Н ЯМР (CDCl3):1.05 (t, J=7.3 Гц, 3 Н), 1.25 (t, J=7.1 Гц, 3 Н), 2.35 (m, 1H), 2.60 (m, 1 Н), 3.10 (m,2 Н), 3.75 (t, J=7.6 Гц, 1 Н), 4.15 (m, 2 Н), 7.05 (d, J=8.5 Гц, 2 Н), 7.40 (d, J=8.5 Гц, 2 Н). Подготовительный пример 2 б. [3-(4-Бромбензил)-2-этил-8-фтор-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-фторфенокси)уксусной кислоты метилового эфира и 2-(4-бромбензил)-3-оксопентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 448 (М+Н)+. Время удержания 3,2 мин. Подготовительный пример 2 в. [3-(4-Бромбензил)-4-дифторметокси-2-этил-8-фторхинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 г, с использованием [3-(4-бромбензил)-2-этил-8-фтор-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метилового эфира и уксусной кислоты хлордифторметилового эфира. МС: ИЭР (+ve) (методика Б): 498 (М+Н)+. Время удержания 4,1 мин. Подготовительный пример 2 г. [4-Дифторметокси-2-этил-8-фтор-3-(4-оксазол-2-илбензил)хинолин 5-илокси]уксусной кислоты метиловый эфир. Смесь [3-(4-бромбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,36 г), 2-трибутилстаннанилоксазола (0,46 мл), тетракис(трифенилфосфин)палладия (0)(0,084 г) и 1,4-диоксана (3,0 мл) нагревали при 100 С в течение 3 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водой и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде желтой смолы (1,1 г). МС: ИЭР (+ve) (методика Б): 487 (М+Н)+. Время удержания 3,8 мин. Подготовительный пример 2 д. [4-Дифторметокси-2-этил-8-фтор-3-(4-оксазол-2-илбензил)хинолин 5-илокси]уксусная кислота. Раствор [4-дифторметокси-2-этил-8-фтор-3-(4-оксазол-2-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,73 г) в метаноле (6,0 мл) и воде (0,6 мл) обрабатывали 5,0 М водным раство- 10017093 ром гидроксида лития (0,30 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, концентрировали при пониженном давлении и остаток распределяли между этилацетатом и водой. Органическую фазу сушили над сульфатом магния, концентрировали при пониженном давлении и затем разбавляли ацетонитрилом. Образовавшийся осадок удаляли путем фильтрации, промывали ацетонитрилом и полученный фильтрат концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь дихлорметана, метанола и ледяной уксусной кислоты(50:1:1-10:1:1 по объему). В результате дополнительной очистки путем препаративной обратнофазовой ЖХВД и последующей колоночной хроматографии на силикагеле с использованием для элюирования смеси дихлорметана, метанола и ледяной уксусной кислоты (40:1:0,1-20:1:0,1 по объему) получали указанное в заголовке соединение в виде белого твердого вещества (0,082 г). 1 Н ЯМР (ДМСО-d6):1.15 (t, J=7.5 Гц, 3 Н), 2.80 (q, J=7.5 Гц, 2 Н), 4.35 (s, 2 Н), 4.85 (s, 2 Н), 7.00 (dd,J=3.7, 5.2 Гц, 1 Н), 7.20 (d, J=8.5 Гц, 2 Н), 7.25 (t, J=75 Гц, 1 Н), 7.30 (s, 1 Н), 7.50 (dd, J=8.9, 10.1 Гц, 1 Н),7.85 (d, J=8.5 Гц, 2 Н), 8.15 (s, 1 Н). МС: ИЭР (+ve) (методика А): 473 (М+Н)+. Время удержания 10,9 мин. МС: ИЭР (+ve) (методика Б): 473 (М+Н)+. Время удержания 3,2 мин. Пример 3. [4-Дифторметокси-2-этил-8-фтор-3-(4-метоксибензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 3 а. 2-(4-Метоксибензил)-3-оксопентановой кислоты этиловый эфир. Смесь трет-бутилата калия (5,4 г), тетрагидрофурана (80 мл), трет-бутанола (0,1 мл) и 3 оксопентановой кислоты этилового эфира (5,0 г) при 0 С обрабатывали раствором 1-хлорметил-4 метоксибензола (4,7 мл) в тетрагидрофуране (20 мл) и полученную смесь перемешивали при 0 С в течение 30 мин и затем при комнатной температуре в течение 24 ч. Смесь разбавляли насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия и удаляли при пониженном давлении растворитель. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь пентана и этилацетата (1:0-0:1 по объему), и последующей дистилляции при пониженном давлении (150 С, 1 мбар (100 Па с получением указанного в заголовке соединения в виде бесцветного масла (3,0 г). Согласно данным 1 Н ЯМР-анализа полученный продукт представлял собой смесь кетоенольных форм. 1 Н ЯМР (CDCl3):1.00 (t, J=7.3 Гц), 1.20 (t, J=7.1 Гц), 2.25 -2.35 (m), 2.50-2.60 (m), 3.10 (m), 3.75 (t,J=7.7 Гц), 3.80 (s), 4.10-4.15 (m), 4.45 (s), 6.80 (d, J=8.8 Гц), 6.90 (d, J=8.7 Гц), 7.10 (d, J=8.8 Гц), 7.25 (d,J=8.7 Гц). Подготовительный пример 3 б. [2-Этил-8-фтор-3-(4-метоксибензил)-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-фторфенокси)уксусной кислоты метилового эфира и 2-(4-метоксибензил)-3-оксопентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 400 (М+Н)+. Время удержания 2,9 мин. Подготовительный пример 3 в. [4-Дифторметокси-2-этил-8-фтор-3-(4-метоксибензил)хинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 г, с использованием [2-этил-8-фтор-3-(4-метоксибензил)-4-оксо-1,4-дигидрохинолин 5-илокси]уксусной кислоты метилового эфира и уксусной кислоты хлордифторметилового эфира. МС: ИЭР (+ve) (методика Б): 450 (М+Н)+. Время удержания 4,1 мин. Подготовительный пример 3 г. [4-Дифторметокси-2-этил-8-фтор-3-(4-метоксибензил)хинолин-5 илокси]уксусная кислота. Раствор [4-дифторметокси-2-этил-8-фтор-3-(4-метоксибензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,30 г) в метаноле (10 мл) и воде (1,0 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (0,67 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, концентрировали при пониженном давлении и остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (0,086 г). 1 Н ЯМР (ДМСО-d6):1.10 (t, J=7.4 Гц, 3 Н), 2.80 (q, J=7.4 Гц, 2 Н), 3.65 (s, 3 Н), 4.20 (s, 2 Н), 4.85 (s,2 Н), 6.80 (d, J=8.8 Гц, 2 Н), 6.95 (т, 3 Н), 7.20 (t, J=75 Гц, 1 Н), 7.45 (dd, J=8.9, 10.1 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 436 (М+Н)+. Время удержания 11,2 мин. Подготовительный пример 4 а. [3-(4-трет-Бутоксикарбониламинобензил)-4-дифторметокси-2-этил 8-фторхинолин-5-илокси]уксусной кислоты метиловый эфир. Смесь [3-(4-бромбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,40 г), карбаминовой кислоты трет-бутилового эфира (0,19 г), трис(дибензилиденацетон)дипалладия(0)(9,9-диметил-4,5-бис(дифенилфосфино)ксантена) (0,014 г), карбоната цезия (0,58 г) и 1,4-диоксана (5,0 мл) нагревали при 100 С в течение 10 ч. Смесь охлаждали до комнатной температуры, подкисляли путем добавления ледяной уксусной кислоты и распределяли между этилацетатом и водой. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь дихлорметана и этилацетата (1:0-10:1 по объему), с получением указанного в заголовке соединения в виде желтой смолы (0,11 г). МС: ИЭР (+ve) (методика Б): 535 (М+Н)+. Время удержания 4,3 мин. Подготовительный пример 4 б. [3-(4-Аминобензил)-4-дифторметокси-2-этил-8-фторхинолин-5 илокси]уксусной кислоты метиловый эфир. Раствор[3-(4-трет-бутоксикарбониламинобензил)-4-дифторметокси-2-этил-8-фторхинолин-5 илокси]уксусной кислоты метилового эфира (0,11 г) в дихлорметане (2,5 мл) обрабатывали трифторуксусной кислотой (0,25 мл) и полученную смесь выдерживали при комнатной температуре в течение 1 ч. Смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде желтой смолы (0,051 г). МС: ИЭР (+ve) (методика Б): 435 (М+Н)+. Время удержания 2,8 мин. Подготовительный пример 4 в. [4-Дифторметокси-3-(4-этансульфониламинобензил)-2-этил-8 фторхинолин-5-илокси]уксусной кислоты метиловый эфир. Смесь [3-(4-аминобензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,051 г), пиридина (0,019 мл) и дихлорметана (0,5 мл) при 0 С обрабатывали этансульфонилхлоридом (0,013 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли дихлорметаном и водой и затем подкисляли путем добавления ледяной уксусной кислоты. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде желтой смолы (0,051 г). МС: ИЭР (+ve) (методика Б): 527 (М+Н)+. Время удержания 3,7 мин. Подготовительный пример 4 г. [4-Дифторметокси-3-(4-этансульфониламинобензил)-2-этил-8 фторхинолин-5-илокси]уксусная кислота. Раствор[4-дифторметокси-3-(4-этансульфониламинобензил)-2-этил-8-фторхинолин-5 илокси]уксусной кислоты метилового эфира (0,051 г) в метаноле (5,0 мл) и воде (0,5 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (0,25 мл) и полученную смесь выдерживали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, концентрировали при пониженном давлении и остаток распределяли между этилацетатом и водой. Органическую фазу сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь дихлорметана,метанола и ледяной уксусной кислоты (100:1:0,5-25:1:0,125 по объему), с получением указанного в заголовке соединения в виде твердого вещества кремового цвета (0,032 г). 1 Н ЯМР (ДМСО-d6):1.10 (t, J=7.4 Гц, 6 Н), 2.80 (q, J=7.4 Гц, 2 Н), 3.00 (q, J=7.4 Гц, 2 Н), 4.25 (s, 2 Н),4.85 (s, 2 Н), 6.95 (dd, J=3.6, 8.9 Гц, 1 Н), 7.00 (d, J=8.6 Гц, 2 Н), 7.05 (d, J=8.6 Гц, 2 Н), 7.25 (t, J=75 Гц, 1 Н),7.50 (dd, J=8.9, 10.1 Гц, 1 Н), 9.60 (s, 1H). МС: ИЭР (+ve) (методика А): 513 (М+Н)+. Время удержания 9,8 мин. МС: ИЭР (+ve) (методика Б): 513 (М+Н)+. Время удержания 3,4 мин. Подготовительный пример 5 а. 2-(4-Ацетилбензил)-3-оксопентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 3 а, с использованием 2-(4-ацетилбензил)-3-оксопентановой кислоты этилового эфира и 1-(4-бромметилфенил)этанона. 1 Н ЯМР (CDCl3):1.00 (t, J=7.2 Гц, 3 Н), 1.20 (t, J=7.2 Гц, 3 Н), 2.35 (m, 1H), 2.55 (s, 3 Н), 2.60 (m,1 Н), 3.20 (m, 2 Н), 3.80 (t, J=7.5 Гц, 1 Н), 4.15 (m, 2H), 7.25 (d, J=8.5 Гц, 2 Н), 7.85 (d, J=8.5 Гц, 2 Н). Подготовительный пример 5 б. [3-(4-Ацетилбензил)-2-этил-8-фтор-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-фторфенокси)уксусной кислоты метилового эфира и 2-(4-ацетилбензил)-3-оксопентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 412 (М+Н)+. Время удержания 2,9 мин. Подготовительный пример 5 в. [3-(4-Ацетилбензил)-4-дифторметокси-2-этил-8-фторхинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 г, с использованием [3-(4-ацетилбензил)-2-этил-8-фтор-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метилового эфира и уксусной кислоты хлордифторметилового эфира. МС: ИЭР (+ve) (методика Б): 462 (М+Н)+. Время удержания 4,0 мин. Подготовительный пример 5 г. [3-(4-Ацетилбензил)-4-дифторметокси-2-этил-8-фторхинолин-5 илокси]уксусная кислота. Раствор [3-(4-ацетилбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,13 г) в метаноле (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития(0,54 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь концентрировали при пониженном давлении, разбавляли водой и подкисляли путем добавления 0,1 М водного раствора соляной кислоты. Данную смесь экстрагировали этилацетатом и объединенные экстракты промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали путем колоночной хроматографии на колонке С-18 с получением указанного в заголовке соединения (0,20 г). 1 Н ЯМР (CD3OD):1.15 (t, J=7.5 Гц, 3 Н), 2.50 (s, 3 Н), 2.85 (q, J=7.5 Гц, 2 Н), 4.45 (s, 2 Н), 4.85 (s, 2 Н),6.90 (dd, J=3.7, 8.8 Гц, 1 Н), 7.15 (t, J=75 Гц, 1 Н), 7.20 (d, J=8.3 Гц, 2 Н), 7.35 (dd, J=8.8, 10.0 Гц, 1 Н), 7.90(0,50 г),тетракис(трифенилфосфин)палладия(0) (0,055 г) и 1,4-диоксана (4,4 мл) нагревали при 100 С в течение 1 ч. Смесь охлаждали до комнатной температуры и использовали на следующей стадии. МС: ИЭР (+ve) (методика Б): 500 (М+Н)+. Время удержания 2,5 мин. Подготовительный пример 6 б. 4-Дифторметокси-2-этил-8-фтор-3-[4-(1-метил-1 Н-имидазол-2 ил)бензил]хинолин-5-илоксиуксусная кислота. Реакционную смесь, полученную в подготовительном примере 6 а, обрабатывали метанолом (0,25 мл), водой (1,0 мл) и 5,0 М водным раствором гидроксида лития (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь разбавляли водой, подкисляли путем добавления ледяной уксусной кислоты и затем концентрировали до минимального объема при пониженном- 13017093 давлении. Остаток экстрагировали этилацетатом и объединенные экстракты сушили над сульфатом магния. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь дихлорметана, метанола и ледяной уксусной кислоты (1:0:0-2:1:0,01 по объему), затем путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества (0,025 г). 1 Н ЯМР (CD3OD):1.20 (t, J=7.6 Гц, 3 Н), 2.90 (q, J=7.6 Гц, 2 Н), 3.70 (s, 3 Н), 4.45 (s, 2 Н), 4.65 (s, 2 Н),6.85 (dd, J=3.7, 8.8 Гц, 1 Н), 7.10 (d, J=1.2 Гц, 1 Н), 7.25 (d, J=8.3 Гц, 2 Н), 7.30-7.50 (m, 3 Н), 7.35 (t, J=75 Гц,1 Н), 8.10 (s, 1H). МС: ИЭР (+ve) (методика А): 486 (М+Н)+. Время удержания 6,7 мин. Пример 7. [8-Хлор-4-дифторметокси-2-этил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 7 а. (4-Хлор-3-нитрофенокси)уксусной кислоты метиловый эфир. Смесь 4-хлор-3-нитрофенола (25 г), N,N-диметилформамида (200 мл), карбоната калия (60 г) и бромуксусной кислоты метилового эфира (15,5 мл) перемешивали при комнатной температуре в течение 2,5 ч. Смесь распределяли между этилацетатом и водой и водную фазу экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Остаток промывали диэтиловым эфиром с получением указанного в заголовке соединения в виде белого твердого вещества (30 г). 1 Н ЯМР (CDCl3):3.85 (s, 3 Н), 4.70 (s, 2 Н), 7.10 (dd, J=3.0, 8.9 Гц, 1 Н), 7.40 (dd, J=3.0 Гц, 1 Н), 7.45(d, J=8.9 Гц, 1 Н). Подготовительный пример 7 б. (3-Амино-4-хлорфенокси)уксусной кислоты метиловый эфир. К смеси железа (26 г), хлорида аммония (33 г) и воды (400 мл) при комнатной температуре добавляли раствор (4-хлор-3-нитрофенокси)уксусной кислоты метилового эфира (30 г) в метаноле (100 мл) и полученную смесь нагревали в ультразвуковой бане при 60 С в течение 4 ч. Смесь подщелачивали путем добавления гидроксида натрия, экстрагировали этилацетатом и объединенные экстракты промывали 1,0 М водным раствором соляной кислоты. рН объединенных водных фаз доводили до 7-8 путем добавления гидроксида натрия, образовавшийся осадок собирали путем фильтрации и затем сушили с получением указанного в заголовке соединения (14 г). 1 Н ЯМР (ДМСО-d6):3.70 (s, 3 Н), 4.60 (s, 2H), 5.35 (br s, 2H), 6.10 (dd, J=3.0, 8.8 Гц, 1 Н), 6.35 (d,J=3.0 Гц, 1 Н), 7.05 (d, J=8.8 Гц, 1 Н). Подготовительный пример 7 в. [8-Хлор-2-этил-4-оксо-3-(4-пиразол-1-илбензил)-1,4-дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира и 3-оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 452 (М+Н)+. Время удержания 3,2 мин. Подготовительный пример 7 г. [8-Хлор-4-дифторметокси-2-этил-3-(4-пиразол-1-илбензил)хинолин 5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 г, с использованием [8-хлор-2-этил-4-оксо-3-(4-пиразол-1-илбензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и уксусной кислоты хлордифторметилового эфира. МС: ИЭР (+ve) (методика Б): 502 (М+Н)+. Время удержания 4,3 мин. Подготовительный пример 7 д. [8-Хлор-4-дифторметокси-2-этил-3-(4-пиразол-1-илбензил)хинолин 5-илокси]уксусная кислота. Раствор [8-хлор-4-дифторметокси-2-этил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,56 г) в тетрагидрофуране (20 мл) обрабатывали 1,0 М водным раствором гидроксида лития (2,4 мл) и полученную смесь перемешивали при комнатной температуре в течение 30 мин. Смесь разбавляли 0,1 М водным раствором соляной кислоты, концентрировали при пониженном давлении и затем экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем растирания со смесью метанола и воды и последующей колоночной хроматографии на колонке С-18 с получением указанного в заголовке соединения (0,35 г). 1 Н ЯМР (ДМСО-d6):1.15 (t, J=7.3 Гц, 3 Н), 2.85 (q, J=7.3 Гц, 2 Н), 4.35 (s, 2 Н), 4.90 (s, 2 Н), 6.45 (dd,- 14017093 Подготовительный пример 8 а. 4-Дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метиловый эфир. Смесь [3-(4-бромбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,39 г), 4,4,5,5,4',4',5',5'-октаметил[2,2']би 1,3,2]диоксабороланила] (0,24 г), [1,1-бис(дифенилфосфино)ферроцен]дихлорпалладия (0,060 г), ацетата калия (0,23 г) и 1,4-диоксана (4,4 мл) нагревали при 100 С в течение 18 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом и дихлорметаном и затем фильтровали. Фильтрат концентрировали при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата, с получением указанного в заголовке соединения (0,24 г). МС: ИЭР (+ve) (методика Б): 546 (М+Н)+. Время удержания 4,6 мин. Подготовительный пример 8 б. [4-Дифторметокси-2-этил-8-фтор-3-(4-тиазол-2-илбензил)хинолин-5 илокси]уксусная кислота. Смесь 4-дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира (0,052 г), 2-бромтиазола (0,076 г), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (0,060 г), 1,4-диоксана (2,0 мл) и 2,0 М водного раствора карбоната цезия (0,19 мл) нагревали при 90 С в течение ночи. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали. Фильтрат концентрировали при пониженном давлении,остаток растворяли в тетрагидрофуране (5,0 мл) и 1,0 М водном растворе гидроксида лития (0,19 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали до минимального объема при пониженном давлении и остаток подкисляли путем добавления 0,1 М водного раствора соляной кислоты и затем экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на колонке С-18 с получением указанного в заголовке соединения (0,020 г). 1 Н ЯМР (CD3OD):1.15 (t, J=7.5 Гц, 3 Н), 2.90 (q, J=7.5 Гц, 2 Н), 4.45 (s, 2H), 4.85 (s, 2 Н), 6.90 (dd,J=3.5, 8.8 Гц, 1 Н), 7.15 (t, J=75 Гц, 1 Н), 7.20 (d, J=8.3 Гц, 2 Н), 7.35 (dd, J=9.0, 10.0 Гц, 1 Н), 7.50 (d, J=3.5 Гц, 1 Н), 7.80 (d, J=3.5 Гц, 1 Н), 7.85 (d, J=8.3 Гц, 2 Н). МС: ИЭР (+ve) (методика А): 489 (М+Н)+. Время удержания 11,4 мин. МС: ИЭР (+ve) (методика Б): 489 (М+Н)+. Время удержания 3,8 мин. Пример 9. Подготовительный пример 9 а. [4-Дифторметокси-2-этил-8-фтор-3-(4-пиримидин-2-илбензил)хинолин-5-илокси]уксусная кислота. Смесь 4-дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира (0,10 г), 2-бромпиримидина (0,076 г), [1,1 бис-(дифенилфосфино)ферроцен]дихлорпалладия (0,016 г), 1,4-диоксана (2,0 мл) и 2,0 М водного раствора карбоната цезия (0,38 мл) нагревали с использованием микроволнового излучения при 90-130 С в течение 1 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом и затем фильтровали. Фильтрат концентрировали при пониженном давлении, остаток растворяли в тетрагидрофуране (5,0 мл) и 1,0 М водном растворе гидроксида лития (0,38 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь подкисляли путем добавления 0,1 М водного раствора соляной кислоты и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной Подготовительный пример 10 а. 2-[4-(2,2-Диметилпропионил)бензил]-3-оксопентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 3 а, с использованием 3-оксопентановой кислоты этилового эфира и 1-(4 бромметилфенил)-2,2-диметилпропан-1-она. Подготовительный пример 10 б. 8-Хлор-3-[4-(2,2-диметилпропионил)бензил]-2-этил-4-оксо-1,4 дигидрохинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира и 2-[4-(2,2-диметилпропионил)бензил]-3-оксопентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 470 (М+Н)+. Время удержания 3,8 мин. Подготовительный пример 10 в. 8-Хлор-4-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-2 этилхинолин-5-илоксиуксусной кислоты метиловый эфир. Смесь 8-хлор-3-[4-(2,2-диметилпропионил)бензил]-2-этил-4-оксо-1,4-дигидрохинолин-5-илоксиуксусной кислоты метилового эфира (0,14 г), N,N-диметилформамида (5,0 мл) и карбоната калия(0,13 г) перемешивали при 40C в течение 5 ч в атмосфере хлордифторметана. Смесь разбавляли водой,экстрагировали этилацетатом и объединенные экстракты промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата (7:3 по объему), с получением указанного в заголовке соединения (0,071 г). МС: ИЭР (+ve) (методика Б): 520 (М+Н)+. Время удержания 4,7 мин. Подготовительный пример 10 г. 8-Хлор-4-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-2 этилхинолин-5-илоксиуксусная кислота. Раствор 8-хлор-4-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-2-этилхинолин-5 илоксиуксусной кислоты метилового эфира (0,071 г) в тетрагидрофуране (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,28 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь концентрировали до минимального объема при пониженном давлении, подкисляли путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения в виде желтого твердого вещества (0,040 г). 1 Н ЯМР (CD3OD):1.25 (t, J=7.4 Гц, 3 Н), 1.30 (s, 9 Н), 2.85 (q, J=7.4 Гц, 2 Н), 4.40 (s, 2 Н), 4.90 (s, 2 Н),6.95 (d, J=8.9 Гц, 1 Н), 7.10 (t, J=75 Гц, 1 Н), 7.15 (d, J=8.3 Гц, 2 Н), 7.60 (d, J=8.3 Гц, 2 Н), 7.75 (d, J=8.7 Гц,1 Н). МС: ИЭР (+ve) (методика А): 506 (М+Н)+. Время удержания 13,6 мин. Подготовительный пример 11 а. 3-Оксо-2-(4-пиразол-1-илбензил)тиомасляной кислоты S-третбутиловый эфир. К перемешиваемой суспензии гидрида натрия (60% в масле, 0,92 г) в 1,2-диметоксиэтане (25 мл) при -10C добавляли раствор 3-оксотиомасляной кислоты S-трет-бутилового эфира (3,7 г) в 1,2 диметоксиэтане (5,0 мл), и полученную смесь нагревали до 15 С в течение 15 мин, охлаждали до -10 С и затем обрабатывали путем добавления по каплям в течение 30 мин смеси 1-(4-бромметилфенил)-1 Нпиразола (5,0 г) и 1,2-диметоксиэтана (20 мл). Полученную смесь нагревали до комнатной температуры и затем перемешивали при этой же температуре в течение ночи. Смесь разбавляли водой, подводили до рН 5 путем добавления ледяной уксусной кислоты и затем насыщали хлоридом натрия. Данную смесь экстрагировали этилацетатом, объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь пентана, дихлорметана и этилацетата (1:3:0, 0:1:0-0:10:1 по объему), с получением указанного в заголовке соединения в виде бесцветной смолы (0,6 г). 1 Н ЯМР (CDCl3):1.40 (s, 9H), 2.20 (s, 3H), 3.15 (m, 2H), 3.90 (t, J=7.5 Гц, 1 Н), 6.45 (m, 1 Н), 7.25 (d,J=8.5 Гц, 2 Н), 7.60 (d, J=8.5 Гц, 2 Н), 7.70 (m, 1 Н), 7.90 (m, 1 Н). Подготовительный пример 11 б.N-(2-Хлор-5-гидроксифенил)-3-оксо-2-(4-пиразол-1 илбензил)бутирамид. К перемешиваемому раствору 3-амино-4-хлорфенола (0,67 г) и 3-оксо-2-(4-пиразол-1 илбензил)тиомасляной кислоты S-трет-бутилового эфира (1,7 г) в 1,2-диметоксиэтане (10 мл) при комнатной температуре добавляли в течение 1 ч трифторацетат серебра (1,5 г) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. Смесь концентрировали при пониженном давлении и остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь дихлорметана и этилацетата (1:0-3:1 по объему), с получением указанного в заголовке соединения в виде коричневого твердого вещества (1,1 г). МС: ИЭР (+ve) (методика Б): 384 (М+Н)+. Время удержания 3,1 мин. Подготовительный пример 11 в. 8-Хлор-5-гидрокси-4-метил-3-(4-пиразол-1-илбензил)-1H-хинолин 2-он. Смесь N-(2-хлор-5-гидроксифенил)-3-оксо-2-(4-пиразол-1-илбензил)бутирамида (1,3 г) и метансульфоновой кислоты (7,0 мл) нагревали при 100 С в течение 10 мин. Смесь охлаждали до комнатной температуры и затем вливали в насыщенный водный раствор ацетата натрия. Образовавшийся осадок собирали путем фильтрации, промывали водой и сушили с получением указанного в заголовке соединения в виде бежевого твердого вещества (0,81 г). 1 Н ЯМР (ДМСО-d6):2.65 (s, 3 Н), 4.05 (s, 2 Н), 6.50 (dd, J=1.8, 2.5 Гц, 1 Н), 6.65 (d, J=8.7 Гц, 2 Н),7.30 (d, J=8.7 Гц, 2 Н), 7.40 (d, J=8.7 Гц, 1 Н), 7.65-7.75 (m, 3 Н), 8.40 (dd, J=0.5, 2.5 Гц, 1 Н), 10.30 (brs, 1H). Подготовительный пример 11 г.[8-Хлор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2 дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 7 а, с использованием 8-хлор-5-гидрокси-4-метил-3-(4-пиразол-1-илбензил)-1 Нхинолин-2-она и бромуксусной кислоты метилового эфира. МС: ИЭР (+ve) (методика Б): 438 (М+Н)+. Время удержания 3,5 мин. Подготовительный пример 11 д. [8-Хлор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5 илокси]уксусной кислоты метиловый эфир. Смесь[8-хлор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,35 г), карбоната калия (0,33 г), йодметана (0,50 мл) и N,Nдиметилформамида (5,0 мл) перемешивали при комнатной температуре в течение 16 ч. Смесь разбавляли водой, подкисляли путем добавления ледяной уксусной кислоты и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества кремового цвета (0,37 г).- 17017093 МС: ИЭР (+ve) (методика Б): 452 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 11 е. [8-Хлор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5 илокси]уксусная кислота. Раствор [8-хлор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,37 г) в метаноле (7,0 мл) и воде (0,7 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (0,32 мл), и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из метанола с получением указанного в заголовке соединения в виде белого твердого вещества (0,18 г). 1 Н ЯМР (ДМСО-d6):2.75 (s, 3H), 4.00 (s, 3H), 4.15 (s, 2H), 4.75 (s, 2H), 6.45 (m, 1 Н), 6.80 (d, J=8.7 Гц, 1 Н), 7.15 (d, J=8.6 Гц, 2 Н), 7.60-7.65 (m, 4 Н), 8.35 (d, J=2.4 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 438 (М+Н)+. Время удержания 12,5 мин. МС: ИЭР (+ve) (методика Б): 438 (М+Н)+. Время удержания 4,1 мин. Пример 12. [2-Дифторметокси-8-фтор-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 12 а. N-(2-Фтор-5-гидроксифенил)-3-оксо-2-(4-пиразол-1-илбензил)бутирамид. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 б, с использованием 3-оксо-2-(4-пиразол-1-илбензил)тиомасляной кислоты S-третбутилового эфира и 3-амино-4-фторфенола. МС: ИЭР (+ve) (методика Б): 368 (М+Н)+. Время удержания 2,9 мин. Подготовительный пример 12 б. 8-Фтор-5-гидрокси-4-метил-3-(4-пиразол-1-илбензил)-1 Н-хинолин 2-он. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 в, с использованием N-(2-фтор-5-гидроксифенил)-3-оксо-2-(4-пиразол-1 илбензил)бутирамида. 1 Н ЯМР (ДМСО-d6):2.65 (s, 3 Н), 4.05 (s, 2H), 6.50-6.55 (m, 2H), 7.15 (dd, J=8.9, 10.2 Гц, 1 Н), 7.30(d, J=8.6 Гц, 2 Н), 7.70 (m, 3 Н), 8.40 (dd, J=0.4, 2.5 Гц, 1 Н), 10.10 (s, 1H), 11.40 (s, 1H). Подготовительный пример 12 в. [8-Фтор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2-дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 7 а, с использованием 8-фтор-5-гидрокси-4-метил-3-(4-пиразол-1-илбензил)-1 Нхинолин-2-она и бромуксусной кислоты метилового эфира. МС: ИЭР (+ve) (методика Б): 422 (М+Н)+. Время удержания 3,3 мин. Подготовительный пример 12 г.[2-Дифторметокси-8-фтор-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [8-фтор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 472 (М+Н)+. Время удержания 4,2 мин. Подготовительный пример 12 д.[2-дифторметокси-8-фтор-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,43 г) в метаноле (7,0 мл) и воде (0,7 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (0,36 мл) и полученную смесь перемешивали при комнатной температуре в течение 1,5 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, разбавляли водой и затем экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле с получением указанного в заголовке соединения в виде белого твердого вещества (0,034 г). 1 Н ЯМР (ДМСО-d6):2.85 (s, 3H), 4.20 (s, 2H), 4.80 (s, 2H), 6.45 (t, J=2.0 Гц, 1 Н), 6.90 (dd, J=4.0, 8.9 Гц, 1 Н), 7.20 (d, J=8.6 Гц, 2 Н), 7.45 (dd, J=8.9, 9.7 Гц, 1 Н), 7.65 (d, J=2.0 Гц, 1 Н), 7.70 (d, J=8.6 Гц, 2 Н),- 18017093 7.85 (t, J=72 Гц, 1 Н), 8.35 (d, J=2.7 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 458 (М+Н)+. Время удержания 11,5 мин. МС: ИЭР (+ve) (методика Б): 458 (М+Н)+. Время удержания 3,8 мин. Пример 13. [8-Хлор-2-дифторметокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 13 а. [8-Хлор-2-дифторметокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [8-хлор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 488 (М+Н)+. Время удержания 4,4 мин. Подготовительный пример 13 б.[8-хлор-2-дифторметокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,38 г) в метаноле (7,0 мл) и воде (0,7 мл) обрабатывали 5,0 М водным раствором гидроксида натрия (0,32 мл) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь подкисляли путем добавления ледяной уксусной кислоты, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем растирания с метанолом и последующей колоночной хроматографии на силикагеле с получением указанного в заголовке соединения в виде белого твердого вещества (0,036 г). 1 Н ЯМР (ДМСО-d6):2.85 (s, 3H), 4.20 (s, 2H), 4.80 (s, 2H), 6.45 (dd, J=1.7, 2.5 Гц, 1 Н), 6.95 (d, J=8.6 Гц, 1 Н), 7.20 (d, J=8.6 Гц, 2 Н), 7.65 (d, J=1.7 Гц, 1 Н), 7.70 (d, J=8.6 Гц, 2 Н), 7.75 (d, J=8.6 Гц, 1 Н), 7.85 (t,J=73 Гц, 1 Н), 8.35 (d, J=2.6 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 474 (М+Н)+. Время удержания 12,2 мин. МС: ИЭР (+ve) (методика Б): 474 (М+Н)+. Время удержания 4,0 мин. Пример 14. [8-Хлор-4-дифторметокси-2-этил-3-(4-изобутирилбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 14 а. 2-(4-Изобутирилбензил)-3-оксопентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 3 а, с использованием 3-оксопентановой кислоты этилового эфира и 1-(4 бромметилфенил)-2-метилпропан-1-она. МС: ИЭР (+ve) (методика Б): 305 (М+Н)+. Время удержания 3,8 мин. Подготовительный пример 14 б.[8-Хлор-2-этил-3-(4-изобутирилбензил)-4-оксо-1,4 дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира и 2-(4-изобутирилбензил)-3-оксопентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 456 (М+Н)+. Время удержания 3,6 мин. Подготовительный пример 14 в. [8-Хлор-4-дифторметокси-2-этил-3-(4-изобутирилбензил)хинолин 5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [8-хлор-2-этил-3-(4-изобутирилбензил)-4-оксо-1,4 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 506 (М+Н)+. Время удержания 4,6 мин.- 19017093 Подготовительный пример 14 г. [8-Хлор-4-дифторметокси-2-этил-3-(4-изобутирилбензил)хинолин 5-илокси]уксусная кислота. Раствор [8-хлор-4-дифторметокси-2-этил-3-(4-изобутирилбензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,22 г) в тетрагидрофуране (5,0 мл) и воде (1,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,86 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали до минимального объема при пониженном давлении и рН доводили до 4-5 путем добавления 1,0 М водного раствора соляной кислоты. Данную смесь экстрагировали этилацетатом, объединенные экстракты сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения (0,18 г). 1 Н ЯМР (CDCl3):1.15 (d, J=6.9 Гц, 6 Н), 1.30 (t, J=7.4 Гц, 3 Н), 2.85 (q, J=7.4 Гц, 2 Н), 3.45 (m, 1 Н),4.40 (s, 2 Н), 4.85 (s, 2 Н), 6.10 (d, J=8.3 Гц, 1 Н), 6.80 (t, J=75 Гц, 1 Н), 7.15 (d, J=8.4 Гц, 2 Н), 7.70 (d, J=8.3 Гц, 1 Н), 7.80 (d, J=8.3 Гц, 2 Н). МС: ИЭР (+ve) (методика А): 492 (М+Н)+. Время удержания 13,1 мин. Пример 15. [8-Фтор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 15 а. [8-Фтор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5 илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 д, с использованием [8-фтор-4-метил-2-оксо-3-(4-пиразол-1-илбензил)-1,2 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и йодметана. Подготовительный пример 15 б. [8-Фтор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5 илокси]уксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 13 б, с использованием [8-фтор-2-метокси-4-метил-3-(4-пиразол-1-илбензил)хинолин-5 илокси]уксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):2.80 (s, 3H), 3.95 (s, 3H), 4.20 (s, 2H), 4.75 (s, 2H), 6.45 (m, 1 Н), 6.75 (dd, J=4.0,8.9 Гц, 1 Н), 7.20 (d, J=8.5 Гц, 2 Н), 7.30 (dd, J=8.9, 9.8 Гц, 1 Н), 7.65 (m, 3 Н), 8.35 (d, J=2.5 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 422 (М+Н)+. Время удержания 11,3 мин. Пример 16. [4-Дифторметокси-2-этил-8-фтор-3-(4-трифторметоксибензил)хинолин-5-илокси]уксусная кислота Подготовительный пример 16 а. 3-Оксо-2-(4-трифторметоксибензил)пентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 3 а, с использованием 3-оксопентановой кислоты этилового эфира и 1-бромметил-4 трифторметоксибензола. 1 Н ЯМР (CDCl3):1.00 (t, J=7.3 Гц, 3 Н), 1.20 (t, J=7.1 Гц, 3 Н), 2.30-2.40 (m, 1 Н), 2.55-2.65 (m, 1 Н),3.15 (m, 2 Н), 3.75 (t, J=7.6 Гц, 1 Н), 4.15 (q, J=7.1 Гц, 2 Н), 7.10 (m, 2H), 7.20 (m, 2H). Подготовительный пример 16 б. [2-Этил-8-фтор-4-оксо-3-(4-трифторметоксибензил)-1,4-дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира и 3-оксо-2-(4-трифторметоксибензил)пентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 454 (М+Н)+. Время удержания 3,5 мин.[4-Дифторметокси-2-этил-8-фтор-3-(4-трифторметоксибензил)хинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [2-этил-8-фтор-4-оксо-3-(4-трифторметоксибензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 504 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 16 г.[4-Дифторметокси-2-этил-8-фтор-3-(4-трифторметоксибензил)хинолин-5-илокси]уксусная кислота. Раствор [4-дифторметокси-2-этил-8-фтор-3-(4-трифторметоксибензил)хинолин-5-илокси]уксусной кислоты метилового эфира (0,054 г) в тетрагидрофуране (4,0 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,21 мл) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь подкисляли путем добавления 0,1 М водного раствора соляной кислоты и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества (0,042 г). 1 Н ЯМР (CDCl3):1.25 (t, J=7.5 Гц, 3 Н), 2.90 (q, J=7.5 Гц, 2 Н), 4.35 (s, 2 Н), 4.85 (s, 2 Н), 6.75 (dd,J=3.6, 8.6 Гц, 1 Н), 6.85 (t, J=75 Гц, 1 Н), 7.06 (br s, 4H), 7.25 (m, 1H). МС: ИЭР (+ve) (методика А): 490 (М+Н)+. Время удержания 12,6 мин. Пример 17. 8-Хлор-2-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-4-метилхинолин-5 илоксиуксусная кислота Подготовительный пример 17 а. 2-[4-(2,2-Диметилпропионил)бензил]-3-оксотиомасляной кислоты 3-трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 а, с использованием 1-(4-бромметилфенил)-2,2-диметилпропан-1-она и 3 оксотиомасляной кислоты S-трет-бутилового эфира. МС: ИЭР (+ve) (методика А): 349 (М+Н)+. Время удержания 4,4 мин. Подготовительный пример 17 б. N-(2-Хлор-5-гидроксифенил)-2-[4-(2,2-диметилпропионил)бензил]3-оксобутирамид. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 б, с использованием 2-[4-(2,2-диметилпропионил)бензил]-3-оксотиомасляной кислоты S-трет-бутилового эфира и 3-амино-4-хлорфенола. МС: ИЭР (+ve) (методика Б): 402 (М+Н)+. Время удержания 3,5 мин. Подготовительный пример 17 в. 8-Хлор-3-[4-(2,2-диметилпропионил)бензил]-5-гидрокси-4-метил 1H-хинолин-2-он. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 в, с использованием N-(2-хлор-5-гидроксифенил)-2-[4-(2,2-диметилпропионил)бензил]-3-оксобутирамида. МС: ИЭР (+ve) (методика Б): 384 (М+Н)+. Время удержания 3,6 мин. Подготовительный пример 17 г. 8-Хлор-3-[4-(2,2-диметилпропионил)бензил]-4-метил-2-оксо-1,2 дигидрохинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 7 а, с использованием 8-хлор-3-[4-(2,2-диметилпропионил)бензил]-5-гидрокси-4-метил 1 Н-хинолин-2-она и бромуксусной кислоты метилового эфира. МС: ИЭР (+ve) (методика Б): 456 (М+Н)+. Время удержания 4,0 мин. Подготовительный пример 17 д. 8-Хлор-2-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-4 метилхинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием 8-хлор-3-[4-(2,2-диметилпропионил)бензил]-4-метил-2-оксо 1,2-дигидрохинолин-5-илоксиуксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 506 (М+Н)+. Время удержания 4,7 мин.- 21017093 Подготовительный пример 17 е. 8-Хлор-2-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-4 метилхинолин-5-илоксиуксусная кислота. Раствор 8-хлор-2-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-4-метилхинолин-5 илоксиуксусной кислоты метилового эфира (0,18 г) в тетрагидрофуране (10 мл) и воде (1,5 мл) обрабатывали 1,0 М водным раствором гидроксида лития (0,71 мл) и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Смесь концентрировали при пониженном давлении, разбавляли водой и дихлорметаном и затем подкисляли путем добавления 0,1 М водного раствора соляной кислоты. Водную фазу экстрагировали дихлорметаном и объединенные органические фазы сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (0,16 г). 1 Н ЯМР (ДМСО-d6):1.20 (s, 9H), 2.85 (s, 3 Н), 4.25 (s, 2 Н), 4.80 (s, 2H), 6.95 (d, J=8.6 Гц, 1 Н), 7.15 Подготовительный пример 18 а. 3-[4-(4-Хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусной кислоты метиловый эфир. Смесь 4-дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира (0,14 г), 4-хлор-1 Н-пиразола (0,053 г), ацетата меди (0,093 г) и пиридина (3 мл) нагревали при 50 С в течение 116 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (10 мл) и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата (1:0-7:3 по объему), с получением указанного в заголовке соединения в виде бесцветного масла (0,13 г). МС: ИЭР (+ve) (методика Б): 520 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 18 б. 3-[4-(4-Хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(4-хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):1.20 (t, J=7.4 Гц, 3 Н), 2.85 (q, J=7.4 Гц, 2 Н), 4.38 (s, 2 Н), 4.88 (s, 2 Н), 6.99 (m,1 Н), 7.21 (d, J=8.6 Гц, 2 Н), 7.30 (t, J=75 Гц, 1 Н), 7.53 (t, J=9 Гц, 1 Н), 7.70 (d, J=8.6 Гц, 2 Н), 7.83 (s, 1H),8.71 (s, 1H). МС: ИЭР (+ve) (методика А): 506 (М+Н)+. Время удержания 12,1 мин. Пример 19. Подготовительный пример 19 а. 4-Метил-3-оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 б, с использованием 4-метил-3-оксопентановой кислоты этилового эфира и 1-(4 бромметилфенил)-1 Н-пиразола. МС: ИЭР (+ve) (методика Б): 315 (М+Н)+. Время удержания 3,8 мин. Подготовительный пример 19 б.[8-Хлор-2-изопропил-4-оксо-3-(4-пиразол-1-илбензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира и 4-метил-3-оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 466 (М+Н)+. Время удержания 3,8 мин.[8-Хлор-4-дифторметокси-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [8-хлор-2-изопропил-4-оксо-3-(4-пиразол-1-илбензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 516 (М+Н)+. Время удержания 4,7 мин. Подготовительный пример 19 г.[8-Хлор-4-дифторметокси-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием [8-хлор-4-дифторметокси-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира. 1 Н ЯМР (CDCl3):1.25 (d, J=6.7 Гц, 6 Н), 3.32 (m, 1H), 4.43 (s, 2H), 4.85 (s, 2 Н), 6.44 (t, J=2.1 Гц, 1 Н),6.74 (d, J=8.6 Гц, 1 Н), 6.86 (t, J=75 Гц, 1 Н), 7.15 (d, J=8.3 Гц, 2 Н), 7.55 (d, J=8.3 Гц, 2 Н), 7.68 (d, J=8.6 Гц,1 Н), 7.72 (d, J=1.6 Гц, 1 Н), 7.86 (d, J=2.1 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 502 (М+Н)+. Время удержания 13,3 мин. МС: ИЭР (+ve) (методика Б): 502 (М+Н)+. Время удержания 4,4 мин. Пример 20. 3-[4-(3-Хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5 илоксиуксусная кислота Подготовительный пример 20 а. 3-[4-(3-Хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 18 а,с использованием 4-дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира и 3-хлор-1 Н-пиразола. МС: ИЭР (+ve) (методика Б): 520 (М+Н)+. Время удержания 4,4 мин. Подготовительный пример 20 б. 3-[4-(3-хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(3-хлорпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8 фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):1.18 (t, J=7.4 Гц, 3 Н), 2.85 (q, J=7.4 Гц, 2 Н), 4.38 (s, 2 Н), 4.89 (s, 2 Н), 6.62 (d,J=2.6 Гц, 1 Н), 7.01 (dd, J=3.6, 9.0 Гц, 1 Н), 7.21 (d, J=8.6 Гц, 2 Н), 7.29 (t, J=75 Гц, 1 Н), 7.53 (m, 1 Н), 7.69 (d,J=8.6 Гц, 2 Н), 8.49 (d, J=2.6 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 506 (М+Н)+. Время удержания 12,1 мин. Пример 21.[8-Фтор-2-изопропил-4-оксо-3-(4-пиразол-1-илбензил)-1,4 дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 в, с использованием (3-амино-4-фторфенокси)уксусной кислоты метилового эфира и 4-метил-3-оксо-2-(4-пиразол-1-илбензил)пентановой кислоты этилового эфира. МС: ИЭР (+ve) (методика Б): 450 (М+Н)+. Время удержания 3,5 мин. Подготовительный пример 21 б.[4-Дифторметокси-8-фтор-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [8-фтор-2-изопропил-4-оксо-3-(4-пиразол-1-илбензил)-1,4- 23017093 дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 500 (М+Н)+. Время удержания 4,3 мин. Подготовительный пример 21 в.[4-Дифторметокси-8-фтор-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием [4-дифторметокси-8-фтор-2-изопропил-3-(4-пиразол-1 илбензил)хинолин-5-илокси]уксусной кислоты метилового эфира. 1 Н ЯМР (CDCl3):1.23 (d, J=6.7 Гц, 6 Н), 3.32 (m, 1H), 4.43 (s, 2H), 4.82 (s, 2 Н), 6.44 (t, J=2.2 Гц, 1 Н),6.75 (dd, J=3.3, 8.6 Гц, 1 Н), 6.87 (t, J=75 Гц, 1 Н), 7.14 (d, J=8.6 Гц, 2 Н), 7.26 (m, 1 Н), 7.56 (d, J=8.6 Гц, 2 Н),7.71 (d, J=1.6 Гц, 1 Н), 7.86 (d, J=2.2 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 486 (М+Н)+. Время удержания 12,2 мин. МС: ИЭР (+ve) (методика Б): 486 (М+Н)+. Время удержания 4,2 мин. Пример 22. 4-Дифторметокси-2-этил-8-фтор-3-[4-(1-изопропил-1H-пиразол-3-ил)бензил]хинолин 5-илоксиуксусная кислота Подготовительный пример 22 а. 1-Изопропил-3-(4,4,5,5-тетраметил [1,3,2]диоксаборолан-2-ил)-1 Нпиразол. К перемешиваемой суспензии гидрида натрия (60% в масле, 0,096 г) в N,N-диметилформамиде (18 мл) при 0 С добавляли 3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-пиразол (0,52 г) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Затем смесь охлаждали до 0 С, обрабатывали 2-йодпропаном (0,4 мл) и перемешивали при комнатной температуре в течение 16 ч. Данную смесь разбавляли водой (10 мл) и концентрировали до минимального объема при пониженном давлении. Остаток экстрагировали этилацетатом и объединенные экстракты промывали насыщенным водным раствором хлорида натрия и затем сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (0,152 г). Подготовительный пример 22 б. 4-Дифторметокси-2-этил-8-фтор-3-[4-(1-изопропил-1 Н-пиразол-3 ил)бензил]хинолин-5-илоксиуксусная кислота. Смесь [3-(4-бромбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты метилового эфира (0,05 г), 1-изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразола(0,047 г), тетракис(трифенилфосфин)палладия(0) (0,012 г), N,N-диметилформамида (0,3 мл) и 2,0 М водного раствора карбоната цезия (0,2 мл) нагревали с использованием микроволнового излучения при 140 С в течение 6 мин. Смесь охлаждали до комнатной температуры, подкисляли путем добавления 1,0 М водного раствора соляной кислоты и затем экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения (0,014 г). 1 Н ЯМР (ДМСО-d6):1.17 (t, J=7.5 Гц, 3 Н), 1.42 (d, J=6.7 Гц, 6 Н), 2.84 (q, J=7.5 Гц, 2 Н), 4.35 (s, 2 Н),4.50 (m, 1 Н), 4.81 (s, 2 Н), 6.59 (d, J=2.3 Гц, 1 Н), 6.96 (dd, J=3.7, 8.9 Гц, 1 Н), 7.09 (d, J=8.3 Гц, 2 Н), 7.43 (t,J=75 Гц, 1 Н), 7.51 (dd, J=8.9, 10.0 Гц, 1 Н), 7.68 (d, J=8.3 Гц, 2 Н), 7.76 (d, J=2.3 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 514 (М+Н)+. Время удержания 11,7 мин. МС: ИЭР (+ve) (методика Б): 514 (М+Н)+. Время удержания 4,2 мин. Пример 23. 3-[4-(4-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5 илоксиуксусная кислота(4-[4-Дифторметокси-2-этил-8-фтор-5-(2-метокси-2 оксоэтокси)хинолин-3-ил]метилфенил)бороновая кислота. Смесь 4-дифторметокси-2-этил-8-фтор-3-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира (0,89 г), периодата натрия (1,7 г), ацетата аммония (0,46 г), ацетона (23 мл) и воды (11 мл) перемешивали при комнатной температуре в течение 41 ч. Смесь концентрировали до минимального объема при пониженном давлении, остаток разбавляли во- 24017093 дой и затем экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,70 г). МС: ИЭР (+ve) (методика Б): 464 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 23 б. 3-[4-(4-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метиловый эфир. Смесь(3 мл) нагревали при 40 С в течение 24 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (10 мл) и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата (1:0-7:3 по объему), с получением указанного в заголовке соединения в виде бледно-зеленого масла (0,09 г). МС: ИЭР (+ve) (методика Б): 526 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 23 в. 3-[4-(4-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(4-циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):0.57 (m, 2 Н), 0.84 (m, 2 Н), 1,17 (t, J=7.4 Гц, 3 Н), 1.74 (m, 1 Н), 2.86 (q, J=7.4 Гц, 2 Н), 4.36 (s, 2 Н), 4.88 (s, 2 Н), 7.00 (dd, J=3.5, 8.7 Гц, 1 Н), 7.16 (d, J=8.3 Гц, 2 Н), 7.32 (t, J=75 Гц, 1 Н),7.50 (m, 2 Н), 7.67 (d, J=8.3 Гц, 2 Н), 8.18 (s, 1H). МС: ИЭР (+ve) (методика А): 512 (М+Н)+. Время удержания 11,9 мин. МС: ИЭР (+ve) (методика Б): 512 (М+Н)+. Время удержания 4,2 мин. Пример 24. 4-Дифторметокси-2-этил-8-фтор-3-[4-(2-изопропилимидазол-1-ил)бензил]хинолин-5 илоксиуксусная кислота Подготовительный пример 24 а. 4-Дифторметокси-2-этил-8-фтор-3-[4-(2-изопропилимидазол-1 ил)бензил]хинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 23 б, с использованием (4-[4-дифторметокси-2-этил-8-фтор-5-(2-метокси-2 оксоэтокси)хинолин-3-ил]метилфенил)бороновой кислоты и 2-изопропил-1 Н-имидазола. МС: ИЭР (+ve) (методика Б): 528 (М+Н)+. Время удержания 2,7 мин. Подготовительный пример 24 б. 4-Дифторметокси-2-этил-8-фтор-3-[4-(2-изопропилимидазол-1 ил)бензил]хинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 4-дифторметокси-2-этил-8-фтор-3-[4-(2-изопропилимидазол-1 ил)бензил]хинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):1.08 (d, J=6.7 Гц, 6 Н), 1.18 (t, J=7.3 Гц, 3 Н), 2.80 (m, 3 Н), 4.42 (s, 2 Н), 4.89 (s,2 Н), 6.94 (br s, 1 Н), 7.00 (dd, J=3.7, 8.9 Гц, 1 Н), 7.19 (d, J=1.2 Гц, 1 Н), 7.25 (d, J=8.5 Гц, 2 Н), 7.29 (t, J=75 Гц, 1 Н), 7.33 (d, J=8.5 Гц, 2 Н), 7.54 (dd, J=8.9, 10.1 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 514 (М+Н)+. Время удержания 7,2 мин. МС: ИЭР (+ve) (методика Б): 514 (М+Н)+. Время удержания 2,6 мин. Пример 25. 3-[4-(3-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5 илоксиуксусная кислота- 25017093 Подготовительный пример 25 а. 3-[4-(3-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 23 б, с использованием (4-[4-дифторметокси-2-этил-8-фтор-5-(2-метокси-2 оксоэтокси)хинолин-3-ил]метилфенил)бороновой кислоты и 5-циклопропил-1H-пиразола. МС: ИЭР (+ve) (методика Б): 526 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 25 б. 3-[4-(3-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(3-циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):0.70 (m, 2 Н), 0.90 (m, 2 Н), 1,17 (t, J=7.4 Гц, 3 Н), 1.95 (m, 1 Н), 2.86 (q, J=7.4 Гц, 2 Н), 4.36 (s, 2 Н), 4.89 (s, 2 Н), 6.20 (d, J=2.5 Гц, 1 Н), 7.01 (dd, J=3.7, 8.8 Гц, 1 Н), 7.16 (d, J=8.6 Гц, 2 Н),7.30 (t, J=75 Гц, 1 Н), 7.51 (m, 1 Н), 7.60 (d, J=8.6 Гц, 2 Н), 8.24 (d, J=2.5 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 512 (М+Н)+. Время удержания 11,9 мин. МС: ИЭР (+ve) (методика Б): 512 (М+Н)+. Время удержания 4,2 мин. Пример 26. 3-[4-(5-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5 илоксиуксусная кислота Подготовительный пример 26 а. 3-[4-(5-Циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 23 б, с использованием (4-[4-дифторметокси-2-этил-8-фтор-5-(2-метокси-2 оксоэтокси)хинолин-3-ил]метилфенил)бороновой кислоты и 5-циклопропил-1 Н-пиразола. МС: ИЭР (+ve) (методика Б): 526 (М+Н)+. Время удержания 4,4 мин. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(5-циклопропилпиразол-1-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):0.67 (m, 2 Н), 0.91 (m, 2 Н), 1.18 (t, J=7.4 Гц, 3 Н), 1.79 (m, 1 Н), 2.88 (q, J=7.4 Гц, 2 Н), 4.41 (s, 2 Н), 4.89 (s, 2 Н), 6.06 (d, J=1.6 Гц, 1 Н), 7.00 (dd, J=3.7, 8.9 Гц, 1 Н), 7.23 (d, J=8.5 Гц, 2 Н),7.29 (t, J=75 Гц, 1 Н), 7.48 (d, J=1.6 Гц, 1 Н), 7.54 (m, 3 Н). МС: ИЭР (+ve) (методика А): 512 (+Н)+. Время удержания 11,4 мин. Пример 27. 3-[4-(5-Циклопропилизоксазол-4-ил)бензил]-4-дифторметокси-2-этил-8-фторхинолин 5-илоксиуксусная кислота(0,24 г),[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (0,027 г), гидрокарбоната натрия (0,082 г), 1,2 диметоксиэтана (1,0 мл) и воды (0,4 мл) нагревали при 85 С в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли водой (5 мл), нейтрализовали путем добавления 1,0 М водного раствора соляной кислоты (1,0 мл) и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования смесь циклогексана и этилацетата (1:0-7:3 по объему), с получением указанного в заголовке соединения в виде бесцветного масла (0,03 г).- 26017093 МС: ИЭР (+ve) (методика Б): 527 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 27 б. 3-[4-(5-Циклопропилизоксазол-4-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 3-[4-(5-циклопропилизоксазол-4-ил)бензил]-4-дифторметокси-2 этил-8-фторхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6):0.98 (m, 2 Н), 1.08 (m, 2 Н), 1.19 (t, J=7.4 Гц, 3 Н), 2.26 (m, 1 Н), 2.87 (q, J=7.4 Гц, 2 Н), 4.38 (s, 2 Н), 4.89 (s, 2 Н), 7.00 (dd, J=3.8, 8.9 Гц, 1 Н), 7.18 (d, J=8.2 Гц, 2 Н), 7.29 (t, J=75 Гц, 1 Н),7.51 (m, 3 Н), 8.77 (s, 1H). МС: ИЭР (+ve) (методика А): 513 (М+Н)+. Время удержания 12,3 мин. МС: ИЭР (+ve) (методика Б): 513 (М+Н)+. Время удержания 4,2 мин. Пример 28. 2-Дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-8-фтор-4-метилхинолин-5 илоксиуксусная кислотаS-трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 а, с использованием 1-(4-бромметилфенил)-2,2-диметилпропан-1-она и 3 оксотиомасляной кислоты S-трет-бутилового эфира. МС: ИЭР (+ve) (методика Б): 349 (М+Н)+. Время удержания 4,4 мин. Подготовительный пример 28 б. 2-[4-(2,2-Диметилпропионил)бензил]-N-(2-фтор-5-гидроксифенил)3-оксобутирамид. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 б, с использованием 2-[4-(2,2-диметилпропионил)бензил]-3-оксотиомасляной кислоты S-трет-бутилового эфира и 3-амино-4-фторфенола. МС: ИЭР (+ve) (методика Б): 386 (М+Н)+. Время удержания 3,4 мин. Подготовительный пример 28 в. 3-[4-(2,2-Диметилпропионил)бензил]-8-фтор-5-гидрокси-4-метил 1H-хинолин-2-он. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 в,с использованием 2-[4-(2,2-диметилпропионил)бензил]-N-(2-фтор-5 гидроксифенил)-3-оксобутирамида. МС: ИЭР (+ve) (методика Б): 368 (М+Н)+. Время удержания 3,4 мин. Подготовительный пример 28 г. 3-[4-(2,2-Диметилпропионил)бензил]-8-фтор-4-метил-2-оксо-1,2 дигидрохинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 7 а, с использованием 3-[4-(2,2-диметилпропионил)бензил]-8-фтор-5-гидрокси-4-метил 1H-хинолин-2-она и бромуксусной кислоты метилового эфира. МС: ИЭР (+ve) (методика Б): 440 (М+Н)+. Время удержания 3,7 мин. Подготовительный пример 28 д. 2-Дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-8-фтор-4 метилхинолин-5-илоксиуксусной кислоты метиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием 3-[4-(2,2-диметилпропионил)бензил]-8-фтор-4-метил-2-оксо 1,2-дигидрохинолин-5-илоксиуксусной кислоты метилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 490 (М+Н)+. Время удержания 4,6 мин. Подготовительный пример 28 е. 2-Дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-8-фтор-4 метилхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 1 д, с использованием 2-дифторметокси-3-[4-(2,2-диметилпропионил)бензил]-8-фтор 4-метилхинолин-5-илоксиуксусной кислоты метилового эфира. 1 Н ЯМР (ДМСО-d6): 1.24 (s, 9H), 2.88 (s, 3H), 4.27 (s, 2H), 4.82 (s, 2H), 6.93 (dd, J=3.8, 8.8 Гц, 1 Н),7.20 (d, J=8.4 Гц, 2 Н), 7.48 (dd, J=8.8, 9.9 Гц, 1 Н), 7.66 (d, J=8.4 Гц, 2 Н), 7.85 (t, J=72 Гц, 1 Н). МС: ИЭР (+ve) (методика А): 476 (М+Н)+. Время удержания 13,1 мин. МС: ИЭР (+ve) (методика Б): 476 (М+Н)+. Время удержания 4,2 мин. Подготовительный пример 29 а. 2-(4-Бромбензил)-3-оксотиомасляной кислоты S-трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 а, с использованием 1-бром-4-бромметилбензола и 3-оксотиомасляной кислоты Sтрет-бутилового эфира. МС: ИЭР (+ve) (методика Б): Время удержания 4,4 мин. Подготовительный пример 29 б. 2-(4-Бромбензил)-N-(2-хлор-5-гидроксифенил)-3-оксобутирамид. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 б, с использованием 2-(4-бромбензил)-3-оксотиомасляной кислоты S-третбутилового эфира и 3-амино-4-хлорфенола. МС: ИЭР (+ve) (методика Б): 397 (М+Н)+. Время удержания 3,4 мин. Подготовительный пример 29 в. 3-(4-Бромбензил)-8-хлор-5-гидрокси-4-метил-1H-хинолин-2-он. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 11 в,с использованием 2-(4-бромбензил)-N-(2-хлор-5-гидроксифенил)-3 оксобутирамида. МС: ИЭР (+ve) (методика Б): 379 (М+Н)+. Время удержания 3,6 мин. Подготовительный пример 29 г. [3-(4-Бромбензил)-8-хлор-4-метил-2-оксо-1,2-дигидрохинолин-5 илокси]уксусной кислоты трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 7 а, с использованием 3-(4-бромбензил)-8-хлор-5-гидрокси-4-метил-1H-хинолин-2-она и бромуксусной кислоты трет-бутилового эфира. МС: ИЭР (+ve) (методика Б): 493 (М+Н)+. Время удержания 4,5 мин. Подготовительный пример 29 д. [3-(4-Бромбензил)-8-хлор-2-дифторметокси-4-метилхинолин-5 илокси]уксусной кислоты трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 10 в, с использованием [3-(4-бромбензил)-8-хлор-4-метил-2-оксо-1,2-дигидрохинолин 5-илокси]уксусной кислоты трет-бутилового эфира и хлордифторметана. МС: ИЭР (+ve) (методика Б): 543 (М+Н)+. Время удержания 5,1 мин. Подготовительный пример 29 е. 8-Хлор-2-дифторметокси-4-метил-3-[4-(1 Н-пиразол-4 ил)бензил]хинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 22 б, с использованием [3-(4-бромбензил)-8-хлор-2-дифторметокси-4-метилхинолин-5 илокси]уксусной кислоты трет-бутилового эфира и пиразол-4-бороновой кислоты. 1 Н ЯМР (ДМСО-d6): 2.89 (s, 3H), 4.19 (s, 2H), 4.86 (s, 2H), 6.98 (d, J=8.5 Гц, 1 Н), 7.10 (d, J=8.4 Гц,2 Н), 7.48 (d, J=8.4 Гц, 2 Н), 7.78 (d, J=8.5 Гц, 1 Н), 7.90 (t, J=72 Гц, 1 Н), 7.96 (brs, 1H), 13.01 (brs, 1H). МС: ИЭР (+ve) (методика А): 474 (М+Н)+. Время удержания 11,0 мин. Пример 30. 8-Хлор-2-дифторметокси-3-[4-(1-изопропил-1H-пиразол-3-ил)бензил]-4 метилхинолин-5-илоксиуксусная кислота- 28017093 Подготовительный пример 30 а. 8-Хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-3 ил)бензил]-4-метилхинолин-5-илоксиуксусной кислоты трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 22 б, с использованием [3-(4-бромбензил)-8-хлор-2-дифторметокси-4-метилхинолин-5 илокси]уксусной кислоты трет-бутилового эфира и 1-изопропил-3-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1 Н-пиразола. МС: ИЭР (+ve) (методика Б): 572 (М+Н)+. Время удержания 5,0 мин. Подготовительный пример 30 б. 8-Хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-3 ил)бензил]-4-метилхинолин-5-илоксиуксусная кислота. Раствор 8-хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-3-ил)бензил]-4-метилхинолин-5 илоксиуксусной кислоты трет-бутилового эфира (0,24 г) в тетрагидрофуране (5,0 мл) обрабатывали 1,0 М водным раствором гидроксида натрия (0,64 мл) и полученную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь нейтрализовали путем добавления 1,0 М водного раствора соляной кислоты (0,64 мл) и затем концентрировали при пониженном давлении. Остаток очищали путем препаративной обратнофазовой ЖХВД с получением указанного в заголовке соединения в виде белого твердого вещества (0,051 г). 1 Н ЯМР (ДМСО-d6):1.38 (d, J=6.6 Гц, 6 Н), 2.86 (s, 3H), 4.16 (s, 2H), 4.45 (m, 1 Н), 4.81 (s, 2 Н), 6.55 Подготовительный пример 31 а. 8-Хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-4 ил)бензил]-4-метилхинолин-5-илоксиуксусной кислоты трет-бутиловый эфир. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 22 б, с использованием [3-(4-бромбензил)-8-хлор-2-дифторметокси-4-метилхинолин-5 илокси]уксусной кислоты трет-бутилового эфира и 1-изопропил-4-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразола. МС: ИЭР (+ve) (методика Б): 572 (М+Н)+. Время удержания 4,9 мин. Подготовительный пример 31 б. 8-Хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-4 ил)бензил]-4-метилхинолин-5-илоксиуксусная кислота. Указанное в заголовке соединение получали в соответствии с методикой, описанной в подготовительном примере 30 б, с использованием 8-хлор-2-дифторметокси-3-[4-(1-изопропил-1 Н-пиразол-4 ил)бензил]-4-метилхинолин-5-илоксиуксусной кислоты трет-бутилового эфира. 1 Н ЯМР (ДМСО-d6):1.41 (d, J=6.6 Гц, 6 Н), 2.89 (s, 3H), 4.19 (s, 2H), 4.46 (m, 1 Н), 4.84 (s, 2 Н), 6.97
МПК / Метки
МПК: A61K 31/4709, C07D 413/10, C07D 401/10, A61P 11/00, C07D 417/10, C07D 215/233, C07D 215/227
Метки: терапевтическое, применение, хинолины
Код ссылки
<a href="https://eas.patents.su/30-17093-hinoliny-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолины и их терапевтическое применение</a>
Предыдущий патент: Бескабельная артроскопия
Следующий патент: Фармацевтические композиции, содержащие холиновые соли янтарной кислоты, для интраназального введения
Случайный патент: Многоножевая кустарниковая косилка












