Хинолины и их терапевтическое применение
Номер патента: 15358
Опубликовано: 30.06.2011
Авторы: Кракетт Питер, Рей Николас Чарльз, Финч Гарри, Гаррисон Тревор Кейт, Ариэнцо Роза, Монтана Джон Гарри, Хайнд Джордж, Крамп Майкл Колин, Гриффон Янн
Формула / Реферат
1. Применение соединения формулы [1] или его фармацевтически приемлемой соли, N-оксида, гидрата или сольвата
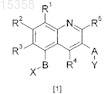
где R1, R2, R3, R4 и R5независимо представляют собой атом водорода, C1-C6-алкил, галогено, -CN или группу -OR9;
где R9представляет собой C1-C6-алкил или фторированный C1-C6-алкил;
A представляет собой -CHR10-, -S(O)n- или -O-, где n представляет собой целое число от 0-2 и R10 представляет собой атом водорода;
B представляет собой двухвалентный радикал, выбранный из -CH2-, -CH2O-, -CH(CH3)O- и -(CR11R12)p-Z-, где Z присоединен к кольцу, несущему R1, R2и R3;
где R11 представляет собой C1-C3-алкил;
R12 представляет собой метил;
p независимо равно 1 или 2 и
Z представляет собой -O;
X представляет собой группу карбоновой кислоты, тетразол, либо группу формулы C(=O)NHSO2R6 или SO2NHC(=O)R6, где R6 представляет собой C1-C6-алкил или арил; и
Y представляет собой арильную группу;
для изготовления лекарства для применения при лечении состояний, реагирующих на модулирование рецепторной активности CRTH2.
2. Применение по п.1, где R1 представляет собой фторо или хлоро.
3. Применение по п.1 или 2, где R2 представляет собой атом водорода, хлоро или метил.
4. Применение по любому из пп.1-3, где R3 представляет собой атом водорода.
5. Применение по любому из пп.1-4, где R4 представляет собой метил, этил, метокси или дифторметокси.
6. Применение по любому из пп.1-5, где R5 представляет собой метил, этил, этокси, изопропокси, дифторметокси или циано.
7. Применение по любому из пп.1-6, где A представляет собой -CH2-, -O- или -S(O)n-, где n равно 0, 1 или 2.
8. Применение по любому из пп.1-7, где B представляет собой -CH2-, -OCH(CH3)- или -OCH2-, где атом кислорода присоединен к кольцу, несущему R1, R2 и R3.
9. Применение по любому из пп.1-8, где X представляет собой -CO2H.
10. Применение по любому из пп.1-9, где Y представляет собой 4-фторфенил, 4-хлорфенил, 4-метансульфонилфенил, 4-этансульфонилфенил, 4-(морфолин-4-сульфонил)фенил, 4-(пирролидин)-1-карбонил)фенил, 2,4-дифторфенил, 2,4-дихлорфенил, 2-хлор-2-фторфенил, 2-хлор-4-фторфенил, 2-хлор-4-метансульфонилфенил, 2-хлор-4-(пирролидин-1-карбонил)фенил или 2-хлор-4-циклобутилкарбамоилфенил.
11. Соединение формулы [1]
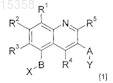
где R1, R2, R3, R4 и R5независимо представляют собой атом водорода, C1-C6-алкил, галогено, -CN или группу -OR9;
где R9представляет собой C1-C6-алкил или фторированный C1-C6-алкил;
A представляет собой -CHR10-, -S(O)n- или -O-, где n представляет собой целое число от 0-2 и R10 представляет собой атом водорода;
В представляет собой двухвалентный радикал, выбранный из -CH2-, -CH2O-, -CH(CH3)O- и -(CR11R12)p-Z-, где Z присоединен к кольцу, несущему R1, R2и R3;
где R11 представляет собой C1-C3-алкил;
R12 представляет собой метил;
p независимо равно 1 или 2 и
Z представляет собой -O;
X представляет собой группу карбоновой кислоты, тетразол, либо группу формулы C(=O)NHSO2R6или SO2NHC(=O)R6, где R6 представляет собой C1-C6-алкил или арил; и
Y представляет собой арильную группу;
где R4и R5 одновременно не представляют собой атом водорода,
или его фармацевтически приемлемая соль, N-оксид, гидрат или сольват.
12. Соединение по п.11, где R1 представляет собой фторо или хлоро; R2 и R3представляют собой атом водорода; R4представляет собой метил, этил, метокси или дифторметокси; R5 представляет собой метил, этил, этокси, изопропокси, дифторметокси или циано; A представляет собой -CH2-, -O- или -S(O)n-, где n равно 0, 1 или 2; B представляет собой -CH2-, -OCH(CH3)- или -OCH2-, где атом кислорода присоединен к кольцу, несущему R1, R2 и R3; X представляет собой -CO2H и Y представляет собой 4-фторфенил, 4-хлорфенил, 4-метансульфонилфенил, 4-этансульфонилфенил, 4-(морфолин-4-сульфонил)фенил, 4-(пирролидин-1-карбонил)фенил, 2,4-дифторфенил, 2,4-дихлорфенил, 2-хлор-2-фторфенил, 2-хлор-4-фторфенил, 2-хлор-4-метансульфонилфенил, 2-хлор-4-(пирролидин-1-карбонил)фенил или 2-хлор-4-циклобутилкарбамоилфенил.
13. Соединение, выбранное из группы, состоящей из
[8-хлор-3-(4-хлорбензил)-4-дифторметокси-2-этилхинолин-5-илокси]уксусной кислоты,
[3-(4-хлорбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
[3-(2,4-дихлорбензил)-2-дифторметокси-8-фтор-4-метилхинолин-5-илокси]уксусной кислоты,
[4-дифторметокси-2-этил-8-фтор-3-(4-фторбензил)хинолин-5-илокси]уксусной кислоты,
[3-(2,4-дифторбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
[3-(2,4-дихлорбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
[3-(4-хлор-2-фторбензил)-2-дифторметокси-8-фтор-4-метилхинолин-5-илокси]уксусной кислоты,
[8-хлор-3-(4-хлорбензил)-2-дифторметокси-4-метилхинолин-5-илокси]уксусной кислоты,
[3-(2-хлор-4-фторбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
[3-(2-хлор-4-фторбензил)-2-дифторметокси-8-фтор-4-метилхинолин-5-илокси]уксусной кислоты,
[8-хлор-3-(4-хлор-2-фторбензил)-4-дифторметокси-2-этилхинолин-5-илокси]уксусной кислоты,
[3-(4-хлор-2-фторбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
{4-дифторметокси-2-этил-8-фтор-3-[4-(морфолин-4-сульфонил)бензил]хинолин-5-илокси}уксусной кислоты,
{4-дифторметокси-2-этил-8-фтор-3-[4-(пирролидин-1-карбонил)бензил]хинолин-5-илокси}уксусной кислоты,
2-[3-(2,4-дихлорбензил)-2-дифторметокси-8-фтор-4-метилхинолин-5-илокси]пропионовой кислоты,
(S)-2-[3-(2,4-дихлорбензил)-2-дифторметокси-8-фтор-4-метилхинолин-5-илокси]пропионовой кислоты,
2-[8-хлор-3-(4-хлорбензил)-2-дифторметокси-4-метилхинолин-5-илокси]пропионовой кислоты,
{8-хлор-4-дифторметокси-2-этил-3-[4-(пирролидин-1-карбонил)бензил]хинолин-5-илокси}уксусной кислоты,
{3-[2-хлор-4-(пирролидин-1-карбонил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5-илокси}уксусной кислоты,
(S)-2-{3-[2-хлор-4-(пирролидин-1-карбонил)бензил]-4-дифторметокси-2-этил-8-фторхинолин-5-илокси}пропионовой кислоты,
(S)-2-[3-(2,4-дихлорбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]пропионовой кислоты,
[3-(2-хлор-4-циклобутилкарбамоилбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]уксусной кислоты,
(S)-2-[3-(2-хлор-4-циклобутилкарбамоилбензил)-4-дифторметокси-2-этил-8-фторхинолин-5-илокси]пропионовой кислоты
и их фармацевтически приемлемых солей, N-оксидов, гидратов и сольватов.
14. Фармацевтическая композиция, содержащая соединение по любому из пп.11-13 вместе с фармацевтически приемлемым носителем.
15. Применение по п.1, где соединение является таким, как определено в любом из пп.11-13.
16. Применение по любому из пп.1-10 и 15, где состояние выбрано из астмы, хронической обструктивной болезни легких, аллергического синдрома дыхательных путей, бронхита, муковисцидоза, эмфиземы и ринита.
17. Применение по любому из пп.1-10 и 15, где состояние выбрано из псориаза, атопического и неатопического дерматита, болезни Крона, неспецифического язвенного колита и синдрома раздраженной кишки.
18. Способ лечения состояния, реагирующего на модулирование рецепторной активности CRTH2, при котором пациенту, страдающему таким заболеванием, вводят эффективное количество соединения, как определено в п.1.
19. Способ по п.18, где состояние выбрано из астмы, хронической обструктивной болезни легких, аллергического синдрома дыхательных путей, бронхита, муковисцидоза, эмфиземы и ринита.
20. Способ по п.18, где состояние выбрано из псориаза, атопического и неатопического дерматита, болезни Крона, неспецифического язвенного колита и синдрома раздраженной кишки.
Текст
являются антагонистами CRTH2, полезными при лечении состояний, имеющих воспалительный компонент, где R1, R2, R3, R4 и R5 независимо представляют собой атом водорода, C1-C6-алкил,галогено, -CN или группу -OR9; где R9 представляет собой C1-C6-алкил или фторированный C1C6-алкил; A представляет собой -CHR10-, -S(O)n- или -O-, где n представляет собой целое число от 0-2 и R10 представляет собой атом водорода; B представляет собой двухвалентный радикал,выбранный из -CH2-, -CH2O-, -CH(CH3)O- и -(CR11R12)p-Z-, где Z присоединен к кольцу, несущему R1, R2 и R3; где R11 представляет собой C1-C3-алкил; R12 представляет собой метил; p независимо равно 1 или 2 и Z представляет собой -O; X представляет собой группу карбоновой кислоты, тетразол, либо группу формулы C(=O)NHSO2R6 или SO2NHC(=O)R6, где R6 представляет собой C1-C6-алкил или арил; и Y представляет собой арильную группу. 015358 Область изобретения Данное изобретение относится к классу соединений хинолина, которые являются лигандами рецептора CRTH2 (Chemoattractant Receptor-homologous molecule, молекулы, гомологичной рецептору хемоаттрактанта, экспрессируемой на T-хелперах типа 2), и к их применению в терапии, в частности при лечении заболеваний, реагирующих на модулирование рецепторной активности CRTH2, главным образом заболеваний, имеющих значительный воспалительный компонент. Изобретение также относится к новым членам этого класса лигандов и к фармацевтическим композициям, содержащим их. Предшествующий уровень техники Известно, что мастоциты играют важную роль в аллергическом и иммунном ответах посредством высвобождения ряда медиаторов, таких как гистамин, лейкотриены, цитокины, простагландин D2 и т. д.(Boyce; Allergy Asthma Proa, 2004, 25, 27-30). Простагландин D2 (PGD2) является основным метаболитом,продуцируемым мастоцитами посредством действия циклооксигеназы на арахидоновую кислоту в ответ на стимуляцию аллергеном (Lewis et al.; J. Immunol., 1982, 129, 1627-1631). Показано, что продуцирование PGD2 повышено у пациентов с системным мастоцитозом (Roberts; N. Engl. J. Med., 1980, 303, 14001404), аллергическим ринитом (Naclerio et al.; Am. Rev. Respir. Dis., 1983, 128, 597-602; Brown et al; Arch.J. Allergy Clin. Immunol., 1986, 78, 458-461). PGD2 опосредует его эффекты через два рецептора, рецепторPowell; Prostaglandins Luekot. Essent. Fatty Acids, 2003, 69, 179-185). Таким образом, установлено, что агенты, которые антагонизируют эффекты PGD2 и его рецепторов, могут обладать полезными эффектами при ряде болезненных состояний. Показано, что рецептор CRTH2 экспрессируется на клеточных типах, связанных с аллергическим воспалением, таких как базофилы, эозинофилы и иммунные клетки-хелперы Th2-типа (Hirai et al.; J. Exp.Med., 2001, 193, 255-261). Показано, что рецептор CRTH2 опосредует PGD2-опосредованную клеточную миграцию в этих типах клеток (Hirai et al.; J. Exp. Med., 2001, 193, 255-261), а также играет основную роль в рекрутменте клеток нейтрофмлов и эозинофилов в модели контактного дерматита (Takeshita et al.;Int. Immunol., 2004, 16, 947-959). Показано, что раматробан (3R)-3-[(4-фторфенил)сульфониламино]1,2,3,4-тетрагидро-9H-карбазол-9-пропановая кислота, двойной антагонист CRTH2 и рецептора тромбоксана A2, аттенуирует эти ответы (Sugimoto et al.; J. Pharmacol. Exp. Ther., 2003, 305, 347-352; Takeshitaet al.; op. cit). Потенциал PGD2 как в отношении усиления аллергического воспаления, так и в отношении индукции воспалительного ответа продемонстрирован на мышах и крысах. Трансгенные мыши с гиперэкспрессией синтазы PGD2 проявляют усиленную легочную эозинофилию и повышенные уровни цитокинов Th2 в ответ на стимуляцию аллергеном (Fujitani et al., J. Immunol., 2002, 168, 443-449). Кроме того,вводимые экзогенно агонисты CRTH2 усиливают аллергический ответ у сенсибилизированных мышей(Spik et al.; J. Immunol., 2005, 174, 3703-3708). У крыс применяемые экзогенно агонисты CRTH2 вызывают легочную эозинофилию, но агонист DP (BW 245C) или агонист TP (I-BOP) не показал никакого эффекта (Shirashi et al.; J. Pharmacol. Exp Ther., 2005, 312, 954-960). Эти наблюдения позволяют предположить, что антагонисты CRTH2 могут обладать ценными свойствами для лечения заболеваний, опосредованных PGD2. В дополнение к раматробану описан ряд других антагонистов CRTH2. Примеры включают: индолуксусные кислоты (WO 2003/022813; WO 2003/066046; WO 2003/066047; WO 2003/097042; WO 2003/097598; WO 2003/101961; WO 2003/101981; WO 2004/007451; WO 2004/078719; WO 2004/106302;WO 2005/019171; GB2407318; WO 2005/040112; WO 2005/040114; WO 2005/044260); тетрагидрохинолины (EP1413306; EP1435356; WO 2004/032848; WO 2004/035543; WO 2005/007094) и фенилуксусные кислоты (WO 2004/058164; WO 2004/089884; WO 2004/089885; WO 2005/018529). Хинолиновая матрица является распространенной в соединениях, предложенных для применения в качестве фармацевтических агентов. Однако соединения, к которым относится настоящее изобретение,обладают паттерном замещения на хинолиновой матрице, который отличает их от конкретных известных фармацевтических агентов хинолинового типа или в целом известных предложенных классов фармацевтических агентов хинолинового типа. Подробное описание изобретения Применение соединения формулы [1] или его фармацевтически приемлемой соли, N-оксида, гидрата или сольвата:R1, R2, R3, R4 и R5 независимо представляют собой атом водорода, C1-C6-алкил, галогено, -CN или группу -OR9; где R9 представляет собой C1-C6-алкил или фторированный C1-C6-алкил; A представляет собой-CHR10-, -S(O)n-, -O-, где n представляет собой целое число от 0-2 и R10 представляет собой атом водорода;B представляет собой двухвалентный радикал, выбранный из -CH2-, -CH2O-, -CH(CH3)O- иR12 представляет собой метил ;X представляет собой группу карбоновой кислоты, тетразол, либо группу формулы C(=O)NHSO2R6 или SO2NHC(=O)R6, где R6 представляет собой C1-C6-алкил или арил;Y представляет собой арильную группу; для изготовления лекарства для применения при лечении состояний, реагирующих на модулирование рецепторной активности CRTH2. Соединения (1), к которым относится настоящее изобретение, являются антагонистами рецептораCRTH2 и являются селективными по сравнению с рецептором DP. Вторым аспектом изобретения является способ лечения состояний, реагирующих на модулирование рецепторной активности CRTH2, при котором пациенту, страдающему таким заболеванием, вводят эффективное количество соединения (I), как определено выше, или его фармацевтически приемлемой соли,N-оксида, гидрата или сольвата. Важные состояния, реагирующие на модулирование рецепторной активности CRTH2, включают астму, хроническую обструктивную болезнь легких, аллергический синдром дыхательных путей, бронхит,муковисцидоз, эмфизему и ринит. Другие состояния, реагирующие на модулирование рецепторной активности CRTH2, включают псориаз, дерматит (атопический и неатопический), болезнь Крона, неспецифический язвенный колит и синдром раздраженной кишки. Соединения (1), как определено выше, за исключением того, что R4 и R5 одновременно не представляют собой атом водорода и B не представляет собой прямую связь, а также их фармацевтически приемлемые соли, N-оксиды, гидраты и сольваты, по праву считают новыми, и такие новые соединения образуют третий аспект изобретения. Фармацевтическая композиция, содержащая такие соединения в смеси с фармацевтически приемлемым носителем или эксципиентом, и применение таких соединений в терапии,также составляют аспекты изобретения. Терминология Как используют здесь, термин "(Ca-Cb)алкил", где a и b представляют собой целые числа, относится к прямоцепочечному или разветвленному алкильному радикалу, имеющему от a до b атомов углерода. Так, когда a равно 1 и b равно 6, например, этот термин включает метил, этил, н-пропил, изопропил, нбутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Как используют здесь, термин "полностью или частично фторированный Ca-Cb-алкил", где a и b представляют собой целые числа, относится к прямоцепочечному или разветвленному алкильному радикалу, имеющему от a до b атомов углерода, в котором атомы водорода все замещены фтором (полностью фторированному) или в котором некоторые из атомов водорода заменены фтором (частично фторированному). Этот термин включает, например, -CF3, -CHF2, -CFH2, и CF3CH2-. Как используют здесь, термин "карбоциклический" относится к возможно замещенному моно-, биили трициклическому радикалу, имеющему вплоть до 16 кольцевых атомов, все из которых представляют собой атомы углерода, и включает арил и циклоалкил. Как используют здесь, термин "циклоалкил" относится к возможно замещенному моноциклическому насыщенному карбоциклическому радикалу, имеющему от 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используют здесь, неограниченный термин "арил" относится к возможно замещенному моно-,би- или трициклическому карбоциклическому ароматическому радикалу и включает радикалы, имеющие-2 015358 два моноциклических карбоциклических ароматических кольца, которые соединены прямой ковалентной связью. Арильные радикалы могут иметь, например, от 6 до 14 кольцевых атомов углерода, предпочтительно от 6 до 10 атомов углерода. Иллюстративными из арильных радикалов являются фенил, дифенил и нафтил. Если не указано иное в контексте, в котором он встречается, термин "замещенный" применительно к любой группировке здесь означает замещенный совместимыми заместителями в количестве вплоть до четырех, каждый из которых независимо может представлять собой, например, (C1-C6)алкил, циклоалкил, (C1C6)алкокси, гидрокси, гидрокси(C1-C6)алкил, меркапто, меркапто(C1-C6)алкил, (C1-C6)алкилтио, фенил, моноциклический гетероарил, имеющий 5 или 6 кольцевых атомов, галогено (включая фторо, бромо и хлоро),трифторметил, трифторметокси, нитро, нитрил (-CN), оксо, -COOH, -COORA, -CORA, -SO2RA, -CONH2,-SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA,-OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NRBSO2ORA, -NHCONH2,-NRACONH2, -NHCONHR8 -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкил, (C3-C6) циклоалкил, фенил или моноциклическую гетероциклическую группу,имеющую 5 или 6 кольцевых атомов, либо RA и RB, когда они присоединены к одному и тому же тому азота,могут образовать кольцо с этим атомом азота из 5 или 6 кольцевых атомов, возможно содержащее дополнительные гетероатомы, выбранные из N, O или S (примерами которого являются морфолинил, пиперидинил,пиперазинил, 4-метилпиперазинил и тетрагидропирролил). "Возможным заместителем" может быть одна из вышеуказанных групп заместителей. Как используют здесь, термин "соль" включает соли присоединения основания, соли присоединения кислоты и четвертичные соли. Соединения по изобретению, которые являются кислыми, могут образовать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочно-земельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например N-метил-Dглюкамином,холином,трис(гидроксиметил)аминометаном,L-аргинином,L-лизином,Nэтилпиперидином, дибензиламином и тому подобным. Конкретные соли с основаниями включают соли бензатина, кальция, диоламина, меглумина, оламина, калия, прокаина, натрия, трометамина и цинка. Те соединения (I), которые являются основными, могут образовать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например с галогеноводородными кислотами, такими как соляная или бромисто-водородная кислота, с серной кислотой, азотной кислотой или фосфорной кислотой и тому подобным, и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, пара-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и тому подобным. Дополнительные солевые формы подробно описаны в "Handbook of Pharmaceutical Salts. Properties, selectionand use", P. Heinrich StahlCamille G. Wermuth, Wiley-VCH, 2002. Также, как используют здесь: Термин "фосфинат" относится к группе формулы -P(O)R(OR), в которой R представляет собой атом водорода или C1-C4-алкил. Примерными группами являются -P(O)(OH)CH3 и -P(O)(OH)H. Термин "фосфонат" относится к группе формулы -P(O)(OH)OR, в которой R представляет собой атом водорода или C1-C4-алкил. Примерными группами являются -P(O)(OH)2 и -Р(О)(ОН)OC2H5 Термин "фосфонамид" относится к группе формулы -P(O)(OR)NR2, в которой R представляет собой атом водорода или C1-C4-алкил. Примерной группой является -P(O)(OH)NH2. Соединения, к которым относится изобретение, могут существовать в одной или более чем одной стереоизомерной форме в связи с присутствием асимметрических атомов или ротационных ограничений,и в таких случаях они могут существовать в виде ряда стереоизомеров с R или S стереохимией в каждом хиральном центре или в виде атропизомеров с R или S стереохимией при каждой хиральной оси. Изобретение включает все такие энантиомеры и диастереоизомеры и их смеси. Применение пролекарств, таких как эфиры, соединений (I), к которым относится изобретение, также составляет часть изобретения. "Пролекарство" означает соединение, которое является преобразуемымin vivo посредством метаболизма (например, путем гидролиза, восстановления или окисления) в соединение формулы (1). Например, эфирное пролекарство соединения формулы (1) может быть преобразуемым посредством гидролиза in vivo в исходную молекулу. Пригодными эфирами соединений формулы(1) являются, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-р-гидроксинафтоаты, гентизаты, изэтионаты, дипара-толуолтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты,циклогексилсульфаматы и хинаты. Примерами эфирных пролекарств являются те, которые описаны F. J.Leinweber, Drug Metab. Res., 1987, 18, 379. Как используют здесь, подразумевают, что ссылки на соединения формулы (1) также включают пролекарственные формы. Переменные R1-R5, A, B, X и Y Для применения в соответствии с изобретением приведенные ниже структурные характеристики, в частности, являются предпочтительными в любой совместимой комбинации в соединениях (1):R1, R2, R3, R4 и R5 независимо представляют собой атом водорода; C1-C6-алкил, например метил,-3 015358 этил или н- или изопропил; галогено, например, фторо, хлоро или бромо; -CN или группы -OR9; где R9 представляет собой C1-C6-алкил, например, метил, этил или н- или изопропил; полностью или частично фторированный C1-C6-алкил, например трифторметил или дифторметил. В частности,предпочтительными значениями R1-R5 являются:R1 представляет собой фторо или хлоро;R2 представляет собой атом водорода, хлоро или метил;R3 представляет собой атом водорода;A представляет собой -CHR10-, -S(O)n-, -O-, где n представляет собой целое число от 0-2 и R10 представляет собой атом водорода. B частности, предпочтительными значениями A являются -CH2-, -O- или-S(O)n-, где n равно 0, 1 или 2. В представляет собой двухвалентный радикал, выбранный из -CH2-,-CH2O-, -CH(CH3)O-, и двухвалентных радикалов формулы -(CR11R12)p-Z-, где Z присоединен к кольцу,несущему R1, R2 и R3; гдеZ представляет собой -O-; В частности, предпочтительными значениями B являются -CH2-, -OCH(CH3)- или -OCH2-, где атом кислорода присоединен к кольцу, несущему R1, R2 и R3. X представляет собой группу карбоновой кислоты, тетразол, либо группу формулы C(=O)NHSO2R6 или SO2NHC(=O)R6, где R6 представляет собой C1C6-алкил или арил. В частности, предпочтительными являются соединения, где X представляет собой группу карбоновой кислоты. Конечно, пролекарства таких соединений включают те, где группа карбоновой кислоты этерифицирована в виде эфира, который гидролизуется in vivo с высвобождением карбоновой кислоты.Y представляет собой арил, такой как фенил. В частности, предпочтительно, чтобы Y был возможно замещенным. В частности, предпочтительные примеры Y включают 4-фторфенил, 4-хлорфенил, 4 метансульфонилфенил, 4-этансульфонилфенил, 4-(морфолин-4-сульфонил)фенил, 4-(пирролидин-1 карбонил)фенил, 2,4-дифторфенил, 2,4-дихлорфенил, 2-хлор-2-фторфенил, 2-хлор-4-фторфенил, 2-хлор 4-метансульфонилфенил,2-хлор-4-(пирролидин-1-карбонил)фенил и 2-хлор-4-циклобутилкарбамоилфенил. Особенно предпочтительный подкласс соединений (1) по изобретению состоит из тех, где R1 представляет собой фтор или хлор; R2 и R3 представляют собой атом водорода; R4 представляет собой метил,этил, метокси или дифторметокси; R5 представляет собой метил, этил, этокси, изопропокси, дифторметокси или циано; A представляет собой -CH2-, -O- или -S(O)n-, где n равно 0, 1 или 2; B представляет собой -CH2-, -OCH(CH3)- или -OCH2-, где атом кислорода присоединен к кольцу, несущему R1, R2 и R3; X представляет собой -CO2H; и Y представляет собой 4-фторфенил, 4-хлорфенил, 4-метансульфонилфенил,4-этансульфонилфенил, 4-(морфолин-4-сульфонил)фенил, 4-(пиррол идин-1-карбонил)фенил, 2,4 дифторфенил, 2,4-дихлорфенил, 2-хлор-2-фторфенил, 2-хлор-4-фторфенил, 2-хлор-4-метансульфонилфенил, 2-хлор-4-(пирролидин-1-карбонил)фенил и 2-хлор-4-циклобутилкарбамоил, и их фармацевтически приемлемые соли, N-оксиды, гидраты или сольваты. Конкретные соединения, к которым относится изобретение, включают соединения приведенных здесь примеров, и их фармацевтически приемлемые соли, N-оксиды, гидраты или сольваты. Композиции Как упомянуто выше, соединения, к которым относится настоящее изобретение, являются антагонистами рецептора CRTH2 и полезны при лечении заболеваний, при которых благоприятно такое модулирование. Примеры таких заболеваний упомянуты выше и включают астму, ринит, аллергический синдром дыхательных путей и бронхит. Понятно, что конкретный уровень дозы для любого конкретного пациента зависит от ряда факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, путь введения, скорость выделения, комбинацию лекарств и тяжесть конкретного заболевания, подлежащего лечению. Оптимальные уровни дозы и частоту дозирования определяют путем клинического испытания, как требуется в области фармацевтики. Как правило, суточный диапазон дозы находится в интервале от примерно 0,001 до примерно 100 мг на кг массы тела млекопитающего, часто от 0,01 мг до примерно 50 мг на кг, например от 0,1 до 10 мг на кг в однократных или дробных дозах. С другой стороны, в некоторых случаях может быть необходимым использовать дозировки вне этих пределов. Соединения, к которым относится настоящее изобретение, можно готовить для введения любым путем, соответствующим их фармакокинетическим свойствам. Композиции, вводимые перорально, могут находиться в форме таблеток, капсул, порошков, гранул, лепешек, жидких или гелеобразных препаратов, таких как пероральные, местные или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального введения могут быть представлены в виде стандартной лекарственной-4 015358 формы и могут содержать общепринятые эксципиенты, такие как связующие агенты, например сироп,аравийскую камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающий агент для таблеток,например стеарат магния, тальк, полиэтиленгликоль или кремнезем; разрыхлители, например картофельный крахмал, или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие препараты могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, либо могут быть представлены в виде сухого продукта для восстановления водой или других подходящим растворителем перед применением. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие агенты,например сорбит, сироп, метилцеллюлозу, глюкозный сироп, желатин, гидрогенизированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитанмоноолеат или аравийскую камедь; неводные растворители (которые могут включать пищевые жиры), например миндальное масло, фракционированное кокосовое масло, масляные эфиры, такие как глицерин, пропиленгликоль; или этиловый спирт; консерванты, например, метил- или пропил-пара-гидроксибензоат или сорбиновую кислоту, и, если желательно, общепринятые корригенты и красители. Для местного введения на кожу лекарство можно готовить в виде крема, лосьона или мази. Препараты в виде крема или мази, которые можно использовать для лекарства, являются общепринятыми препаратами, известными в данной области техники, например, как описано в стандартных руководствах по фармацевтике, таких как Британская Фармакопея. Лекарство можно также включать в препарат для ингаляции, например, в виде назального спрея,либо ингаляторов сухого порошка или аэрозольных ингаляторов. Для доставки путем ингаляции активное соединение предпочтительно находится в форме микрочастиц. Они могут быть получены с помощью ряда методик, включая распылительную сушку, лиофилизацию и измельчение в микронной коллоидной мельнице. Образование аэрозоля можно осуществлять с помощью, например, струйных аэрозольных ингаляторов, управляемых давлением, или ультразвуковых аэрозольных ингаляторов, предпочтительно используя аэрозоли с дозатором, управляемым пропеллентом, или введение без пропеллента тонко измельченных активных соединений, например, из ингаляционных капсул или других систем доставки сухого порошка. Активный ингредиент можно также вводить парентерально в стерильной среде. В зависимости от используемых растворителя и концентрации лекарство может быть либо суспендировано, либо растворено в растворителе. Предпочтительно в этом растворителе могут быть растворены адъюванты, такие как местный анестетик, консерванты и буферные агенты. Другие соединения можно комбинировать с соединениями по данному изобретению формулы [I] для предупреждения и лечения заболеваний, опосредованных простагландином. Таким образом, настоящее изобретение также касается фармацевтических композиций для предупреждения и лечения PGD2 опосредованных заболеваний, содержащих терапевтически эффективное количество соединения по изобретению формулы [I] и один или более чем один другой терапевтический агент. Пригодные терапевтические агенты для комбинированной терапии с соединениями формулы [1] включают, но не ограничены ими: (1) кортикостероиды, такие как флутиказон, циклесонид или будесонид; (2) агонисты 2 адренорецепторов, такие как салметерол, индакатерол или формотерол; (3) модуляторы лейкотриенов,например антагонисты лейкотриенов, такие как монтелукаст, зафирлукаст или пранлукаст, или ингибиторы биосинтеза лейкотриенов, такие как зилейтон или BAY-1005; (4) антихолинергические агенты, например антагонисты мускаринного-3 (M3) рецептора, такие как тиотропия бромид; (5) ингибиторы фосфодиэстеразы-IV (PDE-IV), такие как рофлумиласт или циломиласт; (6) антигистаминные агенты, например селективные антагонисты рецептора гистамина-1 (Н 1), такие как фексофенадин, цетиризин, лоратадин или астемизол; (7) противокашлевые агенты, такие как кодеин или декстраморфан; (8) неселективные ингибиторы COX-1/COX-2, такие как ибупрофен или кетопрофен; (9) ингибиторы COX-2, такие как целекоксиб и рофекоксиб; (10) антагонисты VLA-4, такие как описаны в WO 97/03094 и WO 97/02289; (11) ингибиторы TACE и ингибиторы TNF-, например, моноклональные антитела анти-TNF,такие как ремикад и CDP-870, и молекулы иммуноглобулинов-рецепторов TNF, такие как энбрел; (12) ингибиторы матриксной металлопротеазы, например MMP12; (13) ингибиторы эластазы нейтрофилов человека, такие как описаны в WO 2005/026124, WO 2003/053930 и WO 06/082412; (14) агонисты A2a,такие как описаны в ЕР 1052264 и ЕР 1241176; (15) антагонисты A2b, такие как описаны в WO 2002/42298; (16) модуляторы функции рецепторов хемокинов, например антагонисты CCR3 и CCR8; (17) соединения, которые модулируют действие других рецепторов простаноидов, например, антагонист рецептора DP или антагонист тромбоксана A2 и (18) агенты, которые модулируют функцию Th2, такие как агонисты PPAR. Массовое отношение соединения по изобретению ко второму активному ингредиенту может варьировать и зависит от эффективной дозы каждого ингредиента. Как правило, следует применять эффективную дозу каждого.-5 015358 Способы синтеза Настоящее изобретение также касается способов получения соединений по данному изобретению. Соединения формулы [1] по настоящему изобретению могут быть получены в соответствии с методиками приведенных ниже схем и примеров, используя соответствующие вещества, и примеры их дополнительно приведены следующими далее конкретными примерами. Кроме того, путем использования методик, описанных в приведенном здесь описании, обычный специалист в данной области техники может легко получить дополнительные соединения по настоящему изобретению, заявленные здесь. Соединения, проиллюстрированные в примерах, не следует, однако, истолковывать как составляющие единственный род, который рассмотрен в качестве изобретения. Примеры дополнительно иллюстрируют подробности получения соединений по настоящему изобретению. Специалист в данной области техники легко поймет, что известные вариации условий и способов приведенных ниже методик получения можно использовать для получения этих соединений. Соединения по изобретению формулы [1a], в которых группа B представлена группой формулы O(возможно замещенный)алкилен, и R1-5, A, X и Y являются такими, как определено выше, могут быть удобно получены путем взаимодействия соединения формулы [2] и подходящего алкилирующего агента формулы [3], где группа LG представляет собой подходящую уходящую группу (например, хлоро, бромо или метансульфонилокси). Типично реакцию алкилирования проводят в присутствии основания (например, карбоната калия) в инертном растворителе (например, в ацетоне или N,N-диметилформамиде). Специалистам, которые практикуют в данной области техники, должно быть понятно, что может быть удобным проведение преобразования промежуточного соединения [2] до конечного соединения [1a] с использованием формы алкилирующего агента [3], в котором какая-либо из функциональных групп на любом компоненте соответствующим образом защищена. Например, если группа X представляет собой карбоновую кислоту, может быть удобным проведение реакции с использованием алкилирующего агента, в котором кислотная группа защищена в виде эфира (например, этилового или трет-бутилового эфира). Понятно, что, если реакцию проводят на защищенной форме алкилирующего агента [3], потребуется соответствующая стадия удаления защиты для получения желаемого соединения [1a] по изобретению Промежуточные соединения формулы [2] могут быть удобно получены путем взаимодействия между аминофенолом формулы [4] и 1,3-дикарбонильным соединением формулы [5] (схема 2). Эту реакцию можно проводить в чистом виде или в присутствии подходящего дегидратирующего агента, такого как полифосфорная кислота, пара-толуолсульфоновая кислота или метансульфоновая кислота. Соединения формулы [4] и [5] имеются в продаже, либо их получают известными способами. Схема 2 Соединения формулы [1a], в которых R4 представляет собой алкоксигруппу, такую как дифторметокси, могут быть удобно получены в результате взаимодействия анилина формулы [6] и -кетоэфира формулы [7], в котором PG представляет собой соответствующую алкильную группу (такую как метил и этил), с последующим алкилированием хлордифторметаном (схема 3). Должно быть понятно, что, если реакцию проводят на защищенной форме промежуточного соединения [6], потребуется соответствующая стадия удаления защиты для получения желаемого соединения [1a]. Кетоэфиры формулы [7] известны или могут быть получены из известных соединений в соответствии со способами, известными специалистам в данной области техники. Соединение формулы [6] может быть получено из соединений формулы [4] путем обработки алкилирующим агентом формулы [3] (схема 4), используя способы, описанные выше для получения соединений формулы [1a] из соединений формулы [2] (схема 1). Схема 4 Соединения формулы [1a], в которых R5 представляет собой алкоксигруппу, такую как дифторметокси, могут быть удобно получены из промежуточных соединений формулы [11], используя способы,описанные выше для получения соединений формулы [1a] из соединений формулы [2] (схема 1) и соединений формулы [1a] из соединений формулы [8] (схема 3). Соединения формулы [11] могут быть удобно получены из соединений формулы [10]. Эту реакцию можно проводить в присутствии подходящего дегидратирующего агента, например метансульфоновой кислоты или пара-толуолсульфоновой кислоты. Промежуточные соединения формулы [10] могут быть получены в результате взаимодействия аминофенолов формулы [4] с -кетотиоэфирами формулы [9] в присутствии трифторацетата серебра. Соединения формулы [4] и [9] имеются в продаже, либо их получают известными способами. Схема 5 Соединения по изобретению формулы [1b], где R1-5, A и Y являются такими, как определено выше,могут быть получены путем взаимодействия между промежуточным соединением формулы [12], в котором группа T представляет собой атом хлора, брома или йода или группу трифторметансульфонилокси, и 1-(трет-бутилдиметилсилилокси)-1-метоксиэтаном (схема 6). Эту реакцию можно удобно проводить в присутствии подходящего катализатора (например, соединения палладия) и основания, такого как ацетат натрия. Промежуточные соединения формулы [12], в котором T представляет собой трифторметансульфонилокси, могут быть получены в результате взаимодействия промежуточных соединений формулы [2] сN-фенилтрифторметансульфонимидом в присутствии основания, такого как карбонат калия. Специалистам, практикующим в данной области техники, понятно, что соединения по изобретению могут быть получены путем преобразований других соединений по изобретению. Например, соединения по изобретению формулы [1c], в которых группа A представляет собой сульфонильную группу, могут быть удобно получены путем окисления соединений по изобретению формулы [1a], в которых группа A представляет собой сульфанильную группу, подходящим окисляющим агентом, таким как пероксимоносульфат калия, мета-хлорпероксибензойная кислота или другие хорошо известные окисляющие агенты. В следующем примере соединения формулы [1b], в которых группа R5 представляет собой атом водорода, могут быть удобно получены путем восстановления соединений формулы [1b], в которых группаR5 представляет собой группу галогено, такую как хлоро или бромо. Это преобразование может быть удобно достигнуто взаимодействием с водородом в присутствии подходящего катализатора, такого как палладий на углеродном носителе. Примеры Теперь изобретение будет описано со ссылкой на приведенные ниже примеры. Понятно, что изобретение описано только для примера, и модификация деталей может быть произведена без отклонения от объема изобретения. 1H ЯМР спектры записывали при температуре окружающей среды, используя спектрометр VarianUnity Inova (400 МГц) с тройным резонансным 5 мм спектрометром зонда. Химические сдвиги выражены в млн-1 относительно тетраметилсилана. Использованы приведенные ниже сокращения: br s = широкий синглет, s = синглет, d = дублет, dd = двойной дублет, t = триплет, q = квартет, m = мультиплет. Масс-спектрометрические (LCMS) эксперименты по определению времени удерживания и ассоциированных массовых ионов проводили, используя нижеописанные способы: Способ А: эксперименты проводили на спектрометре Micromass Platform LCT с электрораспылением положительных ионов и с обнаружением УФ единой длины волны 254 нм, используя колонку HigginsClipeus C18 5 мкм 1003,0 мм и скорость тока 2 мл/мин. Исходная система растворителей представляла собой 95% воду, содержащую 0,1% муравьиную кислоту (растворитель A) и 5% ацетонитрил, содержащий 0,1% муравьиную кислоту (растворитель B) в течение первой минуты с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 14 мин. Конечную систему растворителей поддерживали постоянной в течение следующих 2 мин. Способ Б: эксперименты проводили на спектрометре Micromass Platform LC с электрораспылением положительных и отрицательных ионов и ELS/цифровым диодным детектором, используя колонку Phenomenex Luna C18(2) 304,6 мм и скорость тока 2 мл/мин. Система растворителей представляла собой 95% растворителя A и 5% растворителя B в течение первых 0,50 мин с последующим градиентом вплоть до 5% растворителя A и 95% растворителя B в течение следующих 4 мин. Конечную систему растворителей поддерживали постоянной в течение следующих 0,50 мин. Микроволновые эксперименты проводили, используя Personal Chemistry Smith Synthesizer, в котором используют резонатор, работающий в одном режиме, и динамическое вращение поля, где оба эти условия дают хорошую воспроизводимость и контроль. Могут быть достигнуты температуры 40-250C и давления вплоть до 20 бар. Для данного процессора имеются два типа сосудов на 0,5-2,0 мл и 2,0-5,0 мл. Очистки с помощью ВЭЖХ с обращенной фазой проводили, используя в качестве стационарной фазы 7-микронный C-18-связанный силикагель в колонках длиной 10 см и внутренним диаметром 2 см. Используемая подвижная фаза представляла собой смеси ацетонитрила и воды (оба растворителя забу-8 015358 ферены 0,1% по объему трифторуксусной кислотой) при скорости тока 10 мл в минуту и типичных градиентах от 40 до 90% органического модификатора, повышаемого в течение 30-40 мин. Фракции, содержащие требуемый продукт (идентифицированные с помощью анализа LC-MS), объединяли, органическую фракцию удаляли выпариванием, и оставшуюся водную фракцию лиофилизировали с получением конечного продукта. Пример 1. [8-Хлор-3-(4-хлорбензил)-4-метокси-2-метилхинолин-5-илокси]уксусная кислота(4,7 г) и толуол-4-сульфоновой кислоты (0,3 г) нагревали при 160C в атмосфере азота в течение 10 ч. Смесь охлаждали до комнатной температуры и остаток растирали с метанолом, а затем кристаллизовали из бутан-1-ола с получением бежевого порошка. В результате очистки колоночной хроматографией на силикагеле, элюируя смесью этил ацетата и дихлорметана (0:1-1:0 по объему) получили соединение, указанное в заголовке, в виде желтого твердого вещества, 0,77 г. 1MS: ESI (+ve) (Способ Б): 334 (M+H)+,Время удерживания 3,8 мин. Приготовление 1b. [8-Хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир Раствор 8-хлор-3-(4-хлорбензил)-5-гидрокси-2-метил-1H-хинолин-4-она (0,56 г) в тетрагидрофуране(7,0 мл) очищали сильной струей азота и охлаждали до -40C. Добавляли 1,0 М раствор бис(триметилсилил)амида натрия в тетрагидрофуране (1,7 мл), и полученную в результате смесь нагревали до 0C за 1 ч. Смесь охлаждали до -30C и добавляли раствор бромуксусной кислоты метилового эфира (0,26 г) в тетрагидрофуране (1,0 мл), и полученную в результате смесь нагревали до комнатной температуры за 2 ч а затем перемешивали при этой температуре в течение 3 суток. Смесь разбавляли 1,0 М водной соляной кислотой и экстрагировали этилацетатом, и объединенные экстракты промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и дихлорметана (1:19 -19:1 по объему), получили соединение,указанное в заголовке, в виде смолы, 0,13 г.MS: ESI (+ve) (Способ Б): 406 (M+H)+, Время удерживания 3,1 мин. Приготовление 1c. [8-Хлор-3-(4-хлорбензил)-4-метокси-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [8-хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,13 г), йодометана (0,20 мл), N,N-диметилформамида (1,0 мл) и карбоната калия(0,14 г) перемешивали при комнатной температуре в течение 22 ч. Смесь разбавляли водой и экстрагировали этилацетатом, и объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и дихлорметана (1:19 - 19:1 по объему), получили соединение, указанное в заголовке, в виде смолы, 0,059 г.MS: ESI (+ve) (Способ Б): 420 (M+H)+, Время удерживания 4,0 мин. Приготовление 1d. [8-Хлор-3-(4-хлорбензил)-4-метокси-2-метилхинолин-5-илокси]уксусная кислота Смесь [8-хлор-3-(4-хлорбензил)-4-метокси-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,059 г), метанола (2,0 мл), насыщенного раствора гидроксида лития (0,25 мл) и воды (0,4 мл) перемешивали при комнатной температуре в течение 15 ч. Метанол удаляли при пониженном давлении,и pH остатка доводили до 1 добавлением 1,0 М водной соляной кислоты. В результате очистки ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде (20-80% органического модификатора), получили соединение, указанное в заголовке, в виде желтого твердого вещества, 0,060 г. 1 Приготовление 2a: [8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ола (0,23 г), N,N-диметилформамида (5,0 мл), карбоната калия (0,11 г) и бромуксусной кислоты метилового эфира (0,075 мл) перемешивали при комнатной температуре в течение 17 ч. Смесь концентрировали при пониженном давлении, и остаток разбавляли этилацетатом, и эту смесь промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:1 по объему), получили соединение, указанное в заголовке, 0,11 г. 1MS: ESI (+ve) (Способ Б): 404 (M+H)+, Время удерживания 4,1 мин. Приготовление 2b. [8-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,11 г), ацетонитрила (2,0 мл) и 4,0 М водного раствора гидроксида лития (2,0 мл) перемешивали при комнатной температуре в течение 1 ч. Ацетонитрил удаляли при пониженном давлении, и pH остатка доводили до 5 добавлением насыщенного водного раствора дигидрофосфата натрия. Полученную в результате смесь экстрагировали этилацетатом, и объединенные экстракты высушивали над сульфатом магния и концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на флэш-картридже NH2, элюируя метанолом, а затем 2,0 М аммиаком в метаноле, получили соединение, указанное в заголовке, 0,10 г. 1 Приготовление 3a. 3-Амино-5-метилфенол Смесь 5-метилбензол-1,3-диола (6,0 г), хлорида аммония (3,0 г), воды (9,0 мл) и гидроксида аммония (6,8 мл, 33% в воде) запаивали в бомбу и нагревали при 180C в течение 17 ч. Смесь охлаждали до комнатной температуры, и полученный в результате осадок собирали фильтрованием. В результате кристаллизации из воды получили соединение, указанное в заголовке, 1,7 г. 1(0,52 г) нагревали при 150C в атмосфере азота в течение 7 ч. Смесь охлаждали до комнатной температуры, и остаток растирали с метанолом с получением соединения, указанного в заголовке, в виде беловатого твердого вещества, 0,32 г. 1MS: ESI (+ve) (Способ Б): 314 (M+H)+, Время удерживания 3,14 мин. Приготовление 3c. Трифторметансульфоновой кислоты 3-(4-хлорбензил)-4,7-диметил-2-оксо-1,2 дигидрохинолин-5-иловый эфир Смесь 3-(4-хлорбензил)-5-гидрокси-4,7-диметил-1H-хинолин-2-она (1,4 г), N-фенилтрифторметан- 10015358 сульфонимида (1,75 г), карбоната калия (1,85 г) и тетрагидрофурана (7,0 мл) нагревали микроволновым излучением при 120C в течение 12 мин. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и дихлорметана (1:25-1:5 по объему), получили соединение, указанное в заголовке, в виде беловатого твердого вещества, 3,3 г. 1MS: ESI (+ve) (Способ Б): 446 (M+H)+,Время удерживания 4,1 мин. Приготовление 3d. [3-(4-Хлорбензил)-4,7-диметил-2-оксо-1,2-дигидрохинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 3-(4-хлорбензил)-4,7-диметил-2-оксо-1,2-дигидрохинолин-5-илового эфира (1,1 г), 1-(трет-бутилдиметилсилилокси)-1-метоксиэтена (2,7 мл), ацетата натрия (0,25 г), бис(дибензилиденацетон)палладия (0,07 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,07 г) в N,N-диметилформамиде (15,0 мл) нагревали микроволновым излучением при 120C в течение 15 мин. Смесь разбавляли этилацетатом, промывали насыщенным раствором хлорида аммония, водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и дихлорметана (0:1-1:3 по объему), получили соединение, указанное в заголовке, в виде бледно-оранжевого твердого вещества, 1,75 г. 1MS: ESI (+ve) (Способ Б): 370 (M+H)+,Время удерживания 3,4 мин. Приготовление 3e. [3-(4-Хлорбензил)-2-этокси-4,7-диметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь [3-(4-хлорбензил)-4,7-диметил-2-оксо-1,2-дигидрохинолин-5-ил]уксусной кислоты метилового эфира (1,0 г), бромэтана (0,24 мл), карбоната калия (1,1 г) и N,N-диметилформамида (10 мл) нагревали при 40C в течение 17 ч. Смесь разбавляли этилацетатом и промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле,элюируя смесью этилацетата и дихлорметана (0:1-1:5 по объему), получили соединение, указанное в заголовке, в виде смолы, 0,28 г. 1(0,10 г), метанола (2,0 мл), насыщенного водного раствора гидроксида лития (0,20 мл) и воды (0,4 мл) перемешивали при 50C в течение 5 ч. Метанол удаляли при пониженном давлении, и остаток подкисляли добавлением трифторуксусной кислоты. Полученный в результате осадок собирали фильтрованием,промывали водой и высушивали с получением соединения, указанного в заголовке, в виде белого твердого вещества, 0,095 г. 1 Приготовление 4a. [3-(4-Хлорбензил)-2,4,7-триметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 3-(4-хлорбензил)-2,4,7-триметилхинолин-5-ола (0,24 г), N,N-диметилформамида (2,0 мл),карбоната калия (0,12 г) и бромуксусной кислоты метилового эфира (0,12 мл) перемешивали при комнатной температуре в течение 17 ч. Смесь фильтровали, и фильтрат концентрировали при пониженном- 11015358 давлении. Остаток растирали с диэтиловым эфиром и дополнительно очищали колоночной хроматографией на силикагеле, элюируя смесью метил-трет-бутилового эфира и дихлорметана (1:4-3:7 по объему), с получением соединения, указанного в заголовке, 0,078 г. 1(0,045 г), ацетонитрила (2,0 мл), тетрагидрофурана (1,0 мл) и 4,0 М водного раствора гидроксида натрия(2,0 мл) перемешивали при комнатной температуре в течение 2 ч. Органические растворители удаляли при пониженном давлении, и pH остатка доводили до 5-6 добавлением насыщенного водного раствора дигидрофосфата натрия. Полученную в результате смесь экстрагировали хлороформом, и объединенные экстракты высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате растирания остатка с диэтиловым эфиром, а затем с метанолом получили соединение, указанное в заголовке, 0,025 г. 1 Приготовление 5a. 3-(4-Хлорбензил)-2,4,7-триметилхинолин-5-ол Смесь 3-амино-5-метилфенола (1,0 г), 3-(4-хлорбензил)пентан-2,4-диона (1,7 г) и толуол-4 сульфоновой кислоты (0,30 г) нагревали при 160C в атмосфере азота в течение 3 ч. Смесь охлаждали до комнатной температуры, и остаток растирали с метанолом с получением соединения, указанного в заголовке, 1,5 г. MS: ESI (+ve) (Способ Б): 312 (M+H)+, Время удерживания 2,3 мин. Приготовление 5b. Трифторметансульфоновой кислоты 3-(4-хлорбензил)-2,4,7-триметилхинолин-5 иловый эфир Смесь 3-(4-хлорбензил)-2,4,7-триметилхинолин-5-ола (0,32 г), N-фенилтрифторметансульфонимида(0,36 г), карбоната калия (0,42 г) и тетрагидрофурана (5,0 мл) нагревали микроволновым излучением при 120C в течение 20 мин. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метил-трет-бутилового эфира (9:1 по объему), получили соединение, указанное в заголовке, 0,39 г. 1H ЯМР (CDCl3):2,55 (s, 3H), 2,65 (s, 3H), 2,75 (s, 3H), 4,25 (s, 2H), 6,90 (m, 2H), 7,25-7,40 (m, 4H). Приготовление 5c. [3-(4-Хлорбензил)-2,4,7-триметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 3-(4-хлорбензил)-2,4,7-триметилхинолин-5-илового эфира (0,39), 1-(трет-бутилдиметилсилилокси)-1-метоксиэтена (0,95 мл), ацетата натрия (0,086 г),трис(дибензилиденацетон)дипалладия (0) (0,080 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,048 г) вN,N-диметилформамиде (3,0 мл) нагревали микроволновым излучением при 120C в течение 10 мин. Смесь разбавляли насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом. Объединенные экстракты высушивали над сульфатом натрия и растворитель удаляли при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:1 по объему), получили соединение, указанное в заголовке, 0,11 г. 1(d, J = 8,6 Гц, 2H), 7,25 (m, 3H), 7,0 (m, 1H). Приготовление 5d. [3-(4-Хлорбензил)-2,4,7-триметилхинолин-5-ил]уксусная кислота Раствор [3-(4-хлорбензил)-2,4,7-триметилхинолин-5-ил]уксусной кислоты метилового эфира (0,10 г), метанола (2,0 мл) и 4,0 М водного раствора гидроксида лития (2,0 мл) перемешивали при комнатной температуре в течение 2 ч. Метанол удаляли при пониженном давлении, и pH остатка доводили до 5-6 добавлением насыщенного водного раствора дигидрофосфата натрия. Полученную в результате смесь экстрагировали этилацетатом, и объединенные экстракты высушивали над сульфатом магния и удаляли растворитель при пониженном давлении. В результате растирания остатка с ацетонитрилом получили соединение, указанное в заголовке, 0,010 г. Приготовление 6a. 8-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (2,2 г), 3-(4-хлорбензил)пентан-2,4-диона (3,4 г) и толуол-4 сульфоновой кислоты (несколько кристаллов) нагревали при 170C в атмосфере азота в течение 10 ч. Смесь охлаждали до комнатной температуры и в результате очистки колоночной хроматографией на силикагеле, элюируя смесью метанола и дихлорметана (1:19 по объему), с последующим растиранием с диэтиловым эфиром получили соединение, указанное в заголовке, в виде бледно-коричневого твердого вещества, 0,41 г. 1MS: ESI (+ve) (Способ Б): 332 (M+H)+,Время удерживания 3,4 мин. Приготовление 6b. Трифторметансульфоновой кислоты 8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-иловый эфир Смесь 8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ола (0,20 г), N-фенилтрифторметансульфонимида (0,26 г), карбоната калия (0,25 г) и тетрагидрофурана (2,0 мл) нагревали микроволновым излучением при 120C в течение 10 мин. Смесь разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:19 по объему),получили соединение, указанное в заголовке, в виде бежевого твердого вещества, 0,25 г. 1H ЯМР (CDCl3):2,70 (s, 3H), 2,75 (s, 3H), 4,30 (s, 2H), 6,90 (d, J = 8,8 Гц, 2H), 7,25 (d, J = 8,8 Гц,2H), 7,40 (d, J = 8,4 Гц, 1H), 7,80 (d, J = 8,4 Гц, 1H). Приготовление 6c. [8-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илового эфира (0,24 г), 1-(трет-бутилдиметилсилилокси)-1-метоксиэтена (0,56 мл), ацетата натрия (0,053 г),трис(дибензилиденацетон)дипалладия (0) (0,024 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,014 г) вN,N-диметилформамиде (2 мл) нагревали микроволновым излучением при 120C в течение 10 мин. Смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:9 1:6 по объему), с получением соединения, указанного в заголовке, в виде розового твердого вещества,0,12 г. 1(0,11 г), метанола (5,0 мл) и 1,0 М водного раствора гидроксида лития (0,84 мл) перемешивали при комнатной температуре в течение 17 ч. Растворитель удаляли при пониженном давлении, и остаток разбавляли водой. pH смеси доводили до 3-4 добавлением 1,0 М водной соляной кислоты, и полученный в результате осадок собирали фильтрованием и промывали водой. В результате кристаллизации из промышленных метилированных спиртов получили соединение, указанное в заголовке, в виде белого твердого вещества, 0,056 г. 1 Приготовление 7a. 8-Хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (0,36 г), 3-(4-хлорфенокси)пентан-2,4-диона (0,57 г) и паратолуолсульфоновой кислоты моногидрата (0,020 г) нагревали при 125C в течение 3 ч. Смесь охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-0:1 по объему) с получением соединения, указанного в заголовке, в виде коричневого масла, 0,16 г. 1MS: ESI (+ve) (Способ Б): 334 (M+H)+,Время удерживания 4,2 мин. Приготовление 7b. [8-Хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-ола (0,16 г), N,N-диметилформамида (3,0 мл), карбоната калия (0,20 г) и бромуксусной кислоты метилового эфира (0,88 г) перемешивали при комнатной температуре в течение 15 ч. Смесь разбавляли дихлорметаном, промывали водой и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-5:1 по объему), получили соединение, указанное в заголовке, в виде беловатого твердого вещества, 0,20 г.MS: ESI (+ve) (Способ Б): 406 (M+H)+,Время удерживания 4,5 мин. Приготовление 7c. [8-Хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,20 г), метанола (5,0 мл), воды (1,0 мл) и 5,0 М водного раствора гидроксида натрия (1,0 мл) перемешивали при комнатной температуре в течение 3 ч. pH раствора доводили до 1 добавлением 1,0 М соляной кислоты, и метанол удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде (40-98% органического модификатора) с получением соединения, указанного в заголовке, в виде желто-зеленого твердого вещества, 0,025 г. 1 Приготовление 8a: 8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (0,36 г), 3-(4-хлорфенилсульфанил)пентан-2,4-диона (0,61 г) и паратолуолсульфоновой кислоты моногидрата (0,040 г) нагревали при 140C в течение 10 ч. Смесь охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-0:1 по объему), с получением соединения, указанного в заголовке, в виде коричневого масла, 0,050 г.MS: ESI (-ve) (Способ Б): 348 (M-H)-,Время удерживания 4,4 мин. Приготовление 8b. [8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-илокси]уксусной ки- 14015358 слоты метиловый эфир Смесь 8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ола (0,050 г), N,N-диметилформамида(2,0 мл), карбоната калия (0,059 г) и бромуксусной кислоты метилового эфира (0,031 г) перемешивали при комнатной температуре в течение 15 ч. Смесь разбавляли дихлорметаном и раствор промывали водой, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде коричневого твердого вещества, 0,11 г.MS: ESI (+ve) (Способ Б): 422 (M+H)+,Время удерживания 4,8 мин. Приготовление 8c. [8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,11 г), метанола (5,0 мл), воды (1,0 мл) и 5,0 М водного раствора гидроксида натрия (0,5 мл) перемешивали при комнатной температуре в течение 3 ч. pH раствора доводили до 1 добавлением 1,0 М водной соляной кислоты. Полученную в результате смесь очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 минут ацетонитрила в воде (30-90% органического модификатора) с получением соединения, указанного в заголовке, в виде белого твердого вещества, 0,045 г. 1 Приготовление 9a. [8-Хлор-3-(4-хлорбензил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир К смеси [8-хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,080 г), N,N-диметилформамида (2,0 мл) и карбоната калия (0,080 г) при -80C добавляли хлордифторметан (0,4 мл). Колбу герметично закрывали, и полученную в результате смесь нагревали до комнатной температуры, а затем перемешивали при этой температуре в течение 17 ч. Избытку хлордифторметана давали испариться, и остаток разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде светло-коричневого твердого вещества, 0,10 г.MS: ESI (+ve) (Способ Б): 456 (M+H)+,Время удерживания 4,3 мин. Пример 9b. [8-Хлор-3-(4-хлорбензил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорбензил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,10 г), метанола (6,0 мл), воды (0,6 мл) и насыщенного водного раствора гидроксида лития (0,3 мл) перемешивали при комнатной температуре в течение 17 ч. Метанол удаляли при пониженном давлении, и pH остатка доводили до 4 добавлением ледяной уксусной кислоты. Полученный в результате осадок собирали фильтрованием и промывали водой. В результате очистки твердого вещества препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 37 мин ацетонитрила в воде(20-95% органического модификатора), получили соединение указанное в заголовке, в виде твердого вещества кремового цвета, 0,020 г. 1 Приготовление 10a. [4,8-Дихлор-3-(4-хлорбензил)-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Раствор [8-хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,13 г) в оксихлориде фосфора (5,0 мл) нагревали при 180C в микроволновом реакторе в течение 15 мин. Смесь наливали в лед и pH раствора доводили до 3 добавлением ацетата натрия. Смесь экстрагировали этилацетатом и объединенные экстракты промывали насыщенным водным раствором гидрокарбоната натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде бежевого твердого вещества,0,12 г. Приготовление 10b. [8-Хлор-3-(4-хлорбензил)-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [4,8-дихлор-3-(4-хлорбензил)-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира(0,12 г), палладия, 5% мас./мас. на активированном углероде (0,010 г), этанола и 1,0 М водной соляной кислоты (1,0 мл) перемешивали при комнатной температуре в течение 17 ч в атмосфере водорода. Смесь фильтровали через Hyflo, промывая этанолом и водой, и растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, 0,11 г. Приготовление 10c. [8-Хлор-3-(4-хлорбензил)-2-метилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорбензил)-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира(0,10 г), этанола (6,0 мл), воды (2,0 мл) и насыщенного водного раствора гидроксида лития (2,0 мл) перемешивали при комнатной температуре в течение 5 ч. Этанол удаляли при пониженном давлении и pH остатка доводили до 4 добавлением ледяной уксусной кислоты. Полученный в результате осадок собирали фильтрованием, промывали водой, и в результате очистки препаративной ВЭЖХ с обращенной фазой,используя градиент в течение 37 мин ацетонитрила в воде (20-95% органического модификатора), получили соединение, указанное в заголовке, в виде беловатого твердого вещества, 0,039 мг. 1 Приготовление 11a. 7-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ол Смесь 3-амино-5-хлорфенола (0,46 г), 3-(4-хпорбензил)пентан-2,4-диона (0,72 г) и паратолуолсульфоновой кислоты моногидрата (0,26 г) нагревали при 160C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли метанолом (5,0 мл) и озвучивали ультразвуком. Полученный в результате осадок собирали фильтрованием, промывали метанолом и высушивали с получением смеси 50:50 соединения, указанного в заголовке, и 5-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-7-ола в виде беловатого твердого вещества, 0,67 г.MS: ESI (+ve) (Способ Б): 332 (M+H)+,Время удерживания 2,4 мин. Приготовление 11b. Трифторметансульфоновой кислоты 7-хлор-3-(4-хлорбензил)-2,4 диметилхинолин-5-иловый эфир Смесь 7-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ола и 5-хлор-3-(4-хлорбензил)-2,4 диметилхинолин-7-ола (0,66 г), N-фенилтрифторметансульфонимида (0,86 г), карбоната калия (0,82 г) и тетрагидрофурана (10 мл) нагревали микроволновым излучением при 130C в течение 20 мин. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя 1,2-дихлорэтаном, получили смесь 50:50 соединения,- 16015358 указанного в заголовке, и трифторметансульфоновой кислоты 5-хлор-3-(4-хлорбензил)-2,4 диметилхинолин-7-илового эфира в виде смолы медового цвета, 0,86 г.MS: ESI (+ve) (Способ Б): 464 (M+H)+,Время удерживания 4,9 мин. Приготовление 11c. [7-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 7-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илового эфира и трифторметансульфоновой кислоты 5-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-7-илового эфира (0,86 г), трет-бутил-(1-метоксивинилокси)диметилсилана (2,0 мл), ацетата натрия (0,18 г),бис(дибензилиденацетон)палладия (0,05 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,05 г) в N,Nдиметилформамиде (11,0 мл) нагревали микроволновым излучением при 120C в течение 15 мин. Смесь разбавляли этилацетатом, и этот раствор промывали насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана, этилацетата и пентана (4:0:1-1:0:0-50:1:0-25:1:0-12.5:1:0 по объему), получили соединение, указанное в заголовке, в виде смолы медового цвета, 0,25 г. 1(0,24 г), метанола (10 мл), воды (2,0 мл) и насыщенного водного раствора гидроксида лития (1,0 мл) перемешивали при комнатной температуре в течение 17 ч. pH раствора доводили до 5 добавлением ледяной уксусной кислоты, и метанол удаляли при пониженном давлении. Полученный в результате осадок собирали фильтрованием и промывали водой. В результате кристаллизации из этилацетата получили соединение, указанное в заголовке, в виде пушистого белого твердого вещества, 0,16 г. 1 Приготовление 12a. 8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (5,0 г), 3-(4-хлорфенилсульфанил)пентан-2,4-диона (8,4 г), паратолуолсульфоновой кислоты моногидрата (12 г) нагревали при 140C в течение 6 ч. Смесь охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-1:1 по объему) с получением соединения, указанного в заголовке, в виде коричневого твердого вещества, 1,3 г.(1,3 г),N-фенилтрифторметансульфонимида (1,7 г), карбоната калия (1,6 г) и тетрагидрофурана (10 мл) нагревали микроволновым излучением при 120C в течение 20 мин. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью пентана и дихлорметана (9:1 - 0:1 по объему), получили соединение, указанное в заголовке, 0,27 г.MS: ESI (+ve) (Способ Б): 482 (M+H)+,Время удерживания 5,1 мин. Приготовление 12c. [8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин 5-илового эфира (0,31 г), трет-бутил-(1-метоксивинилокси)диметилсилана (0,71 мл), ацетата натрия(0,064 г), бис(дибензилиденацетон)палладия (0,018 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,018 г) в N,N-диметилформамиде (4,0 мл) нагревали микроволновым излучением при 120C в течение 15 мин. Смесь разбавляли этилацетатом, и этот раствор промывали насыщенным водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и циклогексана (1:1-2:0 по объему), получили соединение, указанное в заголовке в виде бледно-желтого твердого вещества, 0,15 г. 1MS: ESI (+ve) (Способ Б): 406 (M+H)+,Время удерживания 4,5 мин. Приготовление 12d. [8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ил]уксусная кислота Смесь [8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ил]уксусной кислоты метилового эфира (0,040 г), метанола (2,0 мл), воды (0,4 мл) и насыщенного водного раствора гидроксида лития (0,2 мл) перемешивали при комнатной температуре в течение 17 ч. Растворитель удаляли при пониженном давлении, и остаток разбавляли водой (2,0 мл), а затем pH доводили до 4 добавлением ледяной уксусной кислоты. Полученный в результате осадок собирали фильтрованием, промывали водой и высушивали с получением соединения, указанного в заголовке, в виде серо-коричневого твердого вещества, 0,038 г. 1 Приготовление 13a. N-2-[8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]ацетилметансульфонамид Смесь [8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]уксусной кислоты (0,050 г), 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорида (0,037 г), метансульфонамида (0,020 г) и 4(N,N-диметиламино)пиридина (0,005 г) в дихлорметане (5,0 мл) перемешивали при комнатной температуре 1 ч. Смесь разбавляли дихлорметаном, и этот раствор промывали водой, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде(40-95% органического модификатора), получили соединение, указанное в заголовке, в виде желтого твердого вещества, 0,010 г. 1 Приготовление 14a. N-2-[8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]ацетилбензолсульфонамид Смесь [8-хлор-3-(4-хлорбензил)-2,4-диметипхинолин-5-илокси]уксусной кислоты (0,050 г), 1-(3- 18015358 диметиламинопропил)-3-этилкарбодиимида гидрохлорида (0,037 г), бензолсульфонамида (0,030 г) и 4(N,N-диметиламино)пиридина (0,005 г) в дихлорметане (5,0 мл) перемешивали при комнатной температуре 1 ч. Смесь очищали колоночной хроматографией на силикагеле, элюируя смесью метанола и дихлорметана (1:19 по объему), с последующим растиранием с циклогексаном, содержащим небольшое количество диэтилового эфира, с получением соединения, указанного в заголовке, в виде темно-желтого твердого вещества, 0,020 г. 1 Приготовление 15a. Трифторметансульфоновой кислоты 8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-иловый эфир Смесь 8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-ола (0,50 г), N-фенилтрифторметансульфонимида (0,68 г), карбоната калия (0,62 г) и тетрагидрофурана (3,0 мл) нагревали микроволновым излучением при 120C в течение 20 мин. Смесь разбавляли дихлорметаном, и этот раствор промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и пентана (1:9 по объему), с получением соединения, указанного в заголовке, в виде желтого твердого вещества, 0,36 г.MS: ESI (+ve) (Способ Б): 466 (M+H)+,Время удерживания 5,1 мин. Приготовление 15b. [8-Хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5 илового эфира (0,20 г), трет-бутил-(1-метоксивинилокси)диметилсилана (0,40 г), ацетата натрия (0,044 г),трис(дибензилиденацетон)дипалладия (0,020 г) и 1,1'-бис(дифенилфосфино)ферроцена (0) (0,012 г) вN,N-диметилформамиде (5,0 мл) нагревали микроволновым излучением при 120C в течение 15 мин. Смесь очищали колоночной хроматографией на силикагеле, элюируя смесью пентана и дихлорметанаMS: ESI (+ve) (Способ Б): 390 (M+H)+,Время удерживания 4,4 мин. Приготовление 15c. [8-Хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-ил]уксусная кислота Смесь [8-хлор-3-(4-хлорфенокси)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,035 г), метанола (5,0 мл) и 5,0 М водного раствора гидроксида натрия (0,36 мл) перемешивали при комнатной температуре в течение 4 ч. Растворитель удаляли при пониженном давлении, и остаток очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде (30-95% органического модификатора) с получением соединения, указанного в заголовке, в виде белого твердого вещества, 0,0050 г. 1- 19015358 Приготовление 16a. 3-(4-Хлорбензил)гексан-2,4-дион Раствор гексан-2,4-диона (5,7 г) в N,N-диметилформамиде (20 мл) добавляли по каплям за период 15 мин к перемешанной суспензии гидрида натрия (60% в масле, 2,2 г) в N,N-диметилформамиде (60 мл) при -5C. Смесь перемешивали при комнатной температуре в течение 30 мин, а затем добавляли раствор 1-бромметил-4-хлорбензола (11 г) в N,N-диметилформамиде (20 мл) по каплям за период 20 мин. Полученную в результате смесь перемешивали при комнатной температуре в течение 17 ч, а затем разбавляли 1,0 М водной соляной кислотой (100 мл). Смесь экстрагировали диэтиловым эфиром, и объединенные экстракты промывали 1,0 М водной соляной кислотой и насыщенным водным раствором хлорида натрия,а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью пентана и толуола(1:1-1:2-0:1 по объему), получили соединение, указанное в заголовке (55:45 смесь кето-енольных таутомеров), в виде белого твердого вещества, 2,6 г. 1(m, 4H), 3,05-3,25 (М, 2H), 3,65 (s, 2H), 3,95 (t, J = 7,5 Гц, 1H), 7,05-7,10 (m, 4H), 7,20-7,30 (m, 4H). Приготовление 16b и 17a. 8-Хлор-3-(4-хлорбензил)-4-этил-2-метилхинолин-5-ол и 8-хлор-3-(4 хлорбензил)-2-этил-4-метилхинолин-5-ол Смесь 3-амино-4-хлорфенола (0,72 г), 3-(4-хлорбензил)гексан-2,4-диона (1,2 г) и паратолуолсульфоновой кислоты моногидрата (0,10 г) нагревали при 160C в течение 1,5 ч. Смесь охлаждали до комнатной температуры, а затем очищали колоночной хроматографией на силикагеле, элюируя смесью толуола и дихлорметана (2:1-3:2-1:1-2:3-1:2-1:4-0:1 по объему), с получением соединения, указанного в заголовке, 0,25 г.MS: ESI (+ve) (Способ Б): 346 (M+H)+,Время удерживания 3,6 и 3,9 мин. Приготовление 16c и 17b. [8-Хлор-3-(4-хлорбензил)-4-этил-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир и [8-хлор-3-(4-хлорбензил)-2-этил-4-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 8-хлор-3-(4-хлорбензил)-4-этил-2-метилхинолин-5-ола и 8-хлор-3-(4-хлорбензил)-2-этил-4 метилхинолин-5-ола (0,25 г), N,N-диметилформамида (4,0 мл), карбоната калия (0,12 г) и бромуксусной кислоты метилового эфира (0,12 г) перемешивали при комнатной температуре в течение 4 ч. Смесь разбавляли этилацетатом и эту смесь промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде полутвердого вещества медового цвета, 0,26 г.MS: ESI (+ve) (Способ Б): 418 (M+H)+,Время удерживания 4,5 и 4,8 мин. Приготовление 16d и 17c. [8-Хлор-3-(4-хлорбензил)-4-этил-2-метилхинолин-5-илокси]уксусная кислота и [8-хлор-3-(4-хлорбензил)-2-этил-4-метилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорбензил)-4-этил-2-метипхинолин-5-илокси]уксусной кислоты метилового эфира и [8-хлор-3-(4-хлорбензил)-2-этил-4-метилхинолин-5-илокси]уксусной кислоты метилового эфира(0,26 г), метанола (15 мл), воды (1,5 мл) и насыщенного водного раствора гидроксида лития (1,5 мл) перемешивали при комнатной температуре в течение 3 ч. pH раствора доводили до 4 добавлением ледяной уксусной кислоты, и метанол удаляли при пониженном давлении. Полученный в результате осадок собирали фильтрованием и очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 минут ацетонитрила в воде (40-98% органического модификатора) с получением [8-хлор-3-(4 хлорбензил)-4-этил-2-метилхинолин-5-илокси]уксусной кислоты в виде желтой пены, 0,049 г, и [8-хлор 3-(4-хлорбензил)-2-этил-4-метилхинолин-5-илокси]уксусной кислоты в виде желтой пены, 0,10 г. Приготовление 18a. 2-(4-фторбензил)-3-оксомасляной кислоты этиловый эфир Суспензию трет-бутоксида калия (11,2 г) в безводном тетрагидрофуране (200 мл) при 0C обрабатывали смесью трет-бутанола (0,2 мл) и 3-оксомасляной кислоты этилового эфира (12,7 мл). Смесь нагревали до 15C за период 40 мин и добавляли раствор 1-хлорметил-4-фторбензола (11,9 мл) в тетрагидрофуране (40 мл), и полученную в результате смесь нагревали при 70C в течение 20 ч. Смесь охлаждали до комнатной температуры, разбавляли водой, и тетрагидрофуран удаляли при пониженном давлении. Остаток экстрагировали этилацетатом, и объединенные экстракты промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали перегонкой при пониженном давлении (точка кипения 102104C при 0,42 мбар) с получением соединения, указанного в заголовке, в виде бесцветного масла, 12,4 г. 1H ЯМР (CDCl3):1,20 (t, J = 7,2 Гц, 3H), 2,20 (s, 3H), 3,15 (m, 2H), 3,75 (t, J = 7,6 Гц, 1H), 4,15 (m,2H), 6,95-7,00 (m, 2H), 7,10-7,15 (m, 2H). Приготовление 18b и 19b. [8-Хлор-3-(4-фторбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси] уксусной кислоты метиловый эфир и [8-хлор-3-(4-фторбензил)-4-метил-2-оксо-1,2-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир Смесь (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира (1,3 г), 2-(4-фторбензил)-3 оксомасляной кислоты этилового эфира (7,4 г), полифосфорной кислоты (15 г) и диоксана (8,0 мл) нагревали при 112C в течение 5 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали водой и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (19:1 по объему), с получением соединения,указанного в заголовке, 0,39 г. 1H ЯМР (CDCl3):2,75 (s, 6H), 3,80 (s, 3H), 3,85 (s, 3H), 4,05 (s, 2H), 4,15 (s, 2H), 4,70 (s, 2H), 4,85 (s,2H), 6,50-7,55 (m, 12), 9,00 (br s, 1H), 9,10 (br s, 1H). Приготовление 18c и 19c. [8-Хлор-4-дифторметокси-3-(4-фторбензил)-2-метилхинолин-5-илокси] уксусной кислоты метиловый эфир и [8-хлор-2-дифторметокси-3-(4-фторбензил)-4-метилхинолин-5 илокси]уксусной кислоты метиловый эфир Смесь [8-хлор-3-(4-фторбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира и [8-хлор-3-(4-фторбензил)-4-метил-2-оксо-1,2-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,39 г), N,N-диметилформамида (70 мл), карбоната калия (0,41 г) и уксусной кислоты хлордифторметилового эфира (0,22 мл) перемешивали при 80C в течение 2 ч. Смесь разбавляли водой, экстрагировали этилацетатом, и объединенные экстракты высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (4:1 по объему), с получением соединения, указанного в заголовке, в виде смеси, 0,26 г. 1H ЯМР (CDCl3):2,65 (s, 3H), 2,95 (s, 3H), 3,80 (s, 3H), 3,85 (s, 3H), 4,20 (s, 2H), 4,35 (s, 2H), 4,75 (s,2H), 4,85 (s, 2H), 6,60-8,05 (m, 14H). Приготовление 18d и 19d. [8-хлор-4-дифторметокси-3-(4-фторбензил)-2-метилхинолин-5-илокси] уксусная кислота и [8-хлор-2-дифторметокси-3-(4-фторбензил)-4-метилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-4-дифторметокси-3-(4-фторбензил)-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира и [8-хлор-2-дифторметокси-3-(4-фторбензил)-4-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,26 г), метанола (5,0 мл), воды (3,0 мл) и раствора гидроксида лития (0,13 г/мл) перемешивали при комнатной температуре в течение 1 ч. Этот раствор подкисляли добавлением соляной кислоты, экстрагировали этилацетатом, и объединенные экстракты высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 минут ацетонитрила в воде с получением [8-хлор-4 дифторметокси-3-(4-фторбензил)-2-метилхинолин-5-илокси]уксусной кислоты в виде белого твердого вещества, 0,032 г, и [8-хлор-2-дифторметокси-3-(4-фторбензил)-4-метилхинолин-5-илокси]уксусной кислоты в виде белого твердого вещества, 0,029 г. Приготовление 20a. 3-(4-Метансульфонилбензил)пентан-2,4-дион Раствор пентан-2,4-диона (4,4 г) в N,N-диметилформамиде (10 мл) добавляли по каплям за период 15 минут к перемешанной суспензии гидрида натрия (60% в масле, 1,7 г) в N,N-диметилформамиде (50 мл) при -5C. Смесь нагревали до комнатной температуры за 20 мин и добавляли раствор 1-бромметил-4 метансульфонилбензола (10 г) в N,N-диметилформамиде (20 мл) по каплям за период 10 мин. Полученную в результате смесь перемешивали при комнатной температуре в течение 17 ч, а затем разбавляли 1,0 М водной соляной кислотой (100 мл). Полученную в результате смесь экстрагировали смесью диэтилового эфира и этилацетата (1:1 по объему), и объединенные экстракты промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (2:1-1:2 по объему), получили соединение, указанное в заголовке, в виде бесцветной смолы, 3,7 г. 1H ЯМР (CDCl3):2,05 (s, 6H), 2,15 (s, 6H), 3,00 (s, 3H), 3,05 (s, 3H), 3,25 (d, J = 7,3 Гц, 2H), 3,75 (s,2H), 4,00 (t, J = 7,3 Гц, 1H), 7,35-7,40 (m, 4H), 7,85-7,90 (m, 4H). Приготовление 20b. 8-Хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (0,36 г), 3-(4-метансульфонилбензил)пентан-2,4-диона (0,5 г) и паратолуолсульфоновой кислоты моногидрата (0,05 г) нагревали при 160C в течение 2,5 ч. Смесь охлаждали до комнатной температуры и очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (50:1-2:1 по объему), с получением соединения, указанного в заголовке (7:10 смесь кето-енольных таутомеров), в виде бежевого твердого вещества, 0,32 г.MS: ESI (+ve) (Способ Б): 376 (M+H)+,Время удерживания 2,5 мин. Приготовление 20c. [8-Хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 8-хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ола (0,31 г), N,N-диметилформамида (5,0 мл), карбоната калия (0,46 г) и бромуксусной кислоты метилового эфира (0,35 г) перемешивали при комнатной температуре в течение 17 ч. Смесь разбавляли этилацетатом, и этот раствор промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью толуола, дихлорметана и этилацетата (1:1:0 - 0:1:0 и 0:1:1 по объему) получили соединение, указанное в заголовке, в виде белого твердого вещества, 0,20 г. 1MS: ESI (+ve) (Способ Б): 448 (M+H)+,Время удерживания 3,4 мин. Приготовление 20d: [8-хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,11 г), метанола (5,0 мл), воды (1,0 мл) и насыщенного водного раствора гидроксида лития (0,5 мл) перемешивали при комнатной температуре в течение 3 суток. pH раствора доводили до 4 добавлением ледяной уксусной кислоты, и метанол удаляли при пониженном давлении. Полученный в результате осадок собирали фильтрованием, промывали водой и высушивали с получением соединения,- 22015358 указанного в заголовке, в виде белого твердого вещества, 0,08 г. 1 Приготовление 21a. 8-Хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (5,0 г), 3-(4-хлорфенилсульфанил)пентан-2,4-диона (8,4 г), паратолуолсульфоновой кислоты моногидрата (3,20 г) и толуола (150 мл) нагревали с обратным холодильником в течение 2 суток. Смесь охлаждали до комнатной температуры, и растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате, промывали водой и насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и циклогексана (1:9 по объему), получили соединение, указанное в заголовке, в виде бледножелтого твердого вещества, 0,99 г. 1MS: ESI (+ve) (Способ Б): 350 (M+H)+,Время удерживания 4,5 мин. Приготовление 21b. [8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь 8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-ола (0,99 г), N,N-диметилформамида (40 мл), карбоната калия (0,60 г) и бромуксусной кислоты метилового эфира (0,32 мл) перемешивали при комнатной температуре в течение 24 ч. Растворитель удаляли при пониженном давлении и остаток разбавляли водой, и эту смесь экстрагировали этилацетатом. Объединенные экстракты промывали водой и насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:9 по объему), получили соединение,указанное в заголовке, в виде белого твердого вещества, 0,26 г. 1MS: ESI (+ve) (Способ Б): 421 (M+H)+,Время удерживания 4,2 мин. Приготовление 21c. [8-Хлор-3-(4-хлорбензолсульфонил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир и [8-хлор-3-(4-хлорбензолсульфинил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [8-хлор-3-(4-хлорфенилсульфанил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,050 г), 3-хлорпероксибензойной кислоты (0,040 г) и хлороформа перемешивали при комнатной температуре в течение 2 ч. После выпаривания растворителей смесь очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (99:1 по объему), с получением [8-хлор-3-(4-хлорбензолсульфонил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира в виде белого твердого вещества, 0,020 г, и [8-хлор-3-(4-хлорбензолсульфинил)-2,4 диметилхинолин-5-илокси]уксусной кислоты метилового эфира в виде твердого вещества кремового цвета, 0,056 г.- 23015358 Приготовление 21d. [8-хлор-3-(4-хлорбензолсульфонил)-2,4-диметилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорбензолсульфонил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,020 г), метанола (3,0 мл) и 1,0 М водного раствора гидроксида натрия (0,22 мл) перемешивали при комнатной температуре в течение 3 ч. pH раствора доводили до 5 добавлением муравьиной кислоты, и растворитель удаляли при пониженном давлении. В результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде, получили соединение, указанное в заголовке, в виде бледно-желтого твердого вещества, 0,0025 г. 1 Приготовление 22a. [8-Хлор-3-(4-хлорбензолсульфинил)-2,4-диметилхинолин-5-илокси]уксусная кислота Смесь [8-хлор-3-(4-хлорбензолсульфинил)-2,4-диметилхинолин-5-илокси]уксусной кислоты метилового эфира (0,050 г), метанола (3,0 мл) и 1,0 М водного раствора гидроксида натрия (0,57 мл) перемешивали при комнатной температуре в течение 3 ч. pH смеси доводили до 5 добавлением муравьиной кислоты, и растворитель удаляли при пониженном давлении. В результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде, получили соединение, указанное в заголовке, в виде бледно-желтого твердого вещества, 0,029 г. 1 Приготовление 23a. [8-Хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-илокси]ацетонитрил Смесь 8-хлор-3-(4-хлорбензил)-2,4-диметилхинолин-5-ола (0,80 г), N,N-диметилформамида (10 мл),карбоната калия (1,0 г) и бромацетонитрила (0,25 мл) перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли этилацетатом, и эту смесь промывали водой и насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде светло-коричневого твердого вещества,0,90 г. 1(0,026 г), хлорида аммония (0,022 г) и N,N-диметилформамида (1,5 мл) нагревали микроволновым излучением при 100C в течение 45 мин. Смесь разбавляли этилацетатом (20 мл) и насыщенным водным раствором хлорида натрия (20 мл). Полученный в результате осадок собирали фильтрованием, промывали водой и этилацетатом и высушивали с получением соединения, указанного в заголовке, в виде белого твердого вещества, 0,14 г. 1 Приготовление 24a. 2-(4-Хлорфенилсульфанил)-3-оксомасляной кислоты метиловый эфир К раствору 2-хлор-3-оксомасляной кислоты метилового эфира (3,5 г) и 4-хлорбензолтиола (4,1 г) в дихлорметане (60 мл) при 0C добавляли триэтиламин (4,0 мл). Смесь нагревали до комнатной температуры, а затем перемешивали при этой температуре в течение 3 суток. Растворитель удаляли при пониженном давлении, и остаток разбавляли этилацетатом, и эту смесь промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетата и циклогексана (1:4 по объему), с получением соединения, указанного в заголовке, в виде воскового твердого вещества, 7,2 г. 1H ЯМР (CDCl3):2,35 (s, 3H), 3,75 (s, 3H), 7,05 (d, J = 8,7 Гц, 2H), 7,25 (d, J = 8,7 Гц, 2H). Приготовление 24b. [8-хлор-3-(4-хлорфенилсульфанил)-2-метил-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир Смесь (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира (2,1 г), 2-(4 хлорфенилсульфанил)-3-оксомасляной кислоты метилового эфира (2,5 г), полифосфорной кислоты (10 г) и диоксана (30 мл) нагревали при 130C в течение 2 суток. Смесь охлаждали до комнатной температуры,и растворитель удаляли при пониженном давлении. Остаток разбавляли водой, и полученный в результате осадок собирали фильтрованием, промывали водой и дихлорметаном и высушивали с получением соединения, указанного в заголовке, 1,6 г.MS: ESI (+ve) (Способ Б): 424 (M+H)+,Время удерживания 3,4 мин. Приготовление 24c. [8-Хлор-3-(4-хлорфенилсульфанил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [8-хлор-3-(4-хлорфенилсульфанил)-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,26 г), N,N-диметилформамида (5,0 мл), карбоната калия (0,25 г) и уксусной кислоты хлордифторметилового эфира (0,13 мл) перемешивали при 80C в течение 17 ч. Смесь разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и циклогексана (7:3 по объему), с получением соединения, указанного в заголовке, 0,044 г.MS: ESI (+ve) (Способ Б): 474 (M+H)+,Время удерживания 4,5 мин. Приготовление 24d. [8-Хлор-3-(4-хлорфенилсульфанил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусная кислота Раствор [8-хлор-3-(4-хлорфенилсульфанил)-4-дифторметокси-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,044 г), тетрагидрофурана (3,0 мл) и 1,0 М водного раствора гидроксида натрия (0,15 мл) перемешивали при комнатной температуре в течение 1 ч. Раствор подкисляли добавлением 1,0 М водной соляной кислоты, и растворитель удаляли при пониженном давлении. Остаток разбавляли этилацетатом, и эту смесь промывали водой, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и полученное в результате твердое вещество промывали дихлорметаном и высушивали с получением соединения, указанного в заголовке, 0,024 г. 1 Приготовление 25a. [8-Хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-ил]уксусная кислота Смесь (3-амино-4-хлорфенил)уксусной кислоты метилового эфира (1,0 г), 2-(4-хлорбензил)-3 оксомасляной кислоты этилового эфира (1,3 г), полифосфорной кислоты (5 мл) и диоксана (10 мл) нагревали при 130C в течение 1,5 ч. Смесь разбавляли водой и pH этого раствора доводили до 3 добавлением ацетата натрия. Полученный в результате осадок собирали фильтрованием и очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана, этилацетата и метанола (1:0:0-10:1:0-1:1:020:0:1 и 0:0:1 по объему), с получением соединения, указанного в заголовке, 0,60 г. 1MS: ESI (+ve) (Способ Б): 376 (M+H)+, Время удерживания 3,6 мин. Приготовление 25b: [8-хлор-3-(4-хлорбензил)-4-дифторметокси-2-метилхинолин-5-ил]уксусная кислота Смесь [8-хлор-3-(4-хлорбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5-ил]уксусной кислоты (0,45 г), тетраэтиламмония бромида (0,025 г), 7,5 М водного раствора гидроксида натрия (1,6 мл) и диоксана(25 мл) нагревали при 80C, а затем через этот раствор барботировали хлордифторметан в течение 30 мин. Смесь охлаждали до комнатной температуры, и pH раствора доводили до 5 добавлением ледяной уксусной кислоты. Смесь экстрагировали этилацетатом, и объединенные экстракты промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении, и в результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде (40-95% органического модификатора),получили соединение, указанное в заголовке, в виде беловатого твердого вещества, 0,003 г. 1 Приготовление 26a. 2-(4-Метансульфонилбензил)-3-оксомасляной кислоты этиловый эфир Суспензию трет-бутоксида калия (4,5 г) в безводном тетрагидрофуране (70 мл) при 0C обрабатывали смесью трет-бутанола (0,2 мл) и 3-оксомасляной кислоты этилового эфира (5,2 г). После перемешивания при 15C в течение 15 мин добавляли раствор 1-бромметил-4-метансульфонилбензола (10 г) в тетрагидрофуране (30 мл), и полученную в результате смесь нагревали при 70C в течение 17 ч. Смесь разбавляли насыщенным водным раствором лимонной кислоты (20 мл) и экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью пентана и дихлорметана (2:1-0:1 по объему), с получением соединения, указанного в заголовке, в виде смолы, 3,5 г. 1H ЯМР (CDCl3):1,20 (t, J = 6,5 Гц, 3H), 2,25 (s, 3H), 3,05 (s, 3H), 3,25 (m, 2H), 3,85 (t, J = 7,6 Гц,1H), 4,10-4,25 (m, 2H), 7,40 (d, J = 8,4 Гц, 2H), 7,85 (d, J = 8,4 Гц, 2H). Приготовление 26b. [8-Хлор-3-(4-метансульфонилбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир Смесь (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира (0,54 г), 2-(4 метансульфонилбензил)-3-оксомасляной кислоты этилового эфира (0,75 г), полифосфорной кислоты (2,5- 26015358 мл) и диоксана (10 мл) нагревали при 130C в течение 20 ч. Смесь разбавляли водой, и pH этого раствора доводили до 3 добавлением ацетата натрия. Полученный в результате осадок собирали фильтрованием и высушивали с получением соединения, указанного в заголовке, в виде белого твердого вещества, 1,0 г. 1MS: ESI (+ve) (Способ Б): 450 (M+H)+, Время удерживания 2,7 мин. Приготовление 26c: [8-хлор-4-дифторметокси-3-(4-метансульфонилбензил)-2-метилхинолин-5 илокси]уксусной кислоты метиловый эфир Перемешанную смесь [8-хлор-3-(4-метансульфонилбензил)-2-метил-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метилового эфира (0,40 г), N,N-диметилформамида (15 мл) и карбоната калия(0,37 г) охлаждали до -80C, и через этот раствор барботировали хлордифторметан в течение 30 мин. Колбу герметично закрывали, и полученную в результате смесь нагревали до комнатной температуры за 30 мин, а затем перемешивали при этой температуре в течение 3 суток, а затем при 50C в течение 6 ч. Избытку хлордифторметана давали испариться, и остаток разбавляли этилацетатом. Смесь промывали водой и насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-1:2 по объему), с получением соединения, указанного в заголовке, в виде бесцветной смолы, 0,41 г. 1MS: ESI (+ve) (Способ Б): 500 (M+H)+,Время удерживания 3,6 мин. Приготовление 26d. [8-Хлор-4-дифторметокси-3-(4-метансульфонилбензил)-2-метилхинолин-5 илокси]уксусная кислота Раствор [8-хлор-4-дифторметокси-3-(4-метансульфонилбензил)-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,13 г), метанола (20 мл), насыщенного водного раствора гидроксида лития(1,0 мл) и воды (2,0 мл) перемешивали при комнатной температуре в течение 45 мин. pH раствора доводили до 5 добавлением ледяной уксусной кислоты, и метанол удаляли при пониженном давлении. Полученный в результате осадок собирали фильтрованием и очищали препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 45 мин ацетонитрила в воде (10-95% органического модификатора) с получением соединения, указанного в заголовке, в виде бледно-желтого твердого вещества, 0,014 г. 1 Приготовление 27a. [3-(4-Хлорбензил)-8-фтор-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метиловый эфир Смесь (3-амино-4-фторфенокси)уксусной кислоты метилового эфира (0,50 г), 2-(4-хлорбензил)-3 оксомасляной кислоты этилового эфира (7,4 г) и полифосфорной кислоты (1,1 г) нагревали при 130C в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали водой и высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле,элюируя смесью дихлорметана и метанола (19:1 по объему), с получением соединения, указанного в заголовке, 0,29 г. 1H ЯМР (CDCl3):2,60 (s, 3H), 3,90 (s, 3H), 4,10 (s, 2H), 4,80 (s, 2H), 6,60 (dd, J = 3,6, 8,7 Гц, 1H),7,15-7,25 (m, 5H). Приготовление 27b. [3-(4-Хлорбензил)-4-дифторметокси-8-фтор-2-метилхинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [3-(4-хлорбензил)-8-фтор-2-метил-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (0,29 г), N,N-диметилформамида (10 мл), карбоната калия (0,62 г) и уксусной кислоты хлордифторметилового эфира (0,31 мл) перемешивали при 70C в течение 17 ч. Смесь охлаждали до- 27015358 комнатной температуры, разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты высушивали над сульфатом натрия, и растворитель удаляли при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью циклогексана и этилацетата (4:1 по объему), получили соединение, указанное в заголовке, 0,18 г.MS: ESI (+ve) (Способ Б): 439 (M+H)+,Время удерживания 4,1 мин. Приготовление 27c. [3-(4-Хлорбензил)-4-дифторметокси-8-фтор-2-метилхинолин-5-илокси]уксусная кислота Раствор [3-(4-хлорбензил)-4-дифторметокси-8-фтор-2-метилхинолин-5-илокси]уксусной кислоты метилового эфира (0,18 г), метанола (3,5 мл), воды (2,0 мл), тетрагидрофурана (3,5 мл) и раствора гидроксида лития (0,036 г) перемешивали при комнатной температуре в течение 30 мин. Раствор подкисляли добавлением 1,0 М водной соляной кислоты, экстрагировали этилацетатом, и объединенные экстракты высушивали над сульфатом натрия. Растворитель удаляли при пониженном давлении, и в результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 мин ацетонитрила в воде, получили соединение, указанное в заголовке, в виде желтого твердого вещества, 0,088 г. 1 Приготовление 28a. 8-Хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ол Смесь 3-амино-4-хлорфенола (1,0 г), 3-(4-метансульфонилбензил)пентан-2,4-диона (0,53 г), метансульфоновой кислоты (3 капли) и толуола (20 мл) нагревали с обратным холодильником в течение 3 ч. Смесь охлаждали до комнатной температуры, и растворитель удаляли при пониженном давлении. Остаток разбавляли этилацетатом, а затем промывали водой и насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (1:0-99:1 по объему) получили соединение, указанное в заголовке, в виде бледно-желтого твердого вещества, 0,32 г.(0,10 г),N-фенилтрифторметансульфонимида (0,11 г), карбоната калия (0,11 г) и тетрагидрофурана (3,0 мл) нагревали микроволновым излучением при 130C в течение 5 мин. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. В результате очистки остатка колоночной хроматографией на силикагеле,элюируя дихлорметаном, получили соединение, указанное в заголовке, в виде твердого вещества кремового цвета, 0,11 г.MS: ESI (+ve) (Способ Б): 508 (M+H)+,Время удерживания 4,1 мин. Приготовление 28c. [8-Хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ил]уксусной кислоты метиловый эфир Смесь трифторметансульфоновой кислоты 8-хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-илового эфира (0,11 г), 1-трет-бутилдиметилсилилокси)-1-метоксиэтена (0,22 мл), ацетата натрия (0,019 г), бис(дибензилиденацетон)палладия (0,006 г) и 1,1'-бис(дифенилфосфино)ферроцена (0)(0,006 г) в N,N-диметилформамиде (1,0 мл) нагревали микроволновым излучением при 120C в течение 20 мин. Смесь разбавляли этилацетатом, и этот раствор промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и в результате очистки остатка колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и метанола (1:0-99:1 по объему), получили соединение, указанное в заголовке, в виде коричневого масла, 0,050 г.MS: ESI (+ve) (Способ Б): 431 (M+H)+,- 28015358 Время удерживания 3,3 мин. Приготовление 28d. [8-Хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ил]уксусная кислота Раствор [8-хлор-3-(4-метансульфонилбензил)-2,4-диметилхинолин-5-ил]уксусной кислоты метилового эфира (0,050 г), метанола (3,0 мл) и 1,0 М водного раствора гидроксида натрия (0,63 мл) перемешивали при комнатной температуре в течение 18 ч. pH раствора доводили до 5 добавлением муравьиной кислоты, и растворитель удаляли при пониженном давлении. В результате очистки остатка препаративной ВЭЖХ с обращенной фазой, используя градиент в течение 30 минут ацетонитрила в воде (30-70% органического модификатора), получили соединение, указанное в заголовке, в виде белого твердого вещества, 0,0060 г. 1 Приготовление 29a. 2-(4-Метансульфонилбензил)-3-оксопентановой кислоты этиловый эфир Суспензию трет-бутоксида калия (3,9 г) в безводном тетрагидрофуране (60 мл) при 0C обрабатывали смесью трет-бутанола (0,15 мл) и 3-оксопентановой кислоты этилового эфира (5,0 г). Смесь нагревали до комнатной температуры, и через 30 мин добавляли раствор 1-бромметил-4 метансульфонилбензола (8,6 г) в тетрагидрофуране (20 мл), и полученную в результате смесь нагревали при 70C в течение 17 ч. Смесь охлаждали до комнатной температуры и разбавляли водой (20 мл), и эту смесь экстрагировали этилацетатом. Объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-4:1 по объему), с получением соединения, указанного в заголовке, в виде белого твердого вещества, 3,6 г.MS: ESI (+ve) (Способ Б): 313 (M+H)+,Время удерживания 3,2 мин. Приготовление 29b. [8-Хлор-2-этил-3-(4-метансульфонилбензил)-4-оксо-1,4-дигидрохинолин-5 илокси]уксусной кислоты метиловый эфир Смесь (3-амино-4-хлорфенокси)уксусной кислоты метилового эфира (0,54 г), 2-(4 метансульфонилбензил)-3-оксопентановой кислоты этилового эфира (0,78 г), полифосфорной кислоты(2,5 мл) и диоксана (10 мл) нагревали при 130C в течение 17 ч. Смесь разбавляли водой (100 мл), и pH этого раствора доводили до 4 добавлением ацетата натрия. Смесь экстрагировали этилацетатом, и объединенные экстракты промывали насыщенным водным раствором хлорида натрия и высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении с получением соединения, указанного в заголовке, в виде твердого вещества медового цвета, 1,2 г.MS: ESI (+ve) (Способ Б): 462 (M+H)+,Время удерживания 2,9 мин. Приготовление 29c. [8-Хлор-4-дифторметокси-2-этил-3-(4-метансульфонилбензил)хинолин-5-илокси]уксусной кислоты метиловый эфир Смесь [8-хлор-2-этил-3-(4-метансульфонилбензил)-4-оксо-1,4-дигидрохинолин-5-илокси]уксусной кислоты метилового эфира (1,2 г), N,N-диметилформамида (15 мл) и карбоната калия (1,1 г) охлаждали до -80C, и через этот раствор барботировали хлордифторметан в течение 30 мин. Колбу герметично закрывали, и полученную в результате смесь нагревали до комнатной температуры в течение 30 мин, а затем нагревали при 50C в течение 17 ч. Избытку хлордифторметана давали испариться, и остаток разбавляли этилацетатом, и эту смесь промывали насыщенным водным раствором хлорида натрия, а затем высушивали над сульфатом магния. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и этилацетата (1:0-4:1 по объему), с получением соединения, указанного в заголовке, в виде прозрачной смолы, 0,27 г.
МПК / Метки
МПК: A61P 11/00, A61P 43/00, C07D 215/00, A61K 31/47
Метки: хинолины, терапевтическое, применение
Код ссылки
<a href="https://eas.patents.su/30-15358-hinoliny-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Хинолины и их терапевтическое применение</a>












