Производные бензилпиперазина и их применение для лечения состояний или расстройств, опосредованных gpr38-рецепторами
Номер патента: 14061
Опубликовано: 30.08.2010
Авторы: Стэнвэй Стивен Джеймс, Вестауэй Сьюзан Мари, Джонсон Кристофер Норберт, Томпсон Мервин, Макферсон Дэвид Тимоти, Стемп Джеффри
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
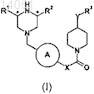
где А представляет собой фенил или 6-членное гетероарильное кольцо, необязательно замещенное галогеном, C1-4алкилом или C1-4алкокси;
R1 и R2независимо представляют собой Н или C1-4алкил;
R3 является необязательно замещенным фенилом или необязательно замещенным 5- или 6-членным гетероарилом;
X представляет собой (CR4R5)n;
n равно 1 или 2;
Y представляет собой NH, О или СН2;
R4 и R5независимо выбраны из водорода и C1-4алкила.
2. Соединение формулы (I) или его фармацевтически приемлемая соль, где
А представляет собой фенил или пиридил;
R1 представляет собой водород или метил;
R2 представляет собой водород или метил;
R3 представляет собой необязательно замещенный фенил;
Y представляет собой NH или О;
X представляет собой (CR4R5)n;
n равно 1 или 2 и
R4 и R5независимо представляют собой водород или метил.
3. Соединение по любому из пп.1, 2, где (пиперазинил)метиленовый заместитель и X находятся в пара-положении по отношению друг к другу в кольце А.
4. Соединение по любому из пп.1-3, где R1 и R2 являются отличными от водорода и пиперазиновые
С*-атомы углерода имеют 3R,5S-конфигурацию.
5. Соединение, выбранное из
1-[(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)ацетил]-N-(4-фторфенил)-4-пиперидинамина;
N-(3-фторфенил)-1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
N-(4-фторфенил)-1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
3-({1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
4-({1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
N-(3,4-дифторфенил)-1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
N-[4-фтор-3-(метилокси)фенил]-1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
(3S)-1-{[4-(2-{4-[(4-фторфенил)окси]-1-пиперидинил}-2-оксоэтил)фенил]метил}-3-метилпиперазина;
(3S)-1-{[4-(2-{4-[(3-фторфенил)окси]-1-пиперидинил}-2-оксоэтил)фенил]метил}-3-метилпиперазина;
1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-N-[3-(трифторметил)фенил]-4-пиперидинамина;
1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-N-[4-(трифторметил)фенил]-4-пиперидинамина;
N-(3-фторфенил)-1-{[4-(1-пиперазинилметил)фенил]ацетил}-4-пиперидинамина;
N-(3-фторфенил)-1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
N-(3,4-дифторфенил)-1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
(3R)-1-{[4-(2-{4-[(4-фторфенил)окси]-1-пиперидинил}-2-оксоэтил)фенил]метил}-3-метилпиперазина;
(3R)-1-{[4-(2-{4-[(3-фторфенил)окси]-1-пиперидинил}-2-оксоэтил)фенил]метил}-3-метилпиперазина;
4-({1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}окси)бензонитрила;
4-({1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
3-({1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-N-[3-(трифторметил)фенил]-4-пиперидинамина;
N-(3-фторфенил)-1-[(3-(метилокси)-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
2-фтор-5-({1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
1-[3-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)пропаноил]-N-(4-фторфенил)-4-пиперидинамина;
1-[3-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)пропаноил]-N-(3-фторфенил)-4-пиперидинамина;
N-(4-фторфенил)-1-[3-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)пропаноил]-4-пиперидинамина;
N-(3-фторфенил)-1-[3-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)пропаноил]-4-пиперидинамина;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)пропаноил]-N-(4-фторфенил)-4-пиперидинамина;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)пропаноил]-N-(3-фторфенил)-4-пиперидинамина;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)-2-метилпропаноил]-N-(4-фторфенил)-4-пиперидинамина;
1-[2-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)-2-метилпропаноил]-N-(3-фторфенил)-4-пиперидинамина;
(3R,5S)-1-{[4-(2-{4-[(4-фторфенил)окси]-1-пиперидинил}-1,1-диметил-2-оксоэтил)фенил]метил}-3,5-диметилпиперазина;
N-(3-фторфенил)-1-[3-(5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)пропаноил]-4-пиперидинамина;
1-[(3-хлор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-N-(3-фторфенил)-4-пиперидинамина;
N-(2-фторфенил)-1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина;
N-(3-фторфенил)-1-[(5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)ацетил]-4-пиперидинамина;
2-({1-[(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино)бензонитрила;
гидрохлорида 2-фтор-4-({1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинил}амино) бензонитрила.
6. Применение соединения по любому из пп.1-5 для лечения состояний или расстройств, опосредованных GPR38-рецепторами.
7. Применение по п.6, в котором состояние или расстройство представляет собой расстройства типа гастроэзофагеального рефлюкса, функциональную диспепсию, синдром раздраженной кишки, запор, кишечную псевдонепроходимость, паралитическую непроходимость кишечника после хирургического вмешательства или другой манипуляции, рвоту, желудочный застой или гипокинезию, вызванную различными болезнями, такими как диабет, и/или введением других лекарств, болезнь Крона, колит, кахексию, ассоциированную с запущенными заболеваниями, такими как рак и/или последствия его лечения, нарушение аппетита/метаболизма, связанное с кахексией, и другие расстройства, такие как недержание.
8. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства для лечения состояний или расстройств, опосредованных GPR38-рецепторами.
9. Применение по п.8, в котором состояние или расстройство представляют собой расстройства типа гастроэзофагеального рефлюкса, функциональную диспепсию, синдром раздраженной кишки, запор, кишечную псевдонепроходимость, паралитическую непроходимость кишечника после хирургического вмешательства или другой манипуляции, рвоту, желудочный застой или гипокинезию, вызванную различными заболеваниями, такими как диабет, и/или введением других лекарств, болезнь Крона, колит, кахексию, ассоциированную с запущенными заболеваниями, такими как рак и/или последствия его лечения, нарушение аппетита/метаболизма, связанное с кахексией, и другие расстройства, такие как недержание.
10. Способ получения соединения или его фармацевтически приемлемой соли по любому из пп.1-5, где А представляет собой фенил и X представляет собой СН2, который включает:
а) взаимодействие соединения формулы (II)
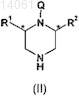
где R1и R2 такие, как определено для формулы (I); и
Q представляет собой водород или подходящую защитную группу азота,
с соединением формулы (III)
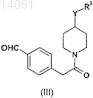
где Y и R3такие, как определено для формулы (I),
в условиях реакции, подходящих для восстановительного алкилирования, в подходящем растворителе и
b) последующее необязательное проведение одной или нескольких из следующих реакций:
1) превращение одного соединения формулы (I) в другое соединение формулы (I);
2) удаление любой защитной группы;
3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения.
11. Способ получения соединения формулы (III), где способ включает взаимодействие соединения формулы (IV)
![]()
где R3и Y такие, как определено в отношении формулы (I) в п.1,
с соединением формулы (V)
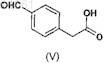
в присутствии подходящего реагента сочетания.
12. Способ получения соединения или его фармацевтически приемлемой соли по любому из пп.1-5, где А представляет собой фенил и X представляет собой СН2, который включает:
а) взаимодействие соединения формулы (VI)
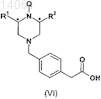
где R1и R2 такие, как определено в отношении формулы (I); и
Q представляет собой водород или подходящую защитную группу азота,
с соединением формулы (IV) в присутствии подходящего реагента сочетания, в подходящем растворителе и
b) последующее необязательное проведение одной или нескольких из следующих реакций:
1) превращение одного соединения формулы (I) в другое соединение формулы (I);
2) удаление любой защитной группы или
3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения.
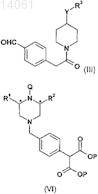
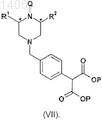
13. Способ получения соединения формулы (VI), который включает гидролиз и декарбоксилирование соединения формулы (VII)

где R1, R2 и Q такие, как определено в п.12; и
Р представляет собой подходящую алкильную группу.
14. Соединение формул (III), (VI) или (VII), в которых R1, R2, R3 и Y являются такими, как определено в отношении формулы (I) в п.1; Q представляет собой водород или подходящую защитную группу азота и Р представляет собой подходящую алкильную группу
15. Фармацевтическая композиция, включающая соединение по любому из пп.1-5.
16. Способ получения фармацевтической композиции по п.15.
17. Способ лечения состояний или расстройств у млекопитающих, включая людей, которые могут быть опосредованы через GPR38-рецепторы.
18. Соединение по любому из пп.1-5, представляющее собой N-(3-фторфенил)-1-[(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)ацетил]-4-пиперидинамина.
Текст
ПРОИЗВОДНЫЕ БЕНЗИЛПИПЕРАЗИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ ИЛИ РАССТРОЙСТВ, ОПОСРЕДОВАННЫХ GPR38-РЕЦЕПТОРАМИ Настоящее изобретение относится к производным бензилпиперазина, таким как соединения формулы (I) которые обладают активностью в качестве агонистов GPR38-рецептора, и к применению таких соединений или их фармацевтических композиций для приготовления лекарственных средств,пригодных для лечения желудочно-кишечных расстройств.(71)(73) Заявитель и патентовладелец: ГЛАКСО ГРУП ЛИМИТЕД (GB) 014061 Настоящее изобретение относится к новым производным бензилпиперазина, обладающим фармакологической активностью, к способам их получения, фармацевтическим композициям, содержащим их,и их применению при лечении различных расстройств.GPR38 представляет собой 7-трансмембранный, спаренный с G-белком рецептор, с высоким сродством к пептиду мотилину [Feighner et al. Science, 1999, 284, 2184], что позволяет предполагать, что вся или большая часть эндогенного мотилина опосредована через этот рецептор. Мотилин представляет собой пептид, состоящий из 22 аминокислот, найденный в больших количествах в пределах эндокриноподобных клеток желудочно-кишечного тракта и особенно в области двенадцатиперстной кишки - тощей кишки. Во время отсутствия пищи пептид, как известно, связан с началом активности перемещающегося комплекса фазы III в пределах желудка [Boivin et al., Dig. Dis. Sci. 1992,37, 1562], что позволяет предполагать роль в механизмах прокинетической активности. Мотилин также высвобождается из кишки в процессе еды, мнимого кормления, растяжения желудка или путем перорального или внутривенного введения питательного вещества [Christofides et al. Gut 1979, 20, 102;Bormans et al., Scand. J. Gastroenterol. 1987, 22, 781], что предполагает дополнительные функции этого пептида при модуляции режимов перистальтики в течение кормления. У животных или у человека мотилин, как давно известно, повышает желудочно-кишечную перистальтику и способствует опорожнению желудка и кишечному поступательному движению в направлении заднего прохода во время как состояний отсутствия пищи, так и еды. Эта активность, как полагают,проявляется, главным образом, благодаря облегчению, по меньшей мере, холинергической возбуждающей функции кишки [Van Assche et al. Eur. J. Pharmacol. 1997, 337, 267], возможно также включая активацию блуждающего нерва [MathisMalbert, Am. J. Physiol. 1998, 274, G80]. Кроме того, более высокие концентрации мотилина непосредственно индуцируют небольшое сокращение мышцы [Van Assche et al.,Eur. J. Pharmacol. 1997, 337, 267]. Антибиотик эритромицин, как было показано, имитирует желудочно-кишечную активность мотилина в дополнение к его описанным ранее антибиотическим свойствам [см. Peeters, in Problems of theGastrointestinal Tract in Anaesthesia Ed., Herbert M.K. et al. Springer-Verlag, Berlin, Heidelberg, 1999,p. 39-51]. Не так давно было показано, что эритромицин активирует GPR38-рецептор, подтверждая его способность имитировать функцию мотилина [Carreras et al., Analyt. Biochem. 2002, 300, 146]. Кроме того, доступность этого непептидного агониста мотилинового рецептора позволила предпринять, по меньшей мере, некоторые клинические исследования для того, чтобы изучить клинический потенциал агонистов мотилинового рецептора. Эти исследования согласованно продемонстрировали способность повышать опорожнение желудка в различных состояниях, ассоциированных с парезом желудка, таким как функциональная диспепсия и диабетический парез желудка. Кроме того, эритромицин, как было показано, увеличивает давление нижнего пищеводного сфинктера у человека, что, совместно с ускорением опорожнения желудка, допускает роль при лечении расстройства типа гастроэзофагеального рефлюкса(GERD). В конечном счете эритромицин был использован для промотирования кишечной продвигающей активности, нашел клиническое применение при лечении псевдонепроходимости и при состояниях с нарушенной перистальтикой толстой кишки [Peeters, in Problems of the Gastrointestinal Tract in AnaesthesiaEd., Herbert M.K. et al. Springer-Verlag, Berlin, Heidelberg 1999, p. 39-51]. Следовательно, ожидается, что агонисты GPR38-рецептора будут имитировать активность мотилина и находить клиническое применение при лечении желудочно-кишечных расстройств, ассоциированных с гипокинезией, особенно функциональных кишечных расстройств, таких как GERD, функциональная диспепсия (FD) и синдром раздраженной кишки (IBS). Также соединения будут применимы для лечения других GI состояний, где причина известна и в которых GI-моторика понижена. Такие состояния включают запор, вызванный различными болезнями, такими как те, что ассоциированы с невропатией,и/или введением других лекарств, кишечной псевдонепроходимостью, паралитической непроходимостью кишечника после хирургического вмешательства или некоторых других манипуляций, желудочного застоя или гипокинезии, вызванной различными болезнями, такими как диабет, и/или введением других лекарств. Интересно, что способность мотилина или эритромицина активировать блуждающий нерв, ассоциация этого нерва с изменениями в пищевом поведении [например, Fumess et al. Auton. Neurosci. 2001, 92, 28] и хромосомном положении GPR38 [основываясь на Ensembl: 13q21.1 (58,46-59,46 Mb)] в пределах маркеров (D13S257-13q14.11 до D13S258 при 13q21.33) локуса, ассоциированного с ожирениемGPR38-рецептора, будут в дополнение к промотированию желудочно-кишечной подвижности, облегчать поведение во время еды, по меньшей мере, у тех пациентов, у которых присутствует некоторая степень подавления аппетита или кахексии. Такая активность указывает на то, что агонисты этого рецептора найдут клиническое применение при лечении симптомов, ассоциированных, например, с лечением рака или присутствием рака как такового.-1 014061 Кроме способности агонистов мотилинового рецептора промотировать желудочно-кишечную подвижность, связь полиморфизма мотилинового гена с болезнью Крона [Annese et al. Dig. Dis. Sci. 1998, 43,715-710] и изменения в плотности мотилинового рецептора во время колита [Depoortere et al.,Neurogastroenterol. Motil. 2001, 13, 55] предполагают применение агонистов мотилинового рецептора для лечения воспалительных кишечных состояний вообще. Наконец, GPR38 также был найден в областях вне желудочно-кишечного тракта. Эти области включают гипофиз, жировую ткань, мочевой пузырь и определенные области мозга. Предшествующие данные предполагают клиническое применение при стимуляции функции гипофиза, такое как высвобождение агентов, активирующих секрецию гормона роста, присутствие в пределах жировой ткани также предполагает роль в контроле массы тела, и присутствие в пределах мочевого пузыря предполагает значимость агонистов этого рецептора при лечении недержания. Присутствие GPR38 в пределах мозга поддерживает уже упомянутые желудочно-кишечные функции и функции питания, но, кроме того, предполагает вовлечение рецептора в большой спектр вагусно-гипоталамических функций. В WO 9410185, ЕР 838469, WO 9823629, DE 19805822 и US 6165985 заявлены производные эритромицина, направленные на GPR38 для применения при расстройствах, связанных с желудочнокишечной подвижностью. В WO 9921846, WO 0185694, WO 0168620, WO 0168621 и WO 0168622 раскрыты серии низкомолекулярных антагонистов GPR38-рецептора. В JP 07138284 и ЕР 807639 раскрыты пептидные агонисты. В JP 09249620, WO 02092592, WO 05027637, US 2005065156 и Li et al. 2004, Journalof Medicinal Chemistry, 47(7), p. 1704-1708 раскрыты серии низкомолекулярных агонистов. В настоящее время найден структурно новый класс соединений, которые являются частичными или полными агонистами GPR38-рецептора. Таким образом, настоящее изобретение предоставляет соединения формулы (I) или их фармацевтически приемлемые соли или сольваты где А представляет собой фенил или 6-членное гетероарильное кольцо, необязательно замещенное галогеном, C1-4 алкилом или C1-4 алкокси;R1 и R2 независимо представляют собой Н или C1-4 алкил;R3 представляет собой необязательно замещенный фенил или необязательно замещенный 5- или 6-членный гетероарил;R4 и R5 независимо выбраны из водорода и C1-4 алкила. Когда R3 является замещенным, он может иметь 1, 2 или 3 заместителя, каждый независимо выбранный из галогена, C1-4 алкила, C1-4 алкокси, C3-7 циклоалкила, гидрокси, трифторметокси, трифторметила, нитро, циано, фенила, NH2, NHR8, NR8R9, NHCOR8, NHSO2R8, C(O)CF3, С(O)C1-4 алкила,С(O)C3-7 циклоалкила, C(O)OC1-4 алкила, С(О)ОС 3-7 циклоалкила, ОС(О)C1-4 алкила, ОС(О)С 3-7 циклоалкила,CONH2, CONHR8, CONR8R9, SOR9, SO2R9, OSO2R9, OSO2CF3, SO2NH2, SO2NHR8, SO2NR8R9, где R8 и R9 могут быть одинаковыми или различными и представлять собой C1-4 алкил, фенил, необязательно замещенный галогеном или 5- или 6-членным гетероарилом, необязательно замещенным галогеном. Термин "алкил" в виде группы или части группы, например алкокси или гидроксиалкил, относится к линейной или разветвленной алкильной группе во всех изомерных формах. Термин "С 1-4 алкил" относится к алкильной группе, как определено выше, содержащей по меньшей мере 1 и самое большее 4 атома углерода. Примеры таких алкильных групп включают метил, этил, пропил, изопропил, н-бутил, изобутил, втор-бутил или трет-бутил. Примеры таких алкоксигрупп включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси и трет-бутокси. Используемый в данном описании термин "галоген" относится к фтору (F), хлору (Cl), брому (Br) или йоду (I); термин "галоид" относится к галогенам: фтору (-F), хлору (-Cl), брому (-Br) и йоду (-I). Термин "гетероарил" представляет 5- или 6-членное ненасыщенное кольцо, которое включает один или несколько гетероатомов. Когда гетероарил представляет 5-членную группу, она содержит гетероатом, выбранный из О, N или S и может необязательно содержать дополнительно от 1 до 3 атомов азота. Когда гетероарил представляет 6-членную группу, она содержит от 1 до 3 атомов азота. Примеры таких 5- или 6-членных гетероарильных колец включают пирролил, триазолил, тиадиазолил, тетразолил,имидазолил, пиразолил, изотиазолил, тиазолил, изоксазолил, оксазолил, оксадиазолил, фуразанил, фуранил, тиенил, пиридил, пиримидинил, пиразинил, пиридазинил и триазинил.-2 014061 В одном варианте осуществления изобретения: А представляет собой фенил или пиридил;R1 представляет собой водород или метил;R2 представляет собой водород или метил;R3 представляет собой необязательно замещенный фенил;R4 и R5 независимо представляют собой водород или метил. В другом варианте осуществления изобретения: А представляет собой фенил;R1 представляет собой водород или метил;R2 представляет собой водород или метил;R3 представляет собой необязательно замещенный фенил;R4 и R5, оба, представляют собой водород. Когда R3 представляет собой замещенный фенил, он может быть замещен 1-2 заместителями, выбранными из фтора, циано, трифторметила и метокси. В следующем варианте осуществления изобретения (пиперазинил)метиленовый заместитель и X расположены в пара-положении по отношению друг к другу в кольце А. В определенных соединениях формулы (I), в зависимости от природы заместителя имеются хиральные атомы углерода, такие как атом углерода, обозначенный символом , и, следовательно, соединения формулы (I) могут существовать в виде стереоизомеров. Изобретение распространяется на все оптические изомеры, такие как стереоизомерные формы соединений формулы (I), включая энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Различные стереоизомерные формы могут быть разделены или расщеплены одна от другой традиционными способами или любой данный изомер может быть получен традиционными стереоселективными или асимметрическими синтезами. Предпочтительные соединения формулы (I), где R1 и R2, оба, представляют собой метил, являются соединениями, в которых пиперазиновые С атомы углерода имеют цис-конфигурацию. Согласно изобретению определенные соединения могут существовать в различных таутомерных формах, и будет понятно, что изобретение охватывает все такие таутомерные формы. Подходящие соединения по изобретению представляют собой следующие соединения: 1-[(4-[(3R,5S)-3,5-диметил-1-пиперазинил]метилфенил)ацетил]-N-(4-фторфенил)-4 пиперидинамин (Е 1);N-(3-фторфенил)-1-[(5-[(3S)-3-метил-1-пиперазинил]метил-2-пиридинил)ацетил]-4 пиперидинамин; 2-(1-[(4-[(3R)-3-метил-1-пиперазинил]метилфенил)ацетил]-4-пиперидиниламино)бензонитрил; гидрохлорид 2-фтор-4-(1-[(4-[(3S)-3-метил-1-пиперазинил]метилфенил)ацетил]-4-пиперидиниламино)бензонитрила. Соединения формулы (I) могут образовывать соответствующие кислотно-аддитивные соли. Понятно, что для применения в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают те, что описаны в J. Pharm. Sci, 1977, 66, 1-19, такие как кислотно-аддитивные соли,образованные с неорганическими кислотами, например хлористо-водородной, бромисто-водородной,серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной, малеиновой,уксусной, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Определенные соединения формулы (I) могут образовывать кислотноаддитивные соли с одним или несколькими эквивалентами кислоты. Настоящее изобретение включает в пределах его объема все возможные стехиометрические и нестехиометрические формы. Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме и в случае выделения в кристаллической форме могут необязательно быть гидратированными или сольватированными. Данное изобретение включает в пределах его объема стехиометрические гидраты или сольваты, а также соединения, содержащие переменные количества воды и/или растворителя.-4 014061 В следующем аспекте данное изобретение предоставляет способы получения соединения формулы (I) где А представляет собой фенил иX представляет собой СН 2,или его фармацевтически приемлемой соли или сольвата,причем способы включают взаимодействие соединения формулы (II)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ),с соединением формулы (III) где Y и R3 такие, как определено в формуле (I),с применением условий реакции, подходящих для восстановительного алкилирования, например, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (III) могут быть получены путем взаимодействия соединения формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси. Альтернативно, соединение формулы (III) может быть получено путем взаимодействия соединения формулы (IV) с активированным производным соединения формулы (V), таким как хлорангидрид, с применением общих способов, описанных в J. March, Advanced Organic Chemistry, 4th Edition, J. WileySons, 1992, p. 417-418. Соединения формулы (IV), в которых Y=NH, могут быть получены по реакции восстановительного алкилирования, которая включает взаимодействие подходящего производного анилина с подходящим образом защищенным пиперидин-4-оном, таким как 1-(трет-бутоксикарбонил)пиперидин-4-он, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в растворителе, таком как дихлорэтан, с последующим удалением защитной группы азота традиционными способами, как описано ниже.-5 014061 Соединения формулы (IV), где Y=NH, также могут быть получены по реакции арилирования, которая включает взаимодействие подходящего арилгалогенида с подходящим образом защищенным 4-аминопиперидином, таким как (1-трет-бутоксикарбонил)-4-аминопиперидин, в присутствии подходящей каталитической системы, такой как ацетат палладия(II)/BINAP, в растворителе, таком как 1,4-диоксан, с последующим удалением защитной группы азота традиционными способами, как описано ниже. Соединения формулы (IV), где Y=O, могут быть получены по реакции алкилирования, которая включает взаимодействие подходящего производного фенола с подходящим образом защищенным 4-гидроксипиперидином, таким как 1-(трет-бутоксикарбонил)-4-гидроксипиперидин, в присутствии трифенилфосфина и диизопропилазодикарбоксилата, в растворителе, таком как тетрагидрофуран, с последующим удалением защитной группы азота традиционными способами, как описано ниже. Соединения формулы (V) являются известными или могут быть получены с применением традиционных способов. Например, для 4-формилфенилуксусной кислоты обработка 4-бромметилфенилуксусной кислоты гексаметилентетрамином с применением способов, подобных тем, что описаны в J. March, Advanced Organic Chemistry, 4th Edition, J. WileySons, 1992, p. 1194. Настоящее изобретение предоставляет дополнительный способ получения соединения формулы (I),где А представляет собой фенил и X представляет собой CH2, или его фармацевтически приемлемой соли или сольвата, причем способ включает взаимодействие соединения формулы (VI)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ),с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Альтернативно, соединение формулы (I), где А представляет собой фенил и X представляет собой СН 2, или его фармацевтически приемлемая соль или сольват могут быть получены способом, который включает взаимодействие активированного производного соединения формулы (VI), такого как хлорангидрид, с соединением формулы (IV) с применением общих способов, описанных в J. March, AdvancedOrganic Chemistry, 4th Edition, J. WileySons, 1992, p. 417-418; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (VI) могут быть получены традиционным гидролизом и декарбоксилированием соединения формулы (VII)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ), и Р представляет собой подходящую алкильную группу, такую как метил или этил,с использованием водного гидроксида натрия в приемлемом растворителе, таком как 1,4-диоксан, с последующим подкислением и декарбоксилированием путем нагревания в подходящем растворителе, та-6 014061 ком как толуол. Соединения формулы (VII) могут быть получены путем взаимодействия соединения формулы (VIII)L является подходящей уходящей группой, такой как галоген, например бром; иQ представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ), с подходящим диалкилмалонатом, таким как диэтилмалонат, в условиях палладиевого катализа в подходящем растворителе, таком как 1,4-диоксан,при кипении с обратным холодильником с применением способа, подобного тому, что описан в S.L.Buchwald et al. J. Am. Chem. Soc., 2000, vol. 122, p. 1360-1370. Соединения формулы (VIII) могут быть получены путем взаимодействия соединения формулы (IX) где L представляет собой галоген,с соединением формулы (II), с применением условий реакции, подходящих для восстановительного аминирования, например, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан. Соединения формулы (VI) также могут быть получены традиционным гидролизом соединения формулы (X)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как метил,с использованием подходящего основания, такого как водный гидроксид натрия, в подходящем растворителе, таком как тетрагидрофуран или 1,4-диоксан. Соединения формулы (X) могут быть получены путем взаимодействия соединения формулы (II) с соединением формулы (XI) где Р представляет собой подходящую алкильную группу, такую как метил; иL представляет собой подходящую уходящую группу, такую как галоген, например бром, в присутствии подходящего основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как диметилформамид. Соединения формулы (XI), где Р представляет собой метил, могут быть получены путем взаимодействия соединения формулы (XII)-7 014061 Соединения формулы (XII) являются коммерчески доступными. Настоящее изобретение предоставляет способ получения соединения формулы (I), где А представляет собой замещенный фенил и X представляет собой СН 2, или его фармацевтически приемлемой соли или сольвата, причем способ включает взаимодействие соединения формулы (XIII)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ),с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3 диметиламинопропил)-3-этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Альтернативно, соединение формулы (I), где А является замещенным фенилом и X представляет собой CH2, или его фармацевтически приемлемая соль или сольват могут быть получены способом, который включает взаимодействие активированного производного соединения формулы (XIII), такого как хлорангидрид, с соединением формулы (IV) с применением общих способов, описанных в J. March,Advanced Organic Chemistry, 4th Edition, J. WileySons, 1992, p. 417-418; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (XIII) могут быть получены традиционным гидролизом и декарбоксилированием соединения формулы (XIV)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ);Z представляет собой C1-4 алкокси и Р представляет собой подходящую алкильную группу, такую как метил или этил,с использованием водного гидроксида натрия, с последующим подкислением и декарбоксилированием путем нагревания в подходящем растворителе, таком как тетрагидрофуран или 1,4-диоксан. Соединения формулы (XIV) могут быть получены путем взаимодействия соединения формулы где Z представляет собой C1-4 алкокси и Р представляет собой подходящую алкильную группу, такую как метил или этил, с соединением формулы (II), с применением условий реакции, подходящих для восстановительного аминирования, например, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан.-8 014061 Соединения формулы (XV) могут быть получены традиционным гидролизом соединения формулы где Z представляет собой C1-4 алкокси и Р представляет собой алкил, такой как этил,с использованием подходящей водной кислоты, такой как разбавленная соляная кислота, в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (XVI) могут быть получены взаимодействием соединения формулы (XVII)Z представляет собой C1-4 алкокси, с подходящим диалкилмалонатом, таким как диэтилмалонат, в условиях палладиевого катализа в подходящем растворителе, таком как 1,4-диоксан, при кипении с обратным холодильником с применением способа, подобного тому, что описан в S.L. Buchwald et al. J. Am.Chem. Soc., 2000, vol. 122, p. 1360-1370. Соединения формулы (XVII) могут быть получены согласно методике, описанной в A. Tromelinet al., European Journal of Medicinal Chemistry, 1986, vol. 21(5), p. 397-402. Настоящее изобретение предоставляет способ получения соединения формулы (I), где А представляет собой фенил и X представляет собой CMe2, или его фармацевтически приемлемой соли или сольвата, причем способ включает взаимодействие соединения формулы (XVIII)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ), с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) илиN,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Альтернативно, соединение формулы (I), где А представляет собой фенил и X представляет собой СМе 2, или его фармацевтически приемлемая соль или сольват могут быть получены способом, который включает взаимодействие активированного производного соединения формулы (XVIII), такого как хлорангидрид, с соединением формулы (IV) с применением общих способов, описанных в J. March,Advanced Organic Chemistry. 4th Edition, J. WileySons, 1992. p. 417-418; и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения.-9 014061 Соединения формулы (XVIII) могут быть получены традиционным гидролизом соединения формулы (XIX)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как метил,с использованием подходящего основания, такого как водный гидроксид лития, в подходящем растворителе, таком как 1,4-диоксан. Соединения формулы (XIX) могут быть получены путем взаимодействия соединения формулы где Р представляет собой подходящую алкильную группу, такую как метил,с использованием методики, аналогичной той, что описана в J.F. Hartwig et al. J.Am. Chem. Soc., 2002,vol. 124, p.12557-12565. Реакция может быть проведена в присутствии подходящего основания, такого как ди(циклогексил)амид лития, подходящей каталитической системы, такой как бис(дибензилиден)палладий(0)/три(трет-бутил)фосфин, и в подходящем растворителе, таком как толуол. Настоящее изобретение предоставляет способ получения соединения формулы (I), где А представляет собой фенил и X представляет собой СНМе, или его фармацевтически приемлемой соли или сольвата, причем способ включает взаимодействие соединения формулы (XXI)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ), с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) илиN,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси,и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Альтернативно, соединение формулы (I), где А представляет собой фенил и X представляет собой СНМе, или его фармацевтически приемлемую соль или сольват можно получить способом, который включает взаимодействие активированного производного соединения формулы (XXI), такого как хлорангидрид, с соединением формулы (IV) с применением общих способов, описанных в J. March,Advanced Organic Chemistry, 4th Edition, J. WileySons, 1992, p. 417-418,и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения.- 10014061 Соединения формулы (XXI) могут быть получены традиционным гидролизом и декарбоксилированием соединения формулы (XXII)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как метил или этил,с использованием водного гидроксида натрия, с последующим подкислением и декарбоксилированием путем нагревания в подходящем растворителе, таком как 1,4-диоксан или тетрагидрофуран. Соединения формулы (XXII) могут быть получены из соединения формулы (VII)Q представляет собой водород или подходящую защитную группу азота, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как метил или этил, с применением стандартных условий алкилирования, например реакция с подходящим основанием, таким как гидрид натрия, вместе с подходящим метилирующим агентом, таким как йодметан, в подходящем растворителе,например, диметилформамиде. Настоящее изобретение предоставляет способ получения соединения формулы (I), где А представляет собой фенил и X представляет собой СН 2 СН 2, или его фармацевтически приемлемой соли или сольвата, причем способ включает взаимодействие соединения формулы (XXIII) где Y и R3 такие, как определено в формуле (I), с соединением формулы (II), с применением условий реакции, подходящих для восстановительного аминирования, например, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан,и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (XXIII) могут быть получены взаимодействием соединения формулы (XXIV) с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси. Альтернативно, соединение формулы (XXIII) может быть получено взаимодействием соединения формулы (IV) с активированным производным соединения формулы (XXIV), таким как хлорангидрид, с применением общих способов, описанных в J. March, Advanced Organic Chemistry, 4th Edition, J.- 11014061 Настоящее изобретение предоставляет способ получения соединения формулы (I), где А представляет собой 2,5-пиридил и X представляет собой СН 2 СН 2, или его фармацевтически приемлемой соли или сольвата, причем способ включает гидрирование соединения формулы (XXV)Q представляет собой подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ), в присутствии подходящего катализатора, такого как палладиевая чернь,и в подходящем растворителе, таком как метанол,и последующее необязательное проведение одной или нескольких из следующих реакций: 1) превращение одного соединения формулы (I) в другое соединение формулы (I); 2) удаление любой защитной группы; 3) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (XXV) могут быть получены взаимодействием соединения формулы (XXVI)Q является подходящей защитной группой, такой как трет-бутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ),с соединением формулы (IV) в присутствии подходящего реагента сочетания, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или N,N'-дициклогексилкарбодиимид (DCC), в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси. Альтернативно, соединение формулы (XXV) может быть получено взаимодействием соединения формулы (IV) с активированным производным соединения формулы (XXVI), таким как хлорангидрид, с применением общих способов, описанных в J. March, Advanced Organic Chemistry, 4th Edition, J. WileySons, 1992, p. 417-418. Соединения формулы (XXVI) могут быть получены традиционным гидролизом соединения формулы (XXVII)Q представляет собой подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как метил,с использованием подходящего основания, такого как водный гидроксид лития, в подходящем растворителе, таком как 1,4-диоксан.- 12014061 Соединения формулы (XXVII) могут быть получены взаимодействием соединения формулы где Р представляет собой подходящую алкильную группу, такую как метил,с соединением формулы (II), с применением условий реакции, подходящих для восстановительного аминирования, например, в присутствии восстанавливающего агента, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан. Соединения формулы (XXVIII) могут быть получены взаимодействием соединения формулы с подходящим алкилакрилатом, таким как метилакрилат, при повышенной температуре, например в условиях микроволнового облучения, в присутствии подходящей каталитической системы, такой как димер хлорида аллилпалладия(II)/три(о-толил)фосфин, и подходящего основания, такого как ацетат натрия. Подходящим растворителем является диметилформамид. Специалистами в данной области будет понятно, что может быть необходимо защищать определенные реакционноспособные заместители в процессе некоторых из упомянутых выше методик. Могут быть использованы стандартные методики введения и снятия защиты, такие как те, что описаны в Greene T.W.Protective groups in organic synthesis, New York, Wiley (1981). Например, первичные амины могут быть защищены в виде фталимидных, трифторацетильных, бензильных, трет-бутилоксикарбонильных, бензилоксикарбонильных или тритильных производных. Группы карбоновой кислоты могут быть защищены в виде сложных эфиров. Альдегидные или кетонные группы могут быть защищены в виде ацеталей, кеталей, тиоацеталей или тиокеталей. Снятия защиты таких групп достигают, используя традиционные методики, хорошо известные в данной области. Например, защитные группы, такие как третбутилоксикарбонил, могут быть удалены действием кислоты, такой как соляная или трифторуксусная кислота, в подходящем растворителе, таком как дихлорметан, диэтиловый эфир, 1,4-диоксан, изопропанол или их смеси. Фармацевтически приемлемые соли могут быть обычно получены путем взаимодействия с соответствующей кислотой или производным кислоты. Настоящее изобретение также предоставляет соединения формулы (III), (VI), (VII), (X), (XIII),(XIV), (XVIII), (XIX), (XXI)-(XXIII), (XXV), (XXVI) и (XXVII), как представлено выше, гдеY, R1, R2 и R3 такие, как определено для формулы (I);Q представляет собой водород или подходящую защитную группу, такую как третбутилоксикарбонил (ВОС) или бензилоксикарбонил (CBZ); и Р представляет собой подходящую алкильную группу, такую как этил. Эти соединения применимы в качестве промежуточных соединений при получении соединений по настоящему изобретению. Активности и эффективности соединений по данному изобретению в отношении GPR38 могут быть определены исследованием FLIPR, проводимом на клонированном человеческом рецепторе, как здесь описано. Соединения формулы (I) демонстрировали активность частичного или полного агониста в отношении GPR38-рецептора при использовании описанного здесь функционального исследования FLIPR(планшеты со считывающим устройством для флуорометрического изображения). Следовательно, соединения формулы (I) и их фармацевтически приемлемые соли применимы при лечении состояний или расстройств, которые опосредованы через GPR38-рецептор. В частности, соединения формулы (I) и их фармацевтически приемлемые соли применимы при лечении определенных желудочно-кишечных расстройств, таких как расстройства типа гастроэзофагеального рефлюкса, функциональной диспепсии, синдрома раздраженной кишки, запора, кишечной псевдонепроходимости, паралитической непроходимости кишечника после хирургического вмешательства или других манипуляций,рвоты, желудочного застоя или гипокинезии, вызванной различными заболеваниями, такими как диабет,и/или введением других лекарств, болезни Крона, колита, кахексии, ассоциированной с запущенными болезнями, такими как рак и/или последствия его лечения, нарушения аппетита/метаболизма, связанные с кахексией, и других расстройств, таких как недержание (здесь и далее обозначаемых как "расстройства по изобретению"). Будет понятно, что используемый в данном описании термин "лечение" включает профилактику, а также смягчение установленных симптомов.- 13014061 Таким образом, изобретение также предоставляет соединение формулы (I) или его фармацевтически приемлемую соль для применения в качестве терапевтического средства, в частности при лечении состояний или расстройств, опосредованных через GPR38-рецептор. В частности, изобретение предоставляет соединение формулы (I) или его фармацевтически приемлемую соль для применения в качестве терапевтического средства при лечении желудочно-кишечных расстройств, таких как расстройства типа гастроэзофагеального рефлюкса, функциональной диспепсии, синдрома раздраженной кишки, запора,кишечной псевдонепроходимости, паралитической непроходимости кишечника после хирургического вмешательства или других манипуляций, рвоты, желудочного застоя или гипокинезии, вызванной различными болезнями, такими как диабет, и/или введением других лекарств, болезни Крона, колита, кахексии, ассоциированной с запущенными болезнями, такими как рак и/или последствия его лечения, нарушения аппетита/метаболизма, связанного с кахексией, и других расстройств, таких как недержание. Изобретение дополнительно предоставляет способ лечения состояний или расстройств у млекопитающих, включая людей, которые могут быть опосредованы через GPR38-рецептор, который включает введение пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом аспекте изобретение предусматривает применение соединения формулы (I) или его фармацевтически приемлемой соли для лечения состояний или расстройств, опосредованных через GPR38 рецептор. Для применения соединений формулы (I) в терапии обычно они должны быть включены в состав фармацевтической композиции согласно стандартной фармацевтической практике. Настоящее изобретение также предоставляет фармацевтическую композицию, которая включает соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент. В следующем аспекте настоящее изобретение предоставляет способ получения фармацевтической композиции, причем способ включает смешение соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическая композиция по изобретению, которая может быть получена путем смешения преимущественно при температуре окружающей среды и атмосферном давлении, обычно адаптирована для перорального, парентерального или ректального введения и как таковая может находиться в форме таблеток, капсул, оральных жидких препаратов, порошков, гранул, пастилок, порошков для восстановления влагосодержания, инъецируемых или инфузируемых растворов или суспензий или суппозиториев. Перорально вводимые композиции, как правило, являются предпочтительными. Таблетки и капсулы для перорального введения могут быть в форме стандартной дозы и могут содержать традиционные эксципиенты, такие как связующие агенты (например, пептизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например,лактоза, микрокристаллическая целлюлоза или вторичный кислый фосфат кальция); таблетирующие смазки (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие агенты (например,картофельный крахмал или натриевый гликолят крахмала) и приемлемые смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты в соответствии со способами, хорошо известными в обычной фармацевтической практике. Пероральные жидкие препараты могут быть в форме, например, водной или масляной суспензии,растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для восстановления, перед применением, влагосодержания водой или другим приемлемым носителем. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрированные пищевые жиры), эмульгирующие агенты (например, лецитин или камедь), неводные носители (которые могут включать пищевые масла, например миндальное масло, масляные эфиры, этиловый спирт или ректифицированные растительные масла), консерванты (например, метил или пропил-п-гидроксибензоаты или сорбиновая кислота) и, если желательно,традиционные корригенты или красители, буферные соли и подсластители, по необходимости. Препараты для перорального введения могут быть соответствующим образом составлены для контролируемого высвобождения активного соединения. Для парентерального введения жидкие формы стандартной дозы готовят, используя соединение по изобретению или его фармацевтически приемлемую соль и стерильный носитель. Рецептуры для инъекции могут быть представлены в форме стандартной дозы, например в ампулах, или в виде множественных доз с использованием соединения по изобретению или его фармацевтически приемлемой соли и стерильного носителя, необязательно с добавленным консервантом. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать составляющие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для восстановления, перед применением, с подходящим носителем, например стерильной, свободной от пирогена водой. Соединение, в зависимости от носителя и используемой концентрации, может быть либо суспендировано, либо растворено в носителе. В полученных растворах соединение может быть растворено для инъекции и стерилизовано через фильтр, перед помещением в подходящий пузырек или ампулу, и запаяно. Преимущественно, в- 14014061 носителе растворяются адъюванты, такие как местные анестетики, консерванты и буферирующие агенты. Для повышения стабильности композицию можно заморозить после помещения в пузырек и воду удалить в вакууме. Парентеральные суспензии готовят, по существу, таким же образом, за исключением того, что соединение суспендируют в носителе вместо растворения и стерилизация не может быть выполнена фильтрованием. Соединение можно стерилизовать действием этиленоксида на суспензию в стерильном носителе. Преимущественно поверхностно-активное вещество или смачивающий агент включают в композицию для облегчения равномерного распределения соединения. Лосьоны могут быть составлены с водным или масляным основанием и будут, как правило, также содержать один или несколько эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов, суспендирующих агентов, загущающих агентов или окрашивающих агентов. Капли могут быть составлены с водным или неводным основанием, также включающим один или несколько диспергирующих агентов, стабилизирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Они также могут содержать консервант. Соединения по изобретению также могут быть включены в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные основания для суппозитория, такие как масло какао или другие глицериды. Соединения по изобретению также могут быть включены в состав депо-препаратов. Такие длительно действующие препараты могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения по изобретению могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле), или ионообменными смолами, или в виде малорастворимых производных, например в виде малорастворимой соли. Для интраназального введения соединения по изобретению могут быть составлены в виде растворов для введения через подходящее отмеряющее устройство или стандартное дозирующее устройство,или, альтернативно, в виде порошковой смеси с подходящим носителем для введения с применением подходящего устройства доставки. Так, соединения формулы (I) могут быть включены в составы для перорального, буквального, парентерального, местного (включая глазное и назальное), в форме депо или ректального введения или в форме, подходящей для введения путем ингаляции или инфузии (или через рот, или через нос). Соединения по изобретению могут быть включены в препараты для местного назначения в форме мазей, кремов, гелей, лосьонов, пессариев, аэрозолей или капель (например, глазных, ушных или носовых капель). Мази и кремы могут, например, быть составлены с водным или масляным основанием с добавлением подходящих загущающих и/или гелеобразующих агентов. Мази для глазного назначения можно производить стерильным способом с применением стерилизующих компонентов. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного вещества в зависимости от способа введения. Доза соединения, применяемого при лечении вышеупомянутых расстройств, будет варьировать обычным образом в зависимости от серьезности расстройств, массы пациента и других подобных факторов. Однако в качестве общего руководства приемлемые стандартные дозы могут составлять от 0,05 до 1000 мг, от 1,0 до 500 мг или от 1,0 до 200 мг, и такие стандартные дозы могут быть назначены более чем один раз в день, например два или три раза в день. Такая терапия может продолжаться в течение ряда недель или месяцев. Соединения по настоящему изобретению могут быть использованы в комбинационных препаратах. Например, соединения по изобретению могут быть использованы в комбинации с одним или несколькими соединениями, обладающими активностью понижения желудочной кислотности; с одним или несколькими соединениями, обладающими активностью в отношении ослабления гастроэзофагеального рефлюкса; с одним или несколькими соединениями, обладающими активностью в отношении уменьшения эзофагожелудочного раздражения или воспаления, особенно при использовании для облегчения эрозивного или неэрозивного эзофагита; с одним или несколькими соединениями, обладающими аналгезирующей активностью; и/или с одним или несколькими соединениями, обладающими смешанной активностью на подвижность и боль. Примеры соединений, уменьшающих желудочную кислотность, включают антагонисты Н 2-рецептора, антагонисты кислотного насоса и ингибиторы протонного насоса. Примеры соединений,ослабляющих гастроэзофагеальный рефлюкс, включают агонисты GABA-B. Примеры соединений, обладающих аналгезирующей активностью, включают соединения, активные в отношении рецепторов нейрокинина (NK1, 2, 3), TRPV1 и натриевых каналов. Примеры соединений, обладающих смешанной активностью на подвижность и боль, включают антагонисты CRF2, антагонисты 5-HT3, или октреотид, или другие молекулы, активные в отношении рецепторов sst2. Все публикации, включая, без ограничения, патенты и заявки на патент, цитированные в данном описании, включены в описание посредством ссылки, как если бы каждая индивидуальная публикация была специально и индивидуально указана как включенная посредством ссылки, даже если полностью изложена в данном описании.- 15014061 Следующие описания и примеры иллюстрируют получение соединений по изобретению. Условия, оборудование и программное обеспечение для аналитических LCMS систем Оборудование: градиентный насос Agilent 1100; автоматический пробоотборник Agilent 1100;Waters MassLynx, версия 4.0 SP2. Колонка. Используемой колонкой была Waters Atlantis, размеры которой составляли 4,650 мм. Размер частиц стационарной фазы составлял 3 мкм. Растворители. А: Водный растворитель=вода+0,05% муравьиной кислоты. В: Органический растворитель=ацетонитрил+0,05% муравьиной кислоты. Способ. Стандартно используемый способ имел 5-минутное время прогона. Скорость потока. Упомянутый способ имел скорость потока. 3 мл/мин. Патентная информация в отношении автоматической препаративной системы открытого доступа с масс-детекторным контролем (MDAP) Оборудование. Аппараты автоматической препаративной системы открытого доступа с масс-детекторным контролем состояли из следующих: 1 градиентный насос Waters 600; 1 инжектор/коллектор Waters 2767; 1 система управления реагентами Waters; 1 масс-спектрометр MicroMass ZQ; 1 коллектор сливов Gilson Aspec; 1 постфракционный УФ детектор Gilson 115; 1 компьютерная система. Программное обеспечение.MicroMass MassLynx v4.0. Колонка. Используемая колонка обычно представляла собой колонку Supelco LCABZ, размеры которой составляли: внутренний диаметр 20 мм; длина 100 мм. Размер частиц стационарной фазы составлял 5 мкм. Растворители. А: Водный растворитель=вода+0,1% муравьиной кислоты. В: Органический растворитель=MeCN:вода 95:5+0,05% муравьиной кислоты. Промывочный растворитель=МеОН:вода 80:20+50 ммоль ацетата аммония. Растворитель для промывки иглы=МеОН:вода:ДМСО 80:10:10.- 16014061 Способы. Может быть использован один из пяти способов, в зависимости от аналитического времени удерживания соединения, представляющего интерес. Все имеют 15-минутное время прогона, которое включает 10-минутный градиент, с последующей 5-минутной промывкой колонки и стадией реэквилибрации.MDP 3,8-5,5=50-90% В. Скорость потока. Все упомянутые способы имели скорость потока 20 мл/мин. Условия, использованные для ЯМР Оборудование: ультразащитный Bruker 400 МГц; автоматический пробоотборник Bruker B-ACS60; консоль Bruker Advance 400;Bruker DRX600. Программное обеспечение. Пользовательский интерфейс - NMR Kiosk. Контролирующее программное обеспечение - Xwin NMR version 3.0. Хроматография. Пока не указано иное, все хроматографические разделения проводили, используя колонки с диоксидом кремния. СокращенияBINAP - -2,2'-бис-(дифенилфосфино)-1,1'-бинафталин. Описание 1. 1,1-Диметилэтил 4-[(4-фторфенил)амино]-1-пиперидинкарбоксилат (D1). Раствор 1,1-диметилэтил 4-оксо-1-пиперидинкарбоксилата (1 г, 5 ммоль), 4-фторанилина (0,56 г,5 ммоль) и уксусной кислоты (0,26 мл, 5 ммоль) в 1,2-DCE (30 мл) перемешивали при комнатной температуре в течение 24 ч. Затем добавляли три(ацетокси)боргидрид натрия (1,48 г, 7 ммоль) и перемешивание продолжали в течение 24 ч. Реакционную смесь промывали водой, высушивали (MgSO4) и затем концентрировали в вакууме, получая указанное в заголовке соединение в виде неочищенного твердого вещества (1,6 г).N-(4-Фторфенил)-4-пиперидинамин (D2). Раствор D1 (1,6 г) в 2 М HCl (5 мл) и 1,4-диоксане (20 мл) нагревали при 60 С в течение 24 ч. После охлаждения раствор разбавляли водой, подщелачивали 2 М раствором NaOH и экстрагировали EtOAc(3). Объединенные органические фракции высушивали (MgSO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде желтого масла (0,71 г).(4-Формилфенил)уксусная кислота (D3). Указанное в заголовке соединение получали из [4-(бромметил)фенил]уксусной кислоты и гексаметилентетрамина, используя способ, аналогичный описанному J. March, Advanced Organic Chemistry, 4thEdition, J. WileySons, 1992, p.1194. Описание 4. 4-(2-4-[(4-Фторфенил)амино]-1-пиперидинил-2-оксоэтил)бензальдегид (D4). Смесь D3 (87 мг, 0,53 ммоль), D2 (102 мг, 0,53 ммоль), гидрохлорида 1-(3-диметиламинопропил)-3 этилкарбодиимида (123 мг, 0,64 ммоль) и 1-гидроксибензотриазола (98 мг, 0,64 ммоль) в ДМФА (2 мл) перемешивали при комнатной температуре в течение ночи. ДМФА удаляли в вакууме, затем добавлялиEtOAc и воду. Продукт экстрагировали в EtOAc и объединенные органические слои промывали насыщенным водным раствором NaHCO3 (2) и насыщенным раствором соли, затем высушивали (Na2SO4). Растворитель удаляли в вакууме и полученный остаток очищали хроматографией, элюируя градиентом(1,06, 9,53 ммоль) и уксусной кислоты (0,55 мл, 9,53 ммоль) в 1,2-DCE (50 мл) перемешивали при комнатной температуре в течение ночи. Затем добавляли три(ацетокси)боргидрид натрия (2,82 г,13,3 ммоль), перемешивали в течение 8 ч и затем давали стоять при комнатной температуре. Реакционную смесь разбавляли DCM и промывали раствором NaHCO3, высушивали над MgSO4 и затем концентрировали с получением продукта, который очищали колоночной хроматографией. Элюирование смесью 0-40% EtOAc/пентан давало указанное в заголовке соединение в виде белого твердого вещества (2,3 г).N-(3-Фторфенил)-4-пиперидинамин (D5b). Раствор D5a (2,91 г) в 2 М HCl (5 мл) и 1,4-диоксане (40 мл) нагревали при 70 С при перемешивании в течение ночи. После охлаждения растворитель удаляли в вакууме и остаток разбавляли 2 М раствором NaOH и экстрагировали смесью 9:1 EtOAc/ трет-BuOH (2). Органические фракции высушивали(MgSO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде желтого твердого вещества (1,33 г).(1,505 г, 6,42 ммоль) и триацетоксиборгидрида натрия (2,04 г, 9,63 ммоль) в 1,2-DCE (15 мл) перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор NaHCO3 и смесь перемешивали в течение 30 мин. Продукт экстрагировали и экстракты высушивали (Na2SO4). Хроматография (0-30% EtOAc в пентане) давала указанное в заголовке соединение (2,18 г).(83 мг, 0,264 ммоль) в 1,4-диоксане (20 мл) кипятили вместе с обратным холодильником в атмосфере аргона в течение 20 ч. Смесь фильтровали через Целит и концентрировали. Хроматография (0-40%EtOAc/гексан) давала указанное в заголовке соединение в виде прозрачного масла (1,165 г).(D8). Смесь D7 (761 мг, 1,58 ммоль), 2 М раствора NaOH (6 мл) и 1,4-диоксана (6 мл) перемешивали при комнатной температуре в течение 2 ч. Растворители удаляли, остаток растворяли в воде и рН доводили до 4 с помощью 2 М HCl. Продукт экстрагировали EtOAc и объединенные экстракты высушивали и концентрировали. Продукт кипятили с обратным холодильником в толуоле (20 мл) в течение 2 ч и растворитель выпаривали, получая указанное в заголовке соединение в виде желтой пены (505 мг).MS (ES): МН+ 383, (М-Н)- 381. Описание 9 а. 1,1-Диметилэтил 4-[(3,4-дифторфенил)амино]-1-пиперидинкарбоксилат (D9a). Указанное в заголовке соединение получали из 1,1-диметилэтил 4-оксо-1-пиперидинкарбоксилата и 3,4-дифторанилина с использованием способа, аналогичного описанному для D1, но неочищенный продукт очищали хроматографией. Описание 9b.N-(3,4-Дифторфенил)-4-пиперидинамин (D9b). Указанное в заголовке соединение получали из D9a с использованием способа, аналогичного описанному для D2, но реакционную смесь нагревали при 80 С. Описание 10 а. 1,1-Диметилэтил 4-[(3-цианофенил)амино]-1-пиперидинкарбоксилат (D10a). Смесь BINAP (560 мг, 0,9 ммоль), ацетата палладия (135 мг, 0,9 ммоль) и карбоната цезия (2,932 г,9 ммоль) в 1,4-диоксане (10 мл) облучали ультразвуком в течение 50 мин. Добавляли 1,1-диметилэтил 4 амино-1-пиперидинкарбоксилат (1,2 г, 6 ммоль) и 3-бромбензонитрил (1,638 г, 9 ммоль) и смесь нагревали до 105 С в течение ночи в атмосфере аргона. После охлаждения растворитель удаляли в вакууме и остаток распределяли между водой (100 мл) и EtOAc (100 мл). Органический слой отделяли, высушивали и концентрировали, неочищенный продукт очищали хроматографией. Элюирование градиентом 0-50%Et2O/петролейный эфир давало указанное в заголовке соединение в виде белого твердого вещества(6 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли в вакууме и остаток загружали на картридж Isolute SCX. Элюирование МеОН (100 мл) с последующим 2 М NH3 в МеОН (100 мл) давало указанное в заголовке соединение в виде белого твердого вещества (613 мг).MS (ES): MH+ 202. Описание 11 а. 1,1-Диметилэтил[(4-цианофенил)амино]-1-пиперидинкарбоксилат (D11a). Указанное в заголовке соединение получали из 1,1-диметилэтил 4-амино-1-пиперидинкарбоксилата и 4-бромбензонитрила с использованием способа, аналогичного описанному для D10a. Описание 11b. 4-(4-Пиперидиниламино)бензонитрил (D11b). Указанное в заголовке соединение получали из D11a с использованием способа, аналогичного описанному для D10b, но также проводили очистку хроматографией. Описание 12 а. 1,1-Диметилэтил 4-[4-фтор-3-(метилокси)фенил]амино-1-пиперидинкарбоксилат (D12a). Указанное в заголовке соединение получали из 1,1-диметилэтил 4-оксо-1-пиперидинкарбоксилата и 4-фтор-3-метоксианилина с использованием способа, аналогичного описанному для D1. Описание 12b.N-[4-Фтор-3-(метилокси)фенил]-4-пиперидинамин (D12b). Указанное в заголовке соединение получали из D12a с использованием способа, аналогичного описанному для D2, но реакционную смесь нагревали при 80 С.(5,6 г, 59 ммоль) и трифенилфосфина (31,4 г, 118 ммоль) в ТГФ (100 мл) добавляли диизопропилазодикарбоксилат (23,3 мл, 118 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней и затем растворитель удаляли в вакууме. Остаток разбавляли DCM, добавляли гексан и отфильтровывали полученный белый осадок. Фильтрат концентрировали в вакууме и очищали хроматографией. Элюирование DCM давало указанное в заголовке соединение (16,4 г, 87% чистый).H (CDCl3, 250 МГц) 1,47 (9 Н, с), 1,76 (2 Н, м), 1,92 (2 Н, м), 3,35 (2 Н, ддд), 3,69 (2 Н, ддд), 4,44 (1 Н,м), 6,65 (3H, м), 7,20 (1 Н, м). Описание 14. 4-[(3-Фторфенил)окси]пиперидин (D14). Раствор D13 (16,4 г, 55 ммоль) в DCM (200 мл) при 0 С обрабатывали по каплям ТФУК (17 мл). Реакционную смесь нагревали до комнатной температуры в течение 2,5 ч и оставляли на ночь. Затем растворитель удаляли в вакууме и остаток распределяли между DCM и 2 М раствором NaOH. Водный слой затем экстрагировали DCM (2) и объединенные органические фракции концентрировали в вакууме. Остаток повторно растворяли в DCM и экстрагировали 2 М HCl (2), затем подщелачивали и повторно экстрагировали DCM. Объединенные органические фракции концентрировали в вакууме, получая указанное в заголовке соединение (12 г).MS (ES): МН+ 196. Это вещество целиком разбавляли МеОН и обрабатывали 1 М HCl в Et2O с получением гидрохлоридной соли указанного в заголовке соединения (8,0 г). Описание 15. 4-[(4-Фторфенил)окси]пиперидин (D15). Указанное в заголовке соединение может быть получено с использованием способа, аналогичного описанному у L.С. Blumberg, M.F. Brown, M.M. Hayward and CS. Poss, PCT Int. Appl., WO 2004009550. Описание 16. Метил[4-(бромметил)фенил]ацетат (D16). К раствору 4-(бромметил)фенилуксусной кислоты (20 г, 87,3 ммоль) в МеОН (200 мл) добавляли триметилсилилхлорид (2 мл) и реакционную смесь перемешивали в течение 2 ч. Растворитель удаляли в вакууме и остаток дважды повторно растворяли в МеОН (200 мл) и повторно концентрировали, получая указанное в заголовке соединение (21,08 г).(100 мл) добавляли раствор 1,1-диметилэтил (2S)-2-метил-1-пиперазинкарбоксилата (18,8 г, 94,1 ммоль) в сухом ДМФА (75 мл) при охлаждении на ледяной бане. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 15 мин. Растворитель удаляли в вакууме и остаток распределяли между EtOAc и 2 М раствором NaOH (400 мл, 1:1). Органическую фазу промывали водой (200 мл) и насыщенным раствором соли (200 мл) и объединенные промывные воды обратно экстрагировали EtOAc(200 мл). EtOAc-экстракты объединяли, высушивали (MgSO4) и концентрировали в вакууме, получая неочищенный продукт, который очищали хроматографией. Элюирование смесью 20-25% EtOAc/гексан давало указанное в заголовке соединение в виде бесцветного масла (29,3 г).H (CDCl3, 250 МГц) 7,29 (2 Н, д), 7,22 (2 Н, д), 4,18 (1 Н, м), 3,74 (1 Н, м), 3,69 (3H, с), 3,62 (2 Н, с),3,51 (1 Н, д), 3,39 (1 Н, д), 3,10 (1 Н, тд), 2,75 (1 Н, м), 2,59 (1 Н, м), 2,12 (1 Н, дд), 1,99 (1 Н, м), 1,45 (9 Н, с),1,24 (3H, д). Описание 18. 4-[3S)-4-[(1,1-Диметилэтил)окси]карбокил-3-метил-1-пиперазинил)метил]фенилуксусная кислота (D18). К раствору D17 (29,3 г, 80,9 ммоль) в ТГФ (200 мл) добавляли 2 М раствор NaOH (100 мл) и двухфазную реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь концентрировали в вакууме для удаления ТГФ и водный раствор экстрагировали EtOAc (2100 мл). Водную фазу подкисляли до рН 6 концентрированной HCl и экстрагировали DCM (3300 мл). Объединенные органические фракции промывали насыщенным раствором соли (2), высушивали и концентрировали в вакууме, получая указанное в заголовке соединение в виде бесцветной пены (27,8 г).H (CDCl3, 400 МГц) 7,27 (2 Н, д), 7,23 (2 Н, д), 4,20 (1 Н, м), 3,81 (1 Н, м), 3,62 (2 Н, с), 3,59 (1 Н, д),3,49 (1 Н, д), 3,15 (1 Н, м), 2,88 (1 Н, м), 2,69 (1 Н, м), 2,20 (1 Н, дд), 2,05 (1 Н, м), 1,45 (9 Н, с), 1,25 (3H, д). Описание 19. 1,1-Диметилэтил (2S)-4-[4-(2-4-[(3-фторфенил)амино]-1-пиперидинил-2-оксоэтил)фенил]метил-2 метил-1-пиперазинкарбоксилат (D19). Смесь D18 (27,8 г, 79,8 ммоль), гидрохлорида N-[3-(диметиламино)]-N'-этилкарбодиимида (22,9 г,119,7 ммоль), гидрата 1-гидроксибензотриазола (16,2 г, 119,7 ммоль), триэтиламина (45 мл, 319,1 ммоль) и гидрохлоридной соли D56b (18,4 г, 79,8 ммоль) в сухом ДМФА (400 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме и остаток повторно растворяли в DCM(300 мл), промывали 2 М NaOH (2200 мл), водой (200 мл) и насыщенным раствором соли (200 мл). Все промывные воды объединяли и обратно экстрагировали DCM (2100 мл). Объединенные органические фракции высушивали и концентрировали, получая твердое вещество, которое очищали хроматографией(диоксид кремния, предварительно промытый смесью 50% EtOAc/гексан). Элюирование смесью 70%EtOAc/гексан давало указанное в заголовке соединение в виде белого твердого вещества (34,95 г).(5 мл) перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Добавляли насыщенный водный раствор NaHCO3 (15 мл) и перемешивание продолжали в течение 1 ч. Реакционную смесь экстрагировали DCM и органическую фазу концентрировали в вакууме. Перекристаллизация твердого остатка давала указанное в заголовке соединение в виде белого твердого вещества (0,86 г).N-[3-(Трифторметил)фенил]-4-пиперидинамин (D21). Раствор из двух объединенных экспериментов D20 (0,86 г, 2,5 ммоль) в DCM (40 мл) обрабатывали ТФУК (10 мл) и реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 2 ч. Растворитель удаляли в вакууме и остаток распределяли между DCM и водой. Водный слой подщелачивали до рН 14 2 М раствором NaOH, затем экстрагировали EtOAc (5). Объединенные органические фракции высушивали (Na2SO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде прозрачного масла (0,64 г).H (CDCl3, 250 МГц) 7,24 (1H, т), 6,90 (1H, д), 6,74 (2H, м), 3,75 (1 Н, м), 3,40 (1 Н, м), 3,14 (2 Н, м),2,74 (2 Н, м), 2,07 (2 Н, м), 1,34 (2 Н, м). Описание 22. 1,1-Диметилэтил 4-[4-(трифторметил)фенил]амино-1-пиперидинкарбоксилат (D18). Указанное в заголовке соединение получали из 1,1-диметилэтил 4-оксо-1-пиперидинкарбоксилата и 4-трифторметиланилина с использованием способа, аналогичного описанному для D20. Описание 23.N-[4-(Трифторметил)фенил]-4-пиперидинамин (D23). Указанное в заголовке соединение получали из D22 с использованием способа, аналогичного описанному для D21. Описание 24. Фенилметил 4-[(4-бромфенил)метил]-1-пиперазинкарбоксилат (D24). Указанное в заголовке соединение получали из фенилметил 1-пиперазинкарбоксилата и 4-бромбензальдегида с использованием способа, аналогичного описанному для D6. Описание 25. Диэтил 4-[(4-[(фенилметил)окси]карбонил-1-пиперазинил)метил]фенилпропандиоат (D25). Указанное в заголовке соединение получали из D24 с использованием способа, аналогичного описанному для D7. Описание 26. 4-[(4-[(Фенилметил)окси]карбонил-1-пиперазинил)метил]фенилуксусная кислота (D26). Раствор D25 (304 мг, 0,65 ммоль) в 2 М растворе NaOH (10 мл) и ТГФ (10 мл) перемешивали при комнатной температуре в течение 1 ч, затем при 40 С в течение 1 ч. Добавляли 2 М HCl, доводя раствор до рН 6, с последующим нагреванием до 60 С в течение ночи. Растворитель удаляли в вакууме и остаток распределяли между водой и EtOAc. Органический экстракт высушивали и концентрировали, получая указанное в заголовке соединение (145 мг).(D27). Смесь D16 (243 мг, 1 ммоль), диизопропилэтиламина (174 мкл, 1 ммоль) 1,1-диметилэтил (2R)-2 метил-1-пиперазинкарбоксилата (234 мг, 1 ммоль) в ДМФА перемешивали при комнатной температуре в течение 1 ч, затем давали стоять в течение ночи. Растворитель удаляли в вакууме, затем остаток разбавляли водой (20 мл) и экстрагировали EtOAc (220 мл). Объединенные органические экстракты высушивали (MgSO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде желтого масла (383 мг).(D28). Раствор D27 (380 мг, 0,96 ммоль) в ТГФ (4 мл) и 2 М растворе NaOH (1 мл) перемешивали при комнатной температуре в течение ночи. Добавляли воду (10 мл) и раствор промывали EtOAc (20 мл). Водную фазу доводили до pH 6 и экстрагировали EtOAc (220 мл). Объединенные экстракты промывали насыщенным раствором соли, высушивали (MgSO4) и концентрировали в вакууме, получая указанное в заголовке соединение: в виде бесцветной смолы (255 мг).(75 мг, 0,392 ммоль), 1-гидроксибензотриазола (53 мг, 0,392 ммоль), триэтиламина (110 мкл,0,784 ммоль) и гидрохлоридной соли D5b (60 мг, 0,261 ммоль) в ДМФА (2 мл) перемешивали при комнатной температуре в течение 3 дней. Растворитель удаляли в вакууме и остаток очищали хроматографией. Элюирование смесью 0-10% MeOH/DCM давало указанное в заголовке соединение в виде бесцветного масла (136 мг).MS (ES): МН+ 559. Описание 30. 1,1-Диметилэтил 4-[(4-цианофенил)окси]-1-пиперидинкарбоксилат (D30). Указанное в заголовке соединение получали из 4-гидроксибензонитрила и 1,1-диметилэтил 4-гидрокси-1-пиперидинкарбоксилата с использованием способа, аналогичного описанному для D13. Описание 31. 4-(4-Пиперидинилокси)бензонитрил (D31). Указанное в заголовке соединение получали из D30 с использованием способа, аналогичного описанному для D14. Описание 32. 2-[4-Бром-2-(метилокси)фенил]-1,3-диоксолан (D32). Указанное в заголовке соединение может быть получено с использованием способа, описанного в(16,6 мг, 0,053 ммоль) в сухом 1,4-диоксане (10 мл) нагревали при 120 С в атмосфере аргона в течение 7 ч. Водная обработка (вода/EtOAc) с последующей очисткой хроматографией (50% Et2O/петролейный эфир) давала указанное в заголовке соединение (191 мг).- 22014061 Описание 34. Диэтил [4-формил-3-(метилокси)фенил]пропандиоат (D34). Раствор D33 (191 мг, 0,56 ммоль) в ТГФ (5 мл) и 2 М HCl (5 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель удаляли в вакууме и после водной обработки (вода/EtOAc) получали указанное в заголовке соединение (149 мг).[4-[3S)-4-[(1,1-диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]-3-(метилокси)фенил]пропандиоат (D35). Указанное в заголовке соединение получали из D34 и 1,1-диметилэтил (2S)-2-метил-1 пиперазинкарбоксилата с использованием способа, аналогичного описанному для D6. Описание 36.[4-[3S)-4-[(1,1-Диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]-3-(метилокси)фенил]уксусная кислота (D36). Указанное в заголовке соединение получали из D35 с использованием способа, аналогичного описанному для D26. Описание 37. 1,1-Диметилэтил(2S)-4-[4-(2-4-[(3-фторфенил)амино]-1-пиперидинил-2-оксоэтил)-2-(метилокси)фенил]метил-2-метил-1-пиперазинкарбоксилат (D37). Смесь D36 (90 мг, 0,24 ммоль), DCC на полимерной подложке (225 мг, 1,6 ммоль/г, 0,36 ммоль),D5b (46 мг, 0,24 ммоль) и 1-гидроксибензотриазола (49 мг, 0,36 ммоль) в ДМФА (9 мл) и DCM (3 мл) перемешивали при комнатной температуре в течение ночи. Добавляли поглощающие смолы(PS-трисамин, PS-изоцианат и МР-карбонат) и смесь перемешивали в течение 2 ч, затем фильтровали. Очистка хроматографией давала указанное в заголовке соединение (42 мг).MS (ES): МН+ 555. Описание 38. 1,1-Диметилэтил 4-[(3-циано-4-фторфенил)амино]-1-пиперидинкарбоксилат (D38). Указанное в заголовке соединение получали из 5-бром-2-фторбензонитрила и 1,1-диметилэтил 4 амино-1-пиперидинкарбоксилата с использованием способа, аналогичного описанному для D10a. Описание 39. 2-Фтор-5-(4-пиперидиниламино)бензонитрил (D39). Указанное в заголовке соединение получали из D38 с использованием способа, аналогичного описанному для D10b. Описание 40. 1,1-Диметилэтил(2S)-4-[4-(2-4-[(3-циано-4-фторфенил)амино]-1-пиперидинил-2-оксоэтил)фенил]метил-2-метил-1-пиперазинкарбоксилат (D40). Указанное в заголовке соединение получали из D8 и D39 с использованием способа, аналогичного описанному для D29, но реакция протекала в течение ночи и водную обработку (DCM/вода) проводили перед хроматографией. Описание 41. 4-(3-4-[(4-Фторфенил)амино]-1-пиперидинил-3-оксопропил)бензальдегид (D41). Стадия 1. (2 Е)-3-(4-Формилфенил)-2-пропеновую кислоту (2,55 г) растворяли в EtOH (250 мл) и гидрировали при атмосферном давлении над 10% Pd/C (0,8 г) в качестве катализатора. Через 5 ч реакционную смесь фильтровали и концентрировали, получая смесь 1:1 3-[4-(гидроксиметил)фенил]пропановой кислоты и 3-(4-метилфенил)пропановой кислоты (2,43 г). Стадия 2. Кислотную смесь со стадии 1 (500 мг), гидрохлорид N-[3-(диметиламино)пропил]-N'этилкарбодиимида (723 мг, 3,78 ммоль), 1-гидроксибензотриазол (578 мг, 3,78 ммоль) в ДМФА (10 мл) обрабатывали D2 (561 мг, 2,9 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч. ДМФА удаляли в вакууме и добавляли EtOAc и воду. Водный слой экстрагировали EtOAc и объединенные органические фракции промывали насыщенным водным раствором NaHCO3 и насыщенным раствором соли, затем высушивали (Na2SO4) и концентрировали с получением смеси[4-(3-4-[(4-фторфенил)амино]-1-пиперидинил-3-оксопропил)фенил]метанола и N-(4-фторфенил)-1-[3(4-метилфенил)пропаноил]-4-пиперидинамина (1,1 г). Стадия 3. Вещество целиком растворяли в DCM (20 мл) и обрабатывали диоксидом марганца (2 г). После перемешивания в течение ночи добавляли дополнительно диоксид марганца (5 г) и перемешивание продолжали в течение 30 мин. Смесь фильтровали, концентрировали и очищали хроматографией(10-90% EtOAc/пентан), получая указанное в заголовке соединение в виде желтой смолы (282 мг).- 23014061 Описание 42. 4-(3-4-[(3-Фторфенил)амино]-1-пиперидинил-3-оксопропил)бензальдегид (D42). Указанное в заголовке соединение получали из D5b с использованием способа, аналогичного описанному для D41. Описание 43. 1,1-Диметилэтил (2R,6S)-4-[(4-бромфенил)метил]-2,6-диметил-1-пиперазинкарбоксилат (D43). Смесь 4-бромбензальдегида (1,85 г, 10 ммоль), 1,1-диметилэтил (2R,6S)-2,6-диметил-1 пиперазинкарбоксилата (2,15 г, 10 ммоль) и триацетоксиборгидрида натрия (3,18 г) в 1,2-DCE (35 мл) перемешивали при комнатной температуре в течение 3 дней. Добавляли насыщенный водный растворNaHCO3 и смесь перемешивали в течение 30 мин. Продукт экстрагировали в EtOAc и экстракты высушивали (Na2SO4) и концентрировали. Остаток растворяли в DCM и обрабатывали PS-гидразиновой смолой при перемешивании в течение 2 ч. Смолу удаляли фильтрованием и растворитель удаляли в вакууме. Хроматография (0-40% EtOAc/гексан) давала указанное в заголовке соединение (3,52 г).MS (ES): МН+ 383/385. Описание 44. Диэтил 4-[3S)-4-[(1,1-диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]фенилпропандиоат (D44). Указанное в заголовке соединение получали из D43 с использованием способа, аналогичного описанному для D7. Описание 45. Диэтил 4-[3S)-4-[(1,1-диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]фенил(метил)пропандиоат (D45). Раствор D44 (538 мг, 1,16 ммоль) в ДМФА (10 мл) добавляли по каплям к гидриду натрия (61 мг,60% мас./мас. в масле, 1,51 ммоль) в ДМФА (2 мл) при 0 С в атмосфере аргона. После перемешивания в течение 10 мин добавляли метилйодид (0,144 мл, 2,32 ммоль) и реакционной смеси давали нагреться до комнатной температуры за 1 ч. Добавляли раствор хлорида аммония и смесь экстрагировали EtOAc. Экстракты промывали насыщенным водным раствором NaHCO3 и водой, затем высушивали (Na2SO4) и концентрировали в вакууме. Хроматография с элюированием смесью 0-10% EtOAc/гексан давала указанное в заголовке соединение в виде прозрачной смолы (356 мг).MS (ES): МН+ 477. Описание 46. 2-4-[3S)-4-[(1,1-Диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]фенилпропановая кислота (D46). Раствор D45 (356 мг, 1,34 ммоль) в 2 М растворе NaOH (3 мл) и 1,4-диоксане (3 мл) перемешивали при комнатной температуре в течение 1 ч, затем при 80 С в течение 3 ч. Растворители удаляли в вакууме,добавляли воду и смесь доводили до рН 4 с помощью 2 М HCl. Продукт экстрагировали в EtOAc и экстракты промывали насыщенным раствором соли, затем высушивали (Na2SO4) и концентрировали, получая указанное в заголовке соединение (256 мг).MS (ES): MH+ 377, (М-Н+) 375. Описание 47. 1,1-Диметилэтил (2R,6S)-4-(4-[1,1-диметил-2-(метилокси)-2-оксоэтил]фенилметил)-2,6-диметил 1-пиперазинкарбоксилат (D47). Раствор метил 2-метилпропаноата (188 мкл, 1,64 ммоль) в толуоле (3 мл) добавляли к дициклогексиламиду лития (362 мг, 1,93 ммоль) в условиях сухого бокса с перчатками. Суспензию перемешивали в течение 10 мин, затем добавляли к смеси D43 (570 мг, 1,49 ммоль) и бис-(дибензилиденацетон)палладия(0) (43 мг, 0,074 ммоль). Добавляли три(трет-бутил)фосфин (18 мкл,0,074 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме и хроматографировали, элюируя смесью 0-90% EtOAc/петролейный эфир, с получением указанного в заголовке соединения в виде желтого масла (395 мг).- 24014061 Описание 48. 2-4-[3R,5S)-4-[(1,1-Диметилэтил)окси]карбонил-3,5-диметил-1-пиперазинил)метил]фенил-2 метилпропановая кислота (D48). Смесь D47 (395 мг, 0,978 ммоль) и моногидрата гидроксида лития (82 мг, 1,95 ммоль) в воде (5 мл) и 1,4-диоксане (10 мл) перемешивали при комнатной температуре в течение 3 дней. Растворители удаляли в вакууме и остаток растворяли в воде. Раствор промывали эфиром, подкисляли до рН 4 1 М HCl, затем экстрагировали DCM (2). Объединенные органические фракции высушивали (Na2SO4) и концентрировали в вакууме, получая указанное в заголовке соединение в виде желтой пены (316 мг).MS (ES): MH+ 391, (M-H+) 389. Описание 49. Этил (2 Е)-3-(5-формил-2-пиридинил)-2-пропеноат (D49). Смесь 2-бром-5-формилпиридина (500 мг, 2,6 ммоль), метилакрилата (0,6 мл, 6,5 ммоль),три-(о-толил)фосфина (80 мг, 0,26 ммоль), димера хлорида аллилпалладия(II) (47 мг, 0,13 ммоль) и ацетата натрия (1,08 г, 8 ммоль) в ДМФА (10 мл) нагревали при 170 С в микроволновом реакторе в течение 0,75 ч. Реакционную смесь фильтровали через Целит, затем разбавляли DCM и водой. Органическую фазу высушивали, концентрировали в вакууме и очищали хроматографией, получая указанное в заголовке соединение в виде белого твердого вещества (50 мг).MS (ES): МН+ 192. Описание 50. Фенилметил (2S)-4-(6-[(1E)-3-(этилокси)-3-оксо-1-пропен-1-ил]-3-пиридинилметил)-2-метил-1 пиперазинкарбоксилат (D50). Указанное в заголовке соединение получали из D49 и фенилметил (2S)-2-метил-1-пиперазинкарбоксилата с использованием способа, аналогичного описанному для D6. Описание 51.(2 Е)-3-5-[3S)-3-метил-4-[(фенилметил)окси]карбонил-1-пиперазинил)метил]-2-пиридинил-2 пропеновая кислота (D51). Указанное в заголовке соединение получали из D50 с использованием способа, аналогичного описанному для D48, но время реакции составляло 3 ч. Описание 52. Фенилметил (2S)-4-[6-1E)-3-4-[(3-фторфенил)амино]-1-пиперидинил-3-оксо-1-пропен-1-ил)-3 пиридинил]метил-2-метил-1-пиперазинкарбоксилат (D52). Указанное в заголовке соединение получали из D51 и D5b с использованием способа, аналогичного описанному для D37. Описание 53. 1,1-Диметилэтил (2S)-4-(2-хлор-4-[2-(метилокси)-2-оксоэтил]фенилметил)-2-метил-1-пиперазинкарбоксилат (D53). Указанное в заголовке соединение получали из метил (3-хлор-4-формилфенил)ацетата (Epple, R. etal. PCT Int. Appl. WO 2005116000) и гидрохлорида 1,1-диметилэтил (2S)-2-метил-1-пиперазинкарбоксилата с использованием способа, аналогичного описанному для D6, с добавлением к реакционной смеси триэтиламина (1,1 экв.) и временем реакции примерно 3 дня. Описание 54. 3-Хлор-4-[3S)-4-[(1,1-диметилэтил)окси]карбонил-3-метил-1-пиперазинил)метил]фенилуксусная кислота (D54). Указанное в заголовке соединение получали из D53 с использованием способа, аналогичного описанному для D48, с временем реакции 4 ч. Описание 55. 1,1-Диметилэтил(2S)-4-[2-хлор-4-(2-4-[(3-фторфенил)амино]-1-пиперидинил-2-оксоэтил)фенил]метил-2-метил-1-пиперазинкарбоксилат (D55). Указанное в заголовке соединение получали из D54 и D5b, используя методику, аналогичную описанной для D37, и реакцию проводили в атмосфере аргона.- 25014061 Описание 56. Гидрохлорид N-(3-фторфенил)-4-пиперидинамина (D56). 3-Фторанилин (28,38 мл, 0,296 моль) добавляли к раствору 4-оксо-1-пиперидинкарбоксилата (60 г,0,302 моль) в 1,2-DCE (600 мл) и смесь перемешивали в течение 15 мин. Постепенно добавляли три(ацетокси)боргидрид натрия (83 г, 0,392 моль) в течение 5 мин и смесь перемешивали в течение 5,5 ч,затем выливали в смесь 2 М HCl (100 мл), воды (200 мл) и льда (1 л). Фазы разделяли и водную фазу экстрагировали DCM (200 мл). Объединенные органические фазы высушивали над MgSO4 и концентрировали, получая светло-желтое твердое вещество, которое растворяли в МеОН (400 мл) и обрабатывали 2 М HCl (100 мл). Полученный раствор перемешивали при 60 С в течение ночи. Добавляли 5 М HCl(100 мл) и нагревание продолжали еще в течение 7 ч. Реакционную смесь концентрировали в вакууме,получая желтое масляное твердое вещество. Его перекристаллизовывали из смеси MeOH/EtOAc, получая две порции указанного в заголовке соединения (42,6 г и 17,0 г). Эти порции затем перекристаллизовывали из смеси IMS/EtOAc и полученные порции высушивали в вакууме при 50 С с получением указанного в заголовке соединения (общий выход 49,0 г).N-(3-Фторфенил)-4-пиперидинамин (D58). К суспензии, полученной в D57, добавляли воду (250 мл), смесь перемешивали и нагревали до 30-35 С и слои разделяли. Добавляли 5 М водную серную кислоту (75 мл) и смесь перемешивали при 50-55 С в течение 5 ч. Добавляли воду (250 мл), смесь охлаждали до 30-35 С и слои разделяли. Водный раствор разбавляли трет-бутилметиловым эфиром (ТВМЕ, 250 мл), смесь перемешивали в течение 1 мин и подщелачивали до рН 12-14 осторожным добавлением 32% мас./мас. водного NaOH (140 г, 100 мл), поддерживая температуру между 30 и 35 С. Слои разделяли и водный слой экстрагировали свежим ТВМЕ (250 мл). Объединенные органические экстракты промывали при 25-35 С 20% мас./об. водным NaCl (200 мл). Водный слой отбрасывали и органический раствор отгоняли при атмосферном давлении до конечного объема около 200 мл и охлаждали до 50 С. Медленно добавляли изооктан (250 мл) при 45-50 С, удаляли нагревающую баню и реакционную смесь охлаждали до 20-25 С. Раствор перемешивали при 20-25 С в течение ночи. Добавляли изооктан (250 мл), суспензию нагревали до 40 С и отгоняли в вакууме до конечного объема 250 мл, поддерживая температуру между 30 и 40 С. Конечную суспензию охлаждали до 0-5 С (в ледяной воде), перемешивали в течение 40 мин,фильтровали, твердый остаток промывали изооктаном (2100 мл) и высушивали в вакууме при 44 С в течение 3 ч, получая указанный в заголовке продукт (33,5 г).[4-(Бромметил)фенил]уксусную кислоту (75 г, 0,33 моль) добавляли к 4-метил-2-пентанону (MIBK,750 мл), охлажденному до 7 С, и добавляли хиральный пиперазин (1,1-диметилэтил (2S)-2-метил-1 пиперазинкарбоксилат, 72 г, 0,36 моль) одной порцией. Суспензию охлаждали до 5 С и по каплям добавляли диизопропилэтиламин (DIPEA, 112 мл, 0,64 моль) в течение 21 мин, поддерживая температуру ниже 5 С. После этого добавления суспензию перемешивали при 3 С в течение ночи. Добавляли гидроксид натрия (1 М, 750 мл), реакционную смесь доводили до 21 С и слоям давали разделиться. Реакционную емкость промывали водой (250 мл) и водный слой возвращали в реакционную емкость. Добавляли свежий MIBK (375 мл) и перемешиваемую смесь подкисляли приблизительно до рН 5 добавлением концентрированной соляной кислоты. Содержимое емкости интенсивно перемешивали в течение 5 мин, фазы разделяли и водную фазу экстрагировали дополнительным количеством MIBK (2375 мл), каждый раз доводя рН водного слоя до 5,1-5,3. Органические фазы объединяли (приблизительно 1,5 л) и удаляли 500 мл растворителя. Затем реакционную смесь охлаждали до комнатной температуры в течение ночи и удаляли еще 500 мл растворителя, оставляя конечный объем 600 мл (8 объемов), с получением безводного раствора указанного в заголовке продукта.(2S)-4-[4-(2-4-[(3-фторфенил)амино]-1-пиперидинил-2-оксоэтил)фенил]метил-2-метил-1-пиперазинкарбоксилат. Карбонилдиимидазол (CDI, 53 г, 0,33 моль) добавляли к безводному раствору D59 (охлажденному до комнатной температуры) двумя порциями с интервалом 15 мин после каждого добавления. Полученную смесь нагревали до 62 С и перемешивали в течение 15 мин. Одной порцией добавляли D58 (63,5 г,0,33 моль), вызывая слабую экзотермическую реакцию, нагревающую содержимое до 68 С. Смесь охлаждали до 62 С и перемешивали в течение 2 ч, затем охлаждали до 0 С в течение 2 ч и выдерживали при 0 С в течение ночи. Конечную суспензию фильтровали, твердое вещество промывали охлажденным льдом MIBK (375 мл), высушивали в вакууме при 50 С в течение ночи, получая указанный в заголовке продукт (142 г).(94 мг, 0,438 ммоль) в 1,2-DCE (3 мл) перемешивали в течение 5 мин при комнатной температуре. Добавляли три(ацетокси)боргидрид натрия (139 мг, 0,66 ммоль) и смесь перемешивали в течение 3 ч, затем добавляли насыщенный водный раствор NaHCO3. Смесь перемешивали в течение 15 мин, затем экстрагировали EtOAc. Объединенные экстракты высушивали (Na2SO4) и концентрировали в вакууме, получая неочищенный продукт, который очищали хроматографией. Элюирование смесью 20-90% EtOAc/пентан давало 1,1-диметилэтил (2R,6S)-4-[4-(2-4-[(4-фторфенил)амино]-1-пиперидинил-2-оксоэтил)фенил]метил-2,6-диметил-1-пиперазинкарбоксилат (143 мг).MS (ES): МН+ 539. Вещество целиком растворяли в смеси 2:1 DCM/ТФУК и перемешивали в течение 1 ч. Смесь концентрировали и свободное основание указанного в заголовке соединения выделяли с использованием картриджа Isolute SCX.MS (ES): MH+ 439. Это вещество целиком превращали в дигидрохлоридную соль указанного в заголовке соединения Смесь D8 (115 мг, 0,3 ммоль), DCC на полимерной подложке (270 мг, 1,7 ммоль/г, 0,45 ммоль) и 1-гидроксибензотриазола (55 мг, 0,36 ммоль) в смеси 2:1 ДМФА/DCM (3 мл) обрабатывали D5b (58 мг,0,3 ммоль) и перемешивали в течение ночи. Поглощающие смолы (PS-трисамин, PS-изоцианат и- 27014061 Это вещество целиком гидрировали в МеОН (5 мл) с катализатором 10% Pd/C (20 мг) в течение 2 ч. Хроматография (0-20% MeOH/DCM) давала указанное в заголовке соединение (29,6 мг).MS (ES): MH+ 425. Это вещество целиком обрабатывали 1,1 экв. 1 М HCl в Et2O, получая гидрохлоридную соль указанного в заголовке соединения (25 мг).N-(3-Фторфенил)-1-[(4-[(3S)-3-метил-1-пиперазинил]метилфенил)ацетил]-4-пиперидинамин (E2). Раствор D19 (83,01 г, 0,158 моль) в DCM (900 мл) разделяли на две порции и каждую охлаждали до 0 С и обрабатывали ТФУК (100 мл). После перемешивания в течение 0,5 ч при 0 С реакционные смеси нагревали до комнатной температуры и перемешивали в течение 3,25 ч. Растворитель удаляли в вакууме,остатки объединяли и распределяли между DCM и 2 М раствором NaOH. Водную фазу повторно экстрагировали DCM (2) и объединенные органические фракции затем промывали 2 М NaOH и насыщенным раствором соли. Органические фракции высушивали и концентрировали в вакууме с получением не совсем белого твердого вещества. NaOH фазы повторно экстрагировали DCM, который высушивали и концентрировали, получая дополнительную порцию белой пены. Две порции объединяли, получая указанное в заголовке соединение в виде не совсем белого твердого вещества (66,94 г).MS (ES): МН+ 425. Это вещество (66,22 г, 0,156 ммоль) растворяли в EtOAc (1,71) при 45-50 С с получением гомогенного светло-желтого раствора, который затем охлаждали до комнатной температуры и продували аргоном. При интенсивном перемешивании добавляли 1 М HCl в Et2O (156 мл, 0,156 М) и после еще 15 мин полученный светло-кремовый осадок собирали фильтрованием в атмосфере аргона. Вещество промывали дополнительно EtOAc (0,8 л) и частично высушивали на фильтре в атмосфере аргона в течение 15 мин. Твердое вещество затем высушивали при 80 С в вакууме, получая гидрохлоридную соль указанного в заголовке соединения (58,95 г).N-(3-Фторфенил)-1-[(4-[(3S)-3-метил-1-пиперазинил]метилфенил)ацетил]-4-пиперидинамин (Е 2). Смесь D60 (20 г, 0,038 моль) и 1 М серной кислоты (80 мл, 4 объема) нагревали до 553 С и суспензию перемешивали в течение 90 мин. Раствор охлаждали до 25 С и экстрагировали i-PrOAc (100 мл,5 объемов). Раствор серной кислоты разбавляли свежим i-PrOAc (100 мл, 5 объемов) и смесь подщелачивали до рН 12-14 медленным добавлением 32% мас./мас. гидрюксида натрия (23 г, 1,15 по массе), поддерживая температуру между 20 и 30 С. Водный слой отделяли, экстрагировали еще дважды i-PrOAc(2100 мл) и объединенные органические экстракты промывали 20% мас./об. водным раствором NaCl(60 мл, 3 объема). Органический раствор отгоняли при атмосферном давлении до конечного объема 200 мл и разбавляли свежим i-PrOAc (100 мл, 5 объемов). Раствор нагревали при кипении с обратным холодильником,фильтровали горячим через фильтровальную бумагу и отгоняли при атмосферном давлении до конечного объема 200 мл. Затем раствор медленно охлаждали в течение 1 ч до 30 С и полученную суспензию охлаждали до 5 С и перемешивали в течение 45 мин. Остаток собирали фильтрованием, промывали охлажденным i-PrOAc (22 объема) и высушивали в вакууме в течение ночи, получая указанный в заголовке продукт (12,63 г).H (CDCl3, 400 МГц) 7,27 (2 Н, д), 7,20 (2 Н, м), 7,06 (1 Н, кв), 6,37 (1 Н, м), 6,32 (1 Н, м), 6,25 (1 Н, м),4,52 (1 Н, м), 3,86 (1 Н, м), 3,74 (2 Н, с), 3,61 (1 Н, м), 3,46 (2 Н, с), 3,41 (1 Н, м), 3,12 (1 Н, м), 2,81-2,94 (4 Н,м), 2,73 (2 Н, м), 1,92-2,06 (3H, м), 1,65 (1 Н, м), 1,30 (1 Н, м), 1,07 (1 Н, м), 0,99 (3H, д). Следующие примеры 3-11, получали из D8 и аминов, указанных в табл. 1, с использованием способов, аналогичных описанному способу для примера 2, но MP-карбонат использовали вместоSi-карбоната на стадии образования амида и палладиевую чернь использовали вместо 10% Pd/C на стадии снятия защиты. Соединения обладают общей структурой Следующий пример 12 получали из D26 и амина, указанного в табл. 2, с использованием способа,аналогичного описанному для примера 2, но MP-карбонат использовали вместо Si-карбоната на стадии образования амида и палладиевую чернь использовали вместо 10% Pd/C на стадии снятия защиты. Соединения обладают общей структурой
МПК / Метки
МПК: A61P 1/08, C07D 401/10, A61K 31/496
Метки: лечения, применение, gpr38-рецепторами, производные, бензилпиперазина, опосредованных, расстройств, состояний
Код ссылки
<a href="https://eas.patents.su/30-14061-proizvodnye-benzilpiperazina-i-ih-primenenie-dlya-lecheniya-sostoyanijj-ili-rasstrojjstv-oposredovannyh-gpr38-receptorami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензилпиперазина и их применение для лечения состояний или расстройств, опосредованных gpr38-рецепторами</a>
Предыдущий патент: Устройство для выполнения инъекций
Следующий патент: Вирусные вакцины, полученные из клеток с низкими уровнями остаточной клеточной днк
Случайный патент: Горелка












