Производные азетидинкарбоксамида и их применение при лечении нарушений, опосредованных св1 рецепторами
Номер патента: 10583
Опубликовано: 30.10.2008
Авторы: Прэтт Роберт Марк, Мэнселл Ховард Лэнгхем, Доусон Клэр Элизабет, Сохэл Сакджит, Харрисон Керри, Растон Виктория Джэйн, Дэвидсон Джеймс Эдвард Пол
Формула / Реферат
1. Применение соединения формулы (I) или его фармацевтически приемлемой соли
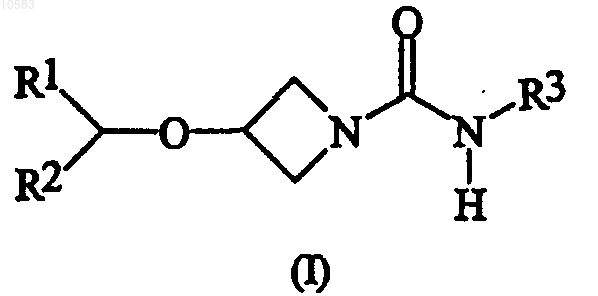
где
R1 и R2 независимо выбирают из арила; и R3 обозначает водород или алкил;
где по меньшей мере один из R1 и R2 содержит неводородный заместитель в орто-положении(-ях) относительно положения присоединения к [-CH-О-]группе, причем арильную группу выбирают из ароматических групп, выбранных из фенила и нафтила, алкильную группу выбирают из разветвленных и неразветвленных С3-С12 циклических и C1-С10 ациклических, насыщенных и ненасыщенных углеводородных радикалов,
для изготовления средств для прекращения курения, лечения никотиновой зависимости и/или лечения симптомов синдрома отмены никотина, расстройств, обусловленных избыточным потреблением пищи, и инсулиннезависимого сахарного диабета.
2. Применение по п.1, отличающееся тем, что R1 и R2 независимо выбирают из моноциклических ароматических групп.
3. Применение по п.1, отличающееся тем, что R1 и R2 независимо выбирают из фенила.
4. Применение по п. 1, отличающееся тем, что R1 и R2 независимо выбирают из группы формулы:
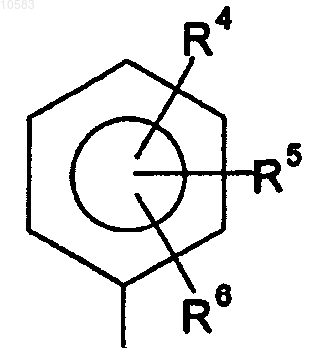
где R4, R5 и R6 независимо выбирают из водорода, галогена, алкила, тиоалкила, алкокси, алкилсульфонила, амино, моно- и диалкиламино, моно-и диариламино, алкилариламино, аминоалкила, алкиламиноалкила, диалкиламиноалкила, NR14C(O)R15, NR14SO2R16, COOR15, OC(O)R16, CONR7R8 и SO2NR7R8, где R7 и R8 независимо выбирают из водорода и алкила, или R7 и R8 могут образовывать 5- или 6-членный цикл, необязательно содержащий 1 или 2 дополнительных гетероатома, выбранных из N, О или S; и где R14 выбирают из Н и низшего алкила, который представляет собой разветвленный и неразветвленный C5-C7 циклический и C1-C4 ациклический, насыщенный и ненасыщенный углеводородный радикал, R15 выбирают из Н, алкила, арила и гетероарила и R16 выбирают из алкила, арила и гетероарила, причем алкильную группу выбирают из разветвленных и неразветвленных С3-С12 циклических и C1-С10 ациклических, насыщенных и ненасыщенных углеводородных радикалов, гетероарильную группу выбирают из моноциклических и бициклических ароматических групп, включающих 5- или 6-членные системы и содержащих от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота.
5. Применение по п.1, отличающееся тем, что R1 и R2 различны.
6. Применение по п.4 или 5, отличающееся тем, что R4, R5 и R6 независимо выбирают из фтора, хлора, брома или йода.
7. Применение по п.4 или 5, отличающееся тем, что R4, R5 и R6 независимо выбирают из алкила, тиоалкила, алкокси, аминоалкила, алкиламиноалкила, диалкиламиноалкила и алкилсульфонила, где алкильную группу выбирают из низшего алкила, который представляет собой разветвленный и неразветвленный С5-С7 циклический и C1-C4 ациклический, насыщенный и ненасыщенный углеводородный радикал.
8. Применение по п.4 или 5, отличающееся тем, что R4, R5 и R6 независимо выбирают из трифторметила и дифторметокси.
9. Применение по п.4 или 5, отличающееся тем, что один или два из R4, R5 и R6 обозначают водород.
10. Применение по п.4 или 5, отличающееся тем, что R14 обозначает Н.
11. Применение по п.4 или 5, отличающееся тем, что R15 и R16 независимо выбирают из алкила.
12. Применение по п.4 или 5, отличающееся тем, что R15 и R16 независимо выбирают из низшего алкила, который представляет собой разветвленный и неразветвленный С5-С7 циклический и C1-C4ациклический, насыщенный и ненасыщенный углеводородный радикал.
13. Применение по п.1, отличающееся тем, что R3 выбирают из алкила.
14. Применение по п.1, отличающееся тем, что R3 выбирают из трет-бутила, изобутила, втор-бутила и изопропила.
15. Применение по п.1, отличающееся тем, что R3 выбирают из -(CHR9)n(CH2)mCR10R11R12, где
n имеет значение 0 или 1;
m обозначает 0, 1, 2 или 3;
R9, R10, R11 и R12 выбирают из водорода, алкила, гидрокси, алкокси, тиоалкила, амино, моно-и диалкиламино, алкоксикарбонила и R13;
где R13 выбирают из арила, гетероарила и неароматической гетероциклической группы, необязательно замещённой одной или более группой, выбранной из алкила, галогена, алкокси, оксо, арила, гетероарила и неароматического гетероцикла, причем алкильную группу выбирают из разветвленных и неразветвленных С3-С12 циклических и C1-С10 ациклических, насыщенных и ненасыщенных углеводородных радикалов, гетероарильную группу выбирают из моноциклических и бициклических ароматических групп, включающих 5- или 6-членные системы и содержащих от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота; неароматическую гетероциклическую группу выбирают из насыщенных или частично ненасыщенных 4-7-членных циклов, содержащих от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота.
16. Применение по п.15, отличающееся тем, что m обозначает 0 или 1.
17. Применение по п.15, отличающееся тем, что m обозначает 0.
18. Применение по п.13, отличающееся тем, что R3 выбирают из циклопентила, циклогексила, норборнила и адамантила.
19. Применение по любому из пп.1-18, отличающееся тем, что пищевое расстройство представляет собой ожирение.
20. Применение по любому из пп.1-18, для прекращения курения.
21. Применение по любому из пп.1-18, для лечения инсулиннезависимого диабета.
22. Соединение, выбранное из группы, включающей
3-(2,4,4'-трихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2-тиофен-2-илэтил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(циклопропилметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2,3-дигидробензофуран-5-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2,5-диметилфуран-3-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2,3-дигидробензо[1,4]диоксин-2-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(5-метилизоксазол-3-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-[(R)-втор-бутил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2-бромтиофен-3-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-[(S)-втор-бутил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(тиофен-3-илметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2-метоксифенилметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2-фуранилметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(3-этоксипропил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(2-тетрагидрофуранилметил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(экзо-2-норборнил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-(1-фенилпропил)азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-[(R)-a-метилбензил]азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-[(R)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид,
3-(2,4'-дихлорбензгидрилокси)-N-[(S)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(н-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(этил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-[(S)-a-метилбензил]азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(2,2,4-триметилпент-4-ил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(циклопентил)азетидин-1-карбоксамид,
3-(2,4-дихлорбензгидрилокси)-N-(2,2,4-триметилпент-4-ил)азетидин-карбоксамид,
3-(2,4-дихлорбензгидрилокси)-N-(2-метилбут-2-ил)азетидин-карбоксамид,
3-[2-(трифторметил)-2'-фтор-4'-бромбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(бензил)азетидин-1-карбоксамид,
3-[2-(трифторметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид,
3-[2-(трифторметил)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-амил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(аллил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(аллил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-[(S)-a-метилбензил]азетидин-1-карбоксамид,
3-[2-(трифторметил)-2'-фтор-4'-(1-пиперидинилоксиметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид,
3-[2-(трифторметил)-2'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид и
3-[(R)-2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид.
23. 3-[(R)-2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид и его фармацевтически приемлемая соль.
24. Применение соединения по п.23 для лечения ожирения.
25. Применение соединения по п.23 для прекращения курения.
26. Применение соединения по п.23 для лечения инсулиннезависимого сахарного диабета.
Текст
010583 Настоящее изобретение относится, главным образом, к применению азетидин-1-карбоксамидов при лечении нарушений, опосредованных каннабиноидным рецептором СВ 1, в частности, к лечению ожирения и других пищевых нарушений, ассоциированных с перееданием. Признано, что ожирение представляет собой болезненный процесс, на который влияют экологические факторы, причм традиционные методы снижения веса с помощью диеты и упражнений требуется дополнять примом терапевтических продуктов (S. Parker, "Obesity: Trends and Treatments", Scrip Reports,PJB Publications Ltd, 1996).To, что классифицируется как избыточный вес или ожирение, как правило, определяется исходя из индекса массы тела (BMI), который рассчитывают как частное от деления веса тела (кг) на квадрат высоты (роста) (м 2). Таким образом единицы BMI имеют размерность кг/м 2 и можно рассчитать интервалBMI, ассоциированный с минимальной смертностью в каждый десятилетний период жизни. Избыточный вес определяют как BMI в интервале 25-30 кг/м 2, а ожирение - как BMI более 30 кг/м 2. Проблема с этим определением заключается в том, что не принимается во внимание соотношение мышечной массы тела и массы жира (жировая ткань). Принимая это во внимание, ожирение можно также определять исходя из веса жира: более 25 и 30% у мужчин и женщин, соответственно. При повышении BMI растт риск умереть от ряда причин, не зависящих от других факторов риска. Наиболее обычными заболеваниями при ожирении являются сердечно-сосудистые заболевания (в частности, гипертензия), диабет (ожирение обостряет развитие диабета), заболевание желчного пузыря (в частности, рак) и болезни репродукции. Исследования показали, что даже самое умеренное снижение веса тела может соответствовать значительному снижению риска развития коронарной сердечной недостаточности. Соединения, выпускаемые как агенты против ожирения, включают Orlistat (Reductil) и Sibutramine. Орлистат (Orlistat, ингибитор липаз) непосредственно ингибирует всасывание жира и имеет тенденцию часто вызывать неприятные (хотя относительно безвредные) побочные эффекты, такие как диарея. Сибутрамин (Sibutramine, смешанный ингибитор повторного всасывания 5 НТ/норадреналина) может повышать у некоторых пациентов кровяное давление и пульс. Сообщалось, что стимуляторы выделения/ингибиторы обратного захвата серотонина фенфлюрамин (Pondimin) и дексфенфлюрамин(Redux) снижают всасывание пищи и массу тела на продолжительный период времени (более 6 месяцев). Однако оба продукта изъяты после предварительных сообщений, свидетельствующих об аномалиях сердечных клапанов, ассоциированных с их применением. Таким образом, имеется необходимость в создании более безопасного агента против ожирения. В настоящее время существуют обширные данные преклинических и клинических исследований,подтверждающие применение антагонистов/обратных агонистов CB1 рецепторов для лечения ожирения. Препараты марихуаны (Cannabis sativa) использовались в течение более 5000 лет как для медицинских, так и для рекреационных целей. Основная психоактивная составляющая марихуаны идентифицирована как 9- тетрагидроканнабинол (9 - ТНС), один из более чем 60 родственных каннабиноидных соединений, выделенных из этого растения. Было показано, что 9 - ТНС проявляет сво действие через взаимодействие агониста с каннабиноидными рецепторами (СВ). До настоящего времени охарактеризованы два подтипа каннабиноидных рецепторов (CB1 и CB2). Подтип CB1 рецепторов обнаруживается преимущественно в центральной нервной системе и, в меньшей степени, в периферической нервной системе и различных периферических органах. Подтип СВ 2 рецепторов обнаруживается преимущественно в лимфоидных тканях и клетках. К настоящему времени идентифицированы три эндогенных агониста (эндоканнабиноиды), которые взаимодействуют как с CB1, так и с СВ 2 рецепторами (анандамид, 2 - арахидонилглицерин и ноладиновый эфир). У крыс и мышей с генетическим ожирением наблюдаются заметно повышенные уровни эндоканнабиноидов в области мозга, ассоциированные с примом пищи (Di Marzo et al. 2001 Nature 410: 822- 825). Кроме того, повышенные уровни эндоканнабиноидов наблюдаются при голодании у нормальных тощих животных (Kirkham et al., British Journal of Pharmacology 2002, 136(4) 550-557). Экзогенное применение эндоканнабиноидов дат такой же физиологический эффект, наблюдаемый при лечении 9- ТНС, включая стимуляцию аппетита (Jamshida et al., British Journal of Pharmacology 2001, 134: 1151-1154), аналгезию, пониженную скорость локомоций, гипотермию и каталепсию. Нокаутированные мыши, лишнные рецепторов CB1 (CB1-'-) и CB2 (CB2-'-), применялись для выяснения специфической роли двух подтипов каннабиноидных рецепторов. Помимо этого, в случае лигандов, таких как 9- ТНС, которые ведут себя как агонисты обоих рецепторов, эти мыши дали возможность идентифицировать, какой подтип рецептора опосредует специфические физиологические эффекты. CB1-'-, но не CB2-'- мыши резистентны к поведенческим эффектам агонистов, таких как 9- ТНС. Также было показано, что CB1-'- животные резистентны как к увеличению веса, связанному с постоянной диетой с высоким содержанием жира,так и к недостатку стимулирующей аппетит острой пищи. Эти открытия наводят на мысль о несомненной роли агонистов как эндогенных, так и экзогенных каннабиноидных рецепторов в увеличении потребления пищи и массы тела с помощью селективной активации CB1 подтипа рецептора.-1 010583 Терапевтический потенциал лигандов каннабиноидных рецепторов очень широко освещался в обзорах (Exp. Opin. Ther. Pat. 1998, 8, 301- 313; Exp. Opin. Ther. Pat. 2000, 10, 1529- 1538; Trends in Pharm.Sci. 2000, 21, 218-224; Exp. Opin. Ther. Pat. 2002, 12(10), 1475-1489). Известно, что проводятся клинические испытания для лечения ожирения, по меньшей мере, одного соединения (SR-141716A), охарактеризованного как антагонист/обратный агонист CB1 рецепторов. В Международных заявках WO 00/15609, WO 01/64632, WO 01/64633 и WO 01/64634 описаны производные азетидина как антагонисты CB1 рецепторов. В Международной заявке WO 02/28346 описана ассоциация производного азетидина, в качестве антагониста CB1 рецепторов, и сибутрамина для лечения ожирения. В медицине остатся необходимость в низкомолекулярных антагонистах/обратных агонистах CB1 рецепторов с фармакокинетическими и фармакодинамическими свойствами, делающими их пригодными для применения в качестве фармацевтических агентов. Также в медицине остатся необходимость в новых медицинских средствах (схемах лечения) для лечения нарушений, опосредованных CB1 рецептором,в частности, нарушений питания и, в частности, ожирения. Целью настоящего изобретения является создание таких фармацевтических агентов и схем лечения. Недавно найдено, что некоторые азетидин-1-карбоксамиды проявляют неожиданную эффективность в качестве агентов против ожирения. Соединения этой общей формулы были ранее описаны в Международной заявке WO-А-99/37612 для лечения страха и эпилепсии. Было показано, что эти азетидин 1-карбоксамиды селективно связываются с рецепторами CB1 подтипа с высокой аффинностью. Было показано, что такие соединения в зависимости от дозы (эффект дозы) блокируют действие экзогенно применяемого агониста каннабиноидного рецептора (например, 9-ТНС) у мышей. Помимо этого показано, что такие соединения снижают потребление пищи и увеличение массы тела как на крысиных, так и на мышиных моделях пищевого поведения. Согласно настоящему изобретению создано соединение формулы (I) где R1 и R2 независимо выбирают из арила; иR3 обозначает водород или алкил; или его фармацевтическая соль или его пролекарство,где по меньшей мере один из R1 и R2 содержит неводородный заместитель в орто-положении(-ях) относительно положения присоединения к [-СН-О-] группе. Активные соединения формулы (I) представляют собой антагонисты и/или обратные агонисты каннабиноидного-1(CB1) рецептора и применимы для лечения, предупреждения и подавления заболеваний,опосредованных CB1 рецептором. Изобретение относится к применению этих соединений для селективного противодействия CB1 рецептору и, в качестве такового, для лечения ожирения и других заболеваний. Термин "алкильная" группа по данному описанию означает разветвленный или неразветвлнный,циклический или ациклический, насыщенный или ненасыщенный (например, алкенильный (включая аллильный) или алкинильный (включая пропаргильный) углеводородный радикал. Алкильная группа,циклическая или ациклическая, обозначает предпочтительно C1-C12 группу, более предпочтительно C1-C8 группу (такую как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, вт-бутил, пентил, изопентил, гексил, гептил, октил). Таким образом, следует понимать, что термин "алкил" по данному описанию включает алкил (разветвлнный или неразветвлнный), алкенил (разветвлнный или неразветвлнный), алкинил (разветвлнный или неразветвлнный), циклоалкил, циклоалкенил и циклоалкинил. Циклическая алкильная группа также может быть циклической алкильной группой с одним мостиком или со многими мостиками. В предпочтительном варианте изобретения циклическая алкильная группа представляет собой предпочтительно С 3-С 12, более предпочтительно C5-C8 группу, а ациклическая алкильная группа представляет собой предпочтительно C1-C10 группу, более предпочтительно С 1-С 6 группу, более предпочтительно метил, этил, пропил (н-пропил или изопропил), бутил (н-бутил, изобутил, трет-бутил или вт-бутил) или пентил (включая н-пентил и изопентил), более предпочтительным является метил. Применяемый в данном описании термин "низший алкил" означает разветвлнный или неразветвлнный, циклический или ациклический, насыщенный или ненасыщенный (например, алкенильный или алкинильный) углеводородный радикал, в котором указанная циклическая низшая алкильная группа представляет собой группу C5, C6 или C7, а указанная низшая ациклическая алкильная группа представляет собой группу C1, С 2, С 3 или С 4. Таким образом, следует понимать, что термин "низший алкил" по данному описанию включает низший алкил (разветвлнный или неразветвлнный), низший алкенил(разветвлнный или неразветвлнный), низший алкинил (разветвленный или неразветвлнный), низший циклоалкил, низший циклоалкенил и низший циклоалкинил. Предпочтительно низшую алкильную груп-2 010583 пу выбирают из метила, этила, пропила (н-пропила или изопропила) или бутила (н-бутила, изобутила,трет-бутила или вт-бутила), более предпочтительным является метил. Термин "арильная" группа по настоящему описанию означает моно или бициклическую ароматическую группу, такую как фенил или нафтил, и предпочтительно моноциклическую ароматическую группу. Термин "гетероарильная" группа по настоящему описанию означает ароматическую группу, содержащую один или более гетероатомов, предпочтительно, 1,2 или 3 гетероатома, предпочтительно, 1 или 2 гетероатома. Предпочтительно гегероатомы выбирают из О, S и N, предпочтительно, из О и N. Предпочтительно, гетероарильная группа содержит 5- или 6-членные циклические системы. Гетероарильная группа предпочтительно представляет собой моноциклическую или бициклическую систему, предпочтительно моноциклическую. Примеры включают тиенил, фуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, хинолинил, изохинолинил, бензофуранил и изобензофуранил. Упоминаемая в данном описании неароматическая гетероциклическая группа представляет собой насыщенный или частично ненасыщенный 4, 5, 6 или 7-членный цикл, содержащий 1, 2 или 3 гетероатома, выбранных из N, О и S, предпочтительно 1 или 2 гетероатома, предпочтительно выбранных из N и О. Примеры включают пиперидинил, морфолинил, пиперазинил и пирролидинил. Алкильные, арильные и гетероарильные группы, определяемые в данном описании как R1- R16, могут быть замещнными. Если R7 и R8 вместе образуют 5 или 6-членный цикл, этот цикл может замещнным или незамещнным. Если цикл является замещнным, он содержит 1-3 заместителя, предпочтительно 1 или 2 заместителя. Заместители могут включать: Если арильная группа представляет собой фенил, этот фенил может быть замещн прилегающими заместителями, образующими 5 или 6-замещнный насыщенный цикл, необязательно содержащий 1 или 2 гетероатома, предпочтительно выбранных из N, О и S, предпочтительно из N и О. Если насыщенный цикл содержит 2 атома азота, цикл предпочтительно является 6-членным циклом. Если насыщенный цикл содержит 2 атома кислорода, цикл может быть 5- или 6-членным циклом. Примеры включают 2,3 дигидробензо[b]фуран-7-ил, 2,3-дигидробензо[b]тиофен-6-ил, 1,2,3,4-тетрагидронафталин-5-ил, 2,3 дигидробензо[1,4]диоксин-6-ил и 1,2,3,4-тетрагидроизохинолин-8-ил. Предпочтительные заместители включают алкил (включая галогеналкил), алкокси (включая галогеналкокси), арил, нитрил или галоген. Предпочтительные галогенсодержащие группы включают трифторметил. Употребляемый в данном описании термин "алкокси" означает алкил-О, а термин "алкоил" означает алкил-СО-. Употребляемый в данном описании термин "галоген" означает радикал фтора, хлора, брома или йода, предпочтительно радикал фтора или хлора. Соединения формулы (I) могут существовать в виде нескольких диастереомерных и/или энантиомерных форм. Если не указано иначе, ссылка в данном описании на "соединение формулы (I)" является ссылкой на все стереоизомерные формы соединения и включает ссылку на неразделнные изомеры в смеси, рацемической или нерацемической, и на каждый стереоизомер в чистом виде. В соединениях формулы (I) R1 и R2 предпочтительно независимо выбирают из замещнного или незамещнного фенила или нафтила (предпочтительно, фенила), более предпочтительно из фенила или нафтила (предпочтительно, фенила), содержащего 1-3 заместителя и наиболее предпочтительно из фенила или нафтила (предпочтительно, фенила), содержащего 1 или 3 заместителя. В одном варианте изобретения группы выбирают из галогена и галогеналкила (в частности, трифторметил). Предпочтительно R1 иR2 выбирают из моноциклических ароматических групп. В предпочтительном варианте изобретения соединения формулы (I) R1 и R2 независимо выбирают из группы формулы где R4, R5 и R6 независимо выбирают из водорода, галогена, алкила (включая галогеналкил), тиоалкила, алкокси (включая галогеналкокси), алкилсульфонила, амино, моно- и диалкиламино, моно- и диариламино, алкилариламино, аминоалкила, алкиламиноалкила, диалкиламиноалкила, NR14C(O)R15,NR14SO2R16, COOR15, OC(O)R16, CONR7R8 и SO2NR7R8, где R7 и R8 независимо выбирают из водорода и алкила, или R7 и R8 могут образовывать 5- или 6-членный цикл, необязательно содержащий 1 или 2 дополнительных гетероатома, выбранных из N, О или S; и где R14 выбирают из Н и низшего алкила (предпочтительно, Н), R15 выбирают из Н, алкила, арила и гетероарила (предпочтительно алкил, предпочтительно, низший алкил) и R16 выбирают нз алкила, арила и гетероарила (предпочтительно алкил, предпоч-5 010583 тительно, низший алкил). Группы R1 и R2 могут быть одинаковыми или различными и в одном варианте изобретения они различны. Если R4, R5 и R6 выбирают из галогена, галоген означает, предпочтительно, фтор, хлор, бром или йод, предпочтительно, хлор или бром. Если R4, R5 и R6 выбирают из алкила, тиоалкила, алкокси и алкилсульфонила, алкил, предпочтительно, выбирают из низшего алкила, и, предпочтительно, из метила и этила, предпочтительно, метила. Если R4, R5 и R6 выбирают из аминоалкила, алкиламиноалкила и диалкиламиноалкила, алкил, предпочтительно, выбирают из низшего алкила и предпочтительно из метила и этила, предпочтительно метила. Если R4, R5 и R6 выбирают из диалкиламиноалкила, диалкиламинофрагмент предпочтительно выбирают из аминогруппы в цикле, предпочтительно из морфолино или пиперазино. Если R4, R5 и R6 выбирают из галогеналкила, алкил, предпочтительно означает метил, a R4, R5 и R6 группа предпочтительно обозначает трифторметил. Если R4, R5 и R6 выбирают из галогеналкокси,алкил предпочтительно означает метил, а R4, R5 и R6 группу предпочтительно выбирают из трифторметокси или дифторметокси, предпочтительно дифторметокси. Предпочтительно один или два из R4, R5 иR6 обозначают водород. По меньшей мере одна из групп R1 и R2 содержит неводородный заместитель в орто-положении(-ях). Группы R1 и R2 могут независимо содержать один или два неводородных заместителя в орто-положении(ях) относительно положения присоединения к [-CH-О-]группе. Предпочтительные ортоаместители включают галоген и галогеналкил по данному описанию. Особенно предпочтительными ортозаместителями являются хлор и трифторметил, в особенности трифторметил. Если R7 и R8 образуют 5- или 6- членный цикл, цикл предпочтительно является 6-членным циклом и предпочтительно насыщенным или частично насыщенным, предпочтительно насыщенным. Если цикл содержит дополнительные гетероатомы, эти атомы предпочтительно выбирают из N и О. Предпочтительно имеется 0 или 1 дополнительный гетероатом. В соединениях формулы (I) R3 выбирают из водорода или алкила, предпочтительно алкила. Если R3 выбирают из алкила, предпочтительно R3 обозначает низший алкил и предпочтительно метил, этил, пропил и бутил по описанию выше. Алкильная группа может быть замещнной или незамещнной, и в одном варианте изобретения она является незамещнной. Может присутствовать один или два заместителя, предпочтительно один заместитель. Предпочтительными заместителями являются заместители, указанные выше в данном описании, в частности, гидрокси, алкокси, тиоалкил, амино, монои диалкиламино, алкоксикарбонил, арил (предпочтительно, фенил), и гетероциклические группы, включая как гетероарильные, так и неароматические гетероциклические группы. Если R3 обозначает ациклическую алкильную группу, она может быть замещена циклической алкильной группой; а если R3 обозначает циклическую алкильную группу, она может быть замещена ациклической алкильной группой. Если заместителем является гетероарил, гетероарил, предпочтительно, представляет собой 5- или 6-членный цикл, содержащий один или более N, О или S атомов, и предпочтительные группы включают тиофенил,фуранил, изоксазолил, тиазолил и бензотиофенил. Другие предпочтительные заместители включают дигидробензофуранил, дигидробензодиоксинил, тетрагидрофуранил, пирролидинил, оксопирролинил и бензодиоксолил. В одном варианте R3 выбирают изR9, R10, R11 и R12 выбирают из водорода, алкила (предпочтительно, низшего алкила), гидрокси, алкокси (предпочтительно, низшего алкокси), тиоалкила (предпочтительно, низшего тиоалкила), амино,моно- и диалкиламино (предпочтительно, низшего диалкиламино), алкоксикарбонила (предпочтительно,низшего алкоксикарбонила) и R13; где R13 выбирают из арила, гетероарила и неароматической гетероциклической группы, необязательно замещнной одной или более (предпочтительно 1 или 2, предпочтительно, 1) группой, предпочтительно выбранной из алкила (предпочтительно, низшего алкила, предпочтительно, метила), галогена(предпочтительно, фтора, хлора и брома), алкокси (предпочтительно, низшего алкокси, предпочтительно,метокси), оксо, арила, гетероарила и неароматического гетероцикла. Предпочтительно m обозначает 0, 1 или 2, предпочтительно 0 или 1, и предпочтительно 0. В одном варианте изобретения по меньшей мере 1 и более предпочтительно 2 из R10, R11 и R12 выбирают из водорода. В другом варианте изобретения по меньшей мере 1 и более предпочтительно 2 изR10, R11 и R12 выбирают из метила. В другом варианте изобретения R3 выбирают из циклического алкила, включая циклопентил, циклогексил, норборнил и адамантил, предпочтительно циклопентил и циклогексил. Предпочтительными R3 группами являются третичный бутил, втор-бутил, изобутил, изопропил, нпропил и этил, в особенности трет-бутил, изобутил, втор-бутил и изопропил, и в особенности трет-бутил. Ниже представлены предпочтительные соединения: 3-(2,4,4'-трихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(этилпропионат-2-ил)азетидин-1-карбоксамид; 3-(2,4'-дихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-тиофен-2-илэтил)азетидин-1-карбоксамид-7 010583 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(аллил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(аллил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-[(S)-а-метилбензил]азетидин-1-карбоксамид 3-[2-(трифторметил)-2'-фтор-4'-(1-пиперидинилоксиметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-2'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид и 3-[(R)-2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид Особенно предпочтительными являются следующие соединения: 3-(2,4,4'-трихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-тиофен-2-илэтил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(циклопропилметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2,3-дигидробензофуран-5-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2,5-диметилфуран-3-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2,3-дигидробенз[1,4]диоксин-2-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(5-метилизоксазол-3-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-[(R)-втор-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-бромтиофен-3-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-[(S)-втор-бутил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(тиофен-3-илметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-метоксифенилметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-фуранилметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(3-этоксипропил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(2-тетрагидрофуранилметил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(экзо-2-норборнил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-(1-фенилпропил)азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-[(R)-а-метилбензил]азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-[(R)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид 3-(2,4'-дихлорбензгидрилокси)-N-[(S)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(н-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(этил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-[(S)-а-метилбензил]азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(2,2,4-триметилпент-4-ил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(циклопентил)азетидин-l-карбоксамид 3-(2,4-дихлорбензгидрилокси)-N-(2,2,4-триметилпент-4-ил)азетидин-карбоксамид 3-(2,4-дихлорбензгидрилокси)-N-(2-метилбут-2-ил)азетидин-карбоксамид 3-[2-(трифторметил)-2'-фтор-4'-бромбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(бензил)азетидин-1-карбоксамид 3-[2-(трифторметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид-8 010583 3-[2-(трифторметил)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'- хлорбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-амил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(аллил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-(дифторметокси)бензгидрилокси]-N-(аллил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(втор-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-[(S)-а-метилбензил]азетидин-1-карбоксамид 3-[2-(трифторметил)-2'-фтор-4'-(1-пиперидинилоксиметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид 3-[2-(трифторметил)-2'-фторбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид и 3-[(R)-2-(трифторметил)-4'-хлорбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид. Согласно другому аспекту изобретения охватывается соединение формулы (I) для применения в терапии. Согласно другому аспекту изобретения охватывается применение соединения формулы (I) для получения лекарственного препарата для лечения нарушения, опосредованного CB1 рецепторами. В другом аспекте настоящее изобретение включает способ лечения нарушения, опосредованного рецепторами CB1, заключающийся во введении субъекту, нуждающемуся в таком лечении, эффективной дозы соединения формулы (I) или его фармацевтически приемлемой соли или пролекарства. Нарушения, опосредованные рецепторами CB1, выбирают из психоза, нарушения памяти, когнитивных нарушений, синдрома дефицита внимания, мигрени, нейропатии, нейровоспалительных нарушений, включая рассеянный склероз и синдром Гийена-Барре и воспалительные осложнения после вирусного энцефалита, церебральных сосудистых поражений, травмы головы, тревожных расстройств, депрессии, стресса, эпилепсии, деменции (слабоумия), болезни Альцгеймера, болезни Хантингтона (Гентингтона), синдрома Туретта, ишемии, боли, болезни Паркинсона, шизофрении, нарушений, связанных со злоупотреблением веществами, особенно никотином, спиртом и опиатами, прекращения курения, лечения никотиновой зависимости и/или лечения абстинентного симптома отмены никотина, желудочнокишечных нарушений (таких как двигательная дисфункция желудка и кишечника или диарея), ожирения и других нарушений пищевого поведения, связанных с перееданием, и ассоциированных осложнений,включая инсулиннезависимый сахарный диабет. Конкретно, настоящее изобретение относится к психозу, нарушению памяти, когнитивным нарушениям, синдрому дефицита внимания, мигрени, тревожным расстройствам, стрессу, болезни Паркинсона,шизофрении, нарушениям, связанным со злоупотреблением веществами, особенно никотином, спиртом и опиатами, прекращению курения, лечению никотиновой зависимости и/или лечению абстинентного симптома отмены никотина, желудочно-кишечным нарушениям (таким как двигательная дисфункция желудка и кишечника или диарея), ожирению и другим нарушениям пищевого поведения, связанным с перееданием, и ассоциированным осложнениям, включая инсулиннезависимый сахарный диабет. Более конкретно, настоящее изобретение относится к нарушениям, выбранным из психоза, шизофрении, когнитивных нарушений, синдрома дефицита внимания, прекращения курения, желудочнокишечных нарушений (таких как двигательная дисфункция желудка и кишечника или диарея), ожирения и других нарушений пищевого поведения, связанных с перееданием (включая булимию и компульсивное-9 010583 переедание (нарушение пищевого поведения) и ассоциированных осложнений, включая инсулиннезависимый сахарный диабет. Настоящее изобретение, в особенности, относится к ожирению и другим нарушениям пищевого поведения, связанным с перееданием, и ассоциированным осложнениям, включая инсулиннезависимый сахарный диабет, и особенно относится к ожирению и другим нарушениям пищевого поведения, связанным с перееданием, и, главным образом, к ожирению. В альтернативном варианте настоящее изобретение относится к злоупотреблению веществами, в особенности, никотином, спиртом и опиатами, прекращению курения, лечению никотиновой зависимости и/или лечению абстинентного симптома отмены никотина, и в особенности, к прекращению курения и его облегчению. В другом альтернативном варианте настоящее изобретение относится к желудочно-кишечным нарушениям (таким как двигательная дисфункция желудка и кишечника или диарея). В другом альтернативном варианте настоящее изобретение относится к лечению болезни Паркинсона. Настоящее изобретение может применяться в отношении человека или животного, более предпочтительно, млекопитающего, более предпочтительно человека. Применяемый в данном описании термин "лечение" включает профилактическое лечение. Применяемый в данном описании термин "пролекарство" означает любое фармацевтически приемлемое пролекарство соединения формулы (I). Например, соединение формулы (I) можно получать в форме пролекарства, в котором дериватизирована -ОН группа (например, за счт сложноэфирной, амидной или фосфатной связи) с помощью подходящей группы (группа может содержать, например, алкильную,арильную, фосфатную, углеводную, аминную, гликолевую, сульфонатную или кислотную функцию),которая является в достаточной степени лабильна, так что е можно удалить/отщепить (например, гидролизом) с высвобождением соединения формулы (I) через некоторое время после введения или под действием заданной биологической среды. Применяемое в данном описании выражение "фармацевтически приемлемая соль" означает любую фармацевтически приемлемую соль соединения формулы (I). Соли можно получать из фармацевтически приемлемых нетоксических кислот и оснований, включая неорганические и органические кислоты и основания. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую,лимонную, этансульфоновую, дихлоруксусную, фумаровую, глюконовую, глутаминовую, гиппуровую,бромистоводородную, хлористоводородную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную,винную, щавелевую, п-толуолсульфоновую и т.п. Особенно предпочтительными являются хлористоводородная, бромисто-водородная, фосфорная, серная и метансульфоновая кислоты, а наиболее предпочтительной является соль метансульфоновой кислоты. Приемлемые основные соли включают соли щелочных металлов (например, натрия, калия), щелочно-земельных металлов (например, кальция, магния) и соли алюминия. Соединение формулы (I) можно применять в комбинации с одним или более дополнительных лекарственных веществ, пригодных для лечения упомянутых выше нарушений, причм компоненты находятся в одном и том же препарате или в раздельных препаратах для одновременного или последовательного введения. Соединение формулы (I) можно получать по схеме реакции (где Р обозначает азот-защитную группу). R1, R2 и R3 имеют значение по определению выше. Простой эфир (IV) может образовываться по реакции азетидинола (II) с бензгидролом (III, X = ОН) с отгонкой воды (например, азеотропной отгонкой воды с обычной насадкой Дина-Старка). Простой эфир (IV) можно также получать по реакции азетидинола (II) с бензгидрильной группой, замещнной подходящей уходящей группой (III, Х = Cl, Br, I, мезилат, тозилат), в присутствии сильного основания, такого как гидрид натрия. Азетидин (V) можно получать по реакции (IV) с подходящим азот-депротекционирующим агентом (для снятия защиты с атома азота). Например, если Р обозначает бензгидрильную группу, снятие защитной группы можно проводить обработкой 1-хлорэтилформиатом, а затем метанолом. Свободный азетидин (V) (без защитной группы) можно выделять непосредственно в виде соли - гидрохлорида или, после подщелачивания, в виде свободного основания. Мочевину (I) можно получать по реакции азетидина (V) с N-алкилизоцианатом илиN-алкилкарбамоилхлоридом и основанием, таким как триэтиламин или карбонат калия. Или же мочевину можно получать непосредственно из защищнного азетидина (IV), не выделяя промежуточный азетидин (V). Например, если Р обозначает бензгидрильную группу, азетидин (IV) можно обрабатывать фосгеном, а затем амином, R3NH2, непосредственно получая мочевину (I). Азетидин (V) можно также превратить в соответствующий карбамоилхлорид (VI), обрабатывая, например, трифосгеном. Этот промежуточный карбамоилхлорид (VI) может реагировать с амином, R3NH2, с образованием мочевины. Далее, изобретение включает фармацевтическую композицию, содержащую эффективное количество формулы (I) в комбинации с фармацевтически приемлемым носителем или эксципиентом, и способ получения такой композиции, заключающийся в смешении эффективного количества соединения формулы (I) с фармацевтически приемлемым носителем или эксципиентом. Для дополнительного повышения эффективности композиция может содержать компоненты, такие как декстраны или циклодекстрины или их простые эфиры, которые способствуют стабильности и дисперсии и уменьшают метаболизм активного ингредиента. Для приготовления композиций, в которых фармацевтически приемлемый носитель содержит циклодекстрин или его простой эфир, активный ингредиент тщательно смешивают с водным раствором циклодекстрина или его эфира, необязательно добавляя дополнительные фармацевтически приемлемые ингредиенты перед смешением, во время или после указанного смешения. Полученный таким образом раствор необязательно лиофилизируют, а затем лиофилизированный остаток необязательно восстанавливают водой. В варианте настоящего изобретения композиция дополнительно содержит буферную систему, изотонический агент и воду. Соединения формулы (I) можно вводить в форме, пригодной для перорального применения, например, таблетки, капсулы, водный или масляный раствор, суспензия или эмульсия; для местного применения, включая трансмукозное и трансдермальное применение, например крем, мазь, гель, водный или масляный раствор или суспензия, "марка" или пластырь; для назального применения, например, порошок для вдыхания через нос, назальный спрей или капли в нос; для вагинального или ректального применения, например, суппозиторий; для ингаляций, например, тонкодисперсный порошок или жидкий аэрозоль; для сублингвального или трансбуккального применения, например, таблетки или капсулы; или для парентерального применения (включая внутривенную, подкожную, внутримышечную, интраваскулярную инъекцию или инфузию), например, стерильный водный или масляный раствор или суспензия. Как правило, вышеприведнные композиции можно готовить обычным методом, применяя традиционные эксципиенты, используя стандартные методы, хорошо известные специалистам в области фармации. Предпочтительно, соединение вводят (пер)орально. Для перорального введения соединения формулы (I),как правило, готовят в форме таблеток или капсул или в виде водного раствора или суспензии. Таблетки для перорального применения включают активный ингредиент, смешанный с фармацевтически приемлемыми эксципиентами, такими как инертные дилюенты (разбавители), вещества, способствующие измельчению, связующие, смазки, подсластители, вещества, придающие вкус и запах, красители и консерванты. Подходящие инертные дилюенты включают карбонат натрия и кальция, фосфат натрия и кальция и лактозу, тогда как маисовый крахмал и альгиновая кислота являются подходящими веществами, способствующими измельчению. Связующие могут включать крахмал и желатин, тогда как смазки, если они присутствуют, представляют собой стеарат магния, стеариновую кислоту или тальк. При желании таблетки могут быть покрыты материалом, таким как глицерилмоностеарат или глицерилстеарат, чтобы замедлить всасывание в желудочно-кишечном тракте. Капсулы для перорального применения включают тврдые желатиновые капсулы, в которых активный ингредиент смешан с тврдым дилюентом, и мягкие желатиновые капсулы, в которых активный ингредиент смешан с водой или маслом, таким как кокосовое масло, жидкий парафин или оливковое масло. Или же активный ингредиент может смешиваться с эксципиентами, поверхностно-активными вещества- 11010583 ми или солюбилизирующими агентами, такими как Labrafil, Labrasol или Myglol, или их подходящие смеси. Для внутримышечного, интраперитонеального (внутрибрюшинного), подкожного и внутривенного применения соединения формулы (I), как правило, выпускаются в виде водных растворов или суспензий,забуференных до соответствующих рН и изотоничности. Подходящие водные носители включают раствор Рингера и изотонический раствор хлористого натрия. Водные суспензии могут включать суспендирующие агенты, такие как производные целлюлозы, альгинат натрия, поливинилпирролидон и камедь трагаканта, и увлажняющий агент, такой как лецитин. Подходящие консерванты для водных суспензий включают этиловый и пропиловый эфир п-гидроксибензойной кислоты. Понятно, что применяемые уровни доз могут варьироваться в широких пределах в зависимости от используемого соединения, тяжести симптомов у пациента и массы тела больного. Далее изобретение подробно описывается на следующих фармакологических примерах. Понятно,что предполагается, что примеры иллюстрируют, но не ограничивают объм настоящего изобретения. Примеры Методы анализа Связывание с CB1 рецепторами Связывание соединений формулы I с рекомбинантными человеческими CB1 рецепторами определяют in vitro стандартными методами со ссылкой на методы, описанные Rinaldi-Carmona et al. (RinaldiCarmona, M., Pialot, F., Congy, C., Redon, E., Barth, F., Bachy, A., Breliere, J.C., Soubre, P., LeFur, G., LifeSci. 1996, 58(15), 1239-1247). Мембраны получают из клеток НЕК 293, экспрессирующих рекомбинантные hCB1 рецепторы. Анализы связывания осуществляют в общем объме 250 мкл, содержащем [3H]-SR141716A (конечная концентрация 1 нМ), мембраны и испытуемое соединение. Неспецифическое связывание определяют, используя СР 55940 (10 мкМ). Серийные разведения делают исходя из 10 мМ растворов тестируемых соединений в ДМСО. Соединения тестируют в интервале концентраций 10-10 - 10-5 M. Значения Ki рассчитывают из значений IC50 по уравнению Cheng-Prussoff. Определнные таким образом значения активности соединений формулы (I) приведены в табл. 1. Таблица 1 Блокада вызванной 9-ТНС замедленной локомоции у мышей Активность in vivo соединений формулы (I) проверяют по их способности противодействовать замедлению локомоторного поведения, вызванному однократным системным введением 9-ТНС самцам мышей С 57 В 1/6. Ниже представлена методика эксперимента. Тестируемые соединения оценивают после однократного перорального или интраперитонеального введения дозы 30 мг/кг. В каждом исследовании используют "between-subject" (межсубъектный) дизайн(как правило, n=8) и сравнивают эффект дозы тестируемого агента с эффектами доз носителя и позитивным контролем. Способ введения тестируемого соединения, объм лекарственного вещества и интервал инъекциятест зависят от применяемого соединения. За 10 мин перед испытанием мышам и.п. вводят дозу 3 мг/кг 9-ТНС. Автоматические боксы (камеры) (мониторы активности AM-1052, Benwick Electronics, LintonInstrumentation) используют для регистрации отклонений луча фотоэлемента как меру локомоторной активности. Световые лучи попадают на матрицу 7 х 4 на металлической сетке. 16 сеток соединяют последовательно и в каждую сетку помещают камеру из плексигласа, 20 (ширина) х 40 (длина) х 20 (высота) см, с плоской перфорированной крышкой из плексигласа. Мышей по одной помещают в камеры из плексигласа и одновременно начинают регистрировать активность во всех 16 камерах. Мышей не беспокоят в течение 15 мин, чтобы изучить новые боксы мониторов активности, пока регистрируется отклонение луча. Данные локомоторной активности используют в модели одностороннего анализа вариаций(ANOVA), применяя лечение лекарственным веществом в качестве "between-subject" (межсубъектного) фактора. Значительный основной эффект наблюдают с помощью теста Даннета, чтобы оценить, ка- 12010583 кой(ие) метод(ы) лечения заметно отличае(ю)тся от среднего контрольного значения. Заметную разницу между группой Носитель/9-ТНС и группами Тестируемое соединение/9-ТНС оценивают с помощью теста Ньюмана- Кеулса. Все статистические анализы осуществляют с помощью программ Statistica Software, Version 6.0 (Statsoft Inc.) и Microsoft Excel 7.0 (Microsoft Corp.). Определнные таким образом значения активности соединений формулы (I) приведены в табл. 2. Таблица 2In vivo активность соединений формулы (I) анализируют по способности регулировать пищевое поведение, измеряя потребление пищи у голодных (лишнных пищи) самцов крыс, помещнных в камеру Листера, следующим образом. Тестируемые соединения оценивают после однократного введения. В каждом исследовании используют "between-subject" (межсубъектный) дизайн (как правило, n=8) и сравнивают эффект дозы тестируемого агента с эффектами доз носителя и позитивным контролем. Аноретик сибутрамин или эталонный антагонист CB1 рецептора, SR141716A, обычно служат в качестве позитивного контроля. Способ введения тестируемого соединения, объм лекарственного вещества и интервал инъекция-тест зависят от применяемого соединения. Интервал инъекция-тест представляет собой время между введением дозы и пищевой репрезентацией. Как правило, животные являются голодными (натощак), так чтобы ко времени пищевой репрезентации они были лишены пищи в течение 18 часов. Потребление пищи анализируют в заданные временные точки (как правило, через 1, 2 и 4 часа после введения). Данные прима пищи используют в модели одностороннего анализа вариаций(ANOVA), применяя лечение лекарственным веществом в качестве "between- subject" (межсубъектного) фактора. Значительный основной эффект наблюдают с помощью теста Даннета, чтобы оценить, какой(ие) метод(ы) лечения заметно отличае(ю)тся от среднего контрольного значения. Все статистические анализы осуществляют с помощью программ Statistica Software, Version 6.0 (Statsoft Inc.) и Microsoft Excel 7.0 (Microsoft Corp.). Определнные таким образом значения активности соединений формулы (I) приведены в табл. 3. Таблица 3 Методики анализа химических веществ ВЭЖХLC (ЖХ) (50/80) относится к элюции образца через колонку XTERRA RP18 (50 мм х 4.6 мм) 5 мкм в градиенте. Начальный элюент содержит 50% метанола (насос-А) и 50% 10 мМ водного раствора ацетата аммония, содержащего 5% IPA (насос-В) при скорости потока 2 мл/мин. Через 1 мин за 5 мин доводят градиент до конечной точки 80% насос-А и 20% насос-В, который поддерживают в изократическом режиме в течение 3 мин. УФ-детектирование, как правило, проводят при длине волны 220 нм.LC (ЖХ) (80/20) относится к элюции образца через колонку XTERRA RP18 (50 мм х 4.6 мм) 5 мкм в изократическом режиме. Элюент содержит 80% метанола (насос-А) и 20% 10 мМ водного раствора ацетата аммония, содержащего 5% IPA (насос-В) при скорости потока 2 мл/мин в течение 10 мин. УФдетектирование, как правило, проводят при длине волны 220 нм.LC (ЖХ) (CHIRAL AD) относится к элюции образца через колонку CHIRALPAK (250 мм х 4.6 мм) 10 мкм в изократических условиях. Как правило, элюент содержит 90% н-гексана и 10% 2-пропанола,скорость потока 1 мл/мин в течение 40 мин. УФ-детектирование, как правило, проводят при длине волны 220 нм.- 13010583 ЯМР 1H ЯМР H спектры снимают на ЯМР-спектрометре Bruker 400 МГц. Растворы, как правило, готовят либо в дейтерохлороформе (CDCl3), либо в дейтерированном диметилсульфоксиде (ДМСО-d6), химсдвиги выражаются в м.д. относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта, константы спин-спинового взаимодействия даются в Гц.MS (Масс-спектрометрия) Масс-спектры получают с помощью петлевого ввода образца в детектор Waters ZQ массспектрометра, снабжнный источником электрораспыления, работающий в режиме переключения для детектирования положительных/отрицательных ионов и при напряжении в конусе 25 В. Синтетические примеры Получение 1-бензгидрил-3-азетидинола (1) Этот продукт получают по методу Anderson и Lok (J. Org. Chem., 1972, 37, 3953 -статья вводится в данное описание в качестве ссылки), т.пл. 111-112 С (лит. т.пл. 113 С). Получение 2,4,4'-трихлорбензгидрола (2) К раствору 2,4-дихлорбензальдегида (286 ммоля) в диэтиловом эфире (500 мл) при перемешивании при 0 С по каплям прибавляют 4-хлорфенилмагнийбромид (1,0 М в диэтиловом эфире, 286 ммоля) в течение 1 ч. Реакционную смесь доводят до комнатной температуры и перемешивают в течение 3 ч. Прибавляют насыщенный раствор хлористого аммония (500 мл) и экстрагируют диэтиловым эфиром (2 х 500 мл), эфирные вытяжки промывают водой и рассолом, сушат (MgSO4) и упаривают в вакууме. Остаток очищают, растирая с изогексаном (500 мл), получают продукт в виде тврдого вещества белого цвета(60,0 г, 73%). ЯМР 1H (400 МГц, ДМСО-d6) H 5,95 (1 Н, д, J=4,5 Гц), 6,23 (1 Н, д, J=4,0 Гц), 7,31 (2 Н, м), 7,37 (2 Н,м), 7,47 (1 Н, дд, J=2,5, 8,5 Гц), 7,55 (1 Н, д, J=2,0 Гц), 7,66 (1 Н, д, J=8,5 Гц). Получение 1-бензгидрил-3-(2,4,4'-трихлорбензгидрилокси)азетидина (3) Раствор 2,4,4'-трихлорбензгидрола (2) (174 ммоля), п-толуолсульфоновую кислоту (174 ммоля) и 1 бензгидрил-3-азетидинол (1) (87 ммоля) в толуоле (700 мл) кипятят с насадкой Дина-Старка в течение 30 мин. Раствор охлаждают, промывают гидрокарбонатом натрия (насыщенный водный раствор, 700 мл),сушат (MgSO4) и упаривают в вакууме. Остаток очищают хроматографией на колонке [SiO2; (10% этилацетат: изогексан)], получают продукт в виде жлтого масла (22,0 г, 50%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,78 (1 Н, т, J=6,5 Гц), 2,84 (1 Н, т, J=6,5 Гц), 3,23 (1 Н, т, J=6,5 Гц),3,31 (1H, т, J=6,5 Гц), 4,18 (1 Н, м), 4,39 (1H, с), 5,71 (1 Н, с), 7,15 (2 Н, м), 7,24 (4 Н, м), 7,32 (2 Н, м), 7,37(6 Н, м), 7,47 (1H, м), 7,57 (2 Н, м). Получение 3-(2,4,4'-трихлорбензгидрилокси)азетидина (4) К раствору 1-бензгидрил-3-(2,4,4'-трихлорбензгидрилокси)азетидина (3) (39 ммолей) в хлористом метилене (400 мл) при перемешивании при 0 С по каплям прибавляют 1-хлорэтилхлорформиат (98 ммолей) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь упаривают в вакууме, затем растворяют в метаноле (400 мл) и перемешивают при комнатной температуре в течение 1 ч. Упаривают в вакууме, растворяют в этилацетате (400 мл) и промывают гидроксидом натрия (5N, 400 мл), сушат (MgSO4) и упаривают в вакууме, получают жлтое масло. Остаток очищают фильтрованием через слой силикагеля, элюируя хлористым метиленом, затем смесью [этилацетат: метанол: гидроксид аммония (90:8:2)], получают жлтое масло (8,0 г, 60%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,38 (4 Н, уш.д), 4,29 (1 Н, м), 5,68 (1H, с), 7,32 (2 Н, м), 7,40 (2 Н, м),7,49 (2 Н, м), 7,50 (1 Н, м), 7,60 (2 Н, м). Пример 1. 3-(2,4,4'-трихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид (5) К раствору 3-(2,4,4'- трихлорбензгидрилокси)азетидина (4) (3 ммоля) в хлористом метилене (10 мл) прибавляют трет-бутилизоцианат (3 ммоля) и триэтиламин (каталитическое количество) и реакционную смесь перемешивают при комнатной температуре в течение 3 ч. Реакционную смесь пропускают через предварительно увлажннный (CH2Cl2) слой SCX-2 (2 г), элюируют хлористым метиленом, получают заданный продукт в виде белой пены (424 мг, 33%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,54 (1H, дд, J=4,5, 8,5 Гц), 3,80 (1 Н, дд, J=6,5, 8,5 Гц),4,29 (1H, м), 5,62 (1 Н, с), 7,34 (2 Н, м), 7,42 (2 Н, м), 7,50 (1 Н, м), 7,61 (1H, м), 7,64 (1H, с) ЖХ (50/80) 97,5%, 7,59 мин Найдено: С, 57,19; Н, 5,30; N, 6,26, C16H14C13NO Вычислено: С, 57,09; Н, 5,25; N, 6,34% Пример 2. 3-(2,4,4'-трихлорбензгидрилокси)-N-(1-гидрокси-2-метилпропан-ил)азетидин-1-карбоксамид (6) К раствору трифосгена (5.5 ммоля) в хлористом метилене (50 мл) при перемешивании при 0 С в течение 1 ч прибавляют раствор 3-(2,4,4'-трихлорбензгидрилокси) азетидина (4) (14,6 ммоля) и пиридина(16,1 ммоля) в хлористом метилене (50 мл). Температуру реакционной смеси доводят до комнатной и перемешивают в течение 1 ч. Смесь очищают фильтрованием через силикагель, элюируя хлористым метиленом, получают промежуточный карбамоилхлорид в виде темно-оранжевого масла. Раствор карбамоилхлорида (2,47 ммоля) триэтиламина (2,47 ммоля) и 2-амино-2-метил-1-пропанола (4,94 ммоля) в хлористом метилене перемешивают при комнатной температуре в течение ночи. Реакционную смесь про 1- 14010583 мывают водой, сушат (MgSO4) и очищают хроматографией [SiO2; (1:1 этилацетат:изогексан)], получают продукт в виде бесцветного масла (352 мг, 31%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,13 (6 Н, с), 3,56 (1 Н, дд, J=4,5, 8,5 Гц), 3,80 (1H, дд, J=6,5, 8,5 Гц),4,30 (1 Н, м), 4,89 (1H, т, J=6,0 Гц), 5,48 (1H, с), 5,73 (1H, с), 7,34 (2 Н, м), 7,42 (2 Н, м), 7,51 (1H, м), 7,61MS 457 [М+Н]+ ЖХ (50/80) 99,4%, 6,80 мин Получение 2,4'-дихлорбензгидрола (7) К раствору 2,4'-дихлорбензофенона (239 ммолей) в метаноле (400 мл) порциями при 0 С прибавляют борогидрид натрия (119 ммолей). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 ч, затем прибавляют воду и отгоняют метанол в вакууме. К остатку прибавляют хлористый метилен (400 мл) и промывают водой и рассолом, сушат (MgSO4) и упаривают в вакууме, получают продукт в виде оранжевого масла (47,1 г, 78%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 5,99 (1H, д, J=4,5 Гц), 6,16 (1H, д, J=4,5 Гц), 7,35 (7 Н, м), 7,66 (1 Н,м). Получение 1-бензгидрил-3-(2,4'-дихлорбензгидрилокси)азетидина (8) Раствор 2,4'-дихлорбензгидрола (7) (178 ммолей), п-толуолсульфоновой кислоты (198 ммолей) и 1 бензгидрил-3-азетидинола (1) (99 ммолей) в толуоле (500 мл) кипятят с насадкой Дина-Старка в течение 40 мин,. Раствор охлаждают, промывают гидрокарбонатом натрия (насыщенный водный раствор, 700 мл), сушат (MgSO4) и упаривают в вакууме. Остаток очищают хроматографией на колонке [SiO2; (10% этилацетат: изогексан)], получают продукт в виде жлтого масла (17.8 г, 38%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,78 (1H, т, J= 6,5 Гц), 2,82 (1H, т, J=6,5 Гц), 3,24 (1H, т, J=5,5 Гц),3,28(1 Н, т, J=5,5 Гц), 4,17 (1H, м), 4,39 (1H, с), 5,74 (1H, с), 7,16 (2 Н, м), 7,25 (4 Н, м), 7,32 (3H, м), 7,37(8 Н, м), 7,57 (1H, м). Получение 3-(2,4'-дихлорбензгидрилокси)азетидина гидрохлорида (9) К раствору 1-бензгидрил-3-(2,4'-дихлорбензгидрилокси)азетидина (8) (38 ммолей) в хлористом метилене (400 мл) при перемешивании при 0 С по каплям прибавляют 1-хлорэтилхлорформиат (94 ммоля) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь упаривают в вакууме, затем растворяют в метаноле (400 мл) и перемешивают при комнатной температуре в течение 2 ч. Упаривают в вакууме и прибавляют изогексан (20 мл), диизопропиловый эфир (200 мл) и метанол (30 мл). При перемешивании выпадает осадок. После фильтрования получают нужный продукт в виде тврдого вещества белого цвета (10,1 г, 77%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,86 (2 Н, уш д), 4,02 (2 Н, уш д), 4,43 (1H, квинтет, J=6,0 Гц), 5,86(1 Н, с), 7,37 (3H, м), 7,44 (4 Н, м), 7,61 (1 Н, м), 8,98 (2 Н, уш д). Пример 3. 3-(2,4'-дихлорбензгидрилокси)-N-(этилпропионат-2-ил)азетидин-1-карбоксамид (10) Раствор 3-(2,4'-дихлорбензгидрилокси)азетидина гидрохлорида (9) (0,58 ммоля), этил 2- изоцианопропионата (0,58 ммоля) и МР-карбоната (3,10 ммоля/г, 1,74 ммоля) в хлористом метилене (3 мл) встряхивают при комнатной температуре в течение ночи. Реакционную смесь пропускают через предварительно увлажннный (CH2Cl2) слой SCX-2 (2 г), элюируют хлористым метиленом, получают заданный продукт в виде бесцветной смолы (72 мг, 28%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,16 (3H, т, J=7,0 Гц), 1,22 (3H, д, J=7,5 Гц), 3,60 (1 Н, м), 3,68 (1 Н,м), 3.87(1 Н, м), 3,95 (1 Н, м), 4,05 (3H, м), 4,36 (1 Н, м), 5,78 (1 Н, с), 6,65 (1 Н, д, J=7,5 Гц), 7,36 (3H, м),7,41 (4 Н, м), 7,61 (1 Н, м). ЖХ (80/20) 96,5%, 0,80 мин Пример 4. 3-(2,4'-дихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид (11) Это соединение получают из соответствующего продажного изоцианата по методу, описанному для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,21 (9 Н, с), 3,56 (1 Н, м), 3,63 (1 Н, м), 3,82 (1 Н, м), 3,89(1 Н, м), 4,27(1 Н, м), 5,62 (1 Н, с), 5,76 (1 Н, м), 7,42 (6 Н, м), 7,61 (1 Н, м) ЖХ (80/20) 99,5%, 6,84 мин Пример 5. 3-(2,4'-дихлорбензгидрилокси)-N-(2-тиофен-2-ил этил)азетидин-1-карбоксамид (12) Это соединение получают из соответствующего продажного изоцианата по методу, описанному для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 2,87 (2 Н, т, J=7,0 Гц), 3,18 (2 Н, м), 3,57 (1 Н, м), 3,65 (1 Н, м), 3,83(13) Это соединение получают из соответствующего продажного изоцианата по методу, описанному для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 2,91 (2 Н, м), 3,58 (2 Н, м), 3,87 (1H, м), 4,20 (1H, м), 4,33 (1 Н,м),5,76 (1H, с), 6,72 (1 Н, д, J=8,0 Гц), 7,20 (3H, м), 7,26 (2 Н, м), 7,36 (3H, м), 7,42 (4 Н,м), 7,60 (1 Н,м). ЖХ (80/20) 99,2%, 1,14 мин Пример 7. 3-(2,4'-дихлорбензгидрилокси)-N-[этил-4-(метилтио)бутират-2-ил)азетидин-1-карбоксамид (14) Это соединение получают из соответствующего продажного изоцианата по методу, описанному для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,16 (3H, т, J=7,5 Гц), 1,87 (2 Н, м), 2,03 (3H, с), 2,46 (2 Н, м), 3,62(1 Н, м), 3,70 (1H, м), 3,85-4,00 (2 Н, м), 4,06 (2 Н, м), 4,16 (1 Н, м), 4,37 (1 Н, м), 5,78 (1H, с), 6,64 (1H, м),7,37 (3H, м), 7,47 (4 Н, м), 7,61 (1 Н, м). ЖХ (80/20) 99,3%, 0,99 мин Пример 8. 3-(2,4'-дихлорбензгидрилокси)-N-(циклопропилметил)азетидин-1-карбоксамид (15) 3-(2,4'-Дихлорбензгидрилокси)азетидина гидрохлорид (9) превращают в соответствующее свободное основание стандартными методами. К раствору трифосгена (6,6 ммоля) в хлористом метилене (50 мл) при перемешивании при 0 С в течение 1 ч прибавляют раствор свободного основания (17,4 ммоля) и пиридина (19,2 ммоля) в хлористом метилене (50 мл). Температуру реакционной смеси доводят до комнатной и перемешивают в течение 1 ч. Смесь очищают фильтрованием через силикагель, элюируя хлористым метиленом, получают карбамоилхлорид в виде темно-оранжевого масла (5,32 г, 83%), которое используют сразу же. Раствор карбамоилхлорида (0,54 ммоля), МР-карбоната (3,10 ммоля/г, 1,62 ммоля) и (аминометил)циклопропана (0,81 ммоля) в хлористом метилене встряхивают при комнатной температуре в течение ночи. Реакционную смесь пропускают через предварительно увлажннный (CH2Cl2) слой SCX-2 (2 г), элюируют хлористым метиленом, получают заданный продукт в виде бесцветной смолы (51 мг, 22%).(16) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 484 [М+Н]+ ЖХ (80/20) 89,9%, 1,06 мин Пример 10. 3-(2,4'-дихлорбензгидрилокси)-N-(2,5-диметилфуран-3-илметил)азетидин-1-карбоксамид (17) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 460 [М+Н]+ ЖХ (80/20) 91,6%, 1,17 мин Пример 11. 3-(2,4'-дихлорбензгидрилокси)-N-(2,3-дигидробензо[1,4] диоксин-2-илметил)азетидин 1-карбоксамид (18) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 500 [М+Н]+ ЖХ (80/20) 94,5%, 1,34 мин Пример 12. 3-(2,4'-дихлорбензгидрилокси)-N-(5-метилизоксазол-3 илметил)азетидин-1-карбоксамид(19) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 447 [M+H]+ ЖХ (80/20) 97,0%, 0,75 мин Пример 13. 3-(2,4'-дихлорбензгидрилокси)-N-[(R)-вт-бутил]азетидин-1-карбоксамид (20) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 408 [M+H]+ ЖХ (80/20) 96,7%, 0,96 мин Пример 14. 3-(2,4'-дихлорбензгидрилокси)-N-(2-бромтиофен-3-илметил)азетидин-1-карбоксамид (21) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 527 [М+Н]+ ЖХ (80/20) 90,0%, 1,38 мин Пример 16. 3-(2,4'-дихлорбензгидрилокси)-N-(тиофен-3-илметил)азетидин-1-карбоксамид (21) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).- 16010583 Пример 17. 3-(2,4'-дихлорбензгидрилокси)-N-(2-метоксифенилметил)азетидин-1-карбоксамид (24) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 472 [М+Н]+ ЖХ (80/20) 97,2%, 1,11 мин Пример 18. 3-(2,4'-дихлорбензгидрилокси)-N-(2-фуранилметил) азетидин-1-карбоксамид (25) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 432 [М+Н]+ ЖХ (80/20) 97,0%, 0,88 мин Пример 19. 3-(2,4'-дихлорбензгидрилокси)-N-(3-этоксипропил)азетидин-1-карбоксамид (26) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 438 [М+Н]+ ЖХ (80/20) 99,5%, 0,847 мин Пример 20. 3-(2,4'-дихлорбензгидрилокси)-N-(2-тетрагидрофуранилилметил)азетидин-1-карбоксамид (27) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).(28) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 477 [М+Н]+ ЖХ (80/20) 97,2%, 0,68 мин Пример 22. 3-(2,4'-дихлорбензгидрилокси)-N-(экзо-2-норборнил)азетидин-1-карбоксамид (29) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 446 [М+Н]+ ЖХ (80/20) 97,9%, 1,38 мин Пример 23. 3-(2,4'-дихлорбензгидрилокси)-N-(1-фенилилпропил)азетидин-1-карбоксамид (30) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 470 [М+Н]+ ЖХ (80/20) 89,7%, 1,33 мин Пример 24. 3-(2,4'-дихлорбензгидрилокси)-N-[(R)метилбензил]азетидин-1-карбоксамид (31) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 456 [М+Н]+ ЖХ (80/20) 92,5%, 1,19 мин Пример 25. 3-(2,4'-дихлорбензгидрилокси)-N-[(R)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид(32) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 486 [М+Н]+ ЖХ (80/20) 93,6%, 1,17 мин Пример 26. 3-(2,4'-дихлорбензгидрилокси)-N-(диметиламиноэтил)азетидин-1-карбоксамид (33) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15). MS 423 [М+Н]+ ЖХ (80/20) 96,8%, 0,71 мин Пример 27. 3-(2,4'-дихлорбензгидрилокси)-N-[(S)-1-(3-метоксифенил)этил]азетидин-1-карбоксамид(34) Это соединение получают из соответствующего продажного амина по методу, описанному для соединения (15).MS 486 [М+Н]+ ЖХ (80/20) 96,8%, 1,18 мин Получение 1-бензгидрил-3-(4,4'-дихлорбензгидрилокси)азетидина (35) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (45,0 ммоля) и 4,4'-дихлорбензгидрола(90,0 ммоля) по методике, описанной для соединения (3) (8,6 г, 40%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 2,80 (2 Н, м), 3,25 (2 Н, м), 4,13 (1 Н, т, J=6,0 Гц), 4,39 (1 Н, с), 5,50(1H, с), 7,15 (2 Н, м), 7,25 (4 Н, м), 7,31-7,40 (12 Н, м). ЖХ (50/80) 99,7%, 3,18 мин Получение 3-(4,4'-дихлорбензгидрилокси)азетидина (36) К раствору 1-бензгидрил-3-(4,4'-дихлорбензгидрилокси)азетидина (35) (8.4 ммоля) в хлористом метилене (50 мл) при перемешивании при 0 С по каплям прибавляют 1-хлорэтилхлорформиат (16.9 ммоля) и реакционную смесь перемешивают при кипячении в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры, упаривают в вакууме, затем растворяют в метаноле (50 мл) и перемешивают при комнатной температуре в течение ночи. Упаривают в вакууме и растирают с диэтиловым эфиром(100 мл), получают нужный продукт в виде тврдого вещества белого цвета (2,16 г, 74%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,84 (2 Н, м), 3,99 (2 Н, м), 4,39 (1 Н, квинтет, J= 6,5 Гц), 5,65 (1 Н, с),7,37 (4 Н, м), 7,44 (4 Н, м). ЖХ (50/80) 98,8%, 4,32 мин- 17010583 Пример 28. 3-(4,4'-дихлорбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид (37) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5) (53,0 мг, 45%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,58 (2 Н, м), 3,83 (2 Н, м), 4,24 (1 Н, м), 5,61 (1 Н, с). 7,39 (8 Н, м). ЖХ (50/80) 99,0%, 6,84 мин Пример 29. 3-(4,4'-дихлорбензгидрилокси)-N-(н-гексил)азетидин-1-карбоксамид (38) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 0,847 (3H, т, J=7,0 Гц), 1,20-1,37 (8 Н, уш м), 2,93 (2 Н, кв, J=6,5 Гц),3,56 (2 Н, м), 3,83 (2 Н, м), 4,28 (1 Н, м), 5,55 (1 Н, с), 6,28 (1 Н, т, J=5,5 Гц), 7,39 (8 Н, м). ЖХ (50/80) 97,6%, 8,21 мин. Пример 30. 3-(4,4'-дихлорбензгидрилокси)-N-(1-адамантил)азетидин-1-карбоксамид (39) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 1,58 (6 Н, уш м), 1,86 (6 Н, м), 1,97 (3H, уш с), 3,57 (2 Н,м), 3,83 (2 Н,м), 4,23 (1 Н, м), 5,53 (1 Н, с), 7,33-7,42 (8 Н, м) ЖХ (50/80) 98,0%, 8,95 мин Пример 31. 3-(4,4'-дихлорбензгидрилокси)-N-(циклогексил)азетидин-1-карбоксамид (40) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1 Н (400 МГц, ДМСО-d6) H 0,97-1,26 (5 Н, уш м), 1,49-1,72 (5 Н, уш м), 3,57 (2 Н, м), 3,83 (2 Н,м), 4,27 (1 Н, с), 6,05 (1 Н, м), 6,34-7,45 (8 Н, м) ЖХ (50/80) 97,2%, 7,67 мин Пример 32. 3-(4,4'-дихлорбензгидрилокси)-N-(3-метилбензил)азетидин-1-карбоксамид (41) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1 Н (400 МГц, ДМСО-d6) H 2,26 (2 Н, с), 3,63 (1 Н, м), 3,89 (1 Н, м), 4,12 (1 Н, м), 4,30 (1 Н, м),5,76 (1 Н, с), 7,01 (2 Н, м), 7,17 (1 Н, м), 7,38 (5 Н, м) ЖХ (50/80) 87,8%, 7,73 мин Пример 33. 3-(4,4'-дихлорбензгидрилокси)-N-(4-метилбензил)азетидин-1-карбоксамид (42) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 2,26 (3H, с), 3,63 (2 Н, м), 3,89 (2 Н, м), 4,11 (2 Н, м), 4,30 (1 Н, м),5,76 (1 Н, с), 6,85 (1 Н, м), 7,10 (4 Н, м), 7,39 (8 Н, м) ЖХ (50/80) 94,4%, 7,77 мин Пример 34. 3-(4,4'-дихлорбензгидрилокси)-N-(2,4-дихлорбензил)азетидин-1-карбоксамид (43) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 3,67 (2 Н, м), 3,94 (2 Н, м), 4,19 (2 Н, м), 4,33 (1 Н, м), 5,58 (1 Н, с),6,97 (1 Н, т, J=6,0 Гц), 7,30 (1 Н, м), 7,36-7,45 (9 Н, м), 7,57 (1H, м) ЖХ (50/80) 97,0%, 8,83 мин Пример 35. 3-(4,4'-дихлорбензгидрилокси)-N-(фенетил)азетидин-1-карбоксамид (44) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 2,66 (2 Н, т, J=7,5 Гц), 3,15 (2 Н, м), 3,58 (2 Н, м), 3,84 (2 Н, м), 4,29(1 Н, м), 5,55 (1 Н, с), 6,42 (1 Н, т, J=5,5 Гц), 7,18 (3H, м), 7,27 (2 Н, м), 7,35-7,44 (8 Н, м) ЖХ (50/80) 90,2%, 7,56 мин Пример 36. 3-(4,4'-дихлорбензгидрилокси)-N-(фторбензил)азетидин-1-карбоксамид (45) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,64 (2 Н, м), 3,89 (2 Н, м), 4,14 (2 Н, м), 4,31 (1H, м), 5,56 (1 Н, с),6,91(1 Н, J=6,0 Гц), 7,11 (2 Н, м), 7,25 (2 Н, м), 7,35-7,44 (8 Н, м) ЖХ (50/80) 96,9%, 7,48 мин Пример 37. 3-(4,4'-дихлорбензгидрилокси)-N-[(S)метилбензил] азетидин-1-карбоксамид (46) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 1,30 (3H, д, J=7,5 Гц), 3,63 (2 Н, м), 3,89(2 Н, м), 4,30 (1 Н, м), 4,75- 18010583 Пример 38. 3-(4,4'-дихлорбензгидрилокси)-N-(4-метоксибензил)азетидин-1-карбоксамид (47) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1H (400 МГц, ДМСО-d6) H 3,61 (2 Н, м), 3,71 (3H, с), 3,88 (2 Н, м), 4,08 (2 Н, м), 4,30 (1 Н, м),5,56 (1 Н, с), 6,84 (3H, м), 7,14 (2 Н, м), 7,35-7,44 (8 Н, м) ЖХ (50/80) 94,9%, 7,30 мин Пример 39. 3-(4,4'-дихлорбензгидрилокси)-N-[(R)метилбензил)азетидин-1-карбоксамид (48) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного изоцианата по методу, описанному для соединения (5). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,31 (3H, д, J=7,0 Гц), 3,62 (2 Н, м), 3,89 (2 Н, м), 4,30 (1 Н, м), 4,73(1 Н, м), 5,55 (1 Н, с), 6,66 (1 Н, д, J=8,0 Гц), 7,18 (1 Н, м), 7,28 (4 Н, м), 7,39 (8 Н, м) ЖХ (80/20) 96,8%, 1,25 мин Пример 40. 3-(4,4'-дихлорбензгидрилокси)-N-(циклопропилметил)азетидин-1-карбоксамид (49) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15) (11,0 мг, 10%). ЯМР 1H (400 МГц, ДМСО-d6) H 0,10 (2 Н, м), 0,33 (2 Н, м), 0,85 (1 Н, м), 2,82 (2 Н, д, J=6,0 Гц),3,59(2 Н, м), 3,85(2 Н, м), 4,29 (1 Н, м), 5,55 (1 Н, с), 6,38 (1 Н, т, J=6,0 Гц), 6,39 (7 Н, м) ЖХ (50/80) 99,5%, 6,83 мин Пример 41. 3-(4,4'-дихлорбензгидрилокси)-N-(бензгидрил)азетидин-1-карбоксамид (50) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,67 (2 Н, м), 3,95 (2 Н, м), 4,31 (1 Н, м), 5,56 (1 Н, м), 5,95 (1H, д,J=9,0 Гц), 7,19-7,43 (20 Н, м) ЖХ (50/80) 96,5%, 8,61 мин Пример 42. 3-(4,4'-дихлорбензгидрилокси)-N-(фуранилметил)азетидин-1-карбоксамид (51) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 432 [М + Н]+ ЖХ (50/80) 96,6%, 6,70 мин Пример 43. 3-(4,4'-дихлорбензгидрилокси)-N-(2-экзонорборнил)азетидин-1-карбоксамид (52) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 446 [М + Н]+ ЖХ (50/80) 98,2%, 7,77 мин Пример 44. 3-(4,4'-дихлорбензгидрилокси)-N-(циклогексилметил)азетидин-1-карбоксамид (53) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 448 [М + Н]+ ЖХ (50/80) 96,2%, 8,02 мин Пример 45. 3-(4,4'-дихлорбензгидрилокси)-N-(тиофен-2-илметил)азетидин-1-карбоксамид (54) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 448 [М + Н]+ ЖХ (50/80) 95,9%, 7,12 мин Пример 46. 3-(4,4'-дихлорбензгидрилокси)-N-(6-фтор-4 Н-бензо[1,3]диоксин-8-илметил)азетидин-1 карбоксамид (55) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).(56) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 484 [М + Н]+ ЖХ (50/80) 95,2%, 7,30 мин Пример 48. 3-(4,4'-дихлорбензгидрилокси)-N-(фуранилметил)азетидин-1-карбоксамид (57) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 432 [М + Н]+ ЖХ (50/80) 96,6%, 6,70 мин Пример 49. 3-(4,4'-дихлорбензгидрилокси)-N-(бензо[1,3]диоксол-5-илметил)азетидин-1-карбоксамид (58) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).- 19010583 Пример 50. 3-(4,4'-дихлорбензгидрилокси)-N-(бензо[1,4]диоксол-2-илметил)азетидин-1-карбоксамид (59) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 500 [М + Н]+ ЖХ (50/80) 95,8%, 7,82 мин Пример 51. 3-(4,4'-дихлорбензгидрилокси)-N-(2-тиофен-2-илтиазол-4-илметил)азетидин-1-карбоксамид (60) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).(61) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 498 [М + Н]+ ЖХ (50/80) 98,1%, 8,26 мин Пример 53. 3-(4,4'-дихлорбензгидрилокси)-N-(тиофен-3-илметил)азетидин-1-карбоксамид (62) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 448 [М + Н]+ ЖХ (50/80) 97,9%, 7,22 мин Пример 54. 3-(4,4'-дихлорбензгидрилокси)-N-(5-метилизоксазол-3-илметил)азетидин-1-карбоксамид (63) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).(64) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15).MS 498 [М + H]+ ЖХ (50/80) 95,8%, 8,23 мин Пример 56. 3-(4,4'-дихлорбензгидрилокси)-N-(2-адамантилметил)азетидин-1-карбоксамид (65) Это соединение получают из 3-(4,4'-дихлорбензгидрилокси)азетидина (36) и соответствующего продажного амина по методу, описанному для соединения (15). ЯМР 1H (400 МГц, ДМСО-d6) H 1,43 (2 Н,м), 1,65-1,80 (8 Н, м), 1,94 (2 Н, м), 3,65 (2 Н, м), 3,92 (2 Н,м), 4,27 (1 Н, м), 5,77 (1 Н, J=6,5 Гц), 7,35-7,43 (6 Н, м) ЖХ (50/80) 97,0%, 8,99 мин Получение 2,2'-дихлорбензгидрола (66) Это соединение получают из 2,2'-дихлорбензофенона по методике, описанной для соединения (7)(8,96 г, 89%). ЯМР 1H (400 МГц, ДМСО-d6) H 6,09 (1H, J=5,5 Гц), 6,62 (1H, J=5,0 Гц), 7,27-7,44 (8 Н, м) ЖХ (50/80) 99,0%, 4,08 мин Получение 1-бензгидрил-3-(2,2'-дихлорбензгидрилокси)азетидина (67) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (13.5 ммоля) и 4,4'-дихлорбензгидрола(27,0 ммолей) по методике, описанной для соединения (3). Получение 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) Это соединение получают из соединения (67) (12,7 ммоля) по методике, описанной для соединения(9) (1,58 г, 48%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,84-3,94 (2 Н, уш м), 4,05-4,15 (2 Н, уш м), 4,49 (1H, кв, J=6,0 Гц),6,10 (1H, с), 7,32-7,44 (7 Н, м), 7,50 (2 Н, м), 9,12 (1 Н, уш с) Пример 57. 3-(2,2'-дихлорбензгидрилокси)-N-(1-трет-бутил)азетидин-1-карбоксамид (69) Раствор 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) (0,29 ммоля), третбутилизоцианата (0,29 ммоля) и триэтиламина (0,58 ммоля) в хлористом метилене (3 мл) встряхивают при комнатной температуре в течение ночи, прибавляют воду, фильтруют через насадку (картридж) из политетрафторэтилена (PTFE) для разделения фаз и отгоняют в вакууме, получают бесцветную смолу(52 мг, 44%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,65 (2 Н, м), 3,92 (2 Н, м), 4,31 (1H, м), 5,43 (1H, с),7,38 (6 Н, м), 7,48 (2 Н, м) ЖХ (50/80) 98,8%, 6,53 мин Пример 58. 3-(2,2'-дихлорбензгидрилокси)-N-(изопропил)азетидин-1-карбоксамид (70) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения(69). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (2 Н, д, J=6,5 Гц), 3,65 (3H, м), 3,92 (2 Н, м), 4,34 (1 Н, м), 6,03- 20010583 ЖХ (50/80) 98,9%, 5,76 мин Пример 59. 3-(2,2'-дихлорбензгидрилокси)-N-(вт-бутил)азетидин-1-карбоксамид (71) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения(69). ЯМР 1H (400 МГц, ДМСО-d6) H 3,45 (1 Н, кв, J 7,0 Гц), 3,65 (2 Н, м), 3,93 (2 Н, м), 4,35 (1 Н, м), 5,98(2 Н, д, J=8,0 Гц), 6,06 (1 Н, с), 7,38 (6 Н, м), 7,47 (2 Н, м) ЖХ (50/80) 97,9%, 6,24 мин Пример 60. 3-(2,2'-дихлорбензгидрилокси)-N-(н-пропил)азетидин-1-карбоксамид (72) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1 Н (400 МГц, ДМСО-d6) H 0,79 (2 Н, т, J=7,5 Гц), 1,38 (2 Н, кв, J=7,0 Гц), 2,90 (2 Н, м), 3,65 (2 Н,м), 3,93 (2 Н, м), 4,36 (1 Н, м), 6,06 (1 Н, с), 6,28 (1 Н, м), 7,38 (6 Н, м), 7,47 (2 Н, м) ЖХ (50/80) 99,4%, 5,82 мин Пример 61. 3-(2,2'-дихлорбензгидрилокси)-N-(аллил)азетидин-1-карбоксамид (73) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1H (400 МГц, ДМСО-d6) H 3,58 (2 Н, м), 3,68 (2 Н, м), 3,96 (2 Н, м), 4,37 (1 Н, м), 5,02 (2 Н, м),5,76 (1 Н, м), 6,07 (1 Н, м), 6,49 (1 Н, т, J=5,5 Гц), 7,38 (6 Н, м), 7,49 (2 Н, м) ЖХ (50/80) 95,9%, 5,59 мин Пример 62. 3-(2,2'-дихлорбензгидрилокси)-N-(н-бутил)азетидин-1-карбоксамид (74) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1H (400 МГц, ДМСО-d6) H 0,85 (3H, т, J=7,5 Гц), 1,23 (2 Н, м), 1,31 (2 Н, м), 2,93 (1 Н, кв, J=7,0 Гц), 3,66 (2 Н, м), 3,92 (2 Н, м), 4,35 (1 Н, м), 6,05 (1H, с), 6,24 (1 Н, т, J=5,5 Гц), 7,38 (6 Н, м), 7,47 (2 Н, м) ЖХ (50/80) 98,6%, 6,53 мин Пример 63. 3-(2,2'-дихлорбензгидрилокси)-N-(циклопентил)азетидин-1-карбоксамид (75) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,31 (2 Н, м), 1,44 (2 Н, м), 1,61 (2 Н, м), 1,73 (2 Н, м), 3,65 (2 Н, м),3,80 (1 Н, м), 3,93 (2 Н, м), 4,35 (1H, м), 6,06 (1H, с), 6,11 (1H, м), 7,38 (6 Н, м), 7,48 (2 Н, м) ЖХ (50/80) 99,7%, 6,60 мин Пример 64. 3-(2,2'-дихлорбензгидрилокси)-N-(циклогексил)азетидин-1-карбоксамид (76) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,12(5 Н, м), 1,60 (5 Н, м), 3,64 (2 Н, м), 3,92 (2 Н, м), 4,32 (1 Н, м),6,05 (2 Н, м), 7,37 (6 Н, м), 7,46 (2 Н, м) ЖХ (50/80) 98,7%, 7,06 мин Пример 65. 3-(2,2'-дихлорбензгидрилокси)-N-(фенетил)азетидин-1-карбоксамид (77) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1H (400 МГц, ДМСО-d6) H 2,70 (2 Н, т, J=7,5 Гц), 3,15 (2 Н, м), 3,65 (2 Н, м), 3,93 (2 Н, м), 4,36(1 Н, м), 6,06 (1H, с), 6,40 (1H, т, J=5,5 Гц), 7,17 (3H, м), 7,26 (2 Н, м), 7,38 (6 Н, м), 7,48 (2 Н, м) ЖХ (50/80) 98,7%, 7,00 мин Пример 66. 3-(2,2'-дихлорбензгидрилокси)-N-(1-адамантил)азетидин-1-карбоксамид (78) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного изоцианата по методике получения соединения (69). ЯМР 1H (400 МГц, ДМСО-d6) H 1,58 (7 Н, уш м), 1,85 (7 Н, уш м), 1,97(3H, уш м), 3,63 (2 Н, м), 3,91(2 Н, м), 4,31 (1 Н, м), 5,51 (1H, с), 6,06 (1 Н, с), 7,38 (6 Н, с), 7,47 (2 Н, м) ЖХ (50/80) 97,6%, 8,27 мин Пример 67. 3-(2,2'-дихлорбензгидрилокси)-N-(6-фтор-4 Н-бензо[1,3]диоксин-8-илметил)азетидин-1 карбоксамид (79) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного амина по методике получения соединения (15) (77,7 мг, 80%).MS 518 [M+H]+ ЖХ (50/80) 88,3%, 6,81 мин Пример 68. 3-(2,2'-дихлорбензгидрилокси)-N-[2-(1-пиперидил)бензил]азетидин-1-карбоксамид (80) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного амина по методике получения соединения (15).- 21010583 Пример 69. 3-(2,2'-дихлорбензгидрилокси)-N-(экзо-2-норборнил)азетидин-1-карбоксамид (81) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного амина по методике получения соединения (15).MS 446 [М + Н]+ ЖХ (50/80) 95,5%, 7,30 мин Пример 70. 3-(2,2'-дихлорбензгидрилокси)-N-(циклогексилметил)азетидин-1-карбоксамид (82) Это соединение получают из 3-(2,2'-дихлорбензгидрилокси)азетидина гидрохлорида (68) и соответствующего продажного амина по методике получения соединения (15).(83) Это соединение получают из 3-(2,2'-дихлорбензгидрил)азетидина гидрохлорида (68) и соответствующего продажного амина по методике получения соединения (15).MS 498 [М + Н]+ ЖХ (50/80) 93,2%, 7,74 мин Получение 4,4'-дибромбензгидрола (84) Это соединение получают из 4,4'-дибромбензофенона по методике, описанной для соединения (7)(9,67 г, 96%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 5,68 (1 Н, J=4,0 Гц), 6,06 (1 Н, J=4,0 Гц), 7,31 (4 Н, м), 7,48 (4 Н, м) ЖХ (50/80) 99,7%, 6,29 мин Получение 1-бензгидрил-3-(4,4'-дибромбензгидрилокси)азетидина (85) Это соединение получают из 4,4'-дибромбензгидрола (84) по методике, описанной для соединения(1H, с), 7,16 (2 Н, м), 7,25 (8 Н, м), 7,52 (4 Н, м) ЖХ (50/80) 97,7%, 4,01 мин Получение 3-(2,2'-дибромбензгидрилокси)азетидина гидрохлорида (86) Это соединение получают из 1-бензгидрил-3-(4,4'-дибромбензгидрил)азетидина (85) по методике,описанной для соединения (9) (1,15 г, 30%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,85 (2 Н, уш. с), 4,02 (2 Н, уш. с), 4,38 (1H, кв, J= 5,5 Гц), 5,61 (1H,с), 7,31 (4 Н, м), 7,56 (4 Н, м), 8,71 (2 Н, уш. д) Пример 72. 3-(4,4'-дибромбензгидрилокси)-N-(трет-бутил)азетидин-1-карбоксамид (87) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10) (92,0 мг, 80%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,58 (2 Н, м), 3,85 (2 Н, м), 4,21 (1 Н, м), 5,51 (1 Н, м),5,61 (1 Н, с), 7,30 (4 Н, м), 7,54 (4 Н, м) ЖХ (50/80) 93,6%, 7,41 мин Пример 73. 3-(4,4'-дибромбензгидрилокси)-N-(изопропил)азетидин-1-карбоксамид (88) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 3,56 (2 Н, м), 3,64 (1 Н, м), 3,84 (2 Н, м), 4,27(1 Н, м), 5,51 (1 Н, с), 6,00 (1 Н, м), 7,30 (4 Н, м), 7,55 (4 Н, м) ЖХ (50/80) 97,5%, 7,15 мин Пример 74. 3-(4,4'-дибромбензгидрилокси)-N-(изобутил)азетидин-1-карбоксамид (89) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,78 (3H, т, J=7,5 Гц), 0,97 (3H, д, J=6,5 Гц), 1,33 (2 Н, м), 3,45 (1 Н,м), 3,58 (2 Н, м), 3,84 (2 Н, м), 4,28 (1 Н, м), 5,51 (1 Н, с), 5,96 (1 Н, д, J=8,5 Гц), 7,30 (4 Н, м), 7,54 (4 Н, м) ЖХ (50/80) 98,6%, 7,41 мин Пример 75. 3-(4,4'-дибромбензгидрилокси)-N-(н-пропил)азетидин-1-карбоксамид (90) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,79 (3H, т, J=7,0 Гц), 1,35 (2 Н, м), 2,89 (2 Н, м), 3,58 (2 Н, м), 3,84(2 Н, м), 4,28 (1 Н, м), 5,51 (1 Н, с), 6,25 (1 Н, т, J=6,0 Гц), 7,30 (4 Н, м), 7,54 (4 Н, м) ЖХ (50/80) 97,0%, 7,12 мин Пример 76. 3-(4,4'-дибромбензгидрилокси)-N-(н-бутил)азетидин-1-карбоксамид (91) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,84 (3H, т, J=7,0 Гц), 1,23 (2 Н, м), 1,32 (2 Н, м), 2,93 (2 Н, м), 3,58- 22010583 ЖХ (50/80) 98,0%, 7,42 мин Пример 77. 3-(4,4'-дибромбензгидрилокси)-N-(циклопентил)азетидин-1-карбоксамид (92) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,32 (2 Н, м), 1,44 (2 Н, м), 1,59 (2 Н, м), 1,73 (2 Н, м), 3,60 (2 Н, м),3,83 (3H, м), 4,27 (1 Н, м), 5,50 (1 Н, с), 6,09 (1 Н, м), 7,30 (4 Н, м), 7,55 (4 Н, м) ЖХ (50/80) 97,6%, 7,69 мин Пример 78. 3-(4,4'-дибромбензгидрилокси)-N-(н-пропил)азетидин-1-карбоксамид (93) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,12 (5 Н, м), 1,55 (1 Н, уш м), 1,67 (4 Н, уш м), 3,56 (2 Н, м), 3,84(2 Н, м), 4,28 (1 Н, м), 5,51 (1 Н, с), 6,00 (1 Н, м), 7,30 (4 Н, м), 7,54 (4 Н, м) ЖХ (50/80) 99,8%, 7,93 мин Пример 79. 3-(4,4'-дибромбензгидрилокси)-N-(циклогексил)азетидин-1-карбоксамид (94) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 2,66 (2 Н, м), 3,15 (2 Н, м), 3,58 (2 Н, м), 3,84 (2 Н, м), 4,29 (1 Н, м),5,51 (1 Н, с), 6,37 (1 Н, м), 7,18 (3H, м), 7,29 (6 Н, м), 7,55 (4 Н, м) ЖХ (50/80) 98,9%, 7,91 мин Пример 80. 3-(4,4'-дибромбензгидрилокси)-N-(1-адамантил)азетидин-1-карбоксамид (95) Это соединение получают из 3-(4,4'-дибромбензгидрилокси)азетидина гидрохлорида (86) по методике получения соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 0,95 (1 Н, м), 1,58 (6 Н, м), 1,85 (6 Н, м), 1,97 (3H, м), 3,57 (2 Н, м),3,81 (2 Н, м), 4,23 (1 Н, м), 5,50 (2 Н, м), 7,31 (4 Н, м), 7,55 (4 Н, м) ЖХ (50/80) 98,0%, 9,44 мин Получение 2-(трифторметил)-4-хлорбензгидрол (96) Магниевую стружку (4.21 г, 170 ммолей) перемешивают под азотом в течение 10 мин. Прекращают перемешивание и из капельной воронки прибавляют раствор 2-бромбензотрифторида (36,37 г, 160 ммолей) в сухом ТГФ (160 мл) до тех пор, чтобы магниевая стружка была лишь покрыта. Реакционную смесь нагревают воздушным тепловым пистолетом до тех пор, пока не появится локализованное помутнение. В этот момент начинают перемешивание и затем скорость реакции регулируют, подставляя и убирая баню со льдом, и варьируя скорость прибавления оставшегося раствора 2-бромбензотрифторида. По окончании прибавления смесь оставляют перемешиваться 1 ч, затем используют в качестве 0,9 М раствора. К раствору 4-хлорбензальдегида (2,17 г, 15 ммолей) в сухом ТГФ (10 мл) при перемешивании за 2 мин прибавляют раствор 2-(трифторметил)фенилмагнийбромида (0,9 М; 18 мл, 16 ммолей). Через 16 ч образовавшуюся смесь распределяют между диэтиловым эфиром и 1N HCl. Водный слой экстрагируют диэтиловым эфиром (2 х 30 мл) и объединнные органические вытяжки промывают 1N HCl, рассолом и сушат (MgSO4). После упаривания в вакууме получают нужный продукт в виде масла янтарного цветаMS 269 [М-ОН]ЖХ (50/80) 97,6%, 5,47 мин Получение 1-бензгидрил-3-[2-(трифторметил)-4'-хлорбензгидрилокси] азетидина (97) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (40.1 ммоля) и 2-(трифторметил)-4 хлорбензгидрола (96) (80.2 ммоля) по методике, описанной для соединения (3) (13,5 г, 66%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,74 (1 Н, уш т), 2,86 (1 Н, уш т), 3,20 (1 Н, уш т), 3,29(1 Н, уш т), 4,15(1 Н, кв, J=6.0 Гц), 4,39 (1 Н, с), 5,71 (1 Н, с), 7,16 (2 Н, м), 7,26 (6 Н, м), 7,38 (6 Н, м), 7,54 (1 Н, м), 7,70 (3H,м) Получение 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида (98) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина(97) (25.6 ммоля) по методике, описанной для соединения (9) (8.2 г, 85%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,78 (1 Н, м), 3,97 (3H, м), 4,89 (1 Н, кв, J=6,0 Гц), 5,85 (1 Н, с), 7,33(99) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) (1.32 ммоля) и трет-бутилизоцианата (1.32 ммоля) по методике, описанной для соединения (10) (474 мг, 81%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,51 (1 Н, м), 3,65 (1H, м), 3,84 (2 Н, м), 4,25 (1 Н,м), 5,62- 23010583 Пример 82. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(н-пропил)азетидин-1-карбоксамид (100) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,79 (3H, т, J=7,5 Гц), 1,33 (2 Н, м), 3,52 (1 Н, м), 3,65 (1 Н, м), 3,85(101) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 3,54 (1 Н, м), 3,64 (2 Н, м), 3,84 (2 Н, м), 4,28(1 Н, м), 5,74 (1 Н, с), 6,02 (1 Н, с), 7,30 (2 Н, м), 7,41 (2 Н, м), 7,58 (1H, м), 7,79 (3H, м) ЖХ (50/80) 98,2%, 6,22 мин Пример 84. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(н-бутил)азетидин-1-карбоксамид (102) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,84 (3H, т, J=7,5 Гц), 1,23 (2 Н, м), 1,32 (2 Н, м), 3,35 (1 Н, м), 3,65(3H, м) ЖХ (50/80) 98,0%, 7,02 мин Пример 85. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(вт-бутил)азетидин-1-карбоксамид (103) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,78 (3H, м), 0,97 (3H, д, J=6,0 Гц), 1,33 (2 Н, м), 3,53 (1 Н, м), 3,65(104) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,14 (3H, т, J=7,0 Гц), 2,38 (2 Н, т, J=7,0 Гц), 3,54 (1 Н, м), 3,66 (1 Н,м), 3,85 (2 Н, м), 4,04 (2 Н, кв, J=7,0 Гц), 4,30 (1 Н, м), 5,74 (1 Н, с), 6,37 (1 Н, уш с), 7,31 (2 Н, м), 4,24 (2 Н,м), 5,57 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 95,0%, 6,40 мин Пример 87. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(метил-3-фенилпропионат-2-ил)азетидин-1 карбоксамид (105) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси] азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 2,88 (1 Н, м), 2,97 (1 Н, м), 3,50 (1 Н, м), 3,62 (1 Н, м), 3,84 (2 Н, м),4,26 (2 Н, м), 5,73 (1 Н, с), 6,75 (1 Н, м), 7,23 (7 Н, м), 7,44 (2 Н, м), 7,56 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 96,0%, 7,40 мин Пример 88. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(этил)азетидин-1-карбоксамид (106) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике, описанной для соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 0,951 (3H, т, J=7,0 Гц), 2,96 (2 Н, м), 3,53 (1 Н, м), 3,64 (1 Н, м), 3,86(107) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,58 (1 Н, м), 3,70 (1 Н, м), 3,89 (2 Н, м), 4,32 (1 Н, м), 4,73 (1 Н, м),6,67 (1 Н, м), 7,31 (6 Н, м), 7,42 (2 Н, м), 7,55 (1 Н, м), 7,79 (3H, м) ЖХ (80/20) 96,0%, 1,09 мин Пример 90. 3-[2-(трифторметил)-4'-хлорбензгидрилокси]-N-(2,2,4-триметилпент-4-ил)азетидин-1 карбоксамид (108) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 0,92 (9 Н, с), 1,24(6 Н, с), 1,64 (2 Н, с), 3,52 (1 Н, м), 3,65 (1 Н, м), 3,83(109) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси]азетидина гидрохлорида(98) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,31(2 Н, м), 1,44 (2 Н, м), 1,58 (2 Н, м), 1,73 (2 Н, м), 3,54 (1H, м),3,67 (1 Н, м), 3,83 (3H, м), 4,28 (1 Н, м), 5,73 (1 Н, с), 6,07 (1 Н, м), 7,30 (2 Н, м), 7,42 (2 Н, м), 7,57 (1 Н, м),7,74 (3H, м) ЖХ (80/20) 99,5%, 1,03 мин Пример 92. 3-(2,4'-дихлорбензгидрилокси)-N-(2,2,4-триметилпент-4-ил)азетидин-1-карбоксамид(110) Это соединение получают из 3-(2,4'-дихлорбензгидрилокси)азетидина гидрохлорида (9) и соответствующего изоцианата по методике получения соединения (10).MS 464 [M+H]+ ЖХ (80/20) 97,9%, 1,80 мин Пример 93. 3-(2,4'-дихлорбензгидрилокси)-N-(метилбут-2-ил)азетидин-1-карбоксамид (111) Это соединение получают из 3-(2,4'-дихлорбензгидрилокси)азетидина гидрохлорида (9) и соответствующего изоцианата по методике получения соединения (10).MS 422 [М+Н]+ ЖХ (50/80) 99,6%, 1,15 мин Получение 2-(трифторметил)-2'-фтор-4'-бромбензгидрола (112) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (60 ммолей) и 4-бром-2 фторбензальдегида (54 ммоля) по методике получения соединения (96) (12,3 г, 74%). ЯМР 1H (400 МГц, ДМСО-d6) H 5,99 (1 Н, уш д), 6,33 (1 Н, д, J=4,5 Гц), 7,27 (2 Н, м), 7,38 (2 Н, м),7,57 (2 Н, м), 7,71 (1 Н, м) Получение 1-бензгидрил-3-[2-(трифторметил)-2'-фтор-4'-бром-бензгидрилокси]азетидина (113) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (23.0 ммоля) и 2-(трифторметил)-2'фтор-4'-бромбензгидрола (112) (34.0 ммоля) по методике получения соединения (3) (8.84 г, 67%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 2,76 (1 Н, т, J=6,5 Гц), 2,87 (1 Н, т, J=6,5 Гц), 3,23 (1 Н, уш т), 3,29(1 Н, м) Получение 3-[2-(трифторметил)-2'-фтор-4'-бром-бензгидрилокси] азетидина гидрохлорида (114) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-2'-фтор-4'-бром-бензгидрилокси]азетидина(113) (15 ммолей) по методике получения соединения (9) (2,26 г, 51%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,78 (1 Н, уш с), 3,96 (3H, уш д), 4,42 (1 Н, м), 5,83 (1 Н, с), 7,33 (2 Н,м), 7,41 (2 Н, м), 7,70 (3H, м) ЖХ (50/80) 99,7%, 4,67 мин Пример 94. 3-[2-(трифторметил)-2'-фтор-4'-бром-бензгидрилокси]-N-(трет-бутил)азетидин-1 карбоксамид (115) Это соединение получают из 3-[2-(трифторметил)-2'-фтор-4'-бром-бензгидрилокси]азетидина гидрохлорида (114) и трет-бутилизоцианата (4,54 ммоля) по методике получения соединения (5) (1,33 г,58%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,58 (1 Н, м), 3,64 (1 Н, м), 3,88 (2 Н, м), 4,26 (1 Н, м),5,98 (1 Н, с), 7,18 (1 Н, м), 7,44 (1 Н, м), 7,61 (2 Н, м), 7,78 (3H, м) ЖХ (50/80) 99,0%, 7,15 мин Найдено: С, 52,29; Н, 4,61; N, 5,63, C22H23BrF4N2O2 Вычислено: С, 52,50; Н, 4,61; N, 5,56% Получение 2-(трифторметил)-4'-(метилтио)бензгидрола (116) Это соединение получают из 2-(трифторметил)фенилмагнибромида (32 ммоля) и 4(метилтио)бензальдегида (30 ммолей) по методике получения соединения (96) (9,4 г, 100%). ЯМР 1H (400 МГц, ДМСО-d6) H 6,26 (1 Н, с), 7,21 (2 Н, м), 7,28 (2 Н, м), 7,39 (1 Н, м), 7,55 (1 Н, м),7,64 (2 Н, м) Получение 1-бензгидрил-3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина (117) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (15 ммолей) и 2-(трифторметил)-4'(метилтио)бензгидрола (116) (30 ммолей) по методике получения соединения (3) (4,68 г, 60%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,42 (3H, с), 2,75 (1 Н, м), 2,85 (1 Н, м), 3,21 (1 Н, м), 3,29 (1 Н, м),4,14 (1 Н, м), 4,38 (1 Н, с), 5,66 (1 Н, с), 7.21 (10 Н, м), 7,37 (4 Н, м), 7,51 (1 Н, м), 7,70 (3H, м)- 25010583 Получение 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина гидрохлорида (118) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина(117) (8,7 ммоля) по методике получения соединения (9) (9,29 г, 68%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 3,89 (4 Н, уш м), 4,41 (1 Н, м), 5,80 (1 Н, с), 7,24 (4 Н, с), 7,57 (1 Н, м),7,75 (3H, м), 9,30 (2 Н, уш с) ЖХ (50/80) 94,5%, 3,55 мин Пример 95. 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид(119) Это соединение получают из 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина гидрохлорида (118) (1,28 ммолей), трет-бутилизоцианата (1,28 ммоля) и трет-карбоната (2,62 ммоля/г, 3,85 ммоля) по методике получения соединения (10) (433 мг, 75%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 2,44 (3H, с), 3,53 (1 Н, м), 3,64 (1 Н, м), 3,83 (2 Н, м),4,22 (1 Н, м), 5,68 (1 Н, с), 7,22 (4 Н, м), 7,54 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 98,0%, 7,00 мин Пример 96. 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид(120) Это соединение получают из 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина гидрохлорида (118) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 2,44 (3H, с), 3,54 (1 Н, м), 3,64 (2 Н, м), 3,84(2 Н, м), 4,27 (1 Н, м), 5,69 (1 Н, с), 6,02 (1 Н, м), 7,22 (4 Н, м), 7,55 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 99,0%, 6,36 мин Пример 97. 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(вт-бутил)азетидин-1-карбоксамид (121) Это соединение получают из 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина гидрохлорида (118) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,78 (3H, т, J=7,0 Гц), 0,97 (3H, д, J=7,5 Гц), 1,32 (2 Н, м), 2,45 (3H,с), 3,45 (1 Н, м), 3,54 (1 Н, м), 3,65 (1 Н, м), 3,85 (2 Н, м), 4,27(1 Н, м), 5,70 (1 Н, м), 5,96 (1 Н, с), 7,22 (4 Н, м),7,55 (1H, м), 7,74 (3H, м) ЖХ (50/80) 98,0%, 6,84 мин Пример 98. 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид(122) Это соединение получают из 3-[2-(трифторметил)-4'-(метилтио)бензгидрилокси]азетидина гидрохлорида (118) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 2,44 (3H, с), 3,60 (1 Н, м), 3,69 (1 Н, м), 3,90 (2 Н, м), 4,15 (2 Н, м),4,31 (1 Н, м), 5,70 (1 Н, с), 6,87 (1 Н, м), 7,24 (8 Н, м), 7,55 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 96,1%, 7,17 мин Получение 2-(трифторметил)-4-фтор-4'-хлорбензгидрола (123) Это соединение получают из 4-хлорфенилмагнийбромида (28,6 ммоля) и 4-фтор-2(трифторметил)бензальдегида (26,0 ммолей) по методике получения соединения (2) (6,04 г, 76%). ЯМР 1H (400 МГц, ДМСО-d6) H 6,00 (1 Н, уш д), 6,33 (1H, д, J=4,5 Гц), 7,26 (2 Н, м), 7,38 (2 Н, м),7,57 (2 Н, м), 7,12 (1H, м) Получение 1-бензгидрил-3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина (124) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (9,8 ммоля) и 2-(трифторметил)-4 фтор-4'-хлорбензгидрола (123) (19,7 ммоля) по методике получения соединения (3) (2,31 г, 45%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,76 (1 Н, т, J=6,5 Гц), 2,86 (1 Н, т, J=6,5 Гц), 3,23 (1H, т, J=6,5 Гц),3,30 (1H, т, J=6,5 Гц), 4,16 (1 Н, м), 4,40 (1H, с), 5,70 (1H, с), 7,17 (2 Н, м), 7,26 (6 Н, м), 7,37 (6 Н, м), 7,60(2 Н, м), 7,75(1 Н, м) Получение 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина (124) (3,8 ммоля) по методике получения соединения (9) (1,45 г, 97%) ЯМР 1H (400 МГц, ДМСО-d6) H 3,31 (1H, уш с), 3,78 (1H, уш с), 3,96 (3H, уш д), 4,40 (1H, м), 5,83(126) Это соединение получают из 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) (0.25 ммоля), трет-бутилизоцианата (0,25 ммоля) и МР-карбоната (2,62 ммоля/г, 0,76 ммоля) по методике получения соединения (10) (72,4 мг, 63%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,21 (9 Н, с), 3,52 (1H, м), 3,64 (1H, м), 3,84 (2 Н, м), 4,25 (1H, м),5,71 (1H, с), 7,30 (2 Н, м), 7,42 (2 Н, м), 7,62 (2 Н, м), 7,77(1 Н, м) ЖХ (50/80) 95,0%, 7,35 мин- 26010583 Пример 100. 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(изопропил)азетидин-1 карбоксамид (127) Это соединение получают из 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 3,51 (1 Н, м), 3,65 (2 Н, м), 3,83 (2 Н, м), 4,28(1 Н, м), 5,72 (1 Н, с), 6,02 (1 Н, м), 7,32 (2 Н, м), 7,40 (2 Н, м), 7,64 (2 Н, м), 7,79 (1 Н, м) ЖХ (50/80) 99.0%, 6,84 мин Пример 101. 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(вт-бутил)азетидин-1 карбоксамид (128) Это соединение получают из 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,78 (3H, т, J=7,5 Гц), 0,97 (3H, д, J=6,5 Гц), 1,33 (2 Н, м), 3,45 (1 Н,м), 3,53 (1 Н, м), 3,65 (1 Н, м), 3,85 (2 Н, м), 4,30 (1 Н, м), 5,73 (1H, с), 5,96 (1H, м), 7,30 (2 Н, м), 7,43 (2 Н, м),7,62 (2 Н, м), 7,78 (1H, м) ЖХ (50/80) 99,0%, 7,29 мин Пример 102. 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(циклогексил)азетидин-1 карбоксамид (128) Это соединение получают из 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,12(5 Н, м), 1,53 (1H, м), 1,66 (4 Н, м), 3,52 (1H, м), 3,64 (1 Н, м),3,83 (2 Н, м), 4,28 (1H, м), 5,71 (1H, с), 6,01 (1H, м), 7,31 (2 Н, м), 7,41 (2 Н, м), 7,62 (2 Н, м), 7,70 (1 Н, м) ЖХ (50/80) 99,9%, 7,77 мин Пример 103. 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]-N-(бензил)азетидин-1 карбоксамид (130) Это соединение получают из 3-[2-(трифторметил)-4-фтор-4'-хлорбензгидрилокси]азетидина гидрохлорида (125) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 3,58 (1 Н, м), 3,70 (1H, м), 3,91 (2 Н, м), 4,16 (2 Н, м), 4,32 (1 Н,м),5,74 (1H, с), 6,87 (1 Н,м), 6,12 (3H, м), 7,30 (4 Н, м), 7,43 (2 Н, м), 7,62 (2 Н, м), 7,85 (1 Н, м) ЖХ (50/80) 94,0%, 7,49 мин Получение 2-(трифторметил)бензгидрола (131) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (16 ммолей) и бензальдегида(15 ммолей) по методике получения соединения (96) (3,7 г, 98%). ЯМР 1 Н (400 МГц, CDCl3) H 6,31 (1 Н, с), 7,26 (1 Н,м), 7,36 (5 Н, м), 7,53 (1 Н, м), 7,65 (2 Н, м) Получение 1-бензгидрил-3-[2-(трифторметил)бензгидрилокси]азетидина (132) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (7,5 ммоля) и 2(трифторметил)бензгидрола (131) (15 ммолей) по методике получения соединения (3) (1,81 г, 51%). ЯМР 1H (400 МГц, ДМСО-d6) H 2,75 (1 Н, уш т), 2,85 (1 Н, уш т), 3,21 (1 Н, уш т), 3,27 (1 Н, уш т),4,15 (1 Н, м), 4,38 (1 Н, с), 5,71 (1 Н, с), 7,12-7,40 (12 Н, м), 7,49-7,72 (7 Н, м). Получение 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида(133) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил) бензгидрилокси]азетидина (132)(3,8 ммоля) по методике получения соединения (9) (0,70 г, 60%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,89 (4 Н, уш м), 4,41 (1 Н, м), 5,80 (1 Н, с), 7,29 (3H, м), 7,35 (2 Н, м),7,55 (1 Н, м), 7,74 (3H, м), 9,30 (2 Н, уш с) ЖХ (50/80) 96,6%, 1,60 мин Пример 104. 3-[2-(трифторметил)бензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид (134) Это соединение получают из 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида (133)(0,33 ммоля), трет-бутилизоцианата (0,33 ммоля) и МР-карбоната (2,62 ммоля/г, 0,98 ммоля) по методике получения соединения (10) (99,5 мг, 75%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,54 (1 Н, м), 3,66 (1 Н, м), 3,84 (2 Н, м), 4,23 (1 Н, м),5,63 (1 Н, с), 7,29 (3H, м), 7,35 (2 Н, м), 7,55 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 93,0%, 6,24 мин Пример 105. 3-[2-(трифторметил)бензгидрилокси]-N-(изопропил)азетидин-1-карбоксамид (135) Это соединение получают из 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида (133) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 3,55 (1 Н, м), 3,65 (2 Н, м), 3,84 (2 Н, м), 4,28(1 Н, м), 5,74 (1 Н, с), 7,32 (5 Н, м), 7,55 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 91,0%, 5,51 мин Пример 106. 3-[2-(трифторметил)бензгидрилокси]-N-(вт-бутил)азетидин-1-карбоксамид (136) Это соединение получают из 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида (133) и соответствующего изоцианата по методике получения соединения (10).(1 Н, м), 3,65 (1 Н, м), 3,85 (2 Н, м), 4,28 (1 Н, м), 5,74 (1 Н, с), 7,32 (5 Н, м), 7,55 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 94,0%, 6,04 мин Пример 107. 3-[2-(трифторметил)бензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид (137) Это соединение получают из 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида (133) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1 Н (400 МГц, ДМСО-d6) H 1,12(5 Н, м), 1,55 (1 Н, м), 1,67 (4 Н, м), 3,54 (1 Н, м), 3,65 (1 Н, м),3,85 (2 Н, м), 4,22 (1H, м), 5,74 (1 Н, с), 7,32 (5 Н, м), 7,55 (1 Н, м), 7,74 (3H, м) ЖХ (50/80) 96,0%, 6,79 мин Пример 108. 3-[2-(трифторметил)бензгидрилокси]-N-(бензил)азетидин-1-карбоксамид (138) Это соединение получают из 3-[2-(трифторметил)бензгидрилокси]азетидина гидрохлорида (133) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 3,59 (1H, м), 3,71 (1 Н, м), 3,91 (2 Н, м), 4,15 (2 Н, м), 4,31(1 Н.м), 5,75(1 Н, с), 6,87 (1 Н, м), 7,21 (3H, м), 7,32 (6 Н, м), 7,55 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 95,5%, 6,45 мин Получение 2-(трифторметил)-4'-(трифторметокси)бензальдегида (139) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (16 ммолей) и 4(трифторметокси)бензальдегида (15 ммолей) по методике получения соединения (96) (5,24 г, 100%). ЯМР 1 Н (400 МГц, CDCl3) H 6,31 (1 Н, с), 7,17 (2 Н, м), 7,39 (3H, м), 7,57 (2 Н, м), 7,68 (1 Н, м) Получение 1-бензгидрил-3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]азетидина (140) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (7.5 ммоля) и 2-(трифторметил)-4(трифторметокси)бензальдегида (139) (15 ммолей) по методике получения соединения (3) (2,65 г, 63%). ЯМР 1 Н (400 МГц, ДМСО-d6) H 2,75 (1 Н, м), 2,85 (1 Н, м), 3,21 (1 Н, м), 3,30 (1 Н, м), 4,15 (1 Н, м),4,39 (1 Н, с), 5,76 (1 Н, с), 7,16 (2 Н, м), 7,25 (3H, м), 7,37 (8 Н, м), 7,52 (1 Н, м), 7,72 (3H, м) Получение 1-бензгидрил-3-[2-(трифторметил)-4'-(трифторметокси) бензгидрилокси]азетидина гидрохлорида (141) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]азетидина (140) (4.8 ммоля) по методике получения соединения (9) (1,32 г, 65%). ЯМР 1H (400 МГц, ДМСО-d6) H 3,89 (4 Н, уш м), 4,41 (1 Н, м), 5,80 (1 Н, с), 7,24 (4 Н, с), 7,57 (1 Н, м),7,75 (3H, м), 9,30 (2 Н, уш с) ЖХ (50/80) 93.5%, 4.63 мин Пример 109. 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(трет-бутил)азетидин-1 карбоксамид (142) Это соединение получают из 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]азетидина гидрохлорида (141) (0,234 ммоля), трет-бутилизоцианата (0,234 ммоля) и МР-карбоната (2,62 ммоля/г,0,702 ммоля) по методике получения соединения (10) (78,7 мг, 69%). ЯМР 1H (400 МГц, ДМСО-d6) H 1,20 (9 Н, с), 3,53 (1 Н, м), 3,69 (1 Н, м), 3,85 (2 Н, м), 4,25 (1 Н, м),5,68 (1 Н, с), 7,35 (2 Н, м), 7,42 (2 Н, м), 7,58 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 98,0%, 7,31 мин Пример 110. 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1 карбоксамид (143) Это соединение получают из 3-[2-(трифторметил)-4'-(трифторметокси) бензгидрилокси]азетидина гидрохлорида (141) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 1,00 (6 Н, д, J=6,5 Гц), 3,53 (1 Н, м), 3,67 (2 Н, м), 3,86 (2 Н, м), 4,28(1 Н, м), 5,78 (1 Н, с), 7,35 (2 Н, м), 7,42 (2 Н, м), 7,58 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 95,0%, 6,85 мин Пример 111. 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(вт-бутил)азетидин-1 карбоксамид (144) Это соединение получают из 3-[2-(трифторметил)-4'-(трифторметокси) бензгидрилокси]азетидина гидрохлорида (141) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 0,79 (3H, м), 0,97 (3H, м), 1,34 (2 Н, м), 3,45 (1 Н, м), 3,55 (1 Н, м),3,70 (1 Н, м), 3,86 (2 Н, м), 4,30 (1 Н, м), 5,79 (1 Н, с), 7,35 (2 Н, м), 7,42 (2 Н, м), 7,58 (1 Н, м), 7,75 (3H, м) ЖХ (50/80) 99,0%, 7,18 мин Пример 112. 3-[2-(трифторметил)-4'-(трифторметокси)бензгидрилокси]-N-(изопропил)азетидин-1 карбоксамид (145) Это соединение получают из 3-[2-(трифторметил)-4'-(трифторметокси) бензгидрилокси]азетидина гидрохлорида (141) и соответствующего изоцианата по методике получения соединения (10). ЯМР 1H (400 МГц, ДМСО-d6) H 3,61 (1 Н, м), 3,75 (1 Н, м), 3,92 (2 Н, м), 4,16 (2 Н, м), 4,30 (1 Н, м),5,80 (1 Н, с), 6,87 (1 Н, м), 7,21 (3H, м), 7,28 (2 Н, м), 7,35 (2 Н, м), 7,43 (2 Н, м), 7,57 (1 Н, м), 7,76 (3H, м) ЖХ (50/80) 99,0%, 7,76 мин(146) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси] азетидина гидрохлорида(98) (0,55 ммоля) и 1-адамантилизоцианата (0,55 ммоля) по методике получения соединения (10) (229 мг,83%).(147) Это соединение получают из 3-[2-(трифторметил)-4'-хлорбензгидрилокси] азетидина гидрохлорида(98) (0.55 ммоля) и циклогексилизоцианата (0,55 ммоля) по методике получения соединения (10) (146 мг,59%).(148) Соединение (98) превращают в соответствующее свободное основание, распределяя между хлористым метиленом и 0,5 N раствором гидроксида натрия. К раствору трифосгена (187 мг, 0,63 ммоля) в сухом хлористом метилене (5 мл) при 0 С порциями,в течение 40 мин прибавляют свободное основание соединения (31) (1,66 ммоля) в сухом хлористом метилене (10 мл). Через 20 мин аликвоту реакционной смеси 5 мл быстро прибавляют к триэтиламину (230 мкл) и трет-амиламину (66 мкл) и полученную смесь встряхивают при комнатной температуре в течение 72 ч,. Реакционную смесь промывают 0,2 N соляной кислотой и органические вещества наносят на слойSCX-2 (2 г), затем элюируют EtOAc, а затем МеОН. Объединнные растворы в органических растворителях упаривают в вакууме, затем очищают флеш-хроматографией на колонке [SiO2; этилацетат: изогексан(30:7050:50)], получают нужный продукт в виде оранжевого масла (30 мг, 12%)MS 455 [М + Н]+ ЖХ (50/80) 92,3%, 7,22 мин Получение 2-(трифторметил)-4'-метилбензгидрола (149) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (16 ммолей) и птолу(ол)альдегида (1,82 мл, 15 ммолей) по методике получения соединения (96) (4,28 г, 100%). ЖХ (50/80) 97,1%, 4,76 мин Получение 1-бензгидрил-3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина (150) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (7,5 ммоля) и 2-(трифторметил)-4 метилбензгидрола (149) (15 ммолей) по методике получения соединения (3). Флеш-хроматографией на колонке [SiO2; этилацетат: изогексан (5:95)], получают жлтую смолу (4.41 г), которую используют на следующей стадии без дополнительной очистки. Получение 3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина гидрохлорида (151) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина(150) (7,5 ммоля) по методике получения соединения (9). Кристаллизацией из смеси DIPE-МеОН получают продукт в виде тврдого вещества белого цвета (1,39 г, 54%). Пример 116. 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид (152) Это соединение получают из 3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина гидрохлорида(151) (0,56 ммоля) и 1-адамантилизоцианата (0,56 ммоля) по методике получения соединения (10). Нужный продукт получают в виде белой пены (229 мг, 83%). ЯМР ЖХ (50/80) 98,1%, 8,20 мин Пример 117. 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(трет-бутил)азетидин-1-карбоксамид(153) Это соединение получают из 3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина гидрохлорида(151) (0,56 ммоля) и трет-бутилизоцианата (0,56 ммоля) по методике получения соединения (10). Нужный продукт получают в виде бесцветной стекловидной массы, которая при растирании превращается в тврдое вещество белого цвета (232 мг, 98%).MS 420 [М + Н]+ ЖХ (50/80) 98,1%, 6,54 мин Пример 118. 3-[2-(трифторметил)-4'-метилбензгидрилокси]-N-(циклогексил)азетидин-1-карбоксамид (154) Это соединение получают из 3-[2-(трифторметил)-4'-метилбензгидрилокси]азетидина гидрохлорида(151) (0,56 ммоля) и циклогексилизоцианата (0,56 ммоля) по методике получения соединения (10). Нужный продукт получают в виде белой пены (230 мг, 91%).- 29010583 Получение 2-(трифторметил)-4'-метоксибензгидрола (155) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (16 ммолей) и п-анизальдегида(1.86 мл, 15 ммолей) по методике получения соединения (96) (4,34 г, 100%). ЖХ (50/80) 97,2%, 3,62 мин Получение 1-бензгидрил-3-[2-(трифторметил)-4'-метоксибензгидрилокси]азетидина (156) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (7,5 ммоля) и 2-(трифторметил)-4 метоксибензгидрола (155) (15 ммолей) по методике получения соединения (3). Флеш-хроматографией на колонке [SiO2; этилацетат: изогексан (10:9020:80)] получают бледно-жлтую смолу (2.73 г), которую используют на следующей стадии без дополнительной очистки. Получение 3-[2-(трифторметил)-4'-метоксибензгидрилокси]азетидина (157) Соответствующий гидрохлорид получают из 1-бензгидрил-3-[2-(трифторметил)-4'метоксибензгидрилокси]азетидина (156) (7,5 ммоля) по методике получения соединения (9). Из-за присутствия примесей соль распределяют между водным раствором основания и органическим растворителем, органическую фазу сушат (MgSO4) и упаривают, получают заданный продукт в виде бесцветного масла. (730 мг, 29%). Пример 119. 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(1-адамантил)азетидин-1 карбоксамид (158) К раствору 3-[2-(трифторметил)-4'-метоксибензгидрилокси]азетидина (157) (100 мг, 0,30 ммоля) в сухом хлористом метилене (DCM) (4 мл) прибавляют МР-карбонат (3,01 ммоля/г, 100 мг, 0,30 ммоля) и 1-адамантилизоцианат (55 мг, 0,30 ммоля). Полученную смесь встряхивают при комнатной температуре в течение 5 ч, после чего е выливают на смоченный DCM слой SCX-2 (1 г). Элюцией DCM (6 мл), а затем DCM-МеОН (6 мл) с последующей отгонкой растворителя в вакууме получают заданный продукт в виде белой пены (140 мг, 92%).MS 515 [M+H]+ ЖХ (50/80) 97,9%, 7,86 мин Пример 120. 3-[2-(трифторметил)-4'-метоксибензгидрилокси]-N-(1-трет-бутил)азетидин-1 карбоксамид (159) К раствору 3-[2-(трифторметил)-4'-метоксибензгидрилокси]азетидина (157) (100 мг, 0,30 ммоля) в сухом хлористом метилене (DCM) (4 мл) прибавляют МР-карбонат (3,01 ммоля/г, 100 мг, 0,30 ммоля) и трет-бутилизоцианат (35 мкл, 0,30 ммоля). Полученную смесь встряхивают при комнатной температуре в течение 5 ч, после чего выливают на смоченный DCM слой SCX-2 (1 г). Элюируют DCM (6 мл), затемDCM-МеОН (6 мл) и упаривают. Очисткой флеш-хроматографией на колонке [SiO2; этилацетат: изогексан (35:6550:50)] получают заданный продукт в виде бесцветного стекла (90 мг, 70%).MS 437 [М + Н]+ ЖХ (50/80) 97,9%, 6,12 мин Получение 2-(трифторметил)-4'-фторбензгидрола (160) Это соединение получают из 2-(трифторметил)фенилмагнийбромида (16 ммолей) и фторальдегида(1,64 мл, 15 ммолей) по методике получения соединения (96) (4,27 г, 100%). ЖХ (50/80) 99,3%, 4,37 мин Получение 1-бензгидрил-3-[2-(трифторметил)-4'-фторбензгидрилокси]азетидина (161) Это соединение получают из 1-бензгидрил-3-азетидинола (1) (7.5 ммоля) и 2-(трифторметил)-4 фторбензгидрола (160) (15 ммолей) по методике получения соединения (3). После обработки основанием сырой продукт используют на следующей стадии без дополнительной очистки. Получение 3-[2-(трифторметил)-4'-фторбензгидрилокси]азетидина гидрохлорида (162) Это соединение получают из 1-бензгидрил-3-[2-(трифторметил)-4'-фторбензгидрилокси]азетидина(161) (7,5 ммоля) по методике получения соединения (9). Кристаллизацией из смеси DIPE-МеОН получают продукт в виде тврдого вещества белого цвета (1,49 г, 55%). Пример 121. 3-[2-(трифторметил)-4'-фторбензгидрилокси]-N-(1-адамантил)азетидин-1-карбоксамид(163) К раствору 3-[2-(трифторметил)-4'-фторбензгидрилокси]азетидина гидрохлорида (162) (200 мг, 0,55 ммоля) в сухом хлористом метилене (DCM) (5 мл) прибавляют МР-карбонат (3,01 ммоля/г, 550 мг, 1,65 ммоля) и 1-адамантилизоцианат (101 мг, 0,55 ммоля). Полученную смесь встряхивают при комнатной температуре в течение 16 ч, после чего е выливают на смоченный DCM слой SCX-2 (1 г). ЭлюируютDCM (16 мл), а затем упаривают, получают заданный продукт в виде белой пены (257 мг, 92%).(164) К раствору 3-[2-(трифторметил)-4'-фторбензгидрилокси]азетидина гидрохлорида (162) (200 мг, 0,55 ммоля) в сухом хлористом метилене (DCM) (5 мл) прибавляют МР-карбонат (3.01 ммоля/г, 550 мг, 1,65 ммоля) и трет-бутилизоцианат (65 мкл, 0,55 ммоля). Полученную смесь встряхивают при комнатной
МПК / Метки
МПК: C07D 409/12, A61K 31/397, C07D 205/04, C07D 413/12, A61P 3/04
Метки: производные, нарушений, св1, опосредованных, применение, рецепторами, лечении, азетидинкарбоксамида
Код ссылки
<a href="https://eas.patents.su/30-10583-proizvodnye-azetidinkarboksamida-i-ih-primenenie-pri-lechenii-narushenijj-oposredovannyh-sv1-receptorami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные азетидинкарбоксамида и их применение при лечении нарушений, опосредованных св1 рецепторами</a>
Предыдущий патент: Способ нейтронного измерения для определения пористости формации вокруг ствола скважины
Следующий патент: Способ снижения содержания ацетальдегида в формованных из расплава полиэфирах, изделие из полиэфира, способ его изготовления и композиция для его изготовления
Случайный патент: Устройство для аморфного соединения труб












