6-замещённые 2, 3, 4, 5-тетрагидро-1н-бензо [ d ] азепины в качестве агонистов рецепторов 5-ht2c
Номер патента: 11011
Опубликовано: 30.12.2008
Авторы: Коэн Майкл Филип, Уилльямс Эндрю Кервин, Чжан Дэи, Родригес Майкл Джон, Сидем Кристофер Стефен, Рейнхард Мэттью Роберт, Тидуэлл Майкл Вэйд, Мартинес-Грау Мария Анхелес, Виктор Франтц, Аллен Джон Гордон, Ли Вай-Мань, Део Арундхати С., Сингх Аджай, Брайнер Карин, Бойд Стивен Армен, Галка Кристофер Стэнли, Ротхаар Роджер Райан, Конвей Ричард Джерард, Хеллман Сара Линн, Мазанетц Майкл Филип
Формула / Реферат
1. Соединение формулы I
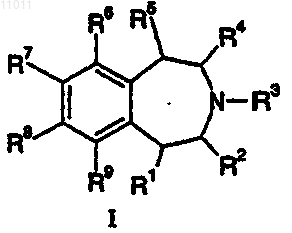
где
R1 представляет собой водород;
R2, R3 и R4, каждый независимо, представляет собой водород;
R5 представляет собой водород;
R6 представляет собой -CуC-R10, -O-R12, -S-R14 или -NR24R25;
R7 представляет собой Cl;
R8 представляет собой водород;
R9 представляет собой водород;
R10 представляет собой -CF3, этил, замещенный 1-5 атомами фтора, (С3-С6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкил, Ar1-(С0-С3)алкил, Ph1-(С0-С3)алкил или 3-(C1-C4)алкил-2-оксоимидазолидин-1-ил-(С1-С3)алкил;
R12 представляет собой Ph2-(C1-C3)алкил, Ar2-(C1-C3)алкил, (C1-C6)алкил-S-(С2-С6)алкил, (С3-С7) циклоалкил-S-(С2-С6)алкил, фенил-S-(С2-С6)алкил, Ph2-S-(C2-C6)алкил, фенилкарбонил-(C1-C3)алкил, Ph2-C(О)-(C1-C3)алкил, (C1-C6)алкоксикарбонил(C3-C6)алкил, (С3-С7)циклоалкил-ОС(О)-(С3-С6)алкил, фенилоксикарбонил-(С3-С6)алкил, Ph2-OC(О)-(С3-С6)алкил, Ar2-OC(О)-(С3-С6)алкил, (С3-С7)циклоалкил-NH-C (О)-(С2-С4)алкил-, Ph1-NH-С(О)-(С2-С4)алкил-, Ar2-NH-C(О)-(С2-С4)алкил- или R13-C(О)NH-(С2-С4)алкил;
R13 представляет собой (С3-С7)циклоалкил(С0-С3)алкил, Ph1, Ar2 или (C1-C3)алкокси, необязательно замещенный 1-6 атомами фтора, Ph1-NH- или N-связанный Het1;
R14 представляет собой Ar2, который у атома азота не связан с атомом серы, Ph2, R15-L-, тетрагидрофуранил, тетрагидропиранил или фенилметил, замещенный по метильному фрагменту заместителем, выбранным из группы, состоящей из (C1-C3)-н-алкила, замещенного гидрокси, (C1-C3)алкил-О-(C1-С2)-н-алкила, (С1-С3)алкил-С(O)-(С0-С2)-н-алкила и (C1-C3)алкил-О-С(О)-(С0-С2)-н-алкила,
где если R14 представляет собой Ph2 или Ar2, где Ar2 является пиридилом, то R14 также необязательно может быть замещен фенил-СН=СН- или фенил-СуС-, где указанный фенил-СН=СН-или фенил-СуС- дополнительно необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора,
и где если Ar2 представляет собой пиридил, который альтернативно необязательно может быть замещен R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,
и где тетрагидрофуранил и тетрагидропиранил необязательно могут быть замещены оксогруппой или одной или двумя группами, независимо выбранными из метила и -CF3;
R15 представляет собой -OR16, циано, -SCF3, Ph2, Ar2, хинолинил, изохинолинил, циннолинил, хиназолинил, фталимидо, бензотиофенил, необязательно замещенный в положении 2 фенилом или бензилом, бензотиазолил, необязательно замещенный в положении 2 фенилом или бензилом, бензотиадиазолил, необязательно замещенный фенилом или бензилом, 2-оксодигидроиндол-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксодигидроиндол-5-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксоимидазолидин-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксотетрагидропиримидинил, необязательно замещенный в положении 3 или 4 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксотетрагидрохинолин-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксодигидробензимидазол-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, -NR17R18, -C(O)R22 или насыщенный гетероцикл, выбранный из группы, состоящей из пирролидинила, пиперидинила, морфолинила и тиоморфолинила, тетрагидрофуранила и тетрагидропиранила,
где Ph2 и Ar2, если Ar2 представляет собой пиридил, также необязательно могут быть замещены фенил-СН=СН- или фенил-СуС-,
где указанный фенил-СН=СН- и фенил-СуС- необязательно дополнительно замещены в фенильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и
где Ar2 альтернативно необязательно может быть замещен заместителем, выбранным из группы, состоящей из (С3-С7)циклоалкил-(С0-С3)алкила, Het1-(С0-С3)алкила, пиридил-(С0-С3)алкила и фенил-(С0-С3)алкила, и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,
указанный пиридил-(С0-С3)алкил и фенил-(С0-С3)алкил дополнительно необязательно замещены 1-3 заместителями, независимо выбранными из галогена, -СН3, -ОСН3, -CF3, -OCF3, -CN и -SCF3, и
где, если Ar2 представляет собой пиридил, то пиридил альтернативно необязательно может быть замещен группой R28R29N-C(О)- или (C1-C6)алкил-С(О)-, необязательно замещенной 1-6 атомами фтора, и может быть необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,
где, если Ar2 представляет собой тиазолил, то тиазолил альтернативно необязательно может быть замещен (C3-С7)циклоалкил-(С0-С3)алкил-NH-, и
где пирролидинил, пиперидинил, морфолинил и тиоморфолинил замещен оксогруппой при атоме углерода, смежном с атомом азота кольца, или при атоме азота замещен заместителем, выбранным из группы, состоящей из (C1-C6)алкилкарбонила, (C1-C6)алкилсульфониыр, (С3-С7)циклоалкил(С0-С3)алкил-С(О)-, (С3-С7)циклоалкил (С0-С3)алкил-S (О)2-, Ph1-(C0-C3)алкил-С(О)- и Ph1-(C0-C3)алкил-S(О)2-, и
дополнительно необязательно может быть замещен 1 или 2 метильными или -CF3 заместителями, и если замещен оксогруппой, дополнительно необязательно может быть замещен у атома азота заместителем, выбранным из группы, состоящей из (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкила и Ph1-(C0-C3)алкила, и
где тетрагидрофуранил и тетрагидропиранил необязательно могут быть замещены оксогруппой и/или одной или двумя группами, независимо выбранными из метила и -CF3;
L представляет собой разветвленный или неразветвленный (C1-C6)алкилен, за исключением случая, когда R15 представляет собой -NR17R18 или Ar2-N-связан с L, тогда L представляет собой разветвленный или неразветвленный (С2-С6)алкилен, и если L представляет собой метилен или этилен, L необязательно может быть замещен гем-этаном или 1-2 атомами фтора, и если R15 представляет собой Ph2, Ar2 или насыщенный гетероцикл, L альтернативно необязательно может быть замещен заместителем, выбранным из группы, состоящей из гидрокси, циано, -SCF3, (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, (C1-C6) алкоксикарбонила, дополнительно необязательно замещенного 1-6 атомами фтора, (C1-C6)алкилкарбонилокси, дополнительно необязательно замещенного 1-6 атомами фтора, (С3-С7)циклоалкил-(С0-С3)алкил-О-, (С3-С7)циклоалкил-(С0-С3)алкил-O-С(O)- и (С3-С7)циклоалкил-(С0-С3)алкил-С(О)-О-;
R16 представляет собой водород, (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (C1-C6)алкилкарбонил, (С3-С7)циклоалкил(С0-С3)алкил, (С3-С7)циклоалкил(С0-С3)алкил-С(О)-, Ph1-(C0-C3) алкил, Ph1-(С0-С3)алкил-С(О)-, Ar2-(С0-С3)алкил или Аr2-(С0-С3)алкил-С(О)-,
R17 представляет собой (С1-С4)алкил, необязательно замещенный 1-6 атомами фтора, трет-бутилсульфонил, (С3-С7)циклоалкил (С0-С3)алкил-С(О)-, (С3-С7)циклоалкил(С0-С3)алкилсульфонил, Ph1-(С0-С3)алкил, Ph1-(С0-С3)алкил-С(О)-, Ph1-(С0-С3)алкилсульфонил, Ar2-(С0-С3)алкил, Ar2-(С0-С3)алкил-С(О)-, Ar2-(С0-С3)алкилсульфонил, R19OC(O)- или R20R21NC (О)-;
R18 представляет собой водород или (С1-С4)алкил, необязательно замещенный 1-6 атомами фтора, или R17 и R18, взятые вместе с атомом азота, к которому они присоединены, образуют Het1, где Het1 замещен оксогруппой у атома углерода, смежного с атомом азота кольца, или
R17 и R18, взятые вместе с атомом азота, к которому они присоединены, образуют ароматический гетероцикл, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, 1,2,3-триазолила и 1,2,4-триазолила, указанный ароматический гетероцикл необязательно замещен 1-2 галогеновыми заместителями или замещен 1-2 (С1-С4)алкильными заместителями, дополнительно необязательно замещенными 1-3 атомами фтора, или монозамещен заместителем, выбранным из фтора, нитро, циано, -SCF3 или (С1-С4)алкокси, дополнительно необязательно замещенного 1-3 атомами фтора, и необязательно дополнительно замещен (С1-С4)алкилом, дополнительно необязательно замещенным 1-3 атомами фтора;
R19 представляет собой (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкил, Ar2-(С0-С3)алкил или Ph1-(C0-C3)алкил,
R20 представляет собой (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкил, Ar2-(С0-С3)алкил или Ph1-(C0-C3)алкил,
R21 представляет собой водород или (С1-С4)алкил, необязательно замещенный 1-6 атомами фтора, или R20 и R21, взятые вместе с атомом азота, к которому они присоединены, образуют Het1;
R22 представляет собой (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил (С0-С3)алкил, R23-O-, Ph1-С0-С3)алкил, Ar2-(С0-С3)алкил или R32R33N-;
R23 представляет собой (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил (С0-С3)алкил, Ph1-(С0-С3)алкил или Ar2-(С0-С3)алкил;
R24 представляет собой (C1-C6)алкокси(С2-С5)алкил, необязательно замещенный 1-6 атомами фтора,
(C1-C6)алкилтио(С2-С5)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(C0-C1)алкил-О-(С1-С5)алкил, (С3-С7)циклоалкил (C0-C1)алкил-S-(С1-С5)алкил, фенил (C1-C3)-н-алкил, Ph2-(C1-C3)-н-алкил, Ar2-(С0-С3)-н-алкил, фенил (C0-C1)алкил-О-(С1-С5)алкил, фенил (C0-C1)алкил-S-(С1-С5)алкил, Ph1-(С0-С1)алкил-С(О)NH-(С2-С4)алкил, Ph1-(C0-C1)алкил-NH-C(О)NH-(С2-С4)алкил, пиридил-(С0-С1)алкил-С(O)NH-(C2-C4)алкил, пиридил-(С0-С1)алкил-NH-C(О)NH-(C2-C4)алкил или Ar3(C1-С2)алкил,
где Ar3 представляет собой бициклический фрагмент, выбранный из группы, состоящей из инданила, индолила, дигидробензофуранила, бензофуранила, бензотиофенила, бензоксазолила, бензотиазолила, бензо[1,3]диоксолила, нафтила, дигидробензопиранила, хинолинила, изохинолинила и бензо[1,2,3]тиадиазолила,
где указанный Ar3 необязательно замещен (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, фенил(С0-С1)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, или замещен (С3-С7)циклоалкил (С0-С3)алкилом или замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, оксо, метила и -CF3,
указанный фенил (C1-C3)-н-алкшы, Ph2-(C1-C3)-н-алкил или Ar2(С0-С3)-н-алкил необязательно замещен в н-алкильном фрагменте, если таковой присутствует, (C1-C3)алкилом, диметилом, гем-этаном, 1-2 атомами фтора или (C1-C6)алкил-С(О)-,
указанный Ar2(С0-С3)-н-алкил альтернативно необязательно замещен заместителем, выбранным из группы, состоящей из (С3-С7)циклоалкил-(С0-С3)алкила, Het1-(C0-C3)алкила, пиридил-(C0-C3)алкила, фенил-(C0-C3)алкила, пиридил-(C0-C3)алкил-NH-, фенил-(C0-C3)алкил-NH-, (C1-C6)алкил-S- и (С3-С7)циклоалкил-(C0-C3)алкил-S-, и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,
указанный пиридил-(C0-C3)алкил и фенил-(С0-С3)алкил дополнительно необязательно замещен 1-3 заместителями, независимо выбранными из галогена, -СН3, -ОСН3, -CF3, -OCF3, -CN и -SCF3, и
указанные Ph2-(C1-C3)-н-алкил и Ar2(C0-C3)-н-алкил, где Ar2 представляет собой пиридил, также необязательно замещены в фенильном или Ar2 фрагменте, соответственно, фенил-СН=СН- или фенил-СуС-,
указанные фенил-СН=СН- или фенил-СуС- дополнительно необязательно замещены 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и
указанный Ar2(С0-С3)-н-алкил, где Ar2 представляет собой пиридил, альтернативно необязательно замещен (C1-C6)алкил-С(О)- или R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,
указанные фенил(C0-C1)алкил-О-(С1-С5)алкил или фенил(C0-C1)алкил-S-(С1-С5)алкил необязательно замещены по фенильному фрагменту (С1-С2)-S(О)2- или замещены 1-5 независимо выбранными галогеновыми заместителями или 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и указанные пиридил-(C0-C1)алкил-С(O)NH-(C2-C4)алкил и пиридил-(C0-C1)алкил-NH-C(O)NH-(C2-C4)алкил необязательно замещены в пиридильном фрагменте метилом, -CF3 или 1-3 галогеновыми заместителями;
R25 представляет собой водород, (C1-C3)алкил, необязательно замещенный 1-6 атомами фтора, или аллил;
R26 представляет собой водород, (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкил;
R27 представляет собой водород или (С1-С4)алкил, необязательно замещенный 1-6 атомами фтора, или R26 и R27, взятые вместе с атомом азота, к которому они присоединены, образуют Het1;
R28 представляет собой (C1-C8)алкил, необязательно замещенный 1-6 атомами фтора, (С3-C8)циклоалкил(С0-С3)алкил, тетрагидропиран-3-ил (С0-С3)алкил, тетрагидропиран-4-ил (С0-С3)алкил, тетрагидрофуранил(С0-С3)алкил, Ph1-(С0-С2)н-алкил или Ar2-(С0-С2) н-алкил,
указанные Ph1-(С0-С2)-н-алкил и Ar2-(С0-С2)-н-алкил необязательно замещены по алкильному фрагменту, если он присутствует, (C1-C3)алкилом, диметилом или гем-этаном;
R29 представляет собой водород или (C1-C3)алкил;
R30 представляет собой водород, (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, (С3-С7)циклоалкил(С0-С3)алкил, Ph1-(С0-С3)алкил или Ar2(С0-С3)алкил,
R31 представляет собой водород или (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, или R30 и R31, взятые вместе с атомом азота, к которому они присоединены, образуют Het1,
указанный Het1 также необязательно замещен фенилом, дополнительно необязательно замещенным 1-3 галогеновыми заместителями;
R32 и R33, каждый независимо, представляет собой водород или (C1-C6)алкил, необязательно замещенный 1-6 атомами фтора, или
R32 и R33, взятые вместе с атомом азота, к которому они присоединены, образуют Het1, или R32 представляет собой Ph1(C0-C1)алкил, при условии, что R33 представляет собой водород;
Ar1 представляет собой ароматический гетероциклический заместитель, выбранный из группы, состоящей из фуранила, тиофенила, тиазолила, оксазолила, изоксазолила, пиридила и пиридазинила, любой из которых может быть необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, (C1-C3)алкила, (C1-C3)алкокси, -CF3, -O-CF3, нитро, циано и трифторметилтио;
Ar2 представляет собой ароматический гетероциклический заместитель, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, 1,2,3-триазолила, 1,2,4-триазолила, фуранила, оксазолила, изоксазолила, 1,2,3-оксадиазолила, 1,2,4-оксадиазолила, 1,3,4-оксадиазолила, тиофенила, тиазолила, изотиазолила, 1,2,3-тиадиазолила, 1,3,4-тиадиазолила, пиридила, пиридазинила и бензимидазолила, любой из которых может быть необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, где пиридил и пиридазинил также необязательно могут быть замещены (C1-C6)алкиламино, дополнительно необязательно замещенным 1-6 атомами фтора, (С3-С7)циклоалкил (С0-С3)алкилом или (С3-С7)циклоалкил(С0-С3)алкиламино;
Het1 представляет собой насыщенный азотсодержащий гетероциклический заместитель, выбранный из группы, состоящей из азетидинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила, тиоморфолинила, гомоморфолинила и гомотиоморфолинила, любой из которых необязательно может быть замещен (C1-C6)алкилом или двумя метильными заместителями;
Het2 представляет собой насыщенный кислородсодержащий гетероциклический заместитель, выбранный из группы, состоящей из тетрагидрофуранила и тетрагидропиранила, любой из которых необязательно может быть замещен (C1-C6)алкилом или двумя метильными заместителями;
Ph1 представляет собой фенил, необязательно замещенный 1-5 независимо выбранными галогеновыми заместителями или 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора;
Ph2 представляет собой фенил, замещенный:
a) 1-5 независимо выбранными галогеновыми заместителями; или
b) 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, нитро, гидрокси, (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-C6) алкокси, дополнительно необязательно замещенного 1-6 атомами фтора; или
c) 0, 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, циано,
-SCF3, метила, -CF3, метокси, -OCF3, нитро и гидрокси, вместе с одним заместителем, выбранным из группы, состоящей из:
i) (C1-C10)алкила, дополнительно необязательно замещенного 1-6 атомами фтора или монозамещенного гидрокси, (C1-C6)алкокси, (С3-С7)циклоалкил(С0-С3)алкилокси, Het2-(C0-C3)алкилокси, Ph1-(С0-С3) алкилокси,
ii) (C1-C10)алкокси-(С0-С3)алкила, дополнительно необязательно замещенного 1-6 атомами фтора и необязательно дополнительно замещенного гидрокси,
iii) (C1-C6)алкил-С(О)-(С0-С5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,
iv) карбокси,
v) (C1-C6)алкоксикарбонила, дополнительно необязательно замещенного 1-6 атомами фтора,
vi) (C1-C6)алкил-С(О)-(С0-С3)-O-, дополнительно необязательно замещенного 1-6 атомами фтора,
vii) (C1-C6)алкилтио-(С0-С5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,
viii) (C1-C6)алкилсульфинил-(С0-С5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,
ix) (C1-C6)алкилсульфонил-(С0-С5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,
х) (C1-C6)алкилсульфонил-(С0-С3)алкил-О-, дополнительно необязательно замещенного 1-6 атомами фтора,
xi) (С3-С7)циклоалкил(С0-С3)алкила, необязательно дополнительно замещенного в циклоалкильном фрагменте 1-4 заместителями, выбранными из метила и фтора,
xii) (С3-С7)циклоалкил (С0-С3)алкил-О-, необязательно дополнительно замещенного в циклоалкильном фрагменте 1-4 заместителями, выбранными из метила и фтора,
xiii) (С3-С7)циклоалкил(С0-С3)алкил-С(О)-,
xiv) (С3-С7)циклоалкил(С0-С3)алкил-О-С(О)-,
xv) (С3-С7)циклоалкил(С0-С3)алкил-S-,
xvi) (С3-С7)циклоалкил(С0-С3)алкил-S(О)-,
xvii) (С3-С7)циклоалкил(С0-С3)алкил-S(О)2-,
xviii) Ph1-(С0-С3)алкила, необязательно замещенного в алкильном фрагменте 1-2 атомами фтора,
xix) Ph1-(С0-С3)алкил-О-, необязательно замещенного в алкильном фрагменте 1-2 атомами фтора,
хх) Ph1-(С0-С3)алкил-С(О)-,
xxi) Ph1-(С0-С3)алкил-О-С(О)-,
xxii) Ph1-(С0-С3)алкил-С(О)-(С0-С3)алкил-О-,
xxiii) Ph1-(С0-С3)алкилтио,
xxiv) Ph1-(С0-С3)алкилсульфинила,
xxv) Ph1-(С0-С3)алкилсульфонила,
xxvi) Ar2(С0-С3)алкила,
xxvii) Ar2(С0-С3)алкил-О-,
xxviii) Ar2(С0-С3)алкил-S-,
xxix) Ar2(C0-C3)алкил-С(O)-,
xxx) Ar2(С0-С3)алкил-С(S)-,
xxxi) Ar2(С0-С3)алкилсульфинила,
xxxii) Ar2(С0-С3)алкилсульфонила,
xxxiii) Het1(С0-С3)алкил-С(О)-, необязательно замещенного в Het1 фрагменте заместителем Ph1,
xxxiv) Het1(С0-С3)алкил-С(S)-, необязательно замещенного в Het1 фрагменте заместителем Ph1,
xxxv) N-связанного Het1-C(O)-(С0-С3)алкил-О-,
xxxvi) Het2-(С0-С3)алкилокси,
xxxvii) R26R27N-,
xxxviii) R28R29-N-(C1-C3)алкокси,
xxxix) R28R29N-C(O)-,
xl) R28R29N-C(O)-(C1-C3)алкил-O-,
xli) R28R29N-C(S)-,
xlii) R30R31N-S(O)2-,
xliii) HON=C(CH3)- и
xliv) HON=C(Ph1)-,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R6 представляет собой -CуC-R10.
3. Соединение по п.1, где R6 представляет собой -O-R12.
4. Соединение по п.1, где R6 представляет собой -S-R14.
5. Соединение по п.4, где R6 представляет собой -S-L-R15.
6. Соединение по п.5, где R15 представляет собой Ph2 или Ar2.
7. Соединение по любому из пп.1-6, где R6 представляет собой -NR24R25.
8. Соединение по п.7, где R24 представляет собой Ph2-(С1-С3)-н-алкил-.
9. Соединение по п.7, где R24 представляет собой Ar2-(C1-C3)-н-алкил-.
10. Соединение по любому из пп.7-9, где R25 представляет собой водород.
11. Фармацевтическая композиция, содержащая соединения по любому из пп.1-10 в качестве активного ингредиента в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
12. Применение соединения по любому из пп.1-10 для лечения расстройств, связанных с рецептором 5-HT2C.
13. Применение по п.12, где расстройством является ожирение у млекопитающих.
14. Применение по п.12, где расстройством является обсессивно-компульсивное расстройств у млекопитающих.
15. Применение по п.12, где расстройством является депрессия у млекопитающих.
16. Применение по п.12, где расстройством является тревога у млекопитающих.
17. Применение по любому из пп.12-16, где млекопитающим является человек.
18. Применение соединения по любому из пп.1-10 для производства лекарственного средства для лечения расстройства, выбранного из ожирения, обсессивно-компульсивных расстройств, тревоги или депрессии.
19. Соединение 7-хлор-6-[4-(2-метилпропан-2-сульфонилметил)бензиламино]-2,3,4,5-тетрагидро-1Н-бензо[d]азепин или его фармацевтически приемлемая соль.
Текст
011011 Нейромедиатор серотонин (5-гидрокситриптамин, 5-НТ) обладает разнообразными фармакологическими свойствами, которые представляют собой результат существования гетерогенной популяции рецепторов, которая состоит, как минимум, из семи классов. Серотониновый класс 5-НТ 2 дополнительно подразделяется, как минимум, на три подтипа, обозначенные 5-HT2A, 5-HT2B и 5-HT2C. Был выделен и описан рецептор 5-HT2C (Julius, et al., патент США No. 4985352); и сообщалось, что у трансгенных мышей с дефицитом рецептора 5-HT2C возникают судороги и расстройства аппетита, которые приводят к повышенному потреблению пищи (Julius et al., U.S. Patent No. 5,698,766). Рецептор 5-HT2C также связывают с различными другими неврологическими расстройствами, такими как ожирение (Vickers et al.,Psychopharmacology, 167: 274-280 (2003, гиперфагия (Tecott et al., Nature, 374: 542-546 (1995, обсессивное компульсивное расстройство (Martin et al., Pharmacol. Biochem. Behav., 71: 615 (2002); Chou-GreenDrugs 2(4), p. 317 (1993. Некоторые замещенные соединения 2,3,4,5-тетрагидро-1 Н-бензо[d]азепина были раскрыты в качестве полезных терапевтических агентов, например,в US 4265890 описаны некоторые замещенные соединения 2,3,4,5-тетрагидро-1 Н-бензо[d]азепина в качестве антагонистов дофаминергических рецепторов для применения, среди прочего, в качестве антипсихотических и противорвотных средств,в ЕР 0285287 описаны некоторые замещенные соединения 2,3,4,5-тетрагидро-1 Н-бензо[d]азепина для применения, среди прочего, в качестве агентов для лечения расстройств перистальтики желудочнокишечного тракта,в WO 93/03015 и WO 93/04686 описаны некоторые замещенные соединения 2,3,4,5-тетрагидро-1 Нбензо[d]азепина в качестве антагонистов альфа-адренергического рецептора для применения в качестве агентов для лечения, среди прочего, гипертензии и сердечно-сосудистых заболеваний, при которых желательными являются изменения сопротивления сосудов. в WO 02/074746 А 1 описаны некоторые замещенные соединения 2,3,4,5-тетрагидро-1 Нбензо[d]азепина в качестве агонистов 5-HT2C для лечения, среди прочего, гипогонадизма, ожирения, гиперфагии, тревоги, депрессии, расстройств сна. В WO 03/006466 А 1 описаны некоторые замещенные соединения трициклического гексагидроазепиноиндола и индолина в качестве лигандов 5-НТ и, как результат, их полезность в лечении заболеваний,при которых желательна модуляция активности 5-НТ. Высокое сродство агонистов рецептора 5-HT2C обеспечивает полезный терапевтический эффект при лечении вышеуказанных расстройств, связанных с рецептором 5-HT2C, включающих ожирение, гиперфагию, обсессивного/компульсивное расстройство, депрессию, тревогу, злоупотребления веществами, которые вызывают привыкание и пристрастие, расстройства сна, приливы и гипогонадизм. Агонисты рецептора 5-HT2C c высоким сродством, которые также обладают избирательностью в отношении рецептора 5-HT2C, обеспечивают такие терапевтические эффекты без нежелательных побочных эффектов, связанных с существующими терапевтическими средствами. Известно, что достижение селективности в отношении рецепторов 5-HT2C, как и в случае рецепторов 5-HT2A и 5-HT2B, является сложным в случае целевых агонистов 5-HT2C. Агонисты рецептора 5-HT2A ассоциировались с проблематичными галлюциногенными побочными эффектами (Nelson et al., Naunyn-Schmiedeberg's Arch. Pharm., 359: 1-6 (1999. Агонисты рецептора 5-HT2B ассоциировались с побочным действием на сердечно-сосудистую систему,таким как вальвулопатия (V. Setola et al., Mol. Pharmacology, 63: 1223-1229 (2003) и цитированные в работе ссылки). Предыдущие ссылки на замещенные соединения 2,3,4,5-тетрагидро-1 Н-бензо[d]азепина в основном повторяют упоминания об их использовании в качестве альфа-адренергических или дофаминергических модуляторов. Модуляторы адренергических рецепторов часто связывают с лечением сердечнососудистых заболеваний (Frishman, Kotob, Journal of Clinical Pharmacology, 39: 7-16 (1999. Дофаминергические рецепторы в основном нацелены на лечение шизофрении и болезни Паркинсона (Seeman, VanTol, Trends in Pharmacological Sciences, 15: 264-270 (1994. Специалистам в данной области будет понятно, что селективность в отношении указанных или других важных с физиологической точки зрения рецепторов в целом также будет являться предпочтительной характеристикой терапевтических средств для специфического лечения описанных выше расстройств, связанных с 5-HT2C. Данное изобретение обеспечивает селективные агонисты 5-HT2C формулы IR14 представляет собой Ar2, который у атома азота не связан с атомом серы, Ph2, R15-L-, тетрагидрофуранил, тетрагидропиранил или фенилметил, замещенный по метильному фрагменту заместителем,выбранным из группы, состоящей из (C1-С 3)-н-алкила, замещенного гидрокси, (C1-С 3)алкил-О-(C1-С 2)-налкила, (C1-C3)алкил-С(О)-(С 0-С 2)-н-алкила и (С 1-С 3)алкил-О-С(О)-(С 0-С 2)-н-алкила,где, если R14 представляет собой Ph2 или Ar2, где Ar2 является пиридилом, то R14 также необязательно может быть замещен фенил-СН=СН- или фенил-СС-, указанный фенил-СН=СН- или фенил-ССдополнительно необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6) алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и где, если Ar2 представляет собой пиридил, то пиридил альтернативно необязательно может быть замещен R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или-SCF3 заместителем или 1-2 галогеновыми заместителями, и где тетрагидрофуранил и тетрагидропиранил необязательно могут быть замещены оксогруппой или одной или двумя группами, независимо выбранными из метила и -CF3;R15 представляет собой -OR16, циано, -SCF3, Ph2, Ar2, хинолинил, изохинолинил, циннолинил, хиназолинил, фталимидо, бензотиофенил, необязательно замещенный в положении 2 фенилом или бензилом,бензотиазолил, необязательно замещенный в положении 2 фенилом или бензилом, бензотиадиазолил,необязательно замещенный фенилом или бензилом, 2-оксодигидроиндол-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-С 6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксодигидроиндол-5-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-С 6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксоимидазолидин-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-С 6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксотетрагидропиримидинил, необязательно замещенный в положении 3 или 4 гем-диметилом или (C1-С 6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2-оксотетрагидрохинолин-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, 2 оксодигидробензимидазол-1-ил, необязательно замещенный в положении 3 гем-диметилом или (C1-C6) алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, -NR17R18, -C(O)R22 или насыщенный гетероцикл, выбранный из группы, состоящей из пирролидинила, пиперидинила, морфолинила и тиоморфолинила, тетрагидрофуранила и тетрагидрофуранила,где Ph2 и Ar2, если Ar2 представляет собой пиридил, также необязательно могут быть замещены фенил-СН=СН- или фенил-СС-,где указанный фенил-СН=СН- и фенил-СС- необязательно дополнительно замещен в фенильном фрагменте 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и где Ar2 альтернативно необязательно может быть замещен заместителем, выбранным из группы, состоящей из (С 3-С 7)циклоалкил-(С 0-С 3)алкила, Het1-(C0-C3)алкила, пиридил-(С 0-С 3)алкила и фенил-(С 0 С 3)алкила, и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями, указанный пиридил-(С 0-С 3)алкил и фенил-(С 0-С 3)алкил дополнительно необязательно замещен 1-3 заместителями, независимо выбранными из галогена, -СН 3,-ОСН 3, -CF3, -OCF3, -CN и -SCF3,-2 011011 где, если Ar2 представляет собой пиридил, то пиридил альтернативно необязательно может быть замещен группой R28R29N-C(О)- или (C1-С 6)алкил-С(О)-, необязательно замещенной 1-6 атомами фтора,и может быть необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,где, если Ar2 представляет собой тиазолил, то тиазолил альтернативно необязательно может быть замещен (С 3-С 7)циклоалкил-(С 0-С 3)алкил-NH-, и где пирролидинил, пиперидинил, морфолинил и тиоморфолинил замещен оксогруппой при атоме углерода, смежном с атомом азота кольца, или при атоме азота замещен заместителем, выбранным из группы, состоящей из (C1-С 6)алкилкарбонила, (C1-С 6)алкилсульфонила, (С 3-С 7)циклоалкил(С 0-С 3)алкилС (О)-, (С 3-С 7)циклоалкил(С 0-С 3)алкил-S(О)2-, Ph1-(С 0-С 3)алкил-С(О)- и Ph1-(С 0-С 3)алкил-S(O)2-, и дополнительно необязательно может быть замещен 1 или 2 метилами или -CF3, и если замещен оксогруппой, дополнительно необязательно может быть замещен у атома азота заместителем, выбранным из группы, состоящей из (C1-C6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,(С 3-С 7)циклоалкил(С 0-С 3)алкила и Ph1-(C0-C3)алкила, и где тетрагидрофуранил и тетрагидропиранил необязательно может быть замещен оксогруппой и/или одной или двумя группами, независимо выбранными из метила и -CF3;L представляет собой разветвленный или неразветвленный (C1-С 6)алкилен, за исключением случая,когда R15 представляет собой -NR17R18 или Ar2-N-связан с L, тогда L представляет собой разветвленный или неразветвленный (C2-С 6)алкилен, и если L представляет собой метилен или этилен, L необязательно может быть замещен гем-этаном или 1-2 атомами фтора и если R15 представляет собой Ph2, Ar2 или насыщенный гетероцикл, L альтернативно необязательно может быть замещен заместителем, выбранным из группы, состоящей из гидрокси, циано, -SCF3, (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, (C1-С 6)алкоксикарбонила, дополнительно необязательно замещенного 1-6 атомами фтора, (C1-С 6)алкилкарбонилокси, дополнительно необязательно замещенного 1-6 атомами фтора, (С 3-С 7)циклоалкил-(С 0-С 3)алкил-О-, (С 3-С 7)циклоалкил-(С 0-С 3)алкил-O-С(O)- и (С 3-С 7)циклоалкил-(С 0-С 3)алкил-С(О)-О-;R18 представляет собой водород или (C1-C4)алкил, необязательно замещенный 1-6 атомами фтора,или R17 и R18, взятые вместе с атомом азота, к которому они присоединены, образуют Het1, где Het1 замещен оксогруппой у атома углерода, смежного с атомом азота кольца, илиR17 и R18, взятые вместе с атомом азота, к которому они присоединены, образуют ароматический гетероцикл, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, 1,2,3-триазолила и 1,2,4-триазолила, указанный ароматический гетероцикл необязательно замещен 1-2 галогеновыми заместителями или замещен 1-2 (С 1-С 4)алкильными заместителями, дополнительно необязательно замещенными 1-3 атомами фтора, или монозамещен заместителем, выбранным из фтора, нитро, циано, -SCF3 или(C1-C4)алкокси, дополнительно необязательно замещенного 1-3 атомами фтора, и необязательно дополнительно замещен (С 1-С 4)алкилом, дополнительно необязательно замещенным 1-3 атомами фтора;R19 представляет собой (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора, (С 3-С 7)циклоалкил(С 0-С 3)алкил, Ar2-(С 0-С 3)алкил или Ph1-(C0-C3)алкил,R20 представляет собой (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора, (С 3-С 7)циклоалкил (С 0-С 3)алкил, Ar2-(С 0-С 3)алкил или Ph1-(C0-C3)алкил,R21 представляет собой водород или (С 1-С 4)алкил, необязательно замещенный 1-6 атомами фтора,или R20 и R21, взятые вместе с атомом азота, к которому они присоединены, образуют Het1;R24 представляет собой (C1-С 6)алкокси(С 2-С 5)алкил, необязательно замещенный 1-6 атомами фтора,(С 1-С 6)алкилтио (С 2-С 5)алкил, необязательно замещенный 1-6 атомами фтора, (С 3-С 7)циклоалкил (C0-C1) алкил-О-(С 1-С 5)алкил, (С 3-С 7)циклоалкил (C0-C1)алкил-S-(С 1-С 5)алкил, фенил (C1-С 3)-н-алкил, Ph2-(C1C3)-н-алкил, Ar2(С 0-С 3)-н-алкил, фенил (C0-C1)алкил-О-(С 1-С 5)алкил, фенил (C0-C1)алкил-S-(С 1-С 5)алкил,Ph1-(C0-C1)алкил-С(О)NH-(C2-C4)алкил, Ph1-(C0-C1)алкил-NH-C(O)NH-(C2-C4)алкил, пиридил-(C0-C1)алкил-С(O)NH-(C2-C4)алкил, пиридил-(C0-C1)алкил-NH-C(O)NH-(C2-C4)алкил или Ar3(C1-C2)алкил,где Ar3 представляет собой бициклический фрагмент, выбранный из группы, состоящей из инданила, индолила, дигидробензофуранила, бензофуранила, бензотиофенила, бензоксазолила, бензотиазолила,бензо[1,3]диоксолила, нафтила, дигидробензопиранила, хинолинила, изохинолинила и бензо[1,2,3]тиа-3 011011 диазолила,где указанный Ar3 необязательно замещен (C1-С 6)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, фенил(C0-C1)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора, или замещен (С 3-С 7)циклоалкил(С 0-С 3)алкилом или замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, оксо, метила и -CF3,указанный фенил(C1-С 3)-н-алкил, Ph2-(C1-C3)-н-алкил или Ar2(С 0-С 3)-н-алкил необязательно замещен в н-алкильном фрагменте, если таковой присутствует, (C1-С 3)алкилом, диметилом, гем-этаном, 1-2 атомами фтора или (C1-С 6)алкил-С(О)-,указанный Ar2(С 0-С 3)-н-алкил альтернативно необязательно замещен заместителем, выбранным из группы, состоящей из (С 3-С 7)циклоалкил-(С 0-С 3)алкила, Het1-(С 0-С 3)алкила, пиридил-(С 0-С 3)алкила, фенил-(С 0-С 3)алкила, пиридил-(С 0-С 3)алкил-NH-, фенил-(С 0-С 3)алкил-NH-, (C1-С 6)алкил-S- и (С 3-С 7)циклоалкил-(С 0-С 3)алкил-S-, и необязательно дополнительно замещен одним метильным, -CF3, циано или-SCF3 заместителем или 1-2 галогеновыми заместителями,указанный пиридил-(С 0-С 3)алкил и фенил-(С 0-С 3)алкил дополнительно необязательно замещен 1-3 заместителями, независимо выбранными из галогена, -СН 3, -ОСН 3, -CF3, -OCF3, -CN и -SCF3, и указанные Ph2-(C1-C3)-н-алкил и Ar2(С 0-С 3)-н-алкил, где Ar2 представляет собой пиридил, также необязательно замещены в фенильном или Ar2 фрагменте, соответственно, фенил-СН=СН- или фенил-СС-,указанные фенил-СН=СН- или фенил-СС- дополнительно необязательно замещены 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и указанный Ar2(С 0-С 3)-н-алкил, где Ar2 представляет собой пиридил, альтернативно необязательно замещен (C1-C6)алкил-С(О)- или R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или 1-2 галогеновыми заместителями,указанные фенил(C0-C1)алкил-О-(C1-C5)алкил или фенил(C0-C1)алкил-S-(C1-C5)алкил необязательно замещены по фенильному фрагменту (С 1-С 2)-S(О)2- или замещены 1-5 независимо выбранными галогеновыми заместителями или 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и(C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, и указанные пиридил-(C0-C1)алкил-С(О)NH-(C2-C4)алкил и пиридил-(C0-C1)алкил-NH-C(О)NH-(C2C4)алкил необязательно замещены в пиридильном фрагменте метилом, -CF3 или 1-3 галогеновыми заместителями;R27 представляет собой водород или (С 1-С 4)алкил, необязательно замещенный 1-6 атомами фтора,или R26 и R27, взятые вместе с атомом азота, к которому они присоединены, образуют Het1;R28 представляет собой (C1-C8)алкил, необязательно замещенный 1-6 атомами фтора, (С 3-С 8)циклоалкил (С 0-С 3)алкил, тетрагидропиран-3-ил (С 0-С 3)алкил, тетрагидропиран-4-ил(С 0-С 3)алкил, тетрагидрофуранил(С 0-С 3)алкил, Ph1-(C0-C2)н-алкил или Ar2-(С 0-С 2)н-алкил, указанные Ph1-(C0-C2)-н-алкил и Ar2(С 0-С 2)-н-алкил необязательно замещены по алкильному фрагменту, если он присутствует, (C1 С 3)алкилом, диметилом или гем-этаном;R29 представляет собой водород или (C1-С 3)алкил;R30 представляет собой водород, (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора, (С 3 С 7)циклоалкил(С 0-С 3)алкил, Ph1-(C0-C3)алкил или Ar2(С 0-С 3)алкил,R31 представляет собой водород или (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора,или R30 и R31, взятые вместе с атомом азота, к которому они присоединены, образуют Het1, указанныйHet1 также необязательно замещен фенилом, дополнительно необязательно замещенным 1-3 галогеновыми заместителями;R32 и R33, каждый независимо, представляет собой водород или (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора, или R32 и R33, взятые вместе с атомом азота, к которому они присоединены,образуют Het1, или R32 представляет собой Ph1(C0-C1)алкил, при условии, что R33 представляет собой водород;Ar1 представляет собой ароматический гетероциклический заместитель, выбранный из группы, состоящей из фуранила, тиофенила, тиазолила, оксазолила, изоксазолила, пиридила и пиридазинила, любой из которых может быть необязательно замещен 1-3 заместителями, независимо выбранными из группы,состоящей из галогена, (C1-С 3)алкила, (C1-С 3)алкокси, -CF3, -O-CF3, нитро, циано и трифторметилтио;Ar2 представляет собой ароматический гетероциклический заместитель, выбранный из группы, состоящей из пирролила, пиразолила, имидазолила, 1,2,3-триазолила, 1,2,4-триазолила, фуранила, оксазолила, изоксазолила, 1,2,3-оксадиазолила, 1,2,4-оксадиазолила, 1,3,4-оксадиазолила, тиофенила, тиазоли-4 011011 ла, изотиазолила, 1,2,3-тиадиазолила, 1,3,4-тиадиазолила, пиридила, пиридазинила и бензимидазолила,любой из которых может быть необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, где пиридил и пиридазинил также необязательно могут быть замещены (C1-С 6)алкиламино, дополнительно необязательно замещенным 1-6 атомами фтора, (С 3-С 7)циклоалкил(С 0-С 3)алкилом или (С 3-С 7)циклоалкил(С 0-С 3)алкиламино;Het1 представляет собой насыщенный азотсодержащий гетероциклический заместитель, выбранный из группы, состоящей из азетидинила, пирролидинила, пиперидинила, гомопиперидинила, морфолинила,тиоморфолинила, гомоморфолинила и гомотиоморфолинила, любой из которых необязательно может быть замещен (C1-С 6)алкилом или двумя метильными заместителями;Het2 представляет собой насыщенный кислородсодержащий гетероциклический заместитель, выбранный из группы, состоящей из тетрагидрофуранила и тетрагидрофуранила, любой из которых необязательно может быть замещен (C1-С 6)алкилом или двумя метильными заместителями;Ph1 представляет собой фенил, необязательно замещенный 1-5 независимо выбранными галогеновыми заместителями или 1-3 заместителями, независимо выбранными из группы, состоящей из галогена,циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6) алкокси, дополнительно необязательно замещенного 1-6 атомами фтора;a) 1-5 независимо выбранными галогеновыми заместителями илиb) 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3,нитро, гидрокси, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6) алкокси, дополнительно необязательно замещенного 1-6 атомами фтора; илиc) 0, 1 или 2 заместителями, независимо выбранными из группы, состоящей из галогена, циано,-SCF3, метила, -CF3, метокси, -OCF3, нитро и гидрокси, вместе с одним заместителем, выбранным из группы, состоящей из:i) (C1-C10)алкила, дополнительно необязательно замещенного 1-6 атомами фтора или монозамещенного гидрокси, (C1-C6)алкокси, (С 3-С 7)циклоалкил(С 0-С 3)алкилокси, Het2-(C0-C3)алкилокси, Ph1-(С 0-С 3) алкилокси,ii) (C1-C10)алкокси-(С 0-С 3)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и необязательно дополнительно замещенного гидрокси,iii) (C1-С 6)алкил-С(О)-(С 0-С 5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,iv) карбокси,v) (C1-C6)алкоксикарбонила, дополнительно необязательно замещенного 1-6 атомами фтора,vi) (C1-C6)алкил-С (О)-(С 0-С 3)-O-, дополнительно необязательно замещенного 1-6 атомами фтора,vii) (C1-С 6)алкилтио-(С 0-С 5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,viii) (C1-С 6)алкилсульфинил-(С 0-С 5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,ix) (C1-С 6)алкилсульфонил-(С 0-С 5)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,х) (C1-С 6)алкилсульфонил-(С 0-С 3)алкил-О-, дополнительно необязательно замещенного 1-6 атомами фтора,xi) (C3-C7)циклоалкил(С 0-С 3)алкила, необязательно, дополнительно замещенного в циклоалкильном фрагменте 1-4 заместителями, выбранными из метила и фтора,xii) (C3-C7)циклоалкил(С 0-С 3)алкил-О-, необязательно, дополнительно замещенного в циклоалкильном фрагменте 1-4 заместителями, выбранными из метила и фтора,xiii) (C3-C7)циклоалкил(С 0-С 3)алкил-С(О)-,xiv) (C3-C7)циклоалкил(С 0-С 3)алкил-О-С(О)-,xv) (C3-C7)циклоалкил(С 0-С 3)алкил-S-,xvi) (C3-C7)циклоалкил(С 0-С 3)алкил-S(О)-,xvii) (C3-C7)циклоалкил(С 0-С 3)алкил-S(О)2-,xviii) Ph1-(C0-C3)алкила, необязательно замещенного в алкильном фрагменте 1-2 атомами фтора,xix) Ph1-(С 0-С 3)алкил-О-, необязательно замещенного в алкильном фрагменте 1-2 атомами фтора,xx) Ph1-(С 0-С 3)алкил-С(О)-,xxi) Ph1-(С 0-С 3)алкил-О-С(О)-,xxii) Ph1-(C0-C3)алкил-С (О)-(C0-C3)алкил-О-,xxiii) Ph1-(C0-C3)алкилтио,xxiv) Ph1-(C0-C3)алкилсульфинила,xxv) Ph1-(C0-C3)алкилсульфонила,xxvi) Ar2(C0-C3)алкила,xxvii) Ar2(C0-C3)алкил-О-,-5 011011xliv) HON=C(Ph1)-,или его фармацевтически приемлемая соль. Изобретение также обеспечивает фармацевтические композиции, которые содержат соединение формулы I или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом. В другом аспекте данного изобретения обеспечен способ повышения активации рецептора 5-HT2C у млекопитающих, включающий введение млекопитающему, нуждающемуся в такой активации, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Данное изобретение также обеспечивает способ лечения ожирения у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Данное изобретение также обеспечивает способ лечения обсессивно-компульсивного расстройства у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Кроме того, данное изобретение обеспечивает способ лечения депрессии у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В предпочтительных вариантах воплощения перечисленных выше способов лечения, используемых соединение формулы I или его фармацевтически приемлемую соль, млекопитающим является человек. В другом аспекте данного изобретения обеспечивается соединение формулы I для применения в избирательно повышенной активации рецептора 5-HT2C и/или для применения при лечении разнообразных расстройств, связанных с пониженной активацией рецепторов 5-HT2C. Предпочтительные варианты воплощения данного аспекта изобретения включают соединение формулы I для применения при лечении ожирения, гиперфагии, обсессивно-компульсивного расстройства, депрессии, тревоги, злоупотребления веществами, вызывающими привыкание и пристрастие, расстройства сна, приливов и/или гипогонадизма. Особенно предпочтительные варианты воплощения данного аспекта изобретения включают лечение ожирения, обсессивно-компульсивного расстройства, депрессии и/или тревоги. В другом аспекте данного изобретения обеспечивается применение одного или более соединений формулы I для получения лекарственного средства для активации 5-HT2C рецепторов у млекопитающего. В предпочтительных вариантах воплощения данного аспекта изобретения обеспечивается применение одного или более соединений формулы I в получении лекарственного средства для лечения ожирения,гиперфагии, обсессивно-компульсивного расстройства, депрессии, тревоги, злоупотребления веществами, вызывающими привыкание и пристрастие, расстройства сна, приливов, и/или гипогонадизма. Особенно предпочтительные варианты воплощения данного аспекта изобретения включают применение одного или более соединений формулы I для получения лекарственного средства для лечения ожирения,обсессивно-компульсивного расстройства, депрессии и/или тревоги. Кроме того, данное изобретение обеспечивает фармацевтическую композицию, адаптированную для лечения ожирения или для лечения обсессивно-компульсивного расстройства, или для лечения депрессии, или для лечения тревоги, каждая из которых включает соединение формулы I в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом. В тех случаях, когда расстройства, которые можно лечить агонистами 5-HT2C, известны из существующих и признанных классификаций, их классификация может быть найдена в различных источниках. Например, в настоящее время четвертое издание Diagnostic and Statistical Manual of Mental Disorders(DSM-IV)(1994, American Psychiatric Association, Washington, D.C.), обеспечивает диагностический инструмент для идентификации многих из описанных в данном описании расстройств. Также International Classification of Diseases, Tenth Revision (ICD-10), обеспечивает классификацию для многих из пе-6 011011 речисленных в данном описании расстройств. Специалисту в данной области будет понятно, что существуют альтернативные номенклатуры, нозологии и системы классификации описанных в данном описании расстройств, включая описанные в DSM-IV и ICD-10, и что терминология и системы классификации эволюционируют с научным прогрессом медицины. Используемые в данном описании общепринятые химические термины имеют обычное значение. Например, термин алкил означает разветвленную или неразветвленную насыщенную углеводородную группу. Термин "н-алкил" означает неразветвленную алкильную группу. Для иллюстрации, но, не ограничиваясь ими, термин "(C1-С 2)алкил" означает метил и этил. Термин "(C1-C3)-н-алкил" означает метил,этил и пропил. Термин "(C1-С 3)алкил" означает метил, этил, пропил и изопропил. Термин (С 1-С 4)-налкил означает метил, этил, н-пропил и н-бутил. Термин (С 1-С 4)алкил означает метил, этил, пропил,изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин (С 1-С 6)алкил означает все разветвленные и неразветвленные алкильные группы, содержащие от одного до шести атомов углерода. Термин(C3-С 6)алкил означает все разветвленные и неразветвленные алкильные группы, содержащие от трех до шести атомов углерода. Термин (C2-С 6)алкил означает все разветвленные и неразветвленные алкильные группы, содержащие от двух до шести атомов углерода.(Сх-Су)алкил может также применяться в соединении с другими заместителями для обозначения разветвленного или неразветвленного углеводородного связующего фрагмента для заместителя, где х и у показывают интервал количества атомов углерода, допустимых в связующем фрагменте. Для иллюстрации, но, не ограничиваясь ими, -(C0-C1)алкил означает одинарную связь или метиленовый связующий фрагмент; -(С 0-С 2)алкил означает одинарную связь, метиленовый, метилметиленовый или этиленовый связующий фрагмент; -(С 0-С 3)алкил дополнительно включает триметилен, альфа- или бета-метилэтилен или зтилметилен. -(C1-С 2)алкил, -(C1-С 3)алкил, -(С 1-С 4)алкил и -(C1-С 6)алкил означает разветвленный или неразветвленный алкиленовый связующий фрагмент, содержащий 1-2, 3, 4 или 6 атомов углерода, соответственно. Термин "алкенил" означает разветвленную или неразветвленную ненасыщенную углеводородную группу. Для иллюстрации, но, не ограничиваясь ими, термин "(С 2-С 6)алкенил" означает разветвленную или неразветвленную углеводородную группу, содержащую от 2 до 6 атомов углерода и 1 или более двойных связей углерод-углерод. Аллил означает пропил-2-ен-1-иловый фрагмент (СН 2=СН-СН 2-). Термин "(С 3-С 7)циклоалкил" означает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Циклоалкилалкил означает циклоалкильный фрагмент, присоединенный через разветвленный или неразветвленный алкиленовый связующий фрагмент, например, но, не ограничиваясь ими, -СН 2-,-СН 2 СН 2-, -СН(СН 3)-, -CH2CH2CH2-, -СН 2 СН(СН 3)-, -СН(СН 3)СН 2-, -СН(СН 2 СН 3)- и т.п.(С 3-С 7)циклоалкил (C0-C1, 2 или 3)алкил означает циклоалкил, связанный через одинарную связь (т.е. С 0-3 алкил)или алкиленовый связующий фрагмент. Каждая алкильная, циклоалкильная и циклоалкилалкильная группа может быть необязательно замещена, как указано в данном описании. Термины "алкокси", "фенилокси", "сульфонилокси" и "карбонилокси" означают алкильную группу,фенильную группу, сульфонильную группу или карбонильную группу, соответственно, которая присоединена через атом кислорода. Термины "алкилтио", "трифторметилтио", "циклоалкилтио" ("циклогексилтио"), "фенилтио" и "фуранилтио" означают алкильную группу, трифторметильную группу, циклоалкильную (циклогексильную)группу, фенильную группу или фуранильную группу, соответственно, которая присоединена через атом серы. Термины "алкилкарбонил", "алкоксикарбонил", "фенилкарбонил" и "фенилоксикарбонил" означают алкильную, алкоксильную, фенильную или фенилоксигруппу, присоединенную через карбонильный фрагмент. Термин "алкилкарбонилокси" означает алкилкарбонильную группу, присоединенную через атом кислорода. Термины "(С 1-С 6)алкилсульфинил", "Ph1-(С 0-С 3)алкилсульфинил" и "Ar2-(С 0-С 3)алкилсульфинил" означают, соответственно, алкильную, Ph1-(С 0-С 3)алкильную или Ar2-(С 0-С 3)алкильную группу, присоединенную через сульфинильный фрагмент (-SO-). Термины "алкилсульфонил" (трет-бутилсульфонил), "(С 3-С 7)циклоалкилсульфонил", "фенилсульфонил", "Ph1-(С 0-С 3)алкилсульфонил" и "Ar2-(С 0-С 3)алкилсульфонил" означают алкильную (трет-бутил),(С 3-С 7)циклоалкильную, фенильную, Ph1-(С 0-С 3)алкильную или Ar2-(С 0-С 3)алкильную группу, присоединенную через сульфонильный фрагмент (-SO2-). Термин "фениламино" означает фенильную группу, присоединенную через атом азота. Термин "N-связанный" означает, что указанный фрагмент присоединен через входящий в него атом азота, например, но, не ограничиваясь ими, N-связанный Het1 означает, что фрагмент Het1 присоединен через атом азота в кольце фрагмента Het1, и N-связанный Ar2 означает, что фрагмент Ar2 присоединен через атом азота в кольце фрагмента Ar2. Термин "галоген" означает фтор, хлор, бром или йод. Предпочтительные галогеновые группы представляют собой фтор, хлор и бром. Более предпочтительные галогеновые группы представляют собой-7 011011 фтор и хлор. Термин "гетероцикл" употребляется для обозначения насыщенного или ненасыщенного 4-7 членного кольца, содержащего 1-3 гетероатома, выбранных из азота, кислорода и серы, где указанное кольцо необязательно конденсировано с бензольным кольцом. Примеры насыщенных гетероциклов для целей данного изобретения включают азетидинил, пирролидинил, пиперидинил, гомопиперидинил, тетрагидрофуранил, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперазинил и т.п. Примеры ненасыщенных гетероциклов, но, не ограничиваясь ими, пирролил, пиразолил, имидазолил, 1,2,3-триазолил,1,2,4-триазолил, фуранил, оксазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4 оксадиазолил, тиофенил, тиазолил, изотиазолил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил,пиридил, пиридазинил и т.п. Примеры гетероциклических колец, конденсированных с бензольным кольцом, включают, но, не ограничиваясь ими, индолил, дигидроиндолил, индазолил, бензизоксазолил, бензимидазолил, бензофуранил, дигидробензофуранил, бензоксазолил, бензо[1,3]диоксолил, бензотиофенил,бензотиазолил, хинолинил, изохинолинил, бензопиранил, дигидробензопиранил, циннолинил, хиназолинил и т.п., все из которых необязательно могут быть замещены, как указано в данном описании, что также включает необязательное замещение бензольного кольца, если гетероцикл конденсирован с бензольным кольцом. В одном варианте воплощения предпочтительные гетероциклы включают пирролидинил, пиперидинил, гомопиперидинил, тетрагидрофуранил, тетрагидропиранил, пирролил, пиразолил, имидазолил,фуранил, изоксазолил, 1,2,4-оксадиазолил, тиофенил, тиазолил, 1,2,3-тиадиазолил, пиридил, пиридазинил, индолил, дигидроиндолил, бензимидазолил, бензофуранил, дигидробензофуранил, бензоксазолил,бензо[1,3]диоксолил, бензотиофенил, бензотиазолил, хинолинил, изохинолинил и бензопиранил, все из которых могут быть необязательно замещены, как описано в данном описании. Еще в одном варианте воплощения предпочтительные гетероциклы включают пиридил, пиридазинил и тиофенил. Термины "гем-", "геминальный" или "геминат" означают два идентичных заместителя, присоединенных к общему атому углерода, например, но без ограничения, гем-метил означает две метильные группы, присоединенные к общему атому углерода, как например, в 3,3-диметилтетрагидробензофуранильной группе. Для целей данного изобретения, гем-этан означает этиленовый заместитель, где оба атома углерода присоединены к одному и тому же атому углерода замещенной группы с образованием циклопропильного фрагмента, например, но без ограничения, этановый заместитель в 2-фенил-(1,1 этан)этиламиновой группе ниже: Следует понимать, что если базовое определение группы перечисляет необязательно допустимые заместители и в другом случае указано, что группа необязательно может быть замещена другими вышеуказанными заместителями, то эти вышеуказанные заместители следует добавить к списку возможных необязательных заместителей, приведенному в базовом определении группы. И наоборот, если в другом месте указано, что группа альтернативно необязательно замещена другими перечисленными заместителями, то этими другими перечисленными заместителями следует заменить перечень возможных необязательных заместителей, приведенный в базовом определении заместителя. Например, но без ограничения,Ar2 имеет базовое определение, где указано, что любая из перечисленных гетероароматических групп может быть "необязательно замещена 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора,и (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора, где пиридил и пиридазинил, также необязательно могут быть замещены(C1-С 6)алкиламино, необязательно дополнительно замещенным 1-6 атомами фтора, (С 3-С 7)циклоалкил(С 0-С 3)алкилом или (С 3-С 7)циклоалкил(С 0-С 3)алкиламино". Это следует понимать, как то, что любая из перечисленных гетероароматических групп необязательно может быть замещена [1-3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6)алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и(C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора], и что если Ar2 представляет собой пиридил или пиридазинил, перечень заместителей, выбранных из 1-3 заместителей, расширяется, а также включает [(С 1-С 6)алкиламино, который дополнительно необязательно замещен 1-6 атомами фтора, (С 3-С 7)циклоалкил(С 0-С 3)алкил и (С 3-С 7)циклоалкил(С 0-С 3)алкиламино]. Подобным образом, в определении R14, выражение "гдеAr2, если Ar2 представляет собой пиридил, то R14 также необязательно может быть замещен фенил-СН=СН- или фенил-СС-" следует понимать как то, что перечень заместителей, которые могут быть выбраны для 1-3 возможных необязательных заместителей при Ar2,представляющим собой пиридил, дополнительно расширяется и включает [фенил-СН=СН- или фенилСС-]. И наоборот, позднее в определении R14, выражение "где, если Ar2 представляет собой пиридил,то пиридил альтернативно необязательно может быть замещен R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или может быть замещен 1-2-8 011011 галогеновыми заместителями", следует понимать как то, что если R14 выбран таким образом, что Ar2 представляет собой пиридил, то перечень 1-3 возможных необязательных независимо выбранных заместителей в базовом определении Ar2 может быть дополнен превалирующим "R28R29N-C(О)- и необязательно дополнительно замещен одним метильным, -CF3, циано или -SCF3 заместителем или может содержать 1-2 галогеновых заместителя". Термин аминозащитная группа в данном описании означает заместитель, который обычно используется для блокирования функциональной аминогруппы при проведении реакций с другими функциональными группами в соединении. Примеры аминозащитных групп включают формильную группу,тритильную группу, ацетильную группу, трихлорацетильную группу, трифторацетильную группу, хлорацетильную, бромацетильную и йодацетильную группы, блокирующие группы карбамоильного типа,такие как бензилоксикарбонил, 9-фторенилметоксикарбонил (FMOC), трет-бутоксикарбонил (t-BOC)и подобные аминозащитные группы. Виды используемых аминозащитных групп не являются критичными,при условии, что замещенная аминогруппа стабильна в условиях последующих реакций по другим положениям молекулы и защитная группа может быть удалена в надлежащей точке без разрушения остальной части молекулы. Выбор и применение (присоединение и последующее удаление) аминозащитных групп, хорошо известно специалисту в данной области. Дополнительные примеры групп, которые обозначаются описанными выше терминами, приведены в издании T.W. Greene и P.G.M. Wuts, "ProtectiveGroups in Organic Synthesis", 3rd edition, John Wiley и Sons, New York, NY, 1999, глава 7, которое далее упоминается как "Greene". Термин фармацевтический или фармацевтически приемлемый в данном описании как прилагательное, означает в существенной мере нетоксичный и в существенной мере безвредный для реципиента. Термин фармацевтическая композиция дополнительно означает, что включенный носитель, растворитель, эксципиенты и/или соль должны быть совместимы с активным ингредиентом композиции(например, соединением формулы I). Специалистам в данной области будет понятно, что термины фармацевтическая рецептура и фармацевтическая композиция в основном являются взаимозаменяемыми и таким способом они используются для целей данного изобретения. Термин эффективное количество означает количество соединения формулы I, способное активировать рецепторы 5-HT2C и/или оказать данное фармакологическое действие. Термин подходящий растворитель означает любой растворитель, смесь растворителей, инертных к проводимой реакции, которые эффективно растворяют реактивы с обеспечением среды, в которой осуществляется целевая реакция. Следует понимать, что соединения по данному изобретению могут существовать в виде стереоизомеров. Все такие энантиомеры, диастереомеры и их смеси включены в объем данного изобретения. Если специфические стереохимические вещества идентифицируются в данном описании, используются обозначения Кана-Прелога-Ингольда (Cahn-Prelog-Ingold) (R)- и (S)-, а также цис-транс-обозначения относительной стереохимии для обозначения специфических изомеров и относительной стереохимии. Известное оптическое вращение обозначается (+) и (-)для правовращающих и левовращающих, соответственно. Если хиральное соединение разделено на изомеры, но абсолютные конфигурации или оптическое вращение не определяли, изомеры произвольно обозначены как изомер 1, изомер 2 и т.д. Хотя все энантиомеры, диастереомеры и их смеси включены в объем данного изобретения, предпочтительные варианты воплощения представляют собой отдельные энантиомеры и отдельные диастереомеры. Специалисту в данной области в целом будет понятно, что соединения, предназначенные для применения в фармацевтических композициях, как правило, но не всегда, будут переведены в форму соли с целью оптимизации таких параметров, как легкость в обращении, стабильность, фармакокинетические свойства и/или биодоступность и т.д. Способы превращения соединения в данную соль хорошо известны в данной области (см., например, Berge, S.M., Bighley, L.D., and Monkhouse, D.C., J. Pharm. Sci., 66:1,(1977. Если соединения по данному изобретению представляют собой амины и, таким образом, являются основными по своей природе, они легко реагируют с широким спектром фармацевтически приемлемых органических и неорганических кислот с образованием фармацевтически приемлемых кислотноаддитивных солей. Такие соли также представляют собой варианты воплощения изобретения. Конкретные неорганические кислоты, которые используются для образования таких солей, включают хлористо-водородную, бромисто-водородную, йодисто-водородную, азотную, серную, фосфорную,гипофосфорную, метафосфорную, пирофосфорную кислоту и т.п. Также могут использоваться соли, полученные с органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты. Такие фармацевтически приемлемые соли, таким образом, включают хлорид, бромид, йодид, нитрат, ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, изобутират, фенилбутират, гидроксибутират, бутин-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, капрат, каприлат, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат,манделат, никотинат, изоникотинат, оксалат, фталат, терефталат, пропионат, пропиолят, фенилпропио-9 011011 нат, салицилат, себакат, сукцинат, суберат, бензолсульфонат, п-бромбензолсульфонат, хлорбензолсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат (мезилат), нафталин-1-сульфонат,нафталин-2-сульфонат, нафталин-1,5-сульфонат, п-толуолсульфонат, ксиленсульфонат, тартрат и т.п. Хорошо известно, что такие соединения могут образовывать соли в различных молярных соотношениях с кислотой для обеспечения, например, геми-кислотной, монокислотной, дикислотной соли и т.п. Если в методике образования соли кислоту добавляют в специфическом стехиометрическом соотношении, если не используют аналитических методов для подтверждения состава, предполагается, но точно не известно, что соль образуется в таких молярных соотношениях. Такие термины как (кислота) следует понимать как то, что молярное соотношение образовавшейся соли точно не известно и его нельзя предположить, как, например, не ограничиваясь ими, в случае (HCl)x и (метансульфоновая кислота). Используемые в данном описании сокращения определены следующим образом: 2 В-3 этанол означает этанол, денатурированный толуолом.AIBN означает 2,2'-азобисизобутиронитрил. Теоретически вычислено означает вычисленные данные элементного анализа.APCI означает химическую ионизацию атмосферного давления. Ткип означает температуру кипения."Вос" или "t-Boc" означает трет-бутоксикарбонил. Рассол означает насыщенный водный раствор хлорида натрия.CV означает тепловой коэффициент кислорода.DCE означает 1,2-дихлорэтан. ДХМ означает дихлорметан (т.е., метиленхлорид, CH2Cl2).EDTA означает этилендиаминотетрауксусную кислоту. ЕЕ означает расход энергии.GTP [35S] означает трифосфат гуанозина, у которого концевой фосфат содержит на 35S вместо кислорода.HATU означает гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония. НМРА означает гексаметилфосфорамид. НОВТ означает 1-гидроксибензотриазолгидрат. ВЭЖХ означает высокоэффективную жидкостную хроматографию. МСВР означает масс-спектрометрия высокого разрешения."ISPA" означает пробу иммуноадсорбционной контактной люминесценции.m-СРВА означает мета-хлорпероксибензойную кислоту. Тпл означает температуру плавления."Ms" в химической структуре означает метансульфонильный фрагмент (-SO2CH3). МС (ES+) означает масс-спектроскопию с использованием ионизации электрораспылением. МТВЕ означает метил-трет-бутиловый эфир.NMP означает 1-метил-2-пирролидинон. ЯМР означает ядерный магнитный резонанс."Pd/C" означает палладий на активированном угле."SCX хроматография" означает хроматографию на SCX колонке или картридже."SCX колонка" или "SCX картридж" в данном описании означает колонку, заполненную смолой для интенсивного катионного обмена Varian Bond Elute на основе кремния диоксида, одноразовый картридж или эквивалент;"Tf" в химической структуре означает трифторметансульфонильный фрагмент (-SO2CF3). ТФУ означает трифторуксусную кислоту. ТГФ означает тетрагидрофуран. ТСХ означает тонкослойную хроматографию. Хотя все соединения по настоящему изобретению являются полезными в качестве агонистов 5HT2C, определенные классы являются предпочтительными, как, например, соединения, содержащие одну из следующих пронумерованных комбинаций заместителей: соединения, где 1) R7 представляет собой галоген; 2) R7 представляет собой хлор; 3) R7 представляет собой (С 1-С 6)алкил, необязательно замещенный 1-6 атомами фтора; 4) R7 представляет собой (С 1-С 3)алкил, необязательно замещенный 1-6 атомами фтора; 5) R7 представляет собой -CF3; 6) R7 представляет собой (C3-С 6)алкенил, необязательно замещенный 1-6 атомами фтора; 7) R7 представляет собой (C3-С 6)алкенил; 8) R7 представляет собой циано; 9) R1-5 каждый представляет собой водород; 10) R4 представляет собой метил или этил; 11) R4 представляет собой метил; 12) R3 представляет собой метил; 13) R8 представляет собой водород; 14) R9 представляет собой (C1-С 3)алкокси; 15) R9 представляет собой метокси; 16) R9 представляет собой галоген; 17) R9 представляет собой хлор; 18) R6 представляет собой -CC-R10; 19) R10 представляет собой Ph1-(С 0-С 3)алкил; 20) R10 представляет собой Ph1-(C1-C2)алкил; 21) R10 представляет собой фенил (С 0-С 3)алкил; 22) R10 представляет собой (С 3-С 7)циклоалкил(С 0-С 3)алкил; 23) R10 представляет собой (С 3-С 7)циклоалкилметил; 24) R10 представляет собой (С 4-С 6)алкил; 25) R10 представляет собой разветвленный (С 4-С 6)алкил; 26) R10 представляет собой (C1-С 6)алкил, замещенный двумя-шестью атомами фтора; 27) R10 представляет собой Ar1-(С 0-С 3)алкил; 28) R10 представляет собой Ar1-(C1-С 2)алкил; 29) R6 представляет собой -O-R12; 30) R12 представляет собой Ph2-(C0-C3)алкил; 31) R12 представляет собой Ph2-(C1-C2)алкил; 32) R12 представляет собой Ph2-(C1-C2)алкил и Ph2 содержит 1-3 галогеновых заместителей; 33) R12 представляет собой Ph2-(C1-C2)алкил и Ph2 содержит 1-3 атомов фтора; 34) R12 представляет собой Ph2-(C1-C2)алкил и Ph2 замещен циано; 35) R12 представляет собой Ph2-(C1-C2)алкил и Ph2 замещен R30R31N-S(O)2-; 36) R12 представляет собой Ph2-(C1-C2)алкил, Ph2 замещен R30R31N-S(O)2-, R30 представляет собой(C1-C3)алкил, необязательно дополнительно замещенный 1-3 атомами фтора, и R31 представляет собой водород; 37) R12 представляет собой Ar2-(С 0-С 3)алкил; 38) R12 представляет собой Ar2-(C1-C2)алкил; 39) R12 представляет собой Ar2-(C1-C2)алкил и Ar2 представляет собой пиридил, тиазолил, оксазолил или пиразолил, каждый из которых необязательно замещен метилом; 40) R12 представляет собой бензазолил-(C1-С 3)алкил; 41) R12 представляет собой Ph2-C(О)-(C1-С 3)алкил,42) R12 представляет собой Ph2-C(O)-(С 1-С 3)алкил и Ph2 замещен 1-3 галогеновыми заместителями; 43) R12 представляет собой Ph2-C(О)-(C1-С 3)алкил и Ph2 содержит 1-3 атомов фтора; 44) R12 представляет собой Ph1-S(O)2-; 45) R12 представляет собой (C1-С 6)алкил-O-С(О)-(С 3-С 6)алкил; 46) R12 представляет собой (C1-С 3)алкил-O-С(О)-(C3-С 6)алкил; 47) R12 представляет собой R13-C(О)NH-(С 2-С 4)алкил; 48) R12 представляет собой R13-C(O)NH-(С 2-С 4)алкил и R13 представляет собой Ph1; 49) R12 представляет собой R13-C(O)NH-(C2-C4)алкил, R13 представляет собой Ph1, замещенный 1-3 галогеновыми заместителями; 50) R12 представляет собой R13-C(O)NH-(C2-C4)алкил и R13 представляет собой (С 3-С 7)циклоалкил; 51) R12 представляет собой R13-C(O)NH-(C2-C4)алкил и R13 представляет собой пиридил;- 11011011 52) R12 представляет собой R13-C(O)NH-(C2-C4)алкил и R13 представляет собой (C1-С 3)алкокси; 53) R12 представляет собой R13-C(O)NH-(C2-C4)алкил и R13 представляет собой (С 3-С 7)циклоалкил; 54) R6 представляет собой -S-R14; 55) R6 представляет собой -S-R14 и R14 представляет собой Ph2; 56) R6 представляет собой -S-R14, R14 представляет собой Ph2, замещенный 1-3 галогеновыми заместителями; 57) R6 представляет собой -S-R14, R14 представляет собой Ph2, замещенный циано; 58) R6 представляет собой -S-R14, R14 представляет собой Ph2, замещенный циано и замещенный 1-2 галогеновыми заместителями; 59) R6 представляет собой -S-R14 и R14 представляет собой Ar2; 60) R6 представляет собой -S-R14, R14 представляет собой Ar2 и Ar2 необязательно замещен пиридилом или пиридазинилом; 61) R6 представляет собой -S-R14, R14 представляет собой Ar2 и Ar2 представляет собой необязательно замещенный тиофенил, тиазолил, изотиазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил; 62) R6 представляет собой -S-R14 и R14 представляет собой тетрагидрофуранил или тетрагидропиранил; 63) R6 представляет собой -S-R14 и R14 представляет собой тетрагидрофуранил или тетрагидропиранил, где тетрагидрофуранил или тетрагидропиранил замещен оксогруппой при атоме углерода, смежном с кислородом кольца; 64) R6 представляет собой -S-R14 и R14 представляет собой R15-L-; 65) L представляет собой (C1-С 2)алкилен; 66) L представляет собой разветвленный (С 2-С 3)алкилен; 67) L представляет собой метилметилен; 68) L представляет собой диметилметилен; 69) L представляет собой метилэтилен; 70) L представляет собой гем-диметилэтилен; 71) L представляет собой гем-этанэтилен; 72) R15 представляет собой Ph2; 73) R15 представляет собой Ph2, замещенный 1-3 галогеновыми заместителями; 74) R15 представляет собой Ph2, замещенный циано; 75) R15 представляет собой Ph2, замещенный (C1-С 6)алкокси; 76) R15 представляет собой Ph2, замещенный (С 1-С 6)алкокси, дополнительно необязательно замещенным 1-3 атомами фтора; 77) R15 представляет собой Ph2, замещенный (C1-С 6)алкокси(C1-C1)алкил; 78) R15 представляет собой Ph2, замещенный (C1-С 6)алкокси(C1-C1)алкилом, дополнительно замещенным 1-3 атомами фтора; 79) R15 представляет собой Ph2, замещенный (C1-C6)алкилтио; 80) R15 представляет собой Ph2, замещенный (C1-С 6)алкилтио, дополнительно необязательно замещенным 1-3 атомами фтора; 81) R15 представляет собой Ph2, замещенный (C1-С 6)алкилтио(C1-C1)алкилом; 82) R15 представляет собой Ph2, замещенный (C1-С 6)алкилтио(C1-C1)алкилом, дополнительно замещенным 1-3 атомами фтора; 83) R15 представляет собой Ph2, замещенный (С 3-С 7)циклоалкил (C0-C1)алкилом; 84) R15 представляет собой Ph2, замещенный (C1-С 6)алкилсульфонил(C0-C1)алкилом, дополнительно необязательно замещенным 1-3 атомами фтора; 85) R15 представляет собой Ph2, замещенный (C1-C6)алкилсульфинил(C0-C1)алкилом, дополнительно необязательно замещенным 1-3 атомами фтора; 86) R15 представляет собой Ph2, замещенный Ph1-(С 0-С 1)алкилсульфонилом; 87) R15 представляет собой Ph2, замещенный Ph1-(С 0-С 1)алкилом; 88) R15 представляет собой Ph2, замещенный R26R27N-; 89) R15 представляет собой Ph2, замещенный Het1; 90) R15 представляет собой Ph2, замещенный (C1-С 6)алкил-С(О)-, дополнительно необязательно замещенным 1-3 атомами фтора; 91) R15 представляет собой Ph2, замещенный (C1-C6)алкил-O-С(O)-, дополнительно необязательно замещенным 1-3 атомами фтора; 92) R15 представляет собой Ph2, замещенный Ph1; 93) R15 представляет собой Ph2, замещенный Ph1(C0-C3)алкил-О-; 94) R15 представляет собой Ph2, замещенный Ph1(C0-C3)алкил-С(O)-; 95) R15 представляет собой Ph2, замещенный Ph1(C0-C3)алкил-С(O)-; 96) R15 представляет собой Ph2, замещенный Ar2(C0-C3)алкил-С(O)-; 97) R15 представляет собой Ph2, замещенный Ar2(C0-C3)алкил-С(O)- и Ar2 представляет собой пиразолил, дополнительно необязательно замещенный, как указано для Ar2;Het , пиридилом или фенилом, необязательно дополнительно замещенным метилом, -CF3, циано, -SCF3 или замещенным 1-3 галогеновыми заместителями; 108) R15 представляет собой пирролил, пиразолил, имидазолил, 1,2,3-триазолил, 1,2,4-триазолил,фуранил, оксазолил, изоксазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, тиофенил,тиазолил, изотиазолил, 1,2,3-тиадиазолил или 1,3,4-тиадиазолил, любой из которых необязательно может быть замещен 1-3 заместителями, выбранными из группы, состоящей из галогена, циано, -SCF3, (C1-С 6) алкила, дополнительно необязательно замещенного 1-6 атомами фтора, и (C1-С 6)алкокси, дополнительно необязательно замещенного 1-6 атомами фтора; 109) R15 представляет собой пиридил, необязательно, дополнительно замещенный, как указано для 2Ar ; 110) R15 представляет собой тетрагидрофуранил или тетрагидропиранил, необязательно замещенный оксогруппой или одной или двумя группами, независимо выбранными из метила и -CF3; 111) R15 представляет собой тетрагидрофуранил или тетрагидропиранил, замещенный оксогруппой и дополнительно необязательно замещенный одной или двумя группами, независимо выбранными из метила и -CF3; 112) R15-L- представляет собой пирид-2-илметил; 113) R15-L- представляет собой пирид-3-илметил; 114) R15-L- представляет собой пирид-2-ил-СН(СН 3)-; 115) R15-L- представляет собой пирид-3-ил-СН(СН 3)-; 116) R15 представляет собой пиридазинил, необязательно дополнительно замещенный, как указано для Ar2; 117) R15-L- представляет собой пиридазин-2-илметил; 118) R15-L- представляет собой пиридазин-3-илметил; 119) R15-L- представляет собой пиридазин-2-ил-СН(СН 3)-; 120) R15-L- представляет собой пиридазин-3-ил-СН(СН 3)-; 121) R15 представляет собой пиридил, дополнительно замещенный (С 3-С 7)циклоалкил(С 0-С 2)алкилом, Het1, пиридилом или фенилом, необязательно дополнительно замещенным метилом, -CF3, циано,-SCF3 или замещенным 1-3 галогеновыми заместителями; 122) R15 представляет собой пиридазинил, дополнительно замещенный (С 3-С 7)циклоалкил(С 0 С 2)алкилом, Het1, пиридилом или фенилом, необязательно дополнительно замещенным метилом, -CF3,циано, -SCF3 или замещенным 1-3 галогеновыми заместителями; 123) R15 представляет собой R22-C(O)-; 124) R15 представляет собой R22-C(O)- и R22 представляет собой (C1-С 6)алкил, необязательно замещенный 1-6 атомами фтора; 125) R15 представляет собой R22-C(O)- и R22 представляет собой (C1-С 6)алкокси, необязательно замещенный 1-6 атомами фтора; 126) R15 представляет собой R22-C(O)- и R22 представляет собой (С 3-С 7)циклоалкил (С 0-С 3)алкил; 127) R15 представляет собой R22-C(O)- и R22 представляет собой (С 3-С 7)циклоалкил (С 0-С 3)алкил-О-; 128) R15 представляет собой R22-C(O)- и R22 представляет собой Ph1-(С 0-С 3)алкил; 129) R15 представляет собой R22-C(O)- и R22 представляет собой Ph1-(C0-C3)алкил-О- ; 130) R15 представляет собой R22-C(O)- и R22 представляет собой Ar2-(С 0-С 3)алкил; 131) R15 представляет собой R22-C(O)- и R22 представляет собой Ar2-(С 0-С 3)алкил-О-; 132) R15 представляет собой R22-C(O)- и R22 представляет собой R32R33N-; 133) R15 представляет собой фталимидо; 134) R15 представляет собой R17R18N-; 135) R15 представляет собой R17R18N- и R17 представляет собой (C1-С 3)алкокси-С(О)-; 136) R15 представляет собой R17R18N- и R17 представляет собой (С 3-С 7)циклоалкил(С 0-С 2)-С(О)-;- 13011011 137) R15 представляет собой R17R18N- и R17 представляет собой Ph1-(C0-C2)-C(O)-; 138) R15 представляет собой R17R18N- и R17 представляет собой Ar2-(С 0-С 2)-С(О)-; 139) R15 представляет собой R16O-; 140) R15 представляет собой R16O- и R16 представляет собой (C1-C6)алкил-С(О)-; 141) R15 представляет собой R16O- и R16 представляет собой (С 3-С 7)циклоалкил(С 0-С 2)-С(О)-; 142) R6 представляет собой R24R25N- и R24 представляет собой (C1-С 6)алкокси(С 2-С 5)алкил, необязательно замещенный 1-6 атомами фтора; 143) R6 представляет собой R24R25N- и R24 представляет собой (C1-C6)алкилтио(С 2-С 5)алкил, необязательно замещенный 1-6 атомами фтора; 144) R6 представляет собой R24R25N- и R24 представляет собой (С 3-С 7)циклоалкил(C0-C1)алкил-О(С 1-С 5)алкил; 145) R6 представляет собой R24R25N- и R24 представляет собой (С 3-С 7)циклоалкил(C0-C1)алкил-S(С 1-С 5)алкил; 146) R6 представляет собой R24R25N- и R24 представляет собой фенил(C1-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном; 147) R6 представляет собой R24R25N- и R24 представляет собой Ph2-(C1-C3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если таковой присутствует, (C1-С 3)алкилом, диметилом или гем-этаном; 148) R6 представляет собой R24R25N- и R24 представляет собой Ar2(С 0-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном; 149) R6 представляет собой R24R25N- и R24 представляет собой Ar2(С 0-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном, где Ar2 содержит атом азота и Ar2 является замещенным; 150) R6 представляет собой R24R25N- и R24 представляет собой Ar2(С 0-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном, где Ar2 содержит атом азота и Ar2 замещен (C1-С 6)алкокси, дополнительно необязательно замещенным 1-6 атомами фтора, (С 1-С 6)алкиламино, дополнительно необязательно замещенным 1-6 атомами фтора, или (С 3-С 7)циклоалкил (С 0-С 2)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора; 151) R6 представляет собой R24R25N- и R24 представляет собой Ar2(С 0-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном, где Ar2 представляет собой пиридил или пиридазинил и замещен (С 1-С 6)алкокси, дополнительно необязательно замещенным 1-6 атомами фтора, (С 1-С 6)алкиламино, дополнительно необязательно замещенным 1-6 атомами фтора, или (С 3-С 7)циклоалкил(С 0-С 2)алкилом, необязательно дополнительно замещенным 1-6 атомами фтора; 152) R6 представляет собой R24R25N- и R24 представляет собой Ar2 (С 0-С 3)-н-алкил, необязательно замещенный по н-алкильному фрагменту, если он присутствует, (C1-С 3)алкилом, диметилом или гемэтаном, где Ar2 представляет собой пиридил, замещенный R28R29N-C(O)-, и R28 представляет собой (С 3 С 7)циклоалкил (С 0-С 2)алкил или Ph1 и R29 представляет собой водород; 153) R6 представляет собой R24R25N- и R24 представляет собой Ar2(С 0-С 3)-н-алкил, где Ar2 представляет собой пиридил, замещенный R28R29N-C(О)-, и R28 представляет собой (С 3-С 7)циклоалкил или фенил,необязательно замещенный 1-3 атомами галогена, предпочтительно фтора, и R29 представляет собой водород; 154) R6 представляет собой R24R25N- и R24 представляет собой Ph1-(C0-C1)алкил-О-(C1-C5)алкил; 155) R6 представляет собой R24R25N- и R24 представляет собой Ph1-(C0-C1)алкил-S-(С 1-С 5)алкил; 156) R6 представляет собой R24R25N- и R24 представляет собой Ph1-(C0-C1)алкил-С(О)NH-(С 2-С 4)алкил; 157) R6 представляет собой R24R25N- и R24 представляет собой Ph1-(C0-C1)алкил-NH-C(О)NH-(С 2-С 4) алкил; 158) R6 представляет собой R24R25N- и R24 представляет собой пиридил-(C0-C1)алкил-С(О)NH-(С 2 С 4)алкил, необязательно замещенный в пиридильном фрагменте метилом, -CF3 или 1-3 галогеновыми заместителями; 159) R6 представляет собой R24R25N- и R24 представляет собой пиридил-(C0-C1)алкил-NH-C(O)NH(C2-C4)алкил, необязательно замещенный в пиридильном фрагменте метилом, -CF3 или 1-3 галогеновыми заместителями; 160) R6 представляет собой R24R25N- и R24 представляет собой Ar3-(C1-C2)алкил; 161) R6 представляет собой R24R25N- и R24 представляет собой Ar3-метил. Следует понимать, что описанные выше классы могут быть комбинированы с образованием дополнительных предпочтительных классов. Примеры комбинаций включают, но не ограничиваясь ими: 162) любое из предпочтительных вариантов воплощения 19)-161) (предпочтительные значения, вы- 14011011 бранные для R6), в сочетании с любым из предпочтительных вариантов воплощения 1)-9) (предпочтительные значения, выбранные для R7); 163) любое из предпочтительных вариантов воплощения 19)-161) (предпочтительные значения, выбранные для R6), где R7 представляет собой галоген; 164) любое из предпочтительных вариантов воплощения 19)-161) (предпочтительные значения, выбранные для R6), где R7 представляет собой хлор; 165) предпочтительная комбинация в соответствии с 162), 163) или 164), где R1-5 и R8 каждый представляет собой водород; 166) предпочтительная комбинация в соответствии с 162), 163) или 164), где каждый из R1-5, R8 и R9 представляет собой водород; 167) любое из предпочтительных вариантов воплощения 37), 38) или 39), где R7 не является водородом; 168) любое из предпочтительных вариантов воплощения 37), 38) или 39), где R9 представляет собой водород; 169) любое из предпочтительных вариантов воплощения 37), 38) или 39), где R7 не является водородом и R9 представляет собой водород; 170) любое из предпочтительных вариантов воплощения 37), 38) или 39), где R7 представляет собой хлор и R9 представляет собой водород; 171) соединения формулы (I), где R6 представляет собой -C=C-R10, где R10 выбран из значений, определенных в любом из вариантов воплощения 19)-28); 172) соединения формулы (I), где R6 представляет собой -O-R12, где R12 выбран из значений, определенных в любом из вариантов воплощения 30)-53); 173) соединения формулы (I), где R6 представляет собой -S-R14, где R14 выбран из значений, определенных в любом из вариантов воплощения 55)-63) или 64), где L выбран из значений, определенных в любом из вариантов воплощения 65)-71) и R15 выбран из значений, определенных в любом из вариантов воплощения 72)-141); 174) соединения формулы (I), где R6 представляет собой R24R25N-, где R24 выбран из значений, определенных в любом из вариантов воплощения 142)-161); 175) соединения в соответствии с воплощением 172), где R12 выбран из значений, определенных в любом из вариантов воплощения 37), 38) или 39); 176) соединения формулы (I), где R7 не является водородом; 177) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R7 не является водородом; 178) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R7 представляет собой хлор; 179) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R9 представляет собой водород; 180) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R9 представляет собой (C1-С 3)алкокси; 181) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R9 представляет собой метокси; 182) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R7 представляет собой хлор и R9 представляет собой водород; 183) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R7 представляет собой хлор и R9 представляет собой (C1-С 3)алкокси; 184) соединения в соответствии с любым из вариантов воплощения 171) или 174), где R7 представляет собой хлор и R9 представляет собой метокси; 185) соединения в соответствии с любым из вариантов воплощения 171) или 184), где R9 представляет собой водород; 186) соединения в соответствии с любым из вариантов воплощения 171) или 185), где R9 представляет собой (C1-С 3)алкокси; 187) соединения в соответствии с любым из вариантов воплощения 171) или 185), где R9 представляет собой метокси; 188) соединения в соответствии с любым из вариантов воплощения 171) или 187), где каждый изR1-5 представляет собой водород. В целом, если R6 представляет собой -S-R14, то R15-L- более предпочтительно представляет собой 14R . Если R14 или R15 представляет собой замещенный Ar2, то предпочтительным является замещение в пара-положении. Если L присутствует, особенно предпочтительными являются метилен и метилметилен. Особенно предпочтительный R15-L- представляет собой, если R15 представляет собой Ph2 и L представляет собой метилен. Также особенно предпочтительно, если R15 представляет собой Ph2 и L представляет собой метилен. Также особенно предпочтительно, если R15 представляет собой Ar2 и L представляет собой метилен. Также особенно предпочтительно, если R15 представляет собой Ar2 и L представляет собой- 15011011 метилметилен. Также в целом, если R6 представляет собой -NR24R25, то Ph2-(С 1-С 3)-н-алкил особенно предпочтителен, чем фенил(C1-C3)-н-алкил. Предпочтительными соединениями формулы (I) является такие, гдеR6 представляет собой -CC-R10, где R10 выбран из значений, определенных в любом из вариантов воплощения 19)-28); илиR6 представляет собой -O-R12, где R12 выбран из значений, определенных в любом из вариантов воплощения 30)-53); илиR6 представляет собой -S-R14, где R14 выбран из значений, определенных в любом из вариантов воплощения 55)-63) или варианте воплощения 64), где L выбран из значений, определенных в любом из вариантов воплощения 65)-71) и R15 выбран из значений, определенных в любом из вариантов воплощения 72)-111) и 121)-141) или R15-L- выбран из значений, определенных в любом из вариантов воплощения 112)-120); илиR6 представляет собой R24R25N-, где R24 выбран из значений, определенных в любом из вариантов воплощения 143)-161). Особенно предпочтительными соединениями формулы (I) являются такие, где R6 представляет собой 12-O-R , где R12 выбран из значений, определенных в любом из вариантов воплощения 37), 38) или 39). Кроме того, предпочтительными соединениями формулы (I) являются такие, где R7 не является водородом. В частности, R7 предпочтительно выбран из значений, определенных в любом из вариантов воплощения 1)-8). Более предпочтительно, R7 выбран из галогена (особенно хлор), (C1-С 3)алкила, необязательно замещенного 1-6 атомами фтора (особенно метила, этила, н-пропила или CF3), и циано. Особенно предпочтительными соединениями формулы (I) являются такие, где R7 представляет собой галоген и, в частности, где R7 представляет собой хлор. Предпочтительными соединениями формулы (I) являются такие, где R9 представляет собой (C1-С 3) алкокси, предпочтительно метокси, или галоген, предпочтительно хлор. Также предпочтительными являются такие соединения формулы (I), где R9 представляет собой водород. Особенно предпочтительными соединениями формулы (I) являются такие, где R7 не является водородом и R9 представляет собой водород, и наиболее предпочтительно, где R7 представляет собой хлор иR9 представляет собой водород. Другими предпочтительными соединениями формулы (I) являются такие, где R1 представляет собой водород. Также предпочтительными являются такие соединения формулы (I), где R2 представляет собой водород. Также предпочтительными являются такие соединения формулы (I), где R3 представляет собой водород или метил и особенно, где R3 представляет собой водород. Другой предпочтительный класс соединений формулы (I) представляет собой такие, где R4 представляет собой водород, метил или этил, особенно, где R4 представляет собой водород или метил и особенно, где R4 представляет собой водород. Предпочтительными являются такие соединения формулы, где R5 представляет собой водород. Также предпочтительными являются такие соединения формулы, где R8 представляет собой водород. Одна из предпочтительных групп соединений по данному изобретению представляет собой соединения, представленные формулой (Ia), и их фармацевтически приемлемые солиR7a представляет собой галоген и, особенно, хлор;R6 является таким, как определено для формулы (I). Конкретные предпочтительные соединения по данному изобретению представляют собой такие,которые описаны в примерах данного описания, включая свободные основания и фармацевтически приемлемые соли этих соединений. Предполагается, что предпочтительные определения различных заместителей, перечисленные в них, могут присутствовать по отдельности или в комбинации и, если не указано иное, применяются к родовой формуле (I) соединений по настоящему изобретению, а также к предпочтительным классам соединений, представленным формулой (Ia). Соединения по данному изобретению могут быть получены в соответствии со следующими схемами синтеза по способам, хорошо известным и признанным в данной области. Подходящие условия реак- 16011011 ции для отдельных стадий на указанных схемах хорошо известны в данной области и соответствующая замена растворителей и сореагентов находятся в компетенции специалиста в данной области. Подобным образом, предполагается, что полупродукты синтеза могут быть выделены и/или очищены с помощью различных методов, хорошо известных специалисту в данной области, которые являются необходимыми или желательными, и что часто будет возможно использовать различные полупродукты на следующих стадиях синтеза непосредственно без очистки или после незначительной очистки. Кроме того, специалисту в данной области будет понятно, что в некоторых обстоятельствах порядок введения фрагментов в молекулу не является критическим. Конкретный порядок стадий, необходимых для получения соединений формулы I, зависит от конкретного соединения, которое должно быть синтезировано, исходного соединения и относительных помех со стороны замещенных фрагментов, как это хорошо понятно среднему специалисту в данной области. Все заместители, если не указано иное, были определены заранее и все реактивы хорошо известны и исследованы в данной области. Соединения формулы I, где R6 представляет собой связанный с ацетиленом заместитель, могут быть получены, как показано на схеме I, где Pg представляет собой подходящую защитную группу для вторичного амина, такую как, но, не ограничиваясь ими, 2,2,2-трифторацетил или трет-бутоксикарбонил, и где заместители R1, R2, R4, R5, R7, R8, R9 и R10 являются такими, как определено выше. Схема I Смешивают 6-трифлаты 2,3,4,5-тетрагидро-1H-бензо[d]азепинов (а) с соответствующим образом замещенным ацетиленом, подходящей смесью катализаторов палладий/медь в растворителе, конкретно ДМФА, с использованием триэтиламина в качестве основания, и нагревают, с получением требуемого соединения (b). Реакция снятия защиты и стандартные методы экстрагирования и хроматографии дают целевое соединение (Ia). Подходящие 6-трифлаты 2,3,4,5-тетрагидро-1H-бензо[d]азепинов (а) могут быть получены, как показано на схеме II. Соединение (а) может быть получено из 1-нафтола. 1-Нафтол может быть превращен в 5-гидрокси-1,4-дигидронафталин (с) восстановлением по Бирху с использованием аммиака и металлического лития при низкой температуре. Метилирование 6-гидроксигруппы дает соединение (d). Озонолиз соединения (d) и последующее восстановление боргидридом натрия дает диол (е). После превращения двух гидроксильных групп в две хорошо уходящие группы, например, метансульфонатные, соединение(f) циклизуют в 6-метокси-2,3,4,5-тетрагидро-1H-бензо[d]азепины (g) с водным аммиаком под давлением. Защищают азот кольца с помощью разнообразных алкилгалогенидов, хлорангидридов или ангидридов, таких как трифторуксусный ангидрид, с получением соединения (h). Далее превращают метиловый эфир (h) в фенол (i) с помощью BBr3 в дихлорметане или других способов, хорошо известных из литературы [см., например, Greene and Wuts, Protective Groups в Organic Synthesis, 3rd Ed., John Wiley and sons,Chapter III, New York (1999)]. Введение функциональных групп в ароматическое кольцо с помощью заместителей R7, R8 и R9 хорошо известно в данной области и в большой степени зависит от желаемого замещения. Последующее трифторметансульфонирование 6-гидроксигруппы соединения (j) дает требуемые 2,3,4,5-тетрагидро-2Hбензо[d]азепины (а). Схема II- 17011011 Альтернативно, соединение (g) может быть получено из 1,2-бис(цианометил)-3-метоксибензола (1),описанного в литературе (J. Med. Chem. 1984, 27, 918-921), как показано на схеме III ниже. Схема III Соединения формулы I, где R6 представляет собой связанный с кислородом заместитель, могут быть получены, как показано на схеме IV, где Pg представляет собою подходящую защитную группу для вторичного амина, такую как 2,2,2-трифторацетил или трет-бутоксикарбонил, и где заместители R7, R9 и Соединение (m) может быть получено путем обработки 6-гидрокси-2,3,4,5-тетрагидро-1Hбензо[d]азепинов (j) подходящим алкилирующим реагентом, таким как алкилгалогенид или сульфонат, и основанием в подходящем растворителе, таком как ацетон, этанол или ацетонитрил, с последующей обработкой стандартными методами экстракции и хроматографии. Снятие защиты с азота кольца дает соединения (Ib). Альтернативно, соединение (m) может быть получено по реакции Мицунобу с подходящим спиртом, фосфиновым реагентом, таким как трифенилфосфин, и диэтилазодикарбоксилатом(DEAD) или 1,1'-(азодикарбонил)дипиперидином в безводном растворителе, например, ТГФ. Соединения формулы Ic, где R6 представляет собой связанный с азотом заместитель, могут быть получены, как показано на схеме V. Защищенные 6-трифлатом 2,3,4,5-тетрагидро-1H-бензо[d]азепины(а) могут быть превращены в соединения (n) в условиях Бухвальда обработкой подходящим амином (q) в присутствии эффективного палладиевого катализатора и основания в подходящем растворителе, таком как толуол или 1,4-диоксан, в атмосфере инертного газа. При необходимости может быть осуществлено введение второго заместителя R25. Стандартные методы обработки и хроматографии с последующим снятием защиты дают соединение (Ic). Альтернативно, 6-амино-2,3,4,5-тетрагидро-1H-бензо[d]азепины (р) могут быть превращены в требуемые соединения (n) реакцией с подходящим бромидом (r) и подходящим основанием в подходящем растворителе. Бромиды (r) или являются коммерчески доступными, или могут быть получены по способам, хорошо известным специалисту в данной области. Амины (q) или являются коммерчески доступными, или могут быть получены по способам, хорошо известным специалисту в данной области. Схема V Соединения формулы I, где R6 представляет собой связанный с серой заместитель, могут быть получены, как показано на схеме VI. Нагревают соответствующим образом замещенный 3-(трет-бутоксикарбонил-6-диметилкарбамоилтио)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (s) с подходящим основанием в подходящем растворителе, таком как метанол, с получением промежуточного тиола (t). При необходимости промежуточный тиол (t) выделяют и обрабатывают подходящим электрофилом (галогенид или алкилсульфонат). Соединение (и) выделяют с помощью стандартных методов экстракции и хроматографии и снимают защиту с получением целевого соединения (Id). Необходимые галогениды или алкилсульфонаты или являются коммерчески доступными, или могут быть получены по способам, хорошо известным специалисту в данной области. Опытному специалисту также будет понятно, что не все заместители в соединениях формулы I смогут перенести определенные условия реакции, которые используются для синтеза соединений. При необходимости или желании фрагменты могут быть введены в подходящих точках синтеза или могут быть защищены с последующим снятием защиты способами, хорошо известными в данной области. Опытному специалисту будет понятно, что защитные группы могут быть удалены в любой подходящей точке синтеза соединений по настоящему изобретению. Способы введения и удаления защитных групп, которые используются в данном изобретении, хорошо известны в данной области; см., например, Greene иWuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and sons, New York (1999). Следующие подготовительные примеры и примеры иллюстрируют полезные способы синтеза соединений по данному изобретению. Приведенные в примерах соединения также являются особенно предпочтительными соединениями по данному изобретению. Общая методика 1-1. Растворяют соответствующим образом замещенный 3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин в растворе аммиак/метанол (1,0-7,0 М). Перемешивают в течение 1-16 ч при комнатной температуре, если не указано иное. Летучие вещества удаляют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью 2 М аммиак/метанол в ДХМ 1-20%, или SCX хроматографией, элюируя 1,07,0 М аммиаком в метаноле. Общая методика 1-2. Растворяют соответствующим образом замещенный 3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (1,0 экв.) в метаноле. Добавляют 0,5 М водный раствор карбоната калия (4,0 экв.) и перемешивают при комнатной температуре в течение 6 ч. Концентрируют в вакууме и остаток распределяют между водой и ДХМ. Водную фракцию дважды экстрагируют ДХМ. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют в вакууме. При необходимости очищают хроматографией на силикагеле, элюируя смесью 2 М аммиак/метанол в ДХМ 1-20%, или SCX хроматографией, элюируя 1,0-7,0 М аммиаком в метаноле. Общая методика 1-3. Растворяют соответствующим образом замещенный 3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (1,0 экв.) в метаноле или этаноле (0,1-2 М раствор) и добавляют от 10-50% по объему 1,05,0 н водного раствора гидроксида натрия или гидроксида лития. Реакционную смесь перемешивают при комнатной температуре в течение 0,25-16 ч и концентрируют в вакууме. Остаток распределяют междуEtOAc или ДХМ и водой. Органическую фракцию отделяют и сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают SCX хроматографией с последующей хроматографией на силикагеле,элюируя смесью 2 М аммиак/метанол в ДХМ 1-20%, или ВЭЖХ с обращенной фазой. Общая методика 1-4. Растворяют соответствующим образом замещенный 3-трет-бутоксикарбонил-2,3,4,5-тетрагидро-1Hбензо[d]азепин в 4 М хлористом водороде в диоксане или 1 М хлористом водороде в этиловом эфире и перемешивают смесь в течение 2-16 ч при комнатной температуре, если не указано иное. Растворитель удаляют в вакууме. Если образуется твердое вещество, промывают его эфиром и фильтруют в вакууме с получением целевого гидрохлорида. Если образуется масло, его растворяют в минимальном объеме ДХМ, метанола или EtOAc и добавляют эфир до осаждения соли. Растворитель удаляют в вакууме, промывают твердое вещество эфиром и фильтруют. Твердое вещество сушат в вакууме или в токе азота. Общая методика 1-5.- 19011011 Растворяют соответствующим образом замещенный 3-трет-бутоксикарбонил-2,3,4,5-тетрагидро-1Hбензо[d]азепин в смеси трифторуксусная кислота/ДХМ (соотношение от 1:0 до 1:10) и перемешивают реакционную смесь в течение 1-16 ч при комнатной температуре. Концентрируют в вакууме и остаток подвергают SCX хроматографией или остаток распределяют между насыщенным водным растворомNaHCO3 и ДХМ или EtOAc. Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле (элюируя смесью 2 М аммиак/метанол в ДХМ 1-20%) или ВЭЖХ с обращенной фазой. Общая методика 1-6. Добавляют ацетилхлорид (40 экв.) к холодному метанолу (0 С) и перемешивают в течение 5 мин. Затем добавляют раствор соответствующим образом замещенного 7-хлор-3-(трет-бутоксикарбонил)2,3,4,5-тетрагидро-1H-бензо[d]азепина (1 экв.) в метаноле. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель удаляют в вакууме, подщелачивают насыщенным водным раствором NaHCO3 и трижды экстрагируют ДХМ. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью 2 М аммиак/метанол в ДХМ 1-20%. Общая методика 2-1. Очищенное свободное основание (1 экв.) растворяют в ацетоне, эфире или метаноле и добавляют раствор янтарной кислоты (1 экв.) в минимальном объеме ацетона или метанола. Перемешивают в течение 1 ч при комнатной температуре. Упаривают до состояния масла, добавляют минимальный объем ДХМ и этилового эфира для осаждения соли. Альтернативно, для осаждения соли дают реакционной смеси стоять в течение 1-16 ч при комнатной температуре, 4 С или -10 С и добавляют эфир или гексан. Фильтруют и промывают твердое вещество эфиром или гексаном с получением сукцината. Альтернативно, растворитель выпаривают в вакууме, промывают твердое вещество эфиром и фильтруют или декантируют растворитель с получением сукцината в виде твердого вещества. Твердое вещество сушат в вакууме или в токе азота. Общая методика 2-2. Очищенное свободное основание растворяют (1 экв.) в минимальном объеме ацетона, диоксана, метанола или ДХМ и добавляют избыток 4 М хлористого водорода в диоксане или 1 М раствор хлористого водорода в этиловом эфире. Перемешивают в течение 1 ч и растворитель выпаривают с получением соли в виде твердого вещества. Альтернативно, дают реакционной смеси стоять в течение 1-16 ч при комнатной температуре и добавляют эфир или гексан для осаждения соли. Фильтруют и промывают твердое вещество эфиром или гексаном с получением соли в виде твердого вещества. Альтернативно, растворитель выпаривают в вакууме, промывают твердое вещество эфиром, фильтруют или декантируют растворитель с получением гидрохлорида в виде твердого вещества. Твердое вещество сушат в вакууме или в токе азота. Общая методика 2-3. Очищенное свободное основание растворяют в метаноле, добавляют раствор хлорида аммония (1 экв.) в метаноле и перемешивают в течение 1 ч. Медленно удаляют летучие вещества в вакууме. Остаток растворяют в метаноле и большую часть растворителя удаляют в вакууме. Добавляют безводный этиловый эфир или EtOAc для осаждения гидрохлорида. Твердое вещество собирают, промывают эфиром и затем твердое вещество сушат в вакууме или в токе азота. Общая методика 2-4. Очищенное свободное основание растворяют (1,0 экв.) в метаноле. Добавляют 0,5 М раствор метансульфоновой кислоты в метаноле (2,0 экв.). Тщательно смешивают, перемешивают в течение 1 ч, затем растворитель удаляют в вакууме. Остаток растворяют в минимальном объеме ДХМ. Добавляют этиловый эфир до осаждения соли. Растворитель удаляют в вакууме с образованием пены. Сушат в вакууме или в токе азота с получением соли метансульфоновой кислоты. Общая методика 2-5. Очищенное свободное основание растворяют (1 экв.) в минимальном объеме ацетона и добавляют раствор щавелевой кислоты (1 экв.) в минимальном объеме ацетона. Смеси дают стоять от 10 мин до 16 ч при температуре от комнатной до -10 С и/или добавляют эфир или гексан для осаждения осадка. Фильтруют и промывают твердое вещество эфиром или гексаном с получением соли щавелевой кислоты в виде твердого вещества. Твердое вещество сушат в вакууме или в токе азота. Общая методика 2-6. Очищенное свободное основание растворяют (1 экв.) в минимальном объеме циклогексана, изогексана, хлороформа, дихлорметана, метанола или смеси этих компонентов и добавляют раствор (L)-винной кислоты в изопропаноле или метаноле. Если выпадает твердый осадок, его отфильтровывают и промывают твердое вещество эфиром, циклогексаном, изогексаном или EtOAc. Если образования твердого вещества не наблюдается, удаляют все летучие вещества в вакууме с образованием пены. Сушат в вакууме или в токе азота с получением соли винной кислоты. Общая методика 3.- 20011011 Растворяют соответствующим образом замещенный 3-трет-бутоксикарбонил-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин или 7-хлор-3-(2,2,2-трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин (1 экв.), PdCl2(PPh3)2 (0,1 экв.), йодид тетрабутиламмония (3 экв.), и йодид меди (I) (0,3 экв.) в смеси триэтиламин/ДМФА (1:5). Смесь перемешивают в течение 5 мин при комнатной температуре, добавляют соответствующим образом замещенный ацетилен (2 экв.) и нагревают до 70 С, выдерживая при этой температуре в течение 2-16 ч в закупоренной пробирке. Реакционную смесь охлаждают до комнатной температуры, разбавляют смесью EtOAc/гексан(1:1) и промывают водой. Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесями гексан/EtOAc. Подготовительный пример 1. 7-Хлор-3-(2,2,2-трифторацетил)-6-трифторметансульфонилокси 2,3,4,5-тетрагидро-1H-бензо[d]азепин 5-Метокси-1,4-дигидронафталин. Добавляют карбонат калия в порошке (193,1 г, 1,397 моль) к раствору 5-гидрокси-1,4-дигидронафталина [68,08 г, чистота по данным 1 Н-ЯМР 90%, 0,4657 моль, от Societa Italiana Medicinala Scandicci, s.r.l., Reggello (Firenze), Италия] в этаноле (700 мл). Охлаждают раствор до 0 С смесью воды со льдом и по каплям добавляют диметилсульфат (88,1 г, 66,1 мл, 0,699 моль), поддерживая температуру в интервале от 5 до 10 С. Затем реакционную смесь нагревают до 40 С и выдерживают при этой температуре до тех пор, пока данные ТСХ (10:1 гексан/EtOAc) покажут отсутствие исходного вещества (около 2 ч). Твердое вещество отфильтровывают вакуумным фильтрованием и растворитель удаляют в вакууме. Разбавляют остаток в виде коричневого масла диэтиловым эфиром (500 мл),промывают 10% водным NH4OH (500 мл), водой (500 мл), рассолом (500 мл), органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением неочищенного продукта в виде коричневого масла (73 г). Неочищенный продукт очищают перегонкой короткого пути в вакууме (Ткип 120-130 С/5 Торр) с получением требуемого полупродукта в виде прозрачного масла (69,0 г, скорректированная чистота 92,5%) (содержит некоторое количество 1,2,3,4-тетрагидро-5-метоксинафталина в виде примеси). 1 Н ЯМР (300 МГц, CDCl3),7,15 (т, 1 Н, J=7,9), 6,72 (дд, 2 Н, J=15,7, 7,9), 5,93-5,88 (м, 2 Н), 3,83 (с,3 Н), 3,42-3,39 (м, 2 Н), 3,30-3,28 (м, 2 Н); Rf=0,58, элюируя смесью гексан/EtOAc 10:1. 2,3-Бис-(2-гидроксиэтил)-1-метоксибензол: помещают в четырехгорлую колбу объемом 5 л, оборудованную механической мешалкой в верхней части, обратным холодильником, термопарой и аппаратом для дисперсии газа, 5-метокси-1,4-дигидронафталин (264,54 г, чистота по данным 1 Н-ЯМР 89,5%, 1,478 моль) в ДХМ (1,3 л) и 2 В-3 этаноле (1 л). Добавляют судан III (10 мг) с образованием тусклого красного цвета. Охлаждают раствор до -65 С или ниже, затем через раствор пропускают О 3 до тех пор, пока раствор не приобретет светло-желтый цвет и данные ТСХ (10:1 гексан/EtOAc, окрашивание KMnO4) покажут отсутствие исходного вещества (около 30 ч). Раствор переносят через канюлю в суспензию NaBH4(97,8 г, 2,59 моль) в 2 В-3 этаноле (500 мл) и охлаждают смесью воды со льдом. Важно поддерживать температуру на уровне 0 С или выше, например, от 0 до 10 С, в ходе переноса для обеспечения полного восстановления озонида до диола. По окончании переноса раствор нагревают до комнатной температуры и перемешивают в течение приблизительно 30 мин. Суспензию охлаждают до 0 С смесью воды со льдом, затем медленно добавляют ацетон (540 мл, 7,4 моль) для удаления избытка NaBH4. После растворения твердого вещества растворитель удаляют в вакууме. Растворяют твердое вещество желтого цвета в ДХМ (1 л) и воде (1 л), слои разделяют и экстрагируют водную фракцию ДХМ (750 мл). Объединенные органические фракции промывают рассолом (1,5 л), добавляют толуол (750 мл) и растворитель удаляют в вакууме. Твердое вещество растворяют в ДХМ (500 мл) при нагревании, затем добавляют толуол (750 мл) и раствор концентрируют в вакууме с получением требуемого полупродукта в виде светло-желтого твердого вещества (283,7 г, уточненная чистота 89%, Тпл 82-83 С) (содержит 1,2,3,4-тетрагидро-5 метоксинафталин в виде примеси (8,6%. Далее продукт очищают сушкой в вакууме в течение ночи при 75 С, 5 Торр, для удаления следовых количеств примеси 1,2,3,4-тетрагидро-5-метоксинафталина. 1 Н ЯМР (300 МГц, CDCl3),7,16 (дд, 1 Н, J=8,2, 7,6), 6,83 (с, 1 Н, J=7,0), 6,76 (с, 1 Н, J=8,2), 3,85-3,77(м, 7 Н), 3,01-2,91 (м, 4H), 2,35 (с, 2 Н); 13C ЯМР (300 МГц, ДМСО-d6),157,5, 138,9, 126,5, 125,2, 122,0,- 21011011 108,4, 62,1, 60,5, 55,3, 36,1, 29,6; ИК (KBr): 3006, 2960, 2886, 2829, 1583, 1461, 1440, 1264, 1091, 1041 см-1; МС (ES+) m/z 178 (М+Н)+. Вычислено для C11H16O3: С 67,32; Н 8,22; N 0; найдено: С 67,26, Н 8,10, N 0,21; Rf=0,23, элюент: ДХМ/метанол 95:5. 2,3-Бис-(2-метансульфонилоксиэтил)-1-метоксибензол: к суспензии 2,3-бис-(2-гидроксиэтил)-1 метоксибензола (50,6 г, 0,258 моль, 1 экв.) и триэтиламина (78,3 г, 0,774 моль, 3 зкв.) в ДХМ (500 мл) при 0 С, добавляют по каплям раствор метансульфонилхлорида (65,0 г, 0,567 моль, 2,2 экв.) в ДХМ (100 мл) в течение 45 мин. Добавление сопровождается экзотермической реакцией и метансульфонилхлорид добавляют, удерживая температуру ниже 10 С. По окончании добавления нагревают реакционную смесь до комнатной температуры. Раствор промывают водой (2500 мл) и затем рассолом (750 мл). Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением требуемого полупродукта в виде темно-желтого масла (87,4 г, 96,2%), которое используют в следующей реакции без дальнейшей очистки. Образец для анализа получают колоночной флэш-хроматографией, элюируя 100% диэтиловым эфиром. 1 Н ЯМР (300 МГц, CDCl3),7,20 (т, 1 Н, J=7,9), 6,82 (с, 1 Н, J=7,2), 6,80 (с, 1 Н, J=8,2), 4,41-4,34 (м,4 Н), 3,83 (с, 3 Н), 3,16-3,09 (м, 4 Н), 2,91 (с, 3 Н), 2,87 (с, 3 Н) ; 13 С ЯМР (300 МГц, CDCl3),158,07, 136,55,128,26, 123,34, 122,39, 109,24, 69,88, 69,08, 55,55, 37,35, 37,14, 32,57, 26,47; 13 С ЯМР (300 МГц, ДМСОd6),157,58, 136,79, 127,81, 122,91, 122,00, 109,33, 70,19, 68,88, 55,55, 36,49, 36,47, 31,56, 25,72; ИК(KBr): 1586,8, 1469,4, 1358,51, 1267,3, 1173,9, 1105,4, 972,4, 954,6, 914,3 см-1; МС (ES+) m/z 257 (М+Н)+. Вычислено для C13H20O7S2: С, 4 4,31; Н, 5,72; N, 0; найдено: С, 44,22, Н, 5,68, N, 0,13; Rf=0,72, элюент: смесь ДХМ/метанол 95:5. 6-Метокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин: растворяют 2,3-бис-(2-метансульфонилоксиэтил)1-метоксибензол (474,4 г, 1,346 моль) в ацетонитриле (7 л) и разделяют смесь на две равные части. В двух отдельных сосудах добавляют концентрированный водный раствор NH4OH (3,5 л) и помещают растворы в сосуд для обработки под давлением (аппарат Парра). Раствор нагревают в закупоренном реакторе до 100 С в течение 20 мин (внутренне давление достигает приблизительно 100 фунт/дюйм 2) и поддерживают температуру 100 С до завершения реакции (около 1 ч, под контролем ВЭЖХ). Реакционную смесь охлаждают до комнатной температуры. Объединяют две части и растворитель удаляют в вакууме. Остаток растворяют в МТВЕ (3,5 л) и воде (3,5 л). рН доводят до 6,5 с использованием 2 М водногоNaOH или 1 М водного HCl в надлежащем количестве (типично рН составляет приблизительно 5,1 и коррекция требует приблизительно 50 мл 2 М водного NaOH). Отбрасывают органическую фракцию, доводят рН водной фракции до 13 с помощью 50% NaOH (около 150 мл). Экстрагируют МТВЕ (23,5 л), объединенные органические фракции промывают рассолом (3,5 л), сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде неочищенного масла желтого цвета, которое затвердевает при стоянии (179,3 г). Продукт используют на следующей стадии без дальнейшей очистки. Образец для анализа готовят очисткой двумя перегонками по Кюгельрору с получением прозрачного масла, которое затвердевает при стоянии, Тпл, 44,3-45,0 С. 13 С ЯМР (300 МГц, ДМСО-d6)156,1, 144,4, 130,3, 126,2, 121,5, 108,9, 55,5, 48,2, 47,9, 39,9, 29,1; МС (ES+) m/z 163 (М+Н)+. Вычислено для C11H15NO: С, 74,54; Н, 8,53; N, 7,90; найдено: С, 74,28, Н, 8,62,N, 7,86. Гидрохлорид 6-метокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина: растворяют неочищенный 6 метокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин (35,1 г, 0,198 моль) в 2 В-3 этаноле (250 мл), нагревают раствор до кипения с обратным холодильником и добавляют 2 М HCl в этаноле (108,9 мл, 0,218 моль, 1,1 экв.). Медленно добавляют гептан (700 мл) в течение 10 мин, затем источник тепла удаляют, раствор охлаждают до комнатной температуры и в конце продолжают охлаждение в смеси воды со льдом. Образовавшееся твердое вещество собирают вакуумным фильтрованием и промывают холодной смесью этанол/гептан (1:2) (3100 мл), сушат на воздухе в течение 15 мин в вакууме, далее продукт сушат в вакуумной печи при 60 С, выдерживая при этой температуре в течение 1 ч с получением требуемого полупродукта в виде белого гранулированного твердого вещества (35,53 г, 63%): Тпл 246,6-246,9 С. 1 Н ЯМР (300 МГц, ДМСО-d6),9,82 (ушир.с, 1 Н), 7,12 (дд, 1 Н, J=7,6, 7,9), 6,88 (д, 1 Н J=8,2), 6,78(д, 1 Н, J=7,3), 3,75 (с, 3 Н), 3,20-3,00 (м, 8 Н); 13 С ЯМР (300 МГц, ДМСО-d6),156,2, 141,3, 127,4, 127,2,121,6, 109,7, 55,7, 44,9, 44,7, 31,6, 21,7; МС (ES+) m/z 178 (М+Н)+. Вычислено для C11H15ClNO: С, 62,12; Н, 7,11; N, 6,59; найдено: С, 61,95, Н, 7,64, N, 6,58. 6-Метокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин: к суспензии гидрохлорида 6-метокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина (35,3 г, 0,165 моль, 1 экв.) и триэтиламина (69,1 мл,0,496 моль, 3 экв.) в ДХМ (300 мл), охлажденной до 0 С смесью воды со льдом, добавляют по каплям раствор трифторуксусного ангидрида (25,7 мл, 0,182 моль, 1,1 экв.) в ДХМ (40 мл) в течение 30 мин,поддерживая температуру ниже 10 С. По окончании добавления реакционную смесь нагревают до комнатной температуры и перемешивают до завершения реакции (проверяют с помощью ТСХ с использованием смеси CH2Cl2/метанол 9:1, приблизительно 2 ч). Раствор промывают водой (2350 мл) и затем рассолом (350 мл), органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме с по- 22011011 лучением требуемого полупродукта в виде желтого масла, которое затвердевает при стоянии (44,9 г,96%). Продукт используют без дальнейшей очистки на следующей стадии. Образец для анализа готовят хроматографией на силикагеле, элюируя 40% диэтиловым эфиром в гексане, Тпл 74-76 С. 1 Н ЯМР (300 МГц, CDCl3),7,16-7,11 (м, 1 Н), 6,81-6,74 (м, 2 Н), 3,81 (с, 3 Н), 3,79-3,64 (м, 4 Н), 3,113,07 (м, 2 Н), 2,99-2,95 (м, 2 Н); 1 Н ЯМР (300 МГц, ДМСО-d6),7,13 (дд, 1 Н, J=1,5, 7,0), 7,08 (д, 1 Н, J=1,5),6,88-6,74 (м, 1H), 3,75 (с, 3 Н), 3,67-3,61 (м, 4 Н), 3,04-2,92 (м, 4 Н); 13 С ЯМР (300 МГц, ДМСО-d6),156,43, 156,38, 155,06, 155,00, 154,60, 154,54, 154,14, 154,08, 141,31, 141,04, 121,44, 127,18, 127,05, 127,01,122,27, 121,94, 121,90, 118,46, 114,64, 110,80, 109,52, 109,41, 55,63, 55,61, 47,11, 47,07, 46,67, 46,63, 45,61,45,16, 35,90, 34,65, 26,18, 24,91. Вычислено для C13H14F3NO2: С, 57,14; Н, 5,16; N, 5,13; найдено: С, 57,17,Н, 5,27, N, 5,08. 6-Гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин: к 1 М раствору BBr3 (1,1 л, 1,6 экв.), охлажденному до 0 С на водяной бане со льдом добавляют 6-метокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (187 г, 0,684 моль) в ДХМ (200 мл) в течение 1 ч, поддерживая температуру от 0 до 10 С. Реакционную смесь нагревают до комнатной температуры и перемешивают до тех пор, пока ВЭЖХ покажет завершение реакции (около 2 ч). Охлаждают раствор до 0 С и переносят его через канюлю в смесь воды со льдом (1,2 л), с осаждением продукта в виде белого твердого вещества. Добавляют EtOAc (2 л) до растворения большей части осадка, слои разделяют и концентрируют органическую фракцию в вакууме. Водную фракцию трижды экстрагируют EtOAc (22 л, 11 л). Объединенные органические фракции промывают водой (2 л) и затем рассолом (2 л), сушат над Na2SO4,фильтруют и концентрируют в вакууме с получением требуемого полупродукта в виде светло-желтого твердого вещества (166,3 г, 94%). Продукт используют на следующей стадии без дальнейшей очистки. Образец для анализа готовят хроматографией на силикагеле, элюируя 40% диэтиловым эфиром в гексане: Тпл 183,0-185,2 С. 1 Н ЯМР (300 МГц, ДМСО-d6),9,39 (с, 1 Н), 6,94-6,88 (м, 1 Н), 6,72-6,68 (м, 1 Н), 6,61-6,57 (м, 1 Н),3,67-3,32 (м, 4 Н), 2,99-2,86 (м, 4 Н); 13 С ЯМР (300 МГц, ДМСО-d6),154,50, 141,47, 141,18, 126,77,126,64, 125,77, 125,33, 120,38, 120,32, 118,49, 114,67, 113,64, 113,47, 47,31, 47,27, 47,00, 46,96, 45,83,45,49, 36,17, 34,93, 26,46, 25,18, 20,66, 14,00; МС (ES+) m/z 260 (М+Н)+. Вычислено для C12H12F3NO2: С,55,60; Н, 4,67; N, 5,40; найдено: С, 55,51, Н, 4,71, N, 5,29. 7-Хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин: нагревают смесь 6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1 Н-бензо[d]азепина (120 г, 0,4629 моль) и толуола(14,4 л) до 70 С, выдерживая при этой температуре в течение 45 мин, до тех пор, пока большая часть исходного вещества растворится. Добавляют диизобутиламин (1,197 г, 1,62 мл, 9,26 ммоль) с последующим добавлением сульфурилхлорида (62,48 г, 37,19 мл, 0,463 моль) в толуоле (360 мл) в течение 20 мин. Реакционную смесь перемешивают в течение 50 мин, затем добавляют дополнительный сульфурилхлорид (4,536 г, 2,70 мл, 0,0336 моль) и перемешивают реакционную смесь в течение 15 мин при 70 С. Реакционную смесь охлаждают до 24 С в течение 30 мин и затем добавляют 1 н. кислоту хлористо-водородную (2,00 л). Разделяют, органическую фракцию промывают насыщенным водным раствором NaHCO3(2,00 л), рассолом (2,00 л) и затем сушат над Na2SO4. Фильтруют и растворитель удаляют на роторном испарителе при 70 С до тех пор, пока останется приблизительно 672,5 г, с использованием минимального эффективного вакуума, чтобы поддержать достаточную паровую фазу для предупреждения высыхания выше уровня растворителя и инициирования кристаллизации, таким образом, предупреждая кристаллизацию в этих условиях. С использованием толуола, нагретого до 70 С, переносят светло-желтый раствор в предварительно нагретую (70 С) трехгорлую колбу, оборудованную механической мешалкой. Температуру понижают до 58 С, выдерживая при этой температуре в течение 1 ч. Для усиления кристаллизации в раствор вносят затравку в виде полученных ранее кристаллов 7-хлор-6-гидрокси-3-(2,2,2 трифторацетил)-2,3,4,5-тетрагидро-1 Н-бензо[d]азепина, если они доступны. По истечении 30 мин температуру далее снижают до 55 С и наблюдают начало процесса кристаллизации. Поддерживают температуру на уровне 55 С, выдерживая при этой температуре в течение 2 ч, затем 4 ч при 45 С, затем источник тепла удаляют, позволяя температуре смеси медленно достигнуть 24 С (комнатная температура). После перемешивания в течение 8 ч без нагревания охлаждают смесь до 0 С, выдерживая при этой температуре в течение 2 ч, и затем еще 2 ч при -10 С. Собирают полученные плотные, белые, гранулированные кристаллы вакуумным фильтрованием при -10 С. Дважды промывают кристаллы холодным (-10 С) толуолом и сушат в вакууме при 50 С, 5 Торр, в течение 12 ч, с получением требуемого полупродукта в виде белого твердого вещества (120,7 г, 99,5% чистота, 88,8%): Тпл 133-134 С. МС (ES+) m/z 294 (М+Н)+. Вычислено для C12H11ClF3NO2: С, 49,08; Н, 3,78; N, 4,77; Cl, 12,07; найдено: С, 49,01; Н, 3,63; N, 4,72; Cl,12,32. 7-Хлор-3-(2,2,2-трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d] азепин. Охлаждают раствор 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d] азепина (60 г, 0,204 моль) и триэтиламина (62,6 мл, 0,448 моль, 2,2 экв.) в ДХМ (590 мл) на ледяной бане и добавляют по каплям трифторметансульфоновый ангидрид (43,5 мл, 0,258 моль, 1,26 экв.) в течение 70- 23011011 мин. Ледяную баню удаляют и перемешивают реакционную смесь в течение 2 ч. Реакционную смесь последовательно промывают водой (500 мл), 1 н. водным HCl (500 мл), водой (500 мл) и рассолом (500 мл). Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме с получением неочищенного продукта в виде коричневого твердого вещества (90 г). Твердое вещество растворяют в нагретом толуоле(200 мл). Далее очищают хроматографией на силикагеле (500 г), последовательно элюируя гексаном (1 л), смесями гексан/EtOAc (9:1, 1 л), гексан/EtOAc (4:1, 1 л), и гексан/EtOAc (7:3, 9 л). Элюаты объединяют и растворитель выпаривают с получением продукта в виде желтого плотного твердого вещества (86,3 г). Твердое вещество растворяют в нагретом EtOAc (86 мл) и затем добавляют гексан (700 мл). Для усиления кристаллизации в раствор вносят затравку в виде ранее полученных кристаллов 7-хлор-3-(2,2,2 трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина. Смеси дают стоять при комнатной температуре в течение 30 мин. Смесь охлаждают приблизительно до -10 С, выдерживая при этой температуре в течение 2 ч, фильтруют, кристаллы промывают холодной (-10 С) смесью гексан/EtOAc и сушат на воздухе, фильтруют в вакууме с получением указанного в заголовке соединения в виде первой порции кристаллов (73,54 г). Маточную жидкость концентрируют с получением твердого вещества (12,7 г). Твердое вещество перекристаллизовывают из смеси EtOAc/гексан (15 мл:121 мл) с получением дополнительного количества указанного в заголовке соединения (7,65 г, общий выход: 81,19 г,93%). Подготовительный пример 2. 3-(2,2,2-Трифторацетил)-6-трифторметансульфонилокси-2,3,4,5 тетрагидро-1H-бензо[d]азепин Охлаждают раствор 6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (2 г,7,72 ммоль) и триэтиламина (1,4 мл, 10,1 ммоль) в ДХМ (50 мл) на криогенной бане, установленной на отметке -30 С, и добавляют по каплям трифторметансульфоновый ангидрид (1,7 мл, 10,1 ммоль) в течение 20 мин. Перемешивают при -30 С в течение 2 ч и затем нагревают до комнатной температуры в течение ночи. Реакционную смесь последовательно промывают водой (100 мл), 1 н. водным HCl (100 мл),водой (200 мл) и рассолом (200 мл). Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме с получением указанного в заголовке соединения в виде бесцветного или светло-желтого масла(2,7 г, 89%), которое используют без очистки. Образец для анализа получают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (9:1), с получением указанного в заголовке соединения в виде не совсем белого воскообразного твердого вещества. ГХ-МС m/z: 391 (М+). Подготовительный пример 3. 3-трет-Бутоксикарбонил-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин Растворяют 6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (5 г, 19,3 ммоль) в 7 н. растворе аммиак/метанол (50 мл) и перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь упаривают до состояния масла и используют без дальнейшей очистки. Остаток растворяют в смеси растворителей, состоящей из метанола (20 мл), ДХМ (10 мл) и воды (100 мл), и добавляют карбонат калия (5 г) и ди-трет-бутилдикарбонат (5,05 г, 23,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и концентрируют в вакууме. Водную фракцию экстрагируют ДХМ, сушат над Na2SO4, фильтруют и концентрируют. Остаток используют без дальнейшей очистки. Растворяют продукт в смеси ДХМ (300 мл) и пиридина (30 мл) и охлаждают на ледяной бане. К раствору при перемешивании добавляют по каплям трифторметансульфоновый ангидрид (5,84 мл, 34,7 ммоль) и перемешивают реакционную смесь в течение 2 ч при комнатной температуре. Реакционную смесь разбавляют ДХМ (400 мл) и промывают 2,5 н. водным HCl. Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения в виде желтого твердого вещества (6,1 г, 80%). МС (ES+) m/z: 396 (М+Н)+. Подготовительный пример 4. 7-Фтор-3-(2,2,2-трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин При перемешивании добавляют 2-сульфонат N-фтор-4,6-бис(трифторметил)пиридиния (3,02 г, 9,6 ммоль) к смеси 6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (2,5 г, 9,6 ммоль) и гексафтор-2-пропанола (10 мл) в ДХМ (150 мл). Перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь упаривают и остаток распределяют между EtOAc и 1 н. водным HCl. Органическую фракцию промывают насыщенным водным раствором NaHCO3, рассолом, сушат надNa2SO4, фильтруют и концентрируют. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (20:1, 10:1, 6:1, 5:1 и 3:1), с получением 7-фтор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5 тетрагидро-1 Н-бензо[d]азепина в виде белого твердого вещества (1,8 г, 68%). Растворяют 7-фтор-6 гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (1,5 г, 5,41 ммоль) в смеси ДХМ(20 мл) и пиридина (2 мл) и охлаждают на ледяной бане. К раствору по каплям добавляют при перемешивании смесь трифторметансульфонового ангидрида (1,64 мл, 9,74 ммоль) и ДХМ и перемешивают реакционную смесь в течение 1,5 ч при комнатной температуре. Реакционную смесь разбавляют ДХМ(300 мл) и промывают 2,5 н. водным HCl. Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке продукта в виде белого твердого вещества (2,2 г, 99%). МС (ES+) m/z: 410 (М+Н)+. Подготовительный пример 5. 3-трет-Бутоксикарбонил-7-хлор-6-гидрокси-2,3,4,5-тетрагидро-1Hбензо[d]азепин Растворяют 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (3 г,10,2 ммоль) в 7 н. растворе аммиак/метанол (50 мл) и перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь упаривают до состояния масла и используют без дальнейшей очистки. Остаток растворяют в смеси растворителей, состоящей из ДХМ (25 мл) и насыщенного водного раствора карбоната калия (25 мл), и добавляют ди-трет-бутилдикарбонат (2,2 г, 10,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, концентрируют в вакууме и водный остаток экстрагируют ДХМ. Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью EtOAc/гексан (1:5), с получением указанного в заголовке соединения в виде белого твердого вещества (2,3 г, 76%). МС (ES-) m/z: 296 (М-Н)-. Пример 1. Гидрохлорид 6-(3-фенилпроп-1-инил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина Применяют способ, аналогично общей методике 3, для осуществления сочетания 3-третбутоксикарбонил-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина (0,6 г, 1,5 ммоль) и 3-фенил-1-пропина (0,38 мл, 3 ммоль). Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (1:0, 40:1 и 20:1), с получением 3-трет-бутоксикарбонил-6-(3-фенилпроп-1-инил)2,3,4,5-тетрагидро-1H-бензо[d]азепина в виде оранжевого масла (400 мг, 74%). Применяют способ, аналогично общей методике 1-5, для снятия защиты с 3-трет-бутоксикарбонил 6-(3-фенилпроп-1-инил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (68 мг, 0,19 ммоль). Очищают хроматографией на силикагеле, элюируя смесью ДХМ/2 М аммиак в метаноле (1:0, 20:1 и 10:1), с получением свободного основания указанного в заголовке соединения. Применяют способ, аналогично общей методике 2-2, с получением указанного в заголовке соединения в виде плотного твердого вещества (48 мг,85%). МС (ES+) m/z: 262 (М+Н)+. Соединения примеров 2-4 могут быть получены по способу, аналогично описанному в примере 1, с использованием 3-трет-бутоксикарбонил-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d] азепина и подходящего алкина. Значения общего выхода и данные МС (ES+) приведены в таблице ниже. Применяют способ, аналогично общей методике 3, для осуществления сочетания 3-третбутоксикарбонил-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина (0,5 г, 1,3 ммоль) и 3,3-диметил-1-бутина (0,311 мл, 2,5 ммоль). Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (10:1), с получением 3-трет-бутоксикарбонил-6-(3,3-диметилбут-1-инил)-2,3,4,5 тетрагидро-1H-бензо[d]азепина в виде желтого масла (304 мг, 74%). Применяют способ, аналогично общей методике 1-5, для снятия защиты с 3-трет-бутоксикарбонил 6-(3,3-диметилбут-1-инил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина. Очищают хроматографией на силикагеле, элюируя смесью ДХМ/2 М аммиак в метаноле (1:0, 50:1, 20:1, 15:1 и 10:1), с получением свободного основания указанного в заголовке соединения. Применяют способ, аналогично общей методике 2-1, с получением указанного в заголовке соединения в виде плотного твердого вещества (171 мг, 53%). МС Применяют способ, аналогично общей методике 3, для осуществления сочетания 7-фтор-3-(2,2,2 трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1H-бензо[d]азепина (1 г, 2,4 ммоль) и 3,3-диметил-1-бутина (0,599 мл, 4,9 ммоль). Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (10:1), с получением 6-(3,3-диметилбут-1-инил)-7-фтор-3-(2,2,2-трифторацетил)-2,3,4,5 тетрагидро-1H-бензо[d]азепина в виде желтого масла (700 мг, 84%). Применяют способ, аналогично общей методике 1-3, для снятия защиты с 6-(3,3-диметилбут-1 инил)-7-фтор-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина. Очищают SCX хроматографией с последующей хроматографией на силикагеле, элюируя смесью ДХМ/2 М аммиак в метаноле(1:0, 50:1, 20:1, 15:1 и 10:1), с получением свободного основания указанного в заголовке соединения. Применяют способ, аналогично общей методике 2-1 с получением указанного в заголовке соединения в виде белого твердого вещества (589 мг, 83%). МС (ES+) m/z: 246 (М+Н)+. Общая методика 4-1. Добавляют 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (1 экв.), подходящий алкилирующий агент (1,2 экв.), измельченный K2CO3 (3 экв.) и KI (0,1 экв.) к подходящему растворителю (ацетон, этанол или ацетонитрил) и кипятят с обратным холодильником в течение 6-16 ч, если не указано иное. Реакционную смесь охлаждают до комнатной температуры, гасят 1 н. водным HCl и водный слой трижды экстрагируют EtOAc. Органические фракции объединяют, промывают насыщенным водным раствором NaHCO3, рассолом, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесями гексан/EtOAc. Общая методика 4-2. Последовательно добавляют 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (1 экв.), подходящий спирт (1,1 экв.), трифенилфосфин (1,2 экв.) и диэтилазодикарбоксилат (1,1 экв.) к безводному ТГФ. Перемешивают смесь при комнатной температуре в атмосфере азота. Если реакция не завершилась, снова добавляют трифенилфосфин (1,2 экв.) и диэтилазодикарбоксилат(1,1 экв.) (контроль по данным ТСХ). Разбавляют смесь EtOAc, промывают насыщенным водным раствором NaHCO3, рассолом, сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесями гексан/EtOAc. Общая методика 4-3. Последовательно добавляют 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (1 экв.), подходящий спирт (1,2-1,5 экв.) и трифенилфосфин (1,5 экв.) к безводному ТГФ. Перемешивают смесь при 0 С в атмосфере азота в течение 10 мин. Добавляют 1,1'-(азодикарбонил)дипиперидин (1,5 экв.) и дают смеси нагреться до комнатной температуры в течение 16 ч. Разбавляют эфиром, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесями гексан/EtOAc. Подготовительный пример 6. 1-Фтор-4-метокси-2-(2-нитровинил)бензол: 2-фтор-5-метоксибензальдегид (15 г, 97,4 ммоль), нитрометан (32 мл, 584 ммоль) и ацетат аммония (30 г, 390 ммоль) в уксусной кислоте (136 мл) кипятят с обратным холодильником в течение 30 мин. Растворитель выпаривают и остаток растворяют в эфире. Органическую фракцию промывают водой, насыщенным водным раствором NaHCO3 и концентрируют с получением требуемого полупродукта (18,7 г, 97%). ГХ-МС m/z: 197 (М)+. 2-(2-Фтор-5-метоксифенил)этиламин. При энергичном перемешивании осторожно добавляют серную кислоту (14,7 мл, 265 ммоль) по каплям при 0 С к литийалюминийгидриду (1 М раствор в ТГФ, 565 мл). Нагревают смесь до комнатной температуры в течение 20 мин и затем охлаждают снова до 0 С. Добавляют раствор 1-фтор-4-метокси-2-(2-нитровинил) бензола (18,7 г, 95 ммоль) в ТГФ (150 мл) с помощью канюли и перемешивают в течение 2,5 ч при комнатной температуре. Охлаждают смесь до 0 С, осторожно добавляют воду (4,6 мл) с последующим добавлением 2 н. водного раствора NaOH (4,6 мл) и воды (6,5 мл). Осадок удаляют фильтрованием и концентрируют фильтрат с получением требуемого полупродукта (16 г, 100%). МС (ES+) m/z: 170 (М+Н)+.N-(2, 2-Диметоксиэтил)-2,2,2-трифтор-N-[2-(2-фтор-5-метоксифенил)этил]ацетамид: растворяют 2(2-фтор-5-метоксифенил)этиламин (16 г, 95 ммоль) и диметоксиацетальдегид (60% водный, 21,5 мл, 142 ммоль) в метаноле (500 мл). По истечении 1,5 ч осторожно добавляют боргидрид натрия (5,39 г, 142 ммоль) при 0 С и затем перемешивают при комнатной температуре в течение 3 ч. Добавляют ацетон и смесь упаривают. Остаток растворяют в ДХМ (250 мл), охлаждают до 0 С и добавляют триэтиламин(26,5 мл, 190 ммоль) и трифторуксусный ангидрид (20,1 мл, 142 ммоль). По истечении 30 мин промывают смесь 1 н. водным HCl (4100 мл), рассолом и насыщенным водным раствором NaHCO3. Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле с получением требуемого полупродукта (19,7 г, 59%). МС (ES+) m/z: 322 (М-ОМе)+. 9-Фтор-6-метокси-3-(2,2,2-трифторацетил)-2,3-дигидро-1H-бензо[d]азепин: растворяют N-(2,2 диметоксиэтил)-2,2,2-трифтор-N-[2-(2-фтор-5-метоксифенил) этил]ацетамид (5 г, 14,2 ммоль) в хлорбензоле (100 мл). Добавляют полифосфорную кислоту (5 г) и Р 2 О 5 (2,5 г) и нагревают до 80 С, выдерживая при этой температуре в течение 2 ч. К горячей смеси добавляют воду, охлаждают до комнатной температуры и экстрагируют ДХМ. Органические экстракты сушат над Na2SO4 и концентрируют в вакууме с получением требуемого полупродукта (3,0 г, 73%). МС (ES+) m/z: 290 (М+Н)+. 9-Фтор-6-метокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин: растворяют 9 фтор-6-метокси-3-(2,2,2-трифторацетил)-2,3-дигидро-1H-бензо[d]азепин (9,4 г, 32,4 ммоль) и 10% Pd/C (в пересчете на сухое вещество, тип Дегусса, 1,4 г, 0,65 ммоль) в смеси EtOAc/этанол (1:1, 200 мл) и перемешивают при комнатной температуре в атмосфере водорода из баллона в течение 4,5 ч. Фильтруют смесь через слой силикагеля и концентрируют фильтрат с получением требуемого полупродукта (8,6 г,91%). МС (ES+) m/z: 292 (М+Н)+. 9-Фтор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин: растворяют 9 фтор-6-метокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (8,1 г, 27,7 ммоль) в ДХМ(250 мл), охлаждают до 0 С и добавляют трибромид бора (5,24 мл, 55,5 ммоль). Перемешивают при комнатной температуре в течение 1,5 ч, промывают смесь рассолом, органическую фракцию сушат надNa2SO4 и концентрируют в вакууме с получением требуемого полупродукта (7,6 г, 99%). МС (ES+) m/z: 278 (М+Н)+. 7-Хлор-9-фтор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин: растворяют 9-фтор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин (1,0 г, 3,6 ммоль) в толуоле (36 мл) с диизопропиламином (41 мкл, 0,29 ммоль). Нагревают до 60 С и добавляют по каплям раствор сульфурилхлорида (0,32 мл, 3,97 ммоль) в толуоле (10 мл). По истечении 2 ч промывают смесь рассолом, органическую фракцию сушат над Na2SO4 и концентрируют на силикагеле. Очищают хроматографией на силикагеле, элюируя смесью EtOAc/гексан (0:1 до 1:0), с получением требуемого полупродукта (1,0 г, 92%). МС (ES+) m/z: 312 (М+Н)+.- 27011011 7-Хлор-9-фтор-3-(2,2,2-трифторацетил)-6-трифторметансульфонилокси-2,3,4,5-тетрагидро-1Hбензо[d]азепин: охлаждают раствор 7-хлор-9-фтор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (2,5 г, 8,0 ммоль), пиридина (3,25 мл, 40,2 ммоль) и ДХМ (80 мл) при 0 С и добавляют по каплям трифторметансульфоновый ангидрид (2,43 мл, 14,5 ммоль) в течение 20 мин. Перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь последовательно промывают 1 н. водным HCl, насыщенным раствором NaHCO3 и рассолом. Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc(1,4 г, 10 ммоль) и безводный ТГФ (60 мл) в атмосфере азота. Охлаждают смесь на ледяной бане, добавляют по каплям 2 М раствор метиламина в ТГФ и перемешивают при той же температуре в течение 30 мин. Ледяную баню удаляют и перемешивают при комнатной температуре в течение 16 ч. РазбавляютEtOAc, затем промывают 1 н. водным HCl. Органическую фракцию отделяют, сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (1:0, 4:1,7:3 и 13:7), с получением указанного в заголовке соединения (1,5 г, 71%). МС (ES+) m/z: 266 (М+Н)+. Соединения подготовительных примеров 8-9 могут быть получены по способу, аналогично описанному в подготовительном примере 7, с использованием 4-(бромметил)бензолсульфонилхлорида и подходящего амина. Значения выхода и данные МС (ES+) приведены в таблице ниже. Смешивают в атмосфере азота 2-тиазолкарбоксальдегид (1,1 г, 10 ммоль) и этанол (30 мл). Добавляют боргидрид натрия (416 мг, 11 ммоль) при 0 С. Перемешивают и медленно нагревают смесь до комнатной температуры в течение 12 ч. Гасят насыщенным водным раствором хлорида аммония и концентрируют в вакууме. Разбавляют остаток EtOAc и промывают рассолом. Органическую фракцию сушат над Na2SO4 и концентрируют в вакууме с получением указанного в заголовке соединения в виде масла (1,0 г, 87%). МС (ES+) m/z: 116 (М+Н)+. Подготовительный пример 11. (1-Метил-1H-пиразол-3-ил)метанол Растворяют 3-диметоксиметил-1-метилпиразол (1,562 г, 10 ммоль) в ацетоне (100 мл), добавляют птолуолсульфоновую кислоту (190 мг, 1,0 ммоль) и перемешивают при комнатной температуре в течение 12 ч. Летучие вещества удаляют в вакууме, остаток растворяют EtOAc, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют в вакууме с получением масла. Растворяют масло в метаноле (15 мл), добавляют боргидрид натрия (567 мг, 15 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Летучие вещества удаляют в вакууме, остаток растворяют в EtOAc, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4,фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью 6-(2-трет-Бутоксикарбониламиноэтокси)-7-хлор-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1 Н- 28011011 бензо[d]азепин: применяют способ, аналогично общей методике 4-3, с использованием 7-хлор-6 гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (277 мг, 0,94 ммоль) и N-(третбутоксикарбонил)этаноламина (244 мг, 1,51 ммоль), с получением, после хроматографии на силикагеле,злюируя смесью гексан/EtOAc (1:0 и 3:1), требуемого полупродукта (392 мг, 95%). МС (ES+) m/z: 337(М+Н-Вос)+. 6-(2-Аминоэтокси)-7-хлор-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепин. Растворяют 6-(2-трет-бутоксикарбониламиноэтокси)-7-хлор-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (997 мг, 2,28 ммоль) в 4 М хлористом водороде в диоксане (15 мл) и перемешивают при комнатной температуре в течение 30 мин. Концентрируют с получением гидрохлоридной соли. Растворяют соль в ДХМ и промывают насыщенным водным раствором NaHCO3. Экстрагируют водный основный слой ДХМ. Объединенные органические экстракты сушат над MgSO4 и концентрируют в вакууме с получением указанного в заголовке соединения (731 мг, 95%). МС (ES+) m/z: 337 (М+Н)+. Соединения подготовительных примеров 13-14 могут быть получены по способу, аналогично описанному в подготовительном примере 12, с использованием 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)2,3,4,5-тетрагидро-1H-бензо[d]азепина и подходящего спирта. Значения общего выхода и данные МС Готовят суспензию гидрида натрия (60% в минеральном масле; 99 мг, 2,5 ммоль) в ДМФА (4 мл) и нагревают до 65 С. Добавляют раствор 3-трет-бутоксикарбонил-7-хлор-6-гидрокси-2,3,4,5-тетрагидро 1H-бензо[d]азепина (250 мг, 0,84 ммоль) в ДМФА (5 мл) по каплям и перемешивают в течение 1 ч. Добавляют раствор 4-фторбензилбромида (191 мг, 1,0 ммоль) в ДМФА (1 мл), перемешивают при 65 С в течение 1,5 ч и охлаждают до комнатной температуры. Добавляют воду (1 мл) и концентрируют смесь до состояния маслянистого остатка. Остаток распределяют между смесью EtOAc/гексан (1:1) и водой. Органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток растворяют в ДХМ, промывают 2 н. водным раствором NaOH, органическую фракцию сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc(20:1, 10:1 и 7:1), с получением 3-трет-бутоксикарбонил-7-хлор-6-(4-фторбензилокси)-2,3,4,5-тетрагидро 1H-бензо[d]азепина в виде масла. Применяют способ, аналогично общей методике 1-5, для снятия защиты с 3-трет-бутоксикарбонил 7-хлор-6-(4-фторбензилокси)-2,3,4,5-тетрагидро-1H-бензо[d]азепина. Очищают SCX хроматографией с последующей хроматографией на силикагеле, элюируя смесью ДХМ/2 М аммиак в метаноле (1:0, 50:1,20:1, 15:1 и 10:1), с получением свободного основания указанного в заголовке соединения. Применяют способ, аналогично общей методике 2-1, с получением указанного в заголовке соединения в виде белого твердого вещества (178 мг, 50%). МС (ES+) m/z: 306 (М+Н)+. Пример 8. Гидрохлорид 7-хлор-6-(4-цианобензилокси)-2,3,4,5-тетрагидро-1H-бензо[d]азепина- 29011011 Объединяют 3-трет-бутоксикарбонил-7-хлор-6-гидрокси-2,3,4,5-тетрагидро-1H-бензо[d]азепин (200 мг, 0,67 ммоль), карбонат калия (111 мг, 0,8 ммоль), и 4-цианобензилбромид (263 мг, 1,34 ммоль) в ДМСО (5 мл) и нагревают смесь при перемешивании до 100 С, выдерживая при этой температуре в течение 24 ч. Охлаждают до комнатной температуры и распределяют смесь между водой и EtOAc/гексан(1:1). Органическую фракцию промывают рассолом и сушат над Na2SO4, фильтруют и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (5:1), с получением 3 трет-бутоксикарбонил-7-хлор-6-(4-цианобензилокси)-2,3,4,5-тетрагидро-1H-бензо[d]азепина в виде масла. Применяют способ, аналогично общей методике 1-5, для снятия защиты с 3-трет-бутоксикарбонил 7-хлор-6-(4-цианобензилокси)-2,3,4,5-тетрагидро-1H-бензо[d]азепина. Очищают SCX хроматографией с получением свободного основания указанного в заголовке соединения. Применяют способ, аналогично общей методике 2-2, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (66 мг, 27%). МС (ES+) m/z: 313 (М+Н)+. Пример 9. Гидрохлорид 7-хлор-6-[2-(4-фторфенил)-2-оксоэтокси]-2,3,4,5-тетрагидро-1H-бензо Применяют способ, аналогично общей методике 4-1, с использованием 7-хлор-6-гидрокси-3-(2,2,2 трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (294 мг, 1,0 ммоль) и 2-бром-4'-фторацетофенона(260 мг, 1,2 ммоль) с получением, после очистки хроматографией на силикагеле, элюируя смесью гексан/EtOAc (7:1), 7-хлор-6-[2-(4-фторфенил)-2-оксоэтокси]-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро 1H-бензо[d]азепина в виде твердого вещества (402 мг, 93%). МС (ES+) m/z: 430 (М+Н)+. Применяют способ, аналогично общей методике 1-1, для снятия защиты с 7-хлор-6-[2-(4 фторфенил)-2-оксоэтокси]-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (402 мг, 0,93 ммоль). Очищают хроматографией на силикагеле, элюируя смесью ДХМ/2 М аммиак в метаноле (96:4), с получением свободного основания указанного в заголовке соединения (278 мг, 89%). МС (ES+) m/z: 334(М+Н) +. Применяют способ, аналогично общей методике 2-3, с получением указанного в заголовке соединения. Пример 10. Гидрохлорид 7-хлор-6-(4-метилсульфамоилбензилокси)-2,3,4,5-тетрагидро-1H-бензо[d] азепина Растворяют в атмосфере азота 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Hбензо[d]азепин (200 мг, 0,68 ммоль) в ацетоне (30 мл). Добавляют безводный карбонат калия в порошке(276 мг, 2,0 ммоль) и йодид калия в порошке (11,3 мг, 0,068 ммоль) с последующим добавлением 4 бромметил-N-метилбензолсульфонамида (528 мг, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Концентрируют в вакууме, разбавляют EtOAc и дважды промывают 1 н. водным HCl. Органическую фракцию отделяют, сушат над Na2SO4 и концентрируют в вакууме. Очищают хроматографией на силикагеле, элюируя смесью гексан/EtOAc (1:0 и 4:1), с получением 7 хлор-6-(4-метилсульфамоилбензилокси)-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина(201 мг, 60%). Применяют способ, аналогично общей методике 1-1, для снятия защиты с 7-хлор-6-(4 метилсульфамоилбензилокси)-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина (196 мг,0,41 ммоль). Очищают на SCX колонке с получением свободного основания указанного в заголовке соединения (110 мг, 70%). МС (ES+) m/z: 381 (М+Н)+. Применяют способ, аналогично общей методике 2-2,с получением указанного в заголовке соединения. Соединения примеров 11-12 могут быть получены по способу, аналогично описанному в примере 10, с использованием 7-хлор-6-гидрокси-3-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1H-бензо[d]азепина и подходящего бромида. Данные МС (ES+) приведены в таблице ниже.
МПК / Метки
МПК: C07D 405/12, C07D 409/12, C07D 417/12, C07D 401/12, C07D 403/06, C07D 223/16, A61K 31/55, C07D 413/14, C07D 413/12, C07D 417/06, C07D 403/12
Метки: 6-замещённые, азепины, 5-тетрагидро-1н-бензо, рецепторов, агонистов, 5-ht2c, качестве
Код ссылки
<a href="https://eas.patents.su/30-11011-6-zameshhyonnye-2-3-4-5-tetragidro-1n-benzo-d-azepiny-v-kachestve-agonistov-receptorov-5-ht2c.html" rel="bookmark" title="База патентов Евразийского Союза">6-замещённые 2, 3, 4, 5-тетрагидро-1н-бензо [ d ] азепины в качестве агонистов рецепторов 5-ht2c</a>


































