Соединения, модулирующие рецептор gpr40, фармацевтическая композиция, способ лечения заболеваний, чувствительных к модулированию рецептора gpr40 (варианты), способ модулирования функции gpr40 (варианты) и способ модулирования циркулирующей концентрации инсулина
Номер патента: 11010
Опубликовано: 30.12.2008
Авторы: Чжу Люшен, Шатлуэрт Стивен Дж., Ван Инцай, Лю Цзивень, Шмитт Майкл Дж., Медина Хулио К., Сунь Ин, Цю Вэй, Линь Дэниэл К.Х., Ма Чжихуа, Лю Цзиньцянь, Чжан Цзянь, Хауз Джонатан, Рейган Джеффри Д., Акерман Мишель, Люо Цзянь, Шарма Раджив
Формула / Реферат
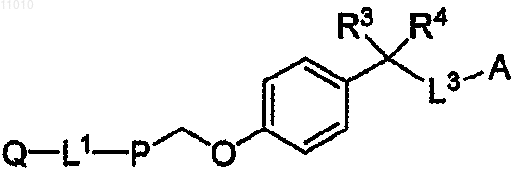
1. Соединение, имеющее формулу I
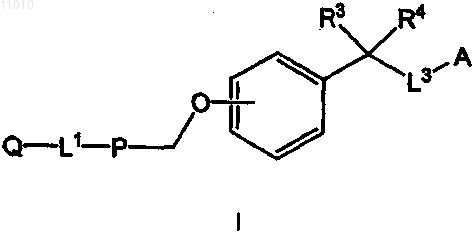
или его фармацевтически приемлемая соль, сольват или пролекарственная форма, в которой
Q представляет собой водород, (С6-С12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С1-С6)алкил или (С2-С6)гетероалкил;
L1 означает связь, (С1-С4)алкилен, (С2-С4)гетероалкилен, О, S(O)m, N(R1), С(О)-(С5-С7)гетероциклоалкилен, (С1-С4)алкилен-SO2N(R2), (С1-С4)алкилен-N(R2)SO2 или C(O)N(R2);
Р представляет собой (С6-С12)ароматическую группу, гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С3-С8)гетероциклоалкилен или (С3-С8)циклоалкилен;
L3 означает метилен;
А представляет собой -СО2Н, тетразол-5-ил, -SO3H, -PO3H2, -SO2NH2, -C(O)NHSO2CH3, -CHO, -C(O)R6, -C(O)NHR6, -C(O)NHOR7, тиазолидиндионил, гидроксифенил или пиридил;
R1 представляет собой (С1-С6)алкил или (С6-С12)арил(С1-С3)алкил(С2-С6)гетероалкил;
R2 представляет собой водород, (С1-С6)алкил или (С2-С6)гетероалкил;
R3 представляет собой цианогруппу, (С6-С12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил или -NR8R9;
R4 представляет собой водород, цианогруппу, (С6-С12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С1-С8)алкил, (С2-С8)алкенил или (С2-С8)алкинил;
R6 представляет собой гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S;
R7 представляет собой водород или (С1-С5)алкил;
R8 и R9 независимо представляют собой водород, (С1-С5)алкил, окси(С1-С5)алкил или карбокси(С1-С5)алкил,
по выбору, R8 и R9 объединены с образованием 4-, 5-, 6- или 7-членного цикла, включающего атом азота, к которому они присоединены, и от 0 до 2 дополнительных гетероатомов, выбранных из N, О и S; и
индекс m равен 0, 1 или 2,
в которой соединение отлично от 3-(4-(4-метоксибензилокси)фенил)пент-4-иновой кислоты, b-этенил-4-фенилметоксибензолпропионовой кислоты, 4-(2-хинолинилметокси)-b-[4-(2-хинолинилметокси)
фенил]бензолпропионовой кислоты, 3-(4-(4-метоксибензилокси)фенил)-5-(триметилсилил)пент-4-иновой кислоты, b-амино-4-[(4-бром-2,5-дигидро-2-метил-5-оксо-1-фенил-1Н-пиразол-3-ил)метокси]-3-метоксибензолпропионовой кислоты или их солей.
2. Соединение по п.1, в котором если Q представляет собой (С6-С12)арил, L1 представляет собой связь и А содержит карбонильную группу, то Р отлично от фурана или тиофена.
3. Соединение по п.1, в котором Р выбран из группы, состоящей из бензола, нафталина, пиррола, пиразола, имидазола, пиразина, оксазола, изоксазола, тиазола, фурана, тиофена, пиридина, пиримидина, пиридазина, бензотиазола, пурина, бензимидазола, бензоксазола, триазола, оксадиазола, тиадиазола, бензооксадиазола, дибензофурана, индола, индазола, карбазола, карболина, изохинолина, хиноксалина и хинолина.
4. Соединение по п.1, в котором Р выбран из группы, состоящей из бензола, нафталина, пиррола, пиразина, пиридина, пиримидина, пиридазина, пурина, индола, карболина, изохинолина, хиноксалина и хинолина.
5. Соединение по п.1, в котором Р представляет собой (С6-С12)ароматическую группу, А представляет собой -СО2Н, L1 представляет собой связь, a R4 представляет собой водород.
6. Соединение по п.1, в котором А представляет собой -СО2Н, тетразол-5-ил, -C(O)NHSO2CH3 или
-C(O)NHR6.
7. Соединение по п.1, в котором R4 представляет собой водород.
8. Соединение по п.7, в котором А представляет собой -СО2Н или тетразол-5-ил.
9. Соединение по п.7, в котором А представляет собой -СО2Н.
10. Соединение по п.9, в котором Р представляет собой (С6-С12)ароматическую группу или гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S.
11. Соединение по п.1, в котором Р представляет собой (С6-С12)ароматическую группу или гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S.
12. Соединение по п.11, в котором А представляет собой -CO2H.
13. Соединение по п.12, в котором R4 представляет собой водород.
14. Соединение по п.12, в котором L1 представляет собой связь, О или N(R1).
15. Соединение по п.12, в котором L1 представляет собой связь.
16. Соединение по п.11, в котором соединение представлено следующей структурной формулой:
17. Соединение по п.16, в котором А представляет собой -СО2Н.
18. Соединение по п.17, в котором L1 представляет собой связь.
19. Соединение по п.18, в котором R4 представляет собой водород.
20. Соединение по п.1, в котором Q представляет собой (С6-С12)арил.
21. Соединение по п.1, в котором L1 представляет собой связь.
22. Соединение по п.1, в котором Р представляет собой (С6-С12)ароматическую группу, а А представляет собой -СО2Н.
23. Соединение по п.1, в котором А представляет собой -CO2H.
24. Соединение по п.23, в котором R3 представляет собой (С2-С8)алкил.
25. Соединение по п.23, в котором R3 представляет собой (С3-С8)алкенил.
26. Соединение по п.23, в котором R3 представляет собой (С2-С8)алкинил.
27. Фармацевтическая композиция, проявляющая активность по отношению к рецептору GPR40, содержащая фармацевтически приемлемый носитель, разбавитель или наполнитель и соединение по п.1.
28. Способ лечения диабета типа II, заключающийся в том, что нуждающемуся в этом субъекту вводят терапевтически эффективное количество соединения по п.1.
29. Способ лечения заболевания или состояния, чувствительных к модулированию GPR40, заключающийся в том, что нуждающемуся в этом лечении субъекту вводят терапевтически эффективное количество соединения по п.1.
30. Способ по п.29, в котором указанное заболевание или состояние выбирают из группы, состоящей из диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемшш, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии, гипертриглицеридемии, дислипидемии, метаболического синдрома, синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза, тромботических нарушений, нефропатии, диабетической невропатии, диабетической ретинопатии, половой дисфункции, дерматопатии, диспепсии, гипогликемии, рака и отека.
31. Способ по п.28, в котором указанное соединение вводят перорально, парентерально или местно.
32. Способ по п.28, в котором указанное соединение вводят в комбинации со вторым терапевтическим агентом.
33. Способ по п.32, в котором в качестве второго терапевтического агента используют метформин или тиазолидиндион.
34. Способ модулирования функции GPR40 в клетке, заключающийся в том, что осуществляют контактирование клетки с соединением по п.1.
35. Способ модулирования функции GPR40, заключающийся в том, что осуществляют контактирование GPR40 с соединением по п.1.
36. Способ модулирования циркулирующей концентрации инсулина в организме субъекта, заключающийся в том, что субъекту вводят соединения по п.1.
37. Способ по п.36, в котором концентрацию инсулина повышают.
Текст
011010 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, способным модулировать G-белоксвязанный рецептор GPR40, композициям, содержащим эти соединения, и способам их применения для контроля уровней инсулина in vivo и для лечения таких состояний, как диабет типа II, гипертензия, кетоацидоз,ожирение, непереносимость глюкозы и гиперхолестеринемии и подобных нарушений, ассоциированных с патологически высокими или низкими уровнями липопротеинов, триглицеридов или глюкозы в плазме. Предшествующий уровень техники Продукция инсулина занимает центральное место в регуляции углеводного и липидного обмена. Дисбаланс инсулина приводит к таким состояниям, как сахарный диабет типа II, серьезному заболеванию обмена веществ, которое поражает около 5% населения западного мира и более 150 млн человек во всем мире. Инсулин секретируется из -клеток поджелудочной железы в ответ на повышенный уровень глюкозы в плазме, который увеличивается в присутствии жирных кислот. Современные представления о функции G-белоксвязанного рецептора GPR40 в модуляции секреции инсулина дает понимание регуляции углеводного и липидного обмена у позвоночных животных и, кроме того, представляет мишени для создания терапевтических агентов для лечения таких нарушений, как ожирение, диабет, сердечнососудистое заболевание и дислипидемия.GPR40 является членом суперсемейства генов рецепторов, связанных с G-белком ("GPCRs").GPCRs представляют собой мембранные белки, характеризующиеся тем, что имеют семь предполагаемых трансмембранных доменов, которые отвечают на ряд молекул активацией внутриклеточных путей передачи сигнала, важных в отношении разнообразных физиологических функций. GPR40 первым идентифицирован как рецептор-сирота (т.е. рецептор без известного лиганда) из фрагмента геномной ДНКчеловека. См. статью Sawzdargo et al. (1997), Biochem. Biophys. Res. Commun., 239: 543-547. GPR40 экспрессируется на высоком уровне в -клетках поджелудочной железы и в секретирующих инсулин клеточных линиях. Активация GPR40 связана с модулированией семейства Gq внутриклеточных сигнальных белков и сопутствующей индукцией повышенных уровней кальция. Показано, что жирные кислоты служат лигандами для GPR40 и что жирные кислоты регулируют секрецию инсулина посредствомGPR40. См. статьи Itoh et al. (2003), Nature, 422: 173-176; Briscoe et al. (2003), J. Biol. Chem., 278: 1130311311; Kotarsky et al. (2003), Biochem. Biophys. Res. Commun., 301: 406-410. Распространенность диабета типа II, ожирения, гипертензии, сердечно-сосудистого заболевания и дислипидемии особенно повышает потребность в новых терапевтических препаратах для эффективного лечения или предупреждения данных состояний. Сущность изобретения В настоящем описании представлены соединения, фармацевтические композиции и способы, которые могут быть использованы для лечения или предупреждения состояния или нарушения, такого как диабет типа II, ожирение, гипергликемия, непереносимость глюкозы, устойчивость к инсулину, гиперинсулинемия, гиперхолестеринемия, гипертензия, гиперлипопротеинемия, гиперлипидемия, гипертриглицеридемия, дислипидемия, метаболический синдром, синдром X, сердечно-сосудистое заболевание, атеросклероз, заболевание почек, кетоацидоз, тромботические нарушения, нефропатия, диабетическая невропатия, диабетическая ретинопатия, половая дисфункция, дерматопатия, диспепсия, гипогликемия, рак или отек. Соединения, соответствующие изобретению,имеют общую формулу I в которой Q представляет собой водород, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1 С 6)алкил или (С 2-С 6)гетероалкил;P представляет собой (С 6-C12)ароматическую группу, гетероароматическую группу, содержащую 510 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 3-С 8)гетероциклоалкилен или (С 3-С 8)циклоалкилен;R4 представляет собой водород, цианогруппу, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 8)алкил, (С 2-С 8)алкенил или (С 2-С 8)алкинил;R6 представляет собой гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S;R7 представляет собой водород или (С 1-С 5)алкил;R8 и R9 независимо представляют собой водород, (С 1-С 5)алкил, окси(С 1-С 5)алкил или карбокси(С 1 С 5)алкил,необязательно R8 и R9 объединены с образованием 4-, 5-, 6- или 7-членного цикла, включающего атом азота, к которому они присоединены, и от 0 до 2 дополнительных гетероатомов, выбранных из N, О и S; и индекс m равен 0, 1 или 2,в которой соединение отлично от 3-(4-(4-метоксибензилокси)фенил)пент-4-иновой кислоты, -этенил-4-фенилметоксибензолпропионовой кислоты, 4-(2-хинолинилметокси)[4-(2-хинолинилметокси) фенил]бензолпропионовой кислоты, 3-(4-(4-метоксибензилокси)фенил)-5-(триметилсилил)пент-4-иновой кислоты, -амино-4-[(4-бром-2,5-дигидро-2-метил-5-оксо-1-фенил-1H-пиразол-3-ил)метокси]-3-метоксибензолпропионовой кислоты или их солей. Соединения, соответствующие изобретению, включают их фармацевтически приемлемые соли,сольваты или пролекарственные формы. В некоторых вариантах осуществления настоящее изобретение представляет соединение, имеющее формулу Ia в которой Q, L1, P, L3, A, R3 и R4 определены для формулы I выше. В другом варианте изобретение представляет фармацевтические композиции, содержащие фармацевтически приемлемые носитель, разбавитель или наполнитель и соединение формулы I или Ia. В другом варианте изобретение представляет способы лечения или предупреждения заболевания или состояния, выбранных из группы, состоящей из диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемии, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии, гипертриглицеридемии, дислипидемии, метаболического синдрома,синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза, нефропатии, диабетической невропатии, диабетической ретинопатии, половой дисфункции, тромботических нарушений, дерматопатии, диспепсии, гипогликемии, гипертензии, рака и отека, заключающиеся во введении нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или Ia. В другом варианте изобретение представляет способы лечения или предупреждения заболевания или состояния, чувствительного к модулированию GPR40, заключающиеся во введении нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или Ia. В другом варианте изобретение представляет способы лечения или предупреждения заболевания или состояния, опосредованного, регулируемого или находящегося под воздействием -клетки поджелудочной железы, заключающиеся во введении нуждающемуся в этом субъекту терапевтически эффективного количества соединения формулы I или Ia. В другом варианте изобретение представляет способы модулирования функции GPR40 в клетке, заключающиеся в контактировании клетки с соединением формулы I или Ia. В другом варианте изобретение представляет способы модулирования функции GPR40, заключающиеся в контактировании GPR40 с соединением формулы I или Ia. В другом варианте изобретение представляет способы модулирования концентрации циркулирующего инсулина в организме субъекта, заключающиеся во введении субъекту соединения формулы I или Ia. Другие объекты, признаки и преимущества изобретения будут очевидны для специалистов, компетентных в данной области, из последующего описания и пунктов формулы. Перечень фигур чертежей и иных материалов На пригалаемой фигуре представлена схема синтеза некоторых соединений, соответствующих изобретению. Сведения, подтверждающие возможность осуществления изобретения Сокращения и определения Термины "лечить", "лечащий" и "лечение", использованные в данном контексте, включают ослабле-2 011010 ние или устранение состояния либо заболевания и/или сопровождающих его симптомов и облегчение. Термины "предупреждать", "предупреждающий" и "предупреждение", использованные в данном контексте,относятся к способу задержки или предотвращения появления состояния или заболевания и/или сопровождающих его симптомов, ограждая субъекта от состояния или заболевания либо уменьшая риск субъекта заболеть. Термин "терапевтически эффективное количество" относится к такому количеству соединения, которое будет вызывать тот биологический или медицинский ответ ткани, системы или субъекта, которого добиваются. Термин "терапевтически эффективное количество" включает такое количество соединения,которое при введении является достаточным для предупреждения развития или облегчения до некоторой степени одного или более симптомов состояния или нарушения, которые лечат у субъекта. Терапевтически эффективное количество для каждого субъекта будет варьироваться в зависимости от соединения,заболевания и его тяжести, а также возраста, массы тела и. т.п. субъекта, подвергаемого лечению. Термин "субъект" определяют в данном контексте как включающий животные организмы, такие как млекопитающие, в том числе, но без ограничения перечисленным, приматы (например, человек), коровы, овцы, козы, лошади, собаки, кошки, кролики, крысы, мыши и т.п. В предпочтительных вариантах осуществления субъектом является человек. Термины "модулировать", "модулирование" и т.п. относятся к способности соединения повышать или снижать функцию или активность GPR40 либо прямо, либо косвенно. Ингибиторы представляют собой соединения, которые, например, связывают, частично или полностью блокируют стимуляцию,снижают, препятствуют, задерживают активацию, инактивируют, десенсибилизируют или регулируют понижающим образом сигнальную трансдукцию, такие как, например, антагонисты. Активаторы представляют собой соединения, которые, например, связывают, стимулируют, повышают, активируют, способствуют, усиливают активацию, сенсибилизируют или регулируют повышающим образом сигнальную трансдукцию, такие как, например, агонисты. Модуляция может присходить in vitro или in vivo. Как используют в данном контексте, термин "GPR40-опосредованное состояние или нарушение" и т.п. относится к состоянию или нарушению, характеризующемуся несоответствующей, например меньшей или большей, чем нормальная, активностью GPR40. GPR40-опосредованное состояние или нарушение может быть полностью или частично опосредовано несоответствующей активностью GPR40. ОднакоGPR40-опосредованное состояние или нарушение представляет собой такое нарушение, при котором модулирование GPR40 приводит в результате к некоторому воздействию на основное состояние или заболевание (например, модулятор GPR40 приводит к некоторому улучшению здоровья пациента среди, по меньшей мере, нескольких пациентов). В качестве примера GPR40-опосредованные состояния и нарушения включают рак и нарушения обмена веществ, например диабет, диабет типа II, ожирение, гипергликемию, непереносимость глюкозы, устойчивость к инсулину, гиперинсулинемию, гиперхолестеринемию,гипертензию, гиперлипопротеинемию, гиперлипидемию, гипертриглицеридемию, дислипидемию, кетоацидоз, гипогликемию, тромботические нарушения, метаболический синдром, синдром X и родственные нарушения, например сердечно-сосудистое заболевание, атеросклероз, заболевание почек, нефропатию,диабетическую невропатию, диабетическую ретинопатию, половую дисфункцию, дерматопатию, диспепсию и отек. Термин "алкил", как таковой или как часть другого заместителя, означает, если не указано иначе,неразветвленную или разветвленную цепь или циклический углеводородный радикал либо их комбинацию, который является полностью насыщенным, имеющим указанное число атомов углерода (например,С 1-С 10 означает от 1 до 10 атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил,изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропил,циклопропилметил, их гомологи и изомеры, например н-пентил, н-гексил, н-гептил, н-октил и т.п. Термин "алкенил", как таковой или как часть другого заместителя, означает неразветвленную или разветвленную цепь или циклический углеводородный радикал либо их комбинацию, который может быть моно- или полиненасыщенным, имея указанное число атомов углерода (т.е. С 2-С 8 означает от 2 до 8 атомов углерода) и одну или более двойных связей. Примеры алкенильных групп включают винил, 2-пропенил, кротил, 2-изопентил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил) и их высшие гомологи и изомеры. Термин "алкинил", как таковой или как часть другого заместителя, означает углеводородный радикал с неразветвленной или разветвленной цепью либо их комбинацию, который может быть моно- или полиненасыщенным, имея обозначенное число атомов углерода (т.е. С 2-С 8 означает от 2 до 8 атомов углерода) и одну или более тройных связей. Примеры алкинильных групп включают этинил, 1- и 3-пропинил, 3-бутинил и их высшие гомологи и изомеры. Термин "алкилен", как таковой или как часть другого заместителя, означает двухвалентный радикал, полученный из алкила, например -СН 2 СН 2 СН 2 СН 2-. Как правило, алкильная (или алкиленовая) группа имеет от 1 до 24 атома углерода, причем группы, имеющие 12 или меньше атомов углерода, являются предпочтительными в настоящем изобретении. "Низший алкил" или "низший алкилен" представляет собой более короткую алкильную или алкиленовую группу, как правило, имеющую 8 или меньше атомов углерода.-3 011010 Термины "алкоксигруппа", "алкиламиногруппа" и "алкилтиогруппа" (или тиоалкоксигруппа) используются в их принятом значении и относятся к тем алкильным группам, которые присоединены к остатку молекулы через атом кислорода, аминогруппу или атом серы, соответственно. Аналогично термин "диалкиламиногруппа" относится к аминогруппе, имеющей две присоединенные алкильные группы,которые могут быть одинаковыми или различными. Термин "гетероалкил", как таковой или в сочетании с другим термином, означает, если не указано иначе, стабильную неразветвленную или разветвленную цепь или циклический углеводородный радикал либо их комбинации, состоящие из атомов углерода и от 1 до 3 гетероатомов, выбранных из группы, состоящей из О, N и S, и где атомы азота и серы могут необязательно быть окисленными и гетероатом азота может быть необязательно переведен в четвертичный. Гетероатом(ы) О, N и S могут быть размещены на любом месте гетероалкильной группы. Примеры включают -СН 2-СН 2-О-СН 3, -CH2-CH2-NH-CH3,-CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2-S(O)-CH3, -CH2-CH2-S(O)2-CH3 и -CH2-CH=N-OCH3. До 2 гетероатомов могут быть следовать друг за другом, как, например, в радикале -CH2-NH-OCH3. Когда используют такое указание, как (С 2-С 8) в отношении гетероалкильной группы, число атомов углерода(2-8 в данном примере) означает, что гетероатомы также учитываются. Например, термин С 2-гетероалкильная группа также означает, например, и -СН 2 ОН (1 атом углерода и 1 гетероатом, замещающий атом углерода), и -CH2SH. Дополнительной иллюстрацией определения гетероалкильной группы, в которой гетероатом является кислород, является гетероалкильная группа, представленная оксиалкильной группой. Например, (С 2 С 5)оксиалкил означает -СН 2-О-СН 3 (С 3-оксиалкильная группа с 2 атомами углерода и 1 атомом кислорода, замещающим атом углерода), -СН 2 СН 2 СН 2 СН 2 ОН и т.п. Термин "гетероалкилен", как таковой или в качестве части другого заместителя, означает двухвалентный радикал, полученный из гетероалкила, например -CH2-CH2-S-CH2CH2- и -CH2-S-CH2-CH2-NHCH2-. В гетероалкиленовых группах гетероатомы могут также располагаться на одном или на обоих концах цепи (например, алкиленокси-, алкилендиокси-, алкиленамино-, алкилендиаминогруппа и т.п.). Кроме того, для алкиленовых и гетероалкиленовых соединительных групп не предусмотрена ориентация. Термины "циклоалкил" и "гетероциклоалкил", как таковые или в сочетании с другими терминами,означают, если не указано иначе, циклические варианты "алкила" и "гетероалкила", соответственно. Так,термины "циклоалкил" и "гетероциклоалкил" означают, что они входят в термины "алкил" и "гетероалкил," соответственно. Кроме того, в гетероциклоалкиле гетероатом может занимать положение, в котором гетероцикл присоединяется к остальной части молекулы. Примеры циклоалкила включают циклопентил, циклогексил, 1-циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3-морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен 3-ил, 1-пиперазинил, 2-пиперазинил и т.п. Термины "циклоалкилен" и "гетероциклоалкилен", как таковые или в сочетании с другими терминами, представляют, если не указано иначе, циклические варианты "алкилена" и "гетероалкилена", соответственно. Так, термины "циклоалкилен" и "гетероциклоалкилен" означают включение в термины "алкилен" и "гетероалкилен", соответственно. Кроме того, в гетероциклоалкилене 1 или более гетероатомов могут занимать положения, в которых гетероцикл присоединяется к остальной части молекулы. Как правило, циклоалкилен или гетероциклоалкилен будут иметь от 3 до 9 атомов, образующих цикл, более типично от 4 до 7 атомов, образующих цикл, и еще более типично, когда 5 или 6 атомов будут образовывать циклоалкиленовый или гетероциклоалкиленовый цикл. Термины "гало" или "галоген", как таковые или в качестве части другого заместителя, означают, если не указано иначе, атом фтора, хлора, брома или йода. Кроме того, такие термины, как "галогеналкил",означают, что они включают алкил, замещенный атомами галогена, которые могут быть одинаковыми или различными, число которых составляет от 1 до (2m'+1), где m' означает общее число атомов углерода в алкильной группе. Например, термин "галоген(С 1-С 4)алкил" означает, что он включает трифторметил,2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п. Так, термин "галогеналкил" включает моногалогеналкил (алкил, замещенный 1 атомом галогена) и полигалогеналкил (алкил, замещенный атомами галогена, число которых составляет от 2 до (2m'+1) атомов галогена). Термин "пергалогеналкил" означает, если не указано иначе, алкил, замещенный (2m'+1) атомами галогена, где m' представляет собой число атомов углерода в алкильной группе. Например, термин "пергалоген(С 1-С 4)алкил" означает, что он включает трифторметил, пентахлорэтил, 1,1,1-трифтор-2-бром-2-хлорэтил и т.п. Термин "арил" означает, если не указано иначе, полиненасыщенный, как правило, ароматический углеводородный заместитель, который может представлять собой одно или несколько колец (до трех колец), которые конденсированы или ковалентно связаны. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от 1 до 4 гетероатомов, выбранных из группы, состоящей изN, О и S, где атомы азота и серы необязательно окислены, а атом(ы) азота необязательно переведен(ы) в четвертичные. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2 нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 1-пиразолил, 3-пиразолил, 5-пиразолил, 2-ими-4 011010 дазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, дибензофурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 4-пиридазинил, 5-бензотиазолил, 2-бензоксазолил,5-бензоксазолил, бензо[с][1,2,5]оксадиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1 Н-индазолил,карбазолил, -карболинил, -карболинил, -карболинил, 1-изохинолил, 5-изохинолил, 2-зинокалинил, 5 хиноксалинил, 2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил и 8-хинолил. В предпочтительном варианте термин "арил" относится к фенильной или нафтильной группе, которая является незамещенной или замещенной. Предпочтительно "гетероарил" относится к пирролиловой,пиразолиловой, имидазолиловой, пиразиниловой, оксазолиловой, изоксазолиловой, тиазолиловой, фуриловой, тиениловой, пиридиловой, пиримидиловой, бензотиазолиловой, пуриниловой, бензимидазолиловой, индолиловой, изохинолиловой, хиноксалиниловой или хинолиловой группе, которая является незамещенной или замещенной. Суммируя вышесказанное, термин "арил" при использовании в сочетании с другими терминами(например, арилоксигруппа, арилтиооксируппа, арилалкил) включает оба, арильный и гетероарильный,циклы, как определено выше. Так, термин "арилалкил" включает те радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенетил, пиридилметил и т.п.), в том числе те алкильные группы, в которых атом углерода (например, метиленовая группа) замещен, например, атомом кислорода (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.). Каждый их вышеуказанных терминов (например, "алкил", "гетероалкил", "арил" и "гетероарил") включает как замещенные, так и незамещенные формы указанного радикала, если на указано иначе. Предпочтительные заместители для каждого типа радикала представлены ниже. Заместители для алкильных и гетероалкильных радикалов (а также тех групп, которые относятся к алкилену, алкенилу, гетероалкилену, гетероалкенилу, алкинилу, циклоалкилу, гетероциклоалкилу, циклоалкенилу и гетероциклоалкенилу) могут быть представлены множеством групп, выбранных из -OR',=O, =NR', =N-OR', -NR'R, -SR', галогена, -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R, -NR"C(O)R',-NR'-C(O)NRR, -NR'-SO2NRR, -NR"CO2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR',-SiR'R"R"', -S(O)R', -SO2R', -SO2NR'R, -NRSO2R, -CN и -NO2, число которых лежит в интервале от 0 до 3, причем те группы, которые имеют 0, 1 или 2 заместителя, особенно предпочтительны. R', R" и R, каждый независимо друг от друга, означают водород, незамещенный (С 1-С 8)алкил и гетероалкил, незамещенный арил, арил, замещенный от 1 до 3 атомов галогена, незамещенный алкил, алкокси- или тиоалкоксигрупы, галоген(С 1-С 4)алкильную или арил(С 1-С 4)алкильную группы. Когда R' и R" присоединены к одному и тому же атому азота, они могут объединяться с атомом азота с образованием 5-, 6- или 4 членного цикла. Например, -NR'R" включает 1-пирролидинил и 4-морфолинил. Как правило, алкильная или гетероалкильная группа несет от 0 до 3 заместителей, причем те группы, которые имеют 2 или меньше заместителей, предпочтительны в настоящем изобретении. Более предпочтительно, когда алкильный или гетероалкильный радикал будет незамещенным или монозамещенным. Наиболее предпочтительно, когда алкильный или гетероалкильный радикал будет незамещенным. Из вышеприведенного описания заместителей компетентный специалист в данной области техники поймет, что "алкил" включает такие группы, как тригалогеналкил (например, -CF3 и -CH2CF3). Предпочтительные заместители для алкильных и гетероалкильных радикалов выбирают из -OR1,=O, -NR'R", -SR', галогена, -OC(O)R', -C(O)R', -CO2R', -CONR'R, -OC(O)NR'R, -NR"C(O)R', -NR"CO2R',-NR'-SO2NR"R, -S(O)R', -SO2R', -SO2NR'R", -NR"SO2R, -CN и -NO2, где R' и R определены выше. Более предпочтительно заместители выбраны из -OR', =O, -NR'R", галогена, -OC(O)R', -CO2R', -CONR'R",-OC(O)NR'R", -NR"C(O)R', -NR"CO2R', -NR1-SO2NRR, -SO2R', -SO2NR'R, -NR"SO2R, -CN и -NO2. Аналогично заместители для арильных и гетероарильных групп варьируют и выбирают из галогенила, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -OC(O)NR'R", -NR"C(O)R',-NR"C(O)2R', -NR'-C(O)NR"R'", -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R',-S(O)2NR'R", -N3, -CH(Ph)2, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила, число которых составляет от 0 до общего числа открытых валентностей на системе ароматического цикла и где R', R" и R'" независимо друг от друга выбраны из водорода, (С 1-С 8)алкила и гетероалкила, незамещенного арила и гетероарила, (незамещенный арил)-(С 1-С 4)алкила и (незамещенный арил)окси-(С 1-С 4)алкила. 2 заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены на заместитель формулы -T-C(O)-(CH2)q-U-, в которой Т и U независимо друг от друга представляют собой -NH-, -O-, -СН 2- или одинарную связь, a q равно целому числу от 0 до 2. Альтернативно 2 заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены на заместитель формулы -А-(СН 2)r-В-, в которой А и В независимо друг от друга представляют собой -СН 2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь, а r равно целому числу от 1 до 3. Одна из одинарных связей образованного таким образом нового цикла может быть необязательно заменена двойной связью. Альтернативно 2 заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно замещены на заместитель формулы -(CH2)S-X-(CH2)t, в которой s и t независимо друг от друга равны целым числам от 0 до 3, а X означает -О-, -NR-, -S-, -S(O)-, -S(O)2-5 011010 или -S(O)2NR'-. Заместитель R' в -NR'- и -S(O)2NR'- выбран из водорода или незамещенного (С 1-С 6)алкила. В других случаях R' имеет определенные выше значения. В настоящем описании термин "гетероатом" включает кислород (О), азот (N) и серу (S). В настоящем описании выражение "биоизостерическая форма -СО 2 Н" означает, что заместитель-СО 2 Н может быть необязательно заменен биоизостерическими группами, такими как и т.п. См., например, монографию The Practice of Medicinal Chemistry (Методы медицинской химии) под ред. Wermuth, С.G., Academic Press, New York, 1996, с. 203. Термин "фармацевтически приемлемая соль" означает, что он включает соль активного соединения,которая получена с использованием относительно нетоксичных кислот и оснований в зависимости от конкретных заместителей, находящихся на соединении, описанном в данном контексте. Когда соединение, соответствующее изобретению, содержит относительно кислотные группы, щелочно-аддитивную соль можно получить путем контактирования нейтральной формы данного соединения с достаточным количеством желательного основания либо в неразбавленном виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых щелочно-аддитивных солей включают соль натрия,калия, кальция, аммония, органического амина или магния либо им подобную соль. Когда соединение,соответствующее изобретению, содержит относительно основные группы, кислотно-аддитивная соль может быть получена путем контактирования нейтральной формы данного соединения с достаточным количеством желательной кислоты либо в неразбавленном виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают те, которые получены из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодисто-водородная или фосфористая кислоты и т.п., а также соли, полученные из относительно нетоксичных органических кислот, например уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, субериновой, фумаровой, миндальной, фталевой, бензолсульфокислоты, птолуолсульфокислоты, лимонной, винной, метансульфокислоты и т.п. Включены также соли аминокислот, таких как аргинин и т.п., и соли органических кислот, например глюкуроновой и галактуроновой кислот и т.п. (см., например, статью Berge et al. (1977), J. Pharm. Sci., 66: 1-19). Некоторые специфические соединения, соответствующие изобретению, содержат как основные, так и кислотные функциональности, которые позволяют соединениям превращаться как в щелочно-, так и кислотно-аддитивные соли. Нейтральные формы соединений можно восстановить путем контактирования соли с основанием или кислотой и выделения исходного соединения обычным образом. Исходная форма соединения отличается от различных солевых форм по ряду физических свойств, таких как растворимость в полярных растворителях, но в других отношениях соли эквивалентны исходной форме соединения для целей изобретения. Кроме солевых форм, изобретение представляет соединения, которые находятся в пролекарственной форме. Пролекарственные формы соединений, описанные в данном контексте, представляют собой те соединения, которые легко подвергаются химическим изменениям в физиологических условиях с превращением в соединения, соответствующие изобретению. Кроме того, пролекарственные формы можно превратить в соединения, соответствующие изобретению, химическими или биохимическими методами в среде ex vivo. Например, пролекарственные формы можно медленно превратить в соединения, соответ-6 011010 ствующие изобретению, если поместить в резервуар чрескожного пластыря с подходящим ферментом или химическим реагентом. Пролекарственные формы часто используют, поскольку в ряде случаев их легче вводить, чем исходный лекарственный препарат. Например, они могут быть биодоступными при пероральном применении, тогда как исходный лекарственный препарат небиодоступен. Пролекарственная форма может также обладать улучшенной растворимостью в фармацевтических композициях по сравнению с исходным лекарственным препаратом. В области техники известно большое разнообразие пролекарственных производных, например таких, которые основаны на гидролитическом расщеплении или окислительной активации пролекарственной формы. Примером, не предусматривающим ограничения пролекарственной формы, могло бы служить соединение, соответствующее изобретению, которое вводят в виде сложного эфира ("пролекарственной формы"), но затем оно метаболически гидролизуется до карбоновой кислоты, активного начала. В качестве дополнительных примеров также можно указать пептидильные производные соединений. В данном описании термин "сольват" относится к соединению, соответствующему настоящему изобретению, или его соли, которыедополнительно связаны со стехиометрическим или нестехиометрическим количеством растворителя нековалентными межмолекулярными силами. Когда растворитель представляет собой воду, сольвент является гидратом. Некоторые соединения, соответствующие изобретению, могут находиться в множестве кристаллических или аморфных форм. В целом, все физические формы равнозначны для применения, предполагаемого изобретением, и предусмотрено их включение в объем изобретения. Некоторые соединения, соответствующие изобретению, имеют асимметричные атомы углерода (оптические центры) или двойные связи; предусмотрено, что все рацематы, энантиомеры, диастереомеры,геометрические изомеры и отдельные изомеры охватываются объемом изобретения. В данном описании (если не указано иначе), термины "стереоизомер" или "стереомерно чистый" означают один стереоизомер соединения, который, практически, не содержит других стереоизомеров данного соединения. Например, стереомерно чистое соединение, имеющее один хиральный центр, будет,практически, чистым от противоположного энантиомера соединения. Стереомерно чистое соединение,имеющее два хиральных центра, будет, практически, чистым от других диастереомеров соединения. Типичное стереомерно чистое соединения содержит больше чем приблизительно 80 мас.% одного стереоизомера соединения и меньше чем приблизительно 20 мас.% других стереоизомеров соединения, более предпочтительно больше чем приблизительно 90 мас.% одного стереоизомера соединения и меньше чем приблизительно 10 мас.% других стереоизомеров соединения, еще более предпочтительно больше чем приблизительно 95 мас.% одного стереоизомера соединения и меньше чем приблизительно 5 мас.% других стереоизомеров соединения и наиболее предпочтительно больше чем приблизительно 97 мас.% одного стереоизомера соединения и меньше чем приблизительно 3 мас.% других стереоизомеров соединения. Следует отметить, что если стереохимия структуры или части структуры не отмечена, например,жирными или пунктирными линиями, то структуру или часть структуры следует интерпретировать как охватывающую все ее стереоизомеры. Некоторые соединения, соответствующие изобретению, имеют один или более хиральных центров и могут находиться в виде рацемических смесей энантиомеров, смесей диастереомеров или энантиомерно или оптически чистых соединений. Данное изобретение охватывает применение стереомерно чистых форм данных соединений, а также применение смесей данных форм. Например, смеси, включающие равные или неравные количества энантиомеров определенного соединения, соответствующего изобретению,могут быть использованы в способах и композициях, соответствующих изобретению. Данные изомеры могут быть асимметрично синтезированы или разделены с помощью стандартных методик, таких как хиральные колонки или агенты для хирального разделения. См., например, монографию Jacques J. et al.,Enantiomers, Racemates and Resolutions (Энантиомеры, рацематы и способы разделения) (WileyInterscience, New York, 1981); статью Wilen S.H. (1997), Tetrahedron, 33: 2725; монографию Eliel E.L.,Stereochemistry of Carbone Compounds (Стереохимия углеродных соединений) (McGraw-Hill, NY, 1962) и справочник Wilen S.H., Tables of Resolving Agents и Optical Resolutions (Таблицы агентов для разделения и оптических разделений), с. 268 (под ред. E.L. Eliel, Univ. of Notre Dame Press, Notre Dame, IN, 1972). Соединения, соответствующие изобретению, могут также характеризоваться неестественным соотношением изотопов одного или более атомов, которые составляют данные соединения. Например, соединения могут быть помечены радиоактивными изотопами, такими как, например, тритий (3 Н), йод-125(125I) или углерод-14 (14 С). Соединения с радиоактивной меткой используют как терапевтические или профилактические агенты, реагенты для исследований, например реагенты для анализа GPR40, и диагностические агенты, например агенты для визуализации in vivo. Предусмотрено, что все изотопные варианты соединений, соответствующих изобретению, радиоактивные они или нет, охватываются объемом изобретения. Варианты осуществления изобретения В одном аспекте класс соединений, которые модулируют GPR40, описан в данном контексте. В зависимости от биологической окружающей среды (например, типа клеток, патологического состояния субъекта и т.п.), данные соединения могут модулировать, например активировать или ингибировать дей-7 011010 ствия GPR40. В связи с модулированией GPR40 соединения находят применение в качестве терапевтических агентов, способных регулировать уровни инсулина у субъекта. Соединения находят применение в качестве терапевтических агентов для модулировании заболеваний и состояний, чувствительных к модулированию GPR40, и/или опосредованных GPR40, и/или опосредованных -клетками поджелудочной железы. Как отмечено выше, примеры данных заболеваний и состояний включают диабет, ожирение,гипергликемию, непереносимость глюкозы, устойчивость к инсулину, рак, гиперинсулинемию, гиперхолестеринемию, гипертензию, гиперлипопротеинемию, гиперлипидемию, гипертриглицеридемию, дислипидемию, кетоацидоз, гипогликемию, метаболический синдром, синдром X, сердечно-сосудистое заболевание, атеросклероз, заболевание почек, нефропатию, тромботические нарушения, диабетическую невропатию, диабетическую ретинопатию, дерматопатию, диспепсию и отек. Кроме того, соединения используют для лечения и/или предупреждения осложнений данных заболеваний и нарушений (например,диабета типа II, половой дисфункций, диспепсии и т.д.). Хотя полагают, что соединения, соответствующие изобретению, реализуют свои эффекты посредством взаимодействия с GPR40, механизм действия соединений не является ограничивающим вариантом осуществления изобретения. Соединения, рассматриваемые в изобретении, включают, но без ограничения перечисленным, иллюстративные соединения, представленные в данном контексте. Соединения Настоящее изобретение представляет соединения, имеющие формулу IQ представляет собой водород, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 6) алкил или (С 2-С 6)гетероалкил. В предпочтительных вариантах осуществления Q представляет собой (С 6-С 12)арил. В дополнительных предпочтительных вариантах осуществления Q представляет собой 4-(трифторметил)фенил или п-толил.L1 означает связь, (С 1-С 4)алкилен, (С 2-С 4)гетероалкилен, О, S(O)m, N(R1), С(О)-(С 5-С 7)гетероциклоалкилен, (С 1-С 4)алкилен-SO2N(R2), (C1-C4)алкилен-N(R2)SO2 или C(O)N(R2). В некоторых вариантах осуществления L1 означает связь, (С 1-С 4)алкилен, (С 2-С 4)гетероалкилен, О,S(O)m, N(R1) или C(O)N(R2). В некоторых вариантах осуществления L1 означает связь, О или N(R1). В предпочтительных вариантах осуществления L1 означает связь. Р представляет собой (С 6-С 12)ароматическую группу, гетероароматическую группу, содержащую 510 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 3-С 8)гетероциклоалкилен или (С 3-С 8)циклоалкилен; В некоторых вариантах осуществления, когда Р представляет собой (С 6-С 12)ароматическую группу,термин "ароматический" включает (С 6-С 12)арил. В других вариантах осуществления, когда Р представляет собой гетероароматический цикл, термин "гетероароматический" включает гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы,включающей N, О или S. В некоторых вариантах осуществления Р представляет собой (С 6-С 12)ароматическую группу или гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S. В некоторых вариантах осуществления Р представляет собой моноциклическую ароматическую группу или моноциклическую гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S. В некоторых вариантах осуществления Р выбрано из группы, состоящей из бензола, нафталина,пиррола, пиразола, имидазола, пиразина, оксазола, изоксазола, тиазола, фурана, тиофена, пиридина, пиримидина, пиридазина, бензотиазола, пурина, бензимидазола, бензоксазола, триазола, оксадиазола, тиадиазола, бензоксадиазола, дибензофурана, индола, индазола, карбазола, карболина, изохинолина, хиноксалина и хинолина. Например, Р может представлять собой бензол, нафталин, пиррол, пиразин, пиридин,пиримидин, пиридазин, пурин, индол, карболин, изохинолин, хиноксалин или хинолин. В некоторых вариантах осуществления Р представляет собой бензольную, тиазоловую или оксазоловую группу. В предпочтительных вариантах осуществления L1 означает связь, О или N(R1), a P представляет собой (С 6-С 12)ароматическую группу или гетероароматическую группу, содержащую 5-10 членов в кольце,-8 011010 из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S. А представляет собой -СО 2 Н, тетразол-5-ил, -SO3H, -PO3H2, -SO2NH2, -C(O)NHSO2CH3, -CHO, -C(O)R6,-C(O)NHR6, -C(O)NHOR7, тиазолидиндионил, гидроксифенил или пиридил. В ряде вариантов осуществления А представляет собой биоизостерическую форму -СО 2 Н. В ряде вариантов осуществления А представляет собой -СО 2 Н или тетразол-5-ил, -C(O)NHSO2CH3 или -C(O)NHR6. В некоторых вариантах осуществления А представляет собой -СО 2 Н или тетразол-5-ил. В предпочтительных вариантах осуществления А представляет собой -СО 2 Н или его соль. В некоторых вариантах осуществления Р представляет собой (С 6-С 12)ароматическую группу или гетероароматическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, а А представляет собой -СО 2 Н. R1 представляет собой (С 1-С 6)алкил, (С 6-С 12)арил(С 1-С 3)алкил или (С 2-С 6)гетероалкил. В ряде вариантов осуществления R1 представляет собой (С 1-С 6)алкил или (С 2-С 6)гетероалкил.R3 представляет собой цианогруппу, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1 С 8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил или -NR8R9. В ряде вариантов осуществления R3 представляет собой цианогруппу, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающейN, О или S, (С 2-С 6)алкенил или (С 2-С 6)алкинил. В ряде вариантов осуществления R3 представляет собой (С 2-С 8)алкил, (С 3-С 8)алкенил или (С 3-С 8)алкинил. В некоторых вариантах осуществления R3 представляет собой (С 6-С 12)арил или гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S. В ряде предпочтительных вариантов осуществления R3 представляет собой тетразолил, тиазолил,пиразолил, изоксазолил, оксазолил, пирролил, тиенил или проп-1-инил. В ряде вариантов осуществления R3 представляет собой тетразолил, тиазолил или проп-1-инил.R4 представляет собой водород, цианогруппу, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 8)алкил, (С 2-С 8)алкенил или (С 2-С 8)алкинил. В некоторых вариантах осуществления R4 представляет собой водород или метил. В предпочтительных вариантах осуществления R4 представляет собой водород. В дальнейших предпочтительных вариантах осуществления R3 представляет собой цианогруппу,(С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 8)алкил, (С 2-С 8)алкенил, (С 2-С 8)алкинил или -NR8R9, и R4 представляет собой водород.R6 представляет собой гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S.R7 представляет собой водород или (С 1-С 5)алкил.R8 и R9 независимо друг от друга представляют собой водород, (С 1-С 5)алкил, окси(С 1-С 5)алкил или карбокси(С 1-С 5)алкил. Необязательно R8 и R9 могут быть объединены с образованием 4-, 5-, 6- или 7-членного цикла, содержащего атом азота, к которому они присоединены, и от 0 до 2 дополнительных гетероатомов, выбранных из N, О и S. Цикл, сформированный путем объединения R8 и R9, может быть насыщенным, ненасыщенным или ароматическим. Индекс m равен 0, 1 или 2. В ряде вариантов осуществления соединения формулы I не включают 3-(4-(4-метоксибензилокси) фенил)пент-4-иновую кислоту, -этенил-4-фенилметокси-бензолпропионовую кислоту, 4-(2-хинолинилметокси)[4-(2-хинолинилметокси)фенил]бензолпропионовую кислоту и 3-(4-(4-метоксибензилокси) фенил)-5-(триметилсилил)пент-4-иновую кислоту или -амино-4-[(4-бром-2,5-дигидро-2-метил-5-оксо-1 фенил-13-пиразол-3-ил)метокси]-3-метоксибензолпропионовуюкислоту, ее соли и ее сложные эфиры. В ряде вариантов осуществления следует иметь в виду, что соединения формулы I не включают соединения, в которых Р представляет собой 1,2-азольный цикл, когда Q представляет собой (С 6-С 12)арил,гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы,выбранные из группы, включающей N, О или S, L1 означает связь, и А содержит карбонильную группу. В ряде вариантов осуществления следует иметь в виду, что соединения формулы не включают соединения, в которых Р представляет собой фуран или тиофен, когда Q представляет собой (С 6-С 12)арил,L1 означает связь и А содержит карбонильную группу. Соединения, соответствующие изобретению, включают их фармацевтически приемлемые соли,сольваты или пролекарственные формы. В ряде вариантов осуществления предпочтительны сложноэфирные пролекарственные формы. В-9 011010 ряде вариантов осуществления настоящее изобретение представляет соединения, имеющие формулу Ia в которой Q, L1, P, L3, A, R3 и R4 определены для формулы I выше. В некоторых вариантах осуществления формулы Ia Q представляет собой замещенный или незамещенный бензол, a L1 означает связь, (С 1-С 4)алкилен, О или S(O)m. В некоторых вариантах осуществления Р выбрано из группы, состоящей из бензола, нафталина,пиррола, имидазола, пиразина, оксазола, тиазола, пиридина, пиримидина, пиридазина, бензотиазола, пурина, бензимидазола, индола, индазола, карбазола, карболина, изохинолина, хиноксалина и хинолина. В ряде вариантов осуществления, когда Р представляет собой бензол, Q представляет собой водород, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 6)алкил, a L1 означает связь, (С 1 С 4)алкилен, О или S(O)m. В некоторых вариантах осуществления L3 представляет собой (С 1-С 5)алкилен. В ряде вариантов осуществления L3 представляет собой метилен. В ряде вариантов осуществления R3 представляет собой цианогруппу, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 2-С 8)алкил, (С 3-С 8)алкенил, (С 3-С 8)алкинил, -NR8R9, a R4 представляет собой водород, цианогруппу, (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 1-С 8)алкил,(С 2-С 8)алкенил или (С 2-С 8)алкинил. В ряде вариантов осуществления R3 представляет собой цианогруппу, незамещенную (С 6-С 12)арильную или гетероарильную моноциклическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 2-С 8)алкил, (С 3-С 8)алкенил, (С 3-С 8)алкинил, R4 представляет собой водород, а Р выбрано из группы, состоящей из бензола, нафталина, пиррола, имидазола, пиразина, оксазола, тиазола, пиридина, пиримидина, пиридазина, бензотиазола, пурина, бензимидазола, индола, индазола, карбазола, карболина, изхинолина, хиноксалина и хинолина. В некоторых вариантах осуществления R3 представляет собой цианогруппу, незамещенную (С 6-С 12) арильную или гетероарильную моноциклическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 3-С 8)алкенил, (С 3-С 8)алкинил, R4 представляет собой водород, a L3 представляет собой метилен. В ряде вариантов осуществления Q представляет собой (С 6-С 12)арил, гетероарил, содержащий 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающейN, О или S, (С 1-С 6)алкил или (С 2-С 6)гетероалкил, L1 означает связь, (С 1-С 4)алкилен, (С 2-С 4)гетероалкилен, S(O)m, N(R1), (С 1-С 4)алкилен-SO2N(R2), (С 1-С 4)алкилен-N(R2)SO2 или C(O)N(R2), P выбрано из группы, состоящей из бензола, нафталина, пиррола, имидазола, пиразина, оксазола, тиазола, пиридина, пиримидина, пиридазина, бензотиазола, пурина, бензимидазола, индола, индазола, карбазола, карболина, изохинолина, хиноксалина и хинолина, R3 представляет собой цианогруппу, незамещенную (С 6-С 12)ароматическую или гетероароматическую моноциклическую группу, содержащую 5-10 членов в кольце, из которых от 1 до 4 представляют собой гетероатомы, выбранные из группы, включающей N, О или S, (С 2-С 8) алкил, (С 3-С 8)алкенил, (С 3-С 8)алкинил, R4 представляет собой водород, a L3 представляет собой метилен. Получение соединений Соединения, соответствующие изобретению, можно получить с помощью ряда методик синтеза или полусинтеза. На фиг. 1 и в примерах в разделе 6 ниже предложен ряд способов синтеза соединений,представленных в данном описании. Соответствующие исходные материалы можно получить с помощью методик, известных или очевидных для компетентных специалистов в данной области, или исходные материалы могут быть коммерчески доступными. Компетентный специалист в данной области будет иметь в виду, что способы синтеза можно модифицировать в плане использования различных исходных материалов и альтернативных реагентов и что можно провести соответствующие корректировки условий(например, температур, растворителей и т.д.) для осуществления требующихся превращений. Кроме того, компетентный специалист в области техники будет принимать во внимание, что для получения ряда соединений могут быть необходимы защитные группы, и будет осведомлен о тех условиях, которые совместимы с выбранной защитной группой. Соответственно, иллюстративные способы и примеры, описанные в данном контексте, служат для объяснения настоящего изобретения и не должны истолковываться как ограничивающие его объем. Композиции В другом варианте изобретение представляет фармацевтические композиции, пригодные для фар- 10011010 мацевтического применения, содержащие одно или более соединений, соответствующих изобретению, и фармацевтически приемлемые носитель, наполнитель или разбавитель. Термин "композиция", используемый в данном описании, предназначен для того, чтобы охватывать продукт, содержащий определенные ингредиенты (если указано, то в определенных количествах), а также любой продукт, который является результатом, прямым или косвенным, полученным из комбинации определенных ингредиентов в определенных количествах. Под выражением "фармацевтически приемлемый" понимают, что носитель или наполнитель совместим с другими ингредиентами состава и не вреден для того, кто его принимает. В ряде вариантов осуществления настоящее изобретение представляет фармацевтическую композицию, включающую соединение формулы II, в которой R22 означает алкинил, содержащий Si, и где R21,L, Y и W определены выше в формуле II. В некоторых вариантах осуществления атом Si несет до трех замещающих алкильных групп. В некоторых вариантах осуществления R22 представляет собой -CC-Si(CH3)3. Состав композиции может улучшать один или более фармакокинетических признаков (например,пероральную биодоступность, мембранную проницаемость) соединения, соответствующего изобретению(в данном описании его называют активным ингредиентом). Фармацевтические композиции для введения соединений, соответствующих изобретению, могут быть удобно представлены в унифицированных дозированных формах и могут быть получены любым из методов, известных в области техники. Все методы включают стадию объединения активного ингредиента с носителем, который содержит один или более вспомогательных ингредиентов. Как правило, фармацевтические композиции получают путем однородного и тесного контактирования активного ингредиента с жидким носителем, или тонкоизмельченного твердого носителя, или их обоих с последующим,если это необходимо, формованием продукта с получением требующегося препарата. В фармацевтическую композицию активное соединение-объект включают в количестве, достаточном для получения требующегося эффекта в отношении процесса или состояния болезней. Фармацевтические композиции, включающие активный ингредиент, могут быть в форме, пригодной для перорального применения, например в виде таблеток, пастилок, лепешек, водных или масляных суспензий, диспергирующихся порошков или гранул, эмульсий, твердых или мягких капсул либо сиропов или эликсиров. Композиции, предназначенные для перорального применения, можно получить согласно любому известному в области техники методу изготовления фармацевтических композиций. Данные композиции могут содержать один или более агентов, выбранных из подсластителей, вкусовых добавок, красителей и консервантов с целью получения фармацевтически высококачественных и приятных на вкус препаратов. Таблетки включают активный ингредиент в смеси с другими нетоксичными фармацевтически приемлемыми наполнителями, которые пригодны для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза фосфат кальция и фосфат натрия; агенты для гранулирования и разрыхлители, например кукурузный крахмал или альгиновую кислоту; связующие агенты, например крахмал, желатин и гуммиарабик; и смазывающие агенты, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут быть непокрытыми или они могут быть покрыты с помощью известных методов с целью задержки распада и всасывания в желудочно-кишечный тракт, и, таким образом, обеспечения замедленного действия в течение более длительного периода. Например, для задержки во времени можно использовать такой материал, как глицерилмоностеарат или глицерилдистеарат. Они могут быть также покрыты с помощью методик, описанных в патентах США 4256108, 4166452 и 4265874, чтобы получить осмотические терапевтические таблетки с контролируемым высвобождением. Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, либо в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Водные суспензии содержат активные материалы в смеси с наполнителями, пригодными для изготовления водных суспензий. Данные наполнители представляют собой суспендирующие агенты, например карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации; разрыхлители и смачивающие агенты могут быть представлены природным фосфатидом, например лецитином или продуктами конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеаратом, или продуктами конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанлолом, или продуктами конденсации этиленоксида с частичными эфирами, полученными из жирных кислот и гекситола, такими как полиоксиэтиленсорбитмоноолеат, или продуктами конденсации этиленоксида с частичными эфирами, полученными из жирных кислот, и гекситоловыми ангидридами, например полиэтиленсорбитмоноолеатом. Водные суспензии могут также содержать один или более консервантов,например этил или н-пропил, п-гидроксибензоат, один или более красителей, один или более вкусовых агентов и один или более подсластителей, таких как сахароза или сахарин.- 11011010 Масляные суспензии можно приготовить путем суспендирования активного ингредиента в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, либо в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать сгуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как приведены выше, и вкусовые агенты могут быть добавлены для получения приятного на вкус перорального препарата. Данные композиции можно законсервировать добавлением антиоксиданта, такого как аскорбиновая кислота. Разрыхляющиеся порошки и гранулы, пригодные для получения водной суспензии путем добавления воды, представляют собой активный ингредиент в смеси с разрыхляющим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Примерами подходящих разрыхляющих или смачивающих агентов является агенты, уже упомянутые выше. Могут также присутствовать дополнительные наполнители, например подсластители, вкусовые добавки и красители. Фармацевтические композиции, соответствующие изобретению, могут быть также в виде эмульсий типа масло в воде. Масляная фаза может быть представлена растительным маслом, например оливковым маслом или арахисовым маслом, либо минеральным маслом, например жидким парафином, или их смесями. Подходящие эмульгаторы могут быть представлены природными камедями, например камедью акации или камедью трагаканта, природными фосфатидами, например соей, лецитином, и сложными эфирами или частичными сложными эфирами, полученными из жирных кислот и гекситоловых ангидридов, например сорбитмоноолеатом, и продуктами конденсации указанных частичных сложных эфиров с этиленоксидом, например полиоксиэтиленсорбитмоноолеатом. Эмульсии могут также включать подсластители и вкусовые добавки. Сиропы и эликсиры могут быть получены с подсластителями, например глицерином, пропиленгликолем, сорбитом и сахарозой. Данные препараты могут включать также успокоительное средство, консервант, а также вкусовые добавки и красители. Фармацевтические композиции могут быть в форме стерильной инъекционной водной или масляной суспензии. Данную суспензию можно получить известным методам при использовании тех подходящих разрыхляющих или смачивающих агентов и суспендирующих агентов, которые упомянуты выше. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального применения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей,которые могут быть использованы, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют как растворитель или среду для суспендирования. С этой целью можно использовать любое успокаивающее нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение при получении инъекционных препаратов. Фармацевтические композиции можно также вводить в форме суппозиториев для ректального введения лекарственного препарата. Данные композиции можно получить путем смешивания лекарственного препарата с подходящим нераздражающим наполнителем, который является твердым при обычных температурах, но жидким при ректальной температуре и, вследствие этого, будет плавиться в прямой кишке,высвобождая лекарственный препарат. Данными материалами являются масло какао и полиэтиленгликоли. Для наружного применения используют кремы, мази, желе, растворы или суспензии и т.п., включающие соединения, соответствующие изобретению. Как используют в данном контексте, наружное применение означает также, что оно включает применение полосканий для рта и полосканий для горла. Фармацевтические композиции и способы, соответствующие изобретению, могут, кроме того,включать другие терапевтически активные соединения, как указано в данном контексте, используемые для лечения диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемии, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии,гипертриглицеридемии, дислипидемии, метаболического синдрома, синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза, тромботических нарушений, нефропатии,диабетической невропатии, диабетической ретинопатии, половой дисфункции, дерматопатии, диспепсии,гипогликемии, рака и отека. Способы применения В другом аспекте изобретение представляет способы лечения или предупреждения заболевания или состояния, выбранного из группы, состоящей из диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемии, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии, гипертриглицеридемии, дислипидемии, метаболического синдрома, синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза,тромботических нарушений, нефропатии, диабетической невропатии, диабетической ретинопатии, половой дисфункции, дерматопатии, диспепсии, гипогликемии, рака и отека, заключающиеся во введении нуждающемуся в этом субъекту терапевтически эффективного количества соединения или композиции,соответствующих изобретению. В одном варианте осуществления заболевание или состояние представляет собой диабет типа II. В другом аспекте настоящее изобретение представляет способ лечения заболевания или состояния,- 12011010 чувствительного к модулированию GPR40, заключающийся во введении нуждающемуся в этом субъекту терапевтически эффективного количества соединения или композиции, соответствующих изобретению. В некоторых вариантах осуществления заболевание или состояние выбрано из группы, состоящей из диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемии, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии, гипертриглицеридемии, дислипидемии, метаболического синдрома, синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза, тромботических нарушений, нефропатии, диабетической невропатии, диабетической ретинопатии, половой дисфункции, дерматопатии, диспепсии,гипогликемии, рака и отека. В ряде вариантов осуществления заболевание или состояние представляет собой диабет типа II. В некоторых вариантах осуществления заболевание или состояние представляет собой ожирение. В некоторых вариантах осуществления заболевание или состояние представляет собой гипертензию. В некоторых вариантах осуществления введения соединений или композиций, соответствующих изобретению, соединение или композицию вводят перорально. В других вариантах осуществления соединение или композицию вводят парентерально. В других вариантах осуществления соединение или композицию вводят в комбинации со вторым терапевтическим агентом. В других вариантах осуществления второй терапевтический агент представляет собой агент, повышающий чувствительность к инсулину, такой как, например, метформин или тиазолидиндион. В другом аспекте изобретение представляет способы лечения или предупреждения заболевания или нарушения, чувствительного к модулированию GPR40, заключающиеся во введении субъекту с данным заболеванием или нарушением терапевтически эффективного количества одного или более данных соединений или композиций. Еще в одном аспекте изобретение представляет способы лечения или предупреждения GPR40-опосредованного состояния, заболевания или нарушения, заключающиеся во введении субъекту с данным состоянием, заболеванием или нарушением терапевтически эффективного количества одного или более данных соединений или композиций. Еще в одном аспекте изобретение представляет способы модулирования GPR40, заключающиеся в контактировании клетки с одним или более данных соединений или композиций. Например, в некоторых вариантах осуществления клетка, которая конститутивно экспрессируетGPR40, контактирует с одним или более данных соединений или композиций. В ряде вариантов осуществления можно сделать, чтобы клетка, которая будет контактировать, экспрессировала или сверхэкспрессировала GPR40, например, посредством экспрессии GPR40 с гетерологичной нуклеиновой кислоты, интродуцированной в клетку, или, в качестве другого примера, посредством повышающей регуляции экспрессии GPR40 с эндогенной для клетки нуклеиновой кислоты. В зависимости от заболевания, которое лечат, и состояния субъекта, соединения, соответствующие изобретению, можно вводить пероральным, парентеральным (например, внутримышечной, внутрибрюшинной, внутривенной, ICV, интрацистернальной инъекцией или инфузией, подкожной инъекцией или с помощью имплантата), ингаляционным, назальным, вагинальным, ректальным, сублингвальным (подъязычным) или наружным (например, чрескожным, местным) путями введения, и они могут быть приготовлены в виде монокомпонента или в комбинации в подходящих дозированных унифицированных препаратах, содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные компоненты и основы, соответствующие каждому из путей введения. Изобретение предусматривает также введение соединений, соответствующих изобретению, в депо-препарате, в котором активный ингредиент высвобождается в течение определенного периода времени. При лечении или предупреждении диабета типа II, ожирения, гипергликемии, непереносимости глюкозы, устойчивости к инсулину, гиперинсулинемии, гиперхолестеринемии, гипертензии, гиперлипопротеинемии, гиперлипидемии, гипертриглицеридемии, дислипидемии, метаболического синдрома, синдрома X, сердечно-сосудистого заболевания, атеросклероза, заболевания почек, кетоацидоза, тромботических нарушений, нефропатии, диабетической невропатии, диабетической ретинопатии, половой дисфункции, дерматопатии, диспепсии, гипогликемии, рака и отека или других состояний или нарушений,ассоциированных с GPR40, соответствующий уровень дозировки будет, как правило, составлять приблизительно от 0,001 до 100 мг/кг массы тела пациента в день, которые можно вводить в однократной или во множестве доз. Предпочтительно, когда уровень дозировки будет составлять от приблизительно 0,01 до приблизительно 25 мг/кг/день; более предпочтительно от приблизительно 0,05 до приблизительно 10 мг/кг/день. Подходящим уровнем дозировки может быть приблизительно от 0,01 до 25, приблизительно от 0,05 до 10 или приблизительно от 0,1 до 5 мг/кг/день. Внутри данного интервала дозировка может составлять от 0,005 до 0,05, от 0,05 до 0,5 или от 0,5 до 5,0 мг/кг/день. Для перорального применения композиции предпочтительно представлены в форме таблеток, содержащих от 1,0 до 1000 мг активного ингредиента, в частности 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0,400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 мг активного ингредиента для симптоматической регуляции дозы для пациента, подвергаемого лечению. Соединения можно вводить по схеме от 1 до 4 раз в- 13011010 день, предпочтительно 1 или 2 раза в день. Однако следует иметь в виду, что конкретный уровень дозировки и частота дозирования для какого-либо определенного пациента могут варьировать и будут зависеть от множества факторов, включая активность конкретного используемого соединения, метаболическую стабильность и длительность действия данного соединения, возраст, массу тела, общее состояние здоровья, пол, диету, способ и время введения, скорость выведения, комбинацию лекарственных препаратов, тяжесть определенного состояния и хозяина, проходящего терапевтическое лечение. Соединения, соответствующие изобретению, можно комбинировать и использовать в комбинации с другими агентами, используемыми для лечения, предупреждения, подавления или облегчения заболеваний или состояний, при которых эффективны соединения, соответствующие изобретению, включая диабет типа II, ожирение, гипергликемию, непереносимость глюкозы, устойчивость к инсулину, гиперинсулинемию, гиперхолестеринемию, гипертензию, гиперлипопротеинемию, гиперлипидемию, гипертриглицеридемию, дислипидемию, метаболический синдром, синдром X, сердечно-сосудистое заболевание,атеросклероз, заболевание почек, кетоацидоз, тромботические нарушения, нефропатию, диабетическую невропатию, диабетическую ретинопатию, половую дисфункцию, дерматопатию, диспепсию, гипогликемию, рак и отек. Данные другие агенты или лекарственные препараты можно вводить способом и в количестве, обычно используемом для них, одновременно или последовательно относительно соединения, соответствующего изобретению. Когда соединение, соответствующее изобретению, используют в одно и то же время с одним или более лекарственных препаратов, предпочтительна фармацевтическая композиция, включающая данные другие лекарственные препараты в дополнение к соединению, соответствующему изобретению. Согласно этому фармацевтические композиции, соответствующие изобретению, включают те, которые содержат также один или более других активных ингредиентов или терапевтических агентов кроме соединения, соответствующего изобретению. Примеры других терапевтических агентов, которые можно комбинировать с соединением, соответствующим изобретению, вводимых либо отдельно, либо в одних и тех же фармацевтических композициях, включают, но без ограничения перечисленным: (а) агенты, снижающие уровень холестерина, такие как ингибиторы HMG (гидроксиметилглутарил)-СоА-редуктазы (например, ловастатин, симвастатин,правастатин, флувастатин, аторвастатин и другие статины), агенты, усиливающие экскрецию желчных кислот (например, холестирамин и колестипол), витамин В 3 (известный также как никотиновая кислота или ниацин), витамин В 6 (пиридоксин), витамин В 12 (цианокобаламин), производные фибровой кислоты(например, гемфиброцил, клофибрат, фенофибрат и бензафибрат), пробукол, нитрогицерин и ингибиторы всасывания холестерина (например, -ситостерол и ингибиторы ацилСоА-холестеролацилтрансферазы (АСАТ), такие как мелинамид), ингибиторы HMG-CoA-синтазы, ингибиторы скваленэпоксидазы и ингибиторы скаваленсинтетазы; (b) антитромботические агенты, такие как тромболитические агенты,(например, стрептокиназа, альтеплаза, анистеплаза и ретеплаза), гепарин, гирудин и производные варфарина, -блокаторы (например, атенолол), -адренергические агонисты (например, изопротеренол), ингибиторы АСЕ (ангиотензин-конвертирующего фермента) и вазодалататоры (например, нитропруссид натрия, никардипин гидрохлорид, нитроглицерин и эналоприлат); и (с) антидиабетические агенты, такие как инсулин и миметики инсулина, сульфонилмочевины (например, глибурид, мелинатид), бигуаниды,например метформин (GlucophageRR), ингибиторы -глюкозидазы (акарбоза), вещества, повышающие чувствительность к инсулину, например тиазолидиноновые соединения, росиглитазон (AvandiaRR),троглитазон (RezulinRR), циглитазон, пиоглитазон (ActosRR) и энглитазон. Соотношение масс соединения, соответствующего изобретению, и второго активного ингредиента могут варьировать и будут зависеть от эффективной дозы каждого ингредиента. Как правило, будут использовать эффективную дозу каждого ингредиента. Комбинации соединения, соответствующего изобретению, и других активных ингредиентов будут, как правило, также лежать в вышеуказанном интервале, но в каждом случае следует использовать эффективную дозу каждого активного ингредиента. В другом аспекте настоящее изобретение представляет способ модулирования циркулирующей концентрации инсулина у субъекта, заключающийся во введении соединения или композиции, соответствующих изобретению. В некоторых вариантах осуществления концентрация инсулина повышена. В других вариантах осуществления концентрация инсулина понижена. В ряде вариантов осуществления могут быть использованы соединение или композиция, содержащие соединение, соответствующее формуле II, в которой R22 означает алкинил, содержащий Si, и где R21,L, Y и W определены выше для формулы II. В некоторых вариантах осуществления атом Si имеет до трех замещающих алкильных групп. В некоторых вариантах осуществления R22 представляет собой -CC-Si(CH3)3. Следующие примеры предложены в виде иллюстрации и не предназначены для ограничения объема изобретения. Компетентные специалисты в данной области легко увидят множество не имеющих решающего значения параметров, которые можно было бы модифицировать для получения в высокой степени близких результатов.- 14011010 Примеры Пример 1. Данный пример иллюстрирует получение метилового эфира (3S)-3-(4-гидроксифенил)гекс-4 иновой кислоты. Схема 1.1 5-(4-Гидроксибензилиден)-2,2-диметил-[1,3]диоксан-4,6-дион (1.1). Конденсацию с кислотой Мелдрама проводят согласно методу Bigi et al., см. (2001) Tetr. Lett. 42: 5203-5205. В грушевидную колбу объемом 2 л вносят 4-гидроксибензальдегид (50 г, 409 ммоль) и воду(400 мл). Колбу помещают в водяную баню при температуре 75 С и добавляют кислоту Мелдрама (62 г,430 ммоль) в виде суспензии в 400 мл воды. Реакционную смесь перемешивают в течение 2 ч, затем охлаждают в ледяной бане в течение 2 ч. Продукт собирают фильтрацией и промывают холодной водой. После тщательного высушивания получают 95 г (94%) аддукта соединения 1.1 в виде тонкодисперсного порошка желтого цвета. Данные 1 Н ЯМР-спектроскопии (500 МГц) (ДМСО-d6)9,75 (br s, 1H); 8,27 (s, 1H); 8,24 (d, 2H, J=10 Гц); 6,98 (d, 2 Н, J=10 Гц); 1,76 (s, 6 Н). Данные МС ESI (положит.) m/е: 519,0 (2 М+Na). Схема 1.2(+/-)-5-[1-(4-Гидроксифенил)бут-2-инил]-2,2-диметил[1,3]диоксан-4,6-дион (1.2). Высушенную в сушильном шкафу трехгорлую колбу объемом 3 л оборудуют механической мешалкой, входом для азота, выходом для азота и помещают в водяную баню с комнатной температурой. После барботажа азотом в течение 20 мин с помощью канюли добавляют раствор бромида 1-пропинилмагния в ТГФ (тетрагидрофуране) (0,5 Н, 600 мл). В отдельной высушенной в сушильном шкафу и промытой азотом круглодонной колбе объемом 500 мл соединение 1.1 (35 г, 142 ммоль) растворяют в безводном ТГФ(350 мл) при осторожном нагревании. Раствор соединения 1.1 добавляют в течение 15 мин. В процессе добавления реакционная смесь изменяется, становясь густой суспензией желтого цвета. После окончания добавления реакционную смесь перемешивают в течение 15 мин и затем гасят водным NH4Cl (0,6 Н, 750 мл) и разводят гексанами (800 мл). Слои разделяют и органический слой отбрасывают. Водный слой подкисляют до pH 2 насыщенным водным раствором KHSO4 и экстрагируют этилацетатом (2400 мл). Объединенные экстракты промывают насыщенным солевым раствором, сушат над MgSO4, фильтруют и концентрируют до получения твердого вещества светло-желтого цвета (37 г, 91%). Данные 1 Н ЯМР-спектроскопии (500 МГц) (ацетон-d6)8,26 (s, 1H); 7,39 (d, 2H, J=8,5 Гц); 6,76 (d, 2H, J=8,4 Гц); 4,73 (br s, 1H); 4,46 (d, 1H, J=2,4 Гц); 1,82 (s, 3H); 1,81 (s, 3H); 1,64 (s, 3 Н). Данные MC ESI (положит,) m/е: 599,0 (2 М+Na). Схема 1.3(+/-)-3-(4-Гидроксифенил)гекс-4-иновая кислота (1.3). В круглодонную колбу объемом 1 л вносят соединение 1.2 (37 г), диэтилкетон (160 мл) и воду (80 мл). Суспензию нагревают до кипения с обратным холодильником в течение 48 ч. После охлаждения водный слой насыщают NaCl (насыщ.) и отделяют. Органический слой сушат над MgSO4, фильтруют и концентрируют до получения масла светло-коричневого цвета, которое кристаллизуют из смеси горячего этилацетата и гексанов(1:2). После сбора и сушки получают продукт в виде не совсем белого порошка (20,3 г, 77%). Данные 1 Н ЯМРспектроскопии (500 МГц) (ДМСО-d6)12,2 (s, 1H); 9,27 (s, 1H); 7,12 (d, 2 Н, J=8,5 Гц); 6,67 (d, 2 Н, J=8,6 Гц);(3S)-3-(4-Гидроксифенил)гекс-4-иновая кислота (1.4). В круглодонную колбу объемом 5 л вносят соединение 1.3 (66,4 г, 325 ммоль) и 2-пропанол (1 л) и затем нагревают до 70 С. (1S,2R)-1-Амино-2-инданол (46,1 г, 309 ммоль) растворяют в 2-пропаноле (1 л) при осторожном нагревании. Раствор амина добавляют к растворенной карбоновой кислоте и полученному в результате раствору дают охладиться до комнатной температуры. Через 16 ч кристаллы собирают и сушат. Соль ресуспендируют в 2 л 2-пропанола и растворяют путем нагревания до кипения с обратным холодильником. После охлаждения до комнатной температуры соль собирают через 16 ч. Маленький образец соли подвергают разложению водной кислотой, и анализируют свободную карбоновую кислоту с помощью хиральной ВЭЖХ (высокоэффективной жидкостной хроматорафии) (колонка Daicel ChiralPAKAD-H, элюент: 0,1% ТФУ (трифторуксусная кислота) в 90:10 гексаны:2-пропанол), и обнаруживают, что получают 75% с учетом допустимых ошибок. Соль ресуспендируют в 1,5 л 2-пропанола и растворяют путем нагревания до кипения с обратным холодильником. После охлаждения до комнатной температуры соль собирают через 16 ч. С помощью хиральной ВЭЖХ показывают, что материал имеет 96% с учетом допустимых ошибок. Данный материал суспендируют в этилацетате (300 мл) и воде (100 мл). Насыщенный водный раствор KHSO4 (100 мл) добавляют при сильном перемешивании. После получения двух прозрачных слоев данные слои разделяют и водный слой экстрагируют этилацетатом (100 мл). Объединенные экстракты промывают насыщенным солевым раствором, сушат над MgSO4, фильтруют и концентрируют до получения масла светло-желтого цвета, которое кристаллизуют высушиванием в вакууме. Соединение 1.4 получают в виде твердого вещества не совсем белого цвета (23,5 г, 35%). Схема 1.5 Метиловый эфир (3S)-3-(4-гидроксифенил)гекс-4-иновой кислоты (1). Фенол 1.4 (23,5 г, 115 ммоль) растворяют в ацетоне (230 мл) и обрабатывают KHCO3 (11,5 г, 115 ммоль). Через 15 мин добавляют метилйодид (5 мл, 80 ммоль) и перемешивают реакцию при 40 С в течение 14 ч. Добавляют дополнительную порцию метилйодида (3 мл, 48 ммоль) и продолжают нагревание в течение 24 ч. Соли калия удаляют фильтрацией и осторожно промывают ацетоном. Фильтрат концентрируют до получения масла, которое очищают фильтрацией через силикагелевую пробку толщиной 1 см. Элюция с использованием 2,5% MeOH в дихлорметане с последующим концентрированием дает фенол 1 (21,5 г,85%) в виде масла светло-желтого цвета. Данные 1 Н ЯМР-спектроскопии (500 МГц) (ацетон-d6)8,2 (brs, 1H); 7,20 (d, 2H, J=9,5 Гц); 6,77 (d, 2H, J=9,0 Гц); 3,98 (m, 1H); 3,60 (s, 3H); 2,65 (т, 2 Н); 1,78 (d, 3 Н,J=2,5 Гц). Данные МС ESI (положит.) m/е: 219,1 (M+Н); 241,1 (М+Na). Пример 2. Данный пример иллюстрирует получение натриевой соли (3S)-3-[4-(4'-трифторметилбифенил-3 илметокси)фенил]гекс-4-иновой кислоты. Схема 2.1 3-(4-Трифторметилфенил)бензойная кислота (2.1). Присоединение по Сузуки осуществляют согласно методу Dyer et al. См. Tetrahedron Letters (2001),- 16011010 42: 1765- 1767. Коммерчески доступную 4-(трифторметил)фенилбороновую кислоту (15 г, 78,7 ммоль) и 3-бромбензойную кислоту (15 г, 75 ммоль) суспендируют в 2-смеси пропанол:вода (1:4, 72 мл). Добавляют 10% Pd/C (1,5 г), а затем водный Na2CO3 (39 мл, 20 мас.%). Полученную в результате смесь нагревают при 70 С в течение 4 ч. Осадок отфильтровывают и промывают 20% водным раствором Na2CO3. Фильтрат разводят водой и подкисляют до рН 2. Твердое вещество белого цвета отфильтровывают и сушат в вакууме. Неочищенный материал (2.1) (19,69 г) используют на следующей стадии без дополнительной очистки. Схема 2.2 3-(4-Трифторметилфенил)бензиловый спирт (2.2). Карбоновую кислоту 2.1 (13,3 г, 50 ммоль) в безводном ТГФ (100 мл) добавляют по каплям кLiAIH4 (2,9 г, 75 ммоль) в безводном ТГФ (150 мл) при 0 С в течение 30 мин. Полученную в результате смесь медленно нагревают до комнатной температуры и перемешивают в течение 4 ч. Реакцию медленно гасят водой (2,9 мл) при 0 С, 15% водным раствором NaOH (2,9 мл) и еще одной порцией воды (8,7 мл). Смесь сушат над Na2SO4 и концентрируют, получая твердое вещество белого цвета (11,9 г). Неочищенный продукт (соединение 2.2) используют на следующей стадии без дополнительной очистки. Схема 2.3 3-(4-Трифторметилфенил)бензилхлорид (2.3). Спирт 2.2 (15 г, 59,5 ммоль) растворяют в безводном дихлорметане (100 мл). Тионилхлорид (10 мл) медленно добавляют по каплям к вышеуказанному раствору. Полученную в результате смесь перемешивают при комнатной температуре в течение 24 ч. Органический растворитель удаляют под вакуумом. Затем остаток очищают экспресс-хроматографией (SiO2 гель 60, элюируют 20% ДХМ (дихлорметаном) в гексанах). Фракции, включающие желательный продукт 2.3, объединяют и концентрируют до получения твердого вещества белого цвета (14,0 г). Данные 1 Н ЯМР-спектроскопии (400 МГц) (CDCl3)7,73 (4 Н,s); 7,65 (1 Н, s); 7,58 (1 Н, s); 7,52-7,28 (2 Н, m); 4,69 (2 Н, s). Схема 2.4 Метиловый эфир (3S)-3-[4-(4'-трифторметилбифенил-3-илметокси)фенил]гекс-4-иновой кислоты (2.4). Бензилхлорид 2.3 (28,0 г, 103 ммоль) и фенол 1 (21,5 г, 98 ммоль) растворяют в ацетоне (150 мл) и обрабатывают Cs2CO3 (39,9 г, 122 ммоль). Реакцию перемешивают при 50 С в течение 16 ч, затем фильтруют и концентрируют до получения масла бледно-желтого цвета, которое очищают колоночной хроматографией (силикагель, 33-66% дихлорметана в гексанах). Элюант, содержащий соединение 2.4, концен- 17011010 трируют до получения бесцветного масла (40,0 г, 92%). Схема 2.5 Натриевая соль (3S)-3-[4-(4'-трифторметилбифенил-3-илметокси)фенил]гекс-4-иновой кислоты (2). Метиловый эфир 2.4 растворяют в диэтиловом эфире (50 мл). Триметилсиланолат натрия (0,78 г, 7 ммоль) добавляют в одной порции и перемешивают реакционную смесь в течение 48 ч. Осадок собирают фильтрацией и перекристаллизовывают из этилацетата:гексанов. После высушивания в вакууме получают желаемую натриевую соль в виде порошка белого цвета (1,3 г). Данные 1 Н ЯМР-спектроскопии (500 МГц) Метиловый эфир (3S)-3-[4-(4-метил-2-п-толилтиазол-5-илметокси)фенил]гекс-4-иновой кислоты (3.2). Соединение 3.1 получают согласно способу, описанному в примере 2, начиная от коммерчески доступной 4-метил-2-(4-метилфенил)-1,3-тиазол-5-карбоновой кислоты. Хлорид 3.1 (250 мг, 1,1 ммоль) и фенол 1 (230 мг, 1,1 ммоль) растворяют в безводном ДМФ (диметилсульфоксиде) (5 мл). Затем добавляют Cs2CO3 (650 мг, 2,2 ммоль) в виде тонкого порошка и перемешивают реакционную смесь при комнатной температуре в течение 14 ч. Реакцию выливают в воду и экстрагируют этилацетатом (15 мл 3). Органические фазы объединяют, сушат над Na2SO4 и концентрируют в вакууме до получения остатка, который используют на следующей стадии без дополнительной очистки. Схема 3.2(S)-3-[4-(4-Метил-2-п-толилтиазол-5-илметокси)фенил]гекс-4-иновая кислота (3). Сложный эфир 3.2 растворяют в ТГФ/МеОН/10% NaOH (водн.) (1:1:1) растворе (15 мл). После пе- 18011010 ремешивания при комнатной температуре в течение 30 мин смесь подкисляют 1H HCl (водн.) до рН 4. Водную фазу экстрагируют этилацетатом и объединенные органические фазы сушат над Na2SO4 и концентрируют. Неочищенный остаток растирают с 20% этилацетатом в гексане (20 мл). Осадок фильтруют и соединение 3 получают в виде порошка бледно-желтого цвета (315 мг, 0,8 ммоль). Данные МС ESI m/е: 406 (М-Н). Данные 1 Н ЯМР-спектроскопии (500 МГц) (CDCl3)7,86 (2 Н, d, J=7,5 Гц); 7,36 (2 Н, d, J=9 Гц); 7,26 (2 Н, d, J=8 Гц); 6,96 (2 Н, d, J=8,5 Гц); 5,18 (2 Н, s); 4,1 (1 Н, m); 2,77 (2 Н, m); 2,52 (3 Н, s); 2,42 (3 Н, s); 1,86 (3 Н, s). Пример 4 Данный пример иллюстрирует получение 3-4-[2-(2,6-дихлорбензил)тиазол-4-илметокси]фенил гекс-4-иновой кислоты. Схема 4.1 3-4-[2-(2,6-Дихлорбензил)тиазол-4-илметокси]фенилгекс-4-иновая кислота (4). Получение тиазола 4.1 осуществляют согласно методу Bordwell et al. (1990), J. Amer. Chem. Soc.,112: 792-797. Соединение 4.1 (58 мг, 0,2 ммоль) и фенол 1 (43,6 мг, 0,2 ммоль) растворяют в безводном ДМФА (2 мл) и обрабатывают тонкоизмельченным Cs2CO3 (65 мг, 0,22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 14 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом (10 мл 3). Объединенные органические фазы сушат над Na2SO4, концентрируют в вакууме и остаток растворяют в растворе ТГФ/MeOH/10% NaOH (водн.) (1:1:1) (6 мл). Полученную в результате смесь перемешивают при комнатной температуре в течение 30 мин. Смесь подкисляют 1HHCl (водн.) до рН 4. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, сушат над Na2SO4 и концентрируют в вакууме. Неочищенный остаток растирают с 20% этилацетатом в гексане(10 мл). Осадок фильтруют и получают кислоту 4 в виде порошка бледно-желтого цвета (55 мг, 0,12 ммоль). Данные МС ESI m/e: 460 (М-Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (CDCl3)7,40-7,19 (6 Н, m); 6,94-6,79 (2 Н, m); 5,18 (2 Н, s); 4,73 (2 Н, s); 4,1-4,06 (1 Н, m); 2,77 (2 Н, m); 1,85 (3 Н, s). Пример 5. Данный пример иллюстрирует получение 3-[4-(2-метил-5-фенилфуран-3-илметокси)фенил]гекс-4 иновой кислоты. Схема 5.1 3-[4-(2-Метил-5-фенилфуран-3-илметокси)фенил]гекс-4-иновая кислота (5). Реакцию Митсунобу осуществляют согласно методу Mik et al. (см. J. Med. Chem. (2003), 46: 15231530. Коммерчески доступное соединение 5.1 (37,6 мг, 0,2 ммоль), PPh3 (52 мг, 0,2 ммоль) и фенол 1.3(43,6 мг, 0,2 ммоль) добавляют к безводному ТГФ (3 мл). Затем добавляют по каплям DEAD (45 мкл,0,22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 14 ч. Затем реакцию экстрагируют этилацетатом (10 мл 3). Органические фазы объединяют, сушат над Na2SO4 и концентрируют в вакууме. Полученный в результате остаток растворяют в раствореТГФ/МеОН/10% NaOH(водн.) (1:1:1) (6 мл). Полученную в результате смесь перемешивают при комнатной температуре в течение 30 мин. Смесь подкисляют 1 Н HCl (водн.) до рН 4. Водную фазу экстрагируют этилацетатом. Органические фазы объединяют, сушат над Na2SO4 и концентрируют в вакууме. Неочищенный продукт растирают с 20% этилацетатом в гексане (10 мл). Осадок фильтруют и получают соединение 5 в виде по- 19011010 рошка белого цвета (35 мг, 0,9 ммоль). Данные МС ESI m/e: 375 (М-Н). Данные 1 Н ЯМР-спектроскопии(500 МГц) (CDCl3)7,65 (2 Н, d, J=8 Гц); 7,40-7,24 (5 Н, m); 6,96 (2 Н, d, J=8,5 Гц); 6,68 (1 Н, s); 4,88 (2 Н, s); 4,1 (1 Н, s); 2,77 (2 Н, m); 2,4 (3 Н, s); 1,86 (3 Н, s). Пример 6. Следующие соединения получают способами, аналогичными описанным в примере 2. Таблица 1 Данные 1 Н ЯМР-спектроскопии (400 МГц) CD3)2SO)12,4 (s, 1H); 7,52 (d, 2H, J=8,0 Гц); 7,46 (d,- 20011010 2H, J=8,6 Гц); 7,30 (d, 2H, J=8,8 Гц); 7,46 (d, 2H, J=6,0 Гц); 6,98-7,01 (m, 3 Н); 6,91-6,98 (m, 3 Н); 5,13 (s,2H); 3,92-4,04 (m, 3 Н); 2,61 (d, 2H, J=7,6 Гц); 2,29 (s, 3 Н); 1,79 (d, 2H, J=2,0 Гц); 1,59-1,66 (m, 2H); 1,341,40 (m, 2H); 0,88 (t, 3 Н, J=7,6 Гц). [M+Na]+. Рассчитано для C30H32O4: 471,1. Получено: 471,1. Пример 7. Следующие соединения получают способами, аналогичными описанным в примере 2. Таблица 2 Пример 8. Следующие соединения получают способами, аналогичными описанным в примере 3. Таблица 3 Пример 9. Следующие соединения получают способами, аналогичными описанным в примере 3. Пример 10. Следующие соединения получают способами, аналогичными описанным в примерах 3-5. Карбоновые кислоты для получения соединений 10.2 и 10.5 получают согласно способу Huang et al. (см. J. Amer. Пример 11. Следующие соединения получают способами, аналогичными описанным в примерах 3-5. Таблица 6- 22011010 Пример 12. Данный пример иллюстрирует получение (+/-)-3-(4-[(4-метоксифенил)метокси]фенил)гекс-4-иновой кислоты. Схема 12.1 4-[(4-Метоксифенил)метокси]бензальдегид (12.1). В круглодонную колбу объемом 500 мл вносят 4-гидроксибензальдегид (40 г, 328 ммоль) и ДМФА(250 мл). Добавляют 4-метоксибензилхлорид (57,8 мл, 426 ммоль), а затем карбонат калия (90 г, 656 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, затем вливают в ледяную воду (2,5 л). Продукт собирают фильтрованием и промывают водой. После тщательного высушивания получают 78 г (98%) альдегида 12.1 в виде порошка светло-желтого цвета. Данные 1 Н ЯМР-спектроскопии 5-4-[(4-Метоксифенил)метокси]фенил]метилен]-2,2-диметил[1,3]диоксан-4,6-дион (соединение 12.2). Конденсацию с кислотой Мелдрама проводят согласно способу, предложенному DeWolf et al. (см.Biochemistry, 28: 3833-3842 (1989. Раствор кислоты Мелдрама (18 г, 124 ммоль) соединения 12.1 (30 г,124 ммоль) в толуоле (100 мл) обрабатывают ледяной уксусной кислотой (4 мл) и пиперидином (2 мл). Реакционную смесь перемешивают и нагревают при кипении с обратным холодильником до завершения удаления воды с помощью слива Дина-Старка. Реакционную смесь охлаждают до комнатной температуры и полученное в результате твердое вещество фильтруют и промывают холодным толуолом, получая 28 г (62%) 12.2 в виде порошка ярко-желтого цвета. Данные 1 Н ЯМР-спектроскопии (400 МГц) (ДМСОd6)8,32 (s, 1H); 8,24 (d, 2H, J=8,9 Гц); 7,42 (d, 2H, J=8,6 Гц); 7,17 (d, 2H, J=9,0 Гц); 6,97 (d, 2H, J=8,7 Гц); 5,18 (s, 2H); 3,75 (s, 6H); 1,75 (s, 6H). Схема 12.3(+/-)-3-(4-[(4-Метоксифенил)метокси]фенил)гекс-4-иновая кислота (12). К перемешиваемому раствору соединения 12.2 (13,8 г, 37,5 ммоль) в ТГФ (120 мл) под азотом добавляют 1-пропинилмагний бромид в ТГФ (0,5 Н, 97,5 мл) в течение 20 мин. После завершения добавления реакционную смесь перемешивают в течение 20 мин, гасят насыщенным водным раствором NH4Cl(50 мл) и экстрагируют этилацетатом (350 мл). Объединенные экстракты промывают водой, сушат надMgSO4, фильтруют и концентрируют до образования масла коричневого цвета. Раствор данного масла коричневого цвета смеси 5:1 пиридина и воды (360 мл) нагревают при 100 С в течение 36 ч. Реакционную смесь охлаждают до комнатной температуры и помещают в баню со смесью льда и воды. Осторожно добавляют концентрированную HCl до получения pH 2. Полученную в результате суспензию экстрагируют этилацетатом (200 мл 3), сушат над MgSO4, фильтруют и концентрируют до образования твердого вещества не совсем белого цвета. При перекристаллизации из этанола получают 9,5 г (78%) соединения 12 в виде порошка белого цвета. Данные 1 Н ЯМР-спектроскопии (500 МГц) (ДМСО-d6)12,2 (s,1H); 7,37 (d, 2H, J=8,5 Гц); 7,27 (d, 2H, J=8,5 Гц); 6,95 (d, 2H, J=8,0 Гц); 6,94 (d, 2H, J=8,5 Гц); 4,99 (s, 2 Н); 3,95 (m, 1 Н); 3,76 (s, 3 Н); 2,60 (m, 2 Н); 1,78 (d, 3 Н, J=1,5 Гц). Данные MC ESI (отриц.) m/е: 323,0 (М-1).- 23011010 Пример 13. Данный пример иллюстрирует получение натриевой соли (3S)-3-[4-(2-метилбензилокси)фенил] гекс-4-иновой кислоты. Схема 13.1 Метиловый эфир (3S)-3-[4-(2-метилбензилокси)фенил]гекс-4-иновой кислоты (13.1). 2-Метилбензилбромид (0,98 г, 5,3 ммоль) и фенол 1 (0,97 г, 4,4 ммоль) растворяют в ацетоне (9 мл) и обрабатывают Cs2CO3 (1,45 г, 4,4 ммоль). Реакцию перемешивают при комнатной температуре в течение 16 ч, затем фильтруют и концентрируют до образования масла, которое очищают с помощью круговой хроматографии (силикагелевые пластинки 2 мм, 10% этилацетат в гексанах). Элюант, содержащий соединение 13.1, концентрируют до образования бесцветного масла (1,37 г, 96%). Данный материал анализируют с помощью хиральной ВЭЖХ (колонка Daicel ChiralPAK AD-H, элюент: 0,1% TFA в 95:5 гексаны:2-пропанол) и обнаруживают содержание 94% с учетом допустимых ошибок. Данные 1 Н ЯМРспектроскопии (500 МГц) (MeOH-d4)7,39 (d, 1H, J=7 Гц); 7,28 (d, 2H, J=8,5 Гц); 7,25-7,15 (m, 3 Н); 5,05 Натриевая соль (S)-3-[4-(2-метилбензилокси)фенил]гекс-4-иновой кислоты (13). 2 Н KOH (водн.) (3,2 мл) добавляют к раствору соединения 13.1 (1,37 г, 4,25 ммоль) в метаноле (30 мл). Реакцию перемешивают при комнатной температуре в течение ночи и переносят в большое количество воды. рН водного раствора подводят до 2,0 с помощью 1 Н HCl (водн.) и экстрагируют этилацетатом. Объединенные органические слои промывают водой, а затем солевым раствором. Растворитель удаляют при пониженном давлении и полученный в результате остаток растворяют в этаноле (4 мл) и обрабатывают 1 экв. водного бикарбоната натрия. Растворители удаляют при пониженном давлении и остаток тритурируют диэтиловым эфиром. После сбора путем фильтрования и сушки получают натриевую соль соединения 13 (1,1 г) в виде тонкого порошка белого цвета. Данные 1 Н ЯМР-спектроскопии (500 МГц)(D2O)7,34-7,18 (m, 6H); 6,95 (d, 2H, J=6,5 Гц); 5,05 (s, 2H); 3,88 (m, 1H); 2,47 (d, 2H, J=8,5 Гц); 2,28 (s,3 Н); 1,72 (d, 3 Н, J=2,5 Гц). Данные МС ESI (положит.) m/е: 309,1 (М+Н); 331,0 (М+Na), []D=+20,6. Пример 14. Следующие соединения получают способами, аналогичными описанным в примере 12. Таблица 7- 24011010 Пример 15. Данный пример иллюстрирует получение (3S)-3-[4-(2-метилбензилокси)фенил]гекс-4-иновой кислоты. Схема 15.1 Этиловый эфир(+/-)-[4-(4-метоксибензилокси)фенил]гекс-4-иновой кислоты (15.1). В круглодонную колбу объемом 100 мл вносят соединение 12 (3,00 г, 9,25 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (2,67 г, 13,9 ммоль), 4-диметиламинопиридин (1,13 г, 9,25 ммоль) и дихлорметан (30 мл), смесь перемешивают для образования раствора. Через 15 мин добавляют этиловый спирт (абсолютный, 1,00 мл). Через 2 ч реакцию гасят водным NaHCO3 (насыщ., 100 мл). Слои разделяют и органический слой промывают водным NaHCO3 (2100 мл), сушат над MgSO4 и концентрируют до образования порошка белого цвета (3,19 г, 98%), который используют без дополнительной очистки. Схема 15.2 Этиловый эфир (+/-)-[4-(2-метилтбензилокси)фенил]гекс-4-иновой кислоты (15.2). Сложный эфир 15.1 (3,19 г, 9 ммоль) вносят в ледяной уксусной кислоте (100 мл) в круглодонную колбу объемом 250 мл и нагревают суспензию до кипения с обратным холодильником в течение 16 ч. Растворитель удаляют при пониженном давлении и остаток перерастворяют в этилацетате (200 мл). Раствор промывают 1 Н HCl (водн.) (200 мл) и насыщенным солевым раствором (200 мл), сушат над MgSO4 и концентрируют до образования густого масла желтого цвета, к которому добавляют 2-метилбензилбромид (2,57 г, 13,9 ммоль), карбонат цезия (6,03 г, 18,5 ммоль) и ДМФА (20 мл). Суспензию нагревают до 80 С в течение ночи. После охлаждения реакцию гасят водой (200 мл) и экстрагируют этилацетатом(2100 мл). Объединенные органические слои промывают NaHCO3 (насыщ. 2100 мл) и NaCl (насыщ. 3100 мл), сушат над MgSO4 и концентрируют до образования порошка белого цвета (2,41 г, 79%). Схема 15.3(3S)-3-[4-(2-Метилбензилокси)фенил]гекс-4-иновая кислота (15). Соединение 15.2 растворяют в смеси 24 мл метанола и 24 мл изопропанола с целью обработки ультразвуком. Раствор отфильтровывают в стеклянный стакан объемом 50 мл. Рацемическое соединение 15.2 разделяют с помощью хиральной нормально-фазовой ВЭЖХ при использовании полупрепаративной колонки ChiralTech AD (2,0 см 25,0 см), изократно элюируя системой гексан/изопропанол (92:8) при скорости потока 20 мл/мин. Каждая инжекция содержит 50 мг сложного эфира 15 (1 мл). Для детектирования используют поглощения при 220 нм. Собирают оба энантиомера. После 36 инжекций разделенные энантиомеры сушат, что дает твердые вещества белого цвета. Данные аналитической хиральной ВЭЖХ(колонка Chiraltech AD-H, 0,4 см 25,0 см, 8% изопропанол/гексан, 1 мл/мин) показывают, что оба соединения являются оптически чистыми. Энантиомеры обозначают А (время удерживания=11,5 мин) и В(время удерживания=15,6 мин). В круглодонную колбу вносят энантиомер А (0,65 г), этанол (10 мл) и 2 Н KOH (10 мл) и перемешивают в течение 2 ч при комнатной температуре. После подкисления до рН 2 лимонной кислотой продукт экстрагируют этилацетатом (100 мл). Органические слои промывают насыщенным солевым раствором (250 мл), сушат над MgSO4 и концентрируют до образования масла желтого цвета (0,59 г, 42%, в целом). Делают аликвоту (12,0 мг) в 1 мл раствора ДМФА и измеряют оптическое вращение. Данный энантиомер определяют как (S) по методике, изложенной в работе DeWolf Jr. et al. (1989), Biochemistry,28: 3833-3842. Данные 1 Н ЯМР-спектроскопии (400 МГц, ацетон-d6)7,45 (d, 1H, J=7,15 Гц); 7,37 (d, 2H,J=8,66 Гц); 7,25 (d, 1H, J=1,42 Гц); 7,24 (m, 2H); 7,00 (d, 2 Н, J=8,74 Гц); 5,11 (s, 2 Н); 4,05 (m, 1 Н); 2,70 (m,- 25011010 2 Н); 2,39 (s, 3H); 2,10 (s, 1 Н); 1,80 (d, 3 Н, J=2,41). MC-ESI (отриц.) m/е: 307,1 (М-Н); 637,2 (2 М-Н). []D20:+16,32 (cl.2, ДМФ). Пример 16. Данный пример иллюстрирует получение этилового эфира 3-(4-гидроксифенил)гекс-4-иновой кислоты. Схема 16.1 Этиловый эфир 3-(4-гидроксифенил)гекс-4-иновой кислоты (16). Фенол 1.2 (1,2 г, 4 ммоль) растворяют в пиридине (3 мл) и этаноле (1 мл). Смесь нагревают до 90 С в течение 16 ч и затем концентрируют до образования масла, которое очищают колоночной хроматографией (элюирование с помощью 1-3% МеОН в дихлорметане). Фенол 16 (0,88 г, 91%) получают в виде масла. Данные 1 Н ЯМР-спектроскопии (500 МГц) (ацетон-d6)8,24 (s, 1H); 7,21 (d, 2H, J=9,5 Гц); 6,78 (d,2H, J=9,0 Гц); 4,06 (m, 2 Н); 3,98 (m, 1 Н); 2,68-2,59 (m, 2 Н); 1,78 (d, 3 Н, J=2,5 Гц); 1,75 (t, 3 Н, J=7,0 Гц). Данные MC ESI (положит.) m/e: 233,1 (М+Н); 255,1 (M+Na). Пример 17. Следующие соединения получены способами, аналогичными описанным в примерах 12 и 15. Таблица 8- 26011010 Пример 18. Данный пример иллюстрирует получение 3-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенилгекс-4-иновой кислоты. Схема 18.1 4,5-Диметил-2-(4-трифторметилфенил)оксазол-3-оксид (18.1). В грушевидную колбу объемом 100 мл вносят бутан-2,3-дион монооксим (2,1 г, 20,4 ммоль), 4-(трифторметил)бензальдегид (3,0 мл, 22,4 ммоль) и уксусную кислоту (20 мл). Смесь охлаждают до 0 С. Раствор 4 Н HCl в диоксане (7,0 мл, 28,0 ммоль) добавляют по каплям к реакции и полученную в результате смесь перемешивают при 0 С в течение 20 мин. К реакции добавляют диэтиловый эфир (30 мл) и смеси дают нагреться до комнатной температуры в течение ночи. Растворитель удаляют при пониженном давлении и полученный в результате остаток вносят в воду (300 мл). Добавляют концентрированный водный раствор NH4OH, чтобы довести рН до 9,0. Смесь экстрагируют этилацетатом (275 мл), а объединенные органические слои промывают водой (100 мл), а затем насыщенным солевым раствором (100 мл). Органический слой сушат (Na2SO4) и удаляют растворитель при пониженном давлении. Полученный в результате остаток очищают с помощью круговой хроматографии (3% МеОН в ДХМ (дихлорметане,получая 1,8 г (35%) 4,5-диметил-2-(4-трифторметилфенил)оксазол-3-оксида в виде твердого вещества белого цвета. ЖХ (жидкостная хроматорафия)/MSD m/е: 258,1 (М+Н). Данные 1 Н ЯМР-спектроскопии 4-Хлорметил-5-метил-2-(4-трифторметилфенил)оксазол (18.2). Оксихлорид фосфора (0,72 мл, 7,8 ммоль) добавляют по каплям в высушенную в сушильном шкафу грушевидную колбу объемом 100 мл, в которую внесено соединение 18.1 (1,8 г, 7,00 ммоль) и дихлорметан (20 мл). Реакцию нагревают с обратным холодильником в атмосфере азота в течение 30 мин и затем охлаждают до комнатной температуры. Реакцию промывают водой (2250 мл) и объединенные водные слои снова экстрагируют ДХМ (225 мл). Объединенные органические слои промывают солевым раствором и сушат (Na2SO4). Растворитель удаляют при пониженном давлении и полученный в результате остаток очищают с помощью круговой хроматографии (15% диэтиловый эфир в гексанах), получая 216 мг(15%) 4-хлорметил-5-метил-2-(4-трифторметилфенил)оксазола в виде твердого вещества белого цвета. ЖХ/MSD m/е: 276,0 (М+Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (CDCl3)8,15 (2 Н, d, J=8,0 Гц),7,73 (2 Н, d, J=8,0 Гц), 4,59 (2 Н, s), 2,48 (2 Н, s). Схема 18.3 Этиловый эфир 3-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенилгекс-4-иновой кислоты (18.3). Карбонат цезия (0,51 г, 1,57 ммоль) добавляют к раствору соединения 18.2 (216 мг, 0,79 ммоль) и фенола 16 (220 мг, 0,79 ммоль) в ДМФ (8 мл). Реакцию перемешивают при комнатной температуре в течение ночи и затем вливают в воду (500 мл). рН раствора подводят до 4,0 1H HCl (водн.) и экстрагируют этилацетатом (225 мл). Объединенные органические слои промывают водой, а затем солевым раствором. Растворитель удаляют при пониженном давлении и полученный в результате остаток очищают с помощью круговой хроматографии (20% диэтиловый эфир в гексане), получая 304 мг (82%) этилового эфира 3-4-[5-метил 2-(4-трифторметилфенил)оксазол-4-илметокси]фенилгекс-4-иновой кислоты. ЖХ/MSD m/е 472,0 (М+Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (CDCl3)8,16 (2 Н, d, J=8,0 Гц); 7,73 (2 Н, d, J=8,0 Гц); 7,33 (2 Н,m); 6,99 (2 Н, m); 5,01 (2 Н, s); 4,14 (3 Н, m); 2,72 (2 Н, m), 2,48 (3 Н, s); 1,85 (3 Н, s); 1,26 (3 Н, t, J=8,0 Гц). 3-4-[5-Метил-2-(4-трифторметилфенил)оксазол-4-илметокси]фенилгекс-4-иновая кислота (18). 2 Н KOH (водн.) добавляют к раствору соединения 18.3 (304 мг, 0,65 ммоль) в этаноле (5 мл). Реакцию перемешивают при комнатной температуре в течение ночи и затем выливают в большое количество воды. рН водного раствора доводят до 2,0 с помощью 1 Н HCl (водн.) и экстрагируют этилацетатом (225 мл). Объединенные органические слои промывают водой, а затем солевым раствором. Растворитель удаляют при пониженном давлении и полученный в результате остаток очищают с помощью круговой хроматографии (40% этилацетата в гексанах+0,1% АсОН), получая 150 мг (52%) соединения 18 в виде стекла. ЖХ/MSD m/е: 444,0 (М+Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (ацетон)8,21 (2 Н, m); 7,89 ( 2 Н,d, J=8,0 Гц); 7,38 (2 Н, m); 7,03 (2 Н, m); 5,06 (2 Н, s); 4,06 (1 Н, m); 2,70 (2 Н, m); 2,52 (3 Н, s); 1,81 (3 Н, s). Пример 19. Соединения из примеров 19-22 получают с использованием способов, аналогичных описанным в примере 18. 3-4-[5-Метил-2-(3-цианофенил)оксазол-4-илметокси]фенилгекс-4-иновая кислота (22). ЖХ/MSD m/е: 401,2 (М+Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (ацетон d6)8,33 (2 Н, m),- 28011010 7,91 (1 Н, m), 7,79 (1 Н, m), 7,38 (2 Н,m), 7,08 (2 Н, m), 5,06 (2 Н, s), 4,06 (1 Н, m), 2,70 (2 Н, m), 2,51 (3 Н, s),1,81 (3H,s). Пример 23. Следующий пример иллюстрирует синтез 5-2-[4-(2-метилбензилокси)фенил]пент-3-инил-1H-тетразола. Схема 23.1 Амид 3-[4-(2-метилбензилокси)фенил]гекс-4-иновой кислоты (23.2). Карбонилдиимидазол (0,46 г, 2,84 ммоль) добавляют к раствору 3-[4-(2-метилбензилокси)фенил] гекс-4-иновой кислоты (см. пример 13) (0,73 г, 2,37 ммоль) в безводном ТГФ (10 мл). Смесь перемешивают при комнатной температуре в течение 2 ч. Затем к смеси добавляют концентрированный NH4OH(10 мл) и реакцию перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в воду (300 мл) и рН раствора подводят до 7 с помощью концентрированной HCl. Затем водный слой экстрагируют 325 мл этилацетата. Объединенные органические слои промывают водой, а затем солевым раствором. Затем органический слой сушат (Na2SO4) и концентрируют при пониженном давлении, получая 0,48 г (70%) амида 3-[4-(2-метилбензилокси)фенил]гекс-4-иновой кислоты (соединение 23.2) в виде твердого вещества светло-желтого цвета. ЖХ/MSD m/е: 308,4 (М+Н). Схема 23.2 3-[4-(2-Метилбензилокси)фенил]гекс-4-иненнитрил (23.3). В высушенную в сушильном шкафу круглодонную колбу объемом 50 мл вносят ДМФ (8 мл) и вводят стержень для перемешивания. Раствор охлаждают до 0 С в ледяной бане. С помощью шприца медленно добавляют тионилхлорид (160 мкл, 1,0 ммоль). Смесь перемешивают при 0 С в течение дополнительных 45 мин. Затем к смеси добавляют нитрил 32.2 (300 мг, 0,98 ммоль в виде раствора в ДМФ (2 мл). Реакцию перемешивают при 0 С в течение 1 ч, а затем дают постепенно охладиться до комнатной температуры в течение ночи. Реакционную смесь разделяют между ледяной водой и этилацетатом. Водный слой дважды дополнительно экстрагируют 25 мл этилацетата. Затем к водному слою добавляют насыщенный NaHCO3 и водный слой экстрагируют третий раз этилацетатом. Объединенные органические слои промывают насыщенным NaHCO3 и концентрируют при пониженном давлении. Полученный в результате остаток очищают с помощью круговой хроматографии (15% этилацетат в гексанах), получая 203 мг (72%) 3-[4-(2-метилбензилокси)фенил]гекс-4-иненнитрил (соединение 23.3). Данные 1 Н ЯМРспектроскопии (400 МГц) (ацетон-d6)7,44 (3 Н, m), 7,24 (3 Н, m), 7,05 (2 Н, m), 5,13 (2 Н, s), 4,09 (1 Н, m),2,89 (2 Н, m), 2,39 (3 Н, s), 1,88 (3 Н, s). Схема 23.4 5-2-[4-(2-Метилбензилокси)фенил]пент-3-инил-1 Н-тетразол (23). К раствору соединения 23.3 (200 мг, 0,51 ммоль) в ДМФА (5 мл) добавляют азид натрия (35 мг, 0,54 ммоль) и хлорид аммония (29 мг, 0,54 ммоль). Раствор перемешивают при 110 С в течение 48 ч. Реакционную смесь выливают в 50 мл воды и экстрагируют этилацетатом (225 мл). Объединенные органические слои концентрируют при пониженном давлении и полученный в результате остаток очищают с помощью ВЭЖХ, получая 5 мг (3%) 5-2-[4-(2-метилбензилокси)фенил]пент-3-инил-1H-тетразола (соеди- 29011010 нения 23) в виде пленки. ЖХ/MSD m/е: 333,1 (M+Н). Данные 1 Н ЯМР-спектроскопии (400 МГц) (ацетонd6)7,45 (1H, m); 7,34 (2 Н, m); 7,25 (3 Н, m); 7,00 (2 Н, m); 5,11 (2 Н, s); 4,17 (1 Н, m); 3,37 (2 Н, d, J=7 Гц); 2,39 (3 Н, s); 1,79 (3 Н, s). Пример 24. Следующий пример иллюстрирует синтез 3-[4-(4-метоксибензилокси)фенил]гекс-4-иновой кислоты тиазол-2-иламида. Схема 24.1 3-[4-(4-Метоксибензилокси)фенил]гекс-4-иновой кислоты тиазол-2-иламид (24). В грушевидную колбу вводят стержень для перемешивания, вводят соединение 12 (50 мг, 0,154 ммоль),карбонилдиимидазол (25 мг, 0,154 ммоль) и ТГФ (4 мл). Смесь нагревают с обратным холодильником в течение 1 ч и затем добавляют 2-аминотиазол (16 мг, 0,154 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 48 ч, выливают в воду и экстрагируют этилацетатом. Органический слой концентрируют и полученный в результате остаток очищают с помощью ВЭЖХ, получая 1,0 мг(2%) 3-[4-(4-метоксибензилокси)фенил]гекс-4-иновой кислоты тиазол-2-иламида (соединение 24) в виде пленки. Данные 1 Н ЯМР-спектроскопии (400 МГц) (ацетон-d6)7,39 (4 Н, m); 7,11 (1 Н, s); 6,95 (3 Н, m); 5,03 (2 Н, s); 3,82 (3 Н, s); 2,95 (2 Н, m); 1,79 (3 Н, s). Пример 25. Соединения в следующей таблице получают при использовании способа, описанного в примере 24. Таблица 9 Пример 26. Следующий пример иллюстрирует получение 3-[4-(5-метил-2-фенил-2 Н-[1,2,3]триазол-4-илметокси)фенил]гекс-4-иновой кислоты (соединение 26). Схема 26.1 Этиловый эфир 3-[4-(5-метил-2-фенил-2 Н-[1,2,3]триазол-4-илметокси)фенил]гекс-4-иновой кислоты (26.2). Карбонат цезия (107 мг, 0,33 ммоль) добавляют к раствору соединения 16 (60 мг, 0,22 ммоль) в ДМФА (5 мл). Смесь перемешивают при комнатной температуре в течение 5 мин и добавляют 4-хлорметил-5-метил-2-фенил-2 Н-[1,2,3]триазол (55 мг, 0,22 ммоль). Реакцию нагревают до 60 С и перемешивают в течение ночи. Затем реакционную смесь выливают в большое количество воды. 1 Н HCl (водн.) добав- 30
МПК / Метки
МПК: C07C 213/00, A61K 31/42, A61P 5/48, C07C 277/00, C07C 53/132, A61K 31/19, A61K 31/215
Метки: циркулирующей, заболеваний, инсулина, функции, рецептора, способ, модулированию, чувствительных, лечения, фармацевтическая, варианты, рецептор, композиция, концентрации, модулирования, соединения, модулирующие, gpr40
Код ссылки
<a href="https://eas.patents.su/30-11010-soedineniya-moduliruyushhie-receptor-gpr40-farmacevticheskaya-kompoziciya-sposob-lecheniya-zabolevanijj-chuvstvitelnyh-k-modulirovaniyu-receptora-gpr40-varianty-sposob-modulirovani.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, модулирующие рецептор gpr40, фармацевтическая композиция, способ лечения заболеваний, чувствительных к модулированию рецептора gpr40 (варианты), способ модулирования функции gpr40 (варианты) и способ модулирования циркулирующей концентрации инсулина</a>












