Оптическое разделение (1-бензил-4-метилпиперидин-3-ил)метиламина и его применение для получения производных пирроло 2,3-пиримидина в качестве ингибиторов протеинкиназы
Номер патента: 12666
Опубликовано: 30.12.2009
Авторы: Кехер Кристиан, Уилкокс Гленн Эрнест, Врис Тон, Флэнэган Марк Эдвард, Манчхоф Майкл Джон
Формула / Реферат
1. Способ получения соединения формулы
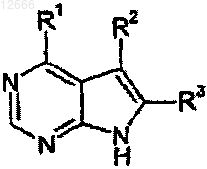
или его фармацевтически приемлемой соли, в котором R1 представляет собой группу формулы

где у равен 0, 1 или 2;
R4 выбран из группы, состоящей из водорода, (C1-С6)алкила, (C1-С6)алкилсульфонила, (C2-С6)алкенила, (C2-С6)алкинила, в которой группы алкила, алкенила и алкинила необязательно замещены дейтерием, гидрокси, амино, трифторметилом, (C1-С4)алкокси, (C1-С6)ацилокси, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, циано, нитро, (C2-С6)алкенилом, (C2-С6)алкинилом или (C1-С6)ациламино; или R4 представляет собой (С3-С10)циклоалкил, в котором циклоалкильная группа необязательно замещена дейтерием, гидрокси, амино, трифторметилом, (C1-С6)ацилокси, (C1-С6)ациламино, (C1-C6)алкиламино, ((C1-С6)алкил)2амино, циано, циано(C1-С6)алкилом, трифторметил(С1-С6)алкилом, нитро, нитро(C1-С6)алкилом или (C1-С6)ациламино;
R5 представляет собой (С3-С9)гетероциклоалкил, при условии, что когда (С3-С9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу, каждый атом азота должен быть защищен защитной группой, и в котором гетероциклоалкильная группа должна иметь от одного до пяти заместителей, выбранных из карбокси, циано, амино, дейтерия, гидрокси, (C1-С6)алкила, (C1-C6)алкокси, галогена, (C1-C6)ацила, (C1-С6)алкиламино, амино(С1-С6)алкила, (C1-C6)алкокси-CO-NH, (С1-С6)алкиламино-СО-, (C2-С6)алкенила, (С2-С6)алкинила, (C1-С6)алкиламино, амино(C1-С6)алкила, гидрокси(С1-С6)алкила, (C1-С6)алкокси(C1-С6)алкила, (C1-C6)ацилокси(C1-С6)алкила, нитро, циано(C1-С6)алкила, галоген(C1-С6)алкила, нитро(C1-С6)алкила, трифторметила, трифторметил(C1-С6)алкила, (C1-С6)ациламино, (С1-С6)ациламино(C1-С6)алкила, (C1-С6)алкокси(C1-С6)ациламино, амино(C1-С6)ацила, амино(C1-С6)ацил(C1-С6)алкила, (C1-С6)алкиламино(C1-С6)ацила, ((C1-С6)алкил)2амино(C1-C6)ацила, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкила, (C1-C6)алкил-S(О)m, R15R16NS(O)m, R15R16NS(O)m(C1-C6)алкила, R15S(O)mR16N, R15S(O)mR16N(C1-С6)алкила, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбраны из водорода или (C1-С6)алкила; или группу формулы II
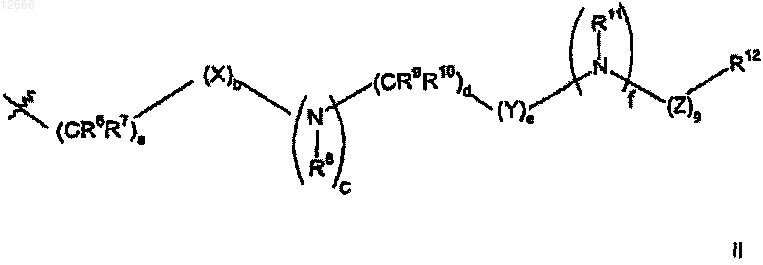
где а равно 0, 1, 2, 3 или 4;
b, с, е, f и g, каждый независимо, равен 0 или 1;
d равно 0, 1, 2 или 3;
X представляет собой S(O)n, где n равно 0, 1 или 2; кислород, карбонил или -С(=N-циано)-;
Y представляет собой S(O)n, где n равно 0, 1 или 2; или карбонил и
Z представляет собой карбонил, С(O)O-, C(O)NR- или S(O)n, где n равно 0, 1 или 2;
R6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1-С6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С6)ацилокси, (C1-С6)ациламино, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, циано, циано(C1-С6)алкилом, трифторметил(C1-С6)алкилом, нитро, нитро(C1-C6)алкилом или (C1-C6)ациламино;
R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (С1-С6)алкил, трифторметил(C1-С6)алкил, (C1-С6)алкокси, галоген, (C1-С6)ацил, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, амино(C1-С6)алкил, (C1-С6)алкокси-CO-NH, (C1-С6)алкиламино-СО-, (C2-С6)алкенил, (С2-С6)алкинил, (C1-С6)алкиламино, гидрокси(C1-С6)алкил, (C1-С6)алкокси(C1-С6)алкил, (C1-С6)ацилокси(C1-С6)алкил, нитро, циано(C1-C6)алкил, галоген(C1-С6)алкил, нитро(C1-С6)алкил, трифторметил, трифторметил(C1-С6)алкил, (C1-С6)ациламино, (С1-С6)ациламино(C1-C6)алкил, (С1-С6)алкокси(C1-С6)ациламино, амино(С1-С6)ацил, амино(C1-С6)ацил(C1-С6)алкил, (C1-С6)алкиламино(C1-С6)ацил, ((C1-С6)алкил)2амино(C1-С6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH, R15NHC(O)NH, (C1-С6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1-C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С6)алкила;
R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена, гидрокси, нитро, карбокси, (C2-С6)алкенила, (C2-С6)алкинила, трифторметила, трифторметокси, (C1-С6)алкила, (С1-С6)алкокси, (С3-С10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены одной-тремя группами, выбранными из галогена, гидрокси, карбокси, амино(C1-С6)алкилтио, (С1-С6)алкиламино, ((C1-С6)алкил)2амино, (С5-С9)гетероарила, (С2-С9)гетероциклоалкила, (С3-С9)циклоалкила или (С6-С10)арила; или R2 и R3, каждый независимо, представляют собой (С3-С10)циклоалкил, (С3-С10)циклоалкокси, (C1-С6)алкиламиэю, ((С1-С6)алкил)2амино, (С6-С10)ариламино, (C1-С6)алкилтио, (С6-С10)арилтио, (C1-С6)алкилсульфинил, (С6-С10)арилсульфинил, (C1-С6)алкилсульфонил, (С6-С10)арилсульфонил, (С1-С6)ацил, (C1-С6)алкокси-CO-NH-, (C1-С6)алкиламино-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкил или (С6-С10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-С6)алкилом, (C1-С6)алкил-CO-NH-, (C1-С6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-(C1-C6)алкилом, (С1-С6)алкокси-CO-NH-(C1-С6)алкилом, (C1-C6)алкокси-CO-NH-(C1-С6)алкокси, карбокси, карбокси(C1-С6)алкилом, карбокси(C1-С6)алкокси, бензилоксикарбонил(C1-С6)алкокси, (C1-С6)алкоксикарбонил(C1-С6)алкокси, (С6-С10)арилом, амино, амино(C1-С6)алкилом, (C1-С6)алкоксикарбониламино, (С6-С10)арил(C1-С6)алкоксикарбониламино, (C1-C6)алкиламино, ((C1-C6)алкил)2амино, (C1-С6)алкиламино(C1-C6)алкилом, ((C1-С6)алкил)2амино(C1-С6)алкилом, гидрокси, (С1-С6)алкокси, карбокси, карбокси(C1-С6)алкилом, (C1-С6)алкоксикарбонилом, (C1-С6)алкоксикарбонил(C1-С6)алкилом, (C1-С6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-, циано, (С5-С9)гетероциклоалкилом, амино-CO-NH-, (C1-С6)алкиламино-СО-NH-, ((C1-С6)алкил)2амино-CO-NH-, (С6-С10)ариламино-CO-NH-, (С5-С9)гетероариламино-CO-NH-, (C1-C6)алкиламино-CO-NH-(C1-С6)алкилом, ((C1-С6)алкил)2амино-CO-NH-(C1-С6)алкилом, (С6-С10)ариламино-CO-NH-(C1-С6)алкилом, (С5-С9)гетероариламино-CO-NH(C1-С6)алкилом, (C1-С6)алкилсульфонилом, (C1-С6)алкилсульфониламино, (C1-С6)алкилсульфониламино(C1-С6)алкилом, (С6-С10)арилсульфонилом, (С6-С10)арилсульфониламино, (С6-С10)арилсульфониламино(С1-С6)алкилом, (C1-С6)алкилсульфониламино, (C1-С6)алкилсульфониламино(C1-С6)алкилом, (С5-С9)гетероарилом или (С2-C9)гетероциклоалкилом;
указанный способ включает стадии:
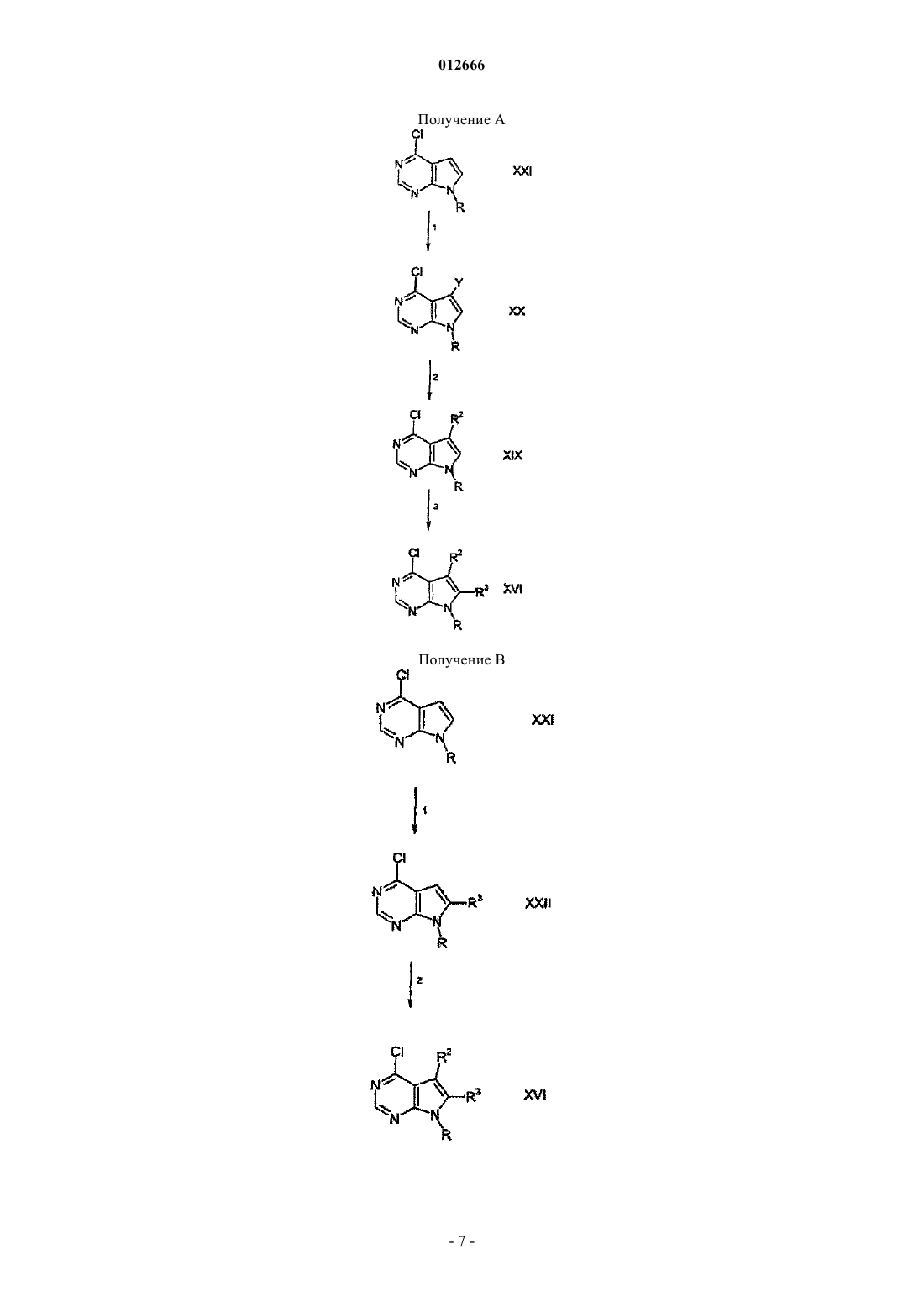
а) смешения рацемической смеси энантиомерных соединений формулы
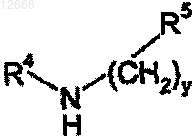
где у, R4 и R5 определены выше, в растворителе с агентом разделения, имеющим определенную стереоспецифичность с образованием раствора, при этом указанный агент разделения, является способным к связыванию по меньшей мере с одним, но не со всеми указанными энантиомерами, с образованием осадка, содержащего по меньшей мере один из указанных энантиомеров;
b) выдерживания смеси в течение периода времени, достаточного для достижения существенного осаждения стереоспецифического энантиомера рацемической смеси из раствора, и где другой из указанных энантиомеров остается в указанном растворе;
с) в зависимости от стереоспецифичности желаемого соединения, либо сбор осадка и его очистку, либо сбор раствора с содержащимся в нем другим из указанных энантиомеров, и перекристаллизацию энантиомера, содержащегося в данном растворе;
d) взаимодействие полученного таким образом желаемого стереоспецифического энантиомера с соединением формулы
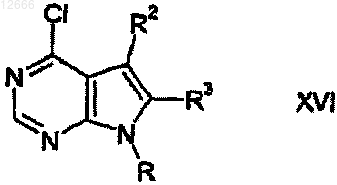
где R представляет собой водород или защитную группу и R2 и R3 являются такими, как определено выше;
e) в случае необходимости удаление бензильной защитной группы R5, когда (С3-С9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу; и
f) в случае необходимости взаимодействие азотсодержащей гетероциклоалкильной группы R5, полученной на стадии (е), с соединением формулы II
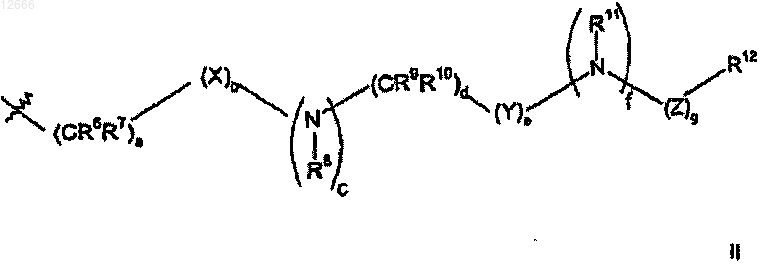
где а равно 0, 1, 2, 3 или 4;
b, с, е, f и g, каждый независимо, равен 0 или 1;
d равно 0, 1, 2 или 3;
X представляет собой S(O)n, где n равно 0, 1 или 2; кислород, карбонил или -С(=N-циано)-;
Y представляет собой S(O)n, где n равно 0, 1 или 2, или карбонил и
Z представляет собой карбонил, С(O)O-, C(O)NR- или S(O)n, где n равно 0, 1 или 2;
R6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1-С6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С6)ацилокси, (C1-С6)ациламино, (C1-С6)алкиламино, ((С1-С6)алкил)2амино, циано, циано(C1-С6)алкилом, трифторметил(C1-С6)алкилом, нитро, нитро(C1-C6)алкилом или (C1-C6)ациламино;
R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (C1-С6)алкил, трифторметил(C1-С6)алкил, (С1-С6)алкокси, галоген, (С1-С6)ацил, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, амино(C1-С6)алкил, (C1-С6)алкокси-CO-NH, (C1-С6)алкиламино-СО-, (C2-С6)алкенил, (С2-С6)алкинил, (C1-С6)алкиламино, гидрокси(C1-С6)алкил, (C1-С6)алкокси(C1-С6)алкил, (C1-С6)ацилокси(C1-С6)алкил, нитро, циано(C1-С6)алкил, галоген(C1-С6)алкил, нитро(C1-С6)алкил, трифторметил, трифторметил(C1-С6)алкил, (C1-С6)ациламино, (C1-С6)ациламино(C1-С6)алкил, (C1-С6)алкокси(C1-C6)ациламино, амино(C1-C6)ацил, амино(C1-С6)ацил(C1-С6)алкил, (C1-С6)алкиламино(C1-С6)ацил, ((C1-С6)алкил)2амино(C1-С6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH, R15NHC(O)NH, (C1-C6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1-C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С6)алкила.
2. Способ по п.1, в котором указанный агент разделения выбирают из винной кислоты и ее производных и аденокислоты и ее производных.
3. Способ по п.2, в котором указанные производные винной кислоты включают толуоил- и бензоилвинные кислоты в стереоспецифической конформации.
4. Способ по п.3, в котором указанное производное винной кислоты представляет собой дипаратолуоил-L-винную кислоту.
5. Способ по п.2, в котором аденокислота включает (-)фенцифос.
6. Способ по п.1, в котором соединение на стадии а) представляет собой
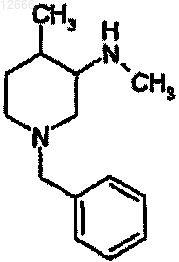
7. Способ по п.1, в котором соединение преобразовывают в форму кислотно-аддитивной соли этого соединения перед указанной стадией разделения.
8. Способ по п.7, в котором указанная форма аддитивной соли представляет собой гидрохлоридную форму.
9. Способ по п.1, в котором температура, при которой осуществляют разделение и осаждение, представляет собой температуру окружающей среды, и время составляет около не более 4 ч.
10. Способ по п.8, в котором гидрохлоридную соль соединения образуют в растворителе, выбранном из группы, состоящей из метанола, этанола, изопропанола, ацетонитрила, тетрагидрофурана, воды, толуола, этилацетата, дихлорметана, дихлорэтана или их смесей.
11. Способ по п.10, в котором указанный растворитель включает этанол с незначительным количеством толуола в качестве сорастворителя.
12. Способ по п.1, в котором растворитель выбирают из группы, состоящей из этилацетата, толуола, ацетонитрила, гептана, воды и их смесей.
13. Способ по п.1, в котором добавляют затравочные кристаллы осажденного энантиомера, чтобы облегчить указанное осаждение.
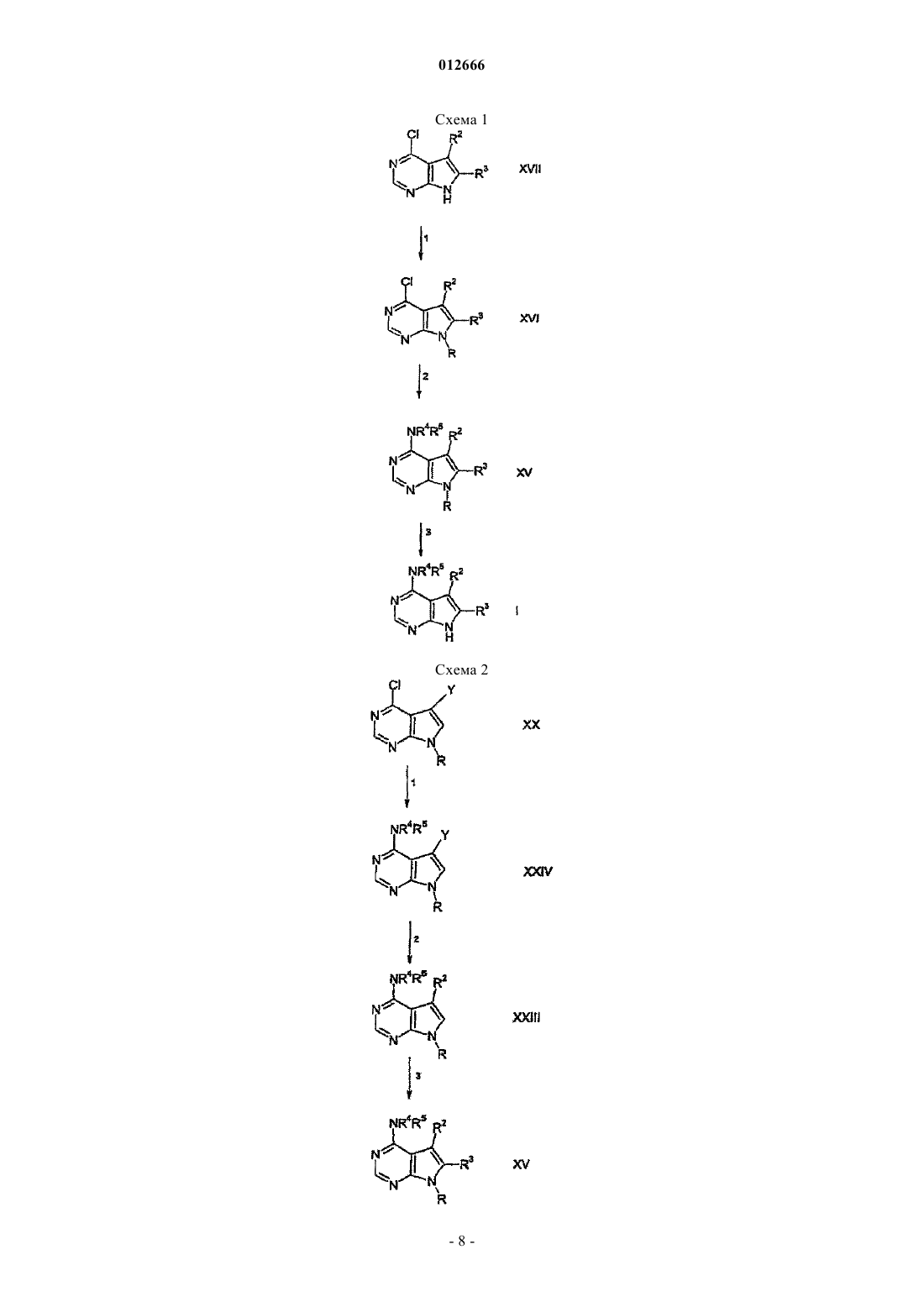
14. Соединение формулы
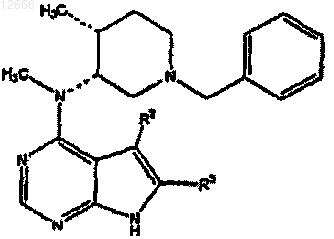
где R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена, гидрокси, нитро, карбокси, (C2-С6)алкенила, (C2-С6)алкинила, трифторметила, трифторметокси, (C1-С6)алкила, (C1-С6)алкокси, (С3-С10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены одной-тремя группами, выбранными из галогена, гидрокси, карбокси, амино(C1-С6)алкилтио, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, (С5-С9)гетероарила, (С2-С9)гетероциклоалкила, (С3-С9)циклоалкила или (С6-С10)арила; или R2 и R3, каждый независимо, представляют собой (С3-С10)циклоалкил, (С3-С10)циклоалкокси, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, (С6-С10)ариламино, (C1-C6)алкилтио, (С6-С10)арилтио, (C1-С6)алкилсульфинил, (С6-С10)арилсульфинил, (C1-С6)алкилсульфонил, (С6-С10)арилсульфонил, (С1-С6)ацил, (C1-С6)алкокси-СО-NH-, (C1-С6)алкиламино-СО-, (С5-С9)гетероарил, (С2-С9)гетероциклоалкил или (С6-С10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-С6)алкилом, (C1-С6)алкил-CO-NH-, (C1-С6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-(C1-C6)алкилом, (C1-С6)алкокси-CO-NH-(C1-C6)алкилом, (C1-С6)алкокси-CO-NH-(С1-С6)алкокси, карбокси, карбокси(C1-C6)алкилом, карбокси(C1-С6)алкокси, бензилоксикарбонил(C1-С6)алкокси, (C1-С6)алкоксикарбонил(C1-С6)алкокси, (С6-С10)арилом, амино, амино(C1-С6)алкилом, (C1-С6)алкоксикарбониламино, (С6-С10)арил(C1-С6)алкоксикарбониламино, (C1-С6)алкиламино, ((C1-С6)алкил)2амино, (C1-C6)алкиламино(C1-С6)алкилом, ((C1-С6)алкил)2амино(C1-С6)алкилом, гидрокси, (C1-C6)алкокси, карбокси, карбокси(C1-С6)алкилом, (C1-С6)алкоксикарбонилом, (C1-С6)алкоксикарбонил(C1-С6)алкилом, (C1-С6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-, циано, (С5-С9)гетероциклоалкилом, амино-CO-NH-, (C1-C6)алкиламино-СО-NH-, ((C1-С6)алкил)2амино-СО-NH-, (С6-С10)ариламино-CO-NH-, (С5-С9)гетероариламино-CO-NH-, (C1-С6)алкиламино-CO-NH-(C1-С6)алкилом, ((C1-С6)алкил)2амино-CO-NH-(C1-С6)алкилом, (С6-С10)ариламино-CO-NH-(C1-С6)алкилом, (С5-С9)гетероариламино-CO-NH(C1-C6)алкилом, (C1-С6)алкилсульфонилом, (C1-С6)алкилсульфониламино, (C1-С6)алкилсульфониламино(C1-С6)алкилом, (С6-С10)арилсульфонилом, (С6-С10)арилсульфониламино, (С6-С10)арилсульфониламино(C1-С6)алкилом, (C1-С6)алкилсульфониламино, (C1-С6)алкилсульфониламино(С1-С6)алкилом, (С5-С9)гетероарилом или (С2-С9)гетероциклоалкилом.
15. Соединение по п.14, в котором R2 и R3 представляют собой водород.
16. Фармацевтическая композиция, ингибирующая протеинкиназу или киназу 3 Janus (JAK3) у млекопитающих, включая человека, предназначенная для лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний, включающая эффективное для таких нарушений или состояний количество 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрила или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция, включающая 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрил или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
18. Способ ингибирования протеинкиназ или киназы 3 Janus (JAK3) у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрила или его фармацевтически приемлемой соли.
19. Способ лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I ш осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного для лечения такого состояния количества 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрила или его фармацевтически приемлемой соли.
20. Способ ингибирования протеинкиназ или киназы 3 Janus (JAK3) у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрила или его фармацевтически приемлемой соли отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами.
21. Способ лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного для лечения такого состояния количества 3-{(3R,4R)-4-метил-3-[метил-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил}-3-оксопропионитрила или его фармацевтически приемлемой соли отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами.
22. Соединение формулы
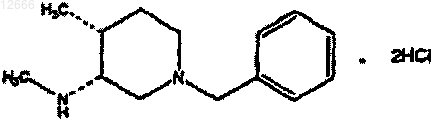
23. Соединение формулы
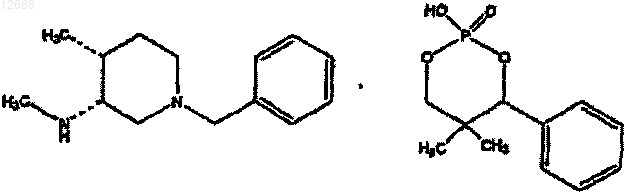
24. Соединение формулы
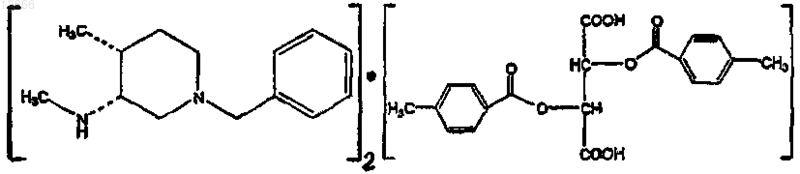
25. Способ по п.1, где защитная группа для атома азота представляет собой бензильную группу.
Текст
012666 Область изобретения Данное изобретение относится к способам осуществления разделения хиральных солей из рацемических смесей энантиомеров и, в частности, предшественников энантиомеров, используемых в получении соединений пирроло[2,3-d]пиримидина, которые являются ингибиторами протеинкиназ. Данное изобретение также относится к соединениям пирроло[2,3-d]пиримидина и способам получения таких соединений в качестве ингибиторов протеинкиназ, таких как фермент киназа 3 Janus. Предпосылки изобретения Соединения пирроло[2,3-d]пиримидина являются ингибиторами протеинкиназ, таких как фермент киназа 3 Janus (JAK3), и поэтому используются в терапии в качестве иммуносуппрессивных средств для трансплантации органов, ксенотрансплантации, для лечения волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы,атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкоза и других симптомов, где иммуносуппрессивное средство является желательным. Соединения пирроло[2,3-d]пиримидина, их фармацевтические композиции и способы применения описаны в находящейся на одновременном рассмотрении заявке 09/732669, поданной 8 декабря 2000 г. и принадлежащей правоприемнику данного изобретения. Раскрытие указанной заявки включено в объем данного изобретения в качестве ссылки. Первоначально получают рацемические смеси соединений пирроло[2,3-d]пиримидина, тогда как индивидуальные энантиомеры, выделенные, по существу, в чистой форме, являются предпочтительными и иногда требуются для использования в качестве лекарственных средств. Представляется возможным предопределить стереохимию соединений в их синтезе путем использования стереоспецифических соединений-предшественников. Способы данного изобретения, соответственно, непосредственно относятся к способу существенного разделения хиральных солей из рацемических смесей соединений-предшественников, используемых для получения отдельных энантиомерных форм соединений пирроло[2,3-d]пиримидина. Краткое изложение изобретения Предложенное изобретение относится к способу получения соединения формулы или его фармацевтически приемлемой соли, в которомR1 представляет собой группу формулыR4 выбран из группы, состоящей из водорода, (C1-С 6)алкила, (C1-С 6)алкилсульфонила, (C2 С 6)алкенила, (C2-С 6)алкинила, в которой группы алкила, алкенила и алкинила необязательно замещены дейтерием, гидрокси, амино, трифторметилом, (С 1-С 4)алкокси, (C1-С 6)ацилокси, (С 1-С 6)алкиламино, C1 С 6)алкил)2 амино, циано, нитро, (C2-С 6)алкенилом, (C2-С 6)алкинилом или (C1-С 6)ациламино; или R4 представляет собой (С 3-С 10)циклоалкил, в котором циклоалкильная группа необязательно замещена дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси, (C1-С 6)ациламино, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, циано, циано(C1-С 6)алкилом, трифторметил(C1-С 6)алкилом, нитро, нитро(C1 С 6)алкилом или (C1-С 6)ациламино;R5 представляет собой (С 3-С 9)гетероциклоалкил, при условии, что когда (С 3-С 9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу, каждый атом азота должен быть защищен защитной группой, и в котором гетероциклоалкильная группа должна иметь от одного до пяти заместителей, выбранных из карбокси, циано, амино, дейтерия, гидрокси, (C1-С 6)алкила, (C1-C6)алкокси,галогена, (C1-C6)ацила, (C1-С 6)алкиламино, амино(C1-С 6)алкила, (C1-С 6)алкокси-CO-NH, (C1 С 6)алкиламино-СО-, (C2-С 6)алкенила, (C2-С 6)алкинила, (С 1-С 6)алкиламино, амино(C1-С 6)алкила, гидрокси(C1-С 6)алкила, (С 1-С 6)алкокси(C1-С 6)алкила, (C1-C6)ацилокси(C1-С 6)алкила, нитро, циано(C1 С 6)алкила, галоген(C1-С 6)алкила, нитро(C1-С 6)алкила, трифторметила, трифторметил(C1-C6)алкила, (C1 С 6)ациламино, (C1-С 6)ациламино(C1-C6)алкила, (C1-С 6)алкокси(C1-С 6)ациламино, амино(C1-С 6)ацила,амино(C1-C6)ацил(С 1-С 6)алкила,(С 1-С 6)алкиламино(C1-С 6)ацила,C1-С 6)алкил)2 амино(C1-С 6)ацила,R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкила, (C1-C6)алкил-S(О)m, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкила, R15S(O)mR16N, R15S(O)mR16N(C1-С 6)алкила, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбраны из водорода или (C1-C6)алкила; или группу формулы IIR6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1C6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси,(C1-С 6)ациламино, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, циано, циано(C1-C6)алкилом, трифторметил(C1-С 6)алкилом, нитро, нитро(С 1-С 6)алкилом или (C1-С 6)ациламино;R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (C1 С 6)алкил, трифторметил(C1-С 6)алкил, (C1-С 6)алкокси, галоген, (С 1-С 6)ацил, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, амино(C1-С 6)алкил, (C1-С 6)алкокси-CO-NH, (C1-C6)алкиламино-СО-, (С 2-С 6)алкенил,(С 2-С 6)алкинил,(C1-С 6)алкиламино,гидрокси(C1-С 6)алкил,(C1-С 6)алкокси(C1-С 6)алкил,(C1C6)ацилокси(C1-C6)алкил, нитро, циано(C1-С 6)алкил, галоген(C1-С 6)алкил, нитро(C1-С 6)алкил, трифторметил, трифторметил(C1-С 6)алкил, (C1-С 6)ациламино, (C1-С 6)ациламино(C1-С 6)алкил, (C1-С 6)алкокси(C1 С 6)ациламино, амино(C1-C6)ацил, амино(C1-С 6)ацил(C1-С 6)алкил, (C1-С 6)алкиламино(C1-C6)ацил, C1C6)алкил)2 амино(C1-C6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH,R15NHC(O)NH, (C1-C6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С 6)алкила;R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена,гидрокси, нитро, карбокси, (С 2-С 6)алкенила, (С 2-С 6)алкинила, трифторметила, трифторметокси, (C1 С 6)алкила, (C1-С 6)алкокси, (С 3-С 10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены от одной до трех групп, выбранных из галогена, гидрокси, карбокси, амино(C1 С 6)алкилтио, (C1-C6)алкиламино, C1-С 6)алкил)2 амино, (С 5-С 9)гетероарила, (С 2-С 9)гетероциклоалкила,(С 3-С 9)циклоалкила или (С 6-С 10)арила; или R2 и R3, каждый независимо, представляют собой (С 3 С 10)циклоалкил, (С 3-С 10)циклоалкокси, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 6-С 10)ариламино, (С 1 С 6)алкилтио, (С 6-С 10)арилтио, (C1-С 6)алкилсульфинил, (С 6-С 10)арилсульфинил, (C1-С 6)алкилсульфонил,(С 6-С 10)арилсульфонил, (C1-С 6)ацил, (C1-С 6)алкокси-CO-NH-, (C1-C6)алкиламино-СО-, (С 5-С 9)гетероарил,(С 2-С 9)гетероциклоалкил или (С 6-С 10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-С 6)алкилом, (C1-С 6)алкил-CO-NH-, (C1-С 6)алкоксиCO-NH-, (C1-С 6)алкил-CO-NH-(C1-С 6)алкилом, (C1-С 6)алкокси-CO-NH-(C1-C6)алкилом, (C1-С 6)алкоксиCO-NH-(C1-С 6)алкокси, карбокси, карбокси(C1-С 6)алкилом, карбокси(C1-С 6)алкокси, бензилоксикарбонил(C1-С 6)алкокси, (С 1-С 6)алкоксикарбонил(C1-С 6)алкокси, (С 6-С 10)арилом, амино, амино(С 1-С 6)алкилом,(C1-С 6)алкоксикарбониламино, (С 6-С 10)арил(C1-С 6)алкоксикарбониламино, (C1-C6)алкиламино, C1 С 6)алкил)2 амино, (C1-С 6)алкиламино(C1-С 6)алкилом, C1-С 6)алкил)2 амино(С 1-С 6)алкилом, гидрокси, (C1 С 6)алкокси, карбокси, карбокси(С 1-С 6)алкилом, (C1-С 6)алкоксикарбонилом, (C1-С 6)алкоксикарбонил(C1 С 6)алкилом, (C1-C6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-, циано, (С 5-С 9)гетероциклоалкилом, аминоCO-NH-, (C1-С 6)алкиламино-СО-NH-, C1-С 6)алкил)2 амино-CO-NH-, (С 6-С 10)ариламино-CO-NH-, (С 5 С 9)гетероариламино-CO-NH-, (C1-C6)алкиламино-CO-NH-(C1-С 6)алкилом, C1-C6)алкил)2 амино-CO-NH(C1-С 6)алкилом,(С 6-С 10)ариламино-CO-NH-(C1-С 6)алкилом,(С 5-С 9)гетероариламино-CO-NH-(C1 С 6)алкилом, (C1-С 6)алкилсульфонилом, (C1-С 6)алкилсульфониламино, (C1-C6)алкилсульфониламино(C1 С 6)алкилом, (С 6-С 10)арилсульфонилом, (С 6-С 10)арилсульфониламино, (С 6-С 10)арилсульфониламино(C1 С 6)алкилом, (C1-C6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(C1-С 6)алкилом, (С 5-С 9)гетероарилом или (С 2-С 9)гетероциклоалкилом; указанный способ включает стадии: а) смешения рацемической смеси энантиомерных соединений формулы где у, R4 и R5 определены выше, в растворителе с агентом разделения, имеющим определенную стерео-2 012666 специфичность с образованием раствора, при этом указанный агент разделения является способным к связыванию по меньшей мере с одним, но не со всеми указанными энантиомерами, с образованием осадка, содержащего указанный по меньшей мере один из указанных энантиомеров;b) выдерживания смеси в течение периода времени, достаточного для достижения существенного осаждения стереоспецифического энантиомера рацемической смеси из раствора, и где другой из указанных энантиомеров остается в указанном растворе;c) в зависимости от стереоспецифичности желаемого соединения, либо сбор осадка и его очистку,либо сбор раствора с содержащимся в нем другим из указанных энантиомеров и перекристаллизацию энантиомера, содержащегося в данном растворе;d) взаимодействие полученного таким образом желаемого стереоспецифического энантиомера с соединением формулы где R представляет собой водород или защитную группу и R2 и R3 являются такими, как определено выше;e) в случае необходимости удаление бензильной защитной группы R5, когда (С 3-С 9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу; иf) в случае необходимости взаимодействие азотсодержащей гетероциклоалкильной группы R5, полученной на стадии (е), с соединением формулы IIR6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1 С 6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси,(C1-С 6)ациламино, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, циано, циано(C1-С 6)алкилом, трифторметил(C1-С 6)алкилом, нитро, нитро(C1-C6)алкилом или (C1-C6)ациламино;R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (C1 С 6)алкил, трифторметил(C1-С 6)алкил, (C1-С 6)алкокси, галоген, (С 1-С 6)ацил, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, амино(C1-С 6)алкил, (C1-С 6)алкокси-CO-NH, (C1-С 6)алкиламино-СО-, (C2-С 6)алкенил,(С 2-С 6)алкинил,(C1-С 6)алкиламино,гидрокси(C1-С 6)алкил,(C1-С 6)алкокси(C1-С 6)алкил,(C1 С 6)ацилокси(C1-С 6)алкил, нитро, циано(C1-С 6)алкил, галоген(C1-С 6)алкил, нитро(C1-С 6)алкил, трифторметил, трифторметил(C1-С 6)алкил, (C1-С 6)ациламино, (C1-С 6)ациламино(C1-С 6)алкил, (C1-С 6)алкокси(C1 С 6)ациламино, амино(C1-С 6)ацил, амино(C1-C6)ацил(C1-С 6)алкил, (С 1-С 6)алкиламино(C1-С 6)ацил, C1 С 6)алкил)2 амино(C1-С 6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH,R15NHC(O)NH, (C1-C6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С 6)алкила. В предпочтительном варианте агент разделения выбирают из винной кислоты и ее производных и аденокислоты и ее производных. Наиболее предпочтительно, когда указанные производные винной кислоты включают толуоил- и бензоилвинные кислоты в стереоспецифической конформации. Ещ более предпочтительно, когда производное винной кислоты представляет собой дипаратолуоил-L-винную кислоту. В предпочтительном варианте воплощения предложенного способа аденокислота включает (-)фенцифос. Предпочтительно соединение на стадии а) представляет собой В предпочтительном варианте вополощения предложенного способа указанное соединение преобразовывают в форму кислотно-аддитивной соли этого соединения, предпочтительно в гидрохлоридную форму, перед стадией разделения. В предпочтительном варианте предложенного способа температура, при которой осуществляют разделение и осаждение, представляет собой температуру окружающей среды, и время составляет не более чем около четырех часов. В предпочтительном варианте осуществления предложенного изобретения гидрохлоридную соль соединения получают в растворителе, выбранном из группы, состоящей из метанола, этанола, изопропанола, ацетонитрила, тетрагидрофурана, воды, толуола, этилацетата, дихлорметана, дихлорэтана или их смесей. Предпочтительно, когда указанный растворитель включает этанол с незначительным количеством толуола в качестве сорастворителя. Наиболее предпочтительно, когда растворитель выбирают из группы, состоящей из этилацетата,толуола, ацетонитрила, гептана, воды и их смесей. Предпочтительно при осуществлении предложенного способа добавляют затравочные кристаллы осажденного энантиомера, чтобы облегчить указанное осаждение. В контексте данного изобретения термин алкил, если не указано иное, включает насыщенные одновалентные углеводородные радикалы, имеющие прямые или разветвленные фрагменты или их комбинации. Термин алкокси, как используется в данном описании, включает О-алкильные группы, в которых алкил является таким, как определен выше. Термин галоген, как используется в данном описании, если не указано иное, включает фтор,хлор, бром или йод. Соединения данного изобретения могут содержать двойные связи. Когда такие связи присутствуют, соединения изобретения существуют как в цис-, так и транс-конфигурациях, а также в виде их смесей. Если не указано иное, указанные в данном описании алкильные и алкенильные группы,так же как указанные алкильные фрагменты других групп (например, алкокси), могут быть линейными или разветвленными, и они также могут быть циклическими (например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил) или линейными или разветвленными и содержать циклические фрагменты. Если не указано иное, галоген включает фтор, хлор, бром и йод.(С 2-С 9)Гетероциклоалкил, когда используется в данном описании, относится к пирролидинилу, тетрагидрофуранилу, дигидрофуранилу, тетрагидропиранилу, пиранилу, тиопиранилу, азиридинилу, оксиранилу, метилендиоксилу, хроменилу, изоксазолидинилу, 1,3-оксазолидин-3-илу, изотиазолидинилу, 1,3 тиазолидин-3-илу, 1,2-пиразолидин-2-илу, 1,3-пиразолидин-1-илу, пиперидинилу, тиоморфолинилу, 1,2 тетрагидротиазин-2-илу, 1,3-тетрагидротиазин-3-илу, тетрагидротиадиазинилу, морфолинилу, 1,2 тетрагидродиазин-2-илу, 1,3-тетрагидродиазин-1-илу, тетрагидроазепинилу, пиперазинилу, хроманилу и т.д. Обычному специалисту в данной области будет понятно, что связывание указанных (С 2C9)гетероциклоалкильных колец происходит через атом углерода или sp3-гибридизированный гетероатом азота.(С 2-С 9)Гетероарил, когда используется в данном описании, относится к фурилу, тиенилу, тиазолилу, пиразолилу, изотиазолилу, оксазолилу, изоксазолилу, пирролилу, триазолилу, тетразолилу, имидазолилу, 1,3,5-оксадиазолилу, 1,2,4-оксадиазолилу, 1,2,3-оксадиазолилу, 1,3,5-тиадиазолилу, 1,2,3 тиадиазолилу, 1,2,4-тиадиазолилу, пиридилу, пиримидилу, пиразинилу, пиридазинилу, 1,2,4-триазинилу,1,2,3-триазинилу, 1,3,5-триазинилу, пиразоло[3,4-b]пиридинилу, циннолинилу, птеридинилу, пуринилу,6,7-дигидро-5 Н-[1]пириндинилу, бензо[b]тиофенилу, 5,6,7,8-тетрагидрохинолин-3-илу, бензоксазолилу,бензотиазолилу, бензизотиазолилу, бензизоксазолилу, бензимидазолилу, тианафтенилу, изотианафтенилу, бензофуранилу, изобензофуранилу, изоиндолилу, индолилу, индолизинилу, индазолилу, изохинолинилу, хинолилу, фталазинилу, хиноксалинилу, хиназолинилу, бензоксазинилу и т.д. Обычному специалисту в данной области будет понятно, что связывание указанных (С 2-С 9)гетероарильных колец происходит через атом углерода или sp3-гибридизированный гетероатом азота.(С 6-С 10)Арил, когда используется в данном описании, относится к фенилу или нафтилу. Соединения, используемые в данном изобретении, включают все конформационные изомеры (например, цис- и транс-изомеры). Соединения, используемые в данном изобретении, имеют центры асимметрии и поэтому являются хиральными и существуют в различных энантиомерных и диастереомерных формах. В данном изобретении описано разделение оптических изомеров и стереоизомеров предшест-4 012666 венников составляющих компонентов и, посредством этого, соединений данного изобретения и их смесей, и ко всем фармацевтическим композициям и способам лечения, в которых они могут быть использованы или включены в них. В этом отношении изобретение включает как Е-, так и Z-конфигурации. Соединения формулы I также могут существовать в виде таутомеров. Данное изобретение включает такие таутомеры и их смеси. В частности, разделение рацемических смесей энантиомеров соединений, используемых в получении заместителя R1 формулы I, осуществляют путем обработки рацемической смеси специфическим оптическим изомером дизамещенной винной кислоты или тартрата в подходящем растворителе, таком как этанол с водой или без воды в качестве сорастворителя. Разделение при получении желаемого энантиомера в избытке 90% является возможным в соответствии со способом данного изобретения с использованием растворителей, таких как оптические изомеры винной кислоты и производные винной кислоты, такие как ди-пара-толуол-L-винная кислота и соль (S)-(+)-анденокислоты (пенцифос, соль (S)-(+)-2-гидрокси-5,5-диметил-4-фенил-1,3,2-диоксифосфоринан-2-оксида). Взаимодействие между антиподами - агентом разделения и определенным энантиомером обеспечивает разделение рацемической смеси, за счет чего осадок вещества для разделения и энантиомера обеспечивает одно из желаемых стереоспецифических веществ, и оставшийся в растворе энантиомер может быть отдельно выделен. Таким образом, в зависимости от желаемого определенного энантиомера и используемого способа разделения (т.е. от осадка или раствора) может быть одновременно выбрана стереоспецифическая природа процесса разделения; например, L форма агента разделения, такого как производное тартрата, обеспечивает осадок R формы заместителя R1 и раствора, содержащего L форму, и наоборот. Данное изобретение также относится к соединению формулы где R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена,гидрокси, нитро, карбокси, (C2-С 6)алкенила, (C2-С 6)алкинила, трифторметила, трифторметокси, (C1 С 6)алкила, (C1-С 6)алкокси, (С 3-С 10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены от одной до трех групп, выбранных из галогена, гидрокси, карбокси, амино(C1 С 6)алкилтио, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 5-С 9)гетероарила, (С 2-С 9)гетероциклоалкила,(С 3-С 9)циклоалкила или (С 6-С 10)арила; или R2 и R3, каждый независимо, представляют собой (С 3 С 10)циклоалкил, (С 3-С 10)циклоалкокси, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 6-С 10)ариламино, (C1C6)алкилтио, (С 6-С 10)арилтио, (C1-С 6)алкилсульфинил, (С 6-С 10)арилсульфинил, (C1-С 6)алкилсульфонил,(С 6-С 10)арилсульфонил, (С 1-С 6)ацил, (C1-С 6)алкокси-CO-NH-, (C1-C6)алкиламино-СО-, (С 5-С 9)гетероарил,(С 2-С 9)гетероциклоалкил или (С 6-С 10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-C6)алкилом, (C1-C6)алкил-CO-NH-, (C1-С 6)алкоксиCO-NH-, (C1-C6)алкил-CO-NH-(C1-C6)алкилом, (С 1-С 6)алкокси-CO-NH-(C1-С 6)алкилом, (C1-C6)алкоксиCO-NH-(C1-С 6)алкокси, карбокси, карбокси(C1-С 6)алкилом, карбокси(C1-С 6)алкокси, бензилоксикарбонил(C1-C6)алкокси, (С 1-С 6)алкоксикарбонил(C1-С 6)алкокси, (С 6-С 10)арилом, амино, амино(C1-C6)алкилом,(C1-С 6)алкоксикарбониламино, (С 6-С 10)арил(C1-С 6)алкоксикарбониламино, (C1-C6)алкиламино, C1 С 6)алкил)2 амино, (C1-С 6)алкиламино(C1-C6)алкилом, С 1-С 6)алкил)2 амино(C1-С 6)алкилом, гидрокси, (C1C6)алкокси, карбокси, карбокси(C1-С 6)алкилом, (C1-С 6)алкоксикарбонилом, (C1-С 6)алкоксикарбонил(C1 С 6)алкилом, (C1-C6)алкокси-CO-NH-, (C1-С 6)алкил-CO-NH-, циано, (С 5-С 9)гетероциклоалкилом, аминоCO-NH-, (C1-С 6)алкиламино-СО-NH-, C1-C6)алкил)2 амино-CO-NH-, (С 6-С 10)ариламино-CO-NH-, (С 5 С 9)гетероариламино-CO-NH-, (C1-С 6)алкиламино-CO-NH-(C1-С 6)алкилом, C1-С 6)алкил)2 амино-CO-NH(С 1-С 6)алкилом, (С 6-С 10)ариламино-CO-NH-(С 1-С 6)алкилом, (С 5-С 9)гетероариламино-CO-NH(C1-C6)алкилом, (C1-С 6)алкилсульфонилом, (C1-С 6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(C1-С 6)алкилом, (С 6-С 10)арилсульфонилом, (С 6-С 10)арилсульфониламино, (С 6-С 10)арилсульфониламино(C1 С 6)алкилом, (C1-С 6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(C1-С 6)алкилом, (С 5-С 9)гетероарилом или (С 2-C9)гетероциклоалкилом. Предпочтительно R2 и R3 представляют собой водород. Данное изобретение также относится к фармацевтической композиции, ингибирующей протеинкиназу или Киназу 3 Janus (JAK3) у млекопитающих, включая человека, предназначенной для лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации,ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза,-5 012666 диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний, включающей эффективное для таких нарушений или состояний количество 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил-3 оксопропионитрила или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель. Данное изобретение также относится к способу ингибирования протеинтирозинкиназ или киназы 3Janus (JAK3) у млекопитающих, включая человека, включающему введение указанному млекопитающему эффективного количества 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино] пиперидин-1-ил-3-оксопропионитрила или его фармацевтически приемлемой соли, отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами. Данное изобретение также относится к способу лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы,язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного для лечения такого состояния количества 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3d]пиримидин-4-ил)амино]пиперидин-1-ил-3-оксопропионитрила или его фармацевтически приемлемой соли, отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами. Данное изобретение также относится к соединению формулы Данное изобретение также относится к соединению формулы Данное изобретение также относится к соединению формулы Подробное описание изобретения Следующие схемы реакций иллюстрируют получение соединений данного изобретения. Если не указано иное, то R2, R3, R4 и R5 в схемах реакций и в следующем далее обсуждении являются такими, как определено выше. В реакции 1 получения А соединение 4-хлорпирроло[2,3-d]пиримидина формулы XXI, где R представляет собой водород или защитную группу, такую как бензолсульфонил или бензил, преобразовывали в соединение 4-хлор-5-галогенпирроло[2,3-d]пиримидина формулы XX, где Y представляет собой хлор,бром или йод, путем взаимодействия соединения XXI с N-хлорсукцинимидом, N-бромсукцинимидом или N-йодсукцинимидом. Реакционную смесь нагревали при кипячении с обратным холодильником в хлороформе в течение периода времени между приблизительно 1 и приблизительно 3 ч, предпочтительно около 1 ч. Альтернативно, в реакции 1 получения А 4-хлорпирроло[2,3-d]пиримидин формулы XXI, гдеR представляет собой водород, преобразовывали в соответствующий 4-хлор-5-нитропирроло[2,3d]пиримидин формулы XX, где Y представляет собой нитро, путем взаимодействия соединения XXI с азотной кислотой в серной кислоте при температуре между около -10 и около 10 С, предпочтительно около 0 С, в течение периода времени между приблизительно 5 и приблизительно 15 мин, предпочтительно около 10 мин. Соединение формулы XXI, где Y представляет собой нитро, преобразовывали в соответствующий 4-хлор-5-аминопирроло[2,3-d]пиримидин формулы XX, где Y представляет собой амино, путем взаимодействия XXI при различных условиях, известных специалисту в данной области, таких как гидрогенолиз с палладием или хлоридом олова (IV) и хлористо-водородной кислотой. В реакции 2 получения А соединение 4-хлор-5-галогенпирроло[2,3-d]пиримидина формулы XX, гдеR представляет собой водород, преобразовывали в соответствующее соединение формулы XIX, где R2 представляет собой (C1-С 6)алкил или бензил, путем обработки XX N-бутиллитием, при температуре приблизительно -78 С, и взаимодействия образованного таким образом промежуточного дианиона с алкилгалогенидом или бензилгалогенидом при температуре между приблизительно -78 С до комнатной температуры, предпочтительно при комнатной температуре. Альтернативно, образованный таким образом дианион подвергали взаимодействию с молекулярным кислородом для получения соответствующего соединения 4-хлор-5-гидроксипирроло[2,3-d]пиримидина формулы XIX, где R2 представляет собой гидрокси. Соединение формулы XX, где Y представляет собой бром или йод и R представляет собой бензолсульфонат, преобразовывали в соединение формулы XIX, где R2 представляет собой (С 6-С 12)арил или винил, путем обработки XX N-бутиллитием при температуре приблизительно -78 С с последующим добавлением хлорида цинка, при температуре приблизительно -78 С. Образованное таким образом соответствующее цинкорганическое промежуточное соединение затем подвергали взаимодействию с арилйодидом или винилйодидом в присутствии каталитического количества палладия. Реакционную смесь перемешивали при температуре между приблизительно 50 и приблизительно 80 С, предпочтительно около 70 С, в течение периода времени между приблизительно 1 и 3 ч, предпочтительно около 1 ч. В реакции 3 получения А соединение формулы XIX преобразовывали в соответствующее соединение формулы XVI путем обработки XIX N-бутиллитием, диизопропиламином лития или гидридом натрия при температуре приблизительно -78 С, в присутствии полярного апротонного растворителя, такого как тетрагидрофуран. Образованное таким образом анионное промежуточное соединение далее подвергали взаимодействию с (а) алкилгалогенидом или бензилгалогенидом при температуре между приблизительно -78 С и комнатной температурой, предпочтительно -78 С, если R3 представляет собой алкил или бензил; (b) альдегидом или кетоном при температуре между приблизительно -78 С и комнатной температурой, предпочтительно -78 С, если R3 представляет собой алкокси; и (с) хлоридом цинка при температуре между приблизительно -78 С и комнатной температурой, предпочтительно -78 С, и образованное таким образом соответствующее цинкорганическое промежуточное соединение затем подвергали взаимодействию с арилйодидом или винилйодидом в присутствии каталитического количества палладия.-9 012666 Полученную реакционную смесь перемешивали при температуре между приблизительно 50 и приблизительно 80 С, предпочтительно около 70 С, в течение периода времени между приблизительно 1 и 3 ч,предпочтительно около 1 ч. Альтернативно, образованный таким образом анион подвергали взаимодействию с молекулярным кислородом до образования соответствующего соединения 4-хлор-6 гидроксипирроло[2,3-d]пиримидина формулы XVI, где R3 представляет собой гидрокси. В реакции 1 получения В соединение 4-хлорпирроло[2,3-d]пиримидина формулы XXI преобразовывали в соответствующее соединение формулы XXII в соответствии с методикой, описанной выше в реакции 3 получения А. В реакции 2 получения В соединение формулы XXII преобразовывали в соответствующее соединение формулы XVI в соответствии с методиками, описанными выше в реакциях 1 и 2 получения А. В реакции 1 схемы 1 соединение 4-хлорпирроло[2,3-d]пиримидина формулы XVII преобразовывали в соответствующее соединение формулы XVI, где R представляет собой бензолсульфонил или бензил,путем обработки XVII бензолсульфонилхлоридом, бензилхлоридом или бензилбромидом в присутствии основания, такого как гидрид натрия или карбонат калия, и полярного апротонного растворителя, такого как диметилформамид или тетрагидрофуран. Реакционную смесь перемешивали при температуре между приблизительно 0 и приблизительно 70 С, предпочтительно около 30 С, в течение периода времени между приблизительно 1 и 3 ч, предпочтительно около 2 ч. В реакции 2 схемы 1 соединение 4-хлорпирроло[2,3-d]пиримидина формулы XVI преобразовывали в соответствующее соединение 4-аминопирроло[2,3-d]пиримидина формулы XV путем реакции сочетания с амином формулы HNR4R5. Реакцию проводили в водном или спиртовом растворителе, таком как трет-бутанол, метанол или этанол, или других высококипящих органических растворителях, таких как диметилформамид, триэтиламин, 1,4-диоксан или 1,2-дихлорэтан, при температуре в пределах от около 60 до около 120 С, предпочтительно около 80 С. Обычно время реакции составляет от около 2 до около 100 ч, предпочтительно около 48 ч. Если R5 представляет собой азотсодержащую гетероциклоалкильную группу, то каждый атом азота должен быть защищен защитной группой, такой как бензил. Снятие защиты с группы R5 проводили при условиях, подходящих для такой конкретно используемой защитной группы, не оказывая воздействия на R защитную группу в кольце пирроло[2,3-d]пиримидина. Удаление защитной группы у R5, когда защитной группой является бензил, проводили в спиртовом растворителе,таком как этанол, в присутствии водорода и катализатора, такого как гидроксид палладия на угле, при температуре в пределах от комнатной температуры до около 70 С. Образованная таким образом азотсодержащая гетероциклоалкильная группа R5 может далее взаимодействовать с множеством различных электрофилов формулы II. Для образования мочевины электрофилы формулы II, такие как изоцианаты,карбаматы и карбамоилхлориды, подвергали взаимодействию с атомом азота гетероциклоалкильной группы R5 в растворителе, таком как ацетонитрил или диметилформамид, в присутствии основания, такого как карбонат натрия или калия, при температуре в пределах от около 20 до около 100 С, в течение периода времени от около 24 до около 72 ч. Для образования амида и сульфонамида электрофилы формулы II, такие как ацилхлориды и сульфонилхлориды, подвергали взаимодействию с атомом азота гетероциклоалкильной группы R5 в растворителе, таком как метиленхлорид, в присутствии основания, такого как пиридин, при температуре окружающей среды в течение периода времени от около 12 до около 24 ч. Образование амида также можно осуществлять взаимодействием карбоновой кислоты с гетероалкильной группой в присутствии карбодиимида, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимид, в растворителе, таком как метиленхлорид, при температуре окружающей среды в течение времени от около 12 до около 24 ч или с активированным сложным эфиром, таким как сложный эфир Nгидроксисукцинимида или 4-нитрофениловый сложный эфир, в растворителе, таком как метиленхлорид,тетрагидрофуран или этанол. Для образования алкила, электрофилы формулы II, такие как ,ненасыщенные амиды, кислоты, нитрилы, сложные эфиры и -галогенамиды, подвергали взаимодействию с атомом азота гетероциклоалкильной группы R5 в растворителе, таком как метанол, при температуре окружающей среды, в течение периода времени от около 12 до около 18 ч. Образование алкила также можно осуществлять взаимодействием альдегидов с гетероалкильной группой в присутствии восстановителя, такого как цианоборгидрид натрия, в растворителе, таком как метанол, при температуре окружающей среды в течение времени от около 12 до около 18 ч. В реакции 3 схемы 1 удаление защитной группы из соединения формулы XV, где R представляет собой бензолсульфонил, с получением соответствующего соединения формулы I проводили путем обработки XV щелочным основанием, таким как гидроксид натрия или гидроксид калия, в спиртовом растворителе, таком как метанол или этанол, или смешанных растворителях, таких как спирт/тетрагидрофуран или спирт/вода. Реакцию проводили при комнатной температуре в течение периода времени от около 15 мин до около 1 ч, предпочтительно 30 мин. Удаление защитной группы из соединения формулы XV, гдеR представляет собой бензил, проводили путем обработки XV натрием в аммиаке при температуре около-78 С в течение периода времени от около 15 мин до около 1 ч. В реакции 1 схемы 2 соединение 4-хлорпирроло[2,3-d]пиримидина формулы XX преобразовывали в соответствующее соединение 4-аминопирроло[2,3-d]пиримидина формулы XXIV, в соответствии со спо- 10012666 собом, описанным выше в реакции 2 схемы 1. В реакции 2 схемы 2 соединение 4-амино-5-галогенпирроло[2,3-d]пиримидина формулы XXIV, гдеR представляет собой бензолсульфонат и Z представляет собой бром или йод, преобразовывали в соответствующее соединение формулы XXIII путем взаимодействия XXIV с (а) арилборной кислотой, где R2 представляет собой арил, в апротонном растворителе, таком как тетрагидрофуран или диоксан, в присутствии каталитического количества палладия(0) при температуре в пределах от около 50 до около 100 С,предпочтительно около 70 С, в течение периода времени от около 2 до около 48 ч, предпочтительно около 12 ч; (b) алкинами, где R2 представляет собой алкинил, в присутствии каталитического количества йодида меди(I) и палладия(0), в полярном растворителе, таком как диметилформамид, при комнатной температуре в течение периода времени от около 1 до около 5 ч, предпочтительно около 3 ч; и (с) алкенами или стиренами, где R2 представляет собой винил или стиренил, в присутствии каталитического количества палладия в диметилформамиде, диоксана или тетрагидрофурана при температуре в пределах от около 80 до около 100 С, предпочтительно около 100 С, в течение периода времени от около 2 до около 48 ч, предпочтительно около 48 ч. В реакции 3 схемы 2, соединение формулы XXIII преобразовывали в соответствующее соединение формулы XV, в соответствии со способом, описанным выше в реакции 3 получения А. В реакции 1 схемы 3 соединение формулы XVII преобразовывали в соответствующее соединение формулы I в соответствии со способом, описанным выше в реакции 2 схемы 1. Соединения данного изобретения, которые являются основными по природе, способны к образованию широкого диапазона различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто является желательным изначально выделить соединение данного изобретения из реакционной смеси в качестве фармацевтически неприемлемой соли и затем просто преобразовать последнюю обратно в свободное основное соединение обработкой щелочным реагентом и последовательно преобразовать последнее свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотноаддитивные соли основных соединений данного изобретения легко получают путем обработки основного соединения, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как ацетон,метанол или этанол. Желаемую твердую соль легко получить при осторожном выпаривании растворителя. Желаемую соль кислоты также можно осаждать из раствора свободного основания в органическом растворителе при добавлении к раствору подходящей минеральной или органической кислоты. Те соединения данного изобретения, которые являются по своей природе кислотными, являются способными к образованию основных солей с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов и, в частности, соли кальция, натрия и калия. Все эти соли получают обычными методами. Химические основания, которые используются в качестве реагентов для получения фармацевтически приемлемых основных солей настоящего изобретения, представляют собой основания, которые образуют нетоксичные основные соли с кислотными соединениями данного изобретения. Такие нетоксичные основные соли включают те соли,которые являются производными от таких фармакологически приемлемых катионов, как натрий, калий,кальций и магний и т.д. Эти соли можно легко получить путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, и затем выпариванием полученного раствора досуха предпочтительно при пониженном давлении. Альтернативно, их также можно получить смешением низших алканольных растворов кислотных соединений с желаемым алкоксидом щелочного металла и затем выпариванием полученного раствора досуха способом, аналогичным ранее описанному. В каждом случае предпочтительно используются стехиометрические количества реагентов для того, чтобы обеспечить завершенность реакции и максимальные выходы желаемого конечного продукта. Композиции по данному изобретению могут быть получены обычным способом с использованием одного или более фармацевтически приемлемых носителей. Таким образом, активные соединения изобретения могут быть изготовлены для перорального, буккального, интраназального, парентерального(например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме,подходящей для введения путем ингаляции или вдувания. Активные соединения по изобретению могут быть также изготовлены в форме для замедленного высвобождения. Для перорального введения фармацевтические композиции могут иметь форму, например, таблеток или капсул, полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или кремнезем); дезинтегранты (например, картофельный крахмал или крахмалгликолят натрия); или увлажнители (например,лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в данной области.- 11012666 Жидкие препараты для перорального введения могут иметь форму, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для смешения с водой или другим подходящим растворителем перед использованием. Такие жидкие препараты могут быть получены обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты(например, сорбитоловый сироп, метилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или акация); неводные растворители (например, миндальное масло, масляные сложные эфиры или этиловый спирт) и консерванты (например, метил или пропил, парагидроксибензоаты или сорбиновая кислота). Для буккального введения композиции могут иметь форму таблеток или лепешек, приготовленных обычным способом. Активные соединения по изобретению могут быть изготовлены в форме композиции для парентерального введения путем инъекции, включая использование обычных катетерных методик или вливания. Фармацевтические композиции для инъекции могут быть представлены в единичной дозированной форме, например в ампулах, или в упаковках, содержащих множество доз, с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных растворителях, и могут содержать средства для приготовления лекарственных препаратов, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для восстановления подходящим растворителем перед использованием,например, стерильной апирогенной водой. Активные соединения изобретения также можно изготавливать в форме ректальных композиций,таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции активные соединения изобретения удобным образом доставляются в форме раствора или суспензии из контейнера с диспергирующим устройством, который сжимается или накачивается пациентом, или доставляются в виде аэрозольного спрея из контейнера, находящегося под давлением, или распылителя с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, разовая доза может определяться за счет клапана для доставки отмеренного количества. Контейнер, находящийся под давлением, или распылитель может содержать раствор или суспензию активного соединения. Капсулы и картриджи (сделанные, например, из желатина) для использования в ингаляторе или вдувателе могут изготовляться содержащими порошковую смесь соединения по данному изобретению и подходящего порошкового основания, такого как лактоза или крахмал. Предложенная доза активных соединений по данному изобретению для перорального, парентерального или буккального введения среднему взрослому человеку для лечения состояний, относящихся к описанным выше (например, ревматоидному артриту) составляет 0,1-1000 мг активного ингредиента на единичную дозу, которая может вводиться, например, от 1 до 4 раз в день. Аэрозольные композиции для лечения состояний, относящихся к описанным выше (например, астме) у среднего взрослого человека, предпочтительно составлены так, что каждая отмеренная доза или импульс аэрозоля содержит 20-1000 мкг соединения по данному изобретению. Верхний предел суточной дозы аэрозоля должен быть в пределах от 0,1 до 1000 мг. Введение можно осуществлять несколько раз в день, например 2, 3, 4 или 8 раз, получая, например, 1, 2 или 3 дозы каждый раз. Соединение формулы (I) вводят в фармацевтически приемлемой форме либо отдельно, либо в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами, средствами, которые могут включать, но не ограничиваются этим, циклоспорин А (например, Sandimmune или Neoral), рапамицин, FK-506(такролимус), лефлуномид, дезоксиспергуалин, микофенолят (например, Cellcept), азатиоприн (например, Imuran), даклизумаб (например, Zenapax), ОКТ 3 (например, Orthocolone), AtGam, аспирин,акктаминофен, ибупрофен, напроксен, пироксикам и противовоспалительные стероиды (например, преднизолон или дексаметазон); и такие средства могут вводиться как часть одной и той же или в виде отдельной дозированной формы, одним и тем же или различными путями введения, и по одним и тем же или разным схемам введения, в соответствии со стандартной фармацевтической практикой.FK-506 (Такролимус) вводят перорально в дозе 0,10-0,15 мг/кг веса тела каждые 12 ч, в первые 48 ч после операции. Доза контролируется по падению уровней Такролимуса в сыворотке. Циклоспорин А (пероральная или внутривенная композиция Sandimmune или Neoral, пероральный раствор или капсулы) вводят перорально в дозе 5 мг/кг веса тела каждые 12 ч, в первые 48 ч после операции. Доза контролируется по падению уровней циклоспорина А в крови. Активные агенты могут быть представлены в форме композиции замедленного высвобождения в соответствии со способами, хорошо известными обычному специалисту в данной области. Примеры таких композиций можно найти в патентах США 3538214, 4060598, 4173626, 3119742 и 3492397. Способность соединений формулы I или их фармацевтически приемлемых солей ингибировать ки- 12012666 назу 3 Janus, следовательно, демонстрировать эффективность для лечения нарушений или состояний,охарактеризованных киназой 3 Janus, представлена при помощи следующих анализов in vitro. Биологический анализ Ферментный анализ JAK3 (JH1:GST). В анализе киназы JAK3 используют белок, экспрессированный в клетках SF9, инфицированных бакуловирусом (слитый белок GST и каталитического домена человеческой JAK3), очищенный аффинной хроматографией на глутатион-сефарозе. Субстрат для реакции представляет собой полиглутаминовую кислоту-тирозин (PGT(4:1) Sigma catalog P0275), нанесенный на планшеты Nunc Maxi Sorp в количестве 100 мкг/мл, в течение ночи при 37 С. На утро, следующее после нанесения, планшеты промывали три раза и добавляли JAK3 в лунки, содержащие 100 мкл киназного буфера (50 мМ HEPES, рН 7,3, 125 мМNaCl, 24 мМ MgCl2)+0,2 мкМ АТФ+1 мМ ортованадата Na). Реакцию продолжали в течение 30 мин при комнатной температуре и планшеты промывали еще три раза. Уровень фосфорилированного тирозина в данной лунке подсчитывали при помощи стандартного анализа ELISA с использованием антифосфотирозинового антителя (ICN PY20, cat.69-151-1). Ингибирование зависимой от человеческого IL-2 пролиферации Т-бластных клеток. В этом анализе измеряют ингибирующее действие соединений на зависимую от человеческого IL-2 пролиферацию Т-бластных клеток in vitro. Так как передача сигнала через IL-2 рецептор требует JAK3,клеточно-активные ингибиторы JAK3 должны ингибировать зависимую от IL-2 пролиферацию Тбластных клеток. Клетки для этого анализа выделяли из свежей человеческой крови. После отделения моноядерных клеток с использованием Accuspin System-Histopaque-1077 (SigmaA7054), первичные человеческие Тклетки выделяли при помощи отрицательной выборки, используя Lympho-Kwik T (One Lambda, Inc.,CatLK-50T). Т-клетки культивировали при 1-2106/мл в Среде (RPMI+10% фетальная телячья сыворотка, инактивированная теплом (Hyclone CatA-1111-L) + 1% пенициллин/стрептомицин (Gibco и индуцировали для пролиферации путем добавления 10 мкг/мл РНА (Murex Diagnostics, CatНА 16). Через 3 дня при 37 С в 5% СО 2 клетки промывали 3 раза в Среде, ресуспендировали до плотности 1-2106 клеток/мл в Среде плюс 100 ед./мл человеческого рекомбинантного IL-2 (RD Systems, Cat202-IL). Через одну неделю клетки являются IL-2 зависимыми и могут поддерживаться до трех недель за счет подпитки равными объемами Среды + 100 ед./мл IL-2 дважды в неделю. Для анализа способности испытываемых соединений ингибировать зависимую от IL-2 пролиферацию Т-клеток, IL-2-зависимые клетки промывали 3 раза, ресуспендировали в среде и затем высевали(50000 клеток/лунку/0,1 мл) в 96-луночный микротитровальный планшет с плоским дном (Falcon353075). Из 10 мМ исходного раствора тестируемого соединения в ДМСО, серийные двукратные разведения соединения добавляли в лунки в трех повторах, начиная с 10 мкМ. Спустя 1 ч в каждую тестируемую лунку добавляли 10 ед./мл IL-2. Планшеты затем инкубировали при 37 С, 5% СО 2 в течение 72 ч. Затем планшеты метили 3 Н-тимидином (0,5 мкКюри/лунку) (NEN CatNET-027A), и инкубировали дополнительно 18 ч. Культуральные планшеты затем собирали при помощи 96-луночного планшетного харвестера и определяли количество 3 Н-тимидина, включенного в пролифирирующие клетки, считыванием на сцинтилляционном счетчике Packard Top Count. Данные анализировали построением графика зависимости ингибирования пролиферации (%) от концентрации тестируемого соединения. ВеличинуIC50 (мкМ) определяли из этого графика. Следующие примеры иллюстрируют получение соединений данного изобретения, но конкретно не ограничивают его. Температуры плавления нескорректированы. Данные ЯМР приведены в частях на миллиони соотнесены с сигналом дейтерия из содержащего образец растворителя (дейтериохлороформа, если не указано иное). Коммерческие реагенты использовались без дальнейшей очистки. ТГФ относится к тетрагидрофурану. ДМФ относится к N,N-диметилформамиду. Масс-спектр низкого разрешения (Low Resolution Mass Spectra (LRMS записывали либо на Hewlett Packard 5989, используя химическую ионизацию (аммоний), либо используя платформу Fisons (или Micro Mass) химической ионизации при атмосферном давлении (APCI), в которой используется смесь 50/50 ацетонитрил/вода с 0,1% муравьиной кислотой в качестве ионизирующего средства. Комнатная или температура окружающей среды относится к 20-25 С. Пример 1 (образование устойчивой соли). Бисгидрохлорид (1-бензил-4-метилпиперидин-3 ил)метиламина. К раствору 23,4 кг (1-бензил-4-метилпиперидин-3-ил)метиламина в 10 л толуола и 120 л этанола при 3 С добавляли 25 л 32% HCl в воде, поддерживая температуру реакции ниже 10 С. 100 л растворителя отгоняли дистилляцией при частичном вакууме и при 30 С добавляли 215 л этилацетата. 210 л растворителя отгоняли дистилляцией при частичном вакууме и добавляли еще 215 л этилацетата, и следующие 210 л растворителя отгоняли дистилляцией при частичном вакууме. При 35 С добавляли 111 л ацетона, суспензию охлаждали до 0 С и затем продукт, бисгидрохлорид (1-бензил-4-метилпиперидин-3 ил)метиламина, отфильтровывали и промывали 55 л ацетона. Мокрую лепешку ресуспендировали 3 раза в этаноле (10 об.экв. при кипячении с обратным холодильником) для изменения соотношения диастере- 13012666 омеров цис:транс от 91:9 до более чем 97:3. Всего было получено 19,4 кг, выход 62%. 1 Н ЯМР (CD3OD, 400 МГц): 7,55 (м, 5 Н), 4,88 (с, 3 Н), 4,52 (д, J=12,8 Гц, 1 Н), 4,45 (д, J=12,8 Гц, 1 Н),3,76 (м, 1 Н), 3,67 (м, 1 Н), 3,40-3,00 (м, 3 Н), 2,78 (3,3 Н), 2,55 (м, 1 Н), 2,14 (м, 1 Н), 1,90 (м, 1 Н), 1,16 (д,J=7,2 Гц, 3 Н). Пример 2 (разделение). бис[(1-Бензил-4-метилпиперидин-3-ил)метиламин]ди-пара-толуил-Lтартрат. К раствору 9,5 кг бис-гидрохлорида (1-бензил-4-метилпиперидин-3-ил)метиламина в 16 л воды добавляли 33 л 2 н. гидроксида натрия. Из смеси осаждали твердые вещества. Суспензию разбавляли 43 л изопропанола и 11 л метанола, чтобы повторно растворить твердые вещества. Добавляли ди-паратолуил-L-винную кислоту (6,3 кг) с осаждением твердых веществ. Суспензию нагревали при кипячении с обратным холодильником, чтобы повторно растворить твердые вещества, затем медленно охлаждали до 72 С. Добавляли затравочные кристаллы бис[(1-бензил-4-метилпиперидин-3-ил)метиламин]ди-паратолуил-L-тартрата (180 г) и мутный раствор медленно охлаждали до 15 С. Твердые вещества фильтровали и промывали изопропанолом, чтобы на выходе получить 5,9 кг бис[(1-бензил-4-метилпиперидин-3 ил)метиламин]ди-пара-толуил-L-тартрата с выходом 44%. 1H ЯМР (CD3OD, 400 МГц): 8,04 (д, J=8,4 Гц, 2 Н), 7,30 (м, 7 Н), 5,86 (с, 1 Н), 4,91 (с, 3 Н), 3,64 (д,J=12,8 Гц, 1 Н), 3,41 (д, J=12,8 Гц, 1 Н), 3,09 (с, 1 Н), 2,90 (м, 2 Н), 2,40 (с, 3 Н), 2,22 (м, 2 Н), 1,92 (м, 1 Н),1,57 (м, 2 Н), 1,03 (д, J=7,2 Гц, 3 Н). Пример 3 (разделение фенцифоса). К раствору 6,83 г (31,3 ммоль) в 250 мл IPA и 10 мл воды добавляли 7,57 г (+)фенцифоса (31,3 ммоль) и смесь нагревали при кипячении с обратным холодильником, чтобы получить чистый раствор. При температуре приблизительно 65 С добавляли затравочные кристаллы с 90% ЭИ. Кристаллизация начиналась в течение одного часа, и смесь оставляли на ночь для достижения комнатной температуры. Выделение достигало 6,85 г (47%) с 99% ЭИ. Фильтрат концентрировали, добавляли ТВМЕ, воду иK2CO3 и слои разделяли. Органический слой сушили (Na2SO4) и растворитель выпаривали. Получившееся масло (3,99 г) растворяли в 200 мл IPA и 10 мл воды и добавляли 4,4 г (-)фенцифоса. Смесь нагревали при кипячении с обратным холодильником и оставляли на ночь остывать до комнатной температуры. Это давало 6 г (41%) соли с 99,9+% ЭИ. Анализы проводили на свободный амин. Свободный амин получали путем обработки соли ТВМЕ, водой и K2CO3. Далее схематически проиллюстрированы способы примеров 1-3 (где Bn означает бензил (-СН 2 С 6 Н 5 Пример 4. Растворяли рацемическую смесь соединения формулы III Обработка образца. Соединение формулы III фильтровали через фильтровальный диск из нейлона 66 с диаметром отверстий 0,2 мкм. Процедура: (96% этанола, 4% воды в качестве растворителя). 0,8711 г соединения формулы III, фильтрата, растворяли в 5,0 мл смеси этанол/вода в соотношении 96:4. Добавляли 1,544 г ди-пара-толуоил-L-винной кислоты и смесь перемешивали, чтобы получить чистый раствор. Раствор оставляли стоять при комнатной температуре в течение приблизительно 4 ч. Получившуюся суспензию фильтровали на фильтровальной бумаге Whatman2 и промывали 4,0 мл смеси этанол/вода в соотношении 96:4. Твердые вещества сушили на воздухе с получением 0,488 г диастереомерной соли. 0,488 г диастереомерной соли суспендировали в 50 мл воды, затем добавляли 50 мл метиленхлорида. рН смеси доводили до приблизительно 9, используя насыщенный бикарбонат натрия с последующим добавлением 1,0 н. гидроксида натрия. После регулирования достижения уровня рН, слои разделяли и слой метиленхлорида фильтровали через фильтровальную бумагу Whatman2. Растворители затем удаляли выпариванием при пониженном давлении с получением масла светло-оранжевого цвета. Вес не определяли. Это масло оценивали с помощью газовой хроматографии. Аналитический анализ: 97,3% желаемого энантиомера, определенного по нормализованной площади пика (процент). Пример 5. Процедура: (100% этанол в качестве растворителя). 0,8714 г (1-бензил-4-метилпиперидин-3-ил)метиламина растворяли в 5,0 мл 200-градусного этанола. Добавляли 1,544 г ди-пара-толуоил-L-винной кислоты и смесь перемешивали, чтобы получить чистый раствор. Раствор оставляли стоять при комнатной температуре в течение приблизительно 4 ч. Получившуюся суспензию фильтровали на фильтровальной бумаге Whatman2 и промывали 4,0 мл смеси этанол/вода в соотношении 96:4. Твердые вещества сушили на воздухе с получением 0,628 г диастереомерной соли. 0,628 г диастереомерной соли суспендировали в 50 мл воды, затем добавляли 50 мл метиленхлорида. рН смеси доводили до приблизительно 9, используя насыщенный бикарбонат натрия с последующим добавлением 1,0 н. гидроксида натрия. По завершении достижения уровня рН слои разделяли и слой метиленхлорида фильтровали через фильтровальную бумагу Whatman2. Растворители затем удаляли выпариванием при пониженном давлении с получением масла светло-желтого цвета. Вес не определяли. Оценку масла проводили аналитическим анализом: 90,5% желаемого энантиомера, определенного при нормализованной площади пика (процент). Пример 6. 3-(3R,4R)-4-Метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1 ил-3-оксопропионитрил. Способ А. (3R,4R)-(1-Бензил-4-метилпиперидин-3-ил)метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил) амин. 4-Хлорпирроло[2,3-d]пиримидин (5,37 г, 34,9 ммоль), полученный способом Davoll, J. Am. Chem.Soc, 82, 131 (1960), который введен в данное описание посредством ссылки в полном объеме, продукт примера 2 (6 г, 27,5 ммоль) и карбонат калия (11,4 г, 82,5 ммоль) соединяли в воде (60 мл). Суспензию нагревали при кипячении с обратным холодильником в течение 90 ч. Смесь охлаждали до 90 С и добавляли толуол (60 мл). Двухфазную смесь фильтровали при помощи фильтра и слои разделяли. Водный слой экстрагировали толуолом. Объединенные толуоловые слои промывали 1 н. NaOH, обрабатывали активированным углем и фильтровали с помощью фильтра. Толуол выпаривали в вакууме и остаток кристаллизовали из смеси изопропилацетата и гексанов 1:1 с получением 5 г не совсем белого твердого вещества; выход 54%. LRMS: 336,1 (М+1). Способ В. Метил-3R,4R)-4-метилпиперидин-3-ил)-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. К продукту способа А (0,7 г, 2,19 ммоль), растворенному в 15 мл этанола, добавляли 1,5 мл 2 н. хлороводородной кислоты и реакционную смесь дегазировали пропусканием через нее азота. К реакционной смеси затем добавляли 0,5 г 20% гидроксида палладия на угле (50% воды) (Aldrich) и полученную смесь встряхивали (Parr-Shaker) в атмосфере водорода при 50 фунт/кв.дюйм (345 кПа) и комнатной температу- 15012666 ре в течение 2 дней. Отфильтрованную через целит реакционную смесь концентрировали досуха в вакууме и остаток очищали флэш-хроматографией (силикагель; 5% метанол в дихлорметане), получая 0,48 г (90%) указанного в заголовке соединения. LRMS: 246,1 (М+1). Способ С. 3-(3R,4R)-4-Метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1 ил-3-оксопропионитрил. К перемешиваемому раствору продукта способа В (1,0 г), растворенному в 30 мл этанола, добавляли 0,82 г 2,5-диоксопирролидин-1-илового эфира циано-уксусной кислоты и полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали через Celite и концентрировали в вакууме. Остаток повторно растворяли в дихлорметане, промывали насыщенным водным бикарбонатом натрия, сушили над сульфатом натрия, фильтровали и концентрировали досуха в вакууме, получая 1,1 г (86%) указанного в заголовке соединения в виде желтой пены. LRMS: 313 (М+1). Пример 7. 1-(3R,4R)-4-Метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1 илэтанон. К перемешиваемому раствору продукта способа В (0,03 г, 0,114 ммоль), растворенному в 5 мл смеси дихлорметан/пиридин 10:1, добавляли (0,018 г, 0,228 ммоль) ацетилхлорида и полученную смесь перемешивали при комнатной температуре в течение 18 ч. Затем реакционную смесь распределяли между дихлорметаном и насыщенным бикарбонатом натрия (NaHCO3). Органический слой снова промывали насыщенным NaHCO3, сушили над сульфатом натрия и концентрировали досуха в вакууме. Остаток очищали препаративной тонкослойной хроматографией (PTLC) (силикагель; 4% метанол в дихлорметане), получая 0,005 г (15%) указанного в заголовке соединения в виде бесцветного масла. Указанные в заголовках соединения для примеров 8-31 получали способом, аналогичным описанному в примере 7. Пример 8. (3R,4R)-[1-(2-Аминоэтансульфонил)-4-метилпиперидин-3-ил]метил-(7 Н-пирроло[2,3d]пиримидин-4-ил)амин. Пример 9. (3R,4R)-(1-Этансульфонил-4-метилпиперидин-3-ил)метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. Пример 10.- 16012666 Пример 28. 3-Этокси-1-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-илпропан-1-он. Пример 29. Метиламид (3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-карбоновой кислоты. Пример 30. Диэтиламид (3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-карбоновой кислоты. Пример 31. (3R,4R)-Метил-[4-метил-1-(2-метиламиноэтансульфонил)пиперидин-3-ил]-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы или его фармацевтически приемлемой соли, в котором R1 представляет собой группу формулыR4 выбран из группы, состоящей из водорода, (C1-С 6)алкила, (C1-С 6)алкилсульфонила, (C2 С 6)алкенила, (C2-С 6)алкинила, в которой группы алкила, алкенила и алкинила необязательно замещены дейтерием, гидрокси, амино, трифторметилом, (C1-С 4)алкокси, (C1-С 6)ацилокси, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, циано, нитро, (C2-С 6)алкенилом, (C2-С 6)алкинилом или (C1-С 6)ациламино; или R4 представляет собой (С 3-С 10)циклоалкил, в котором циклоалкильная группа необязательно замещена дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси, (C1-С 6)ациламино, (C1-C6)алкиламино, C1 С 6)алкил)2 амино, циано, циано(C1-С 6)алкилом, трифторметил(С 1-С 6)алкилом, нитро, нитро(C1 С 6)алкилом или (C1-С 6)ациламино;R5 представляет собой (С 3-С 9)гетероциклоалкил, при условии, что когда (С 3-С 9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу, каждый атом азота должен быть защищен защитной группой, и в котором гетероциклоалкильная группа должна иметь от одного до пяти заместителей, выбранных из карбокси, циано, амино, дейтерия, гидрокси, (C1-С 6)алкила, (C1-C6)алкокси,галогена, (C1-C6)ацила, (C1-С 6)алкиламино, амино(С 1-С 6)алкила, (C1-C6)алкокси-CO-NH, (С 1 С 6)алкиламино-СО-, (C2-С 6)алкенила, (С 2-С 6)алкинила, (C1-С 6)алкиламино, амино(C1-С 6)алкила, гидрокси(С 1-С 6)алкила, (C1-С 6)алкокси(C1-С 6)алкила, (C1-C6)ацилокси(C1-С 6)алкила, нитро, циано(C1 С 6)алкила, галоген(C1-С 6)алкила, нитро(C1-С 6)алкила, трифторметила, трифторметил(C1-С 6)алкила, (C1 С 6)ациламино, (С 1-С 6)ациламино(C1-С 6)алкила, (C1-С 6)алкокси(C1-С 6)ациламино, амино(C1-С 6)ацила,амино(C1-С 6)ацил(C1-С 6)алкила,(C1-С 6)алкиламино(C1-С 6)ацила,C1-С 6)алкил)2 амино(C1-C6)ацила,R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкила, (C1-C6)алкил-S(О)m, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкила, R15S(O)mR16N, R15S(O)mR16N(C1-С 6)алкила, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбраны из водорода или (C1-С 6)алкила; или группу формулы IIR6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1 С 6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси,(C1-С 6)ациламино, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, циано, циано(C1-С 6)алкилом, трифторметил(C1-С 6)алкилом, нитро, нитро(C1-C6)алкилом или (C1-C6)ациламино;R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (С 1 С 6)алкил, трифторметил(C1-С 6)алкил, (C1-С 6)алкокси, галоген, (C1-С 6)ацил, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, амино(C1-С 6)алкил, (C1-С 6)алкокси-CO-NH, (C1-С 6)алкиламино-СО-, (C2-С 6)алкенил,(С 2-С 6)алкинил,(C1-С 6)алкиламино,гидрокси(C1-С 6)алкил,(C1-С 6)алкокси(C1-С 6)алкил,(C1 С 6)ацилокси(C1-С 6)алкил, нитро, циано(C1-C6)алкил, галоген(C1-С 6)алкил, нитро(C1-С 6)алкил, трифторметил, трифторметил(C1-С 6)алкил, (C1-С 6)ациламино, (С 1-С 6)ациламино(C1-C6)алкил, (С 1-С 6)алкокси(C1 С 6)ациламино, амино(С 1-С 6)ацил, амино(C1-С 6)ацил(C1-С 6)алкил, (C1-С 6)алкиламино(C1-С 6)ацил, C1 С 6)алкил)2 амино(C1-С 6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH,R15NHC(O)NH, (C1-С 6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С 6)алкила;R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена,гидрокси, нитро, карбокси, (C2-С 6)алкенила, (C2-С 6)алкинила, трифторметила, трифторметокси, (C1 С 6)алкила, (С 1-С 6)алкокси, (С 3-С 10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены одной-тремя группами, выбранными из галогена, гидрокси, карбокси, амино(C1 С 6)алкилтио, (С 1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 5-С 9)гетероарила, (С 2-С 9)гетероциклоалкила,(С 3-С 9)циклоалкила или (С 6-С 10)арила; или R2 и R3, каждый независимо, представляют собой (С 3 С 10)циклоалкил, (С 3-С 10)циклоалкокси, (C1-С 6)алкиламино, С 1-С 6)алкил)2 амино, (С 6-С 10)ариламино, (C1 С 6)алкилтио, (С 6-С 10)арилтио, (C1-С 6)алкилсульфинил, (С 6-С 10)арилсульфинил, (C1-С 6)алкилсульфонил,(С 6-С 10)арилсульфонил, (С 1-С 6)ацил, (C1-С 6)алкокси-CO-NH-, (C1-С 6)алкиламино-СО-, (С 5-С 9)гетероарил,(С 2-С 9)гетероциклоалкил или (С 6-С 10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-С 6)алкилом, (C1-С 6)алкил-CO-NH-, (C1-С 6)алкоксиCO-NH-, (C1-C6)алкил-CO-NH-(C1-C6)алкилом, (С 1-С 6)алкокси-CO-NH-(C1-С 6)алкилом, (C1-C6)алкоксиCO-NH-(C1-С 6)алкокси, карбокси, карбокси(C1-С 6)алкилом, карбокси(C1-С 6)алкокси, бензилоксикарбонил(C1-С 6)алкокси, (C1-С 6)алкоксикарбонил(C1-С 6)алкокси, (С 6-С 10)арилом, амино, амино(C1-С 6)алкилом,(C1-С 6)алкоксикарбониламино, (С 6-С 10)арил(C1-С 6)алкоксикарбониламино, (C1-C6)алкиламино, C1C6)алкил)2 амино, (C1-С 6)алкиламино(C1-C6)алкилом, C1-С 6)алкил)2 амино(C1-С 6)алкилом, гидрокси, (С 1 С 6)алкокси, карбокси, карбокси(C1-С 6)алкилом, (C1-С 6)алкоксикарбонилом, (C1-С 6)алкоксикарбонил(C1 С 6)алкилом, (C1-С 6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-, циано, (С 5-С 9)гетероциклоалкилом, аминоCO-NH-, (C1-С 6)алкиламино-СО-NH-, C1-С 6)алкил)2 амино-CO-NH-, (С 6-С 10)ариламино-CO-NH-, (С 5 С 9)гетероариламино-CO-NH-, (C1-C6)алкиламино-CO-NH-(C1-С 6)алкилом, C1-С 6)алкил)2 амино-CO-NH(C1-С 6)алкилом,(С 6-С 10)ариламино-CO-NH-(C1-С 6)алкилом,(С 5-С 9)гетероариламино-CO-NH(C1 С 6)алкилом, (C1-С 6)алкилсульфонилом, (C1-С 6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(C1 С 6)алкилом, (С 6-С 10)арилсульфонилом, (С 6-С 10)арилсульфониламино, (С 6-С 10)арилсульфониламино(С 1 С 6)алкилом,(C1-С 6)алкилсульфониламино,(C1-С 6)алкилсульфониламино(C1-С 6)алкилом,(С 5 С 9)гетероарилом или (С 2-C9)гетероциклоалкилом; указанный способ включает стадии: а) смешения рацемической смеси энантиомерных соединений формулы где у, R4 и R5 определены выше, в растворителе с агентом разделения, имеющим определенную стереоспецифичность с образованием раствора, при этом указанный агент разделения, является способным к связыванию по меньшей мере с одним, но не со всеми указанными энантиомерами, с образованием осадка, содержащего по меньшей мере один из указанных энантиомеров;b) выдерживания смеси в течение периода времени, достаточного для достижения существенного осаждения стереоспецифического энантиомера рацемической смеси из раствора, и где другой из указанных энантиомеров остается в указанном растворе; с) в зависимости от стереоспецифичности желаемого соединения, либо сбор осадка и его очистку,либо сбор раствора с содержащимся в нем другим из указанных энантиомеров, и перекристаллизацию энантиомера, содержащегося в данном растворе;d) взаимодействие полученного таким образом желаемого стереоспецифического энантиомера с соединением формулы где R представляет собой водород или защитную группу и R2 и R3 являются такими, как определеноe) в случае необходимости удаление бензильной защитной группы R5, когда (С 3 С 9)гетероциклоалкил представляет собой азотсодержащую гетероциклоалкильную группу; иf) в случае необходимости взаимодействие азотсодержащей гетероциклоалкильной группы R5, полученной на стадии (е), с соединением формулы IIR6, R7, R8, R9, R10 и R11, каждый независимо, выбран из группы, состоящей из водорода или (C1 С 6)алкила, необязательно замещенного дейтерием, гидрокси, амино, трифторметилом, (C1-С 6)ацилокси,(C1-С 6)ациламино, (C1-С 6)алкиламино, С 1-С 6)алкил)2 амино, циано, циано(C1-С 6)алкилом, трифторметил(C1-С 6)алкилом, нитро, нитро(C1-C6)алкилом или (C1-C6)ациламино;R12 представляет собой карбокси, циано, амино, оксо, дейтерий, гидрокси, трифторметил, (C1 С 6)алкил, трифторметил(C1-С 6)алкил, (С 1-С 6)алкокси, галоген, (С 1-С 6)ацил, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, амино(C1-С 6)алкил, (C1-С 6)алкокси-CO-NH, (C1-С 6)алкиламино-СО-, (C2-С 6)алкенил,(С 2-С 6)алкинил,(C1-С 6)алкиламино,гидрокси(C1-С 6)алкил,(C1-С 6)алкокси(C1-С 6)алкил,(C1 С 6)ацилокси(C1-С 6)алкил, нитро, циано(C1-С 6)алкил, галоген(C1-С 6)алкил, нитро(C1-С 6)алкил, трифторметил, трифторметил(C1-С 6)алкил, (C1-С 6)ациламино, (C1-С 6)ациламино(C1-С 6)алкил, (C1-С 6)алкокси(C1C6)ациламино, амино(C1-C6)ацил, амино(C1-С 6)ацил(C1-С 6)алкил, (C1-С 6)алкиламино(C1-С 6)ацил, C1 С 6)алкил)2 амино(C1-С 6)ацил, R15R16N-CO-O-, R15R16N-CO-(C1-C6)алкил, R15C(O)NH, R15OC(O)NH,R15NHC(O)NH, (C1-C6)алкил-S(O)m, (C1-C6)алкил-S(O)m(C1-C6)алкил, R15R16NS(O)m, R15R16NS(O)m(C1C6)алкил, R15S(O)mR16N, R15S(O)mR16N(C1-C6)алкил, где m равно 0, 1 или 2 и R15 и R16, каждый независимо, выбран из водорода или (C1-С 6)алкила. 2. Способ по п.1, в котором указанный агент разделения выбирают из винной кислоты и ее производных и аденокислоты и ее производных. 3. Способ по п.2, в котором указанные производные винной кислоты включают толуоил- и бензоилвинные кислоты в стереоспецифической конформации. 4. Способ по п.3, в котором указанное производное винной кислоты представляет собой дипаратолуоил-L-винную кислоту. 5. Способ по п.2, в котором аденокислота включает (-)фенцифос. 6. Способ по п.1, в котором соединение на стадии а) представляет собой 7. Способ по п.1, в котором соединение преобразовывают в форму кислотно-аддитивной соли этого соединения перед указанной стадией разделения. 8. Способ по п.7, в котором указанная форма аддитивной соли представляет собой гидрохлоридную форму. 9. Способ по п.1, в котором температура, при которой осуществляют разделение и осаждение, представляет собой температуру окружающей среды, и время составляет около не более 4 ч. 10. Способ по п.8, в котором гидрохлоридную соль соединения образуют в растворителе, выбранном из группы, состоящей из метанола, этанола, изопропанола, ацетонитрила, тетрагидрофурана, воды,толуола, этилацетата, дихлорметана, дихлорэтана или их смесей. 11. Способ по п.10, в котором указанный растворитель включает этанол с незначительным количеством толуола в качестве сорастворителя. 12. Способ по п.1, в котором растворитель выбирают из группы, состоящей из этилацетата, толуола,- 19012666 ацетонитрила, гептана, воды и их смесей. 13. Способ по п.1, в котором добавляют затравочные кристаллы осажденного энантиомера, чтобы облегчить указанное осаждение. 14. Соединение формулы где R2 и R3, каждый независимо, выбран из группы, состоящей из водорода, дейтерия, амино, галогена, гидрокси, нитро, карбокси, (C2-С 6)алкенила, (C2-С 6)алкинила, трифторметила, трифторметокси, (C1 С 6)алкила, (C1-С 6)алкокси, (С 3-С 10)циклоалкила, где алкильная, алкокси или циклоалкильная группы необязательно замещены одной-тремя группами, выбранными из галогена, гидрокси, карбокси, амино(C1 С 6)алкилтио, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 5-С 9)гетероарила, (С 2-С 9)гетероциклоалкила,(С 3-С 9)циклоалкила или (С 6-С 10)арила; или R2 и R3, каждый независимо, представляют собой (С 3 С 10)циклоалкил, (С 3-С 10)циклоалкокси, (C1-С 6)алкиламино, C1-С 6)алкил)2 амино, (С 6-С 10)ариламино, (C1C6)алкилтио, (С 6-С 10)арилтио, (C1-С 6)алкилсульфинил, (С 6-С 10)арилсульфинил, (C1-С 6)алкилсульфонил,(С 6-С 10)арилсульфонил, (С 1-С 6)ацил, (C1-С 6)алкокси-СО-NH-, (C1-С 6)алкиламино-СО-, (С 5-С 9)гетероарил,(С 2-С 9)гетероциклоалкил или (С 6-С 10)арил, где гетероарильная, гетероциклоалкильная и арильная группы необязательно замещены одним-тремя галогеном, (C1-С 6)алкилом, (C1-С 6)алкил-CO-NH-, (C1-С 6)алкоксиCO-NH-, (C1-C6)алкил-CO-NH-(C1-C6)алкилом, (C1-С 6)алкокси-CO-NH-(C1-C6)алкилом, (C1-С 6)алкоксиCO-NH-(С 1-С 6)алкокси, карбокси, карбокси(C1-C6)алкилом, карбокси(C1-С 6)алкокси, бензилоксикарбонил(C1-С 6)алкокси, (C1-С 6)алкоксикарбонил(C1-С 6)алкокси, (С 6-С 10)арилом, амино, амино(C1-С 6)алкилом,(C1-С 6)алкоксикарбониламино, (С 6-С 10)арил(C1-С 6)алкоксикарбониламино, (C1-С 6)алкиламино, C1 С 6)алкил)2 амино, (C1-C6)алкиламино(C1-С 6)алкилом, C1-С 6)алкил)2 амино(C1-С 6)алкилом, гидрокси, (C1C6)алкокси, карбокси, карбокси(C1-С 6)алкилом, (C1-С 6)алкоксикарбонилом, (C1-С 6)алкоксикарбонил(C1 С 6)алкилом, (C1-С 6)алкокси-CO-NH-, (C1-C6)алкил-CO-NH-, циано, (С 5-С 9)гетероциклоалкилом, аминоCO-NH-, (C1-C6)алкиламино-СО-NH-, C1-С 6)алкил)2 амино-СО-NH-, (С 6-С 10)ариламино-CO-NH-, (С 5 С 9)гетероариламино-CO-NH-, (C1-С 6)алкиламино-CO-NH-(C1-С 6)алкилом, C1-С 6)алкил)2 амино-CO-NH(C1-С 6)алкилом,(С 6-С 10)ариламино-CO-NH-(C1-С 6)алкилом,(С 5-С 9)гетероариламино-CO-NH(C1C6)алкилом, (C1-С 6)алкилсульфонилом, (C1-С 6)алкилсульфониламино, (C1-С 6)алкилсульфониламино(C1 С 6)алкилом, (С 6-С 10)арилсульфонилом, (С 6-С 10)арилсульфониламино, (С 6-С 10)арилсульфониламино(C1 С 6)алкилом,(C1-С 6)алкилсульфониламино,(C1-С 6)алкилсульфониламино(С 1-С 6)алкилом,(С 5 С 9)гетероарилом или (С 2-С 9)гетероциклоалкилом. 15. Соединение по п.14, в котором R2 и R3 представляют собой водород. 16. Фармацевтическая композиция, ингибирующая протеинкиназу или киназу 3 Janus (JAK3) у млекопитающих, включая человека, предназначенная для лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы,язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний, включающая эффективное для таких нарушений или состояний количество 3-(3R,4R)-4-метил-3[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил-3-оксопропионитрила или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 17. Фармацевтическая композиция, включающая 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3d]пиримидин-4-ил)амино]пиперидинил-3-оксопропионитрил или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. 18. Способ ингибирования протеинкиназ или киназы 3 Janus (JAK3) у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества 3-(3R,4R)-4 метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил-3-оксопропионитрила или его фармацевтически приемлемой соли. 19. Способ лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного для лечения такого состояния- 20012666 количества 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил-3 оксопропионитрила или его фармацевтически приемлемой соли. 20. Способ ингибирования протеинкиназ или киназы 3 Janus (JAK3) у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного количества 3-(3R,4R)-4 метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил-3-оксопропионитрила или его фармацевтически приемлемой соли отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами. 21. Способ лечения или предотвращения заболевания или состояния, выбранного из отторжения органов при трансплантации, ксенотрансплантации, волчанки обыкновенной, рассеянного склероза, ревматоидного артрита, псориаза, диабета типа I и осложнений, связанных с диабетом, рака, астмы, атопического дерматита, аутоиммунных нарушений щитовидной железы, язвенных колитов, болезни Крона, болезни Альцгеймера, лейкемии и других аутоиммунных заболеваний у млекопитающего, включая человека, включающий введение указанному млекопитающему эффективного для лечения такого состояния количества 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидинил-3 оксопропионитрила или его фармацевтически приемлемой соли отдельно или в комбинации с одним или более дополнительными средствами, которые модулируют иммунную систему млекопитающего, или с противовоспалительными средствами. 22. Соединение формулы 25. Способ по п.1, где защитная группа для атома азота представляет собой бензильную группу.
МПК / Метки
МПК: A61P 37/06, C07D 487/04, A61K 31/505
Метки: протеинкиназы, качестве, ингибиторов, оптическое, получения, 1-бензил-4-метилпиперидин-3-ил)метиламина, производных, применение, пирроло, 2,3-пиримидина, разделение
Код ссылки
<a href="https://eas.patents.su/22-12666-opticheskoe-razdelenie-1-benzil-4-metilpiperidin-3-ilmetilamina-i-ego-primenenie-dlya-polucheniya-proizvodnyh-pirrolo-23-pirimidina-v-kachestve-ingibitorov-proteinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Оптическое разделение (1-бензил-4-метилпиперидин-3-ил)метиламина и его применение для получения производных пирроло 2,3-пиримидина в качестве ингибиторов протеинкиназы</a>
Предыдущий патент: Синергическая гербицидная смесь, гербицидная композиция, способ ее получения и способ борьбы с нежелательной растительностью
Следующий патент: Анилиды пиразолкарбоновой кислоты и содержащее их средство для борьбы с патогенными грибами
Случайный патент: Защищенное суперраспределение пользовательских данных.