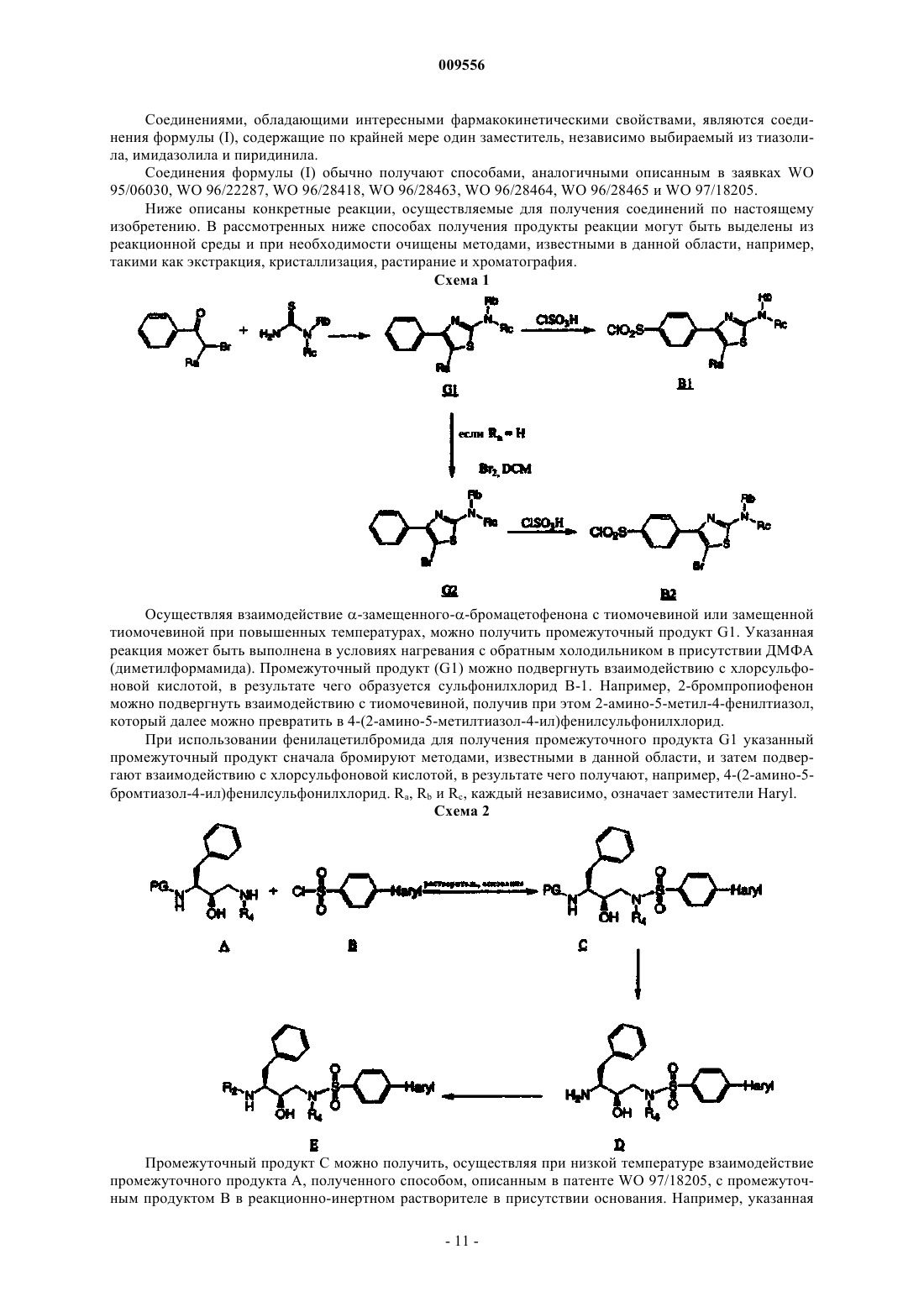
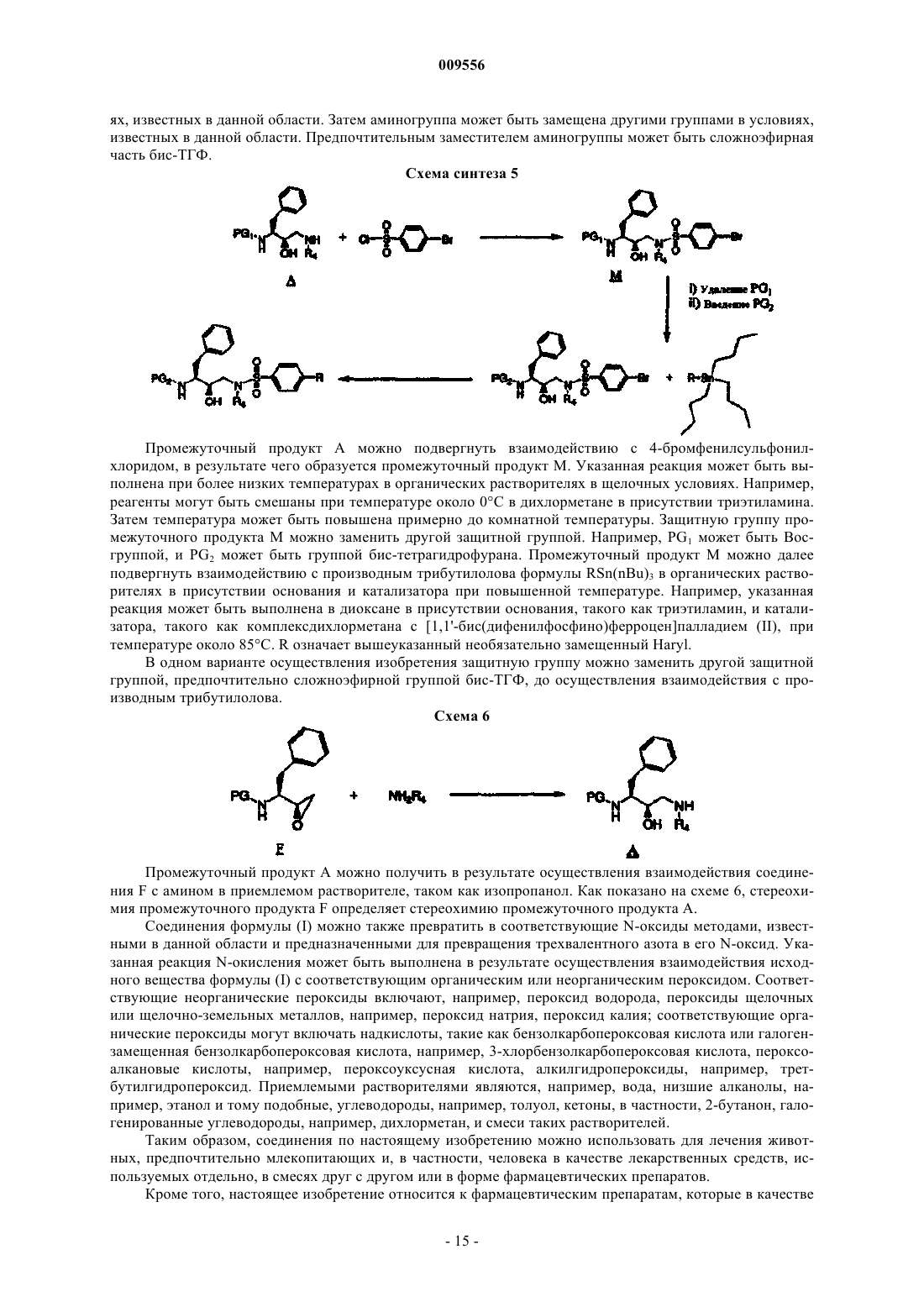
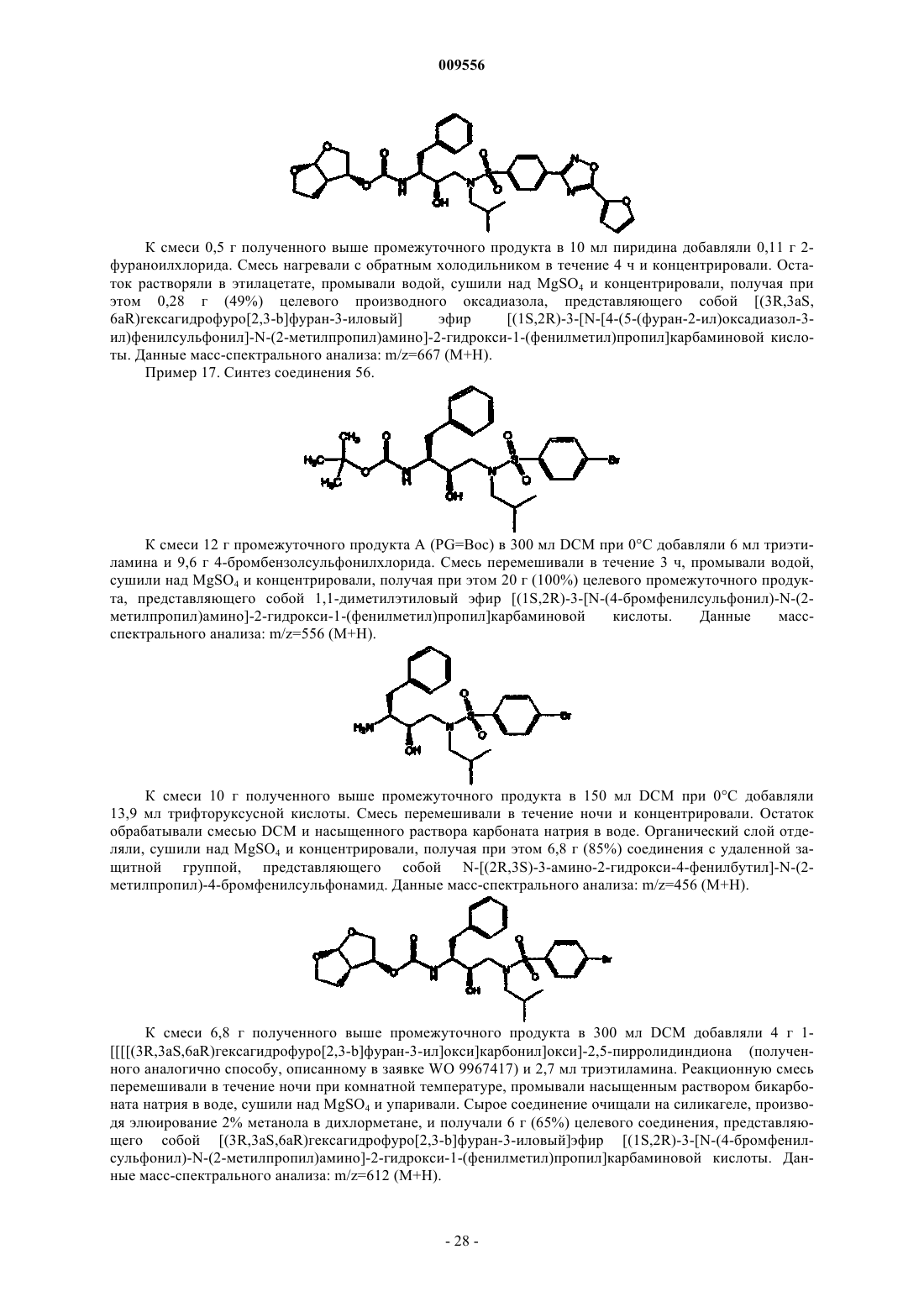
Гетероциклические замещённые фенилсодержащие сульфонамиды широкого спектра действия в качестве ингибиторов протеазы вич
Номер патента: 9556
Опубликовано: 28.02.2008
Авторы: Тахри Абделлах, Вендевилль Сандрин Мари Элен, Морс Самуел Лео Кристиан, Версхуэрен Вим Гастон, Эрра Сола Монтсеррат
Формула / Реферат
1. Соединение формулы
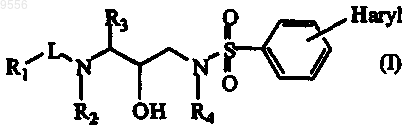
его N-оксид, соль, стереоизомерная форма, рацемическая смесь или сложный эфир, где
R1 и R8 независимо означают водород, C1-6алкил, С2-6алкенил, арилC1-6алкил, C3-7циклоалкил,
C3-7циклоалкилC1-6алкил, арил, Het1, Het1C1-6алкил, Het2, Het2C1-6алкил;
R1 может быть также радикалом формулы
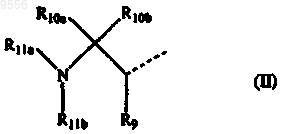
где R9, R10a и R10b, каждый независимо, означают водород, С1-4алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4алкил)аминокарбонил, C3-7циклоалкил, С2-6алкенил, С2-6алкинил или С1-4алкил, необязательно замещенный арилом, Het1, Het2, C3-7циклоалкилом, С1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди(C1-4алкил)аминокарбонилом, аминосульфонилом, С1-4алкилS(О)t, гидрокси, циано, галогеном или аминогруппой, необязательно моно- или дизамещенной, заместителями, выбранными из группы, включающей С1-4алкил, арил, арилС1-4алкил, C3-7циклоалкил,
C3-7циклоалкилС1-4алкил, Het1, Het2, Het1C1-4алкил и Het2C1-4алкил; кроме того, R9 и R10a вместе с атомами углерода, к которым они присоединены, могут образовывать C3-7циклоалкильный радикал;
R11a означает водород, С2-6алкенил, С2-6алкинил, C3-7циклоалкил, арил, аминокарбонил, необязательно моно- или дизамещенный, аминоC1-4алкилкарбонилокси, необязательно моно- или дизамещенный, C1-4алкилоксикарбонил, арилоксикарбонил, Het1оксикарбонил, Het2оксикарбонил, арилоксикарбонилС1-4алкил, арилС1-4алкилоксикарбонил, C1-4алкилкарбонил, C3-7циклоалкилкарбонил, C3-7циклоалкилС1-4алкилоксикарбонил, С3-7циклоалкилкарбонилокси, карбоксилC1-4алкилкарбонилокси, С1-4алкилкарбонилокси, арилC1-4алкилкарбонилокси, арилкарбонилокси, арилоксикарбонилокси, Het1карбонил, Het1карбонилокси, Het1C1-4алкилоксикарбонил, Het2карбонилокси, Het2C1-4алкилкарбонилокси, Het2C1-4алкилоксикарбонилокси или C1-4алкил, необязательно замещенный арилом, арилокси, Het2 или гидрокси; причем заместители аминогрупп независимо выбирают из группы, включающей C1-4алкил, арил,
арилC1-4алкил, C3-7циклоалкил, С3-7циклоалкилC1-4алкил, Het1, Het2, Het1C1-4алкил и Het2C1-4алкил;
R11b означает водород, C3-7циклоалкил, С2-6алкенил, С2-6алкинил, арил, Het1, Het2 или C1-4алкил, необязательно замещенный галогеном, гидрокси, C1-4алкилS(=O)t, арилом, C3-7циклоалкилом, Het1, Het2, аминогруппой, необязательно моно- или дизамещенной, заместители которой выбирают из группы, включающей C1-4алкил, арил, арилС1-4алкил, C3-7циклоалкил, С3-7циклоалкилС1-4алкил, Het1, Het2,
Het1C1-4алкил и Het2C1-4алкил; кроме того, R11b может быть присоединен к остальной части молекулы при помощи сульфонильной группы;
R2 означает водород или С1-6алкил;
L означает -С(=O)-, -O-С(=O)-, -NR8-C(=O)-, -O-С1-6алкандиил-С(=O)-, -NR8-С1-6алкандиил-С(=O)-,
-S(=O)2-, -O-S(=O)2-, -NR8-S(=O)2, причем группа С(=O) или группа S(=O)2 присоединена к части NR2;
R3 означает C1-6алкил, арил, C3-7циклоалкил, C3-7циклоалкилС1-4алкил или арилС1-4алкил;
R4 означает водород, C1-4алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, C3-7циклоалкил, С2-6алкенил, С2-6алкинил или C1-6алкил, кроме того, C3-7циклоалкил,
С2-6алкенил, С2-6алкинил и C1-6алкил могут быть необязательно замещены заместителем, выбираемым из группы, включающей арил, Het1, Het2, C3-7циклоалкил, C1-4алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, необязательно моно- или дизамещенный аминосульфонил,
C1-4алкилS(=O)t, гидрокси, циано, необязательно моно- или дизамещенную аминогруппу и галоген, причем необязательные заместители любой функциональной аминогруппы независимо выбирают из группы, включающей C1-4алкил, арил, арилC1-4алкил, С3-7циклоалкил, C3-7циклоалкилС1-4алкил, Het1, Het2,
Het1C1-4алкил и Het2C1-4алкил;
t равно 0, 1 или 2;
все t независимо выбирают из 0, 1 или 2;
Haryl означает ароматический моноциклический, бициклический или трициклический гетероцикл, который имеет 3-14 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода и серы, и может быть необязательно замещен (i) в положении одного или нескольких атомов углерода группой, включающей C1-6алкил, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано, галогенС1-6алкил, карбоксил, C3-7циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил, арил, -(R7a)n-M-R7b, Het1 и Het2, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) в положении атома азота, если он присутствует, гидроксилом или -A-R6;
А означает C1-6алкандиил, -С(=O)-, -C(=S)-, -S(=O)2-, C1-6алкандиил-С(=O)-, C1-6алкандиил-С(=S)- или С1-6алкандиил-S(=O)2-, причем в группах, содержащих C1-6алкандиильную часть, C1-6алкандиильная часть присоединена к аминогруппе;
R5 означает гидрокси, C1-6алкил, Het1С1-6алкил, Het2С1-6алкил, аминоC1-6алкил, причем аминогруппа может быть необязательно моно- или дизамещена С1-4алкилом;
R6 означает водород, C1-6алкилокси, Het1, Het1окси, Het2, Het2окси, арил, арилокси или амино; и, если -А- не является C1-6алкандиилом, R6 может быть также C1-6алкилом, Het1C1-4алкилом, Het1оксиC1-4алкилом, Het2C1-4алкилом, Het2оксиC1-4алкилом, арилC1-4алкилом, арилоксиC1-4алкилом или аминоC1-4алкилом, причем все аминогруппы в определении R6 могут быть необязательно замещены одним или двумя заместителями, выбираемыми из группы, включающей C1-4алкил, C1-4алкилкарбонил, C1-4алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1, Het2, арилC1-4алкил, Het1C1-4алкил или
Het2C1-4алкил;
R7a означает С1-8алкандиил, необязательэю замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, C1-4алкилкарбонил, C1-4алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2;
R7b означает C1-8алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, C1-4алкилкарбонил, C1-4алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2;
М означает -С(=O)-, -O-С(=O)-, -С(=O)-O-, -СН2-СНОН-, -СНОН-СН2-, -NR8-C(=O)-, -(C=O)-NR8-,
-S(=O)2-, -O-, -S-, -O-S(=O)2-, -S(=O)2-O-, -NR8-S(=O)2 или -S(=O)2-NR8-;
n равно 0 или 1;
причем Het1 в значении группы или части группы означает насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 3-14 членов в кольце, более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-8 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода группой, включающей C1-6алкил, C1-6алкилокси, галоген, гидрокси, оксо, необязательно моно- или дизамещенную аминогруппу, нитро, циано, гидроксиC1-6алкил, галогенC1-6алкил, карбоксил, C1-6алкоксикарбонил,
С3-7циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил, арил и насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет 3-14 членов в кольце и содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6алкил,
C1-6алкилокси-А-, Het2-A-, Het2C1-6алкил, Het2C1-6алкил-А-, Het2окси-A-, Het2оксиC1-4алкил-А-, арил-А-, арилокси-А-, арилоксиC1-4алкил-А-, арилC1-6алкил-А-, С1-6алкилоксикарбониламино-А-, амино-А-, аминоC1-6алкил и аминоС1-6алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены С1-4алкилом; и
Het2 в значении группы или части группы означает ароматический моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 3-14 членов в кольце, более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-6 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода группой, включающей C1-6алкил, С1-6алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано, гидроксиC1-6алкил, галогенC1-6алкил, карбоксил, С1-6алкоксикарбонил, C3-7циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил, арил, Het1 и ароматический моноциклический, бициклический или трициклический гетероцикл, имеющий 3-14 членов в кольце; кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей С1-6алкил, C1-6алкилокси-А-, Het1-A-, Het1C1-6алкил, Het1C1-6алкил-А-, Het1окси-А-, Het1оксиC1-4алкил-А-, арил-А-, арилокси-А-, арилоксиC1-4алкил-А-, арилC1-6алкил-А-, C1-6алкилоксикарбониламино-А-, амино-А-, аминоC1-6алкил и аминоC1-6алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены C1-4алкилом.
2. Соединение по п.1, в котором заместитель Haryl является ароматическим моно- или бициклическим гетероциклом, имеющим 3-8 членов в кольце и содержащим в кольце один или несколько гетероатомов, выбираемых из N, О или S, при этом (i) Haryl может быть необязательно замещен в положении одного или нескольких атомов углерода галогеном, необязательно моно- или дизамещенной аминогруппой, нитро, циано, C3-7циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, -(R7a)n-M-R7b, Het1 и Het2, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) Haryl может быть необязательно замещен в положении атома азота гидроксилом или -A-R6.
3. Соединение по любому из пп.1 или 2, в котором Haryl выбирают из группы, включающей тиазолил, имидазолил, оксазолил, оксадиазолил, пиразолил, пиразинил, имидазолинонил, хинолинил, изохинолинил, индолил, пиридазинил, пиридинил, пирролил, пиранил, пиримидинил, фуранил, триазолил, тетразолил, бензофуранил, бензоксазолил, изоксазолил, изотиазолил, тиадиазолил, тиофенил, тетрагидрофурофуранил, тетрагидропиранофуранил, бензотиофенил, карбазолил, имидазолонил, оксазолонил, индолизинил, триазинил или хиноксалинил, при этом (i) Haryl может быть необязательно замещен в положении одного или нескольких атомом углерода группой, включающей галоген, необязательно моно- или дизамещенную аминогруппу, нитро, циано, C3-7циклоалкил, необязательно моно- или дизамещенный аминокарбонил, -(R7a)n-M-R7b, Het1 и Het2, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) Haryl может быть необязательно замещен в положении атома азота гидроксилом или -A-R6-.
4. Соединение по любому из пп.1 или 3, в котором R1 означает водород, C1-6алкил, С2-6алкенил, арилC1-6алкил, С3-7циклоалкил, С3-7циклоалкилС1-6алкил, арил, Het1, Het1C1-6алкил, Het2, Het2C1-6алкил, где Het1 является насыщенным или частично ненасыщенным моноциклическим гетероциклом, имеющим 5 или 6 членов в кольце.
5. Соединение по любому из пп.1-4, в котором R1-L- означает Het1-O-C(=O)-.
6. Соединение по любому из пп.1-4, в котором R1-L- означает Het2-О-C1-6алкандиил-С(=O)-, арил-О-C1-6алкандиил-С(=O)- или арил-С(=O)-.
7. Соединение по любому из пп.1-4, в котором R1 означает Het2 или Het2C1-6алкил, где указанный Het2 содержит по крайней мере один гетероатом, независимо выбираемый из азота, кислорода и серы, и L означает -С(=O)-, -O-С(=O)- или O-C1-6алкил-С(=O)-.
8. Соединение по любому из пп.1-4, в котором R1 означает Het2 или Het2C1-6алкил, где указанный Het2 содержит по крайней мере два гетероатома, независимо выбираемых из азота, кислорода и серы, и L означает -С(=O)-, -O-С(=O)- или O-С1-6алкил-С(=O)-.
9. Соединение по любому из пп.1-4, в котором R1 означает 2-тиазолилметил- и L означает -O-С(=O)-.
10. Соединение по любому из пп.1-4, в котором R1 означает Het1 или Het1C1-6алкил, где указанный Het1 содержит по крайней мере один гетероатом, независимо выбираемый из азота, кислорода и серы, и L означает -С(=O)-, -O-С(=O)- или О-C1-6алкил-С(=O)-.
11. Соединение по любому из пп.1-10, которое обладает множественной устойчивостью в диапазоне от 0,01 до 100 против видов ВИЧ, имеющих по крайней мере одну мутацию в протеазе ВИЧ в положении, выбираемом из 10, 71 и 84, по сравнению с последовательностью дикого типа.
12. Соединение, выбираемое из соединений, имеющих общие формулы
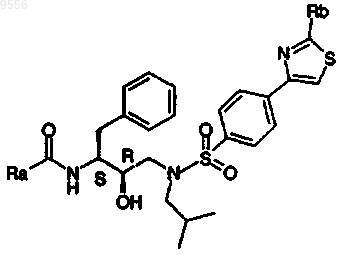
где
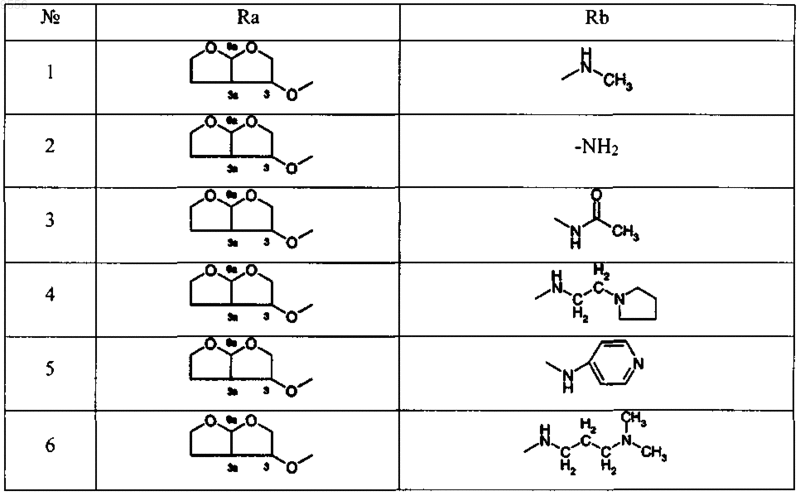

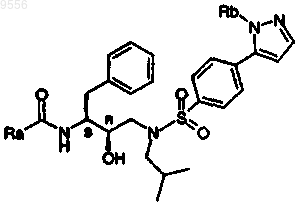
где

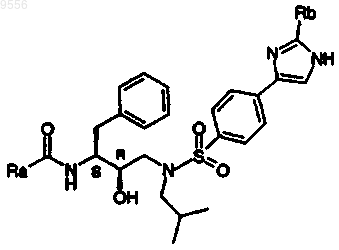
где
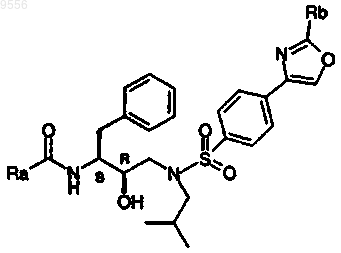
где

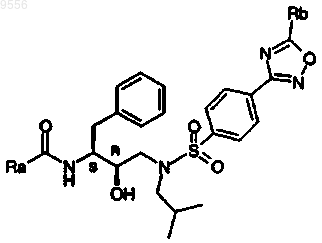
где
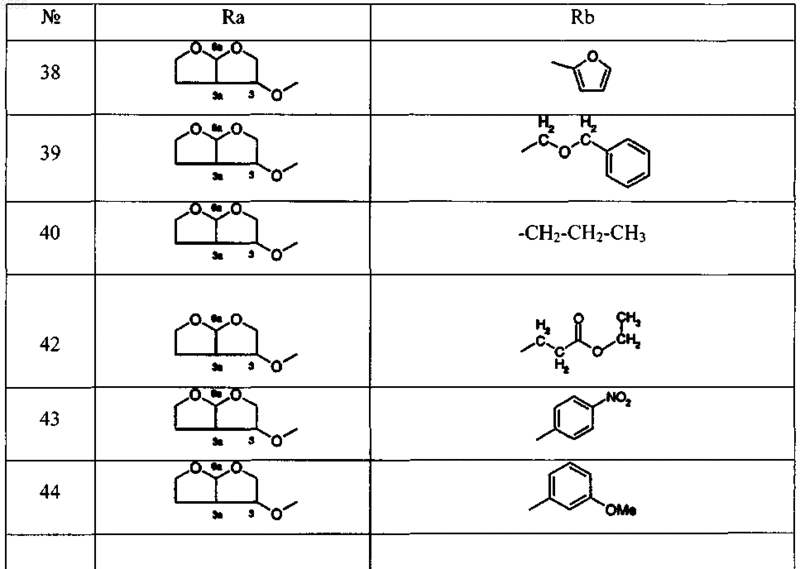
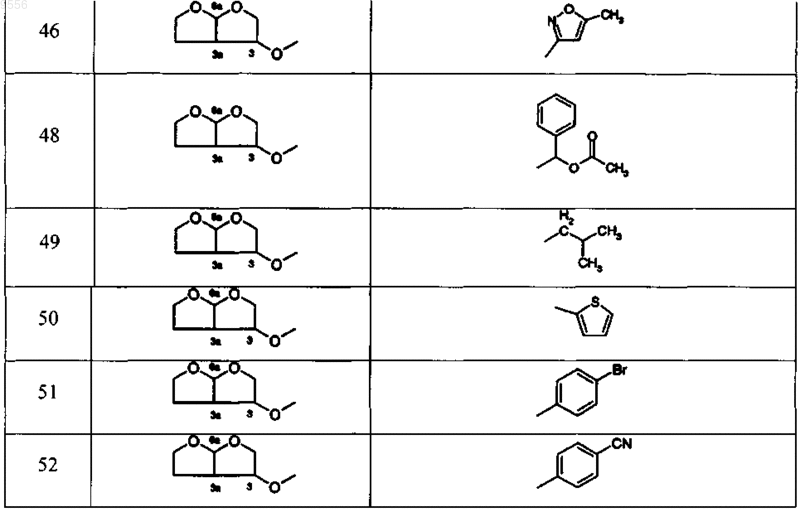

где
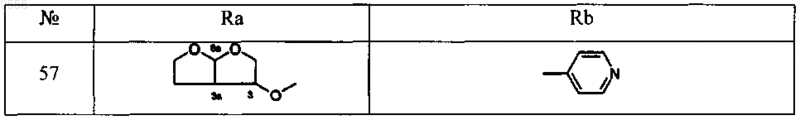
13. Фармацевтическая композиция, содержащая эффективное количество по крайней мере одного соединения по любому из пп.1-12, и фармацевтически толерантный наполнитель.
14. Фармацевтическая композиция, содержащая эффективное количество по крайней мере одного соединения по любому из пп.1-12 и модулятор метаболизма указанного соединения.
15. Применение соединения по любому из пп.1-12 в качестве лекарственного средства.
16. Способ ингибирования протеазы ретровируса у млекопитающего, инфицированного указанным ретровирусом, который включает введение указанному млекопитающему ингибирующего протеазу количества соединения по любому из пп.1-12.
17. Способ лечения, профилактики или борьбы с инфекцией или заболеванием, вызванным ретровирусной инфекцией у млекопитающего, который включает введение указанному млекопитающему эффективного количества по крайней мере одного соединения по любому из пп.1-12.
18. Способ лечения, профилактики или борьбы с инфекцией или заболеванием, вызванным ретровирусной инфекцией у млекопитающего, который включает введение эффективного количества по крайней мере одного первого соединения по любому из пп.1-12, последующее введение по крайней мере одного второго соединения, модулирующего метаболизм указанного первого соединения, причем указанное второе соединение можно вводить одновременно, отдельно или последовательно с указанным первым соединением.
19. Способ ингибирования репликации ретровируса, который включает осуществление контактирования ретровируса с эффективным количеством по крайней мере одного соединения по любому из пп.1-12.
20. Способ по любому из пп.16-19, в котором ретровирус является вирусом иммунодефицита человека (ВИЧ).
21. Фармацевтическая композиция, которая представляет собой твердую дисперсию, содержащую (а) соединение по любому из пп.1-12, (b) один или несколько фармацевтически приемлемых водорастворимых полимеров.
22. Продукт, содержащий по крайней мере одно соединение формулы (I) по любому из пп.1-12 и антиретровирусное средство в виде комбинированного препарата для одновременного, раздельного или последовательного применения в антиретровирусной терапии.
Текст
009556 Настоящее изобретение относится к гетероциклическим замещенным фенилсодержащим сульфонамидам, их применению в качестве ингибиторов аспарагиновой протеазы, в частности, ингибиторов протеазы ВИЧ широкого спектра действия, способам получения указанных веществ, а также к фармацевтическим композициям и диагностическим наборам, содержащим указанные вещества. Настоящее изобретение относится также к комбинациям замещенных фенилсодержащих сульфонамидов по данному изобретению с другими антиретровирусными средствами. Настоящее изобретение далее относится к применению указанных веществ в качестве эталонов или реагентов при выполнении анализов. Вирус, вызывающий синдром приобретенного иммунодефицита (СПИД), известен под разными названиями, включающими вирус человеческого Т-клеточного лейкоза III (HTLV-III), лимфаденопатический вирус (LAV), СПИД-ассоциированный вирус или вирус иммунодефицита человека (ВИЧ). Идентифицированы разные семейства указанного вируса, такие как ВИЧ-1 и ВИЧ-2. Далее в описании изобретения будет использовано название ВИЧ для общего обозначения указанных вирусов. Одним из важных путей жизненного цикла ретровируса является процессинг предшественников липопротеина аспарагиновой протеазой. Например, в случае вируса ВИЧ протеаза данного вируса процессирует белок gag-pol. Правильный процессинг предшественников полипротеинов аспарагиновой протеазой необходим для сборки инфекционных вирионов, что делает аспарагиновую протеазу привлекательной мишенью для антивирусной терапии. В частности, протеаза ВИЧ является привлекательной мишенью для лечения ВИЧ-инфекции. Ингибиторы протеазы ВИЧ (PI) обычно вводят больным СПИДом в сочетании с другими лекарственными средстами, воздействующими на ВИЧ-инфекцию, такими как, например, ингибиторы обратной транскриптазы нуклеозидов (NRTI), ингибиторы обратной транскриптазы ненуклеозидов (NNRTI), ингибиторы обратной транскриптазы нуклеотидов (NtRTI) или другие ингибиторы протеазы. Несмотря на то что указанные антиретровирусные средства являются весьма полезными, все они характеризуются общим недостатком, выражающимся в том, что ферменты-мишени в вирусе ВИЧ могут мутировать, в результате чего известные лекарственные средства становятся менее эффективными или даже совсем неэффективными в отношении указанных мутантных вирусов ВИЧ. Другими словами, у вируса ВИЧ постоянно возникает устойчивость к существующим лекарственным средствам. Устойчивость ретровирусов и, в частности, вируса ВИЧ к ингибиторам является главной причиной неэффективности лечения. Например, половина субъектов, проходящих курс комбинированной терапии против ВИЧ-инфекции, не реагируют в полной мере на такое лечение главным образом из-за устойчивости данного вируса к одному или нескольким используемым лекарственным средствам. Кроме того, установлено, что устойчивый вирус передается вновь инфицированным субъектам, существенно ограничивая возможности лечения таких субъектов, так как они не реагируют на лекарственные средства, используемые для лечения ВИЧ-инфекции. Поэтому в данной области существует потребность в новых соединениях для лечения ретровирусной инфекции, в частности для лечения СПИДа. Особенно необходимы соединения, которые активно воздействуют не только на вирус ВИЧ дикого типа, но и на все более устойчивые вирусы ВИЧ. Известные антиретровирусные средства, часто применяемые в схеме комбинированного лечения, в конечном счете вызывают указанную выше лекарственную устойчивость. Подобное явление часто заставляет лечащего врача увеличивать уровни активных лекарственных средств в плазме с тем, чтобы восстановить эффективность указанных антиретровирусных средств против мутированных вирусов ВИЧ. Последствием таких действий является весьма нежелательное увеличение лекарственной нагрузки. Повышение уровней лекарственных средств в плазме может также стать причиной несоблюдения режима приема предписываемых лекарственных средств. Таким образом, важно иметь соединения, активно воздействующие на целый ряд мутантов ВИЧ, при этом не менее важно, чтобы такие соединения одинаково или почти одинаково воздействовали как на мутантный вирус ВИЧ, так и на вирус ВИЧ дикого типа(определяется также как множественная устойчивость или FR) в широком диапазоне мутантных штаммов вируса ВИЧ. Благодаря этому нуждающийся в лечении субъект сможет не менять схему комбинированного лечения в течение более продолжительного периода времени, так как вполне вероятно, что мутантный вирус ВИЧ будет более восприимчив к воздействию активных ингредиентов на протяжении всего курса лечения. Кроме того, получение соединений, эффективно воздействующих как на вирус дикого типа, так и на целый ряд мутантов, имеет важное значение потому, что позволяет снизить лекарственную нагрузку благодаря максимальному уменьшению доз вводимых лекарственных средств. Одним способом снижения лекарственной нагрузки является создание соединений против ВИЧ, обладающих хорошей биологической доступностью, т.е. благоприятным фармакокинетическим и метаболическим профилем, благодаря чему можно сократить до минимума суточную дозу, а затем и количество принимаемых таблеток. Другой важной отличительной особенностью хорошего соединения против ВИЧ является то, что связывание ингибитора белком плазмы оказывает минимальное воздействие или вообще не влияет на эффективность действия такого лекарственного средства. Таким образом, в медицине существует большая потребность в ингибиторах протеазы, которые способны воздействовать на широкий спектр мутантов вируса ВИЧ при возникновении незначительной-1 009556 лекарственной устойчивости, обладают хорошей биологической доступностью и, по существу, не утрачивают или полностью сохраняют свою активность при связывании белком плазмы. Кроме того, всегда необходимы соединения с улучшенным терапевтическим индексом. В настоящее время известны лишь несколько ингибиторов протеазы, которые поступают на рынок сбыта или находятся на стадии разработки. Одна конкретная структура ядра (приведена ниже) была рассмотрена в ряде ссылок, таких как заявки WO 95/06030, WO 96/22287, WO 96/28418, WO 96/28463, WO 96/28464, WO 96/28465 и WO 97/18205. Соединения, описанные в указанных заявках, представлены как ингибиторы протеазы ретровируса. В заявке WO 99/67254 описаны 4-замещенные-фенилсульфонамиды, способные ингибировать протеазы ретровирусов с множественной лекарственной устойчивостью. В патенте Японии 9124630 и заявке WO 96/33184 также описаны замещенные фенилсульфонамиды в качестве ингибиторов протеазы ВИЧ. Установлено, что гетероциклические замещенные фенилсодержащие сульфонамиды по настоящему изобретению обладают благоприятным фармакологическим и фармакокинетическим профилем. Указанные соединения не только активно воздействуют на вирус ВИЧ дикого типа, но обладают широким спектром действия против разных мутантных вирусов ВИЧ, характеризующихся устойчивостью к известным ингибиторам протеазы. Настоящее изобретение относится к гетероциклическим замещенным фенилсодержащим ингибиторам протеазы ВИЧ, имеющим формулу их N-оксиду, соли, стереоизомерной форме, рацемической смеси или сложному эфиру, гдеR1 может быть также радикалом формулы где R9, R10a и R10b, каждый независимо, означают водород, C1-4 алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4 алкил)аминокарбонил, C3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или C1-4 алкил,необязательно замещенный группой, включающей арил, Het1, Het2, C3-7 циклоалкил, C1-4 алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4 алкил)аминокарбонил, аминосульфонил,C1-4 алкилS(О)t, гидрокси, циано, галоген или аминогруппу, необязательно моно- или дизамещенную, заместители которой выбирают из группы, включающей C1-4 алкил, арил, арилC1-4 алкил, C3-7 циклоалкил,C3-7 циклоалкилC1-4 алкил, Het1, Het2, Het1C1-4 алкил и Het2C1-4 алкил; кроме того, R9 и R10a вместе с атомами углерода, к которым они присоединены, могут образовывать C3-7 циклоалкильный радикал;R11b означает водород, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, арил, Het1, Het2 или С 1-4 алкил, необязательно замещенный галогеном, гидрокси, C1-4 алкилS(=O)t, арилом, C3-7 циклоалкилом, Het1, Het2,аминогруппой, необязательно моно- или дизамещенной, заместители которой выбирают из группы,включающей C1-4 алкил, арил, арилC1-4 алкил, С 3-7 циклоалкил, C3-7 циклоалкилC1-4 алкил, Het1, Het2,Het1C1-4 алкил и Het2C1-4 алкил; кроме того, R11b может быть присоединен к остальной части молекулы при помощи сульфонильной группы;R2 означает водород или C1-6 алкил;R3 означает C1-6 алкил, арил, С 3-7 циклоалкил, C3-7 циклоалкилС 1-4 алкил или арилС 1-4 алкил;R4 означает водород, С 1-4 алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или C1-6 алкил, кроме того, C3-7 циклоалкил,С 2-6 алкенил, С 2-6 алкинил и C1-6 алкил могут быть необязательно замещены заместителем, выбираемым из группы, включающей арил, Het1, Het2, C3-7 циклоалкил, С 1-4 алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, необязательно моно- или дизамещенный аминосульфонил,С 1-4 алкилS(=O)t, гидрокси, циано, необязательно моно- или дизамещенную аминогруппу и галоген, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей С 1-4 алкил, арил, арилС 1-4 алкил, C3-7 циклоалкил, C3-7 циклоалкилС 1-4 алкил,Het1, Het2, Het1C1-4 алкил и Het2C1-4 алкил;t равно 0, 1 или 2; все t независимо выбирают из 0, 1 или 2;Haryl означает ароматический моноциклический, бициклический или трициклический гетероцикл,который имеет 3-14 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода и серы, и может быть необязательно замещен (i) в положении одного или нескольких атомов углерода группой, включающей С 1-6 алкил, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано, галогенC1-6 алкил, карбоксил, C3-7 циклоалкил, необязательно моноили дизамещенный аминокарбонил, метилтио, метилсульфонил, арил, -(R7a)n-M-R7b, Het1 и Het2, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) в положении атома азота, если он присутствует, гидроксилом или -A-R6; А означает C1-6 алкандиил, -С(=O)-, -C(=S)-, -S(=O)2-, C1-6 алкандиил-С(=O)-, C1-6 алкандиил-С(=S)или С 1-6 алкандиил-S(=O)2-, причем в группах, содержащих С 1-6 алкандиильную часть, указанная часть присоединена к аминогруппе;R5 означает гидрокси, C1-6 алкил, HetC1-6 алкил, Het2C1-6 алкил, аминоC1-6 алкил, причем аминогруппа может быть необязательно моно- или дизамещена C1-4 алкилом;R6 означает водород, C1-6 алкилокси, Het1, Het1 окси, Het2, Het2 окси, арил, арилокси или амино; и, если -А- не является C1-6 алкандиилом, R6 может быть также C1-6 алкилом, Het1C1-4 алкилом,Het1 оксиC1-4 алкилом, Het2C1-4 алкилом, Het2 оксиC1-4 алкилом, арилC1-4 алкилом, арилоксиC1-4 алкилом или аминоС 1-4 алкилом, причем все аминогруппы в определении R6 могут быть необязательно замещены одним или двумя заместителями, выбираемыми из группы, включающей C1-4 алкил, C1-4 алкилкарбонил,C1-4 алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1, Het2, арилС 1-4 алкил, Het1C1-4 алкил или Het2C1-4 алкил;R7a означает C1-8 алкандиил, необязательно замещенный одним или несколькими заместителями,выбираемыми из группы, включающей галоген, C1-4 алкилкарбонил, C1-4 алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2;R7b означает C1-8 алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, C1-4 алкилкарбонил, C1-4 алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2; М означает -С(=O)-, -O-С(=O)-, -С(=O)-O-, -СН 2-СНОН-, -СНОН-CH2-, -NR8-C(=O)-, -(C=O)-NR8-,-S(=O)2-, -O-, -S-, -O-S(=O)2-, -S(=O)2-O-, -NR8-S(=O)2 или -S(=O)2-NR8-;n равно 0 или 1. Настоящее изобретение относится также к кватернизации атомов азота в соединениях по данному изобретению. Основный азот может быть кватернизован любыми веществами, известными специалистам в данной области, включающими, например, низшие алкилгалогениды, диалкилсульфаты, галогениды с длинной цепью и аралкилгалогениды.-3 009556 Термин "замещенный" применительно к соединениям формулы (I) означает, что один или несколько атомов водорода, находящихся в положении атома, определяемого термином "замещенный", заменены одной из указанных групп при условии, что не превышена нормальная валентность указанного атома и в результате замещения образуется химически устойчивое соединение, т.е. соединение, которое не разрушается при выделении из реакционной смеси с достаточной степенью чистоты и в процессе приготовления лекарственного средства. Термин "галоген" в значении группы или части группы означает фтор, хлор, бром или йод. Термин "С 1-4 алкил" в значении группы или части группы означает насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например,метил, этил, пропил, бутил, 2-метилпропил и тому подобные. Термин "С 1-6 алкил" в значении группы или части группы означает насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 6 атомов углерода, в частности, группы,определяемые как C1-4 алкил и пентил, гексил, 2-метилбутил, 3-метилпентил и тому подобные. Термин "C1-8 алкил" в значении группы или части группы означает насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 8 атомов углерода, в частности, группы,определяемые как С 1-6 алкил и гептил, октил, 2-метилгептил, 3-этилгексил и тому подобные. Термин "C1-6 алкандиил" в значении группы или части группы означает двухвалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как, например, метилен, этан-1,2-диил, пропан-1,3-диил, пропан-1,2-диил, бутан-1,4-диил, пентан 1,5-диил, гексан-1,6-диил, 2-метилбутан-1,4-диил, 3-метилпентан-1,5-диил и тому подобные. Термин "С 1-8 алкандиил" в значении группы или части группы означает двухвалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащие от 1 до 8 атомов углерода, в частности, группы, определяемые как C1-6 алкандиил и 2-этилгексан-1,6-диил, 3-метилгептан-1,7-диил и тому подобные. Термин "С 2-6 алкенил" в значении группы или части группы означает углеводородные радикалы с прямой и разветвленной цепью, содержащие от 2 до 6 атомов углерода и имеющие по крайней мере одну двойную связь, например, такие как этенил, пропенил, бутенил, пентенил, гексенил и тому подобные. Термин "С 2-6 алкинил" в значении группы или части группы означает углеводородные радикалы с прямой и разветвленной цепью, содержащие от 2 до 6 атомов углерода и имеющие по крайней мере одну тройную связь, например, такие как этинил, пропинил, бутинил, пентинил, гексинил и тому подобные. Термин "С 3-7 циклоалкил" в значении группы или части группы означает циклопропил, циклобутил,циклопентил, циклогексил или циклогептил. Термин "арил" в значении группы или части группы означает моно-, би- и трициклические ароматические углеродные циклы, такие как фенил и нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, независимо выбираемыми из группы, включающей С 1-6 алкил,C1-6 алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано,гидроксиC1-6 алкил, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил, C3-7 циклоалкил, Het1, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил и фенил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей C1-6 алкил,C1-6 алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано,галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил, C3-7 циклоалкил, Het1, необязательно моно- или дизамещенный аминокарбонил, метилтио и метилсульфонил; кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6 алкил,C1-6 алкилокси-А-, Het1-A-, Het1C1-6 алкил, Het1C1-6 алкил-А-, Het1 окси-А-, Het1 оксиC1-4 алкил-A-, фенил-А-,фенилокси-А-, фенилоксиC1-4 алкил-А-, фенилС 1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-,аминоC1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены C1-4 алкилом, и А имеет указанные выше значения. Интересная подгруппа "арила" в значении группы или части группы включает моно-, би- и трициклические ароматические углеродные циклы, такие как фенил и нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, независимо выбираемыми из группы, включающей C1-6 алкил,C1-6 алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано,галогенС 1-6 алкил, карбоксил, C1-6 алкоксикарбонил, С 3-7 циклоалкил, Het1, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил и фенил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей С 1-6 алкил, C1-6 алкилокси, галоген,гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил, C3-7 циклоалкил, Het1, необязательно моно- или дизамещенный аминокарбонил, метилтио и метилсульфонил; кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6 алкил, C1-6 алкилокси-А-,Het1-A-, Het1C1-6 алкил, Het1C1-6 алкил-А-, Het1 окси-А-, Het1 оксиC1-4 алкил-А-, фенил-А-, фенилокси-А-,фенилоксиC1-4 алкил-А-, фенилC1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-, аминоС 1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены C1-4 алкилом, и А имеет указанные выше значения.-4 009556 Термин "галогенC1-6 алкил" в значении группы или части группы означает C1-6 алкил, замещенный одним или несколькими атомами галогена, предпочтительно атомами хлора или фтора, более предпочтительно атомами фтора. Предпочтительные галогенC1-6 алкильные группы, включают, например, трифторметил и дифторметил. Термин "гидроксиC1-6 алкил" в значении группы или части группы означает C1-6 алкил, замещенный одним или несколькими атомами гидроксильной группы. Термин "Het1" в значении группы или части группы означает насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 3-14 членов в кольце, более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-8 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода группой,включающей C1-6 алкил, C1-6 алкилокси, галоген, гидрокси, оксо, необязательно моно- или дизамещенную аминогруппу, нитро, циано, гидроксиC1-6 алкил, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил,C3-7 циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил,арил и насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет 3-14 членов в кольце и содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6 алкил,C1-6 алкилокси-А-, Het2-A-, Het2C1-6 алкил, Het2C1-6 алкил-А-, Het2 окси-А-, Het2 оксиC1-4 алкил-А-, арил-А-,арилокси-А-, арилоксиC1-4 алкил-А-, арилC1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-,аминоC1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены C1-4 алкилом, и А имеет указанные выше значения. Интересная подгруппа "Het1" в значении группы или части группы включает насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 314 членов в кольце, более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-8 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы,и необязательно замещен в положении одного или нескольких атомов углерода группой, включающейC1-6 алкил, C1-6 алкилокси, галоген, гидрокси, оксо, необязательно моно- или дизамещенную аминогруппу,нитро, циано, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил, C3-7 циклоалкил, необязательно моноили дизамещенный аминокарбонил, метилтио, метилсульфонил, арил и насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, который имеет 3-14 членов в кольце и содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6 алкил, C1-6 алкилокси-А-, Het2-A-, Het2C1-6 алкил,Het2C1-6 алкил-А-, Het2 окси-А-, Het2 оксиC1-4 алкил-А-, арил-А-, арилокси-А-, арилоксиС 1-4 алкил-А-,арилС 1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-, аминоC1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещеныC1-4 алкилом, и А имеет указанные выше значения. Термин "Het2" в значении группы или части группы означает ароматический моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 3-14 членов в кольце,более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-6 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода группой, включающей C1-6 алкил,C1-6 алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано,гидроксиC1-6 алкил, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил, C3-7 циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил, арил, Het1 и ароматический моноциклический, бициклический или трициклический гетероцикл, имеющий 3-14 членов в кольце; кроме того, необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-6 алкил, C1-6 алкилокси-А-, Het1-A-, Het1C1-6 алкил, Het1C1-6 алкил-А-,Het1 окси-A-, Het1 оксиC1-4 алкил-A-, арил-А-, арилокси-А-, арилоксиС 1-4 алкил-А-, арилС 1-6 алкил-А-,C1-6 алкилоксикарбониламино-А-, амино-А-, аминоC1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно, дизамещены C1-4 алкилом, и А имеет указанные выше значения. Интересная подгруппа "Het2" в значении группы или части группы включает ароматический моноциклический, бициклический или трициклический гетероцикл, который имеет предпочтительно 3-14 членов в кольце, более предпочтительно 5-10 членов в кольце и еще предпочтительнее 5-6 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода группой, включающей С 1-6 алкил, C1-6 алкилокси, галоген, гидрокси, необязательно моно- или дизамещенную аминогруппу, нитро, циано, галогенC1-6 алкил, карбоксил, C1-6 алкоксикарбонил,C3-7 циклоалкил, необязательно моно- или дизамещенный аминокарбонил, метилтио, метилсульфонил,арил, Het1 и ароматический моноциклический, бициклический или трициклический гетероцикл, имеющий 3-14 членов в кольце; кроме того, необязательные заместители в положении любой функциональной-5 009556 аминогруппы независимо выбирают из группы, включающей C1-6 алкил, C1-6 алкилокси-А-, Het1-A-,Het1C1-6 алкил, Het1C1-6 алкил-А-, Het1 окси-A-, Het1 оксиC1-4 алкил-А-, арил-А-, арилокси-А-, арилоксиС 1-4 алкил-А-, арилC1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-, аминоC1-6 алкил и аминоC1-6 алкил-А-, причем все аминогруппы могут быть необязательно монозамещены и там, где это возможно,дизамещены C1-4 алкилом, и А имеет указанные выше значения. В контексте данного изобретения группа (=O) образует карбонильную часть с атомом углерода, к которому он присоединен. Группа (=O) образует сульфоксид с атомом серы, к которому он присоединен. Группа (=O)2 образует сульфонил с атомом серы, к которому он присоединен. В контексте данного изобретения группа (=S) образует тиокарбонильную часть с атомом углерода,к которому он присоединен. В контексте данного изобретения термин "один или несколько" означает, что все имеющиеся атомы С при необходимости могут быть замещены, предпочтительно один, два или три атома. Когда любой переменный элемент (например, галоген или С 1-4 алкил) несколько раз встречается в любом структурном элементе, он имеет независимое значение в каждом конкретном случае. Термин "пролекарство" в значении, используемом в данном описании изобретения, означает фармакологически приемлемые производные соединения, такие как сложные эфиры, амиды и фосфаты, конечным продуктом биологического превращения которых является активное лекарственное средство,определяемое соединениями формулы (I). В данное описание изобретения включена ссылка на публикацию Гудмана и Гилмана, в которой дается характеристика пролекарств (Goodman and Gilman, The Pharmacological Basis of Therapeutics, 8th ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15). Пролекарства соединений по настоящему изобретению получают путем модификации функциональных групп, имеющихся в соединении, в результате чего такие группы отщепляются вследствие обычной манипуляции или in vivo с образованием исходного соединения. Пролекарства включают соединения по настоящему изобретению, в которых гидроксильная группа, например гидроксильная группа у асимметричного атома углерода, или аминогруппа связаны с любой группой, которая при введении данного пролекарства нуждающемуся субъекту отщепляется с образованием соответственно свободного гидроксила или свободной аминогруппы. Типичные примеры пролекарств приведены, например, в заявках WO 99/33795, WO 99/33815, WO 99/33793 и WO 99/33792, которые включены в данное описание изобретения в качестве ссылки. Пролекарства характеризуются великолепной растворимостью в воде, более высокой биологической доступностью и легко преобразуются в ходе обмена веществ in vivo в активные ингибиторы. Солями соединений формулы (I), предназначенными для применения в лечебных целях, являются такие соли, в которых имеется фармацевтически или физиологически приемлемый противоион. Однако соли, содержащие фармацевтически неприемлемый противоион, также можно использовать, например, в процессе получения или очистки фармацевтически приемлемого соединения формулы (I). Все соли независимо от того, являются они фармацевтически приемлемыми или нет, входят в объем настоящего изобретения. Фармацевтически приемлемые или физиологически толерантные аддитивные соли, которые могут образовывать соединения по настоящему изобретению, можно получить, используя соответствующие кислоты, например, неорганические кислоты, в частности, галогенводородные кислоты, такие как хлористо-водородная и бромисто-водородная кислоты, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная,щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, цикламиновая, салициловая, парааминосалициловая, памовая и подобные кислоты. И наоборот, указанные кислотно-аддитивные соли можно превратить в свободное основание в результате обработки соответствующим основанием. Соединения формулы (I), содержащие кислотный протон, можно также превратить в нетоксичную соль присоединения металла или амина в результате обработки соответствующими органическими и неорганическими основаниями. Соответствующие основные соли включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности, соли лития, натрия, калия, магния, кальция и тому подобные, соли с органическими основаниями, например, соли бензатина, N-метил-D-глюкамина,гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобные. И наоборот, указанные основно-аддитивные соли можно превратить в свободную кислоту в результате обработки соответствующей кислотой. Термин "соли" включает также гидраты и формы присоединения растворителя, которые могут образовывать соединения по настоящему изобретению. Примерами таких форм являются, например, гидраты, алкоголяты и тому подобные.N-оксиды соединений по настоящему изобретению включают соединения формулы (I), в которых один или несколько атомов азота окислены в так называемый N-оксид. Соединения по настоящему изобретению могут также существовать в таутомерных формах. Такие формы, не будучи четко представленными в приведенной выше формуле, входят в объем настоящего-6 009556 изобретения. Термин "стереохимически изомерные формы" соединений по настоящему изобретению в используемом здесь значении означают все возможные соединения, состоящие из одинаковых атомов, связанных одинаковой последовательностью связей, но имеющие разные трехмерные структуры, не являющиеся взаимозаменяемыми, которые могут принадлежать соединениям по настоящему изобретению. За исключением особо оговоренных случаев химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединение. Указанная смесь может включать все диастереомеры и/или энантиомеры основной молекулярной структуры данного соединения. Все стереохимически изомерные формы соединений по настоящему изобретению как в чистом виде, так и в смеси друг с другом входят в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных продуктов, рассматриваемых в данном описании изобретения, определяются как изомеры, по существу, не содержащие других энантиомерных или диастереомерных форм той же основной молекулярной структуры указанных соединений или промежуточных продуктов. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным продуктам, характеризующимся стереоизомерным избытком, равным по крайней мере 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров), вплоть до стереоизомерного избытка, равного 100% (т.е. 100% одного изомера и никаких других изомеров), предпочтительно к соединениям или промежуточным продуктам со стереоизомерным избытком от 90 до 100%, более предпочтительно со стереоизомерным избытком от 94 до 100% и наиболее предпочтительно со стереоизомерным избытком от 97 до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" имеют подобные значения, но относятся соответственно к энантиомерному избытку и диастереомерному избытку рассматриваемой смеси. Чистые стереоизомерные формы соединений и промежуточных продуктов по данному изобретению можно получить способами, известными в данной области. Например, энантиомеры можно отделить друг от друга путем избирательной кристаллизации диастереомерных солей оптически активными кислотами. Альтернативно, энантиомеры можно разделить хроматографическими методами, используя хиральные стационарные фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии стереоспецифического выполнения данной реакции. Если необходимо получить специфический стереоизомер, указанное соединение синтезируют при помощи стереоспецифических методов получения. В процессе выполнения таких методов преимущественно используют энантиомерно чистые исходные вещества. Диастереомерные рацематы формулы (I) можно разделить известными методами. Приемлемые методы физического разделения, которые можно эффективно использовать, включают, например, избирательную кристаллизацию и хроматографию, например хроматографию на колонках. Специалисту в данной области должно быть понятно, что соединения формулы (I) имеют по крайней мере один асимметрический центр и, таким образом, могут существовать в виде разных стереоизомерных форм. Указанный асимметрический центр обозначен звездочкойв нижеследующей формуле: Абсолютная конфигурация каждого асимметрического центра, присутствующего в соединениях формулы (I), может быть обозначена стереохимическими символами R и S в соответствии с правилами,описанными в публикации Pure Appl. Chem. 1976, 45, 11-30. Атом углерода, отмеченный звездочкой ,предпочтительно имеет R-конфигурацию. Настоящее изобретение относится также ко всем изотопам атомов, имеющихся в соединениях по данному изобретению. Изотопы включают атомы, имеющие одинаковое атомное число, но разные массовые числа. В качестве общего примера, не ограничивающего объем данного изобретения, можно привести изотопы водорода, которые включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. В значении, используемом в данном описании изобретения, термин "соединения формулы (I)", "соединения по настоящему изобретению" или подобный термин означает соединения общей формулы (I),их N-оксиды, соли, стереоизомерные формы, рацемические смеси, пролекарства, сложные эфиры и метаболиты, а также их аналоги с кватернизованным азотом. Определенную подгруппу соединений составляют соединения формулы (I), их N-оксиды, соли, стереоизомерные формы, рацемические смеси, пролекарства, сложные эфиры и метаболиты, в которыхR1 может быть также радикалом формулы где R9, R10a и R10b, каждый независимо, означает водород, C1-4 алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(С 1-4 алкил)аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или С 1-4 алкил,необязательно замещенный группой, включающей арил, Het1, Het2, С 3-7 циклоалкил, C1-4 алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4 алкил)аминокарбонил, аминосульфонил,C1-4 алкилS(О)t, гидрокси, циано, галоген или аминогруппу, необязательно моно- или дизамещенную, заместители которой выбирают из группы, включающей С 1-4 алкил, арил, арилC1-4 алкил, С 3-7 циклоалкил,С 3-7 циклоалкилС 1-4 алкил, Het1, Het2, Het1C1-4 алкил и Het2C1-4 алкил; кроме того, R9 и R10a вместе с атомами углерода, к которым они присоединены, могут образовывать C3-7 циклоалкильный радикал;R11b означает водород, C3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, арил, Het1, Het2 или C1-4 алкил, необязательно замещенный галогеном, гидрокси, C1-4 алкилS(=O)t, арилом, C3-7 циклоалкилом, Het1, Het2,аминогруппой, необязательно моно- или дизамещенной, заместители которой выбирают из группы,включающей C1-4 алкил, арил, арилC1-4 алкил, C3-7 циклоалкил, C3-7 циклоалкилС 1-4 алкил, Het1, Het2,Het1C1-4 алкил и Het2C1-4 алкил; кроме того, R11b может быть присоединен к остальной части молекулы при помощи сульфонильной группы;R2 означает водород или C1-6 алкил;R3 означает C1-6 алкил, арил, С 3-7 циклоалкил, С 3-7 циклоалкилC1-4 алкил или арилС 1-4 алкил;R4 означает водород, С 1-4 алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, C3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или C1-6 алкил, кроме того, C3-7 циклоалкил,С 2-6 алкенил, C2-6 алкинил и C1-6 алкил могут быть необязательно замещены заместителем, выбираемым из группы, включающей арил, Het1, Het2, C3-7 циклоалкил, С 1-4 алкилоксикарбонил, карбоксил, необязательно моно- или дизамещенный аминокарбонил, необязательно моно- или дизамещенный аминосульфонил,C1-4 алкилS(=O)t, гидрокси, циано, необязательно моно- или дизамещенную аминогруппу и галоген, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из группы, включающей C1-4 алкил, арил, арилС 1-4 алкил, C3-7 циклоалкил, C3-7 циклоалкилC1-4 алкил,Het1, Het2, Het1C1-4 алкил и Het2C1-4 алкил;t равно 0, 1 или 2; все t независимо выбирают из 0, 1 или 2;Haryl означает ароматический моноциклический, бициклический или трициклический гетероцикл,который имеет 3-14 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода и серы, и может быть необязательно замещен (i) в положении одного или нескольких атомов углерода C1-6 алкилом, C1-6 алкилокси, галогеном, гидрокси, необязательно моно- или дизамещенной аминогруппой, нитро, циано, галогенC1-6 алкилом, карбоксилом, C1-6 алкоксикарбонилом,C1-6 алкилкарбонилокси, C3-7 циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом,метилтио, метилсульфонилом, арилом, -(R7a)n-M-R7b, Het1 и Het2, причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) в положении атома азота гидроксилом или -A-R6; А означает C1-6 алкандиил, -С(=O)-, -C(=S)-, -S(=O)2-, C1-6 алкандиил-С(=O)-, C1-6 алкандиил-С(=S)или C1-6 алкандиил-S(=O)2-, причем в группах, содержащих С 1-6 алкандиильную часть, указанная часть присоединена к аминогруппе;R5 означает гидрокси, C1-6 алкил, Het1C1-6 алкил, Het2C1-6 алкил, аминоC1-6 алкил, причем аминогруппа может быть необязательно моно- или дизамещена C1-4 алкилом;R6 означает водород, C1-6 алкилокси, Het1, Het1 окси, Het2, Het2 окси, арил, арилокси или амино; и, если -А- не является C1-6 алкандиилом, R6 может быть также C1-6 алкилом, Het1C1-4 алкилом, Het1 оксиC1-4-8 009556 алкилом, Het2C1-4 алкилом, Het2 оксиC1-4 алкилом, арилC1-4 алкилом, арилоксиC1-4 алкилом или аминоC1-4 алкилом, причем все аминогруппы в определении R6 могут быть необязательно замещены одним или двумя заместителями,выбираемыми из группы,включающейR7a означает С 1-8 алкандиил, необязательно замещенный одним или несколькими заместителями,выбираемыми из группы, включающей галоген, C1-4 алкилкарбонил, C1-4 алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2;R7b означает С 1-8 алкил, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, включающей галоген, C1-4 алкилкарбонил, C1-4 алкилоксикарбонил, арил, арилкарбонил, арилоксикарбонил, Het1 или Het2; М означает -С(=O)-, -O-С(=O)-, -С(=O)-O-, -СН 2-СНОН-, -СНОН-СН 2-, -NR8-C(=O)-, -(C=O)-NR8-,-S(=O)2-, -O-, -S-, -O-S(=O)2-, -S(=O)2-O-, -NR8-S(=O)2 или -S(=O)2-NR8-;n равно 0 или 1. Определенную группу соединений составляют соединения формулы (I), к которым применимо одно или несколько нижеследующих ограничений:R1 означает водород, Het1, Het2, арил, Het1C1-6 алкил, Het2C1-6 алкил, арилC1-6 алкил, в частности, R1 означает водород, насыщенный или частично ненасыщенный моноциклический или бициклический гетероцикл, который имеет в кольце 5-8 членов, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен, фенил, необязательно замещенный одним или несколькими заместителями, ароматический моноциклический гетероцикл, который имеет 5-6 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода, или C1-6 алкил,замещенный ароматическим моноциклическим гетероциклом, который имеет 5-6 членов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода;L означает -С(=O)-, -O-С(=O)-, -O-С 1-6 алкандиил-С(=O)-, в частности, L означает -С(=O)-, -O-С(=O)-,-O-СН 2-С(=O)-, при этом во всех случаях группа С(=O) присоединена к части NR2;R4 означает необязательно замещенный С 1-6 алкил, в частности, C1-6 алкил, необязательно замещенный арилом, Het1, Het2, C3-7 циклоалкил или аминогруппу, необязательно моно- или дизамещенную, заместители которой выбирают из C1-4 алкила, арила, Het1 и Het2; А означает C1-6 алкандиил, -С(=O)- или C1-6 алкандиил-С(=O)-, в частности, А означает метилен, 1,2 этандиил, 1,3-пропандиил, -С(=O)- или -СН 2-С(=O)-;R5 означает водород, C1-6 алкил, Het1C1-6 алкил, аминоC1-6 алкил, причем аминогруппа может быть необязательно моно- или дизамещена C1-4 алкилом;R6 означает C1-6 алкилокси, Het1, арил, амино; и в том случае, когда -А- не является C1-6 алкандиилом,R6 может быть также C1-6 алкилом, Het1C1-4 алкилом, арилоксиC1-4 алкилом или аминоC1-4 алкилом; причем все аминогруппы могут быть необязательно замещены; илиR5 и -A-R6 вместе с атомом азота, к которому они присоединены, могут также образовывать Het1;Haryl означает ароматический моно- или бициклический гетероцикл, который имеет 3-8 членов в кольце и содержит один или несколько гетероатомов, выбираемых из N, О или S, при этом (i) Haryl может быть необязательно замещен в положении одного или нескольких атомов углерода C1-6 алкилом,C1-6 алкилокси, галогеном, гидрокси, необязательно моно- или дизамещенной аминогруппой, нитро, циано, галогенC1-6 алкилом, карбоксилом, C1-6 алкоксикарбонилом, C1-6 алкилкарбонилокси, C3-7 циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, метилтио, метилсульфонилом,арилом, (R7a)n-M-R7b, Het1 и Het2; причем необязательные заместители в положении любой функциональной аминогруппы независимо выбирают из R5 и -A-R6; и (ii) Haryl может быть необязательно замещен в положении атома азота гидроксилом или -A-R6. Особую группу соединений составляют соединения формулы (I), в которых R1 означает Het1, арил,Het2C1-6 алкил; R2 означает водород; L означает -С(=O)-, -O-С(=O)-, -O-CH2-С(=O)-, при этом во всех случаях группа С(=O) присоединена к части NR2; R3 означает фенилметил; и R4 означает C1-6 алкил. Другую интересную группу соединений составляют соединения формулы (I), в которых R1 означает водород, C1-6 алкил, С 2-6 алкенил, арилC1-6 алкил, C3-7 циклоалкил, С 3-7 циклоалкилС 1-6 алкил, арил, Het1,Het1C1-6 алкил, Het2, Het2C1-6 алкил; причем Het1 является насыщенным или частично ненасыщенным моноциклическим гетероциклом, который имеет 5 или 6 атомов в кольце, содержит в кольце один или несколько гетероатомов, выбираемых из азота, кислорода или серы, и необязательно замещен в положении одного или нескольких атомов углерода. Другую интересную группу соединений составляют соединения формулы (I), в которых R1 означает арилC1-6 алкил, Het1C1-6 алкил, Het2C1-6 алкил или Het1, содержащий по крайней мере 5 атомов углерода. Другую интересную группу соединений составляют соединения формулы (I), в которых L означает-O-C1-6 алкандиил-С(=O)-. Интересную группу соединений составляют соединения формулы (I), в которых заместитель Haryl в положении фенила находится в пара-положении относительно сульфонамидной части. Интересную группу соединений составляют соединения формулы (I), в которых заместитель Haryl содержит по крайней мере один атом азота, причем указанный заместитель предпочтительно содержит по крайней мере один атом азота в альфа-положении относительно Haryl-фенильной связи. Другую интересную группу соединений составляют соединения формулы (I), в которых R1 выбирают из группы, включающей дизамещенный арил, тризамещенный арил, Het2C1-6 алкил или Het1; Haryl может быть монозамещен или дизамещен, причем, если Haryl дизамещен, по крайней мере один заместитель выбирают из метила, галогена или аминогруппы. Другую интересную группу соединений составляют соединения формулы (I), в которых Haryl выбирают из группы, включающей тиазолил, имидазолил, оксазолил, оксадиазолил, пиразолил, пиразинил,имидазолинонил, хинолинил, изохинолинил, индолил, пиридазинил, пиридинил, пирролил, пиранил, пиримидинил, фуранил, триазолил, тетразолил, бензофуранил, бензоксазолил, изоксазолил, изотиазолил,тиадиазолил, тиофенил, тетрагидрофурофуранил, тетрагидропиранофуранил, бензотиофенил, карбазолил, имидазолонил, оксазолонил, индолизинил, триазинил или хиноксалинил; кроме того, Haryl может быть необязательно замещен в положении одного или нескольких членов кольца; Haryl предпочтительно выбирают из группы, включающей тиазолил, имидазолил, оксазолил, оксадиазолил, пиразолил или пиридинил, которые могут быть необязательно замещены в положении одного или нескольких членов кольца. Другую интересную группу соединений составляют соединения формулы (I), в которых Haryl является тиазолилом, замещенным необязательно моно- или дизамещенной аминогруппой; причем указанная аминогруппа предпочтительно не замещена или монозамещена. Другую интересную группу соединений составляют соединения формулы (I), в которых Haryl является пиразолилом, замещенным в положении атома азота. Другую интересную группу соединений составляют соединения формулы (I), в которых Haryl является оксазолилом, замещенным метилом или аминогруппой, причем указанный заместитель предпочтительно находится в положении 2 оксалильной части. Другую интересную группу соединений составляют соединения формулы (I), в которых Haryl является оксадиазолилом, замещенным в положении 5 оксадиазолильной части. Приемлемую группу соединений составляют соединения формулы (I) в виде соли, причем соль выбирают из трифторацетата, фумарата, хлорацетата и метансульфоната. Интересную группу соединений составляют соединения формулы (I), обладающие множественной устойчивостью, определяемой описанными здесь методами в интервале от 0,01 до 100, к разным видам ВИЧ, имеющим по крайней мере одну мутацию в протеазе ВИЧ в положении, выбираемом из 10, 71 и 84,по сравнению с последовательностью дикого типа (например, в банке генов под номерами доступа М 38432, K03455, gi 327742), или по крайней мере две мутации в протеазе ВИЧ в положении, выбираемом из 10, 71 и 84; в частности, указанные соединения обладают множественной устойчивостью в интервале от 0,1 до 100, более предпочтительно в интервале от 0,1 до 50. Интересную группу соединений составляют соединения 1-6, 24, 32-33, 35, 23-24, 38-40, 42-44, 46, 48-52 и 57, описанные в настоящем изобретении. Приемлемую группу соединений составляют соединения 1-6, 24, 32, 35, 23-24, 38 и 40, описанные в настоящем изобретении. В одном варианте осуществления изобретения R5 может быть С 2-6 алкенилом, таким как -СН 2 СН=CH2, арилом, таким как фенил, или Het2, таким как пиридин. В одном варианте осуществления изобретения Haryl может быть также замещен C1-6 алкилкарбоновой кислотой, такой как -СН 2-СН 2-COOH. Данное изобретение относится также к фармацевтической композиции, которая представляет собой твердую дисперсию, содержащую (а) соединение формулы (I) и (b) один или несколько фармацевтически приемлемых водорастворимых полимеров. В частности, указанное соединение выбирают из соединений 1-6, 24, 32-33, 35, 23-24, 38-40, 42-44, 46, 48-52 и 57. Водорастворимый полимер обычно включает гидроксипропилметилцеллюлозу, сополимер поливинилпирролидона с винилацетатом (PVP-VA). Данное изобретение относится также к способу получения композиции, содержащей по крайней мере одно соединение формулы (I) или соединение, приведенное в табл. 1-6. Данное изобретение далее относится к соединению формулы (I) или соединению, приведенному в табл. 1-6, синтезированному в соответствии с любой схемой 1-6. Данное изобретение далее относится к промежуточным продуктам, описанным в настоящем изобретении при рассмотрении синтеза соединения формулы (I). Интересные промежуточные продукты имеют формулу В-1, В-2 или K. Данное изобретение далее относится к соединению формулы (I) или соединению, приведенному в табл. 1-6, которое используют при приготовлении лекарственного средства для лечения, профилактики или борьбы с инфекцией или заболеванием, вызванным ретровирусной инфекцией у млекопитающего,предпочтительно у человека.- 10009556 Соединениями, обладающими интересными фармакокинетическими свойствами, являются соединения формулы (I), содержащие по крайней мере один заместитель, независимо выбираемый из тиазолила, имидазолила и пиридинила. Соединения формулы (I) обычно получают способами, аналогичными описанным в заявках WO 95/06030, WO 96/22287, WO 96/28418, WO 96/28463, WO 96/28464, WO 96/28465 и WO 97/18205. Ниже описаны конкретные реакции, осуществляемые для получения соединений по настоящему изобретению. В рассмотренных ниже способах получения продукты реакции могут быть выделены из реакционной среды и при необходимости очищены методами, известными в данной области, например,такими как экстракция, кристаллизация, растирание и хроматография. Схема 1 Осуществляя взаимодействие -замещенногобромацетофенона с тиомочевиной или замещенной тиомочевиной при повышенных температурах, можно получить промежуточный продукт G1. Указанная реакция может быть выполнена в условиях нагревания с обратным холодильником в присутствии ДМФА(диметилформамида). Промежуточный продукт (G1) можно подвергнуть взаимодействию с хлорсульфоновой кислотой, в результате чего образуется сульфонилхлорид В-1. Например, 2-бромпропиофенон можно подвергнуть взаимодействию с тиомочевиной, получив при этом 2-амино-5-метил-4-фенилтиазол,который далее можно превратить в 4-(2-амино-5-метилтиазол-4-ил)фенилсульфонилхлорид. При использовании фенилацетилбромида для получения промежуточного продукта G1 указанный промежуточный продукт сначала бромируют методами, известными в данной области, и затем подвергают взаимодействию с хлорсульфоновой кислотой, в результате чего получают, например, 4-(2-амино-5 бромтиазол-4-ил)фенилсульфонилхлорид. Ra, Rb и Rc, каждый независимо, означает заместители Haryl. Схема 2 Промежуточный продукт С можно получить, осуществляя при низкой температуре взаимодействие промежуточного продукта А, полученного способом, описанным в патенте WO 97/18205, с промежуточным продуктом В в реакционно-инертном растворителе в присутствии основания. Например, указанная- 11009556 реакция может быть выполнена при температуре около 0 С в дихлорметане в присутствии триэтиламина(Et3N). Концевая аминогруппа в промежуточных продуктах может быть защищена известной в данной области защитной группой (PG), такой как трет-бутилоксикарбонильная группа. Указанная защитная группа может быть заменена другой приемлемой защитной группой, такой как фталимидо, дибензил или бензилоксикарбонил. Защитная группа может быть удалена из промежуточного продукта С при помощи кислоты, такой как трифторуксусная кислота, в приемлемом растворителе, таком как дихлорметан, в результате чего получают промежуточный продукт D. В одном варианте осуществления изобретения производное С 4-(2-замещенный амино-5-бромтиазол-4-ил)фенилсульфонамида может быть дебромировано,например, при помощи каталитического гидрирования до удаления защитной группы. Концевая аминогруппа промежуточного продукта D затем может быть замещена методами, известными в данной области, в результате чего образуется соединение Е. Альтернативно, защитные группы в промежуточных продуктах могут быть удалены при помощи сильной кислоты, такой как хлористо-водородная кислота в изопропаноле, в приемлемом растворителе, таком как смесь этанола и диоксана. В предпочтительном варианте осуществления изобретения защитная группа может быть выбрана из таких групп, как Fmoc, ацетил,трет-бутилоксикарбонил, бензилоксикарбонил и дибензил. Схема 3 Промежуточный продукт А можно получить в соответствии со схемой синтеза 2. Соединение А может быть подвергнуто взаимодействию с 4-ацетилфенилсульфонилхлоридом, в результате чего образуется соединение Н. Приемлемые условия для выполнения указанной реакции включают использование полярного апротонного растворителя, такого как дихлорметан, и основания, такого как Et3N. Защитную группу можно удалить и заменить другой защитной группой, ацетильную часть фенильного кольца галогенируют методами, известными в данной области, например, при помощи Br2. Замена защитной группы может повысить эффективность реакции бромирования. Гетероцикл в положении фенильной части можно ввести в результате осуществления реакций, показанных на схеме синтеза 1. После введения указанного гетероцикла можно удалить защитную группу концевой аминогруппы в условиях, известных в данной области, после чего свободная аминогруппа может быть замещена при помощи методов, известных специалистам в данной области. Схема синтеза 3.1 Примерами продуктов данной реакции являются фенилзамещенные тиазолы. Тиомочевину или необязательно замещенную тиомочевину можно подвергнуть взаимодействию с промежуточным продук- 12009556 том K, в результате чего образуются производные 2-аминозамещенного тиазола. Указанная реакция может быть выполнена в органических растворителях при повышенных температурах. Например, условия реакции могут включать нагревание в этаноле с обратным холодильником. Ra и Rb независимо означают заместители Haryl. В соответствии с другим примером тиоамиды могут быть подвергнуты взаимодействию с промежуточным продуктом K с образованием 2-замещенных тиазолов. Схема синтеза 3.2 Оксазолы можно получить, используя в качестве исходного вещества промежуточный продукт K,который подвергают взаимодействию с молекулами мочевины или замещенной мочевины, получая при этом 2-аминозамещенные оксазолы. Указанная реакция может быть выполнена в органических растворителях при повышенных температурах. Например, условия реакции могут включать нагревание в этаноле с обратным холодильником. Ra и Rb независимо означают заместители Haryl. 2-Алкилзамещенные оксазолы получают, осуществляя взаимодействие промежуточного продукта K с амидами формулы R-C(=O)NH2, где R является заместителем Haryl. Схема синтеза 3.3 Имидазолы можно получить, осуществляя взаимодействие производных гуанидина с промежуточным продуктом K. В результате выполнения указанной реакции получают производные 2 аминозамещенного имидазола. В другом варианте осуществления изобретения промежуточный продуктK может быть подвергнут взаимодействию с амидинами с образованием 2-замещенных имидазолов. Указанная реакция может быть выполнена в органических растворителях при повышенных температурах,например, в присутствии ТГФ (тетрагидрофурана) в условиях нагревания с обратным холодильником. В одном варианте осуществления изобретения в цикл, такой как 2-аминотиазол, может быть введена функциональная иминогруппа производного гуанидина. В результате осуществления указанной реакции получают, например, имидазо[2,1-b]тиазол. В одном варианте осуществления изобретения промежуточный продукт K можно подвергнуть взаимодействию с солями алкилкарбоновых кислот с образованием ацетилоксикарбонильных заместителей. Указанная реакция может быть выполнена при повышенных температурах в органических растворителях, например, при температуре около 60 С в ДМФА (диметилформамиде). Полученный промежуточный продукт можно подвергнуть взаимодействию с ацетатом аммония, в результате чего образуются 2-замещенные имидазолы. R, Ra и Rb независимо означают заместители Haryl. Промежуточный продукт Н можно подвергнуть взаимодействию с диметилацеталем N,Nдиметилформамида в органическом растворителе, таком как толуол. Указанная реакция может быть выполнена при повышенных температурах, в результате чего образуется промежуточный продукт в виде смеси цис- и транс-изомеров. Промежуточный продукт, указанный последним, можно далее подвергнуть взаимодействию с гидразином или замещенным гидразином. Указанная реакция может быть выполнена при повышенных температурах в органическом растворителе в присутствии основания. Например, указанная реакция может быть выполнена в присутствии основания, такого как карбонат калия, с использованием этанола в качестве растворителя в условиях нагревания с обратным холодильником. Полученный продукт представляет смесь изомеров. R означает заместитель Haryl. Схема синтеза 4 Промежуточный продукт А можно подвергнуть взаимодействию с 4 цианофенилсульфонилхлоридом, в результате чего образуется промежуточный продукт K-5. Указанная реакция может быть выполнена при более низких температурах в органических растворителях в щелочных условиях. Например, реагенты могут быть смешаны при температуре около 0 С в дихлорметане(DCM) в присутствии триэтиламина. Затем температура может быть повышена примерно до комнатной температуры. Промежуточный продукт K-5 затем можно подвергнуть взаимодействию с гидроксиламином с образованием промежуточного продукта L. Например, промежуточный продукт K-5 можно подвергнуть взаимодействию с гидроксиламином в этаноле в присутствии основания, такого как карбонат калия, при повышенных температурах. Данная реакция может быть выполнена в условиях нагревания с обратным холодильником. Производные (S-R-оксадиазол-3-ил)фенилсульфонамида можно получить в результате осуществления взаимодействия промежуточного продукта L с ацилхлоридом формулыRC(=O)Cl. В одном варианте осуществления изобретения последняя реакция может быть выполнена с использованием пиридина в качестве растворителя при повышенных температурах, например, при температуре около 110 С. R означает заместитель Haryl. Аминозащитную группу можно удалить после образования фенильной части гетероцикла в услови- 14009556 ях, известных в данной области. Затем аминогруппа может быть замещена другими группами в условиях,известных в данной области. Предпочтительным заместителем аминогруппы может быть сложноэфирная часть бис-ТГФ. Схема синтеза 5 Промежуточный продукт А можно подвергнуть взаимодействию с 4-бромфенилсульфонилхлоридом, в результате чего образуется промежуточный продукт М. Указанная реакция может быть выполнена при более низких температурах в органических растворителях в щелочных условиях. Например,реагенты могут быть смешаны при температуре около 0 С в дихлорметане в присутствии триэтиламина. Затем температура может быть повышена примерно до комнатной температуры. Защитную группу промежуточного продукта М можно заменить другой защитной группой. Например, PG1 может быть Восгруппой, и PG2 может быть группой бис-тетрагидрофурана. Промежуточный продукт М можно далее подвергнуть взаимодействию с производным трибутилолова формулы RSn(nBu)3 в органических растворителях в присутствии основания и катализатора при повышенной температуре. Например, указанная реакция может быть выполнена в диоксане в присутствии основания, такого как триэтиламин, и катализатора, такого как комплексдихлорметана с [1,1'-бис(дифенилфосфино)ферроцен]палладием (II), при температуре около 85 С. R означает вышеуказанный необязательно замещенный Haryl. В одном варианте осуществления изобретения защитную группу можно заменить другой защитной группой, предпочтительно сложноэфирной группой бис-ТГФ, до осуществления взаимодействия с производным трибутилолова. Схема 6 Промежуточный продукт А можно получить в результате осуществления взаимодействия соединения F с амином в приемлемом растворителе, таком как изопропанол. Как показано на схеме 6, стереохимия промежуточного продукта F определяет стереохимию промежуточного продукта А. Соединения формулы (I) можно также превратить в соответствующие N-оксиды методами, известными в данной области и предназначенными для превращения трехвалентного азота в его N-оксид. Указанная реакция N-окисления может быть выполнена в результате осуществления взаимодействия исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать надкислоты, такие как бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например, 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды, например, третбутилгидропероксид. Приемлемыми растворителями являются, например, вода, низшие алканолы, например, этанол и тому подобные, углеводороды, например, толуол, кетоны, в частности, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей. Таким образом, соединения по настоящему изобретению можно использовать для лечения животных, предпочтительно млекопитающих и, в частности, человека в качестве лекарственных средств, используемых отдельно, в смесях друг с другом или в форме фармацевтических препаратов. Кроме того, настоящее изобретение относится к фармацевтическим препаратам, которые в качестве- 15009556 активных компонентов содержат эффективную дозу по крайней мере одного из соединений формулы (I) помимо обычных фармацевтически нетоксичных наполнителей и вспомогательных средств. Фармацевтические препараты обычно содержат 0,1-90 мас.% соединения формулы (I). Фармацевтические препараты могут быть получены методами, известными специалистам в данной области. Для достижения указанной цели по крайней мере одно соединение формулы (I) смешивают с одним или несколькими твердыми или жидкими фармацевтическими наполнителями и/или вспомогательными веществами и при желании с другими фармацевтически активными соединениями и получают из указанной смеси приемлемую лекарственную форму, которую можно использовать в качестве фармацевтического препарата в медицине или ветеринарии. Фармацевтические препараты, содержащие соединение по данному изобретению, можно вводить перорально, парентерально, например, внутривенно, ректально, путем ингаляции или местно, причем предпочтительный способ введения зависит от каждого конкретного случая, например, от характера заболевания, подлежащего лечению. Пероральное введение является предпочтительным. Специалисту в данной области должны быть известны вспомогательные средства, пригодные для использования в требуемом фармацевтическом препарате. Помимо растворителей, гелеобразующих агентов, основ для суппозиториев, вспомогательных средств для таблеток и других активных соединений могут быть также использованы носители, антиоксиданты, диспергаторы, эмульгаторы, противовспенивающие вещества, ароматизаторы, консерванты, солюбилизаторы, агенты, создающие эффект депо, буферы или красители. Благодаря благоприятным фармакологическим свойствам, в частности, наличию активности против ферментов протеазы ВИЧ с множественной лекарственной устойчивостью, соединения по настоящему изобретению пригодны для лечения и профилактики ВИЧ-инфицированных субъектов. Как правило,соединения по настоящему изобретению могут быть пригодны для лечения теплокровных животных,инфицированных вирусами, существование которых опосредовано или зависит от фермента протеазы. Заболевания, которые можно предотвратить или лечить соединениями по настоящему изобретению, особенно заболевания, вызванные ВИЧ и другими патогенными ретровирусами, включают СПИД, СПИДассоциированный комплекс (ARC), прогрессирующую генерализованную лимфаденопатию (PGL), синдром Капоши, тромбоцитопеническую пурпуру, а также хронические заболевания центральной нервной системы, вызываемые ретровирусами, такие как, например, ВИЧ-опосредованное слабоумие и рассеянный склероз. Соединения по настоящему изобретению пригодны для использования в случае действительного или возможного заражения ВИЧ и вирусом тропической лихорадки, а также положительной реакции на антитела против ВИЧ и ВИЧ-положительной реакции, включая такие реакции у бессимптомных субъектов. Соединения по настоящему изобретению или любую подгруппу указанных соединений можно использовать в качестве лекарственных средств против вышеуказанных заболеваний. Применение в качестве лекарственного средства или способ лечения включает системное введение ВИЧ-инфицированным субъектам эффективного количества лекарственного средства, необходимого для лечения заболевания,вызванного ВИЧ или другими патогенными ретровирусами, такими как ВИЧ-1. Соединения по настоящему изобретению можно использовать для получения лекарственного средства, пригодного для лечения заболеваний, вызванных ВИЧ и другими патогенными ретровирусами, в частности, лекарственных препаратов, пригодных для лечения субъектов, инфицированных вирусом ВИЧ с множественной лекарственной устойчивостью. Соединения по данному изобретению можно использовать для лечения вирусных инфекций, таких как ВИЧ и HTLV, которые зависят от аспарагиновых протеаз для выполнения обязательных функций в течение жизненного цикла. Хотя данное изобретение относится главным образом к применению описанных соединений для профилактики и лечения ВИЧ-инфекции, указанные соединения можно также использовать в качестве ингибиторов других вирусов, обязательные функции жизненного цикла которых находятся в зависимости от подобных аспарагиновых протеаз. Указанные вирусы включают другие подобные СПИДу заболевания, вызываемые ретровирусами, такими как вирусы иммунодефицита обезьян,HTLV-I и HTLV-II. Кроме того, соединения по данному изобретению можно также использовать для ингибирования других аспарагиновых протеаз,в частности, других аспарагиновых протеаз человека,включающих ренин и аспарагиновые протеазы, процессирующие предшественники эндотелина. В соответствии с одним вариантом осуществления данное изобретение относится к использованию соединения формулы (I) или любой подгруппы указанного соединения при получении лекарственного средства для лечения, профилактики или борьбы с инфекцией или заболеванием, вызванным ретровирусом с множественной лекарственной устойчивостью у млекопитающего, в частности ВИЧ-1. Таким образом, данное изобретение относится также к способу лечения ретровирусной инфекции или заболевания,вызванного ретровирусом с множественной лекарственной устойчивостью, который включает введение нуждающемуся млекопитающему эффективного количества соединения формулы (I) или его подгруппы. Термин "предупреждение" означает профилактику инфицирования ВИЧ и профилактику развития ВИЧинфекции в СПИД. В соответствии с другим вариантом осуществления настоящее изобретение относится к использо- 16009556 ванию соединения формулы (I) или любой подгруппы указанного соединения при получении лекарственного средства для ингибирования протеазы ретровируса с множественной лекарственной устойчивостью у млекопитающего, инфицированного указанным ретровирусом, в частности, ретровирусом ВИЧ-1. В соответствии с другим вариантом осуществления настоящее изобретение относится к использованию соединения формулы (I) или любой подгруппы указанного соединения при получении лекарственного средства для ингибирования репликации ретровируса с множественной лекарственной устойчивостью, в частности, репликации ВИЧ-1. Соединения по настоящему изобретению можно также использовать для ингибирования ex vivo образцов, содержащих ВИЧ или подвергаемых воздействию ВИЧ. Таким образом, соединения по настоящему изобретению можно использовать для ингибирования ВИЧ, присутствующего в образце жидкости организма, который содержит, предположительно содержит или подвергается воздействию ВИЧ. Кроме того, в качестве лекарственного средства можно использовать комбинацию антиретровирусного соединения с соединением по настоящему изобретению. Таким образом, настоящее изобретение относится также к продукту, содержащему (а) соединение по настоящему изобретению и (b) другое антиретровирусное соединение, в виде комбинированного препарата, предназначенного для одновременного, раздельного или последовательного введения с целью профилактики или лечения ретровирусных инфекций, в частности, для лечения инфекций, вызываемых ретровирусами с множественной лекарственной устойчивостью. Для профилактики или лечения ВИЧ-инфекций, а также инфекций и заболеваний,вызванных вирусом ВИЧ, таких как синдром приобретенного иммунодефицита (СПИД) или СПИДассоциированный комплекс (ARC), соединения по данному изобретению можно вводить в сочетании с такими средствами, как ингибиторы связывания, в частности, декстрансульфат, сурамин, полианионы,растворимый CD4, PRO-542, BMS-806; ингибиторы слияния, такие как, например, Т 20, Т 1249, RPR 103611, YK-FH312, IC 9564, 5-геликс, D-пептид ADS-J1; ингибиторы связывания с корецепторами, такие как, например, AMD 3100, AMD-3465, AMD7049, AMD3451 (бицикламы), TAK 779, Т-22, ALX40-4C;SHC-C (SCH351125), SHC-D, PRO-140, RPR 103611; ингибиторы обратной транкриптазы (RT), такие как,например, фоскарнет и пролекарства; ингибиторы обратной транскриптазы нуклеозидов, такие как, например, AZT, 3 ТС, DDC, DDI, D4T, абакавир, FTC, DAPD (амдоксовир), dOTC (BCH-10652), фозивудин,DPC 817; ингибиторы обратной транскриптазы нуклеотидов, такие как, например, РМЕА, РМРА (тенофовир); ингибиторы обратной транскриптазы ненуклеозидов, такие как, например, невирапин, делавирдин, эфавиренз, 8 и 9-Cl TIBO (тивирапин), ловирид, ТМС-125, дапивирин, MKC-442, UC 781, UC 782,каправирин, QM96521, GW420867X, DPC 961, DPC963, DPC082, DPC083, ТМС-125, каланолид А, SJ3366, TSAO, 4"-деаминированный TSAO, MV150, MV026048, PNU-142721; ингибиторы РНКазы Н, такие как, например, SP1093V, PD126338; ингибиторы ТАТ, такие как, например, RO-5-3335, K12, K37; ингибиторы интегразы, такие как, например, L 708906, L 731988, S-1360; ингибиторы протеазы, такие как,например, ампренавир и пролекарство GW908 (фосампренавир), ритонавир, нелфинавир, саквинавир,индинавир, лопинавир, палинавир, BMS 186316, атазанавир, DPC 681, DPC 684, типранавир, AG1776,мозенавир, DMP-323, GS3333, KNI-413, KNI-272, L754394, L756425, LG-71350, PD161374, PD173606,PD177298, PD178390, PD178392, PNU 140135, ТМС-114, маслиновая кислота, U-140690; ингибиторы гликозилирования, такие как, например, кастаноспермин, дезоксинойримицин; ингибиторы проникновения инфекции CGP64222. Соединения по данному изобретению можно вводить отдельно или в сочетании с другими лекарственными средствами. Комбинированная терапия может вызывать аддитивное или синергичное действие при ингибировании репликации ВИЧ, так как каждое соединение в такой комбинации может воздействовать на разные сайты репликации ВИЧ или на разные сайты белка-мишени. Применение такой комбинированной терапии может способствовать сокращению дозы данного антиретровирусного средства, которая необходима для достижения требуемого терапевтического или профилактического эффекта, по сравнению с применением данного средства в монотерапии. Такие комбинации могут уменьшать или устранить побочные эффекты отдельно применяемых антиретровирусных средств, не влияя на антиретровирусную активность указанных средств. Описываемые комбинации уменьшают вероятность возникновения устойчивости к лечению отдельным средством, сводя до минимума любую ассоциированную токсичность. Данные комбинации могут также повышать эффективность обычного лекарственного средства, не увеличивая присущую ему токсичность. Примеры комбинаций включают множественные комбинации, содержащие от 2 до 6 лекарственных средств. В одном варианте осуществления изобретения такая комбинация может вызывать синергичное действие, благодаря которому может быть предотвращено возникновение, значительно уменьшена или полностью устранена вирусная инфективность и вызываемые ею симптомы. Для каждой комбинации можно определить индекс комбинации (CI) методами, описанными Chou and Talalay (Adv. Enzyme Regul. 22:27-55, 1984). Значение CI в пределах от около 0,8 до около 1,2 отражает аддитивное ингибирование, вызываемое объединенными соединениями, причем значение менее 0,8 свидетельствует о синергии двух молекул и значение выше 1,2 является показателем антагонизма. Соединения по настоящему изобретению можно также вводить в комбинации с такими средствами,как иммуномодуляторы (например, бропиримин, антитело против альфа-интерферона человека, IL-2,- 17009556 метионинэнкефалин, альфа-интерферон, НЕ-2000 и налтрексон), антитела (например, моноклональное антитело Hu-5 А 8), вакцины (например, AG-1661, Aidsvax В/В), антибиотики (например, пентамидинизотиорат), цитокины (например, Th2), модуляторы цитокинов, хенокины или их рецепторы (например,CCR5) или гормоны (например, гормон роста, филграстим), для уменьшения интенсивности или устранения ВИЧ-инфекции и ее симптомов. При комбинированной терапии разные препараты можно вводить одновременно, отдельно или последовательно. Альтернативно, такую комбинацию можно вводить в виде одного препарата, при этом активные ингредиенты высвобождаются из препарата одновременно или раздельно. Соединения по настоящему изобретению можно также использовать в комбинации с модуляторами преобразования лекарственного средства в ходе обмена веществ, которые вводят нуждающемуся субъекту после лекарственного средства. Указанные модуляторы включают соединения, которые замедляют преобразование лекарственного средства в ходе обмена веществ на уровне цитохромов, таких как цитохром Р 450. Некоторые модуляторы ингибируют цитохром Р 450. Известно, что некоторые изоферменты включают цитохром Р 450, одним из которых является цитохром Р 450 3 А 4. Ритонавир является примером модулятора преобразования лекарственного средства в ходе обмена веществ, воздействующего на цитохром Р 450. Другие пригодные ингибиторы цитохрома Р 450 включают кетоконазол, циметидин или бергамоттин. Другую группу ингибиторов цитохрома Р 450 составляют итраконазол, кларитромицин, эритромицин, нефазодон, делавирдин или тролеандомицин. Указанный модулятор может быть также ингибитором протеазы ВИЧ, который, например, выбирают из группы, включающей индинавир, нелфинавир,саквинавир, ампренавир, лопинавир, лазинавир, палинавир, телинавир, типранавир, мозенавир, атазанавир. При такой комбинированной терапии разные препараты можно вводить одновременно, отдельно или последовательно. Альтернативно, такую комбинацию можно вводить в виде одного препарата, при введении которого активные ингредиенты высвобождаются одновременно или раздельно. Такой модулятор можно вводить в одинаковом или разном отношении к соединению по настоящему изобретению. Массовое отношение такого модулятора к соединению по настоящему изобретению(модулятор:соединение по настоящему изобретению) предпочтительно составляет 1:1 или меньше, более предпочтительно 1:3 или меньше, приемлемо отношение, равное 1:10 или меньше, более приемлемо отношение, равное 1:30 или меньше. Для получения лекарственной формы для перорального введения соединения по настоящему изобретению смешивают с приемлемыми добавками, такими как наполнители, стабилизаторы или инертные разбавители, и из полученной смеси при помощи известных методов получают соответствующие лекарственные формы, такие как таблетки, таблетки с покрытием, твердые капсулы, водные, спиртовые или масляные растворы. Примерами приемлемых инертных носителей являются аравийская камедь, оксид магния, карбонат магния, фосфат калия, лактоза, глюкоза или крахмал, в частности, кукурузный крахмал. В данном случае препарат может быть получен в виде сухих или мокрых гранул. Приемлемыми масляными наполнителями или растворителями являются растительные или животные масла, такие как подсолнечное масло или рыбий жир. Приемлемыми растворителями для водных или спиртовых растворов являются вода, этанол, сахарные растворы или их смеси. Полиэтиленгликоли и полипропиленгликоли можно также использовать в качестве дополнительных вспомогательных веществ для других лекарственных форм. Для получения лекарственных средств, предназначенных для подкожного или внутривенного введения, активные соединения при желании смешивают с предназначенными для этой цели веществами,такими как солюбилизаторы, эмульгаторы или другие вспомогательные вещества, получая при этом раствор, суспензию или эмульсию. Соединения формулы (I) можно также лиофилизовать и полученные лиофилизаты использовать, например, для получения препаратов для инъекций или вливаний. Приемлемыми растворителями являются, например, вода, физиологический раствор или спирты, такие как этанол, пропанол, глицерин, а также сахарные растворы, в частности, растворы глюкозы или маннита, или альтернативно смеси вышеуказанных разных растворителей. Приемлемые фармацевтические препараты, предназначенные для введения в форме аэрозолей или распыляемых растворов, представляют собой, например, растворы, суспензии или эмульсии соединений формулы (I) или их физиологически толерантные соли в фармацевтически приемлемом растворителе,таком как этанол или вода, либо смесь таких растворителей. При необходимости указанный препарат может дополнительно содержать другие фармацевтические вспомогательные вещества, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также пропеллент. Такой препарат обычно содержит активное соединение в концентрации от около 0,1 до 50%, в частности от около 0,3 до 3 мас.%. Для увеличения растворимости и/или устойчивости соединений формулы (I) в фармацевтических композициях можно эффективно использовать -, - или -циклодекстрины или их производные. Кроме того, растворимость и/или устойчивость соединений формулы (I) в фармацевтических композициях могут улучшать сорастворители, такие как спирты. При получении водных композиций добавление солей соединений по данному изобретению, очевидно, является более приемлемым благодаря лучшей растворимости таких солей в воде.- 18009556 Приемлемыми циклодекстринами являются -, - или -циклодекстрины (CD), их простые эфиры и смешанные эфиры, в которых одна или несколько гидроксильных групп ангидроглюкозных звеньев циклодекстрина замещены группой, включающей C1-6 алкил, в частности, метил, этил или изопропил, например, произвольно метилированный -CD; гидроксиС 1-6 алкил, в частности, гидроксиэтил, гидроксипропил или гидроксибутил; карбоксиC1-6 алкил, в частности, карбоксиметил или карбоксиэтил;C1-6 алкилкарбонил, в частности, ацетил; C1-6 алкилоксикарбонилC1-6 алкил или карбоксиC1-6 алкилоксиC1-6 алкил, в частности, карбоксиметоксипропил или карбоксиэтоксипропил; С 1-6 алкилкарбонилоксиС 1-6 алкил, в частности, 2-ацетилоксипропил. Особенно предпочтительными комплексообразующими веществами и/или растворителями являются -CD, произвольно метилированный -CD, 2,6-диметилCD, 2 гидроксиэтилCD, 2-гидроксиэтилCD, 2-гидроксипропилCD и (2-карбоксиметокси)пропилCD и, в частности, 2-гидроксипропилCD (2-HPCD). Термин "смешанный эфир" означает производные циклодекстрина, в которых по крайней мере две гидроксильные группы циклодекстрина этерифицированы разными группами, такими как, например, гидроксипропил и гидроксиэтил. Интересный способ получения фармацевтических препаратов, содержащих соединения по настоящему изобретению в комбинации с циклодекстрином или его производным, описан в заявке на европейский патент ЕР-А-721331. Хотя препараты, описанные в вышеуказанной заявке, содержат противогрибковые активные ингредиенты, они в равной степени интересны для получения препаратов, содержащих соединения по настоящему изобретению. Представленные препараты особенно пригодны для перорального введения и содержат противогрибковое средство в качестве активного ингредиента, достаточное количество циклодекстрина или его производного в качестве солюбилизатора, водно-кислую среду в качестве основного жидкого носителя и спиртовой сорастворитель, который значительно упрощает получение данной композиции. Указанные препараты можно сделать более приятными на вкус, добавляя фармацевтически приемлемые подсластители и/или ароматизаторы. Другие приемлемые способы улучшения растворимости соединений по настоящему изобретению в фармацевтических композициях описаны в заявках WO-94/05263, РСТРСТ/ЕР 98/01773, ЕР-А-499299 и WO 97/44014, которые включены в данное описание изобретения в качестве ссылки. В частности, соединения по настоящему изобретению могут быть использованы для получения фармацевтической композиции, содержащей терапевтически эффективное количество частиц, представляющих собой твердую дисперсию, содержащую (а) соединение формулы (I) и (b) один или несколько фармацевтически приемлемых водорастворимых полимеров. Термин "твердая дисперсия" означает систему в твердом состоянии (в отличие от жидкого или газообразного состояния), которая содержит по крайней мере два компонента, причем один компонент более или менее равномерно диспергирован в другом компоненте или компонентах. Если указанная дисперсия компонентов такова, что система является химически и физически однородной или гомогенной или состоит из одной фазы в соответствии с определением, принятым в термодинамике, такая твердая дисперсия определяется как "твердый раствор". Твердые растворы являются предпочтительными физическими системами, так как компоненты такой системы обычно легко биологически доступны для организмов, в которые их вводят. Термин "твердая дисперсия" означает также дисперсии, которые являются менее гомогенными по сравнению с твердыми растворами. Такие дисперсии не являются химически и физически однородными или состоят из нескольких фаз. Водорастворимый полимер в виде частиц обычно является полимером с кажущейся вязкостью от 1 до 100 мПас при растворении в 2% водном растворе при 20 С. Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы или НРМС. НРМС со степенью замещения метоксильных групп от около 0,8 до около 2,5 и молярным замещением гидроксипропильных групп от около 0,05 до около 3,0 обычно являются водорастворимыми. Степень замещения метоксильных групп означает среднее число групп метилового эфира в одном ангидроглюкозном звене молекулы целлюлозы. Молярное замещение гидроксипропильных групп означает среднее число молей пропиленоксида, прореагировавших с каждым ангидроглюкозным звеном молекулы целлюлозы. Вышеуказанные частицы можно получить в результате создания твердой дисперсии компонентов с последующим измельчением или размалыванием такой дисперсии. Существуют разные методы получения твердых дисперсий, которые включают экструзию из расплава, распылительную сушку и выпаривание из раствора, причем экструзия из расплава является предпочтительным методом. Препараты, содержащие соединения по настоящему изобретению, могут быть получены в виде наночастиц, на поверхности которых адсорбирован модификатор поверхности в количестве, достаточном для сохранения эффективного среднего размера частиц менее 1000 нм. Пригодными модификаторами поверхности считаются такие вещества, которые физически сцепляются с поверхностью антиретровирусного средства, но не образуют химическую связь с указанным средством. Приемлемые модификаторы поверхности предпочтительно выбирают из известных органических и неорганических фармацевтических наполнителей. Такие наполнители включают разные полимеры, низ- 19009556 комолекулярные олигомеры, природные продукты и поверхностно-активные вещества. Предпочтительные поверхностно-активные вещества включают неионогенные и анионогенные поверхностно-активные вещества. Другим интересным способом получения фармацевтических препаратов, содержащих соединения по настоящему изобретению, является введение соединений по настоящему изобретению в гидрофильные полимеры и нанесение полученной смеси в виде покровной пленки на множество мелких гранул, в результате чего образуется композиция с хорошей биологической доступностью, которую можно легко приготовить и которая пригодна для получения дозированных лекарственных форм для перорального введения. Указанные гранулы имеют (а) центральную, округленную или сферическую сердцевину, (b) покровную пленку из гидрофильного полимера и антиретровирусное средство и (с) уплотняющий полимерный слой. В качестве сердцевины указанных гранул можно использовать разные вещества при условии, что такие вещества являются фармацевтически приемлемыми и обладают соответствующими размерами и прочностью. Примерами таких веществ являются полимеры, неорганические вещества, органические вещества, сахариды и их производные. Другим объектом настоящего изобретения является набор или комплект, содержащий соединение формулы (I) в количестве, достаточном для использования в качестве эталона или реагента при выполнении испытания или анализа по определению способности потенциального фармацевтического средства ингибировать протеазу ВИЧ, рост ВИЧ или оба параметра. Данный объект настоящего изобретения может найти применение в фармацевтических научно-исследовательских программах. Соединения по настоящему изобретению можно использовать для определения фенотипической устойчивости при помощи таких анализов, как известные рекомбинантные анализы, во время клинического лечения заболеваний, сопровождающихся возникновением лекарственной устойчивости, таких как ВИЧ. Особенно пригодной системой контроля лекарственной устойчивости является рекомбинантный анализ,известный как Antivirogram. Antivirogram является полностью автоматизированным, высокопроизводительным рекомбинантным анализом второго поколения, который позволяет измерять чувствительность, в частности, чувствительность вирусов к соединениям по настоящему изобретению (публикацияHertogs K., de Bethune M.P., Niller V. et al. Antimicrob Agents Chemother, 1998; 42(2):269-276, которая включена в данное описание изобретения в качестве ссылки). Соединения по настоящему изобретению могут содержать химически активные части, способные образовывать ковалентные связи с локализованными сайтами, благодаря чему увеличивается время существования в тканях и период полувыведения такого соединения. Термин "химически активная группа" в используемом здесь значении означает химические группы, способные образовывать ковалентную связь. Реакционноспособные группы обычно являются устойчивыми в водной среде и представляют собой карбоксильные, фосфорильные или ацильные группы в сложном эфире, смешанном ангидриде, имидате или имидате малеиновой кислоты, способные образовывать ковалентную связь с функциональными группами, такими как аминогруппа, гидрокси или тиол, на сайте-мишени компонентов крови, таких как альбумин. Соединения по настоящему изобретению могут связываться с имидом малеиновой кислоты или его производными с образованием конъюгатов. Доза соединений по настоящему изобретению или их физиологически толерантных солей, предназначенная для введения нуждающемуся субъекту, зависит от конкретной ситуации и должна быть индивидуальной в каждом отдельном случае для достижения оптимального эффекта. Так, доза зависит от частоты введения, активности и продолжительности действия соединений, используемых для лечения или профилактики, а также от характера и тяжести инфекции и симптомов, от пола, возраста, массы тела и индивидуальной чувствительности человека или животного, подвергаемого лечению, и от того, является ли лечение неотложным или профилактическим. Суточная доза соединения формулы (I) при введении субъекту с массой тела около 75 кг составляет от 1 мг до 1 г, предпочтительно от 3 мг до 0,5 г. Указанную дозу можно вводить в виде разовой дозы или разделенной на несколько, например, две, три или четыре отдельные дозы. В нижеследующих таблицах представлены соединения формулы (I), полученные в соответствии с одной из приведенных выше схем реакций. Экспериментальная часть 1. Получение соединений формулы (В) и промежуточных продуктов указанных соединений. Пример 1. Смесь 2 г 2-бромпропиофенона и 0,71 г тиомочевины в 50 мл этанола нагревали с обратным холодильником в течение ночи. Растворитель выпаривали, остаток вновь растворяли в 50 мл этилацетата и- 20009556 обрабатывали 50 мл 2% раствора карбоната натрия в воде. Органический слой сушили и упаривали, получая при этом 1,77 г (99%) промежуточного продукта G, представляющего собой 5-метил-4-фенил-2 тиазоламин. Данные масс-спектрального анализа: m/z=191 (M+H). 2,11 г хлорсульфоновой кислоты добавляли к 0,77 г промежуточного продукта G в 20 мл DCM (дихлорметан). Смесь нагревали примерно до 50 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, выливали на лед и экстрагировали этилацетатом. Органический слой отделяли, сушили над MgSO4 и упаривали, получая при этом 0,74 г (63%) соединения В, представляющего собой 4-(2 амино-5-метилтиазол-4-ил)бензолсульфонилхлорид. Данные масс-спектрального анализа: m/z=289 Смесь 2 г фенацилбромида и 0,76 г тиомочевины в 50 мл этанола нагревали с обратным холодильником в течение ночи. Растворитель выпаривали, остаток вновь растворяли в 50 мл DCM и обрабатывали 50 мл 2% раствора карбоната натрия в воде. Органический слой сушили и упаривали, получая при этом 1,45 г (82%) 4-фенил-2-тиазоламина (промежуточный продукт G). Данные масс-спектрального анализа:m/z=177 (M+H). 0,71 г Br2 добавляли к 0,77 г промежуточного продукта G в 10 мл DCM при 0 С. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 30 мин. Добавляли 2% раствор Na2CO3 в воде. Органический слой отделяли, сушили над MgSO4 и упаривали, получая при этом 1,07 г (95%) промежуточного продукта N, представляющего собой 5-бром-4-фенил-2-тиазоламин. Данные масс-спектрального анализа: m/z=255 (M+H). 1,2 мл хлорсульфоновой кислоты добавляли к 0,75 г промежуточного продукта N в 5 мл DCM. Смесь нагревали примерно до 50 С в течение 2 ч. Затем реакционную смесь охлаждали до комнатной температуры, выливали на лед и экстрагировали этилацетатом. Органическую фазу удаляли, к водной фазе добавляли насыщенный раствор Na2CO3 и экстрагировали этилацетатом. Органический слой отделяли, сушили над MgSO4 и упаривали, получая при этом 0,67 г промежуточного продукта О, представляющего собой 4-(2-амино-5-бромтиазол-4-ил)бензолсульфонилхлорид. Данные масс-спектрального анализа: m/z=394 (M+H). 2. Получение соединений формулы (С) и промежуточных продуктов указанных соединений. Смесь 0,48 г промежуточного продукта А, представляющего собой 1,1-диметилэтиловый эфир [2Rгидрокси-3-[(2-метилпропил)амино]-1S-(фенилметил)пропил]карбаминовой кислоты (PG=Boc) и 0,36 г триэтиламина в 25 мл дихлорметана перемешивали примерно при 0 С. Затем добавляли 0,67 г промежуточного продукта О и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Смесь промывали водой, органический слой отделяли, сушили над MgSO4 и растворитель выпаривали,получая при этом 1,06 г (100%) промежуточного продукта Р, представляющего собой 1,1 диметилэтиловый эфирPd/C и водород добавляли к смеси 1,06 г промежуточного продукта Р в 25 мл метанола. Реакционную смесь перемешивали в течение ночи, фильтровали через декалит и упаривали, получая при этом 0,94 г соединения С, представляющего собой 1,1-диметилэтиловый эфир [(1S,2R)-3-[N-[4-(2-аминотиазол-4 ил)фенилсульфонил]-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=575 (М+Н). Пример 3. Получение соединений формулы (K-1) и промежуточных продуктов указанных соединений. Смесь 20 г промежуточного продукта A (PG=Boc) и 6,61 г триэтиламина в 500 мл дихлорметана пе- 21009556 ремешивали примерно при 0 С. Затем добавляли 13,6 г 4-ацетилбензолсульфонилхлорида и реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Реакционную смесь промывали водой, органический слой отделяли и сушили над MgSO4 растворитель выпаривали, получая при этом 30,9 г (100%) промежуточного продукта Н, представляющего собой 1,1-диметилэтиловый эфир [(1S,2R)3-[N-(4-ацетилфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=519 (М+Н). 100 мл HCl (5-6 н. раствор в изопропаноле) добавляли к 30,9 г промежуточного продукта Н в 400 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Растворитель выпаривали и получали промежуточный продукт I в виде соли HCl, представляющей собой гидрохлорид N-[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-4-ацетилфенилсульфонамида(26,9 г, 99%) (I). Данные масс-спектрального анализа: m/z=419 (M+H). 2,85 г 9-флуоренилметилхлорформиата Fmoc-Cl и 2,23 г триэтиламина добавляли к 5 г промежуточного продукта I в 150 мл дихлорметана. Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем промывали водой, сушили над MgSO4 и упаривали, получая при этом 7,2 г промежуточного продукта J-1, представляющего собой 9-флуоренилметиловый эфир [(1S,2R)-3-[N-(4 ацетилфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=641 (M+H). 2,11 г брома добавляли к 6,5 г промежуточного продукта J-1 в 200 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем промывали насыщенным раствором NaHCO3 в воде, сушили над MgSO4 и упаривали. Сырой продукт очищали на силикагеле, производя элюирование 20% этилацетата в гексане, и получали 3,6 г (50%) промежуточного продукта K-1, представляющего собой 9-флуоренилметиловый эфир [(1S,2R)-3-[N-[(4-бромацетилфенил)сульфонил]-N-(2 метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные массспектрального анализа: m/z=719 (M+H). Пример 4. Получение соединений формулы (K-2) и промежуточных продуктов указанных соединений. 3,33 г триэтиламина добавляли к 5 г промежуточного продукта I в 100 мл дихлорметана. Смесь охлаждали примерно до 0 С и добавляли 0,94 г ацетилхлорида. Затем реакционную смесь перемешивали в течение ночи при комнатной температуре, промывали водой, сушили над MgSO4 и упаривали, получая при этом 5 г (99%) промежуточного продукта J-2, представляющего собой [(1S,2R)-3-[N-(4 ацетилфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]ацетамид. Данные масс-спектрального анализа: m/z=461 (M+H). К 10 г промежуточного продукта J-2 в 250 мл дихлорметана в течение одного часа по каплям добавляли раствор брома (3,78 г в 20 мл дихлорметана). Смесь перемешивали в течение ночи при комнатной температуре и добавляли 1 мл 12 н. раствора HCl. Затем реакционную смесь перемешивали в течение 3 дней, промывали насыщенным раствором NaHCO3 в воде, сушили над MgSO4 и упаривали. Сырой продукт очищали на силикагеле, производя элюирование 60% этилацетата в гексане, и получали 5,9 г[(1S,2R)-3-[N-[4(бромацетил)фенилсульфонил]-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]ацетамид. Данные масс-спектрального анализа: m/z=539 (M+H). Пример 5. Получение соединений формулы (K-3) и промежуточных продуктов указанных соединений. Смесь 8,3 г промежуточного продукта А (PG=дибензил), представляющего собой [(1R,2S)-2[бис(фенилметил)амино]-1-[(2-метилпропил)амино]метил]бензолпропанол, и 2,12 г триэтиламина в 200 мл дихлорметана (DCM) перемешивали при 0 С. Затем по каплям добавляли 4,5 г 4 ацетилбензолсульфонилхлорида, растворенного в 100 мл DCM, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь промывали водой, органический слой отделяли, сушили над MgSO4 и выпаривали растворитель, получая при этом 12,07 г (100%) промежуточного продукта Н,- 22009556 представляющего собойN-[(2R,3S)-3-(N',N'-дибензил)амино-2-гидрокси-4-фенилбутил]-N-(2 метилпропил)-4-ацетилфенилсульфонамид. Данные масс-спектрального анализа: m/z=599 (M+H). 2,40 г брома и 0,6 г уксусной кислоты добавляли к смеси 5 г промежуточного продукта Н в 100 мл дихлорметана. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч, затем добавляли 0,25 мл брома и смесь перемешивали в течение 1 ч. Затем смесь промывали насыщенным растворомNaHCO3 в воде, сушили над MgSO4 и упаривали. Сырой продукт очищали на силикагеле, производя элюирование 20% гексана в DCM, и получали 2,25 г (40%) промежуточного продукта K-3, представляющего собойN-[(2R,3S)-3-(N',N'-дибензил)амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-4 бромацетилфенилсульфонамид. Данные масс-спектрального анализа: m/z=679 (M+H). Пример 6. Получение соединений формулы (K-4) к промежуточных продуктов указанных соединений.MgSO4 и концентрировали, получая при этом 7,67 г (100%) целевого промежуточного продукта Н-4,представляющего собой [(1S,2R)-3-[N-(4-ацетилфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси 1-(фенилметил)пропил]-(2,6-диметилфенокси)ацетамид. Данные масс-спектрального анализа: m/z=581(M+H). К смеси 4 г полученного выше промежуточного продукта в 100 мл дихлорметана в течение 15 мин по каплям добавляли раствор брома (1,66 г в 20 мл дихлорметана). Реакционную смесь перемешивали в течение 2,5 ч, затем промывали насыщенным раствором NaHCO3 в воде, сушили над MgSO4 и упаривали. Сырой продукт очищали на силикагеле, производя элюирование 3% этилацетата в DCM, и получали 2 г (45%) промежуточного продукта K-4, представляющего собой [(1S,2R)-3-[N-(4-бромацетилфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]-(2,6 диметилфенокси)ацетамид. Данные масс-спектрального анализа: m/z=659 (M+H). Пример 7. Синтез пиразолов - получение соединения 24. К 2 г промежуточного продукта Н-4 в 100 мл толуола добавляли 0,45 г диметилацеталя N,Nдиметилформамида. Смесь нагревали с обратным холодильником в течение ночи, затем добавляли еще 0,2 г диметилацеталя N,N-диметилформамида. Реакционную смесь перемешивали в течение ночи при нагревании с обратным холодильником и повторяли вышеуказанную процедуру (добавление 0,2 г реагента и нагревание с обратным холодильником в течение ночи). Затем смесь концентрировали и сырой продукт очищали на силикагеле, производя элюирование 40% этилацетата в гексане. Фракции, содержащие целевое соединение, собирали и упаривали. Остаток растворяли в 100 мл метанола, содержащего 1,43 г карбоната калия. Смесь перемешивали в течение 1 ч при комнатной температуре и упаривали, получая при этом 1,74 г промежуточного продукта 1-4 в виде смесь двух изомеров, представляющих собой цис- и транс-[(1S,2R)-3-[N-[4-(3-(диметиламино)-1-оксо-2-пропенил)фенилсульфонил]-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]-(2,6-диметилфенокси)ацетамид. Данные массспектрального анализа: m/z=636 (M+H). К 95 мг промежуточного продукта 1-4 в 5 мл этанола добавляли 62 мг карбоната калия и 10 мг гидразингидрохлорида. Смесь нагревали с обратным холодильником в течение 18 ч и упаривали. Сырую смесь очищали препаративной ВЭЖХ, получая при этом 21 мг (23%) целевого пиразола, представляющего собой [(1S,2R)-2-гидрокси-3-[N-(2-метилпропил)-N-(4-пиразол-3(5)-илфенилсульфонил)амино]-1(фенилметил)пропил]-(2,6-диметилфенокси)ацетамид. Данные масс-спектрального анализа: m/z=605- 23009556 Пример 8. Синтез тиазолов - получение соединении формулы (L-1). К 0,5 г промежуточного продукта K-1 в 40 мл этанола добавляли 0,063 г метилтиомочевины. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 ч и упаривали, получая при этом 0,55 г промежуточного продукта L-1, представляющего собой 9 флуоренилметиловый эфир [(1S,2R)-2-гидрокси-3-[N-[4-(2-метиламинотиазол-4-ил)фенилсульфонил]-N(2-метилпропил)амино]-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=645 (M+H). Пример 9. Получение соединений формула (М-1) - получение соединения 9. К 0,49 г промежуточного продукта L-1 в 40 мл ДМФА добавляли 0,59 г пиперидина. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали, сырое соединение очищали на силикагеле, производя элюирование градиентом от 2% метанола в дихлорметане до 4% метанола, и получали 0,21 г (62%) промежуточного продукта М-1, представляющего собой N[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-[4-(2-метиламинотиазол-4-ил)фенил]сульфонамид. Данные масс-спектрального анализа: m/z=489 (M+H). К 0,74 мл бензоилизотиоцианата в 30 мл тетрагидрофурана добавляли 0,64 мл N,Nдиметиламинопропиламина. Смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли 0,6 мл 50% раствора гидроксида натрия в воде и смесь нагревали до температуры кипения с обратным холодильником в течение ночи. Реакционную смесь фильтровали и фильтрат упаривали. Образовавшийся остаток вновь растворяли в 30 мл DCM, промывали насыщенным раствором бикарбоната натрия в воде, сушили над MgSO4 и упаривали, получая при этом 0,46 г (57%) промежуточного продукта тиомочевины, представляющего собой (3-диметиламинопропил)тиомочевину. Данные массспектрального анализа: m/z=162 (M+H). К 0,14 г промежуточного продукта K-1 в 40 мл этанола добавляли 0,063 г полученного выше промежуточного продукта тиомочевины. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение ночи и упаривали. Остаток очищали препаративной ВЭЖХ, получая при этом 0,06 г (56%) промежуточного продукта L-1, представляющего собой N-[(2R,3S)-3-амино-2 гидрокси-4-фенилбутил]-N-(2-метилпропил)-[4-[2-(3-диметиламинопропиламино)тиазол-4 ил]фенил]сульфонамид. Данные масс-спектрального анализа: m/z=560 (M+H). К 0,1 г промежуточного продукта K-4 в 2 мл этанола добавляли 13,7 мг метилтиомочевины. Реакционную смесь нагревали до температуры кипения с обратным холодильником в течение 1 ч и упаривали. Сырое соединение очищали препаративной ВЭЖХ, получая при этом 50 мг конечного соединения,представляющего собой [(1S,2R)-2-гидрокси-3-[N-[4-[2-(метиламино)тиазол-4-ил]фенилсульфонил]-NДанные масс(2-метилпропил)амино]-1-(фенилметил)пропил]-(2,6-диметилфенокси)ацетамид. спектрального анализа: m/z=651 (M+H).- 24009556 Пример 10. Синтез оксазолов - получение соединений формулы (L-2). К 0,2 г промежуточного продукта K-2 в 10 мл диметилформамида добавляли 0,26 г ацетамида. Реакционную смесь нагревали до 140 С в течение 2 ч. Затем растворитель выпаривали, сырое соединение очищали на силикагеле, производя элюирование 5% метанола в дихлорметане, и получали 0,09 (45%) промежуточного продукта L-2, представляющего собой [(1S,2R)-2-гидрокси-3-[N-[4-(2-метилоксазол-4 ил)фенилсульфонил]-N-(2-метилпропил)амино]-1-(фенилметил)пропил]ацетамид. Данные массспектрального анализа: m/z=500 (M+H). Пример 11. Получение соединений формулы (М-2). 0,09 г промежуточного продукта L-2 растворяли в 10 мл 5 н. раствора HCl в изопропаноле. Реакционную смесь нагревали при 70 С в течение ночи. Растворитель выпаривали, остаток вновь растворяли в 20 мл DCM и промывали 2% раствором карбоната натрия в воде. Органический слой сушили над MgSO4 и упаривали, получая при этом 0,05 г (62%) промежуточного продукта М-2, представляющего собой N[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-[4-(2-метилоксазол-4 ил)фенил]сульфонамид. Данные масс-спектрального анализа: m/z=458 (M+H). Пример 12. Синтез имидазолов - получение соединений формулы (L-1). К 0,100 г промежуточного продукта K-1 в 5 мл ДМФА добавляли 0,015 г ацетата калия. Смесь нагревали при 60 С в течение 2 дней и упаривали, получая при этом 98 мг (94%) целевого промежуточного продукта, представляющего собой 9-флуоренилметиловый эфир [(1S,2R)-3-[N-[4-(ацетилоксиацетил)фенилсульфонил]-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=699 (M+H). К 0,098 г полученного выше промежуточного продукта в 5 мл уксусной кислоты добавляли 0,043 г ацетата аммония. Смесь нагревали в течение ночи при 95 С, упаривали и очищали препаративной ВЭЖХ, получая при этом 0,015 г промежуточного продукта L-3, представляющего собой 9 флуоренилметиловый эфир [(1S,2R)-2-гидрокси-3-[N-[4-(2-метилимидазол-4-ил)фенилсульфонил]-N-(2 метилпропил)амино]-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=679 (M+H). К 0,215 г промежуточного продукта K-1 в 20 мл этанола добавляли 0,040 г 2-аминотиазола. Смесь нагревали при 90 С в течение ночи и упаривали, получая при этом 216 мг (100%) целевого промежуточного продукта, представляющего собой 9-флуоренилметиловый эфир [(1S,2R)-3-[N-[4-(имидазо[2,1b]тиазол-6-ил)фенилсульфонил]-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=721 (M+H).- 25009556 Пример 13. Получение соединений формулы (L-3). К 0,5 г промежуточного продукта K-3 в 50 мл ТГФ добавляли 0,075 г ацетилгуанидина. Смесь нагревали в течение ночи при температуре кипения с обратным холодильником, добавляли 0,15 г ацетилгуанидина и продолжали нагревать с обратным холодильником в течение 3 ч. Растворитель выпаривали и остаток растворяли в DCM, промывали водой, сушили над MgSO4 и упаривали. Сырое соединение очищали на силикагеле, производя элюирование 20% этилацетата в дихлорметане, и получали 0,2 г(45%) промежуточного продукта L-3, представляющего собой N-[(2R,3S)-3-(N',N'-дибензил)амино-2 гидрокси-4-фенилбутил]-N-(2-метилпропил)-4-[2-(ацетиламино)имидазол-4-ил]фенилсульфонамид. Данные масс-спектрального анализа: m/z=680 (M+H). Пример 14. Получение соединений формулы (М-3). К смеси 0,2 г промежуточного продукта L-3 в МеОН и ацетате калия добавляли 0,1 г 10% Pd/C. Смесь перемешивали в атмосфере H2 в течение ночи и добавляли еще 0,1 г 10% Pd/C. Реакционную смесь перемешивали в атмосфере Н 2 в течение ночи, фильтровали через целит и упаривали. Остаток вновь растворяли в DCM, промывали водой, сушили над MgSO4 и упаривали, получая при этом 0,05 г(33%) промежуточного продукта М-3, представляющего собой N-[(2R,3S)-3-амино-2-гидрокси-4 фенилбутил]-N-(2-метилпропил)-[4-(2-ацетиламиноимидазол-4-ил)фенил]сульфонамид. Данные массспектрального анализа: m/z=500 (М+Н). Пример 15. Получение соединений формулы (Е) - получение соединения 1 и соединения 36. К смеси 0,21 г промежуточного продукта М-1 в 25 мл DCM добавляли 0,248 г 1(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]оксикарбонилокси]-2,5-пирролидиндиона (полученного аналогично способу, описанному в заявке WO 9967417) и 0,048 г триэтиламина. Реакционную смесь перемешивали в течение ночи при комнатной температуре и упаривали. Сырое соединение очищали на силикагеле, производя элюирование 2% метанола в дихлорметане, и получали 0,19 г (68%) целевого конечного соединения, представляющего собой [(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-иловый] эфир К смеси 0,015 г 5-гидроксиметилтиазола в 5 мл DCM добавляли 0,034 г дисукцинимидилкарбоната и 0,018 мл триэтиламина. Смесь перемешивали при комнатной температуре в течение 2 ч, добавляли 0,050 г промежуточного продукта М-2 и перемешивали в течение ночи. Затем реакционную смесь разбавляли 5 мл DCM, промывали 2% раствором карбоната натрия в воде и насыщенным раствором соли,сушили над MgSO4 и упаривали. Сырое соединение очищали на силикагеле, производя элюирование 5% метанола в дихлорметане, и получали 0,026 г (36%) целевого конечного соединения, представляющего собой К смеси 13,44 г промежуточного продукта A (PG=Boc) в 400 мл DCM добавляли 8,08 г триэтиламина. Затем смесь охлаждали до 0 С и по каплям добавляли 8,87 г 4-цианобензолсульфонилхлорида, растворенного в 100 мл DCM. Смесь оставляли нагреваться до комнатной температуры, перемешивали в течение ночи и промывали водой. Органический слой сушили над MgSO4 и концентрировали, получая при этом 19,4 г (96%) целевого сульфонамида, представляющего собой 1,1-диметилэтиловый эфир К смеси 9 г полученного выше промежуточного продукта в 100 мл DCM при 0 С по каплям добавляли 20,5 г трифторуксусной кислоты. Смесь перемешивали в течение ночи при комнатной температуре,промывали насыщенным раствором карбоната натрия и насыщенным раствором соли, сушили надMgSO4 и концентрировали, получая при этом 6,4 г (88%) целевого амина, представляющего собой N[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-4-цианофенилсульфонамид (K-5). К смеси 6,4 г полученного выше промежуточного продукта в 100 мл DCM добавляли 4,75 г 1(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона (полученного аналогично способу, описанному в заявке WO 9967417) и 1,77 г триэтиламина. Реакционную смесь перемешивали в течение ночи при комнатной температуре и упаривали. Сырое соединение очищали на силикагеле, производя элюирование 30% этилацетата в дихлорметане, и получали 4,86 г (55%) целевого соединения, представляющего собой [(3R,3aR,6aR)гексагидрофуро[2,3-b]фуран-3-иловый] эфир [(1S,2R)3-[N-(4-цианофенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. К смеси 4,8 г полученного выше промежуточного продукта в 100 мл этанола добавляли 7,12 г карбоната калия и 2,98 г хлоргидрата гидроксиламина. Смесь нагревали с обратным холодильником в течение ночи и концентрировали. Остаток растворяли в этилацетате, промывали водой, сушили над MgSO4 и концентрировали, получая при этом 4,88 г (96%) целевого соединения, представляющего собой К смеси 0,5 г полученного выше промежуточного продукта в 10 мл пиридина добавляли 0,11 г 2 фураноилхлорида. Смесь нагревали с обратным холодильником в течение 4 ч и концентрировали. Остаток растворяли в этилацетате, промывали водой, сушили над MgSO4 и концентрировали, получая при этом 0,28 г (49%) целевого производного оксадиазола, представляющего собой [(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-иловый] эфир К смеси 12 г промежуточного продукта A (PG=Boc) в 300 мл DCM при 0 С добавляли 6 мл триэтиламина и 9,6 г 4-бромбензолсульфонилхлорида. Смесь перемешивали в течение 3 ч, промывали водой,сушили над MgSO4 и концентрировали, получая при этом 20 г (100%) целевого промежуточного продукта, представляющего собой 1,1-диметилэтиловый эфир [(1S,2R)-3-[N-(4-бромфенилсульфонил)-N-(2 метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные массспектрального анализа: m/z=556 (M+H). К смеси 10 г полученного выше промежуточного продукта в 150 мл DCM при 0 С добавляли 13,9 мл трифторуксусной кислоты. Смесь перемешивали в течение ночи и концентрировали. Остаток обрабатывали смесью DCM и насыщенного раствора карбоната натрия в воде. Органический слой отделяли, сушили над MgSO4 и концентрировали, получая при этом 6,8 г (85%) соединения с удаленной защитной группой, представляющего собой N-[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2 метилпропил)-4-бромфенилсульфонамид. Данные масс-спектрального анализа: m/z=456 (M+H). К смеси 6,8 г полученного выше промежуточного продукта в 300 мл DCM добавляли 4 г 1(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона (полученного аналогично способу, описанному в заявке WO 9967417) и 2,7 мл триэтиламина. Реакционную смесь перемешивали в течение ночи при комнатной температуре, промывали насыщенным раствором бикарбоната натрия в воде, сушили над MgSO4 и упаривали. Сырое соединение очищали на силикагеле, производя элюирование 2% метанола в дихлорметане, и получали 6 г (65%) целевого соединения, представляющего собой [(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-иловый]эфир [(1S,2R)-3-[N-(4-бромфенилсульфонил)-N-(2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=612 (M+H). К смеси 61 г полученного выше промежуточного продукта в 5 мл диоксана добавляли 41 мг 2 пиразинилтрибутилолова, 10 мг триэтиламина и 7 мг PdCl2 (dppf) CH2Cl2 (комплекс дихлорметана с дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладием(II. Реакционную смесь перемешивали в течение ночи при 85 С и упаривали. Сырую смесь очищали препаративной ВЭЖХ, получая при этом 4 мг целевого соединения, представляющего собой [(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-иловый]эфир[(1S,2R)-2-гидрокси-3-[N-(2-метилпропил)-N-[4-(пиразин-2-ил)фенилсульфонил]амино]-1(фенилметил)пропил]карбаминовой кислоты. Данные масс-спектрального анализа: m/z=611 (М+Н). Соединения, приведенные в нижеследующих таблицах, были получены одним из описанных выше способов. В приведенных ниже таблицах (табл. 1-6) в колонке "синтез" указан общий способ получения соединения.
МПК / Метки
МПК: C07D 233/88, A61P 31/18, C07D 277/42, C07D 417/14, C07D 513/04, C07D 233/54, C07D 493/04, C07D 263/32, A61K 31/4178, C07D 277/40, C07D 231/12
Метки: действия, сульфонамиды, фенилсодержащие, вич, замещённые, качестве, ингибиторов, гетероциклические, протеазы, спектра, широкого
Код ссылки
<a href="https://eas.patents.su/30-9556-geterociklicheskie-zameshhyonnye-fenilsoderzhashhie-sulfonamidy-shirokogo-spektra-dejjstviya-v-kachestve-ingibitorov-proteazy-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические замещённые фенилсодержащие сульфонамиды широкого спектра действия в качестве ингибиторов протеазы вич</a>
Предыдущий патент: Пептид, обладающий иммуномодулирующей активностью, и фармацевтическая композиция
Следующий патент: Синтетические соединения, пригодные в качестве агентов формирования клубеньков бобовых растений, и способы их получения
Случайный патент: Сульфоновые соединения в качестве лигандов 5-ht6 рецептора