Ингибиторы протеазы вич широкого спектра действия на основе сульфонамидов 2-(замещенных-амино) бензотиазолов
Номер патента: 6096
Опубликовано: 25.08.2005
Авторы: Вендевилль Сандрин, Де Керпел Ян Октаф Антон, Де Кок Херман Аугустинус, Сюрлеро Доминик Луи Нестор Гилейн, Гетмен Даниел, Морс Самюэль Лео Кристиан, Вигеринк Пит Том Берт Поль, Версхюэрен Вим Гастон, Вутс Марике Кристиан Йоханна, Де Бетюн Мари-Пьер
Формула / Реферат
1. Соединение, имеющее формулу (I)

и его N-оксиды, соли, стереоизомеры, рацемические смеси, пролекарства, эфиры и метаболиты, в которой
R1 и R8, каждый независимо, представляет атом водорода, C1-6алкил, C2-6алкенил, арилC1-6алкил, C3-7циклоалкил, C3-7циклоалкилC1-6алкил, арил, Het1, Het1C1-6алкил, Het2 или Het2C1-6алкил;
R1 также может быть радикалом формулы
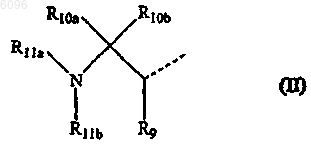
в которой
R9, R10a и R10b, каждый независимо, представляет атом водорода, C1-4алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4алкил)аминокарбонил, C3-7циклоалкил, C2-6алкенил, C2-6алкинил или C1-4алкил, необязательно замещенный арилом, Het1, Het2, C3-7циклоалкилом, C1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди(C1-4алкил)аминокарбонилом, аминосульфонилом, C1-4алкилS(O)t, гидрокси, циано, атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила; где R9, R10a и атомы углерода, с которыми они связаны, могут также образовать радикал C3-7циклоалкил; когда L представляет -O-C1-6 алкандиил-C (=O)- или -NR8-C1-6 алкандиил-C (=O)-, то тогда R9 может быть также оксо;
R11a представляет атом водорода, C2-6алкенил, C2-6алкинил, C3-7циклоалкил, арил, арилC1-4алкил, аминокарбонил, необязательно моно- или дизамещенный, аминоC1-4алкилкарбонилокси, необязательно моно- или дизамещенный, C1-4алкилоксикарбонил, арилоксикарбонил, Het1оксикарбонил, Het2оксикарбонил, арилоксикарбонилC1-4алкил, арилC1-4алкилоксикарбонил, C1-4алкилкарбонил, C3-7циклоалкилкабонил, C3-7циклоалкилC1-4алкилоксикарбонил, C3-7циклоалкилкарбонилокси, карбоксилC1-4алкилкарбонилокси, C1-4алкилкарбонилокси, арилC1-4алкилкарбонилокси, арилкарбонилокси, арилоксикарбонилокси, Het1карбонил, Het1карбонилокси, Het1C1-4алкилоксикарбонил, Het2карбонилокси, Het2C1-4алкилкарбонилокси, Het2C1-4алкилоксикарбонилокси или C1-4алкил, необязательно замещенный арилом, арилокси, Het2, атомом галогена или гидрокси; где каждый заместитель в аминогруппах независимо выбран из C1-4 алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1Cl-4алкила и Het2C1-4алкила;
R11b представляет атом водорода, C3-7циклоалкил, C2-6алкенил, C2-6алкинил, арил, C1-6алкилоксикарбонил, Het1, Het2 или C1-4алкил, необязательно замещенный атомом галогена, гидрокси, C1-4алкил S(=O)t, арилом, C3-7циклоалкилом, Het1, Het2, амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила;
где R11b может быть связан с остальной частью молекулы через сульфонильную группу;
каждый t независимо равен 0, 1 или 2;
R2 представляет атом водорода или C1-6алкил;
L представляет -C(=O)-, -O-C(=O)-, -NR8-C(=O)-, -O-C1-6алкандиил-C (=O)-, -NR8-C1-6алкандиил-C(=O)-, -S(=O)2-, -O-S(O=)2-, -NR8-S(=O)2, где группа C(=O) или группа S(=O)2 связана с NR2-группой; и где алкандиил необязательно замещен арилом, арилC1-4алкилом, C3-7циклоалкилом, C3-7циклоалкилC1-4алкилом, Het1, Het2, Het1C1-4алкилом и Het2C1-4алкилом;
R3 представляет C1-6алкил, арил, C3-7циклоалкил, C3-7циклоалкилC1-4алкил или арилC1-4алкил;
R4 представляет атом водорода, C1-4алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4алкил) аминокарбонил, C3-7циклоалкил, C2-6алкенил, C2-6алкинил или C1-6алкил, необязательно замещенный арилом, Het1, Het2, C3-7циклоалкилом, C1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди(C1-4алкил)аминокарбонилом, аминосульфонилом, C1-4алкилS(=O)t, гидрокси, циано, атомом галогена или амино, необязательно моно-или дизамещенным, где заместители выбраны из C1-4 алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила;
A представляет C1-6алкандиил, -C(=O)-, -C(=S)-, -S(=O)2-, C1-6алкандиил-C (=O)-, C1-6алкандиил-C (=S)- или C1-6алкандиил-S(=O)2-; где место связывания с атомом азота представляет C1-6алкандиил в группах, которые включают указанный радикал;
R5 представляет атом водорода, гидрокси, C1-6алкил, Het1C1-6алкил, Het2C1-6алкил, аминоC1-6алкил, где аминогруппа может быть необязательно моно- или дизамещенной C1-4алкилом;
R6 представляет C1-6алкилокси, Het1, Het1окси, Het2, Het2окси, арил, арилокси или амино; и в случае, когда -A- представляет другую группу, чем C1-6алкандиил, то тогда R6 может быть также C1-6алкилом, Het1C1-4алкилом, Het1оксиC1-4алкилом, Het2C1-4алкилом, Het2оксиCl-4алкилом, арилC1-4алкилом, арилоксиC1-4алкилом или аминоC1-4алкилом; где каждая из аминогрупп при определении R6 может быть необязательно замещена одним или более заместителями, выбранными из C1-4алкила, C1-4алкилкарбонила, C1-4 алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилC1-4алкила, Het1Cl-4 алкила или Het2C1-4алкила; и
R5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1 или Het2;
Het1 представляет насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, содержащий 3-14 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода C1-6алкилом, C1-6алкилокси, атомом галогена, гидрокси, оксо, необязательно моно- или дизамещенным амино, нитро, циано, галогенC1-6алкилом, карбоксилом, C1-6 алкоксикарбонилом, C3-7циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, необязательно моно- или дизамещенным аминоC1-6алкилом, метилтио, метилсульфонилом, арилом и насыщенным или частично ненасыщенным моноциклическим, бициклическим или трициклическим гетероциклом, содержащим 3-14 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и где необязательные заместители в любой аминогруппе независимо выбраны из C1-6алкила, C1-6алкилкарбонила, C1-6алкилокси-A-, Het1-A-, Het2C1-6алкила, Het2C1-6алкил-A-, Het2окси-A-, Het2оксиC1-4алкил-A-, арил-A-, арилокси-A-, арилоксиC1-4алкил-A-, арилC1-6алкил-A-, C1-6алкилоксикарбониламино-A-, амино-A-, аминоC1-6алкила и аминоC1-6алкил-A-, где каждая из аминогрупп необязательно может быть моно- или, где возможно, дизамещенной C1-4алкилом и где A имеет значения, определенные выше;
Het2 представляет ароматический моноциклический, бициклический или трициклический гетероцикл, содержащий 3-14 атомов в кольце, который включает один или более гетероатомов, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода с C1-6алкилом, C1-6алкилокси, атомом галогена, гидрокси, необязательно моно- или дизамещенным амино, нитро, циано, галогенC1-6алкилом, карбоксилом, C1-6алкоксикарбонилом, C3-7циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, необязательно моно- или дизамещенным аминоC1-6алкилом, метилтио, метилсульфонилом, арилом, Het1 и ароматическим моноциклическим, бициклическим или трициклическим гетероциклом, содержащим 3-14 атомов в кольце, и где необязательные заместители в любой аминогруппе независимо выбраны из C1-6алкила, C1-6алкилкарбонила, C1-6алкилокси-A-, Het1-A-, Het1C1-6алкила, Het1C1-6алкил-A-, Het1окси-A-, Het1оксиC1-4алкил-A-, арил-A-, арилокси-A-, арилоксиC1-4алкил-A-, арилC1-6алкил-A-, C1-6алкилоксикарбониламино-A-, амино-A-, аминоC1-6алкила и аминоC1-6алкил-A-, где каждая из аминогрупп необязательно может быть моно- или, где возможно, дизамещенной C1-4алкилом и где A имеет значения, определенные выше.
2. Соединение по п.1, в котором
R1 и R8, каждый независимо, представляет атом водорода, C1-6алкил, C2-6алкенил,арилC1-6алкил, C3-7циклоалкил, C3-7циклоалкилC1-6алкил, арил, Het1, Het1C1-6алкил, Het2 или Het2C1-6алкил;
R1 также может быть радикалом формулы
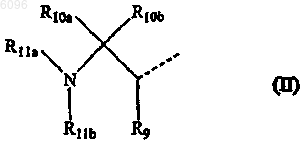
в которой
R9, R10a и R10b, каждый независимо, представляет атом водорода, C1-4алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4алкил) аминокарбонил, C3-7циклоалкил, C2-6алкенил, C2-6алкинил или C1-4алкил, необязательно замещенный арилом, Het1, Het2, C3-7циклоалкилом, C1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди(C1-4алкил)аминокарбонилом, аминосульфонилом, C1-4алкилS(O)t, гидрокси, циано, атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила, арила, арил C1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила; где R9, R10a и атомы углерода, с которыми они связаны, могут также образовать радикал C3-7циклоалкил;
R11a представляет атом водорода, C2-6алкенил, C2-6алкинил, C3-7циклоалкил, арил, аминокарбонил, необязательно моно- или дизамещенный, аминоC1-4алкилкарбонилокси, необязательно моно- или дизамещенный, C1-4алкилоксикарбонил, арилоксикарбонил, Het1оксикарбонил, Het2оксикарбонил, арилоксикарбонилC1-4алкил, арилC1-4алкилоксикарбонил, C1-4алкилкарбонил, C3-7циклоалкилкарбонил, C3-7циклоалкилC1-4алкилоксикарбонил, C3-7циклоалкилкарбонилокси, карбоксилC1-4алкилкарбонилокси, C1-4алкилкарбонилокси, арилC1-4алкилкарбонилокси, арилкарбонилокси, арилоксикарбонилокси, Het1карбонил, Het1карбонилокси, Het1C1-4алкилоксикарбонил, Het2карбонилокси, Het2C1-4алкилкарбонилокси, Het2C1-4алкилоксикарбонилокси или C1-4алкил, необязательно замещенный арилом, арилокси, Het2 или гидрокси; где каждый заместитель в аминогруппах независимо выбран из C1-4алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила;
R11b представляет атом водорода, C3-7циклоалкил, C2-6алкенил, C2-6алкинил, арил, Het1, Het2 или C1-4 алкил, необязательно замещенный атомом галогена, гидрокси, C1-4алкилS(=O)t, арилом, C3-7циклоалкилом, Het1, Het2, амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила;
где R11b может быть связан с остальной частью молекулы через сульфонильную группу;
каждый t независимо равен 0, 1 или 2;
R2 представляет атом водорода или C1-6алкил;
L представляет -C(=O)-, -O-C(=O)-, -NR8-C(=O)-, -O-C1-6алкандиил-C (=O)-, -NR8-C1-6алкандиил-C (=O) -, -S(=O)2-, -O-S(O=)2-, -NR8-S(=O)2, где группа C(=O) или группа S(=O)2 связана с NR2-группой;
R3 представляет C1-6алкил, арил, C3-7циклоалкил, C3-7циклоалкилC1-4алкил или арилC1-4алкил;
R4 представляет атом водорода, C1-4алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(C1-4алкил)аминокарбонил, C3-7циклоалкил, C2-6алкенил, C2-6алкинил или C1-6алкил, необязательно замещенный арилом, Het1, Het2, C3-7циклоалкилом, C1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди (C1-4алкил) аминокарбонилом, аминосульфонилом, C1-4алкилS(=O)t, гидрокси, циано, атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила, арила, арилC1-4алкила, C3-7циклоалкила, C3-7циклоалкилC1-4алкила, Het1, Het2, Het1C1-4алкила и Het2C1-4алкила;
A представляет C1-6алкандиил, -C(=O)-, -C(=S)-, -S(=O)2-, C1-6алкандиил-C (=O)-, C1-6алкандиил-C (=S)- или C1-6алкандиил-S(=O)2-; где место связывания с атомом азота представляет C1-6алкандииы т группах, которые включают указанный радикал;
R5 представляет атом водорода, гидрокси, C1-6алкил, Het1C1-6алкил, Het2C1-6алкил, аминоC1-6алкил, где аминогруппа может быть необязательно моно- или дизамещенной C1-4алкилом;
R6 представляет C1-6алкилокси, Het1, Het1окси, Het2, Het2окси, арил, арилокси или амино; и в случае когда -A- представляет другую группу, чем C1-6алкандиил, то тогда R6 может быть также C1-6алкилом, Het1C1-4алкилом, Het1оксиC1-4алкилом, Het2C1-4алкилом, Het2оксиC1-4алкилом, арилC1-4алкилом, арилоксиC1-4алкилом или аминоC1-4алкилом; где каждая из аминогрупп при определении R6 может быть необязательно замещена одним или более заместителями, выбранными из C1-4алкила, C1-4алкилкарбонила, C1-4 алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилC1-4алкила, Het1C1-4 алкила или Het2C1-4алкила; и
R5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1 или Het2.
3. Соединение по одному из п.1 или 2, в котором R1 представляет атом водорода, C1-6алкил, C2-6 алкенил, арилC1-6алкил, C3-7циклоалкил, C3-7циклоалкилC1-6алкил, арил, Het1, Het1C1-6алкил, Het2, Het2C1-6 алкил; где Het1 представляет насыщенный или частично насыщенный моноциклический гетероцикл, содержащий 5 или 6 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода.
4. Соединение по одному из пп.1-3, в котором L представляет -O-C1-6алкандиил-C(=O)-.
5. Соединение по одному из пп.1-3, в котором L представляет -O-C(=O)-.
6. Соединение по одному из пп.1-3, в котором L представляет -NR8-C1-6алкандиил-C(=O)-, где алкандиил необязательно замещен арилом, арилC1-4алкилом, Het1, Het2, Het1C1-4алкилом и Het2C1-4алкилом.
7. Соединение по одному из пп.1-6, в котором R1 представляет Het1, Het1C1-6алкил, Het2 или Het2C1-6 алкил.
8. Соединение по п.7, в котором R1 представляет Het1 или Het2.
9. Соединение по п.8, в котором R1 представляет Het1.
10. Соединение по п.9, в котором R1 представляет гексагидрофуро[2,3-b]фуранил.
11. Соединение по п.10, в котором R1 представляет тетрагидрофуранил.
12. Соединение по одному из пп.1-6, в котором L представляет -O-C1-6алкандиил-C(=O)- или -NR8-C1-6алкандиил-C(=O)- и R1 представляет радикал формулы
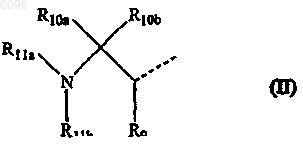
в которой
R9 представляет оксо,
R10a и R10b, каждый независимо, представляет атом водорода или C1-4алкил, необязательно замещенный арилом, Het1, Het2, C1-4алкилоксикарбонилом, карбоксилом, аминокарбонилом, гидрокси или амино, необязательно моно- или дизамещенным, где заместители выбраны из C1-4алкила,
R11a представляет арилC1-4алкил или C1-4алкил, необязательно замещенный арилом или атомом галогена и
R11b представляет атом водорода или C1-6алкилоксикарбонил.
13. Соединение по п.12, в котором L представляет -O-C1-6алкандиил-C(=O)- или -NR8-C1-6алкандиил-C(=O)- и R1 представляет радикал формулы
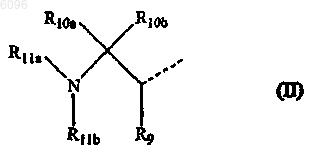
в которой
R9 представляет оксо,
R10a и R10b представляют атом водорода,
R11a представляет арилC1-4алкил, в котором арил замещен атомом галогена, и
R11b представляет атом водорода или C1-6алкилоксикарбонил.
14. Соединение по п.13, в котором L представляет -O-C1-6алкандиил-C(=O)- или -NR8-C1-6алкандиил-C(=O)- и R1 представляет радикал формулы
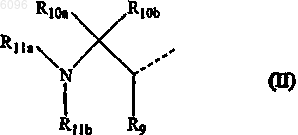
в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил и R11b представляет атом водорода или C1-6алкилоксикарбонил.
15. Соединение по п.14, в котором L представляет -O-C1-6алкандиил-C(=O)- или -NR8-C1-6 алкандиил-C(=O)- и R1 представляет радикал формулы
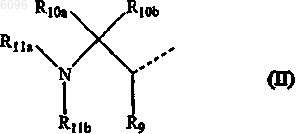
в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил и R11b представляет атом водорода.
16. Соединение по п.14, в котором L представляет -O-C1-6алкандиил-C (=O)- или -NR8-C1-6алкандиил-C(=O)- и R1 представляет радикал формулы
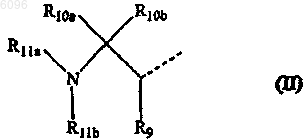
в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил, и R11b представляет трет-бутилоксикарбонил.
17. Соединение по одному из пп.1-16, в котором R3 представляет арилC1-4алкил.
18. Соединение по п.17, в котором R3 представляет арилCH2-.
19. Соединение по п.18, в котором R3 представляет бензил.
20. Соединение по одному из пп.1-19, в котором R4 представляет C1-6алкил.
21. Соединение по п.20, в котором R4 представляет бутил.
22. Соединение по п.21, в котором R4 представляет изобутил.
23. Соединение по одному из пп.1-22, в котором A представляет C1-6алкандиил, -C(=O)- или C1-6алкандиил-C (=O)-; где место связывания с атомом азота представляет C1-6алкандиил в группах, которые включают указанный радикал;
R5 представляет атом водорода, C1-6алкил, Het1C1-6алкил, Het2C1-6алкил, аминоC1-6алкил, где аминогруппа может быть необязательно моно- или дизамещенной C1-4алкилом; и
в случае когда -A- представляет -C(=O)-, то тогда R6 представляет C1-6алкилокси, Het1, Het1окси или Het2окси, арил, Het1C1-4алкил, Het1оксиC1-4алкил, Het2C1-4алкил, Het2оксиC1-4алкил, арилC1-4алкил, арилоксиC1-4алкил или аминоC1-4алкил; и
в случае когда -A- представляет C1-6алкандиил, то тогда R6 представляет амино, C1-6алкилокси, Het1, Het1окси или Het2окси; и
в случае когда -A- представляет C1-6алкандиил-C(=O)-, то тогда R6 представляет C1-6алкилокси, Het1, Het1окси или Het2окси, арил, C1-6алкил, Het1C1-4алкил, Het1оксиC1-4алкил, Het2C1-4алкил, Het2оксиC1-4алкил, арилC1-4алкшы, арилоксиC1-4алкил или аминоC1-4 алкил;
где каждая из аминогрупп при определении R6 может быть необязательно замещенной одним или более заместителями, выбранными из C1-4алкила, C1-4алкилкарбонила,
C1-4алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилC1-4алкила, Het1C1-4алкила или Het2C1-4алкила; и
R5 и -A-R6-, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1, где Het1 замещен по меньшей мере одной оксогруппой.
24. Соединение по п.23, в котором R5 представляет атом водорода или C1-6алкил.
25. Соединение по п.24, в котором R5 представляет атом водорода.
26. Соединение по п.24, в котором R5 представляет метил или этил.
27. Соединение по п.26, в котором R5 представляет метил.
28. Соединение по п.23, в котором A представляет C1-6алкандиил.
29. Соединение по п.28, в котором A представляет этилендиил.
30. Соединение по одному из пп.1-29, в котором R6 представляет Het1.
31. Соединение по п.30, в котором R6 представляет Het1C1-4алкил.
32. Соединение по п.30, в котором R6 представляет пирролидинил или пирролидинилC1-4алкил.
33. Соединение по п.32, в котором R6 представляет пирролидинилэтил.
34. Соединение по одному из пп.1-29, в котором R6 представляет амино; где каждая из аминогрупп может быть необязательно замещенной одним или более заместителями, выбранными из C1-4алкила, C1-4алкилкарбонила, C1-4алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилC1-4алкила, Het1C1-4алкила или Het2C1-4алкила.
35. Соединение по п.34, в котором R6 представляет амино; где каждая из аминогрупп замещена двумя заместителями, выбранными из C1-4алкила.
36. Соединение по п.35, в котором R6 представляет диметиламино.
37. Соединение по п.1, имеющее формулу
гексагидрофуро[2,3-b]фуран-3-иловый эфир (1-бензил-3-{[2-(2-диметиламиноэтиламино)бензотиазол-6-сульфонил]изобутиламино}-2-гидроксипропил)карбаминовой кислоты,
тетрагидрофуран-3-иловый эфир (1-бензил-3-{[2-(2-диметиламиноэтиламино)бензотиазол-6-сульфонил]изобутиламино}-2-гидроксипропил)карбаминовой кислоты,
гексагидрофуро[2,3-b]фуран-3-иловый эфир (1-бензил-2-гидрокси-3-{изобутил-[2-(2-пирролидин-1-илэтиламино)бензотиазол-6-сульфонил]амино}пропил)карбаминовой кислоты,
гексагидрофуро[2,3-b]фуран-3-иловый эфир [1-бензил-3-({2-[(3-диметиламинопропил)метиламино] бензотиазол-6-сульфонил}изобутиламино)-2-гидроксипропил]карбаминовой кислоты,
гексагидрофуро[2,3-b]фуран-3-иловый эфир [1-бензил-3-({2-[(1-этилпирролидин-2-илметил)амино] бензотиазол-6-сульфонил}изобутиламино)-2-гидроксипропил]карбаминовой кислоты.
38. Способ получения соединения по п.1 по схеме G
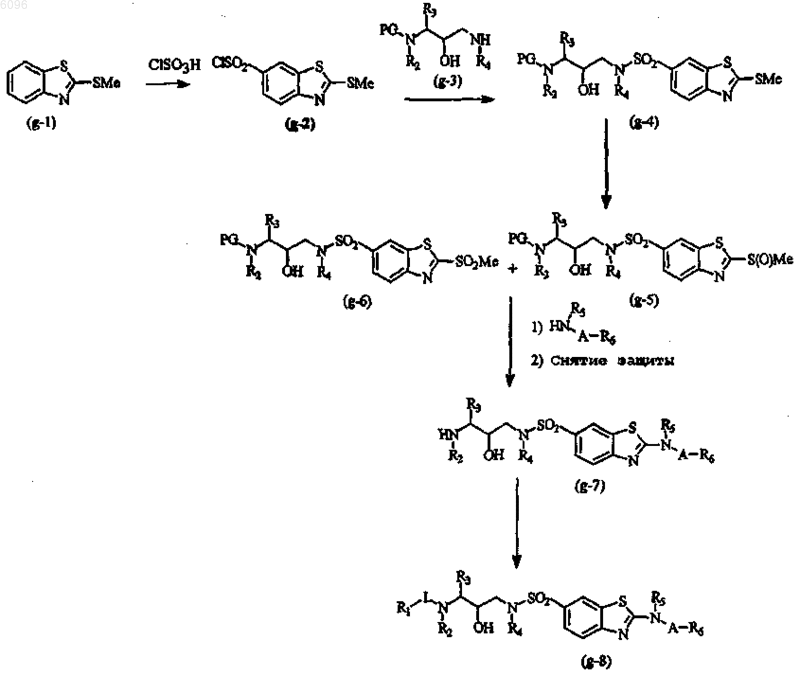
включающий стадии
a) взаимодействия производного бензотиазола g-1 с хлорсульфоновой кислотой и затем с тионилхлоридом с получением промежуточного соединения g-2,
b) взаимодействия указанного промежуточного соединения g-2 с промежуточным соединением g-3 с получением промежуточного соединения g-4, в котором PG является защитной группой,
c) превращения промежуточного соединения g-4 в промежуточные соединения g-5 и g-6,
d) функционализации промежуточных соединений g-5 и g-6 соединением формулы HN(R5)A-R6 и последующего получения промежуточного соединения g-7 со снятой защитой,
e) взаимодействия промежуточного соединения g-7 с промежуточным соединением формулы R1-L-(уходящая группа) с получением соединения g-8.
39. Способ по п.38, в котором защитной группой является Boc.
40. Способ по одному из пп.38 или 39, в котором стадию (c) проводят с подходящим реагентом, выбранным из группы, включающей метахлорпероксибензойную кислоту или гексагидрат монопероксифталата магния.
41. Фармацевтическая композиция, содержащая эффективное количество по меньшей мере одного соединения по одному из пп.1-37 и фармацевтически переносимый наполнитель.
42. Способ ингибирования протеазы ретровируса с множественной лекарственной устойчивостью у млекопитающего, зараженного указанным ретровирусом, включающий введение ингибирующего протеазу количества соединения по одному из пп.1-37 указанному млекопитающему, в случае его необходимости.
43. Способ лечения или борьбы с инфекцией или заболеванием, связанным с инфицированием ретровирусом с множественной лекарственной устойчивостью, у млекопитающего, включающий введение эффективного количества по меньшей мере одного соединения по одному из пп.1-37 указанному млекопитающему.
44. Способ подавления репликации ретровируса с множественной лекарственной устойчивостью у млекопитающего, включающий контактирование ретровируса с эффективным количеством по меньшей мере одного соединения по одному из пп.1-37.
45. Способ по пп.42, 43 и 44, в котором ретровирус представляет вирус иммунодефицита человека (ВИЧ).
46. Применение соединения по одному из пп.1-37 при производстве лекарственного препарата для лечения или борьбы с инфекцией или заболеванием, связанным с инфицированием ретровирусом с множественной лекарственной устойчивостью, у млекопитающего.
47. Применение соединения по одному из пп.1-37 при производстве лекарственного препарата для ингибирования протеазы ретровируса с множественной лекарственной устойчивостью у млекопитающего, зараженного указанным ретровирусом.
48. Применение соединения по одному из пп.1-37 при производстве лекарственного препарата для подавления репликации ретровируса с множественной лекарственной устойчивостью.
49. Применение по одному из пп.46-48, в котором ретровирус представляет вирус иммунодефицита человека (ВИЧ).
50. Соединение по п.1, где соединение представляет собой гексагидрофуро[2,3-b]фуран-3-иловый эфир (1-бензил-2-гидрокси-3-{изобутил-[2-(2-пирролидин-1-илэтиламино)бензотиазол-6-сульфонил]амино}пропил)карбаминовой кислоты;
гексагидрофуро[2,3-b]фуран-3-иловый эфир [1-бензил-3-({2-[(3-диметиламинопропил)метиламино]бензотиазол-6-сульфонил}изобутиламино)-2-гидроксипропил]карбаминовой кислоты и
тетрагидрофуран-3-иловый эфир (1-бензил-3-{[2-(2-диметиламиноэтиламино)бензотиазол-6-сульфонил]изобутиламино}-2-гидроксипропил)карбаминовой кислоты.
Текст
006096 Настоящее изобретение относится к сульфонамидам 2-(замещенныхамино)бензотиазолов, их применению в качестве ингибиторов аспарагиновой протеазы, в частности, ингибиторов протеазы ВИЧ широкого спектра действия, способам их получения, а также фармацевтическим композициям и диагностическим наборам, включающим их. Также настоящее изобретение касается комбинаций настоящих сульфонамидов 2-(замещенныхамино)бензотиазолов с другими противоретровирусными средствами. Кроме того, оно относится к их применению в аналитических тестах в качестве стандартов или реагентов. Вирус, вызывающий синдром приобретенного иммунодефицита (СПИД), известен под несколькими названиями, включая Т-лимфоцитарный вирус III (HTLV-III) или связанный с лимоденопатией вирус(LAV) и СПИД-ассоциированный вирус (ARV), или вирус иммунодефицита человека. К настоящему времени установлено наличие двух различных семейств, т.е. ВИЧ-1 и ВИЧ-2. В последующем ВИЧ будет использоваться в общем для обозначения этих вирусов. Одним из критических путей жизненного цикла ретровирусов является процессинг предшественников полипротеинов под действием аспарагиновой протеазы. Например, белок gag-pol вируса ВИЧ подвергается процессингу под действием протеазы ВИЧ. Правильный процессинг предшественников полипротеинов под действием аспарагиновой протеазы необходим для сборки инфекционных вирионов, что таким образом делает аспарагиновую протеазу привлекательной мишенью для противовирусной терапии. В частности, протеаза ВИЧ представляет привлекательную мишень при лечении ВИЧ. Ингибиторы протеазы ВИЧ (PI) обычно вводят больным СПИДом в сочетании с другими средствами против ВИЧ, например, такими, как ингибиторы нуклеозидной обратной транскриптазы (NRTI), ингибиторы ненуклеозидной обратной транскриптазы (NNRTI) или другие ингибиторы протеазы. Несмотря на то, что эти противоретровирусные препараты являются очень полезными, они имеют общее ограничение, а именно, ферменты-мишени у вируса ВИЧ способны подвергаться мутациям таким образом, что известные лекарственные препараты становятся менее эффективными или даже неэффективными против данных мутантных вирусов ВИЧ. Другими словами, у вируса ВИЧ возникает всевозрастающая резистентность к выпускаемым препаратам. Возникновение резистентности у ретровирусов и, в частности, вируса ВИЧ, к ингибиторам является основной причиной отсутствия эффективности при лечении. Например, половина пациентов, получавших комбинированную терапию против ВИЧ, не реагировали в полной мере на лечение в основном в результате наличия резистентности вируса к одному или более использованным препаратам. Кроме того,было показано, что резистентные вирусы передаются вновь заразившимся индивидуумам, приводя к резкому ограничению выбора для лечения данных пациентов. Следовательно, в данной области имеется потребность в новых препаратах для лечения инфекций, вызванных ретровирусами, конкретнее, для лечения СПИДа. В данной области имеется особо острая потребность в соединениях, которые проявляют активность не только в отношении вируса ВИЧ дикого типа, но также более распространенных в настоящее время резистентных вирусов ВИЧ. Как указывалось выше, известные противоретровирусные препараты, часто вводимые по комбинированной схеме лечения, в конечном счете, будут вызывать резистентность. Часто это приводит к необходимости для врача повышать концентрацию активных препаратов в плазме крови для того, чтобы указанные противоретровирусные препараты проявляли эффективность против мутантных вирусов ВИЧ. Следствием этого является высокое нежелательное увеличение лекарственной нагрузки. Увеличение концентрации препаратов в плазме крови также может привести к повышенному риску отказа от назначенного лечения. Таким образом, важно не только иметь соединения, проявляющие активность в отношении широкого ряда мутантов ВИЧ, но также при этом важно, чтобы имелось незначительное или отсутствовало вовсе различие между активностью против мутантных вирусов ВИЧ и активностью против вируса ВИЧ дикого типа (также определяемая, как относительная резистентность или FR) в отношении широкого ряда мутантных штаммов ВИЧ. При этом пациент может оставаться на той же схеме комбинированного лечения в течение длительного периода времени, поскольку шанс того, что мутантный вирус ВИЧ будет чувствительным к активным компонентам, будет повышаться. Поиск соединений с высокой активностью в отношении вируса дикого типа и широкого ряда мутантов имеет также значение и потому, что можно снизить лекарственную нагрузку, если терапевтические концентрации поддерживаются на минимальном уровне. Одним путем снижения лекарственной нагрузки является поиск соединений против ВИЧ с хорошей биодоступностью, т.е. благоприятным фармакокинетическим и метаболическим профилем так, чтобы в результате можно было бы свести до минимума суточную дозу и, следовательно, количество пилюль для приема. Другой важной характеристикой хорошего противоретровирусного препарата является то, чтобы связывание ингибитора с белками плазмы крови оказывало минимальные или вовсе не оказывало воздействия на его активность. Таким образом, в медицине имеется острая потребность в ингибиторах протеазы, с помощью которых можно было бы бороться с мутантами вируса ВИЧ широкого спектра с небольшим различием в относительной резистентности, которые обладают высокой биодоступностью, и на эффективность которых оказывает незначительное влияние, или оно отсутствует вовсе, связывание с белками плазмы крови.-1 006096 К настоящему времени на рынке имеется или находится на стадии разработки несколько ингибиторов протеазы. Одна основная структура (представлена ниже) раскрыта в ряде источников таких, как заявки WO 95/06030, WO 96/22287, WO 96/28418, WO 96/28463, WO 96/28464, WO 96/28465 и WO 97/18205. Раскрытые там соединения описаны в качестве ингибиторов протеазы ретровирусов. В заявке WO 99/67254 раскрываются 4-замещенные-фенилсульфонамиды, способные ингибировать протеазы ретровирусов с множественной лекарственной устойчивостью. Неожиданно было установлено, что сульфонамиды 2-(замещенных-амино)бензотиазолов по настоящему изобретению обладают хорошей фармакологической активностью и фармакокинетическим профилем. Они активны не только против вируса ВИЧ дикого типа, но также они проявляют активность широкого спектра против различных мутантных вирусов ВИЧ, обладающих резистентностью к известным ингибиторам протеаз. Несмотря на то, что настоящие сульфонамиды 2-(замещенных-амино) бензотиазолов попадают в общее описание в некоторых из вышеприведенных патентных публикаций, специально они не раскрывались, не предлагались или не заявлялись там, кроме того, специалисты в данной области не предполагали использовать их в качестве ингибиторов протеазы широкого спектра действия. Настоящее изобретение относится к ингибиторам протеазы на основе 2-(замещенных-амино)бензотиазолов, имеющих формулуR1 также может быть радикалом формулыR9, R10a и R10b, каждый независимо, представляет атом водорода, С 1-4 алкилоксикарбонил, карбоксил,аминокарбонил, моно- или ди (С 1-4 алкил) аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или С 1-4 алкил, необязательно замещенный арилом, Het1, Het2, С 3-7 циклоалкилом, С 1-4 алкилоксикарбонилом,карбоксилом, аминокарбонилом, моно- или ди(С 1-4 алкил)аминокарбонилом, аминосульфонилом, С 1-4 алкилS(О)t, гидрокси, циано, атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила,Het1, Het2, Неt1 С 1-4 алкила и Het2Cl-4aлкилa; где R9 и R10a и атомы углерода, с которыми они связаны, могут также образовать радикал С 3-7 циклоалкил; когда L представляет -O-C1-6 алкандиил-С (=O) - или -NR8-C1-6 алкандиил-С (=O)-, то тогда R9 может быть также оксо;aлкилкapбoнилoкcи, Het2Cl-4aлкилoкcикapбoнилoкcи или С 1-4 алкил, необязательно замещенный арилом,арилокси, Het2, атомом галогена или гидрокси; где каждый заместитель в аминогруппах независимо выбран из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1, Het2, Het1Cl-4R11b представляет атом водорода, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, арил, C1-6 алкилоксикарбонил, Het1, Het2 или С 1-4 алкил, необязательно замещенный атомом галогена, гидрокси, С 1-4 алкилS(=O)t, арилом, С 3-7 циклоалкилом, Het1, Het2, амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1,Het2, Неt1 С 1-4 алкила и Het2Cl-4aлкилa; где R11b может быть связан с остальной частью молекулы через сульфонильную группу; каждый t независимо равен 0, 1 или 2;R2 представляет атом водорода или C1-6 алкил;(=O)-, -S(=O)2-, -O-S(O=)2-, -NR8-S(=O)2, где группа С(=O) или группа S(=O)2 связана с NR2-группой; и где алкандиил необязательно замещен арилом, арилС 1-4 алкилом, С 3-7 циклоалкилом, С 3-7 циклоалкилС 1-4 алкилом, Het1, Het2, Неt1 С 1-4 алкилом и Het2C1-4 алкилом;R3 представляет C1-6 алкил, арил, С 3-7 циклоалкил, С 3-7 циклоалкилС 1-4 алкил или арилС 1-4 алкил;(С 1-4 алкил)аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или C1-6 алкил, необязательно замещенный арилом, Het1, Het2, С 3-7 циклоалкилом, С 1-4 алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди (С 1-4 алкил) аминокарбонилом, аминосульфонилом, С 1-4 алкилS(=O)t, гидрокси, циано,атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1, Het2, Het1C1-4aлкилa и Неt2 С 1-4 алкила; А представляет C1-6 алкандиил, -С(=O)-, -C(=S)-, -S(=O)2-, C1-6 алкандиил-С (=O)-, C1-6 алкандиил-С(=S)- или C1-6 алкандиил-S(=O)2-; где место связывания с атомом азота представляет С 1-6 алкандиил в группах, которые включают указанный радикал;R5 представляет атом водорода, гидрокси, C1-6 алкил, Неt1 С 1-6 алкил, Het2C1-6aлкил, аминоС 1-6 алкил,где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом;R6 представляет C1-6 алкилокси, Het1, Het1 окси, Het2, Het2 окси, арил, арилокси или амино; и в случае когда -А- представляет другую группу, чем C1-6 алкандиил, то тогда R6 может быть также C1-6 алкилом,Неt1C1-4 алкилом, Неt1 оксиС 1-4 алкилом, Het2Cl-4aлкилoм, Het2oкcиC1-4aлкилoм, арилС 1-4 алкилом, арилоксиС 1-4 алкилом или аминоС 1-4 алкилом; где каждая из аминогрупп при определении R6 может быть необязательно замещена одним или более заместителями, выбранными из С 1-4 алкила, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилС 1-4 алкила, Неt1C1-4 алкила или Неt2C1-4 алкила; иR5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1 или 2Het . Одно воплощение настоящего изобретения относится к ингибиторам протеазы на основе 2(замещенных-амино)бензотиазолов формулы (I), их N-оксидам, солям, стереоизомерам, рацемическим смесям, пролекарствам, эфирам и метаболитам, в которой:R1 и R8 каждый независимо представляет атом водорода, C1-6 алкил, С 2-6 алкенил, арилС 1-4 алкил, С 3-7 циклоалкил, С 3-7 циклоалкилС 1-6 алкил, арил, Het1, Неt1C1-4 алкил, Het2 или Het2C1-6 алкил.R1 также может быть радикалом формулыR9, R10a и R10b, каждый независимо, представляет атом водорода, С 1-4 алкилоксикарбонил, карбоксил,аминокарбонил, моно- или ди(С 1-4 алкил)аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или С 1-4 алкил, необязательно замещенный арилом, Het1, Het2, С 3-7 циклоалкилом, С 1-4 алкилоксикарбонилом,карбоксилом, аминокарбонилом, моно- или ди(С 1-4 алкил)аминокарбонилом, аминосульфонилом, С 1-4 алкилS(=O)t, гидрокси, циано, атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила,Het1, Het2, Het1Cl-4aлкилa и Het2Cl-4aлкилa; где R9, R10a и атомы углерода, с которыми они связаны, могут также образовать радикал С 3-7 циклоалкил;R11a представляет атом водорода, С 2-6 алкенил, С 2-6 алкинил, С 3-7 циклоалкил, арил, аминокарбонил,необязательно моно- или дизамещенный, аминоС 1-4 алкилкарбонилокси, необязательно моно- или дизамещенный, С 1-4 алкилоксикарбонил, арилоксикарбонил, Het1oкcикapбoнил, Неt2 оксикарбонил, арилокси-3 006096 карбонилС 1-4 алкил, арилС 1-4 алкилоксикарбонил, С 1-4 алкилкарбонил, С 3-7 циклоалкилкарбонил, С 3-7 циклоалкилС 1-4 алкилоксикарбонил, С 3-7 циклоалкилкарбонилокси, карбоксилС 1-4 алкилкарбонилокси, С 1-4 алкилкарбонилокси, арилС 1-4 алкилкарбонилокси, арилкарбонилокси, арилоксикарбонилокси, Неt1 карбонил,Het1 кapбoнилoкcи, Het1Cl-4aлкилoкcикapбoнил, Неt2 карбонилокси, Het2Cl-4aлкилкapбoнилoкcи, Het2Cl2 4aлкилoкcикapбoнилoкcи или С 1-4 алкил, необязательно замещенный арилом, арилокси, Het или гидрокси; где каждый заместитель в аминогруппах независимо выбран из С 1-4 алкила, арила, арилС 1-4 алкила,С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1, Het2, Неt1 С 1-4 алкила и Het2Cl-4aлкилa;R11b представляет атом водорода, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, арил, Het1, Het2 или С 1-4 алкил, необязательно замещенный атомом галогена, гидрокси, С 1-4 алкилS(=O)t, арилом, С 3-7 циклоалкилом, Het1, Het2, амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила,арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1, Het2, НеtC1-4 алкила и Het2Cl-4aлкилa; где R11b может быть связан с остальной частью молекулы посредством сульфонильной группы; каждый t независимо равен 0, 1 или 2;R2 представляет атом водорода или C1-6 алкил;R3 представляет С 1-6 алкил, арил, С 3-7 циклоалкил, С 3-7 циклоалкилС 1-4 алкил или арил С 1-4 алкил;R4 представляет атом водорода, С 1-4 алкилоксикарбонил, карбоксил, аминокарбонил, моно- или ди(С 1-4 алкил)аминокарбонил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил или С 1-4 алкил, необязательно замещенный арилом, Het1, Het2, С 3-7 циклоалкилом, С 1-4 алкилоксикарбонилом, карбоксилом, аминокарбонилом, моно- или ди (С 1-4 алкил)аминокарбонилом, аминосульфонилом, С 1-4 алкилS(=O)t, гидрокси, циано,атомом галогена или амино, необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила, арила, арилС 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкилС 1-4 алкила, Het1, Het2, Неt1C1-4 алкила и Неt2 С 1-4 алкила; А представляет С 1-6 алкандиил, -С(=O)-, -C(=S)-, -S(=O)2-, С 1-6 алкандиил-С (=O)-, С 1-6 алкандиил-С(=S)- или С 1-6 алкандиил-S(=O)2-; где место связывания с атомом азота представляет С 1-6 алкандиил в группах, которые включают указанный радикал;R5 представляет атом водорода, гидрокси, С 1-6 алкил, Het1C1-6aлкил, Het2C1-6aлкил, аминоС 1-6 алкил,где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом;R6 представляет С 1-6 алкилокси, Het1, Het1 окси, Het2, Het2 окси, арил, арилокси или амино; и в случае,когда -А- представляет другую группу, чем С 1-6 алкандиил, то тогда R6 может быть также С 1-6 алкилом,Неt1 С 1-4 алкилом, Het1oкcиCl-4aлкилoм, Неt2 С 1-4 алкилом, Het2oкcиC1-4aлкилoм, арилС 1-4 алкилом, арилоксиС 1-4 алкилом или аминоС 1-4 алкилом; где каждая из аминогрупп при определении R6 может быть необязательно замещена одним или более заместителями, выбранными из С 1-4 алкила, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, арила, арилкарбонила, арилоксикарбонила, Het1, Het2, арилС 1-4 алкила, Het1C1-4R5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1 или 2Het . Изобретение также включает кватернизацию атомов азота настоящих соединений. Основный атом азота может быть кватернизован любым агентом, известным специалистам в данной области, включая,например, низшие алкилгалогениды, диалкилсульфаты, галогениды и аралкилгалогениды с длинной цепью. Там, где при определении соединений формулы (I) используется термин замещенный, он предназначен для указания того, что один или более атомов водорода у атома, указанного в выражении замещенный, замещен при выборе из указанной группы при условии, что не превышается обычная валентность атома, и что замещение приводит к получению химически стабильного соединения, т.е. соединения, которое в достаточной мере устойчиво для выделения из реакционной смеси до подходящей степени чистоты и включения в терапевтическое средство. В том смысле, в котором он здесь используется, термин галоген, в виде группы или части группы,означает атомы фтора, хлора, брома или йода. Термин С 1-4 алкил, в виде группы или части группы, означает насыщенные углеводородные радикалы с нормальной или разветвленной цепью, содержащие 1-4 атомов углерода, например, такие, как метил, этил, пропил, бутил и 2-метилпропил, и тому подобное. Термин C1-6 алкил, в виде группы или части группы, означает насыщенные углеводородные радикалы с нормальной или разветвленной цепью, содержащие 1-6 атомов углерода, такие группы, как определены для С 1-4 алкила, и пентил, гексил, 2-метилбутил, 3-метилпентил и тому подобное. Термин C1-6 алкандиил, в виде группы или части группы, означает бивалентные насыщенные углеводородные радикалы с нормальной или разветвленной цепью, содержащие 1-6 атомов углерода, например, такие, как метилен, этан-1,2-диил, пропан-1,3-диил, пропан-1,2-диил, бутан-1,4-диил, пентан 1,5-диил, гексан-1,6-диил, 2-метилбутан-1,4-диил, 3-метилпентан-1,5-диил и тому подобное.-4 006096 Термин С 2-6 алкенил, в виде группы или части группы, означает углеводородные радикалы с нормальной или разветвленной цепью, содержащие 2-6 атомов углерода, включающие, по меньшей мере,одну двойную связь, например, такие, как этенил, пропенил, бутенил, пентенил, гексенил и тому подобное. Термин С 2-6 алкинил, в виде группы или части группы, означает углеводородные радикалы с нормальной или разветвленной цепью, содержащие 2-6 атомов углерода, включающие, по меньшей мере,одну тройную связь, например, такие, как этинил, пропинил, бутинил, пентинил, гексинил и тому подобное. Термин С 3-7 циклоалкил, в виде группы или части группы, относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу или циклогептилу. Термин арил, в виде группы или части группы, предназначен для обозначения фенила и нафтила,которые оба могут быть необязательно замещены одним или более заместителями, независимо выбранными из C1-6 алкила, C1-6 алкилокси, атома галогена, гидрокси, необязательно моно- или дизамещенного амино, нитро, циано, галогенС 1-6 алкила, карбоксила, C1-6 алкоксикарбонила, С 3-7 циклоалкила, Het1, необязательно моно- или дизамещенного аминокарбонила, необязательно моно- или дизамещенного аминоС 1-6 алкила, метилтио, метилсульфонила и фенила, необязательно замещенного одним или более заместителями, выбранными из C1-6 алкила, C1-6 алкилокси, атома галогена, гидрокси, необязательно моно- или дизамещенного амино, нитро, циано, галогенС 1-6 алкила, карбоксила, C1-6 алкоксикарбонила, С 3-7 циклоалкила, Het1, необязательно моно- или дизамещенного аминокарбонила, метилтио и метилсульфонила; где необязательные заместители по аминогруппе независимо выбраны из C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкилокси-А-, Het1-A-, Неt1 С 1-6 алкила, Неt1 С 1-6 алкил-А-, Het1 окси-A-, Неt1 оксиС 1-4 алкил-А-, фенил-А-, фенилокси-А-, фенилоксиС 1-4 алкил-А-, фенилС 1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-,амино-А-, аминоС 1-6 алкила и аминоС 1-6 алкил-А-, где каждая из аминогрупп необязательно может быть моно- или дизамещенной С 1-4 алкилом, и где А имеет значения, определенные выше. Термин галогенС 1-6 алкил, в виде группы или части группы, относится к С 1-6 алкилу, замещенному одним или более атомами галогена, предпочтительно атомами хлора или фтора, более предпочтительно атомами фтора. Предпочтительные группы галогенС 1-6 алкила включают, например, трифторметил и дифторметил. Термин Het1, в виде группы или части группы, определяется, как насыщенный или частично ненасыщенный моноциклический, бициклический или трициклический гетероцикл, содержащий 3-14 атомов в кольце, более предпочтительно 5-10 атомов в кольце и более предпочтительно 5-8 атомов в кольце,который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода C1-6 алкилом, C1-6 алкилокси, атомом галогена, гидрокси, оксо, необязательно моно- или дизамещенным амино, нитро, циано, галогенС 1-6 алкилом, карбоксилом, C1-6 алкоксикарбонилом, С 3-7 циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, необязательно моно- или дизамещенным аминоС 1-6 алкилом, метилтио,метилсульфонилом, арилом и насыщенным или частично ненасыщенным моноциклическим, бициклическим или трициклическим гетероциклом, содержащим 3-14 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и где необязательные заместители в любой аминогруппе независимо выбраны из C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкилоксиА-, Het1-А-, Неt2 С 1-6 алкила, Неt2 С 1-6 алкил-А-, Het2 окси-A-, Неt2 оксиС 1-4 алкил-А-, арил-А-, арилокси-А-,арилоксиС 1-4 алкил-А-, арилС 1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-, аминоС 1-6 алкила и аминоС 1-6 алкил-А-, где каждая из аминогрупп необязательно может быть моно- или, где возможно, дизамещенной С 1-4 алкилом, и где А имеет значения, определенные выше. Термин Het2, в виде группы или части группы, относится к ароматическому моноциклическому,бициклическому или трициклическому гетероциклу, содержащему предпочтительно 3-14 атомов в кольце, более предпочтительно 5-10 атомов в кольце и более предпочтительно 5-6 атомов в кольце, который включает один или более гетероатомов, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода с C1-6 алкилом, C1-6 алкилокси, атомом галогена, гидрокси, необязательно моно- или дизамещенным амино, нитро, циано, галогенС 1-6 алкилом, карбоксилом, C1-6 алкоксикарбонилом, С 3-7 циклоалкилом, необязательно моно- или дизамещенным аминокарбонилом, необязательно моно- или дизамещенным аминоС 1-6 алкилом, метилтио, метилсульфонилом, арилом, Het1 и ароматическим моноциклическим, бициклическим или трициклическим гетероциклом, содержащим 3-14 атомов в кольце, и где необязательные заместители в любой аминогруппе независимо выбраны из C1-6 алкила, C1-6 алкилкарбонила, C1-6 алкилокси-А-, Het1-A-, Неt1 С 1-6 алкила, Het1C1-6aлкил-A-,Het1 окси-A-, Неt1 оксиС 1-4 алкил-А-, арил-А-, арилокси-А-, арилоксиС 1-4 алкил-А-, арилС 1-6 алкил-А-, C1-6 алкилоксикарбониламино-А-, амино-А-, аминоС 1-6 алкила и аминоС 1-6 алкил-А-, где каждая из аминогрупп необязательно может быть моно- или, где возможно, дизамещенной С 1-4 алкилом, и где А имеет значения, определенные выше. В том смысле, в котором он здесь используется, термин (=O) означает карбонил с атомом углерода,с которым он связан.-5 006096 В том смысле, в котором он здесь используется, термин один или более включает возможность замещения по всем доступным С-атомам, предпочтительно по одному, двум или трем. В случаях, когда любая переменная (например, атом галогена или С 1-4 алкил) присутствует более чем один раз в любом заместителе, каждое определение является независимым. Термин пролекарство, в том смысле, в котором он используется в тексте, означает фармакологически приемлемые производные такие, как эфиры, амиды и фосфаты, так, что продукт, полученный в результате биотрансформации производного in vivo, представляет активный препарат, определенный для соединений формулы (I). Источник, авторы Goodman и Gilman (The Pharmacological Basis of Therapeutics,8th ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), в котором описываются пролекарства, указан в качестве ссылки. Пролекарства соединения по настоящему изобретению получают модификацией функциональных групп, имеющихся в соединении таким образом, что модифицированные соединения превращаются при расщеплении либо в результате обычного химического превращения, либо в условиях in vivo в исходное соединение. Пролекарства включают соединения по настоящему изобретению, в которых гидроксильная группа, например, гидроксильная группа при асимметричном атоме углерода, или аминогруппа связана с любой группой так, что, когда пролекарство вводят пациенту, то она расщепляется с образованием соответственно свободной гидроксильной или свободной аминогруппы. Типичные примеры пролекарств описаны, например, в заявках WO 99/33795, WO 99/33815, WO 99/33793 и WO 99/33792, которые все включены здесь для сведения. Для пролекарств характерна высокая растворимость в воде, повышенная биодоступность, и они легко метаболизируются в активные ингибиторы in vivo. Для терапевтического применения соли соединений формулы (I) необходимо, чтобы противоион являлся фармацевтически или физиологически приемлемым. Однако соли, не имеющие фармацевтически приемлемый противоион, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения формулы (I). Все соли, фармацевтически приемлемые или нет, включены в объем изобретения. Фармацевтически приемлемые или физиологически переносимые аддитивные соли, которые могут образовать соединения по настоящему изобретению, можно преимущественно получить с использованием соответствующих кислот, например, таких, как неорганические кислоты такие, как галогенводородные кислоты, например, хлористоводородная или бромистоводородная кислота; серная; азотная; фосфорная и подобные кислоты, или органические кислоты, например, такие, как уксусная, пропановая, оксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная,винная,лимонная,метансульфоновая,этансульфоновая,бензолсульфоновая,птолуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. С другой стороны, аддитивные соли кислоты можно превратить при обработке соответствующим основанием в свободное основание. Соединения формулы (I) , включающие кислотный протон, можно также превратить в их нетоксичную аддитивную соль металла или амина обработкой соответствующими органическими и неорганическими основаниями. Соответствующие основные соли включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и тому подобное, соли органических оснований, например, соли бензатина, N-метила, -D-глюкамина, гидрабамина и соли аминокислот, например, таких как аргинина, лизина и тому подобное. С другой стороны, аддитивные соли основания можно превратить при обработке соответствующей кислотой в свободную кислоту. Термин соли также включает гидраты и сольваты, которые могут образовать соединения по настоящему изобретению. Примерами подобных форм являются, например, гидраты, алкоголяты и тому подобное.N-оксиды настоящих соединений включают соединения формулы (I), в которых один или несколько атомов азота окислены в так называемые N-оксиды. Настоящие соединения могут также находиться в их таутомерных формах. Хотя, подобные формы определенно не указаны в формуле выше, они включены в объем изобретения. Термин стереохимические изомеры соединений по настоящему изобретению в том смысле, в котором он использовался ранее, определяет все возможные соединения по настоящему изобретению, полученные из одинаковых атомов, связанных одинаковой последовательностью связей, но имеющих различные трехмерные структуры, и не являющиеся взаимозаменяемыми. Если не упоминается или указано иначе, химическое определение соединения включает смесь всех возможных стереохимических изомеров, которое данное указанное соединение может иметь. Указанная смесь может включать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимические изомеры соединений по настоящему изобретению как в чистой форме, так и в смеси друг с другом, включены в объем настоящего изобретения. Чистые стереоизомеры соединений и промежуточных соединений, упомянутые здесь, определяются как изомеры, в основном не содержащие других энантиомеров или диастереомеров одной и той же-6 006096 основной молекулярной структуры указанных соединений или промежуточных соединений. В частности,термин стереоизомерно чистый относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток, по меньшей мере, от 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) до 100% стереоизомерного избытка (т.е. 100% одного изомера и отсутствие других), конкретнее, к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток в пределах от 90 до 100%, еще конкретнее, имеющим стереоизомерный избыток от 94 до 100% и, наиболее конкретно, имеющим стереоизомерный избыток от 97 до 100%. Термины энантиомерно чистый и диастереомерно чистый следует понимать также, но соответственно в данном случае речь идет о энантиомерном избытке и диастереомерном избытке в данной смеси. Чистые стереоизомеры соединений и промежуточных соединений по данному изобретению можно получить при использовании известных в данной области способов. Например, энантиомеры можно отделить друг от друга избирательной кристаллизацией их диастереомерных солей с оптически активными кислотами. Альтернативно энантиомеры можно разделить хроматографическими методами с использованием хиральных неподвижных фаз. Указанные чистые стереоизомеры можно также получить из соответствующих чистых стереоизомеров соответствующих исходных соединений при условии проведения реакции в стереоспецифических условиях. Предпочтительно, если желательно получить определенный стереоизомер, указанное соединение следует синтезировать стереоспецифическими способами получения. В данных случаях преимущественно следует использовать энантиомерно чистые исходные соединения. Диастереомерные рацематы формулы (I) можно получить по отдельности обычными способами. Соответствующими физическими методами разделения, которые могут преимущественно использоваться, являются, например, избирательная кристаллизация и хроматография, например, колоночная хроматография. Специалистам в данной области, очевидно, понятно, что соединения формулы (I) включают, по меньшей мере, один асимметричный центр и таким образом они могут находиться в различных стереоизомерных формах. Данный асимметричный центр указан звездочкойна фигуре ниже. Абсолютную конфигурацию каждого асимметричного центра, который может находиться в соединениях формулы (I), можно указать стереохимическими обозначениями R и S, обозначение условными знаками R и S соответствует правилам, описанным в Pure Appl. Chem. 1976, 45, 11-30. Атом углерода,обозначенный звездочкой , предпочтительно имеет R-конфигурацию. Настоящее изобретение также включает все изотопы атомов, имеющихся в настоящих соединениях. Изотопы включают также атомы, имеющие одинаковый атомный номер, но различные массовые числа. В качестве общего примера и без ограничения изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. В последующем термин соединения формулы (I) или настоящие соединения или аналогичный термин включает соединения общей формулы (I), их N-оксиды, соли, стереоизомеры, рацемические смеси, пролекарства, эфиры и метаболиты, а также их кватернизованные по азоту аналоги. Конкретной группой соединений являются такие соединения формулы (I), для которых используется одно или более из последующих ограничений:R1 представляет атом водорода, Het1, Het2, арил, Неt1C1-6 алкил, Неt2 С 1-6 алкил, арилС 1-6 алкил, конкретнее R1 представляет атом водорода, насыщенный или частично ненасыщенный моноциклический или бициклический гетероцикл, содержащий 5-8 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который необязательно замещен, фенил, необязательно замещенный одним или более заместителями, ароматический моноциклический гетероцикл, содержащий 5-6 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который необязательно замещен по одному или более атомов углерода, или C1-6 алкил, замещенный ароматическим моноциклическим гетероциклом,содержащим 5-6 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода и серы, и который необязательно замещен по одному или более атомов углерода;L представляет -С(=O)-, -O-С(=O)-, -O-C1-6 алкандиил-С(=O) -, -NR8-C1-6 алкандиил-С(=O)-, конкретнее L представляет -С(=O)-, -O-С(=O)-, -О-СН 2-С(=O)-, где в каждом случае группа С(=O) связана с NH2 группой;R4 необязательно замещен C1-6 алкилом, конкретнее C1-6 алкилом, необязательно замещенным арилом, Het1, Het2, С 3-7 циклоалкилом или амино, необязательно моно- или дизамещенной, где заместители выбраны из С 1-4 алкила, арила, Het1, Het2; А представляет C1-6 алкандиил, -С(=0)- или C1-6 алкандиил-С(=O)-, в частности, А представляет метилен, 1,2-этандиил, 1,3-пропандиил, -С(=O)- или -СН 2-С(=О)-;R5 представляет атом водорода, С 1-6 алкил, Неt1 С 1-6 алкил, аминоС 1-6 алкил, где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом;R6 представляет C1-6 алкилокси, Het1, арил, амино; и в случае, когда -А- представляет другую группу, чем C1-6 алкандиил, то тогда R6 может также быть C1-6 алкилом, Неt1C1-4 алкилом, арилоксиС 1-4 алкилом или аминоС 1-4 алкилом; где каждая из аминогрупп может быть необязательно замещенной; илиR5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1. Особой группой соединений являются такие соединения формулы (I), в которых R1 представляетHet1, арил, Неt2 С 1-6 алкил; R2 представляет атом водорода; L представляет -С(=O)-, -O-С(=O)-, -О-СН 2 С(=O)-, где в каждом случае группа С(=O) связана с NH2-группой; R3 представляет фенилметил; и R4 представляет C1-6 алкил. Также особой группой соединений являются такие соединения формулы (I), в которых А представляет C1-6 алкандиил или -С(=O)-; R5 представляет атом водорода, метил, Неt1 С 1-6 алкил, аминоС 1-6 алкил,где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом; R6 представляет С 1-6 алкилокси, Het1, амино; и в случае, когда -А- представляет другую группу, чем C1-6 алкандиил, то тогда R6 может быть также C1-6 алкилом, Неt1 С 1-4 алкилом и аминоС 1-4 алкилом, где каждая из аминогрупп может быть необязательно замещенной. Интерес представляет группа соединений формулы (I), в которых -А- представляет карбонил, и R6 представляет арил, Неt1 С 1-4 алкил, арилоксиС 1-4 алкил или аминоС 1-4 алкил, где аминогруппы могут быть необязательно замещенными; или -А- представляет карбонил, R6 представляет С 1-4 алкил, и R5 является Неt1 С 1-6 алкилом или аминоС 1-6 алкилом, где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом. Также интерес представляет группа соединений формулы (I), в которых -А- представляет С 1-6 алкандиил, и R6 представляет амино и Het1; где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом. Интересной группой соединений являются такие соединения формулы (I), в которых R1 представляет атом водорода, С 1-6 алкил, С 2-6 алкенил, арилС 1-6 алкил, С 3-7 циклоалкил, С 3-7 циклоалкилС 1-6 алкил,арил, Het1, Неt1 С 1-6 алкил, Het2, Неt2 С 1-6 алкил; где Het1 представляет насыщенный или частично ненасыщенный моноциклический гетероцикл, содержащий 5 или 6 атомов в кольце, который включает один или более гетероатомов в кольце, выбранных из атомов азота, кислорода или серы, и который может быть необязательно замещен по одному или более атомов углерода. Еще одной интересной группой соединений являются такие соединения формулы (I), в которых L представляет -О-С 1-6 алкандиил-С (=O). Другой интересной группой соединений являются такие соединения формулы (I), в которых А представляет C1-6 алкандиил, -С(=O)- или C1-6 алкандиил-С(=O)-; где место связывания с атомом азота представляет C1-6 алкандиил в группах, которые включают указанный радикал;R5 представляет атом водорода, C1-6 алкил, Неt1 С 1-6 алкил, Неt2 С 1-6 алкил, аминоС 1-6 алкил, где аминогруппа может быть необязательно моно- или дизамещенной С 1-4 алкилом; и в случае, когда -А- представляет -С(=O)-, то тогда R6 представляет C1-6 алкилокси, Het1, Het1 окси или Het2 окси, арил, Het1C1-4aлкил,Неt2 оксиС 1-4 алкил, Het2Cl-4aлкил, Het2oкcиCl-4aлкил, арилС 1-4 алкил, арилоксиС 1-4 алкил или аминоС 1-4 алкил; и в случае, когда -А- представляет C1-6 алкандиил, то тогда R6 представляет амино, C1-6 алкилокси, Het1,1Het окси или Het2 окси; и в случае, когда -А- представляет C1-6 алкандиил-С(=O)-, то тогда R6 представляет C1-6 алкилокси,Het1, Het1 окси или Het2 окси, арил, C1-6 алкил, Het1C1-4aлкил, Het1oкcиC1-4aлкил, Het2C1-4aлкил, Неt2 оксиС 1-4 алкил, арилС 1-4 алкил, арилоксиС 1-4 алкил или аминоС 1-4 алкил; где каждая из аминогрупп при определении R6 может быть необязательно замещенной одним или более заместителями, выбранными из С 1-4 алкила, С 1-4 алкилкарбонила, С 1-4 алкилоксикарбонила, арила,арилкарбонила, арилоксикарбонила, Het1, Het2, арилС 1-4 алкила, Неt1 С 1-4 алкила или Het2C1-4aлкилa; иR5 и -A-R6, взятые вместе с атомом азота, с которым они связаны, могут также образовать Het1, где 1Het замещен по меньшей мере одной оксогруппой. Интересными соединениями являются такие, в которых L представляет -O-C1-6 алкандиил-С (=O)или -NR8-C1-6 алкандиил-С (=O)-, и R1 представляет радикал формулыR9 представляет оксо,R10a и R10b, каждый независимо, представляет атом водорода или С 1-4 алкил, необязательно замещенный арилом, Het1, Het2, С 1-4 алкилоксикарбонилом, карбоксилом, аминокарбонилом, гидрокси или амино,необязательно моно- или дизамещенным, где заместители выбраны из С 1-4 алкила,R11a представляет арилС 1-4 алкил или С 1-4 алкил, необязательно замещенный арилом или атомом галогена иR11b представляет атом водорода или C1-6 алкилоксикарбонил. Также интересными соединениями являются такие, в которых L представляет -O-C1-6 алкандиил-СR9 представляет оксо,R10a и R10b представляют атом водорода,R11a представляет арилС 1-4 алкил, в котором арил замещен атомом галогена, иR11b представляет атом водорода или C1-6 алкилоксикарбонил. Другими интересными соединениями являются такие, в которых L представляет -O-C1-6 алкандиилС (=O) - или -NR8-С 1-6 алкандиил-С(=O)-, и R1 представляет радикал формулы в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил,и R11b представляет атом водорода или C1-6 алкилоксикарбонил. Далее интересными соединениями являются такие, в которых L представляет -O-C1-6 алкандиил-С в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил,и R11b представляет атом водорода. Другими интересными соединениями являются такие, в которых L представляет -O-C1-6 алкандиилС (=O)- или -NR8-C1-6 алкандиил-С(=O)-, и R1 представляет радикал формулы в которой R9 представляет оксо, R10a и R10b представляют атом водорода, R11a представляет м-фторбензил,и R11b представляет трет-бутилоксикарбонил. Примечательно, что соединения по настоящему изобретению могут включать химически реакционноспособные группы, способные образовать ковалентные связи с определенными сайтами так, что указанное соединение приобретает повышенное удерживание в тканях и период полураспада. Термин химически реакционноспособная группа, в том смысле, в котором он здесь используется, относится к химическим группам, способным образовать ковалентную связь. Реакционноспособные группы, как правило, будут стабильны в водной среде, и обычно они представляют собой карбокси, фосфорил или соответствующий ацил, либо в виде эфира или смешанного ангидрида, или имидат, или малеимидат, способные таким образом образовать ковалентную связь с функциональными группами такими, как аминогруппа,гидрокси или тиол в сайте-мишени, например, в компонентах крови.-9 006096 При введении индивидууму, в случае его необходимости, указанное соединение способно образовать ковалентные связи с определенными сайтами, например, компонентами крови, так, что указанное соединение по изобретению приобретает повышенное удерживание в тканях и период полураспада. Как правило, ковалентная связь, которая образуется, способна сохраняться во время периода существования компонента крови, если не предполагается, что это место выделения. Большим преимуществом указанного нового соединения является небольшое количество соединения, необходимое для обеспечения эффективного действия. Причины данного преимущества заключаются в целенаправленной доставке, высоком выходе реакции между реакционноспособной группой Y и реакционноспособной функциональной группой и необратимой природе связи, образуемой после реакции. Кроме того, связавшись с мембраной или тканью, указанное соединение по изобретению не подвергается метаболизму в печени, фильтрации и выделению почками, и может быть даже защищено от воздействия протеазы (включая эндопептидазу),что обычно приводит к потере активности и быстрому выделению. Компоненты крови, в том смысле, в котором этот термин здесь используется, относится к связанным или подвижным компонентам крови. Связанные компоненты крови представляют неподвижные компоненты крови и включают ткани, мембранные рецепторы, интерстициальные белки, белки фибрина,коллагены, тромбоциты, эндотелиальные клетки, эпителиальные клетки и их связанные мембранные и мембраноподобные рецепторы, соматические клетки организма, и клетки скелетной и гладкой мускулатуры, нейронные компоненты, остеоциты и остеокласты, и все ткани организма, особенно связанные с кровеносной и лимфатической системами. Подвижные компоненты крови представляют компоненты крови, не связанные в течение любого продолжительного периода времени, как правило, не более 5,обычно не более одной минуты. Данные компоненты крови не связаны с мембранами и находятся в крови в течение продолжительных периодов времени и находятся в минимальной концентрации, равной, по меньшей мере, 0,1 мкг/мл. Подвижные компоненты крови включают сывороточный альбумин, трансферрин, ферритин и иммуноглобулины такие, как IgM и IgG. Период полураспада подвижных компонентов крови составляет, по меньшей мере, 12 ч. Соединения формулы (I) в основном можно получить с использованием способов, аналогичных способам, описанным в заявках WO 95/06030, WO 96/22287, WO 96/28418, WO 96/28463, WO 96/28464,WO 96/28465 и WO 97/18205. Конкретные реакционные способы получения настоящих соединений описаны ниже. При осуществлении способов получения, описанных ниже, продукты реакций можно выделить из среды и, затем, если необходимо, дополнительно очистить способами, обычно известными в данной области, например,такими, как экстракция, кристаллизация, растирание и хроматография. Схема А 2-ацетамидо-6-хлорсульфонилбензотиазол (промежуточное соединение а-2) получали, следуя способу, описанному в ЕР-А-0445926. Промежуточные соединения а-4 получали взаимодействием промежуточного соединения а-3, полученного способом, описанным в заявке WO 97/18205 и также представленным на схеме F, с промежуточным соединением а-2 в инертном растворителе таком, как дихлорметан, в присутствии основания такого, как триэтиламин, при низкой температуре, например, при 0 С. Восгруппа в промежуточном соединении а-3 представляет защитную трет-бутилоксикарбонильную группу.- 10006096 Соответственно, ее можно заменить на другую подходящую группу такую, как фталимидо или бензилоксикарбонил. При использовании промежуточного соединения а-4 в качестве исходного соединения, с промежуточного соединения а-5 снимали защиту с применением кислоты такой, как трифторуксусная кислота, в подходящем растворителе таком, как дихлорметан. Затем полученное промежуточное соединение можно подвергнуть взаимодействию с промежуточным соединением формулы R1-L-(уходящая группа) в присутствии основания такого, как триэтиламин, и необязательно в присутствии гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) или спирта такого, как трет-бутанол, в подходящем растворителе таком, как дихлорметан; с получением, таким образом, промежуточного соединения а 6. В частности, промежуточные соединения формулы R1-C(=O)-ОН подходят для дальнейшего взаимодействия с промежуточным соединением а-5. Альтернативно с промежуточных соединений а-4 можно снять защиту сильной кислотой такой, как хлороводород в изопропаноле, в подходящем растворителе таком, как смесь этанол-диоксан, с получением, таким образом, промежуточного соединения а-7. Промежуточное соединение а-8 можно получить аналогично способу, описанному для получения промежуточных соединений а-6. Схема В Промежуточное соединение b-5 можно получить способом, представленным на схеме А. Производное аминобензотиазола b-5 можно дезаминировать, например, обработкой нитритом натрия в сочетании с фосфорной кислотой, и затем сульфатом меди и хлоридом натрия, с получением, таким образом, промежуточного соединения b-6. Затем промежуточное соединение b-6 можно подвергнуть взаимодействию с промежуточным соединением формулы R1-L-(уходящая группа) в присутствии основания такого, как триэтиламин, необязательно в присутствии EDC или спирта такого, как трет-бутанол, в подходящем растворителе таком, как дихлорметан, с получением, таким образом, промежуточного соединения b-8. Затем промежуточное соединение b-8 можно функционализировать амином формулы H2N-A-R6 в подходящем растворителе таком, как ацетонитрил, с получением промежуточного соединения b-9. Альтернативно промежуточные соединения b-6 вначале можно подвергнуть взаимодействию с H2N-A-R6 и затем с соединением формулы R1-L-(уходящая группа), как представлено на схеме В. Наконец, затем промежуточное соединение b-9 может взаимодействовать с R5COCl или его функциональным эквивалентом в присутствии основания такого, как триэтиламин, в подходящем растворителе таком, как дихлорметан. Преимущественно указанную реакцию проводят в инертной атмосфере. Альтернативный путь получения соединений формулы (I) представлен на схеме С. Промежуточное соединение с-1, полученное способом, описанным в патенте США 6140505, подвергали взаимодействию с тиокарбонилдиимидазолом в инертном растворителе таком, как тетрагидрофуран, и затем взаимодействию полученного промежуточного соединения с амином, например, таким, как диметилэтиламин, с получением, таким образом, производного тиомочевины с-2. Затем указанное промежуточное соединение с-2 подвергали циклизации с использованием брома в присутствии кислоты такой, как уксусная кислота, с получением, таким образом, производного бензотиазола с-3. Последующие две стадии на схеме С являются аналогичными описанным для получения промежуточных соединений а-5 и а-6 на схеме А. Если желательно, промежуточное соединение с-5 можно окислить по N с использованием, например,мета-хлорпербензойной кислоты в дихлорметане. Конкретный путь получения бензотиазолов, замещенных ацетамидом, представлен на схеме D. Схема D Промежуточное соединение d-1, полученное способом, представленным на схеме А, можно подвергнуть взаимодействию с хлорацетилхлоридом или его функциональным аналогом, в присутствии основания такого, как триэтиламин, в растворителе таком, как 1,4-диоксан, для получения амида формулыd-2. Затем указанное промежуточное соединение d-2 может взаимодействовать с амином формулыNRaRb, где Ra и Rb определяют, как возможные заместители по аминогруппе в переменной группе R6. Другой конкретный путь получения бензотиазолов, замещенных ацетамидом, представлен на схеме Е. Промежуточное соединение е-2 можно получить обработкой промежуточного соединения е-1, полученного способом, представленным на схеме А, основанием таким, как карбонат натрия в водной среде такой, как смесь вода-диоксан. Все стадии синтеза, представленные на схеме Е для получения промежуточного соединения е-6, аналогичны стадиям реакций, представленным на схемах синтеза выше. Ряд промежуточных соединений и исходных соединений, использованных в вышеописанных способах, являются известными соединениями, в то время, как другие можно получить известными в данной области способами получения указанных или подобных соединений. Схема F Промежуточное соединение f-2, соответствующее промежуточному соединению а-3 на схеме А, можно получить добавлением амина формулы H2N-R4 к промежуточному соединению f-1 в подходящем растворителе таком, как изопропанол. Соединения по настоящему изобретению можно также получить способом, представленным на схеме G. Схема G- 13006096 Производное бензотиазола g-1 можно подвергнуть взаимодействию с хлорсульфоновой кислотой, и затем обработать его тионилхлоридом с получением промежуточного соединения g-2. Затем указанное промежуточное соединение g-2 может взаимодействовать с промежуточным соединением g-3 с образованием промежуточного соединения g-4, в котором PG означает подходящую защитную группу, например, такую, как Воc. Указанную реакцию можно проводить в подходящем растворителе, например, таком, как 2-метилтетрагидрофуран и необязательно в присутствии подходящего основания такого, как триэтиламин. Затем промежуточное соединение g-4 можно подвергнуть взаимодействию с подходящим реагентом таким, как метахлорпероксибензойная кислота (mCPBA) или гексагидрат монопероксифталата магния (ММРР) в присутствии подходящего растворителя такого, как 2-метилтетрагидрофуран в этаноле, с получением тем самым промежуточных соединений g-5 и g-6. Затем промежуточные соединения g-5 и g-6 можно функционализировать соединением формулыHN(R5)A-R6 с получением промежуточного соединения g-7 после снятия защиты. Затем промежуточное соединение g-7 может взаимодействовать с промежуточным соединением формулы R1-L-(уходящая группа) в присутствии основания такого, как триэтиламин, и необязательно в присутствии EDC или спирта такого, как трет-бутанол, в подходящем растворителе таком, как дихлорметан с получением, таким образом, соединения g-8, которое является соединением формулы (I). Другой конкретный путь получения некоторых соединений по изобретению представлен на схеме Н. Схема Н После снятия защиты удалением защитной группы соединения h-1 с использованием способов, известных в данной области, например, НСl в изопропаноле, в случае, когда PG является Вос-группой, свободный амин взаимодействует с карбоновой кислотой в присутствии агента сочетания такого, как EDC иHOBt, в органическом растворителе, таком как дихлорметан, с получением соединения h-2. В одном предпочтительном воплощении карбоновая кислота представляет Вос-защищенный Lтрет-лейцин. Затем с соединения h-2 снимают защиту, как описано ранее, и подвергают взаимодействию с хлоруксусной кислотой в присутствии EDC и HOBt в дихлорметане с получением промежуточного соединения h-3, затем проводят замещение первичным амином в органическом растворителе таком, как диметилформамид (ДМФА), при нагревании, затем проводят защиту подходящей защитной группой такой,как Boc, с получением промежуточного соединения h-4. Промежуточное соединение h-4 взаимодействует с мета-хлорпероксибензойной кислотой в дихлорметане с получением сульфоксида h-5, затем проводят замещение амином формулы NHR3R4 в органическом растворителе, таком как ацетонитрил, при нагревании. Конечное соединение h-6 получают после удаления защитной группы, как описано ранее. Соединения формулы (I) можно также превратить в соответствующие N-оксиды, следуя известным в данной области способам превращения трехвалентного азота в его N-окисленную форму, например,как показано для промежуточного соединения с-6 на схеме С. Указанную реакцию N-окисления, как правило, можно проводить при взаимодействии исходного соединения формулы (I) с соответствующей органической или неорганической перекисью. Соответствующие неорганические перекиси включают, например, перекись водорода, перекиси щелочных металлов или щелочноземельных металлов, например,перекись натрия, перекись калия; соответствующие органические перекиси могут включать пероксикис- 14006096 лоты, например, такие как пероксибензойная кислота или галогензамещенная пероксибензойная кислота,например, 3-хлорпероксибензойная кислота, пероксиалкановые кислоты, например, пероксиуксусная кислота, алкилгидропероксиды, например, гидропероксид трет-бутила. Подходящими растворителями являются, например, вода, низшие алканолы, например, этанол и тому подобное, углеводороды, например, толуол, кетоны, например, 2-бутанол, галогенированные углеводороды, например, дихлорметан, и смеси подобных растворителей. Интересной группой промежуточных соединений являются такие промежуточные соединения а-8,b-9 или d-1, в которых -A-R6 представляет водород. Указанные промежуточные соединения также могут обладать фармакологическими свойствами, аналогичными фармакологическим свойствам соединений формулы (I). Таким образом, настоящие соединения можно использовать у животных, предпочтительно млекопитающих и, в частности, у людей в качестве фармацевтических препаратов в чистом виде, в смеси друг с другом или в виде фармацевтических композиций. Кроме того, настоящее изобретение относится к фармацевтическим композициям, которые в качестве активных компонентов включают эффективную дозу по меньшей мере одного из соединений формулы (I) в дополнении к обычным фармацевтически безвредным наполнителям и вспомогательным веществам. Фармацевтические препараты обычно включают 0,1-90 мас.% соединения формулы (I). Фармацевтические композиции можно получить способом, известным специалистам в данной области. Для этой цели по меньшей мере одно соединение формулы (I) вместе с одним или более твердым или жидким фармацевтическим наполнителем и/или вспомогательным веществом и, если желательно, в сочетании с другими фармацевтическими активными соединениями, включают в подходящую форму для введения или лекарственную форму, которую затем можно использовать в качестве фармацевтического препарата в медицине или ветеринарии. Фармацевтические препараты, которые включают соединение по изобретению, можно вводить перорально, парентерально, например, внутривенно, ректально, ингаляционно или местно, предпочтительный путь введения зависит от конкретного случая, например, конкретного течения заболевания, которое подвергается лечению. Пероральное введение является предпочтительным. Специалисты в данной области, основываясь на их специальных знаниях, хорошо знакомы со вспомогательными веществами, которые подходят для желаемой фармацевтической композиции. Помимо растворителей, можно также использовать гелеобразующие агенты, основы для суппозиториев, вспомогательные вещества для таблеток и другие носители для активных соединений, антиоксиданты, диспергаторы, эмульгаторы, противовспенивающие вещества, вкусовые вещества, консерванты, солюбилизаторы, агенты для достижения эффекта отсроченного высвобождения, буферные соединения и красители соединения. Вследствие наличия полезных фармакологических свойств, в частности, активности против протеаз ВИЧ с множественной лекарственной устойчивостью, соединения по настоящему изобретению пригодны для лечения пациентов, зараженных ВИЧ, и для профилактики развития инфекции у таких пациентов. В основном соединения по настоящему изобретению могут быть полезны для лечения теплокровных животных, зараженных вирусами, присутствие которых опосредуется или зависит от протеаз. Состояния,которые можно профилактировать или лечить соединениями по изобретению, особенно состояния, связанные с ВИЧ и другими патогенными ретровирусами, включают СПИД, СПИД-ассоциированный комплекс (ARS), прогрессирующая генерализованная лимфаденопатия (PGL), а также хронические заболевания ЦНС, вызванные ретровирусами, например, такие, как опосредуемая ВИЧ деменция и рассеянный склероз. Следовательно, соединения по настоящему изобретению или любую их подгруппу можно использовать в качестве лекарственных препаратов при вышеуказанных состояниях. Указанное применение в качестве лекарственного препарата или способ лечения включают системное введение ВИЧинфицированным субъектам количества, эффективного для борьбы с состояниями, связанными с ВИЧ и другими патогенными ретровирусами, особенно ВИЧ-1. Следовательно, соединения по настоящему изобретению можно использовать при производстве лекарственного препарата, пригодного для лечения состояний, связанных с ВИЧ и другими патогенными ретровирусами, в частности, лекарственных препаратов, пригодных для лечения пациентов, зараженных вирусом ВИЧ с множественной лекарственной устойчивостью. В предпочтительном воплощении изобретение относится к применению соединения формулы (I) или любой его подгруппы при производстве лекарственного препарата для лечения или борьбы с инфекцией или заболеванием, связанным с инфицированием ретровирусами с множественной лекарственной устойчивостью, у млекопитающего, в частности, ВИЧ-инфекции. Таким образом, изобретение также относится к способу лечения инфекции, вызванной ретровирусами или заболевания, связанного с инфицированием ретровирусами с множественной лекарственной устойчивостью, включающему введение млекопитающему, при его необходимости, эффективного количества соединения формулы (I) или его подгруппы.- 15006096 В другом предпочтительном воплощении настоящее изобретение относится к применению соединения формулы (I) или любой его подгруппы при производстве лекарственного препарата для ингибирования протеазы ретровируса с множественной лекарственной устойчивостью у млекопитающего, зараженного указанным ретровирусом, в частности, ретровирусом ВИЧ-1. В другом предпочтительном воплощении настоящее изобретение относится к применению соединения формулы (I) или любой его подгруппы при производстве лекарственного препарата для подавления репликации ретровируса с множественной лекарственной устойчивостью, в частности, репликации ВИЧ-1. Соединения по настоящему изобретению также могут найти применение для ингибирования пробex vivo, содержащих ВИЧ, или с предполагаемым воздействием ВИЧ. Следовательно, настоящее изобретение можно использовать для ингибирования ВИЧ, находящегося в пробе биологической жидкости,которая содержит или предполагается, что содержит ВИЧ, или было оказано его воздействие. Кроме того, в качестве лекарственного препарата можно использовать комбинацию противоретровирусного препарата и соединения по настоящему изобретению. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение по настоящему изобретению и (b) другое противоретровирусное соединение, в качестве комбинированного препарата для одновременного, раздельного и последовательного применения при лечении инфекций, вызванных ретровирусами с множественной лекарственной устойчивостью. Таким образом, для борьбы или лечения ВИЧ-инфекций или инфекции, или заболевания, связанного с инфицированием ВИЧ, такого как синдром приобретенного иммунодефицита (СПИД) или СПИД-ассоциированный комплекс (ARC), соединения по настоящему изобретению можно вводить совместно в комбинации, например, с ингибиторами связывания такими, как декстрансульфат, сурамин, полианионы, растворимые CD4; ингибиторами слияния, например, такими, как Т 20, Т 1249, SHC-C, PRO542; ингибиторами связывания сорецепторов, такими как AMD 3100(Bicyclams), ТАК 779; ингибиторами обратной транскриптазы, например, такими как фоскарнет и его пролекарства, MIV-310; ингибиторами нуклеозидной обратной транскриптазы, например, такими какAZT, ЗТС, DDC, DDI, D4T, абакавир, FTC, DAPD, dOTC; ингибиторами нуклеотидной обратной транскриптазы, например, такими как РМЕА, РМРА, тенофовир; NNRTI, например, такими как невирапин,делавирдин, эфавиренз, 8 и 9-С 1 TIBO (тивирапин), ловирид, ТМС-125, ТМС-120, МКС-442, UC 781,каправирин, DPC 961, DPC 963, DPC 082, DPC 083, каланолид A, SJ-3366, TSAO, 4"-деаминированныйTSAO; ингибиторами РНКазы Н, например, такими как SP1093V, PD126338; ингибиторами ТАТ, например, такими как RO-5-3335, K12, К 37; ингибиторами интегразы, например, такими как L 708906, L 731988; ингибиторами протеазы, например, такими как ампренавир, ритонавир, нельфинавир, саквинавир, индинавир, лопинавир, BMS 232632, BMS 186316, DPC 681, DPC 684, типранавир, AG1776, DMP 450, L 756425, PD178390, PNU 140135; ингибиторами гликозилирования, например, такими как кастаноспермин, дезоксинойиримицин. Комбинация может обеспечить синергетический эффект, посредством чего инфекционность и связанные с ней симптомы можно профилактировать, в значительной мере снизить или полностью устранить. Соединения по настоящему изобретению также можно вводить в комбинации с иммуномодуляторами (например, бропиримином, антителами против человеческого альфа-интерферона, IL-2, метионинэнкефалином, альфа-интерфероном и налтрексоном), антибиотиками (например, пентамидином, изотиоратом), вакцинами или гормонами (например, гормоном роста) для ослабления, борьбы или элиминации ВИЧ-инфекции и ее симптомов. Для получения лекарственной формы для перорального введения соединения по настоящему изобретению смешивают с подходящими добавками, такими как наполнители, стабилизаторы или инертные разбавители, и получают обычными способами подходящие лекарственные формы, такие как таблетки,покрытые оболочкой таблетки, твердые капсулы, водные, спиртовые или масляные растворы. Примерами подходящих инертных носителей являются гуммиарабик, магнезия, карбонат магния, фосфат калия,лактоза, глюкоза или крахмал, в частности кукурузный крахмал. В данном случае препарат можно приготовить как в виде сухих, так и в виде влажных гранул. Подходящими масляными наполнителями или растворителями являются растительные или животные масла такие, как подсолнечное масло или масло,полученное из печени трески. Подходящими растворителями для водных или спиртовых растворов являются вода, этанол, растворы сахаров или их смеси. Полиэтиленгликоли и полипропиленгликоли также являются пригодными в качестве дополнительных вспомогательных веществ для других лекарственных форм. Для подкожного или внутривенного введения активные соединения, если желательно, с обычными вспомогательными веществами такими, как солюбилизаторы, эмульгаторы или другие вспомогательные вещества переводят в раствор, суспензию или эмульсию. Соединения формулы (I) также можно лиофилизовать и полученные лиофилизаты использовать, например, для получения инъекционных или инфузионных препаратов. Подходящими растворителями являются, например, вода, физиологический раствор или спирты, например, этанол, пропанол, глицерин, также в дополнении к растворам сахаров, таких как растворы глюкозы или маннита, или альтернативно смеси различных вышеупомянутых растворителей.- 16006096 Подходящими фармацевтическими композициями для введения в форме аэрозолей или спреев являются, например, растворы, суспензии или эмульсии соединений формулы (I) или их физиологически переносимых солей в фармацевтически приемлемом растворителе, таком как этанол или вода, или смесь этих растворителей. Если необходимо, композиция может дополнительно включать другие фармацевтические вспомогательные вещества такие, как поверхностно-активные вещества, эмульгаторы и стабилизаторы, а также пропеллент. Подобный препарат обычно содержит активное соединение в концентрации примерно от 0,1 до 50%, в частности примерно от 0,3 до 3 мас.%. Для того чтобы повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях полезно использовать -, - и -циклодекстрины или их производные. При использовании сорастворителей таких, как спирты, также можно повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях. При получении водных композиций очевидно более подходящим является введение солей целевых соединений за счет их повышенной растворимости в воде. Соответствующие циклодекстрины представляют -, - и-циклодекстрины (CDs) или их эфиры и смешанные эфиры, в которых одна или более гидроксильных групп ангидроглюкозных звеньев циклодекстрина замещены C1-6 алкилом, в частности, метилом, этилом или изопропилом, например, произвольно метилированный -CD; гидроксиС 1-6 алкилом, в частности, гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиС 1-6 алкилом, в частности, карбоксиметилом или карбоксиэтилом; C1-6 алкилкарбонилом, в частности, ацетилом; С 1-6 алкилоксикарбонилС 1-6 алкилом или карбоксиС 1-6 алкилоксиС 1-6 алкилом, в частности, карбоксиметоксипропилом или карбоксиэтоксипропилом; С 1-6 алкилкарбонилоксиС 1-6 алкилом, в частности, 2-ацетилоксиропилом. Особо следует упомянуть в качестве комплексообразующих агентов и/или солюбилизаторов -CD, произвольно метилированный -CD, 2,6-диметилCD,2-гидроксиэтилCD, 2-гидроксиэтилСD, 2-гидроксипропилCD и (2-карбоксиметокси)пропилCD и, в частности, 2-гидроксипропилCD (2-HPCD). Термин смешанный эфир означает производные циклодекстрина, в которых, по меньшей мере,две гидроксильные группы циклодекстрина этерифицированы различными группами, например, такими как гидроксипропил и гидроксиэтил. Интересный способ формулирования настоящих соединений в сочетании с циклодекстрином или его производными описан в ЕР-А-721331. Несмотря на то, что описанные там композиции включают в качестве активных компонентов противогрибковые средства, они в равной степени представляют интерес для формулирования соединений по настоящему изобретению. Описанные композиции в частности пригодны для перорального введения и включают в качестве активного компонента противогрибковое средство, достаточное количество циклодекстрина или его производного в качестве солюбилизатора,водную кислую среду в качестве объемного жидкого носителя и спиртовой сорастворитель, который в значительной мере упрощает получение композиции. Указанные композиции можно сделать более приятными на вкус добавлением приемлемых подсластителей и/или вкусовых веществ. Другие подходящие способы повышения растворимости соединений по настоящему изобретению в фармацевтических композициях описаны в заявке WO-94/05263, заявке РСТРСТ/ЕР 98/01773, ЕР-А 499299 и заявке WO 97/44014, все они указаны здесь в качестве ссылки. Конкретнее, настоящие соединения можно включить в фармацевтическую композицию, содержащую терапевтически эффективное количество частиц, состоящих из твердой дисперсии, включающей (а) соединение формулы (I) и (b) один или более фармацевтически приемлемых водорастворимых полимеров. Термин твердая дисперсия означает систему в твердом состоянии (в противоположность жидкому или газообразному состоянию), включающую, по меньшей мере, два компонента, где один компонент диспергирован более или менее равномерно в другом компоненте или компонентах. Когда указанная дисперсия компонентов представляет такую систему, которая химически и физически однородна или гомогенна, или состоит из одной фазы, что определяется термодинамикой, то тогда твердая дисперсия называется твердым раствором. Твердые растворы представляют предпочтительные физические системы, поскольку компоненты, находящиеся в них, обычно обладают высокой биодоступностью в организмах, которым их вводят. Термин твердая дисперсия также включает дисперсии, которые являются менее гомогенными,чем твердые растворы. Подобные дисперсии не являются химически или физически однородными, или включают более чем одну фазу. Водорастворимый полимер в частицах является соответственно полимером, который имеет кажущуюся вязкость от 1 до 100 мПас при растворении в 2% водном растворе при 20 С раствора. Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы и НРМС. НРМС, имея степень замещения метоксигруппами в пределах примерно от 0,8 до примерно 2,5 и молярное замещение гидроксипропилом в пределах примерно от 0,05 до примерно 3,0, как правило, растворимы в воде. Степень замещения метоксигруппой означает среднее количество метиловых эфирных групп на единицу ангидроглюкозы в молекуле целлюлозы. Молярное замещение гидроксипропилом оз- 17006096 начает среднее количество молей пропиленоксида, которые взаимодействуют с каждой единицей ангидроглюкозы в молекуле целлюлозы. Частицы, определенные здесь выше, можно получить вначале приготовлением твердой дисперсии компонентов и затем необязательно размолом или измельчением дисперсии. Для получения твердых дисперсий существуют различные способы, включая экструзию в расплаве,распылительную сушку и упаривание раствора, предпочтительной является экструзия в расплаве. Кроме того, можно соответственно приготовить настоящее соединение в форме наночастиц, которые имеют адсорбированный на их поверхности поверхностный модификатор в количестве, достаточном для сохранения эффективного среднего размера частиц менее чем 1000 нм. Полагается, что подходящие поверхностные модификаторы включают такие, которые имеют физическую адгезию к поверхности противоретровирусного средства, но не связываются химически с противоретровирусным средством. Подходящие поверхностные модификаторы можно предпочтительно выбрать из известных органических и неорганических фармацевтических наполнителей. Подобные наполнители включают различные полимеры, низкомолекулярные олигомеры, природные соединения и поверхностно-активные вещества. Предпочтительные поверхностные модификаторы включают неионогенные и анионогенные поверхностно-активные вещества. Другой интересный способ формулирования настоящих соединений включает фармацевтическую композицию, где настоящие соединения включают в гидрофильные полимеры, и эту смесь наносят в качестве покровной пленки на множество маленьких гранул, получая, таким образом, композицию с хорошей биодоступностью, которую удобно производить и которая пригодна для получения фармацевтических лекарственных форм для перорального введения. Указанные гранулы включают (а) центральное, округлой или сферической формы ядро, (b) покровную пленку из гидрофильного полимера и противоретровирусного средства и (с) покрывной полимерный слой. Вещества, подходящие для применения в качестве ядер в гранулах, являются самыми разнообразными, при условии, что указанные вещества являются фармацевтически приемлемыми и имеют соответствующие размеры и прочность. Примерами подобных веществ являются полимеры, неорганические соединения, органические соединения и сахариды и их производные. Другой аспект настоящего изобретения касается набора или контейнера, включающего соединение формулы (I) в количестве, эффективном для применения в качестве стандарта или реагента в тесте или при анализе определения способности потенциального фармацевтического препарата ингибировать протеазу ВИЧ, рост ВИЧ или оба фактора. Данный аспект изобретения может найти свое применение в исследовательских программах по фармации. Соединения по настоящему изобретению можно использовать в высокопроизводительных, целенаправленных аналитических тестах для определения эффективности указанного соединения для лечения ВИЧ. Соединения по настоящему изобретению можно использовать при контрольном анализе фенотипической резистентности таком, как рекомбинантный анализ при контроле в клинике заболеваний с резистентностью таких, как ВИЧ. Особенно пригодную систему для контроля резистентности представляет рекомбинантный анализ, известный как Антивирограм. Антивирограм представляет высоко автоматизированный, производительный рекомбинантный анализ второго поколения, с помощью которого можно определить чувствительность, особенно чувствительность вирусов, к соединениям по настоящему изобретению. (Hertogs К., de Bethune МР, Miller V. et al., Antimicrob Agents Chemother, 1998; 42(2):269276, включен для сведения). Доза настоящих соединений или их физиологически переносимой соли(ей), которую следует вводить, зависит от конкретного случая и, как правило, адаптирована к состояниям в каждом конкретном случае для получения оптимального эффекта. Таким образом, она зависит, конечно, от кратности введения и от эффективности и продолжительности действия соединений, используемых в каждом случае для лечения или профилактики, а также от природы и тяжести инфекции и симптомов, от пола, возраста,массы и индивидуальной восприимчивости человека или животного, которые подвергаются лечению, и от того, является ли терапия лечебной или профилактической. Как правило, суточная доза соединения формулы (I) в случае введения пациенту массой примерно 75 кг находится в пределах от 1 мг до 1 г,предпочтительно от 3 мг до 0,5 г. Дозу можно вводить в виде отдельной дозы, или разделить ее на несколько, например, две, три или четыре отдельные дозы. Экспериментальный раздел Получение соединений формулы (I) и их промежуточных соединений. Пример 1. Получение соединения 29.- 18006096 Смесь 1,56 г промежуточного соединения а-3 (R2=H и R4=-CH2-CH2-NH-(2-пиридинил) ) и 0,59 г триэтиламина в 50 мл дихлорметана перемешивали при 0 С. Затем добавляли 1,25 г 2-(ацетиламино)-6 бензотиазолсульфонилхлорида и реакционную смесь перемешивали в течение ночи при комнатной температуре. После промывки водой отделяли органический слой, высушивали и растворитель выпаривали. Полученное коричневое твердое вещество повторно растворяли в метаноле при 70 С, охлаждали и отфильтровывали с получением 1,9 г (75%) промежуточного соединения а-4 (R2=H, R4=-CH2-CH2-NH- (2 пиридинил) и -A-R6=H). К смеси 6 г промежуточного соединения а-4 (R2=H, R4=-CH2-CH2-NH-(2-пиридинил) и -A-R6=H) в 50 мл дихлорметана добавляли 7,3 мл трифторуксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Добавляли еще дихлорметан и промывали раствором NaHCO3. Органический слой высушивали и растворитель выпаривали при пониженном давлении с получением 4,1 г (81%) промежуточного соединения а-5 (R2=H, R4=-CH2-CH2-NH- (2-пиридинил) и -A-R6=H). Смесь 0,60 г промежуточного соединения а-5 (R2=H, R4=-CH2-CH2-NH-(2-пиридинил) и -A-R6=H),0,29 г 1-(3S,3aR,6aS)+(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона (полученного аналогично способу, описанному в WO 9967417) и 0,33 г триэтиламина в 15 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. Растворители выпаривали и полученное твердое вещество повторно растворяли в метаноле при 70 С, охлаждали и отфильтровывали с получением 0,53 г (69%) соединения 29. Данные масс-спектрометрии: m/z=711 (M+H). Пример 2. Получение соединения 31. Смесь 540 мг промежуточного соединения а-5 (R2=H, R4=-CH2-(2-пиридинил) и -A-R6=H), 135 мг трет-бутанола, 192 мг EDC и 101 мг триэтиламина в 5 мл дихлорметана перемешивали в течение ночи при комнатной температуру. Реакционную смесь промывали раствором Na2CO3 и насыщенным раствором соли. Органический слой отделяли, высушивали и растворитель выпаривали. Остаток очищали препаративной ВЭЖХ с получением 184 мг (26%) соединения 31. Данные масс-спектрометрии: m/z=702 (M+H). Пример 3. Получение соединения 33. Смесь 540 мг промежуточного соединения а-5 (R2=H, R4=-CH2-(2-пиридинил) и -A-R6=H), 271 мг 1-(3S,3aR,6aS)+(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона и 101 мг триэтиламина в 5 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. Затем реакционную смесь промывали раствором Na2CO3 и насыщенным раствором соли. Органический слой отделяли, высушивали и растворитель выпаривали. Остаток очищали препаративной ВЭЖХ с получением 161 мг (23%) соединения 33. Данные масс-спектрометрии: m/z=696 (M+H). Пример 4. Получение соединения 2. К смеси 0,3 г рацемата промежуточного соединения а-8 (R2=H, R4=изобутил, -A-R6=H и -L-R1= гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил) и 0,061 г триэтиламина в безводном диоксане добавляли порциями 0,18 г этилхлорформиата. Реакционную смесь нагревали в течение ночи до 60 С. К смеси добавляли 10 мл воды и 0,4 г карбоната калия с последующим перемешиванием в течение 2 ч. Диоксан удаляли в вакууме. Водную фазу экстрагировали дихлорметаном. Объединенную органическую фазу концентрировали, и полученный остаток очищали хроматографией с получением 0,23 г (68%) соединения 2. Пример 5. Получение соединения 56.- 19006096 Смесь 19,66 г 1,1-диметилэтилового эфира [2R-гидрокси-3-[(2-метилпропил)амино]-1S-(фенилметил)пропил)карбаминовой кислоты (описанного в заявке WO97/18205) и 17,76 г триэтиламина в 200 мл дихлорметана перемешивали при 0 С в течение 2 0 мин в инертной атмосфере. Небольшими порциями добавляли 18,72 г 2-(ацетиламино)-6-бензотиазолсульфонилхлорида и затем смесь перемешивали при комнатной температуре в течение 2 ч. После промывания 5% раствором НСl, насыщенным раствором бикарбоната натрия и насыщенным раствором соли, органический слой высушивали и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали на силикагеле, элюируя 4% метанолом в дихлорметане, с получением 30,82 г (90%) промежуточного соединения b-4 (R2=H и R4=изобутил). К смеси 13,75 г промежуточного соединения b-4 (R2=H и R4=изобутил) в 130 мл смеси этанол/диоксан (1:1) добавляли 65 мл НСl (5-6 Н в изопропаноле). Реакционную смесь перемешивали при 50 С в течение 22 ч. После упаривания соль обрабатывали насыщенным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой высушивали, растворитель выпаривали и остаток очищали на силикагеле, элюируя 3% метанолом в дихлорметане, с получением 18,36 г (72%) промежуточного соединения b-5 (R2=H и R4=изобутил). Раствор 1,81 г нитрита натрия в 10 мл воды добавляли в течение 40 мин к смеси 9,80 г промежуточного соединения b-5 (R2=H и R4=изобутил) в 180 мл 85% фосфорной кислоты при -10 С. После перемешивания в течение 1,5 ч смесь добавляли к перемешиваемому раствору 10,90 г пентагидрата сульфата меди и 12,67 г хлорида натрия в 80 мл воды при -10 С. Смесь перемешивали в течение 1,5 ч, давая нагреться до комнатной температуры, и подщелачивали (рН=8) раствором гидроксида аммония при охлаждении. Полученный раствор экстрагировали этилацетатом. После высушивания и выпаривания растворителя получали 7,5 9 г (74%) промежуточного соединения b-6 (R2=H и R4=изобутил). Смесь 1,63 г промежуточного соединения b-6 (R2=H и R4=изобутил), 0,80 г 1-(3S)-тетрагидро-3 фуранил]окси]карбонил]окси]-2,5-пирролидиндиона и 0,53 г триэтиламина в 50 мл дихлорметана перемешивали при комнатной температуре в течение 5 ч. После выпаривания дихлорметана при пониженном давлении неочищенный продукт очищали на силикагеле, элюируя 3% метанолом в дихлорметане, с получением 0,58 г (29%) промежуточного соединения b-8 (R2=H и R4=изобутил, R1-L-=(3S)-тетрагидро-3 фуранил]окси]карбонил). К раствору 0,23 г промежуточного соединения b-8 (R2=H и R4=изобутил, R1-L-=(3S)-тетрагидро-3 фуранил]окси]карбонил) в 30 мл ацетонитрила добавляли 0,20 г, N,N-диметилэтилендиамина. Этот раствор перемешивали при 80 С в течение 4 ч. После выпаривания ацетонитрила при пониженном давлении неочищенный продукт очищали на силикагеле, элюируя 2% метанолом в дихлорметане, с получением 0,12 г (50%) соединения 56. Данные масс-спектрометрии: m/z=634 (M+H). Пример 6. Получение соединения 44. К раствору 0,90 г промежуточного соединения b-6 (R2=H и R4=изoбyтил) в 20 мл ацетонитрила добавляли 0,85 г N,N-диметилэтилендиамина. Данный раствор перемешивали при 80 С в течение 3 ч. После выпаривания ацетонитрила при пониженном добавлении продукт промывали 2% раствором карбоната натрия и экстрагировали этилацетатом. Органический слой высушивали, растворитель выпаривали при пониженном давлении и очищали на силикагеле, элюируя 1% аммиаком в дихлорметане, с получением 0,57 г (58%) промежуточного соединения b-7 (R2=H, R4=изобутил и -A-R6=CH2CH2N(CH3)2). Смесь 0,65 г (транс)-4-(диметиламино)тетрагидро-3-фуранола (синтез описан в патенте США 3265711), 3,78 г дисукцинимидилкарбоната и 1,50 г триэтиламина в 30 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. После промывания полученного раствора насыщенным раствором бикарбоната натрия органический слой высушивали и растворитель выпаривали при пониженном давлении с получением 0,52 г (38%) (транс)-1-4-(диметиламино)тетрагидрофуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона. Смесь 0,25 г промежуточного соединения b-7 (R1=H, R2=CH2CH2N(Me)2), 0,13 г (транс)-1-4(диметиламино)тетрагидрофуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона и 0,07 г триэтиламина в 15 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. После выпаривания дихлорметана при пониженном давлении неочищенный продукт очищали на силикагеле, элюируя 4% аммиаком в дихлорметане, с получением 0,14 г (43%) соединения 44. Данные масс-спектрометрии: m/z=677 (M+H). Пример 7. Получение соединения 19.- 20006096 К раствору 0,83 г промежуточного соединения b-6 (R2=H и R4=изoбyтил) в 20 мл ацетонитрила добавляли 0,40 г N-(2-аминоэтил)пирролидина. Данный раствор перемешивали при 80 С в течение 4 ч. После выпаривания ацетонитрила при пониженном давлении продукт промывали 2% раствором карбоната натрия и экстрагировали этилацетатом. Органический слой высушивали, выпаривали при пониженном давлении и очищали на силикагеле, элюируя 1% аммиаком в дихлорметане, с получением 0,47 г (49%) промежуточного соединения b-7 (R2=H, R4=изобутил и -A-R6=CH2CH2-(1-пирролидинил. Смесь 0,47 г промежуточного соединения b-7 (R2=H, R4=изобутил и -A-R6=CH2CH2 (1-пирролидинил, 0,25 г 1-(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона и 0,10 г триэтиламина в 20 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. После выпаривания дихлорметана при пониженном давлении неочищенный продукт очищали на силикагеле, элюируя 2% аммиаком в дихлорметане, с получением 0,54 г (88%) промежуточного соединения b-9 (R2=H, R4=изoбyтил, -A-R6=CH2CH2-(1-пирролидинил) и -L-R1=(3R,3aS,6aR) гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил). К раствору 0,54 г промежуточного соединения b-9 (R2=H, R4=изoбyтил, -A-R6=CH2CH2-(1-пирролидинил) и -L-R1=(3R, 3aS, 6aR) -гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил) и 0,16 г триэтиламина в 40 мл дихлорметана в инертной атмосфере добавляли 0,22 г ацетилхлорида. После перемешивания при комнатной температуре в течение 2 ч и промывания водой органический слой высушивали и упаривали при пониженном давлении с получением 0,50 г (87%) соединения 19. Данные массспектрометрии: m/z=744 (М+Н). Пример 8. Получение соединения 16. К раствору 4,91 г 1,1-диметилэтилового эфира [(lS,2R)-3-(4-аминофенил)сульфонил](2-метилпропил)амино]-2-гидрокси-1-(фенилметил)пропил]карбаминовой кислоты (полученного, как описано в патенте США 6140505) в 40 мл безводного тетрагидрофурана добавляли 1,7 8 г 1,1'-тиокарбонилдиимидазола. Данный раствор кипятили с обратным холодильником в течение 4 ч. После охлаждения до 25 С добавляли 0,88 г N,N-диметилэтиламина и затем данный раствор вновь кипятили с обратным холодильником в течение 16 ч. После охлаждения до 25 С, выпаривания тетрагидрофурана при пониженном давлении добавляли дихлорметан, промывали водой, органическую фазу высушивали и концентрировали. Данный неочищенный продукт очищали на силикагеле, элюируя 5% метанолом в дихлорметане, с получением 3,8 г (62%) промежуточного соединения с-2 (R2=H и R4=изобутил). Данные массспектрометрии: m/z=622 (M+H), 566, 532. К раствору 2,5 г промежуточного соединения с-2 (R2=H и R4=изобутил) в 10 мл уксусной кислоты добавляли 0,64 г брома в 10 мл уксусной кислоты. Через 2 ч данный неочищенный продукт концентрировали, добавляли дихлорметан и данную органическую фазу промывали насыщенным раствором карбоната калия. Органическую фазу высушивали сульфатом магния, фильтровали и концентрировали с получением промежуточного соединения с-3 (R2=H и R4=изобутил). Данные масс-спектрометрии:m/z=620 (M+H), 564, 520, 261. Промежуточное соединение с-3 (R2=H и R4=изобутил) разбавляли 20 мл дихлорметана и добавляли 5 мл трифторуксусной кислоты. Данный раствор перемешивали в течение 1 ч и затем концентрировали. Данный остаток промывали раствором карбоната калия и экстрагировали дихлорметаном. Данное неочищенное вещество очищали на силикагеле, элюируя 5% метанолом в дихлорметане, с получением 1,5 г(72%) промежуточного соединения с-4 (R2=H и R4=изобутил). 1,5 г промежуточного соединения с-4 (R2=H и R4=изoбyтил), 0,81 г 1-(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона и 0,67 г триэтиламина в 5 мл дихлорметана перемешивали в течение 4 ч при комнатной температуре. Данный неочищенный продукт непосредственно очищали на силикагеле, элюируя 5% метанолом в дихлорметане, с получением 0,80 г (39%) соединения 16. Пример 9. Получение соединения 27. К 0,34 г соединения 16 в 5 мл дихлорметана добавляли 0,08 г бикарбоната натрия и 0,15 г (75%) мета-хлорпербензойной кислоты. Данный раствор перемешивали в течение 2 ч при комнатной температуре. Добавляли воду и остаток экстрагировали дихлорметаном. Органическую фазу высушивали над сульфа- 21006096 том магния, фильтровали и концентрировали. Данное неочищенное вещество очищали на силикагеле,элюируя 5% метанолом в дихлорметане, с получением 0,09 г (26%) соединения 27. Данные массспектрометрии: m/z=692 (M+H). Пример 10. Получение соединения 11. К смеси 2,32 г 2-амино-N-[(2R,3S)-3-амино-2-гидрокси-4-фенилбутил]-N-(2-метилпропил)-6-бензотиазолсульфонамида и 1,0 г триэтиламина в дихлорметане добавляли 1,47 г 1-(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона. После перемешивания в течение ночи реакционную смесь промывали насыщенным раствором бикарбоната натрия, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией (смесь дихлорметан:метанол 95:5) с получением 2,76 г промежуточного соединения d-1 (R2=H,R4=изобутил, -A-R6=H и -L-R1=(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил) (88%). К смеси промежуточного соединения d-1 (R2=H, R4=изобутил, -A-R6=H и -L-R1= (3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил)(2,0 г; 3,3 ммоль) и триэтиламина (1,16 г; 11,5 ммоль) в безводном 1,4-диоксане добавляли хлорацетилхлорид (429 мг; 3,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 ч. Добавляли еще порцию хлорацетилхлорида (180 мг; 1,5 ммоль) и перемешивание продолжали в течение 3 ч. После выпаривания растворителя остаток очищали хроматографией (смесь дихлорметан:метанол 98:2) с получением 1,57 г (70%) промежуточного соединения d-2 (R2=H, R4=изобутил, -A-R6=H и -L-R1=(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3 ил]окси]карбонил). Данные масс-спектрометрии: (ES+):681/683(М+Н). К раствору промежуточного соединения d-2 (R2=H, R4=изобутил, -A-R6=H и -L-R1=(3R,3aS,6aR) гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил) (0,45 г; 0,66 ммоль) в тетрагидрофуране добавляли 4,6 мл 40% водного раствора диметиламина. После перемешивания в течение 2 ч тетрагидрофуран выпаривали. Водный слой экстрагировали дихлорметаном. Объединенные органические слои высушивали над сульфатом магния. Концентрирование в вакууме давало 0,42 г (92%) соединения 11. Данные массспектрометрии: (ES+):690(М+Н), 560. Пример 11. Получение соединения 12. К раствору промежуточного соединения d-2 (R2=H, R4=изобутил, -A-R6=H и -L-R1= (3R,3aS,6aR) гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил) в дихлорметане добавляли 1,5 экв пирролидина вместе с карбонатом натрия в виде основания. После перемешивания в течение ночи при комнатной температуре растворитель выпаривали в вакууме. Остаток очищали хроматографией (смесь дихлорметан:метанол) с получением 76% соединения 12. Данные масс-спектрометрии: (ES+):715(М+Н). Пример 12. Получение соединения 43. Смесь 6,13 г промежуточного соединения е-1 (R2=H, R4=изобутил и -A-R6=H) и 10 г карбоната натрия в смеси вода/диоксан (1/2) нагревали до 80 С в течение 48 ч. Диоксан удаляли в вакууме. Полученную водную фазу экстрагировали дважды этилацетатом. После высушивания над сульфатом магния и фильтрования объединенную органическую фазу концентрировали с получением 5,08 г промежуточного соединения е-2 (R2=H, R4=изобутил и -A-R6=H). Данные масс-спектрометрии: (ES+):549(М+Н), 449. К смеси 3,0 г 2-аминобензотиазола промежуточного соединения е-2 (R2=H, R4=изобутил и -A-R6=H) и 1,1 г триэтиламина в сухом 1,4-диоксане добавляли 0,7 7 г хлорацетилхлорида. Полученную смесь перемешивали в течение ночи. После выпаривания растворителя остаток очищали хроматографией (смесь дихлорметан:метанол 98:2) с получением 2,7 г (78%) промежуточного соединения е-3 (R2=H, R4= изoбyтил и -A-R6=H). Данные масс-спектрометрии: (ES+):625/627(М+Н). К раствору 0,8 г промежуточного соединения е-3 (R2=H, R4=изобутил и -A-R6=H) в тетрагидрофуране добавляли 8 мл 40 мас.% водного раствора диметиламина. После перемешивания в течение 3 ч тетрагидрофуран выпаривали. Водный слой экстрагировали дихлорметаном. Объединенные органические- 22006096 слои высушивали над сульфатом магния. Концентрирование в вакууме давало 0,58 г (85%) промежуточного соединения е-4 (R2=H, R4=изoбyтил, -A-R6=H и Ra=Rb=CH3). Данные масс-спектрометрии:(ES+):634(М+Н), 534. К раствору промежуточного соединения е-4 (R2=H, R4=изобутил, -A-R6=H и Ra=Rb=CH3) в дихлорметане добавляли трифторуксусную кислоту (10 экв). После перемешивания в течение ночи органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным раствором соли, высушивали над сульфатом магния, фильтровали и концентрировали с получением промежуточного соединения е-5 (R2=H, R4=изобутил, -A-R6=H и Ra=Rb=CH3). К раствору 0,35 г 4-амино-2-метилбензойной кислоты в дихлорметане добавляли при 0 С 0,09 г 1 гидроксибензотриазола и 0,13 г EDC. После перемешивания в течение 30 мин температуру повышали до комнатной температуры и перемешивание продолжали еще в течение 1 ч. После добавления промежуточного соединения е-5 (R2=H, R4=изобутил, -A-R6=H и Ra=Rb=CH3) реакционную смесь перемешивали при комнатной температуре в течение двух суток. Затем растворитель удаляли в вакууме и полученный остаток очищали хроматографией (смесь дихлорметан:метанол 97:3) с получением 0,12 г (29%) соединения 43. Данные масс-спектрометрии: (ES+):667(М+Н). Пример 13. Получение промежуточного соединения f-2 (R2=H и R4=-CH2- (2-пиридинил. 25 г 2-пиридилметиламина перемешивали при кипении с обратным холодильником в 400 мл изопропанола. Затем добавляли по каплям раствор 21 г доступного в продаже 2S,3S-1,2-эпокси-3-(третбутоксикарбониламино)-4-фенилбутана в 200 мл изопропанола. Реакционную смесь перемешивали в течение ночи при кипении с обратным холодильником. После выпаривания растворителя остаток повторно растворяли в дихлорметане и 4 раза промывали водой. Органический слой высушивали и выпаривали. Полученный остаток очищали хроматографией (смесь дихлорметан:7 Н NH3 в метаноле, 98:2) с получением 24 г (84%) промежуточного соединения f-2 (R2=H и R4=-CH2-(2-пиридинил. Пример 14. Получение соединения 20. Соединение 20 также можно получить способом, представленным на схеме G. Конкретный способ представлен на схеме I. Схема I- 23006096 Хлорсульфоновую кислоту (0,193 кг; 1,65 моль) перемешивали при 10 С в атмосфере азота. Осторожно добавляли соединение i-1. Реакционную смесь перемешивали в течение 3 ч при 90 С. Нагревание прекращали и медленно добавляли тионилхлорид (0,079 кг; 0,66 моль). Реакционную смесь перемешивали еще в течение 1 ч при 90 С. Реакционную смесь охлаждали до 35 С и затем медленно добавляли 200 мл этилацетата. После начала осаждения продукта быстро добавляли еще 200 мл этилацетата. Осадок отфильтровывали и дважды промывали 2 00 мл этилацетата и дважды 1000 мл холодной водой. Затем осадок перемешивали в растворе NaHCO3 до рН 7. Данную смесь фильтровали и белое твердое вещество i-2 высушивали в вакуумной печи при 50 С (0,123 кг, 80%)(ЖХ/МС MW+; 280,282). Смесь 0,120 кг (0,36 моль) промежуточного соединения i-3 и 0,073 кг (0,72 моль) триэтиламина в 2 метилтетрагидрофуране (1,150 кг) перемешивали при 35 С до растворения реагентов. Затем добавляли 0,100 кг (0,36 моль) промежуточного соединения i-2 и реакционную смесь перемешивали в течение 1,5 ч при 55 С. После промывки реакционной смеси водой (0,500 кг) органический слой отделяли и промывали 0,500 кг 1,5 Н раствора HCl. Затем отделяли органический слой, высушивали и выпаривали с получением соединения i-4; 0,208 кг (100%). (ЖХ/МС MW+; 480, 481, 482). 0,208 кг (0,36 моль) промежуточного соединения i-4 перемешивали в смеси 1 кг 2-метилтетрагидрофурана, 0,060 кг H2O и 0,110 кг этанола при 40 С до растворения всех реагентов. Затем добавляли 0,200 кг (0,4 моль) гексагидрата монопероксифталата магния. Смесь перемешивали и нагревали в течение 15 мин при 60 С. Реакционную смесь подщелачивали 0,400 кг Na2CO3 до рН 10. Промежуточные соединения i-5 и i-6 (примерно 70% соединения i-5 и 30% соединения i-б) . (ЖХ/МС MW+ i-5; 496, 497, 498MW+ i-6; 511, 513). К данной реакционной смеси добавляли при 60 С 0,050 кг (0,43 моль) N-(2-аминоэтилпирролидина). Данную смесь перемешивали в течение 20 ч при 70 С. Затем суспензию охлаждали до 4 0 С и по каплям добавляли концентрированную HCl (12 Н) до рН 7-8. Наблюдали осаждение твердой фазы. Органический слой отделяли, упаривали и высушивали в вакуумной печи при 50 С с получением Воc N-защищенного соединения i-7; 0,217 кг (93%). (ЖХ/МС MW+; 646, 647, 648). 0,217 кг (0,36 моль) промежуточного Воc N-защищенного соединения i-7 растворяли в 1,4 кг изопропанола при 50 С. Затем добавляли 0,370 л 6 Н HCl (2 моль) и смесь нагревали и перемешивали в течение 2,5 ч при 70 С. Данную горячую реакционную смесь добавляли по каплям к 0,50 кг холодного(0 С-15 С) изопропанола. Осадок отфильтровывали и промывали диизопропиловым эфиром. Светлокоричневое вещество растирали в смеси DIPE/толуол (50/50) и затем фильтровали, и высушивали в вакуумной печи при 50 С с получением 0,170 кг (76%) гидрохлорида i-7. (ЖХ/МС MW+; 546, 547, 548). Смесь 1,3 г промежуточного соединения i-7, 0,774 г 1-(3S,3aR,6aS)+(3R,3aS,6aR)гексагидрофуро[2,3-b]фуран-3-ил]окси]карбонил]окси]-2,5-пирролидиндиона (полученного аналогично способу, описанному в заявке WO9967417) и 0,33 г триэтиламина в 100 мл дихлорметана перемешивали при комнатной температуре в течение 24 ч. Данный неочищенный продукт промывали раствором NaHCO3. Органический слой высушивали и растворитель выпаривали при пониженном давлении. Остаток очищали на силикагеле с получением 0,74 г (45%) соединения 20. Данные масс-спектрометрии: m/z=702 (M+H). Пример 15. Получение соединения 85 и его промежуточных соединений (R1=изобутил). Данное соединение получали способом, представленным на схеме Н. 11 г промежуточного соединения h-1 (PG=Boc, R1=изобутил) 1,1-диметилэтиловый эфир [(IS,2R)-2 гидрокси-3-[(2-метилпропил)2-(метилтио)бензотиазол-6-ил]сульфонил]амино]-1-(фенилметил)пропил] карбаминовой кислоты растворяли в 300 мл HCl в изопропаноле и 100 мл дихлорметана, и раствор перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали и обрабатывали смесью дихлорметана и гидроксида натрия в воде. Затем органический слой высушивали над MgSO4 и выпаривали с получением 8,8 г (97%) промежуточного соединения N-[(2R,3S)-3-амино-2 гидрокси-4-фенилбутил]-N-(2-метилпропил)[2-(метилтио)бензотиазол-б-ил]сульфонамида со снятой защитой в виде свободного основания. Данные масс-спектрометрии: m/z=480 (M+H). 4,15 г предыдущего промежуточного соединения, 2 г Boc-L-трет-лейцина, 1,17 г HOBt и 1,66 г EDC растворяли в 150 мл дихлорметана и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь последовательно промывали раствором NaHCO3 в воде, насыщенным раствором соли, высушивали над MgSO4 и выпаривали с получением 6 г (100%) промежуточного соединения h-2 1,1 диметилэтилового эфира [(1S)-1-(1S,2R)-2-гидрокси-3-[(2-метилпропил)[(2-(метилтио)-бензотиазол-6 ил)сульфонил]амино]-1-(фенилметил)пропил]амино]карбонил]-2,2-диметилпропил]карбаминовой кислоты. Данные масс-спектрометрии: m/z=693 (M+H). 6 г промежуточного соединения h-2 растворяли в 100 мл HCl в изопропаноле и перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь концентрировали и обрабатывали сме- 24006096 сью дихлорметана и раствора карбоната натрия в воде. Затем органическую фазу промывали насыщенным раствором соли, высушивали над MgSO4 и упаривали с получением 3,9 г (76%) промежуточного соединения со снятой защитой в виде свободного основания. Данные масс-спектрометрии: m/z=593(M+H). 3,9 г предыдущего соединения, 0,69 г хлоруксусной кислоты, 0,98 г HOBt и 1,38 г EDC растворяли в 100 мл дихлорметана и перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь промывали насыщенным раствором соли, высушивали над MgSO4 и выпаривали. Неочищенное соединение очищали на силикагеле, элюируя 0-5% метанолом в дихлорметане с получением 3,72 г (85%) желаемого промежуточного соединения h-3 2-[(хлорацетил)амино]-3,3-диметил-N-[(1S,2R)-2-гидрокси 3-[(2-метилпропил)2-(метилтио)бензотиазол-6-ил]сульфонил]амино]-1-(фенилметил)пропил]-(2S)бутанамида. Данные масс-спектрометрии: m/z=669 (M+H). 3,72 г промежуточного соединения h-З и 1,27 мл мета-фторбензиламина растворяли в ДМФА и перемешивали при 60 С в течение 2 ч. Затем реакционную смесь концентрировали и обрабатывали смесью дихлорметана и раствора карбоната натрия в воде. Затем органическую фазу высушивали над MgSO4 и упаривали с получением 4,3 г (100%) желаемого промежуточного соединения N'-[(3-фторфенил)метил] глицил-N-[(1S,2R)-2-гидрокси-З-[(2-метилпропил)2-(метилтио)бензотиазол-6-ил]сульфонил]амино]-1(фенилметил)пропил]-3-метил-L-валинамида. Данные масс-спектрометрии: m/z=758 (M+H). 4,2 г предыдущего промежуточного соединения, 1,2 г Вос 2 О и 0,77 мл триэтиламина растворяли в 50 мл дихлорметана. Реакционную смесь перемешивали в течение ночи при комнатной температуре и добавляли 1,2 г Вос 2 О. Через 5 ч реакционную смесь последовательно промывали раствором карбоната натрия в воде, насыщенным раствором соли, высушивали над MgSO4 и упаривали. Неочищенное вещество очищали на силикагеле, элюируя 2-5% метанолом в дихлорметане, с получением 3,2 г (67%) желаемого промежуточного соединения h-4 N'-[(1,1-диметилэтокси)карбонил]-N'-[(3-фторфенил)метил]глицил-N-[(1S,2R)-2-гидрокси-3-[(2-метилпропил)2-(метилтио)бензотиазол-6-ил]сульфонил]амино]-1(фенилметил)пропил]-3-метил-L-валинамида. Данные масс-спектрометрии: m/z=858 (M+H). Проводили реакцию 3,2 г промежуточного соединения h-4 с 0,92 г мета-хлорпероксибензойной кислоты (mСРВА) в 100 мл дихлорметана при комнатной температуре в течение 1 ч 30 мин. Затем реакционную смесь промывали раствором карбоната натрия в воде, высушивали над MgSO4 и упаривали с получением 3,45 г (100%) желаемого промежуточного соединения h-5 N'-[(1,1-диметилэтокси)карбонил]N'-[(3-фторфенил)метил]глицил-N-[(1S,2R)-2-гидрокси-3-[(2-метилпропил)2-(метилтио)бензотиазол-6 ил]сульфонил]амино]-1-(фенилметил)пропил]-3-метил-L-валинамида. Данные масс-спектрометрии:m/z=874 (M+H). 0,5 г промежуточного соединения h-5 вводили в реакцию с 0,16 мл N-(2-аминоэтил)пирролидина в 10 мл ацетонитрила при 60 С в течение 1 ч 30 мин. Затем реакционную смесь упаривали и очищали на силикагеле, элюируя 5-10% метанолом в дихлорметане, с получением 0,24 г (46%) желаемого промежуточного соединения N'-[(1,1-диметилэтокси)карбонил]-N'-[(3-фторфенил)метил]глицил-N-[(1S,2R)-2 гидрокси-3-[(2-метилпропил)2-[2-(пирролидин-1-ил)этиламино]бензотиазол-6-ил]сульфонил]амино]-1(фенилметил)пропил]-3-метил-L-валинамида. Данные масс-спектрометрии: m/z=924 (M+H). 0,15 г предыдущего промежуточного соединения растворяли в 5 мл HCl в изопропаноле. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали. Сырое соединение очищали препаративной ВЭЖХ с получением 60 мг желаемого конечного соединения 85 бистрифторацетата N'-[(3-фторфенил)метил]глицил-N-[(1S,2R)-2-гидрокси-3-[(2-метилпропил)2-[2-(пирролидин-1-ил)этиламино]бензотиазол-6-ил]сульфонил]амино]-1-(фенилметил)пропил]-3-метил-Lвалинамида, полученного в виде соли ТФУК. Данные масс-спектрометрии: m/z=824 (М+Н). Пример 16. Получение соединения 86 (R1=изобутил). Проводили реакцию 0,5 г промежуточного соединения h-5 с 0,16 мл 3-(диметиламино)пропиламина в 10 мл ацетонитрила при 60 С в течение 2 ч. Затем реакционную смесь выпаривали с получением 0,54 г(100%) желаемого промежуточного соединения N'-[(1,1-диметилэтокси)карбонил]-N'-[(3-фторфенил) метил]глицил-N-[(1S,2R)-2-гидрокси-3-2-[3-(диметиламино)пропиламино]бензотиазол-6-ил]сульфонил](2-метилпропил)амино]-1-(фенилметил)пропил]-3-метил-L-валинамида. Данные масс-спектрометрии: m/z=912 (М+Н). 0,54 г предыдущего промежуточного соединения растворяли в 10 мл HCl в изопропаноле. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали. Сырое соединение очищали препаративной ВЭЖХ с получением 83 мг желаемого конечного соединения 86 бистрифторацетата Проводили реакцию 0,5 г промежуточного соединения h-5 с 0,18 г N-метил,N-(2-морфолин-4 илэтил)амина в 10 мл ацетонитрила при 60 С в течение ночи. В реакционную смесь вводили еще 0,9 г Nметил, N-(2-морфолин-4-илэтил)амина и дополнительно перемешивали в течение 2 суток. Затем реакционную смесь упаривали и очищали на силикагеле, элюируя 5% метанолом в дихлорметане, с получением 0,6 г (100%) желаемого промежуточного соединения N'-[(1,1-диметилэтокси)карбонил]-N'-[(3-фторфенил)метил]глицил-N-[(1S,2R)-2-гидрокси-3-2-[N-метил,N-(2-морфолин-4-илэтил)амино]бензотиазол-6 ил]сульфонил](2-метилпропил)амино]-1-(фенилметил)пропил]-3-метил-L-валинамида. Данные массспектрометрии: m/z=954 (M+H). 0,6 г предыдущего промежуточного соединения растворяли в 100 мл HCl в изопропаноле. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем упаривали и обрабатывали смесью дихлорметана и раствора карбоната натрия в воде. Затем органическую фазу высушивали надMgSO4 и упаривали. Неочищенное соединение очищали препаративной ВЭЖХ с получением 424 мг(60%) желаемого конечного соединения 87 бис-трифторацетата N'-[(3-фторфенил)метил]глицил-N[(1S,2R)-2-гидрокси-3-2-[N-метил,N-(2-морфолин-4-илэтил)амино]бензотиазол-6-ил]сульфонил](2 метилпропил)амино]-1-(фенилметил)пропил]-3-метил-L-валинамида, полученного в виде соли ТФУК. Данные масс-спектрометрии: m/z=854 (M+H). В последующих таблицах представлены соединения формулы (I), которые были получены по одной из представленных выше схем реакций.
МПК / Метки
МПК: C07D 277/82, A61K 31/428, A61P 31/18
Метки: действия, вич, спектра, протеазы, ингибиторы, основе, широкого, сульфонамидов, 2-(замещенных-амино, бензотиазолов
Код ссылки
<a href="https://eas.patents.su/30-6096-ingibitory-proteazy-vich-shirokogo-spektra-dejjstviya-na-osnove-sulfonamidov-2-zameshhennyh-amino-benzotiazolov.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы протеазы вич широкого спектра действия на основе сульфонамидов 2-(замещенных-амино) бензотиазолов</a>












