Гетероциклические замещённые 4-(аминометил) пиперидин бензамиды в качестве 5-нт4-антагонистов
Номер патента: 8514
Опубликовано: 29.06.2007
Авторы: Мевеллек Лоранс Анн, Босман Жан-Поль Рене Мари Андре, Гейсен Хенрикус Якобус Мария
Формула / Реферат
1. Соединение формулы (I)
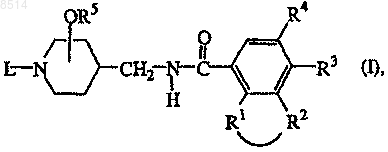
его стереохимически изомерная форма, его N-оксидная форма или его фармацевтически приемлемая соль присоединения кислоты или основания, в которой
-R1-R2- представляет собой бивалентный радикал формулы
| -О-СН2-О- | (а-1), |
| -О-СН2-СН2- | (а-2), |
| -О-СН2-СН2-О- | (а-3), |
| -О-СН2-СН2-СН2- | (а-4), |
| -О-СН2-СН2-СН2-О- | (а-5), |
| -О-СН2-СН2-СН2-СН2- | (а-6), |
| -О-СН2-СН2-СН2-СН2-О- | (а-7), |
| -О-СН2-СН2-СН2-СН2-СН2- | (а-8), |
где в указанных бивалентных радикалах необязательно 1 или 2 атома водорода при одном и том же или при различных атомах углерода могут быть замещены C1-6алкилом или гидрокси,
R3 представляет собой водород, галоген, C1-6алкил или C1-6алкилокси;
R4 представляет собой водород, галоген, C1-6алкил; C1-6алкил, замещенный циано или C1-6алкилокси; C1-6алкилокси; циано; амино или моно или ди(C1-6алкил)амино;
R5 представляет собой водород или C1-6алкил и радикал -OR5 находится в 3- или 4-положении пиперидинового фрагмента;
L представляет собой радикал формулы
| -Alk-R6 | (b-1), |
| -Alk-X-R7 | (b-2), |
где каждый Alk представляет собой C1-12алкандиил; и
R6 представляет собой Het;
R7 представляет собой Het;
X представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород или C1-6алкил; и
Het представляет собой морфолинил; морфолинил, замещенный C1-6алкилом; тетразолил; тетразолил, замещенный галогеном, гидрокси или C1-6алкилом; пиразолил; пиразолил, замещенный галогеном, гидрокси или C1-6алкилом; изоксазолил; изоксазолил, замещенный галогеном, гидрокси или C1-6алкилом; изотиазолил; изотиазолил, замещенный галогеном, гидрокси или C1-6алкилом; 2,4-диоксоимидазо-лидинил; 2,4-диоксоимидазолидинил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена или C1-6алкила; оксазолил; оксазолил, замещенный галогеном, гидрокси или C1-6алкилом; тиазолил; тиазолил, замещенный галогеном, гидрокси или C1-6алкилом; или пиранил; пиранил, замещенный галогеном, гидрокси или C1-6алкилом.
2. Соединение по п.1, где радикал -OR5 находится в 3-положении пиперидинового фрагмента в транс-конфигурации.
3. Соединение по п.2, где абсолютная конфигурация указанного пиперидинового фрагмента представляет собой конфигурацию (3S,4S).
4. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4алкандиил и R6 представляет собой Het, где Het представляет собой морфолинил.
5. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4алкандиил и R6 представляет собой Het, где Het представляет собой пиразолил, замещенный гидрокси, изоксазолил, замещенный гидрокси, или 2,4-диоксоимидазолидинил.
6. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой С1-4алкандиил и R6 представляет собой Het, где Het представляет собой тетразолил или тетразолил, замещенный гидрокси.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, где терапевтически активное количество соединения по любому из пп.1-6 тщательно перемешивают с фармацевтически приемлемым носителем.
9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
10. Способ получения соединения формулы (I), в котором
промежуточное соединение формулы (II) подвергают взаимодействию с производным карбоновой кислоты формулы (III) или ее реакционноспособным функциональным производным
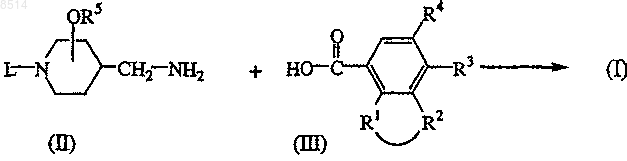
или соединения формулы (I) превращают друг в друга по известным в данной области реакциям превращения; или при необходимости соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или наоборот, соль присоединения кислоты соединения формулы (I) переводят в форму свободного основания под действием щелочи; и при необходимости получения их стереохимически изомерных форм.
11. Способ получения соединения формулы (I), в котором
промежуточное соединение формулы (IV) подвергают N-алкилированию промежуточным соединением формулы (V) в реакционноинертном растворителе необязательно в присутствии подходящего основания
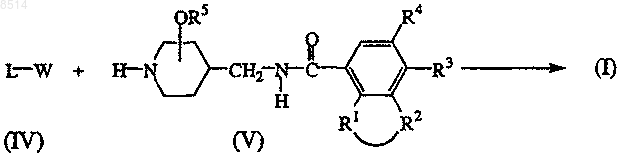
где в вышеприведенных реакционных схемах радикалы -R1-R2-, R3, R4, R5 и L имеют значения, определеные в п.1, и W представляет собой подходящую удаляемую группу;
или соединения формулы (I) превращают друг в друга по известным в данной области реакциям превращения; или при необходимости соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или наоборот, соль присоединения кислоты соединения формулы (I) переводят в форму свободного основания под действием щелочи; и при необходимости получения их стереохимически изомерных форм.
Текст
008514 Настоящее изобретение относится к новым соединениям формулы (I), обладающим свойствами 5 НТ 4-антагонистов. Изобретение также относится к способам получения таких новых соединений, фармацевтическим композициям, содержащим указанные новые соединения, а также применению указанных соединений в качестве лекарственных средств. В документе WO-00/37461 описываются бициклические бензамиды 3- или 4-замещенных 4-(аминометил)пиперидиновых производных, обладающие свойствами 5-НТ 4-антагонистов. Соединения по настоящему изобретению структурно отличаются от указанных известных из уровня техники соединений наличием другого фрагмента радикала L. Неожиданно настоящие соединения формулы (I) проявили повышенную метаболическую стабильность по сравнению с соединениями, описанными в WO-00/37461. Настоящее изобретение относится к соединениям формулы (I) их стереохимически изомерным формам, N-оксидным формам или фармацевтически приемлемым солям присоединения кислоты или основания, в которой-R1-R2- представляет собой бивалентный радикал формулы-О-СН 2-О(а-1),-О-СН 2-СН 2(а-2),-О-СН 2-СН 2-О(а-3),-О-СН 2-СН 2-СН 2(а-4),-О-СН 2-СН 2-СН 2-О(а-5),-О-СН 2-СН 2-СН 2-СН 2(а-6),-О-СН 2-СН 2-СН 2-СН 2-О(а-7),-О-СН 2-СН 2-СН 2-СН 2-СН 2(a-8),где в указанных бивалентных радикалах необязательно 1 или 2 атома водорода при одном и том же или при различных атомах углерода могут быть замещены C1-6 алкилом или гидрокси;R4 представляет собой водород, галоген, C1-6 алкил; C1-6 алкил, замещенный циано или C1-6 алкилокси;C1-6 алкилокси; циано; амино или моно или ди(C1-6 алкил)амино;R5 представляет собой водород или С 1-6 алкил и -OR5 радикал находится в 3- или 4-положении пиперидинового фрагмента;L представляет собой радикал формулыX представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород или C1-6 алкил; иHet представляет собой морфолинил; морфолинил, замещенный C1-6 алкилом; тетразолил; тетразолил, замещенный галогеном, гидрокси или C1-6 алкилом; пиразолил; пиразолил, замещенный галогеном,гидрокси или C1-6 алкилом; изоксазолил; изоксазолил, замещенный галогеном, гидрокси или C1-6 алкилом; изотиазолил; изотиазолил, замещенный галогеном, гидрокси или C1-6 алкилом; 2,4-диоксоимидазолидинил; 2,4-диоксоимидазолидинил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена или C1-6 алкила; оксазолил; оксазолил, замещенный галогеном, гидрокси или C1-6 алкилом; тиазолил; тиазолил, замещенный галогеном, гидрокси или C1-6 алкилом; или пиранил; пиранил, замещенный галогеном, гидрокси или C1-6 алкилом. В вышеприведенных определениях галоген обобщенно означает фтор, хлор, бром и иод; C1-4 алкил означает насыщенные углеводородные радикалы с нормальной или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил и т.п.; подразумевается, что C1-6 алкил включает C1-4 алкил и его высшие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, пентил, гексил и т.п.; C1-12 алкандиил означает бивалентные углеводородные радикалы с нормальной или разветвленной цепью, содержащие от 1 до 12 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил, 1,11-ундекандиил,1,12-додекандиил и их разветвленные изомеры. C1-4 Алкандиил означает бивалентные углеводородные радикалы с нормальной или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метандиил, 1,2-этандиил, 1,3-пропандиил и 1,4-бутандиил. Вышеприведенный термин "стереохимически изомерные формы" означает все возможные изомер-1 008514 ные формы, которые могут иметь соединения формулы (I). Если не отмечено или не указано особо, то химическое обозначение соединений относится к смеси всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереоизомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители в бивалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию. Соединения, включающие двойные связи, могут обладать Е- или Z-стереохимией при указанной двойной связи. Предполагается, что стереохимически изомерные формы соединений формулы (I) с очевидностью включены в объем данного изобретения. Предполагается, что вышеупомянутые фармацевтически приемлемые соли присоединения кислоты или основания включают терапевтически активные нетоксичные солевые формы присоединения кислоты или основания, которые могут быть образованы соединениями формулы (I). Фармацевтически приемлемые соли присоединения кислоты могут быть легко получены обработкой основной формы соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлористо-водородная или бромисто-водородная кислота, серная, азотная, фосфорная и т.п. кислоты; органические кислоты, такие как,например, уксусная, пропионовая, оксиуксусная, молочная, пировиноградная, щавелевая, (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и т.п. кислоты. Обратно, указанные солевые формы могут быть превращены в свободную основную форму обработкой соответствующим основанием. Соединения формулы (I), содержащие кислотный протон, могут быть также превращены в их нетоксичные солевые формы присоединения металла или амина обработкой соответствующими ограническими или неорганическими основаниями. Соответствующие основно-солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия,магния, кальция и т.п., соли с ограническими основаниями, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Вышеупомянутый термин "соль присоединения" также включает сольваты, которые могут быть образованы соединениями формулы (I), а также их солями. Такие сольваты представляют собой, например,гидраты, алкоголяты и т.п. Некоторые из соединений формулы (I) могут также существовать в их таутомернойформе. Предполагается, что такие формы, хотя точно не указанные в вышеприведенной формуле, включены в объем данного изобретения. Предполагается, что N-оксидные формы соединений формулы (I), которые могут быть получены способами, известными в данной области, включают такие соединения формулы (I), где 1 или несколько атомов азота окислены до N-оксида. В частности, такие N-оксиды предусмотрены в случаях, где пиперидиновый азот является N-окисленным. Группа соединений, представляющих интерес, включает такие соединения формулы (I), где действуют одно или несколько следующих ограничений:a) -R1-R2- представляет собой радикал формулы (а-3); и/илиb) -R1-R2- представляет собой радикал формулы (а-5); и/илиf) R5 представляет собой водород или метил и -OR5 радикал находится в 3- или 4-положении пиперидинового цикла; и/илиg) R5 представляет собой водород или метил и -OR5 радикал находится в 3-положении пиперидинового цикла; и/илиh) -OR5 радикал, в котором R5 представляет собой водород или метил, находится в 3-положении пиперидинового цикла и в транс-положении по отношению к метилену в 4-положении пиперидинового фгагмента; и/илиi) -OR5 радикал, в котором R5 представляет собой водород или метил, находится в 3-положении пиперидинового цикла и в транс-положении по отношению к метилену в 4-положении пиперидинового фрагмента и абсолютная конфигурация указанного пиперидинового фрагмента представляет собой конфигурацию (3S,4S); и/илиj) L представляет собой радикал формулы (b-1), в которой Alk представляет собой С 1-4 алкандиил иL представляет собой радикал формулы (b-1), в которой Alk представляет собой С 1-4 алкандиил и R6 представляет собой Het, где Het представляет собой пиразолил, замещенный гидрокси, или изоксазолил,замещенный гидрокси; илиL представляет собой радикал формулы (b-1), в которой Alk представляет собой С 1-4 алкандиил и R6 представляет собой Het, где Het представляет собой 2,4-диоксоимидазолидинил; илиL представляет собой радикал формулы (b-1), в которой Alk представляет собой С 1-4 алкандиил и R6 представляет собой Het, где Het представляет собой тетразолил или тетразолил, замещенный гидрокси. Другими соединениями, представляющими интерес, являются такие соединения формулы (I), где-R1-R2- представляет собой бивалентный радикал формулыR5 представляет собой водород или C1-6 алкил и -OR5 радикал находится в 3- или 4-положении пиперидинового фрагмента;L представляет собой радикал формулыHet представляет собой морфолинил; морфолинил, замещенный C1-6 алкилом; тетразолил; тетразолил, замещенный галогеном, гидрокси или C1-6 алкилом; пиразолил; пиразолил, замещенный галогеном,гидрокси или C1-6 алкилом; изоксазолил; изоксазолил, замещенный галогеном, гидрокси или C1-6 алкилом; или 2,4-диоксоимидазолидинил; 2,4-диоксоимидазолидинил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена или C1-6 алкила. Конкретными соединениями являются такие соединения формулы (I), где радикал -OR5, предпочтительно представляющий собой гидрокси или метокси, находится в 3-положении пиперидинового фрагмента в транс-конфигурации, т.е. радикал -OR5 находится в транс-положении относительно метилена пиперидинового фрагмента. Более конкретными соединениями являются такие соединения формулы (I), где бивалентный радикал -R1-R2- представляет собой радикал формулы (а-3), (а-5), радикал -OR5 представляет собой гидрокси и находится в 3-положении пиперидинового фрагмента в (3S-транс)-конфигурации, которая соответствует абсолютной (3S, 4S)-конфигурации указанного пиперидинового фрагмента. Предпочтительными соединениями являются такие более конкретные соединения, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой морфолинил. Другими предпочтительными соединениями являются такие более конкретные соединения, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой пиразолил, замещенный на гидрокси, или изоксазолил,замещенный на гидрокси. Другими предпочтительными соединениями являются такие более конкретные соединения, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой 2,4-диоксоимидазолидинил. Другими предпочтительными соединениями являются такие более конкретные соединения, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой тетразолил или тетразолил, замещенный на гидрокси. Соединения формулы (I) могут быть получены взаимодействием промежуточного соединения формулы (II) с производным карбоновой кислоты формулы (III) или необязательно с ее реакционноспособным функциональным производным, таким как, например, карбонилимидазольные производные, ацилгалогениды или смешанные ангидриды. Образование указанной амидной связи может быть достигнуто при перемешивании реагентов в соответствующем растворителе, необязательно в присутствии основания,такого как триэтиламин. Также соединения формулы (I) большей частью могут быть получены N-алкилированием промежуточного соединения формулы (V) с помощью промежуточного соединения формулы (IV), где W представляет собой удаляемую группу, такую как, например, галоген, например фтор, хлор, бром, иод, или в некоторых примерах W также может представлять собой сульфонилоксигруппу, например метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и подобные реакционноспособные удаляемые группы. Взаимодействие может быть проведено в реакционноинертном растворителе, таком как,например, ацетонитрил, 2-пентанол, изобутанол, диметилацетамид или ДМФА (DMF), и необязательно в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия, N-метилпирролидон или триэтиламин. Перемешивание может повышать скорость реакции. Взаимодействие мо-3 008514 жет быть легко проведено при температуре, изменяющейся от комнатной температуры до температуры дефлегмации реакционной смеси. Промежуточные соединения формулы (V) могут быть получены взаимодействием промежуточного соединения формулы (VI), где PG представляет собой соответствующую защитную группу, известную в данной области, такую как, например, трет-бутоксикарбонил, или бензилгруппа, или группа, удаляемая при действии света, с кислотой формулы (III) или ее реакционноспособным функциональным производным, таким как, например, карбонилимидазольные производные, и последующим снятием защиты с полученного таким образом промежуточного соединения, т.е. удалением PG способами, известными в данной области. Соединения формулы (I) также могут быть получены превращением соединений формулы (I) друг в друга по известным в данной области реакциям превращения групп. Исходные продукты и некоторые промежуточные соединения представляют собой известные соединения и являются коммерчески доступными или могут быть получены обычными методами взаимодействия, в целом, известными в данной области. Например, промежуточные соединения формулы (II) из(VI) могут быть получены по методикам, описанным в WO-99/02156 или WO-00/37461. Промежуточные соединения формулы (VI) могут быть приготовлены по общей методике, описанной в документе WO-99/02156 и WO-00/37461 для описанных в нем промежуточных соединений формулы (VIII). Соединения формулы (I), полученные вышеописанными способами, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть разделены с помощью известных в данной области методик разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереоизомерные солевые формы взаимодействием с подходящей хиральной кислотой. Указанные диастереоизомерные солевые формы затем разделяют, например, селективной или дробной кристаллизацией и энантиомеры извлекают посредством щелочи. Другой способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных продуктов при условии, что реакция проходит стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В таких способах преимущественно будут применяться энантиомерно чистые исходные продукты. Соединения формулы (I), их N-оксидные формы, их фармацевтически приемлемые соли присоединения кислоты или основания (их кислотно- или основно-аддитивные соли), их стереоизомерные формы обладают 5-НТ 4-антагонистическими свойствами, описанными в примере С.1. Кроме того, соединения формулы (I) проявили повышенную метаболическую стабильность, описанную в примере С.2. Такие полезные свойства метаболической стабильности способствуют снижению риска взаимодействия лекарственное средство-лекарственное средство на уровне ферментов цитохрома Р 450, таких как, например, CYP1A2, CYP3A4, CYP2D6, CYP2C9 и CYP2C19, и поэтому данные соединения обладают повышенным профилем лекарственной безопасности. Более того, такие полезные свойства метаболической стабильности могут преполагать только одноразовое суточное введение соединений формулы (I) вместо обычного введения активного ингредиента по схеме от 2 до 4 введений в сутки, тем самым улучшая соблюдение больным режима и схемы лечения. С учетом 5-НТ 4-антагонистических свойств соединений по настоящему изобретению заявленные соединения, в основном, могут применяться для лечения или профилактики желудочно-кишечных состояний, таких как гипермотильность, синдром раздраженной толстой кишки (IBS), IBS с преобладанием запора или поноса, IBS с преобладанием боли или без боли, гиперчувствительность пищеварительного тракта, редукция боли, связанная с гиперчувствительностью и/или гиперактивностью желудочно-кишечного тракта. Также предполагают, что соединения формулы (I) применимы для предотвращения или профилактики расстроенной, задержанной или ослабленной желудочной аккомодации, такой как диспепсия. Диспепсические симптомы представляют собой, например, эпигастральное давление, отсутствие аппетита,чувство переполнения, раннее насыщение, тошноту, рвоту, метеоризм и газовую отрыжку.-4 008514 Соединения формулы (I) также могут применяться для лечения других нарушений, связанных с 5 НТ 4-рецепторами, таких как булимия и гиперфагия. Из применимости соединений формулы (I) следует, что данное изобретение также относится к способу лечения теплокровных животных, включая людей (здесь, в основном, пациентов), страдающих желудочно-кишечными нарушениями, такими как синдром раздраженной толстой кишки (IBS). Таким образом, способ лечения относится к облегчению состояний у пациентов, страдающих от нарушений, таких как гипермотильность, синдром раздраженной толстой кишки (IBS), IBS с преобладанием запора или поноса, IBS с преобладанием боли или без боли, гиперчувствительность пищеварительного тракта, редукции боли, связанной с гиперчувствительностью и/или гиперактивностью желудочно-кишечного тракта. Потенциально соединения формулы (I) могут также применяться при других желудочно-кишечных расстройствах, таких как расстройства, связанные с перистальтикой верхнего отдела пищеварительного тракта. В частности, они потенциально применимы для лечения желудочных симптомов гастроэзофагеального рефлюкса, таких как изжога (включая эпизодическую изжогу, ночную изжогу и изжогу от пищи). Кроме того, потенциально 5-НТ 4-антагонистические соединения формулы (I) также могут применяться для лечения и профилактики гиперчувствительности мочевого пузыря, гиперфункции мочевого пузыря, симптомов нижнего отдела мочевых путей, доброкачественной гипертрофии предстательной железы (ВРН), простатита, детрузорной гиперрефлексии, обструкции истечения, частого мочеиспускания, никтурии, неотложного недержания мочи, тазовой гиперчувствительности, недержания позывов,уретрита, простатодинии, цистита, идиопатической гиперчувствительности мочевого пузыря, недержания мочи или недержания мочи, связанного с синдромом раздраженной толстой кишки. В этом отношении преимущество может заключаться в комбинации 5-НТ 4-антагонистических соединений формулы (I) с антагонистом альфа-адренорецептора, таким как альфузозин, индорамин, тамсулозин, доксазозин, теразозин, абанохил или празозин, для получения фармацевтических композиций, содержащих такой антагонист альфа-адренорецептора и антагонист 5-НТ 4-рецептора формулы (I). Таким образом, настоящее изобретение предусматривает соединения формулы (I) для применения в качестве лекарственных средств, и в частности применение соединений формулы (I) для производства лекарственных средств для лечения желудочно-кишечных нарушений, таких как гипермотильность, IBS,IBS с преобладанием запора или поноса, IBS с преобладанием боли или без боли, и редукции боли, связанной с гиперчувствительностью и/или гиперактивностью желудочно-кишечного тракта. Предусматривается как профилактическое, так и терапевтическое лечение. С учетом 5-НТ 4-антагонистических свойств соединений по настоящему изобретению заявленные соединения могут также применяться для лечения или профилактики нарушений ЦНС (CNS), связанных с 5-НТ 4-рецепторами, у человека. В частности, соединения формулы (I) могут применяться для лечения ряда нарушений ЦНС, включающих, но не ограниченных ими, токсикоманию, расстройства познавательной способности, такие как болезнь Альцгеймера, старческая деменция; поведенческие расстройства, такие как шизофрения, мания, обисивно-компульсивное расстройство и расстройства, связанные с употреблением психотропных веществ; расстройства настроения, такие как депрессия, биполярное аффективное расстройство, тревога и паника; нарушения контроля автономной функции, такие как гипертензия и расстройства сна; обиссивные/компульсивные расстройства, включающие анорексию, булимию и неврологические расстройства с нарушением психики, такие как синдром Жилль де ла Туретта и болезнь Хантингтона. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения, взятого в форме основно- или кислотно-аддитивной соли в качестве активного ингредиента, комбинируют при тщательном перемешивании с фармацевтически приемлемым носителем, при этом данный носитель может быть в различных формах в зависимости от формы препарата,требуемой для введения. Такие фармацевтические композиции желательно иметь в стандартной лекарственной форме, подходящей предпочтительно для введения перорально, ректально или для парентеральной инъекции. Например, при получении композиций в пероральной лекарственной форме может быть использована любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, замасливатели, связующие вещества, диспергирующие средства и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря легкости их введения таблетки и капсулы представляют собой наиболее удобную пероральную стандартную лекарственную форму, когда, очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель, как правило, содержит стерильную воду, по меньшей мере, в значительном количестве,хотя могут быть включены другие ингредиенты, например, для улучшения растворимости. Растворы для инъекций, например, могут быть получены в таком носителе, который состоит из физиологического раствора, раствора глюкозы или смеси физиологического раствора и раствора глюкозы. Могут быть также получены суспензии для инъекций, в которых может быть использован набор соответствующих жидких носителей и суспендирующих средств. В композициях, подходящих для чрескожного введения, носитель необязательно содержит средство, повышающее проницаемость, или подходящий смачивающий реагент,необязательно комбинированный с подходящими добавками любой природы в небольших количествах,-5 008514 которые не оказывают значительного вредного эффекта на кожу. Указанные добавки могут облегчать введение через кожу и/или могут быть полезными при приготовлении желаемых/требуемых композиций. Эти композиции могут быть введены различными путями, например в виде трансдермальной накладки,пятна, мази. Кислотно-аддитивные соли соединений (I) из-за их повышенной растворимости в воде по сравнению с соответствующей основной формой, очевидно, являются более подходящими при получении водных композиций. Особенно полезно получать вышеуказанные фармацевтические композиции в стандартной лекарственной форме для облегчения введения и единообразия дозировки. Стандартная лекарственная форма,как упоминается в описании и в формуле изобретения, относится к физически дискретным единицам,пригодным в качестве стандартных доз, причем каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного на получение желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая шероховатые таблетки или таблетки в оболочке), капсулы, пилюли, пакетики с порошком, облатки, инъецируемые растворы или суспензии, чайная ложка, столовая ложка и т.п. и их отдельные комбинации. Для перорального введения фармацевтические композиции могут быть в виде твердых лекарственных форм, например таблеток (формы, пригодные как для проглатывания, так и для разжевывания), капсул или гелей, полученных обычными способами с фармацевтически приемлемыми разбавителями, такими как связующие вещества (например, предварительно желатинизированный кукурузный крахмал,поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния,тальк или кремнезем); диспергирующие средства (например, картофельный крахмал или натрийгликолатное производное крахмала); или смачивающие реагенты (например, лаурилсульфат натрия). На таблетки способами, известными в данной области, может быть нанесено покрытие. Жидкие препараты для перорального введения могут принимать форму, например, растворов, сиропов или суспензий, или они могут быть сухим соединением для смешивания с водой или другим подходящим наполнителем перед применением. Такие жидкие препараты могут быть получены обычными способами, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сироп с сорбитом, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт); и консерванты (например, метил или пропил п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители включают предпочтительно по меньшей мере один сильный подсластитель, такой как сахарин, натриевая или кальциевая соль сахарина, аспартам, калий ацесульфам, натрия цикламат, элитам, дигидрохалконовый подсластитель, монелин, стевиозид или сукралоза (4,1',6'-трихлор-4,1',6'-тридеоксигалактосахароза), предпочтительно сахарин, натриевая или кальциевая соль сахарина, и необязательно объемный подсластитель, такой как сорбит, маннит, фруктоза,сахароза, мальтоза, изомальтоза, глюкоза, сироп с гидрированной глюкозой, ксилит, карамель или мед. Сильные подсластители удобно применять в малых концентрациях. Например, в случае натриевой соли сахарина концентрация может составлять от 0,04 до 0,1% (мас./об.) от общего объема конечного препарата и предпочтительно составляет примерно 0,06% в препаратах с низкой дозировкой и примерно 0,08% в препаратах с высокой дозировкой. Объемный подсластитель эффективно может быть применен в более значительных количествах, составляющих примерно от 10 до примерно 35%, предпочтительно примерно от 10 до 15% (мас./об.). Фармацевтически приемлемые корригенты, которые могут маскировать более горькие на вкус ингредиенты в препаратах с низкой дозировкой, представляют собой предпочтительно фруктовые корригенты, такие как вишневый, малиновый, черносмородиновый или земляничный корригенты. Комбинация двух корригентов может приводить к очень хорошим результатам. Для препаратов с высокой дозировкой могут потребоваться более эффективные корригенты, такие как карамельно-шоколадный корригент(Caramel Chocolate flavour), корригент со свежестью мяты (Mint Cool flavour) и корригент-фантазия (Fantasyflavour), и подобные фармацевтически приемлемые эффективные корригенты. Каждый корригент может присутствовать в окончательной композиции в концентрации, составляющей от 0,05 до 1% (мас./об.). Преимущественно применяются комбинации указанных эффективных корригентов. Предпочтительно применяют такой корригент, который не подвержен какому-либо изменению или не теряет вкус или цвет при подкислении препарата. Препараты по настоящему изобретению необязательно могут включать средство, предотвращающее метеоризм, такое как симетикон, альфа-D-галактосидаза и т.п. Соединения по настоящему изобретению могут быть получены как депо-препараты. Такие длительно действующие препараты могут быть введены путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения могут быть получены с подходящими полимерными или гидрофобными продуктами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или как умеренно растворимые производные, например как уме-6 008514 ренно растворимая соль. Соединения по настоящему изобретению могут быть получены для парентерального введения инъекцией, удобной внутривенной, внутримышечной или подкожной инъекцией, например болюсной инъекцией или непрерывной внутривенной инфузией. Препараты для инъекции могут находиться в стандартной лекарственной форме, например в ампулах или в многодозовых емкостях с добавлением консерванта. Композиции могут находиться в таких формах как суспензии, растворы или эмульсии в масляных или водных разбавителях и могут содержать адъюванты, такие как изотонизирующие, суспендирующие,стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для сочетания с подходящим разбавителем, например со стерильной апирогенной водой перед применением. Соединения по настоящему изобретению могут быть получены как ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные для суппозитория основы, такие как масло какао или другие глицериды. Для интраназального введения соединения по настоящему изобретению могут применяться, например, как жидкости для разбрызгивания, как порошки или в форме капель. В целом, предполагается, что терапевтически эффективное количество должно составлять от примерно 0,0001 до примерно 1 мг/кг массы тела, предпочтительно от примерно 0,001 до примерно 0,5 мг/кг массы тела. Экспериментальная часть В процедурах, описанных ниже, применяли следующие сокращения: "ACN" означает ацетонитрил;"THF" означает тетрагидрофуран; "DCM" означает дихлорметан; "DIPE" означает диизопропиловый эфир; "EtOAc" означает этилацетат; "NH4OAc" означает ацетат аммония; "MIK" означает метилизобутилкетон; "DMF" означает диметилформамид; "DMA" означает диметилацетамид. Для некоторых реагентов применяли химическую формулу, например NaOH для гидроксида натрия, Na2CO3 для карбоната натрия,К 2 СО 3 для карбоната калия, NH3 для аммиака, CuО для оксида меди(II), CH2Cl2 для дихлорметана,СН 3 ОН для метанола, НСl для хлористо-водородной кислоты и КОН для гидроксида калия, NaBF4 для тетрафторбората натрия. Chiralcel AD представляет собой хиральный продукт стационарной фазы колонки, полученный от Daicel Chemical Industries, LTD, в Японии. А. Получение промежуточных соединений. Пример А.1. а) Получение промежуточного соединения (1). Смесь метил 2,3-дигидрокси-5-метилбензоата (0,198 моль), 1,3-дибромпропана (0,198 моль) и К 2 СО 3 (0,396 моль) в 2-пропаноне (360 мл) перемешивали и кипятили с обратным холодильником 6 ч,затем охлаждали и растворитель выпаривали. Смесь выливали в ледяную воду и фильтровали. Фильтрат экстрагировали этилацетатом. Органический слой отделяли, сушили, фильтровали, растворитель выпаривали и очищали колоночной хроматографией на силикагеле (элюент: циклогексан/этлацетат от 80/20 до 70/30), получая промежуточный продукт (1).b) Получение промежуточного соединения (2). Смесь промежуточного соединения (1) (0,1129 моль) в смеси 2N раствора NaOH (370 мл) и ТГФ(THF) (370 мл) перемешивали при комнатной температуре 15 ч. ТГФ выпаривали и смесь подкисляли с помощью 12N НСl. Осадок фильтровали, промывали водой и сушили, получая 21,9 г промежуточного соединения (2) (т.пл. 74 С). Пример А.2. а) Получение промежуточного соединения (3). Смесь метилового эфира 2,3-дигидрокси-4-метилбензойной кислоты (1,2 моль), 1,3-дибромпропанаb) Получение промежуточного соединения (4). Смесь промежуточного соединения (3) (1,12 моль) в NaOH (2 М) (1800 мл) и ТГФ (THF) (500 мл) перемешивали и кипятили с обратным холодильником 3 ч. Реакционную смесь охлаждали и органический растворитель выпаривали. Водный концентрат подкисляли с помощью НСl и образовавшийся осадок отфильтровывали, промывали водой и сушили, получая 403 г промежуточного соединения (4). Пример А.3. а) Получение промежуточного соединения (5). Смесь метилового эфира 5-хлор-2,3-дигидроксибензойной кислоты (0,3 моль), 1,3-дибромпропана(0,42 моль) и К 2 СО 3 (0,66 моль) в 2-пропаноне (500 мл) перемешивали и кипятили с обратным холодильником 20 ч, затем горячую смесь фильтровали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: DCM). Целевые фракции собирали и растворитель выпаривали. Добавляли толуол и отгоняли азеотропную смесь на роторном испарителе, получая 69 г метил 8-хлор-3,4 дигидро-2H-1,5-бензодиоксепин-6-карбоксилата (промежуточное соединение 5).b) Получение промежуточного соединения (6). Смесь промежуточного соединения (5) (0,25 моль) и КОН (1 моль) в воде (650 мл) перемешивали и кипятили с обратным холодильником 2 ч. Реакционную смесь охлаждали, подкисляли с помощью НСl и образовавшийся осадок отфильтровывали, промывали водой и сушили, получая 48 г 8-хлор-3,4-дигидро 2H-1,5-бензодиоксепин-6-карбоновой кислоты (промежуточное соединение 6). Пример А.4. а) Получение промежуточного соединения (7). Смесь метилового эфира 2,3-дигидрокси-4-метоксибензойной кислоты (0,45 моль), 1,3-дибромпропана (0,72 моль), К 2 СО 3 (155 г) и СuО в ДМФА (DMF) (2500 мл) перемешивали при температуре от 120 до 130 С в течение 7 ч, охлаждали и фильтровали. Растворитель выпаривали. Добавляли НСl (0,5N водный раствор, 1000 мл). Смесь дважды экстрагировали DCM (750 мл). Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат/DCM 70/30/15). Очищенные фракции собирали и растворитель выпаривали. Остаток кристаллизовали из DIPE, получая метил 3,4-дигидро-9-метокси-2H-1,5-бензодиоксепин-6-карбоксилат (промежуточное соединение 7).b) Получение промежуточного соединения (8). Раствор NaOH (500 мл, 2N) добавляли к раствору промежуточного соединения (7) в ТГФ (THF) (250 мл). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель частично выпаривали. Остаток экстрагировали с помощью DCM. Смесь разделялась на два слоя. Водный слой подкисляли концентрированным раствором НСl до рН=1-2. Твердое вещество отфильтровывали, промывали водой и сушили, получая 35,5 г 9-метокси-3,4-дигидро-2H-1,5-бензодиоксепин-6-карбоновой кислоты (промежуточное соединение 8). Пример А.5. а) Получение промежуточного соединения (9). Смесь метилового эфира 5-хлор-2,3-дигидроксибензойной кислоты (0,49 моль) в уксусной кислоте(2000 мл) перемешивали и кипятили с обратным холодильником. Раствор N-хлорсукцинимида (0,49 моль) в уксусной кислоте (600 мл) добавляли по каплям при кипячении с обратным холодильником. Реакционную смесь перемешивали и кипятили с обратным холодильником 30 мин. Дополнительное количество раствора N-хлорсукцинимида (0,075 моль) в уксусной кислоте (100 мл) добавляли по каплям при кипячении с обратным холодильником. Реакционную смесь перемешивали и кипятили с обратным холодильником 30 мин, затем охлаждали и выливали в воду (500 мл). Остаток экстрагировали толуолом (3 раза). Отделенный органический слой промывали водой, сушили и упаривали. Остаток кристаллизовали изb) Получение промежуточного соединения (10). Смесь промежуточного соединения (9) (0,3 моль), 1,3-дибромпропана (0,35 моль) и К 2 СО 3 (0,7 моль) в 2-пропаноне (1000 мл) перемешивали и кипятили с обратным холодильником 30 ч. Реакционную смесь охлаждали, разбавляли водой (2000 мл) и экстрагировали дважды с помощью DCM. Отделенный органический слой промывали водой, сушили и растворитель упаривали. Остаток кристаллизовали из DIPE и петролейного эфира, получая 55 г промежуточного соединения (10). с) Получение промежуточного соединения (11). Смесь промежуточного соединения (10) (0,2 моль) и КОН (1 моль) в воде (1000 мл) перемешивали и кипятили с обратным холодильником 90 мин. Реакционную смесь охлаждали, подкисляли с помощью НСl и образовавшийся осадок отфильтровывали, промывали водой и сушили, получая 46 г промежуточного соединения (11). Пример А.6. а) Получение промежуточного соединения (12). Смесь метилового эфира 5-хлор-2,3-дигидроксибензойной кислоты (0,1 моль) в уксусной кислоте(250 мл) и N-бромсукцинимида (0,11 моль) перемешивали и кипятили с обратным холодильником 4 ч. Реакционную смесь охлаждали и выливали в воду (500 мл). Осадок фильтровали и сушили, получая 23 г промежуточного соединения (12).b) Получение промежуточного соединения (13). Смесь промежуточного соединения (12) (0,7 моль), 1,3-дибромпропана (0,94 моль) и К 2 СО 3 (1,55 моль) в 2-пропаноне (1300 мл) перемешивали и кипятили с обратным холодильником 20 ч. Реакционную смесь охлаждали, фильтровали и растворитель выпаривали. Остаток превращали в твердое вещество в петролейном эфире, фильтровали и сушили, получая 240 г промежуточного соединения (13). с) Получение промежуточного соединения (14). Смесь промежуточного соединения (13) (0,053 моль) и КОН (0,2 моль) в воде (160 мл) перемешивали и кипятили с обратным холодильником 90 мин. Реакционную смесь охлаждали и водный слой экстрагировали DCM. Водный слой подкисляли с помощью НСl и образовавшийся осадок отфильтровывали,промывали водой и сушили, получая 13 г промежуточного соединения (14). Пример А.7. а) Получение промежуточного соединения (15). Смесь метилового эфира 5-нитро-2,3-дигидроксибензойной кислоты (0,3 моль), К 2 СО 3 (0,66 моль),1,3-дибромпропана (0,42 моль) и бромида тетра-н-бутиламмония (4,5 г) в 2-пропаноне (900 мл) и DMA(600 мл) перемешивали и кипятили с обратным хлолдильником 30 ч. Реакционную смесь перемешивали 2 дня при комнатной температуре и затем фильтровали. Растворитель выпаривали и остаток распределяли между водой и DCM. Отделенный органический слой сушили. Фильтровали и концентрировали. Остаток суспендировали в DIPE, фильтровали, сушили и очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 98/2), получая 33,5 г промежуточного соединения (15).b) Получение промежуточного соединения (16). Смесь промежуточного соединения (15) (0,11 моль) в ТГФ (THF) (250 мл) гидрировали на катализаторе 10% палладиевая чернь (3 г) в присутствии раствора тиофена (1 мл). После поглощения водорода (3 экв.) катализатор отфильтровывали через дикалит и фильтрат концентрировали, получая 24,7 г промежуточного соединения (16). с) Получение промежуточного соединения (17). Промежуточное соединение (16) (0,0448 моль) добавляли порциями при 5 С к смеси концентрированной НСl (10 мл) в воде (10 мл). Температуру смеси доводили до 0 С. Раствор NaNO2 (0,048 моль) в воде (10 мл) добавляли по каплям при 0 С. Смесь перемешивали при температуре от 0 до 5 С в течение 1 ч,затем фильтровали. Фильтрат охлаждали до 0 С, затем добавляли к раствору NaBF4 (0,076 моль) в воде(20 мл). Смесь перемешивали при 0 С в течение 30 мин. Осадок фильтровали, промывали минимальным количеством воды, затем смесью диэтиловый эфир/вода (50/50), затем диэтиловым эфиром и сушили при комнатной температуре в вакууме, получая 12,10 г промежуточного соединения (17).d) Получение промежуточного соединения (18). Смесь промежуточного соединения (17) (0,0387 моль) и фторида натрия (0,1549 моль) в толуоле(120 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем доводили до комнатной температуры. Осадок фильтровали. Фильтрат промывали толуолом и упаривали досуха. Остаток обрабатывали с помощью DCM. Растворитель выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: DCM), получая 2,8 г промежуточного соединения (18). е) Получение промежуточного соединения (19). Смесь промежуточного соединения (18) (0,0124 моль) в растворе NaOH (2N, 25 мл) и ТГФ (THF)(25 мл) перемешивали при комнатной температуре в течение ночи. ТГФ выпаривали и к остатку добавляли этилацетат. Смесь экстрагировали этилацетатом, затем подкисляли с помощью НСl до установления рН, равного 2. Осадок фильтровали, промывали водой, затем диэтиловым эфиром и сушили, получая 2,16 г промежуточного соединения (19). Пример А.8. а) Получение промежуточного соединения (20).- 10008514 Смесь метилового эфира 5-бром-2,3-дигидроксибензойной кислоты (0,397 моль) и К 2 СО 3 (0,87 моль) в 1,3-дибромпропане (49 мл) и 2-пропаноне (1000 мл) перемешивали и кипятили с обратным холодильником 22 ч, затем реакционную смесь охлаждали, фильтровали через дикалит и растворитель выпаривали. Остаток распределяли между NаНСО 3 (5%, водн.) и DCM. Органический слой отделяли, сушили, фильтровали через дикалит и растворитель выпаривали, получая 112 г промежуточного соединения (20).b) Получение промежуточного соединения (21). Смесь промежуточного соединения (20) (0,14 моль) в ТГФ (THF) (200 мл) и 2N раствора NaOH(300 мл) перемешивали при 30-60 С в течение 4 ч, затем органический растворитель выпаривали и водный концентрат охлаждали льдом и экстрагировали с помощью DCM. Водный слой затем охлаждали льдом, подкисляли до рН=1 и твердый остаток отфильтровывали и сушили, получая 33 г промежуточного соединения (21). с) Получение промежуточного соединения (22). Смесь промежуточного соединения (21) (0,33 моль) и цианида меди(I) (2,7 моль) в DMA (800 мл) перемешивали при 140 С в течение 20 ч, затем реакционную смесь охлаждали и к ней добавлялиFeCl36H2O (130 г), НСl (33 мл) и воду (200 мл). Смесь перемешивали при 60 С в течение 20 ч, охлаждали и выливали в воду. Добавляли этилацетат и фильтровали слои для удаления нерастворимых солей. Органический слой отделяли, промывали водой, сушили, фильтровали и растворитель выпаривали. К остатку добавляли воду и 5% раствор NaOH, затем смесь экстрагировали с помощью DIPE, подкисляли НСl и экстрагировали этилацетатом. Органический слой отделяли, сушили и растворитель выпаривали. Остаток очищали ускоренной колоночной хроматографией (элюент: CH2Cl2/CH3OH 95/5+2 мл уксусной кислоты), получая 7 г промежуточного соединения (22). Пример А.9. а) Получение промежуточного соединения (23). Смесь 3-фтор-1,2-бензолдиола (0,078 моль) и К 2 СО 3 в атмосфере СО 2 (газ, 50 атм или 5066 МПа) перемешивали при 170 С в течение 16 ч. Реакционную смесь подкисляли водным раствором НСl и растворитель выпаривали. К остатку добавляли диэтиловый эфир (500 мл) и смесь перемешивали 15 мин,охлаждали, затем фильтровали через броунмиллерит. Раствор-фильтрат упаривали, получая 3,8 г промежуточного соединения (23).b) Получение промежуточного соединения (24). Серную кислоту (20 мл) добавляли к метанолу (60 мл) и получали смесь (I). Промежуточное соединение (23) (0,022 моль) растворяли в метаноле (70 мл) и добавляли к смеси (I). Реакционную смесь перемешивали и кипятили с обратным холодильником 20 ч. Растворитель выпаривали и остаток распределяли между этилацетатом и водой. Органический слой сушили и растворитель выпаривали. Реакцию повторяли несколько раз с неочищенной смесью и все фракции с продуктом объединяли, получая 31 г промежуточного соединения (24). с) Получение промежуточного соединения (25). Смесь промежуточного соединения (24) (0,166 моль) и К 2 СО 3 (0,365 моль) в 1,3-дибромпропане(0,166 моль) и ацетоне (500 мл) перемешивали и кипятили с обратным холодильником 24 ч. Реакционную смесь охлаждали, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле. Фракции с продуктом собирали и растворитель выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией (с обращенной фазой). Фракции с продуктом собиралиd) Получение промежуточного соединения (26). Смесь промежуточного соединения (25) (0,013 моль) в NaOH (80 мл, 2N) и ТГФ (THF) (50 мл) перемешивали при 30 С в течение 6 ч. Растворитель частично выпаривали и концентрат охлаждали льдом и подкисляли с помощью НСl (конц.). Твердые вещества отфильтровывали, промывали водой и сушили,получая 2,45 г промежуточного соединения (26). Пример А.10. а) Получение промежуточного соединения (27).b) Получение промежуточного соединения (28). Раствор промежуточного соединения (27) (0,146 моль) в NaOH (2N) (400 мл) и ТГФ (THF) (400 мл) перемешивали и кипятили с обратным холодильником 18 ч. Реакционную смесь охлаждали и ТГФ удаляли выпариванием. Остаток подкисляли концентрированной НСl. Образовавшееся твердое вещество отфильтровывали, промывали и сушили, получая 26,5 г промежуточного соединения (28). Пример А.11. а) Получение промежуточного соединения (29). Смесь метилового эфира 2,3-дигидрокси-5-нитробензойной кислоты (0,35 моль), К 2 СО 3 (0,77 моль) и бромида тетра-н-бутиламмония (5 г) в дибромэтане (42 мл), DMA (680 мл) и 2-пропаноне (1000 мл) перемешивали и кипятили с обратным холодильником (70 С) в течение 20 ч. Дополнительно добавлялиDMA (250 мл), бромид тетра-н-бутиламмония (5 г) и 1-бром-2-хлорэтан (29 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником 44 ч. Затем реакционной смеси позволяли охлаждаться до комнатной температуры в продолжение выходного дня. Суспензию фильтровали и фильтрат концентрировали. Концентрат распределяли между водой и толуолом. Отделенный водный слой несколько раз промывали DCM. Отделенные органические слои объединяли, сушили, фильтровали и концентрировали. Образовавшийся продукт кристаллизовали из DIPE и ACN, получая промежуточное соединение (29).b) Получение промежуточного соединения (30). Смесь промежуточного соединения (29) (0,089 моль) в метаноле (500 мл) гидрировали при 50 С на катализаторе палладиевая чернь (10%, 3 г) в присутствии раствора тиофена (1 мл). После поглощения водорода (3 экв.) катализатор отфильтровывали через дикалит и фильтрат упаривали, получая 20,9 г промежуточного соединения (30). с) Получение промежуточного соединения (31).- 12008514 Раствор NaNO2 (0,1314 моль) в Н 2 О (29,3 мл) добавляли по каплям при 0 С к смеси промежуточного соединения (30) (0,1195 моль) в 1,5N HCl (190 мл). Смесь перемешивали при 10 С в течение 15 мин и добавляли по каплям при 5 С к смеси CuCN (0,1673 моль) и KCN (0,2749 моль) в Н 2 О (293 мл). Смесь перемешивали 1 ч при 5 С, затем 1 ч 30 мин при 60 С, затем охлаждали и фильтровали. Фильтрат экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали досуха. Остаток промывали с помощью CH2Cl2/CH3OH, сушили, фильтровали и растворитель выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/этилацетат 98/2). Очищенные фракции собирали и растворитель выпаривали досуха, получая 10,4 г промежуточного соединения (31).d) Получение промежуточного соединения (32). Смесь промежуточного соединения (31) (0,0446 моль) и моногидрата гидроксида лития (0,0891 моль) в ТГФ (THF) (300 мл) и воде (300 мл) перемешивали при комнатной температуре 20 ч. ТГФ частично выпаривали. Смесь подкисляли 3N НСl и экстрагировали этилацетатом. Органический слой отделяли,сушили, фильтровали и растворитель выпаривали досуха, получая 9,4 г прмежуточного соединения (32). Пример А.12. а) Получение промежуточного соединения (33). Промежуточное соединение (30) (0,086 моль) добавляли порциями к раствору концентрированной НСl (18 мл) в воде (18 мл). Смесь охлаждали до 5 С. Раствор нитрита натрия (0,086 моль) в воде (18 мл) добавляли по каплям. Смесь перемешивали при 10 С в течение 1 ч. Осадок фильтровали. Фильтрат охлаждали, затем добавляли к раствору NaBF4 (0,146 моль) в воде (36 мл). Смесь перемешивали в течение 30 мин. Осадок фильтровали, промывали водой, затем диэтиловым эфиром и сушили в вакууме при 40 С в течение 12 ч, получая 20 г промежуточного соединения (33).b) Получение промежуточного соединения (34). Смесь промежуточного соединения (33) (0,0649 моль) и фторида натрия (0,259 моль) в толуоле (250 мл) перемешивали и кипятили с обратным холодильником 2 дня. Растворитель выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 80/20). Очищенные фракции собирали и растворитель выпаривали, получая 7,6 г промежуточного соединения (34). с) Получение промежуточного соединения (35). Смесь промежуточного соединения (34) (0,0358 моль) и гидроксида лития (0,0716 моль) в ТГФ (THF)(70 мл) и воде (70 мл) перемешивали при комнатной температуре в течение ночи. ТГФ выпаривали. Остаток подкисляли 6N НСl. Осадок фильтровали, промывали водой, затем растворяли в CH2Cl2/CH3OH. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, получая 6,22 г промежуточного соединения (35). Пример А.13. Получение промежуточного соединения (36).- 13008514 Смесь 5-(3-хлорпропил)-1 Н-тетразола (0,04 моль), 1,1',1-(хлорметилиден)трисбензола (0,04 моль) в триэтиламине (0,05 моль) и N,N-диметилформамиде перемешивали 2 ч при 60 С. Реакционную смесь охлаждали, выливали в воду и экстрагировали с помощью DCM. Органический слой отделяли, сушили,фильтровали и растворитель выпаривали. Остаток суспендировали в петролейном эфире и образовавшийся осадок отфильтровывали, затем сушили, получая промежуточное соединение (36). Аналогичным образом, но исходя из 5-(4-хлорбутил)-1 Н-тетразола или 1-(3-хлорпропил)-1,2-дигидро-5 Н-тетразол-5-она, получали промежуточные соединения 5-(4-хлорбутил)-1-тритил-1 Н-тетразол (промежуточное соединение 37) и 1-(3-хлорпропил)-4-тритил-1,4-дигидротетразол-5-он (промежуточное соединение 38), соответственно. Пример А.14. Получение промежуточного соединения (39). Смесь этилового эфира 4-гидроксибензойной кислоты (0,12 моль), 1-бром-3-хлорпропана (0,144 моль) и К 2 СО 3 (0,144 моль) в ACN (200 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем доводили до комнатной температуры, упаривали на две трети, выливали в ледяную воду и экстрагировали с помощью DCM. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток фильтровали через силикагель (элюент: СН 2 Сl2/циклогексан 50/50). Очищенные фракции собирали и растворитель выпаривали, получая 27,9 г промежуточного соединения (39). Пример А.15. Получение промежуточного соединения (40). Смесь этилового эфира 6-хлор-2-гексиновой кислоты (0,26 моль) в метаноле (200 мл) добавляли к смеси гидроксиламина (0,31 моль) в метаноле (500 мл) и 10% раствора NaOH (1,25 моль). Реакционную смесь перемешивали при 30 С в течение ночи, затем подкисляли с помощью НСl и насыщали с помощьюNaCl. Смесь экстрагировали эфиром (3x300 мл). Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток распределяли между водой (300 мл) и DCM (300 мл). Растворитель выпаривали и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат 70/30), получая 21,4 г промежуточного соединения (40). Пример А.16. Получение промежуточного соединения (41). К смеси промежуточного соединения (40) (0,121 моль) в ТГФ (THF) (1000 мл) последовательно добавляли трифенилфосфин (0,181 моль), бензолметанол (0,145 моль) и эфир бис(1-метилэтил)диазендикарбоновой кислоты (0,181 моль). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Растворитель выпаривали и остаток очищали через силикагель на стеклянном светофильтре (элюент: СН 2 Сl2/СН 3 ОН 99/1, 98/2, 95/5) и затем очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/гексан 50/50, 70/30). Целевые фракции с продуктом собирали и растворитель выпаривали, получая 8,47 г промежуточного соединения (41). Пример А.17. Получение промежуточного соединения (42).[описанного в WO-00/37461 как промежуточное соединение (1-d)] (0,023 моль) в метаноле (100 мл) гидрировали на катализаторе палладиевая чернь (10%, 1 г). После поглощения водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток превращали в твердое вещество в DIPE+ACN, отфильтровывали и сушили, получая 4 г 1,1-диметилэтил(транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение 42, т.пл. 178 С). Пример А.18. а) Получение промежуточного соединения (43).- 14008514 1,1-Диметилэтил (транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинокарбоксилат [описанный в WO-00/37461 как промежуточное соединение (1-d)] (2,73 моль) отделяли и очищали хиральной колоночной хроматографией на Chiralcel AD (элюент: гексан/этанол 80/20). Целевые фракции собирали и растворитель выпаривали. Добавляли толуол и отгоняли азеотропную смесь на роторном испарителе,получая 377 г 1,1-диметилэтил (3S-транс)-3-гидрокси-4-(фенилметил)амино]метил]-1-пиперидинкарбоксилата (промежуточное соединение 43).b) Получение промежуточного соединения (44). Смесь промежуточного соединения (43) (0,028 моль) в метаноле (100 мл) гидрировали на катализаторе палладиевая чернь (10%, 2 г). После поглощения водорода (1 экв.) катализатор отфильтровывали и фильтрат упаривали, получая 4,7 г 1,1-диметилэтил (3S-транс)-4-(аминометил)-3-гидрокси-1-пиперидинкарбоксилата (промежуточное соединение (44); []D20=+4,37 (с=24,03 мг/5 мл в СН 3 ОН. Пример А.19. а) Получение промежуточного соединения (45).WO-00/37461 как промежуточное соединение (1-с)] (0,027 моль) в ТГФ (THF) (1300 мл). Смесь перемешивали 30 мин. Добавляли йодистый метил (0,54 моль) и полученную реакционную смесь перемешивали 90 мин. Добавляли небольшое количество воды. Растворитель выпаривали и остаток распределяли между водой и DCM. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, получая 1,1-диметилэтил (транс)-4-(4-метилфенил)сульфонил]окси]метил]-3-метокси-1-пиперидинкарбоксилат (промежуточное соединение 45).b) Получение промежуточного соединения (46). Смесь промежуточного соединения (45) (0,065 моль) в ТГФ (THF) (250 мл) обрабатывали жидкимNH3 в автоклаве при 125 С в течение 16 ч. Реакционную смесь фильтровали и фильтрат упаривали. Остаток распределяли между 5% водным раствором NaOH и DCM. Органический слой отделяли, сушили,фильтровали и растворитель выпаривали, получая 16 г 1,1-диметилэтил (транс)-4-(аминометил)-3-метокси-1-пиперидинкарбоксилата (промежуточное соединение 46). Пример А.20. а) Получение промежуточного соединения (47) (3S-транс). Смесь промежуточного соединения (2) (0,336 моль) и триэтиламина (0,4 моль) в DCM (1000 мл) перемешивали при 5 С, затем добавляли по каплям этилхлорформиат (0,35 моль) и реакционную смесь перемешивали 30 мин. К данной смеси при 5 С добавляли раствор промежуточного соединения (44) (83 г) в DCM (1000 мл), затем реакционной смеси позволяли достигнуть комнатной температуры и смесь промывали водой. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, получая 150 г промежуточного соединения (47). Смесь промежуточного соединения (47) (0,336 моль) в 2-пропаноле, насыщенном НСl (160 мл), и 2 пропанола (1400 мл) перемешивали и кипятили с обратным холодильником 1 ч. Растворитель выпаривали и остаток обрабатывали смесью DCM и небольшого количества метанола. Смесь промывали водным раствором аммиака и органический слой отделяли, сушили, фильтровали. Растворитель выпаривали, получая 71 г промежуточного соединения (51).- 16008514 Промежуточные соединения (48)-(70) получены по методике примера А.20. Пример А.21. а) Получение промежуточного соединения (71). Смесь промежуточного соединения (51) (0,0156 моль) в акрилонитриле (0,0189 моль) и изопропаноле (80 мл) перемешивали и кипятили с обратным холодильником 4 ч. Реакционную смесь охлаждали и растворитель выпаривали. Остаток кристаллизовали из DIPE, отфильтровывали и сушили, получая 5,90 г промежуточного продукта (71) (т.пл. 84-86 С; []D20=-10,03 (с=24,93 мг/5 мл в СН 3 ОН. Аналогичным образом, но исходя из промежуточных соединений (49) или (52), получали промежуточные соединения (72) и (73). Пример A.22. Получение промежуточного соединения (74). Смесь промежуточного соединения (50) (0,0197 моль), этилового эфира (3-хлорпропиламино)уксусной кислоты (приготовленного взаимодействием гидрохлорида 3-хлорпропиламина с этилбромацетатом)(0,0393 моль), триэтиламина (0,0591 моль) и иодистого калия (0,0197 моль) в ДМФА (DMF) (100 мл) перемешивали при 120 С в течение 6 ч, затем температуру доводили до комнатной и растворитель выпаривали досуха. Остаток обрабатывали смесью CH2Cl2/H2O. Смесь фильтровали через броунмиллерит. Броунмиллерит промывали с помощью DCM. Фильтрат экстрагировали смесью CH2Cl2/CH3OH. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NН 4 ОН 90/10/1). Очищенные фракции собирали и растворитель выпаривали, получая 5,4 г промежуточного соединения (74). Аналогичным образом, но исходя из промежуточных соединений (48) или (52), приготавливали промежуточное соединение (75) и (76). В. Получение конечных соединений. Пример В.1. а) Получение промежуточного соединения (77). Смесь промежуточного соединения (36) (0,01 моль), промежуточного соединения (48) (0,008 моль),триэтиламина (0,02 моль) и иодида калия (0,01 моль) в ДМФА (DMF) (50 мл) перемешивали при 60 С в течение 20 ч, затем реакционную смесь охлаждали и растворитель выпаривали. Остаток обрабатывали водой и смесь экстрагировали с помощью DCM. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:b) Смесь промежуточного соединения (77) (0,003 моль) и НСl/2-пропанола (3 мл) в 2-пропаноле (50 мл) перемешивали и кипятили с обратным холодильником 3 ч при комнатной температуре, затем твердые вещества отфильтровывали, промывали петролейным эфиром и сушили, получая 0,85 г соединения (7)(т.пл. 212 С). Пример В.2. Смесь промежуточного соединения (39) (0,009 моль), промежуточного продукта (52) (0,006 моль) и иодида калия (0,009 моль) в DMA (70 мл) и триэтиламина (0,018 моль) перемешивали при 60 С в течение 72 ч. Реакционную смесь охлаждали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH от 90/10 до 85/15). Фракции с продуктом собирали и растворитель выпаривали. Остаток очищали колоночной хроматографией. Фракции с продуктом собирали и растворитель частично выпаривали. Добавляли NaOH и смесь экстрагировали с помощью DCM (3 раза 200 мл). Органический слой сушили, фильтровали и растворитель выпаривали. Остаток кристаллизовали из DIPE, отфильтровывали и сушили. Растворитель выпаривали и остаток фильтровали и сушили, получая 0,36 г соединения (14) (т.пл. 186,5 С). Пример В.3. Смесь промежуточного соединения (71) (0,0075 моль) и азидотрибутилстаннана (0,015 моль) перемешивали в запаянном сосуде при 80 С в течение выходного дня. Смесь растворяли в НСl (80 мл, 6N),кипятили с обратным холодильником 5 мин и охлаждали до комнатной температуры. Водный слой промывали диэтиловым эфиром (4 раза 150 мл) и упаривали. Остаток очищали флэш-колоночной хроматографией через Biotage (элюент: СН 2 Сl2/(CH3OH/NH3) 95/5, 90/10, 85/15). Фракции с продуктом собирали и растворитель выпаривали. Остаток кристаллизовали из ACN (200 мл) и твердое вещество отфильтровывали и сушили, получая соединение (19) (т.пл.125 С; []D20=-12,79 (с=24,23 мг/5 мл в СН 3 ОН. Пример В.4. Изоцианатотриметилсилан (0,0133 моль) добавляли по каплям при комнатной температуре к смеси промежуточного соединения (74) (0,0116 моль) в диоксане (60 мл) и ТГФ (THF) (20 мл). Смесь перемешивали и кипятили с обратным холодильником 1 ч, затем доводили до комнатной температуры и растворитель выпаривали досуха. Упаривали НСl (60 мл, 6N). Смесь перемешивали и кипятили с обратным холодильником 1 ч, затем доводили до комнатной температуры и выливали в ледяную воду. ДобавлялиDCM. Смесь подщелачивали с помощью K2CО 3. Водный слой насыщали K2 СО 3 и экстрагировали с помощью DCM. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток кристаллизовали из смеси 2-пропанон/диэтиловый эфир. Осадок отфильтровывали и сушили, получая 2,43 г соединения (24) (т.пл. 135 С). Пример В.5. а) Получение промежуточного соединения (78). Смесь промежуточного соединения (41) (0,015 моль), промежуточного продукта (51) (0,012 моль) и иодида калия (0,015 моль) в триэтиламине (0,015 моль) и DMA (100 мл) перемешивали при 60 С в течение 24 ч. Растворитель выпаривали, добавляли DCM (100 мл) и смесь промывали насыщенным солевым раствором (2 раза 100 мл). Органический слой сушили, фильтровали и растворитель выпаривали. Остаток очищали на силикагеле на стеклянном светофильтре (элюент 1: чистый CH2Cl2, элюент 2: СН 2 Сl2/(CH3OH/NH3) 99/1, 98/2, 97/3, 96/4). Фракции с продуктом собирали и растворитель выпаривали, получая 6,12 г промежуточного соединения (78).b) Смесь промежуточного соединения (78) (0,0056 моль) в растворе НВr в уксусной кислоте (33%)(60 мл) перемешивали при комнатной температуре 24 ч в инертных атмосферных условиях. Реакционную смесь выливали в ледяную воду (500 мл) и экстрагировали с помощью DCM (2 раза 150 мл). Медленно добавляли NaOH при охлаждении на ледяной бане до установления рН 10. Реакционную смесь перемешивали 1 ч и растворитель частично выпаривали при 50 С. Добавляли НСl до установления рН 67. Смесь насыщали с помощью NaCl, экстрагировали DCM (3 раза 150 мл) и эфиром (150 мл). Объединенные органические слои сушили и очищали флэш-колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 95/5, 94/6, 92/8). Фракции с продуктом собирали и растворитель выпаривали. Остаток кристаллизовали из DIPE, получая соединение (23) (т.пл.93 С; []D20=-9,46 (с=23,26 мг/5 мл в СН 3 ОН. В табл. F-1 и F-2 приведены соединения, которые были получены по одному из вышепредставленных примеров. Таблица F-l Фармакологические примеры Пример С.1. "5-НТ 4-антагонизм". Клетки h5-HT4b-HEK 293 клон 9 выращивали в 150 мм чашках Петри и промывали дважды холодным ФСБ (PBS). Клетки затем извлекали из чашек и суспендировали в 50 мМ Tris-HCl буфере, рН 7,4 и собирали центрифугированием при 23500 об./мин в течение 10 мин. Осадок затем повторно суспендировали в 5 мМ Tris-HCl, рН 7,4 и гомогенизировали гомогенизатором Ultra Turrax. Мембраны собирали центрифугированием при 30000 об./мин в течение 20 мин, повторно суспендировали в 50 мМ Tris-HCl,рН 7,4 и хранили при -80 С. Для опыта исследуемые смеси (0,5 мл) содержали 50 мкл меченного тритием лиганда (5-НТ 4-антагонист [3H]GR113808 0,1 нМ) и 0,4 мл мембранного препарата (15 мкг протеин/мл). 50 мкл 10% ДМСО (DMSO) добавляли для полного связывания. 50 мкл 1 мкМ (+)-транс-(1-бутил-3 гидрокси-4-пиперидинил)метил 8-амино-7-хлор-2,3-дигидро-1,4-бензодиоксин-5-карбоксилата (запатен- 20008514 тованный 5-НТ 4-агонист из Janssen Pharmaceutica) добавляли для определения неспецифического связывания.[3H]GR113808 буфер для анализа представлял собой 50 мМ HEPES-NaOH, pH 7,4. Смеси инкубировали 30 мин при 25 С. Инкубацию завершали фильтрованием через фильтр Unifilter 96 GF/B, предварительно пропитанный 0,1% полиэтиленимином, с последующими 6 промываниями с помощью 50 мМHEPES-NaOH, рН 7,4. Концентрационные изотермы лигандного связывания (прямоугольная гипербола) были рассчитаны нелинейным регрессионным анализом, и данные по рIС 50 для всех испытанных соединений приводятся ниже в табл. С.1. Таблица С.1 Данные по 5-НТ 4-антагонизму Пример С.2. "Метаболическая стабильность". Получение субклеточной ткани осуществляли по публикации Gorrod et al. (Xenobiotica 5: 453-462,1975) центорбежным разделением после механической гомогенизации ткани. Ткань печени промывали в ледяном 0,1 М Tris-HCl (pH 7,4) буфере для удаления избытка крови. Ткани затем осушали промокательной бумагой, взвешивали и грубо разрезали, используя хирургические ножницы. Кусочки ткани гомогенизировали в 3 объемах ледяного 0,1 М фосфатного буфера (рН 7,4). Тканевые гомогенаты центрифугировали при 9000 х g в течение 20 мин при 4 С. Полученный супернатант хранили при -80 С и обозначали как "S9".S9 фракция может быть дополнительно центрифугирована при 100000 х g в течение 60 мин (4 С). Полученный супернатант осторожно аспирировали, отделяли и обозначали как "цитозоль". Осадок повторно суспендировали в 0,1 М фосфатном буфере (рН 7,4) в конечном объеме из 1 мл на 0,5 г первоначальной массы ткани и обозначали как "микросомы". Все субклеточные фракции отделяли, немедленно замораживали в жидком азоте и хранили при -80 С до применения. Для образцов, подлежащих испытанию, смесь для инкубации содержала ФСБ (PBS) (0,1 М), соединение (5 мкМ), микросомы (1 мг/мл) и НАДФН (NADPH)-генерирующую систему (0,8 мМ глюкоза-6 фосфат, 0,8 мМ хлорид магния и 0,8 единиц глюкоза-6-фосфатдегидрогеназа). Контрольные образцы содержали тот же самый материал, но микросомы были заменены на микросомы, инактивированные нагреванием (10 мин при 95 С). Регенерация соединений в контрольных образцах составляла всегда 100%. Смеси предварительно инкубировали в течение 5 мин при 37 С. Взаимодействие начинали с нулевой временной точки (t=0) добавлением 0,8 мМ НАДФ (NADP) и образцы инкубировали в течение 60 мин(t=60). Взаимодействие завершали добавлением 2 объемов ДМСО (DMSO). Затем образцы подвергали центрифугированию в течение 10 мин при 900 х g и супернатанты хранили при комнатной температуре не более чем 24 ч перед анализом. Все инкубации выполняли в двойном варианте. Оценку супернатантов- 21008514 проводили ЖМ-МС (LC-MS) анализом. Элюирование образцов выполняли на колонке Xterra MS C18(50 х 4,6 мм, 5 мкм, Waters, US). Была использована ВЭЖХ (HPLC) система Alliance 2790 (поставщик:Waters, US). Элюирование проводилось буфером А (25 мМ ацетат аммония (рН 5,2) в Н 2O/ацетонитрил(95/5, растворителем В, являющимся ацетонитрилом, и растворителем С метанолом при скорости потока 2,4 мл/мин. Применяли линейное градиентное элюирование с увеличением концентрации огранической фазы от 0 до 50% В и 50% С за 5 мин вплоть до 100% В за 1 мин, и концентрация органической фазы держалась стационарно в течение дополнительных 1,5 мин. Общий объем введенных проб составлял 25 мкл. В качестве детектора применяли Quarto трехквадрупольный масс-спектрометр, снабженный ESP источником ионизации. Температуру источника и десольвации устанавливали при 120 и 350 С, соответственно, и применяли азот в качестве газа-носителя и осушителя. Измерения проводили в режиме сканирования положительных ионов (первичная ионная реакция). Напряжение на конусе составляло 10 В, и время пребывания было равно 1 с. Метаболическую стабильность выражали в виде % метаболизма соединения после 60 мин (уравнение дано в качестве примера) инкубации в присутствии активных микросом (Е(акт% метаболизированного соединения через 60 мин его стереохимически изомерная форма, его N-оксидная форма или его фармацевтически приемлемая соль присоединения кислоты или основания, в которой-R1-R2- представляет собой бивалентный радикал формулы(а-6),-О-СН 2-СН 2-СН 2-СН 2-О-СН 2-СН 2-СН 2-СН 2-О(а-7),-О-СН 2-СН 2-СН 2-СН 2-СН 2(а-8),где в указанных бивалентных радикалах необязательно 1 или 2 атома водорода при одном и том же или при различных атомах углерода могут быть замещены C1-6 алкилом или гидрокси,R3 представляет собой водород, галоген, C1-6 алкил или C1-6 алкилокси;R4 представляет собой водород, галоген, C1-6 алкил; C1-6 алкил, замещенный циано или C16 алкилокси; C1-6 алкилокси; циано; амино или моно или ди(C1-6 алкил)амино;R5 представляет собой водород или C1-6 алкил и радикал -OR5 находится в 3- или 4-положении пиперидинового фрагмента;L представляет собой радикал формулыX представляет собой О, S, SO2 или NR8; причем указанный R8 представляет собой водород или C16 алкил; иHet представляет собой морфолинил; морфолинил, замещенный C1-6 алкилом; тетразолил; тетразолил, замещенный галогеном, гидрокси или C1-6 алкилом; пиразолил; пиразолил, замещенный галогеном,гидрокси или C1-6 алкилом; изоксазолил; изоксазолил, замещенный галогеном, гидрокси или C1-6 алкилом; изотиазолил; изотиазолил, замещенный галогеном, гидрокси или C1-6 алкилом; 2,4-диоксоимидазолидинил; 2,4-диоксоимидазолидинил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена или C1-6 алкила; оксазолил; оксазолил, замещенный галогеном, гидрокси или C1-6 алкилом; тиазолил; тиазолил, замещенный галогеном, гидрокси или C1-6 алкилом; или пиранил; пиранил, замещенный галогеном, гидрокси или C1-6 алкилом. 2. Соединение по п.1, где радикал -OR5 находится в 3-положении пиперидинового фрагмента в транс-конфигурации. 3. Соединение по п.2, где абсолютная конфигурация указанного пиперидинового фрагмента представляет собой конфигурацию (3S,4S). 4. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой морфолинил. 5. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой C1-4 алкандиил и R6 представляет собой Het, где Het представляет собой пиразолил,замещенный гидрокси, изоксазолил, замещенный гидрокси, или 2,4-диоксоимидазолидинил. 6. Соединение по любому из пп.1-3, где L представляет собой радикал формулы (b-1), в которой Alk представляет собой С 1-4 алкандиил и R6 представляет собой Het, где Het представляет собой тетразолил или тетразолил, замещенный гидрокси. 7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6. 8. Способ получения фармацевтической композиции по п.7, где терапевтически активное количество соединения по любому из пп.1-6 тщательно перемешивают с фармацевтически приемлемым носителем. 9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства. 10. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (II) подвергают взаимодействию с производным карбоновой кислоты формулы (III) или ее реакционноспособным функциональным производным или соединения формулы (I) превращают друг в друга по известным в данной области реакциям превращения; или при необходимости соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или наоборот, соль присоединения кислоты соединения формулы(I) переводят в форму свободного основания под действием щелочи; и при необходимости получения их стереохимически изомерных форм. 11. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (IV) подвергают N-алкилированию промежуточным соединением формулы (V) в реакционноинертном растворителе необязательно в присутствии подходящего основания где в вышеприведенных реакционных схемах радикалы -R1-R2-, R3, R4, R5 и L имеют значения, определеные в п.1, и W представляет собой подходящую удаляемую группу; или соединения формулы (I) превращают друг в друга по известным в данной области реакциям превращения; или при необходимости соединение формулы (I) превращают в фармацевтически приемлемую соль присоединения кислоты, или наоборот, соль присоединения кислоты соединения формулы(I) переводят в форму свободного основания под действием щелочи; и при необходимости получения их стереохимически изомерных форм.
МПК / Метки
МПК: C07D 405/14, A61K 31/4545, A61K 31/453, A61K 31/4525, A61K 31/454, C07D 405/12
Метки: 4-(аминометил, качестве, пиперидин, замещённые, бензамиды, гетероциклические, 5-нт4-антагонистов
Код ссылки
<a href="https://eas.patents.su/25-8514-geterociklicheskie-zameshhyonnye-4-aminometil-piperidin-benzamidy-v-kachestve-5-nt4-antagonistov.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические замещённые 4-(аминометил) пиперидин бензамиды в качестве 5-нт4-антагонистов</a>
Предыдущий патент: Система теплоснабжения (варианты )
Следующий патент: Способ получения присадки к смазочным материалам ( варианты)
Случайный патент: Промышленный способ отделения диалкилкарбоната












