Сульфоновые соединения в качестве лигандов 5-ht6 рецептора
Номер патента: 22043
Опубликовано: 30.10.2015
Авторы: Ребалли Веена, Ахмад Иштияк, Абрахам Ренни, Схинде Анил Карбхари, Джасти Венкатесварлу, Намала Рамбабу, Нироджи Рамакришна, Чиндхе Анил Кашинатх, Баданже Раджеш Кумар, Камбхампати Рама Састри, Мулла Мохамад Садик Абдулхамид
Формула / Реферат
1. Соединение общей формулы (I)
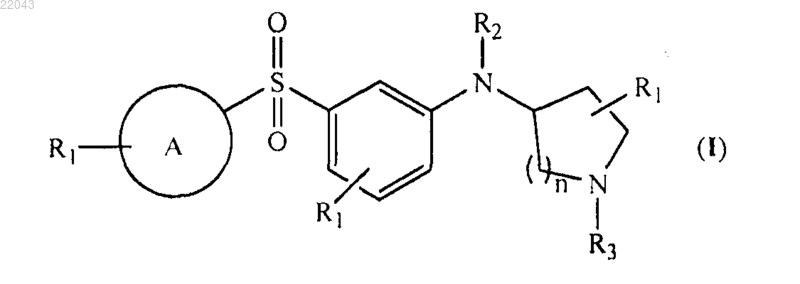
в котором  представляет собой
представляет собой
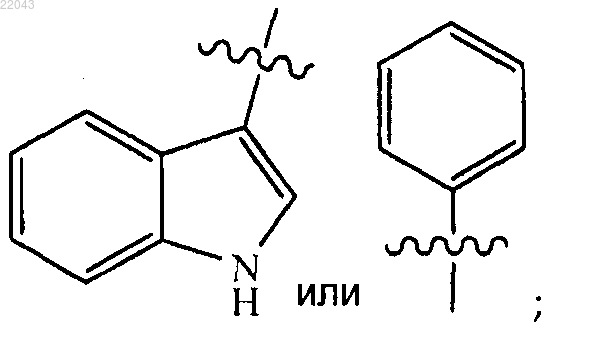
при условии, что указанная связь между кольцом
и группой SO2 не является сульфонамидной связью;
в каждом случае R1 представляет собой водород, хлор, бром, фтор, метил или метокси;
R2 представляет собой водород;
R3 представляет собой водород или метил;
n равно 2,
или его фармацевтически приемлемые соли.
2. Соединение по п.1, которое выбрано из группы, состоящей из
N-[2-метил-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]-N-(1-метилпиперидин-4-ил)амина;
тартрата N-[2-метил-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]-N-(1-метилпиперидин-4-ил)амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
N-(1-метилпиперидин-4-ил)-N-[3-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
гидрохлорида N-(1-метилпиперидин-4-ил)-N-[3-(6-хлор-1Н-индол-3-илсульфонил)фенил]амина;
гидрохлорида N-(1-метилпиперидин-4-ил)-N-[3-(5-фтор-1Н-индол-3-илсульфонил)фенил]амина;
тартрата N-(1-метилпиперидин-4-ил)-N-[2-метил-5-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
гидрохлорида N-(1-метилпиперидин-4-ил)-N-[2-хлор-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]амина;
гидрохлорида N-(1-метилпиперидин-4-ил)-N-[2-хлор-5-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[3-(1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[2-метокси-5-(1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[2-метил-5-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[2-метокси-5-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
N-(пиперидин-4-ил)-N-[2-метокси-5-(5-метокси-1Н-индол-3-илсульфонил)фенил]амина;
N-(пиперидин-4-ил)-N-[2-метокси-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[2-метокси-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]амина;
N-(1-метилпиперидин-4-ил)-N-[2-метокси-5-(6-хлор-1Н-индол-3-илсульфонил)фенил]амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метилфенил]-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-[5-(3-бром-4-метоксибензолсульфонил)-2-метоксифенил]-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-[5-(3-хлор-4-метоксибензолсульфонил)-2-метоксифенил]-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-(5-бензолсульфонил-2-метоксифенил)-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метилфенил]-N-(пиперидин-4-ил)амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метилфенил]-N-(1-метилпиперидин-4-ил)амина;
гидрохлорида N-[5-(5-фтор-2-метоксибензолсульфонил)-2-метоксифенил]-N-(3-фторпиперидин-4-ил)амина;
N-(5-бензолсульфонил-2-метилфенил)-N-(3-фтор-1-метилпиперидин-4-ил)амина;
N-[5-(5-бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(3-фтор-1-метилпиперидин-4-ил)амина;
гидрохлорида N-(5-бензолсульфонил-2-метилфенил)-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(3-фторпиперидин-4-ил)амина;
гидрохлорида N-[5-(5-бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(пиперидин-4-ил)амина;
тартрата N-[5-(3-бром-4-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
татрата N-[5-(5-фтор-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
тартрата N-[5-(4-хлорбензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
тартрата N-[5-(5-хлор-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
тартрата N-[5-(3-хлор-4-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина;
N-(5-бензолсульфонил-2-метилфенил)-N-(1-метилпиперидин-4-ил)амина
и их фармацевтически приемлемых солей.
3. Способ получения соединения формулы (I) по п.1, включающий восстановительное аминирование соединения формулы (II)

с пиперидин-4-оновым производным, применяя подходящий восстанавливающий агент в присутствии полярного или неполярного, протонного или апротонного органического растворителя при температуре 10-40°С для получения соединения формулы (I), в котором все заместители определены, как в п.1.
4. Фармацевтическая композиция для лечения заболеваний, связанных с 5-НТ6 рецептором, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель, разбавитель, эксципиент.
5. Фармацевтическая композиция по п.4 для лечения клинических заболеваний, выбранных из болезни Альцгеймера, депрессии, когнитивных расстройств памяти, шизофрении или умеренных когнитивных нарушений.
6. Применение соединения по любому одному из пп.1, 2 для получения лекарственного средства для лечения заболеваний, связанных с 5-НТ6 рецептором.
7. Применение соединения по п.6 для лечения клинических заболеваний, выбранных из болезни Альцгеймера, депрессии, когнитивных расстройств памяти, шизофрении или умеренных когнитивных нарушений.
8. Соединение формулы (I) по п.1 для получения лекарственного средства для лечения заболевания центральной нервной системы, связанного с или опосредованного 5-НТ6 рецептором.
Текст
Изобретение относится к новым сульфоновым соединениям в качестве лигандов 5-НТ 6 рецептора формулы (I), их фармацевтически приемлемым солям и содержащим их композициям. Настоящее изобретение также относится к способу получения упомянутых выше новых соединений, их фармацевтически приемлемых солей и содержащих их композиций. Данные соединения являются пригодными для лечения/предотвращения различных заболеваний, которые связаны с функциями 5-НТ 6 рецептора. Нироджи Рамакришна, Схинде Анил Карбхари, Камбхампати Рама Састри, Баданже Раджеш Кумар, Ребалли Веена, Чиндхе Анил Кашинатх, Намала Рамбабу, Мулла Мохамад Садик Абдулхамид, Ахмад Иштияк, Абрахам Ренни, Джасти Венкатесварлу (IN) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) Изобретение относится к новым сульфоновым соединениям в качестве лигандов 5-НТ 6 рецептора формулы (I) и их фармацевтически приемлемым солям и содержащим их композициям. Изобретение также относится к способу получения вышеупомянутых новых соединений и их фармацевтически приемлемых солей и содержащих их композиций. Данные соединения являются пригодными для лечения/предотвращения различных заболеваний,которые связаны с функциями 5-НТ 6 рецептора. Уровень техники настоящего изобретения Считают, что различные расстройства центральной нервной системы, такие как тревога, депрессия,моторные расстройства и т.д., сопровождаются нарушениями, связанными с нейромедиатором, 5 гидрокситриптамином (5-НТ) или серотонином. Серотонин располагается в центральной и периферической нервной системе и известно, что он имеет отношение ко многим типам состояний, включая в частности, психические расстройства, двигательную активность, пищевое поведение, сексуальную активность и нейроэндокринную регуляцию. Подтипы 5-НТ рецептора регулируют различные эффекты серотонина. Известное семейство 5-НТ рецептора включает 5-HT1 семейство (например, 5- HT1A), 5-HT2 семейство (например, 5-НТ 2 А и 5-НТ 2 С) , 5-НТ 3, 5-НТ 4, 5-НТ 5, 5-НТ 6 и 5-НТ 7 подтипы. 5-НТ 6 рецепторный подтип впервые был клонирован из ткани крысы в 1993 году (Monsma, F. J.;Shen, Y. ; Ward, R. P.; Hamblin, M. W., Sibley, D.R., Molecular Pharmacology, 1993, 43, 320-327), и затем из ткани человека (Kohen, R.; Metcalf, M. A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D. R., Journal of Neurochemistry, 1996, 66, 47-56). Рецептор представляет собой сопряженный с G-белком рецептор (GPCR), положительно сопряженный с аденилатциклазой (Ruat, М.; Traiffort, Е.; Arrang, J-M.; Tardivel-Lacombe, L.;Diaz, L.; Leurs, R.; Schwartz, J-C, Biochemical Biophysical Research Communications, 1993, 193, 268-276). Рецептор обнаруживается практически исключительно в областях центральной нервной системы (CNS) как у крыс, так и у людей. Исследования in situ гибридизации 5-НТ 6 рецептора в мозге крыс, применяя мРНК, показали основную локализацию в областях, содержащих 5-НТ рецептор, включая стриатум, прилежащее ядро, обонятельный бугорок и гиппокампальную формацию (Ward, R. Р.; Hamblin, M. W.; Lachowicz, J. E.; Hoffman,В. J.; Sibley, D. R. ; Dorsa, D. M., Neuroscience, 1995, 64, 1105-1111). Наибольшие концентрации мРНК 5 НТ 6 рецептора наблюдались в обонятельном бугорке, стриатуме, прилежащем ядре и зубчатой извилине,а также CA1, CA2 и СА 3 областях гиппокампа. Меньшие концентрации мРНК 5-НТ 6 рецептора наблюдались в зернистом слое мозжечка, нескольких диэнцефальных ядрах, миндалинах и в коре головного мозга. Нозерн-блоттинг показал, что мРНК 5-НТ 6 рецептора, по-видимому, в основном присутствует в мозге,с небольшим количеством данных об ее присутствии в периферических тканях. Значительные усилия были сделаны для понимания возможной роли 5-HT6 рецептора в психиатрии,при когнитивных дисфункциях, моторной функции и контроля, памяти, настроения и подобных. Непрестанно искали соединения, которые обладают связывающей способностью относительно 5-НТ 6 рецептора и в качестве вспомогательного вещества в исследовании 5-НТ 6 рецептора и в качестве потенциальных терапевтических агентов для лечения заболеваний центральной нервной системы, например, см. Reavill С. and Rogers D. С, Current Opinion in Investigational Drugs, 2001, 2(1): 104-109, Pharma Press Ltd. Обработка антагонистами 5-НТ 6 рецептора увеличивает судорожный порог в испытании на максимальный электросудорожный шок [Stean, T. et al. (1999) Anticonvulsant properties of the selective 5-HT6IP; Routledge, C. et al. (2000) Characterization of SB-271046: a potent, selective and orally active 5-HT6 receptor antagonist. Br. J. Pharmacol. 130, 1606-1612]. Хотя это показывает, что 5-НТ 6 рецепторы могут регулировать судорожный порог, данный эффект не выражен явно, как в случае известных противосудорожных средств. Наше понимание роли лигандов 5-НТ 6 рецептора наиболее продвинулось в случае двух заболеваний, нарушений обучения и памяти и нарушенного пищевого поведения, в которых данный рецептор,вероятно, играет основную роль. Точная роль 5-НТ 6 рецептора до сих пор не установлена для других заболеваний ЦНС, таких как тревога; хотя один 5-НТ 6 агонист достиг в настоящее время первой стадии клинических испытаний, точную роль рецептора еще только следует установить, и она является фокусом значительных исследований. Существует большое количество терапевтических применений для лигандов 5-НТ 6 рецептора у человека, основанных на прямых эффектах и показаний, имеющихся в наличии научных исследований. Данные исследования включают локализацию рецептора, сродство лигандов с известной in-vivo активностью и различные исследования на животных, проведенных до настоящего времени. Предпочтительно, соединения, являющиеся антагонистами 5-НТ 6 рецепторов, пользуются спросом в качестве терапевтических агентов. Одним потенциальным терапевтическим применением модуляторов 5-НТ 6 рецепторных функций является улучшение обучения и памяти при заболеваниях человека, таких как болезнь Альцгеймера. Высокие концентрации рецептора, обнаруженные в структурах, таких как передний мозг, включая хвостовое ядро/путамен, гиппокамп, прилежащее ядро и корковый слой, свидетельствуют о роли рецептора для памяти и обучения, поскольку известно, что данные области играют жизненно важную роль для памятиMestikawy, S., Brain Research, 1997, 746, 207-219). Способность известных лигандов 5-НТ 6 рецептора усиливать холинергическую передачу также свидетельствует о потенциальном применении для улучшения обучения (Bentley, J. С; Boursson, A.; Boess, F. G.; Kone, F. С; Marsden, С. A.; Petit, N.; Sleight, A. J.,British Journal of Pharmacology, 1999, 126 (7), 1537-1542). В исследованиях было обнаружено, что известный 5-НТ 6 селективный антагонист значительно увеличивает концентрации глютамата и аспартата в лобной доли без увеличения концентраций норадреналина, допамина или 5-НТ. Данное селективное увеличение концентрации определенных нейрохимических соединений отмечается при напряжении памяти и обучении, решительно свидетельствуя о роли 5 НТ 6 лигандов при обучении (Dawson, L. A.; Nguyen, H. Q.; Li, P. British Journal of Pharmacology, 2000, 130(1), 23-26). Исследования на животных памяти и обучения с применением известного селективного 5-НТ 6 антагониста имели некоторые положительные результаты (Rogers, D. С; Hatcher, P. D.; Hagan, J. J. Societyof Neuroscience, Abstracts, 2000, 26, 680). Родственным потенциальным терапевтическим применением 5-НТ 6 лигандов является лечение синдрома дефицита внимания (ADD, также известный как синдром дефицита внимания с гиперактивностью или ADHD) у детей, а также у взрослых. Поскольку 5-НТ 6 антагонисты, по-видимому, увеличивают активность нигростриального допаминового пути, и ADHD связан с нарушениями хвостатого ядра (Ernst,.M; Zametkin, A. J. ; Matochik, J. H.; Jons, P. A.; Cohen, R. M., Journal of Neuroscience, 1998, 18(15), 59015907), 5-HT6 антагонисты могут облегчать синдром дефицита внимания. В настоящее время доступно несколько полностью селективных агонистов. Агонист WAY-181187 Вайета в настоящее время проходит первую фазу клинических испытаний для лечения тревоги [Cole,D.C. et al. (2005) Discovery of a potent, selective and orally active 5-HT6 receptor agonist, WAY-181187. 230thACS Natl. Meet. (Aug 28-Sept 1, Washington DC), Abstract MEDI 17]. В международной патентной заявке WO 03/066056 А 1 сообщается, что антагонизм 5-НТ 6 рецептора может способствовать росту нейронов в центральной нервной системе млекопитающего. В другой международной патентной заявке WO 03/065046 А 2 описывают новый вариант человеческого 5-НТ 6 рецептора и предполагают, что 5-НТ 6 рецептор связан со многими другими заболеваниями. Ранние исследования, изучающие сродство различных ЦНС лигандов с известной терапевтической применимостью или большим структурным сходством с известными лекарственными средствами, предполагают роль 5-НТ 6 лигандов для лечения шизофрении и депрессии. Например, клозапин (эффективный клинический антипсихотик) обладает высоким сродством к 5-НТ 6 подтипу рецептора. Также несколько клинических антидепрессантов обладают высоким сродством к рецептору, а также действуют в качестве антагонистов в данной области (Branchek, Т. А.; Blackburn, Т. P., Annual Reviews in Pharmacology andToxicology, 2000, 40, 319-334). Кроме того, недавние in-vivo исследования на крысах показывают, что 5-НТ 6 модуляторы могут быть пригодны для лечения двигательных расстройств, включая эпилепсию (Stean, Т.; Routledge, С; Upton, N., British Journal of Pharmacology, 1999, 127 Proc. Supplement-131P; и Routledge, C; Bromidge, S. M.;Brown, A. M.; British Journal of Pharmacology, 2000, 30 (7), 1606-1612). Взятые вместе вышеуказанные исследования с большой вероятностью предполагают, что соединения, которые являются модуляторами 5-НТ 6 рецептора, т.е. лигандами, могут быть пригодны для лечения заболеваний, включая лечение заболеваний, связанных с дефицитом памяти, познавательной способности, обучения, таких как болезнь Альцгеймера и синдром дефицита внимания; лечения личностных расстройств, таких как шизофрения; лечения расстройств поведения, например тревоги, депрессии и обсессивно-компульсивных расстройств; лечения двигательных и моторных заболеваний, таких как болезнь Паркинсона и эпилепсия; лечения заболеваний, связанных с нейродегенерацией, таких как инсульт или травма головы; или абстиненция после привыкания к наркотическому средству, включая привыкание к никотину, алкоголю и другим веществам, которыми злоупотребляют. Также ожидают, что данные соединения будут пригодны для применения в лечении определенных заболеваний желудочно-кишечного тракта (GI), таких как функциональное заболевание кишечника. См.,например, Roth, В. L.; et al., Journal of Pharmacology and Experimental Therapeutics, 1994, 268, страницы 1403-1412; Sibley, D. R.; et al., Molecular Pharmacology, 1993, 43, 320-327. Кроме того, сообщалось об эффекте 5-НТ 6 антагониста и 5-НТ 6 антисенс-олигонуклеотидов, снижающем потребления пищи у крыс, таким образом, потенциально они могут применяться для лечения ожирения. См., например, Bentley, J. С; Boursson, A.; Boess, F. G.; Kone, F. С; Marsden, С. A.; Petit, N.; 5-HT6 receptor ligands as potential cognitive enhancers and antiobesiry agents, содержит подробное обсуждение эволюции 5-НТ 6 лигандов. В нем приводятся фармакологические инструменты и принципиальные кандидаты, применяемые в оценке 5-НТ 6 рецептора при заболеваниях, таких как шизофрения, другие связанные с допамином заболевания и депрессия, и описаны нейрохимические и электрофизиологические эффекты или блокирование или активация 5-НТ 6 рецепторов. Кроме того, они применялись для получения характеристик 5-НТ 6 рецептора и исследования его распределения. На настоящий момент несколько клинических кандидатов образуют часть структур индольного типа и являются структурно близкородственными эндогенному лиганду 5-НТ, например, соединения Glennon, R.A. et al., 2-Substituted tryptamines: agents with selectivity for 5-HT6 serotonin receptors, J. Med. Chem. 43, 1011-1018, 2000; Tsai, Y. et al., N1-(Benzenesulfonyl)tryptaraines as novel 5-HT6 antagonists, Bioorg. Med.Chem. Lett. 15, 4230-4234, 2005]. Отношения структура-функциональность описывают в параграфе структур, подобных индолу, и рецептор-модулирующем исследовании, в котором Pullagurla et al., утверждают о различных регионах связывания для агонистов и антагонистов [Pullagurla, M.R. et al. (2004) possible differences in modes ofagonist and antagonist binding at human 5-HT6 receptors. Bioorganic Medicinal Chemistry Letters, 14, 45694573]. Большинство антагонистов, которые приводятся, образуют часть моноциклических, бициклических и трициклических арилпиперазиновых классов [Bromidge, S.M.et.al., (1999) 5-chloro-N-(4-methoxy-3piperazin-l-ylphenyl)-3-methyl-2-benzothiophenesulfonamide (SB-271046): A potent, selective and orally bioavailable 5-HT6 receptor antagonist. J. Med. Chem. 42, 202-205; Characterisation of SB-399885, a potent andindol-5-yl esters as antagonists of the 5-HT6 receptor, WO 2002060871]. SB-271046, первый антагонист 5 НТ 6 рецептора, для которого были начаты клинические испытания 1 фазы, был отброшен (вероятно из-за плохого проникновения через гематоэнцефалитический барьер). Кроме того, селективный антагонист 5 НТ 6 рецептора SB-271046 является неактивным в испытаниях на животных, относящихся или к положительным или отрицательным симптомам шизофрении [Pouzet, В. et al. (2002) Effects of the 5-HT6 receptorantagonist, SB-271046, in animal models for schizophrenia. Pharmacol. Biochem. Behav. 71, 635-643]. Международные патентные заявки WO 2007/046112, WO 2007/020653, WO2007/138611, WO 2005/066157, WO 2004/108671, WO 2004/048331, WO 2004/048330 и WO 2004/048328 (все закрепленные за Suven Life Sciences Limited) описывают родственный уровень техники. Дополнительные WO 98/27081,WO 99/02502, WO 99/37623, WO 99/42465 и WO 01/32646 (все закрепленные за Glaxo SmithKline Beecham PLC) описывают серию арилсульфамидов и сульфоксидных соединений в качестве антагонистов 5 НТ 6 рецептора, и заявляется, что они пригодны для лечения различных заболеваний ЦНС. Тогда как описаны некоторые 5-НТ 6 модуляторы, по-прежнему есть необходимость в соединениях, которые являются пригодными для модулирования 5-НТ 6. В наших исследованиях в области 5-НТ 6 рецепторов мы обнаружили, что сульфоновые соединения формулы (I) показывают очень высокое сродство к 5-НТ 6 рецептору. Следовательно, цель настоящего изобретения заключается в обеспечении соединениями, которые являются пригодными в качестве терапевтических агентов для лечения/предотвращения ряда заболеваний ЦНС или заболеваний, связанных с 5-НТ 6 рецептором. Сущность настоящего изобретения Изобретение относится к новым лигандным соединениям 5-НТ 6 рецептора формулы (I) и их фармацевтически приемлемым солям и содержащим их композициям. представляет собой арил или гетероарил; при условии, что упомянутая связь между кольцом и SO2 группой не является сульфамидной связью;R3 представляет собой водород или метил;"n" представляет собой 2; Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства для лечения/предотвращения различных заболеваний, которые связаны с 5-НТ 6 рецепторами. Конкретно, соединения настоящего изобретения являются пригодными для лечения различных заболеваний, выбранных из тревоги, болезни Альцгеймера, депрессии, судорожных расстройств, обсессивно-компульсивных расстройств, когнитивных расстройств памяти, ADHD (дефицит внимания с гиперактивностью), личностных расстройств, психозов, парафрении, психотической депрессии, болезни Паркинсона, мании, шизофрении, панических расстройств, нарушении сна, абстиненции после злоупотребления наркотиками, инсульта, травмы головы, умеренных когнитивных нарушений, нейродегенеративных заболеваний и ожирения. В другом аспекте, настоящее изобретение относится к фармацевтическим композициям для лечения заболевания, связанного с 5-НТ 6 рецептором, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) и фармацевтически приемлемых солей в смеси по меньшей мере с одним подходящим носителем, разбавителем, эксципиентом или лекарственным средством. В еще другом аспекте настоящее изобретение относится к композиции, содержащей соединения формулы (I), и способам применения соединений формулы (I). В еще другом аспекте настоящее изобретение дополнительно относится к способу получения соединений формулы (I) и фармацевтически приемлемых солей. Примерные соединения настоящего изобретения включают соединения, указанные ниже, и фармацевтически приемлемые соли. Настоящее изобретение не следует понимать как ограниченное ими.N-(3-фтор-1-метилпиперидин-4-ил)-N-[2-этил-5-(6-цианоиндол-3-сульфонил)фенил]амин; Подробное описание настоящего изобретения Если не указано особо, следующие термины, применяемые в описании и формуле изобретения,имеют значения, приведенные ниже. Термин "шизофрения" обозначает шизофрению, шизофреноподобные и шизоаффективные расстройства. Термин "психическое расстройство" относится к бреду, галлюцинациям, расстройству речи или дезорганизованному или кататоническому поведению. См. Diagnostic and Statistical Manual of Mental Disorder, четвертое издание, American Psychiatric Association, Washington, D.C. Термины "лечить" или "лечение" включают все значения, такие как превентативное, профилактическое и временно облегчающее. Фраза "фармацевтически приемлемые соли" обозначает то, что соединение или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, образующими состав,который применяют для лечения млекопитающего. Фразу "терапевтически эффективное количество" определяют как количество соединения настоящего изобретения, которое (i) лечит или предотвращает конкретное заболевание, состояние или расстройство, (ii) облегчает, улучшает или устраняет один или более симптомов конкретного заболевания,состояния или расстройства, (iii) предотвращает или задерживает возникновение одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем изобретении. Имеющиеся в продаже реагенты применяли без дополнительной очистки. Комнатная температура относится к 25-30 С. ИК получали, применяя KBr и в твердом состоянии. Если не указано особо, все масс-спектры получали, применяя ESI условия. 1 Н-ЯМР спектры регистрировали при 400 МГц на приборе фирмы Bruker. Дейтерированный хлороформ (99,8% D) применяли в качестве растворителя. TMS применяли в качестве внутреннего стандарта. Величины химических сдвигов выражали ввеличинах частей на миллион. Следующие сокращения применяют для мультиплетности ЯМР сигналов: s=синглет,bs=уширенный синглет, d=дуплет, t=триплет, q=квартет, qui=квинтет, h=гептет, dd=дуплет дуплетов,dt=дуплет триплетов, tt=триплет триплетов, m=мультиплет. Хроматография относится к колоночной хроматографии, проводимой, применяя 100-200 мэш силикагель и выполненной в атмосфере азота(флэш-хроматография). Соединения настоящего изобретения можно применять в комбинации друг с другом или с другими терапевтическими агентами или подходами, применяемыми для лечения или предотвращения заболеваний, перечисленных выше. Данные агенты или подходы включают ингибиторы бета-секретазы; ингибиторы гамма-секретазы; ингибиторы амилоидного агрегирования (например, Alzhemed); прямо или опосредованно действующие нейропротекторные соединения; антиоксиданты, такие как витамин Е и гинколиды; противовоспалительные агенты, такие как Сох-ингибиторы или NSAID; ингибиторы HMG-CoA редуктазы (статины); ингибиторы ацетилхолин-эстеразы, такие как донепезил, ривастигмин, такрин, галантамин; антагонисты NMDA рецептора (например, мемантин); АМРА агонисты; соединения, которые модулируют высвобождение или концентрацию нейромедиаторов (например, NS-2330); соединения, вызывающие высвобождение гормонов роста (например, ибутаморенмезилат и капроморелин); антагони-6 022043 сты СВ 1 рецептора или обратные агонисты; антибиотики, подобные миноциклину или рифампицину;PDE-IV и PDE-IX ингибиторы; GABAA обратные агонисты; никотиновые агонисты; антагонисты гистаминового Н 3, 5-НТ 4 агонисты или частичные агонисты; 5-НТ 6 антагонисты; антагонисты 2 адренорецептора; мускариновые M1 агонисты; мускариновые М 2 антагонисты; положительные модуляторы метаботропного глутаматного рецептора 5; и соединения, которые модулируют рецепторы или ферменты таким образом, что увеличивается эффективность и/или безопасность соединений настоящего изобретения или снижаются побочные эффекты. В комбинации настоящего изобретения соединения настоящего изобретения и партнеры вышеупомянутых комбинаций можно вводить отдельно (например, набор частей) или вместе в одной фармацевтической композиции (например, капсула или таблетка). Кроме того, введение одного элемента комбинации настоящего изобретения можно осуществлять до, одновременно или после введения другого элемента комбинации. Если соединения настоящего изобретения и один или более дополнительных активных ингредиентов присутствуют в отдельных составах, данные отдельные составы можно вводить одновременно или последовательно. Фармацевтические композиции Для того чтобы применять соединения формулы (I) в терапии, их обычно формулируют в виде фармацевтических композиций согласно стандартной фармацевтической практике. Фармацевтические композиции настоящего изобретения можно формулировать общепринятым способом, применяя один или более фармацевтически приемлемых носителей. Таким образом, активные соединения настоящего изобретения можно формулировать для перорального, буккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения или в форме, пригодной для введения ингаляцией или инсуфляцией. Для перорального ведения фармацевтические композиции могут быть в виде, например, таблеток или капсул, полученных общепринятыми способами с фармацевтически приемлемыми эксципиентами,такими как связующие агенты (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или оксид кремния); разрыхлители (например, картофельный крахмал или крахмалгликолят натрия); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки можно покрывать способами, хорошо известными в данной области техники. Жидкие препараты для перорального введения могут быть в виде,например, растворов, сиропов или суспензий, или они могут представлять собой твердый продукт для растворения водой или другой подходящей средой перед применением. Данные жидкие препараты можно получить общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или камедь); неводные среды (например, миндальное масло,жирные эфиры или этиловый спирт) и консерванты (например, метил или пропил п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может быть в виде таблеток или пастилок, формулированных общепринятым способом. Активные соединения настоящего изобретения можно формулировать для парентерального введения инъекцией, включая применение общепринятых способов катеризации или вливания. Составы для инъекции могут присутствовать в единичной лекарственной форме, например, в ампулах или в емкостях с большим количеством доз, с добавленным консервантом. Композиции могут быть в такой форме, как суспензии, растворы или эмульсии в масляной или водной средах, и могут содержать агенты для разработки рецептур, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может находиться в порошковой форме для растворения подходящей средой, например стерильной апирогенной водой, перед применением. Активные соединения настоящего изобретения можно также формулировать в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или введения ингаляцией активные соединения настоящего изобретения удобно составлять в форме спрей-аэрозоля из герметизированного контейнера или распылителя или из капсулы, применяя ингалятор или инсуфлятор. В случае аэрозоля под давлением подходящий пропеллент, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и дозирующее устройство может определяться обеспечением клапана для доставки дозированного количества. Лекарственное средство для герметизированного контейнера или распылителя может содержать раствор или суспензию активного соединения, тогда как для капсулы он предпочтительно должен быть в виде порошка. Капсулы и картриджи (полученные, например, из желатина) для применения в ингаляторе или инсуфляторе можно формулировать содержащими порошковую смесь соединения настоящего изобретения и подходящей порошковой основы, такой как лактоза или крахмал. Аэрозольные составы для лечения заболеваний, которые упоминаются выше (например, мигрени), у среднего взрослого человека предпочтительно оформляют так, чтобы каждая отмеренная доза или"впрыскивание" аэрозоля содержало 20-1000 мкг соединения настоящего изобретения. Суммарная дневная доза аэрозоля будет находиться в диапазоне 100 мкг - 10 мг. Введение можно осуществлять несколько раз в день, например 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз. Эффективное количество соединения общей формулы (I) или его производных, как определено выше, можно применять для получения лекарственного средства, вместе с общепринятыми фармацевтическими вспомогательными веществами, носителями и добавками. Данная терапия включает большое количество вариантов: например, введение двух совместимых соединений одновременно в одной дозовой форме или введение каждого соединения отдельно в отдельных дозах; или, в случае необходимости, через одинаковые интервалы времени или отдельно для того,чтобы получить максимальный полезный эффект или снизить до минимума возможные побочные эффекты лекарственных средств, согласно известным принципам фармакологии. Доза активных соединений может меняться в зависимости от факторов, таких как путь введения,возраст и вес пациента, природа и тяжесть заболевания, которое подвергают лечению, и подобных факторов. Следовательно, любая ссылка в настоящем изобретении на фармакологически эффективное количество соединений общей формулы (I) относится к упомянутым выше факторам. Предполагаемая доза активных соединений настоящего изобретения для перорального, парентерального, назального или буккального введения среднему взрослому человеку для лечения заболеваний, упоминаемых выше, составляет 0,1-200 мг активного ингредиента на одноразовую дозу, которую можно вводить, например, 1-4 раза в день. Способы получения Соединения формулы (I) можно получить согласно схеме I. Как показано ниже, ключевое промежуточное соединение (II) получают различными способами, известными в литературе. Способ настоящего изобретения включает восстановительное аминирование соединения формулы пиперидин-4-оновыми производными, применяя подходящий восстанавливающий агент в присутствии подходящего растворителя при подходящей температуре, получая соединение формулы (I), в котором все заместители описаны ранее. Вышеуказанную реакцию предпочтительно проводят в растворителе, таком как этанол, тетрагидрофуран, дихлорметан, дихлорэтан, толуол, уксусная кислота, диметилформамид, диметилсульфоксид и подобные или их смеси и предпочтительно применяя уксусную кислоту и 1,2-дихлорэтан. Реакцию проводят, применяя восстанавливающие агенты, подобные боргидриду натрия, цианоборгидриду натрия,триацетоксиборгидриду натрия и подобные или их смесь, и предпочтительно применяя сульфат натрия и триацетоксиборгидрид натрия. Температура реакции может изменяться в диапазоне 10-40 С в зависимости от выбранного растворителя и предпочтительно при температуре в диапазоне от 20 до 30 С. Продолжительность реакции может изменяться в диапазоне от 2 до 6 ч, предпочтительно от 3 до 5 ч. Ключевое промежуточное соединение формулы (II) получают, как описано в способах получения 1 и 2. Данное ключевое промежуточное соединение формулы (II) может быть имеющимся в продаже или его можно получить, применяя известные способы. Соединения, полученные вышеуказанным способом получения настоящего изобретения, можно превратить в другое соединение настоящего изобретения дополнительными химическими модификациями, применяя хорошо известные реакции, такие как окисление, восстановление, защита, деблокирование,реакция перегруппировки, галогенирование, гидроксилирование, алкилирование, алкилтиолирование,деметилирование, О-алкилирование, О-ацилирование, N-алкилирование, N-алкенилирование, Nацилирование, N-цианирование, N-сульфонилирование, реакция конденсации, применяя переходные металлы и подобные. В случае необходимости можно осуществлять любой один или более чем один из следующих способов:i) превращение соединения формулы (I) в другое соединение формулы (I);ii) удаление любых защитных групп илиiii) образование его фармацевтически приемлемой соли, сольвата или пролекарства. Способ (i) можно осуществлять, применяя общепринятые способы взаимопревращения, такие как эпимеризация, окисление, восстановление, алкилирование, галогенирование, гидроксилирование и нуклеофильное или электрофильное замещение и гидролиз эфира или образование амидной связи. В способе (ii) примеры защитных групп и способы их удаления можно найти в Т. W. Greene 'Protec-8 022043tive Groups in Organic Synthesis' (J. Wiley and Sons, 1991). Подходящие защитные группы для амина включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые можно удалять гидролизом (например, применяя кислоту, такую как хлороводородная или трифторуксусная кислота) или восстанавливать (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы, применяя цинк в уксусной кислоте), при необходимости. Другие подходящие защитные группы амина включают трифторацетил, который можно удалить гидролизом, катализируемым основанием, или бензильную группу, связанную с твердофазной смолой, такую как 2,6-диметоксибензильная группа, связанную со смолой Меррифилда (линкер Эллмана), которую можно удалить гидролизом, катализируемым кислотой, например, трифторуксусной кислотой. В способе (iii) фармацевтически приемлемые соли можно традиционно получить реакцией с подходящей кислотой или кислотным производным, как описано подробно ранее. Определенные соединения формулы (I) способны существовать в стереоизомерных формах (например, диастереомеры и энантиомеры) и настоящее изобретение распространяется на каждую из данных стереоизомерных форм и на их смеси, включая рацематы. Различные стереоизомерные формы можно разделять друг от друга стандартными способами, или любой данный изомер можно получить стереоспецифическим или асимметрическим синтезом. Настоящее изобретение также распространяется на таутомерные формы и их смеси. Стереоизомеры, как правило, обычно получают в виде рацематов, которые можно разделить на оптически активные изомеры известным способом. В случае соединений общей формулы (I), содержащих асимметрический атом углерода, настоящее изобретение относится к D-форме, L-форме и D,L-смесям и в случае соединения общей формулы (I), содержащего ряд асимметрических атомов углерода, диастереомерным формам, и настоящее изобретение распространяется на каждую из данных стереоизомерных форм и на их смеси, включая рацематы. Соединения общей формулы (I), которые содержат асимметрический атом углерода и которые, как правило, получают в виде рацематов, можно отделить друг от друга обычными способами, или любой данный изомер можно получить стереоспецифическим или асимметрическим синтезом. Однако также возможно применять оптически активное соединение с самого начала,причем затем соответственно получают оптически активное энантиомерное или диастереомерное соединение в качестве конечного соединения. Стереоизомеры соединений общей формулы (I) можно получить одним или более способами, представленными ниже:i) один или более из реагентов можно применять в его оптически активной форме;ii) оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором можно применять в способе восстановления. Металлический катализатор может представлять собой родий, рутений, индий и подобное. Хиральные лиганды могут предпочтительно представлять собой хиральные фосфины (Principles of Asymmetric synthesis, J. E. Baldwin Ed., Tetrahedron series, 14, 311-316);iii) смесь стереоизомеров можно разделить общепринятыми способами, такими как получение диастереомерных солей с хиральными кислотами или хиральными аминами или хиральными аминоспиртами, хиральными аминокислотами. Затем, полученную в результате смесь диастереомеров можно разделить способами, такими как фракционная кристаллизация, хроматография и подобными, за которыми следует дополнительная стадия выделения оптически активного продукта гидролизом производногоiv) смесь стереоизомеров можно разделить общепринятыми способами, такими как микробное разделение, разделение диастереомерных солей, образованных с хиральными кислотами или хиральными основаниями. Хиральные кислоты, которые можно применять, могут представлять собой винную кислоту, миндальную кислоту, молочную кислоту, камфорсульфоновую кислоты, аминокислоты и т.п. Хиральные основания, которые можно применять, могут представлять собой алкалоиды хинного дерева, бруцин или основную аминокислоту, такую как лизин, аргинин, и подобные. В случае соединений общей формулы(I) , обладающих геометрической изомерией, настоящее изобретение относится ко всем данным геометрическим изомерам. Подходящие фармацевтически приемлемые соли будут очевидны специалистам в данной области техники, и они включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как соли присоединения кислоты, образованные неорганическими кислотами например, хлороводородной, бромоводородной,серной, азотной или фосфорной кислотой, и органическими кислотами, например, янтарной, малеиновой,уксусной, фумаровой, лимонной, яблочной, винной, бензойной, п-толуиловой, п-толуолсульфо-, метансульфо-или нафталинсульфокислотой. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, образующие часть настоящего изобретения, можно получить обработкой соединения формулы (I) 1-6 эквивалентами основания, такого как гидрид натрия, метоксид натрия, этоксид натрия, гидроксид натрия, трет-бутоксид калия, гидроксид кальция, ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и подобные. Можно применять растворители, такие как вода, ацетон, эфир, ТГФ, метанол, этанол, трет-бутанол, диоксан, изопропанол, изопропиловый эфир или их смеси. Примеры Новые соединения настоящего изобретения получали согласно следующим способам, применяя подходящие вещества, и они дополнительно пояснены следующими конкретными примерами. Самые предпочтительные соединения настоящего изобретения представляют собой любые или все из соединений, конкретно описанных в данных примерах. Однако данные соединения не следует истолковывать как образующие только класс, который рассматривается как настоящее изобретение, и любая комбинация соединений или их фрагментов может сама образовывать класс. Следующие примеры дополнительно иллюстрируют подробности получения соединений настоящего изобретения. Специалисты в данной области техники легко поймут, что известные варианты условий и способ следующих способов получения можно применять для получения данных соединений. Способ получения 1. Способ получения N-[2-метил-5-(6-хлор-1 Н-индол-3-илсульфонил)фенил]-N(1-метилпиперидин-4-ил)амина. Стадия (i). Способ получения 4-метил-3-нитробензолсульфонилхлорида. Помещали хлорсульфокислоту (12 8 мл, 1,91 ммоль) в 500 мл четырехгорлую круглодонную колбу. Затем добавляли 2-нитротолуол (65 мл, 0,547 ммоль) по каплям при перемешивании в течение 25 мин при 25 С. Реакционную массу нагревали при 85 С в течение 3 ч. Гасили реакционную массу ледяной водой и экстрагировали этилацетатом (4250 мл), объединенный органический слой промывали соляным раствором (1100 мл), сушили над безводным сульфатом натрия, и растворитель удаляли при пониженном давлении для получения продукта в виде сиропа. Выход: 109,5 г. ИК-спектр (СМ-1): 1381, 1181; 1H ЯМР ( м.д.): 2,76 (3 Н, с), 7,66-7,68 (1 Н, д, J=8,2 Гц), 8,14-8,17(1 Н, дд, J=8,20, 2,0 Гц), 8,63 (1 Н, д, J=1,9 Гц). Стадия (ii). Способ получения 4,4'-диметил-3,3'-динитродифенилдисульфида. 4-Метил-3-нитробензолсульфонилхлорид (полученный на стадии выше) помещали в 500 мл четырехгорлую круглодонную колбу (50 г, 0,212 ммоль). Добавляли хлороводородную кислоту (89 мл, 0,636 ммоль) в течение 30 мин через капельную воронку при 25 С. Реакционную массу нагревали при 110 С в течение 3 ч. Затем массу охлаждали до комнатной температуры и гасили ледяной водой. Добавляли порциями бисульфит натрия при энергичном перемешивании. Твердые вещества, которые отделились,фильтровали через воронку Бюхнера и растворяли в дихлорметане (500 мл). Водный слой удаляли, органический слой промывали соляным раствором (250 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли на роторном испарителе в вакууме для получения продукта. Выход: 22,8 г. Диапазон температур плавления: 80,1-82,5 С; ИК-спектр (см-1): 1339, 879; 1 Н-ЯМР ( м.д.): 2,57(3 Н, с), 7,30-7,32 (1 Н, д, J=8,0 Гц), 7,59-7,61 (1 Н, дд, J=8,0, 1,9 Гц), 8,09 (1 Н, д, J=1,9 Гц). Стадия (iii). Способ получения 6-хлор-3-(4-метил-3-нитрофенилсульфанил)-1 Н-индола. Гидрид натрия (950,4 мг, 19,8 ммоль) помещали в сухую 100 мл трехгорлую круглодонную колбу и добавляли диметилформамид (3,0 мл). Раствор 6-хлориндола (2 г, 13 ммоль), растворенный в диметилформамиде (3,0 мл), добавляли в указанную выше колбу в течение 5-10 мин при 25 С в атмосфере азота. Реакционную массу перемешивали в течение 1 ч при 25 С, затем добавляли 4,4'-диметил-3,3'динитродифенилдисульфид (полученный на стадии выше), растворенный в диметилформамиде (25 мл),через капельную воронку при 5-7 С в течение 30 мин. Реакция была экзотермической в процессе добавления. Затем массу перемешивали в течение ночи при комнатной температуре (25 С). Реакционную массу гасили ледяной водой и экстрагировали продукт этилацетатом (4x200 мл). Объединенный органический слой промывали соляным раствором (1x100 мл), сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении для получения технического продукта. Его дополнительно очищали колоночной хроматографией для получения 3,5 г продукта, причем элюентом был 5% этилацетат в н-гексане. Диапазон температур плавления: 151,2-153,0 С; ИК (см-1) : 3359, 1333; 1 Н-ЯМР ( м.д.): 2,48 (3H,s),7,11-7,18 (3 Н, м), 7,43-7,46 (1 Н, д, J=8,5 Гц), 7,46-7,47 (1 Н, д, J=1,1 Гц), 7,52-7,53 (1 Н, д, J=2,5 Гц), 7,63(1 Н, д, J=1,4 Гц), 8,51 (1 Н, ушир.с); масс (m/z) : 317,1 [М-Н+]. Стадия (iv). Способ получения 6-хлор-3-(4-метил-3-нитробензолсульфонил)-1 Н-индола. Помещали м-хлорпероксибензойную кислоту (6,5 г, 37,68 ммоль) в 100 мл трехгорлую круглодонную колбу, с последующим добавлением дихлорметана (15,0 мл). Раствор 6-хлор-3-(4-метил-3 нитрофенилсульфанил)-1 Н-индола (полученного на стадии выше) (3,0 г, 9,4 ммоль), растворенного в 30 мл дихлорметана, добавляли в колбу в течение 20-25 мин через капельную воронку. Реакционную массу перемешивали в течение ночи при 25 С. Затем, массу разбавляли 200 мл дихлорметана и нейтрализовали насыщенным раствором бикарбоната натрия при охлаждении (5-10 С). Органический слой отделяли. Водный слой экстрагировали дихлорметаном (3100 мл). Объединенные органические слои промывали соляным раствором и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении для получения, заявленного в заголовке продукта. Выход: 2,85 г. Диапазон температур плавления: 139,6-145,0 С; ИК (см-1): 3295, 1316, 1341; 1 Н-ЯМР ( м.д.): 2,62(3 Н, с), 7,45 (1 Н, д, J=1,3 Гц), 7,58-7,60 (1 Н, д, J=8,0 Гц), 7,82-7,84 (1 Н, д, J=8,6 Гц), 7,96-7,95 (1 Н, д, J=2,9 Гц), 7,98-8,00 (1 Н, д, J=7,5 Гц), 8,11-8,14 (1 Н, дд, J=8,0, 1,6 Гц), 8,55-8,56 (1 Н, д, J=1,6 Гц), 8,95 (1 Н,ушир.с); масс (m/z): 349,2 [М-Н+]. Стадия (v). Способ получения 5-(6-хлор-1 Н-индол-3-илсульфонил)-2-метилфениламина. В 250 мл круглодонную колбу добавляли порошок железа (1,56 г, 27,9 ммоль), 10 мл деминерализованной воды и нагревали до 90-95 С. При данной температуре добавляли по каплям 4 мл концентрированной хлороводородной кислоты. Массу дополнительно нагревали при 90-95 С в течение 1 ч. Затем охлаждали массу до 60 С и добавляли абсолютный этанол (25 мл). Раствор 6-хлор-3-(4-метил-3 нитробензолсульфонил)-1 Н-индола (полученного на стадии выше) (2,8 г, 7,9 ммоль) в 10 мл абсолютного этанола добавляли по каплям в течение 15 мин. Затем массу кипятили с обратным холодильником в течение 3 ч при 80 С. Массу охлаждали до 25 С, добавляли этилацетат (200 мл) и перемешивали в течение 5 мин. Затем реакционную массу фильтровали через воронку Бюхнера, промывали этилацетатом (3x50 мл). Водный слой отделяли от фильтрата и органический слой промывали соляным раствором (150 мл),сушили над безводным сульфатом натрия и растворитель концентрировали для получения маслянистой массы. Технический продукт дополнительно очищали колоночной хроматографией для получения заявленного в заголовке продукта, причем элюентом был 70% этилацетат и 30% н-гексан. Выход: 1,47 г. ИК (см-1): 3392, 3005, 1301; 1H-ЯМР ( м.д.): 2,01 (3 Н, с), 5,32 (2 Н, ушир.с), 6,97-7,00 (1 Н, д, J=7,7,1,7 Гц), 7,03-7,05 (1 Н, д, J=7,8 Гц), 7,15 (1 Н, д, J=1,7 Гц), 7,19-7,22 (1 Н, дд, J=8,5, 1,8 Гц), 7,52-7,53 (1 Н, д,J=1,7 Гц), 7,69-7,71 (1 Н, д, J=8,5 Гц), 8,08-8,09 (1 Н, д, J=2,9 Гц), 8,25 (1 Н, ушир.с); Масс (m/z): 319,4 [М-Н+]. Способ получения 2. N-[5-(5-Бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амина. Стадия (i). Способ получения 2,2,2-Трифтор-N-(2-метоксифенил)ацетамида. Помещали о-анизидин (37 г, 300,8 ммоль) в 500 мл четырехгорлую круглодонную колбу. Добавляли дихлорметан (200 мл), и содержимое охлаждали до 0 С. Затем добавляли по каплям пиридин (26,2 мл,330,8 ммоль) при перемешивании в течение 15 мин при 0 С. Реакционную массу перемешивали в течение 15 мин и добавляли ангидрид трифторуксусной кислоты (69,5 г, 330,8 ммоль) по каплям в течение 15 мин. Перемешивали реакционную массу в течение 1 ч при комнатной температуре. Гасили реакционную массу ледяной водой и экстрагировали этилацетатом (4250 мл), объединенные органические слои промывали соляным раствором (1100 мл), сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении для получения технического продукта. Его дополнительно очищали колоночной хроматографией для получения продукта, причем элюентом был 5% этилацетат в н-гексане. Выход: 20 г. 1H-ЯМР ( м.д.): 3,93 (3 Н, с), 6,93-6,95 (1 Н, д, J=8,14 Гц), 7,01-7,04 (1 Н, т, J=7,71 Гц), 7,16-7,20 (1 Н,т, J=8,07 Гц)., 8,3-8,33 (1 Н, дд, J=8,06, 1,16 Гц), 8,57 (1 Н, ушир.с); масс (m/z) : 218,1 [М-Н+]. Стадия (ii). Способ получения 4-метокси-3-(2,2,2-трифторацетиламино)бензолсульфонилхлорида. Помещали хлорсульфокислоту (33 мл, 274 ммоль) в 500 мл четырехгорлую круглодонную колбу. Затем добавляли по каплям 2,2,2-трифтор-N-(2-метоксифенил)ацетамид (20 г, 91,3 ммоль) в дихлорметане (100 мл) при перемешивании в течение 45 мин при 0 С. Реакционную массу нагревали до комнатной температуры и перемешивали в течение следующих 2 ч. Гасили реакционную массу ледяной водой и экстрагировали этилацетатом (4200 мл), объединенный органический слой промывали соляным раствором (150 мл), сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении для получения продукта в виде сиропа. Выход: 17,5 г. 1(1 Н, с), 9,06-9,07 (1 Н, д, J=2,32 Гц). Стадия (iii). Способ получения N-[5-(5-бром-2-метоксибензолсульфонил)-2-метоксифенил]-2,2,2 трифторацетамида. В 500 мл 3-горлую круглодонную колбу, снабженную противоточным холодильником, впускным отверстием для N2, отверстием для термометра и магнитной мешалкой внутри, добавляли 4-метокси-3(2,2,2-трифторацетиламино)бензолсульфонилхлорид (17 г, 53,5 ммоль) в 1,2-дихлопентане (200 мл). К перемешиваемому раствору указанной выше реакционной массы медленно добавляли хлорид алюминия(7,86 г, 58,89 ммоль) и 4-броманизол (20 г, 107 ммоль). Затем реакционную массу перемешивали при температуре кипения в течение 20 ч. Реакционную массу гасили ледяной водой и подкисляли 2N хлороводородной кислотой (50 мл) до рН 4 и экстрагировали продукт этилацетатом (3200 мл). Объединенные органические слои промывали соляным раствором (1x50 мл), сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении для получения технического продукта. Его дополнительно очищали колоночной хроматографией для получения, заявленного в заголовке продукта,причем элюентом был 15% этилацетат в н-гексане. Выход: 18,4 г. 1- 11022043 Масс (m/z): 468,0 [М+Н+]. Стадия (iv). Способ получения 5-(5-бром-2-метоксибензолсульфонил) -2-метоксианилина. В 500 мл 3-горлую круглодонную колбу, снабженную противоточным холодильником, капельной воронкой, отверстием для термометра и магнитной мешалкой внутри, добавляли N-[5-(5-Бром-2 метоксибензолсульфонил)-2-метоксифенил]-2,2,2-трифторацетамид (18,0 г, 38,54 ммоль) в метаноле (200 мл). Содержимое колбы охлаждали до 5 С, и медленно добавляли 6N раствор гидроксида натрия (3,1 г,растворенные в 12,4 мл) (3,1 г, 77 ммоль) в течение 30 мин при 5 С. Реакционную массу нагревали до комнатной температуры и кипятили с обратным холодильником реакционную массу в течение 3 ч при 70 С. Реакционную массу охлаждали до комнатной температуры, и метанол упаривали в вакууме, и полученный остаток обрабатывали водой (50 мл), и массу экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали соляным раствором, и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении для получения технического продукта и его очищали перекристаллизацией из смеси метанол/н-гексан для получения заявленного в заголовке продукта. Выход: 2,85 г. 1H-ЯМР ( м.д.): 3,78 (3 Н, с), 3,90 (3 Н, с), 3,96 (2 Н, ушир.с), 6,78-6,83 (2 Н, м), 7,21-7,22 (1 Н, д,J=2,26 Гц), 7,37-7,40 (1 Н, дд, J=8,44 2,2 Гц), 7,57-7,60 (1 Н, дд, J=8,57, 2,5 Гц), 8,21-8,22 (1 Н, д, J=2,46 Гц); масс (m/z) : 371,2, 373,2 [М+Н+]. Стадия (v). Способ получения N-[5-(5-Бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1 метилпиперидин-4-ил)амина. 5-(5-Бром-2-метоксибензолсульфонил)-2-метоксианилин (2 г, 5,35 ммоль) добавляли в 100 мл трехгорлую круглодонную колбу, с последующим добавлением 1-метил-4-пиперидона (550 мг, 4,86 ммоль),сульфата натрия (1,4 г, 9,73 ммоль) и уксусной кислоты (40 мл) в атмосфере азота. Реакционную массу перемешивали в течение 4 ч при комнатной температуре (27 С). Затем добавляли к реакционной массе триацетоксиборгидрид натрия (3,08 г, 14,60 ммоль) при 20-25 С в течение 5 мин. Данную реакционную смесь дополнительно перемешивали в течение следующих 2 ч при комнатной температуре. Затем реакционную смесь гасили 100 мл воды, подщелачивали до рН 950% водным раствором гидроксида натрия при охлаждении (10 С) и экстрагировали продукт этилацетатом (3100 мл). Объединенный органический слой промывали насыщенным соляным раствором (250 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме для получения маслянистой массы. Технический продукт дополнительно очищали колоночной хроматографией, применяя этилацетат и метанол в качестве элюентов, для получения, заявленного в заголовке продукта. Выход: 1,56 г. ИК (см-1): 3413, 1411, 1296 и 1139; 1 Н-ЯМР ( м.д.): 1,47-1,53 (2 Н, м) , 2,03-2,06 (2 Н, м), 2,14-2,19(2 Н, м) , 2,31 (3 Н, с), 2,80-2,82 (2 Н, м); 3,32-3,35 (1 Н, ушир.с), 3,78 (3 Н, с), 3,86 (3 Н, с); 4,26-4,28 (1 Н, д,J=8,03 Гц), 6,76-6,80 (2 Н, м) , 7,10-7,11 (1 Н, д, J=1,97 Гц), 7,24-7,27 (1 Н, м) , 7,56-7,59 (1 Н, дд, J=8,78, 2,45 Гц), 8,21-8,22 (1 Н, д, 2,46 Гц); масс (m/z): 469,0, 471,3 [М+Н+]. Пример 1. Способ получения N-[2-метил-5-(6-хлор-1 Н-индол-3-илсульфонил)фенил]-N-(1-метилпиперидин-4-ил)амина. 5-(6-Хлор-1 Н-индол-3-илсульфонил)-2-метилфениламин [полученный в способе получения 1, стадия (v)] (600 мг, 1,87 ммоль) добавляли в 100 мл трехгорлую круглодонную колбу, с последующим добавлением 1-метил-4-пиперидона (423 мг, 3,74 ммоль), сульфата натрия (2,6 г, 18,7 ммоль) и уксусной кислоты (12 мл). Реакционную массу перемешивали в течение 4 ч при комнатной температуре (30 С). Затем добавляли к реакционной массе триацетоксиборгидрид натрия (1,18 г, 5,61 ммоль) при 20-25 С в течение 5 мин. Данную реакционную смесь дополнительно перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь гасили 100 мл воды, подщелачивали до рН 9 50% водным раствором гидроксида натрия при охлаждении (10 С) и экстрагировали продукт этилацетатом (450 мл). Объединенный органический слой промывали насыщенным соляным раствором (250 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали в вакууме для получения маслянистой массы. Технический продукт дополнительно очищали колоночной хроматографией, применяя этилацетат и метанол в качестве элюентов, для получения 0,31 г заявленного в заголовке продукта. Диапазон температур плавления: 170,3-175,0 С; ИК (см-1): 3413, 1411, 1296, 1139; 1 Н-ЯМР ( м.д.): 1,45-1,48 (2 Н, м); 1,75-1,77 (2 Н, м); 2,02 (3 Н, с); 2,10-2,13 (2 Н, м); 2,23 (3 Н, с); 2,77-2,79 (2 Н, д); 3,26 (1 Н,м); 4,85-4,87 (1 Н, д, J=7,6 Гц); 6,95 (1 Н, с); 7,02-7,04 (1 Н, дд, J=7,7 Гц); 7,08-7,10 (1H, д, J=7, 7 Гц); 7,197,22 (1H, дд, J=8,4, 1,6 Гц); 7,53 (1H, д, J=1,6 Гц), 7,74-7,77 (1 Н, д, J=8,5 Гц), 8,14 (1 Н, с), 12,26 (1 Н,ушир.с); масс (m/z): 418,4 [М+Н+]. Пример 2. Способ получения тартратной солиN-[2-метил-5-(6-хлор-1 Н-индол-3-илсульфонил)фенил]-N-(1-метилпиперидин-4-ил)амин (полученный в примере 1) (360 мг, 0,86 ммоль) растворяли в метаноле (10 мл) в 50 мл круглодонной колбе. Добавляли по каплям при перемешивании при 25 С L(+)-винную кислоту (125,6 мг), растворенную в метаноле (5 мл). Реакционную массу дополнительно перемешивали в течение часа при 25 С. Растворитель удаляли при пониженном давлении для получения 373 мг тартратной соли.- 12022043 Диапазон температур плавления: 155,0-159,0 С; ИК (см-1): 3395, 1724, 1598, 1138, 1297; 1 Н-ЯМР ( м.д.): 1,40-1,45 (2 Н, м), 1,84-1,87 (2 Н, м), 2,07 (3 Н, с),. 2,65-2,75 (2 Н, м) , 3,08-3,11 (3 Н, м) 3,15 (3 Н, с),4,03 (2 Н, с), 4,97-4,99 (1 Н, д, J=7,4 Гц), 7,02-7,05 (2 Н, м), 7,10-7,12 (1 Н, д, J=7,7 Гц), 7,20-7,23 (1 Н, дд,J=8,6, 1,6 Гц), 7,53-7,54 (1 Н, д, J=1,3 Гц), 7,76-7,78 (1 Н, д, J=8,5 Гц), 8,13 (1 Н, с), 12,32 (1 Н, ушир.с); Масс (m/z): 418,2 [М+Н+]. Пример 3. Способ получения гидрохлоридной соли N-[5-(5-бром-2-метоксибензолсульфонил)-2 метоксифенил]-N-(1-метилпиперидин-4-ил)амина.N-[5-(5-Бром-2-метоксибензолсульфонил)-2-метоксифенил]-N-(1-метилпиперидин-4-ил)амин [полученный в способе получения 2, стадия (v)] (100 мг, 0,213 ммоль) растворяли в метаноле (5 мл) в 25 мл круглодонной колбе. IPA:HCl (0,1 мл, 18,23 мас./мас.) добавляли по каплям при 25 С при перемешивании. Реакционную массу дополнительно перемешивали в течение одного часа при 25 С. Растворитель удаляли при пониженном давлении и полученный продукт промывали диэтиловым эфиром (25 мл), декантировали эфирный слой и твердый остаток сушили при пониженном давлении для получения 80 мг гидрохлоридной соли. ИК (см-1): 3395, 1724, 1598, 1297 и 1138; 1H ЯМР ( м.д.): 1,73-1,82 (2 Н, м), 2,1-2,20 (1 Н, м), 2,252,28 (2 Н, м) , 2,89 (3 Н, с), 3,16-3,35 (2 Н, м), 3,57-3,60 (2 Н, м) , 3,66-3,72 (1 Н, ушир.с), 3,80 (3 Н, с), 3,94 Примеры 36-93. Специалист в данной области техники может получить соединения примеров 3693, следуя способам, описанным выше. Биологические анализы Пример 94. Определение Kb величин для 5-HT6 рецептора. Стабильную СНО клеточную линию, экспрессирующую человеческий 5-НТ 6 рецептор и pCRE-Luc репортерную систему применяли для анализа на основе клеток. Данный анализ обеспечивается подходом, не основанным на радиоактивности, для определения связывания соединений с GPCR. В данном конкретном анализе измеряли концентрацию внутриклеточного циклического АМФ, который опосредован активацией или ингибированием рецептора. Рекомбинантные клетки содержат люциферазный репортерный ген под контролем цАМФ чувствительного элемента. Указанные выше клетки выращивали в 96-луночных планшетах с прозрачным дном в Hams F12 среде, содержащей 10% фетальную бычью сыворотку (FBS). Перед добавлением соединений и/или агониста, клетки оставляли без сыворотки в течение ночи. Повышающиеся концентрации испытуемых соединений добавляли вместе с 10 мкм серотонина в Hams F12 среде, содержащей 1% диализированныйFBS, к клеткам. Выдерживания продолжали при 37 С в CO2 инкубаторе в течение 4 ч. Среду удаляли и клетки промывали физиологическим раствором с фосфатным буфером. Клетки лизировали и люциферазную активность измеряли в люминометре. Единицы люминесценции наносили на график относитель- 21022043 но концентраций соединений, применяя Graphpad прогное обеспечение. ЕС 50 величины соединений определяли в виде требующейся концентрации, снижающей люциферазную активность на 50%. Kb величины рассчитывали, введением концентрации агониста, применяемого в данном анализе, и его ЕС 50 величины в то же програмное обеспечение.signaling pathways. Br. J. Pharmacol., 148, 1133-1143. Пример 95. Анализ на связывание с человеческим 5-НТ 6 рецептором. Соединения испытывали согласно следующим способам. Материалы и способы: источник рецептора - человеческий рекомбинантный, экспрессирующийся в НЕК 293 клетках радиолиганд: [3 Н]LSD (60-80 Ки/ммоль); конечная концентрация лиганда - [1,5 нМ]; неспецифический детерминант - метиотепинмезилат - [0,1 мкМ]; эталонное соединение: метиотепинмезилат; положительный контроль: метиотепинмезилат. Условия выдерживания: реакции проводили в 50 мкМ TRIS-HC1 (рН 7,4), содержащем 10 мкМ MgCl2, 0,5 мМ EDTA в течение 60 мин при 37 С. Реакцию прекращали быстрой вакуумной фильтрацией через фильтры из стеклянного волокна. Определяли радиоактивность, захваченную фильтрами, и сравнивали с контрольными величинами для того, чтобы установить любые взаимодействия испытуемого соединения (соединений) с клонированным серотониновым 5-НТ 6 сайтом связывания. Литературные ссылки: Monsma F. J. Jr., et al., Molecular Cloning and Expression of Novel SerotoninReceptor with High Affinity for Tricyclic Psychotropic Drugs. Mol. Pharmacol. (43): 320-327 (1993). Пример 96. 5-HT6 функциональный анализ циклического АМФ. Антагонистические свойства соединений относительно человеческих 5-НТ 6 рецепторов определяли исследованием их эффекта на цАМФ накопление в стабильно трасфецированных НЕК 293 клетках. Связывание агониста с человеческим 5-НТ 6 рецептором будет приводить к увеличению аденилциклазной активности. Соединение, которое является агонистом, будет проявлять усиление синтеза цАМФ и соединение, которое является антагонистом, будет блокировать агонистический эффект. Человеческие 5-НТ 6 рецепторы клонировали и стабильно экспрессировали в НЕК 293 клетках. Данные клетки помещали в 6-луночные планшеты в DMEM/F12 среде с 10% фетальной телячьей сывороткой(FCS) и 500 мкг/мл G418 и выдерживали при 37 С в CO2 инкубаторе. Клетки выращивали до приблизительно 70% конфлюэнции перед началом эксперимента. В день эксперимента культуральную среду удаляли, и клетки промывали один раз бессывороточной средой (SFM). Добавляли 2 мл SFM+IBMX среды и выдерживали при 37 С в течение 10 мин. Среду удаляли и свежую SFM+IBMX среду, содержащую различные соединения и 1 мкМ серотонина (в качестве антагониста), добавляли к подходящим лункам и выдерживали в течение 30 мин. После выдерживания среду удаляли и клетки промывали один раз 1 млPBS (физиологический раствор с фосфатным буфером). Каждую лунку обрабатывали 1 мл холодного 95% этанола и 5 мкм EDTA (2:1) при 4 С в течение 1 ч. Затем клетки соскабливали и переносили в пробирки Эппендорфа. Пробирки центрифугировали в течение 5 мин при 4 С и надосадочную жидкость хранили при 4 С до анализа. Содержание цАМФ определяли EIA (ферментный иммунноанализ), применяя Amersham Biotrak цАМФ EIA набор (Amersham RPN 225). Применяемый способ представлял собой, как описано для набора. Вкратце, цАМФ определяли конкуренцией между немеченным цАМФ и фиксированным количеством меченного пероксидазой цАМФ для сайтов связывания на анти-цАМФ антитело. Антитело иммобилизовали на полистирольные лунки на микротитровальном планшете, предварительно покрытые вторичным антителом. Реакцию начинали добавлением 50 мкл меченного пероксидазой цАМФ к образцу (100 мкл), предварительно выдержанному с антисывороткой (100 мл) в течение 2 ч при 4 С. После выдерживания в течение 1 ч при 4 С, несвязанный лиганд отделяли простым способом промывки. Затем добавляли ферментный субстрат, триметилбензидин (1), и выдерживали при комнатной температуре в течение 60 мин. Реакцию прекращали добавлением 100 мл 1,0 М серной кислоты и полученный в результате цвет считывали спектрофотометром для микротитровальных планшетов при 450 нм в течение 30 мин. В функциональном анализе на основе аденилилциклазы было обнаружено, что некоторые из соединений настоящего изобретения являются конкурентными антагонистами с высокой селективностью по сравнению с рядом других рецепторов, включая другие серотониновые рецепторы, такие как 5-HT1A и 5 НТ 7. Пример 97. Фармакокинетическое исследование на грызунах. Самцов крыс линии Вистар (230-280 г), полученных у NIN (National Institute of Nutrition, Hyderabad,India) применяли в качестве экспериментальных животных. Три - пять животных держали в каждой клетке. Животных держали натощак в течение ночи и держали при 12-часовом цикле день/ночь. Трем животным вводили перорально и внутривенно дозу NCE (10 мг/кг) на 0 и 2 день. В каждый момент времени кровь собирали из яремной вены. Плазму хранили замороженной при-20 С до анализа. Концентрации NCE соединения в плазме определяли, применяя LC-MS/MS способ. Запланированное время: перед дозой 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после введения дозы (n=3).NCE соединения определяди количественно в плазме утвержденным LC-MS/MS способом, применяя способ твердофазной экстракции. NCE соединения определяли количественно в калибровочном диапазоне 2-2000 нг/мл в плазме. Испытуемые образцы анализировали, применяя калибровочные образцы в группе, и образцы для контроля качества применяли для всей группы. Фармакокинетические параметры Cmax, Tmax, AUCt, T1/2 и биодоступность рассчитывали некомпартментной моделью, применяя прогное обеспечение WinNonlin версии 5,1. Пример 98. Исследования на проникновение в мозг на грызунах. Самцов крыс линии Вистар (230-280 г), полученных у NIN (National Institute of Nutrition, Hyderabad,India) применяли в качестве экспериментальных животных. Трех животных держали в каждой клетке. Животным обеспечивали свободный доступ к воде и пище в течение всего эксперимента и держали на 12-часовом цикле день/ночь. Проникновение в мозг определяли в равновесном состоянии у крыс. За один день до дня введения дозы самцов крыс линии Вистар (225-250 г) анестезировали галотаном для хирургического введения катетеров для яремной и бедренной вен. После операции крыс держали в отдельных клетках для вливания,соединенных с компонентами для - вливания (Instech Solomon; Plymouth Meeting, PA. USA) и обеспечивали свободным доступом к пище и воде.NCE соединение растворяли в воде и вводили при постоянной скорости вливания (5 мл/кг/ч) в течение 6-10 ч при целевой скорости дозирования 1,0 мг свободное основание/кг/ч. Образцы крови отбирали в процессе последней части вливания для подтверждения равновесных концентраций в крови, мозг и кровь собирали и оценивали. Животных умерщвляли, собирали плазму и ткань мозга и гомогенизировали. Плазму и мозг хранили при -20 С до анализа. Концентрации NCE соединения в плазме и мозге определяли, применяя LC-MS/MS способ.NCE соединения определяли количественно в гомогенате плазмы и мозга утвержденным LCMS/MS способом, применяя способ твердофазной экстракции. NCE соединения определяли количественно в калибровочном диапазоне 1-500 нг/мл в гомогенате плазмы и мозга. Испытуемые образцы анализировали, применяя калибровочные образцы в группе, и образцы для контроля качества применяли для всей группы. Рассчитывали величины отношений кровь/мозг (Cb/Cp). Пример 99. Микродиализное исследование мозга грызунов на возможную модуляцию нейромедиаторов. Самцов крыс линии Вистар (230-280 г), полученных у N. I. N. (National Institute of Nutrition, Hyderabad, India), применяли в качестве экспериментальных мышей. Группа 1 размещения по группам: среда (вода; 5 мл/кг; перорально), группа 2: NCE (3 мг/кг; перорально), группа 3: NCE (10 мг/кг; перорально). Хирургический способ: крыс анестезировали хлоралгидратом и помещали в стереотаксический аппарат. Направляющую канюлю (СМА/12) помещали при АР: -5,2 мм, мл: +5,0 мм относительно темени иDV: -3,8 мм от поверхности мозга, согласно атласу Паксиноса и Уотсона (1986). В то время как животное оставалось все еще под анестезией, микродиализный зонд (СМА/12, 4 мм, PC) вставляли через ведущую канюлю и закрепляли на этом месте. После операции животных выдерживали в течение периода восстановления 48-72 ч перед тем, как подвергнуть их исследованиям. За день до исследования животных переносили в клетки для акклиматизации и имплантированный зонд опрыскивали в течение ночи модифицированным раствором Рингера, состоящим из 1,3 мкМ CaCl2Na2HPO47H2O и 0,2 мкМ NaH2PO42H2O и 0,3 мкМ неостиграмсинбромида (Sigramsa) (рН до 7,2) при скорости 0,2 мкл/мин, установленной на насосе для микровливания (PicoPlus, Harward). В день эксперимента скорость опрыскивания изменяли на 1,2 мкл/мин и осуществляли 3-часовую стабилизацию. После периода стабилизации базальные образцы собирали через 20-минутные интервалы перед введением дозы. Диализатные образцы собирали в стеклянные пробирки, применяя СМА/170 охлажднный коллектор фракций. Среду или NCE (3 мг/кг или 10 мг/кг) вводили принудительным питанием после того, как были собраны четыре фракции. Перфузаты собирали до 6 ч после введения. Концентрации ацетилхолина в диализатных образцах измеряли LC-MS/MS (API 4000, MDS SCIEX) способом. Ацетилхолин количественно определяли в калибровочном диапазоне 0,250-8,004 нг/мл в диализатах. После завершения микродиализных экспериментов животных умерщвляли, удаляли их мозг и хранили в 10% формалиновом растворе. Каждый мозг разрезали на слои 50 мкм на криостате (Leica), прокрашивали и исследовали микроскопически для подтверждения размещения зонда. Данные для животных с неправильным размещением зонда отбрасывали. Микродиализные данные выражали в виде процентных изменений (среднее значение + S.E.M.) относительно базового значения, которое определяли как среднюю абсолютную величину (в fM/10 мкл) четырех образцов перед введением лекарственного средства. Эффекты обработки NCE (3 и 10 мг/кг) и средой статистически оценивали однофакторнымANOVA, с последующим критерием множественного сравнения Дуннетта. Во всех статистических величинах р 0,05 считалось статистически значимым. Программа Graph Pad Prism статистически обрабатывала данные. Пример 100. Измерение потребления пищи. Применяли самцов крыс линии Вистар (120-140 г), полученных у N. I. N. (National Institute of Nutrition, Hyderabad, India). Затем определяли длительный эффект соединений общей формулы (I) на поглощение пищи для крыс при хорошем кормлении. Крыс держали в клетках для одного животного в течение 28 дней. В течение данного периода кры- 24022043 сам вводили или перорально или внутрибрюшинно композицию, содержащую соединение формулы (I) или соответствующую композицию (среду) без указанного соединения (контрольная группа) раз в день,и крыс обеспечивали свободным доступом к пище и воде. На 0, 1, 7, 14, 21 и 28 день крыс оставляли с предварительно взвешенным количеством пищи. Поглощение пищи и набор веса измеряли стандартным способом. Также способ приема пищи описывают в литературе (Kask et al. , European Journal of Pharmacology, 414, 2001, 215-224 и Turnball et. al. , Diabetes,vol 51, August, 2002, и некоторые собственные модификации). Соответствующие части описаний вводятся в настоящее изобретение в виде ссылки, и они образуют часть настоящего описания. Некоторые типичные соединения показали статистически значимое снижение поглощения пищи при проведении экспериментов указанным выше способом при дозах или 10 мг/кг или 30 мг/кг или обеих. Пример 101. Модель выполнения задачи распознавания объекта. Улучшающие познавательные способности свойства соединений настоящего изобретения оценивали, применяя модель узнавания животного: модель выполнения задачи распознавания объекта. Самцов крыс линии Вистар (230-280 г), полученных у N. I. N. (National Institute of Nutrition, Hyderabad, India) применяли в качестве экспериментальных животных. В каждой клетке держали четырех животных. Животных держали при 20% пищевой депривации за один день, обеспечивали свободный доступ к воде в течение всего эксперимента и держали при 12-часовом цикле день/ночь. Также крыс приучали к отдельным аренам в течение 1 ч в отсутствии объектов. Одной группе из 12 крыс давали перорально среду (1 мл/кг), другому набору животных давали соединение формулы (I) или перорально или внутрибрюшинно за один час до ознакомительного испытания(Т 1) и испытания на выбор (Т 2). Эксперимент осуществляли на 505050 см открытых полях, полученных из акрила. В фазе ознакомления (Т 1) крыс помещали отдельно на поле в течение 3 мин, в котором два идентичных объекта(пластиковые бутылки, 12,5 см высота 5,5 мм диаметр), покрытые только желтой изоляционной лентой(a1 и а 2), помещали в 2 соседних угла в 10 см от стенок. Через 24 ч после (Т 1) испытания на длительную память тех же крыс помещали на те же самые зоны, на которые их помещали в Т 1 испытании. Крысам на фазе выбора (Т 2) позволяли исследовать открытое поле в течение 3 мин в присутствии одного знакомого объекта (а 3) и одного нового объекта (b) (бутылка из желтого стекла, 12 см высота и 5 см в диаметре). Знакомые объекты имели одинаковую текстуру, цвет и размер. В процессе Т 1 и Т 2 испытаний, исследования каждого объекта (определенные как нюханье, лизание, жевание или движение волосков носа при направлении носа в сторону объекта на меньше чем 1 см) записывали отдельно по секундомеру. Сидение на объекте не считалось исследовательской активностью, однако, оно наблюдалось редко. Т 1 представляет собой суммарное время, потраченное на исследование известных объектов (a1+a2). Т 2 представляет собой суммарное время, потраченное на исследование известного объекта и нового объекта (а 3+b). Испытания на узнавание объекта проводили, как описано Ennaceur, A., Delacour, J., 1988, A newone-trial test for neurobiological studies of memory in rats -Behavioural data, Behav. Brain Res., 31, 47-59. Некоторые типичные соединения показали положительный эффект, показывающий явное улучшение распознавания новых объектов; повышенное время исследования нового объекта и большой индекс различения. Пример 102. Водный лабиринт. Прибор с водным лабиринтом состоял из круглого бассейна (1,8 м диаметр, 0,6 м высота), полученного из черного перспекса (TSE systems, Germany), заполненного водой (242 С) и расположенного под широкоугольной камерой для слежки за животным. 10 см 2 перспексную платформу, лежащую на 1 см ниже поверхности воды, помещали в центр одного из четырех воображаемых секторов и оставляли по- 25022043 стоянной для всех крыс. Черный перспекс, применяемый для получения лабиринта и платформы, не позволяет возникнуть сигналам внутри лабиринта, обеспечивающим реакцию избегания. В отличие от этого тренировочная комната дает несколько сильных внешних сигналов вне лабиринта, способствующих получению пространственной карты, необходимой для обучения избеганию. Применяли автоматическую систему слежения [Videomot 2 (5,51), TSE systems, Germany]. Данная программа анализирует видеоизображения, полученные с помощью цифровой камеры, и панели с полученным изображением, которые определяют длину пути, скорость плавания, число вхождений и продолжительность плавания, потраченную на каждый сектор водного лабиринта. Пример 103. Вызывание жевания/зевания/потягивания 5-НТ 6 антагонистами. Применяли самцов крыс линии Вистар, весящих 200-250 г. Крысам вводили инъекции среды и помещали в отдельные прозрачные камеры в течение 1 ч каждый день в течение 2 дней перед днем испытания для того, чтобы приучить их к камерам для наблюдения и способу испытания. В день испытания крыс помещали в камеры для наблюдения непосредственно перед введением лекарственного средства и непрерывно наблюдали на проявление поведения, связанного с зеванием, потягиванием и жеванием, через 60-90 мин после инъекции лекарственного средства или среды. За 60 мин до введения лекарственного средства псисостиграмсин 0,1 мг/кг интраперитонеально вводили всем животным. Регистрировали среднее число зевков, потягиваний и бессмысленных жевательных движений в процессе 30 мин наблюдения. Ссылки: (A) King M.V., Sleight A.J., Woolley M.L. et al., Neuropharmacology, 2004, 47, 195-204. (В)Bentey J.С, Bourson A., Boess F.G., Fone K.С.F., Marsden C.A., Petit N., Sleight A.J., British Journal of Pharmacology, 1999, 126 (7), 1537-1542. Пример 104. Пассивное избегание. Животных тренировали в системе однопробного шага и освещенно-затемненного пассивного избегания. Прибор для подготовки состоял из камеры 300 мм в длину, 260 мм в ширину и 270 мм в высоту,имеющую установленную конструкцию. Передняя сторона и верх были прозрачными, позволяя экспериментаторам наблюдать за поведением животного внутри прибора. Камеру разделяли на два отсека,разделенные центральным затвором, который содержал маленькое отверстие 50 мм шириной и 75 мм высотой, расположенное вблизи передней стороны камеры. Меньший из отсеков был 9 мм в ширину и содержал маломощный (6V) источник освещения. Больший отсек был 210 мм в ширину и не освящался. Пол темного отсека состоял из сектора с 16 горизонтальными стержнями из нержавеющей стали, которые были 5 мм в диаметре и располагались на 12,5 мм друг от друга. Генератор тока подавал 0,75 мА к полу сектора, которые подавались один раз каждые 0,5 с вдоль 16 стержней. Диапазон устойчивости 4060 мкОм рассчитывали для контрольной группы крыс и прибор калибровали соответствующим образом. Электронная схема, обнаруживающая сопротивление животного, обеспечивала точную подачу тока автоматическим изменением напряжения с изменением устойчивости. Экспериментальный способ Его проводили, как описано ранее. Применяли взрослых самцов крыс линии Вистера, весящих 200230 г. Животных переносили в рабочую зону за 1 ч до эксперимента. В день тренировки животных помещали спиной к светлому отсеку прибора. Секундомер начинал отсчет сразу после того, как животное полностью повернулось мордой к передней части камеры. Регистрировали время ожидания до вхождения в темную камеру (обычно 20 с) и после полного перемещения в темный отсек у животных вызывали неизбежное электроболевое раздражение лап 0,75 мА в течение 3 с. Затем животных возвращали в их клетки. Между каждым обучающим сеансом оба отсека камеры чистили для удаления любых смущающих обонятельных сигналов. Воспоминание о данных ингибирующих стимулах оценивали через 24 ч, 72 ч и на 7-ой день после тренировки,возвращая животного в светлую камеру и, регистрируя время его ожидания для того, чтобы войти в темную камеру, применяли минимальное время 300 с. Ссылки: (A) Callahan P.M., Rowe N.В., Tehim A., Abst. 776, 19, 2004, Society for neuroscience, 2004. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) при условии, что указанная связь между кольцом и группой SO2 не является сульфонамидной связью; в каждом случае R1 представляет собой водород, хлор, бром, фтор, метил или метокси;R3 представляет собой водород или метил;n равно 2,или его фармацевтически приемлемые соли. 2. Соединение по п.1, которое выбрано из группы, состоящей изN-(5-бензолсульфонил-2-метилфенил)-N-(1-метилпиперидин-4-ил)амина и их фармацевтически приемлемых солей. 3. Способ получения соединения формулы (I) по п.1, включающий восстановительное аминирование соединения формулы (II) с пиперидин-4-оновым производным, применяя подходящий восстанавливающий агент в присутствии полярного или неполярного, протонного или апротонного органического растворителя при температуре 10-40 С для получения соединения формулы (I), в котором все заместители определены, как в п.1. 4. Фармацевтическая композиция для лечения заболеваний, связанных с 5-НТ 6 рецептором, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель, разбавитель, эксципиент. 5. Фармацевтическая композиция по п.4 для лечения клинических заболеваний, выбранных из болезни Альцгеймера, депрессии, когнитивных расстройств памяти, шизофрении или умеренных когнитивных нарушений. 6. Применение соединения по любому одному из пп.1, 2 для получения лекарственного средства для лечения заболеваний, связанных с 5-НТ 6 рецептором. 7. Применение соединения по п.6 для лечения клинических заболеваний, выбранных из болезни Альцгеймера, депрессии, когнитивных расстройств памяти, шизофрении или умеренных когнитивных нарушений. 8. Соединение формулы (I) по п.1 для получения лекарственного средства для лечения заболевания центральной нервной системы, связанного с или опосредованного 5-НТ 6 рецептором.
МПК / Метки
МПК: A61K 31/4709, A61P 25/28, C07D 401/12, A61P 25/22, A61P 29/00, A61P 25/18, C07D 211/58, C07D 401/14, A61P 25/08, A61P 25/24, A61K 31/4725, A61K 31/4468
Метки: сульфоновые, 5-ht6, качестве, лигандов, рецептора, соединения
Код ссылки
<a href="https://eas.patents.su/29-22043-sulfonovye-soedineniya-v-kachestve-ligandov-5-ht6-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфоновые соединения в качестве лигандов 5-ht6 рецептора</a>
Предыдущий патент: Устройство для выдачи напитков с устройством для охлаждения воды
Следующий патент: Устройство для хранения сыпучих материалов
Случайный патент: Бициклические диазомиметики smac, способы их получения, их применения, содержащие их фармацевтические композиции и набор, содержащий указанные композиции












