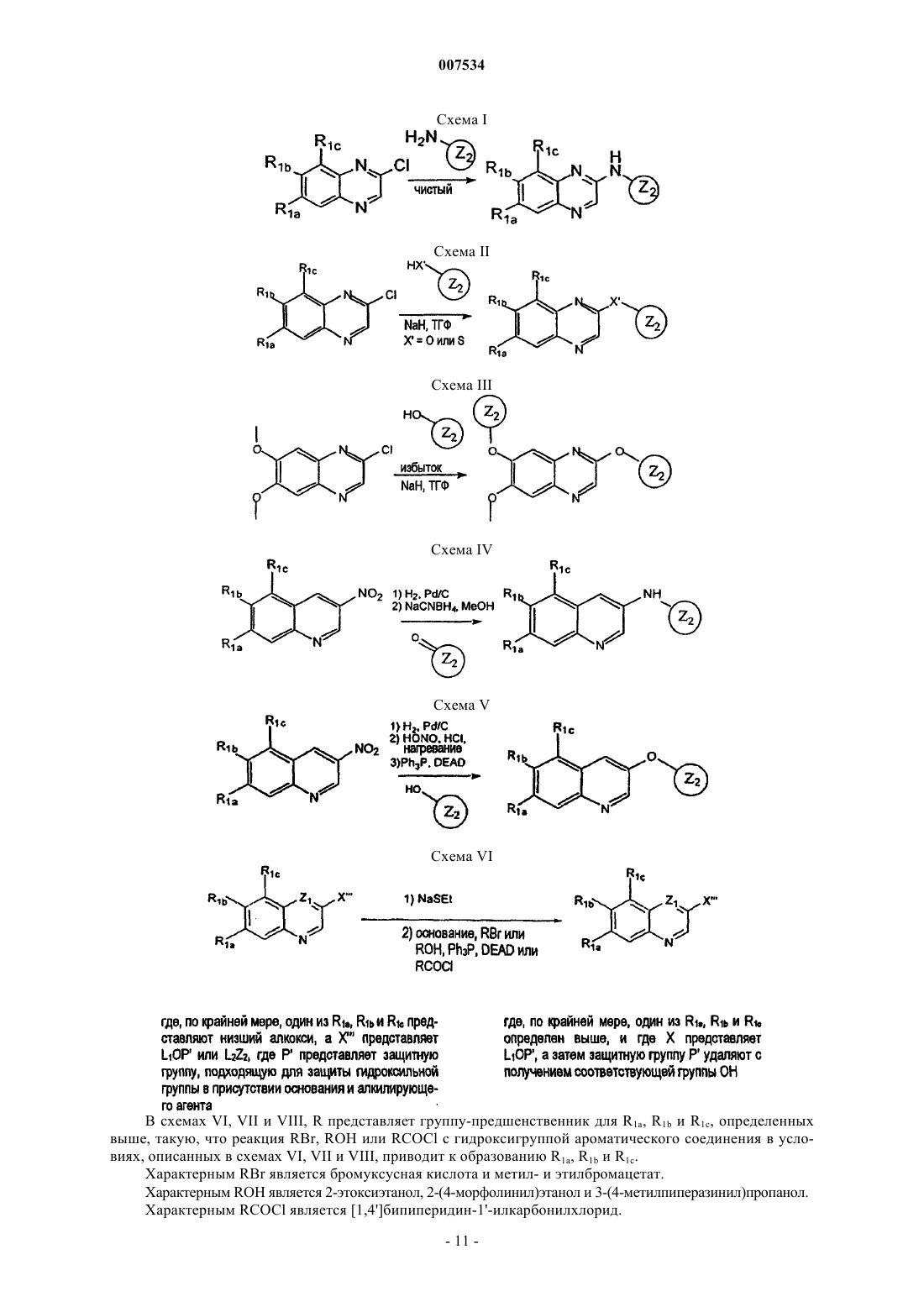
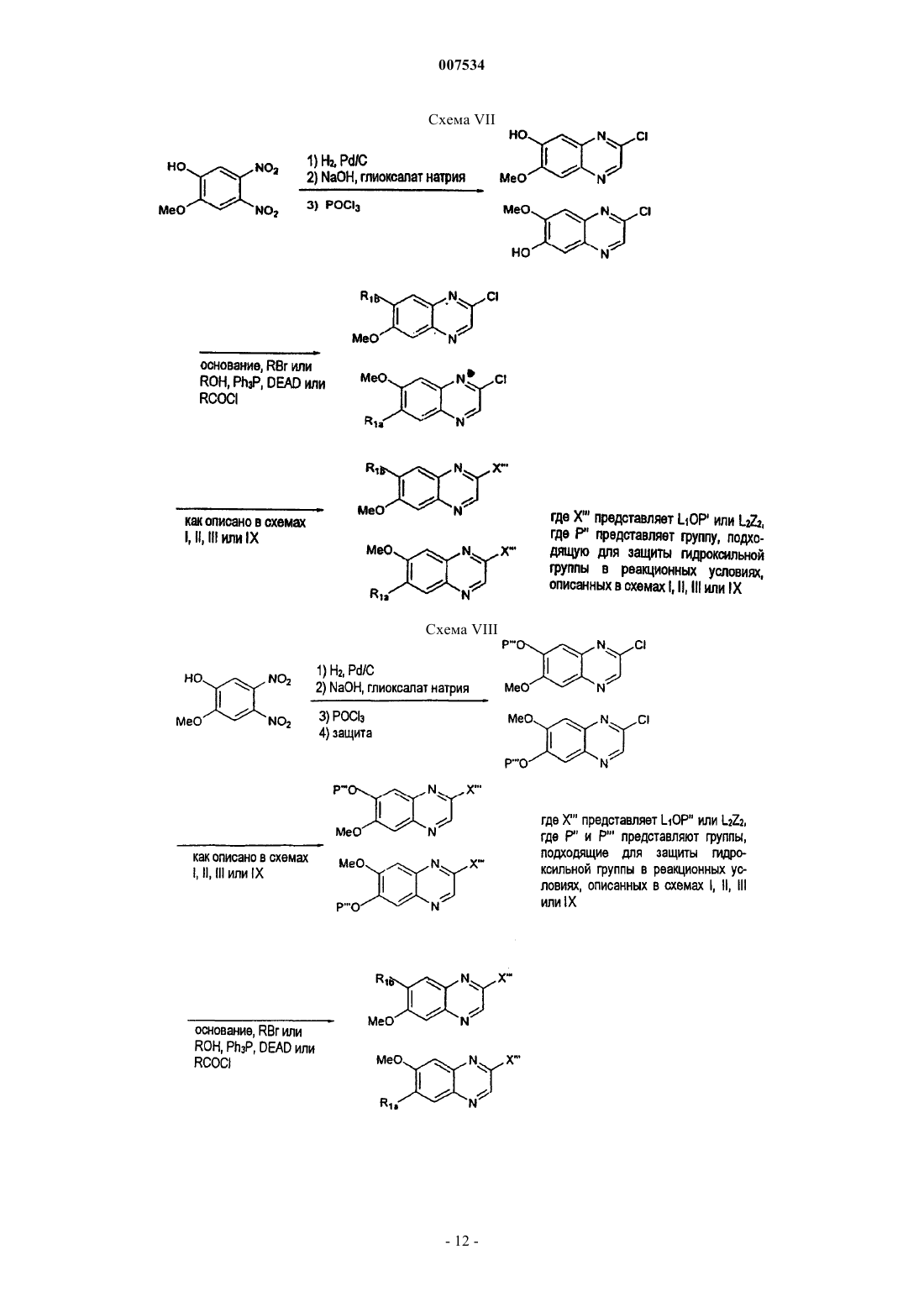
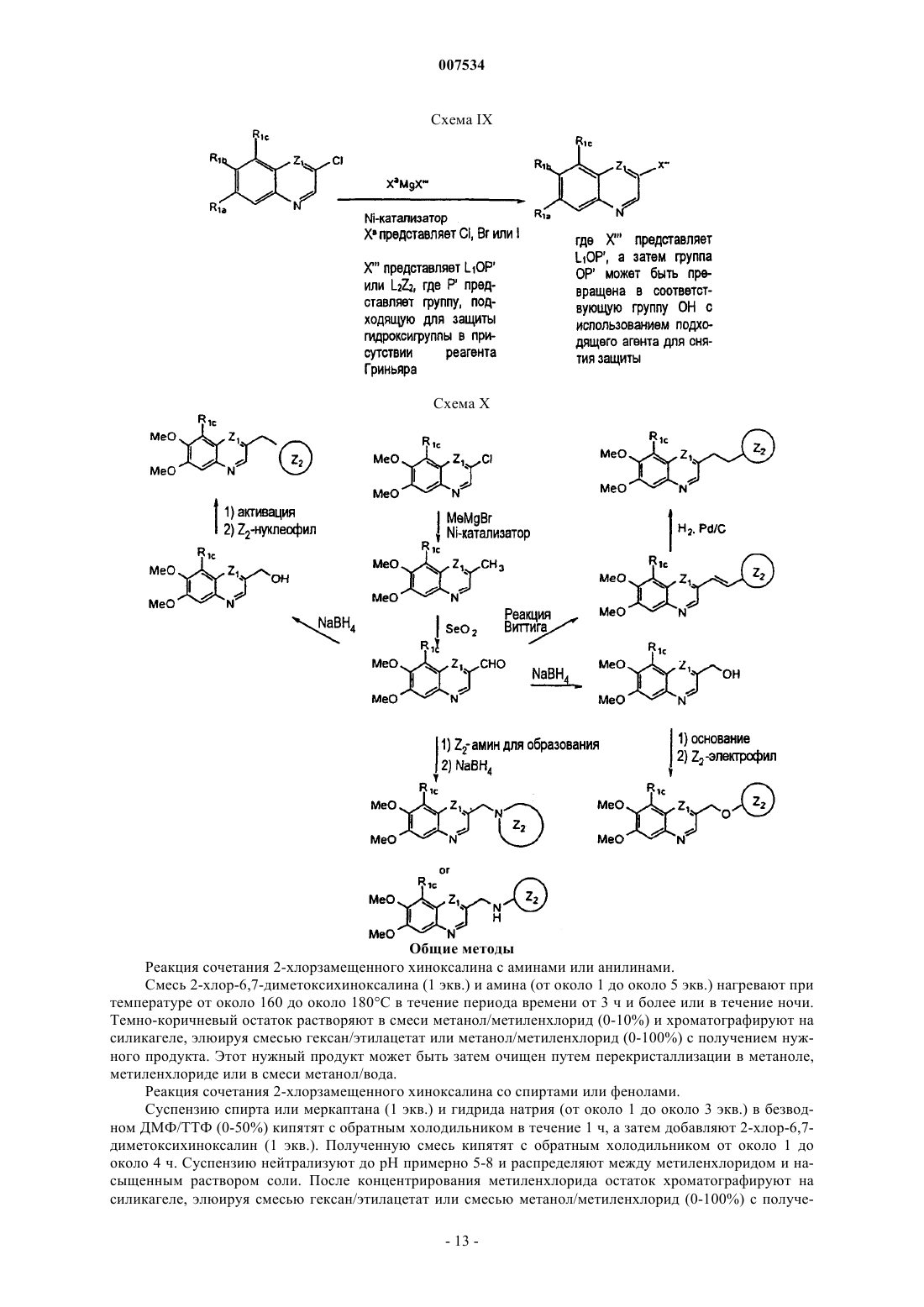
Стентовое устройство на основе хинолиновых и хиноксалиновых соединений в качестве ингибиторов pdgf-рецептора и/или тирозинкиназы lck
Номер патента: 7534
Опубликовано: 27.10.2006
Авторы: Майерс Майкл Р., Хе Вей, Магвайер Мартин П., Спада Альфред П.
Формула / Реферат
1. Стентовое устройство, включающее полимерное покрытие с включенным в него соединением формулы I, в количестве, эффективном для ингибирования рестеноза
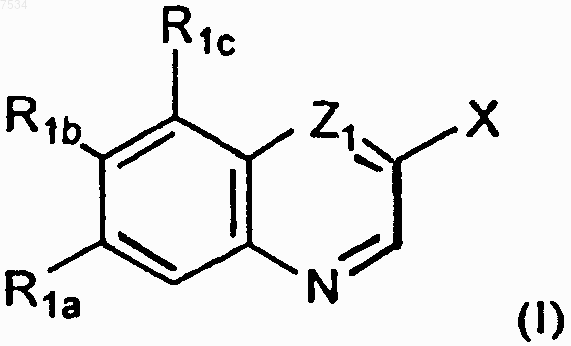
где
X представляет L1H или L2Z2;
L1 представляет (CR3aR3b)r или (CR3aR3b)m-Z3-(CR3'aR3'b)n;
L2 представляет (CR3aR3b)p-Z4-(CR3'aR3'b)q или этенил;
Z1 представляет СН или N;
Z2 представляет необязательно замещенный циклоалкил, необязательно замещенный циклоалкенил, необязательно замещенный гетероциклил или необязательно замещенный гетероцикленил;
Z3 представляет О, NR4, S, SO или SO2;
Z4 представляет О, NR4, S, SO, SO2 или связь;
m равно 0 или 1;
n равно 2 или 3, a n+m=2 или 3;
р и q независимо равны 0, 1, 2, 3 или 4, a p+q=0, 1, 2, 3 или 4, если Z4 представляет связь, и р+q=0, 1, 2 или 3, если Z4 не является связью;
r равно 2, 3 или 4;
R1a и R1b независимо представляют необязательно замещенный C1-С10алкил, необязательно замещенный арил, необязательно замещенный гетероарил, гидрокси, ацилокси, необязательно замещенный C1-С10алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси, необязательно замещенный гетероциклилкарбонилокси, необязательно замещенный арилокси, необязательно замещенный гетероарилокси, циано, R5R6N- или ацил R5N-, либо один из R1a и R1b представляет водород или галоген, а другой представляет необязательно замещенный C1-С10алкил, необязательно замещенный арил, необязательно замещенный гетероарил, гидрокси, ацилокси, необязательно замещенный C1-С10алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси, необязательно замещенный гетероциклилкарбонилокси, необязательно замещенный арилокси, необязательно замещенный гетероарилокси, циано, R5R6N- или ацил R5N-;
R1c представляет водород, необязательно замещенный C1-С10алкил, необязательно замещенный арил, необязательно замещенный гетероарил, гидрокси, ацилокси, необязательно замещенный C1-С10алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси, необязательно замещенный арилокси, необязательно замещенный гетероарилокси, галоген, циано, R5R6N- или ацил R5N-;
R3а, R3b, R3'а и R3'b независимо представляют водород или C1-С10алкил;
R4 представляет водород, C1-С10алкил или ацил; и
R5 и R6 независимо представляют водород или C1-С10алкил, либо R5 и R6, взятые вместе с атомом азота, с которым они связаны, образуют азагетероциклил, где
арил представляет ароматический карбоциклический радикал, содержащий от 6 до 10 атомов углерода,
гетероарил представляет 5-10-членную ароматическую моно- или полициклическую углеводородную кольцевую систему, в которой один или несколько атомов отличны от атома углерода и выбраны из азота, кислорода или серы,
циклоалкил представляет неароматическую моно- или полициклическую кольцевую систему, имеющую от 3 до 10 атомов углерода,
гетероциклил представляет 4-10-членную моно- или полициклическую углеводородную кольцевую систему, в которой один или несколько атомов отличны от атома углерода и выбраны из азота, кислорода или серы,
циклоалкенил представляет неароматическую моноциклическую или мультициклическую кольцевую систему, содержащую углерод-углеродную двойную связь, имеющую примерно от 3 до 10 атомов углерода,
гетероцикленил представляет 4-10-членную моноциклическую или мультициклическую кольцевую систему, которая является частично ненасыщенной и в которой один или несколько атомов не являются атомами углерода и выбраны из азота, кислорода или серы, где
C1-С10алкил необязательно замещен C1-С10алкокси, галогеном, карбокси, гидрокси или R5R6N-,
C1-С10алкокси необязательно замещен одним или несколькими заместителями, выбранными из амино, C1-С10алкокси, карбокси, C1-С10алкоксикарбонила, карбоксиарила, карбамоила, гетероциклила,
арил и гетероарил необязательно замещены одним или несколькими заместителями, выбранными из гидрокси, галогена, C1-С10алкила, C1-С10алкокси, карбокси, C1-С10алкоксикарбонила или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или C1-С10алкил,
циклоалкил, циклоалкенил, гетероцикленил и гетероциклил необязательно замещены одним или несколькими заместителями, выбранными из C1-С10алкила, гидрокси, ацилокси, C1-С10алкокси, галогена, R5R6N-, ацил-R5N-, карбокси или R5R6NCO-, или двухвалентным кислородом (-O-) у двух смежных атомов углерода с образованием эпоксида, или
его N-оксидом, гидратом, сольватом, его пролекарственной формой или его фармацевтически приемлемой солью.
2. Стентовое устройство по по п.1, где в соединении формулы I
L2 представляет (CR3aR3b)p-Z4-(CR3'aR3'b)q;
Z2 представляет необязательно замещенный циклогексил, необязательно замещенный норборнил или необязательно замещенный гетероцикленил;
р равно 0;
q равно 0 или 1;
R1a и R1b независимо представляют необязательно замещенный C1-С10алкил, необязательно замещенный C1-С10алкокси, необязательно замещенный циклоалкилокси или необязательно замещенный гетероциклилокси, либо один из R1a и R1b представляет водород или галоген;
R1c представляет водород;
R3'a и R3'b независимо представляют водород;
R4 представляет водород; или
его N-оксид, гидрат, сольват, пролекарственная форма или его фармацевтически приемлемая соль.
3. Стентовое устройство по п.1, где
Z2 представляет метилциклопентил, метилциклогексил, [2,2,1]бициклогептанил, [2,2,2]бициклооктанил, циклопентенил, циклогексенил, [2,2,1]бициклогептенил, [2,2,2]бициклооктенил.
4. Стентовое устройство по п.1, где Z4 представляет О.
5. Стентовое устройство по п.1, где Z4 представляет NR4.
6. Стентовое устройство по п.1, где Z4 представляет S.
7. Стентовое устройство по п.1, где соединение формулы I представляет собой
2-циклогексиламино-6,7-диметоксихиноксалин;
экзобицикло[2,2,1]гепт-2-ил-(6-хлор-7-метоксихиноксалин-2-ил)амин;
экзобицикло[2,2,1]гепт-2-ил-(7-хлор-6-метоксихиноксалин-2-ил)амин;
бицикло[2,2,1]гепт-2-ил-(6,7-диметилхиноксалин-2-ил)амин;
3-аминоциклогексил-6,7-диметоксихинолин;
(6,7-диметоксихинолин-3-ил)-цис-(3-(R)-метилциклогексил)амин;
(6,7-диметоксихинолин-3-ил)-цис/транс-(3-(R)-метилциклогексил)амин;
(6,7-диметоксихинолин-3-ил)-транс-(3-(R)-метилциклогексил)амин;
(6,7-диметоксихинолин-3-ил)-цис-(3-(R)-метилциклогексил)амин;
(± )-бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин;
экзобицикло[2,2,1]гепт-5-ен-2-ил-(6,7-диметоксихиноксалин-2-ил)амин;
эндобицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин;
экзобицикло[2,2,1]гепт-2-ил-(6-метоксихиноксалин-2-ил)амин;
экзо-2-(бицикло[2,2,1]гепт-2-илокси)-6,7-диметоксихиноксалин;
2-(бицикло[2,2,2]окт-2-илокси)-6,7-диметоксихиноксалин;
эндо-2-(бицикло[2,2,1]гепт-2-илокси)-6,7-диметоксихиноксалин;
экзо-2-(бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин;
2-(бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин;
2-циклогексилокси-6,7-диметоксихиноксалин;
экзо,экзо-6,7-диметокси-2-(5,6-эпоксибицикло[2,2,1]-гептан-2-илокси)хиноксалин;
6,7-диметокси-2-(4-метоксициклогексилокси)хиноксалин;
(1R,2R,4S)-(+)-бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин;
(1S,2S,4R)-(-)-бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин;
цис/транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир;
цис-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир;
транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир;
(6,7-диметоксихиноксалин-2-ил)-цис/транс-(3-(R)-метилциклогексил)амин;
(6,7-диметоксихиноксалин-2-ил)-транс-(3-(R)-метилциклогексил)амин;
(6,7-диметоксихиноксалин-2-ил)-цис-(3-(R)-метилциклогексил)амин;
метил-цис/транс-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанкарбоксилат или
его N-оксид, гидрат, сольват, пролекарственная форма или фармацевтически приемлемая соль.
8. Стентовое устройство по п.1, где полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из поликапролактона, сополимера поли(этилен-винилацетат), поли(винилацетата) и силиконовой ненаполненной резиновой смеси.
9. Стентовое устройство по п.1, где полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из латексов, уретанов, полисилоксанов и блоксополимеров стирола-этилена/бутилена-стирола.
10. Стентовое устройство по п.1, где полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из поли-DL-молочной кислоты, поли-L-молочной кислоты, сложных полиортоэфиров, полииминокарбонатов, алифатических поликарбонатов и полифосфазенов.
11. Стентовое устройство по п.1, где полимерное покрытие дополнительно включает порообразователь.
12. Стентовое устройство по п.11, где порообразователь выбран из группы, состоящей из микрогранул хлорида натрия, лактозы или натрийсодержащего гепарина.
13. Стентовое устройство по п.11, где порообразователь выбран из группы, состоящей из полиэтиленгликоля и сополимеров полиэтиленоксида/полипропиленоксида.
14. Стентовое устройство по п.1, где на полимерное покрытие нанесена мембрана, контролирующая скорость высвобождения, для ограничения скорости высвобождения соединения формулы I из полимерного покрытия.
15. Стентовое устройство по п.14, где мембрана, контролирующая скорость высвобождения, включает порообразователь, выбранный из группы, состоящей из хлорида натрия, лактозы, натрийсодержащего гепарина, полиэтиленгликоля, сополимеров полиэтиленоксида/полипропиленоксида и их смесей.
16. Стентовое устройство по п.1, где соединение формулы I включено в полимерное покрытие нанесением соединения формулы I по крайней мере на одну поверхность стентового устройства с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх биологически активного слоя.
17. Стентовое устройство по п.16, где пористый полимерный материал включает полиамид, парилен или производное парилена.
18. Стентовое устройство по п.16, где пористый полимерный материал наносят осаждением плазмы.
19. Стентовое устройство по п.18, где пористый полимерный материал выбирают из группы, состоящей из поли(этиленоксида), поли(этиленглиоля), поли(пропиленоксида), и полимеров метана, силикона и тетрафторэтилентетраметилдисилоксана.
20. Стентовое устройство по п.1, где полимерное покрытие получают добавлением фотополимеризуемого полиэтиленненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две или более акрилатных и метакрилатных групп на молекулу или их смесей.
21. Стентовое устрйство по п.20, где мономер выбирают из группы, состоящей из диакрилата этиленгликоля, диметакрилата этиленгликоля, триакрилата триметилпропана, триметакрилата триметилпропана, тетраакрилата пентаэритрита, тетраметакрилата пентаэритрита, диметакрилата 1,6-гександиола и диметакрилата диэтиленгликоля.
22. Стентовое устройство по п.20, где мономер выбирают из группы, состоящей из н-бутилакрилата, н-бутилметакрилата, 2-этилгексилакрилата, лаурилакрилата и 2-гидроксипропилакрилата.
23. Стентовое устройство по п.1, где полимерное покрытие включает полимер, выбранный из группы, состоящей из поли(L-молочной кислоты), поликапролактона, сополимера поли(лактид-гликолид), поли(гидроксибутирата), сополимера поли(гидроксибутират-валерат), полидиоксанона, полиортоэфира, полиангидрида, поли(гликолевой кислоты), поли(D,L-молочной кислоты), сополимера поли(гликолевая кислота-триметиленкарбонат), полифосфоэфира, полифосфоэфируретана, поли(аминокислот), цианоакрилатов, поли(триметиленкарбоната), поли(иминокарбоната), поли(простой эфир-сложные эфиры), полиалкиленоксалатов, полифосфазенов, фибрина, фибриногена, целлюлозы, крахмала, коллагена и гиалуроновой кислоты.
24. Стентовое устройство по п.1, где полимерное покрытие включает полимер, выбранный из группы, состоящей из полиуретанов, силиконов, полиэфиров, полиолефинов, полиизобутилена и сополимера этилен-альфаолефин, полимеров и сополимеров акриловой кислоты, полимеров и сополимеров винилгалогенида, таких как поливинилхлорид, поливиниловых простых эфиров, таких как поливиниловый этиловый эфир, поливинилиденгалогенидов, таких как поливинилиденфторид и поливинилиденхлорид, полиакрилонитрила, поливинилкетонов, поливиниловых ароматических соединений, таких как полистирол, поливиниловых сложных эфиров, таких как поливинилацетат, сополимеров виниловых мономеров друг с другом и олефинами, таких как сополимеры этилена-метилметакрилата, сополимеры акрилонитрила-стирола, смолы ABS и сополимеры этилена-винилацетата, полиамидов, таких как Nylon 66 и поликапролактам, алкиловых смол, поликарбонатов, полиоксиметиленов, полиимидов, полиэфиров, эпоксидных смол, полиуретанов, искусственного волокна, триацетатного искусственного волокна, целлюлозы, ацетата целлюлозы, бутирата целлюлозы, ацетатбутирата целлюлозы, целллофана, нитрата целлюлозы, пропионата целлюлозы, простых эфиров целлюлозы и карбоксиметилцеллюлозы.
25. Применение стентового устройства по п.1 для лечения рестеноза у пациента в заранее определeнном месте.
26. Применение по п.25, где указанным заранее определенным местом является место механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой.
27. Применение соединения формулы I по п.1 для производства стентового устройства для ингибирования рестеноза, где соединение формулы I включено в полимерное покрытие, нанесенное на указанный стент.
28. Применение по п.27, где рестеноз имеется в месте механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой.
Текст
007534 Перекрестная ссылка на родственные заявки Настоящая заявка является частичным продолжением заявки на патент США 09/198718, поданной 24 ноября 1998, которая, в свою очередь, является частичным продолжением Международной патентной заявки РСТ/США 98/11036, поданной 28 мая 1998 г., которая, в свою очередь, является частичным продолжением заявки на патент США 08/972614, поданной 18 ноября 1997, которая, в свою очередь,является частичным продолжением заявки на патент США 08/864455, поданной 18 мая 1997 и в настоящее время отозванной. Предпосылки создания изобретения Область, к которой относится изобретение Настоящее изобретение направлено на ингибирование пролиферации клеток, и/или продуцирования клеточного матрикса, и/или миграции клеток (хемотаксиса), и/или активации и пролиферации Т-клеток с использованием хинолиновых/хиноксалиновых соединений, которые могут быть использованы в качестве ингибиторов протеин-тирозинкиназы (TKI). Передача клеточного сигнала опосредуется системой взаимодействий, которая включает контактирование клеток друг с другом, контактирование клеток с матриксом или внеклеточное контактирование рецептора с субстратом. Внеклеточный сигнал часто передается другим частям клетки благодаря опосредованному тирозинкиназой событию фосфорилирования, которое воздействует на белки субстрата, расположенные ниже от передающего сигнал комплекса, ассоциированного с клеточной мембраной. Примерами тирозинкиназных ферментов, участвующих в процессе передачи клеточного сигнала, является специфическая серия рецепторов-ферментов, таких как инсулиновый рецептор, рецептор эпидермального фактора роста (EGF-R) или рецептор тромбоцитарного фактора роста (PDGF-R). Для эффективного опосредованного ферментом фосфорилирования субстратных белков, содержащих тирозиновые остатки,необходимо автофосфорилирование фермента. Известно, что указанные субстраты ответственны за различные клеточные события, включая, среди прочих, клеточную пролиферацию, продуцирование клеточного матрикса, миграцию клеток и апоптоз. При этом следует отметить, что большое число патологических состояний вызывается неконтролируемым репродуцированием клеток, или сверхпродуцированием клеточного матрикса, или плохой регуляцией запрограммированной гибели клеток (апоптоза). Такие патологические состояния ассоциируются с различными типами клеток, и примерами таких состояний являются лейкоз, рак, глиобластома, псориаз, воспалительные расстройства, болезни костей, фиброзные болезни, атеросклероз и рестеноз, возникающий после ангиопластики коронарных, бедренных или почечных артерий, или фибропролиферативные заболевания, такие как артрит, фиброз легких, почек и печени. Кроме того, нарушение регуляции клеточных пролиферативных состояний происходит в результате хирургической операции по коронарному шунтированию. Очевидно, что ингибирование тирозинкиназной активности является эффективным способом для регуляции неконтролируемого репродуцирования клеток, или сверхпродуцирования клеточного матрикса, или плохой регуляции запрограммированной гибели клеток (апоптоза). Известно также, что некоторые ингибиторы тирозинкиназы могут взаимодействовать с более, чем одним типом тирозинкиназных ферментов. Некоторые тирозинкиназные ферменты имеют важное значение для нормального функционирования организма. Так, например, ингибирование действия инсулина было бы нежелательным в абсолютно нормальных условиях. Поэтому соединения, которые ингибируют тирозинкиназную активность PDGF-R при концентрациях, меньших, чем концентрации, эффективные для ингибирования киназной активности рецептора инсулина, являются ценными агентами для эффективного лечения заболеваний, характеризующихся клеточной пролиферацией и/или продуцированием клеточного матрикса, и/или миграцией клеток (хемотаксисом), таких как рестеноз. Настоящее изобретение относится к модуляции и/или ингибированию передачи клеточного сигнала, пролиферации клеток, продуцированию внеклеточного матрикса, хемотаксису; и к регуляции аномального роста клеток и клеточного воспалительного ответа. Более конкретно, настоящее изобретение относится к использованию замещенных хиноксалиновых соединений, которые селективно ингибируют дифференцировку, пролиферацию или высвобождение медиатора путем эффективного ингибирования тирозинкиназной активности рецептора тромбоцитарного фактора роста (PDGF-R) и/или тирозинкиназной активности Lck. Известные разработки В ряде литературных источниковописаны ингибиторы тирозинкиназы, которые являются селективными для тирозинкиназных рецепторов-ферментов, таких как EGF-R и PDGF-R и нерецепторных цитозольных тирозинкиназных ферментов, таких как v-abl, p561ck или c-src. Недавно в литературе, SpadaMyers (Exp. Opin. Ther. Patents. 1995, 5(8), 805) и Bridges (Exp. Opin. Ther. Patents 1995, 5(12), 1245) были кратко описаны ингибиторы тирозинкиназы и селективные ингибиторы EGF-R, соответственно. Кроме того, в работах Law и Lydon приводится краткое описание противоракового действия ингибиторов тирозинкиназы (Emerging Drugs: The Prospect For Improved Medicines 1996, 241-260). Известными ингибиторами тирозинкиназной активности PDGF-R являются ингибиторы на основе хинолина, о которых сообщалось в работе Maguire et al. (J.Med.Chem. 1994, 37, 2129) и Dolle et al.(J.Med.Chem. 1994, 37, 2627). Класс ингибиторов на основе фениламинопиримидина был недавно описан-1 007534 в работе Traxler et al. в ЕР 564409 и Zimmerman J.; и Traxler P. et al. (Biorg. Med.Chem. Lett. 1996, 6(11),1221-1226) и Buchdunger E. et al. (Proc. Natl. Acad. Sci. 1995, 92, 2528). Несмотря на достигнутый прогресс в этой области, еще не существует агентов указанных классов соединений, которые были бы разрешены для их использования в целях лечения пролиферативного заболевания у человека. Корреляция между многофакторным заболеванием рестеноза, вызываемого PDGF и PDGF-R, хорошо документирована в научной литературе. Однако, недавно достигнутые успехи в изучении фиброзных заболеваний легких (Antoniades H.N. et al., J.Clin.Invest. 1990, 86, 1055), почек и печени (Peterson,Т.С. Hepatology, 1993, 17, 486) также позволяет сделать вывод о том, что PDGF и PDGF-R играют определенную роль в данном процессе. Так, например, гломерулонефрит является основной причиной почеченой недостаточности, a PDGF был идентифицирован как сильный митоген для мезангиальных клетокin vitro, как было продемонстрировано Shultz и др. (Am. J. Physiol. 1988, 255, F674) и Floege et al. (Clin.TNF-альфа и PDGF (полученные от пациентов с ревматоидным артритом) являются главными цитокинами, участвующими в пролиферации синовиальных клеток. Кроме того, были идентифицированы специфические типы опухолевых клеток (см. Silver, B.J., BioFactors, 1992, 3, 217), таких как клетки глиобластомы и саркомы Капоши, которые способствуют сверхэкспрессии либо белка, либо рецептора PDGF,что приводит к неконтролируемому росту раковых клеток по аутокринному или паракринному механизму. Следовательно, ожидается, что ингибитор тирозинкиназы PDGF может быть использован для лечения ряда, на первый взгляд, не связанных друг с другом патологических состояний человека, которые по своей этиологии могут характеризоваться участием PDGF и/или PDGF-R. Роль различных нерецепторных тирозинкиназ, таких как р 56lсk (далее называемых "Lck"), в состояниях, ассоциированных с воспалениями, которая заключается в активации и пролиферации Т-клеток,описана Hanke и др. (Inflamm. Res. 1995, 44, 357) и BolenBrugge (Ann.Rev.Immunol., 1997, 15, 371). Этими воспалительными состояниями являются аллергия, аутоиммунные заболевания, ревматоидный артрит и отторжение трансплантата. В другом недавно опубликованном обзоре кратко описаны различные классы ингибиторов тирозинкиназы, включая соединения, обладающие Lck-ингибирующей активностью (Groundwater et al., Progress in Medicinal Chemistry, 1996, 33, 233). К ингибиторам Lck-тирозинкиназной активности относятся некоторые природные соединения, которые, в основном, являются неселективными ингибиторами тирозинкиназы, такие как стауроспорин, генистеин, некоторые флавоны и эрбстатин. Недавно сообщалось, что дамнакантол является ингибитором Lck при низких нМконцентрациях (Faltynek et al., Biochemistry, 1995, 34. 12404). Примерами синтетических ингибиторовLck являются ряд дигидроксиизохинолиновых ингибиторов, которые, как сообщалось, имеют низкую активность при концентрациях в микромолярном-субмикромолярном диапазоне (Burke et al.,J.Med.Chem., 1993, 36, 425); и хинолиновое производное, которое, как обнаружено, обладает гораздо меньшей активностью, то есть его ингибирующая концентрация для Lck составляет IC50 = 610 мкМ. Исследователями был также описан ряд 4-замещенных хиназолинов, которые ингибируют Lck при низких микромолярных-субмикромолярных концентрациях (Myers et al., WO 95/15758 и Myers et al., BioorgMed.Chem.Lett. 1997, 7, 417). Исследователями в Пфитце (Hanke et al., J.Biol.Chem., 1996, 271, 695) были описаны два специфических пиразолопиримидиновых ингибитора, известных как РР 1 и РР 2, которые обладают низкой наномолярной активностью против Lck и Fyn (другой киназы семейства Src). Что касается хинолиновых или хиноксалиновых соединений, то о их Lck-ингибирующей активности ничего не сообщалось. Следовательно, ожидается, что хинолиновый или хиноксалиновый ингибитор тирозинкиназной активности Lck может быть использован для лечения ряда, на первый взгляд, не связанных друг с другом патологических состояний человека, которые, по своей этиологии, могут характеризоваться передачей сигнала тирозинкиназы Lck. Краткое описание изобретения Настоящее изобретение относится к стентовому устройству, включающему полимерное покрытие с включенным в него соединением формулы IZ1 представляет СН или N;Z2 представляет необязательно замещений циклоалкил, необязательно замещенный циклоалкенил,необязательно замещенный гетероциклил или необязательно замещенный гетероцикленил;R1a и R1b независимо представляют необязательно замещенный алкил, необязательно замещенный арил, необязательно замещенный гетероарил, гидрокси, ацилокси, необязательно замещенный алкокси,необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси, необязательно замещенный гетероциклилкарбонилокси, необязательно замещенный арилокси, необязательно замещенный гетероарилокси, циано, R5R6N- или ацил R5N-, либо один из R1a и R1b представляет водород или галоген, а другой представляет необязательно замещенный алкил, необязательно замещенный арил,необязательно замещенный гетероарил, гидрокси, ацилокси, необязательно замещенный алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси, необязательно замещенный гетероциклилкарбонилокси, необязательно замещенный арилокси, необязательно замещенный гетероарилокси, циано, R5R6N- или ацил R5N-;R3 а, R3b, R3'а и R3'b независимо представляют водород или алкил;R5 и R6 независимо представляют водород или алкил, либо R5 и R6, взятые вместе с атомом азота, с которым они связаны, образуют азагетероциклил, или его N-оксиду, его гидрату, его сольвату, его пролекарству или его фармацевтически приемлемой соли. В другом своем аспекте, настоящее изобретение относится к применению стентового устройства для лечения рестеноза у пациента. Настоящее изобретение также относится к применение соединения формулы I для производства стентового устройства для ингибирования рестеноза. Подробное описание изобретения Термины, используемые выше и на протяжении всего описания изобретения, имеют, если это не оговорено особо, нижеследующие значения: Определения"Эффективное количество" означает количество соединения настоящего изобретения, эффективное для ингибирования тирозинкиназной активности PDGF-R и тирозинкиназной активности Lck, и тем самым для продуцирования нужного терапевтического эффекта."Алкил" означает алифатическую углеводородную группу, которая может быть разветвленной или прямой и содержать примерно от 1 до 10 атомов углерода. Предпочтительным алкилом является "низший алкил", имеющий примерно от 1 до 6 атомов углерода, а более предпочтительно примерно от 1 до 4 атомов углерода. Термин "разветвленный" означает, что одна или несколько низших алкильных групп,таких как метил, этил или пропил связаны с линейной алкильной цепью. Алкильная группа также необязательно замещена алкокси, галогеном, карбокси, гидрокси или R5R6N-. Примерами алкила являются метил, фторметил, дифторметил, трифторметил, этил, н-пропил, изопропил, бутил, втор-бутил, третбутил, амил и гексил."Алкенил" означает алифатическую углеводородную группу, которая содержит углеродуглеродную двойную связь и которая может быть прямой или разветвленной группой, имеющей примерно от 2 до 10 атомов углерода в цепи. Предпочтительные алкенильные группы имеют примерно от 2 до 6 атомов углерода в цепи, а более предпочтительно, примерно от 2 до 4 атомов углерода в цепи. Термин"разветвленный" означает, что одна или несколько низших алкильных групп, таких как метил, этил или пропил связаны с линейной алкенильной цепью. "Низший алкенил" означает алкенил, имеющий примерно от 2 до 4 атомов углерода в цепи, которая может быть прямой или разветвленной. Алкенильная группа может быть замещена карбалкокси. Примерами алкенильных групп являются этенил, пропенил, нбутенил, изобутенил, 3-метилбут-2-енил, н-пентенил, гептенил, октенил, циклогексилбутенил и деценил."Циклоалкил" означает не-ароматическую моно- или мультициклическую кольцевую систему,имеющую примерно от 3 до 10 атомов углерода. Циклоалкильная группа как часть радикалов R1a, R1b илиR1c необязательно замещена одним или несколькими, а предпочтительно, одним-тремя, а более предпочтительно, одним или двумя заместителями, выбранными из нижеуказанных "заместителей для циклоалкила", алкильных, гидрокси-, ацилокси-, алкокси-, галогеновых, R5R6N-, ацил-R5N-, карбокси- илиR5R6NCO-зaмecтитeлeй, либо двухвалентным кислородом (-O-) у двух смежных атомов углерода с обра-3 007534 зованием эпоксида; причем, более предпочтительными заместителями являются алкил, гидрокси, ацилокси, алкокси, двухвалентный кислород и R5R6NCO-. Циклоалкильная группа как часть радикалов Z2 необязательно замещена одним или несколькими, а предпочтительно, одним-тремя, а более предпочтительно, одним или двумя заместителями, выбранными из нижеуказанных "заместителей для циклоалкила", алкильных, алкокси-, галогеновых, R5R6N-, ацил-R5N-, карбокси- или R5R6NCO-зaмecтитeлeй, либо двухвалентным кислородом (-O-) у двух смежных атомов углерода с образованием эпоксида; причем,более предпочтительными заместителями являются алкил, гидрокси, ацилокси, алкокси, двухвалентный кислород и R5R6NCO-. Кроме того, если циклоалкильная группа замещена по крайней мере двумя гидрокси-заместителями, то по крайней мере два из этих гидроксизаместителей могут быть кеталированы или ацеталированы альдегидом или кетоном, имеющим один-шесть атомов углерода, с образованием соответствующего кеталя или ацеталя. Кетализация гемдиола приводит к образованию спироконденсированной кольцевой системой. Предпочтительным спироциклоалкильным кольцом является 1,4-диоксаспиро[4,5]дек-8-ил. Предпочтительными незамещенными или замещенными моноциклическими циклоалкильными кольцами являются циклопентил, фторциклопентил, циклогексил и циклогептил; более предпочтительными являются циклогексил и циклопентил. Примерами мультициклических циклоалкильных колец являются 1-декалин, адамант-(1 или 2-)-ил, [2,2,1]бициклогептанил (норборнил) и[2,2,2]бициклооктанил; при этом, более предпочтительными являются [2,2,1]бициклогептанил и"Циклоалкенил" означает неароматическую моноциклическую или мультициклическую кольцевую систему, содержащую углерод-углеродную двойную связь, имеющую примерно от 3 до 10 атомов углерода. Циклоалкенильная группа как часть радикалов R1a, R1b или R1c необязательно замещена одним или несколькими, а предпочтительно одним-тремя, а более предпочтительно одним или двумя заместителями, описанными выше. Циклоалкенильная группа как часть радикалов Z2 необязательно замещена одним или несколькими, а предпочтительно одним-тремя, а более предпочтительно одним или двумя заместителями, описанными выше. Предпочтительными незамещенными или замещенными моноциклическими циклоалкенильными кольцами являются циклопентенил, циклогексенил и циклогептенил; более предпочтительными являются циклогептенил и циклогексенил. Предпочтительными мультициклическими циклоалкенильными кольцами являются [2,2,1]бициклогептенил (норборненил) и [2,2,2]бициклооктенил."Арил" означает ароматический карбоциклический радикал, содержащий примерно от 6 до 10 атомов углерода. Примерами арила являются фенил или нафтил, либо фенил или нафтил, замещенные одним или несколькими заместителями арильной группы, которые могут одинаковыми или различными,где "заместителем арильной группы" являются водород, гидрокси, галоген, алкил алкокси, карбокси, алкоксикарбонил или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или алкил. Предпочтительными заместителями арильной группы являются водород, галоген и алкокси."Гетероарил" означает примерно 5-10-членную ароматическую моноциклическую или мультициклическую углеводородную кольцевую систему, в которой один или несколько атомов углерода на указанной кольцевой системе являются не атомами углерода, а например, атомами азота, кислорода или серы. Префиксы "аза", "окса" или "тиа" перед гетероарилом означают, что в данной кольцевой системе присутствует по крайней мере один атом азота, кислорода или серы, соответственно, в качестве кольцевого атома. "Гетероарил" может быть также замещен одним или несколькими вышеупомянутыми "заместителями для арильной группы". Примерами гетероарильных групп являются замещенный пиразинил фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил,фуразанил, пирролил, имидазо-[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил,бензотиенил, хинолинил, имидазолил и изохинолинил."Гетероциклил" означает примерно 4-10-членную моноциклическую или мультициклическую углеводородную кольцевую систему, в которой один или несколько атомов углерода на указанной кольцевой системе являются не атомами углерода, а атомами, выбранными из атомов азота, кислорода или серы. Гетероциклильная группа как часть радикалов R1a, R1b или R1c необязательно замещена одним или несколькими, а предпочтительно, одним-тремя, а более предпочтительно, одним или двумя заместителями,описанными выше. Гетероциклильная группа как часть радикалов Z2 необязательно замещена одним или несколькими, а предпочтительно, одним-тремя, а более предпочтительно, одним или двумя заместителями, описанными выше. Префиксы "аза", "окса" или "тиа" перед гетероциклилом означают, что в данной кольцевой системе присутствует по крайней мере один атом азота, кислорода или серы, соответственно,в качестве кольцевого атома. Примерами гетероциклильных групп являются пиперидил, пирролидинил,пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксоланил, 1,4 диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил и т.п. Примерами гетероциклильных групп являются хинуклидил, пентаметиленсульфид, тетрагидропиранил, тетрагидротиофенил, пирролидинил, тетрагидрофуранил, 7-оксабицикло[2,2,1]гептанил или 4-пиперидинопиперидин."Гетероциклилкарбонилокси" означает гетероциклил-С(О)O-группу, где гетероциклил определен в настоящем описании. Примером гетероциклилкарбонилоксигруппы является [1,4']-биперидинил-1'карбонилокси-(4-пиперидинопиперид-1-илкарбонилокси)."Гетероцикленил" означает примерно 4-10-членную ароматическую моноциклическую или мульти-4 007534 циклическую кольцевую систему, которая является частично ненасыщенной и в которой один или несколько атомов углерода на указанной кольцевой системе являются не атомами углерода, а атомами, выбранными из атомов азота, кислорода или серы. Гетероцикленильная группа как часть радикалов R1a, R1b или R1c необязательно замещена одним или несколькими, а предпочтительно одним-тремя, а более предпочтительно одним или двумя заместителями для циклоалкилов, описанными выше. Гетероцикленильная группа как часть радикалов Z2 необязательно замещена одним или несколькими, а предпочтительно,одним-тремя, а более предпочтительно, одним или двумя заместителями для циклоалкилов, описанными выше. Префиксы "аза", "окса" или "тиа" перед гетероцикленилом означают, что в данной кольцевой системе присутствует по крайней мере один атом азота, кислорода или серы, соответственно, в качестве кольцевого атома. Примерами моноциклических азагетероцикленильных групп являются 1,2,3,4 тетрагидрогидропиридил, 1,2-дигидропиридил, 1,4-дигидропиридил, 1,2,3,6-тетрагидропиридил, 1,4,5,6 тетрагидропиримидил, 2-пирролинил, 3-пирролинил, 2-имидазолинил, 2-пиразолинил и т.п. Примерами оксагетероцикленильных групп являются 3,4-дигидро-2 Н-пиран, дигидрофуранил и фтордигидрофуранил. Примером мультициклической оксагетероцикленильной группы является 7 оксабицикло[2,2,1]гептенил. Примерами моноциклических тиагетероцикленильных групп являются дигидротиофенил и дигидротиопиранил."Ацил" означает группу Н-СО- или алкил-СО-, где алкильная группа описана выше. Предпочтительные ацилы содержат низший алкил. Примерами ацильных групп являются формил, ацетил, пропаноил, 2-метилпропаноил, бутаноил и капроил."Ароил" означает группу арил-СО-, где арильная группа описана выше. Примерами таких групп являются бензоил и 1- и 2-нафтоил."Алкокси" означает группу алкил-О-, где алкильная группа описана выше. Предпочтительным алкокси является "низший алкокси", имеющий от около 1 до около 6 атомов углерода. Алкокси может быть необязательно замещен одной или несколькими амино, алкокси, карбокси, алкоксикарбонильной, карбоксиарильной, карбамоильной или гетероциклильной группами. Примерами алкоксигрупп являются метокси, этокси, н-пропокси, изопропокси, н-бутокси, гептокси, 2-(морфолин-4-ил)этокси, 2(этокси)этокси, 2-(4-метилпиперазин-1-ил)этокси, карбамоил, N-метилкарбамоил, N,N-диметилкарбамоил, карбоксиметокси и метоксикарбонилметокси."Циклоалкилокси" означает циклоалкил-О-группу, где циклоалкильная группа описана выше. Примерами циклоалкилоксигрупп являются циклопентилокси и циклогексилокси."Гетероциклилокси" означает группу гетероциклил-О-, где указанная гетероциклильная группа описана выше. Примерами гетероциклилоксигрупп являются хинуклидилокси, пентаметиленсульфидокси, тетрагидропиранилокси, тетрагидротиофенилокси, пирролидинилокси, тетрагидрофуранилокси и 7-оксабицикло[2,2,1]гептанилокси."Арилокси" означает группу арил-О-, где арильная группа описана выше."Гетероарилокси" означает группу гетероарил-О-, где гетероарильная группа описана выше."Ацилокси" означает группу ацил-О-, где ацильная группа описана выше."R5R6N-" означает замещенную или незамещенную аминогруппу, где R5 и R6 описаны выше. Примерами таких групп являются амино (H2N-), метиламино, этилметиламино, диметиламино и диэтиламино."R5R6NCO-" означает замещенную или незамещенную карбамоильную группу, где R5 и R6 определены выше. Примерами таких групп являются карбамоил (H2NCO-) , N-метилкарбамоил (MeNHCO-) и"Галоген" означает фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром, а более предпочтительными являются фтор или хлор."Пролекарство" означает форму соединения формулы I, подходящую для введения пациенту и не оказывающую нежелательные токсическое, раздражающее, аллергическое и тому подобное действие, а также эффективную для целей ее использования, включая кеталевые, сложноэфирные и цвиттерионные формы. Пролекарство трансформируется in vivo, например, путем гидролиза в крови, с образованием исходного соединения вышеуказанной формулы. Подробное обсуждение приводится в работе Т. HiguchiV.Stella, Pro-drugs as Novel Delivery Systems. Vol. 14 of the A.C.S. Symposium Series и в работе Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and PergamonPress, 1987, которые вводятся в настоящее описание посредством ссылки."Сольват" означает физическую ассоциацию соединения настоящего изобретения с одним или несколькими молекулами растворителя. Эта физическая ассоциация имеет различные степени ионного и ковалентного связывания, включая водородное связывание. В некоторых случаях, сольват может быть выделен, например, если одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. Термин "сольват" включает сольват в растворенной фазе и выделенный сольват. Примерами сольватов являются этаноляты, метаноляты и т.п. "Гидрат" означает сольват, где молекула(ы) растворителя представляет(ют) собой Н 2 О.-5 007534 Предпочтительные варианты осуществления изобретения В своем предпочтительном аспекте, настоящее изобретение относится к стентовому устойству, содержащему соединение формулы I, гдеZ2 представляет необязательно замещенный циклоалкил, необязательно замещенный циклоалкенил или необязательно замещенный гетероциклил;R1a и R1b независимо представляют необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси илиR5R6N-, либо один из R1a и R1b представляет водород или галоген, а другой представляет необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный циклоалкилокси,необязательно замещенный гетероциклилокси или R5R6N-;R1c представляет водород, необязательно замещенный алкил или необязательно замещенный алкокси;R3a, R3b, R3'a и R3'b независимо представляют водород или низший алкил;R5 и R6, взятые вместе с атомом азота, с которым они связаны, образуют азагетероциклил, или его N-оксиду, гидрату, сольвату, пролекарству или его фармацевтически приемлемой соли. В другом предпочтительном аспекте настоящего изобретения указанным соединением является соединение формулы I, гдеZ2 представляет необязательно замещенный циклоалкил или необязательно замещенный циклоалкенил;R1a и R1b независимо представляют необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный циклоалкилокси, необязательно замещенный гетероциклилокси,либо один из R1a и R1b представляет водород или галоген;R4 представляет водород, или его N-оксид, гидрат, сольват, пролекарство или фармацевтически приемлемая соль. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где L1H представляет низший алкил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z1 представляет СН. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z1 представляет N. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет необязательно замещенный циклоалкил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет алкил-замещенный моноциклический циклоалкил; а более предпочтительно, метилциклопентил или метилциклогексил. В другом предпочтительном своем аспекте, настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет мультициклический циклоалкил; а более предпочтительно, [2,2,1]бициклогептанил (норборнил) и [2,2,1]бициклооктанил. В другом предпочтительном своем аспекте, настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет необязательно замещенный циклоалкенил; а более предпочтительно, циклопентенил и циклогексенил. Предпочтительными мультициклическими циклоалкенильными кольцами являются [2,2,1]-бициклогептенил (норборненил) и[2,2,1]бициклооктенил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет циклопентенил или циклогексенил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет мультициклический циклоалкенил; а более предпочтительно, [2,2,1]бициклогептенил (норборненил) и [2,2,1]бициклооктенил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устрой-6 007534 ству, содержащему соединение формулы I, где р и q равны 0. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где р + q =1. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет О. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет О, а р и q равны 0. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет О, а р + q =1. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет NR4. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет NR4, a p и q равны 0. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет NR4, a m+n =1. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет S. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет S, а р и q равны 0. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z4 представляет S, a p + q =1. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где R1a и R1b независимо представляют необязательно гидроксизамещенный низший алкил, гидрокси, низший алкокси, циклоалкилокси, гетероциклилокси, либо один из R1a и R1b представляет водород или галоген. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где R1a и R1b независимо представляют гетероциклилкарбонилокси или необязательно замещенный низший алкокси; а более предпочтительно, низший алкокси представляет метокси или этокси. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет низший алкил; более предпочтительным низшим алкилом является метил или этил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет низший алкокси, а другой из Rla и R1b представляет галоген; более предпочтительным низшим алкокси является метокси или этокси, а галогеном является хлор или бром. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет низший алкил, а другой изR1a и R1b представляет низший алкокси; более предпочтительно низший алкокси представляет метокси или этокси, а низший алкил представляет метил или этил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет низший алкокси, а другой из R1a и R1b представляет циклоалкилокси; более предпочтительно низший алкокси представляет метокси или этокси, а циклоалкилокси представляет циклопентилокси или циклогексилокси. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет водород, а другой из R1a иR1b представляет низший алкокси, циклоалкилокси или гетероциклоалкилокси; более предпочтительно низший алкокси представляет метокси или этокси, а циклоалкилокси представляет циклопентилокси или циклогексилокси, а гетероциклилокси представляет фуранилокси. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где R1c представляет водород, низший алкил или низший алкокси; более предпочтительно низший алкокси представляет метокси или этокси. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где Z2 представляет (гидрокси или алкил)замещенный гидроксициклоалкил, а более предпочтительно (низший алкил)гидроксициклоалкил. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где R1a и R1b представляют низший алкокси, где указанный низший алкокси необязательно замещен алкокси, гетероциклилом, карбокси, алкоксикарбонилом или карбамоилом. В другом предпочтительном своем аспекте настоящее изобретение относится к стентовому устройству, содержащему соединение формулы I, где один из R1a и R1b представляет незамещенный низший алкокси, а другой из R1a и R1b представляет низший алкокси, замещенный алкокси, гетероциклилом, кар-7 007534 бокси, алкоксикарбонилом или карбамоилом. В другом предпочтительном своем аспекте, настоящее изобретение относится к стентовому устойству, содержащему соединение формулы I, где один из R1a и R1b представляет метокси, а другой из R1a иR1b представляет [1,4']бипиперадин-1'-илкарбонилокси, 2-(этокси)этокси, 2-(4-морфолинил)этокси, 2-(4 метилпиперазин-1-ил)этокси, карбоксиметокси, метоксикарбонилметокси, аминокарбонилметокси, Nметиламинокарбонилметокси или N,N-диметиламинокарбонилметокси. Предпочтительные соединения, используемые в стентовом устройстве настоящего изобретения,выбраны из следующих типов соединений, таких как 3-циклогексилокси-6,7-диметоксихинолин; 2-циклогексиламино-6,7-диметоксихиноксалин; экзобицикло[2,2,1]гепт-2-ил-(6-хлор-7-метоксихиноксалин-2-ил)амин; экзобицикло[2,2,1]гепт-2-ил-(7-хлор-6-метоксихиноксалин-2-ил)амин; бицикло[2,2,1]гепт-2-ил-(6,7-диметилхиноксалин-2-ил)амин; 2-циклогептиламино-6,7-диметоксихиноксалин; 2-циклопентиламино-6,7-диметоксихиноксалин; 2-циклогексиламино-6-метоксихиноксалин; 3-aминоциклогексил-6,7-диметоксихинолин;(1S,2S,4R)-(-)-бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин; 2-(6,7-диметоксихиноксалин-2-ил)-2-азабицикло[2,2,2]октан-3-он; цис/транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир цис/транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновая кислота; цис-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир; транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир;(6,7-диметоксихиноксалин-2-ил)-цис-(3-(R)-метилциклогексил)амин; и метил-цис/транс-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанкарбоксилат, или их N-оксид, гидрат, сольват, пролекарство или фармацевтически приемлемая соль. Более предпочтительными являются следующие соединения: 2-циклогексиламино-6,7-диметоксихиноксалин;(6,7-диметоксихиноксалин-2-ил)-цис-(3-(R)-метилциклогексил)амин; и метил-цис/транс-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанкарбоксилат, или их N-оксид, гидрат, сольват, пролекарство или фармацевтически приемлемая соль. Следует отметить, что в объем настоящего изобретения входят все соответствующие комбинации конкретных и предпочтительных групп, указанных в данной заявке. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из поликапролактона, сополимера поли(этиленвинилацетат), поли(винилацетата) и силиконовой ненаполненной резиновой смеси, латексов, уретанов, полисилоксанов и блоксополимеров стиролаэтилена/бутилена-стирола, поли-DL-молочной кислоты, поли-L-молочной кислоты, сложных полиортоэфиров, полииминокарбонатов, алифатических поликарбонатов и полифосфазенов. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором полимерное покрытие дополнительно включает порообразователь, предпочтительно выбранный из группы, состоящей из микрогранул хлорида натрия, лактозы или натрийсодержащего гепарина, полиэтиленгликоля и сополимеров полиэтиленоксида/полипропиленоксида. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором на полимерное покрытие нанесена мембрана, контролирующая скорость высвобождения, для ограничения скорости высвобождения соединения формулы I из полимерного покрытия, предпочтительно включающая порообразователь, выбранный из группы, состоящей из хлорида натрия, лактозы, натрийсодержащего гепарина, полиэтиленгликоля, сополимеров полиэтиленоксида/полипропиленоксида и их смесей. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором соединение формулы I включено в полимерное покрытие нанесением соединения формулы I по крайней мере на одну поверхность стентового устройства с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх-9 007534 биологически активного слоя, где пористый полимерный материал включает полиамид, парилен или производное парилена. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором пористый полимерный материал наносят осаждением плазмы. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором пористый полимерный материал выбирают из группы, состоящей из поли(этиленоксида), поли(этиленглиоля), поли(пропиленоксида), и полимеров метана, силикона и тетрафторэтилентетраметилдисилоксана. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором полимерное покрытие получают добавлением фотополимеризуемого полиэтиленненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две или более акрилатных и метакрилтных групп на молекулу или их смесей. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором мономер выбирают из группы, состоящей из диакрилата этиленгликоля, диметакрилата этиленгликоля, триакрилата триметилпропана, триметакрилата триметилпропана, тетраакрилата пентаэритрита, тетраметакрилата пентаэритрита, диметакрилата 1,6-гександиола и диметакрилата диэтиленгликоля, н-бутилакрилата, н-бутилметакрилата, 2-этилгексилакрилата, лаурилакрилата и 2-гидроксипропилакрилата. Другим предпочтительным вариантом настоящего изобретения является стентовое устройство, в котором полимерное покрытие включает полимер, выбранный из группы, состоящей из поли(Lмолочной кислоты), поликапролактона, сополимера поли(лактидгликолид), поли(гидроксибутирата),сополимера поли(гидроксибутиратвалерат), полидиоксанона, полиортоэфира, полиангидрида, поли(гликолевой кислоты), поли(D,L-молочной кислоты), сополимера поли(гликолевая кислотатриметиленкарбонат), полифосфоэфира, полифосфоэфируретана, поли(аминокислот), цианоакрилатов,поли(триметиленкарбоната), поли(иминокарбоната), поли(простой эфир-сложные эфиры), полиалкиленоксалатов, полифосфазенов, фибрина, фибриногена, целлюлозы, крахмала, коллагена и гиалуроновой кислоты, полиуретанов, силиконов, полиэфиров, полиолефинов, полиизобутилена и споплимера этиленальфаолефин, полимеров и сополимеров акриловой кислоты, полимеров и сополимеров винилгалогенида, таких как поливинилхлорид, поливиниловых простых эфиров, таких как поливиниловый этиловый эфир, поливинилиденгалогенидов, таких как поливинилиденфторид и поливинилиденхлорид, полиакрилонитрила, поливинилкетонов, поливиниловых ароматических соединений, таких как полистирол, поливиниловых сложных эфиров, таких как поливинилацетат, сополимеров виниловых мономеров друг с другом и олефинами, таких как сополимеры этилена-метилметакрилата, сополимеры акрилонитриластирола, смолы ABS и сополимеры этилена-винилацетата, полиамидов, таких как Nylon 66 и поликапролактам, алкиловых смол, поликарбонатов, полиоксиметиленов, полиимидов, полиэфиров, эпоксидных смол, полиуретанов, искусственного волокна, триацетатного искусственного волокна, целлюлозы, ацетата целлюлозы, бутирата целлюлозы, ацетатбутирата целлюлозы, целллофана, нитрата целлюлозы, пропионата целлюлозы, простых эфиров целлюлозы и карбоксиметилцеллюлозы. Другим предпочтительным вариантом настоящего изобретения является применение стентового устройства для лечения рестеноза у пациента в заранее определнном месте, предпочтительно месте механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой. Другим предпочтительным вариантом настоящего изобретения является применение применение соединения формулы I для производства стентового устройства для ингибирования рестеноза, где соединение формулы I включено в полимерное покрытие, нанесенное на указанный стент и где рестеноз имеется в месте механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой. Соединения настоящего изобретения могут быть образованы из известных соединений или из легко получаемых промежуточных соединений стандартными методами, описанными в литературе. Примеры общих методов приводятся ниже. Кроме того, соединения формулы I получают в соответствии с нижеследующими схемами I-VIII,где указанные радикалы определены выше, за исключением тех радикалов, которые, по определению специалистов, не соответствуют описанному методу. В схемах VI, VII и VIII, R представляет группу-предшенственник для R1a, R1b и R1c, определенных выше, такую, что реакция RBr, ROH или RCOCl с гидроксигруппой ароматического соединения в условиях, описанных в схемах VI, VII и VIII, приводит к образованию R1a, R1b и R1c. Характерным RBr является бромуксусная кислота и метил- и этилбромацетат. Характерным ROH является 2-этоксиэтанол, 2-(4-морфолинил)этанол и 3-(4-метилпиперазинил)пропанол. Характерным RCOCl является [1,4']бипиперидин-1'-илкарбонилхлорид. Общие методы Реакция сочетания 2-хлорзамещенного хиноксалина с аминами или анилинами. Смесь 2-хлор-6,7-диметоксихиноксалина (1 экв.) и амина (от около 1 до около 5 экв.) нагревают при температуре от около 160 до около 180 С в течение периода времени от 3 ч и более или в течение ночи. Темно-коричневый остаток растворяют в смеси метанол/метиленхлорид (0-10%) и хроматографируют на силикагеле, элюируя смесью гексан/этилацетат или метанол/метиленхлорид (0-100%) с получением нужного продукта. Этот нужный продукт может быть затем очищен путем перекристаллизации в метаноле,метиленхлориде или в смеси метанол/вода. Реакция сочетания 2-хлорзамещенного хиноксалина со спиртами или фенолами. Суспензию спирта или меркаптана (1 экв.) и гидрида натрия (от около 1 до около 3 экв.) в безводном ДМФ/ТТФ (0-50%) кипятят с обратным холодильником в течение 1 ч, а затем добавляют 2-хлор-6,7 диметоксихиноксалин (1 экв.). Полученную смесь кипятят с обратным холодильником от около 1 до около 4 ч. Суспензию нейтрализуют до рН примерно 5-8 и распределяют между метиленхлоридом и насыщенным раствором соли. После концентрирования метиленхлорида остаток хроматографируют на силикагеле, элюируя смесью гексан/этилацетат или смесью метанол/метиленхлорид (0-100%) с получе- 13007534 нием нужного продукта. Реакция восстановительного аминирования с аминохинолинами и с альдегидами или кетонами. Соответствующим образом замещенный 3-аминохинолин (1 экв.) перемешивают с 1 экв. соответствующего альдегида или кетона в метаноле (или с другой подходящей смесью растворителя) до тех пор,пока ТСХ не будет указывать на образование имина. Затем добавляют избыток NaCNBH4 или NaBH4 или другой подходящий восстановитель и смесь перемешивают до тех пор, пока ТСХ не будет указывать на израсходование промежуточного имина. Полученную смесь концентрируют и остаток хроматографируют на силикагеле, элюируя смесью гексан/этилацетат (0-100%) или хлороформ/метанол (0-20%), с получением нужного продукта. Реакция сочетания 3-аминозамещенных хинолинов и бромфениловых соединений. Соответствующим образом замещенный 3-аминохинолин (1 экв.) перемешивают прибл. с 1,4 экв. сильного основания, такого как трет-бутоксид натрия, с 1 экв. соответствующего бромфенилового соединения и подмешивают каталитическое количество 2,2'-бис(дифенилфосфино)-1,1'-бинафтил(SBINAP) и бис(дибензилиденацетон)палладия (Pd(dba)2) в инертном органическом растворителе, таком как толуол, в инертной атмосфере, такой как атмосфера аргона, и нагревают в течение ночи до около 80 С. Смесь охлаждают, разбавляют растворителем, таким как эфир, фильтруют, концентрируют и хроматографируют, элюируя смесью 50% EtOAc/гексан, с получением нужного продукта. Образование эфира из 3-гидроксизамещенных хинолинов в условиях Митцунобу. ТГФ-раствор соответствующим образом замещенного гидроксихиноксалина (от около 0 до около 25 С) обрабатывают 1 экв. (каждого) нужного спирта, трифенилфосфина и наконец, диэтилазодикарбоксилата (DEAD) или подходящего эквивалента. За ходом реакции следят по ТСХ и после завершения реакции (от около 1 до около 24 ч), смесь концентрируют и остаток хроматографируют на силикагеле с получением нужного продукта. Деалкилирование хинолина или хиноксалина, замещенного низшим алкокси, и последующее алкилирование. Соответствующим образом замещенный низшим алкоксихинолин или хиноксалин (1 экв.) в ДМФ обрабатывают избытком этантиолата натрия (обычно около 2 или более экв.) и реакционную смесь перемешивают при нагревании от около 1 до около 24 ч. Смесь распределяют между водой и этилацетатом. После экстракции, а затем хроматографии, если это необходимо, получают соответствующий нужный гидрокси-замещенный хинолиновый или хиноксалиновый продукт. Полученный гидроксизамещенный хинолиновый или хиноксалиновый продукт может быть алкилирован в условиях реакции Митцунобу, подробно описанных выше. Альтернативно, простое алкилирование хорошо известными методами с реакционным алкил- или бензилгалогенидом с использованиемNaH или другого соответствующего основания в подходящем растворителе дает нужный алкилированный продукт. Окисление азота в хинолине или в хиноксалине с образованием соответствующего N-оксида. Хинолиновое или в хиноксалиновое соединение формулы (I), имеющее иминовую (=N-)группу,может быть превращено в соответствующее соединение, где указанная иминовая группа окислена в Nоксид, предпочтительно путем реакции с перкислотой, например перуксусной кислотой в уксусной кислоте или м-хлорпероксибензойной кислоте в инертном растворителе, таком как дихлорметан, при температуре приблизительно от комнатной температуры до температуры перегонки растворителя, а предпочтительно при повышенной температуре. Соединения настоящего изобретения могут быть использованы в форме свободного основания или кислоты или в форме их фармацевтически приемлемой соли. Все эти формы входят в объем настоящего изобретения. Если соединение настоящего изобретения замещено основной группой, то образуются кислотноаддитивные соли, которые являются просто более удобной формой для использования; а на практике,использование указанной солевой формы, по существу, эквивалентно использованию формы свободного основания. Кислотами, которые могут быть использованы для получения кислотно-аддитивных солей,являются предпочтительно кислоты, которые, при их объединении со свободным основанием, образуют фармацевтически приемлемые соли, т.е., соли, анионы которых являются нетоксичными для пациента в фармацевтических дозах этих солей, такими, что благоприятное ингибирующее действие на PDGF, присущее свободному основанию, не ослабляется побочными эффектами, приписываемыми этим анионам. Хотя фармацевтически приемлемые соли указанных основных соединений являются предпочтительными, все кислотно-аддитивные соли могут быть использованы в качестве источников свободного основания, даже если конкретная соль, per se, необходима только как промежуточный продукт, например, если эту соль получают лишь в целях очистки и идентификации, или если она используется как промежуточное соединение при получении фармацевтически приемлемой соли путем ионообменных реакций. Фармацевтически приемлемые соли, входящие в объем настоящего изобретения, получают из следующих кислот, таких как минеральные кислоты, такие как хлористо-водородная кислота, серная кислота, фосфорная кислота или сульфаминовая кислота; и органические кислоты, такие как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновaя кислота, метансульфоновая кислота,- 14007534 этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и т.п. Соответствующими кислотно-аддитивными солями являются следующие соли: гидрогалогениды, например, гидрохлорид и гидробромид, сульфат, фосфат, нитрат,сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат,малеат, метилен-бисгидроксинафтоаты, гентизаты, мезилаты, изетионаты и ди-п-толуоилтартраты,метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат,соответственно. В соответствии с другим отличительным признаком настоящего изобретения кислотно-аддитивные соли данных соединений настоящего изобретения получают путем реакции свободного основания с соответствующей кислотой с применением или адаптацией известных методов. Так, например, кислотноаддитивные соли настоящего изобретения получают либо путем растворения свободного основания в водном или водно-спиртовом растворе или в других подходящих растворителях, содержащих соответствующую кислоту, и выделения соли путем выпаривания раствора, либо путем реакции свободного основания и кислоты в органическом растворителе, причем, в данном случае, соль выделяют непосредственно, либо она может быть получена путем концентрирования раствора. Соединения настоящего изобретения могут быть получены из кислотно-аддитивных солей путем применения или адаптации известных методов. Так, например, исходное соединения настоящего изобретения могут быть получены из их кислотно-аддитивных солей обработкой щелочью, например водным раствором бикарбоната натрия или водным раствором аммиака. Если соединение настоящего изобретения замещено кислотной группой, то могут быть образованы основно-аддитивные соли, которые являются просто более удобными для использования; а на практике,использование этой солевой формы, по существу, эквивалентно использованию формы свободной кислоты. Основаниями, которые могут быть использованы для получения основно-аддитивных солей, являются, предпочтительно, основания, которые при их объединении со свободной кислотой образуют фармацевтически приемлемые соли, т.е. соли, катионы которых являются не токсичными для пациента в фармацевтических дозах этих солей, такими, что благоприятное ингибирующее действие на PDGF, присущее свободной кислоте, не ослабляется побочными эффектами, присущими этим катионам. Фармацевтически приемлемыми солями, например солями щелочных и щелочно-земельных металлов, входящими в объем настоящего изобретения, являются соли, полученные из следующих оснований: гидрида натрия,гидроксида натрия, гидроксида калия, гидроксида кальция, гидроксида алюминия, гидроксида лития,гидроксида магния, гидроксида цинка, аммиака, триметиламмиака, триэтиламмиака, этилендиамина, нметилглюкамина, лизина, аргинина, орнитина, холина, N,N'-дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина, н-бензилфенетиламина, диэтиламина, пиперазина, трис-(гидроксиметил)аминометана, гидроксида тетраметиламмония и т.п. Металлические соли соединений настоящего изобретения могут быть получены путем контактирования гидрида, гидроксида, карбоната или аналогичного реакционноспособного соединения выбранного металла в водном или органическом растворителе с данным соединением в форме свободной кислоты. Используемым растворителем может быть вода или смесь воды с органическим растворителем, а предпочтительно, спиртом, таким как метанол или этанол, кетоном, таким как ацетон, алифатическим эфиром, таким как тетрагидрофуран или сложным эфиром, таким как этилацетат. Такие реакции обычно проводят при комнатной температуре, но, при необходимости, они могут быть проведены при нагревании. Аминовые соли соединений настоящего изобретения могут быть получены путем контактирования амина в водном или органическом растворителе с данным соединением в форме свободной кислоты. Подходящими водными растворителями являются вода и смеси воды со спиртами, такими как метанол или этанол, с эфирами, такими как тетрагидрофуран, нитрилами, такими как ацетонитрил или кетонами,такими как ацетон. Аналогичным образом могут быть получены соли аминокислот. Соединения настоящего изобретения могут быть получены из основно-аддитивных солей с применением или адаптацией известных методов. Так, например, исходные соединения настоящего изобретения могут быть получены из их основно-аддитивных солей путем обработки кислотой, например хлористо-водородной кислотой. При их применении в качестве активных соединений соли соединений настоящего изобретения могут быть использованы для очистки соединений, например, благодаря различиям в растворимости между указанными солями и исходными соединениями, побочных продуктов и/или исходных продуктов методами, хорошо известными специалистам. Соединения настоящего изобретения могут содержать асимметрические центры. Эти асимметрические центры могут независимо находится либо в R-, либо в S-конфигурации. Следует также отметить,что некоторые соединения формулы I могут обладать геометрической изомерией. Геометрические изомеры включают цис- и транс-формы соединений настоящего изобретения, т.е. соединений, имеющих алкенильные группы или заместители на кольцевых системах. Кроме того, кольцевые бициклосистемы включают эндо- и экзоизомеры. Настоящее изобретение относится к отдельным геометрическим изомерам, стереоизомерам, энантиомерам и к их смесям.- 15007534 Указанные изомеры могут быть выделены из их смесей с применением или адаптацией известных методов, например хроматографических методов и методов перекристаллизации, либо они могут быть отдельно получены из соответствующих изомеров их промежуточных соединений, например с применением или адаптацией описанных здесь методов. Исходные и промежуточные соединения получают с применением или адаптацией известных методов, например методов, описанных в cравнительных примерах или из их очевидных химических эквивалентов, или с применением описанных методов настоящего изобретения. Настоящее изобретение, кроме того, проиллюстрировано, но не ограничено, нижеследующими примерами, в которых описано получение соединений настоящего изобретения. Кроме того, в нижеследующих примерах представлены способы, используемые для синтеза соединений настоящего изобретения. Пример 1. 3-Циклогексилокси-6,7-диметоксихинолин. К раствору ТГФ (30 мл) при 0 С добавляют 3-гидрокси-6,7-диметоксихинолин (0,237 г, 1,15 ммоль),циклогексанол (0,347 г, 3,46 ммоль), Рh3 Р (0,908 г, 3,46. ммоль). Затем порциями добавляют диэтилазодикарбоксилат до тех пор, пока раствор не приобретает темно-красную окраску (0,663 г, 3,81 ммоль). Через 4 ч раствор концентрируют и остаток хроматографируют (50% EtOAc в гексане). Продукт перекристаллизовывают из смеси изопропанол/гексан в виде HCl-соли с получением белого твердого вещества (т.пл. 229-232 С, разл.). Пример 2. 2-Aнилино-6-изопропоксихиноксалина гидрохлорид. К NaH (0,033 г, 0,84 ммоль) в атмосфере аргона добавляют 1 мл ДМФ. Затем порциями добавляют 2-анилино-6-хиноксалинол (0,1 г, 0,42 ммоль) в 1,5 мл ДМФ. Через 30 мин по каплям добавляют 2 бромпропан и раствор нагревают до 50 С в течение 1,5 ч. Охлажденную реакционную смесь гасят водой и распределяют между EtOAc и Н 2O, промывают Н 2O (3 Х), насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученный остаток хроматографируют (30% EtOAc/гексаны) с получением 0,05 г диалкилированного продукта и 0,1 г указанного в заголовке соединения. Аналитический образец HClсоли получают путем добавления смеси IPA (изопропанол)/НСl к Et2O/IPA-pacтвopy свободного основания с получением HCl-соли (т.пл. 205-210 С, разл.). Анализ для С 17 Н 17N3 ОНСl: вычислено С, 64,65; Н,5,74; N, 13,31; найдено: С, 64,51; Н, 5,90; N, 13,09. Пример 3. 2-Циклогексиламино-6,7-диметоксихиноксалин. К 0,3 г (1,34 ммоль) 2-хлор-6,7-диметоксихиноксалина добавляют прибл. 1 мл циклогексиламина. Полученную смесь нагревают в течение ночи при 105 С, а затем в течение 10 ч при 135 С. Смесь распределяют между CH2Cl2 и насыщенным NаНСО 3. Органический слой сушат (MgSO4) и концентрируют. Полученный сироп хроматографируют (1:1, EtOAc:CH2Cl2) с получением 0,265 г продукта в виде светлокоричневого твердого вещества с выходом 69% (т.пл. 188-189,5 С). Анализ для C16H21N3O2: вычислено С, 66,88; Н, 7,37; N, 14,62; найдено: С, 66,82; Н, 7,28; N, 14,45. С использованием стандартной вышеописанной схемы сочетания и с использованием соответствующих исходных соединений были получены следующие соединения. Экзобицикло[2,2,1]гепт-2-ил-(6-хлор-7-метоксихиноксалин-2-ил)амин (т.пл. 171-173 С). Анализ дляC16H18N3OCl: вычислено С, 63,26; H, 5,97; N, 13,83; найдено: С, 63,37; Н, 5,91; N, 13,83. Экзобицикло[2,2,1]гепт-2-ил-(7-хлор-6-метоксихиноксалин-2-ил)амин (т.пл. 146-147,5 С). Анализ для C16H18N3OCl: вычислено С, 63,26; Н, 5,97; N, 13,83; найдено: С, 63,34; Н, 5,93; N, 13,77. Бицикло[2,2,1]гепт-2-ил-(6,7-диметилхиноксалин-2-ил)амин (т.пл. 155-157 С). Анализ для C17H21N3: вычислено С, 76,37; Н, 7,92; N, 15,72; найдено: С, 75,58; Н, 7,55; N, 15,38. 2-Циклогептиламино-6,7-диметоксихиноксалин (т.пл. 134-136 С). Анализ для C17H23N3O2: вычислено С, 67,75; Н, 7,69; N, 13,94; найдено: С, 67,80; Н, 7,61; N, 13,77. 2-Циклопентиламино-6,7-диметоксихиноксалин (т.пл. 149-151 С). Анализ для C15H19N3O2: вычислено С, 65,91; Н, 7,01; N, 15,37; найдено: С, 66,04; Н, 6,96; N, 15,47. 2-Циклогексиламино-6-метоксихиноксалин (т.пл. 242-248 С). Пример 4. 3-Аминоциклогексил-6,7-диметоксихинолин. К раствору МеОН (3 мл) и порошкообразных молекулярных сит 4(0,11 г) в атмосфере аргона добавляют 3-амино-6,7-диметоксихинолина гидрохлорид (0,17 г, 0,68 ммоль) и NaOMe (0,039 г, 0,71 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и порциями добавляют циклогексанон (0,074 мл, 0,71 ммоль), а затем комплекс пиридинборан (0,072 мл, 0,071 ммоль). Смесь перемешивают в течение 4,5 ч, а затем порциями добавляют 5 н НСl (1,4 мл, 6,8 ммоль). Реакционную смесь перемешивают в течение 45 мин, а затем подщелачивают сильным основанием 5 н NaOH. Смесь распределяют между EtOAc и Н 2O и водный слой промывают EtOAc (2X). Объединенные органические слои промывают насыщенным раствором соли (1X), сушат (MgSO4), хроматографируют (50%- 16007534 Пример 5. 2-Циклогексиламино-6-метокси-7-бромхиноксалина гидрохлорид. К 0,75 г (2,7 ммоль) смеси 7-бром-6-метоксихиноксалин-2-ол:6-бром-7-метоксихиноксалин-2-ол,7:1, в герметично закрытой пробирке добавляют 5 мл циклогексиламина. Реакционную смесь нагревают до 120 С в течение 2 ч. Циклогексиламин удаляют при пониженном давлении и остаток распределяют между EtOAc/H2O. Органический слой промывают Н 2 О (2 Х), насыщенным раствором соли (1X) и сушат(MgSO4). Полученный продукт хроматографируют (20%, а затем 30% EtOAc/гексан) с получением 0,81 г главного продукта с выходом 88%. Аналитический образец получают путем превращения приблизительно 0,13 г свободного основания в его гидрохлоридную соль (т.пл. 280 С, разл.). Анализ дляC15H18N3OBrHCl: вычислено С, 48,34; Н, 5,14; N, 11,27; найдено: С, 48,51; Н, 4,98; N, 11,09. Пример 6. (6,7-Диметоксихинолин-3-ил)-цис-(3-(R)-метилциклогексил)амина дигидрохлорид и (6,7 диметоксихинолин-3-ил)-транс-(3-(R)-метилциклогексил)амина дигидрохлорид. Цис/транс-смесь (6,7-диметоксихинолин-3-ил)-(3-(R)-метилциклогексил)амина, полученную путем восстановительного аминирования 3-амино-6,7-диметоксихинолина и 3-(R)-метилциклогексанона, разделяют ОФ-ВЭЖХ. Оба образца снова хроматографируют (70% EtOAc/гексан) с получением чистого свободного основания. Аналитический образец каждого изомера получают путем отдельного превращения свободных оснований в аморфные и до некоторой степени гигроскопичные дигидрохлоридные соли. 500 МГц 1 Н-ЯМР соответствовал данному продукту и ЖХ/МС и FAB подтвердил М+Н=301 для каждого изомера. Пример 7. Циклогекс-3-енил-(6,7-диметоксихиноксалин-2-ил)амин. К раствору транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола (303 мг, 1 ммоль) в 10 мл ТГФ при -78 С добавляют трифенилфосфин (524 мг, 2 ммоль) и диэтилазодикарбоксилат (1 мл). Смесь перемешивают при -78 С в течение 1 ч, а затем добавляют 4-нитробензойную кислоту (334 мг, 2 ммоль). После перемешивания при -78 С в течение 1 ч смесь оставляют для перемешивания при комнатной температуре еще на 1 ч, а затем концентрируют. Остаток хроматографируют на силикагеле (эфир) с получением 250 мг (87,7%) циклогекс-3-енил-(6,7-диметоксихиноксалин-2-ил)амина. Пример 8. 2-Анилино-6-хиноксалинол. Методом, описанным Feutrill, G.I.; Mirrington R.N. Tet.Lett. 1970, 1327, арилметиловый эфир превращают в феноловое производное. К 2-анилино-6-метоксихиноксалину (0,27 г, 1,07 ммоль) в атмосфере аргона в ДМФ добавляют натриевую соль этантиола (0,19 г, 2 ммоль). Реакционную смесь нагревают до 110 С в течение ночи. Смесь концентрируют и распределяют между EtOAc и Н 2O/5% винной кислотой,так, чтобы рН водного слоя составлял приблизительно 4. Органический слой промывают Н 2O (4 Х), а затем 2,5% NaOH (4X). Основные слои объединяют, промывают EtOAc (2X), снова подкисляют 5% винной кислотой и промывают множеством порций EtOAc. Органические слои объединяют, промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Полученное твердое вещество хроматографируют (50% EtOAc/гексан). Аналитический образец получают путем растирания продукта с Et2O с получением желтого порошка (т.пл. 211-213 С). Анализ для С 14 Н 11N3 О: вычислено С, 70,88; Н, 4,67; N,17,71; найдено: С, 70,64; Н, 4,85; N, 17,58. Пример 9. Фенил-[6-(тетрагидрофуран-3-(R)-ил-окси)хиноксалин-2-ил]амин. К раствору ТГФ при 0 С в атмосфере аргона добавляют 2-анилино-6-хиноксалинол (0,23 г, 0,97 ммоль),(S)-(+)-3-гидрокситетрагидрофуран (0,086 мл, 1,3 ммоль) и трифенилфосфин (0,31 г, 1,2 ммоль). Затем порциями добавляют DEAD (0,18 мл, 1,2 ммоль). Реакционную смесь оставляют для нагревания до комнатной температуры и перемешивают в течение 1,5 ч. Смесь концентрируют и распределяют междуEtOAc и Н 2O. Органический слой промывают Н 2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученное желтое масло хроматографируют (50% EtOAc/гексан) и растворяют в Et2O/IPA. Затем по каплям добавляют раствор HCl/Et2O и полученный красно-оранжевый порошок сушат в вакууме. Этот порошок получают в виде свободного основания путем перемешивания в МеОН с промытой(т.пл. 173-175 С). Анализ для C18H17N3O2: вычислено С, 70,35; Н, 5,57; N, 13,67; найдено: С, 70,19; Н,5,60; N, 13,66. Пример 10. 2,7-бис-Циклогексилокси-6-метоксихиноксалин. К раствору ДМФ (5 мл) и NaH (0,32 г, 8 ммоль) в атмосфере аргона по каплям добавляют циклогексанол (0,7 мл, 6,7 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 25 мин,а затем порциями добавляют 2-хлор-6,7-диметоксихиноксалин. Реакционную смесь перемешивают в течение 15 мин при комнатной температуре, при 90 С в течение 2 ч и при 110 С в течение 1 ч. Смесь охлаждают, гасят Н 2O и распределяют между EtOAc и Н 2O. Органический слой промывают Н 2O и насыщенным раствором соли, сушат (MgSO4) и хроматографируют (10% EtOAc/гексан) с получением воскообразного белого твердого вещества (т.пл. 75-78 С). Анализ для C21H28N2O3: вычислено С, 70,76; Н, 7,92;N, 7,86; найдено: С, 70,81; Н, 7,79; N, 7,70. Пример 11. Циклогексил-(6,7-диметоксихиноксалин-2-илметил)амин. К 0,067 М раствору карбоксальдегида 6,7-диметокси-2-хиноксалина в смеси МеОН/1,2-дихлорэтана,2:1 (7,5 мл, 0,5 ммоль) добавляют циклогексиламин (0,11 мл, 0,9 ммоль). Реакционную смесь перемеши- 17007534 вают при комнатной температуре в течение ночи, добавляют NaBH4 (0,038 г, 1 ммоль) и реакционную смесь перемешивают в течение ночи. Затем смесь концентрируют и хроматографируют (смесь 50%EtOAc/гексан - приблизительно 5% МеОН в смеси 50% EtOAc/гексан). Полученное масло растворяют в смеси EtOAc/гексан и обрабатывают НСl в EtOH. Полученный раствор концентрируют и твердые вещества растирают с изопропанолом и после сушки в вакууме при 60 С получают белое твердое вещество(т.пл. 185-190 С, разл.). Анализ для С 17 Н 23N3O2 НСl: вычислено С, 60,44; Н, 7,16; N, 12,44; найдено: С,60,48; Н, 6,88; N, 12,07. Пример 12. (6,7-Диметоксихинолин-3-ил)-транс-(3-(R)-метилциклогексил)амин и (6,7-диметоксихинолин-3-ил)-цис-(3-(R)-метилциклогексил)амин. Реакцию проводят как описано выше в препаративном примере с использованием 3-амино-6,7 диметоксихинолина в виде свободного основания (0,32 г, 1,6 ммоль) и (R)-(+)-3-метилциклогексанона(0,23 мл, 1,9 ммоль). Полученную смесь продуктов хроматографируют (70% EtOAc/гексан) и перекристаллизовывают из EtOAc/гексана с получением белого твердого вещества (смесь цис- и транс-изомеров,1:1) (т.пл. 153-160 С). Анализ для C18H24N2O2: вычислено С, 71,97; Н, 8,05; N, 9,33; найдено: С, 72,12; Н,7,85; N, 9,29. Нижеследующее соединение получают с использованием стандартной схемы сочетания с применением соответствующего исходного продукта.(6,7-Диметоксихинолин-3-ил)-(3-метилциклопентил)амин (т.пл. 106-109 С). Анализ для С 17H22N2 О 2: вычислено С, 71,30; Н, 7,74; N, 9,78; найдено: С, 71,24; Н, 7,56; N, 9,61. Пример 13. 3-(6,7-Диметоксихинолин-3-ил-амино)-2,2-диметилпропан-1-ол. Реакцию осуществляют, как описано в препаративном примере 11. К раствору МеОН и порошкообразных молекулярных сит 4(0,35 г) в атмосфере аргона добавляют 3-амино-6,7-диметоксихинолин(0,32 г, 1,6 ммоль) и 2,2-диметил-3-гидроксипропиональдегид (0,19 г, 1,9 ммоль). Смесь продуктов хроматографируют (смесь 3% МеОН/СНСl3) с получением 0,10 г продукта, который распределяют междуCH2Cl2/10% NaOH. Органический слой промывают 10% NaOH, H2O и насыщенным раствором соли, а затем сушат (MgSO4) и перекристаллизовывают из смеси EtOAc/гексан с получением светло-оранжевого твердого вещества (т.пл. 170-173,5 С). Анализ для C16H22N2O3: вычислено С, 66,18; Н, 7,64; N, 9,65; найдено: С, 66,19; Н, 7,49; N, 9,33. Нижеследующее соединение получают с использованием стандартной схемы сочетания с применением соответствующего исходного продукта.(6,7-Диметоксихинолин-3-ил)изобутиламин (т.пл. 158-162 С). Анализ для C15H20N2O2: вычислено С,69,20; Н, 7,74; N, 10,76; найдено: С, 69,06; Н, 7,82; N, 11,01. Пример 14. Циклогексил-(6-метокси-7-морфолин-4-ил-хиноксалин-2-ил)амин. Получение указанного соединения проводят путем адаптации метода, описанного Buchwald et al.J.Am.Chem.Soc. 1996, 118, 7215. К толуоловому раствору 2-циклогексиламино-6-метокси-7 бромхиноксалина (0,1 г, 0,3 ммоль) в атмосфере аргона добавляют морфолин (0,1 г, 0,3 ммоль), третбутоксид натрия (0,04 г, 0,42 ммоль), S-(-)-BINAP (кат., 0,001 г) и бис(дибензилиденацетон)палладий(кат., 0,001 г). Реакционную смесь нагревают до 80 С в течение ночи. Смесь охлаждают, разбавляютEt2O, фильтруют, концентрируют и хроматографируют (50% EtOAc/гексан). Продукт перекристаллизовывают из смеси EtOAc/гексан и получают, в двух сборах, желтое твердое вещество (т.пл. 194-196 С). Анализ для C19H26N4O2: вычислено С, 66,64; Н, 7,65; N, 16,36; найдено: С, 66,60; Н, 7,60; N, 16,51. Пример 15. транс-4-(7-Хлор-6-метоксихиноксалин-2-амино)циклогексанол и транс-4-(6-хлор-7 метоксихиноксалин-2-ил-амино)циклогексанол. В реакционную колбу, снабженную ловушкой Дина-Старка и холодильником, в атмосфере аргона добавляют смесь (6:1) 2,7-дихлор-6-метоксихиноксалина:2,6-дихлор-7-метоксихиноксалина (0,30 г, 1,3 ммоль) и транс-4-аминоциклогексанол (0,35 г, 3 ммоль). Реакционную смесь нагревают до 170 С примерно в течение 10 ч, а затем концентрируют и дважды хроматографируют (7% МеОН/СНСl3, а затем 5% МеОН/СНСl3). Продукт перекристаллизовывают из смеси EtOAc/гексана и получают светло-желтое твердое вещество (т.пл. 144-147 С). Анализ для C19H26N4O20,4 H2O: вычислено С, 57,20; Н, 6,02; N, 13,34; найдено: С, 57,21; Н, 5,97; N, 13,08. 1 Н-ЯМР-анализ показал, что полученный продукт представляет собой смесь (2:1) транс-4-(7-хлор-6-метоксихиноксалин-2-амино)циклогексанола:транс-4-(6-хлор-7-метоксихиноксалин-2-ил-амино)циклогексанола. Пример 16. транс-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанол. транс-4-Аминоциклогексанол (0,11 г, 2 экв.) и 2-хлор-6,7-диметоксихиноксалин (0,1 г, 1 экв.) объединяют и нагревают до 160-180 С в течение 4-8 ч. Темно-коричневую суспензию фильтруют и концентрируют. Остаток очищают на флеш-колонке, элюируя смесью 3% метанол/метиленхлорид с получением продукта в виде желтого порошка с т.пл. 119-123 С. Анализ для C16H21N3O3: вычислено С, 62,33; Н, 7,05;N, 13,63; найдено: С, 62,35; Н, 7,09; N, 13,18. Полученное соединение может быть перекристаллизовано следующим способом. Исходя из 0,2 г желтого порошка в смеси 2,5 мл воды и 1,25 мл метанола получают после кипячения с обратным холодильником прозрачный оранжевый раствор. Горячий раствор оставляют и постепенно охлаждают.- 18007534 Оранжевые иглообразные кристаллы собирают путем фильтрации и сушат в условиях высокого вакуума с получением желтого твердого вещества (т.пл. 119-120 С). Альтернативно, HCl-соль соединения, указанного в заголовке, получают следующим образом: к раствору транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанола в изопропаноле добавляют раствор НСl при 0 С. Смесь перемешивают в течение 15 мин, а затем фильтруют. Собранное твердое вещество сушат в высоком вакууме с получением гидрохлоридной соли транс-4-(6,7-диметоксихиноксалин-2 иламино)циклогексанола. Анализ для C16H22ClN3O31,2 Н 2O: вычислено С, 53,19; Н, 6,80; N, 11,63, Сl 9,81; найдено: С, 53,14; Н, 6,85; N, 11,24, Сl 10,28. Альтернативно, сульфатную соль соединения, указанного в заголовке, получают следующим образом: в обычной процедуре, транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанол растворяют в ацетоне или в другом подходящем органическом растворителе с нагреванием до 45 С, если это необходимо. К полученному раствору осторожно добавляют водную H2SO4 (1 экв., 1 М раствор) быстро перемешивая при этом. Образовавшуюся таким образом соль собирают, сушат и получают сульфат с выходом 80%. Пример 17. -Бицикло[2,2,1]гепт-2-ил(6,7-диметоксихиноксалин-2-ил)амин. Процедура А. Смесь 2-хлор-6,7-диметоксихиноксалина (5 г, 22,3 ммоль) и -экзонорборнил-2-амина (10 г, 90 ммоль) нагревают в течение ночи при 160-180 С. Темно-коричневый остаток растворяют в 200 мл метиленхлорида и промывают 1 н NaOH (50 мл). Органический слой сушат над сульфатом магния, а затем фильтруют. После концентрирования остаток хроматографируют на силикагеле смесью гексан/этилацетат (80%) с получением нужного продукта в виде желтого твердого вещества, которое может быть перекристаллизовано в метаноле. Процедура В. Смесь 2-хлор-6,7-диметоксихиноксалина (9 г, 40,1 ммоль) и -экзонорборнил-2-амина (5,77 г, 52 ммоль),трет-бутоксид натрия (4,22 г, 44 ммоль), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP, 120 мг) и бис(дибензилиденацетон)палладий (Pd(dba)2, 40 мг) в 80 мл толуола нагревают при 80 С в течение 8 ч. Затем добавляют другую часть BINAP (60 мг) и Pd(dba)2 (20 мг) и смесь нагревают при 100 С в течение ночи. После разбавления 200 мл метиленхлорида реакционную смесь промывают 1 н NaOH (100 мл). Органический слой сушат над сульфатом магния и фильтруют. После концентрирования остаток хроматографируют на силикагеле, элюируя смесью гексан/этилацетат (80%) с получением нужного продукта в виде светло-желтого твердого вещества (т.пл. 188-189 С). Анализ для C17H21N3O3: вычислено С, 68,20; Н,7,07; N, 14,04; найдено: С, 68,18; Н, 7,03; N, 14,03. Нижеследующие соединения получали аналогичным образом из соответствующего исходного соединения (процедура А). Экзобицикло[2,2,1]гепт-5-ен-2-ил-(6,7-диметоксихиноксалин-2-ил)амин (т.пл. 175-177 С). Анализ для С 17 Н 19N3 О 20,4 Н 2O: вычислено С, 60,94; Н, 6,56; N, 13,78; найдено: С, 66,98; Н, 6,62; N, 12,73. Циклогексил-(6,8-диметилхиноксалин-2-ил)амин [МС m/z: 255 (М+)]. Анализ для C16H21N3: вычислено С, 75,26; Н, 8,29; N, 16,46; найдено: С, 75,08; Н, 8,28; N, 15,86. Эндобицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин (т.пл. 79-82 С).C16H19N3O: вычислено С, 71,35; Н, 7,11; N, 15,60; найдено: С, 70,38; Н, 7,03; N, 15,05. Пример 18. Экзо-2-(бицикло[2,2,1]гепт-2-илокси)-6,7-диметоксихиноксалин. Смесь экзо-2-норборнеола (223 мг, 2 ммоль) и NaH (60%, 100 мг, 2,5 ммоль) в 10 мл безводного ТГФ кипятят с обратным холодильником в течение 0,5 ч, а затем добавляют 2-хлор-6,7 диметоксихиноксалин (336 мг, 1,5 ммоль). Полученную смесь продолжают кипятить с обратным холодильником в течение 2 ч. После фильтрации и концентрирования остаток хроматографируют на силикагеле (смесь 50% эфир/гексан) с получением нужного продукта в виде белого твердого вещества (т.пл. 135-137 С). Анализ для C17H20N2O3: вычислено С, 67,98; Н, 6,71; N, 9,33; найдено: С, 67,96; Н, 6,762; N,9,19. Нижеследующие соединения получают по стандартной вышеописанной схеме сочетания с использованием соответствующих исходных продуктов. 2-(Бицикло[2,2,1]окт-2-илокси)-6,7-диметоксихиноксалин (т.пл. 147-148 С). Эндо-2-(бицикло[2,2,1]гепт-2-илокси)-6,7-диметоксихиноксалин (т.пл. 110-111 С). Экзо-2-(бицикло[2,2,1]гепт-5-ен-2-илокси)-6,7-диметоксихиноксалин (т.пл. 108-110 С). Анализ дляC17H18N2O3: вычислено С, 68,44; Н, 6,08; N, 9,39; найдено: С, 68,32; Н, 5,98; N, 9,25. 2-Циклогексилокси-6,7-диметоксихиноксалин (т.пл. 104-106C). 2-Циклопентилтио-6,7-диметоксихиноксалин (т.пл. 123-124 С). Анализ для C15H18N2O2S: вычисле- 19007534 но С, 62,04; Н, 6,25; N, 9,65; найдено: С, 61,90; Н, 6,02; N, 9,48. 6,7-Диметокси-2-циклопентилоксихиноксалин (т.пл. 87-89 С). Анализ для C15H18N2O3: вычислено С, 65,68; Н, 6,61; N, 10,21; найдено: С, 65,63; Н, 6,52; N, 10,13. 2-Циклопентилметилокси-6,7-диметоксихиноксалин (т.пл. 99-102 С). Анализ для C16H20N2O3: вычислено С, 66,65; Н, 6,99; N, 9,72; найдено: С, 66,66; Н, 7,03; N, 9,70. 6,7-Диметокси-2-тетрагидропиран-4-оксихиноксалин (т.пл. 155-158 С). Анализ для C15H18N2O4: вычислено С, 62,06; Н, 6,25; N, 9,65; найдено: С, 62,26; Н, 6,27; N, 9,67. Экзо,экзо-6,7-диметокси-2-(5,6-эпоксибицикло[2,2,1]гептан-2-илокси)хиноксалин (т.пл. 173-175 С). Пример 19. цис/транс-4-(6,7-Диметоксихиноксалин-2-илокси)циклогексанкарбоновая кислота. Смесь цис/транс-4-гидроксициклогексанкарбоновой кислоты (144 мг, 1 ммоль) и NaH (60%, 160 мг,4 ммоль) в безводном ТГФ/ДМФ (10 мл/2 мл) кипятят с обратным холодильником в течение 1 ч, а затем добавляют 2-хлор-6,7-диметоксихиноксалин (225 мг, 1 ммоль). Полученную смесь кипятят с обратным холодильником еще 4 ч. Реакционную смесь нейтрализуют до рН=5 и экстрагируют этилацетатом (2 х 50 мл). Объединенные органические растворы сушат над сульфатом магния и фильтруют. После концентрирования остаток хроматографируют на силикагеле (элюируя этилацетатом, а затем метанолом) с получением нужного продукта в виде белого твердого вещества (т.пл. 90-93 С). Анализ для C17H20N2O50,5 H2O: вычислено С, 59,89; Н, 6,19; N, 8,22; найдено: С, 59,91; Н, 6,62; N, 7,90. Пример 20. 6,7-Диметокси-2-(4-метоксициклогексилокси)хиноксалин. Смесь цис/транс-4-(6,7-диметоксихиноксалин-2-илокси)циклогексанола (170 мг, 0,56 ммоль) и NaH(60%, 22,4 мг, 0,56 ммоль) в безводном ТГФ/ДМФ (10 мл/2 мл) перемешивают при 0 С в течение 10 мин,а затем добавляют метилиодид (50 мкл, 0,56 ммоль). После перемешивания при комнатной температуре в течение 4 ч реакцию гасят водой (0,5 мл) и смесь концентрируют. Водный слой экстрагируют метиленхлоридом (2 х 20 мл) и объединенные органические растворы промывают насыщенным раствором соли(5 мл). После концентрирования остаток хроматографируют на силикагеле (смесь 30% этилацетат/гексан) с получением 80 мг (45%) нужного продукта (т.пл. 85-90 С). Пример 21. 3-Циклогексилокси-6,7-диметоксихиноксалина 1-оксид. Смесь 2-циклогексилокси-6,7-диметоксихиноксалина (110 мг, 0,38 ммоль) и метахлорбензойной перкислоты (70%, 113 мг, 0,46 ммоль) в 10 мл метиленхлорида перемешивают при комнатной температуре в течение 1 дня. После фильтрации раствор концентрируют и остаток хроматографируют на силикагеле (смесь 20% этилацетат/гексан) с получением нужного продукта (т.пл. 167-169 С). Аналогичным образом получают транс-4-(6,7-диметокси-4-оксихиноксалин-2-иламино)циклогексанол (т.пл. 220222 С). Анализ для С 16 Н 21N3O40,2 Н 2O: вычислено С, 59,42; Н, 6,69; N, 12,99; найдено: С, 59,43; Н, 6,64;-Бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин примера 17 разделяют на хиральной ВЭЖХ-колонке (Chiralpac AD, 25x2 см, 60% гептан/40% этанол с 10 мМ (1S)-(+)камфорсульфоновой кислотой, 12 мл/мин) и получают указанный в заголовке продукт в качестве первого элюата. Собранные фракции объединяют и промывают 50 мл 1 н NaOH, а затем сушат (MgSO4). После фильтрации, раствор концентрируют на роторном испарителе, а затем сушат в условиях высокого вакуума. В результате получают желтое твердое вещество. []d20+19,5 (c=0,20, СН 2 Сl2), т.пл. 184-186 С. Анализ для C17H21N3O20,3 Н 2O: вычислено С, 66,90; Н, 7,15; N, 13,77; найдено: С, 66,86; Н, 7,01; N, 13,86. Пример 23. (1S,2S,4R)-(-)-Бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин.(i) -Бицикло[2,2,1]гепт-2-ил-(6,7-диметоксихиноксалин-2-ил)амин примера 17 разделяют на хиральной ВЭЖХ-колонке (Chiralpac AD, 25x2 см, 60% гептан/40% этанол с 10 мМ (1S)-(+)камфорсульфоновой кислотой, 12 мл/мин) в качестве второго элюата. Собранные фракции объединяют и промывают 50 мл 1 н NaOH, а затем сушат сульфатом магния. После фильтрации раствор концентрируют на роторном испарителе, а затем сушат в условиях высокого вакуума. В результате получают желтое твердое вещество. []d20-19,5 (с=0,22, СН 2 Сl2), т.пл. 185-187 С.(300 мг, 2,7 ммоль), трет-бутоксида натрия (220 мг, 2,3 ммоль), BINAP (9 мг) и Pd(dba)2 (3 мг) в 10 мл толуола нагревают в течение ночи при 80-100 С. Полученную суспензию хроматографируют на силикагеле, элюируя смесью гексан/этилацетат (60%), с получением 370 мг (60%) нужного продукта в виде желтого твердого вещества, которое имеет то же самое время удерживания, что и первый элюат в вышеуказанном хиральном ВЭЖХ-условии. []d20-19 (c=0,19, СН 2 Сl2). Пример 24. 2-(6,7-Диметоксихиноксалин-2-ил)-2-азабицикло[2,2,2]октан-3-он. 2-Азабицикло[2,2,2]октан-3-он (228 мг, 2,3 ммоль) растворяют в смеси ТГФ/ДМФ (5 мл/3 мл) и обрабатывают NaH (60%, 184 мг, 4,6 ммоль). Полученную смесь нагревают при 60 С в течение 0,5 ч, а затем добавляют 2-хлор-6,7-диметоксихиноксалин (344 мг, 1,5 ммоль). После нагревания при 80 С в течение ночи реакционную смесь концентрируют. Остаток хроматографируют на силикагеле (элюируя смесью 50% этилацетат/гексан) с получением 164 мг (23%) желтого твердого вещества (т.пл. 158-159 С).- 20007534 Пример 25. цис/транс-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир. К раствору 2-(6,7-диметоксихиноксалин-2-ил)-2-азабицикло[2,2,2]октан-3-она (100 мг, 0,32 ммоль) в 10 мл метанола добавляют свежеприготовленный раствор NaOMe/метанола (54 мг, 1 ммоль) и смесь перемешивают при комнатной температуре в течение 0,5 ч, а затем концентрируют. После экстракции метиленхлоридом смесь сушат сульфатом магния. После фильтрации и концентрирования остаток хроматографируют на силикагеле (40% этилацетат) и получают 85 мг (77%) цис/транс-4-(6,7 диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метилового эфира в виде светложелтого твердого вещества (т.пл. 8-80 С). Пример 26. цис/транс-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанкарбоновая кислота. 2-(6,7-Диметоксихиноксалин-2-ил)-2-азабицикло[2,2,2]ок-тан-3-он превращают в цис/транс-4-(6,7 диметоксихиноксалин-2-иламино)циклогексанкарбоновую кислоту вышеуказанным методом, за исключением того, что вместо NaOMe используют NaOH. Пример 27. цис-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир и транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир. цис-4-(6,7-Диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир[МС m/z: 345 (М+)] и транс-4-(6,7-диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты метиловый эфир [МС m/z: 345 (М+)] разделяют препаративной ТСХ из эфира цис/транс-4-(6,7 диметоксихиноксалин-2-иламино)циклогексанкарбоновой кислоты, элюируя смесью 65% этилацетат/гексан, в качестве первого и второго элюатов, соответственно. Пример 28. транс-4-[7-Метокси-6-(2-морфолин-4-ил-этокси)хиноксалин-2-иламино]циклогексанол и транс-4-[6-метокси-7-(2-морфолин-4-ил-этокси)хиноксалин-2-иламино]циклогексанол. Указанное в заголовке соединение получают реакцией сочетания по Митцунобу смеси 6-гидрокси 7-метокси-2-хлорхиноксалина:7-(2-морфолин-4-илэтокси)-6-метокси-2-хлорхиноксалина и 2-(морфолин 4-ил)этанола методом, описанным в примере 1, и реакцией полученной смеси 6-(2-морфолин-4 илэтокси)-7-метокси-2-хлорхиноксалина:7-(2-морфолин-4-илэтокси)-6-метокси-2-хлорхиноксалина и транс-4-аминоциклогексанола методом, описанным в примере 11. Пример 29. 2-[2-(транс-4-Гидроксициклогексиламино)-7-метоксихиноксалин-6-илокси]-1-уксусная кислота и 2-[2-(транс-4-гидроксициклогексиламино)-6-метоксихиноксалин-7-илокси]-1-уксусная кислота. Указанное в заголовке соединение получают путем деалкилирования 4-(6,7-диметоксихиноксалин 2-иламино)циклогексанола с использованием натриевой соли этантиола в ДМФ, как описано в примере 8, с последующим алкилированием бромуксусной кислотой в присутствии основания, как описано в общей методике 6. Пример 30. 2-[2-(транс-4-Гидроксициклогексиламино)-7-метоксихиноксалин-6-илокси]-N,N-диметилацетамид и 2-[2-(транс-4-гидроксициклогексиламино)-6-метоксихиноксалин-7-илокси]-N,N-диметилацетамид. Указанное в заголовке соединение получают путем аминолиза соединения примера 29 с использованием диметиламина. Пример 31. (6,7-Диметоксихиноксалин-2-ил)-(3-(R)-метилциклогексил)амин и его цис- и транс-изомеры. Сначала указанные соединения получают в виде смеси цис- и транс-изомеров. Указанные изомеры получают из циклогексиламина путем восстановления оксима 3-(R)-метилциклогексанона с последующей реакцией сочетания амина с 2-хлор-6,7-диметоксихиноксалином в стандартных условиях. Аналитический образец каждого изомера получают путем проведения препаративной ОФ-ВЭЖХ. 300 МГц-1 НЯМР и МС соответствуют обеим структурам, хотя близкая стереохимия не может быть точно отнесена к циклогексил-углероду, несущему атом азота. Пример 32. Метил-цис/транс-4-(6,7-диметоксихиноксалин-2-ил-окси)циклогексанкарбоксилат. Указанное в заголовке соединение получают этерификацией продукта примера 19 стандартными методами. Т.пл. 130-132 С. Анализ для C18H22N2O5: вычислено С, 62,42; Н, 6,40; N, 8,09; найдено: С,62,60; Н, 6,55; N, 7,89. Пример 1 промежуточного соединения. 4-Бром-5-метоксибензол-1,2-диамина дигидрохлорид. К раствору EtOAc (50 мл) и 5-бром-4-метокси-2-нитрофениламина (2,5 г, 10 ммоль) в атмосфере аргона добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 50 фунт/кв.дюйм (3,515 кг/см 2) в течение 1 ч. Полученную смесь фильтруют через целит в раствор HCl/IPA/EtOAc и слой промывают дополнительным количеством EtOAc. Полученный осадок отфильтровывают и получают белое твердое вещество. Пример 2 промежуточного соединения. 7-Бром-6-метоксихиноксалин-2-ол и 6-бром-7-метоксихиноксалин-2-ол. К раствору МеОН (15 мл) в атмосфере аргона добавляют порошкообразные гранулы NaOH (0,86 г,21 ммоль) и дигидрохлорид 4-бром-5-метоксибензол-1,2-диамина (2,7 г, 9,3 ммоль). Смесь перемешивают в течение 10 мин, а затем порциями добавляют раствор 45% этилглиоксилата в толуоле (2,7 г, 12 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч, а затем охлаждают. После добавления воды, суспензию фильтруют. Полученное твердое вещество последовательно промывают Н 2O,МеОН, IPA и Et2O с получением желтого порошка.- 21007534 Пример 3 промежуточного соединения. 7-Бром-2-хлор-6-метоксихиноксалин и 6-бром-2-хлор-7 метоксихиноксалин. К смеси 7-бром-6-метоксихиноксалин-2-ола и 6-бром-7-метоксихиноксалин-2-ола (1 г, 3,9 ммоль) добавляют РОСl3 (5 мл). Реакционную смесь кипятят с обратным холодильником в течение 1 ч, выливают в ледяную воду, фильтруют и промывают водой с получением светло-коричневатого твердого вещества. Отношение 7-бром-2-хлор-6-метоксихиноксалина:6-бром-2-хлор-7-метоксихиноксалина составляет приблизительно 7:1, на что указывает 1 Н-ЯМР. Пример 4 промежуточного соединения. 5-Хлор-4-метокси-2-нитроанилин. К раствору N-(5-хлор-4-метокси-2-нитрофенил)ацетамида (2 г, 8,2 ммоль) в 5 н НСl (20 мл) добавляют 1,4-диоксан (10 мл) и смесь перемешивают при 60 С в течение 1,5 ч. Реакционную смесь концентрируют и распределяют между EtOAc/2H NaOH. Водные слои промывают EtOAc (3 Х), насыщенным раствором соли, сушат (MgSO4), адсорбируют на силикагеле и хроматографируют (смесь 70%EtOAc/гексан) с получением оранжевого порошка. Пример 5 промежуточного соединения. 4-Хлор-5-метоксибензол-1,2-диамина дигидрохлорид. К раствору EtOAc (25 мл) и 5-хлор-4-метокси-2-нитрофениламина (1,6 г, 7,9 ммоль) в атмосфере аргона добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 50 фунт/кв.дюйм (3,515 кг/см 2) в течение 1 ч. Полученную смесь фильтруют через целит в атмосфере N2 в раствор 1 н HCl/Et2O в EtOAc и слой промывают дополнительным количеством EtOAc. Полученный осадок отфильтровывают и получают белое твердое вещество. Пример 6 промежуточного соединения. 7-Хлор-6-метоксихиноксалин-2-ол и 6-хлор-7-метоксихиноксалин-2-ол. К раствору дигидрохлорида 4-хлор-5-метокси-бензол-1,2-диамина (1,8 г, 7,2 ммоль) в EtOH (15 мл) в атмосфере аргона добавляют TEA (2,5 мл, 18 ммоль) при 0 С. Смесь перемешивают в течение 20 мин, а затем порциями добавляют раствор 45% этилглиоксилата в толуоле (2,1 г, 9,3 ммоль). Реакционную смесь нагревают до комнатной температуры, кипятят с обратным холодильником в течение 1,5 ч, а затем охлаждают, добавляют воду и суспензию фильтруют и последовательно промывают Н 2 О, IPA и Et2O с получением светло-желтого порошка. Полученный продукт несколько раз подвергают азеотропной перегонке с толуолом и сушат в вакууме перед использованием. Пример 7 промежуточного соединения. 2,7-Дихлор-6-метоксихиноксалин и 2,6-дихлор-7-метоксихиноксалин. К смеси 7-хлор-6-метоксихиноксалин-2-ола и 6-хлор-7-метоксихиноксалин-2-ола (1 г, 4,7 ммоль) в осушенной СаСl2 пробирке добавляют РОСl3 (5 мл). Реакционную смесь кипятят с обратным холодильником в течение 30 мин, выливают в холодный насыщенный раствор NаНСО 3, фильтруют, а затем промывают водой с получением твердого вещества. Отношение 2,7-дихлор-6-метоксихиноксалина:2,6 дихлор-7-метоксихиноксалина составляет приблизительно 6:1, на что указывает 1 Н-ЯМР. Пример 8 промежуточного соединения. (1S,2S,4R)-Норборнил-2-амин.(3 а). К раствору R-(+)-эндонорборнеола (2,24 г, 20 ммоль) в 20 мл ТГФ при -78 С добавляют трифенилфосфин (6,55 г, 25 ммоль), фталимид (3,68 г, 25 ммоль) и диэтилазодикарбоксилат (4,4 мл, 28 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, а затем концентрируют. Остаток хроматографируют на силикагеле (смесь 20% этилацетат/гексан) с получением 4,6 г (95%) (1S,2S,4R)-2 бицикло[2,2,1]гепт-2-ил-изоиндол-1, 3-диона.(3b). Смесь (1S,2S,4R)-2-бицикло[2,2,1]гепт-2-ил-изоиндол-1,3-диона (1,2 г, 5 ммоль) и моногидратированного H2NNH2 (300 мг, 6 ммоль) в 10 мл метанола кипятят с обратным холодильником в течение 4 ч,а затем концентрируют досуха. После экстракции метиленхлоридом (2 х 100 мл) твердое вещество удаляют путем фильтрации. После выпаривания метиленхлорида получают 300 мг (54%) (1S,2S,4R)норборнил-2-амина. Пример промежуточного соединения 9. Экзобицикло[2,2,1]гепт-5-ен-2-амин. Экзобицикло[2,2,1]гепт-5-ен-2-амин получают в соответствии с процедурами, описанными в примере промежуточного соединения 12, из 5-норборнен-2-ола через универсальное промежуточное соединение экзо-2-бицикло[2,2,1]гепт-2-ил-изоиндол-1,3-диона. Пример промежуточного соединения 10. 2-Метил-6,7-диметоксихиноксалин. Указанное в заголовке соединение получают путем адаптации опубликованного метода Tamao et al.,Tetrahedron, 1982, 38, 3347-3354. К раствору ТГФ в атмосфере аргона добавляют 2-хлор-6,7 диметоксихиноксалин (5 г, 26 ммоль) и NiCl2 (dppp) (0,14 г, 0,26 ммоль). Реакционную смесь охлаждают до 0 С и порциями добавляют 3 М раствор MeMgBr в Et2 О (13 мл, 39 ммоль). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение 1 ч, а затем кипятят с обратным холодильником в течение 1,5 ч. Смесь охлаждают, гасят 10% НСl, перемешивают в течение 10 мин, а затем подщелачивают 5% NaOH. К реакционной смеси добавляют СН 2 Сl2 и Н 2O и смесь перемешивают в течение ночи. Затем добавляют еще СН 2 Сl2, Н 2O и NaCl и смесь фильтруют. Полученный раствор выливают в делительную склянку и водные слои промывают CH2Cl2 (3 Х). Органические слои объединяют, промывают насыщенным раствором соли, сушат (MgSO4), концентрируют на силикагеле и хроматографируют(смесь 50-80% EtOAc/гексан) с получением оранжевого твердого вещества (выход 49%).- 22007534 Пример промежуточного соединения 11. 6,7-Диметокси-2-хиноксалина карбоксальдегид. В реакционную колбу в атмосфере аргона добавляют 1,4-диоксан (20 мл), 2-метил-6,7-диметоксихиноксалин (1,09 г, 5,3 ммоль) и SeO2 (1,8 г, 16 ммоль). Смесь нагревают до 100 С в течение 2 ч 45 мин, охлаждают и фильтруют через целит. Слой промывают порциями EtOAc и СН 2 Сl2. Полученный раствор концентрируют, растворяют в смеси МеОН/СН 2 Сl2, загружают на колонку с силикагелем и хроматографируют (смесь 30% EtOAc/CH2Cl2) с получением не совсем белого твердого вещества (выход 73%). Пример промежуточного соединения 12. (2-Экзо,5-экзо)-5-аминобицикло[2,2,1]гептан-2-ацетат. Экзо-5-ацетоксибицикло[2,2,1]гептан-2-он и экзо-6-ацетоксибицикло[2,2,1]гептан-2-он получают из бицикло[2,2,1]гепта-2,5-диена в соответствии с методом R.Gagnon (J.Chem.Soc.Perkin trans. I, 1505, 1995) с небольшими модификациями. К раствору экзо-5-ацетоксибицикло[2,2,1]гептан-2-она (350 мг, 2,08 ммоль) в 10 мл ТГФ при комнатной температуре добавляют раствор 1 М борана/ТГФ (1,2 мл, 1,2 ммоль). Смесь перемешивают в течение 0,5 ч, а затем гасят при 0 С метанолом (3 мл) и 1 н НСl (1,5 мл). Затем смесь экстрагируют этилацетатом (3 х 30 мл) и сушат сульфатом магния. После фильтрации и концентрирования остаток хроматографируют на силикагеле с получением (2-эндо,5-экзо)-5-ацетоксибицикло[2,2,1]гептан-2-ола. К раствору (2-эндо, 5-экзо)-5-ацетоксибицикло[2,2,1]гептан-2-ола (350 мг, 2,06 ммоль) в ТГФ (10 мл) добавляют фталимид (454 мг, 3,09 ммоль), трифенилфосфин (810 мг, 3,09 ммоль) и диэтилазодикарбоксилат (0,49 мл, 3,09 ммоль) при 0 С. Реакционную смесь оставляют на ночь для перемешивания, а затем конденсируют на роторном испарителе и остаток очищают колоночной хроматографией (смесь 20% этилацетат/гексан) с получением нужного продукта в виде желтого твердого вещества. Смесь вышеуказанного твердого вещества (300 мг, 1 ммоль) и гидразина (0,126 мл, 2,2 ммоль) в 5 мл метанола нагревают с обратным холодильником в течение 6 ч. После удаления метанола остаток экстрагируют дихлорметаном (3 х 30 мл). После концентрирования растворителей получают (экзо, экзо)-5 аминобицикло[2,2,1]гептан-2-ацетат (127 мг, 75%), который используют в реакции сочетания без дополнительной очистки. Аналогичным образом, из соответствующего исходного соединения получают (2-эндо, 5-экзо)-5 аминобицикло[2,2,1]гептан-2-ацетат, (2-эндо, 6-экзо)-6-аминобицикло[2,2,1]гептан-2-ацетат и (2-экзо, 6 экзо)-6-аминобицикло[2,2,1]гептан-2-ацетат. Пример промежуточного соединения 13. 2-Метокси-4,5-диаминофенола дигидрохлорид. Указанное в заголовке соединение получают путем гидрирования 2-метокси-4,5-динитрофенола методом, описанным Ehrlich et al., J.Org.Chem. 1947, 12, 522. Пример промежуточного соединения 14. 7-Гидрокси-6-метоксихиноксалин-2-ол и 6-гидрокси-7 метоксихиноксалин-2-ол. Указанное в заголовке соединение получают из дигидрохлорида 4-метокси-5-гидроксибензол-1,2 диамина посредством реакции с NaOH и с этилглиоксилатом в соответствии с процедурой, описанной в примере промежуточного соединения 2. Пример промежуточного соединения 15. 7-Гидрокси-6-метокси-2-хлорхиноксалин и 6-гидрокси-7 метокси-2-хлорхиноксалин. Указанное в заголовке соединение получают из 7-гидрокси-6-метоксихиноксалин-2-ола и 6 гидрокси-7-метоксихиноксалин-2-ола реакцией с РОСl3 в соответствии с процедурой, описанной в примере промежуточного соединения 3. Соединения формулы (I), описанные в настоящей заявке, ингибируют пролиферацию клеток и/или продуцирование клеточного матрикса, и/или миграции клеток (хемотаксиса) посредством ингибирования тирозинкиназной активности PDGF-R. Большое число патологических состояний вызывается неконтролируемым репродуцированием клеток, или сверхпродуцированием клеточного матрикса, или плохой регуляцией запрограммированной гибели клеток (апоптоза). Такие патологические состояния вызываются различными типами клеток, и примерами таких состояний являются лейкоз, рак, глиобластома, псориаз, воспалительные расстройства, заболевания костей, фиброзные заболевания, атеросклероз и нарушения, возникающие после ангиопластики коронарных, бедренных или почечных артерий, или фибропролиферативные заболевания, такие как артрит, фиброз легких, почек и печени. В частности, сообщалось, что PDGF и PDGF-R участвуют в индуцировании конкретных типов раковых заболеваний и опухолей, таких как рак головного мозга, рак яичника, рак толстой кишки, рак предстательной железы,рак легких, саркома Капоши и злокачественная меланома. Кроме того, нарушение регуляции клеточных пролиферативных состояний происходит в результате хирургической операции по коронарному шунтированию. Очевидно, что ингибирование тирозинкиназной активности окажется эффективным для регуляции неконтролируемого репродуцирования клеток или продуцирования клеточного матрикса, или плохого регулирования запрограммированной гибели клеток (апоптоза). Настоящее изобретение относится к модуляции и/или ингибированию передачи клеточного сигнала, пролиферации клеток и/или продуцирования внеклеточного матрикса, и/или миграции клеток (хемотаксиса); к регуляции аномального роста клеток и клеточного воспалительного ответа. Более конкретно,настоящее изобретение относится к использованию замещенных хинолиновых и хиноксалиновых соеди- 23007534 нений, которые селективно ингибируют дифференцировку, пролиферацию, продуцирование матрикса,хемотаксис или высвобождение медиатора путем эффективного ингибирования тирозинкиназной активности рецептора тромбоцитарного фактора роста (PDGF-R). Инициация самофосфорилирования, т.е. фосфорилирования самого рецептора фактора роста и фосфорилирования хозяина внутриклеточных субстратов, представляет собой некоторые биохимические процессы, которые участвуют в передаче клеточного сигнала, пролиферации клеток, продуцировании клеточного матрикса, хемотаксисе и высвобождении медиатора. Благодаря эффективному ингибированию Lck-тирозинкиназной активности соединения настоящего изобретения могут быть также использованы для лечения резистентности к трансплантации и аутоиммунных болезней, таких как ревматоидный артрит, рассеянный склероз и системная красная волчанка,отторжение трансплантата, реакция "трансплантат против хозяина"; гиперпролиферативных нарушений,таких как опухоли и псориаз; и заболеваний, при которых клетки получают провоспалительные сигналы,таких как астма, воспалительные заболевания кишечника и панкреатит. При лечении резистентности к трансплантации соединение настоящего изобретения может быть использовано либо в профилактических целях, либо при продуцировании ответа человеческого организма на нежелательную реакцию при трансплантации органа или ткани. При профилактическом использовании соединение настоящего изобретения вводят пациенту или в ткань или орган перед операцией по трансплантации. Профилактическое лечение может также предусматривать введение лекарственного средства после операции по трансплантации, но до проявления каких-либо признаков нежелательного ответа на трансплантат. При введении в ответ на нежелательную реакцию соединение настоящего изобретения вводят непосредственно пациенту для подавления у него резистентности к трансплантации после обнаружения у него внешних признаков такой резистентности. В соответствии с другим своим отличительным признаком настоящее изобретение относится к способу ингибирования тирозинкиназной активности PDGF, предусматривающему контактирование соединения по п.1 формулы изобретения с композицией, содержащей тирозинкиназу PDGF. В соответствии с другим своим отличительным признаком настоящее изобретение относится к способу ингибирования тирозинкиназной активности Lck, предусматривающему контактирование соединения по п.1 формулы изобретения с композицией, содержащей тирозинкиназу Lck. В соответствии с другим своим отличительным признаком настоящее изобретение относится к способу лечения пациента, страдающего расстройством, или подверженного расстройству, которое может быть ослаблено или предупреждено путем введения ингибитоингибитора тирозинкиназной активностиPDGF-R и/или тирозинкиназной активности Lck, и примеры которого приведены выше, где указанный способ предусматривает введение данному пациенту эффективного количества соединения формулы I или композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль. Используемое здесь понятие "лечение" следует понимать как профилактическая терапия, а также как лечение уже установленных расстройств. Соединения настоящего изобретения могут быть также приготовлены так, чтобы они не могли быть быстро выведены через стенку сосудов (артериальных или венозных) путем конвекции и/или диффузии,что будет способствовать увеличению времени нахождения вирусных частиц в нужном участке действия. Для пролонгированного высвобождения может быть использовано периадвентициальное депо, содержащее соединение настоящего изобретения. Одним из таких депо, подходящих для введения соединений настоящего изобретения, может быть сополимерная матрица, такая как сополимер этиленавинилацетата, или гель на основе поливинилового спирта, окруженный оболочкой из силастика. Альтернативно, соединение настоящего изобретения может быть введено путем локальной доставки из силиконового полимера, имплантированного в адвентицию. Альтернативный способ минимизации выведения соединения настоящего изобретения во время чрезкожной, трансваскулярной доставки предусматривает использование недиффундируемых, высвобождающих лекарственное средство микрочастиц. Эти микрочастицы могут быть включены в различные синтетические полимеры, такие как, например, полилактид, или природные вещества, включая белки или полисахариды. Такие микрочастицы могут быть подвергнуты стратегическому изменению параметров,включая общую дозу лекарственного средства и кинетику его высвобождения. Микрочастицы могут быть эффективно инъецированы в стенки артерий или вен через пористый балонный катетер или баллон,установленный на стенте и удерживаться в стенке сосуда или в периадвентициальной ткани в течение, по крайней мере, примерно двух недель. Композиции и методика для локальной, внутривенной местоспецифической доставки терапевтических агентов обсуждается в работе Reissen et al. (J.Am.Coll.Cardiol. 1994; 23: 1234-1244), полное содержание которой вводится в настоящее описание посредством ссылки. Композиция настоящего изобретения может также содержать гидрогель, который получают из любого биологически совместимого или нецитотоксичного (гомо- или гетеро)полимера, такого как полимер гидрофильной поликриловой кислоты, который может функционировать как губка, абсорбирующая лекарственное средство. Такие полимеры были описаны, например, в заявке WO93/08845, полное содержание которой вводится в настоящее описание посредством ссылки. Некоторые из этих полимеров, а в частности, полимеры, получаемые из этилен- и/или пропиленоксида, являются коммерчески доступными.- 24007534 При использовании соединений настоящего изобретения для лечения патологий, ассоциированных с гиперпролиферативными расстройствами, указанные соединения настоящего изобретения могут быть введены различными способами. Для лечения рестеноза соединения настоящего изобретения вводят непосредственно в стенки кровеносных сосудов с помощью баллона для ангиопластики, покрытого гидрофильной пленкой (например, гидрогелем), которую насыщают указанным соединением, или с помощью какого-либо другого катетера, содержащего инфузионную камеру для данного соединения, который, таким образом, может быть введен непосредственно в участок, подвергаемый лечению, и который позволяет данному соединению локально и эффективно высвобождаться в месте нахождения клеток, подвергаемых лечению. Преимущество данного способа введения заключается в том, что он дает возможность указанному соединению быстро контактировать с клетками, нуждающимися в лечении. Способ лечения в соответствии с настоящим изобретением предусматривает введение соединения настоящего изобретения в участок, подвергаемый лечению. Так, например, гидрогель, содержащий композицию, может нанесен непосредственно на поверхность подвергаемой лечению ткани, например, в процессе хирургического вмешательства. Гидрогель предпочтительно вводят в нужный внутрисосудистый участок путем покрытия им катетера, например балонного катетера, и доставки в стенку сосуда,предпочтительно, во время ангиопластики. В особенно предпочтительном способе, насыщенный гидрогель вводят в участок, подвергаемый лечению, с помощью баллонного катетера. Так как катетер проталкивают в направлении к нужному сосуду, то для минимизации потери лекарственного средства после того, как этот катетер будет введен в кровоток, указанный баллон может быть покрыт защитной оболочкой. В других вариантах своего осуществления настоящее изобретение относится к соединению, вводимому с помощью баллонов для перфузии. Эти баллоны для перфузии, которые дают возможность поддерживать кровоток и, таким образом, снижать риск возникновения ишемии миокарда, после раздувания баллона, также позволяют указанному соединению непосредственно взаимодействовать с нужным участком при нормальном давлении в течение относительно длительного промежутка времени, т.е. более,чем двадцать минут, который может оказаться необходимым для его оптимального действия. Альтернативно, может быть использован баллонный катетер с ситемой каналов ("канализированный баллонный катетер для ангиопластики", Mansfield Medical, Boston Scientific Corp., Watertown, MA). Этот катетер состоит из стандартного баллона, покрытого слоем из 24 перфорированных каналов, которые перфузируются с помощью независимой полости через дополнительное отверстие для инфузии. Различные типы баллонных катетеров, двойной баллоный кататер, пористый баллонный катетер, микропористый баллонный катетер, канальный баллонный катетер, баллонный катетер на стенте и гидрогелевый катетер, каждый из которых может быть использован для осуществления настоящего изобретения, описаны в работеReissen и др. (1994), полное содержание которой вводится в настоящее описание посредством ссылки. Использование перфузионного баллонного катетера является особенно предпочтительным, поскольку он имеет то преимущество, что при его применении одновременно достигается поддерживание баллона в раздутом состоянии в течение длительного периода времени при сохранении свойств, облегчающих скольжение, и местоспецифичности гидрогеля. В другом своем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение настоящего изобретения и полоксамер, такой как Полоксамер 407, который является коммерчески доступным нетоксичным биологически совместимым полиолом (BASF, Parsippany, NJ). Полоксамер, пропитанный соединением настоящего изобретения, может быть нанесен непосредственно на поверхность ткани, подвергаемой лечению, например, в процессе хирургического вмешательства. Полоксамер обладает, в основном, теми же преимуществами, что и гидрогель, но имеет более низкую вязкость. Особенно предпочтительным является использование канального баллонного катетера с полоксамером, пропитанным соединением настоящего изобретения. В данном случае он имеет то преимущество,что при его использовании одновременно достигается поддерживание баллона в раздутом состоянии в течение длительного периода времени при сохранении свойств, облегчающих скольжение, и местоспецифичности полоксамера. Процентное содержание активного ингредиента в указанных композициях настоящего изобретения может варьироваться, но при этом необходимо, чтобы это содержание было таким, которое позволяло бы получить нужную дозу. Очевидно, что некоторые разовые лекарственные формы могут быть введены приблизительно в одно и то же время. Используемая доза может быть определена врачом или квалифицированным специалистом-медиком и зависит от желаемого терапевтического эффекта, способа введения, продолжительности лечения и состояния пациента. Для взрослых указанные дозы, вводимые путем ингаляции, обычно составляют от около 0,001 до около 50, а предпочтительно от около 0,001 до около 5 мг/кг массы тела в день, перорально вводимые дозы составляют от около 0,01 до около 100, предпочтительно от около 0,1 до около 70, а более предпочтительно от 0,5 до 10 мг/кг массы тела в день, а внутривенно вводимые дозы составляют от около 0,001 до около 10, а предпочтительно от 0,01 до 10 мг/кг массы тела в день. В каждом конкретном случае указанные дозы определяют в зависимости от факторов,индивидуальных для каждого пациента, подвергаемого лечению, таких как возраст, вес, общее состояние здоровья и другие характеристики, которые влияют на эффективность соединения настоящего изобрете- 25007534 ния. Соединения/композиции настоящего изобретения могут быть введены с частотой, необходимой для получения нужного терапевтического эффекта. Некоторые пациенты могут быстро реагировать на более высокие или более низкие дозы и могут гораздо хуже выдерживать адекватные дозы. Для других пациентов может оказаться необходимым длительный курс лечения при частоте введения 1-4 доз в день в соответствии с физиологической потребностью для каждого конкретного пациента. В основном, активный продукт может быть введен перорально 1-4 раза в день. Само собой разумеется, что для других пациентов может быть необходимо назначение не более 1 или 2 доз в день. Соединения настоящего изобретения могут быть также приготовлены для их использования в сочетании с другими терапевтическими агентами, или вместе с применением терапевтических методов, направленных на фармакологические состояния, которые могут быть улучшены с использованием соединения формулы I, так как описано ниже. Соединения настоящего изобретения могут быть использованы для лечения рестеноза после ангиопластики с использованием любого устройства, такого как баллонное, абляционной или лазерной техники. Соединения настоящего изобретения могут быть использованы для лечения рестеноза после помещения стента в сосудистую систему либо в качестве 1) предварительного лечения для блокировки сосудов, либо 2) в случае, когда ангиопластика с использованием какого-либо устройства не эффективна для артерий пациента. Соединения настоящего изобретения могут быть использованы либо перорально, либо парентерально, либо данное соединение может быть использовано местно путем его включения в специальное устройство или путем его применения в виде композиции, нанесенной на стент в качестве покрытия. В одном из аспектов настоящего изобретения покрытие на стент осуществляют путем нанесения полимерного материала, в который вводят соединение настоящего изобретения по крайней мере на одну поверхность данного стента. Полимерными материалами, подходящими для введения соединения настоящего изобретения, являются полимеры, обладающие относительно низкими технологическим температурами, такие как поликапролактон, сополимер поли(этиленвинилацетат) или поли(винилацетат) или силиконовая ненаполненная резиновая смесь и полимеры, имеющие аналогичные относительно низкие технологические температуры. Другими подходящими полимерами являются неразлагаемые полимеры, способные переносить и доставлять терапевтические лекарственные средства, такие как латексы, уретаны, полисилоксаны, блоксополимеры стирола-этилена/бутилена-стирола (SEBS) и биологически разлагаемые, биологически абсорбируемые полимеры, способные осуществлять перенос и доставку терапевтических лекарственных средств, такие как поли-DL-молочная кислота (DL-PLA) и поли-L-молочная кислота (L-PLA), сложные полиортоэфиры, полииминокарбонаты, алифатические поликарбонаты и полифосфазены. В полимер, нагруженный лекарственным средством, может быть также введен порообразователь путем его добавления в полимер вместе с терапевтическим лекарственным средством в целях образования пористой нагруженной лекарственным средством полимерной мембраны. "Порообразователь" означает любую частицу, такую как, например, микрогранула из хлорида натрия, лактозы или натрийсодержащего гепарина, которая будет растворяться или каким-либо иным способом разлагаться при ее погружении в физиологическую жидкость, создавая при этом пористую сетку в данном полимерном материале. Обычно, поры, оставленные такими порообразователями, могут составлять до 10 мкм. Поры,создаваемые порообразователями, такими как, например, полиэтиленгликоль (ПЭГ), сополимеры полиэтиленоксида/полипропиленоксида (ПЭО/ППО), могут быть также меньше, чем один микрон, хотя для образования пор, меньших одного микрона, могут быть также использованы и другие подобные материалы, которые способствуют разделению фаз в непрерывном нагруженным лекарственным средством полимерном матриксе и могут быть затем выведены с физиологической жидкостью организма. Данный полимерный материал может быть нанесен на стент, а терапевтическое лекарственное средство и порообразующий материал содержатся в полимерном материале, что позволяет указанному порообразователю растворяться или разлагаться под действием физиологических жидкостей, если стент помещен в кровеносном сосуде, или альтернативно, указанный порообразователь может быть растворен и удален из полимерного материала с образованием пор в этом полимерном материале непосредственно перед помещением этого полимерного материала, объединенного со стентом, в кровеносный сосуд. Если необходимо, то для ограничения скорости высвобождения соединения настоящего изобретения, поверх нагруженного лекарственным средством полимера может быть нанесена мембрана, регулирующая скорость высвобождения. Указанная скоростьрегулирующая мембрана может быть добавлена путем нанесения покрытия с образованием раствора или путем ламинирования. Скоростьограничивающая мембрана, нанесенная поверх полимерного материала, может быть сформирована так,чтобы она включала в себя однородную дисперсию порообразователя, а порообразователь в данной скоростьограничивающей мембране может быть растворен с образованием в ней пор, составляющих, например, максимум 10 мкм, или по крайней мере 1 мкм, хотя эти поры могут иметь размер менее чем 1 мкм. Порообразователь в указаннной скорость-ограничивающей мембране может быть, например, хлорид натрия, лактоза, натрийсодержащий гепарин, полиэтиленгликоль, сополимеры полиэтиленоксида/полипропиленоксида и их смеси.- 26007534 В другом аспекте покрытие на стенте может быть образовано путем нанесения соединения настоящего изобретения по крайней мере на одну поверхность данного стента с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх этого биоактивного слоя так, чтобы этот пористый полимерный материал имел адекватную толщину для обеспечения регулируемого высвобождения указанного соединения. Указанный пористый полимерный материал может состоять из полиамида, парилена или париленового производного, нанесенных путем осаждения из паровой фазы, не содержащей катализатора. Термин"парилен" означает полимер на основе п-ксилилена, полученный путем полимеризации в паровой фазе,как описано в патенте США 5824049, вводимом в настоящее описание посредством ссылки. Альтернативно, указанный пористый полимерный материал может быть нанесен осаждением из плазмы. Характерными полимерами, подходящими для осаждения из плазмы, являются поли(этиленоксид), поли(этиленгликоль), поли(пропиленоксид) и полимеры метана, силикона, тетрафторэтилентетраметилдисилоксана и т.п. Другими подходящими полимерными системами являются полимеры, происходящие от фотополимеризуемых мономеров, таких как жидкие мономеры, предпочтительно, имеющие по крайней мере две перекрестно-сшиваемые С-С (углерод-углеродные) двойные связи, и представляющие собой негазообразное ступенчато полимеризуемое этилено-ненасыщенное соединение, имеющее температуру кипения выше 100 С при атмосферном давлении, и молекулярную массу приблизительно 100-1500, и способные легко образовывать высокомолекулярный полимер при ступенчатой полимеризации. Более предпочтительным мономером является полиэтилено-ненасыщенный сложный эфир акриловой или метакриловой кислоты, получаемый путем ступенчатой фотополимеризации и содержащий две или несколько акрилатных или метакрилатных групп на молекулу, или его смеси. Характерными примерами таких многофункциональных акрилатов являются диакрилат этиленгликоля, диметакрилат этиленгликоля, триакрилат триметилпропана, триметилакрилат триметилпропана, тетраакрилат пентаэритрита или тетраметакрилат пентаэритрита, диметакрилат 1,6-гександиола и диметакрилат диэтиленгликоля. В некоторых конкретных случаях могут быть также использованы моноакрилаты, такие как нбутилакрилат, н-бутилметакрилат, 2-этилгексилакрилат, лаурилакрилат и 2-гидроксипропилакрилат. Могут быть также использованы небольшие количества амидов (мет)акриловой кислоты, таких как бутиловый эфир N-метилолметакриламида. Подходящими также являются N-виниловые соединения, такие какN-винилпирролидон, виниловые эфиры алифатических монокарбоновых кислот, таких как винилолеат,виниловые эфиры диолов, такие как бутандиол-1,4-дивиниловый эфир и аллиловый эфир, и аллиловый сложный эфир. Могут быть также использованы и другие мономеры, такие как продукты реакций диили полиэпоксидов, таких как бутандиол-1,4-диглицидилового эфира или диглицидилового эфира бисфенола А, с (мет)акриловой кислотой. Параметры среды для диспергирования фотополимеризуемой жидкости могут быть модифицированы для конкретных целей путем подходящего выбора мономеров или их смесей. Другие подходящие полимерные системы включают полимеры, которые являются биологически совместимыми и минимизируют раздражение стенок сосудов при имплантировании стента. Этот полимер может быть биологически стабильным или биологически абсорбируемым полимером в зависимости от нужной скорости высвобождения или от нужной степени стабильности полимера. Биологически абсорбируемыми полимерами, которые могут быть использованы, являются поли(L-молочная кислота),поликапролактон, поли(лактид-согликолид), поли(гидроксибутират), поли(гидроксибутират-совалерат),полидиоксанон, полиортоэфир, полиангидрид, поли(гликолевая кислота), поли(D,L-молочная кислота),поли(гликолевая кислота-сотриметиленкарбонат), полифосфоэфир, полифосфоэфируретан, поли(аминокислоты), цианоакрилаты, поли(триметилен-карбонат) , поли(иминокарбонат), сополимер простого эфира-сложного эфира (например, PEO/PLA), полиалкиленоксалаты, полифоосфазены и биомолекулы, такие как фибрин, фибриноген, целлюлоза, крахмал, коллаген и гиалуроновая кислота. Могут быть также использованы биологически стабильные полимеры с относительно низким и постоянным уровнем воздействия на ткани, такие как полиуретаны, силиконы и полиэфиры, и могут быть также использованы другие полимеры, в том случае, если они могут растворяться и отверждаться или полимеризоваться на стенте, такие как полиолефины, полиизобутилен и сополимеры этилена-альфа-олефина; полимеры и сополимеры акриловой кислоты, полимеры и сополимеры винилгалогенида, такие как поливинилхлорид; поливиниловые эфиры, такие как поливинилметиловый эфир; поливинилиденгалогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливинилкетоны, поливиниловые ароматические соединения, такие как полистирол, поливиниловые эфиры, такие как поливинилацетат; сополимеры виниловых мономеров друг с другом и олефинами, такие как сополимеры этиленаметилметакрилата, сополимеры акрилонитрила-стирола, смолы ABS и сополимеры этиленавинилацетата; полиамиды, такие как Найлон 66 и поликапролактам; алкиловые смолы, поликарбонаты; полиоксиметилены; полиимиды, полиэфиры; эпоксидные смолы, полиуретаны; искусственное волокно,триацетатное искусственное волокно; целлюлоза, ацетат целлюлозы, бутират целлюлозы; бутират-ацетат целлюлозы; целлофан, нитрат целлюлозы; пропионат целлюлозы; эфиры целлюлозы; и карбоксиметилцеллюлоза.- 27007534 Помимо осаждения из плазмы и осаждения из паровой фазы, для нанесения различных покрытий на поверхность стента могут быть применены другие методы. Так, например, полимерный раствор может быть нанесен на стент, который затем оставляют для выпаривания растворителя, в результате чего на поверхности стента будет образовываться покрытие из указанного полимера и терапевтического вещества. Обычно раствор может быть нанесен на стент либо путем напыления раствора на этот стент, либо путем погружения этого стента в раствор. Стентовые устройства настоящего изобретения могут быть использованы для лечения рестеноза в комбинации с любым из противосвертывающих, антитромбоцитарных, антитромботических или профибринолитических агентов. В большинстве случаев, для безопасного осуществления процедуры хирургического вмешательства или для предупреждения нежелательных эффектов в результате образования тромбов пациентам до, во время и после хирургической операции вводят агенты указанных классов. Некоторыми примерами известных классов противосвертывающих, антитромбоцитарных, антитромботических и профибринолитчиеских агентов являются любые композиции гепарина, низкомолекулярных гепаринов, пентасахаридов, антагонистов рецептора фибриногена, ингибиторов тромбина, ингибиторов фактора Ха или ингибиторов фактора VIIa. Стентовые устройства настоящего изобретения могут быть использованы в комбинации с любым гипотензивным агентом или агентом, снижающим уровень холестерина или липида, для лечения рестеноза или атеросклероза одновременно с лечением состояний, характеризующихся высоким кровяным давлением или атеросклерозом. Некоторыми примерами агентов, которые могут быть использованы для лечения состояний, характеризующихся высоким кровяным давлением, являются соединения нижеследующих клессов: бета-блокаторы, ингибиторы АСЕ, антагонисты кальциевых каналов и антагонисты альфа-рецепторов. Некоторыми примерами агентов, которые могут быть использованы для лечения состояний, характеризующихся повышенным уровнем холестерина или нарушением уровней липидов, являются соединения, известные как ингибиторы HMGCoA-редуктазы, соединения классов фибратов. Стентовые устройства настоящего изобретения могут быть использованы для лечения различных форм рака, либо отдельно, либо в комбинации с соединениями, о которых известно, что они могут быть использованы для лечения рака. Следует отметить, что настоящее изобретение включает комбинации соединений настоящего изобретения с одним или несколькими вышеупомянутыми терапевтическими агентами данного класса. Соединения, входящие в объем настоящего изобретения, обладают заметной фармакологической активностью в соответствии с тестами, описанными в литературе, которые со всей очевидностью указывают на корреляцию с фармакологической активностью у человека и других млекопитающих. Результаты нижеописанных фармакологических in vitro и in vivo-тестов является типичными для репрезентативных соединений настоящего изобретения. Получение фармацевтических композиций и срезов для фармакологических тестов Соединения, входящие в объем настоящего изобретения, обладают значительной активностью как ингибиторы протеин-тирозинкиназы и терапевтической ценностью как агенты, предотвращающие пролиферацию клеток, и могут быть использованы для лечения некоторых состояний, включая псориаз, атеросклероз и повреждения при рестенозе. Соединения, входящие в объем настоящего изобретения, обнаруживают модуляцию и/или ингибирование передачи клеточного сигнала, и/или пролиферации клеток,и/или продуцирования внеклеточного матрикса и/или хемотаксиса, и/или клеточного воспалительного ответа, и могут быть использованы для предупреждения или замедления возникновения или рецидива таких состояний или какого-либо другого терапевтического воздействия на данное состояние. Для определения эффективности соединения настоящего изобретения были использованы фармакологические тесты, описанные ниже, которые применяются специалистами и которые, как известно,коррелируют с фармакологической активностью у млекопитающих. Соединения, входящие в объем настоящего изобретения, были подвергнуты указанным различным тестам, и полученные результаты явно коррелировали с нужной активностью медиатора клеточной дифференцировки. Результаты указанных тестов, очевидно, дают информацию, достаточную для того, чтобы специалисты в области фармакологии и медицинской химии могли определить параметры для использования исследуемых соединений в одном или нескольких типах терапии, описанных в настоящей заявке. 1. ELISA-анализ на самофосфорилирование тирозинкиназы PDGF-R. Указанный в заголовке анализ осуществляют, как описано в работе Dolle и др. (J.Med.Chem. 1994,37, 2627), которая вводится в настоящее описание посредством ссылки, за исключением того, что в данном случае используют клеточные лизаты, происходящие от клеток гладкой мышцы аорты человека(HAMSC), как описано ниже. 2. Общая методика анализа на митогенез.a. Культивирование клеток. Клетки гладкой мышцы аорты человека (пассаж 4-9) высевали в 96-луночные планшеты в среде,поддерживающей рост клеток, при 6000 клеток/лунку и оставляли для роста на 2-3 дня. После достижения приблизительно 85% конфлюэнтности рост клеток прекращали путем добавления бессывороточной среды (SFM).b. Анализ на митогенез. Через 24 ч при истощении сыворотки среду удаляли и заменяли смесью тестируемое соединение/носитель в SFM (200 мкл/лунку). Соединения солюбилизировали в клеточной культуре в ДМСО при концентрации 10 мМ, а последующие разведения осуществляли в SFM. После 30-минутного предварительного инкубирования с соединением клетки стимулировали PDGF при концентрации 10 нг/мл. Определение проводили в дубликате со стимулированными и нестимулированными лунками при каждой концентрации соединения. Через 4 ч добавляли 1 мкКи 3 Н-тимидина/лунку. Культивирование прекращали через 24 ч после добавления фактора роста. Клетки отделяли трипсином и собирали на фильтровальный мат с использованием автоматического сборника клеток (Wallac MachII96). Клетки на этом фильтровальном мате подсчитывали в сцинтилляционном счетчике (Wallac Betaplate) для определения метки с включенной ДНК. 3. Анализ на хемотаксис. Клетки гладкой мышцы аорты человека (HASMC) при более ранних пассажах получали из АТСС. Клетки культивировали в Clonetics SmGM 2 SingleQuots (использовали среды и клетки в пассажах 4-10). При достижении клетками 80% конфлюэнтности в среду добавляли флуоресцентный зонд, кальцеин AM(5 мМ, Molecular Probe) и клетки инкубировали в течение 30 мин. После промывки физиологическим раствором, забуференным HEPES, клетки отделяли трипсином и нейтрализовали буфером MCDB 131(Gibco) с 0,1% BSA, 10 мМ глутамином и 10% фетальной бычьей сывороткой. После центрифугирования клетки промывали еще один раз и ресуспендировали в том же самом буфере без фетальной бычьей сыворотки при концентрации 30000 клеток/50 мл. Клетки инкубировали с различными концентрациями соединения формулы I (конечная концентрация ДМСО = 1%) в течение 30 мин при 37 С. Для исследования хемотаксиса использовали 96-луночные модифицированные камеры Бойдена (Neuroprobe, Inc.) и поликарбонатную мембрану с размером пор 8 мм (Poretics, CA). Указанную мембрану сенсибилизировали коллагеном (Sigma C3657, 0,1 мг/мл). В нижнюю часть камеры помещали PDGF- (3 нг/мл) в буфере с соединением формулы I и без него. В верхнюю часть камеры помещали клетки (30000) с ингибитором и без ингибитора. Клетки инкубировали в течение 4 ч. Фильтровальную мембрану снимали и клетки на верхней стороне мембраны удаляли. После сушки флуоресценцию на мембране определяли с использованием Cytofluor II (Millipore) при длинах волн возбуждения/излучения 485/530 нм. В каждом эксперименте среднюю миграцию клеток получали от шести повторений. Определяли процент ингибирования по отношению к ДМСО-обработанному контролю. IC50 вычисляли по пяти точкам для величин ингибирования в зависимости от концентрации. Результаты представлены как среднее + ср.кв.ош. для пяти таких экспериментов. 4. Очистка EGF-рецептора. Очистку EGF-рецептора осуществляли в соответствии с методикой YardenSchlessinger. Клетки А 431 культивировали в 80 см 2-сосудах до конфлюэнтности (2 х 107 клеток на сосуд). Эти клетки дважды промывали PBS и собирали с использованием PBS, содержащего 11,0 ммоль EDTA (1 ч при 37 С), и центрифугировали при 600 г в течение 10 мин. Затем клетки солюбилизировали в 1 мл на 2 x 107 клеток холодного буфера для солюбилизации (50 ммоль буфера Hepes, рН 7,6, 1% Тритон Х-100, 150 ммоль NaCl,5 ммоль EGTA, 1 ммоль PMSF, 50 мг/мл апротинина, 25 ммоль бензамидина, 5 мг/мл лейпептина и 10 мг/мл ингибитора соевого трипсина) в течение 20 мин при 4 С. После центрифугирования при 100000 г в течение 30 мин супернатант загружали на колонку с WGA-агарозой (100 мл упакованной смолы на 2 х 107 клеток) и встряхивали в течение 2 ч при 4 С. Неабсорбированный материал удаляли и смолу дважды промывали буфером HTN (50 ммоль Hepes, рН 7,6, 0,1% Тритон Х-100, 150 ммоль NaCl), дважды промывали буфером HTN, содержащим 1 М NaCl, и дважды промывали буфером HTNG (50 мМ Hepes, рН 7,6, 0,1% Тритон Х-100, 150 ммоль NaCl и 10% глицерина). Рецептор EGF подвергали периодическому элюированию буфером HTNG, содержащим 0,5 М N-ацетил-D-глюкозамин (200 мл на 2 х 107 клеток). Проэлюированный материал хранили в аликвотах при -70 С и перед использованием разводили буферомTMTNG (50 мМ Tpиc-Mes-буфер, рН 7,6, 0,1% Тритон Х-100, 150 ммоль NaCl, 10% глицерина). 5. Ингибирование автофосфорилирования EGF-R. Клетки А 431 культивировали до конфлюэнтности в чашках для культивирования тканей, сенсибилизированных фибронектином человека. После промывки (2 раза) охлажденным льдом PBS клетки лизировали добавлением 500 мл/чашку буфера для лизиса (50 ммоль Hepes, рН 7,5, 150 ммоль NaCl, 1,5 ммоль МgСl2, 1 ммоль EGTA, 10% глицерина, 1% Тритон Х-100, 1 ммоль PMSF, 1 мг/мл апротинина, 1 мг/мл лейпептина) и инкубированием в течение 5 мин при 4 С. После стимуляции EGF (500 мг/мл, 10 мин при 37 С), иммунопреципитацию осуществляли с использованием антитела против EGF-R (Ab 108) и реакцию автофосфорлирования образца (50 мл-аликвоты, 3 мКи [g-32 Р]АТР) проводили в присутствии 2 или 10 мМ соединения настоящего изобретения в течение 2 мин при 4 С. Реакцию прекращали добавлением горячего буфера для электрофореза образца. Проводили анализ методом электрофореза в ПААГ с ДСН (7,5%) с последующей авторадиографией и реакцию количественно оценивали путем денситометрического сканирования рентгеновских пленок.- 29007534 а. Культивирование клеток. Клетки, обозначенные HER 14 и К 721 А, получали путем трансфекции клеток NIH3T3 (клон 2.2) (отC.Fryling, NCI, NIH), у которых отсутствовали эндогенные EGF-рецепторы, кДНК-конструкцией EGFрецептора дикого типа или мутантного EGF-рецептора, у которой отсутствовала тирозинкиназная активность (где Lys 721 в АТР-связывающем сайте заменен на остаток Ala, соответственно). Все эти клетки культивировали в DMEM с 10% сывороткой теленка (Hyclone, Logan, Utah). 6. Селективность по отношению к РКА и РКС определяли с использованием коммерческих наборов.a. Набор для колориметрического анализа РКА, Pierce Colorimetric РКА Assay Kit, Spinzyme Format. Краткий протокол: 1 ед. фермента РКА (бычьего сердца)/аналитическая пробирка Пептидный субстрат Кемпептид (меченный красителем) 45 мин при 30 С оптическая плотность при 570 нмb. Набор для колориметрического анализа РКА, Pierce Colorimetric PKC Assay kit, Spinzyme Format. Краткий протокол: 0,025 ед. фермента РКС (головного мозга крысы)/аналитическая пробирка Пептидный субстрат Нейрогранин (меченный красителем) 30 мин при 30 С оптическая плотность при 570 нм. 7. Определение ингибирования тирозинкиназной активности р 56lсk. Ингибирование тирозинкиназной активности р 56lсk определяли в соответствии с процедурой, описанной в патенте США 5714493, который вводится в настоящее описание посредством ссылки. В альтернативном варианте, ингибирование тирозинкиназной активности определяли следующим методом. Субстрат (тирозинсодержащий субстрат, Biot-(-ala)3-Lys-Val-Glu-Lys-Ile-Gly-Glu-Gly-Thr-TyrGlu-Val-Val-Tyr-Lys-(NH2), узнаваемый Р 56lсk, 1 мкМ) сначала фосфорилировали в присутствии или в отсутствие данной концентрации тестируемого соединения соответствующим количеством фермента(фермент получали путем экспрессии гена P56lck в дрожжевой конструкции), выделенным из клонированных дрожжей (очистку фермента проводят нижеследующими классическими методами), в присутствии АТР (10 мкМ), МgСl2 (2,5 мМ), МnСl2 (2,5 мМ), NaCl (25 мМ), DTT (0,4 мМ) в Hepes, 50 мМ, рН 7,5,в течение 10 мин при комнатной температуре. Полный объем реакционной смеси составлял 50 мкл, и реакции проводили в черном 96-луночном флуоресцентном планшете. Реакцию прекращали добавлением 150 мкл буфера, используемого для прекращения реакции (100 мМ Hepes, рН 7,5, KF 400 мМ, EDTA 133 мМ, BSA 1 г/л), содержащего выбранное антитело против тирозина, помеченное криптатом европия(PY20-K) при 0,8 мкг/мл, и стрептавидин, помеченный аллофикоцианином (XL665), при 4 мкг/мл. Мечение стрептавидина и антител против тирозина осуществляли с помощью набора Cys-Bio International(France). Смесь анализировали путем подсчета с использованием счетчика Packard Discovery, на котором можно измерять гомогенный перенос флуоресценции с разрешением по времени (возбуждение при 337 нм, считывание при 620 нм и 665 нм). Отношение 665 нм-сигнал/620 нм-сигнал является мерой концентрации фосфорилированного тирозина. Контроль получают путем замены фермента буфером. Специфический сигнал представляет собой разность между отношением, полученным без ингибитора, и отношением, полученным для контроля. Затем вычисляли процент специфического сигнала. IC50 вычисляли для 10 концентраций ингибитора в дубликате с использованием Xifit soft. Эталонным соединением является стауроспорин (Sigma), и это соединение давало IC50, составляющую 306 нМ (n=20). 8. Определение ингибирования опухоли in vitro. Ингибирование роста опухоли in vitro соединениями настоящего изобретения определяли следующим образом. Клеточную линию глиомы крысы С 6 (полученную от АТСС) культивировали в виде монослоев в модифицированной по способу Дульбекко среде Игла, содержащей 2 мМ L-глутамина, 200 ед./мл пенициллина, 200 мкг/мл стрептомицина и дополненной 10% (об./об.) термоинактивированной фетальной телячьей сывороткой. Клетки в экспоненциальной фазе роста трипсинизировали, промывали PBS и разводили до конечной концентрации 6500 клеток/мл в полной среде. Тестируемое лекарственное средство или контрольный растворитель добавляли к клеточной суспензии (2,5 мл) при объеме 50 мкл, а затем добавляли 0,4 мл 2,4% агара Noble Difco, поддерживаемого при 45 С, и перемешивали. Полученную смесь сразу выливали в чашки Петри и оставляли на 5 мин при 4 С. Число клеточных клонов (60 клеток) измеряли после 12-дневного инкубирования при 37 С в атмосфере 5% СО 2. Каждое лекарственное средство тестировали при концентрации 10, 1, 0,1 и 0,01 мкг/мл (конечная концентрация в агаре) в дубликате. Результаты выражали как процент ингибирования клоногенности по отношению к необработанному контролю. IC50 определяли графически, исходя из графика, построенного в логарифмическом масштабе только по одной оси для средней величины, определенной для каждой концентрации лекарственного средства.
МПК / Метки
МПК: C07D 215/38, C07D 405/12, C07D 453/06, C07D 241/42, C07D 215/20, C07D 241/44, A61K 31/50, A61F 2/82
Метки: соединений, устройство, pdgf-рецептора, основе, качестве, тирозинкиназы, стентовое, хиноксалиновых, хинолиновых, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-7534-stentovoe-ustrojjstvo-na-osnove-hinolinovyh-i-hinoksalinovyh-soedinenijj-v-kachestve-ingibitorov-pdgf-receptora-i-ili-tirozinkinazy-lck.html" rel="bookmark" title="База патентов Евразийского Союза">Стентовое устройство на основе хинолиновых и хиноксалиновых соединений в качестве ингибиторов pdgf-рецептора и/или тирозинкиназы lck</a>