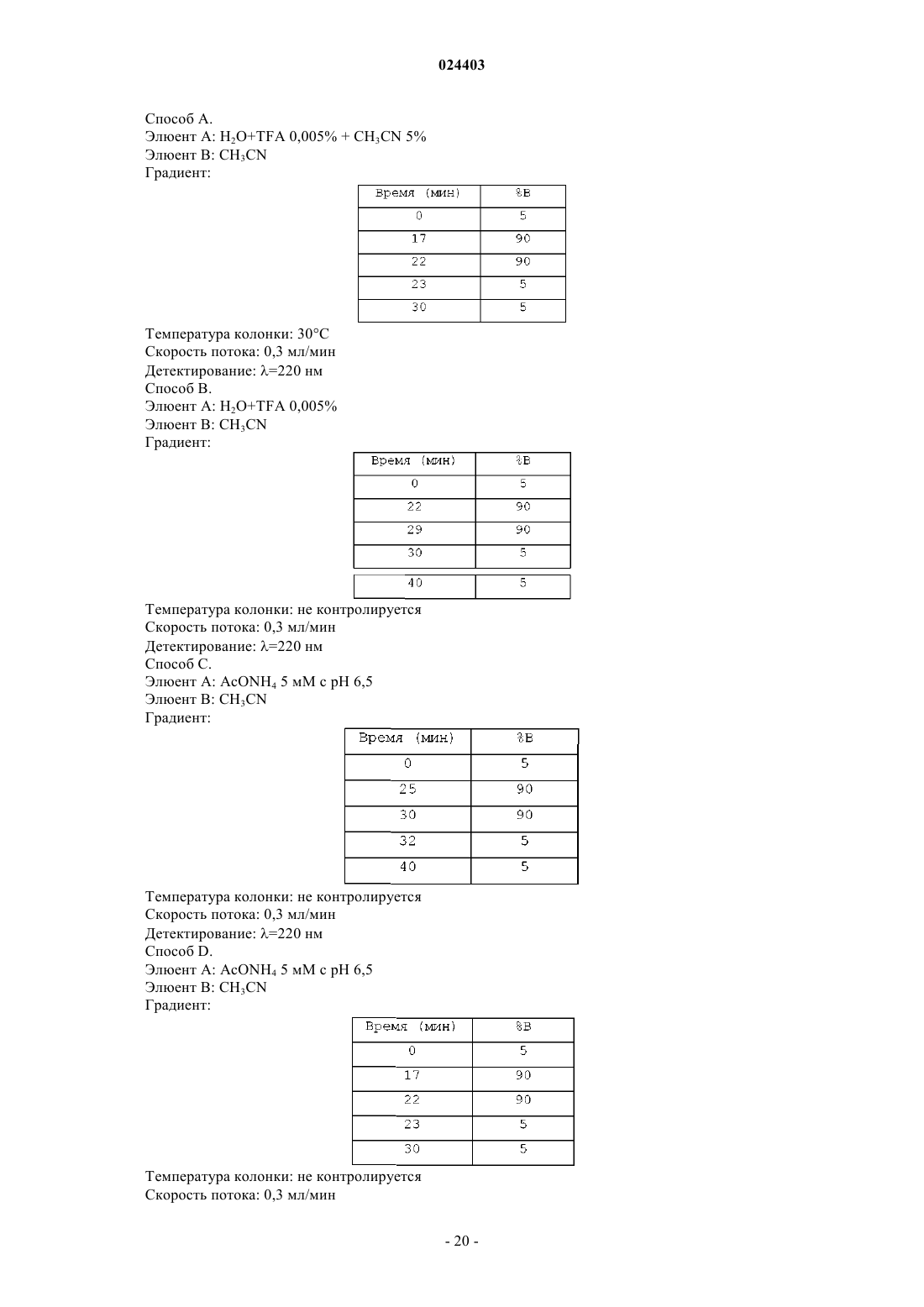
Производные (гетероциклотетрагидропиридин)(пиперазинил)-1-алканона и (гетероциклодигидропирролидин)(пиперазинил)-1-алканона и их применение в качестве ингибиторов рецептора р75ntr
Номер патента: 24403
Опубликовано: 30.09.2016
Авторы: Боно Франсуаз, Дельбари-Госсар Сандрин, Барони Марко, Верчези Валентина
Формула / Реферат
1. Соединение общей формулы (I)
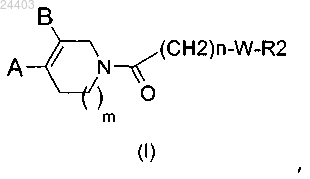
где n представляет 1 или 2;
m представляет 0 или 1;
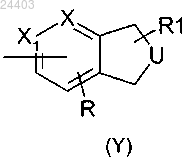
А представляет конденсированную гетероциклическую группу формулы (Y)
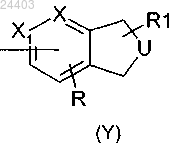
и В представляет атом водорода или
А представляет атом водорода и В представляет конденсированную гетероциклическую группу формулы (Y)
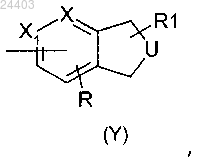
причем конденсированный гетероцикл формулы Y может быть соединен с остатком молекулы через любой из имеющихся атомов углерода, где кольцо, содержащее U, представляет собой
либо 6-членный цикл, ароматический или насыщенный, содержащий 1 или 2 атома азота, причем цикл может быть, замещен одним или двумя атомами галогена, одной или двумя группами (С1-С4)алкил или (С1-С4)алкокси, одним или двумя перфтор(С1-С4)алкилами;
либо 5-членый цикл, ароматический или насыщенный, содержащий один атом азота, кислорода или серы, причем цикл может быть замещен одним или двумя (С1-С4)алкилами;
X и X1 представляют СН или N;
R и R1, находящиеся в одном из незанятых положений, представляют независимо атом водорода, атом галогена, (С1-С4)алкил, (С1-С4)алкокси, перфтор(С1-С4)алкил, трифторметокси, циано, СООН, СОО(С1-С4)алкил, CONR3R4 или NHCOR3;
-W- является азотсодержащим гетероциклом, выбранным из
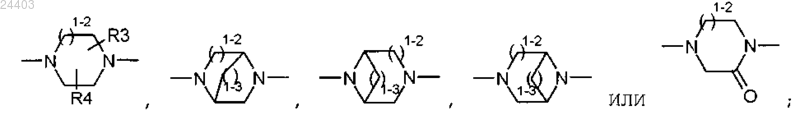
1-2 представляет 1 или 2;
1-3 представляет 1, 2 или 3;
R2 представляет группу, выбранную из
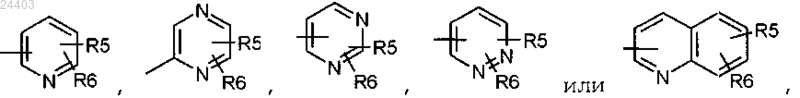
где R5 и R6, находящиеся в одном из незанятых положений, представляют независимо атом водорода, атом галогена, (С1-С4)алкил, (С1-С4)алкокси, трифторметил, трифторметокси, циано, СООН, COO(C1-C4)алкил, СООцикло(С3-С6)алкил, SO(C1-C4)алкил, SO2(C1-C4)алкил, CONR3R4, NR3R4 или NHCOR3;
или один из R5 и R6 может также представлять гетероцикл, выбранный из
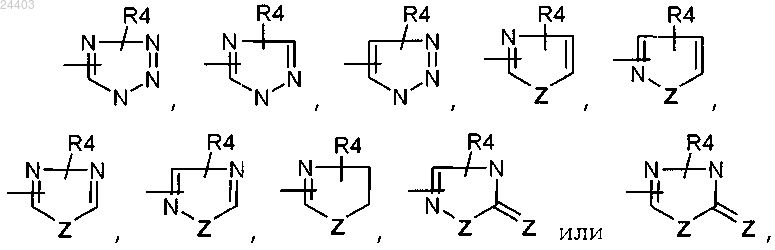
Z представляет атом кислорода или серы;
R3 и R4 представляют водород или С1-С6алкил,
или его аддитивная соль с фармацевтически приемлемой кислотой.
2. Соединение по п.1, в котором
А представляет конденсированную гетероциклическую группу формулы (Y)
и В представляет атом водорода или
А представляет атом водорода и В представляет конденсированную гетероциклическую группу формулы (Y)

причем X и X1 представляют собой СН,
при этом конденсированный гетероцикл формулы Y может быть связан с остатком молекулы через любой из атомов углерода, имеющихся в бензольном кольце;
или его аддитивная соль с фармацевтически приемлемой кислотой.
3. Соединение по любому из пп.1, 2, в котором R и R1, находящиеся в одном из незанятых положений, представляют независимо атом водорода, атом галогена, (С1-С4)алкил, СОО(С1-С4)алкил; или его аддитивная соль с фармацевтически приемлемой кислотой.
4. Соединение по любому из пп.1-3, в котором
-W- представляет азотсодержащий гетероцикл, выбранный из
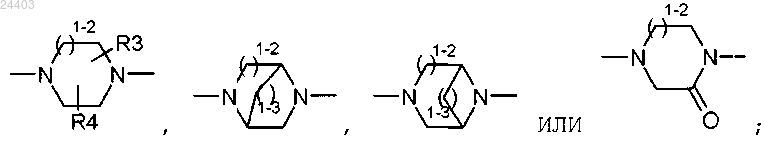
R3 и R4 представляют водород или метил;
или его аддитивная соль с фармацевтически приемлемой кислотой.
5. Соединение по любому из пп.1-4, в котором
R2 представляет группу, выбранную из
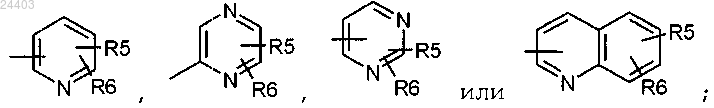
R5 и R6, находящиеся в любом из незанятых положений, представляют независимо атом водорода, трифторметил, СООН, COO(C1-C4)алкил или СООцикло(С3-С6)алкил;
или один из R5 и R6 может также представлять гетероцикл, выбранный из
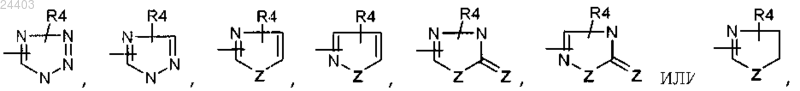
Z представляет атом кислорода или серы;
R3 и R4 представляют водород или метил;
или его аддитивная соль с фармацевтически приемлемой кислотой.
6. Соединение по любому из пп.1-5, выбранное из
соединения № 1: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(3,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)этанона;
соединения № 2: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(8-пиримидин-2-ил-3,8-диазабицикло[3.2.1]окт-3-ил)этанона;
соединения № 3: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(8-пиримидин-2-ил-3,8-диазабицикло[3.2.1]окт-3-ил)этанона;
соединения № 4: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 5: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2S,5R)-2,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)этанона;
соединения № 6: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2S,5R)-2,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)этанона;
соединения № 7: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-лиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 8: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-циазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 9: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2R,5S)-2,5-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 10: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(2-метилбензо[b]тиофен-7-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 11: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(2-пропилбензо[b]тиофен-7-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 12: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанона;
соединения № 13: 1-(4-бензо[b]тиофен-6-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2R,5S)-2,5-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 14: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2R,5S)-2,5-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 15: 1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-ил]-2-(8-пиримидин-2-ил-3,8-диазабицикло[3.2.1]окт-3-ил)этанона;
соединения № 16: 1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 17: 4-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 18: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 19: 1-(4-бензо[b]тиофен-7-ил-3,6-дигицро-2Н-пиридин-1-ил)-2-((2S,6R)-2,6-диметил-4-хинолин-2-илпиперазин-1-ил)этанона;
соединения № 20: 1-(4-хинолин-8-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 21: 1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 22: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 23: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 24: 1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 25: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-(4-тиено[3,2-с]пиридин-4-ил-3,6-дигидро-2Н-пиридин-1-ил)этанона;
соединения № 26: 1-(4-бензофуран-3-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 27: 2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]-1-[4 -(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 28: 1-[4-(6-фтор-1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 29: 1-(4-бензо[b]тиофен-3-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 30: 4-{2-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 31: 4-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 32: 4-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 33: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 34: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 35: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)этанона;
соединения № 36: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 37: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанона;
соединения № 38: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 39: 2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 40: 2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 41: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)этанона;
соединения № 42: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 43: 4-[2-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 44: 1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 45: 1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанона;
соединения № 46: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 47: 1-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанона;
соединения № 48: 5-{(3S,5R)-4-[2-(4-бензо[b]тиофен-4-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}пиридин-2-карбоновой кислоты;
соединения № 49: 4-{2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-1-(6-трифторметилпиридин-3-ил)пиперазин-2-она;
соединения № 50: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанона;
соединения № 51: метилового эфира 5-{(3S,5R)-4-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}пиридин-2-карбоновой кислоты;
соединения № 52: метилового эфира 6-{(3S,5R)-4-[2-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 53: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 54: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанона;
соединения № 55: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2S,6R)-2,6-диметил-4-пиримидин-5-илпиперазин-1-ил)этанона;
соединения № 56: 6-{(3S,5R)-4-[2-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 57: 6-{(3S,5R)-4-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 58: метилового эфира 6-{(3S,5R)-4-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 59: 6-{(3S,5R)-4-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 60: 4-[2-(4-бензофуран-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 61: метилового эфира 6-((3S,5R)-3,5-диметил-4-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}пиперазин-1-ил)никотиновой кислоты;
соединения № 62: 6-((3S,5R)-3,5-диметил-4-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}пиперазин-1-ил)никотиновой кислоты;
соединения № 63: 1-(5-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 64: этилового эфира 6-((3S,5R)-4-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}никотиновой кислоты;
соединения № 65: метилового эфира 6-{3-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 66: метилового эфира 7-(1-{2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]ацетил}-1,2,3,6-тетрагидропиридин-4-ил)бензо[b]тиофен-2-карбоновой кислоты;
соединения № 67: метилового эфира 5-(1-{2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]ацетил}-1,2,3,6-тетрагидропиридин-4-ил)бензо[b]тиофен-2-карбоновой кислоты;
соединения № 68: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(2-пропилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 69: метилового эфира 6-{3-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 70: метилового эфира 6-{3-[2-(4-бензо[b]тиофен-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 71: 6-{3-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 72: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(7-фторбензофуран-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 73: 1-[4-(2,3-диметилбензофуран-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 74: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(4-хинолин-2-ил-3,6-дигидро-2Н-пиридин-1-ил)этанона;
соединения № 75: 1-(4-бензофуран-5-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)этанона;
соединения № 76: метилового эфира 6-{3-[2-оксо-2-(4-тиено[3,2-c]пиридин-4-ил-3,6-дигидро-2Н-пиридин-1-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 77: метилового эфира 6-(3-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 78: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(4-пиридин-3-ил-[1,4]диазепан-1-ил)этанона;
соединения № 79: 6-{3-[2-оксо-2-(4-тиено[3,2-c]пиридин-4-ил-3,6-дигидро-2Н-пиридин-1-ил)этил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 80: 6-(3-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 81: метилового эфира 6-{3-[2-(3-бензофуран-7-ил-2,5-дигидропиррол-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 82: метилового эфира 6-{3-[2-(3-бензо[b]тиофен-7-ил-2,5-дигидропиррол-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 83: 4-[2-(3-бензофуран-7-ил-2,5-дигидропиррол-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 84: 6-{3-[2-(4-бензофуран-7-ил)-2,3-дигидропиррол-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 85: 6-{3-[2-(5-бензо[b]тиофен-7-ил-3,4-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 86: 6-{3-[2-(4-бензо[b]тиофен-7-ил-2,3-дигидропиррол-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотиновой кислоты;
соединения № 87: метилового эфира 6-(3-{2-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты;
соединения № 88: 2-{(3S,5R)-4-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридиь-1-ил)-2-оксоэтил]-3,5-диметилпиперазин-1-ил}пиримидин-5-карбоновой кислоты;
соединения № 89: 3-(6-{3-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-кл)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}пиридин-3-ил)-4Н-[1,2,4]оксадиазол-5-она;
соединения № 90: 3-(6-{3-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-кл)-2-оксоэтил]-3,8-циазабицикло[3.2.1]окт-8-ил}пиридин-3-ил)-4Н-[1,2,4]оксадиазол-5-она;
соединения № 91: 6-(3-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотинонитрила;
соединения № 92: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(3-хлор-5-трифторметилпиридин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 93: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(8-пиридин-3-ил-3,8-диазабицикло[3.2.1]окт-3-ил)этанона;
соединения № 94: 6-{3-[2-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-ил}никотинонитрил;
соединения № 95: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[5-(5-трифторметилпиридин-2-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанона;
соединения № 96: циклобутилового эфира 6-(3-{2-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-оксоэтил}-3,8-диазабицикло[3.2.1]окт-8-ил)никотиновой кислоты;
соединения № 97: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 98: 1-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-(4-хинолин-2-илпиперазин-1-ил)этанона;
соединения № 99: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(7-хлорхинолин-4-ил)пиперазин-1-ил]этанона;
соединения № 100: 2-[(2S,6R)-4-(5-фторпиримидин-2-ил)-2,6-диметилпиперазин-1-ил]-1-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 101: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(5-хлорпиридин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
соединения № 102: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-((2R,5S)-2,5-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-ил)этанона;
соединения № 103: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-фторпиримидин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 104: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(6-трифторметилпиридин-2-ил)-3,8-циазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 105: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(4-хинолин-2-илпиперазин-1-ил)этанона;
соединения № 106: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(7-хлорхинолин-4-ил)пиперазин-1-ил]этанона;
соединения № 107: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(5-хлорпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 108: 2-[4-(6-хлорпиридин-2-ил)пиперазин-1-ил]-1-[4-(lH-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 109: 1-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 110: 2-((2S,6R)-2,6-диметил-4-хинолин-2-илпиперазин-1-ил)-1-[4-(1Н-индол-3-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 111: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-(4-пиридин-3-ил-[1,4]диазепан-1-ил)этанона;
соединения № 112: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(5,6-дихлорпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 113: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[4-(6-бромпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 114: 1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-(4-хинолин-2-илпиперазин-1-ил)этанона;
соединения № 115: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[5-(6-трифторметилпиридазин-3-ил)-2,5-диазабицикло[2.2.1]гепт-2-ил]этанона;
соединения № 116: 1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]-2-[4-(6-трифторметилпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 117: 2-[4-(7-хлорхинолин-4-ил)пиперазин-1-ил]-1-[4-(2-метилбензо[b]тиофен-5-ил)-3,6-дигидро-2Н-пиридин-1-ил]этанона;
соединения № 118: 4-[2-оксо-2-(4-тиено[3,2-c]пиридин-4-ил-3,6-дигидро-2Н-пиридин-1-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 119: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-ил]этанона;
соединения № 120: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-{(2S,6R)-2,6-диметил-4-[5-(2-метил-2Н-тетразол-5-ил)пиридин-2-ил]пиперазин-1-ил}этанона;
соединения № 121: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(4-хинолин-2-ил-3,6-дигидро-2Н-пиридин-1-ил)этанона;
соединения № 122: 4-[2-оксо-2-(4-хинолин-2-ил-3,6-дигидро-2Н-пиридин-1-ил)этил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-она;
соединения № 123: 1-(4-хинолин-2-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[8-(5-трифторметилпиридин-2-ил)-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 124: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-{8-[5-(1-метил-1Н-тетразол-5-ил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]окт-3-ил]этанона;
соединения № 125: 1-(4-бензофуран-7-ил-3,6-дигидро-2Н-пиридин-1-ил)-2-[(2S,6R)-4-(5-метансульфонилпиридин-2-ил)-2,6-диметилпиперазин-1-ил]этанона;
или его аддитивная соль с фармацевтически приемлемой кислотой.
7. Способ получения соединения формулы (I) по любому из пп.1-6, отличающийся тем, что подвергают взаимодействию соединение формулы (II)
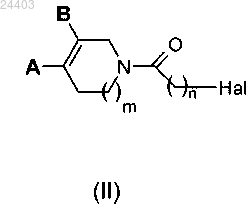
где А, В, m и n определены в любом из пп.1-6 и Hal представляет атом галогена, с соединением общей формулы (III)
H-W-R2 (III)
где W и R2 определены в любом из пп.1-6.
8. Лекарственное средство для лечения и профилактики нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга и черепа, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-6 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой.
9. Фармацевтическая композиция для лечения и профилактики нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга и черепа, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-6 или его фармацевтически приемлемую соль, а также по меньшей мере один фармацевтически приемлемый эксципиент.
10. Применение соединения по любому из пп.1-6 в качестве лекарственного средства для лечения и профилактики нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга и черепа, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
11. Применение соединения по любому из пп.1-6 для получения лекарственного средства, предназначенного для профилактики или лечения нейродегенеративных заболеваний центральной и периферической нервной системы, эпилепсии, синдрома Дауна, прионных заболеваний, амнезии, шизофрении, депрессии, биполярного расстройства, сердечно-сосудистых заболеваний, поражений зрительного нерва и сетчатки, пигментной дистрофии сетчатки, глаукомы, ишемии сетчатки, макулярной дистрофии, травм спинного мозга и черепа, атеросклероза, стенозов, нарушений рубцевания ран, алопеции, панкреатита, фиброза печени, раковых заболеваний, расстройств дыхательных путей, аллергии, кожной, соматической, висцеральной и неврологической боли, невропатических и воспалительных хронических болей, аутоиммунных заболеваний, переломов костей, костных заболеваний.
12. Применение по п.11, в котором лекарственное средство обладает способностью ингибировать димеризацию рецептора нейротрофинов p75NTR независимо от своего лиганда.
Текст
ПРОИЗВОДНЫЕ (ГЕТЕРОЦИКЛОТЕТРАГИДРОПИРИДИН)(ПИПЕРАЗИНИЛ)-1 АЛКАНОНА И (ГЕТЕРОЦИКЛОДИГИДРОПИРРОЛИДИН)(ПИПЕРАЗИНИЛ)-1 АЛКАНОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЦЕПТОРА Р 75NTR где А, В, m, W, n и R2 являются такими, как определено в п.1, а также к способу их получения и к применению их в терапии. Настоящее изобретение относится к производным (гетероциклотетрагидропиридин)(пиперазинил)1-алканона и (гетероциклодигидропирролидин)(пиперазинил)-1-алканона, способа их получения и применения их в терапии. Соединения согласно изобретению обладают аффинностью в отношении p75NTR рецептора нейротрофинов. Нейротрофины принадлежат к семейству белков, биологическая роль которых заключается в обеспечении выживаемости и дифференцировки клеток. Рецептор p75NTR, который является рецептором всех нейротрофинов, представляет собой трансмембранный гликопротеин и относится к семейству рецепторов фактора некроза опухоли (TNF, Tumor Necrosis Factor) (W.J.Friedman et L.A.Greene, Exp. Cell. Res., 1999, 253, 131-142). Рецептор p75NTR эксперессируется в клетках разного типа и выполняет многочисленные биологические функции: с одной стороны,модулирует сродство нейротрофинов к рецепторам тирозинкиназ (trk); с другой стороны, в отсутствиеtrk, индуцирует сигнал гибели клеток путем апоптоза. Кроме того, предшественники нейротрофинов пронейротрофины - способны связываться с высокой аффинностью с p75NTR и рассматриваются как мощные индукторы p75NTR-зависимого апоптоза в нейронах и в некоторых клеточных линиях. Что касается центральной нервной системы, то многочисленные работы показывают, что апоптоз участвует во многих патологических процессах, таких как боковой амиотрофический склероз, рассеянный склероз, болезни Альцгеймера, Паркинсона и Хантингтона, а также прионные заболевания. P75NTR известен также тем, что может суперэкспрессироваться при различных типах нейродегенеративных заболеваний, таких как болезнь Альцгеймера и боковой амиотрофический склероз (ALS) (Longo F.M. et al.,Curr. Alzheimer Res. 2007; 4; 503-506; Lowry K.S. et al., Amyotroph. Lateral. Scler. Other. Motor. Neuron.Disord. 2001; 2:127-34). Результаты дают возможность предположить, что p75NTR может играть главенствующую роль в механизмах, приводящих к гибели нейронов путем постишемического апоптоза (P.P.Roux et al., J. Neurosci.,1999, 19, 6887-6896). Результаты (V.Della-Bianca et al., J.Biol. Chem., 2001, 276:38029-33), (S.Rabizadeh et al., Proc. Natl.Acad. Sci. USA, 1994, 91, 10703-10706) подтверждают гипотезу, согласно которой p75NTR по-видимому играет важную роль в гибели нейронов, индуцированной инфекционным прионным белком (губкообразная трансмиссивная энцефалопатия) или бета-амилоидным белком (болезнь Альцгеймера). Кроме того, рецептор p75NTR ассоциируется с рецептором Hogo и участвует в передаче ингибирующих сигналов этих белков миелина в отношении роста аксонов. В связи с этим, рецептор p75NTR играет главную роль в регуляции пластичности нейронов и во взаимодействии нейроны-глии, представляя собой, таким образом, мишень терапии выбора для стимулирования нервной регенерации. Помимо нервной системы и нейродегенеративных заболеваний предполагается, что p75NTR может играть роль в сердечно-сосудистых заболеваниях, таких как атеросклероз и ишемия миокарда(М.L.Bochaton-Pialat et al., Am. J. Pathol., 1995, 146, 1-6; H.Perlman, Circulation, 1997, 95, 981-987). Последние работы показывают увеличение экспрессии p75NTR и нейротрофинов, а также массивный апоптоз в местах атеросклеротических повреждений. Несколько экспериментов указывают также на то, что p75NTR является медиатором воспаления (RihiP75NTR описан также как рецептор, играющий важную роль в формировании воспалительной боли. Так, повреждение нерва, по-видимому, селективно увеличивает экспрессию и аксональный транспортp75NTR, участвующего в возникновении невропатической боли. Кроме того, использование специфического антитела против p75NTR или антисмыслового олигодеоксинуклеотида, способного блокировать активность рецептора in vivo, по-видимому, способствует реверсии невропатической боли (гипералгезия на тепло и холод и механическая аллодиния), индуцируемой у крысы после поражения спинального нерваL5 (Obata К. et al., J. Neurosci. 2006; 26:11974-11986). Антитело, нейтрализующее анти-p75NTR, в значительной степени восстанавливает воспалительную боль, возникающую после инъекции адъюванта в свод стопы мыши, а также в мышиную краш-модель с седалищным нервом (Watanabe T. et al., J.Neurosci. Res. 2008; 86:3566-357; Fukui Y. et al., J Orthop Res. 2010; 28(3):279-83). Экспрессия p75NTR описана также при хроническом панкреатите с вовлечением в апоптозный процесс экзокринной и эндокринной частей поджелудочной железы (Zhu Z. et al., Dig. Dis. Sci. 2003; 48(4):717-25) . Другие публикации также сообщают о важной роли p75NTR в развитии фиброза печени (Kendall T.J.P75NTR играет также критическую роль в биологии опухолей. Известно много соединений, которые могут взаимодействовать с системой trkA/NGF/p75NTR или обладают NGF-подобной активностью (фактор роста нервов). Так, в заявке на патент WO 00/59893 описаны производные замещенных пиримидинов, которые обладают NGF-подобной активностью и/или увеличивают активность NGF в отношении РС 12 клеток. Настоящее изобретение относится к соединениям, отвечающим формуле (I)m представляет 0 или 1; А представляет конденсированную гетероциклическую группу формулы (Y) и В представляет атом водорода или А представляет атом водорода и В представляет конденсированную гетероциклическую группу формулы (Y) причем конденсированный гетероцикл формулы Y может быть соединен с остатком молекулы через любой из имеющихся атомов углерода, гдеU дополняет либо 6-членный цикл, ароматический или насыщенный, содержащий 1 или 2 атома азота, причем цикл может быть замещен одним или двумя атомами галогена, одной или двумя группами (С 1-С 4)алкил или (С 1-С 4)алкокси, одним или двумя перфторалкилами; либо 5-членый цикл, ароматический или насыщенный, содержащий один атом азота, кислорода или серы, причем цикл может быть замещен одним или двумя (С 1-С 4)алкилами;X и X1 представляют СН или N;R и R1, находящиеся в одном из незанятых положений, представляют независимо атом водорода,атом галогена, (С 1-С 4)алкил, (С 1-С 4)алкокси, перфторалкил, трифторметокси, циано, СООН, СООалкил,CONR3R4 или NHCOR3; где R5 и R6, находящиеся в одном из незанятых положений, представляют независимо атом водорода, атом галогена, (С 1-С 4)алкил, (С 1-С 4)алкокси, трифторметил, трифторметокси, циано, СООН, СООалкил, СООциклоалкил, SOалкил, SO2 алкил, CONR3R4, NR3R4 или NHCOR3; или один из R5 и R6 может также представлять гетероцикл, выбранный изZ представляет атом кислорода или серы;R3 и R4 представляют водород или С 1-С 6 алкил. Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиоме-2 024403 ры, диастереоизомеры, а также их смеси, включая рацемические, составляют часть изобретения. Соединения формулы (I) могут существовать в форме оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть изобретения. Эти соли могут быть получены с фармацевтически приемлемыми кислотами, но соли с другими кислотами, пригодными, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. В объеме настоящего изобретения подразумевают под атомом галогена - фтор, хлор, бром или йод; алкилом - алифатическую насыщенную группу, линейную или разветвленную; в качестве примеров можно назвать (С 1-С 4)алкил, который может представлять собой метил, этил, пропил, изопропил, бутил,изобутил или трет-бутил; фторалкилом - алкильную группу, в которой один или несколько атомов водорода заменены атомом фтора; перфторалкилом - алкильную группу, в которой все атомы водорода заменены атомом фтора, например, трифторалкил; алкокси - радикал-О-алкил, в котором алкил является таким, как описано выше; перфторалкокси - алкоксигруппу, в которой все атомы водорода заменены атомом фтора, например трифторалкокси; циклоалкилом - циклическую алкильную группу. В качестве примеров можно назвать циклопропил,метилциклопропил, циклобутил, циклопентил, циклогексил и т.д. Среди соединений формулы (I) согласно изобретению другую группу соединений составляют соединения формулы (I), гдеm представляет 0 или 1; и/или А представляет конденсированную гетероциклическую группу формулы (Y) и В представляет атом водорода; или А представляет атом водорода,и В представляет конденсированную гетероциклическую группу формулы (Y) при этом конденсированный гетероцикл формулы Y может быть связан с остатком молекулы через любой из атомов углерода, имеющихся в бензольном кольце;U дополняет либо 6-членный цикл, ароматический или насыщенный, содержащий 1 или 2 атома азота, причем цикл может быть замещен одним или двумя атомами галогена, одной или двумя группами (С 1-С 4)алкил или (С 1-С 4)алкокси, одним или двумя перфторалкилами; либо 5-членый цикл, ароматический или насыщенный, содержащий один атом азота, кислорода или серы, причем цикл может быть замещен одним или двумя (С 1-С 4)алкилами; и/или X и X1 представляют СН или N; и/или R и R1, находящиеся в одном из незанятых положений, представляют независимо атом водорода, атом галогена, (С 1-С 4)алкил, СООалкил; и/или -W- является азотсодержащим гетероциклом, выбранным изR5 и R6, находящиеся в одном из незанятых положений, представляют независимо атом галогена,трифторметил, СООН, СООалкил или СООциклоалкил; или один из R5 и R6 может также представлять гетероцикл, выбранный изZ представляет атом кислорода или серы; и/или R3 и R4 представляет водород или метил. Среди соединений формулы (I) согласно изобретению можно назвать следующие соединения: в форме основания или кислотно-аддитивной соли. В дальнейшем описании под выражением "защитная группа Pg" понимают группу, которая позволяет, с одной стороны, защитить реакционноспособную функциональную группу, такую как гидроксильная или аминогруппа, в процессе синтеза и, с другой стороны, регенерировать сохранившуюся реакционноспособную функциональную группу в конце синтеза. Примеры защитных групп, а также способы введения и удаления защитных групп приведены в книге Protective Groups in Organic Synthesis, Green etal., 2nd Edition (John WileySons, Inc., New York). В соответствии с изобретением соединения общей формулы (I) можно получить согласно следующему способу: Схема 1 Более конкретно, способ получения соединений общей формулы (I), где А, В, m, n, W и R2 определены выше, включает взаимодействие соединения формулы (II)Hal представляет атом галогена, например, хлора, с соединением общей формулы (III) где W и R2 являются такими, как определено в общей формуле (I), согласно методам, известным специалисту в данной области, например, в присутствии основания, в растворителе, таком как описано в заявке WO 03/104225. Так, в качестве основания можно назвать органические основания, такие как триэтиламин, N,N-диизопропиламин, диизопропилэтиламин (DPEA) или N-метилморфолин, или карбонаты или бикарбонаты щелочного металла, такие как карбонат калия, карбонат натрия или бикарбонат натрия,и в отсутствие или в присутствии иодида щелочного металла, такого как иодид калия или иодид натрия. Реакцию проводят в растворителе, таком как ацетонитрил, N,N-диметилформамид (ДМФА), Nметилпирролидон, толуол или пропан-2-ол, и при температуре от комнатной до температуры кипения растворителя с обратным холодильником. Под комнатной температурой понимают температуру от 5 до 25 С. Например, реакцию можно осуществить в присутствии бикарбоната натрия, иодида натрия в растворителе, таком как ДМФА. Эти же реакции можно осуществить также и в микроволновом реакторе. В полученных таким образом соединениях заместители R, R1, R3, R4, R5 и R7 могут быть модифицированы способами, широко используемыми в данной области, такими как, например, гидролиз сложноэфирной группы, с получением карбоксильной группы, или цианогруппы, с получением тетразольной группы. Как правило, кислотно-аддитивные соли соединений общей формулы (I) можно получить путем добавления соответствующей кислоты, такой как хлористоводородная кислота, бромистоводородная кислота или щавелевая кислота. Соединения формулы (III), необязательно в форме солей, могут быть получены, исходя из соответствующих соединений формулы (VIII) где W и R2 являются такими, как определено в формуле (I), и Pg представляет защитную группу атома азота W. Предпочтительно Pg является бензильной группой, и удаление защитной группы осуществляют согласно классическим способам, хорошо известным в данной области, например, каталитическим гидрированием на катализаторе Pd/C или обработкой хлорформиатами с последующим гидролизом в кислой среде. Соединения формулы (VIII) могут быть получены, исходя из соединений формулы (VI) где Pg, W, R2 являются такими, как определено выше, и Hal представляет атом галогена, предпочтительно, хлора. Эту реакцию обычно осуществляют в таких же условиях, как и реакцию получения соединений общей формулы (I), исходя из соединений формулы (II) и (III). Альтернативно, соединения формулы (VIII) могут быть получены реакцией сочетания Бухвальда в присутствии палладиевого катализатора и надлежащим образом выбранного фосфина, используя в качестве растворителя инертные растворители, такие как толуол или ксилол, при температуре от комнатной температуры до 110 С. В полученных таким образом соединениях общей формулы (VIII) R7 и R8 могут быть модифицированы способами, широко используемыми в данной области, такими как, например, получение оксадиазольной группы из цианогруппы, или путем образования промежуточного боронового соединения и сочетания по Сузуки, как описано на схеме, представленной ниже. На представленной выше схеме 2 символ L представляет уходящую группу, такую как йод, бром или трифторметансульфонат, R7 представляет гетероциклы, такие как определено в общей формуле (I),R8 является таким, как определено в общей формуле (I), и В является атомом бора. Примеры таких реакций описаны в экспериментальной части описания. Соединения формулы (III), необязательно в форме солей, где W представляет оксопиперазин, коммерчески доступны или описаны в литературе, или могут быть получены из соответствующих соединений формулы (VIII) согласно способам, которые описаны или известны в данной области. Примеры таких способов получения описаны в экспериментальной части описания. Соединения формулы (II) могут быть получены взаимодействием соответствующего соединения формулы (IV) где Hal и n являются такими, как определено в формуле (II), и Hal' представляет атом галогена, одинаковый или отличающийся от Hal. Предпочтительно Hal' представляет атом хлора. Эту реакцию осуществляют обычно в присутствии основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, диоксан или смесь этих растворителей, при температуре от 0 С до комнатной температуры. Соединения формулы (V) обычно являются коммерчески доступными продуктами. При необходимости, способ согласно изобретению включает дальнейшую стадию, заключающуюся в выделении полученного целевого продукта. Продукты формул (IV), (V), (VI), (VII) и реагенты, способ получения которых не описан, являются коммерчески доступными или описаны в литературе, либо могут быть получены способами, которые описаны или известны в данной области. Альтернативно, соединения формулы (I) могут быть получены согласно следующему способу: Схема 3 Более конкретно, способ получения соединений общей формулы (I), где А, В, R2, m и n определены выше, включает взаимодействие соединения формулы (XIV) где R2, W и n являются такими, как определено в общей формуле (I), с соединением общей формулы (IV)(DPEA), и конденсирующего агента, такого как ВОР, DBU или DCC. Реакцию проводят при температуре от комнатной температуры до температуры кипения растворителя с обратным холодильником. Под комнатной температурой понимают температуру от 5 до 25 С. В качестве примера реакцию можно проводить в присутствии бикарбоната натрия, иодида натрия в растворителе, таком как ДМФА. Эти реакции могут также быть осуществлены в микроволновом реакторе. В соединениях общей формулы (I), полученных таким образом, R, R1, R3, R4, R5, R6, R7 и R8 могут быть модифицированы способами, широко используемыми в данной области, такими как, например,гидролиз сложноэфирной группы, с получением карбоксильной группы или цианогруппы, с получением тетразольной группы. Как правило, кислотно-аддитивные соли соединений общей формулы (I) можно получить путем добавления соответствующей кислоты, такой как хлористо-водородная кислота, бромисто-водородная кислота или щавелевая кислота. Соединения формулы (XIV) можно получить из соединений формулы (XIII) где R2, W и n являются такими, как определено в общей формуле (I), и Q представляет остаток,способный образовывать сложный эфир, такой как метил, этил или бензил, путем гидролиза сложноэфирной связи согласно способам, известным специалисту в данной области, например обработкой в кислой или щелочной среде или восстановлением в полярном растворителе, таком как спирт или ТГФ, в токе водорода. Соединения формулы (XIII) могут быть получены, исходя из соединений формулы (III) где Q представляет остаток, способный образовывать сложный эфир, такой как метил, этил или бензил, Hal представляет атом галогена, предпочтительно атом хлора, и n определен в общей формуле(I). Эту реакцию осуществляют обычно в присутствии основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в растворителе, таком как дихлорметан, хлороформ, тетрагидрофуран, диоксан или смесь указанных растворителей, при температуре от 0 С до комнатной температуры. Соединения формулы (XII) являются, как правило, коммерчески доступными. Соединения формулы (III), необязательно в форме солей, могут быть получены, исходя из соответствующих соединений формулы (VIII) где W и R2 являются такими, как определено в формуле (I), и Pg представляет защитную группу атома азота W. Предпочтительно Pg является бензильной группой, и удаление защитной группы осуществляют согласно классическим способам, хорошо известным в данной области, например каталитическим гидрированием на катализаторе Pd/C или обработкой хлорформиатами с последующим гидролизом в кислой среде. Соединения формулы (VIII) могут быть получены, исходя из соединений формулы (VI) где Pg, W, R2 являются такими, как определено выше, и Hal представляет атом галогена, предпочтительно хлора. Эту реакцию обычно осуществляют в таких же условиях, как и реакцию получения соединений общей формулы (I), исходя из соединений формулы (II) и (III). Альтернативно, соединения формулы (VIII) могут быть получены реакцией сочетания Бухвальда в присутствии палладиевого катализатора и надлежащим образом выбранного фосфина, используя в качестве растворителя инертные растворители, такие как толуол или ксилол, при температуре от комнатной температуры до 110 С. В полученных таким образом соединениях общей формулы (VIII) R7 и R8 могут быть модифицированы способами, широко используемыми в данной области, такими как, например, получение оксадиазольной группы из цианогруппы, или используя реакции сочетания по Сузуки, описанные на схеме 2,представленной выше. Соединения формулы (III), необязательно в форме солей, где W является оксопиперазином, коммерчески доступны или описаны в литературе, или могут быть получены из соответствующих соединений формулы (VII) в соответствии со способами, которые описаны или известны в данной области. Примеры таких способов получения описаны в экспериментальной части описания. При необходимости, способ согласно изобретению включает дальнейшую стадию, заключающуюся в выделении полученного целевого продукта. Продукты формул (IV), (VI), (VII), (XII) и реагенты, способ получения которых не описан, являются коммерчески доступными или описаны в литературе, либо могут быть получены способами, которые описаны или известны в данной области. Примеры таких способов получения описаны в экспериментальной части описания. Следующие примеры описывают получение некоторых соединений согласно изобретению. Эти примеры не являются ограничивающими и служат только для иллюстрации настоящего изобретения. Номера соединений, полученных согласно примерам, соответствуют номерам, приведенным в таблице,представленной ниже, эта таблица иллюстрирует химическую структуру и физические характеристики некоторых соединений согласно изобретению. Физико-химические измерения были проведены следующим образом: Температуру плавления измеряли на приборе Buchi B540. Спектры ядерно-магнитного резонанса протона (ЯМР 1 Н) регистрировали в следующих условиях:a) при 500 МГц на приборе Bruker, оснащенном консолью Avance III;b) при 400 МГц на приборе Bruker, оснащенном консолью Avance I; Химические сдвиги выражены в м.д. относительно частоты TMS. Спектры были сняты в следующих температурных условиях: Температура А: 40 С Температура В: 30 С Сокращения, используемые при характеристике сигналов, следующие: с = синглет, шир.с = широкий синглет, м мультиплет, шир.м = широкий мультиплет, д. = дублет, шир.д. = широкий дублет, т. = триплет, к. = квадруплет.= неинтегрируемый сигнал из-за интерференции с широким пиком, обусловленным водой.= неинтегрируемый сигнал из-за интерференции с широким пиком, обусловленным растворителем ЯМР. 2s = два частично наложенных синглета. 2bs = два частично наложенных широких синглета. 2m = два частично наложенных широких мультиплета. Соединения анализировали комбинацией методов ВЭЖХ-УФ-МС (жидкостная хроматорграфияУФ-детектирование и детектирование массы). Используемый прибор представлял собой хроматографическую систему Thermo Surveyor, в которую входит детектор с диодной матрицей Thermo и масс-спектрометр Thermo Deca XPMax с ионной ловушкой. Условия для проведения анализов были следующие: Условия ВЭЖХ Использовали различные условия ВЭЖХ в зависимости от соединений: Температура колонки: не контролируется Скорость потока: 0,3 мл/мин Детектирование: =220 нм Способ С. Элюент A: AcONH4 5 мМ с рН 6,5 Элюент В: CH3CN Градиент: Температура колонки: не контролируется Скорость потока: 0,3 мл/мин Детектирование: =220 нм Способ D. Элюент A: AcONH4 5 мМ с рН 6,5 Элюент В: CH3CN Градиент: Температура колонки: не контролируется Скорость потока: 0,3 мл/мин Температура колонки: не контролируется Скорость потока: 0,3 мл/мин Детектирование: =220 нм Способ G. Элюент A: AcONH4 5 мМ с рН 6,5 Элюент В: CH3CN Градиент: Температура колонки: не контролируется Скорость потока: 0,3 мл/мин Детектирование: =220 нм Способ Н. Элюент A: H2O+TFA 0,05% Элюент В: CH3CN+TFA 0,035% Градиент: Температура колонки: 40 С Скорость потока: 0,5 мл/мин Детектирование: =220 нм Используемыми колонками являются колонки С 18 с размером зерен от 2 до 5 мкм, предпочтительно 3,5 мкм. Условия масс-спектрометрии Регистрирование масс-спектров осуществляли методом электрораспыления (ESI) в режиме положительных или отрицательных ионов для контроля ионов, выходящих после протонирования анализируемых соединений (МН+ или МН-) или после образования аддуктов с другими катионами, таким как Na+,K+ и т.д. Хроматография в тонком слое осуществляли на ТСХ пластинах из силикагеля Merk Silica gel 60. Силикагель для колоночной флэш-хроматографии выпускается в продажу компанией Biotage или Superelco. Все используемые растворители имели степень реагентной чистоты или чистоты "для хроматографии". Получение 1. (3R,5S)-3,5-диметил-1-(5-трифторметилпиридин-2-ил)пиперазин Загружали 0,8 г 2-хлор-5-(трифторметил)пиридина (соединение формулы (VII, 0,5 г цис-2,6 диметилпиперазина (соединение формулы (VI, 0,67 г карбоната калия и 0,3 г NaI в 8 мл ДМФА. Реакцию проводили в микроволновом реакторе CEMdiscover в течение 30 мин при 160 С. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,1 г маслянистого вещества, соответствующего продукту, указанному в заголовке. Получение 2. (3R,5S)-2,5-диметил-1-(5-трифторметилпиридин-2-ил)пиперазин Работали согласно методике, описанной в получении 1, но использовали транс-2,5 диметилпиперазин вместо цис-2,6-диметилпиперазина и получали указанное в заголовке соединение в виде маслянистого вещества. Получение 3. Гидрохлорид 2-[8-(5-фторпиримидин-2-ил)]-3,8-диазабицикло[3.2.1]октана Загружали 1,44 г 2-хлор-5-фторпиримидина (соединение формулы (VII, 2,2 г 1-бензил-3,8 диазабицикло[3.2.1]октана (соединение формулы (VI, 1,7 г карбоната калия и 0,7 3 г NaI в 27 мл Nметилпирролидона. Нагревали при 110 С в течение 5 ч. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 3,2 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 95/этилацетат 5. Выделяли 1,4 г белого твердого вещества, которое растворяли в 35 мл 1,2-дихлорэтана. Прибавляли при 0 С 0,72 мл 1 хлорэтилхлорформиата и перемешивали в токе азота в течение 10 мин при 0 С, а затем в течение 3 ч при 85 С. Растворитель выпаривали и прибавляли 35 мл метанола. Нагревали в течение 30 мин при температуре кипения с обратным холодильником. Выпаривали растворитель и остаток обрабатывали изопропанолом. Получали белое твердое вещество, которое отфильтровывали и получали 900 мг продукта, указанного в заголовке. Т.пл. 236-239 С. Получение 4. (3R,5S)-3,5-диметил-1-(6-трифторметилпиридин-2-ил)пиперазин Загружали 2,2 г 2-трифторметил-5-бромпиридина (соединение формулы (VII, 1,1 г цис-2,6 диметилпиперазина (соединение формулы (VI, 0,22 г ацетата палладия, 0,28 г трет-бутоксида натрия и 1,3 г три-трет-бутилфосфина в 16 мл о-ксилола. Нагревали при 120 С в течение 6 ч. Фильтровали через целит и выпаривали растворитель. Получали 1,8 г маслянистого продукта, соответствующего указанному в заголовке соединению. Получение 5. Гидрохлорид метилового эфира 3,8-диазабицикло[3.2.1]окт-8-ил никотиновой кислоты Загружали 0,42 г метил-6-хлорникотината (соединение формулы (VII, 0,5 г 1-бензил-3,8 диазабицикло[3.2.1]октана (соединение формулы (VI, 0,4 г карбоната калия и 0,17 г NaI в 7 мл Nметилпирролидона. Нагревали в течение 7 ч при 110 С. Затем выливали в насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,1 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 8/этилацетат 2. Выделяли 520 мг светлого масла. Продукт, полученный на предыдущей стадии, в 20 мл этанола, 2 мл изопропанола/HCl гидрировали при 40 С при атмосферном давлении в течение 2 ч в присутствии 0,22 г 10%-го Pd/C. Фильтровали,выпаривали в вакууме и выделяли 440 мг продукта, указанного в заголовке, в виде белого твердого вещества, соответствующего указанному в заголовке соединению. Получение 6. Гидрохлорид 1-(5-трифторметилпиридин-2-ил)пиперазин-2-она Нагревали в колбе при 135 С в течение 6 ч 10 г 2-хлор-5-(трифторметил)пиридина и 40,5 мл Nбензилэтилендиамина. Выливали в воду и экстрагировали этилацетатом. Сушили и выпаривали в вакууме; полученный неочищенный продукт очищали флэш-хроматографией. Выделенный продукт (соединение формулы (VIII (14 г) солюбилизировали в 200 мл 2 н. раствора HCl. Прибавляли 30 г тримерного дигидрата глиоксаля и перемешивали при комнатной температуре в течение 72 ч. Экстрагировали этилацетатом. Сушили и выпаривали в вакууме; полученный неочищенный продукт очищали флэшхроматографией. Выделенный продукт (10 г) солюбилизировали в 450 мл этанола, затем добавляли 15 мл насыщенного HCl раствора изопропанола и 3 г 10%-го Pd/C. Осуществляли реакцию в токе водорода в течение 4 ч при температуре 40 С. Фильтровали, выпаривали в вакууме и получали 3 г указанного в заголовке продукта. Т.пл. 205-207 С. Получение 7. 2-Хлор-1-(2-фенил-6,7-дигидро-4 Н-тиазоло[4,5-с]пиридин-5-ил)этанон Стадия а) получения 1-(трет-бутоксикарбонил)-4-(7-бензо(b)тиофен)-4-гидроксипиперидина Растворяли в 135 мл ТГФ 45 г 7-бромбензотиофена и полученный раствор прибавляли по каплям к суспензии 5,13 г магния в 10 мл ТГФ, находящейся в колбе в атмосфере азота. Прибавляли йод в каталитическом количестве и нагревали при температуре кипения с обратным холодильником в течение 3 ч. Охлаждали до комнатной температуры и добавляли раствор 36 г 1-(трет-бутоксикарбонил)-4-пиперидона в 80 мл ТГФ. Перемешивали в течение 3 ч при комнатной температуре и прибавляли насыщенный раствор хлорида аммония. Экстрагировали этилацетатом. Сушили и выпаривали в вакууме; полученный неочищенный продукт очищали флэш-хроматографией с использованием элюента: гексан 95/этилацетат 5. Выделяли 47,5 г белого твердого вещества с температурой плавления 130-131 С. Стадия b) получения гидрохлорида 4-(7-бензо(b)тиофен)-4-гидроксипиперидина Растворяли в 650 мл этилацетата 40 г продукта, полученного на стадии а). Медленно прибавляли 88 мл 37% HCl и перемешивали при комнатной температуре в течение 30 мин. Выпаривали растворители и остаток обрабатывали ацетоном. Фильтровали и получали 34 г белого твердого вещества с температурой плавления 232-233 С. Стадия с) получения гидрохлорида 4-(7-бензо(b)тиофен)-1,2,3,6-терагидропиридина Растворяли в 437 мл уксусной кислоты 34 г продукта, полученного на стадии b). Прибавляли 20 мл 96% сульфоновой кислоты и нагревали при температуре 60 С в течение 2 ч. Выливали в смесь воды и льда и устанавливали щелочной рН с помощью 40%-ого NaHCO3. Экстрагировали этилацетатом. Сушили, выпаривали в вакууме и получали 30 г продукта в виде маслянистого вещества. Образование гидрохлорида в изопропаноле осуществляли с помощью раствора изопропанола, насыщенного HCl. Фильтровали и получали 25,8 г белого твердого вещества с температурой плавления 226227 С. Стадия d) получения 2-хлор-1-(2-фенил-6,7-дигидро-4 Н-тиазоло[4,5-с]пиридин-5-ил)этанона В колбе, снабженной магнитной мешалкой, суспендировали 2,8 г продукта, полученного на стадии с), в 50 мл дихлорметана. Прибавляли 2,8 мл триэтиламина и доводили температуру до 0 С. При температуре 0 С добавляли по каплям 1,5 мл хлорацетилхлорида, т.е. соединение общей формулы (V), гдеHal=Hal'=Cl и n=1. Осуществляли реакцию в течение 1 ч 30 мин и выливали в воду. Экстрагировали дихлорметаном. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 4,1 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 9/этилацетат 1. Выделяли 1,1 мг продукта, указанного в заголовке, в виде светлого маслянистого вещества. Получение 8. 1-(4-Бензофуран-7-ил)-3,6-дигидро-2 Н-пиридин-1-ил)-2-хлорэтанон Работали согласно методике, описанной в получении 1, но используя 7-бромбензофуран вместо 7 бромбензотиофена, и получали указанное в заголовке соединение. Получение 9. 1-(5-Бензофуран-7-ил)-3,6-дигидро-2 Н-пиридин-1-ил)-2-хлорэтанон Работали согласно методике, описанной в получении 1, но используя 7-бромбензофуран вместо 7 бромбензотиофена и 1-(трет-бутоксикарбонил)-3-пиперидон вместо 1-(трет-бутоксикарбонил)-4 пиперидона, и получали указанное в заголовке соединение. Получение 10. Метиловый эфир 5-[1-(2-хлорацетал)-1,2,3,6-тетрагидропиридин-4-ил]бензо[b]тиофен-3-карбоновой кислоты Стадия а) получения трет-бутилового эфира 4-(2-метоксикарбонилбензо[b]тиофен-5-ил)-3,6 дигидро-2 Н-пиридин-1-карбоновой кислоты Загружали в колбу в токе азота 1,1 г трет-бутилового эфира 4-(4,4,5,5-тетраме- 23024403 тил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (чистота 70%), 0,7 г метилового эфира 5-бромбензо[b]тиофен-2-карбоновой кислоты, 0,15 г палладий-тетракис(PdP(Ph3)4), 5,5 мл 2 М раствора карбоната натрия, 0,42 г хлорида лития и 30 мл ДМЭ. Нагревали при температуре кипения с обратным холодильником в течение 3 ч. Выпаривали растворитель и растворяли в 35 мл этилацетата. Промывали 2 М раствором карбоната натрия. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,6 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 98/этилацетат 2. Выделяли 0,45 г желтоватого твердого вещества. Стадия b) получения гидрохлорида метилового эфира 5-(1,2,3,6-тетрагидропиридин-4 ил)бензо[b]тиофен-2-карбоновой кислоты Растворяли в 25 мл этилового эфира 0,45 г продукта, полученного на стадии а). Медленно прибавляли 50 мл раствора этилацетата, насыщенного HCl, и перемешивали при комнатной температуре в течение 3 ч. Выпаривали растворители и остаток обрабатывали ацетоном. Фильтровали и получали 0,35 г не совсем белого твердого вещества. Стадия с) получения метилового эфира 5-[1-(2-хлорацетал)-1,2,3,6-тетрагидропиридин-4 ил]бензо[b]тиофен-3-карбоновой кислоты Работали согласно методике, описанной на стадии d) получения 7, но использовали продукт, полученный на стадии b) вместо продукта, полученного на стадии с) получения 7, и получали 0,4 г продукта,указанного в заголовке, в виде светлого масла. Получение 11. 2-Хлор-1-(4-хинолин-8-ил-3,6-дигидро-2 Н-пиридин-1-ил)этанон Работали согласно методике, описанной в получении 10, но использовали 8-бромхинолин вместо метилового эфира 5-бромбензо[b]тиофен-2-карбоновой кислоты и получали указанное в заголовке соединение. Получение 12. 2-Хлор-1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2 Н-пиридин-1-ил]этанон Работали согласно методике, описанной в получении 1, но использовали 6-бромбензодиоксан вместо 7-бромбензотиофена, и получали указанное в заголовке соединение. Получение 13 1-(3-бензофуран-7-ил-2,5-дигидропиррол-1-ил)-2-хлорэтанон Работали согласно методике, описанной в получении 7, но использовали 1-(трет-бутоксикарбонил)3-пирролидон вместо 1-(трет-бутоксикарбонил)-4-пиперидона и 7-бромбензофуран вместо 7 бромбензотиофена, и получали указанное в заголовке соединение. Получение 14. Метиловый эфир 6-3S,5R)-3,5-диметилпиперазин-1-ил)никотиновой кислоты Работали согласно методике, описанной в получении 1, но использовали метиловый эфир 6 хлорникотиновой кислоты вместо 2-трифторметил-5-бромпиридина и получали указанное в заголовке соединение в виде светлого масла. Получение 15. Гидрохлорид 3-[6-(3,8-диазабицикло[3.2.1]окт-8-ил)пиридин-3-ил]-4 Н-[1,2,4]оксадиазол-5-она Стадия а): гидрохлорид 6-(3,8-диазабицикло[3.2.1]окт-8-ил)никотинонитрила Работали согласно методике, описанной в получении 3, но использовали 6-хлорникотинонитрил вместо 2-хлор-5-фторпиримидина и получали указанное в заголовке соединение в виде белого твердого вещества. Стадия b): трет-бутиловый эфир 8-(5-цианопиридин-2-ил)-3,8-диазабицикло[3.2.1]октан-3 карбоновой кислоты Растворяли в 83 мл ДМФА 7 г продукта, полученного на стадии а). Прибавляли 11,7 мл триэтиамина. Прибавляли при 0 С 6,7 г (ВОС)2 О и перемешивали при комнатной температуре в течение 1 ч. Выпаривали в вакууме. Промывали водой и экстрагировали этилацетатом. Органический слой сушили надNa2SO4, фильтровали и выпаривали в вакууме. Выделяли 12 г маслянистого вещества, которое очищали флэш-хроматографией на автоматической колонке Biotage с использованием элюента циклогексан 8/этилацетат 2 с градиентом концентрации этилацетата до 100%. Выделяли 7,6 г указанного в заголовке соединения в виде белого твердого вещества. Стадия с): трет-бутиловый эфир 8-[5-(N-гидроксикарбамидоил)пиридин-2-ил]-3,8-диазабицикло[3.2.1]октан-3-карбоновой кислоты Растворяли продукт, полученный на стадии b) (7,6 г) в 7 5 мл этанола и прибавляли раствор 3,36 г хлоргидрата гидроксиламина в 38 мл воды, затем 5 г карбоната натрия. Перемешивали при 90 С в течение 4 ч. Охлаждали и фильтровали. Получали 8 г указанного в заголовке соединения в виде белого твердого вещества. Стадия d): трет-бутиловый эфир 8-[5-(5-оксо-4,5-дигидро[1,2,4]оксадиазол-3-ил)пиридин-2-ил]-3,8 диазабицикло[3.2.1]октан-3-карбоновой кислоты Загружали в колбу в токе азота 1 г соединения, полученного на стадии с), прибавляли 10 мл ДМФА и 0,3 мл пиридина. Прибавляли при 0 С 0,23 мл метилхлорформиата и перемешивали при комнатной температуре в течение 3 ч. Промывали водой и экстрагировали этилацетатом. Органический слой суши- 24024403 ли над Na2SO4, фильтровали и выпаривали в вакууме. Прибавляли 30 мл толуола и перемешивали при нагревании с обратным холодильником в течение 4 ч. Выпаривали растворитель и получали 0,8 г соединения, указанного в заголовке. Стадия е): гидрохлорид 3-[6-(3,8-диазабицикло[3.2.1]окт-8-ил)пиридин-3-ил]-4 Н-[1,2,4]оксадиазол 5-она Растворяли продукт в 20 мл этилацетата, прибавляли раствор этилацетата, насыщенный HCl, и перемешивали при комнатной температуре в течение 2 ч. Выпаривали растворитель и остаток обрабатывали изопропанолом. Фильтровали и получали 0,65 г указанного в заголовке соединения в виде желтого твердого вещества. Получение 16. [(2R,6S)-2,б-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]уксусная кислота Стадия а): этиловый эфир [(2R,6S)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1 ил]уксусной кислоты В колбу, снабженную магнитной мешалкой, загружали 3,6 г продукта, полученного в получении 1,100 мл ТГФ, 1,9 мл этилбромацетата, 4,7 мл триэтиламина. Осуществляли реакцию в течение 7 ч при 80 С. Выпаривали растворитель, промывали этиловым эфиром и фильтровали. Воду после фильтрования очищали флэш-хроматографией на автоматической колонке Biotage при градиентном элюировании от циклогексан 8/этилацетат 2 до этилацетат 7/метанол 3. Выделяли 2,5 г указанного в заголовке соединения в виде белого твердого вещества. Стадия b): [(2R,6S)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]уксусная кислота 2,5 г продукта, полученного на предыдущей стадии, солюбилизировали в 22 мл этанола, затем прибавляли 5 мл 40%-го водного раствора NaOH. Осуществляли реакцию в течение 3 ч при 70 С. Доводили рН до 6 1 н. раствором HCl. Экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 1,6 г продукта, указанного в заголовке, в виде белого твердого вещества. Получение 17. Гидрохлорид 2-(1,2,3,6-тетрагидропиридин-4-ил)хинолина Работали согласно методике, описанной в получении 10, но использовали хинолин-2-иловый эфир трифторметансульфоновой кислоты вместо метилового эфира 5-бромбензо[b]тиофен-2-карбоновой кислоты и получали указанное в заголовке соединение в виде белого твердого вещества. Получение 18. (3S,5R)-3,5-диметил-1-(5-тиазол-2-илпиридин-2-ил)пиперазин Стадия a): (3S,5R)-3,5-диметил-1-(5-йод-2-илпиридин-2-ил)пиперазин Работали согласно методике, описанной в получении 1, но использовали 2-фтор-5-иодпиридин вместо 2-хлор-5-(трифторметил)пиридина и получали указанное в заголовке соединение в виде масла. Стадия b): Трет-бутиловый эфир (2S,6R)-2,6-диметил-4-(5-иод-2-илпиридин-2-ил)пиперазин-1 карбоновой кислоты Загружали в токе азота при 0 С 0,35 г соединения, полученного на стадии а), 0,26 г (Вос)2 О, 0,46 мл триэтиламина и 5 мл ДМФА. Нагревали при температуре 140 С в течение 4 ч. Выпаривали растворитель. Выделяли 0,49 г неочищенного продукта. Остаток очищали флэш-хроматографией на колонке Biotage с использованием этилацетата в качестве элюента. Выделяли 0,43 г указанного в заголовке соединения в виде бледно-желтого масла. Стадия с): трет-бутиловый эфир (2S,6R)-2,6-диметил-4-[5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан 2-ил)пиридин-2-ил]пиперазин-1-карбоновой кислоты Загружали в колбу в токе азота 0,43 г соединения, полученного на стадии b), 0,29 г бис(пинаколят)дибора, 0,026 г палладия Cl2(dppf)2CH2Cl2, 0,31 г ацетата калия и 10 мл ДМСО. Нагревали при 85 С в течение 2 ч. Выливали в насыщенный водный раствор NaCl и экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 0,32 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 9/этилацетат 1. Выделяли 0,28 г желтоватого твердого вещества. Стадия d): трет-бутиловый эфир (2S,6R)-2,6-диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1 карбоновой кислоты Загружали в колбу в токе азота 0,28 г соединения, полученного на стадии с), 0,092 г 2-бромтиазола,0,032 г палладийтетракис(PdP(Ph3)4), 0,094 г бикарбоната натрия, 20 мл ДМЭ и 3 мл воды. Нагревали при температуре кипения с обратным холодильником в течение 7 ч. Выливали в насыщенный водный раствор NaCl и экстрагировали этилацетатом. Органический слой сушили над Na2SO4, фильтровали и выпаривали в вакууме. Выделяли 0,36 г маслянистого вещества, которое очищали флэш-хроматографией на колонке Biotage с использованием элюента циклогексан 9/этилацетат 1. Выделяли 0,2 г желтоватого масла. Стадия е): Трифторацетат (3S,5R)-3,5-диметил-1-(5-тиазол-2-илпиридин-2-ил)пиперазина Соединение, полученное на стадии d) (0,2 г), медленно растворяли в 5 мл трифторуксусной кислоты при 0 С. Затем оставляли при перемешивании в течение 2 ч при комнатной температуре. Выпаривали в вакууме трифторуксусную кислоту и получали 0,15 г указанного в заголовке соединения в виде бежевого твердого вещества. Получение 19. [3-оксо-4-(3-трифторметилфенил)пиперазин-1-ил]уксусная кислота Стадия а): Бензиловый эфир [3-оксо-4-(3-трифторметилфенил)пиперазин-1-ил]уксусной кислоты В колбу, снабженную магнитной мешалкой, загружали 1,12 г 1-(5-трифторметилпиридин-2 ил)пиперазин-2-она, 40 мл ТГФ, 0,87 мл бензилбромацетата, 1,5 мл триэтиламина. Осуществляли реакцию в токе азота в течение ночи при комнатной температуре. Выпаривали растворитель и очищали флэш-хроматографией на колонке Biotage с использованием элюента гексан 1/этилацетат 1. Выделяли 2,9 г продукта, указанного в заголовке, в виде белого твердого вещества. Стадия b): [3-оксо-4-(3-трифторметилфенил)пиперазин-1-ил]уксусная кислота 1 г продукта, полученного на предыдущей стадии, солюбилизировали в 150 мл этанола, затем прибавляли 0,15 г 10%-го Pd/C. Осуществляли реакцию в токе водорода в течение 4 ч при температуре 40 С. Фильтровали, выпаривали в вакууме и получали 0,74 г указанного в заголовке соединения в виде белого твердого вещества. Пример 1. Соединение 34: 1-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон Подвергают взаимодействие 0,18 г соединения, полученного в получении 8 (соединение формулы(II, 0,17 г соединения, полученного в получении 1 (соединение формулы (III, 0,1 г карбоната калия и 0,04 г NaI в 3 мл ДМФА. Реакцию проводят с использованием микроволновой печи CEMDiscover в течение 30 мин при 160 С. Выливают в воду и экстрагируют этилацетатом. Органический слой сушат надNa2SO4, фильтруют и выпаривают в вакууме. Выделяют 0,36 г маслянистого вещества. Очищают флэшхроматографией на колонке Biotage, элюируя смесью циклогексан 6/этилацетат 4. Выделяют 0,180 г бледно-желтого твердого вещества, которое кристаллизуют из этилового эфира. Фильтруют и получают 0,08 г продукта, указанного в заголовке, в виде белого твердого вещества. Т.пл.: (138-139)С ЯМР: (прибор b),(м.д., ДМСО-d6): 1,06 (м, 6 Н); 2,56-2,79 (м, 4 Н); 3,19 (м, ), 3,73 (м, 4 Н); 4,18 (м,3 Н); 4,31 (м, 1 Н); 6,57 (м, 1 Н); 6,95 (д, J=9,2 Гц, 1 Н); 6,99 (д, J=l,8 Гц, 1 Н); 7,27 (м, 2 Н); 7,58 (д, J=7,2 Гц,1 Н); 7,76 (дд, J=9,2 и 2,2 Гц, 1 Н); 8,01 (д, J=1,7 Гц, 1 Н); 8,39 (шир.с, 1 Н). Пример 2. Соединение 4: 1-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил 4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон и его оксалат Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 7, вместо соединения, полученного в получении 8, и получают указанное в заголовке соединение. Растворяют в ацетоне, прибавляют раствор щавелевой кислоты в ацетоне и получают оксалат в виде белого твердого вещества. Т.пл.: (60-61)С ЯМР: (прибор b),(м.д., ДМСО-d6): 1,17 (м, 6 Н) , 2,60 + 2,68 (2 м, 2 Н); 2,97 (м, ); 3,36 (м, ); 3,76(м, ); 4,00 (м, ); 4,14-4,43 (м, ); 6,30 (шир.с, 1 Н); 7,03 (д, J=9,0 Гц, 1 Н); 7,32 (д, J=7,l Гц, 1 Н) ; 7,42 (т,J=7,6 Гц, 1 Н); 7,51 (d, J=5,3 Гц, 1 Н); 7,77 (д, J=5,5 Гц, 1 Н); 7,83 (м, 2 Н); 8,43 (шир.с, 1 Н). Пример 3. Соединение 14: 1-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[(2R,5S)-2,5-диметил-4(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон и его оксалат Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 2, вместо соединения, полученного в получении 1, и получают указанное в заголовке соединение. Растворяют в ацетоне, прибавляют раствор щавелевой кислоты в ацетоне и получают оксалат в виде белого твердого вещества. Т.пл.: (130-131)С ЯМР: (прибор b),(м.д., ДМСО-d6): 1,02 (м, 3 Н) ; 1,15-1,32 (м, ЗН) ; 2,64 (м, 2 Н) ; 2,78 (м, 1 Н) ; 2,92(м, 1 Н) ; 2,90 (m, 1H); 3,26 (м, ); 3,34-3,67 (м, ); 3,66-3,99 (м, ); 4,07-4,54 (м, ); 4,64 (м, ); 6,58 (м, 1 Н); 6,90 (м, 1 Н) ; 6,98 (д, J= 1,9 Гц, 1 Н); 7,20-7,33 (м, 2 Н); 7,58 (д, J=7,2 Гц, 1 Н); 7,76 (м, 1 Н); 8,00 (д, J=l,8 Гц,1 Н); 8,39 (м, 1 Н). Пример 4. Соединение 69: Метиловый эфир 6-3-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)2-оксоэтил]-3,8-диазабицикло[3.2.1]окт-8-илникотиновой кислоты Подвергают взаимодействию 0,47 г соединения, полученного в получении 7 (соединение формулы(II, 0,45 г соединения, полученного в получении 5 (соединение формулы (III, 0,57 мл диизопропилэтиламина и 18 мл ДМФА. Нагревают в течение 3 ч при 100 С. Выливают в воду и экстрагируют этилацетатом. Органический слой сушат над Na2SO4, фильтруют и выпаривают в вакууме. Выделяют 0,58 г твердого вещества. Очищают флэш-хроматографией на колонке, которую элюируют смесью гексан 1/этилацетат 1. Выделяют 0,24 г продукта, указанного в заголовке. Обрабатывают диэтиловым эфиром,фильтруют и получают 0,21 г белого твердого вещества. Т.пл.: (153-154)С ЯМР: (прибор b),(м.д., ДМСО-d6): 1,87 (м, 2 Н), 1,98 (м, 2 Н); 2,40 (м, 2 Н); 2,56 (м, 1 Н); 2,71 (м,3 Н); 3,17 + 3,20 (2 с, 2 Н); 3,69-3,88 (м, 5 Н); 4,16 (с, 1 Н); 4,42 (с, 1 Н); 4,67 (шир.с, 2 Н); 6,29+6,32 (2 м,1 Н); 6,78 (м, 1 Н); 7,31 (д, J=7,2 Гц, 1 Н); 7,42 (т, J=7,6 Гц, 1 Н); 7,50 (д, J=54 Гц, 1 Н); 7,77 (д, J=5,3 Гц, 1 Н); 7,82 (д, J=7,5 Гц, 1 Н); 7,93 (д, J=8,7 Гц, 1 Н); 8,64 (шир.с, 1 Н). Пример 5. Соединение 36: 1-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[8-(5-фторпиримидин-2 ил)-3,8-диазабицикло[3.2.1]окт-3-илэтанон Работают согласно методике, описанной в примере 4, но используют соединение, полученное в получении 8, вместо соединения, полученного в получении 7, и соединение, полученное в получении 4,вместо соединения, полученного в получении 5, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (174-175)С ЯМР: (прибор а),(м.д., ДМСО-d6): 1,71-2,03 (м, 4 Н); 2,39 (м, 2 Н); 2,57-2,80 (м, 4 Н); 3,16+3,19 (2 с,2 Н); 3,73+3,82 (2 м, 2 Н) ; 4,17 (шир.с, 1 Н) ; 4,42 (шир.с, 1 Н); 4,60 (м, 2 Н); 6,56+6,59 (2 м, 1 Н); 6,98 (д,J=2,3 Гц, 1 Н); 7,27 (м, 2 Н); 7,58 (дд, J=7,35 и 1,8 Гц, 1 Н); 8,01 (д, J=2,l Гц, 1 Н); 8,44 (м, 2 Н) . Пример 6. Соединение 71: 6-3-[2-(4-бензо[b]тиофен-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-оксоэтил]-3,8 диазабицикло[3.2.1]окт-8-илникотиновая кислота Растворяют 0,147 г соединения, полученного в примере 4, в 2 мл 3 н. водного раствора HCl. Нагревают при температуре кипения с обратным холодильником в течение 2 ч. Прибавляют 2 мл 3 н. водного раствора HCl. Нагревают при температуре кипения с обратным холодильником в течение 1 ч. Промывают этиловым эфиром. Доводят рН до 6 раствором NaHCO3 и экстрагируют этилацетатом. Сушат и выпаривают органический слой, получают 200 мг маслянистого вещества. Обрабатывают диэтиловым эфиром, фильтруют и получают 0,015 г бледно-желтого твердого вещества, соответствующего продукту,указанному в заголовке. Т.пл.: (121-122)С ЯМР: (прибор b),(м.д., ДМСО-d6): 1,75-2,06 (м, 4 Н); 2.41 (м, 2 Н); 2,56 (м, ); 2,70 (м, 3 Н); 3,123,33 (м, ); 3,68-3,90 (м, 2 Н); 4,16 (шир.с, 1 Н); 4,42 (шир.с, 1 Н); 4,66 (шир.с, 2 Н); 6,29 (м, 1 Н); 6,78 (м,1 Н); 7,31 (д, J=7 Гц, 1 Н); 7.42 (ддт, J=8 Гц, 1 Н); 7,50 (д, J=5, 6 Гц, 1 Н); 7,77 (д, J=5,4 Гц, 1 Н); 7,82 (д,J=8 Гц, 1 Н); 7,91 (м, 1 Н); 8,63 (шир.с, 1 Н); 11,72-12,49 (шир.с, 1 Н). Пример 7. Соединение 32: 4-[2-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-оксоэтил]-1-(5 трифторметилпиридин-2-ил)пиперазин-2-он Работают согласно методике, описанной в примере 4, но используют соединение, полученное в получении 8, вместо соединения, полученного в получении 7, и соединение, полученное в получении 6,вместо соединения, полученного в получении 5, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (151-152)С ЯМР: (прибор а),(м.д., ДМСО-d6): 2,64 (м, 0,9 Н); 2,73 (м, 1,1 Н); 2,99 (м, 2 Н); 3,51 (с, 3 Н); 3,77 (м,2 Н); 3,98 (м, 2 Н); 4,22 (с, 1,1 Н); 4,33 (с, 0,9 Н); 6,57 (шир.с, 1 Н); 6,98 (д, J=2,2 Гц, 1 Н); 7,22-7,34 (м, 2 Н); 7,58 (шир.д, J=7,5 Гц, 1 Н); 7,99 (шир.с, 1 Н); 8,22 (м, 2 Н); 8,84 (м, 1 Н). Пример 8. Соединение 20: 1-(4-хинолин-8-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон и его оксалат Работают согласно методике, описанной в примере 4, но используют соединение, полученное в получении 11, вместо соединения, полученного в получении 7, и (5-трифторметилпиридин-2-ил)пиперазин вместо соединения, полученного в получении 5, и получают указанное в заголовке соединение. Растворяют в ацетоне, прибавляют раствор щавелевой кислоты в ацетоне и получают оксалат в виде бежевого твердого аморфного вещества. ЯМР: (прибор а),(м.д., ДМСО-d6): 2,77 + 2,87 (2 м, 2 Н); 3.02 (м, 4 Н); 3,53-3,98 (м, ); 4,22 (м, 2 Н); 5,96 (м, 1 Н); 7.03 (д, J=9,l Гц, 1 Н); 7,50-7,65 (м, 3 Н); 7,86 (дд, J=9, 0 и 2,1 Гц, 1 Н); 7,92 (м, 1 Н); 8,38 (дд,J=8,2 и 1,8 Гц, 1 Н); 8,46 (шир.с, 1 Н); 8,90 (м, 1 Н). Пример 9. Соединение 45: 1-[4-(2,3-дигидробензо[1,4]диоксин-6-ил)-3,6-дигидро-2 Н-пиридин-1-ил]-2[(2S,6R)-2,6-диметил-4-(6-трифторметилпиридин-3-ил)пиперазин-1-ил]этанон Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 12, вместо соединения, полученного в получении 7, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (200-201)С ЯМР: (прибор а),(м.д., ДМСО-d6): 1,05 (м, 6 Н); 2,39+2,50 (2 м, ); 2,60 (м, 2 Н); 3,21-3,32 (м, ); 3,56-3,73 (м, 4 Н); 3,77 (м, 2 Н); 4,05+4,18 (2 м, 2 Н); 4,24 (с, 4 Н); 6,05 (м, 1 Н); 6,82 (д, J=8,4 Гц, 1 Н); 6,89- 27024403 6,96 (м, 2 Н); 7,39 (дд, J= 8,8 и 2,6 Гц, 1 Н); 7,60 (д, J=8,8 Гц, 1 Н); 8,39 (д, J=2,7 Гц, 1 Н). Пример 10. Соединение 63: 1-(5-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[(2S,6R)-2,6-диметил-4(5-трифторметилпиридин-2-ил)пиперазин-1-ил]этанон Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 9, вместо соединения, полученного в получении 7, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (129-130)С ЯМР: (прибор а),(м.д., ДМСО-d6): 1,06 (м, 6 Н); 2,33 + 2,44 (2 м, 2 Н); 2,71 (м, 2 Н); 3,19 (м, ); 3,68(м, 2 Н); 3,73 (с, 2 Н); 4,17 (м, 2 Н); 4,47 + 4,58 (2 шир.с, 2 Н); 6,63 (шир.с, 1 Н); 6,94 (м, 1 Н); 6,70 (шир.с,1 Н); 7,22-7,39 (м, 2 Н); 7,59 (д, J=7,4 Гц, 1 Н); 7,75 (шир.д, J=9,0 Гц, 1 Н); 8,02 (шир.с, 1 Н); 8,38 (шир.с, 1 Н). Пример 11. Соединение 67: метиловый эфир 5-(1-2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2 ил)пиперазин-1-ил]ацетил-1,2,3,6-тетрагидропиридин-4-ил)бензо[b]тиофен-2-карбоновой кислоты и его оксалат Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 10, вместо соединения, полученного в получении 7, и получают указанное в заголовке соединение. Растворяют его в ацетоне, прибавляют раствор щавелевой кислоты в ацетоне и получают оксалат в виде бежевого твердого аморфного вещества. ЯМР: (прибор b),(м.д., ДМСО-d6): 1,15 (м, 6 Н); 2,58 + 2,68 (2 м, 2 Н); 2,95 (м, 2 Н); 3,35 (м, 2 Н); 3,74 (м, ); 3,82-4,08 (м, ); 4,12-4,40 (м, ); 6,31 (м, 1 Н); 7,03 (д, J=9,0 Гц, 1 Н); 7,70 (м, 1 Н); 7,83 (шир.д,J=9,1 Гц, 1 Н); 8,01-8,11 (м, 2 Н); 8,20 (шир.с, 1 Н); 8,43 (шир.с, 1 Н). Пример 12. Соединение 83: 4-[2-(3-бензофуран-7-ил-2,5-дигидропиррол-1-ил)-2-оксоэтил]-1-(5-трифторметилпиридин-2-ил)пиперазин-2-он Работают согласно методике, описанной в примере 4, но используют соединение, полученное в получении 13, вместо соединения, полученного в получении 7, и соединение, полученное в получении б,вместо соединения, полученного в получении 5, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (184-186)С ЯМР: (аппарат b),(м.д., ДМСО-d6): 2,89-3,12 (м, 4 Н); 3,45-3,59 (м, 4 Н); 3,80-4,02 (м, 4 Н); 4,74 + 4,83 (2 с, 2 Н); 7,51 (м, 3 Н); 8,20 (м, 2 Н), 8,37 (м, 2 Н); 8,65-8,88 (м, 2 Н). Пример 13. Соединение 89: 3-(6-3-[2-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-оксоэтил]-3,8 диазабицикло[3.2.1]окт-8-илпиридин-3-ил)-4 Н-[1,2,4]оксадиазол-5-он Работают согласно методике, описанной в примере 4, но используют соединение, полученное в получении 8, вместо соединения, полученного в получении 7, и соединение, полученное в получении 15,вместо соединения, полученного в получении 5, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (230-232)С ЯМР: (температура В),(м.д., ДМСО-d6): 1,76-2,04 (м, 4 Н), 2,41 (м, 2 Н), 2,56-2,81 (м, 4 Н), 3,17 + 3,21 (2 с, 2 Н), 3,73 (м, 1 Н), 3,81 (м, 1 Н), 4,17 (м, 1 Н), 4,42 (м, 1 Н), 4,64 (м, 2 Н), 6,56 (м, 0,5 Н), 6,61 (м,0,5 Н), 6,89 (м, 1 Н), 6,99 (д, J=2,2 Гц, 1 Н), 7,24-7,32 (м, 2 Н), 7,58 (дд, J=7,3 и 1,4 Гц, 1 Н), 7,82 (м, 1 Н), 8,02(м, 1 Н), 8,48 (м, 1 Н), 12,69 (шир.с, 1 Н). Пример 14. Соединение 51: метиловый эфир 6-(3R,5S)-4-[2-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1 ил)-2-оксоэтил]-3,5-диметилпиперазин-1-илникотиновой кислоты Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 8, вместо соединения, полученного в получении 7, и соединение, полученное в получении 14,вместо соединения, полученного в получении 1, и получают указанное в заголовке соединение. Растворяют его в ацетоне, прибавляют раствор щавелевой кислоты в ацетоне и получают оксалат в виде белого твердого аморфного вещества. ЯМР: (аппарат b, температура А),(м.д., ДМСО-d6): 1,19 (м, 6 Н), 2,67+2,76 (2 м, 2 Н), 3,04 (м, ),3,43 (м, ), 3,58-4.58 (м, ), 6,58 (м, 1 Н), 6,88-7,12 (м, 2 Н), 7,28 (м, 2 Н), 7.59 (м, 1 Н), 7,90-8,12 (м, 2 Н),8,68 (м, 1 Н). Пример 15. Соединение 57: 6-(3S,5R)-4-[2-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-оксоэтил]3,5-диметилпиперазин-1-илникотиновая кислота Работают согласно методике, описанной в примере 6, но используют соединение, полученное в примере 13, вместо соединения, полученного в примере 4, и получают указанное в заголовке соединение в виде маслянистого вещества. Это вещество обрабатывают диэтиловым эфиром, фильтруют и получают бледно-желтое твердое вещество, соответствующее продукту, указанному в заголовке. Т.пл.: (272-274)С ЯМР: (температура В),(м.д., ДМСО-d6): 1,06 (м, 6 Н), 2,55-2,76 (м, 4 Н), 3,17 (м, 2 Н), 3,72 (м, 4 Н),4,18 (м, 3 Н), 3,41 (с, 1 Н), 6,57 (м, 1 Н), 6,81 (д, J=9,0 Гц, 1 Н), (д, J=2,l Гц, 1 Н), 7,22-7,32 (м, 2 Н), 7,58 (д,J=7,4 Гц, 1 Н), 7,93 (д, J=9,0 Гц, 1 Н), 8,02 (с, 1 Н), 8,62 (м, 1 Н). Пример 16. Соединение 118: 4-[2-оксо-2-(4-тиено[3,2-е]пиридин-4-ил-3,6-дигидро-2 Н-пиридин-1-ил)этил]-1(5-трифторметилпиридин-2-ил)пиперазин-2-он В колбе, снабженной магнитной мешалкой, суспендируют 0,11 г соединения, полученного в получении 19, в 13 мл дихлорметана. Прибавляют 0,1 г 4-(1,2,3,6-тетрагидропиридин-4-ил)тиено[3,2 с]пиридина, 0,19 мл триэтиламина и 0,15 г ВОР. Осуществляют реакцию в течение 1 ч при комнатной температуре. Затем выливают в воду и экстрагируют дихлорметаном. Органический слой сушат надNa2SO4, фильтруют и выпаривают в вакууме. Выделяют 0,22 г маслянистого вещества. Очищают флэшхроматографией на колонке Biotage, которую элюируют этилацетатом. Выделяют 0,7 г белого твердого вещества. Т.пл.: (145-148)С ЯМР: (прибор а, температура В),(м.д., ДМСО-d6): 2,69 (м, 0,9 Н), 2,79 (м, 1,1 Н), 3,00 (м, 2 Н), 3,51(м, 4 Н), 3,77 (м, 2 Н), 3,97 (м, 2 Н), 4,25 (м, 1,1 Н), 4,35 (м, 0,9 Н), 6,34 + 6,37 (2 м, 1 Н), 7,75 (м, 1 Н), 7,84 + 7,88 (2 м, 1 Н), 7,97 (м, 1 Н) , 8,22 (м, 2 Н), 8,40 (м, 1 Н), 8,84 (м, 1 Н). Пример 17. Соединение 119: оксалат 1-(4-бензофуран-7-ил-3,6-дигидро-2 Н-пиридин-1-ил)-2-[(2S,6R)-2,6 диметил-4-(5-тиазол-2-илпиридин-2-ил)пиперазин-1-ил]этанона Работают согласно методике, описанной в примере 1, но используют соединение, полученное в получении 8, вместо соединения, полученного в получении 7, и соединение, полученное в получении 18,вместо соединения, полученного в получении 1, и получают указанное в заголовке соединение в форме свободного основания. Растворяют его в ацетоне, затем прибавляют раствор щавелевой кислоты в ацетоне. Получают продукт, указанный в заголовке, в виде белого твердого вещества. Т.пл.: (140-145)С ЯМР: (прибор а, температура В),(м.д., ДМСО-d6): 1,21 (м, 6 Н), 2,67 (м, ), 2,77 (м, ), 2,91-3,95 (м, ),4,04-4,47 (м, ), 6,59 (м, 1 Н), 7,00 (д, J=2,l Гц, 1 Н), 7,05 (м, 1 Н), 7,27 (м, 1 Н), 7,32 (м, 1 Н), 7,59 (д, J=7,4 Гц, 1H),7,68 (шир.д, J=3,2 Гц, 1 Н), 7,86 (шир.д, J=3,2 Гц, 1 Н), 8,03 (шир.д, 1 Н), 8,08 (м, 1 Н), 8,71 (шир.с, 1 Н). Пример 18. Соединение 121: 2-[(2S,6R)-2,6-диметил-4-(5-трифторметилпиридин-2-ил)пиперазин-1-ил]-1-(4 хинолин-2-ил-3,6-дигидро-2 Н-пиридин-1-ил)этанон Работают согласно методике, описанной в примере 16, но используют соединение, полученное в получении 16, вместо соединения, полученного в получении 19, и соединение, полученное в получении 17, вместо 4-(1,2,3,6-тетрагидропиридин-4-ил)тиено[3,2-е]пиридина, и получают указанное в заголовке соединение в виде белого твердого вещества. Т.пл.: (94-95)С ЯМР: (прибор а, температура В),(м.д., ДМСО-d6): 1,06 (м, 6 Н), 2,66-2,78 (м, 3 Н), 2,85 (м, 1 Н), 3,20(м, 2 Н), 3,66-3,79 (м, 4 Н), 4,20 (м, 3 Н), 4,35 (м, 1 Н), 6,89 (м, 1 Н), 6,95 (д, J=9,l Гц, 1 Н), 7,56 (м, 1 Н), 7,727,79 (м, 2 Н), 7,87 (д, J=8,7 Гц, 1 Н), 7,92-7,99 (м, 2 Н), 8,33 (м, 1 Н), 8,39 (м, 1 Н). В следующую таблицу сведены примеры, осуществленные с применением и/или путем адаптации описанных способов с использованием соответствующих реагентов и исходных веществ:
МПК / Метки
МПК: A61K 31/497, C07D 407/14, C07D 409/04, C07D 495/04, A61K 31/506, A61K 31/496, A61P 25/00, A61K 31/4995, A61K 31/551, C07D 407/04, C07D 409/14, C07D 401/04, C07D 401/14, C07D 403/14
Метки: применение, производные, ингибиторов, р75ntr, гетероциклотетрагидропиридин)(пиперазинил)-1-алканона, гетероциклодигидропирролидин)(пиперазинил)-1-алканона, качестве, рецептора
Код ссылки
<a href="https://eas.patents.su/30-24403-proizvodnye-geterociklotetragidropiridinpiperazinil-1-alkanona-i-geterociklodigidropirrolidinpiperazinil-1-alkanona-i-ih-primenenie-v-kachestve-ingibitorov-receptora-r75ntr.html" rel="bookmark" title="База патентов Евразийского Союза">Производные (гетероциклотетрагидропиридин)(пиперазинил)-1-алканона и (гетероциклодигидропирролидин)(пиперазинил)-1-алканона и их применение в качестве ингибиторов рецептора р75ntr</a>
Предыдущий патент: Применение каталитической системы на носителе для получения полиолефинов
Следующий патент: Электрод для плазменной обработки диэлектрическим барьерным разрядом