Производные 2-пиридин-2-ил-пиразол-3(2h)-она, их получение и применение в терапии в качестве активаторов hif
Номер патента: 19591
Опубликовано: 30.04.2014
Авторы: Иллиано Стефан, Фоссе Валери, Альтенбюрже Жан-Мишель, Манетт Жеральдин
Формула / Реферат
1. Соединение, соответствующее следующей формуле (I)
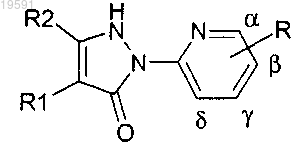
где R представляет собой -SO2-NR3R4 или -SO2R4, где R3, R4 и R5 имеют значения, определенные далее;
R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С3-С6)циклоалкил, -W-арил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6;
причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С1-С5)алкилов, -(С1-С5)алкилен-О-(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, -галоген(С1-С5)алкилов, цианогруппы, -О(С1-С5)алкилен-О-(С1-С5)алкилов, групп -О-(С1-С5)алкилен-NR5R6, -SO2-(C1-C5)алкилов, групп -NR5R6 и -CO2R5;
при условии, что в случае гетероциклоалкила он содержит по меньшей мере один атом азота, который при необходимости может иметь заместитель, выбранный из (С1-С5)алкилов;
R2 представляет собой атом водорода, -(С1-С5)алкил, -(С1-С5)алкилен-О-(С1-С5)алкил, -галоген(С1-С5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(O)NR5R6, где W, R5 и R6 имеют значения, определенные далее;
при условии, что
W представляет собой
-(С1-С5)алкилен-, имеющий при необходимости заместитель, выбранный из групп -(СН2)n-CO2R5 и -(СН2)n-(CO)NR5R6, n равно 0, 1 или 2, a R5 и R6 имеют значения, определенные далее; или
-(С3-С6)циклоалкилен-;
R3 и R4, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атом водорода, -(С1-С5)алкил, -(С3-С6)циклоалкил, -(С1-С5)алкилен-О-(С1-С5)алкил, арил, -СН2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-CH2OH, -W-CO2R5, -W-NR5R6 или -W-O-(СН2)n-арил;
причем -(С3-С6)циклоалкилы и гетероциклоалкилы при необходимости имеют в качестве заместителей
в случае -(С3-С6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, групп -W-NR5R6 и -W-CO2R5; и/или
в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С1-С5)алкилов;
где W и n имеют определенные ранее значения, a R5 и R6 имеют значения, определенные далее, при условии, что в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода;
или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С1-С5)алкилов и -СН2-арилов;
R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С1-С5)алкилы или (С1-С5)галогеналкилы;
причем арил представляет собой ароматический цикл, содержащий 5 или 6 атомов углерода;
гетероарил представляет собой ароматический цикл, содержащий 2, 3, 4 или 5 атомов углерода и от 1 до 3 гетероатомов, которые могут быть выбраны из атомов азота, кислорода и серы и независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 2, или независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 3;
гетероциклоалкил представляет собой циклический алкил, являющийся при необходимости мостиковым и содержащий 4, 5, 6 или 7 атомов углерода и 1, 2 или 3 гетероатома, выбранных из атомов кислорода, азота и серы;
в виде основания или кислотно-аддитивной соли.
2. Соединение, соответствующее формуле (I) по п.1, отличающееся тем, что
R представляет собой -SO2-NR3R4 или -SO2R4, где R3, R4 и R5 имеют значения, определенные далее; и/или
R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С3-С6)циклоалкил, -W-арил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6;
причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С1-С5)алкилов, -(С1-С5)алкилен-О-(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, -галоген(С1-С5)алкилов, цианогруппы, -О-(С1-С5)алкилен-О-(С1-С5)алкилов, групп -О-(С1-С5)алкилен-NR5R6, -SO2-(C1-C5)алкилов, групп
-NR5R6 и -CO2R5;
при условии, что в случае -W-гетероциклоалкила он содержит по меньшей мере один атом азота, который при необходимости может иметь заместитель, выбранный из (С1-С5)алкилов; и/или
R2 представляет собой атом водорода, -(С1-С5)алкил, -(С1-С5)алкилен-О-(С1-С5)алкил, -галоген(С1-С5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(О)NR5R6, где W, R5 и R6 имеют значения, определенные далее; и/или
W представляет собой -(С1-С5)алкилен-, имеющий при необходимости заместитель, выбранный из групп
-(СН2)n-CO2R5 и -(СН2)n-(CO)NR5R6, где n имеет определенные ранее значения, a R5 и R6 имеют значения, определенные далее; или
-(С3-С6)циклоалкилен-; и/или
R3 и R4, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атом водорода, -(С1-С5)алкил, -(С3-С6)циклоалкил, -(С1-С5)алкилен-О-(С1-С5)алкил, арил, -СН2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-CH2OH, -W-CO2R5, -W-NR5R6 или -W-O-(СН2)n-арил;
причем -(С3-С6)циклоалкилы и гетероциклоалкилы при необходимости имеют в качестве заместителей
в случае -(С3-С6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, групп -W-NR5R6 и -W-CO2R5; и/или
в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С1-С5)алкилов;
где W и n имеют определенные ранее значения, a R5 и R6 имеют значения, определенные далее, при условии, что в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода;
или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С1-С5)алкилов и -СН2-арилов; и/или
R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С1-С5)алкилы или (С1-С5)галогеналкилы.
3. Соединение формулы (I) по любому из пп.1, 2, отличающееся тем, что R представляет собой -SO2-NR3R4, где R3 и R4 имеют значения, определенные в п.1.
4. Соединение формулы (I) по любому из пп.1, 2, отличающееся тем, что R представляет собой -SO2R4, где R4 и R5 имеют значения, определенные в п.1.
5. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что R представляет собой заместитель, связанный с атомом, находящимся в положении β пиридинового цикла.
6. Соединение формулы (I) по любому из пп.1-5, отличающееся тем, что R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С3-С6)циклоалкил, -W-арил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6;
причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С1-С5)алкилов, -(С1-С5)алкилен-О-(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, -галоген(С1-С5)алкилов, цианогруппы, -О(С1-С5)алкилен-О-(С1-С5)алкилов, групп -О-(С1-С5)алкилен-NR5R6, -SO2-(C1-C5)алкилов, групп -NR5R6 и -CO2R5;
при условии, что в случае гетероциклоалкила он содержит по меньшей мере один атом азота, который при необходимости может иметь заместитель, выбранный из (С1-С5)алкилов;
где W означает (С1-С5)алкилен или (С3-С6)циклоалкилен, а R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С1-С5)алкилы или (С1-С5)галогеналкилы.
7. Соединение формулы (I) по п.6, отличающееся тем, что гетероциклоалкил представляет собой пиперидил, арил представляет собой фенил, а гетероарил представляет собой пиридил.
8. Соединение формулы (I) по любому из пп.1-7, отличающееся тем, что R2 представляет собой атом водорода, (С1-С5)алкил, -(С1-С5)алкилен-О-(С1-С5)алкил, -галоген(С1-С5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(О)-NR5R6, где W, R5 и R6 имеют значения, определенные в п.1.
9. Соединение формулы (I) по любому из пп.1-3 и 5-7, отличающееся тем, что R представляет собой группу -SO2-NR3R4, которая предпочтительно находится в положении β пиридинового цикла и в которой R3 и R4, являющиеся одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С1-С5)алкил, -(С3-С6)циклоалкил, -(С1-С5)алкилен-О-(С1-С5)алкил, арил, -СН2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-CH2OH, -W-CO2R5, -W-NR5R6 или -W-O-(СН2)n-арил;
при условии, что
в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода;
а также в случае, когда R3 и/или R4 выбраны из упомянутых -(С3-С6)циклоалкилов и гетероциклоалкилов, они могут при необходимости иметь в качестве заместителей
в случае -(С3-С6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С1-С5)алкилов, -(С1-С5)алкоксигрупп, гидроксигруппы, групп -W-NR5R6 и -W-CO2R5; и/или
в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С1-С5)алкилов;
где W, R5 и R6 имеют значения, определенные в п.1, а n равно 0, 1 или 2.
10. Соединение формулы (I) по п.9, отличающееся тем, что гетероциклоалкил представляет собой пиперидил, арил представляет собой фенил, а гетероарил представляет собой пиридил.
11. Соединение формулы (I) по любому из пп.1-3 и 5-7, отличающееся тем, что R представляет собой группу -SO2-NR3R4, которая предпочтительно находится в положении β пиридинового цикла и в которой R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С1-С5)алкилов и -СН2-арилов.
12. Соединение формулы (I) по п.11, отличающееся тем, что гетероциклоалкил представляет собой группу, выбранную из пиперидила, пиперазинила, морфолинила, пирролидинила, гексаметилениминогруппы, а арил представляет собой фенил.
13. Соединение формулы (I) по любому из пп.1-12, отличающееся тем, что один или несколько радикалов R, R1 и/или R2 необязательно содержат один или несколько радикалов R5 и/или R6;
R5 или R6 представляют собой атомы водорода, -(С1-С5)алкилы или (С1-С5)галогеналкилы или
R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С1-С5)алкилы или (С1-С5)галогеналкилы.
14. Соединение формулы (I) по п.13, отличающееся тем, что R5 и/или R6 выбраны из (С1-С5)алкилов.
15. Соединение формулы (I) по любому из пп.1-13, отличающееся тем, что R представляет собой -SO2-NR3R4, a R3 и R4 имеют значения, определенные в п.1, и/или R2 представляет собой атом водорода или
-(С1-С5)алкил, предпочтительно метил, и/или R1 представляет собой -W-арил или -W-гетероарил, причем W предпочтительно представляет собой -СН2-, арил представляет собой фенил, а гетероарил представляет собой пиридил.
16. Соединение формулы (I) по любому из пп.1-15, отличающееся тем, что оно представляет собой
трифторацетат 4-(2-хлорбензил)-5-метил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
(+/-)4-(2-хлорбензил)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-5-метил-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(2-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-диэтилпиридин-3-сульфонамид;
6-[4-(2-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(2-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
4-(2-хлорбензил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
N,N-диэтил-6-[4-(2-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
трифторацетат 4-(2-фторбензил)-5-метил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-4-(2-фторбензил)-5-метил-1,2-дигидро-3Н-пиразол-3-он;
N-этил-6-[4-(2-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
4-(2-фторбензил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
трифторацетат 4-(2,4-дихлорбензил)-5-метил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
4-(2,4-дихлорбензил)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-5-метил-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(2,4-дихлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(2,4-дихлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
4-(2,4-дихлорбензил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
4-(2-хлор-6-фторбензил)-5-метил-2-[5-(трифторметил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
трифторацетат 4-(2-хлор-6-фторбензил)-5-метил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
4-(2-хлор-6-фторбензил)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-5-метил-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(2-хлор-6-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-диэтилпиридин-3-сульфонамид;
6-[4-(2-хлор-6-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(2-хлор-6-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
4-(2-хлор-6-фторбензил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
4-(4-хлорбензил)-5-метил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
4-(4-хлорбензил)-2-(5-{[(3R,5S)-3,5-диметилпиперидин-1-ил]сульфонил}пиридин-2-ил)-5-метил-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(4-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-диэтилпиридин-3-сульфонамид;
6-[4-(4-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(4-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
4-(4-хлорбензил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(2-фторбензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
4-(1,1-диоксидотетрагидротиофен-3-ил)-5-метил-2-[5-(пиперидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(1,1-диоксидотетрагидротиофен-3-ил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(1,1-диоксидотетрагидротиофен-3-ил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N,N-ди(пропан-2-ил)пиридин-3-сульфонамид;
N-этил-6-{4-[4-(метоксиметил)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-{4-[3-(метоксиметил)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
6-[4-(3-цианобензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(4-цианобензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-(2-цианобензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-{4-[3-(2-метоксиэтокси)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-{3-метил-4-[4-(метилсульфонил)бензил]-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-[3-метил-5-оксо-4-(пиридин-4-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
N-этил-6-[3-метил-5-оксо-4-(пиридин-2-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-бензил-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-[4-(2,5-диметоксибензил)-3-метил-5-оксо-2,5-дигидро-1H-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-{3-метил-4-[(1-метилпиперидин-4-ил)метил]-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-{3-метил-5-оксо-4-[4-(трифторметил)бензил]-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-{3-метил-5-оксо-4-[3-(трифторметил)бензил]-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
6-[4-(3,5-диметоксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-[4-(4-гидроксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-{4-[2-(диметиламино)этокси]бензил}-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
6-{4-[4-(диметиламино)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-{3-метил-5-оксо-4-[2-(трифторметил)бензил]-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
6-(4-бензил-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-(3-метилбутил)пиридин-3-сульфонамид;
6-{4-[3-(диметиламино)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-[4-(4-метоксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
N-этил-6-[4-(3-метоксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-{3-[2-(диметиламино)этокси]бензил}-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-[4-(2-метоксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
4-бензил-5-метил-2-[5-(морфолин-4-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
N-этил-6-[4-(3-гидроксибензил)-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-бензил-3-этил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-{4-[4-(2-метоксиэтокси)бензил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
4-бензил-5-метил-2-[5-(пирролидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
2-[5-(азепан-1-илсульфонил)пиридин-2-ил]-4-бензил-5-метил-1,2-дигидро-3Н-пиразол-3-он;
N,N-диэтил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
гидрохлорид N,N-диэтил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
N,N-диметил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
гидрохлорид N,N-диметил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
гидрохлорид 6-(4-бензил-5-оксо-3-пропил-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамида;
гидрохлорид 6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-(пропан-2-ил)пиридин-3-сульфонамида;
гидрохлорид 5-метил-4-(пиридин-3-илметил)-2-[5-(пирролидин-1-илсульфонил)пиридин-2-ил]-1,2-дигидро-3Н-пиразол-3-он;
гидрохлорид N-трет-бутил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
гидрохлорид N-циклопропил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
гидрохлорид N-циклопентил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
N-этил-6-[3-метил-5-оксо-4-(2-фенилэтил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
гидрохлорид N-метил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-(пиридин-2-ил)пиридин-3-сульфонамида;
2-{5-[(4-бензилпиперидин-1-ил)сульфонил]пиридин-2-ил}-5-метил-4-(пиридин-3-илметил)-1,2-дигидро-3Н-пиразол-3-он;
N-этил-6-[3-метил-5-оксо-4-(2-фенилпропан-2-ил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
N-этил-6-{4-[(6-метоксипиридин-2-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
гидрохлорид 6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1H-пиразол-1-ил]-N-(пиридин-2-ил)пиридин-3-сульфонамида;
N-этил-6-[3-метил-5-оксо-4-(1-фенилциклопропил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
гидрохлорид N-этил-6-{4-[(3-метоксипиридин-2-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамида;
6-[4-бензил-3-(метоксиметил)-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
6-[4-бензил-5-оксо-3-(трифторметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
1-[5-(азепан-1-илсульфонил)пиридин-2-ил]-3-метил-4-(пиридин-3-илметил)-1Н-пиразол-5-олат;
N-этил-6-{3-метил-5-оксо-4-[2-(пиридин-2-ил)этил]-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-этил-6-{4-[(5-метоксипиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
N-(2-метоксиэтил)-N-метил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
6-[4-бензил-3-(2-метилпропил)-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
N-этил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
N-этил-6-[3-метил-5-оксо-4-(3-фенилпропил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид;
N-циклопропил-N-метил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
N-трет-бутил-6-{4-[(5-метоксипиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}пиридин-3-сульфонамид;
6-{4-[(5-цианопиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-этил-N-фенилпиридин-3-сульфонамид;
N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
гидрохлорид N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамида;
N-этил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-трет-бутил-N-метилпиридин-3-сульфонамид;
N-этил-6-{4-[(5-метоксипиридин-3-ил)метил]-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-фенилпиридин-3-сульфонамид;
5-метил-2-[5-(фенилсульфонил)пиридин-2-ил]-4-(пиридин-3-илметил)-1,2-дигидро-3Н-пиразол-3-он;
N-трет-бутил-6-{4-[(5-метоксипиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-метилпиридин-3-сульфонамид;
6-{4-[(6-цианопиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-этил-N-фенилпиридин-3-сульфонамид;
(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)уксусная кислота;
2-(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)-N,N-диметилацетамид;
метил-(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)ацетат;
этил-(4-бензил-1-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-5-оксо-2,5-дигидро-1Н-пиразол-3-ил)ацетат;
2-(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)-N-метилацетамид;
N-трет-бутил-6-{4-[(5-метоксипиридин-2-ил)метил]-3-метил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил}-N-метилпиридин-3-сульфонамид;
2-(4-бензил-1-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-5-оксо-2,5-дигидро-1Н-пиразол-3-ил)-N,N-диметилацетамид;
3-(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)пропановая кислота;
метил-3-[(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-5-метил-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)метил]бензоат;
метил-3-(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)пропаноат;
метил {2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1Н-пиразол-4-ил}(фенил)ацетат;
метил 2-[(2-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-5-метил-3-оксо-2,3-дигидро-1H-пиразол-4-ил)метил]бензоат;
N-циклопентил-N-этил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
N-циклопентил-N-метил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
2-[(1-{5-[этил(фенил)сульфамоил]пиридин-2-ил}-3-метил-5-оксидо-1H-пиразол-4-ил)метил]бензоат;
2-[5-(азепан-1-илсульфонил)пиридин-2-ил]-4-(пиридин-3-илметил)-1,2-дигидро-3Н-пиразол-3-он;
N-циклопентил-N-метил-6-[5-оксо-4-(пиридин-4-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
N-циклопентил-N-этил-6-[5-оксо-4-(пиридин-4-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
метил 3-(2-{5-[циклопентил(метил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)-3-фенилпропаноат;
N-(2,2-диметилпропил)-N-метил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
метил-N-циклопентил-N-({6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-ил}сульфонил)глицинат;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-[2-(бензилокси)этил]-N-циклопентилпиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-[3-(бензилокси)пропил]-N-циклопентилпиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-(3-гидроксипропил)пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-(2-гидроксиэтил)пиридин-3-сульфонамид;
метил (1S,2R)-2-[метил({6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-2-ил}сульфонил)амино]циклопентанкарбоксилат;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-(2,3-дигидроксипропил)пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1H-пиразол-1-ил)-N-циклопентил-N-[2-(диметиламино)этил]пиридин-3-сульфонамид;
4-бензил-2-{5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
6-[4-(циклопентилметил)-5-оксо-2,5-дигидро-1Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамид;
4-бензил-2-{5-[(4-метил-1,4-диазепан-1-ил)сульфонил]пиридин-2-ил}-1,2-дигидро-3Н-пиразол-3-он;
N-(2,2-диметилпропил)-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
N-(2-метилбутан-2-ил)-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-[(1R,3S)-3-(гидроксиметил)циклопентил]-N-метилпиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-метил-N-(1-метилпирролидин-3-ил)пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-(2-метокси-2-метилпропил)пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-[(2R)-2,3-дигидроксипропил]пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-(2,3-дигидроксипропил)-N-фенилпиридин-3-сульфонамид;
N-циклопентил-6-{4-[(4-метоксипиридин-3-ил)метил]-5-оксо-2,5-дигидро-1H-пиразол-1-ил}-N-метилпиридин-3-сульфонамид;
N-метил-N-(2-метилбутан-2-ил)-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
3-(2-{5-[циклопентил(метил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)-3-фенил-N-(2,2,2-трифторэтил)пропанамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-[3-гидрокси-2-(гидроксиметил)пропил]пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-[(2S)-2,3-дигидроксипропил]пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-[(1S,2S)-2-гидроксициклопентил]пиридин-3-сульфонамид;
N-трет-бутил-6-[5-оксо-4-(пиридин-4-илметил)-2,5-дигидро-1Н-пиразол-1-ил]пиридин-3-сульфонамид;
4-бензил-2-(5-{[(3R)-3-(диметиламино)пирролидин-1-ил]сульфонил}пиридин-2-ил)-1,2-дигидро-3Н-пиразол-3-он;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-[1-(диметиламино)-2-метилпропан-2-ил]пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-метил-N-фенилпиридин-3-сульфонамид;
метил-3-{2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1Н-пиразол-4-ил}-3-(пиридин-3-ил)пропаноат;
этил-3-{2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1Н-пиразол-4-ил}-3-фенилпропаноат;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-трет-бутил-N-(2,3-дигидроксипропил)пиридин-3-сульфонамид;
6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-(2-гидроксиэтил)пиридин-3-сульфонамид;
гидрохлорид N-(2,3-дигидроксипропил)-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид;
гидрохлорид метил-3-(2-{5-[циклопентил(метил)сульфамоил]пиридин-2-ил}-3-оксо-2,3-дигидро-1Н-пиразол-4-ил)-3-(пиридин-3-ил)пропаноата;
гидрохлорид 6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-[3-(диметиламино)пропил]пиридин-3-сульфонамида;
гидрохлорид 6-(4-бензил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)-N-циклопентил-N-[3-(диметиламино)пропил]пиридин-3-сульфонамида.
17. Способ получения соединения формулы (I) по любому из пп.1-16, отличающийся тем, что соединение формулы (II)
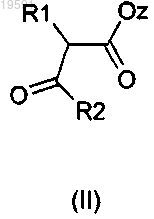
где R1, R2 имеют значения, определенные в п.1, a z представляет собой алкил;
вводят в реакцию с соединением общей формулы (III)
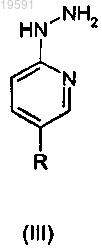
где R имеет значения, определенные в п.1.
18. Лекарственное средство, активирующее транскрипционный фактор HIF, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-16 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой.
19. Фармацевтическая композиция, активирующая транскрипционный фактор HIF, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-16 или фармацевтически приемлемую соль этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
20. Применение соединения формулы (I) по любому из пп.1-16 для получения лекарственного средства, предназначенного для лечения/профилактики сердечно-сосудистых заболеваний.
21. Применение соединения формулы (I) по любому из пп.1-16 для получения лекарственного средства, предназначенного для лечения/профилактики ишемии нижних конечностей, сердечной недостаточности, коронарных болезней сердца ишемического происхождения, таких как стенокардия или инфаркт миокарда, атеросклероз, сосудистых повреждений головного мозга ишемического происхождения, легочной гипертензии и любых патологий, вызываемых частичной или полной непроходимостью сосудов.
22. Применение соединения формулы (I) по любому из пп.1-16 для получения лекарственного средства, предназначенного для лечения/профилактики глаукомы, болезней почек или болезней головного мозга необязательно нейродегенеративного происхождения, анемии, или лекарственного средства, предназначенного для улучшения заживления ран или для сокращения периода послеоперационной реабилитации, или лекарственного средства, предназначенного для лечения состояний общей слабости, или также лекарственного средства, используемого с целью получения крови при осуществлении аутотрансфузий, необходимых в связи со сложными хирургическими вмешательствами, такими как операции на головном мозге или в области грудной клетки или такими как операции на сердце или на уровне сонных артерий или аорты.
23. Применение соединения формулы (I) по любому из пп.1-16 для получения лекарственного средства, предназначенного для лечения/профилактики болезней сердца или периферических органов ишемического происхождения в порядке регенеративной терапии с использованием клеток.
24. Комбинация соединения формулы (I) по любому из пп.1-16 с одним или несколькими другими активными соединениями, приемлемыми для лечения гипертензии, сердечной недостаточности, диабета и анемии.
Текст
Изобретение относится к соединениям, соответствующим формуле (I), в которой R представляет собой SO2-NR3R4, атом водорода, атом галогена, -галоген(С 1-С 5)алкил, -CO2R5 или -SO2R4; R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С 3-С 6)циклоалкил, -W-арил, -W-гетероарил, -Wгетероциклоалкил, -W-COOR5, -W-CONR5R6; R2 представляет собой атом водорода, -(С 1-С 5)алкил, -(С 1 С 5)алкилен-О-(С 1-С 5)алкил, -галоген(С 1-С 5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(О)NR5R6; n равно 0, 1 или 2; W означает -(С 1-С 5)алкилен- или -(С 3-С 6)циклоалкилен-; R3 и R4, являющиеся одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил, (С 3-С 6)циклоалкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил, арил, -СН 2-арил, гетероарил, гетероциклоалкил, -WOH, -W-CHOH-CH2OH, -W-CO2R5, -W-NR5R6 или -W-O-(СН 2)n-арил; или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил; R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1 С 5)галогеналкилы; изобретение относится также к способу их получения и их применению в терапии. Объектами настоящего изобретения являются новые производные замещенных дигидропиразолонов, их получение и применение в терапии в качестве активаторов транскрипционного фактора HIF. Гипоксия-индуцируемый фактор (HIF от "Hypoxia Inducible Factor" (гипоксия-индуцируемый фактор (HIF1) представляет собой транскрипционный фактор, конститутивно экспрессируемый во всех тканях. Этот белок обнаружен в 1994 году Gregg Semenza в ходе исследования регуляторных последовательностей гена ЕРО. Им идентифицирована последовательность, расположенная в некодирующем положении 3' в промоторе ЕРО, называемом "гипоксия-респонсивный элемент" (HRE) и представляющем собой сайт фиксации белка HIF1, обеспечивающего транскрипционную активацию ЕРО. Впоследствии последовательность HRE также была локализована более, чем в 70 других генов, таких как VEGF (фактор роста сосудистого эндотелия) или Glut1 (переносчик-1 глюкозы). Транскрипционный комплекс HIF-1 представляет собой, по меньшей мере, гетеродимер, образуемый белком HIF1 или HIF2 и другим транскрипционным фактором ARNT (ранее называемым HIF1). ARNT конститутивно и стабильно экспрессируется в клетках, при этом сущность регулирования транскрипционного комплекса связана с количеством HIF1, присутствующим в клетках и, таким образом, представляющим собой лимитирующий фактор. В нормальных условиях по кислороду белок HIF1 быстро деградирует (время полужизни составляет 5 мин). Такая деградация является следствием гидроксилирования HIF1 или HIF2 HIFпролилгидроксилазами (HIFPHD или EGLN) соответственно на пролиновых остатках 402 и 563 и пролиновых остатках 405 и 531 в случае человеческих форм. Это гидроксилирование обеспечивает связывание белка Хиппель-Линдау (pVHL), ассоциированного с убиквитинлигазой, вследствие чего вызывается деградация HIF1 или HIF2 убиквитин-протеасомной системой. В случае, когда клетка или ткань претерпевает гипоксию/ишемию, HIF1 или HIF2 больше не деградируются убиквитин-протеасомной системой и потому могут ассоциироваться с другими транскрипционными факторами комплекса HIF для перехода в ядро и активации своих целевых генов. Хотя гипоксия представляется главной причиной активации белков HIF1 и HIF2, другие индукторы, такие, как инсулин и факторы роста, также могут играть роль в их стабилизации, в частности, путем фосфорилирования на сериновых остатках 641 и 643. Таким образом, для идентификации соединений по настоящему изобретению был принят фенотипический скрининг, предусматривающий измерение стабилизации белка HIF1 и/или HIF2. Соединения по настоящему изобретению соответствуют приведенной далее формуле (I)R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(C3-C6)циклоалкил, -Wарил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6;(i) причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С 1-С 5)алкилов, -(С 1-С 5)алкилен-О-(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы, -галоген(С 1-С 5)алкилов,цианогруппы, -О-(С 1-С 5)алкилен-О-(С 1-С 5)алкилов, групп -О-(С 1-С 5)алкилен-NR5R6, -SO2-(C1-C5)алкилов, групп -NR5R6 и -CO2R5;(ii) при условии, что в случае гетероциклоалкила, он содержит по меньшей мере один атом азота,который при необходимости может иметь заместитель, выбранный из (С 1-С 5)алкилов;R2 представляет собой атом водорода, -(С 1-С 5)алкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил, -галоген(С 1 С 5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(О)-NR5R6, где W, R5 и R6 имеют значения, определенные далее; при условии, что(i) -(C1-C5)алкилен-, имеющий при необходимости заместитель, выбранный из групп -(СН 2)n-CO2R5 и -(СН 2)n-(CO)NR5R6, где n имеет определенные ранее значения, a R5 и R6 имеют значения, определенные далее; илиR3 и R4,(i) являющиеся одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил, -(С 3-С 6)циклоалкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил, арил,-СН 2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-СН 2 ОН, -W-CO2R5, -W-NR5R6 или -W-O(СН 2)n-арил; причем -(С 3-С 6)циклоалкилы и гетероциклоалкилы при необходимости имеют в качестве замести-1 019591 телей: в случае -(С 3-С 6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы,групп -W-NR5R6 и -W-CO2R5, и/или в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов; где W и n имеют определенные ранее значения, a R5 и R6 имеют значения, определенные далее,при условии, что в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода;(ii) или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил,имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С 1-С 5)алкилов иR5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1-С 5)галогеналкилы; за исключением следующих соединений: 4-бензил-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(2,4-дихлорбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(4-метоксибензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(4-бромбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 2-(пиридин-2-ил)-4-[2-(трифторметил)бензил]-1,2-дигидро-3 Н-пиразол-3-он; 4-(4-хлорбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(1,3-бензодиоксол-5-илметил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(3-метилбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(2-хлорбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(4-метилбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(3-хлорбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-(4-трет-бутилбензил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-бензил-5-метил-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 5-метил-4-(1-фенилэтил)-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; 4-бензил-2-(6-хлорпиридин-2-ил)-5-метил-1,2-дигидро-3 Н-пиразол-3-он; 4-1-[4-(диэтиламино)фенил]этил-5-метил-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он. Соединения формулы (I) могут находиться в виде оснований или солей, причем соединения формулы (I) в данном случае переводят в солевую форму кислотами или основаниями и предпочтительно фармацевтически приемлемыми кислотами или основаниями. В данном случае речь идет об аддитивных солях, составляющих часть настоящего изобретения. Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами, но соли других кислот, которые могут использоваться, например, для очистки или выделения соединений формулы (I),также составляют часть настоящего изобретения. Соединения формулы (I) могут находиться также в виде гидратов или сольватов, а именно в виде ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть настоящего изобретения. Различные таутомерные формы соединений формулы (I) также составляют часть настоящего изобретения. Кроме того, объектом настоящего изобретения является также способ однотипного прямого измерения, основанного на бета-галактозидазной комплементации, количества белка HIF1- в ядре клеток,предпочтительно клеток HEK, после обработки данных клеток одним или несколькими испытуемыми соединениями, причем способ состоит в том, что:(а) предпочтительно в 384-луночные планшеты осуществляют посев упомянутых клеток в приемлемую культуральную среду, предпочтительно в 1%-ю эмбриональную телячью сыворотку (сокращенно(b) одно или несколько испытуемых соединений с соответствующей концентрацией в приемлемом растворителе прибавляют к клеткам, посеянным ранее в упомянутую культуральную среду, при этом испытуемые соединения предпочтительно растворяют в 0,1%-й SVF;(c) подготовленные таким образом клетки инкубируют в инкубаторе приблизительно при 37 С(d) лизируют клетки буферным лизирующим раствором, содержащим хемилюминесцентный субстрат для бета-галактозидазы;(e) инкубируют без доступа света перед считыванием и измерением люминесценции, представляющей собой функцию активности бета-галактозидазы. Скрининг соединений по настоящему изобретению осуществляют согласно испытанию, определенному ранее. В описании настоящего изобретения, если в тексте не упомянуто иное, принято, что атом галогена представляет собой атом фтора, хлора, брома или иода; алкил представляет собой алифатическую насыщенную линейную или разветвленную группу, которая может содержать 1, 2, 3, 4 или 5 атомов углерода (сокращенно -(С 1-С 5)алкил). В качестве примеров можно назвать (i) метил в качестве -С 1 алкила, (ii) этил в качестве -С 2 алкила, (iii) пропил и изопропил в качестве -С 3 алкила, (iv) бутил, изобутил и трет-бутил в качестве -С 4 алкила, группа, (v) пентил и изопентил в качестве -С 5 алкила; алкилен представляет собой определенный ранее двухвалентный насыщенный линейный или разветвленный алкил, который может содержать 1, 2, 3, 4 или 5 атомов углерода (сокращенно -(С 1 С 5)алкилен-). В качестве примеров можно назвать метилен (или -СН 2-), этилен (или -СН 2-СН 2-), пропилен (-СН 2-СН 2-СН 2- или -С(СН 3)2-); циклоалкил представляет собой циклический алкил, могущий содержать 3, 4, 5 или 6 атомов углерода и обозначаемый сокращенно -(С 3-С 6)циклоалкил. В качестве примеров можно назвать циклопропил,циклобутил, циклопентил, циклогексил; циклоалкилен представляет собой определенный ранее двухвалентный насыщенный циклоалкил,могущий содержать 3, 4, 5 или 6 атомов углерода и обозначаемый сокращенно -(С 3-С 6)циклоалкилен-. В качестве примеров можно назвать циклопропилен-, -циклобутилен-, -циклопентилен-, циклогексилен-; алкоксигруппа представляет собой -О-алкил, в котором алкильная группа имеет определенные ранее значения. В качестве примеров можно назвать -О-(С 1-С 5)алкил или -(С 1-С 5)алкоксигруппу, в частности, (i) -О-метил в качестве -O-С 1 алкила, (ii) -О-этил в качестве -O-С 2-алкила, (iii) -О-пропил и -Оизопропил в качестве -О-С 3-алкила, (iv) -О-бутил, -O-изобутил и -О-трет-бутил в качестве -O-С 4-алкила,(v) -O-пентил, -O-изопентил, -О-неопентил в качестве -O-С 5-алкила; алкоксиалкил представляет собой радикал формулы алкилен-О-алкил, в котором алкил и алкилен,необязательно содержащие одинаковое число атомов углерода, имеют определенные ранее значения. В качестве примеров можно назвать -(С 1-С 5)алкилен-O-(C1-C5)алкил, в котором -(C1-C5)алкилен- и -(С 1 С 5)алкил имеют определенные ранее значения; алкоксиалкоксигруппа представляет собой радикал формулы -О-алкилен-O-алкил, в котором алкилен и алкил, необязательно содержащие одинаковое число атомов углерода, имеют определенные ранее значения; галогеналкил представляет собой определенный ранее алкил, имеющий в качестве заместителей 1,2, 3, 4 или 5 атомов галогенов, определенных ранее. Можно назвать, например, галоген (С 1-С 5)алкил,содержащий определенный ранее (С 1-С 5)алкил, такой как, например, трифторметил (сокращенно -CF3),-CH2-CF3; арил представляет собой ароматический цикл, содержащий 5 или 6 атомов углерода. В качестве примера арила можно назвать фенил; гетероарил представляет собой ароматический цикл, содержащий 2, 3, 4 или 5 атомов углерода и от 1 до 3 гетероатомов, которые могут быть выбраны из атомов азота, кислорода и серы и независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 2, или независимо друг от друга являются одинаковыми или разными в том случае, когда их число равно 3. В качестве примеров можно назвать пиридил, пиррол, фурил; гетероциклоалкил представляет собой циклический алкил, являющийся при необходимости мостиковым и содержащий 4, 5, 6 или 7 атомов углерода и 1, 2 или 3 гетероатома, выбранных из атомов кислорода, азота и серы. Предпочтительно можно назвать пиперидил, пиперазинил, пирролидинил, гексаметилениминогруппу, морфолинил, 1,1-диоксотетрагидротиенил; литеры , ,ипри пиридиновом цикле соединений формулы (I) позволяют идентифицировать положения различных атомов углерода. Среди соединений, описанных в настоящем изобретении, можно назвать первую группу соединений, соответствующих формуле (I), в которой-SO2R4, где R3, R4 и R5 имеют значения, определенные далее; и/или R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С 3-С 6)циклоалкил,-W-арил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6;(i) причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С 1-С 5)алкилов, -(С 1-С 5)алкилен-О-(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы, -галоген(С 1-С 5)алкилов,-3 019591(ii) при условии, что в случае гетероциклоалкила, он содержит по меньшей мере один атом азота,который при необходимости может иметь заместитель, выбранный из (С 1-С 5)алкилов; и/или R2 представляет собой атом водорода, -(С 1-С 5)алкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил,-галоген(С 1-С 5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(О)-NR5R6, где W, R5 и R6 имеют значения,определенные далее; и/или n равно 0, 1 или 2; и/или W представляет собой:(i) -(C1-C5)алкилен-, имеющий при необходимости заместитель, выбранный из групп -(СН 2)n-CO2R5 и -(СН 2)n-(CO)NR5R6, где n имеет определенные ранее значения, a R5 и R6 имеют значения, определенные далее; или (ii) -(С 3-С 6)циклоалкилен-; и/или R3 и R4,(i) являющиеся одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил, -(С 3-С 6)циклоалкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил, арил,-СН 2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-СН 2 ОН, -W-CO2R5, -W-NR5R6 или -W-O(СН 2)n-арил; причем -(С 3-С 6)циклоалкилы и гетероциклоалкилы при необходимости имеют в качестве заместителей: в случае -(С 3-С 6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы,групп -W-NR5R6 и -W-CO2R5,и/или в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов; где W и n имеют определенные ранее значения, a R5 и R6 имеют значения, определенные далее,при условии, что в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода;(ii) или R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил,имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С 1-С 5)алкилов и-СН 2-арилов; и/или R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1-С 5)галогеналкилы; за исключением уже упомянутых ранее соединений в качестве таковых. Первую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R представляет собой -SO2-NR3R4, галоген(С 1-С 5)алкил, -CO2R5 или -SO2R4, где R3, R4 и R5 имеют определенные ранее значения. Вторую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R представляет собой -SO2-NR3R4 или CO2R5, где R3, R5 и R4 имеют определенные ранее значения. Третью подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R представляет собой атом водорода, атом галогена, галоген(С 1-С 5)алкил, -CO2R5 или -SO2R4,где R4 и R5 имеют определенные ранее значения. Четвертую подгруппу соединений по настоящему изобретению составляют соединения формулы(I), в которой R представляет собой заместитель, связанный с атомом, находящимся в положениипиридинового цикла. Пятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R1 представляет собой гетероциклоалкил, не содержащий атом азота, -W-(С 3-С 6)циклоалкил,-W-арил, -W-гетероарил, -W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6; причем арил, гетероарил и гетероциклоалкил по меньшей мере у одного атома углерода при необходимости имеют по меньшей мере один заместитель, выбранный из атомов галогенов, (С 1-С 5)алкилов,-(С 1-С 5)алкилен-О-(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы, -галоген(С 1-С 5)алкилов, цианогруппы, -О(С 1-С 5)алкилен-О-(С 1-С 5)алкилов, групп -О-(С 1-С 5)алкилен-NR5R6, -SO2-(C1-C5)алкилов,групп -NR5R6 и -CO2R5; при условии, что когда речь идет о гетероциклоалкиле, то он содержит по меньшей мере один атом азота, который при необходимости может иметь заместитель, выбранный из (С 1-С 5)алкилов; где W означает (С 1-С 5)алкилен или (С 3-С 6)циклоалкилен, а R5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1-С 5)галогеналкилы. Гетероциклоалкил предпочтительно представляет собой пиперидил, арил представляет собой фенил, а гетероарил представляет собой пиридин. Шестую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R2 представляет собой атом водорода, -(С 1-С 5)алкил, -(С 1-С 5)алкилен-О-(С 1-С 5)алкил,-галоген(С 1-С 5)алкил, -W-COOR5, -W-C(O)NHR5 или -W-C(O)-NR5R6, где W, R5 и R6 имеют определенные ранее значения. Седьмую подгруппу соединений по настоящему изобретению составляют соединения формулы (I),где R представляет собой группу -SO2-NR3R4, которая предпочтительно находится в положениипиридинового цикла и в которой R3 и R4, являющиеся одинаковыми или разными, независимо друг от друга представляют собой такие группы, как атом водорода, -(С 1-С 5)алкил, -(С 3-С 6)циклоалкил, -(С 1 С 5)алкилен-О-(С 1-С 5)алкил, арил, -СН 2-арил, гетероарил, гетероциклоалкил, -W-OH, -W-CHOH-CH2OH,-W-CO2R5, -W-NR5R6 или -W-O-(СН 2)n-арил; при условии, что в случае, когда R3 и R4 являются одинаковыми, они не могут представлять собой атомы водорода; а также в случае, когда R3 и/или R4 выбраны из упомянутых -(С 3-С 6)циклоалкилов и гетероциклоалкилов, они могут при необходимости иметь в качестве заместителей: в случае -(С 3-С 6)циклоалкилов и гетероциклоалкилов по меньшей мере у одного атома углерода по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов, -(С 1-С 5)алкоксигрупп, гидроксигруппы,групп -W-NR5R6 и -W-CO2R5, и/или в случае гетероциклоалкилов по меньшей мере у одного гетероатома, выбранного из азота, по меньшей мере одну группу, выбранную из -(С 1-С 5)алкилов; где W, R5 и R6 имеют определенные ранее значения, а n равно 0, 1 или 2. Гетероциклоалкил предпочтительно представляет собой пиперидил, арил представляет собой фенил, а гетероарил представляет собой пиридин. Восьмую подгруппу соединений по настоящему изобретению составляют соединения формулы (I),где R представляет собой группу -SO2-NR3R4, которая предпочтительно находится в положениипиридинового цикла и в которой R3 и R4 совместно с атомом азота, с которым они связаны, образуют гетероциклоалкил, имеющий при необходимости по меньшей мере у одного атома углерода и/или при необходимости по меньшей мере у одного гетероатома по меньшей мере один заместитель, выбранный из -(С 1 С 5)алкилов и -СН 2-арилов. Упомянутый гетероциклоалкил предпочтительно представляет собой группу,выбранную из пиперидила, пиперазинила, морфолинила, пирролидинила, гексаметилениминогруппы, а арил представляет собой фенил. Девятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой один или несколько радикалов R, R1 и/или R2 необязательно содержат один или несколько радикалов R5 и/или R6;R5 или R6 представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1-С 5)галогеналкилы, илиR5 и R6, являющиеся одинаковыми или разными, независимо друг от друга представляют собой атомы водорода, -(С 1-С 5)алкилы или (С 1-С 5)галогеналкилы. R5 и/или R6 предпочтительно выбирают из(С 1-С 5)алкилов. Десятую подгруппу соединений по настоящему изобретению составляют соединения формулы (I), в которой R представляет собой -SO2-NR3R4 или атом водорода, a R3 и R4 имеют определенные ранее значения, и/или R2 представляет собой атом водорода или -(С 1-С 5)алкил, предпочтительно метил, и/или-СН 2-, арил представляет собой фенил, а гетероарил представляет собой пиридин. Подгруппы, определенные ранее и взятые раздельно или в комбинации, также составляют часть настоящего изобретения. В настоящем изобретении исключения составляют приведенные далее соединения, а именно: Соединения типа 4R1-1[2-пиримидил]пиразолин-5-она, в которых R1 представляет собой: Среди соединений формулы (I), являющихся объектами настоящего изобретения, предпочтительно можно назвать следующие соединения: 4-(2-хлорбензил)-5-метил-2-[5-(трифторметил)пиридин-2-ил]-1,2-дигидро-3 Н-пиразол-3-он; 6-[4-(2-хлорбензил)-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3-карбоновая кислота; 4-(2-хлорбензил)-5-метил-2-(пиридин-2-ил)-1,2-дигидро-3 Н-пиразол-3-он; трифторацетат 4-(2-хлорбензил)-5-метил-2-5-[(4-метилпиперазин-1-ил)сульфонил]пиридин-2-ил 1,2-дигидро-3 Н-пиразол-3-он;N-трет-бутил-6-[5-оксо-4-(пиридин-4-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3-сульфонамид; 4-бензил-2-(5-[(3R)-3-(диметиламино)пирролидин-1-ил]сульфонилпиридин-2-ил)-1,2-дигидро 3 Н-пиразол-3-он; 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-[1-(диметиламино)-2-метилпропан-2-ил]пиридин-3-сульфонамид; 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-метил-N-фенилпиридин-3-сульфонамид; метил-3-2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил-3(пиридин-3-ил)пропаноат; этил-3-2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил-3 фенилпропаноат; 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-трет-бутил-N-[2,3-дигидроксипропил)пиридин 3-сульфонамид; 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-(2-гидроксиэтил)пиридин-3-сульфонамид; гидрохлорид N-(2,3-дигидроксипропил)-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол 1-ил]-N-фенилпиридин-3-сульфонамид; гидрохлорид метил-3-(2-5-[циклопентил(метил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро 1 Н-пиразол-4-ил)-3-(пиридин-3-ил)пропаноата; гидрохлорид 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-циклопентил-N-[3-(диметиламино)пропил]пиридин-3-сульфонамида; гидрохлорид 6-(4-бензил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-циклопентил-N-[3-(диметиламино)пропил]пиридин-3-сульфонамида. В дальнейшем описании под защитной группой (Pg) понимают группу, которая, с одной стороны,позволяет в ходе синтеза защищать реакционноспособную функциональную группу, такую, как гидрокси- или аминогруппа. Примеры защитных групп, а также способы их введения и удаления приведены в"Protective Groups in Organic Synthesis", Green et al., 3nd Edition (John WileySons, Inc., New York). Под уходящей группой (Lg) в дальнейшем описании понимают нуклеофильную группу, которая может быть легко отщеплена от молекулы вследствие разрыва гетеролитической связи с уходом электронной пары. Такая группа также может быть легко замещена другой нуклеофильной группой, например, в ходе реакции замещения. Такими уходящими группами являются, например, галогены или активная гидроксигруппа, такая, как мезил, тозил, трифлат, ацетат и т.д. Примеры уходящих групп, а также информация по их получению приведены в "Advances in Organic Chemistry", J. March, 3rd Edition, WileyInterscience, p. 310-316. По настоящему изобретению соединения общей формулы (I) можно получить приведенными далее способами. На схеме 1 описан синтез соединений формулы (I), в которой: R может представлять собой -SO2NR3R4, атом водорода, атом галогена, -галоген(С 1-С 5)алкил, -CO2R5 или -SO2R4; R1 может представлять собой гетероциклоалкил, не содержащий атом азота, -W-(С 3-С 6)циклоалкил, -W-арил, -W-гетероарил,- 11019591-W-гетероциклоалкил, -W-COOR5 или -W-CONR5R6, где R3, R4 и R5 имеют определенные ранее значения; W может представлять собой (C1-C5)алкилен, а n может быть равно 0, 1 или 2. Такие соединения обозначены далее как соединения формулы (Ia). Схема 1 На схеме 1 соединения формулы (II), в которой R1 и R2 имеют значения, определенные для соединений формулы (Ia), a z представляет собой алкил, такой как метил или этил, взаимодействуют с соединениями формулы (III) с образованием соединений формулы (Ia) предпочтительно в протонном растворителе, таком как смесь "этанолуксусная кислота", при температуре 80 С или в апротонном растворителе, таком как толуол, при температуре в интервале от 80 до 110 С в присутствии каталитического количества органической кислоты, такой как паратолуолсульфоновая кислота. Альтернативным образом, они могут быть получены последовательным осуществлением реакции в смеси "метанолуксусная кислота" с получением промежуточного гидразона и последующей реакции циклизации в метаноле в присутствии метилата натрия предпочтительно при температуре 40 С. Полученные соединения (I) при необходимости превращают с помощью кислоты или основания в их соответствующие соли. Схема 2 Соединения формулы (II) могут быть получены согласно схеме 2 по реакции типа реакции Кневенагеля между бета-кетоэфиром формулы (IV) R2COCH2CO2z и альдегидом формулы (V) R1CHO, в которойR1 имеет определенные ранее значения, a R2 означает (С 1-С 5)алкил, -(С 1-С 5)алкил-(С 1-С 5)алкоксигруппу,галоген(С 1-С 5)алкил, -W-COOR5, где W имеет определенные ранее значения, z представляет собой алкил, такой как метил или этил, в неполярном растворителе, предпочтительно в н-гексане, в присутствии каталитического количества соли паратолуолсульфоната пиридиния с получением соединения формулы(VI) с последующим осуществлением стадии гидрирования в протонном полярном растворителе, предпочтительно в этаноле, в присутствии катализатора, такого, как палладий, нанесенный на уголь. Схема 3 Альтернативным образом, соединения формулы (II) могут быть получены согласно схеме 3 последовательным осуществлением депротонирования бета-кетоэфира (IV) формулы R2COCH2CO2z органическим основанием типа алкоголята, предпочтительно метилата натрия, в спиртовом растворителе или неорганическим основанием, таким как гидроксид калия, или более сильным основанием, таким как гидрид натрия, с последующим прибавлением электрофильного соединения формулы (VII) R1-СН 2-Lg, в которой R1 имеет определенные ранее значения, a R2 означает (С 1-С 5)алкил, -(С 1-С 5)алкил-(С 1-С 5)алкоксигруппу, галоген(С 1-С 5)алкил, -W-COOR5, где W имеет определенные ранее значения, z означает алкил, такой как метил или этил, a Lg имеет значения, описанные ранее. Синтез соединений формулы (II), в которой R1 представляет собой W-арил или W-гетероарил, гдеW означает разветвленный алкилен формулы -CH(алкил)(алкил), описан на схеме 4. Такие соединения обозначены далее как соединения формулы (IIa). Схема 4 Соединения формулы (IX) получают конденсацией кетона формулы (VIII) R7COR8, в которой R7 иR8 могут независимо или совместно представлять собой (С 1-С 4)алкил, с бета-кетоэфиром формулы (IV)R2-CH2-CO2z, где R2 имеет определенные ранее значения, a z означает алкил, такой, как метил или этил,в присутствии кислоты Льюиса, предпочтительно хлорида цинка, в растворителе, таком, как уксусный ангидрид, при температуре в интервале от 40 до 80 С. Затем получают соединения формулы (IIa) 1,4 присоединением металлоорганического соединения формулы (X) "арил-металл" ("ArM"), предпочтительно магнийорганического соединения типа арил-MgX, где X представляет собой атом галогена, такой,как атом брома или хлора, в присутствии каталитического количества иодида меди к соединению формулы (IX) в безводном растворителе, предпочтительно в диэтиловом эфире. Синтез соединений формулы (II), в которой R2 означает водород, описан на схеме 5. Такие соединения обозначены далее как соединения формулы (IIb). Схема 5 Соединения формулы (IIa) получают формилированием сложного эфира (V) формулы R1-CH2CO2z, где R1 имеет определенные ранее значения, a z представляет собой алкил, такой как метил или этил. Стадия формилирования состоит в том, что предпочтительно метилформиат или этилформиат приводят во взаимодействие со сложным эфиром (V) в присутствии металлического натрия в безводном апротонном растворителе, таком, как диэтиловый эфир, при температуре в интервале от 0 до 30 С или в присутствии кислоты Льюиса, такой, как тетрахлорид титана, органического основания, такого, как трибутиламин, в присутствии каталитического количества триметилсилилтрифторметансульфоната в апротонном растворителе, таком, как толуол, при температуре в интервале от 50 до 60 С. Для случая, когда данные соединения отсутствуют в продаже, на схеме 6 описан синтез соединений формулы (III), в которой R представляет собой галогеналкил или -CO2R5, где R5 имеет описанные ранее значения. Такие соединения обозначены далее как соединения формулы (IIIa). Схема 6 Соединения формулы (IIIa) получают исходя из соединения XI, в котором Lg и R имеют определенные ранее значения, прибавлением гидразингидрата предпочтительно в протонном растворителе, таком, как EtOH, при температуре в интервале от 60 до 80 С. Синтез соединений формулы (III), в которой R представляет собой SO2NR3R4, a R3 и R4 имеет описанные ранее значения, описан на схеме 7. Такие соединения обозначены далее как соединения формулы (IIIb). Схема 7 Соединения формулы (IIIb) получают исходя из хлорида 2-хлор-5-сульфонилпиридина формулы(XII) взаимодействием с амином формулы (XIII) R3NHR4, где R3 и R4 имеют определенные ранее значения, в присутствии органического основания, предпочтительно триэтиламина, в полярном растворителе, предпочтительно в дихлорметане. Затем полученное соединение формулы (XIV) обрабатывают гидразингидратом в протонном растворителе, таком, как этанол, при 70 С для получения требуемых соединений. Синтез соединений формулы (III), в которой R означает алкил или алкоксигруппу, описан на схеме 8. Такие соединения обозначены далее как соединения формулы (IIIc). Соединения формулы (IIIc) получают исходя из соединения формулы (XV), где Lg и R имеют определенные ранее значения. Гидразиногруппу вводят сочетанием бензофенонгидразона формулы (XVI) с соединением формулы (XV) в присутствии каталитического количества палладия с получением промежуточного соединения формулы (XVII),- 13019591 гидразиногруппа которого высвобождается обработкой кислотой, такой, как соляная кислота, в бинарной смеси несмешивающихся растворителей, таких, как толуол и вода, при температуре 100 С. Схема 8 На схеме 9 описан синтез соединений формулы (I), в которой R1 означает -W-арил, -W-гетероарил,причем данные группы имеют один или несколько заместителей -NR5R6, a W представляет собой (С 1-С 5) алкилен. Такие соединения обозначены далее как соединения формулы (Ib). Схема 9(С 1-С 5)алкил, a z представляет собой алкил, такой как метил или этил, с бензальдегидом формулы(XVIII), имеющим в качестве заместителей одну или несколько нитрогрупп. Затем получают соединение формулы (XX) полным гидрированием в присутствии катализатора, такого, как палладий, нанесенный на уголь, в протонном растворителе, таком как этанол, предпочтительно с последующим восстановительным аминированием в таких условиях, что в случае, когда R5 и R6 представляют собой метилы, используют муравьиную кислоту в присутствии восстанавливающего агента, такого, как триацетоксиборогидрид натрия, в протонном растворителе, таком, как уксусная кислота. Затем соединение (XX) приводят во взаимодействие соответственно схеме 1 с соединением формулы (III) для получения требуемых соединений формулы (Ib). На схеме 10 описан синтез соединений формулы (I), в которой R1 означает группу -W-арил, где W представляет собой (С 1-С 5)алкилен; причем данный арил имеет в качестве заместителей одну или несколько групп, таких, как -О-(С 1-С 5)алкил-O-(С 1-С 5)алкил-(С 1-С 5)алкоксигруппа, -О-(C1-C5)алкилNR5R6. Такие соединения обозначены далее как соединения формулы (Ic). Схема 10R2COCH2CO2z, где R2 имеет значения, описанные ранее, a z представляет собой алкил, такой, как метил или этил, с бензальдегидом формулы (XXI), с последующим осуществлением стадии полного гидрирования в присутствии палладия, нанесенного на уголь, предпочтительно в растворителе, таком как этанол. Затем соединение формулы (XXIV) получают алкилированием соединения формулы (XXIII) R9-Lg, гдеR9 представляет собой (С 1-С 5)алкилен, -(С 1-С 5)алкил-(С 1-С 5)алкоксигруппу, -(С 1-С 5)алкил-NR5R6, a Lg имеет определенные ранее значения, в присутствии предпочтительно неорганического основания, такого, как карбонат калия, в полярном растворителе, таком, как ДМФА; далее его приводят во взаимодействие соответственно схеме 1 с соединением формулы (III) для получения требуемых соединений формулы(Ic). В приведенных далее примерах исходные вещества, промежуточные соединения и реагенты, способы получения которых не описаны, имеются в продаже или описаны в литературе, или могут быть получены способами, известными специалистам в данной области техники. Приведенными далее примерами пояснено получение некоторых соединений по настоящему изобретению. Номера соединений в приведенных примерах соответствуют номерам в таблице, приведенной далее для пояснения химической структуры и физических свойств некоторых соединений по настоящему изобретению. Приняты следующие сокращения и формулы: Спектры протонного магнитного резонанса (ЯМР 1 Н), приведенные далее, записаны при 400 МГц в ДМСО-d6 с использованием пика ДМСО-d5 в качестве эталона. Химические сдвигивыражены в миллионных долях (м.д.). Наблюдаемые сигналы обозначены как: с = синглет; с ушир. = уширенный синглет; д = дублет; дд = дублет дублетов; дт = дублет триплетов; т = триплет; м = массив; Н = протон. Масс-спектры получены в следующих условиях комбинированной ЖХ/МС: методика 1: колонка Jsphere (332 мм; 4 мкМ); элюенты: А = Н 2 О + 0,05% ТФУ; В = CH3CN +0,05% ТФУ; 1.1. Метил-2-ацетил-3-метилбут-2-еноат. К смеси 9,54 г (70 ммоль) безводного ZnCl2, 53,9 мл (500 ммоль) метилацетоацетата и 55 мл (750 ммоль) ацетона прибавляют 64 мл уксусного ангидрида. Далее реакционную смесь нагревают в течение 3 дней при 50 С, затем разбавляют 1 л ДХМ и промывают водой (3100 мл). Органическую фракцию сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 10% AcOEt. После сгущения при пониженном давлении получают 51,5 г метил-2-ацетил-3-метилбут-2 еноата в виде бесцветного маслоподобного вещества. Выход = 70%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 3,79 (с, 3 Н); 2,29 (с, 3 Н); 2,12 (с, 3 Н); 1,97 (с, 3 Н). 1.2. Метил-2-ацетил-3-метил-3-фенилбутаноат. К суспензии 146 мг (0,8 ммоль) безводного CuI (I) в 5 мл безводного эфира прибавляют при 0 С в токе аргона 3,6 мл (10,9 ммоль) 3M раствора фенилмагнийбромида в Et2O. После перемешивания в течение 1/2 ч при 0 С одной порцией прибавляют 1 г (6,4 ммоль) метил-2-ацетил-3-метилбут-2-еноата. Реакционной смеси дают нагреваться до t комн и перемешивают в течение 18 ч. Далее реакционную смесь обрабатывают 100 мл насыщенного раствора NH4Cl, дают разделиться и органическую фракцию еще раз обрабатывают 100 мл насыщенного раствора NH4Cl. Из водных фракций осуществляют экстракцию посредством ДХМ, 4100 мл. Органические фракции объединяют, сушат над безводным Na2SO4 и сгущают при пониженном давлении. После очистки хроматографией на силикагеле, элюируя смесью циклогексан/AcOEt, 95:5, получают 1 г метил-2-ацетил-3-метил-3-фенилбутаноата в виде бесцветного маслоподобного вещества. Выход = 67%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,4-7,2 (м, 5 Н); 3,9 (с, 1 Н); 3,8 (с, 3 Н); 1,90 (с, 3 Н); 1,6 (с, 3 Н),1,55 (с, 3 Н). 1.3."EtOH/AcOH" (1:1) прибавляют 249 мг (0,85 ммоль) N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида и затем реакционную смесь нагревают в течение 2 ч при 90 С. После сгущения при пониженном давлении остаток растворяют в 100 мл ДХМ, промывают насыщенным раствором NaHCO3 (230 мл),сушат над Na2SO4, фильтруют, сгущают при пониженном давлении и затем очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 20% AcOEt. После сгущения при пониженном давлении получают 312 мг маслоподобного вещества желтого цвета, которое перекристаллизовывают из 20 мл пентана. Полученное твердое вещество отделяют фильтрованием и затем сушат в вакууме. Получают 178 мг N-этил-6-[3-метил-4-(1-метил-1-фенилэтил)-5-оксо-2,5-дигидро 1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 44%. t пл = 122 С. M=C26H28N4O3S=476; M + Н = 477; методика 2: t уд=l,54 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1H); 8,55 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,5-7,3 (м, 7 Н); 7,2 (м, 1 Н); 7,1 (д, 2 Н); 3,65 (кв, 2 Н); 1,9 (с, 3 Н); 1,7 (с, 6 Н); 1,0 (т, 3 Н). Пример 2. N-Этил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид (соединение 43 в табл. I).(1,1 ммоль) PPTS в 27 мл гексана нагревают с обратным холодильником в течение 48 ч в приборе ДинаСтарка. Затем смесь сгущают при пониженном давлении, растворяют в 50 мл AcOEt, последовательно промывают водой (2100 мл), насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4,фильтруют и сгущают при пониженном давлении. Получают 17,6 г метил-(2E/Z)-3-оксо-2-(пиридин-3 илметилиден)бутаноата в виде маслоподобного вещества желтого цвета, используемого в таком виде на следующей стадии. Выход = 99%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,5 (д, 1 Н); 8,00 (д, 1 Н); 7,6 (с, 1 Н); 7,35 (дд, 1 Н); 3,7(с, 3 Н); 2,3 (с, 3H). 2.2. Метил-3-оксо-2-(пиридин-3-илметил)бутаноат. В приборе Парра смесь 14 г (68 ммоль) метил-(2E/Z)-3-оксо-2-(пиридин-3-илметилиден)бутаноата в 200 мл МеОН и 2,2 г Pd/C, 10%, гидрируют в течение 48 ч при 7 бар. Далее реакционную смесь фильтруют через бумагу Whatman GF/F и сгущают при пониженном давлении. Таким образом, получают 14 г метил-3-оксо-2-(пиридин-3-илметил)бутаноата в виде маслоподобного вещества темно-желтого цвета,используемого в таком виде на следующей стадии. Выход = 99%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,5 (м, 2 Н); 7,28 (д 1 Н); 7,21 (дд 1 Н); 3,78 (т, 1 Н); 3,71 (с, 3 Н); 3,16 (дд, 2 Н); 2,23 (с, 3 Н). 2.3. Гидрохлорид N-этил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]N-фенилпиридин-3-сульфонамида. Раствор 300 мг (1,45 ммоль) метил-3-оксо-2-(пиридин-3-илметил)бутаноата и 423 мг (1,45 ммоль)N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида в 4 мл смеси "EtOH/AcOH" (1:1) нагревают в течение 4 ч при 85 С. После доведения до t комн полученный осадок отделяют фильтрованием и затем последовательно промывают Et2O (20 мл) и пентаном (20 мл). Получают 210 мг остатка, который обрабатывают 40 мл воды, 2 мл ацетонитрила и 0,48 мл 0,2 н. раствора HCl перед осуществлением лиофилизации. Таким образом, получают 220 мг гидрохлорида N-этил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамида в виде лиофилизата белого цвета. Выход = 33%. t пл = 128 С. M=C23H23N5O3S= 449; M+H = 450; методика 2: t уд = 0,85 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12,5 (с ушир., 1 Н); 8,90 (с, 1 Н); 8,8 (д, 1 Н); 8,6 (д, 1 Н); 8,5 (д,1 Н); 8,4 (с, 1 Н); 8,2 (дд, 1 Н); 8,05 (дд, 1 Н); 7,4 (м, 3 Н); 7,1 (д, 2 Н); 3,8 (с, 2 Н); 3,65 (кв, 2 Н); 2,3 (с, 3 Н); 1,0(с, 3 Н); 2,4 (с, 3 Н). 3.2. Метил-2-(3-гидроксибензил)-3-оксобутаноат. По методике, описанной в примере 2.2, исходя из 2,5 г метил- (2E/Z)-2-[(3-гидроксифенил)метилиден]-3-оксобутаноата, получают 2,5 г метил-2-(3-гидроксибензил)-3-оксобутаноата в виде прозрачного воскоподобного вещества. Выход = 99%. ЯМР 1 Н CDCl3, 400 МГц,(м.д.): 7,15 (т, 1 Н); 6,7-6,85 (м, 3 Н); 5,6 (с, 1 Н); 3,7 (с, 3 Н); 3,15 (д, 2 Н); 2,25 (с, 3 Н). 3.3. Метил-2-3-[2-(диметиламино)этокси]бензил-3-оксобутаноат. Смесь 1,5 г (6,75 ммоль) метил-метил-2-(3-гидроксибензил)-3-оксобутаноата, 6,6 г (20,25 ммоль) безводного Cs2CO3, 0,1 г (0,67 ммоль) NaI и 1 г (7,1 ммоль) гидрохлорида 2-диметиламиноэтилхлорида в 20 мл безводного CH3CN нагревают в течение 4 ч при 90 С и затем перемешивают в течение ночи приt комн. Далее реакционную смесь фильтруют и затем сгущают при пониженном давлении. Полученный остаток растворяют в ДХМ (100 мл), промывают насыщенным раствором хлорида натрия (30 мл), сушат над Na2SO4, фильтруют, сгущают при пониженном давлении и затем очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/MeOH" с градиентом от 0 до 10% МеОН. После сгущения при пониженном давлении получают 409 мг метил-2-3-[2-(диметиламино)этокси]бензил-3- 17019591 оксобутаноата в виде воскоподобного вещества коричневого цвета. Выход = 19,5%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,2 (т, 1H); 6,7-6,8 (м, 3 Н); 4,1 (т, 2 Н); 3,8 (т, 1 Н); 3,7 (с, 3 Н); 3,15(д, 2 Н); 2,8 (т, 2 Н); 2,4 (с, 6 Н); 2,3 (с, 3 Н). 3.4. Гидрохлорид 6-(4-3-[2-(диметиламино)этокси]бензил)-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамида. По методике, описанной в примере 2.3, исходя из 195 мг метил-2-3-[2-(диметиламино)этокси]бензил-3-оксобутаноата и 194 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 70 мг гидрохлорида 6-(4-3-[2-(диметиламино)этокси]бензил-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)N-этил-N-фенилпиридин-3-сульфонамида в виде лиофилизата белого цвета. Выход = 20%.(с,3 Н). 4.2. Метил-2-(4-аминобензил)-3-оксобутаноат. По методике, описанной в примере 2.2, исходя из 4,2 г метил-1(2Z/E)-2-[(4-нитрофенил)метилиден]3-оксобутаноата, получают 2 г метил-метил-2-(4-аминобензил)-3-оксобутаноата в виде маслоподобного вещества. Выход = 54%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,1 (т, 1 Н); 6,6-6,5 (м, 3 Н); 3,9 (т, 1 Н); 3,8 (с, 3 Н); 3,7 (с ушир.,2 Н); 3,1 (д, 2 Н); 2,2 (с, 3 Н). 4.3. Метил-2-[4-(диметиламино)бензил]-3-оксобутаноат. К смеси 1,5 г (6,78 ммоль) метил-2-(4-аминобензил)-3-оксобутаноата, 40 мкл (0,04 ммоль) АсОН и 5,1 мл (67,8 ммоль) 37%-го водного раствора формальдегида в 13 мл CH3CN небольшими порциями при 0 С прибавляют 4,3 г (20,34 ммоль) триацетоксиборогидрида натрия. Затем реакционной смеси дают постепенно нагреваться до t комн и перемешивают в течение 12 ч. Реакционную смесь выливают в смесь 50 мл насыщенного раствора NaHCO3 и 30 г льда, осуществляют экстракцию посредством AcOEt (2100 мл), сушат над Na2SO4, фильтруют, сгущают при пониженном давлении и затем очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 50% AcOEt. Таким образом, получают 344 мг метил-2-[4-(диметиламино)бензил]-3-оксобутаноата в виде маслоподобного вещества желтого цвета. Выход = 20%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,1 (т, 1 Н); 6,65 (д, 1 Н); 6,55 (м, 2 Н); 3,9 (т, 1 Н); 3,8 (с, 3 Н); 3,2 (д,2 Н); 3,0 (с, 6 Н); 2,2 (с, 3 Н). 4.4. 6-4-[3-(Диметиламино)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 172 мг метил-2-[4-(диметиламино)бензил]-3 оксобутаноата и 202 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 138 мг 6-4-[3(диметиламино)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-N-этил-N-фенилпиридин-3-сульфонамида в виде твердого вещества белого цвета. Выход = 41%. M=C26H29N5O3S = 4 91; М + Н = 492; методика 2: t уд = 0,96 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1 Н); 8,7 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,4 (м, 3 Н); 7,2 (д, 2 Н); 7,1 (т, 1 Н); 6,7 (с, 1 Н); 6,5 (д, 2 Н); 3,7 (кв, 2 Н); 3,5 (с, 2 Н); 2,9 (с, 6 Н); 2,15 (с, 3 Н); 1,0 (т, 3 Н). Пример 5. N,N-Диметил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил] пиридин-3-сульфонамид (соединение 66 в табл.I) 5.1. 6-Хлор-N,N-диметилпиридин-3-сульфонамид. К смеси 4,7 мл (9,43 ммоль) диметиламина (2 н. раствор в ТГФ) и 2,6 мл (18,86 ммоль) ТЭА в 20 мл ТГФ при 0 С по каплям прибавляют раствор 2 г (9,43 ммоль) 6-хлорпиридин-3-сульфонилхлорида в 5 мл ТГФ (методика согласно WO 9840332). После перемешивания в течение 40 мин при 0 С реакционную смесь разбавляют 40 мл AcOEt, промывают водой (240 мл) и насыщенным раствором хлорида натрия(40 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 1,93 г 6-хлорN,N-диметилпиридин-3-сульфонамида в виде твердого вещества коричневого цвета, используемого в таком виде на следующей стадии. Выход = 93%. ЯМР 1H CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,0 (д, 1 Н); 7,4 (д, 1 Н); 2,7 (с, 6 Н). 5.2. 6-Гидразино-N,N-диметилпиридин-3-сульфонамид. Смесь 1,9 г (8,8 ммоль) 6-хлор-N,N-диметилпиридин-3-сульфонамида и 4,6 мл (91,5 ммоль) гидразинмоногидрата в 10 мл EtOH нагревают в течение 2 ч при 80 С. Полученный осадок после доведения доt комн отделяют фильтрованием, затем промывают 10 мл EtOH и сушат в вакууме. Получают 1,62 г 6 гидразино-N,N-диметилпиридин-3-сульфонамида в виде порошка белого цвета. ЯМР 1 Н, d6-ДMCO, 400 МГц,(м.д.): 8,5 (с ушир., 1 Н); 8,3 (с, 1 Н); 7,7 (д, 1 Н); 6,85 (д, 1H); 4,4 (с,2 Н) ; 2,6 (с, 6 Н). 5.3. N,N-Диметил-6-[3-метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин 3-сульфонамид. Смесь 400 мг (1,85 ммоль) 6-гидразино-N,N-диметилпиридин-3-сульфонамида и 383 мг (1,85 ммоль) метил-3-оксо-2-(пиридин-3-илметил)бутаноата в 4 мл смеси "EtOH/AcOH" (1:1) нагревают в течение 4 ч при 80 С и затем сгущают при пониженном давлении. Полученный остаток растворяют в 20 млAcOEt, последовательно промывают водой (220 мл), насыщенным раствором NaHCO3 (20 мл), насыщенным раствором хлорида натрия (20 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Затем остаток перекристаллизовывают из 20 мл смеси "Et2O/пентан" (1:1), отделяют фильтрованием и перекристаллизовывают из смеси "циклогексан/EtOH". Получают 188 мг N,N-диметил-6-[3 метил-5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3-сульфонамида в виде кристаллов белого цвета. Выход = 28%. t пл = 212 С. М = C17H19N5O3S = 373; М + Н = 374; методика 2: t уд = 0,58 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12 (с ушир., 1 Н); 8,7 (с, 1 Н); 8,65 (д, 1 Н); 8,5 (с, 1 Н); 8,4 (д,1 Н); 8,35 (д, 1 Н); 7,7 (д, 1 Н); 7,3 (дд, 1 Н); 3,6 (с, 2 Н); 2,7 (с, 6 Н); 2,2 (с, 3 Н). Пример 6. N-Этил-6-4-[3-(метоксиметил)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-Nфенилпиридин-3-сульфонамид (соединение 34 в табл.I) 6.1. Метил-3-(метоксиметил)бензоат. К раствору 15 г (65,5 ммоль) метил-3-(бромметил)бензоата в 20 мл безводного МеОН при t комн по каплям прибавляют раствор метилата натрия в МеОН, предварительно приготовленного исходя из 2,25 г(98,2 ммоль) натрия и 65 мл МеОН. Далее реакционную смесь нагревают в течение 4 ч при 65 С, затем сгущают при пониженном давлении, растворяют в 500 мл ДХМ, промывают водой (100 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, фильтруют и сгущают при пониженном давлении. Получают 7,8 г метил-3-(метоксиметил)бензоата в виде маслоподобного вещества, используемого в таком виде на следующей стадии. Выход = 66%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,1 (с, 1 Н); 8,0 (д, 1 Н); 7,5 (д, 1 Н); 7,4 (т, 1 Н); 4,5 (с, 2 Н); 4,0 (с,3 Н); 3,4 (с, 3 Н). 6.2. 2-[3-(Метоксиметил)фенил]метанол. К раствору 7,8 г (43,3 ммоль) метил-3-(метоксиметил)бензоата в 60 мл смеси "ТГФ/диоксан" (1:1) прибавляют 0,94 г (43,3 ммоль) борогидрида лития. Далее реакционную смесь нагревают в течение 3 ч при 80 С и затем перемешивают в течение ночи при t комн. Реакционную смесь разбавляют 500 мл AcOEt,промывают водой (2100 мл), сушат над Na2SO4, фильтруют, сгущают при пониженном давлении и получают 5,9 г 2 [3-(метоксиметил)фенил]метанола в виде жидкости желтого цвета, используемой в таком виде на следующей стадии. Выход = 90%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,4-7,2 (м, 4 Н); 4,7 (с, 2 Н); 4,5 (с, 2 Н); 3,4 (с,3 Н); 2,4 (с ушир.,1 Н). 6.3. 1-(Бромметил)-3-(метоксиметил)бензол. К раствору 5,91 г (38,8 ммоль) 2 [3-(метоксиметил)фенил]метанола в 75 мл Et2O при 0 С по каплям прибавляют 9,1 мл (97,1 ммоль) трибромида фосфора. Реакционной смеси дают медленно нагреваться доt комн и перемешивают в течение 4 ч. Затем неочищенный продукт реакции осторожно выливают на смесь 100 г льда и 100 мл MeOH. После выпаривания МеОН при пониженном давлении из водной фракции осуществляют экстракцию посредством ДХМ (2200 мл). Органические фракции объединяют, сушат надNa2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 20% AcOEt. Таким образом, получают 3,25 г 1-(бромметил)-3-(метоксиметил)бензола в виде маслоподобного вещества. Выход = 39%.- 19019591 ЯМР 1H CDCl3, 400 МГц,(м.д.): 7,4-7,1 (м, 4H); 4,45 (с, 2 Н); 4,35 (с, 2 Н); 3,3 (с, 3 Н). 6.4. Метил-2-[3-(метоксиметил)бензил]-3-оксобутаноат. К раствору 0,34 г (15,1 ммоль) натрия в 8 мл безводного МеОН при t комн и в атмосфере аргона по каплям прибавляют 1,6 мл (15,1 ммоль) метилацетоацетата. После перемешивания в течение 1/2 ч по каплям быстро прибавляют 3,25 г (15,11 ммоль) 1-(бромметил)-3-(метоксиметил)бензола и затем реакционную смесь нагревают в течение 2 ч 30 мин при 70 С. Далее реакционную смесь сгущают при пониженном давлении, полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 20% AcOEt. Получают 3,2 г метил-2-[3(метоксиметил)бензил]-3-оксобутаноата в виде маслоподобного вещества. Выход = 85%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,4-7,1 (м, 4 Н); 4,45 (с, 2 Н); 3,8 (т, 1H); 3,7 (т, 3 Н); 3,4 (т, 3 Н); 3,2(д, 2 Н); 2,2 (с, 3 Н). 6.5. N-Этил-6-4-[3-(метоксиметил)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил)-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 300 мг метил-2-[3-(метоксиметил)бензил]-3 оксобутаноата и 350 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 341 мг N-этил 6-4-[3-(метоксиметил)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 58%. t пл = 144 С. M=C26H28N4O4S = 492; М + Н = 493; методика 2: t уд = 1,29 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир. , 1 Н); 8,7 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,4 (м, 3 Н); 7,3-7,1 (м, 6 Н); 4,35 (с, 2 Н); 3,6 (кв, 2 Н); 3,5 (с, 2 Н); 3,3 (с, 3 Н); 2,15 (с, 3 Н); 1,0 (т, 3 Н). Пример 7. N-Этил-6-[3-метил-5-оксо-4-(2-фенилэтил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид (соединение 74 в табл. I) 7.1. Метил-3-оксо-2-(2-фенилэтил)бутаноат. По методике, описанной в примере 6.4, исходя из 5,16 г (2-бромэтил)бензола и 3,2 г метилацетоацетата, получают 1,9 г метил-3-оксо-2-(2-фенилэтил)бутаноата в виде прозрачного маслоподобного вещества. Выход = 31%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,2-7,35 (м, 5 Н); 3,75 (с, 3 Н); 3,5 (т, 1 Н); 2,5-2,7 (м, 2 Н); 2,2 (с,3 Н); 2,15-2,3 (м, 2 Н). 7.2. N-Этил-6-[3-метил-5-оксо-4-(2-фенилэтил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3 сульфонамид. По методике, описанной в примере 1.3, исходя из 264 мг метил-3-оксо-2-(2-фенилэтил)бутаноата и 351 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 291 мг N-этил-6-[3-метил-5 оксо-4-(2-фенилэтил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 53%. t пл = 158 С. M=C25H26N4O3S = 462; М + Н = 463; методика 2: t уд = 1,35 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 11,8 (с ушир., 1 Н); 8,6 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,4 (м, 3 Н); 7,3 (м, 2 Н); 7,2 (д, 3 Н); 7,1 (д, 2 Н); 3,6 (кв, 2 Н); 2,8 (т, 2 Н); 2,5 (т, 2 Н); 1,9 (с, 3 Н); 1,0 (т, 3 Н). Пример 8. 6-(4-Бензил-5-оксо-3-пропил-2,5-дигидро-1 Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3 сульфонамид (соединение 68 в табл. I) 8.1. Этил-2-бензил-3-оксогексаноат. По методике, описанной в примере 6.4, исходя из 2,2 г бензилбромида и 4 г этилбутирилацетата,получают 2,5 г этил-2-бензил-3-оксогексаноата в виде прозрачного маслоподобного вещества. Выход = 40%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,15-7,30 (м, 5 Н); 4,2 (кв, 2 Н); 3,8 (т, 1 Н); 3,2 (дд, 2 Н); 2,5-2,3 (м,2 Н); 1,55 (м, 2 Н); 1,2 (т, 3 Н); 0,86 (т, 3 Н). 8.2. 6-(4-Бензил-5-оксо-3-пропил-2,5-дигидро-1 Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 300 мг этил-2-бензил-3-оксогексаноата и 353 мгN-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 400 мг 6-(4-бензил-5-оксо-3-пропил 2,5-дигидро-1 Н-пиразол-1-ил)-N-этил-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 69%. t пл = 180 С. 9.1. [3-(2-Метоксиэтокси)фенил]метанол. Смесь 10 г (80,6 ммоль) 3-(гидроксиметил)фенола, 78,4 г (2 41,7 ммоль) CS2CO3 и 8,4 мл (88,6 ммоль) бромэтилметилового эфира в 150 мл CH3CN нагревают в течение 12 ч при 110 С. После доведения до t комн смесь фильтруют, сгущают при пониженном давлении, растворяют в 500 мл ДХМ, промывают насыщенным раствором хлорида натрия (2100 мл), сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Получают 10,9 г 3-(2-метоксиэтокси)фенил]метанола в виде маслоподобного вещества желтого цвета. Выход = 75%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,3 (т, 1 Н); 6,95 (м, 2H); 6,85 (д, 1H); 4,6 (с, 2 Н); 4,1 (т, 2 Н); 3,8 (т,2 Н); 3,4 (с, 3 Н); 2,1 (с ушир., 1 Н). 9.2. 1-(Бромметил)-3-(2-метоксиэтокси)бензол. По методике, описанной в примере 6.3, исходя из 10 г [3-(2-метоксиэтокси)фенил]метанола, получают 11,8 г 1-(бромметил)-3-(2-метоксиэтокси)бензола в виде маслоподобного вещества. Выход = 87%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 7,3 (м, 1 Н); 7,0 (м, 2 Н); 6,9 (д, 1 Н); 4,45 (с, 2 Н); 4,15 (т, 2 Н); 3,75(т, 2 Н); 3,4 (с, 3 Н). 9.3. Метил-2-[3-(2-метоксиэтокси)бензил]-3-оксобутаноат. По методике, описанной в примере 6.4, исходя из 5,6 г 1-(бромметил)-3-(2-метоксиэтокси)бензола и 2,52 г метилацетоацетата, получают 3,44 г метил-2-[3-(2-метоксиэтокси)бензил]-3-оксобутаноата в виде маслоподобного вещества желтого цвета. ЯМР 1H CDCl3, 400 МГц,(м.д.): 7,2 (т, 1H); 6,75(м, 3 Н); 4,15 (д, 2 Н); 3,8 (т, 1 Н); 3,75 (с, 3 Н); 3,45(с, 3 Н); 3,15 (д, 2 Н); 2,2 (с, 3 Н). 9.4. N-Этил-6-4-[3-(2-метоксиэтокси)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 336 мг метил-2-[3-(2-метоксиэтокси)бензил]-3 оксобутаноата и 351 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 441 мг N-этил 6-4-[3-(2-метоксиэтокси)бензил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-N-фенилпиридин-3 сульфонамида в виде порошка белого цвета. Выход = 70%. t пл = 126 С. M=C27H30N4O5S = 522; М + Н = 523; методика 2: t уд = 1,27 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1 Н); 8,6 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,4 (м, 3 Н); 7,3-7,1 (м, 3 Н); 6,8 (д, 2 Н); 7,1 (д, 1 Н); 4,1 (д, 2 Н); 3,6 (м, 4 Н); 3,5 (с, 2 Н); 3,3 (с, 3 Н); 2,1 (с,3 Н); 1,0 (т, 3 Н). Пример 10. 10.1. Метил-2-(4-метоксибензил)-3-оксобутаноат. Смесь 1,34 г (8,6 ммоль) 1-(хлорметил)-4-метоксибензола, 0,93 мл (8,6 ммоль) метилацетоацетата,0,24 г (0,86 ммоль) хлорида тетрабутиламмония и 6,9 г смеси "K2CO3/KOH" (соотношение по массе 4:1) в 5 мл толуола нагревают в течение 5 мин при 110 С в микроволновом нагревателе. Реакционную смесь разбавляют 80 мл AcOEt, последовательно промывают водой (220 мл), насыщенным раствором NaHCO3(20 мл), насыщенным раствором хлорида натрия (20 мл), сушат над Na2SO4 и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 30% AcOEt. Таким образом, получают 0,93 г метил-2(4-метоксибензил)-3-оксобутаноата в виде маслоподобного вещества желтого цвета. Выход = 48%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,2 (д, 1 Н); 7,1 (д, 1 Н); 6,8 (м, 2 Н); 3,8 (с, 3 Н); 3,75 (т, 1 Н); 3,7 (с,3 Н); 3,2 (м,2 Н); 2,2 (с, 3 Н). 10.2. N-Этил-6-[4-(4-метоксибензил)-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 300 мг метил-2-(4-метоксибензил)-3-оксобутаноата и 371 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 338 мг N-этил-6-[4-(4 метоксибензил)-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 56%. t пл = 188 С. M=C25H26N4O4S= 478; M + Н = 479; методика 2: t уд = 1,29 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 11,8 (с ушир., 1 Н); 8,6 (с ушир., 1 Н); 8,45 (с, 1 Н); 8,1 (д, 1 Н); 7,4 (м, 3 Н); 7,3-7,1 (м, 4 Н); 6,8 (д, 2 Н); 3,75 (с, 3 Н); 3,6 (с, 2 Н); 3,5 (с, 2 Н); 2,1 (с, 3 Н); 1,0 (т, 3 Н). Смесь 52 мг (0,2 ммоль) метил-2-(2-хлор-6-фторбензил)-3-оксобутаноата, 73 мг (0,25 ммоль) Nэтил-6-гидразино-N-фенилпиридин-3-сульфонамида и 5 мг pTsOH в 2 мл толуола нагревают в течение 12 ч при 110 С и затем сгущают при пониженном давлении. Остаток растворяют в 2 мл ДМФА, фильтруют и фильтрат хроматографируют на инверсной фазе RP18, элюируя смесью "Н 2 О (с 2% ТФУ)/CH3CN" с градиентом CH3CN от 0 до 100%. Получают 86 мг 6-[4-(2-хлор-6-фторбензил)-3-метил-5-оксо-2,5 дигидро-1 Н-пиразол-1-ил]-N-этил-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. Выход = 99%. tпл = 206 С. M = C24H22ClFN4O3S = 501; М + Н = 502; методика 1. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 11,9 (с ушир., 1 Н); 8,6 (с ушир., 1 Н); 8,4 (с, 1 Н); 8,0 (д, 1 Н); 7,5-7,3 (м, 5 Н); 7,2-7,0 (м, 3 Н); 3,7 (с, 2 Н); 3,6 (кв, 2 Н); 2,1 (с, 3 Н); 1,0 (т, 3 Н). Пример 12. N-Этил-6-[3-метил-5-оксо-4-(1-фенилциклопропил)-2,5-дигидро-1 Н-пиразол-1-ил]-Nфенилпиридин-3-сульфонамид (соединение 80 в табл. I)(0,8 ммоль) [ReBr(СО)3(ТГФ)]2 в 55 мл безводного толуола перемешивают в течение 18 ч при 50 С. После доведения до t комн смесь сгущают при пониженном давлении. Полученный остаток растворяют в 100 мл ДХМ, последовательно промывают водой (100 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, затем сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН", 99:1. Получают 5 г метил-2-ацетил-3-фенилбут-3 еноата в виде маслоподобного вещества желтого цвета. Выход = 84%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 12,6 (с, 1H); 7,3-7,2 (м, 5H); 5,7 (с, 1 Н); 5,1 (с, 1 Н); 3,55 (с, 3 Н); 1,9 (с, 3 Н).[ReBr(СО)3(ТГФ)]2 получают непосредственно перед использованием исходя из 2 г (4,9 ммоль)ReBr(CO)5 при перемешивании и нагревании с обратным холодильником в 60 мл безводного ТГФ в течение 16 ч. После сгущения при пониженном давлении и перекристаллизации из 5 мл смеси "нгексан/ТГФ" (1:1) получают 700 мг [ReBr(CO)3 (ТГФ)]2 в виде порошка белого цвета. Выход = 35%. 12.2. Метил-3-оксо-2-(1-фенилциклопропил)бутаноат. К раствору 1 г (4,6 ммоль) метил-2-ацетил-3-фенилбут-3-еноата в 16 мл ДХМ последовательно по каплям прибавляют 20,8 мл (22,9 ммоль) 1,1 М раствор диэтилцинка в толуоле и 3,7 мл (45,8 ммоль) дииодметана. Реакционную смесь нагревают в течение 18 ч с обратным холодильником. После доведения до t комн реакционную смесь обрабатывают 100 мл воды и затем осуществляют экстракцию посредством ДХМ (3100 мл). Органические фракции объединяют, последовательно промывают водой (4100 мл),насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/ACOEt", 95:5. Получают 280 мг метил-3-оксо-2-(1-фенилциклопропил) бутаноата в виде маслоподобного вещества желтого цвета. Выход = 2 6%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,3-6,9 (м, 5 Н); 3,7 (с, 1 Н); 3,6 (с, 3 Н); 2,0 (с, 3 Н); 1,4 (с, 2H); 1,25(с, 2H) 12.3. N-Этил-6-[3-метил-5-оксо-4-(1-фенилциклопропил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 280 мг метил-3-оксо-2-(1-фенилциклопропил)бутаноата и 352 мг N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 110 мг N-этил-6-[3 метил-5-оксо-4-(1-фенилциклопропил)-2,5-дигидро-1 Н-пиразол-1-ил]-N-фенилпиридин-3-сульфонамида в виде порошка белого цвета. t пл = 146 С. M=C26H26N4O3S= 474; M + Н = 475; методика 2: t уд = 1,44 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1 Н); 8,6 (с ушир., 1 Н); 8,4 (с, 1 Н); 8,1 (д, 1 Н); 7,4-7,1 (м, 10 Н); 3,6 (кв, 2 Н); 2,2 (с, 3 Н); 1,15 (дд, 4 Н); 1,0 (t, 3 Н). Пример 14. Гидрохлорид N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол 1-ил]пиридин-3-сульфонамида (соединение 98 В в табл. I) 14.1. N-трет-Бутил-6-хлорпиридин-3-сульфонамид. К смеси 17,3 мл (165 ммоль) трет-бутиламина и 69 мл (4 95 ммоль) ТЭА в 330 мл ДХМ при 0 С небольшими порциями прибавляют 35 г (165 ммоль) 6-хлорпиридин-3-сульфонилхлорида. После перемешивания в течение 2 ч при 0 С реакционную смесь разбавляют 600 мл ДХМ, промывают водой (1 л),насыщенным раствором NaHCO3 (1 л) и насыщенным раствором хлорида натрия (1 л), сушат над Na2SO4,фильтруют и сгущают при пониженном давлении. Получают 32,4 г N-трет-бутил-6-хлорпиридин-3 сульфонамида в виде твердого вещества белого цвета. Выход = 79%. ЯМР 1H CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,0 (д, 1 Н); 7,4 (д, 1 Н); 4,5 (сушир., 1 Н); 1,2 (с, 9 Н). 14.2. Метил-2-формил-3-(пиридин-3-ил)пропаноат. К суспензии 2,1 г (90,8 ммоль) натрия в 55 мл безводного Et2O при 0 С в атмосфере аргона по каплям прибавляют смесь 15 г (90,8 ммоль) метил-3-(пиридин-3-ил)пропаноата и 7,3 мл (57,41 ммоль) этилформиата. Затем смесь перемешивают в течение 12 ч при t комн, обрабатывают 200 мл воды и осуществляют экстракцию посредством 100 мл Et2O. Водную фракцию подкисляют до рН 5 и затем осуществляют экстракцию посредством AcOEt, 2300 мл. Далее органическую фракцию сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН" с градиентом МеОН от 0 до 10%. Получают 4,8 г метил-2 формил-3-(пиридин-3-ил)пропаноата в виде твердого вещества белого цвета. Выход = 28%. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 11,0 (с ушир., 1 Н); 8,45 (с, 1H); 8,4 (д, 1 Н); 7,7 (д, 1 Н); 7,5 (д,1 Н); 7,2 (дд, 1 Н); 3,6 (с, 2 Н); 3,5 (с, 3 Н). 14.3. N-трет-Бутил-6-гидразинилпиридин-3-сульфонамид. По методике, описанной в примере 5.2, исходя из 32,4 г N-трет-бутил-6-хлорпиридин-3 сульфонамида и 12,9 мл гидразинмоногидрата, получают 22,6 г N-трет-бутил-6-гидразинилпиридин-3 сульфонамида в виде твердого вещества белого цвета. Выход = 71%. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 8,3 (д, 2 Н); 7,8 (д, 1 Н); 7,2 (с, 1 Н); 7,0 (с ушир., 1 Н); 4,3 (с ушир., 2 Н); 1,2 (с, 9 Н). 14.4.N-трет-Бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3 сульфонамид (соединение 98 А в табл. I). По методике, описанной в примере 1.3, исходя из 12 г N-трет-бутил-6-гидразинилпиридин-3 сульфонамида и 9,1 г метил-2-формил-3-(пиридин-3-ил)пропаноата, получают 9,92 г N-трет-бутил-6-[5 оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3-сульфонамида в виде твердого вещества белого цвета. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 8,9 (с ушир. 1 Н); 8,5 (с ушир., 2 Н); 8,4 (с, 1 Н); 8,3 (д, 1 Н); 7,9(с, 1 Н); 7,8 (с, 1H); 7,7 (д, 1 Н); 7,3 (дд, 1 Н); 3,6 (с, 2 Н); 1,2 (с, 9 Н). Выход = 64%. t пл = 160 С. M=C18H21N5O3S= 387; М + Н = 388; методика 2: t уд = 0,58 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,3 (с ушир., 3H); 8,4 (с, 1 Н); 8,3 (д, 1 Н); 7,9 (с,1 Н); 7,7 (д, 1 Н); 7,4 (т, 1 Н); 3,6 (с, 2 Н); 3,4 (с ушир., 1 Н); 1,1 (с, 9 Н). 14.5. Гидрохлорид N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил] пиридин-3-сульфонамида. К 912 мг N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3 сульфонамида в 20 мл ДХМ прибавляют 1 экв HCl (4 н. раствор в диоксане) и затем смесь сгущают в вакууме. Получают 1 г гидрохлорида N-трет-бутил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Нпиразол-1-ил]пиридин-3-сульфонамида в виде порошка белого цвета. Выход = 100%. t пл = 140 С. 15.1. Этил-2-формилбутандиоат. К суспензии 1,32 г (57,41 ммоль) натрия в 35 мл безводного Et2O при 0 С в атмосфере аргона по каплям прибавляют смесь 10 г (57,41 ммоль) этилбутандиоата и 4,62 мл (57,41 ммоль) этилформиата. Затем смесь перемешивают в течение 12 ч при t комн, прибавляют 100 мл воды и осуществляют экстракцию посредством 100 мл Et2O. Водную фракцию подкисляют до рН 5 и затем осуществляют экстракцию посредством 100 мл Et2O. Далее органическую фракцию сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем,элюируя смесью "циклогексан/ACOEt", 7:3. Получают 4,3 г этил-2-формилбутандиоата в виде бесцветного маслоподобного вещества. Выход = 37%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 10,0 (с, 1H); 7,1 (д, 1 Н); 4,4-4,2 (м, 5H); 2,9 (дд, 2H); 1,3 (м, 6 Н). 15.2. (2-5-[Этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)уксусная кислота. Смесь 2,17 г (7,42 ммоль) N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида и 1,5 г (7,42 ммоль) этил-2-формилбутандиоата в 15 мл EtOH нагревают в течение 5 ч при 80 С. Затем смесь сгущают при пониженном давлении. Полученный осадок растирают с Et2O, затем отделяют фильтрованием и сушат с вакуумным насосом. 4,1 г полученного порошка бежевого цвета при t комн прибавляют к раствору 212 мг (9,23 ммоль) натрия, растворенного в 17 мл безводного МеОН, и перемешивают в течение 2 ч. Смесь сгущают при пониженном давлении, затем растворяют в 10 мл воды и 4 мл 1 н. раствора гидроксида натрия и далее перемешивают в течение 12 ч при t комн. Затем смесь подкисляют до рН 5 посредством 1 н. раствора HCl и далее осуществляют экстракцию посредством ДХМ (2100 мл). Объединенные органические фракции сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток перекристаллизовывают из пентана, отделяют фильтрованием и сушат в вакууме. Получают 2,1 г (2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)уксусной кислоты в виде порошка белого цвета. Выход = 58%. t пл = 174 С. M=C18H18N4O5S = 402; М + Н = 403; методика: t уд = 1,02 мин. ЯМР 1H, d6-ДMCO, 400 МГц,(м.д.): 12,0 (с ушир., 2 Н); 8,6 (с ушир., 1 Н); 8,5 (с ушир., 1 Н); 8,2 (д,1 Н); 7,9 (с ушир., 1 Н); 7,4 (м, 3 Н); 7,2 (д, 2 Н); 3,7 (кв, 2 Н); 3,4 (с, 2 Н); 1,0 (т, 3 Н). Пример 16. Метил-(2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол 4-ил)ацетат (соединение 107 в табл. I) 16.1. Метил-(2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил) ацетат. Смесь 0,5 г (1,24 ммоль) (2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Нпиразол-4-ил)уксусной кислоты и 0,256 г (1,24 ммоль) DCC перемешивают в течение 3 ч при t комн. Образовавшийся осадок отделяют фильтрованием и фильтрат сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН", 9/1. Получают 0,5 г (2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)ацетата в виде порошка коричневого цвета. Выход = 96%. t пл = 110 С. M=C19H20N4O5S= 416; M + Н = 417; методика 2; t уд = 1,44 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1 Н); 8,6 (с, 1 Н); 8,4 (с, 1 Н); 8,2 (д, 1 Н); 7,9 (с,1 Н); 7,4 (м, 3 Н); 7,2 (д, 2 Н); 5,6 (д, 0,5 Н); 3,75 (кв, 2 Н); 3,7 (с, 3 Н); 3,3 (д, 1,5 Н); 1,0 (т, 3 Н). Пример 17. 2-(2-5-[Этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)N-метилацетамид (соединение 108 в табл. I) К смеси 0,28 г (0,7 ммоль) (2-5-[этил(фенил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Нпиразол-4-ил)уксусной кислоты, 0,61 мл (3,48 ммоль) DIEA и 0,8 мл (1,4 ммоль) метиламина (2 н. раствор в ТГФ) в 2 мл ДХМ при 0 С прибавляют 0,33 г (1,04 ммоль) TBTU. После перемешивания в течение 3 ч при t комн смесь разбавляют 500 мл ДХМ, последовательно промывают 0,1 н. раствором HCl (240 мл),насыщенным раствором NaHCO3 (240 мл) и насыщенным раствором хлорида натрия (30 мл), сушат надNa2SO4, затем сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН", 95:5. Получают 18 мг 2-(2-5-[этил(фенил)сульфамоил]пиридин-2 ил-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)-N-метилацетамида в виде порошка коричневого цвета. Выход 18.1. Диэтил-2-бензил-3-оксопентандиоат. В атмосфере аргона при t комн 1,7 г (74,18 ммоль) натрия вносят в 75 мл безводного EtOH. Затем приt комн по каплям прибавляют сначала 13,5 мл (74,2 ммоль) диэтил-3-оксопентандиоата и затем 8,8 мл (74,2 ммоль) бензилбромида. Далее смесь нагревают в течение 3 ч с обратным холодильником, сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом AcOEt от 0 до 20%. Получают 8,29 г диэтил-2-бензил-3-оксопентандиоата в виде прозрачного маслоподобного вещества. Выход = 38%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,4-7,2 (м, 5 Н); 4,2 (м, 4 Н); 4,1 (т, 1 Н); 3,2 (д, 2 Н); 1,2 (м,6 Н). 18.2. 4-Бензил-1-5-[(этил(фенил)сульфамоил]пиридин-2-ил)-5-оксо-2,5-дигидро-1 Н-пиразол-3-ил этилацетат. По методике, описанной в примере 1.3, исходя из 5 г (17,1 ммоль) диэтил-2-бензил-3-оксопентандиоата и 5 г (17,1 ммоль) N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 3 г этил-4 бензил-1-5-[(этил(фенил)сульфамоил]пиридин-2-ил)-5-оксо-2,5-дигидро-1 Н-пиразол-3-илацетата в виде порошка белого цвета. Выход = 34%. t пл= 156 С. M=C27H28N4O5S= 520; М + Н = 521; методика 2: t уд 19.1. (5-Бромпиридин-3-ил)метанол. К раствору 12 г (59,4 ммоль) 5-бромпиридин-3-карбоновой кислоты в 300 мл безводного ТГФ в атмосфере аргона при -10 С прибавляют сначала 6,6 мл NMM и затем 5,7 мл (59,4 ммоль) этилхлорформиата. После перемешивания в течение 20 мин при -10 С небольшими порциями прибавляют 6,8 г (179,8 ммоль) борогидрида натрия. Далее смесь охлаждают до -70 С и в течение 1 ч 30 мин прибавляют 400 млMeOH. Затем температуре дают повышаться до t комн и перемешивают в течение 12 ч. Далее смесь сгущают при пониженном давлении и затем очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН", 98:2. Получают 8,4 г (5-бромпиридин-3-ил)метанола в виде маслоподобного вещества желтого цвета. Выход = 75%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,5 (с, 1H); 8,4 (с, 1H); 7,9 (1H, с); 4,6 (с, 2H); 2,8 (с ушир., 1 Н). 19.2. 5-(Гидроксиметил)пиридин-3-карбонитрил. Смесь 4,2 г (22,34 ммоль) (5-бромпиридин-3-ил)метанола, 5 г (55,84 ммоль) цианида меди в 22 мл пиридина нагревают в течение 20 ч в загерметизированной ампуле при 160 С. После доведения до t комн смесь обрабатывают 10 мл концентрированного аммиака и 30 мл насыщенного раствора NH4Cl и затем перемешивают в течение 2 ч. Далее из реакционной смеси осуществляют экстракцию посредством 200 мл смеси "ДХМ/iPrOH" (85:15), сушат над Na2SO4, затем сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "ДХМ/МеОН", 98:2. Получают 2,13 г 5(гидроксиметил)пиридин-3-карбонитрила в виде твердого вещества белого цвета. Выход = 51%. ЯМР 1H, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,9 (д, 2 Н); 8,0 (с, 1 Н); 4,9 (с, 2 Н); 2,3 (с ушир., 1 Н). 19.3. 5-(Хлорметил)пиридин-3-карбонитрил. К 0,2 г (1,49 ммоль) 5-(гидроксиметил)пиридин-3-карбонитрила в 2 мл ДХМ прибавляют 1 мл (4 ммоль) 4 н. раствора HCl в диоксане. Смесь сгущают при пониженном давлении, затем прибавляют 0,65 мл (8,95 ммоль) тионилхлорида и далее нагревают в течение 3 ч при 60 С. После доведения до t комн смесь обрабатывают 20 мл толуола, образовавшийся осадок отделяют фильтрованием и затем обрабатывают 30 мл ДХМ и 30 мл насыщенного раствора NaHCO3. Органическую фракцию отделяют, сушат над Na2SO4 и затем сгущают при пониженном давлении. Получают 161 мг 5-(хлорметил)пиридин-3-карбонитрила в виде маслоподобного вещества. Выход = 73%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,9 (д, 2H); 8,0 (с, 1H); 3,5 (с, 2 Н). 19.4. Метил-2-[(5-цианопиридин-3-ил)метил]-3-оксобутаноат. К суспензии 84 мг (2,11 ммоль) гидрида натрия (60%-я суспензия в масле) в 3 мл безводного ДМЭ в атмосфере аргона при 0 С прибавляют 0,23 мл (2,11 ммоль) метилацетоацетата. Реакционную смесь перемешивают в течение 1/2 ч при 0 С и в течение 1/2 ч при t комн и затем прибавляют 161 мг (1,06 ммоль) 5-(хлорметил)пиридин-3-карбонитрила, растворенного в 1 мл ДМЭ, и 29 мг (0,11 ммоль) иодида тетрабутиламмония. Смесь нагревают при 65 С в течение 4 ч. После доведения до t комн смесь обрабатывают 10 мл воды, нейтрализуют прибавлением 0,1 н. раствора HCl, затем осуществляют экстракцию посредствомTAcOEt (240 мл), сушат над Na2SO4, сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" (8:2). Получают 140 мг метил-2-[(5 цианопиридин-3-ил)метил]-3-оксобутаноата в виде бесцветного маслоподобного вещества. Выход = 57%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,6 (с, 1 Н); 7,8 (с, 1 Н); 3,7 (т, 1 Н); 3,65 (с,3 Н); 3,2 (дд, 2 Н); 2,2 (с, 3 Н). 19.5. 6-4-[(5-Цианопиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-N-этил-Nфенилпиридин-3-сульфонамид. По методике, описанной в примере 1.3, исходя из 125 мг (0,43 ммоль) метил-2-[(5-цианопиридин-3 ил)метил]-3-оксобутаноата и 99 мг (0,43 ммоль) N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида,получают 103 мг 6-4-[(5-цианопиридин-3-ил)метил]-3-метил-5-оксо-2,5-дигидро-1 Н-пиразол-1-ил-Nэтил-N-фенилпиридин-3-сульфонамида в виде порошка желтого цвета. Выход = 51%. t пл = 164 С. 20.1. 2-Хлор-5-(фенилсульфанил)пиридин. Смесь 3,4 г (14,3 ммоль) 2-хлор-5-иодпиридина, 1,9 г (17,2 ммоль) тиофенола, 0,93 г (17,2 ммоль) метилата натрия и 0,36 г (5,7 ммоль) меди в 18 мл МеОН нагревают в течение 12 ч при 80 С. После доведения до t комн смесь разбавляют 100 мл 1 н. раствора NaOH и МеОН выпаривают при пониженном давлении. Из реакционной смеси осуществляют экстракцию посредством TacOEt (2100 мл), органическую фракцию промывают 0,1 н. раствором NaOH (230 мл), затем сушат над Na2SO4, сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" (8:2). Получают 1,90 г 2-хлор-5-(фенилсульфанил)пиридина в виде порошка белого цвета. Выход = 60%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,5 (д, 1 Н); 8,3 (с, 1 Н); 7,9 (1 Н, с); 7,5-7,4 (м, 5 Н). 20.2. 2-Хлор-5-(фенилсульфонил)пиридин. К раствору 1,9 г (8,57 ммоль) 2-хлор-5-(фенилсульфанил)пиридина в 40 мл ДХМ при t комн в течение 1/4 ч прибавляют суспензию 4,8 г (21,42 ммоль) 77%-й 3-хлорпербензойной кислоты в 20 мл ДХМ. После перемешивания в течение 1 ч образовавшийся осадок отделяют фильтрованием, фильтрат разбавляют 200 мл ДХМ, последовательно промывают 100 мл 0,2 н. раствора гидроксида натрия и 100 мл насыщенного раствора тиосульфата натрия, сушат над Na2SO4, сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" (8:2). Получают 0,67 г 2-хлор-5-(фенилсульфонил)пиридина в виде порошка белого цвета. Выход = 31%. ЯМР 1 Н, ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,9 (с, 1 Н); 8,1-7,9 (м, 3 Н); 7,6-7,4 (3 Н, м); 7,3 (м, 1H). 20.3. 2-Гидразинил-5-(фенилсульфонил)пиридин. По методике, описанной в примере 5.2, исходя из 0,67 г (2,64 ммоль) 2-хлор-5-(фенилсульфонил) пиридина, получают 340 мг 2-гидразинил-5-(фенилсульфонил)пиридина в виде порошка белого цвета. Выход = 51%. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 9,0 (с, 1 Н); 8,6 (д, 1 Н); 8,5 (с, 1 Н); 8,4 (м, 2 Н); 8,0 (д, 1 Н); 7,87,5 (м, 3 Н); 7,3 (м, 1 Н); 3,3 (с ушир., 1 Н). 20.4. 5-Метил-2-[5-(фенилсульфонил)пиридин-2-ил]-4-(пиридин-3-илметил)-1,2-дигидро-3 Н-пиразол-3-он. По методике, описанной в примере 1.3, исходя из 340 мг (1,36 ммоль) 2-гидразинил-5(фенилсульфонил)пиридина и 283 мг (1,36 ммоль) метил-3-оксо-2-(пиридин-3-илметил)бутаноата, получают 130 мг 5-метил-2-[5-(фенилсульфонил)пиридин-2-ил]-4-(пиридин-3-илметил)-1,2-дигидро-3 Н-пиразол-3-она в виде порошка белого цвета. Выход = 23%. t пл = 176 С. M=C21H18N4O3S= 406; М + Н = 407; методика 2: t yд = 0,78 мин. ЯМР 1H, d6-ДМСО, 400 МГц,(м.д.) 12,0 (с ушир., 1 Н); 9,0 (с, 1 Н); 8,6 (д, 1 Н); 8,5 (с, 1 Н); 8,4 (м,2 Н); 8,0 (д, 2 Н); 7,8-7,6 (м, 4 Н); 7,3 (м, 1 Н); 3,6 (с, 2 Н); 2,2 (с, 3 Н). Пример 21. Гидрохлорид N-этил-6-4-[(5-метоксипиридин-3-ил)метил]-5-оксо-2,5-дигидро-1 Нпиразол-1-ил-N-фенилпиридин-3-сульфонамида (соединение 101 в табл. I) 21.1. Метил-(2 Е)-3-(5-метоксипиридин-3-ил)проп-2-еноат. К суспензии 3,12 г (78,1 ммоль) гидрида натрия (60%-я суспензия в масле) в 30 мл безводного ТГФ в течение 45 мин в атмосфере аргона при 0 С прибавляют 16,4 г (78,1 ммоль) (метил диэтоксифосфорил)ацетата в 10 мл ТГФ. Перемешивают в течение 1/2 ч при 0 С и затем при 0 С по каплям прибавляют 5,1 г (37,2 ммоль) 5-метоксипиридин-3-карбальдегида в 20 мл безводного ТГФ. После доведения до t комн реакционную смесь обрабатывают 150 мл воды и затем осуществляют экстракцию посредством AcOEt(3100 мл). Органические фракции объединяют, последовательно промывают водой (220 мл), сушат надNa2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом от 0 до 40% AcOEt. Получают 1 г метил-1(2 Е)-3-(5-метоксипиридин-3-ил)проп-2-еноата в виде порошка белого цвета. Выход = 14%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 8,4 (д, 1H); 7,7 (д, 1H); 7,4 (с, 1 Н); 6,5 (д, 1 Н); 3,9 (с, 3 Н); 3,8 (с,3 Н). 21.2. Метил-3-(5-метоксипиридин-3-ил)пропаноат. В приборе Парра смесь 1 г (5,33 ммоль) метил-(2E)-3-(5-метоксипиридин-3-ил)проп-2-еноата в 20 мл МеОН и 0,1 г Pd/C, 10%, гидрируют при 7 бар в течение 5 ч. Далее реакционную смесь фильтруют через бумагу Whatman GF/F и сгущают при пониженном давлении. Таким образом, получают 1 г метил 3-(5-метоксипиридин-3-ил)пропаноата в виде воскоподобного вещества, используемого в таком виде на следующей стадии. Выход = 100%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 8,3 (с, 1 Н); 8,2 (с, 1 Н); 7,1 (с, 1 Н); 3,85 (с, 3 Н); 3,6 (с, 3 Н); 3,0 (т,2 Н); 2,7 (т, 3 Н). 21.3. Метил-2-формил-3-(5-метоксипиридин-3-ил)пропаноат. По методике, описанной в примере 14.2, исходя из 1,04 г (5,33 ммоль) метил-3-(5-метоксипиридин 3-ил)пропаноата, получают 600 мг метил-2-формил-3-(5-метоксипиридин-3-ил) пропаноата в виде воскоподобного вещества, используемого в таком виде на следующей стадии. Выход = 51%. 21.4. Гидрохлорид N-этил-6-4-[(5-метоксипиридин-3-ил)метил]-5-оксо-2,5-дигидро-1 Н-пиразол-1 ил-N-фенилпиридин-3-сульфонамида. По методике, описанной в примере 2.3, исходя из 250 мг (1,12 ммоль) метил-2-формил-3-(5 метоксипиридин-3-ил)пропаноата и 327 мг (1,12 ммоль) N-этил-6-гидразино-N-фенилпиридин-3-сульфонамида, получают 131 мг гидрохлорида N-этил-6-4-[(5-метоксипиридин-3-ил)метил]-5-оксо-2,5 дигидро-1 Н-пиразол-1-ил-N-фенилпиридин-3-сульфонамида в виде лиофилизата. Выход =25%. t пл = 136 С. M=C23H23N5O4S= 4 65; М + Н = 466; методика 2: tуд = 0,97 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 11,0 (с ушир., 1 Н); 8,6 (с, 2 Н); 8,4 (д, 2 Н); 8,2 (д, 1 Н); 8,1 (с,1 Н); 7,9 (с, 1 Н); 7,4 (м, 3 Н); 7,1 (д, 2 Н); 4,0 (с, 3 Н); 3,8 (с, 2 Н); 3,6 (кв, 2 Н); 1,0 (т, 3 Н). Пример 22. Метил-2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1 Н-пиразол-4 ил(фенил)ацетат (соединение 113 в табл. I)EtOH и 75 мл воды нагревают в течение 18 ч при 60 С. Затем смесь сгущают при пониженном давлении,обрабатывают 500 мл насыщенного раствора хлорида натрия и осуществляют экстракцию посредствомEt2O (2500 мл). Органические фракции сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Получают 43,5 г этил-3-циано-3-фенилпропаноата в виде твердого вещества, используемого в таком виде на следующей стадии. Выход = 83%. 22.2. 2-Фенилбутандиовая кислота. Смесь 43,5 г (214 ммоль) этил-3-циано-3-фенилпропаноата, 52,2 г (930,4 ммоль) гидроксида калия в 670 мл EtOH нагревают с обратным холодильником в течение 4 ч. После доведения до t комн смесь сгущают в вакууме и затем обрабатывают 1 л 1 н. раствора HCl, при этом образуется осадок, который отделяют фильтрованием и промывают водой (250 мл). Полученное твердое вещество обрабатывают смесью 200 мл толуола и 40 мл EtOH, сгущают при пониженном давлении и затем сушат с вакуумным насосом. Получают 37 г 2-фенилбутандиовой кислоты в виде твердого вещества, используемого в таком виде на следующей стадии. Выход =89%. 22.3. Диэтил-2-фенилбутанедиоат. В приборе Дина-Старка смесь 37 г (190,5 ммоль) 2-фенилбутандиовой кислоты, 6 мл концентрированной H2SO4, 80 мл толуола и 80 мл EtOH нагревают с обратным холодильником в течение 72 ч. После доведения до t комн реакционную смесь сгущают при пониженном давлении, затем обрабатывают 300 мл воды и осуществляют экстракцию посредством Et2O (2400 мл). Органические фракции объединяют,сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом AcOEt от 0 до 10%, и получают 22 г диэтил-2-фенилбутандиоата в виде маслоподобного вещества. Выход = 46%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,5 (м, 5 Н); 4,2 (м, 5 Н); 3,0 (дд, 2 Н); 1,0 (т, 6 Н). 22.4. Диэтил-2-формил-3-фенилбутандиоат. По методике, описанной в примере 14.2, исходя из 7,0 г (28 ммоль) диэтил-2-фенилбутандиоата,получают 7,0 г диэтил-2-формил-3-фенилбутандиоата в виде маслоподобного вещества. Выход = 89%.(с, 1 Н); 4,1 (кв, 2 Н); 1,0 (м, 12 Н). 22.6. 1-[5- (трет-Бутилсульфамоил)пиридин-2-ил]-4-[карбокси(фенил)метил]-1 Н-пиразол-5-олат. Смесь 2,8 г (5,8 ммоль) 2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1 Н-пиразол 4-ил(фенил)этилацетата и 5,8 мл (5,8 ммоль) 1 н. раствора NaOH в 12 мл EtOH перемешивают в течение 5 ч при t комн, затем прибавляют 5,8 мл 1 н. раствора HCl и из смеси осуществляют экстракцию посредством ДХМ (2100 мл). Органические фракции сушат над Na2SO4, фильтруют и затем сгущают при пониженном давлении. Получают 2 г [5-(трет-бутилсульфамоил)пиридин-2-ил]-4-[карбокси(фенил)метил]1 Н-пиразол-5-олата в виде порошка бежевого цвета, используемого в таком виде на следующей стадии. 22.7. Метил-2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро-1 Н-пиразол-4-ил)(фенил)ацетат. К смеси 0,3 г (0,66 ммоль) 1-[5-(трет-бутилсульфамоил)пиридин-2-ил]-4-[карбокси(фенил)метил]1 Н-пиразол-5-олата в 3 мл безводного МеОН при 0 С прибавляют 0,11 мл (0,73 ммоль) тионилхлорида. После доведения до t комн перемешивают в течение 12 ч. Смесь разбавляют 40 мл ДХМ, промывают 20 мл насыщенного раствора NaHCO3, сушат над Na2SO4 и затем сгущают при пониженном давлении. Полученный остаток перекристаллизовывают из смеси "ДХМ/пентан", затем отделяют фильтрованием и сушат в вакууме. Получают 0,67 г метил-2-[5-(трет-бутилсульфамоил)пиридин-2-ил]-3-оксо-2,3-дигидро 1 Н-пиразол-4-ил(фенил)ацетата в виде порошка бежевого цвета. Выход = 73%. t пл = 66 С. 23.1. 6-Хлор-N-циклопентилпиридин-3-сульфонамид. По методике, описанной в примере 14.1, исходя из 5 г (23,6 ммоль) 6 хлорпиридин-3 сульфонилхлорида и 2 г (23,6 ммоль) циклопентиламина, получают 5,1 г 6-хлор-N-циклопентилпиридин-3 сульфонамида в виде твердого вещества коричневого цвета. Выход = 84%. ЯМР 1H, CDCl3, 400 МГц,(м.д.): 8,8 (с, 1 Н); 8,0 (д, 1 Н); 7,4 (д,1 Н); 4,5 (д, 1 Н); 3,6 (м, 1 Н); 1,8 (м,2 Н); 1,6 (м, 4 Н); 1.3 (м, 2 Н). 23.2. Метил-N-[(6-хлорпиридин-3-ил)сульфонил]-N-циклопентилглицинат. Смесь 2 г (7,67 ммоль) 6-хлор-N-циклопентилпиридин-3-сульфонамида, 0,7 мл (7,67 ммоль) метилбромацетата и 1,2 г (8,4 ммоль) K2CO3 в 15 мл CH3CN нагревают в течение 12 ч при 80 С. После доведения до t комн смесь фильтруют и фильтрат сгущают. Остаток растворяют в 100 мл ДХМ, последовательно промывают 50 мл насыщенного раствора NaHCO3 и 50 мл воды, затем органическую фракцию сушат надNa2SO4, сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем,элюируя смесью "гептан/AcOEt", 8:2. Получают 2,4 г метил-N-[(6-хлорпиридин-3-ил)сульфонил]-Nциклопентилглицината в виде маслоподобного вещества. Выход = 93%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.) 9,0 (с, 1H); 8,3 (д, 1 Н); 7,4 (д, 1 Н); 4,1 (с, 2 Н); 4,05 (м, 1 Н); 3,8 (с,3 Н); 1,9 (м, 2 Н);1,6 (м, 4 Н); 1,3 (м, 2 Н). 23.3. Метил-N-циклопентил-N-[(6-гидразинилпиридин-3-ил)сульфонил]глицинат. По методике, описанной в примере 5.2, исходя из 2,4 г (7,2 ммоль) метил-N-[(6-хлорпиридин-3 ил)сульфонил]-N-циклопентилглицината, получают 2 г метил-N-циклопентил-N-[(6-гидразинилпиридин 3-ил)сульфонил]глицината в виде твердого вещества желтого цвета. Выход = 85%. ЯМР 1H, CDCl3, 400 МГц,(м.д.) 8,6 (с, 1 Н); 8,0 (д, 1 Н); 6,8 (д, 1 Н); 6,6 (с ушир., 1 Н); 4,05 (м, 1 Н); 4,0 (с, 2 Н); 3,6 (с, 3 Н); 1,8 (м, 2 Н); 1,6 (м, 4 Н); 1,2 (м, 2 Н). 23.4. Гидрохлорид метил-N-циклопентил-N-(6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Нпиразол-1-ил]пиридин-3-илсульфонил)глицината. По методике, описанной в примере 2.3, исходя из 200 мг (0,61 ммоль) метил-N-циклопентил-N-[(6 гидразинилпиридин-3-ил)сульфонил]глицината и 117 мг (0,61 ммоль) метил-3-оксо-2-(пиридин-3 илметил)бутаноата, получают 130 мг гидрохлорида метил-N-циклопентил-N-(6-[5-оксо-4-(пиридин-3 илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин-3-илсульфонил)глицината в виде лиофилизата белого 24.1. 2,2-Диметилпропил-6-хлорпиридин-3-карбоксилат. К раствору 10 г (56,8 ммоль) 6-хлорпиридин-3-карбонилхлорида в 100 мл безводного толуола в атмосфере аргона при t комн прибавляют 15 г (170,4 ммоль) 2,2-диметилпропанола. Затем реакционную смесь нагревают в течение 6 ч при 80 С. После доведения до t комн смесь сгущают и полученный остаток растворяют в 800 мл AcOEt, последовательно промывают водой (2200 мл), насыщенным раствором NaHCO3 (2200 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4, затем сгущают при пониженном давлении и очищают хроматографией на колонке с силикагелем, элюируя смесью "циклогексан/AcOEt" с градиентом AcOEt от 0 до 5%. Получают 11,9 г 2,2-диметилпропил-6-хлорпиридин-3 карбоксилата в виде порошка белого цвета. Выход = 92%. ЯМР 1 Н, CDCl3, 400 МГц,(м.д.): 7,5 (м, 5 Н); 4,2 (м, 5 Н); 3,0 (дд, 2 Н; 1,0 (т, 6 Н). 24.2. 2,2-Диметилпропил-6-гидразинилпиридин-3-карбоксилат. По методике, описанной в примере 5.2, исходя из 11,9 г (52,26 ммоль) 2,2-диметилпропил-6 хлорпиридин-3-карбоксилата, получают 4,3 г 2,2-диметилпропил-6-гидразинилпиридин-3-карбоксилата в виде порошка белого цвета. Выход = 37%. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 8,7 (с, 1 Н); 8,15 (д, 1 Н); 6,9 (д, 1 Н); 4,0 (с, 2 Н); 3,5 (с ушир.,1 Н); 1,0 (с, 9 Н). 24.3. 2,2-Диметилпропил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил]пиридин 3-карбоксилат. По методике, описанной в примере 1.3, исходя из 0,3 г (1,34 ммоль) 2,2-диметилпропил-6 гидразинилпиридин-3-карбоксилата и 0,26 г (1,34 ммоль) метил-3-оксо-2-(пиридин-3-илметил)бутаноата,получают 185 мг 2,2-диметилпропил-6-[5-оксо-4-(пиридин-3-илметил)-2,5-дигидро-1 Н-пиразол-1-ил] пиридин-3-карбоксилата в виде твердого вещества белого цвета. Выход = 38%. t пл = 160 С. М=C20H22N4O3 = 366; М + Н = 367; методика 2: t уд = 1,01 мин. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.): 12,0 (с ушир., 1 Н); 8,9 (с, 1 Н); 8,8 (с, 1 Н); 8,7 (д, 1 Н); 8,5 (д,1 Н); 8,4 (д, 1 Н); 8,3 (д,1 Н); 8,0 (т, 1 Н) 7,9 (с, 1 Н); 3,9 (с, 2 Н); 3,8 (с, 2 Н); 1,0 (с, 9 Н). Пример 25. Метил-3-(2-5-[циклопентил(метил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Нпиразол-4-ил)-3-фенилпропаноат (соединение 121 в табл. I) 25.1. Диэтил-3-фенилпентандиоат. Смесь 6 г (28,8 ммоль) 3-фенилпентандиовой кислоты и 7,9 мл (109,5 моль) тионилхлорида нагревают при 80 С в течение 1 ч. Затем смесь сгущают и полученное твердое вещество при 0 С небольшими порциями вносят в 8 млEtOH. Далее смесь нагревают при 80 С в течение 1/2 ч. После доведения до t комн смесь сгущают, полученный остаток растворяют в 400 мл ДХМ, последовательно промывают насыщенным растворомNaHCO3 (2100 мл) и насыщенным раствором хлорида натрия (100 мл), сушат над Na2SO4 и затем сгущают при пониженном давлении. Получают 6,97 г диэтил-3-фенилпентандиоата в виде порошка, используемого в таком виде на следующей стадии. Выход = 91,5%. 25.2. Диэтил-2-формил-3-фенилпентандиоат. По методике, описанной в примере 14.2, исходя из 3 г (11,35 ммоль) диэтил-3-фенилпентандиоата,получают 0,23 г диэтил-2-формил-3-фенилпентандиоата в виде маслоподобного вещества желтого цвета. Выход = 7%. ЯМР 1 Н, d6-ДМСО, 400 МГц,(м.д.) 10,9 (с, 1 Н); 7,7 (д, 1H); 7,3-7,1 (м, 5 Н); 4,5 (т, 1H); 4,0 (кв,4H); 3,0 (м, 2 Н); 1,0 (м, 6 Н). 25.3. 3-(2-5-[Циклопентил(метил)сульфамоил]пиридин-2-ил-3-оксо-2,3-дигидро-1 Н-пиразол-4 ил)-3-фенилпропаноат. По методикам примеров 22.5 и 22.6, исходя из 0,23 г (0,79 ммоль) диэтил-2-формил-3 фенилпентандиоата и 0,21 г (0,79 ммоль) N-циклопентил-6-гидразинил-N-метилпиридин-3-сульфонамида, получают 0,38 г 3-(1-5-[циклопентил(метил)сульфамоил]пиридин-2-ил-5-оксидо-1 Н-пиразол-4 ил)-3-фенилпропаноата в виде порошка. Выход = 89%.
МПК / Метки
МПК: A61P 9/00, A61K 31/497, A61K 31/5375, C07D 401/04, A61P 27/00, C07D 401/14, G01N 33/53, A61P 7/00, C07D 409/14, A61K 31/444, A61K 31/4439, A61P 25/00, A61K 31/4545
Метки: получение, активаторов, качестве, применение, терапии, 2-пиридин-2-ил-пиразол-3(2h)-она, производные
Код ссылки
<a href="https://eas.patents.su/30-19591-proizvodnye-2-piridin-2-il-pirazol-32h-ona-ih-poluchenie-i-primenenie-v-terapii-v-kachestve-aktivatorov-hif.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-пиридин-2-ил-пиразол-3(2h)-она, их получение и применение в терапии в качестве активаторов hif</a>
Предыдущий патент: Ингибитор p38 mapk-киназы
Следующий патент: Способ вырезания и размещения накладки на изогнутой подложке
Случайный патент: Сульфонатные соли 2-амино-3-карбэтоксиамино-6-(4-фторбензиламино)пиридина












