Производные 5,6-бис-арил-2-пиридинкарбоксамида, их получение и их применение в терапии в качестве антагонистов рецепторов уротензина ii
Номер патента: 16352
Опубликовано: 30.04.2012
Авторы: Пети Фредерик, Верньер Жан-Клод, Фоссе Валери, Жаниак Филип, Альтенбюрже Жан-Мишель, Лассалль Жильбер
Формула / Реферат
1. Соединения, отвечающие формуле (I)
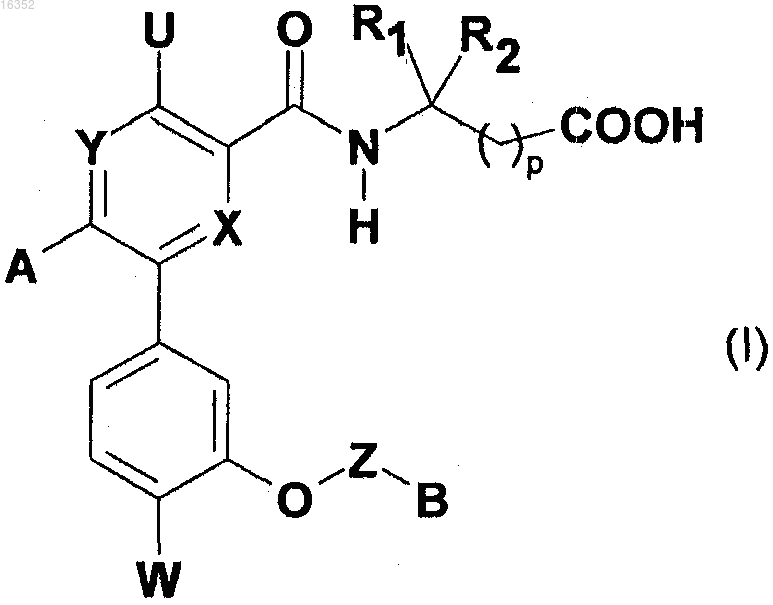
в которой X и Y обозначают, независимо один от другого, атом азота или звено -CR3-, где R3 обозначает атом водорода, или алкил, или алкокси;
U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода или алкил;
А обозначает арил, гетероарил или гетероциклоалкил, которые могут быть в случае необходимости замещены в каких-либо положениях одной или несколькими группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси, -O-(СН2)р-O-алкила, галогеналкокси, -NRR', -NR-CO-алкила и -SO2-алкила, где R и R' обозначают, независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 5;
W обозначает атом галогена, алкил или галогеналкил;
Z обозначает связь или алкилен, в случае необходимости замещенный одной или несколькими группами, выбранными из атома галогена и алкила, гидрокси и алкокси;
В обозначает
либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил или гидроксиалкил или R4 и R5 образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкильной группой,
либо гетероцикл следующей формулы:
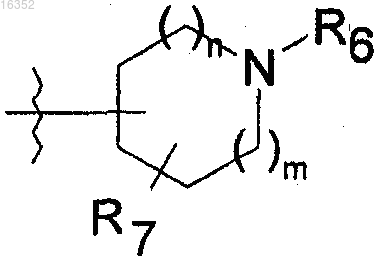
где m и n обозначают, независимо один от другого, 0, 1 или 2;
R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил;
R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или
-CH2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и -O-CO-алкила, причем по меньшей мере один из R1 или R2 отличается от атома водорода, либо
R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси, -O-CO-алкила и ацила;
р обозначает целое число, равное 0 или 1;
где галоген представляет собой атом фтора, хлора, брома или йода;
алкил представляет собой линейную алифатическую группу, содержащую от 1 до 5 атомов углерода, или, когда алкильная цепь содержит по меньшей мере три атома углерода, она может быть линейной, разветвленной или частично циклизованной;
циклоалкил представляет собой насыщенную циклическую группу, которая содержит от 3 до 8 атомов углерода;
гетероциклоалкил представляет собой циклоалкильную группу, такую как определенная выше, в которой один или два атома углерода были заменены атомом азота;
арил представляет собой моноциклическую ароматическую группу, содержащую 5 или 6 атомов углеродов, например фенильную группу;
гетероарил представляет собой циклическую ароматическую группу, содержащую 5 или 6 атомов, в том числе один или несколько гетероатомов, таких как N и/или S;
галогеналкил представляет собой алкильную группу, такую как определенная выше, в которой один или несколько атомов водорода были заменены атомом галогена;
алкокси представляет собой группу формулы -О-алкил, где алкильная группа является такой, как определено выше;
или их энантиомеры и диастереомеры, рацематы, гидраты, сольваты или фармацевтически приемлемые соли.
2. Соединения по п.1, в которых А обозначает арил, гетероарил или гетероциклоалкил, выбранный из фенила, бензодиоксолила, тиенила, тиазолила, пиридинила, пиримидинила, пиридазинила, пиразинила, пиразолила и пирролидинона, причем указанные арил, гетероарил или гетероциклоалкил могут быть в случае необходимости замещены в каких-либо положениях одной или несколькими группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси, -O-(CH2)p-O-алкила, галогеналкокси,
-NRR', -NR-СО-алкила, -SO- и -SO2-алкила, где R и R' обозначают, независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 5; или их энантиомеры и диастереомеры, рацематы, гидраты, сольваты или фармацевтически приемлемые соли.
3. Соединения по п.1, в которых В обозначает группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил или гидроксиалкил, или альтернативно, R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкильной группой, их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
4. Соединения по п.1, в которых В обозначает гетероцикл следующей формулы:
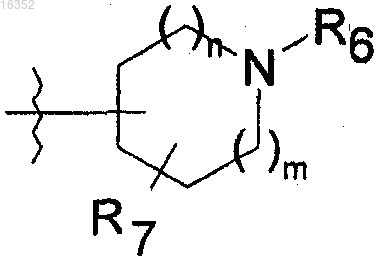
где m и n обозначают, независимо один от другого, 0, 1 или 2;
R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил;
их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
5. Соединения по п.1, в которых R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или -CH2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и -O-CO-алкила, причем по меньшей мере один из R1 или R2 отличается от атома водорода; их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
6. Соединения по п.1, в которых R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси, -O-CO-алкила и ацила; их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
7. Соединения по п.1, в которых
X и Y обозначают, независимо один от другого, атом азота или звено -CR3-, где R3 обозначает атом водорода или алкокси;
U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода или алкил;
А обозначает арил, гетероарил или гетероциклоалкил, выбранный из фенила, бензодиоксолила, тиенила, тиазолила, пиридинила, пиразолила и пирролидинона, причем указанный арил или гетероарил может быть в случае необходимости замещен в каких-либо положениях одной или несколькими группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси, -O-(CH2)p-O-алкила, галогеналкокси,
-NRR', -NR-CO-алкила и -SO2-алкила, где R и R' обозначают, независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 5;
W обозначает атом галогена, алкил или галогеналкил;
Z обозначает связь или алкилен, в случае необходимости замещенный по меньшей мере одной группой, выбранной из атома галогена и алкила, гидрокси;
В обозначает
либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, гидроксиалкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил,
либо гетероцикл следующей формулы:

где m и n обозначают, независимо один от другого, 0, 1 или 2;
R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил;
R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или
-СН2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами гидрокси, причем по меньшей мере один из R1 или R2 отличается от атома водорода, либо
R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из алкила, гидрокси и алкокси;
р обозначает целое число, равное 0 или 1;
их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
8. Соединения по п.1, в которых
X и Y обозначают, независимо один от другого, атом азота или группу СН;
А обозначает фенил, пиридинил или пирролидинон, замещенный в каких-нибудь положениях 1-2 группами, выбранными из атома галогена и алкила, трифторметила, метокси и N,N-диметиламина;
U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода;
W обозначает атом хлора или трифторметил;
Z обозначает связь или алкилен, в случае необходимости замещенный метильной группой;
В обозначает
либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл,
либо гетероциклы следующей формулы:
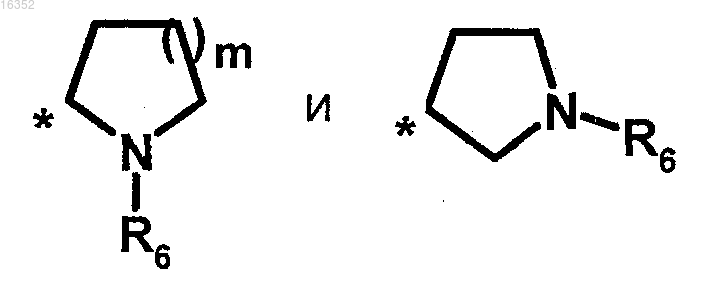
где m=1 или 2;
R6 обозначает этил или метил;
R1 и R2 обозначают, независимо один от другого, атом водорода или изопропил, трет-бутил, либо
R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, тетрагидропиранила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная циклоалкильная группа может быть в случае необходимости замещена в положениях 3 и 4 метилом, гидрокси или метокси либо одним или двумя атомами галогена;
р обозначает 0 или 1;
их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
9. Соединения по п.1, в которых
X обозначает атом азота;
Y обозначает группу СН;
А обозначает фенил или пиридинил, замещенный в положениях 2, 4, 5 и 6 одной или двумя группами, выбранными из атома галогена, такого как хлор или фтор, и алкильных групп, таких как метил, этил или изопропил, трифторметил, метокси и N,N-диметиламин;
U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода;
W обозначает атом хлора или трифторметил;
Z обозначает связь или этилен, пропилен или метилпропилен;
В обозначает
либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, метил, этил или пропил или образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный цикл,
либо гетероцикл следующей формулы:
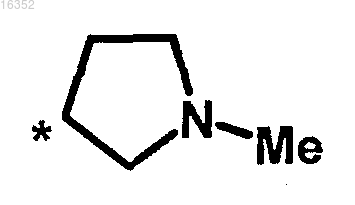
R1 и R2 обозначают
либо R1 обозначает атом водорода и R2 обозначает изопропил, трет-бутил, причем атом углерода, несущий группы R1 и R2, принимает абсолютную конфигурацию S,
либо R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, циклоалкил и адамантил, причем указанный циклоалкил может быть в случае необходимости замещен в положениях 3 и 4 метилом, гидрокси или метокси;
р обозначает 0 или 1;
их соли, их гидраты или сольваты, а также их энантиомеры и диастереомеры, в том числе их рацемические смеси.
10. Соединение по п.1, отличающееся тем, что его выбирают из следующих соединений:
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-4-метокси-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-дифторфенил)пиридин-2-ил]карбонил}амино) циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-этокси-2-метилфенил)пиридин-2-ил]карбонил} амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-дихлорфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-фтор-6-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-метил-5-(1-метилэтил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-хлор-5-(2-метоксиэтокси)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиразин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(метоксиметил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-хлор-5-(1-метилэтокси)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(5-[2-хлор-5-(диметиламино)фенил]-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-этил-6-фторфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метил-5-пропилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(дифторметил)-4-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-6-этокси-2,3'-бипиридин-6'-илкарбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[3-амино-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)-2-фторпропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(дифторметил)-5-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[5-(2-метоксиэтокси)-2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[5-(метоксиметил)-2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-метил-5-(1-метилэтокси)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-метил-5-(2-метилпропокси)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[5-(циклопропилметокси)-2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метил-5-пропоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)-2,3-дигидро-1Н-инден-2-карбоновая кислота;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)циклопентанкарбоновая кислота;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)бицикло[2.2.1]гептан-2-карбоновой кислоты гидрохлорид;
N-{[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}фенилаланин;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)-4-метилпентановая кислота;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)-4-фенилбутановая кислота;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)-4-(1Н-индол-3-ил)бутановая кислота;
({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)(фенил)уксусная кислота;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)-3-циклогексилпропановая кислота;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновая кислота;
N-{[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}-альфа-метилфенилаланин;
N-{[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}-3-метилизовалин;
2-({[6-{4-хлор-3-[(1-метилпирролидин-3-ил)окси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[(1-метилпиперидин-4-ил)окси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[2-(диметиламино)этокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[(1-этилпирролидин-3-ил)окси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-фенилпиридин-2-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-оксопирролидин-1-ил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
9-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)бицикло[3.3.1]нонан-9-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диэтиламино)пропокси]фенил}-5-(2,6-диметоксифенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(2-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3,4'-бипиридин-6-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
3-[({4''-хлор-3''-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1''-терфенил-4'-ил}карбонил)амино]-4-метилпентановая кислота;
3-({[5-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-6-(2-метилфенил)пиридин-3-ил]карбонил}амино)-4-метилпентановой кислоты гидрохлорид;
N-{[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}-3-гидроксифенилаланин гидрохлорид;
2-({[6-{4-хлор-3-[2-(1-метилпирролидин-2-ил)этокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[2-(1-метилпиперидин-2-ил)этокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{3-[3-(диметиламино)пропокси]-4-(трифторметил)фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(трифторметил)фенил]пиридин-2-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-(4-хлор-3-{3-[циклопропил(метил)амино]пропокси}фенил)-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(диметиламино)фенил]пиридин-2-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
4-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)тетрагидро-2Н-пиран-4-карбоновой кислоты гидрохлорид;
(3R)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-метилпентановой кислоты гидрохлорид;
2-[({6-[4-хлор-3-(3-пиперидин-1-илпропокси)фенил]-5-(2-метилфенил)пиридин-2-ил}карбонил)амино]адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)бутокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-[({6-[4-хлор-3-(2-пиперидин-1-илэтокси)фенил]-5-(2-метилфенил)пиридин-2-ил}карбонил)амино]адамантан-2-карбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-метилпентановой кислоты гидрохлорид;
2-[({6-[4-хлор-3-(2-пирролидин-1-илэтокси)фенил]-5-(2-метилфенил)пиридин-2-ил}карбонил)амино]адамантан-2-карбоновой кислоты гидрохлорид;
2-[({6-[4-хлор-3-(3-пирролидин-1-илпропокси)фенил]-5-(2-метилфенил)пиридин-2-ил}карбонил)амино]адамантан-2-карбоновой кислоты гидрохлорид;
2-{[(2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3-метил-2,3'-бипиридин-6'-ил)карбонил]амино}адамантан-2-карбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-метилциклогексанкарбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[3-(диметиламино)-1-метилпропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4-фторфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4-метоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4-метилпентановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
2-({[6-(4-хлор-3-{[(2R)-3-(диметиламино)-2-гидроксипропил]окси}фенил)-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
2-({[6-(4-хлор-3-{[(2S)-3-(диметиламино)-2-гидроксипропил]окси}фенил)-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
ацетил-4-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)пиперидин-4-карбоновой кислоты гидрохлорид;
2-({[6-{4-хлор-3-[2-(диэтиламино)этокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(дифторметил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
[1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексил]уксусной кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(3-амино-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-3-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-3-гидроксициклогексанкарбоновой кислоты гидрохлорид;
цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4-метоксициклогексанкарбоновой кислоты гидрохлорид;
транс-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4-метоксициклогексанкарбоновой кислоты гидрохлорид;
транс-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(метилсульфонил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(метилсульфонил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3-метил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(5-[2-(ацетиламино)фенил]-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
N-{[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}-D-валин гидрохлорид;
1-{[(2-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2'-метил-3,3'-бипиридин-6-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(2-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-4'-метил-3,3'-бипиридин-6-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-[({6-[4-хлор-3-(2-пирролидин-1-илэтокси)фенил]-5-(2-метилфенил)пиридин-2-ил}карбонил)амино]-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-(4-хлор-3-{3-[этил(метил)амино]пропокси}фенил)-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диэтиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[4-(диметиламино)бутокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(1-метилэтил)фенил]пиридин-2-ил)карбонил]амино}-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-хлор-2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,5-диметилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-(4-хлор-3-{3-[этил(метил)амино]пропокси}фенил)-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(4-фтор-2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-(4-хлор-3-{3-[метил(пропил)амино]пропокси}фенил)-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диэтиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-(4-хлор-3-{3-[этил(метил)амино]пропокси}фенил)-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)-2-метилпропокси]фенил}-5-(2-этилфенил)пиридин-2-ил]карбонил}амино)-3-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-пропилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-фтор-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоновой кислоты гидрохлорид;
1-({[3-хлор-2'-(4-хлор-3-{3-[этил(метил)амино]пропокси}фенил)-2,3'-бипиридин-6'-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,5-диметилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогептанкарбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метилфенил)пиридин-2-ил]карбонил}амино)-4-метилпентановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-фторфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3,5-диметил-1Н-пиразол-1-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{3-[3-(диметиламино)пропокси]-4-этилфенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метилфенил)пиридин-2-ил]карбонил}амино)-3-циклобутилпропановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилтиофен-3-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метилфенил)пиридин-2-ил]карбонил}амино)-3-циклопропилпропановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4-гидроксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4,5-диметилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-метил-1,3-тиазол-4-ил)пиридин-2-ил]карбо-нил}амино)циклогексанкарбоновой кислоты гидрохлорид;
4-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)оксепан-4-карбоновой кислоты гидрохлорид;
3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-цианофенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(4-гидрокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3-фтор-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-гидрокси-2-метилфенил)пиридин-2-ил]карбо-нил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-6-фторфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-(4-хлор-3-{3-[(2-гидроксиэтил)(метил)амино]пропокси}фенил)-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3-гидрокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(4,5-дифтор-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(6-метил-1,3-бензодиоксол-5-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3,5-диэтил-1Н-пиразол-1-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[5-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3-(дифторметил)-2,3'-бипиридин-6'-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-метилфенил]-3-[метиламино]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-этил-3-метил-1Н-пиразол-1-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(5-[2-хлор-4-(диметиламино)фенил]-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-хлор-5-(трифторметокси)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид;
1-({[3-амино-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-дихлорфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-дифторциклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3-(метиламино)-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4-фторфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-4-метоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоновой кислоты гидрохлорид;
1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(дифторметил)фенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоновой кислоты гидрохлорид.
11. Соединение формулы (III)

в которой U, X, Y, Z, W, А и В являются такими, как определено в п.1.
12. Способ получения соединения формулы (I) по п.1, отличающийся тем, что соединение формулы (III)
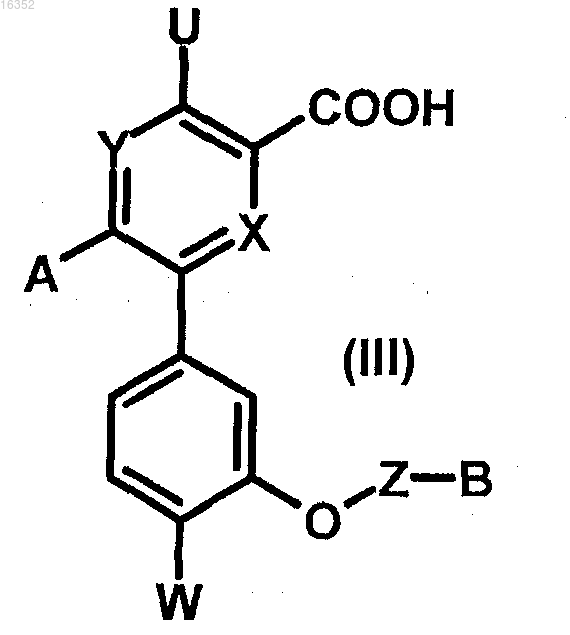
в которой U, X, Y, Z, W, А и В являются такими, как определено в п.1,
вводят в реакцию с соединением формулы (II)
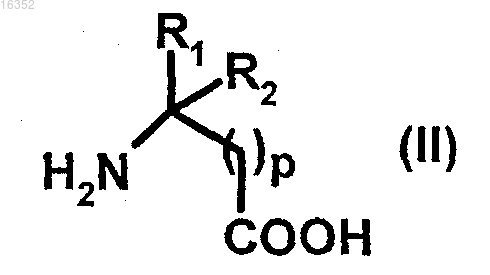
в которой р, R1 и R2 являются такими, как определено в п.1,
в присутствии агента сочетания, слабого органического основания и апротонного полярного растворителя при температуре окружающей среды.
13. Способ получения соединения формулы (I) по п.1, включающий следующие стадии:
а) реакция соединения формулы (V)
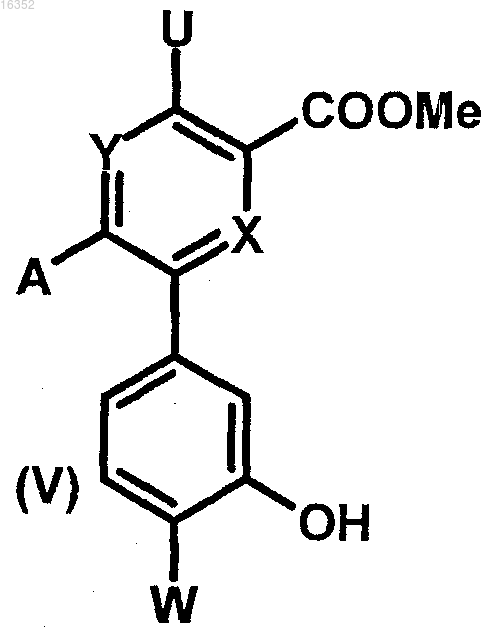
в которой U, X, Y, W и А являются такими, как определено в п.1,
либо с хлорсодержащим производным Cl-Z-В, где Z и В являются такими, как определено в п.1, в присутствии слабого неорганического основания в апротонном полярном растворителе при температуре от 80 до 100°С,
либо со спиртом формулы HO-Z-B, где Z и В являются такими, как определено в п.1, в присутствии трифенилфосфина, диизопропилазодикарбоксилата (DIAD) и каталитического количества слабого органического основания при 0°С в апротонном растворителе с получением соединения формулы (IV)
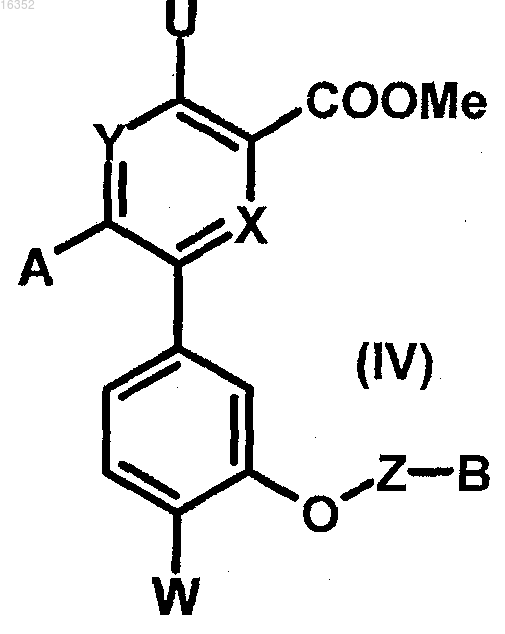
в которой U, X, Y, W, A, Z и В являются такими, как определено в п.1;
b) омыление указанного соединения формулы (IV) при помощи сильного неорганического основания в смеси вода/метанол при температуре окружающей среды или при нагревании с обратным холодильником, затем подкисление с получением соединения формулы (III)
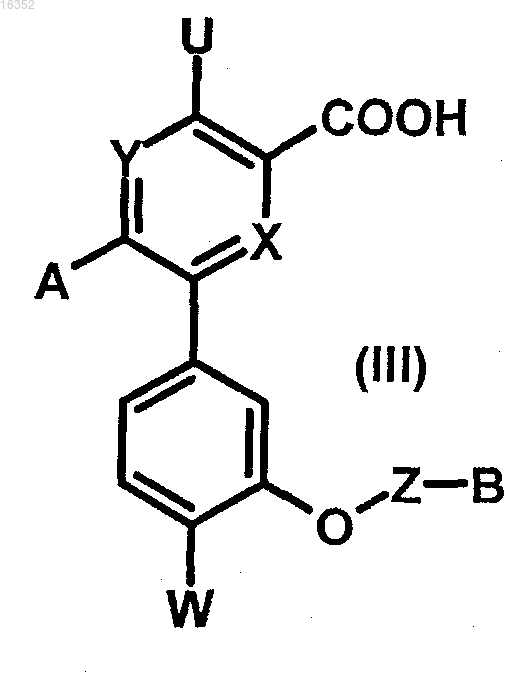
в которой U, X, Y, Z, W, А и В являются такими, как определено в п.1;
с) реакция указанного соединения (III) с соединением формулы (II)
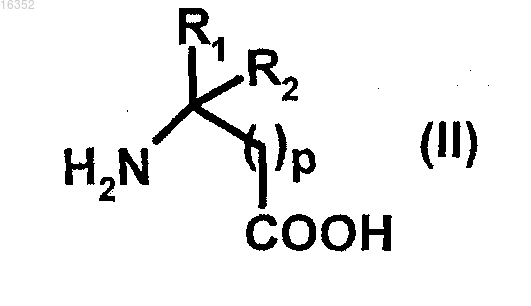
в которой р, R1 и R2 являются такими, как определено в п.1.
14. Фармацевтическая композиция, включающая соединение формулы (I) по п.1 или соль присоединения этого соединения с фармацевтически приемлемой кислотой, гидрат или сольват, а также по меньшей мере один фармацевтически приемлемый эксципиент.
15. Способ лечения заболевания или состояния, выбранного из группы, состоящей из воспалительной сердечной недостаточности, ишемии сердца, инфаркта миокарда, гипертрофии и фиброза сердца, заболеваний коронарных сосудов и атеросклероза, системной и легочной артериальной гипертензии, рестеноза после ангиопластики, острой и хронической почечной недостаточности диабетического и/или гипертонического происхождения, диабета, воспаления, фиброзов и аневризм, расстройств центральной нервной системы, включая нейродегенеративные заболевания, церебрососудистые нарушения, стресс, тревогу, агрессивность, депрессию, шизофрению или нарушения сна, и рака или респираторных заболеваний или астмы, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) по п.1 или его энантиомера, диастереомера, рацемата, гидрата, сольвата или их фармацетически приемлемой соли.
16. Способ лечения рвоты, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) по п.1 или его энантиомера, диастереомера, рацемата, гидрата, сольвата или их фармацетически приемлемой соли.
Текст
ПРОИЗВОДНЫЕ 5,6-БИС-АРИЛ-2-ПИРИДИНКАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ УРОТЕНЗИНА II в которой X, Y, U, А, В, W, Z, R1 и R2 являются такими, как определено в описании, к способу их получения и применения в терапии. 016352 Объектом настоящего изобретения являются производные 5,6-бис-арил-2-пиридинкарбоксамида, их получение и их применение в терапии в качестве антагонистов рецепторов уротензина II. Уротензин II представляет собой циклический пептид, состоящий из 11 аминокислот и считающийся как одним из наиболее мощных вазоконстрикторов, известных на сегодняшний день (Ames et al., 1999,Nature. 401, 282-286). Его биологическая активность опосредуется активацией рецептора с 7 трансмембранными доменами, связанного с G-белками, GPR14, известного как UT (UROTENSIN II RECEPTOR) согласно International Union of Basic and Clinical Pharmacology (IUPHAR). Активация рецептора уротензина II вызывает мобилизацию внутриклеточного кальция. Уротензин II и его рецептор сильно экспрессируются на уровне сердечно-сосудистой системы, а также на уровне почек, мозга и в эндокринной системе (Richards and Charles, 2004, Peptides. 25,1795-1802). На изолированных сосудах человеческий уротензин II провоцирует сужение сосудов, интенсивность которого варьирует в зависимости от затронутого участка и вида (Douglas et al., 2000, Br. J. Phamacol. 131, 1262-1274). Введение уротензина II приматам под анестезией индуцирует увеличение резистентности периферических сосудов и ухудшение способности сокращаться и минутного объема сердца, что может, при использовании высоких доз привести к сердечно-сосудистому коллапсу и, в конце концов, к смерти животного (Ames et al., 1999, Nature. 401, 282286). К тому же, уротензин II стимулирует пролиферацию гладких мышечных клеток сосудов и действует синергически с митогенной активностью серотонина и окисленных LDL (Low Density Lipoproteins)(Watanabe et al., 2001, Circulation. 104; 16-18). Ha кардиомиоцитах в культуре уротензин II индуцирует клеточную гипертрофию и увеличение синтеза внеклеточного матрикса (Tzanidis A., et al., 2003, Cire.Res. 93, 246-253). Сообщалось, что уровни уротензина II в плазме и моче были увеличенными при некоторых сердечно-сосудистых, почечных и метаболических патологий у человека. Эти патологии включают повышенное кровяное давление, сердечную недостаточность, почечную недостаточность, диабет и цирроз печени(Richards and Charles, 2004, Peptides. 25, 1795-1802; Doggrell, 2004, Expert Opin Investig Drugs. 13, 479487). Также были описаны центральные эффекты уротензина II (Matsumoto Y., et al., Neurosci. Lett., 2004,358, 99). Наконец, было показано, что некоторые линии опухолевых клеток суперэкспрессируют рецептор уротензина II (Takahashi K., et al., Peptides, 2003, 24, 301). Антагонисты рецепторов уротензина II могут быть использованы для лечения воспалительной сердечной недостаточности, ишемии сердца, инфаркта миокарда, гипертрофии и фиброза сердца, заболеваний коронарных сосудов и атеросклероза, системной и легочной гипертензии, рестеноза после ангиопластики, острой и хронической почечной недостаточности диабетического и/или гипертонического происхождения, диабета, воспаления сосудов и аневризм. К тому же, антагонисты рецепторов уротензина II могут быть использованы для лечения расстройств центральной нервной системы, включающих нейродегенеративные заболевания, церебрососудистые нарушения, стресс, тревожность, агрессивность, депрессию, шизофрению, а также рвоты и нарушения сна. Наконец, антагонисты рецепторов уротензина II могут также быть использованы для лечения некоторых видов рака. Соединения согласно настоящему изобретению отвечают формуле (I) в которой X и Y обозначают, независимо один от другого, атом азота или звено -CR3-, R3 обозначает атом водорода или галогена или алкил, или алкокси;U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода или алкил; А обозначает арил, гетероарил или гетероциклоалкил;Z обозначает связь, циклоалкилен или алкилен, в случае необходимости замещенный одной или несколькими группами, выбранными из атома галогена и алкила, гидрокси и алкокси;-1 016352 В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил, гидроксиалкил или фторалкил или R4 и R5 образуют вместе с атомом азота, к которому они присоединены,5- или 6-членный цикл, такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкильной группой,либо гетероцикл следующей формулы: где m и n обозначают, независимо один от другого, 0, 1 или 2;R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил;R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил,бензил или -СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и-O-СО-алкила, причем по меньшей мере один из R1 или R2 отличается от атома водорода, либоR1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, тетрагидронафтила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси, -O-СО-алкила и ацила; р обозначает целое число, равное 0 или 1. Соединения формулы (I) могут включать один или несколько асимметрических атомов углерода. Они могут существовать таким образом в форме энантиомеров или диастереомеров. Эти энантиомеры,диастереомеры, а также их смеси, в том числе рацемические смеси, являются частью изобретения. Соединения формулы (I) могут существовать в форме оснований или солей с кислотами или основаниями, в частности с фармацевтически приемлемыми кислотами или основаниями. Такие соли присоединения являются частью изобретения. Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, которые могут быть использованы, например, для очистки или выделения соединений формулы (I), также являются частью изобретения. Соединения формулы (I) могут существовать также в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также являются частью изобретения. Среди соединений формулы (I) можно назвать соединения формулы (I') в которой X и Y обозначают, независимо один от другого, атом азота или звено -CR3-, R3 обозначает атом водорода или галогена, или алкил, или алкокси; А обозначает арил, гетероарил или гетероциклоалкил, выбранный из фенила, тиенила, тиазолила,пиридинила, пиримидинила, пиридазинила, пиразинила, пиразолила и пирролидинона, причем указанный арил, гетероарил или гетероциклоалкил может быть в случае необходимости замещен в каких-либо положениях 1-3 группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси,-NRR', -NR-СО-алкила, -SO- и -SO2-алкила, где R и R' обозначают, независимо один от другого, атом водорода или алкил;Z обозначает связь, циклоалкилен или алкилен, в случае необходимости замещенный 1 или 2 группами, выбранными из атома галогена и алкила, гидрокси и алкокси; В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил или фторалкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл,такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкилом,-2 016352 либо гетероцикл следующей формулы: где m и n обозначают, независимо один от другого, 0, 1 или 2;R6 и R7 обозначают, независимо один от другого, атом водорода или алкил;R1 и R2 обозначают либо, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или-СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и -О-СО-алкила,причем по меньшей мере один из R1 или R2 отличается от атома водорода,либо R1 и R2 вместе, с атомом углерода, к которому они присоединены, образуют моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, тетрагидронафтила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении одной или несколькими группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси,формила и ацетила; р обозначает 0 или 1. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать подгруппу соединений, которая определяется следующим образом:X и Y обозначают, независимо один от другого, атом азота или звено -CR3-, где R3 обозначает атом водорода или алкокси; и/илиU обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода или алкил; и/или А обозначает арил, гетероарил или гетероциклоалкил, выбранный из фенила, бензодиоксолила,тиенила, тиазолила, пиридинила, пиразолила и пирролидинона, причем указанный арил или гетероарил может быть в случае необходимости замещен в каких-либо положениях одной или несколькими группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси, -О-(СН 2)р-Oалкила, галогеналкокси, -NRR', -NR-CO-алкила и -SO2-алкила, где R и R' обозначают, независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 5 и особенно от 1 до 3; и/илиZ обозначает связь или алкилен, в случае необходимости замещенный по меньшей мере одной группой, выбранной из атома галогена и алкила, и гидрокси; и/или В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, гидроксиалкил,или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил,либо гетероцикл следующей формулы: где m и n обозначают, независимо один от другого, 0, 1 или 2;R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил; и/илиR1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил,бензил или -СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами гидрокси, причем по меньшей мере один из R1 или R2 отличается от атома водорода; либоR1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из алкила, гидрокси, ацетила и алкокси; и/или р обозначает целое число, равное 0 или 1. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать вторую подгруппу соединений, для которых X и Y обозначают, независимо один от другого, атом азота или звено-CR3-, где R3 обозначает атом водорода или галогена, или алкил, или алкокси. В частности, среди соединений формулы (I) второй подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых X и Y обозначают, независимо один от другого,атом азота или звено -CR3-, где R3 обозначает атом водорода или алкокси.-3 016352 Среди соединений формулы (I), являющихся объектами изобретения, можно назвать третью подгруппу соединений, для которых U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода или алкил. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать четвертую подгруппу соединений, для которых А обозначает арил, гетероарил или гетероциклоалкил, в случае необходимости замещенный. В частности, среди соединений формулы (I) четвертой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых А обозначает арил, гетероарил или гетероциклоалкил, выбранный из фенила, бензодиоксолила, тиенила, тиазолила, пиридинила, пиримидинила, пиридазинила, пиразинила, пиразолила и пирролидинона, причем указанный арил, гетероарил или гетероциклоалкил может быть в случае необходимости замещен в каких-либо положениях одной или несколькими группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси,-O-(CH2)p-O-алкила, галогеналкокси, -NRR', -NR-CO-алкила, -SO- и -SO2-алкила, где R и R' обозначают,независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 5. Еще более предпочтительно среди соединений формулы (I) четвертой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых А обозначает группу, выбранную из фенила, бензодиоксолила, тиенила, тиазолила, пиридинила, пиразолила и пирролидинона, причем указанный арил или гетероарил может быть в случае необходимости замещен в каких-либо положениях одной-тремя группами, выбранными из атома галогена и циано, алкила, галогеналкила, гидрокси, алкокси, -O-(CH2)p-O-алкила, галогеналкокси, -NRR', -NR-CO-алкила и -SO2-алкила, где R и R' обозначают,независимо один от другого, атом водорода или алкил и р обозначает целое число от 1 до 3. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать пятую подгруппу соединений, для которых W обозначает атом галогена, алкил или галогеналкил. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать шестую подгруппу соединений, для которых Z обозначает связь, циклоалкилен или алкилен, в случае необходимости замещенный 1 или 2 группами, выбранными из атома галогена и алкила, гидрокси и алкокси. В частности, среди соединений формулы (I) шестой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых Z обозначает связь или алкилен, в случае необходимости замещенный по меньшей мере одной группой, выбранной из атома галогена и алкила и гидрокси. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать седьмую подгруппу соединений, для которых В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил, гидроксиалкил или фторалкил или R4 и R5 образуют с атомом азота, к которому они присоединены,5- или 6-членный цикл, такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкильной группой; либо гетероцикл следующей формулы: где m и n обозначают, независимо один от другого, 0, 1 или 2;R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил. В частности, среди соединений формулы (I) седьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых В обозначает группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил, циклоалкил, гидроксиалкил или фторалкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил, в случае необходимости замещенный алкильной группой. Еще более предпочтительно среди соединений формулы (I) седьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых В обозначает группу -NR4R5,где R4 и R5 обозначают, независимо один от другого, алкил, гидроксиалкил или фторалкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл, такой как пирролидинил или пиперидинил. В частности, среди соединений формулы (I) седьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых В обозначает гетероцикл следующей формулы: где m и n обозначают, независимо один от другого, 0, 1 или 2;R6 и R7 обозначают, независимо один от другого, атом водорода, или алкил, или циклоалкил.-4 016352 Среди соединений формулы (I), являющихся объектами изобретения, можно назвать восьмую подгруппу соединений, для которыхR1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил,бензил или -СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и-O-СО-алкила, причем по меньшей мере один из R1 или R2 отличается от атома водорода; либоR1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, тетрагидронафтила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из атома галогена и алкила, фторалкила, гидрокси, алкокси, -O-CO-алкила и ацила. В частности, среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или -СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами, выбранными из атомов галогена и алкила, фторалкила, алкокси, гидрокси и -O-СО-алкила, причем по меньшей мере один из R1 илиR2 отличается от атома водорода. Еще более предпочтительно среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 обозначают, независимо один от другого, атом водорода или алкил, циклоалкил, фенил, бензил или -СН 2-индолил, причем эти группы могут быть в случае необходимости замещены одной или несколькими группами гидрокси, причем по меньшей мере один из R1 или R2 отличается от атома водорода. В частности, среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, тетрагидронафтила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из атома галогена и алкила, гидрокси и алкокси. Еще более предпочтительно среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена в каком-либо положении (в том числе на атоме азота, при необходимости) одной или несколькими группами, выбранными из алкила, гидрокси и алкокси. Еще более предпочтительно среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена, на атоме углерода, одной или несколькими группами, выбранными из алкила, гидрокси и алкокси. Еще более предпочтительно среди соединений формулы (I) восьмой подгруппы, являющихся объектами изобретения, можно назвать подгруппу соединений, для которых R1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила, инданила, тетрагидропиранила, пиперидина, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная моно- или полициклическая система может быть в случае необходимости замещена, на атоме азота, группой, выбранной из алкила и ацила. Среди соединений формулы (I), являющихся объектами изобретения, можно назвать девятую подгруппу соединений, для которых р обозначает целое число, равное 0 или 1. В рамках настоящего изобретения, и если в тексте не указано иное, понимают под атомом галогена: атом фтора, хлора, брома или йода; алкилом: алифатическую насыщенную прямую группу, содержащую от 1 до 5 атомов углерода,или, когда алкильная цепь содержит по меньшей мере три атома углерода, она может быть прямой, разветвленной или частично циклизованной. В качестве примеров можно назвать метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, метилен-циклопропил; алкиленом: алкильную группу, такую как определенная выше, которая является двухвалентной. В качестве примера можно назвать диметилен (-СН 2-СН 2-), пропилен, бутилен, этилен или 2-метилпропилен;-5 016352 циклоалкилом: насыщенную циклическую группу, которая содержит от 3 до 8 атомов углерода и является циклической. В качестве примеров можно назвать циклопропил, циклопентил, циклогексил и циклогептил; гетероциклоалкилом: циклоалкильную группу, такую как определена выше, в которой один или два атома углерода были заменены атомом азота. В качестве примера можно назвать пирролидинон и пиперидин; арилом: моноциклическую ароматическую группу, содержащую 5 или 6 атомов углеродов, например фенил; гетероарилом: циклическую ароматическую группу, содержащую 5 или 6 атомов, в том числе один или несколько гетероатомов, таких как N и/или S. В качестве примеров гетероарильных групп можно назвать тиенил, тиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, пиразолил; циклоалкиленом: циклоалкильную группу, такую как определенная выше, которая является двухвалентной; фторалкилом: алкильную группу, такую как определена выше, в которой один или несколько атомов водорода были заменены атомом фтора. В качестве примера можно назвать трифторметил; алкокси: группа формулы -О-алкил, где алкильная группа является такой, как определено выше. Среди соединений, описанных в настоящем изобретении, можно назвать подгруппу соединений,отвечающих формуле (I), в которойX и Y обозначают, независимо один от другого, атом азота или группу СН; А обозначает фенил, пиридинил или пирролидинон, замещенный в каких-либо положениях 1-2 группами, выбранными из атома галогена, такого как хлор или фтор, и алкила, трифторметила, метокси иU обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода;W обозначает атом хлора или трифторметил;Z обозначает связь или алкилен, в случае необходимости замещенный метильной группой; В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, алкил или R4 и R5 образуют с атомом азота, к которому они присоединены, 5- или 6-членный цикл,либо гетероциклы следующей формулы:R6 обозначает этил или метил;R1 и R2 обозначают, независимо один от другого, атом водорода или изопропил, трет-бутил; либоR1 и R2 образуют вместе с атомом углерода, к которому они присоединены, моно- или полициклическую систему, выбранную из циклоалкила (такого как циклопентил, циклогексил или циклогептил),тетрагидропиранила, бицикло[2.2.1]гептила, бицикло[3.3.1]нонила и адамантила, причем указанная циклоалкильная группа может быть в случае необходимости замещена в положениях 3 и 4 метилом, гидрокси или метокси или одним или двумя атомами галогена, такого как фтор; р обозначает 0 или 1. Можно назвать также вторую подгруппу соединений среди предпочтительных соединений и отвечающих формуле (I), в которойY обозначает группу СН; А обозначает фенил или пиридинил, замещенный в положениях 2, 4, 5 и 6 одной или двумя группами, выбранными из атома галогена, такого как хлор или фтор, и алкильных групп, таких как метил, этил или изопропил, трифторметил, метокси и N,N-диметиламин;U обозначает атом водорода или группу NHR7, где R7 обозначает атом водорода;W обозначает атом хлора или трифторметил;Z обозначает связь или этилен, пропилен или метилпропилен;-6 016352 В обозначает либо группу -NR4R5, где R4 и R5 обозначают, независимо один от другого, метил, этил или пропил или образуют вместе с атомом азота, к которому они присоединены, 5- или 6-членный цикл,либо гетероцикл следующей формулы:R1 обозначает атом водорода и R2 обозначает изопропил, трет-бутил, причем атом углерода, несущий группы R1 и R2, принимает абсолютную конфигурацию S, либоR1 и R2 образуют вместе с атомом углерода, к которому они присоединены, циклоалкил (такой как циклогексил или циклогептил) и адамантил, причем указанная циклоалкильная группа может быть в случае необходимости замещена в положениях 3 и 4 метилом, гидрокси или метокси; р обозначает 0 или 1. Среди соединений, являющихся объектами изобретения, можно назвать, в частности, следующие соединения: 2-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2 ил]карбониламино)адамантан-2-карбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-4-метокси-5-(2-метилфенил)пиридин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид;(3S)-3-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлорфенил)пиридин-2 ил]карбониламино)-4,4-диметилпентановой кислоты гидрохлорид; 1-[(6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-[2-хлор-5-(трифторметокси)фенил]пиридин-2-ил)карбонил]аминоциклогексанкарбоновой кислоты гидрохлорид; 1-([3-амино-6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-метилфенил)пиразин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,4-дихлорфенил)пиридин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-метилфенил)пиридин-2-ил]карбониламино)-4,4-дифторциклогексанкарбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-3-(метиламино)-5-(2-метилфенил)пиридин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлор-4-фторфенил)пиридин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид; 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлор-4-метоксифенил)пиридин-2 ил]карбониламино)циклогексанкарбоновой кислоты гидрохлорид; 1-[(6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-[2-(дифторметил)фенил]пиридин-2 ил)карбонил]аминоциклогексанкарбоновой кислоты гидрохлорид. В соответствии с изобретением соединения общей формулы (I) можно получить согласно следующему способу, который проиллюстрирован на схеме 1. Когда в исходном соединении формулы (XI) X обозначает атом азота, Y обозначает атом углерода(т.е. группу формулы -CR3-, такую как определена в связи с соединениями формулы (I) согласно изобретению) и U обозначает атом водорода, или X обозначает атом углерода, Y обозначает атом азота и U обозначает атом водорода, или X и Y обозначают атом азота и U обозначает атом водорода, тогда на стадии(i) можно осуществить реакцию сочетания по типу Судзуки, катализированную производным палладия(0), таким как тетракис-(трифенилфосфин)палладий(0) [Pd(PPh3)4] между соединением формулы (XI)(где Q = ОН или Br и Т = атом галогена, такой как атом брома или йода) и бороновой кислотой формулы(IX), где GP представляет собой бензильную группу, в случае необходимости замещенную одной или несколькими группами алкокси, в присутствии основания, такого как фосфат калия, и в растворителе,таком как N,N-диметилформамид (DMF), при температуре приблизительно 95 С. Эта реакция позволяет региоселективно заместить функциональную группу Т кольцом фенокси с получением соединения (VIII). Функциональную группу ОН соединения (VIII) затем превращают в удаляемую группу, такую как трифторметансульфонат (OTf), на стадии (ii), при помощи ангидрида трифторметансульфоновой кислоты в присутствии основания, такого как триэтиламин (TEA), и в растворителе, таком как дихлорметан(DCM), с получением соединения формулы (VII). Полученная таким образом трифторметансульфонатная группа позволяет на стадии (iii) благодаря своей реактивности ввести кольцо А реакцией сочетания с органопалладиевым катализатором типа: либо Судзуки между соединением (VII) и бороновой кислотой или ее эфиром соответствующих формул А-В(ОН)2, или в присутствии каталитического количества производного палладия, такого как Pd(PPh3)4, в присутствии основания, такого как фосфат калия, и растворителя, такого как DMF, при температуре 90 С; либо STILLE между соединением (VII) и производным арилтрибутилстаннана или гетероарилстаннана ASnBu3 в присутствии каталитического количества йодида меди (CuI) и производного палладия(II),- 12016352 такого как дихлорид [1,1'-бис-(циклопентадиенилдифенилфосфино)ферроцен]палладий(II) [PdCl2(dppf)],и растворителя, такого как 1,4-диоксан, при температуре 90 С; либо HARTWIG-BUCHWALD между соединением (VII) и амидом, таким как 2-пирролидинон, в присутствии каталитического количества фосфина, такого как 9,9-диметил-4,5-бис-(дифенилфосфино)ксантан (XantPhos), и производного палладия(0), такого как три(дибензилиденацетон)дипалладий(0)[Pd2(dba)3], используя основание, такое как карбонат цезия, и в растворителе, таком как DMF, при температуре 70 С. Таким образом получают соединение (VI). Альтернативно, в исходном соединении формулы (XI), когда X и Y обозначают атомы углерода и U обозначает атом водорода, Q обозначает атом йода и Т обозначает атом брома или X и Y обозначают атом азота и U обозначает группу NHR (такую как определена в связи с соединениями формулы (I) согласно изобретению), Q и Т обозначают атомы хлора, брома или йода, используют обратный порядок введения групп А и фенокси на исходное фенильное кольцо (схема 1). В этом случае первая реакция типа Судзуки (стадия (iv с бороновой кислотой А-В(ОН)2 позволяет ввести селективно группу А вместо атома галогена Q. Реакцию осуществляют в присутствии каталитического количества производного палладия, такого как Pd(PPh3)4, и основания, такого как карбонат цезия, в растворителе, таком как DMF, при температуре 90 С. Затем осуществляют вторую реакцию типа Судзуки (стадия (v между эфиром бороновой кислоты (XII) или бороновой кислотой (IX) и соединением (X) в присутствии каталитического количества производного палладия, такого как Pd(PPh3)4, и основания, такого как карбонат цезия, в растворителе, таком как DMF, при температуре 90 С. Таким образом получают соединение (VI). Удаление защитной группы от фенольной группы соединения формулы (VI) трибромидом бора при-78 С, трифторуксусной кислотой (TFA) при температуре окружающей среды или хлоридом водорода при 0 С в DCM (стадия (vi приводит к соединению формулы (V). Введение группы Z-B на стадии (vii) может быть осуществлено либо алкилированием соединения (V) хлорсодержащим производным Cl-Z-В в присутствии слабого неорганического основания, такого как карбонат цезия, и в апротонном полярном растворителе, таком как DMF, при температуре от 80 до 100 С, такой как 90 С; либо реакцией MITSUNOBU между соединением (V) и спиртом формулы HO-Z-B в присутствии трифенилфосфина, диизопропилазодикарбоксилата (DIAD) и каталитического количества слабого органического основания, такого как TEA, при 0 С в апротонном растворителе, таком как тетрагидрофуран(THF). Соединение формулы (IV) затем омыляют на стадии (viii) при помощи сильного неорганического основания, такого как гидроксид калия, в смеси вода/метанол при температуре окружающей среды (Т.А.) или при нагревании с обратным холодильником, получая, после подкисления сильной кислотой, такой как 1 н. соляная кислота (HCl), соединение (III). В рамках настоящего изобретения под температурой окружающей среды понимают температуру от 20 до 25 С. Реакция пептидного сочетания (стадия (ix между соединением (III) и аминами формулы (II) в присутствии агента сочетания, такого как карбонилдиимидазол (CDI), тетрафторборатN,N'-диизопропилэтиламин (DIEA), и в апротонном полярном растворителе, таком как DMF, при температуре окружающей среды приводит к соединениям формулы (I), соответствующим настоящему изобретению. Схема 2 описывает синтез бороновых производных (IX) и (XII). Случай, когда W=CF3. 2-Амино-5-нитрофенол (XVI) превращают в йодсодержащее производное (XV) реакциейSANDMEYER в водной среде при 0 С в присутствии йодида натрия и с сорастворителем, таким как диметилсульфоксид (DMSO). Защиту фенольной группы (стадия (i бензильной группой осуществляют с использованием галогенсодержащего производного, такого как бензилбромид, в присутствии основания,такого как карбонат калия (K2CO3), в растворителе, таком как DMF, в 60 С. Замена атома йода трифторметильной группой (Eur. J. Org. Chem. (2003), p. 1559-1568), осуществленная с трифторметилтриметилсиланом в присутствии CuI и фторида калия в растворителе, таком как N-метилпирролидинон (NMP),при 45 С (стадия (ii приводит к соединению (XIV), которое после восстановления функциональной нитрогруппы до аминогруппы восстановителем, таким как железо, при 70 С в смеси этанол(EtOH)/вода/уксусная кислота (АсОН) превращают в йодсодержащее производное (XIII) при помощи второй реакции SANDMEYER (стадия (iii. На стадии (iv) реакция обмена металл-галоген, осуществленная между соединением (XIII) и изопропилмагнийхлоридом (iPrMgCl) при -50 С в растворителе, таком как THF, с последующим добавлением триизопропилбората, приводит после ацидолиза с кислотой, такой как 5 н. HCl, к бороновой кислоте- 13016352 Случай, когда W=Cl. Защита 2-хлор-5-йодофенола (XVIIa) бензильной или параметоксибензильной группой, как описано на стадии (i), приводит к йодсодержащему производному (XVII), которое может быть превращено либо на стадии (iv) в бороновую кислоту (IX), как описано раньше; либо на стадии (v) в эфир бороновой кислоты (XII) реакцией сочетания с 4,4,4',4',5,5,5',5'-октаметил 2,2'-бидиоксабороланом в присутствии основания, такого как ацетат калия (KOAc), и каталитического количества производного палладия(II), такого как [PDCl2(dppf)], в растворителе, таком как DMSO, при 100 С. Альтернативно, подгруппа соединений формулы (Ia), соответствующих настоящему изобретению,где группа А представляет собой 2,6-диметоксибензольное кольцо, была получена следующим образом(схема 3). Конденсация 2,6-диметоксибензальдегида на 2-цианоуксусной кислоте (стадия (i в присутствии ацетата аммония и основания, такого как пиридин, при нагревании с обратным холодильником при температуре кипения растворителя, такого как толуол, приводит к производному (XX). Производное (XX) затем обрабатывают диизобутилалюминийгидридом (DIBAL-H) при 0 С в растворителе, таком как толуол. Таким образом, полученный альдегид вводят в реакцию (стадия (ii с 2-азидоэтилацетатом при -10 С в присутствии основания, такого как этилат натрия, в растворителе, таком как этанол, чтобы получить диен (XIX). На стадии (iii) обработка диена (XIX) трифенилфосфином при Т.А. в растворителе, таком как DCM, приводит к азатрифенилфосфоранилидену (XVIII). Реакция (стадия (iv между производным (XVIII) и альдегидом (XVII) в растворителе, таком как ацетонитрил, приводит, посредством циклизации in situ при 100 С промежуточного имина согласно последовательности электроциклическая циклизация/дегидрирование, к пиридиновому производному(IVa). Последовательности алкилирования или реакции MITSUNOBU (стадия (v, омыления (стадия (vi,затем пептидного сочетания (стадия (vii, описанные ранее в схеме 1 и примененные к производному(IVa), приводят к соединениям формулы (Ia), соответствующим настоящему изобретению. В схемах 1 и 2 исходные соединения, промежуточные соединения и реактивы, если способ их получения не описан, являются коммерчески доступными или описанными в литературе или они могут быть получены согласно способам, известным специалисту. Схема 1- 16016352 Следующие примеры иллюстрируют получение некоторых соединений, соответствующих изобретению. Номера представленных в примерах соединений соответствуют номерам в таблице, приведенной дальше, которая иллюстрирует химические структуры и физические свойства некоторых соединений согласно изобретению. Использованы следующие сокращения: Пример 1. 1-([6-(4-Хлордиметоксифенил)пиридин-2-ил]карбониламино)циклогексанкарбоновая кислота (соединение 12). 1.1. (2 Е)-3-(2,6-Диметоксифенил)акрилонитрил. К раствору 61 г (367 ммоль) 2,6-диметоксибензальдегида в 360 мл толуола последовательно добавляли 1,13 г (14,7 ммоль) ацетата аммония, 40,4 мл (500 ммоль) пиридина и 31,2 г (367 ммоль) 2-цианоуксусной кислоты. Реакционную среду нагревали с обратным холодильником в течение 15 ч,дистиллируя азеотроп толуол-вода по методу Dean-Stark. Раствор забирали 500 мл толуола и 40 мл пиридина и снова нагревали с обратным холодильником в течение 48 ч по методу Dean-Stark. После концентрации при пониженном давлении остаток забирали 800 мл дихлорметана (DCM) и промывали последовательно 1 л 1 н. водного раствора HCl, 500 мл насыщенного водного раствора карбоната натрия (Na2CO3) и 1 л воды. После сушки на сульфате натрия (Na2SO4) и концентрации при пониженном давлении получали 62 г (2 Е)-3-(2,6-диметоксифенил)акрилонитрила в форме коричневого масла, используемого телькель на следующей стадии. Выход = 89%.- 17016352 1.2. (2 Е)-3-(2,6-Диметоксифенил)акрилальдегид. К раствору 61 г (322 ммоль) (2 Е)-3-(2,6-диметоксифенил)акрилонитрила в 600 мл безводного толуола, помещенному в атмосферу аргона и охлажденному до 0 С, добавляли 355 мл раствора 1 М диизобутилалюминийгидрида (DIBAL-H) (355 ммоль) в толуоле, поддерживая температуру 0 С. Реакционную среду затем снова нагревали до температуры окружающей среды (Т.А.) и перемешивали в течение 3 ч. Затем добавляли 13 мл (322 ммоль) метанола, затем по каплям 170 г (174 ммоль) 10%-ного (вес.) водного раствора серной кислоты. Суспензию перемешивали 1 ч, затем фильтровали через целит. Фильтрат промывали 500 мл воды, затем высушивали на Na2SO4 и концентрировали при пониженном давлении. Полученный остаток забирали 500 мл DCM и фильтровали на колонке с силикагелем, элюируя DCM. После концентрации при пониженном давлении получали 37 г (2 Е)-3-(2,6-диметоксифенил)акрилальдегида в форме бесцветного масла. Выход = 60%. 1.3. (2 Е,4 Е)-2-Азидо-5-(2,6-диметоксифенил)пентаэтил-2,4-диеноат. К раствору 15,5 г (673 ммоль) натрия в 500 мл абсолютного этанола EtOH, охлажденного до -10 С и помещенного в атмосферу аргона, добавляли по каплям при перемешивании раствор 37 г (192 ммоль)(2 Е)-3-(2,6-диметоксифенил)акрилальдегида и 85,7 г (664 ммоль) 2-азидоэтилацетата в 200 мл абсолютного EtOH, поддерживая температуру -10 С. Через 3 ч перемешивания при -10 С реакционную среду перемешивали затем в течение 15 ч при Т.А., затем выливали на 600 мл водного раствора 30 вес.% хлорида аммония (NH4Cl). После фильтрации через стеклянный фильтр и промывки 2200 мл воды осадок забирали 600 мл DCM, высушивали на Na2SO4 и концентрировали при пониженном давлении, получая 42 г (2 Е,4 Е)-2-азидо-5-(2,6-диметоксифенил)пентаэтил-2,4-диеноата в форме твердого вещества желтого цвета. Выход = 80%.F (C) = 138. 1.4. (2 Е,4 Е)-5-(2,6-Диметоксифенил)-2-[(трифенилфосфоранилиден)амино]пентаэтил-2,4-диеноат. К раствору 4,37 г (16,7 ммоль) трифенилфосфина в 40 мл DCM добавляли по каплям раствор 5 г(2 Е,4 Е)-2-азидо-5-(2,6-диметоксифенил)пентаэтил-2,4-диеноата (16,5 ммоль) в 60 мл DCM. Реакционную среду перемешивали 2 ч при Т.А., затем концентрировали при пониженном давлении. Полученный остаток конкретизировали в 100 мл простого изопропилового эфира, затем фильтровали через стеклянный фильтр и промывали 50 мл простого изопропилового эфира, что позволяет получить 7,9 г (2 Е,4 Е)-5-(2,6 диметоксифенил)-2-[(трифенилфосфоранилиден)амино]пентаэтил-2,4-диеноата в форме твердого вещества белого цвета. Выход = 91%.F (С) = 172. 1.5. 6-(4-Хлор-3-гидроксифенил)-5-(2,6-диметоксифенил)пиридин-2-этилкарбоксилат. Раствор 7,54 г (14 ммоль) (2 Е,4 Е)-5-(2,6-диметоксифенил)-2-[(трифенилфосфоранилиден)амино]пентаэтил-2,4-диеноата и 2,42 г (15,4 ммоль) 4-хлор-3-гидроксибензальдегида в 280 мл безводного ацетонитрила нагревали с обратным холодильником в течение 96 ч. После охлаждения при Т.А. реакционную среду концентрировали при пониженном давлении и полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом циклогексан/этилацетат (AcOEt) от 0 до 30% AcOEt. После концентрации при пониженном давлении получали 2,4 г 6-(4-хлор-3-гидроксифенил)-5-(2,6 диметоксифенил)пиридин-2-этилкарбоксилата в форме белого порошка. Выход = 41%.(2,11 ммоль) гидрохлорида 3-хлор-N,N-диметилпропан-1-амина 3,40 г (1,34 ммоль) арбонатацезия. Реакционную среду перемешивали 15 мин при Т.А., затем нагревали 2 ч при 80 С. После охлаждения до Т. А. добавляли 1 мл водного раствора 5% лимонной кислоты и среду концентрировали при пониженном давлении. Остаток забирали 50 мл AcOEt и промывали 10 мл раствора 5% Na2CO3, затем 10 мл воды. После сушки на Na2SO4 и концентрации при пониженном давлении остаток очищали хроматографией на колонке с силикагелем, элюируя градиентом DCM/метанол 1-15% метанола. После концентрации при пониженном давлении получали 0,55 г 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6 диметоксифенил)пиридин-2-этилкарбоксилата в форме масла. Выход = 91%.- 18016352 1.7. 6-4-Хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2-карбоновая кислота. К раствору 5,63 г (11,28 ммоль) 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6 диметоксифенил)пиридин-2-этилкарбоксилата в 132 мл EtOH добавляли 3,16 г (56,38 ммоль) гидроксида калия. Реакционную среду нагревали 2 ч с обратным холодильником, затем концентрировали при пониженном давлении. Остаток забирали 10 мл воды, затем нейтрализовывали 56,5 мл (56,5 ммоль) 1 н. водного раствора HCl. Полученный осадок фильтровали через стеклянный фильтр и промывали 210 мл воды. После сушки при пониженном давлении получали 5,25 г 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2-карбоновой кислоты в форме белого порошка. Выход = 100%.F (С) = 215. 1.8. 1-([6-4-Хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2 ил]карбониламино)циклогексанкарбоновая кислота. К раствору 200 мг (0,42 ммоль) 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6 диметоксифенил)пиридин-2-карбоновой кислоты в 50 мл безводного DMF добавляли в атмосфере аргона 0,74 мл (0,41 ммоль) диизопропилэтиламина и 409 мг (1,28 ммоль) TBTU. Параллельно, нагревали при 90 С при перемешивании и в атмосфере аргона смесь 84 мг (0,59 ммоль) 2-аминоциклогексан-2 карбоновой кислоты и 0,18 мл (0,76 ммоль) N,O-бис-(триметилсилил)ацетамида (BSA) в 5 мл безводного ацетонитрила. Через 2 ч среда полностью растворялась и раствор охлаждали до Т.А., затем добавляли к раствору 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2 карбоновой кислоты, активированному TBTU. После 18 ч перемешивания при Т.А. добавляли 10 мл водного раствора 0,5 н. HCl и перемешивание продолжали 3 ч. Реакционную среду затем распределяли в смеси 20 млAcOEt/простой эфир 1:1 и 10 мл воды. После экстракции водную фазу снова экстрагировали 10 мл смесиNa2SO4 и концентрировали при пониженном давлении. Остаток очищали затем ВЭЖХ с обратной фазой(RP18), элюируя градиентом 0,01 н. HCl/ацетонитрил от 5 до 100% ацетонитрила. После концентрации при пониженном давлении и лиофилизации получали 106 мг гидрохлорида 1-([6-4-хлор-3-[3(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2-ил]карбониламино)циклогексанкарбоновой кислоты в форме белого порошка. Выход = 41%.(м, 4 Н); 1,25 (м, 4 Н). Пример 2. Гидрохлорид 9-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,6-диметоксифенил)пиридин-2-ил]карбониламино)бицикло[3.3.1]нонан-9-карбоновой кислоты (соединение 25). 2.1. 9-Аминобицикло[3.3.1]нонан-9-карбонитрил. К раствору 3 г (21,7 ммоль) бицикло[3.3.1]нонан-9-она в 40 мл EtOH последовательно добавляли 21 мл воды, 1,12 г (22,8 ммоль) цианида натрия, 4,52 мл (54,27 ммоль) водного раствора 12 н. гидроксида аммония и 2,32 г (43,41 ммоль) NH4Cl. Реакционную смесь перемешивали 18 ч при 50 С. Затем добавляли 5 мл водного раствора 12 н. гидроксида аммония и смесь снова нагревали 4 ч при 50 С. Раствор охлаждали до Т.А., затем распределяли в 100 мл смеси простой эфир/водный раствор 1 н. гидроксида натрия 1:1. После экстракции органическую фазу промывали 350 мл воды, высушивали на Na2SO4 и концентрировали при пониженном давлении. Полученный остаток забирали 50 мл простого эфира, затем обрабатывали 1 мин в легком токе хлорида водорода. Таким образом, полученный гидрохлорид фильтровали,промывали 20 мл простого эфира и распределяли в 100 мл смеси DCM/насыщенный водный растворNa2CO3 1:1. Водную фазу снова экстрагировали 50 мл DCM, затем органические фазы объединяли, затем промывали 220 мл воды и высушивали на Na2SO4. После концентрации при пониженном давлении получали 1,88 г 9-аминобицикло[3.3.1.]нонан-9-карбонитрила в форме масла. Выход = 52%. 2.2. N-(9-Цианобицикло[3.3.1]нон-9-ил)бензамид. К раствору 1,88 г (11,45 ммоль) 9-аминобицикло[3.3.1]нонан-9-карбонитрила в 20 мл THF добавляли раствор 2,37 г (17,17 ммоль) карбоната калия в 30 мл воды, затем 1,37 мл (11,8 ммоль) бензоилхлорида. Реакционную среду перемешивали 1 ч при Т.А., затем распределяли в 100 мл смеси DCM/вода 1:1. Органическую фазу промывали 50 мл воды, высушивали на Na2SO4 и концентрировали при пониженном давлении. Полученный остаток конкретизировали в 100 мл пентана, что позволяет получить, после фильтрации и промывки пентаном, 2,81 г N-(9-цианобицикло[3.3.1]нон-9-ил)бензамида в форме белого порошка. Выход = 92%.- 19016352 2.3. 9-Аминобицикло[3.3.1]нонан-9-карбоновая кислота. К раствору 2,8 г (10,43 ммоль) N-(9-цианобицикло[3.3.1]нон-9-ил)бензамида в 80 мл THF добавляли 200 мл водного раствора 12 н. HCl. Раствор перемешивали 20 ч при Т.А. и постепенно образовывался белый осадок. После фильтрации осадка через стеклянный фильтр и промывки 3200 мл воды получали 3,6 г бензоиламинобицикло-9-[3.3.1]нонан-9-карбоновой кислоты (влажный вес). 3 г (10,44 ммоль) 9-бензоиламинобицикло[3.3.1]нонан-9-карбоновой кислоты растворяли в 200 мл АсОН и 50 мл водного раствора 6 н. HCl и смесь нагревали 18 ч с обратным холодильником, затем частично концентрировали дистилляцией 150 мл растворителя. После охлаждения реакционную смесь фильтровали и распределяли в 150 мл смеси 1 н. водного раствора HCl/простого эфира 1:2. После экстракции водную фазу концентрировали, затем обрабатывали, добавляя по каплям водный раствор 12 н. гидроксида натрия (NaOH) до рН 5-6. Осажденную таким образом аминокислоту фильтровали, промывали 350 мл воды и высушивали при пониженном давлении, получая 1,88 г аминобицикло-9-[3.3.1]нонан 9-карбоновой кислоты в форме белых кристаллов. Выход = 98%.F (С) = 197. М = C35H42ClN3O6 = 635; М+Н =636. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 8,45 (с, 1 Н); 8,00 (д, 1 Н); 7,80 (д, 1 Н); 7,30 (т, 2 Н); 7,25 (с, 1 Н); 7,05 (д, 1 Н); 6,95 (дд, 1 Н); 6,70 (д, 1 Н); 3,85 (т, 2 Н); 3,50 (с, 6 Н); 3,05 (м, 2 Н); 2,70 (с, 6 Н); 2,2-1,4 (м, 16 Н). Пример 3. Гидрохлорид 2-([6-4-хлор-3-[(1-метилпирролидин-3-ил)окси]фенил-5-(2,6 диметоксифенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты (соединение 15). 3.1. 6-4-Хлор-3-[(1-метилпирролидин-3-ил)окси]фенил-5-(2,6-диметоксифенил)пиридин-2 этилкарбоксилат. К раствору 300 мг (0,72 ммоль) 6-(4-хлор-3-гидроксифенил)-5-(2,6-диметоксифенил)пиридин-2 этилкарбоксилата в 2,5 мл безводного THF, охлажденному до 0 С и помещенному в атмосферу аргона,добавляли 88 мг (0,87 ммоль) 1-метил-3-гидроксипирролидина, 246 мг (1,09 ммоль) трифенилфосфина и 0,01 мл (0,07 ммоль) TEA. После растворения добавляли по каплям при 0 С раствор 0,24 мл (1,09 ммоль)DIAD в 2,5 мл безводного THF. Реакционную среду нагревали до Т.А., перемешивали в течение 18 ч,затем забирали 50 мл AcOEt. Органическую фазу промывали последовательно 20 мл насыщенного водного раствора бикарбоната натрия (NaHCO3), затем 20 мл воды. После сушки на Na2SO4 и концентрации при пониженном давлении полученный остаток очищали хроматографией на колонке с силикагелем,элюируя с градиентом DCM/метанол 0-20% метанола. После концентрации при пониженном давлении получали 250 мг 6-4-хлор-3-[(1-метилпирролидин-3-ил)окси]фенил-5-(2,6-диметоксифенил)пиридин-2 этилкарбоксилата в форме масла. Выход = 70%. 3.2. Гидрохлорид 2-([6-4-хлор-3-[(1-метилпирролидин-3-ил)окси]фенил-5-(2,6-диметоксифенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты. Согласно последовательности омыление/пептидное сочетание, описанной в примерах 1.7 и 1.8, соответственно получали, исходя из 250 мг (0,5 ммоль) 6-4-хлор-3-[(1-метилпирролидин-3 ил)окси]фенил-5-(2,6-диметоксифенил)пиридин-2-этилкарбоксилата и 100 мг (0,51 ммоль) 2-аминоадамантан-2-карбоновой кислоты, 160 мг 2-([6-4-хлор-3-[2-(диметиламино)этокси]фенил-5(2,6-диметоксифенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты в форме белого порошка. Выход = 47%.(1415 ммоль) безводного карбоната калия в 1,2 л безводного DMF перемешивали 5 ч при 70 С, затем охлаждали до Т.А. Реакционную среду затем распределяли в 3 л смеси простой эфир/вода 2:1. Органическую фазу промывали 21 л воды, высушивали на Na2SO4 и концентрировали при пониженном давлении и полученный остаток конкретизировали в пентане. Получали таким образом 376 г 2-(бензилокси)-1 хлор-4-йодбензола в форме бежевого порошка. Выход = 92%.F (С) = 72. 4.2. [3-(Бензилокси)-4-хлорфенил]бороновая кислота. К раствору 198 г (575 ммоль) 2-(бензилокси)-1-хлор-4-йодбензола в 1,2 л безводного THF, помещенному в атмосферу аргона и перемешиваемому при -50 С, добавляли по каплям 374 мл (748 ммоль) 2 н. раствора iPrMgCl в THF, поддерживая температуру от -40 до -50 С. Реакционной смеси давали нагреться до -10 С и перемешивание продолжали 1 ч. Затем добавляли 172 мл (748 ммоль) триизопропилбората, затем реакционной смеси давали медленно нагреться до Т.А. После 2 ч перемешивания смесь обрабатывали 1 л 5 н. водного раствора HCl, затем экстрагировали простым эфиром (2600 мл). Органическую фазу промывали 21 л воды, высушивали на Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток конкретизировали в пентане, фильтровали через стеклянный фильтр и промывали пентаном. Получали таким образом 113 г [3-(бензилокси)-4-хлорфенил]бороновой кислоты в форме твердого вещества белого цвета. Выход = 76%.[3-(бензилокси)-4-хлорфенил]бороновой кислоты в 300 мл безводного DMF перемешивали 15 мин при барботировании аргона, затем добавляли 63,8 г (196 ммоль) безводного карбоната цезия и 5 г(4,33 ммоль) Pd(PPh3)4. Реакционную среду перемешивали 10 ч при 90 С в атмосфере аргона, охлаждали до Т.А., затем распределяли в 1 л смеси простой эфир/AcOEt 1:1 и 1 л 0,5 н. водного раствора HCl. Водную фазу повторно экстрагировали 500 мл смеси AcOEt/простой эфир 1:1. Органические фазы объединяли и промывали 4500 мл воды. После сушки на Na2SO4 и концентрации при пониженном давлении осадок забирали 500 мл смеси пентан/DCM 7:3, фильтровали и промывали пентаном. Получали таким образом 32 г 6-[3-(бензилокси)-4-хлорфенил]-5-гидроксипиридин-2-метилкарбоксилата в форме охристожелтого порошка. Выход = 53%.(105 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-гидроксипиридин-2 метилкарбоксилата в 200 мл DCM добавляли 17,7 мл (126 ммоль) TEA. Смесь постепенно солюбилизировали и охлаждали до -5 С в атмосфере аргона. Добавляли по каплям 19,42 мл (115,4 ммоль) ангидрид трифторметансульфоновой кислоты, поддерживая температуру 0 С. После 3 ч при 0 С реакционную среду забирали 300 мл DCM и промывали 2200 мл воды, высушивали на Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем,элюируя с градиентом пентан/AcOEt от 0 до 30% AcOEt. После концентрации при пониженном давлении получали 47,5 г 6-[3-(бензилокси)-4-хлорфенил]-5-[(трифторметил)сульфонил]оксипиридин-2-метилкарбоксилата в форме белых кристаллов. Выход = 90%.DMF перемешивали 15 мин при барботировании аргона, затем добавляли 12,7 г (60 ммоль) безводного фосфата калия (K3PO4) и 5,76 г (5 ммоль) Pd(PPh3)4 и реакционную смесь перемешивали 18 ч при 90 С в атмосфере аргона. Реакционную среду распределяли затем при Т.А. в 600 мл смеси простой эфир/AcOEt 1:1 и 600 мл воды. После экстракции водную фазу повторно экстрагировали 100 мл AcOEt, органические фазы объединяли и промывали 4300 мл воды, высушивали на Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом гептан/AcOEt от 0 до 20% AcOEt. После концентрации при пониженном давлении получа- 21016352 ли 18 г 6-[3-(бензилокси)-4-хлорфенил]-5-(2-метилфенил)пиридин-2-метилкарбоксилата в форме масла. Выход = 81%. 4.6. 6-(4-Хлор-3-гидроксифенил)-5-(2-метилфенил)пиридин-2-метилкарбоксилат. К раствору 19 г (42,8 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-(2-метилфенил)пиридин-2 метилкарбоксилата в 70 мл безводного DCM, охлажденному в атмосфере аргона до -70 С, добавляли по каплям за 1 ч 30 мин 85,6 мл (85,6 ммоль) 1 н. раствора трибромида бора в DCM, поддерживая температуру -65 С. После 2 ч перемешивания при -70 С добавляли по каплям 20 мл (520 ммоль) безводного метанола, поддерживая температуру -65 С. Реакционную среду снова нагревали до Т.А., затем концентрировали при пониженном давлении. Остаток забирали 100 мл толуола и снова концентрировали. Операцию повторяли еще два раза. Полученный остаток забирали 100 мл метанола и охлаждали в атмосфере аргона до 0 С, затем добавляли по каплям 9 мл (128 ммоль) тионилхлорида. Реакционную среду перемешивали 48 ч при Т.А., затем концентрировали при пониженном давлении. Полученный остаток забирали 200 мл AcOEt, охлаждали до 0 С и обрабатывали 300 мл насыщенного водного раствора NaHCO3. После экстракции водную фазу повторно экстрагировали 100 мл AcOEt. Органические фазы объединяли, промывали 100 мл воды, высушивали на Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом гептан/AcOEt от 0 до 30% вAcOEt. После концентрации при пониженном давлении получали 14,7 г 6-(4-хлор-3-гидроксифенил)-5(2-метилфенил)пиридин-2-метилкарбоксилата в форме белого порошка. Выход = 97%.F (С) = 224. М = C35H40ClN3O4 = 601; М+Н = 602. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 8,50 (с, 1 Н); 8,05 (д, 1 Н); 7,90 (д, 1 Н); 7,25 (м, 5 Н); 7,10 (дд, 1 Н); 6,95 (дд, 1 Н); 3,80 (м, 2 Н); 3,1 (м, 2 Н); 2,75 (с, 6 Н); 2,60 (с, 2 Н); 1,90 (с, 3 Н); 2,2-1,6 (м, 14 Н). Пример 5. Гидрохлорид 2-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-оксопирролидин 1-ил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты (соединение 23). 5.1. 6-[3-(Бензилокси)-4-хлорфенил]-5-(2-оксопирролидин-1-ил)пиридин-2-метилкарбоксилат. Раствор 500 мг (1 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-[(трифторметил)сульфонил]оксипиридин-2-метилкарбоксилата, 0,1 мл (1,1 ммоль) 2-пирролидинона и 450 мг (1,4 ммоль) карбоната цезия в 10 мл безводного 1,4-диоксана перемешивали 10 мин при барботировании аргона, затем добавляли 9 мг(0,01 ммоль) Pd2(dba)3 и 17 мг (0,03 ммоль) Xantphos и реакционную среду нагревали 6 ч при 70 С при перемешивании. Смесь распределяли затем в 100 мл смеси простой эфир/AcOEt 1:1 и 50 мл насыщенного водного раствора NH4Cl. После экстракции органическую фазу промывали 250 мл воды, высушивали наNa2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом гептан/AcOEt от 0 до 30% AcOEt. После концентрации при пониженном давлении получали 293 мг 6-[3-(бензилокси)-4-хлорфенил]-5-(2-оксопирролидин-1 ил)пиридин-2-метилкарбоксилата в форме масла. Выход = 67%. 5.2. 6-4-Хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-оксопирролидин-1-ил)пиридин-2 метилкарбоксилат. Согласно последовательности дебензилирование/О-алкилирование, которая была описана в примерах 4.6 и 1.6, соответственно получали, исходя из 511 мг (1,17 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5(2-оксопирролидин-1-ил)пиридин-2-метилкарбоксилата,391 мг 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-оксопирролидин-1-ил)пиридин-2-метилкарбоксилата в форме масла. Выход = 77%.F (С) = 199. М = C32H39ClN4O5 = 594; М+Н = 595. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 8,40 (с, 1 Н); 8,05 (т, 2 Н); 7,55 (д, 1 Н); 7,50 (с, 1 Н); 7,20 (дд, 1 Н); 4,15 (т, 2 Н); 3,65 (т, 2 Н); 2,75 (с, 6 Н); 2,55 (с, 2 Н); 2,2-1,6 (м, 20 Н). Пример 6. Гидрохлорид 2-[(2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'ил)карбонил]аминоадамантан-2-карбоновой кислоты (соединение 27). 6.1. 2'-[3-(Бензилокси)-4-хлорфенил]-2,3'-бипиридин-6'-метилкарбоксилат. Суспензию 0,5 г (1 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-[(трифторметил)сульфонил]оксипиридин-2-метилкарбоксилата, 0,44 г (1,2 ммоль) 2-три-н-бутилстаннилпиридина и 42 мг (1 ммоль) безводного хлорида лития в 2 мл безводного DMF перемешивали 10 мин при барботировании аргона, затем добавляли 9,5 мг (0,05 ммоль) CuI, 45 мг (0,05 ммоль) Pd2(dba)3 и 27 мг (0,05 ммоль) PdCl2 (dppf) и реакционную смесь нагревали при 90 С. После 5 ч перемешивания при 90 С смесь охлаждали до Т.А, забирали 30 мл AcOEt, обрабатывали и перемешивали в течение 15 мин с 30 мл 5%-ного (вес.) водного раствора фторида калия. Двухфазную смесь затем фильтровали через целит и целит промывали 30 млAcOEt. Органическую фазу промывали 460 мл воды, высушивали на Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом толуол/AcOEt от 0 до 15% AcOEt. После концентрации при пониженном давлении получали 240 мг 2'-[3-(бензилокси)-4-хлорфенил]-2,3'-бипиридин-6'-метилкарбоксилата в форме масла. Выход = 55%. 6.2. 2'-4-Хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'-метилкарбоксилат. Согласно последовательности дебензилирование/О-алкилирование, которая была описана в примерах 4.6 и 1.6, соответственно получали, исходя из 680 мг (1,58 ммоль) 2'-[3-(бензилокси)-4-хлорфенил]2,3'-бипиридин-6'-метилкарбоксилата, 580 мг 2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'бипиридин-6'-метилкарбоксилата в форме масла. Выход = 86%. 6.3. Гидрохлорид 2-[(2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'ил)карбонил]аминоадамантан-2-карбоновой кислоты. Согласно последовательности омыление/пептидное сочетание, описанной в примерах 1.7 и 1.8, соответственно получали, исходя из 581 мг (1,36 ммоль) 2'-4-хлор-3-[3-(диметиламино)пропокси]фенил 2,3'-бипиридин-6'-метилкарбоксилата и 365 мг (1,87 ммоль) 2-аминоадамантан-2-карбоновой кислоты,435 мг гидрохлорида 2-[(2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'ил)карбонил]аминоадамантан-2-карбоновой кислоты в форме белого порошка. Выход = 48%.F (С) = 209. М = C33H37ClN4O4 = 588; М+Н = 589. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 10,55 (с, 1 Н); 8,65 (с, 1 Н); 8,50 (с, 1 Н); 8,25 (д, 1 Н); 8,10 (д, 1 Н); 7,80 (т, 1 Н); 7,40 (дд, 1 Н); 7,35 (д, 2 Н); 7,25 (с, 1 Н); 6,80 (д, 1 Н); 3,95 (т, 2 Н); 3,15 (м, 2 Н); 2,75 (с, 3 Н); 2,70 (с, 3 Н); 2,60 (с, 2 Н); 2,2-1,6 (м, 14 Н). Пример 7. Гидрохлорид 2-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2 хлорфенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты (соединение 22). 7.1. 6-4-Хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлорфенил)пиридин-2-метилкарбоксилат. Согласно последовательности дебензилирование/О-алкилирование, которая была описана в примерах 4.6 и 1.6, соответственно получали, исходя из 625 мг (1,35 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5(2-хлорфенил)пиридин-2-метилкарбоксилата, 173 мг 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5(2-хлорфенил)пиридин-2-метилкарбоксилата в форме масла. Выход =28%. 7.2. Гидрохлорид 2-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлорфенил)пиридин-2 ил]карбониламино)адамантан-2-карбоновой кислоты. Согласно последовательности омыление/пептидное сочетание, описанной в примерах 1.7 и 1.8, соответственно получали, исходя из 290 мг (0,63 ммоль) 6-4-хлор-3-[3-(диметиламино)пропокси]фенил 5-(2-хлорфенил)пиридин-2-метилкарбоксилата и 184 мг (0,94 ммоль) 2-аминоадамантан-2-карбоновой кислоты, 120 мг гидрохлорида 2-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-хлорфенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты в форме белого порошка.F (С) = 146-150. М = C31H36ClN3O4 = 549; М+Н = 550. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 10,5 (с, 1 Н); 8,40 (с, 1 Н); 8,05 (д, 1 Н); 7,90 (д, 1 Н); 7,35 (д, 1 Н); 7,25 (м, 5 Н); 7,05 (дд, 1 Н); 3,80 (м, 2 Н); 3,1 (м, 2 Н); 2,75 (с, 6 Н); 1,75 (с, 3 Н); 2,2-1,6 (м, 12 Н). Пример 9. Гидрохлорид цис-1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2 метилфенил)пиридин-2-ил]карбониламино)-4-гидроксициклогексанкарбоновой кислоты (соединение 147). К смеси 490 мг (1 ммоль) гидрохлорида 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2 метилфенил)пиридин-2-карбоновой кислоты в 5 мл безводного DMF добавляли последовательно в атмосфере аргона и при Т.А. 127 мг (1,1 ммоль) N-гидроксисукцинимида и 211 мг (1,1 ммоль) EDC.HCl. После 18 ч перемешивания добавляли последовательно в реакционную среду (ярко-желтую и прозрачную) 0,9 мл (5,4 ммоль) DIEA и 215 мг (1,1 ммоль) цис-1-амино-4-гидроксициклогексан карбоновой кислоты(J. Chem.Soc., Perkin Trans. 1 (1999), p. 3375-3379). Перемешивание продолжали 18 ч при Т.А., затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток затем обрабатывали 18 ч при Т.А. с 7 мл (7 ммоль) 1 н. HCl, затем концентрировали при пониженном давлении. Остаток очищали ВЭЖХ на колонке RP18, элюируя с градиентом 10-2 Н HCl/ацетонитрил от 0 до 100% ацетонитрила. После лиофилизации получали 350 мг гидрохлорида цис-1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2-метилфенил)пиридин-2-ил]карбониламино)-4-гидроксициклогексанкарбоновой кислоты в форме белого порошка. Выход = 55%.F (С) = 168. М = C33H40ClN3O5 = 565; М+Н = 566. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 8,55 (с, 1 Н); 8,05 (д, 1 Н); 7,90 (д, 1 Н); 7,25 (м, 6 Н); 6,90 (дд, 1 Н); 4,65 (si, 1 Н); 3,90 (м, 2 Н); 3,50 (м, 1 Н); 3,10 (м, 2 Н); 2,95 (q, 4H); 2,30 (м, 2 Н); 2,05 (м, 2 Н); 1,90 (с, 3 Н); 1,80 (м, 4 Н); 1,35 (м, 2 Н); 1,10 (т, 6 Н). Пример 10. Гидрохлорид 3-[(4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"терфенил-4'-ил карбонил) амино]-4-метилпентановой кислоты (соединение 28). 10.1. 2-[3-(Бензилокси)-4-хлорфенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан. Суспензию 20 г (67,2 ммоль) 2-бензилокси-4-бром-1-хлорбензола, 28 г (94 ммоль) 4,4,4',4',5,5,5',5'октаметил-2,2'-би-1,3,2-диоксаборолана и 26,4 г (26,9 ммоль) ацетата калия в 280 мл безводного ДМСО перемешивали 10 мин в атмосфере аргона, затем добавляли 2,46 г (3,4 ммоль) PdCl2(dppf) и нагревали 1 ч при 110 С. После распределения в 1 л смеси простой эфир/вода 1:1, после которого следует фильтрация через целит, органическую фазу промывали 100 мл воды, высушивали на Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом гептан/AcOEt от 0 до 10% AcOEt. После концентрации при пониженном давлении получали 17,5 г 2-[3-(бензилокси)-4-хлорфенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолана в форме масла. Выход = 74%. 10.2. 2-Бром-2',6'-диметоксибифенил-4-метилкарбоксилат. Раствор 4,84 г (14,2 ммоль) 3-бром-4-йодметилбензоата (J. Med. Chem., 1999, 42, 4088) и 3,88 г(21,29 ммоль) 2,6-диметоксифенилбороновой кислоты в 120 мл DMF и в 14,2 мл водного раствора 2 М карбоната цезия перемешивали 15 мин в атмосфере аргона, затем добавляли 984 мг (0,85 ммоль)Pd(PPh3)4 и нагревали 2,5 ч при 85 С. После концентрации при пониженном давлении полученный остаток распределяли в 600 мл смеси DCM/вода 1:1. Органическую фазу промывали 100 мл воды, высушивали на MgSO4 и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом гептан/AcOEt от 0 до 10% AcOEt. После концентрации при пониженном давлении получали 2,79 г 2-бром-2',6'-диметоксибифенил-4-метилкарбоксилата в форме масла.- 24016352 Выход = 56%. 10.3. 3"-(Бензилокси)-4"-хлор-2,6-диметокси-1,1':2',1"-терфенил-4'-метилкарбоксилат. Согласно способу, описанному в примере 10.2, получали, исходя из 2,79 г (7,94 ммоль) 2-бром-2',6'диметоксибифенил-4-метилкарбоксилата и 3,28 г (9,53 ммоль) 2-[3-(бензилокси)-4-хлорфенил]-4,4,5,5 тетраметил-1,3,2-диоксаборолана, 1,75 г 3"-(бензилокси)-4"-хлор-2,6-диметокси-1,1':2',1"-терфенил-4'метилкарбоксилата в форме масла. Выход = 45%. 10.4. 4"-Хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил-4'-метилкарбоксилат. Согласно последовательности дебензилирование/О-алкилирование, которая была описана в примерах 4.6 и 1.6, соответственно получали, исходя из 1,75 г (3,58 ммоль) 3"-(бензилокси)-4"-хлор-2,6 диметокси-1,1':2',1"-терфенил-4'-метилкарбоксилата, 900 мг 4"-хлор-3"-[3-(диметиламино)пропокси]-2,6 диметокси-1,1':2',1"-терфенил-4'-метилкарбоксилата в форме масла. Выход = 52%. 10.5. 4"-Хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил-4'-карбоновая кислота. Согласно способу, описанному в примере 1.7, получали, исходя из 900 мг (1,86 ммоль) 4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил-4'-метилкарбоксилата, 700 мг 4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил-4'-карбоновой кислоты в форме твердого вещества розового цвета. Выход = 82%.F (С) = 230. 10.6. Гидрохлорид 3-[(4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил 4'-илкарбонил)амино]-4-метилпентановой кислоты. К раствору 315 мг (0,67 ммоль) кислоту 4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси 1,1':2',1"-терфенил-4'-карбоновой кислоты в 7 мл безводного THF добавляли 141 мг (0,87 ммоль) CDI и реакционную среду перемешивали при 55 С в течение 1 ч в атмосфере аргона. Добавляли 70 мг(0,43 ммоль) карбонил-1,1'-диимидазола и реакцию продолжали 1 ч при 50 С. Затем добавляли суспензию 97 мг (0,74 ммоль) рацемической 3-амино-4-метилпентановой кислоты в смеси 4 мл THF и 0,8 млDMF и перемешивание продолжали 15 ч при 55 С. После концентрации при пониженном давлении полученный остаток распределяли в 30 мл смеси DCM/вода 2:1. Органическую фазу промывали 10 мл воды, высушивали на сульфате магния (MgSO4) и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом DCM/метанол от 0 до 5% метанола. После концентрации при пониженном давлении остаток конкретизировали в простом эфире, фильтровали через стеклянный фильтр и промывали простым эфиром. Получали таким образом 91 мг гидрохлорида 3-[(4"-хлор-3"-[3-(диметиламино)пропокси]-2,6-диметокси-1,1':2',1"-терфенил-4'илкарбонил)амино]-4-метилпентановой кислоты в форме белого порошка. Выход = 23%.(18,64 ммоль) 2-[3-(бензилокси)-4-хлорфенил]-4,4,5,5-тетраметил-1, 3, 2-диоксаборолана в смеси 160 мл диметоксиэтана (DME), 80 мл EtOH и 120 мл насыщенного водного раствора NaHCO3 перемешивали 15 мин в атмосфере аргона, затем добавляли 662 мг Pd(PPh3)4 и реакционную смесь нагревали 4 ч 30 мин при 90 С. После концентрации при пониженном давлении полученный остаток распределяли в смеси 200 мл DCM и 10 мл воды. Водную фазу повторно экстрагировали 100 мл DCM, органические фазы объединяли, высушивали на MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом DCM/метанол от 0 до 2% метанола. После концентрации при пониженном давлении остаток конкретизирован в смеси метанол/простой эфир 5/95, затем фильтровали и промывали простым эфиром. Получали таким образом 1,99 г 5-[3-(бензилокси)-4-хлорфенил]-6-оксо-1,6-дигидропиридин-3-метилкарбоксилата в форме твердого вещества бежевого цвета. Выход = 40%.(3,74 ммоль) 2-метилфенилбороновой кислоты, 1,26 г 5-[3-(бензилокси)-4-хлорфенил]-6-(2 метилфенил)метилникотината в форме масла. Выход = 95%. 11.4. 5-4-Хлор-3-[3-(диметиламино)пропокси]фенил-6-(2-метилфенил)метилникотинат. Согласно последовательности дебензилирование/О-алкилирование, описанной в примерах 4.6 и 1.6,соответственно получали, исходя из 1,26 г (2,84 ммоль) 5-[3-(бензилокси)-4-хлорфенил]-6-(2 метилфенил)метилникотината,843 мг 5-4-хлор-3-[3-(диметиламино)пропокси]фенил-6-(2 метилфенил)метилникотината в форме масла. Выход = 68%. 11.5. Гидрохлорид 3-([5-4-хлор-3-[3-(диметиламино)пропокси]фенил-6-(2-метилфенил)пиридин 3-ил]карбониламино)-4-метилпентановой кислоты. Согласно последовательности омыление/пептидное сочетание, описанной в примерах 1.7 и 10.6, соответственно получали, исходя из 835 мг (1,90 ммоль) 5-4-хлор-3-[3-(диметиламино)пропокси]фенил 6-(2-метилфенил)метилникотината и 258 мг (1,97 ммоль) рацемической 3-амино-4-метилпентановой кислоты, 130 мг гидрохлорида 3-([5-4-хлор-3-[3-(диметиламино)пропокси]фенил-6-(2-метилфенил)пиридин-3-ил]карбониламино)-4-метилпентановой кислоты в форме твердого вещества белого цвета. Выход = 13%.(д, 1 Н); 7,15 (м, 4 Н); 4,25 (м, 1 Н); 3,8 (т, 2 Н); 2,65 (т, 2 Н); 2,45 (с, 6 Н); 1,95 (с, 3 Н); 1,85 (м, 5 Н); 0,90 (д,6 Н). Пример 12. Гидрохлорид 2-([6-[3-[3-(диметиламино)пропокси]-4-(трифторметил)фенил]-5-(2 метилфенил)пиридин-2-ил]карбониламино)адамантан-2-карбоновой кислоты (соединение 43). 12.1. 2-Йод-5-нитрофенол. К раствору 30,81 г (200 ммоль) 2-амино-5-нитрофенола в смеси 500 мл серной кислоты (30 вес.%) и 500 мл ДМСО, охлажденному до 5 С, добавляли по каплям раствор 20,7 г (300 ммоль) нитрита натрия(NaNO2) в 100 мл воды, поддерживая температуру 5 С. После 0,5 ч при 5 С добавляли по каплям раствор 90 г (600 ммоль) йодида натрия в 100 мл воды, затем реакционную среду снова нагревали до Т.А. После 2 ч перемешивания реакционную среду распределяли в 2 л смеси простой эфир/водный раствор(10 вес.%) гидросульфита натрия 1:1. Водную фазу повторно экстрагировали 200 мл простого эфира и объединенные органические фазы промывали 31 л воды, затем высушивали на Na2SO4. После концентрации при пониженном давлении полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом циклогексан/AcOEt от 0 до 10% AcOEt. После концентрации при пониженном давлении получали 39,8 г 2-йод-5-нитрофенола в форме твердого вещества коричневого цвета. Выход = 75%.F (С) = 150. 12.2. 2-(Бензилокси)-1-йод-4-нитробензол. Согласно способу, описанному в примере 4.1, получали, исходя из 20,8 г (78,5 ммоль) 2-йод-5 нитрофенола и 9,3 мл (78,5 ммоль) бензилбромида, 25,2 г 2-(бензилокси)-1-йод-4-нитробензола в форме масла. Выход = 90%. 12.3. 2-(Бензилокси)-4-нитро-1-(трифторметил)бензол. К смеси 4,08 г (70,2 ммоль) безводного фторида калия и 13,36 г (70,18, ммоль) безводного CuI и 19,17 г (54 ммоль) 2-(бензокси)-1-йод-нитробензола в 77 мл безводного NMP добавляли 10,4 мл(70,18 ммоль) трифторметилтриметилсилана и реакционную среду нагревали 18 ч при 45 С в атмосфере аргона. Суспензию распределяли при Т.А. в 1 л смеси простой эфир/вода 1:1, органическую фазу затем промывали 4300 мл воды, высушивали на Na2SO4, затем концентрировали при пониженном давлении. Получали таким образом 15 г 2-(бензилокси)-4-нитро-1-(трифторметил)бензола в форме масла. Выход = 94%.- 26016352 12.4. 3-(Бензилокси)-4-(трифторметил)анилин. К смеси 15 г (50,3 ммоль) 2-(бензилокси)-4-нитро-1-(трифторметил)бензола в 200 мл EtOH, 10 мл АсОН и 100 мл воды добавляли 14,1 г (252 ммоль) железной стружки, затем реакционную смесь сильно взбалтывали при 70 С в течение 20 мин. После охлаждения до Т.А. реакционную смесь медленно добавляли к смеси 300 мл простого эфира и 1 л насыщенного водного раствора Na2CO3. После нейтрализации водную фазу повторно экстрагировали 2100 мл простого эфира. Органические фазы объединяли, промывали 100 мл воды, высушивали на хлориде кальция и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом пентан/AcOEt от 0 до 50% AcOEt. После концентрации при пониженном давлении получали 8,1 г 3-(бензилокси)-4-(трифторметил)анилина в форме масла. Выход = 60%. 12.5. 2-(Бензилокси)-4-йод-1-(трифторметил)бензол. Согласно способу, описанному в примере 12.1, получали, исходя из 8 г (30 ммоль) 3-(бензилокси)4-(трифторметил)анилина, 8 г 2-(бензилокси)-4-йод-1-(трифторметил)бензола в форме масла. Выход = 70%. 12.6. [3-(Бензилокси)-4-(трифторметил)фенил]бороновая кислота. Согласно способу, описанному в примере 4.2, получали, исходя из 8 г (21,2 ммоль) 2-(бензилокси)4-йод-1-(трифторметил)бензола, 11,1 мл (22,2 ммоль) iPrMgCl и 5 мл (21,6 ммоль) триизопропилбората,4,95 г [3-(бензилокси)-4-(трифторметил)фенил]бороновой кислоты в форме масла. Выход = 79%. 12.7. 6-[3-(Бензилокси)-4-(трифторметил)фенил]-5-гидроксипиридин-2-метилкарбоксилат. Согласно способу, описанному в примере 4.3, получали, исходя из 4,95 г (16,7 ммоль)[3-(бензилокси)-4-(трифторметил)фенил]бороновой кислоты и 3,88 г (16,72 ммоль) 6-бром-5 гидроксипиридин-2-метилкарбоксилата, 4,38 г 6-[3-(бензилокси)-4-(трифторметил)фенил]-5-гидроксипиридин-2-метилкарбоксилата в форме твердого вещества белого цвета. Выход = 65%.F (С) = 82. 12.8. 6-[3-(Бензилокси)-4-(трифторметил)фенил]-5-(2-метилфенил)пиридин-2-метилкарбоксилат. Согласно последовательности трифлат/сочетание по Suzuki, описанной в примерах 4.4 и 4.5, соответственно получали, исходя из 4,38 г (10,9 ммоль) 6-[3-(бензилокси)-4-(трифторметил)фенил]-5 гидроксипиридин-2-метилкарбоксилата и 1,8 г (13,1 ммоль) 2-метилфенилбороновой кислоты, 4,63 г 6-[3-(бензилокси)-4-(трифторметил)фенил]-5-(2-метилфенил)пиридин-2-метилкарбоксилата в форме твердого вещества белого цвета. Выход = 89%.F (С) = 226. 12.9. 6-[3-[3-(Диметиламино)пропокси]-4-(трифторметил)фенил]-5-(2-метилфенил)пиридин-2 метилкарбоксилат. Согласно последовательности дебензилирование/O-алкилирование, описанной в примерах 4.6 и 1.6,соответственно получали, исходя из 2,57 г (5,38 ммоль) 6-[3-(бензилокси)-4-(трифторметил)фенил]-5-(2 метилфенил)пиридин-2-метилкарбоксилата, 2,26 г 6-[3-[3-(диметиламино)пропокси]-4-(трифторметил)фенил]-5-(2-метилфенил)пиридин-2-метилкарбоксилата в форме твердого вещества белого цвета. Выход = 89%.- 27016352 13.1. 6-[3-(Бензилокси)-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2 метилкарбоксилат. Раствор 5 г (10 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-[(трифторметил)сульфонил]оксипиридин-2-метилкарбоксилата и 2,78 г (11 ммоль) 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолана в 50 мл безводного 1,4-диоксана перемешивали 15 мин при барботировании аргона, затем добавляли 2,93 г (30 ммоль) безводного ацетата калия и 0,37 г (0,45 ммоль) PdCl2(dppf) и нагревали реакционную смесь 26 ч при 80. Реакционную смесь распределяли затем в 100 мл смеси AcOEt/солевой раствор 1:1. Органическую фазу высушивали на Na2SO4, фильтровали, затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем, элюируя с градиентом циклогексан/AcOEt от 0 до 20% AcOEt. После концентрации при пониженном давлении получали 3,2 г 6-[3-(бензилокси)-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2 метилкарбоксилата в форме воска. Выход = 67%. 13.2. 2'-[3-(Бензилокси)-4-хлорфенил]-3-хлор-2,3'-бипиридин-6'-метилкарбоксилат. Раствор 850 мг (1,77 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)пиридин-2-метилкарбоксилата и 524 мг (3,54 ммоль) 2,3-дихлорпиридина в смеси 4 мл DME и 2 мл воды перемешивали 15 мин в атмосфере аргона, затем добавляли последовательно 734 мг (5,32 ммоль) K2CO3 и 61 мг (0,05 ммоль) Pd(PPh3)4 и нагревали реакционную среду 4 ч при 85 С. Реакционную смесь затем распределяли между 10 мл AcOEt и 10 мл солевого раствора. Органическую фазу высушивали на Na2SO4, фильтровали, затем концентрировали при пониженном давлении. Полученный остаток очищали на колонке с силикагелем, элюируя с градиентом циклогексан/AcOEt от 0 до 20%AcOEt. После концентрации при пониженном давлении получали 237 мг 2'-[3-(бензилокси)-4 хлорфенил]-3-хлор-2,3'-бипиридин-6'-метилкарбоксилата в форме масла. Выход = 28%. 13.3. 3-Хлор-2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'-метилкарбоксилат. Согласно последовательности дебензилирование/О-алкилирование, описанной в примерах 4.6 и 1.6,соответственно получали, исходя из 360 мг (0,77 ммоль) 2'-[3-(бензилокси)-4-хлорфенил]-3-хлор-2,3'бипиридин-6'-метилкарбоксилата, 130 мг 3-хлор-2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'бипиридин-6'-метилкарбоксилата в форме масла. Выход = 37%. 13.4. Гидрохлорид 1-[(3-хлор-2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'-бипиридин-6'ил)карбонил]аминоциклогексанкарбоновой кислоты. Согласно последовательности омыление/пептидное сочетание, описанной в примерах 1.7 и 1.8, соответственно получали,исходя из 130 мг[]D22 = -18 (с=0,1; МеОН). М = C30H35Cl2N3O4 = 571; М+Н = 572. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 8,60 (дд, 1 Н); 8,10 (д, 1 Н); 7,95 (д, 1 Н); 7,40-7,15 (м, 5 Н); 6,90 (д,1 Н); 4,15 (м, 1 Н); 3,90 (м, 2 Н); 3,15 (т, 2 Н); 2,75 (с, 6 Н); 2,55 (т, 2 Н); 2,25 (д, 3 Н (вращательные изомеры; 2,10 (м, 2 Н); 1,90 (м, 1 Н); 0,85 (дд, 6 Н (вращательные изомеры. Пример 15. Гидрохлорид 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,4 диметилфенил)пиридин-2-ил]карбониламино)циклогексанкарбоновой кислоты (соединение 66). 15.1. 6-[3-(Бензилокси)-4-хлорфенил]-5-(2,4-диметилфенил)пиридин-2-метилкарбоксилат. Согласно способу, описанному в примере 4.5, осуществляли сочетание по Suzuki между 1 г(2 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-[(трифторметил)сульфонил]оксипиридин-2-метилкарбоксилата и 418 мг (2,8 ммоль) 2,4-диметилфенилбороновой кислоты, получая 820 мг 6-[3-(бензилокси)-4-хлорфенил]5-(2,4-диметилфенил)пиридин-2-метилкарбоксилата в форме масла. Выход = 90%. 15.2. Гидрохлорид 6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,4-диметилфенил)пиридин 2-карбоновой кислоты. Согласно последовательности дебензилирование/О-алкилирование/омыление, которая была описана в примерах 4.6, 1.6 и 1.7, соответственно получали, исходя из 820 мг (1,8 ммоль) 6-[3-(бензилокси)-4 хлорфенил]-5-(2,4-диметилфенил)пиридин-2-метилкарбоксилата, 659 мг гидрохлорида 6-4-хлор-3-[3(диметиламино)пропокси]фенил-5-(2,4-диметилфенил)пиридин-2-карбоновой кислоты в форме смолы. Выход = 77%. 15.3. Гидрохлорид 1-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,4-диметилфенил)пиридин-2-ил]карбониламино)циклогексанкарбоновой кислоты. Согласно способу, описанному в примере 1.8, пептидное сочетание осуществляли между 356 мг(3S)-3-([6-4-хлор-3-[3-(диметиламино)пропокси]фенил-5-(2,4 диметилфенил)пиридин-2-ил]карбониламино)-4,4-диметилпентановой кислоты (соединение 117). Согласно способу, описанному в примере 9, осуществляли пептидное сочетание между 950 мг[]D22 = -5 (c=0,1; МеОН). М = C32H40ClN3O4 = 565; М+Н = 566. 1 Н ЯМР (м.д., d6-ДМСО, 400 МГц): 10,09 (с, 1 Н); 8,2 (д, 1 Н); 7,85 (д, 1 Н); 7,70 (д, 1 Н); 7,10 (д, 1 Н); 6,95 (д, 1 Н); 6,85 (м, 3 Н); 6,80 (т, 1 Н); 4,10 (т, 1 Н); 3,65 (м, 2 Н); 2,95 (м, 2 Н); 2,50 (д, 6 Н); 2,40 (дд, 1 Н); 2,30 (дд, 1 Н); 2,10 (с, 3 Н); 1,85 (м, 2 Н); 1,65 (с, 3 Н); 0,70 (д, 9 Н, вращательные изомеры). Пример 17. Гидрохлорид 1-[(3,5-дихлор-2'-4-хлор-3-[3-(диметиламино)пропокси]фенил-2,3'бипиридин-6'-ил)карбонил]аминоциклогексанкарбоновой кислоты (соединение 65). 17.1. 2'-[3-(Бензилокси)-4-хлорфенил]-3,5-дихлор-2,3'-бипиридин-6'-метилкарбоксилат. Согласно способу, описанному в примере 13.2, осуществляли сочетание по Suzuki-Myaura между 4,4 г (9,17 ммоль) 6-[3-(бензилокси)-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-метилкарбоксилата и 2,5 г (11 ммоль) 2-бром-3,5-дихлорпиридина, получая 3 г 2'-[3-(бензилокси)-4-хлорфенил]-3,5-дихлор-2,3'-бипиридин-6'-метилкарбоксилата в форме масла. Выход = 65%.
МПК / Метки
МПК: C07D 401/04, A61P 9/00, C07D 241/10, C07D 213/60, A61K 31/435
Метки: антагонистов, получение, терапии, уротензина, применение, рецепторов, производные, 5,6-бис-арил-2-пиридинкарбоксамида, качестве
Код ссылки
<a href="https://eas.patents.su/30-16352-proizvodnye-56-bis-aril-2-piridinkarboksamida-ih-poluchenie-i-ih-primenenie-v-terapii-v-kachestve-antagonistov-receptorov-urotenzina-ii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5,6-бис-арил-2-пиридинкарбоксамида, их получение и их применение в терапии в качестве антагонистов рецепторов уротензина ii</a>
Предыдущий патент: Способ получения серной кислоты из сероводородного газа
Следующий патент: Новый способ синтеза ивабрадина и его солей присоединения с фармацевтически приемлемой кислотой
Случайный патент: Способ формирования тонкой пленки












