Ингибитор p38 mapk-киназы
Номер патента: 19590
Опубликовано: 30.04.2014
Авторы: Кинг-Андервуд Джон, Онионз Стюарт Томас, Рейппорт Уилльям Гарт, Уилльямс Джонатан Гарет, Ито Кадзухиро, Чаррон Кэтрин Элизабет, Стронг Питер, Мюррей Питер Джон
Формула / Реферат
1. Соединение формулы (I)
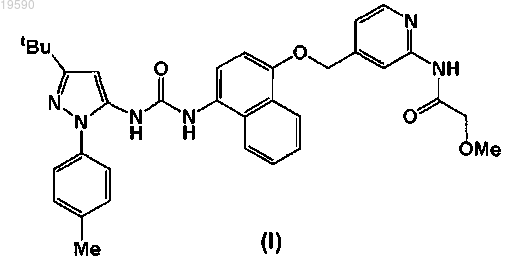
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая соединение по п.1, в комбинации с одним или более фармацевтически приемлемыми разбавителями или носителями.
3. Применение соединения формулы (I) по п.1 для получения лекарственного средства для лечения или предотвращения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, астмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита, контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому.
4. Способ лечения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, астмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита, контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому, который включает введение субъекту эффективного количества соединения формулы (I) по п.1.
5. Способ лечения или предотвращения респираторного расстройства, включающий введение субъекту эффективного количества соединения формулы (I) по п.1.
6. Способ по п.5, где соединения формулы (I) вводят в комбинации с одним или более другими активными ингредиентами, выбранными из стероидов, бета-агонистов и ксантинов.
7. Способ лечения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, астмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита, контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому, который включает введение субъекту эффективного количества фармацевтической композиции по п.2.
8. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает взаимодействие соединения формулы (II)
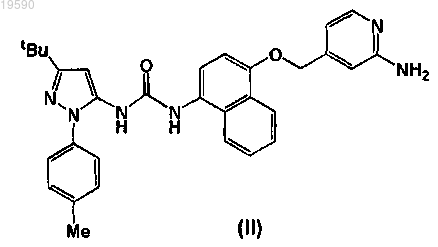
с соединением формулы (III)
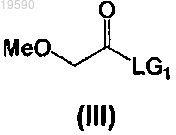
где LG1 представляет уходящую группу.
9. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает взаимодействие соединения формулы (X)
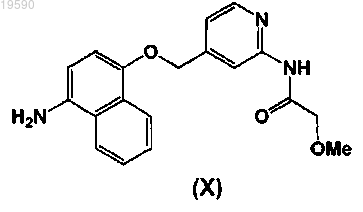
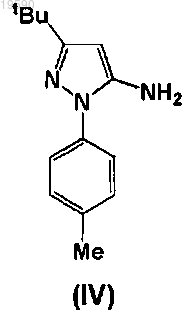
с соединением формулы (IV)
и соединением формулы (XI)
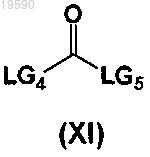
где каждые из LG4 и LG5 независимо представляют уходящие группы.
10. Соединение формулы (X)
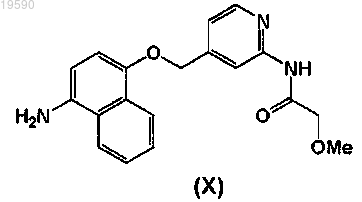
или его защищенное производное или соль.
Текст
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, к композиции, содержащей их, применению указанного соединения и композициям для лечения, в частности для лечения астмы и COPD, и способам получения указанного соединения. Область, к которой относится изобретение Изобретение относится к соединениям, которые представляют собой ингибиторы активированных митогеном р 38 ферментов протеинкиназ (именуемых в настоящем описании ингибиторами р 38 MAP киназы), в частности к их подтипам альфа- и гамма-киназы, и к их применению при лечении, в частности при лечении воспалительных заболеваний, включая воспалительные заболевания легких. Предпосылки изобретения Были идентифицированы 4 изоформы р 38 MAPK (соответственно альфа, бета, гамма и дельта). Изоформы альфа и бета р 38 MAPK повсеместно экспрессированы по всему организму и обнаруживаются во многих различных типах клеток. Изоформы альфа и бета р 38 MAPK ингибируются определенными известными низкомолекулярными ингибиторами р 38 MAPK. Более ранние поколения этих соединений были высокотоксичными вследствие типов повсеместной экспрессии данных изоформ и побочных эффектов соединений. Более поздние ингибиторы усовершенствованы для проявления высокой селективности в отношении альфа- и бета-изоформ р 38 MAPK и имеют более широкие пределы безопасности. Меньше известно о гамма- и дельта-изоформах р 38 MAPK. Данные изоформы экспрессированы в определенных тканях/клетках (в отличие от изоформ р 38 альфа и р 38 бета). Изоформа р 38 MAPK-дельта больше экспрессирована в поджелудочной железе, семенниках, легких, тонкой кишке и почках. Изобилие его также обнаруживается в макрофагах (Smith, S.J. (2006) Br. J. Pharmacol. 149: 393-404), и он выявляется в нейтрофилах, CD4+ Т-клетках и эндотелиальных клетках (www.genecard.org, Karin, K. (1999) J.Immunol.). Очень мало известно об экспрессии р 38 MAPK-гамма, но она больше экспрессирована в мозге, скелетных мышцах и сердце, а также в лимфоцитах и макрофагах (www.genecard.org). В настоящее время нет селективных низкомолекулярных ингибиторов р 38 MAPK-гамма и -дельта,но один существующий ингибитор оказывает ингибирующее действие на все изоформы. BIRB 796 ингибирует все изоформы, но ингибирует р 38 гамма и р 38 дельта в более высоких концентрациях, чем ингибирует р 38 альфа и р 38 бета (Kuma, Y. (2005) J. Biol. Chem. 280: 19472-19479). BIRB 796 также нарушал фосфорилирование р 38 MAPK или JNK (с Jun N-концевых протеинкиназ) находящейся выше по ходу транскрипции киназой MKK6 или MKK4. Авторы обсуждали возможность того, что конформационное изменение, вызванное связыванием ингибитора с MAPK, может воздействовать на структуру и сайта его фосфорилирования, и сайта докинга для находящегося выше по ходу транскрипции активатора, поэтому нарушая фосфорилирование MAPK или JNK. Считают, что р 38 MAP киназа играет основную роль во многих путях передачи сигналов, которые участвуют в инициации и поддержании хронического, персистирующего воспаления при заболеваниях человека, например тяжелой астме и COPD. В настоящее время имеется обширная литература, которая демонстрирует, что р 38 MAP киназа активируется диапазоном провоспалительных цитокинов и что ее активация приводит к выработке и высвобождению других провоспалительных цитокинов. Действительно, данные некоторых клинических исследований демонстрируют благоприятные изменения активности заболевания у пациентов во время лечения ингибиторами р 38 MAP киназы. Например, Smith, S.J. (2006)Br. J. Pharmacol. 149: 393-404 описывает ингибирующий эффект ингибиторов р 38 MAP киназы на высвобождение цитокина из человеческих макрофагов. Предлагается применение ингибиторов р 38 MAP киназы при лечении хронического обструктивного легочного заболевания (COPD). Оказалось, что низкомолекулярные ингибиторы, нацеленные на р 38 MAPK /, эффективны в уменьшении различных параметров воспаления в клетках и тканях, полученных у пациентов с COPD, которые в целом нечувствительны к кортикостероидам (Smith, S.J. (2006) Br. J. Pharmacol., 149: 393-404), и на моделях у животных in vivo(Underwood, D.C. et al. (2000) 279: 895-902; Nath, P. et al. (2006) Eur. J. Pharmacol., 544: 160-167). Irusen с сотрудниками также высказали предположение о возможности участия р 38 MAPK / в нечувствительности к кортикостероидам посредством снижения сродства связывания рецепторов глюкокортикоидов(GR) в ядрах (Irusen, E. et al., (2002) J. Allergy Clin. Immunol., 109: 649-657). Опыт клинического применения диапазона ингибиторов р 38 MAP киназы, включая AMG548, BIRB 796, VX702, SCIO469 иCOPD представляет собой состояние, при котором, как сообщалось, лежащее в его основе воспаление, по существу, устойчиво к противовоспалительным эффектам ингаляционных кортикостероидов. Следовательно, эффективной стратегией лечения COPD вполне может быть разработка вмешательства,которое и оказывает присущий ему противовоспалительный эффект, и способно повысить чувствительность легочных тканей у пациентов с COPD к ингаляционным кортикостероидам. Недавняя публикацияMercado et al. (2007; American Thoracic Society Abstract A56) демонстрирует, что сайленсинг р 38 гамма способен восстановить чувствительность к кортикостероидам. Однако основным препятствием, мешающим определению и использованию потенциальных возможностей применения ингибиторов р 38 MAP киназы при лечении хронических воспалительных заболеваний человека, была токсичность, наблюдавшаяся у пациентов. Она была достаточно тяжелой для того, чтобы отменить клиническую проводившуюся разработку многих соединений. Разработанные к настоящему времени соединения были предназначены для перорального введения. Эта стратегия включает оптимизацию соединений, которые достигают длительности своего действия соответствующим фармакокинетическим профилем. Это обеспечивает то, что имеется достаточная полученная концентрация лекарственного средства и ее поддержание после и между введением доз для обеспечения клинического эффекта. Неизбежным последствием такого подхода является то, что имеется вероятность воздействия терапевтически активных концентраций лекарственного средства на все ткани организма, в частности печень и кишечник, независимо от того, что подвергаемое лечению заболевание оказывает на них неблагоприятное воздействие. Альтернативной стратегией является разработка подходов к лечению, при которых лекарственное средство вводится непосредственно в воспаленный орган (местное лечение). Хотя данный подход непригоден для лечения всех хронических воспалительных заболеваний, он активно использовался для лечения легочных заболеваниях (астма, COPD), кожных заболеваний (атопический дерматит и псориаз), заболеваний носовой полости (аллергический ринит) и желудочно-кишечных заболеваний (язвенный колит). При местном лечении эффективность может быть достигнута или (i) обеспечением того, чтобы лекарственное средство имело продолжительное действие и удерживалось в релевантном органе для минимизации рисков системной токсичности, или (ii) получением препаративной формы, которая создает"резервуар" активного лекарственного средства, которое доступно для поддержания желательных эффектов лекарственного средства. Подход (i) иллюстрируется антихолинергическим лекарственным средством тиотропий (Spiriva), который вводится местно в легкие в качестве средства для лечения COPD и который имеет исключительно высокое сродство с его рецептором-мишенью, приводя к очень медленной диссоциации и, как следствие, к продолжительному действию. Остается потребность в идентификации и разработке новых соединений, которые являются ингибиторами р 38 MAP киназы, которые имеют улучшенный терапевтический потенциал, в частности которые являются более эффективными, длительно действующими и/или менее токсичными. Целью настоящего исследования является предоставление соединений, которые ингибируют р 38 MAP киназу с определенной подтиповой специфичностью и которые проявляют хороший противовоспалительный потенциал. Краткое описание сущности изобретения В соответствии с изобретением предоставляется соединение формулы (I) или его фармацевтически приемлемая соль. Краткое описание чертежей На фиг. 1 показан график зависимости числа нейтрофилов в BALF от времени перед введением соединения формулы (I) в тесте накопления нейтрофилов, вызванного LPS; на фиг. 2 показан график зависимости % ингибирования нейтрофилов от времени перед введением соединения формулы (I) в тесте накопления нейтрофилов, вызванного LPS; на фиг. 3 показаны воздействия дозы соединения формулы (I) на число активированных макрофагов в BAL мышей, подвергнутых воздействию сигаретного дыма; на фиг. 4 показаны воздействия дозы соединения формулы (I) на число нейтрофилов в BAL мышей,подвергнутых воздействию сигаретного дыма; на фиг. 5 показано воздействие дозы соединения формулы (I) на легочную функцию у сенсибилизированных яичным альбумином, зараженных парагриппом морских свинок после антигенной стимуляции яичным альбумином. Детальное описание изобретения Примеры солей соединения (I) включают кислотно-аддитивные соли сильных минеральных кислот,такие как соли HCl и HBr, и кислотно-аддитивные соли сильных органических кислот, такие как соль метансульфоновой кислоты. Способ получения соединения формулы (I) включает взаимодействие соединения формулы (X) где каждые из LG4 и LG5 независимо представляют уходящие группы. В частности, и LG4, и LG5 представляют имидазолил. Реакция может проводиться в полном апротонном растворителе. Соединение формулы (X) может быть получено восстановлением соединения формулы (XII) например гидрированием в присутствии катализатора, такого как платина на углеродной подложке. Соединение формулы (XII) может быть получено взаимодействием соединения формулы (XIII) где LG6 представляет уходящую группу (например, хлор) и соединения формулы (VII), определенного выше. Реакция может проводиться в присутствии основания (например, диизопропилэтиламина). Реакция может проводиться в полярном растворителе, например смеси DCM и DMF. Соединения формул (III), (IV) и (XI) или выпускаются промышленностью, или известны и могут быть получены обычными способами; см., например, Regan, J. et al. J. Med. Chem., 2003, 46, 4676-4686,WO 00/043384, WO 2007/087448 и WO 2007/089512. При желании или необходимости промежуточные соединения могут быть защищены использованием обычных защитных групп. Защитные группы и средства для их удаления описаны в руководствеSons Inc.; 4th Rev Ed., 2006, ISBN-10: 0471697540. Новые промежуточные соединения заявлены в качестве одного аспекта изобретения. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), в комбинации с одним или более фармацевтически приемлемыми разбавителями или носителями. Разбавители и носители могут включать те, которые подходят для парентерального, перорального,местного, через слизистые оболочки и ректального введения. Как указано выше, такие композиции могут быть получены, например, для парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного или околосуставного введения, в частности, в форме жидких растворов или суспензий; для перорального введения, в частности, в форме таблеток или капсул; для местного, например внутрилегочного или интраназального введения, в частности, в форме порошков, носовых капель или аэрозолей, и трансдермального введения; для введения через слизистые оболочки, например в щечную, подъязычную или влагалищную слизистую оболочку, и для ректального введения, например, в форме суппозитории. Композиции могут для удобства вводиться в стандартной лекарственной форме любыми способами, хорошо известными в фармацевтической области, например, как описано в Remington's Pharmaceutical Sciences,17th ed., Mack Publishing Company, Easton, PA. (1985). Препаративные формы для парентерального введения могут содержать в качестве эксципиентов стерильную воду или солевой раствор, алкиленгликоли, такие как пропиленгликоль, полиалкиленгликоли, такие как полиэтиленгликоль, масла растительного происхождения,гидрированные нафталины и т.п. Препаративные формы для интраназального введения могут быть твердыми и могут содержать эксципиенты, например лактозу или декстран, или могут представлять собой водные или масляные растворы для применения в форме носовых капель или дозированного спрея. Для буккального введения обычные эксципиенты включают сахара, стеарат кальция, стеарат магния, предварительно желатинизированный крахмал и т.п. Перорально вводимые композиции могут содержать один или более физиологически совместимых носителей и/или эксципиентов и могут быть представлены в твердой или жидкой форме. Таблетки и капсулы могут быть получены со связывающими агентами, например сиропом, аравийской камедью, желатином, сорбитом, трагакантом или поливинилпирролидоном; наполнителями, такими как лактоза, сахароза, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающими веществами, такими как стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; и ПАВ, такими как лаурилсульфат натрия. Жидкие композиции могут содержать обычные добавки, такие как суспендирующие агенты, например сироп сорбита, метилцеллюлозу, сахарный сироп, желатин, карбоксиметилцеллюлозу, или пищевые жиры; эмульгирующие агенты, такие как лецитин или аравийская камедь; растительные масла, такие как миндальное масло, кокосовое масло, масло печени трески или арахисовое масло; консерванты, такие как бутилированный гидроксианизол (ВНА) и бутилированный гидрокситолуол (ВНТ). Жидкие композиции могут быть инкапсулированы, например, в желатин с получением стандартной лекарственной формы. Твердые лекарственные формы включают таблетки, капсулы, состоящие из двух раковин, и мягкие эластичные желатиновые (SEG) капсулы. Состав сухой раковины капсулы обычно включает желатин в концентрации примерно 40-60%, пластификатор (такой как глицерин, сорбит или пропиленгликоль) в концентрации примерно 20-30% и воду в концентрации примерно 30-40%. Могут также присутствовать другие материалы, такие как консерванты, красящие агенты, вещества, придающие непрозрачность, и ароматизаторы. Жидкий заполняющий материал содержит твердое лекарственное средство, которое было растворено, солюбилизировано или диспергировано (суспендирующими агентами, такими как пчелиный воск, гидрированное касторовое масло или полиэтиленгликоль 4000), или жидкое лекарственное средство в носителях или комбинациях носителей, таких как минеральное масло, растительные масла, триглицериды, гликоли, полиолы и поверхностно-активные вещества. Соединение формулы (I) может вводиться местно в легкие. Следовательно, в соответствии с изобретением предоставляется фармацевтическая композиция, содержащая соединение формулы (I), возможно, в комбинации с одним или более местно доступными разбавителями или носителями. Местное введение в легкие может достигаться использованием аэрозольной препаративной формы. Аэрозольные препаративные формы обычно содержат активный ингредиент, суспендированный или растворенный в подходящем аэрозольном газе-вытеснителе, таком как хлорфторуглерод (CFC) или гидрофторуглеродHFC газы-вытеснители включают тетрафторэтан (HFC-134a) и гептафторэтан (HFC-227). Газвытеснитель обычно составляет от 40 до 99,5 мас.%, например от 40 до 90 мас.%, всей ингаляционной композиции. Препаративная форма может содержать эксципиенты, включая совместные растворители(например, этанол) и ПАВ (например, лецитин, сорбитан триолеат и т.п.). Аэрозольные препаративные формы упакованы в контейнеры, и подходящая доза доставляется посредством мерного клапана (например, такие как выпускаемые компанией Bespak, Valois или 3 М). Местное введение в легкие может также достигаться использованием не сжатой препаративной формы, такой как водный раствор или суспензия. Она может вводиться посредством распылителя. Местное введение в легкие может быть также достигнуто использованием препаративной формы в виде сухого порошка. Препаративная форма в виде сухого порошка содержит соединение формулы (I) в мелко измельченном виде со среднемассовым диаметром (MMAD) 1-10 мкм. Препаративная форма обычно содержит местно приемлемый разбавитель, такой как лактоза, обычно с большим размером частиц, например со среднемассовым диаметром (MMAD) 100 мкм или более. Примеры устройств для доставки сухого порошка включают SPINHALER, DISKHALER, TURBOHALER, DISKUS и CLICKHALER. Соединения формулы (I) предназначены для оказания терапевтического эффекта. В еще одном аспекте настоящее изобретение относится к композиции формулы (I) для применения в качестве лекарственного препарата. Ожидается, что соединения формулы (I) могут применяться при лечении респираторных расстройств, включая COPD (включая хронический бронхит и эмфизему), астму, педиатрическую астму,муковисцидоз, саркоидоз, идиопатический пневмосклероз, аллергический ринит, ринит, синусит, в особенности астму, хронический бронхит и COPD. Ожидается также, что соединения формулы (I) могут применяться при лечении определенных состояний, которые можно лечить местным или локальным лечением, включая аллергический конъюнктивит, конъюнктивит, аллергический дерматит, контактный дерматит, псориаз, язвенный колит, воспалительные поражения суставов, вызванные ревматоидным артритом или остеоартритом. Ожидается также, что соединения формулы (I) могут применяться при лечении определенных других состояний, включая ревматоидный артрит, панкреатит, кахексию, ингибирование роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карци-4 019590 ному желудка, колоректальные карциномы и злокачественную меланому. Таким образом, в еще одном аспекте настоящее изобретение относится к соединению формулы (I) для применения при лечении указанных выше состояний, например, введением терапевтически эффективного количества указанного соединения нуждающемуся в нем пациенту. В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) с получением лекарственного препарата для лечения указанных выше состояний. В еще одном аспекте настоящее изобретение относится к способу лечения указанных выше состояний, который включает введение субъекту эффективного количества соединения формулы (I) или содержащей его фармацевтической композиции. Изобретение также распространяется на применение фармацевтических композиций/препаративных форм при лечении одного или более из указанных состояний. Слово "лечение" предназначено для охвата профилактики, а также терапевтического лечения. Соединение формулы (I) может также вводиться в комбинации с одним или более другими активными ингредиентами, например активными ингредиентами, подходящими для лечения указанных выше состояний. Например, возможные комбинации для лечения респираторных расстройств включают комбинации со стероидами (например, будезонидом, бекламетазоном дипропионатом, флутиказоном пропионатом, мометазоном фуроатом, флутиказоном фуроатом), бета-агонистами (например, тербуталином,сальбутамолом, сальметеролом, форметеролом) и/или ксантинами (например, теофиллином). Примеры Пример 1. К раствору 4-нитронафтола (5,17 г, 27,3 ммоль), трифенилфосфина (10,75 г, 41,0 ммоль) и 2 аминопиридин-4-метанола (2) (5,09 г, 41,0 ммоль) в THF (50 мл) при -15 С по каплям добавляли диизопропилазодикарбоксилат (DIAD) (8,07 мл, 41,0 ммоль). Смесь перемешивали в течение ночи при комнатной температуре и затем удаляли летучие вещества в вакууме. Неочищенный продукт тритурировали из EtOAc (150 мл), отфильтровывали и промывали EtOAc (100 мл). Второе тритурирование из МеОН(100 мл) дало 2-амино-4-[(4-нитронафталин-1-илокси)метил]пиридин (3) (4,54 г, 56%) в виде желтого твердого вещества: m/z 296 (М+Н)+ (ES+). 2-Амино-4-[(4-аминонафталин-1-илокси)метил]пиридин (4) Раствор 2-амино-4-[(4-нитронафталин-1-илокси)метил]пиридина (3) (4,50 г, 15,24 ммоль) в метаноле (200 мл) и ледяной уксусной кислоте (200 мл) пропускали через проточный реактор Thales "H-cube" (2 мл/мин, 40 С, 55 мм 10% Pt/C Cat-Cart, полный H2) и летучие вещества затем удаляли в вакууме. Неочищенный продукт подвергали захвату в SCX и высвобождающему элюированию 1% аммиаком в растворе MeOH и растворитель удаляли в вакууме с получением 2-амино-4-[(4-аминонафталин-1 илокси)метил]пиридина (4) (3,82 г, 94%) розовато-лилового твердого вещества: m/z 266 (М+Н)+ (ES+). 1-4-[(2-Аминопиридин-4-ил)метокси]нафталин-1-ил-3-(3-трет-бутил-1-п-толил-1 Н-пиразол-5 ил)мочевина (5) К раствору 1,1'-карбонилдиимидазола (CDI) (4,18 г, 25,80 ммоль) в DCM (15 мл) по каплям добавляли в атмосфере азота раствор 3-трет-бутил-1-п-толил-1 Н-пиразол-5-амина (6) (5,91 г, 25,80 ммоль) вDCM (15 мл) в течение 40 мин. Полученный раствор перемешивали при комнатной температуре в течение 1 ч и затем добавляли по каплям в атмосфере азота к раствору 2-амино-4-[(4-аминонафталин-1 илокси)метил]пиридин (4) (3,80 г, 12,89 ммоль). Смесь перемешивали в течение ночи и летучие вещества удаляли в вакууме. Неочищенный матери-5 019590DCM и DMF (10:1, 11 мл) добавляли метоксиацетилхлорид (92 мкл, 1,01 ммоль). Через 1 ч при комнатной температуре последовательно добавляли дополнительные аликвоты DIPEA (184 мкл, 1,06 ммоль) и метоксиацетилхлорида (92 мкл, 1,01 ммоль) и перемешивание продолжали в течение 1 ч. Добавляли раствор 1% аммиака в МеОН (40 мл) и смесь перемешивали в течение 15 мин и затем концентрировали в вакууме. Неочищенный продукт очищали колоночной флэш-хроматографией (Biotage 40 г); элюировали 0-6% МеОН в(М+Н)+ (ES+). 1H ЯМР (400 МГц, ДМСО-d6) : 1,27 (9 Н, с), 2,39 (3 Н, с), 3,32 (3 Н, с), 4,08 (2 Н, с), 5,39 (2 Н,с), 6,36 (1 Н, с), 7,03 (1 Н, д), 7,28 (1 Н, дд), 7,36 (2 Н, м), 7,44 (2 Н, м), 7,56-7,64 (3 Н, м), 7,93 (1 Н, м), 8,308,35 (3 Н, м), 8,58 (1 Н, с), 8,79 (1 Н, с) и 10,02 (1 Н, с). Биологическое тестирование Тестирование in vitro. 1 Анализ на основе р 38 MAPK альфа клеток путем выявления фосфорилирования MAPKAP-K2 (активированной МАР-киназой протеинкиназы 2). Отсутствие значимого токсического эффекта, наблюдаемого анализом МТТ. Указанные анализы описаны ниже. Анализ ингибирования ферментов. Активность ингибирования ферментов соединением определяли передачей энергии флуоресцентного резонанса (FRET) с использованием синтетических пептидов, меченых и донорских, и акцепторных флуорофоров (Z-LYTE, Invitrogen). Вкратце, рекомбинантную, фосфорилированную р 38 MAPK гамма(MAPK12: Millipore) разбавляли в буфере HEPES, смешивали с соединением в желательных конечных концентрациях и инкубировали в течение 2 ч при комнатной температуре. Затем к смеси фермента/соединения добавляли пептид FRET (2 мкМ) и АТФ (10 мкМ) и инкубировали в течение 1 ч. Реагент проявления (протеазу) добавляли в течение 1 ч перед выявлением в ридере флуоресценции микропланшет. Сайт-специфическая протеаза расщепляет только не фосфорилированный пептид и устраняет сигнал FRET. Уровни фосфорилирования каждой реакции рассчитывали с использованием соотношения между эмиссией кумарина (донора) и эмиссией флуоресцеина (акцептора) при высоких соотношениях,указывающих на высокое фосфорилирование, а низких соотношениях - на низкие уровни фосфорилирования. Процентную долю ингибирования каждой реакции рассчитывали относительно не ингибированного контроля и затем рассчитывали ингибирующую на 50% концентрацию (величина IC50) по кривой зависимости реакции от концентрации. Для р 38 MAPK альфа (MAPK14: Invitrogen) ферментную активность оценивали косвенно путем определения активации/фосфорилирования молекулы, находящейся ниже по ходу транскрипции,MAPKAP-K2. Белок р 38 MAPKсмешивали с его неактивной мишенью MAPKAP-K2 (Invitrogen) и соединением в течение 2 ч при комнатной температуре. Пептид FRET (2 мкМ), который представляет собой мишень фосфорилирования для MAPKAP-K2, и затем АТФ (10 мкМ) добавляли к смеси ферментов/соединения и инкубировали в течение 1 ч. Затем добавляли реагент проявления и смесь инкубировали в течение 1 ч перед тем, как выявление с помощью флуоресценции завершало протокол анализа. Вызванное LPS высвобождение TNF-альфа: активность. Клетки U937, линия моноцитарных клеток человека, дифференцировали в клетки типа макрофагов инкубацией с форбол-миристат-ацетатом (РМА; 100 нг/мл) в течение 48-72 ч. При целесообразности клетки предварительно инкубировали с соединением в конечной концентрации в течение 2 ч. Затем клетки стимулировали 0,1 мкг/мл LPS (из E.coli: О 111:В 4, Sigma) в течение 4 ч и супернатант собирали для определения концентрации TNF, сэндвич ELISA (Duo-set, RD systems). ТНР-1, линию моноцитарных клеток человека, также использовали для этого анализа. Клетки ТНР-1 стимулировали 1 мкг/мл LPS(из E. coli: 0111: В 4, Sigma) в течение 4 ч и супернатант собирали для определения концентрации TNF. Процентное ингибирование продукции TNF рассчитывали при каждой концентрации тестируемого соединения сравнением с контролем носителя и величину концентрации, ингибирующей на 50% (IC50),определяли по полученной кривой зависимости реакции от концентрации. Анализ МТТ. Дифференцированные клетки U937 предварительно инкубировали с соединением в течение 4 ч в 5% FCS или 10% FCS в течение 24 и 72 ч. Супернатант замещали 200 мл новой среды и в каждую лунку добавляли 10 мкл основного раствора МТТ (5 мг/мл). После 1 ч инкубации среды удаляли, в каждую лунку добавляли 200 мкл DMSO (ДМСО) и планшеты слегка встряхивали в течение 1 ч перед считыванием величин спектральной поглощательной способности при 550 нм. Утрату жизнеспособности клеток в процентах рассчитывали для каждой лунки относительно обработки носителем (0,5% DMSO). Следовательно, видимое увеличение жизнеспособности клеток при использовании лекарственного средства относительно носителя представлено в таблице в виде отрицательной процентной доли. Тестирование in vivo. Вызванная LPS нейтрофилия у мышей. Не голодавшим мышам интратрахеально вводили или носитель, или тестируемое вещество в точки времени ("предварительная доза"), указанные относительно начала обработки LPS. При Т=0 мышей помещали в клетку для воздействия и подвергали контакту с LPS. Через 8 ч после антигенной стимуляцииLPS животных анестезировали, канюлировали трахею и проводили экстракцию BALF вливанием и отсасыванием 1 мл PBS в легкие через трахеальный катетер. Общее количество лейкоцитов и лейкоцитарную формулу в образцах BALF измеряли с использованием гемоцитометра Neubaur. Цитоспиновые мазки образцов BALF получали центрифугированием при 200 об./мин в течение 5 мин при комнатной температуре и окрашивали с использованием системы окрашивания DiffQuik (Dade Behring). Клетки подчитывали с использованием иммерсионной микроскопии с погружением линзы в масло. Результаты показаны на фиг. 1 и 2. Данные о количествах нейтрофилов представлены в виде общих и дифференциальных количеств (тестируемое вещество относительно носителя) клеток на 1 мл BALF,средняя величинаS.E.M. (n=8). Модель воздействия сигаретного дыма. Мышей A/J (самцы, возраст 5 недель) подвергали воздействию сигаретного дыма (4% сигаретного дыма, разведенного сжатым воздухом) в течение 30 мин/день в течение 11 дней с использованием Системы эксперимента ингаляции табачного дыма для мелких животных (Модель SIS-CS; Sibata ScientificTechnology, Tokyo, Japan). Тестируемые вещества вводили интраназально (35 мкл раствора в 50%DMSO/PBS) и в лечебных целях дважды в день в течение 3 дней после последнего воздействия сигаретного дыма. Через 12 ч после последнего введения животных анестезировали, трахею канюлировали и собирали жидкость бронхо-альвеолярного лаважа (BALF). Количества альвеолярных макрофагов и нейтрофилов определяли анализом FACS (активируемым флуоресценцией сортировщиком клеток) (EPICSALTRA II, Beckman Coulter, Inc., Fullerton, CA, USA) с использованием антимышиного антитела М 0 МА 2(к макрофагам) или антимышиного антитела 7/4 (к нейтрофилам). Результаты показаны на фиг. 3 для активированных макрофагов и на фиг. 4 для нейтрофилов. Данные по количеству клеток показаны в виде средней величиныSEM. Модель воздействия сигаретного дыма, использованная в данном исследовании, представлена в виде системы, рефракторной к кортикостероидам (Medicherla S. et al. (2008); J. Pharmacol. Exp. Ther., 324(3): 921-9), и было подтверждено, что флутиказон пропионат не ингибировал накопление ни нейтрофилов, ни макрофагов в дыхательных путях в концентрации 50 мкг/мл (35 мкл, 2 раза в день), в такой же дозе, которая вызывала ингибирование 80% вызванного LPS накопления нейтрофилов. На фиг. 3: значимое различие между воздействием воздуха и воздействием сигаретного дыма; Р 0,001 в сравнении с контролем воздействия сигаретного дыма (CS) (ANNOVA (дисперсионный анализ), множественное сравнение Даннетта), n=6-11. На фиг. 4: значимое различие между воздействием воздуха и воздействием сигаретного дыма. Р 0,05 или Р 0,001 в сравнении с контролем воздействия сигаретного дыма (CS) (ANNOVA,множественное сравнение Даннетта), n=6-11. Модель антигенной стимуляции яичным альбумином/инфекции парагриппом (модель устойчивости к стероидам in vivo). Самцов морских свинок Dunkin-Hartley (300-350 г, n=6/группа) сенсибилизировали 100 мкг яичного альбумина (OVA) + 100 мг Al2(OH)3 в 1 мл физиологического раствора (внутрибрюшинно) в дни 2 и 6. Вирус парагриппа (PIV-3; 106 инфекционных единиц) или среду без вируса интраназально вводили в дни 11 и 12. Животных лечили распыленным флутиказон пропионатом в дозе 1,5 мг в день. В первоначальных исследованиях было установлено, что эта доза флутиказон пропионата ингибировала опосредованные яичным альбумином изменения легочной функции у сенсибилизированных животных, получавших лечение средой PIV3, в примере 1 (4,5 мг в день) или носитель (DMSO:этанол:солевой раствор,30:30:40%) с 10 по 15 день. Всех животных подвергали антигенной стимуляции в течение 1 ч распыленным OVA (10 мкг/мл) на 15-й день и повторяли измерения специфической проводимости дыхательных путей (sGaw) в течение 24-часового периода с использованием плетизмографии всего тела. ИзмеренияsGaw после антигенной стимуляции OVA нанесены на график в виде изменения в % от исходного уровня,см. фиг. 5. Фиг. 5 - данные представлены в виде средней величины 6 наблюденийPIV3 + лечение по примеру 1. Резюме. Биологические исследования in vitro показывают, что соединение формулы (I) является мощным ингибитором подтипов альфа и гамма р 38 MAP киназы с хорошей эффективностью на модели in vitro противовоспалительной активности (вызванное LPS высвобождение TNF альфа из дифференцированных клеток U937 и клеток ТНР-1). По результатам МТТ можно сделать вывод, что соединение не проявляет скрытой клеточной токсичности в используемых концентрациях. Биологические исследования in vivo показывают, что соединение формулы (I) эффективно при ингибировании вызванного LPS накопления нейтрофилов на экспериментальной модели, при длительности эффекта, показанного значительным ингибированием даже через 12 или более часов после предварительного введения. Кроме того, было показано, что соединение формулы (I) эффективно на моделях устойчивого к стероидам воспаления in vivo. Пока контекст не требует иного, во всем описании и в следующей формуле изобретения слово "содержать" и его варианты, такие как "содержит" и "содержащий", следует понимать как относящиеся к включению указанного целого числа, стадии, группы или целых чисел или групп стадий, но не исключению любого другого целого числа, стадии, группы или целых чисел или групп стадий. Все указанные в настоящем описании патенты и патентные заявки полностью включены в него путем ссылки. Заявка, описание и формула изобретения которой составляют ее часть, может использоваться в качестве основания для приоритета в отношении любой последующей заявки. Притязания такой последующей заявки могут быть направлены на любой признак или комбинацию признаков, описанных в настоящем изобретении. Они могут принимать форму притязаний на продукт, композицию, способ или применение и могут включать, в качестве примера и без ограничения, формулу изобретения. или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, содержащая соединение по п.1, в комбинации с одним или более фармацевтически приемлемыми разбавителями или носителями. 3. Применение соединения формулы (I) по п.1 для получения лекарственного средства для лечения или предотвращения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, астмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита,контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому. 4. Способ лечения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, ас-9 019590 тмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита, контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому, который включает введение субъекту эффективного количества соединения формулы (I) по п.1. 5. Способ лечения или предотвращения респираторного расстройства, включающий введение субъекту эффективного количества соединения формулы (I) по п.1. 6. Способ по п.5, где соединения формулы (I) вводят в комбинации с одним или более другими активными ингредиентами, выбранными из стероидов, бета-агонистов и ксантинов. 7. Способ лечения состояния, выбранного из COPD, включая хронический бронхит и эмфизему, астмы, педиатрической астмы, муковисцидоза, саркоидоза, идиопатического пневмосклероза, аллергического ринита, ринита, синусита, аллергического конъюнктивита, конъюнктивита, аллергического дерматита, контактного дерматита, псориаза, язвенного колита, воспаленного состояния суставов, вызванного ревматоидным артритом или остеоартритом, ревматоидного артрита, панкреатита, кахексии, ингибирования роста и метастазирования опухолей, включая немелкоклеточную карциному легких, карциному молочных желез, карциному желудка, колоректальные карциномы и злокачественную меланому, который включает введение субъекту эффективного количества фармацевтической композиции по п.2. 8. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает взаимодействие соединения формулы (II) где LG1 представляет уходящую группу. 9. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает взаимодействие соединения формулы (X) где каждые из LG4 и LG5 независимо представляют уходящие группы. 10. Соединение формулы (X) или его защищенное производное или соль. Воздействие на вызванное LPS накопление нейтрофилов [количество нейтрофилов в BAL] Фиг. 1 Воздействие на вызванное LPS накопление нейтрофилов [ингибирование в %]
МПК / Метки
МПК: A61P 11/00, A61K 31/415, A61P 29/00, C07D 401/12
Метки: mapk-киназы, ингибитор
Код ссылки
<a href="https://eas.patents.su/13-19590-ingibitor-p38-mapk-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор p38 mapk-киназы</a>
Предыдущий патент: Способ увеличения скорости роста или прироста массы тела животного
Следующий патент: Производные 2-пиридин-2-ил-пиразол-3(2h)-она, их получение и применение в терапии в качестве активаторов hif
Случайный патент: Способ производства бумаги












