Производные 5-(пиридин-3-ил)-1-азабицикло[3.2.1]октана, их получение и применение в терапии
Номер патента: 7793
Опубликовано: 27.02.2007
Авторы: Галли Фредерик, Неделек Ален, Леклерк Одиль, Лочид Алистер
Формула / Реферат
1. Соединение в форме чистого энантиомера или в форме смеси энантиомеров, соответствующее общей формуле (I)
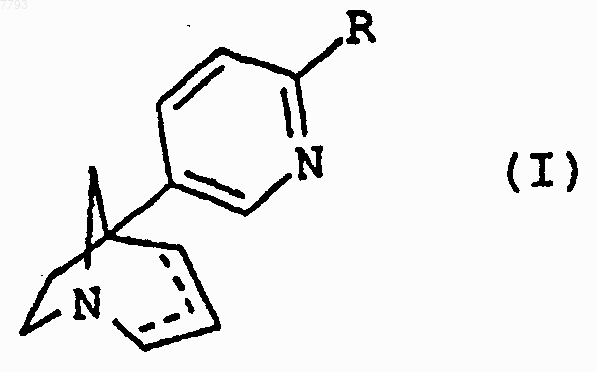
где R представляет атом галогена или фенильную группу, замещенную одной или двумя группами, выбранными из атома галогена или группы (С1-C6)алкил, (C1-C6)алкокси, нитро, трифторметил, трифторметокси, гидрокси, ацетил или метилендиокси, или группу пиперидинил, или морфолин-4-ил, или пирролидин-1-ил, или азетидин-1-ил, или азепин-1-ил, или пиридинил, или хинолинил, или тиенил, или пиразинил, или фурил, или бензофурил, или бензотиенил, или индолил, или пиримидинил, или изоксазолил, или феноксазинил, или феноксатиинил, или дибензотиенил, или дибензофурил, или пирролил или нафтил, где каждая из этих групп возможно может быть замещена одной или двумя группами, выбранными из атомов галогенов, групп (C1-C6)алкил, (C1-С6)алкокси, трифторметокси, трифторметил, нитро, гидрокси, и где из двух углерод-углеродных связей, изображенных как ----, одна является простой, а другая может быть простой или двойной,
в форме основания или соли, полученной присоединением кислоты, при условии, что соединение не представляет собой 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ан, 5-(2-хлорпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ан или 5-(2-фторпиридин-5-ил)-1-азабицикло[3.2.1] окт-3-ан.
2. Соединение по п.1, отличающееся тем, что R либо представляет собой атом галогена или фенильную группу, замещенную одной или двумя группами, выбранными из атомов галогенов и групп (С1-С6)алкил, (С1-С6)алкокси, нитро, трифторметил, ацетил или метилендиокси, либо представляет собой пиридинильную группу, или тиенильную группу, или индолильную группу, или пиримидинильную группу, возможно замещенные одной или двумя (С1-С6)алкоксигруппами.
3. Лекарственное средство, отличающееся тем, что оно состоит из соединения по п.1.
4. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1 вместе с эксципиентом.
Текст
007793 Настоящее изобретение относится к соединениям, которые являются лигандами никотиновых рецепторов и которые полезны в лечении или предупреждении нарушений, связанных с дисфункцией никотиновых рецепторов, в частности на уровне центральной нервной системы. В документах предшествующего уровня техники ранее были упомянуты соединения, проявляющие аффинность к никотиновым рецепторам. Так, WO 00/34279 относится к производным 1,4-диазабицикло[3.3.3]нонана, и WO 00/34284 касается производных 2,5-диазабицикло[2.2.1]гептана. В US 5817679 раскрыты производные 7-азабицикло[2.2.1]-гептана и -гептена. Теперь авторы изобретения продемонстрировали, что производные 1-азабицикло[3.2.1]октана обладают высокой аффинностью к никотиновым рецепторам. Соединения по настоящему изобретению соответствуют общей формуле (I) где R представляет атом галогена или (С 3-С 6)циклоалкильную группу, или фенильную группу, замещенную одной или более чем одной группой, выбранной из атома галогена или группы (C1-C6)алкил,(C1-C6)алкокси, нитро, амино, (C1-C3)диалкиламино, трифторметил, трифторметокси, циано, гидрокси,ацетил или метилендиокси, или группу пиперидинил или морфолин-4-ил, или пирролидин-1-ил, или азетидин-1-ил, или азепин-1-ил, или пиридинил, или хинолинил, или тиенил, или пиразинил, или фурил,или бензофурил, или бензотиенил, или индолил, или пиримидинил, или изоксазолил, или феноксазинил,или феноксатиинил, или дибензотиенил, или дибензофурил, или пирролил, или нафтил, где каждая из этих групп может быть возможно замещена одной или более чем одной группой, выбранной из атомов галогенов, группы (C1-C6)алкил, (C1-C6)алкокси, трифторметокси, трифторметил, нитро, циано, гидрокси,амино, (C1-C3)диалкиламино или (С 3-С 8)циклоалкиламино, при условии, что соединение не представляет собой 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ан, 5-(2-хлорпиридин-5-ил)-1-азабицикло[3.2.1] окт-3-ан или 5-(2-фторпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ан. Из числа двух углерод-углеродных связей, изображенных как , одна является простой, а другая может быть простой или двойной. Кроме того, атом углерода в положении 5 является асимметрическим и, следовательно, соединения могут существовать в форме двух энантиомеров или их смесей. Соединения по изобретению могут существовать в форме оснований или солей, полученных присоединением кислот. Подгруппой предпочтительных соединений является подгруппа соединений общей формулы (I), гдеR либо представляет собой атом галогена или фенильную группу, замещенную одной или более чем одной группой, выбранной из атомов галогена и групп (C1-C6)алкил, (C1-C6)алкокси, нитро, амино, трифторметил, циано, гидрокси, ацетил или метилендиокси, либо представляет собой пиридинильную группу или тиенильную группу, или индолильную группу, или пиримидинильную группу, возможно замещенную одной или более чем одной (C1-C6)алкоксигруппой. Соединения общей формулы (I) можно получить способом, изображенным на следующей схеме. 3 Оксо-1,4-азабицикло[2.2.2]октан формулы (II) подвергают взаимодействию с производным пиридина общей формулы (III), где R такой, как определено выше, a W представляет собой атом галогена. Также можно осуществить реакцию конденсации между 3-оксо-1-азабицикло[2.2.2]октаном и литированным производным соединений общей формулы (III), полученным обменом галоген-металл с алкиллитиевым производным. В результате этого получают соединения общей формулы (IV), при обработке которых нагреванием в кислой среде получают соединения общей формулы (I), где одна из двух углерод-углеродных связей,изображенных как , является двойной. Каталитическое гидрирование этой двойной связи дает соединения общей формулы (I), где все связи азабициклооктанового кольца являются насыщенными. 3-Оксо-1-азабицикло[2.2.2]октан имеется в продаже. Соединения общей формулы (III) имеются в продаже или их можно получить способами, описанными в литературе. Для некоторых соединений заместители R отсутствуют в исходном соединении общей формулы(III); в зависимости от их природы эти заместители можно ввести в конечное соединение общей формулы (I). Так, например, соединения общей формулы (I), где R представляет собой арильную группу, можно получить, начиная с соответствующих соединений, в формуле которых R представляет собой атом галогена, используя любой из известных способов, таких как сочетание Сузуки в присутствии бороновой кислоты и палладиевого катализатора, например тетракис(трифенилфосфин)палладия, или сочетание Стилле с соответствующими реагентами. Следующие примеры иллюстрируют получение некоторых соединений по изобретению. Элементные микроанализы и ИК (инфракрасные) и ЯМР (ядерный магнитный резонанс) спектры подтверждают структуры полученных соединений. Числа, указанные в скобках в заголовках примеров, соответствуют числам в первой колонке таблицы, приведенной ниже. В названиях соединений дефис "-" является частью слова, тогда как символ подчеркивания является просто разрывом в конце строки, и его следует удалять при отсутствии разрыва и не следует заменять стандартным дефисом или пробелом. Пример 1 (соединение 1). Гидробромид 5-(2-фенилпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена(2:1). 1.1. 5-Бром-2-фенилпиридин. 30 г (0,127 моль) 2,5-дибромпиридина в виде суспензии в 100 мл толуола, 15,4 г (0,127 моль) фенилбороновой кислоты, 4,4 г (0,0038 моль) тетракис(трифенилфосфин)палладия, 90 мл 2 М водного раствора карбоната натрия и 4 мл этанола вводят последовательно в трехгорлую колбу емкостью 500 мл и смесь нагревают при 90 С в течение 22 ч. Смесь декантируют, органическую фазу промывают 100 мл воды и сушат и концентрируют при пониженном давлении, а остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 30/70 циклогексана и дихлорметана. В результате получают 22,4 г кристаллов. Точка плавления: 69-72 С. 1.2. 3-Гидрокси-3-(2-фенилпиридин-5-ил)-1-азабицикло[2.2.2]октан. 2,5 г (0,0107 моль) 5-бром-2-фенилпиридина в виде раствора в 40 мл этилового эфира вводят в трехгорлую колбу емкостью 100 мл и реакционную смесь охлаждают до -60 С, затем добавляют по каплям в течение 10 мин 5,6 мл (0,0139 моль) 2,5 М раствора н-бутиллития в гексане, температуру поддерживают при -70 С в течение 1 ч. В течение 10 мин добавляют 1,34 г (0,0107 моль) 1-азабицикло[2.2.2]октан-3-она в виде раствора в 20 мл тетрагидрофурана и смесь перемешивают в течение 30 мин при -70 С, а затем при температуре окружающей среды в течение 4 ч. Реакционную смесь гидролизуют путем добавления 100 мл метанола и концентрируют при пониженном давлении. Остаток переносят в 100 мл насыщенного водного раствора хлорида аммония и водную фазу экстрагируют хлороформом. Органические фазы сушат и концентрируют при пониженном давлении, а остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 90/10/1 хлороформа, метанола и аммиака. В результате получают 0,8 г кристаллов. Точка плавления: 214 С.-2 007793 1.3. Гидробромид 5-(2-фенилпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена (2:1). 0,8 г (2,85 ммоль) 3-гидрокси-3-(2-фенилпиридин-5-ил)-1-азабицикло[2.2.2]октана и затем 10 мл метансульфоновой кислоты вводят в трехгорлую колбу емкостью 25 мл и смесь нагревают до 180 С в течение 24 ч. Смесь выливают на лед и подщелачивают добавлением концентрированного водного раствора гидроксида натрия, водную фазу экстрагируют хлороформом, и органическую фазу сушат и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 98/2/0,2 хлороформа, метанола и аммиака. В результате получают 0,25 г продукта, дигидробромид которого получают, добавляя 5,7 М раствор бромистоводородной кислоты в уксусной кислоте. В результате получают 0,22 г дигидробромида. Точка плавления: 273-274 С. Пример 2 (соединение 2). Гидробромид 5-(2-фенилпиридин-5-ил)-1-азабицикло[3.2.1]октана(2:1). 0,14 г (0,33 ммоль) дигидробромида 5-(2-фенилпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена в виде раствора в 20 мл метанола вводят в сосуд Парра емкостью 250 мл и добавляют 0,14 г палладия 10%, адсорбированного на углероде. На реакционную смесь затем воздействуют давлением водорода 0,35 МПа при перемешивании в течение 5 ч. Катализатор отделяют фильтрованием через диатомовую землю, и растворитель концентрируют при пониженном давлении. В результате получают 0,058 г продукта. Точка плавления: 272-277 С. Пример 3 (соединение 8). Этандиоат 5-[2-(3-метилфенил)пиридин-5-ил)-1-азабицикло[3.2.1 ]октана (1:1). 3.1. 3-Гидрокси-3-(2-бромпиридин-5-ил)-1-азабицикло[2.2.2]октан. 27,6 г (0,116 моль) 2,5-дибромпиридина в 1000 мл этилового эфира вводят в трехгорлую колбу емкостью 2000 мл, реакционную смесь охлаждают до -67 С и в течение 10 мин добавляют по каплям 56 мл(0,140 моль) 2,5 М раствора бутиллития в гексане. Смесь перемешивают при -67 С в течение 45 мин, затем добавляют 14,5 г (0,116 моль) 1-азабицикло[2.2.2]октан-3-она в виде раствора в 150 мл этилового эфира за 45 мин и смесь перемешивают при -67 С в течение 3 ч. Добавляют 300 мл насыщенного водного раствора аммония хлорида, затем 200 мл концентрированного водного раствора натрия гидроксида, водную фазу экстрагируют хлороформом, а органические фазы сушат и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 95/5/0,5, затем смесью 80/15/1,5 хлороформа, метанола и аммиака. В результате получают 19,7 г продукта в форме аморфного твердого вещества. 3.2. 5-(2-Бромпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ен. 9,4 г (0,033 моль) 3-гидрокси-3-(2-бромпиридин-5-ил)-1-азабицикло[2.2.2]октана и 35 мл концентрированной серной кислоты вводят в трехгорлую колбу емкостью 100 мл, и смесь нагревают при 190 С в течение 1 ч 45 мин. Смесь охлаждают и выливают на 400 мл ледяного водного раствора гидроксида натрия, водную фазу экстрагируют хлороформом, органические фазы сушат и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 90/10/1 хлороформа, метанола и аммиака. В результате получают 3,9 г продукта в форме бледно-желтого твердого вещества. Точка плавления: 73-75 С. 3.3. Этандиоат 5-[2-(3-метилфенил)пиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена (1:1). 0,2 г (0,75 ммоль) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена, 3 мл толуола, 0,7 мл 2 М водного раствора карбоната натрия, 0,147 г (1,05 ммоль) 3-метилбензолбороновой кислоты, 0,042 г (0,04 ммоль) тетракис(трифенилфосфин)палладия и 0,7 мл этанола вводят последовательно в пробирку емкостью 10 мл, и смесь нагревают при 100 С в течение 15 ч. Водную фазу удаляют декантацией, а неочищенный продукт экстрагируют на колонке со смолойDowex, промывая последовательно метанолом, а затем хлороформом, элюируя затем раствором аммиака. Остаток очищают хроматографией на колонке с силикагелем, элюируя смесью 90/10/1 хлороформа,метанола и аммиака. В результате получают 0,167 г продукта в виде масла, которое растворяют в 2 мл изопропилового спирта с образованием этандиоата при добавлении 0,051 г (0,057 ммоль) этандиовой кислоты в виде раствора в изопропиловом спирте. В результате получают 0,188 г кристаллического продукта. Точка плавления : 173-174 С. Пример 4 (соединение 26). Гидробромид 5-[2-(3-фторфенил)пиридин-5-ил)-1 -азабицикло[3.2.1 ]октана 2:1. 0,18 г (0,51 ммоль) этандиоата 5-[2-(3-фторфенил)пиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ена в виде раствора в 20 мл метанола вводят в сосуд Парра емкостью 200 мл и добавляют 0,36 г палладия, 10%,-3 007793 адсорбированного на углероде, и на реакционную смесь воздействуют давлением водорода 0,42 МПа при перемешивании при 45 С в течение 6 ч. Катализатор отделяют фильтрованием на диатомовой земле,фильтрат концентрируют при пониженном давлении, остаток переносят в 10 мл 1 н. водного раствора гидроксида натрия, и водную фазу экстрагируют хлороформом, неочищенный продукт очищают хроматографией на колонке с силикагелем, элюируя смесью 80/20/2 хлороформа, метанола и аммиака. В результате получают 0,085 г продукта, дигидробромид которого получают добавлением 0,107 мл 33%-ного раствора бромистоводородной кислоты в уксусной кислоте. В результате получают 0,097 г кристаллов. Точка плавления: 98-100 С. В таблице, которая следует ниже, показаны химические структуры и физические свойства некоторых соединений по изобретению. В колонке "R" символ "(+)" обозначает правовращающий энантиомер, а символ "(-)" -левовращающий энантиомер; соединения без примечаний в этой колонке являются рацематами. В "=" колонке указанное число соответствует положению двойной связи в случае 1 азабициклооктена, символ "-" обозначает насыщенный гетероцикл. В колонке "соль" символ "-" указывает на то, что соединение находится в форме основания, "НВr" обозначает гидробромид, и "окс." обозначает оксалат. Указаны соответствующие молярные соотношения " кислота:основание. В колонке "Т.пл.(С)", "(р)" указывает точку плавления с разложением. Таблица Соединения по изобретению исследовали на их сродство по отношению к никотиновым рецепторам, содержащим 42 субъединицу, используя методы, описанные Anderson и Arneric в Eur. J. Pharmacol. (1994), 253. 261 и Hall et al. в Brain Res. (1993), 600, 127. Самцов крыс Sprague Dawley массой от 150 до 200 г обезглавливают, и быстро целиком извлекают мозг, гомогенизируют в 15 объемах 0,32 М раствора сахарозы при 4 С и затем центрифугируют при 1000 g в течение 10 мин. Осадок удаляют, а супернатант центрифугируют при 20000 g в течение 20 мин при 4 С. Осадок отделяют и гомогенизируют при помощи Polytron мельницы в 15 объемах дважды дистиллированной воды при 4 С, затем центрифугируют при 8000 g в течение 20 мин. Осадок удаляют, а супернатант и верхнюю пленку (лейкоцитную пленку) центрифугируют при 40000 g в течение 20 мин, осадок отделяют и суспендируют в 15 мл дважды дистиллированной воды и снова центрифугируют при 40000 g, затем хранят при -80 С. В день эксперимента ткань медленно размораживают и суспендируют в 3 объемах буфера. 150 мкл этой мембранной суспензии инкубируют при 4 С в течение 120 мин в присутствии 100 мкл 1 нМ [3 Н]-цитизина в конечном объеме 500 мкл буфера, в присутствии или в отсутствие тестируемого соединения. Реакцию останавливают фильтрацией через Whatman GF/B фильтры, предварительно обработанные полиэтиленимином,фильтры дважды промывают, каждый раз 5 мл буфера при 4 С, и радиоактивность, оставшуюся на фильтре, измеряют при помощи жидкостной сцинтиграфии. Определяют неспецифическое связывание в присутствии 10 мкМ (-)-никотина; неспецифическое связывание составляет от 75 до 85% общего связывания, выявленного на фильтре. Для каждой концентрации исследуемого соединения определяют процент ингибирования специфического связывания [3 Н]-цитизина, и затем рассчитывают значение IC50,концентрацию соединения, которая ингибирует 50% специфического связывания. Значения IC50 для соединений по изобретению, обладающих самым высоким сродством, находятся в интервале от 0,01 до 10 мкМ. Соединения по изобретению также изучали на их сродство по отношению к никотиновым рецепторам, содержащим 7 субъединицу, используя методы, описанные Mark and Collins в J. Pharmacol. Exp.Ther. (1982), 22, 564 и Mark et al. в Mol. Pharmacol. (1986), 30, 427. Самцов OFA крыс массой от 150 до 200 г обезглавливают, и целый мозг быстро удаляют, гомогенизируют в 15 объемах 0,32 М раствора сахарозы при 4 С и затем центрифугируют при 1000 g в течение 10 мин. Осадок отделяют, а супернатант центрифугируют при 8000 g в течение 20 мин при 4 С. Осадок отделяют и гомогенизируют при помощи Polytron мельницы в 15 объемах дважды дистиллированной воды при 4 С, затем центрифугируют при 8000 g в течение 20 мин. Осадок удаляют, а супернатант и-6 007793 верхнюю пленку (лейкоцитную пленку) центрифугируют при 40000 g в течение 20 мин, осадок отделяют и суспендируют в 15 мл дважды дистиллированной воды и снова центрифугируют при 40000 g, затем хранят при -80 С. В день эксперимента ткань медленно размораживают и суспендируют в 5 объемах буфера. 150 мкл этой мембранной суспензии предварительно инкубируют при 37 С в течение 30 мин в темноте в присутствии или в отсутствие тестируемого соединения. Мембраны затем инкубируют в течение 60 мин при 37 С в темноте в присутствии 50 мкл 1 нМ [3 Н]-бунгаротоксина в конечном объеме 250 мкл 20 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) буфера, 0,05% полиэтиленимина. Реакцию останавливают фильтрованием через Whatman GF/C фильтры, предварительно обработанные в течение 3 ч 0,05%-ным полиэтиленимином. Фильтры дважды промывают, каждый раз 5 мл буфера при 4 С, и радиоактивность, оставшуюся на каждом фильтре, измеряют жидкостной сцинтиграфией. Определяют неспецифическое связывание в присутствии 1 мкМ -бунгаротоксина; неспецифическое связывание представляет собой приблизительно 60% общего связывания, выявленного на фильтре. Для каждой концентрации исследуемого соединения определяют процент ингибирования специфического связывания [3 Н] -бунгаротоксина и затем рассчитывают значение IC50, концентрации соединения,которая ингибирует 50% специфического связывания. Значения IC50 для соединений по изобретению, обладающих самым высоким сродством, находятся в интервале от 0,005 до 20 мкМ. Приведенные выше результаты свидетельствуют о том, что соединения по изобретению являются лигандами никотиновых рецепторов. Некоторые из них селективны в отношении рецепторов, содержащих 7 субъединицы, другие имеют смешанный характер в отношении рецепторов 42 и 7 типов. Результаты тестов свидетельствуют о возможности применения данных соединений для лечения или предупреждения нарушений, связанных с дисфункцией никотиновых рецепторов, в частности на уровне центральной нервной системы. Эти нарушения включают в себя неблагоприятные когнитивные изменения, более конкретно неблагоприятные изменения памяти, а также неблагоприятные изменения внимания, связанные с болезнью Альцгеймера, с патологическим старением (ассоциированное со старением ухудшение памяти, ageassociated memory impairment, AAMI), с синдромом Паркинсона, с трисомией 21 (синдром Дауна), с алкогольным синдромом Корсакова или с сосудистыми деменциями (мультиинфарктная деменция, multiinfarct dementia, MDI). Соединения по изобретению также могут быть полезны в лечении моторных нарушений, наблюдаемых при болезни Паркинсона или других неврологических заболеваниях, таких как хорея Хантингтона, болезнь Туретта, поздняя дискинезия и гиперкинезия. Соединения по изобретению могут также являться составной частью терапевтического или симптоматического лечения острых нейродегенеративных патологий, таких как инсульты и случаи церебральной гипоксии, и хронических нейродегенеративных патологий, таких как болезнь Альцгеймера и болезнь Паркинсона. Их можно применять в случаях психиатрической патологии: шизофрении, депрессии, тревоги, панических состояний или компульсивного или обсессивного поведения. Они могут предупреждать симптомы синдрома отмены табака или алкоголя или различных вызывающих привыкание веществ, таких как кокаин, ЛСД (лизергиновой кислоты диэтиламид), марихуана,бензодиазепины. В настоящем изобретении соответственно также предложены фармацевтические композиции, содержащие эффективную дозу по меньшей мере одного соединения по изобретению в форме основания или соли, или фармацевтически приемлемого сольвата, или в виде смеси с подходящими эксципиентами,если целесообразно. Выбор указанных эксципиентов зависит от желательного пути введения и конкретной фармацевтической формы. Фармацевтические композиции по изобретению могут быть предназначены для перорального,подъязычного, подкожного, внутримышечного, внутривенного, местного, внутритрахеального, интраназального, чрескожного, ректального или внутриглазного введения. Примерами возможных единичных форм введения являются таблетки, желатиновые капсулы, гранулы, порошки, растворы или суспензии для перорального приема или инъекционного введения, чрескожных пластырей или суппозиториев. Для местного введения можно предусмотреть мази, лосьоны и примочки. Указанные единичные формы дозируют таким образом, чтобы обеспечить суточное введение от 0,01 до 20 мг действующего начала на кг массы тела в зависимости от фармацевтической лекарственной формы. Для приготовления таблеток к действующему началу добавляют следующие вещества в микронизированной или немикронизированной форме: фармацевтический носитель, который может состоять из разбавителей, таких как лактоза, крахмал или микрокристаллическая целлюлоза, или вспомогательные средства для приготовления лекарственной формы, такие как связывающие вещества (поливинилпирролидон, гидроксипропилметилцеллолоза и тому подобное), скользящие агенты, такие как диоксид крем-7 007793 ния, смазывающие вещества, такие как магния стеарат, стеариновая кислота, глицерола трибегенат, натрия стеарилфумарат. Также можно добавлять увлажняющие или поверхностно-активные агенты, такие как натрия лаурилсульфат. Возможными способами получения является прямое таблетирование, сухое гранулирование, влажное гранулирование или горячий расплав. Таблетки могут быть непокрытыми, покрытыми сахаром, например сахарозой, или покрытыми различными полимерами или другими подходящими веществами. Они могут быть предназначены для обеспечения возможности немедленного, отсроченного или замедленного высвобождения действующего начала при помощи полимерных матриц или определенных полимеров, используемых в оболочке. Для приготовления желатиновых капсул действующее начало смешивают с сухими фармацевтическими носителями (простое смешивание, сухое или влажное гранулирование, или горячее плавление) или жидкими или полутвердыми фармацевтическими носителями. Желатиновые капсулы могут быть твердыми или мягкими и могут иметь тонкое пленочное покрытие для того, чтобы обладать немедленной, замедленной или отсроченной активностью (например для энтеросолюбильной формы). Композиция в форме сиропа или эликсира или для введения в форме капель может содержать действующее начало вместе с подсластителем, предпочтительно бескалорийным подсластителем, метилпарабеном или пропилпарабеном в качестве антисептика, корригентом и красителем. Водно-диспергируемые гранулы и порошки могут содержать действующее начало в смеси с диспергирующими или увлажняющими агентами, или диспергирующими агентами, такими как поливинилпирролидон, а также с подсластителями и корригентам. Для ректального введения применяют суппозитории, приготовленные со связывающими веществами, которые тают при ректальной температуре, например маслом какао или полиэтиленгликолями. Для парентерального введения применяют водные суспензии, изотонические солевые растворы или инъецируемые стерильные растворы, содержащие фармакологически совместимые диспергирующие агенты и/или увлажняющие агенты, например пропиленгликоль или бутиленгликоль. Действующее начало также может быть приготовлено в форме микрокапсул, возможно с одним или более чем одним носителем или добавками, или же с полимерной матрицей или с циклодекстрином (чрескожные пластыри или формы с замедленным высвобождением). Местные композиции по изобретению содержат среду, совместимую с кожей. Их можно предусмотреть, в частности, в форме водных, спиртовых или водных/спиртовых растворов, гелей, эмульсий вода-в-масле или масло-в-воде, имеющих вид крема или геля, микроэмульсий или аэрозолей, или в форме пузырьковых дисперсий, содержащих ионные и/или неионные липиды. Эти фармацевтические лекарственные формы получают способами, традиционными в соответствующих областях. Наконец, фармацевтические композиции по изобретению могут содержать, в дополнение к соединению общей формулы (I), другие действующие начала, которые можно применять в лечении нарушений и заболеваний, указанных выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение в форме чистого энантиомера или в форме смеси энантиомеров, соответствующее общей формуле (I) где R представляет атом галогена или фенильную группу, замещенную одной или двумя группами, выбранными из атома галогена или группы (С 1-C6)алкил, (C1-C6)алкокси, нитро, трифторметил, трифторметокси, гидрокси, ацетил или метилендиокси, или группу пиперидинил, или морфолин-4-ил, или пирролидин-1-ил, или азетидин-1-ил, или азепин-1-ил, или пиридинил, или хинолинил, или тиенил, или пиразинил, или фурил, или бензофурил, или бензотиенил, или индолил, или пиримидинил, или изоксазолил,или феноксазинил, или феноксатиинил, или дибензотиенил, или дибензофурил, или пирролил или нафтил, где каждая из этих групп возможно может быть замещена одной или двумя группами, выбранными из атомов галогенов, групп (C1-C6)алкил, (C1-С 6)алкокси, трифторметокси, трифторметил, нитро, гидрокси, и где из двух углерод-углеродных связей, изображенных как , одна является простой, а другая может быть простой или двойной,в форме основания или соли, полученной присоединением кислоты, при условии, что соединение не представляет собой 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]окт-3-ан, 5-(2-хлорпиридин-5-ил)-1 азабицикло[3.2.1]окт-3-ан или 5-(2-фторпиридин-5-ил)-1-азабицикло[3.2.1] окт-3-ан.-8 007793 2. Соединение по п.1, отличающееся тем, что R либо представляет собой атом галогена или фенильную группу, замещенную одной или двумя группами, выбранными из атомов галогенов и групп (С 1 С 6)алкил, (С 1-С 6)алкокси, нитро, трифторметил, ацетил или метилендиокси, либо представляет собой пиридинильную группу, или тиенильную группу, или индолильную группу, или пиримидинильную группу, возможно замещенные одной или двумя (С 1-С 6)алкоксигруппами. 3. Лекарственное средство, отличающееся тем, что оно состоит из соединения по п.1. 4. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по п.1 вместе с эксципиентом.
МПК / Метки
МПК: C07D 221/00, C07D 471/08, A61P 25/00, A61K 31/439, C07D 209/00
Метки: применение, терапии, 5-(пиридин-3-ил)-1-азабицикло[3.2.1]октана, получение, производные
Код ссылки
<a href="https://eas.patents.su/10-7793-proizvodnye-5-piridin-3-il-1-azabiciklo321oktana-ih-poluchenie-i-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-(пиридин-3-ил)-1-азабицикло[3.2.1]октана, их получение и применение в терапии</a>
Предыдущий патент: Новое медицинское применение соединений, способствующих межклеточным связям
Следующий патент: Производные 4-(диарилметил)-1-пиперазинила
Случайный патент: Cпособ получения замещенных фенолов и способ получения витамина е с их использованием












