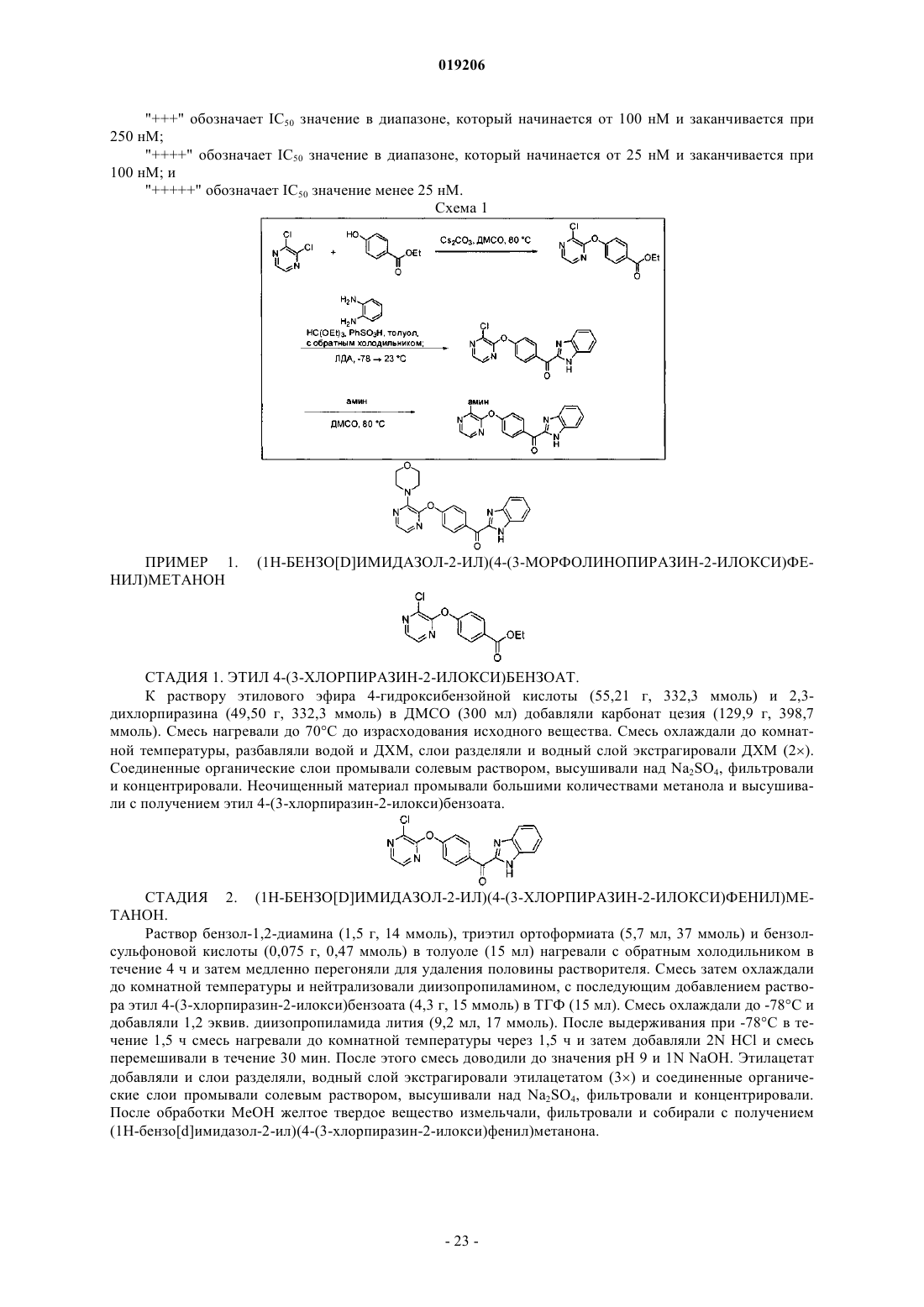
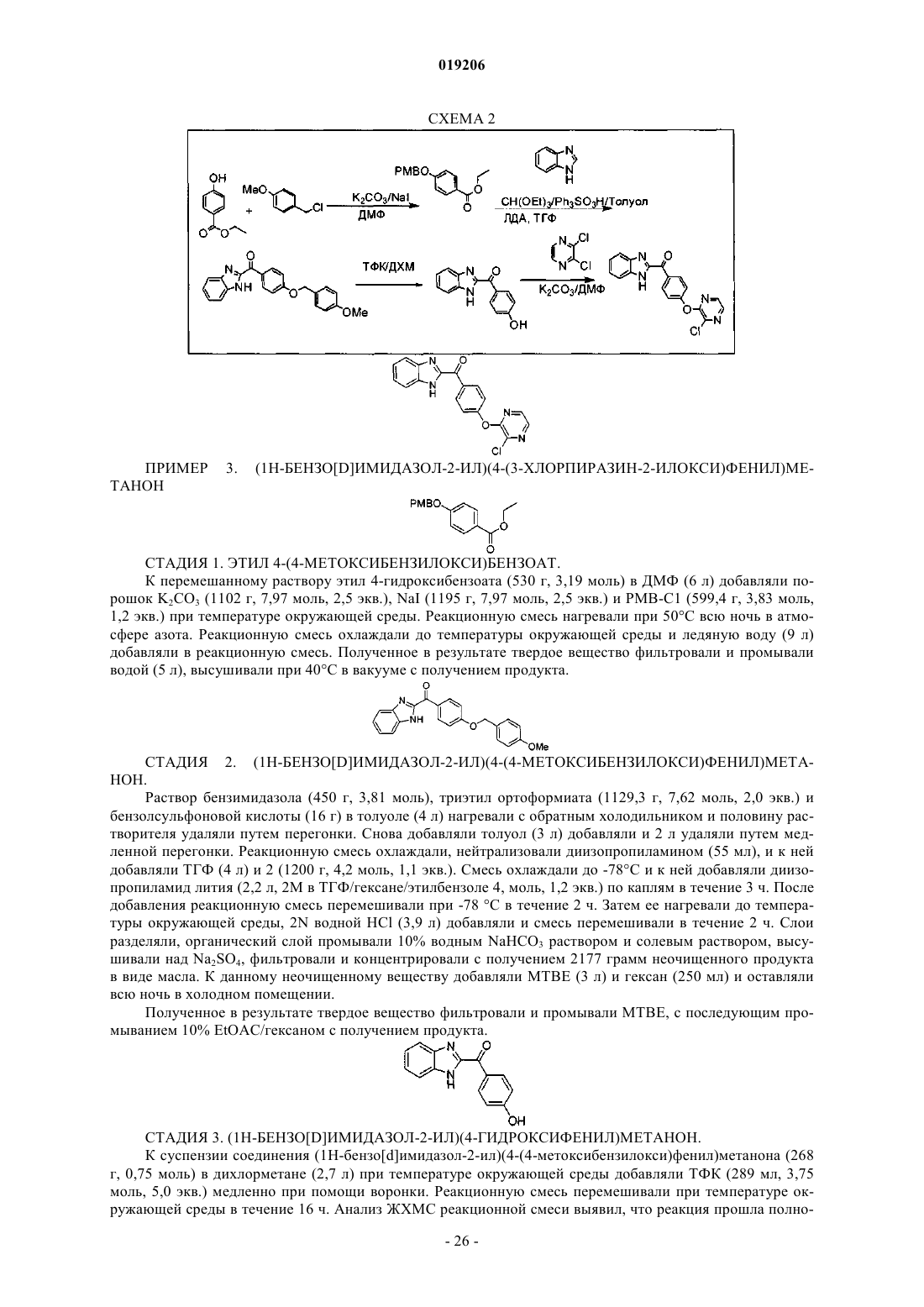
Пиразиновые соединения в качестве ингибиторов фосфодиэстеразы 10
Номер патента: 19206
Опубликовано: 30.01.2014
Авторы: Кунц Роксан, Румфельт Шэннон, Ху Эсса, Борбо Мэтью П., Чен Нинг, Аллен Дженнифер Р.
Формула / Реферат
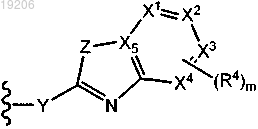
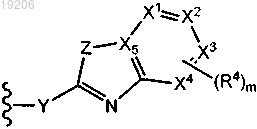
1. Соединение формулы (I)
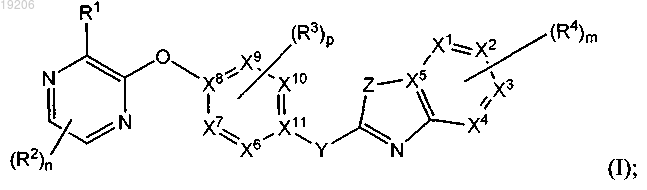
или его любая фармацевтически приемлемая соль,
где каждый из X1, X2, X3 и X4 независимо представляет собой N или С;
где не более чем два из X1, X2, X3 и X4 являются N;
X5 представляет собой С;
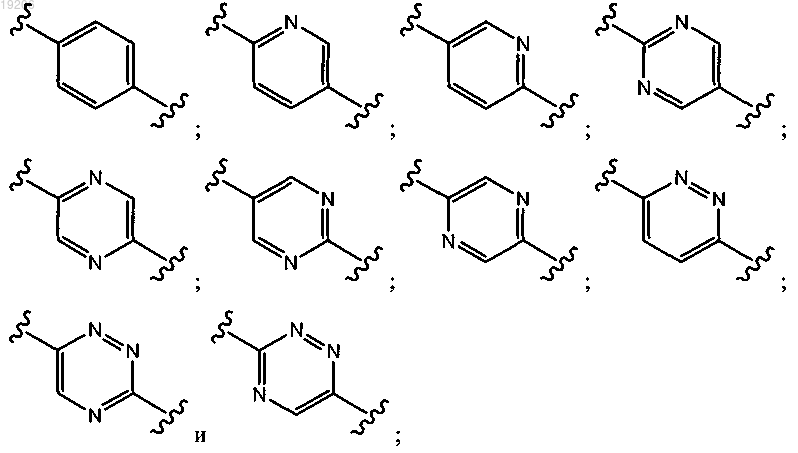
выбирают из группы, состоящей из
Y представляет собой NH, NR5, CH(OH), C(=O), -CRaRb или CF2;
Z представляет собой NH, NR6 или S;
m представляет собой 0, 1, 2, 3 или 4;
n представляет собой 0, 1 или 2;
р представляет собой 0, 1 или 2;
R1 выбирают из группы, состоящей из
(а) насыщенного, частично насыщенного или ненасыщенного 3-, 4-, 5-, 6- или 7-членного моноцикла или насыщенного, частично насыщенного или ненасыщенного 8-, 9-, 10-, 11- или 12-членного бицикла, где каждый из указанных циклов содержит 0, 1, 2, 3 или 4 N атомов и 0, 1 или 2 атомов, выбранных из О и S, и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb,
-OC(=O)NRaRa, -OC2-6алк-NRaRa, -ОС2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -NRaRc,
-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa, R7, R8 и оксо;
(б) группы -L-R7, где L представляет собой CH2, NH, N(C1-4алк), О, S, S=O или S(=O)2; или
R2 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, ОС1-4алк, С1-4алк или C1-4галоалк;
R3 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, ОС1-4алк, С1-4алк, С1-4галоалк или
-NRaC1-4алк;
R4 независимо представляет собой в каждом случае F, Cl, СН3, CN, CF3, CHF2, CH2F, ORa или NRaRa;
R5 представляет собой С1-8алк;
R6 представляет собой С1-8алк или С1-4галоалк;
R7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -OC1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa,
-OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb,
-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa, R8 и оксо;
R8 представляет собой C1-6алк, замещенный 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, С1-6алк, С1-4галоалк, -ORa, -OC1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb,
-OC(=O)NRaRa, -OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa,
-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -С1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa и оксо;
Ra независимо представляет собой, в каждом случае, Н или Rb;
Rb независимо представляет собой, в каждом случае, фенил, бензил или С1-6алк, где указанный фенил, бензил и C1-6алк замещены 0, 1, 2 или 3 заместителями, выбранными из гало, С1-4алк, С1-3галоалк, -ОН,
-ОС1-4алк, -NH2, -NHC1-4алк, -ОС(=О)С1-4алк или -N(C1-4алк)С1-4алк;
Rc представляет собой С0-4алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, где указанный С0-4алк и указанный циклический фрагмент могут быть замещены 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, R7, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6алк-NRaRa, -ОС2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa,
-N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6ORa, -C1-6алк-NRaRa,
-C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa и оксо.
2. Соединение по п.1, где Y представляет собой NH или -С(=О).
3. Соединение по любому из предыдущих пунктов, где Z представляет собой NH или NR6.
4. Соединение по п.1, где R1 выбирают из группы, состоящей из насыщенного, частично насыщенного или ненасыщенного 4-, 5-, 6- или 7-членного моноцикла, где каждый из указанных циклов содержит 0, 1, 2 или 3 N атомов и 0, 1 или 2 О атома и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -OC1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -NRaRa,
-NRaRc, R7, R8 и оксо.
5. Соединение по п.1, где R1 выбирают из группы, состоящей из насыщенного, частично насыщенного или ненасыщенного 8-, 9-, 10-, 11- или 12-членного бицикла, где каждый из указанных циклов содержит 0, 1, 2 или 3 N атомов и 0, 1 или 2 О атомов и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ОRa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -NRaRa,
-NRaRc, R7, R8 и оксо.
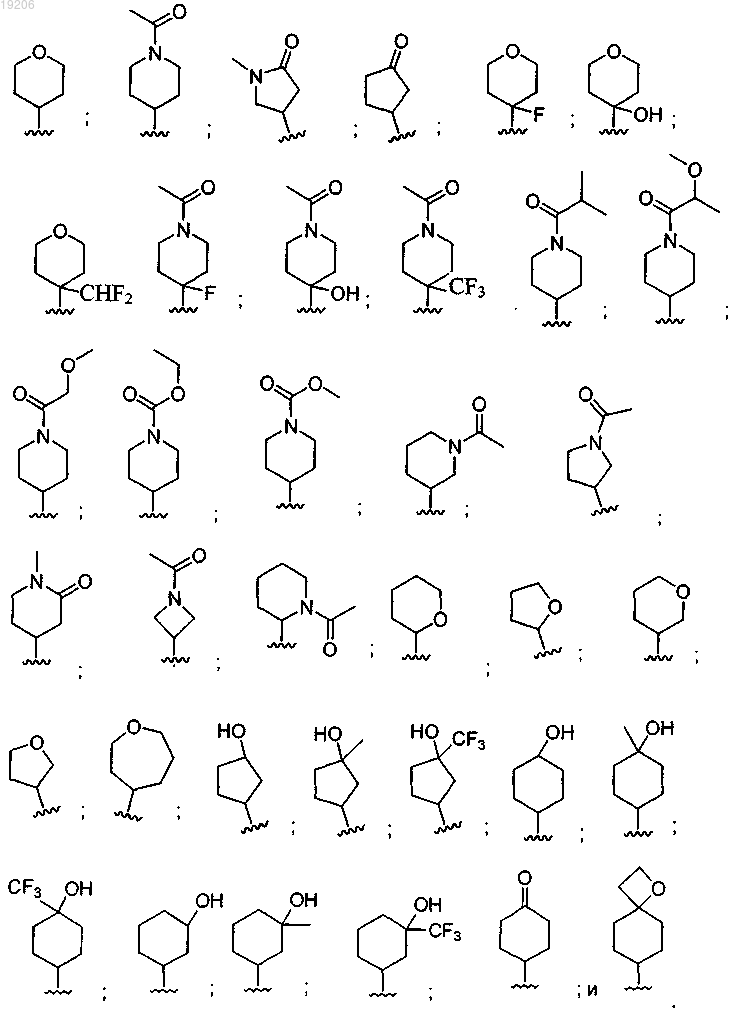
6. Соединение по п.1, где R1 выбирают из группы, состоящей из циклогексила, циклопентила, циклопентенила, циклогексенила, циклогептила, азетидинила, фенила, 2-пиридила, 3-пиридила, пиразолила, морфолинила, пиримидила, пиперазинила, пиперидинила, дигидропиранила, тетрагидропиранила, тетрагидрофуранила, тетрагидропиридинила, тетрагидротиопиранила, оксаспиро[3.5]нонила, азепанила, оксепанила, хинолинила, все из которых замещены 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, CN, -C(=O)Rb, -C(=O)ORa, -SRa, R7 и оксо.
7. Соединение по п.1, где R1 выбирают из группы, состоящей из
8. Соединение по любому из предыдущих пунктов, где R3 представляет собой F.
9. Соединение по любому из предыдущих пунктов, где R4 представляет собой F.
10. Соединение по любому из предыдущих пунктов, где R5 представляет собой метил.
11. Соединение по любому из предыдущих пунктов, где R6 представляет собой метил.
12. Соединение по любому из предыдущих пунктов, где R7 представляет собой насыщенный 3-, 4-, 5- или 6-членный моноцикл, содержащий 0 или 1 N атом и 0 или 1 О атом, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa,
-C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6алк-NRaRa, -ОС2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb,
-S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa,
-N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -С1-6алк-ORa,
-C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa, R8 и оксо.
13. Соединение по любому из предыдущих пунктов, где R8 представляет собой С1-6алк, замещенный 0 или 1 -ORa.
14. Соединение по любому из предыдущих пунктов, где Ra представляет собой Н или С1-6алк, замещенный 0 или 1 -ОН, -ОС1-4алк, -ОС(=О)С1-4алк или -N(C1-4алк)C1-4алк.
15. Соединение по любому из предыдущих пунктов, где Rc представляет собой С0-4алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 5- или 6-членный моноцикл, содержащий 0 или 1 N атом и 0 или 1 атом, выбранный из О и S, который замещен 0 или 1 группами, выбранными из F, С1-6алк, С1-4галоалк, -ORa, R7 или R8.
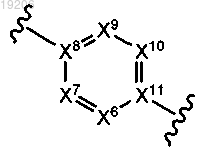
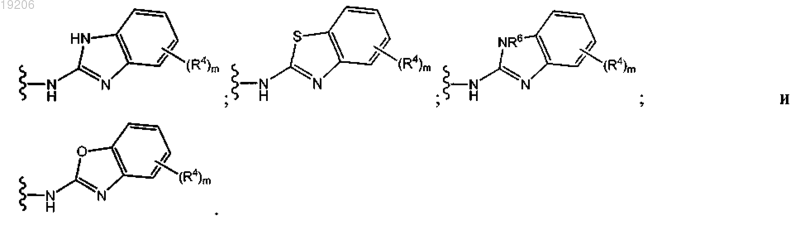
16. Соединение по любому из предыдущих пунктов, где группу формулы
выбирают из группы, состоящей из
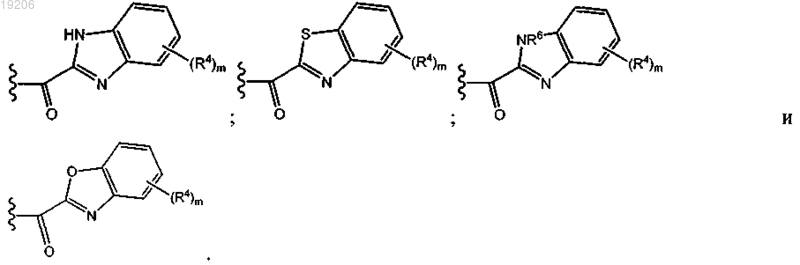
17. Соединение по любому из предыдущих пунктов, где группу формулы
выбирают из группы, состоящей из
18. Соединение по п.1, имеющее формулу (II)
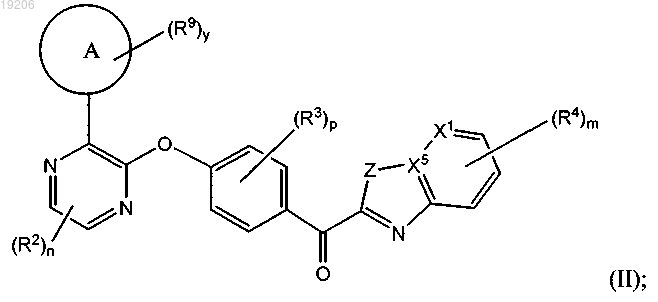
или его любая фармацевтически приемлемая соль,
где Z представляет собой NH, NR6 или S;
m представляет собой 0, 1, 2, 3 или 4;
n представляет собой 0, 1 или 2;
р представляет собой 0, 1 или 2;
у представляет собой 0, 1, 2, 3 или 4;
X1 представляет собой N или С;
X5 представляет собой С;
цикл А представляет собой связанный через углерод насыщенный, связанный через углерод частично насыщенный или связанный через углерод ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членный карбоцикл, содержащий 0, 1 или 2 N атомов и содержащий 0 или 1 S или О атомов; или связанный через азот насыщенный, связанный через азот частично насыщенный или связанный через азот, ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членный гетероцикл, содержащий мостиковый азот и 0, 1 или 2 дополнительных N атомов и содержащий 0 или 1 S или О атомов;
R2 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, ОС1-4алк, С1-4алк или С1-4галоалк;
R3 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, OC1-4алк, С1-4алк, С1-4галоалк или
-NRaC1-4алк;
R4 независимо представляет собой, в каждом случае, F, Cl, СН3, CN, CF3, CHF2, CH2F, ORa или NRaRa;
R6 представляет собой С1-8алк, С1-4галоалк;
R7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2, 3 или 4 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, С1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa,
-OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb,
-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa, R8 и оксо;
R8 представляет собой C1-6алк, замещенный 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, С1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb,
-OC(=O)NRaRa, -OC2-6aлк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa,
-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa и оксо;
R9 независимо выбирают из группы, состоящей из Н, F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6алк-NRaRa, -ОС2-6алк-ORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -NRaRc, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb,
-N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa,
-NRaC2-6алк-ORа, -C1-6алк-NRaRa, -С1-6алкORа, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -С1-6алк-С(=О)ORa, R7, R8 и оксо;
Ra независимо представляет собой, в каждом случае, Н или Rb;
Rb независимо представляет собой, в каждом случае, фенил, бензил или С1-6алк, где фенил, бензил и C1-6алк замещены 0, 1, 2 или 3 заместителями, выбранными из гало, С1-4алк, C1-3галоалк, -ОН, -ОС1-4алк, -NH2,
-NHC1-4алк, -OC(=O)С1-4алк или -N(С1-4алк)С1-4алк;
Rc представляет собой С0-4алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br,
C1-6алк, C1-4галоалк, R7, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,
-OC(=O)Rb, -OC(=O)NRaRa, -ОС2-6алк-NRаRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,
-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -С1-6алк-С(=О)ORa и оксо.
19. Соединение по п.1, имеющее формулу (III)
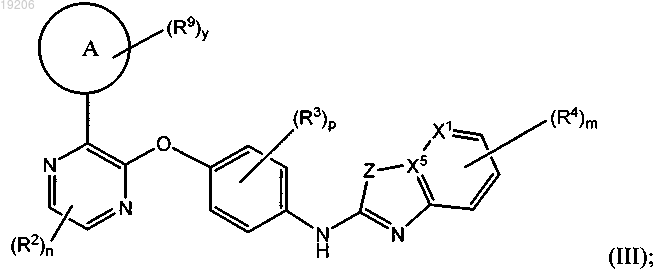
или его любая фармацевтически приемлемая соль,
где Z представляет собой NH, NR6 или S;
m представляет собой 0, 1, 2, 3 или 4;
n представляет собой 0, 1 или 2;
р представляет собой 0, 1 или 2;
y представляет собой 0, 1, 2, 3 или 4;
X1 представляет собой N или С;
X5 представляет собой С;
цикл А представляет собой связанный через углерод насыщенный, связанный через углерод частично насыщенный или связанный через углерод ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членный карбоцикл, содержащий 0, 1 или 2 N атомов и содержащий 0 или 1 S или О атомов; или связанный через азот, насыщенный, связанный через азот частично насыщенный или связанный через азот ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членный гетероцикл, содержащий мостиковый азот и 0, 1 или 2 дополнительных N атомов и содержащий 0 или 1 S или О атомов;
R2 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, ОС1-4алк, С1-4алк или C1-4галоалк;
R3 представляет собой, независимо в каждом случае, F, Cl, Br, CN, ОН, ОС1-4алк, С1-4алк или С1-4галоалк;
R4 независимо представляет собой, в каждом случае, F, Cl, CH3, CN, CF3, CHF2, CH2F, ORa или NRaRa;
R6 представляет собой С1-8алк, С1-4галоалк;
R7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2, 3 или 4 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa,
-OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb,
-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -С1-6алк-C(=O)NRaRa, -С1-6алк-C(=O)ORa, R8 и оксо;
R8 представляет собой С1-6алк, замещенный 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6алк,
С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb,
-OC(=O)NRaRa, -OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa,
-N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алкC(=O)NRaRa, -C1-6алкC(=O)ORa и оксо;
R9 независимо выбирают из группы, состоящей из Н, F, Cl, Br, С1-6алк, С1-4галоалк, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6алкNRaRa,
-OC2-6алкORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -NRaRc, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb,
-N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa,
-NRaC2-6алк-ORа, -C1-6алк-NRaRa, -С1-6алк-ORа, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -C1-6алк-C(=O)ORa, R7, R8 и оксо;
Ra независимо представляет собой, в каждом случае, Н или Rb;
Rb независимо представляет собой, в каждом случае, фенил, бензил или C1-6алк, где фенил, бензил и С1-6алк замещен 0, 1, 2 или 3 заместителями, выбранными из гало, С1-4алк, C1-3галоалк, -ОН, -ОС1-4алк, -NH2,
-NHC1-4алк, -ОС(=О)С1-4алк или -N(С1-4алк)С1-4алк;
Rc представляет собой С0-4алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br,
C1-6алк, С1-4галоалк, R7, -ORa, -ОС1-4галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,
-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6алк-NRaRa, -OC2-6алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,
-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,
-N(Ra)S(=O)2NRaRa, -NRaC2-6алк-NRaRa, -NRaC2-6алк-ORa, -C1-6алк-NRaRa, -C1-6алк-ORa, -C1-6алк-N(Ra)C(=O)Rb, -C1-6алк-OC(=O)Rb, -C1-6алк-C(=O)NRaRa, -С1-6алк-С(=О)ОRа и оксо.
20. Соединение по п.1, выбранное из группы, состоящей из
(1Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона;
(S)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(1,1,1-трифтор-2-гидроксипропан-2-ил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1-метил-1Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона;
(1-изопропил-1Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона;
4-(3-(4-((1Н-бензо[d]имидазол-2-ил)дифторметил)фенокси)пиразин-2-ил)морфолин(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(2-гидроксипропан-2-ил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-гидроксипиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксипиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-метоксипиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(R)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(метоксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2,6-диметилморфолино)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-метилпиперазин-1-ил)пиразин-2-илокси)фенил)метанона;
1-(4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперазин-1-ил)этанона;
1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-4-карбонитрила;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-иламино)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-3-иламино)пиразин-2-илокси)фенил)метанона;
(4-(3-(1,4-оксазепан-4-ил)пиразин-2-илокси)фенил)(1Н-бензо[d]имидазол-2-ил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(метоксиметил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-4-она;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(трифторметил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(2-гидроксиэтил)пиперазин-1-ил)пиразин-2-илокси)фенил)метанона;
этил 2-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперазин-1-ил)ацетата;
(1H-бензо[d]имидазол-2-ил)(4-(3-(6,7-дигидро-1Н-имидазо[4,5-с]пиридин-5(4Н)-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-метоксипиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
8-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-2-метил-2,8-диазаспиро[4.5]декан-1-она;
(1H-бензо[d]имидазол-2-ил)(4-(3-(4-морфолинопиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(±)-(1H-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксипирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-1-метилпиперазин-2-она;
(S)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(гидроксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(S)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-(гидроксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-метил-5,6-дигидро-[1,2,4]триазоло[4,3-а]пиразин-7(8Н)-ил)пиразин-2-илокси)фенил)метанона;
(R)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-(гидроксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(S)-(1H-бензо[d]имидазол-2-ил)(4-(3-(2-(метоксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(2-гидроксиэтил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(±)-1-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-3-карбонитрила;
(±)-1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбонитрила;
этил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-4-карбоксилата;
(±)-метил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбоксилата;
(±)-этил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-3-карбоксилата;
(±)-(1H-бензо[d]имидазол-2-ил)(4-(3-(3-(3-метил-1,2,4-оксадиазол-5-ил)пирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(S)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксипирролидин-1-ил)пиразин-2-илокси)фенил)метанона;
(±)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(1-гидроксиэтил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-4-карбоновой кислоты;
(±)-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-(2-гидроксиэтил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-(гидроксиметил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(±)-(1H-бензо[d]имидазол-2-ил)(4-(3-(3-(2-гидроксипропан-2-ил)пиперидин-1-ил)пиразин-2-илокси)фенил)метанона;
(±)-4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-6-метилпиперазин-2-она;
(1Н-имидазо[4,5-b]пиридин-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксиазетидин-1-ил)пиразин-2-илокси)фенил)метанона;
(S)-N-(4-(3-(2-(метоксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(тетрагидро-2Н-пиран-3-иламино)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(S)-2-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-2-ил)пропан-2-ола;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-4-метилпиперидин-4-ола;
бензо[d]тиазол-2-ил(4-(3-морфолинопиразин-2-илокси)фенил)метанона;
N-(4-(3-морфолинопиразин-2-илокси)фенил)-1Н-бензо[d]имидазол-2-амина;
5-фтор-N-(4-(3-морфолинопиразин-2-илокси)фенил)-1Н-бензо[d]имидазол-2-амина;
N-(4-(3-морфолинопиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
2-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ил)пропан-2-ола;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ола;
N-(4-(3-(пирролидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-3-ола;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-карбонитрила;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперазин-1-ил)этанона;
N-(4-(3-(4-метилпиперазин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
2-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ил)-1,1,1-трифторпропан-2-ола;
N-(4-(3-(2,6-диметилморфолино)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-((3-(1,1-диоксидо-4-тиоморфолинил)-2-пиразинил)окси)фенил)-1,3-бензотиазол-2-амина;
(S)-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-2-ил)метанола;
N-(4-(3-(азетидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)азетидин-3-карбоновой кислоты;
2-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперазин-1-ил)этанола;
N-(4-(3-(6,7-дигидро-1Н-имидазо[4,5-с]пиридин-5(4Н)-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-карбоксамида;
N-(4-(3-(2-метил-6,7-дигидро-1H-имидазо[4,5-с]пиридин-5(4Н)-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
метил 1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)азетидин-3-карбоксилата;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-3-карбонитрила;
(R)-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-3-ил)метанола;
2-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ил)этанола;
N-(4-(3-(4-(метоксиметил)пиперидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(3-(метоксиметил)пирролидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ил)метанола;
4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперазин-2-она;
4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-1-изопропилпиперазин-2-она;
N-(4-(3-(4-метоксипиперидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)азетидин-3-карбонитрила;
4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-6-метилпиперазин-2-она;
1-(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-4-ил)этанола;
метил 1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-3-карбоксилата;
(1-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-2-ил)метанола;
N-(4-(3-(3-(метоксиметил)пиперидин-1-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(1,4-диокса-8-азаспиро[4.5]декан-8-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(трифторметил)пиридин-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(4-метоксибензилокси)пиридин-3-ил)пиразин-2-илокси)фенил)метанона;
3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиридин-2(1Н)-она;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метилпиридин-4-ил)пиразин-2-илокси)фенил)метанона;
4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)бензонитрила;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метилпиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1-метил-1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метилпиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2,6-диметоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-(3-метоксипиридин-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метоксифенил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метоксихинолин-3-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(5-фтор-2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(5-фтор-1H-бензо[d]имидазол-2-ил)(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(5-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)(1-метил-1Н-бензо[d]имидазол-2-ил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метоксипиридин-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(6-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиридин-3-ил)пиразин-2-илокси)фенил)метанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-(пиридин-4-ил)пиразин-2-илокси)фенил)метанона;
3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)бензонитрила;
метил 4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)бензоата;
4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)бензойной кислоты;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-метоксифенил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(хинолин-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(хинолин-5-ил)пиразин-2-илокси)фенил)метанона;
(4-(3-(3,6-дигидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)(1Н-имидазо[4,5-b]пиридин-2-ил)метанона;
2-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-4,4-диметилциклогекс-2-енона;
1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-5,6-дигидропиридин-1(2Н)-ил)этанона;
(1-(2-фторэтил)-1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанона;
N-(4-(3-(2-метилпиридин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
3-(3-(4-(бензо[d]тиазол-2-иламино)-3-фторфенокси)пиразин-2-ил)циклогекс-2-енона;
(рац)-3-(3-(4-(бензо[d]тиазол-2-иламино)-3-фторфенокси)пиразин-2-ил)циклогекс-2-енола;
N-(4-(3-(6-морфолинопиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(4-морфолинофенил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(6-метилпиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(1H-пирроло[2,3-b]пиридин-5-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
5-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиколиннитрила;
N-(4-(3-(пиримидин-5-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(2-метоксипиримидин-5-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(6-хлорпиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(5-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиридин-2-ил)метанола;
N-(4-(3-(хинолин-5-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(пиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(3-метоксипиридин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(3-метоксифенил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
7-фтор-N-(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(2-метоксипиридин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
6-фтор-N-(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
5-фтор-N-(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(5-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(2-фтор-4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(2-фтор-4-(3-(2-фторпиридин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
трет-бутил 4-(3-(4-(бензо[d]тиазол-2-иламино)-3-фторфенокси)пиразин-2-ил)-5,6-дигидропиридин-1(2Н)-карбоксилата;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(циклопропилметокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиридин-2-илметокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-феноксипиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиридин-3-илокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(4-метилтиазол-5-ил)этокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-((тетрагидрофуран-3-ил)метокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-морфолиноэтокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(пирролидин-1-ил)этокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(1-метилпирролидин-2-ил)этокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиридин-4-илметокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-(пиридин-2-ил)этокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-(пиридин-3-ил)пропокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиридин-3-илметокси)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-имидазо[4,5-b]пиридин-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
(6-фтор-1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
(1-метил-1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
(6-фтор-1-метил-1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
(5-фтор-1-метил-1Н-бензо[d]имидазол-2-ил)(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
1Н-бензимидазол-2-ил(4-((3-(тетрагидро-2Н-пиран-3-ил)-2-пиразинил)окси)фенил)метанона;
1Н-бензимидазол-2-ил(4-((3-(4-метокси-1-циклогексен-1-ил)-2-пиразинил)окси)фенил)метанона;
1Н-бензимидазол-2-ил(4-((3-(цис-4-гидроксициклогексил)-2-пиразинил)окси)фенил)метанона;
1Н-бензимидазол-2-ил(4-((3-(транс-4-гидроксициклогексил)-2-пиразинил)окси)фенил)метанона;
(рац)-цис-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(рац)-транс-(1Н-бензо[d]имидазол-2-ил)(4-(3-(3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(рац)-цис-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
(рац)-транс-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
N-(4-(3-(тетрагидро-2Н-пиран-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(рац)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанона;
4-(2-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-3-ил)циклогексанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-((1s,4s)-4-гидрокси-4-метилциклогексил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-((1r,4r)-4-гидрокси-4-метилциклогексил)пиразин-2-илокси)фенил)метанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-(оксепан-4-ил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4,4-дифторциклогекс-1-енил)пиразин-2-илокси)фенил)метанона;
4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)тетрагидро-2Н-пиран-4-карбонитрила;
N-метил-N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)тетрагидро-2Н-пиран-4-ола;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-фтортетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
N-(4-(3-(4-фтортетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-трет-бутил 4-метил 4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1,4-дикарбоксилата;
трет-бутил 4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-4-(гидроксиметил)пиперидин-1-карбоксилата;
N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)-1Н-бензо[d]имидазол-2-амина;
N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
7-метокси-N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)-1H-бензо[d]имидазол-2-амина;
(рац)-3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)циклогексанона;
4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)тетрагидро-2Н-пиран-4-карбонитрила;
метил 4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)тетрагидро-2Н-пиран-4-карбоксилата;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(4-гидрокситетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)метанона;
6-фтор-N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(2-фтор-4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
5-фтор-N-(4-(3-(тетрагидро-2Н-пиран-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
(1Н-бензо[d]имидазол-2-ил)(4-(3-циклопентилпиразин-2-илокси)фенил)метанона;
N-(4-(3-(тетрагидрофуран-3-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1Н-бензо[d]имидазол-2-ил(4-(3-(тетрагидро-2Н-тиопиран-4-ил)пиразин-2-илокси)фенил)метанона;
N-(4-(3-циклопентилпиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(1-(2-фторэтил)пиперидин-4-ил)пиразин-2-илокси)фенил)метанона;
метил 4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-карбоксилата;
1-(4-(3-(4-((1Н-бензо[d]имидазол-2-ил)(гидрокси)метил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(2-метоксипиридин-3-ил)пиразин-2-илокси)фенил)метанола;
(1Н-бензо[d]имидазол-2-ил)(4-(3-(пиперидин-4-ил)пиразин-2-илокси)фенил)метанона;
1-(4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)пердейтероэтанона;
1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-метоксиэтанона;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-метоксиэтанона;
1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
N-(4-(3-(1-(2-фторэтил)пиперидин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
N-(4-(3-(1-метилпиперидин-4-ил)пиразин-2-илокси)фенил)бензо[d]тиазол-2-амина;
1-(4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-1-оксопропан-2-ил ацетата;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-гидроксипропан-1-она;
1-(3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-1-ил)этанона;
1-(3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пирролидин-1-ил)этанона;
1-(4-(3-(4-(1-метил-1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
2-метокси-1-(4-(3-(4-(1-метил-1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
2-(4-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-оксоэтил ацетата;
1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-(диметиламино)этанона;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-(диметиламино)этанона;
3-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-3-оксопропаненитрила;
1-(4-(3-(4-(бензо[d]тиазол-2-иламино)-2-фторфенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
1-(4-(3-(6-(бензо[d]тиазол-2-иламино)пиридин-3-илокси)пиразин-2-ил)пиперидин-1-ил)этанона;
1-(3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)азетидин-1-ил)этанона;
1-(3-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанона;
4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-1-метил-5,6-дигидропиридин-2(1Н)-она;
4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)-1-метилпиперидин-2-она;
(R)-1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбонитрила;
(S)-1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбонитрила;
(R)-этил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-3-карбоксилата;
(S)-этил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-3-карбоксилата;
(S)-метил 1-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбоксилата;
(R)-метил 1-(3-(4-(1H-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пирролидин-3-карбоксилата;
(R)-4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-6-метилпиперазин-2-она;
(S)-4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)-6-метилпиперазин-2-она;
(1Н-бензо[d]имидазол-2-ил)(4-(3-((1R,3S)-3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(1H-бензо[d]имидазол-2-ил)(4-(3-((1S,3R)-3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(1S,3R)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
(1R,3S)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
(1Н-бензо[d]имидазол-2-ил)(4-(3-((1S,3S)-3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(1Н-бензо[d]имидазол-2-ил)(4-(3-((1R,3R)-3-гидроксициклогексил)пиразин-2-илокси)фенил)метанона;
(1S,3S)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
(1R,3R)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанола;
(R)-1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
(S)-1-(4-(3-(4-(1Н-бензо[d]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
(R)-1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
(S)-1-(4-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)пиперидин-1-ил)-2-фторпропан-1-она;
(R)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанона;
(S)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанона
или их любой фармацевтически приемлемой соли.
21. Соединение, имеющее формулу
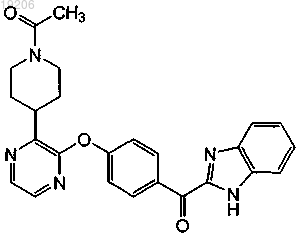
или его фармацевтически приемлемая соль.
22. Соединение, имеющее формулу
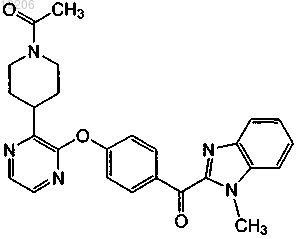
или его фармацевтически приемлемая соль.
23. Соединение, имеющее формулу
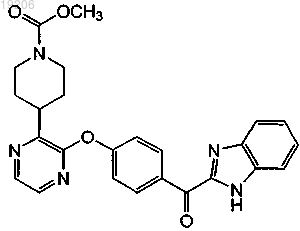
или его фармацевтически приемлемая соль.
24. Соединение, имеющее формулу
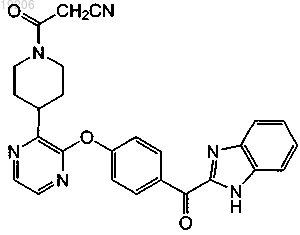
или его фармацевтически приемлемая соль.
25. Соединение, имеющее формулу
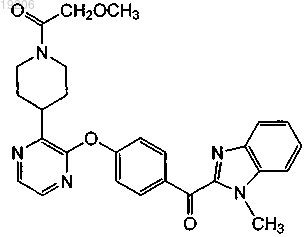
или его фармацевтически приемлемая соль.
26. Соединение, имеющее формулу
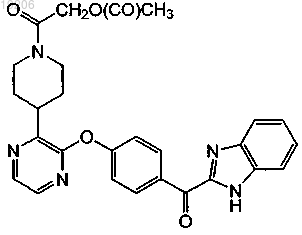
или его фармацевтически приемлемая соль.
27. Соединение, имеющее формулу
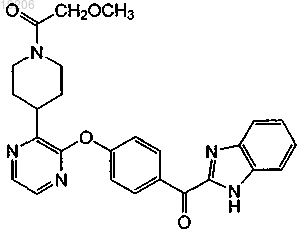
или его фармацевтически приемлемая соль.
28. Соединение, имеющее формулу
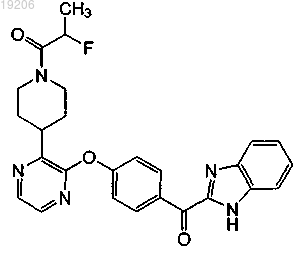
или его фармацевтически приемлемая соль.
29. Способ лечения PDE10-опосредованных состояний, включающий стадию введения соединения по любому из предыдущих пунктов в терапевтически эффективном количестве.
30. Способ по п.29, где указанное состояние выбирают из группы, состоящей из психозов, болезни Паркинсона, деменций, обсессивно-компульсивного расстройства, поздней дискенезии, хорей, депрессии, расстройств настроения, импульсивности, наркомании, дефицита внимания/гиперактивного расстройства (ДВГР), депрессии с паркинсоинальными состояниями, изменений личности с заболеванием хвостатой доли или скорлупы чечевицеобразного ядра, деменций и мании с заболеваниями хвостатой доли и паллидарными заболеваниями и компульсивных влечений с паллидарными заболеваниями.
31. Способ по п.29, где указанное состояние выбирают из группы, состоящей из шизофрении, биполярного расстройства и обсессивно-компульсивного расстройства.
32. Фармацевтическая композиция для лечения PDE10-опосредованных заболеваний, выбранных из группы, включающей шизофрению, биполярное расстройство и обсессивно-компульсивное расстройство, содержащая соединение по п.1 и фармацевтически приемлемый разбавитель или носитель.
33. Фармацевтическая композиция для лечения PDE10-опосредованных заболеваний, выбранных из группы, включающей шизофрению, биполярное расстройство и обсессивно-компульсивное расстройство, содержащая соединение по любому из пп.21-28 и фармацевтически приемлемый разбавитель или носитель.
Текст
ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ 10 Представлены пиразиновые соединения формулы (I) композиции, содержащие их, и способ получения таких соединений. В изобретении также представлены способы лечения расстройств или заболеваний, которые можно лечить путем ингибирования PDE10, таких как ожирение, инсулиннезависимый диабет, шизофрения,биполярное расстройство, обсессивно-компульсивное расстройство и т.п. Область техники В данной заявке представлены некоторые пиразиновые соединения, являющиеся ингибиторамиPDE10, фармацевтические композиции, содержащие такие соединения, и способы получения таких соединений. В данной заявке также представлены способы лечения расстройств или заболеваний, которые можно лечить путем ингибирования PDE10, таких как ожирение, инсулиннезависимый диабет, шизофрения, биполярное расстройство, обсессивно-компульсивное расстройство и т.п. Уровень техники Нейространсмиттеры и гормоны, а также другие типы внеклеточных сигналов, такие как свет и запахи, создают внутриклеточные сигналы путем изменения количеств циклических нуклеотидных монофосфатов (сАМР и cGMP) внутри клеток. Такие внутриклеточные матричные РНК изменяют функции многих внутриклеточных белков. Циклический AMP регулирует активность сАМР-зависимой протеинкиназы (РКА). РКА фосфорилирует и регулирует функцию многих типов белков, включая ионные каналы, ферменты и факторы транскрипции. Прямые медиаторы cGMP сигнализации также включают киназы и ионные каналы. В дополнение к действию, опосредованному киназами, сАМР и cGMP непосредственно связываются с некоторыми клеточными белками и непосредственно регулируют их активность. Циклические нуклеотиды продуцируются в результате действия аденилилциклазы и гуанилилциклазы, которые превращают АТР в сАМР и GTP в cGMP. Внеклеточные сигналы, часто посредством действия G белок-связанных рецепторов, регулируют активность циклаз. Альтернативно, количество сАМР и cGMP может быть изменено путем регулирования активности ферментов, которые разлагают циклические нуклеотиды. Клеточный гомеостаз поддерживается путем быстрого распада циклических нуклеотидов после возрастания, вызванного стимуляцией. Ферменты, разлагающие циклические нуклеотиды,имеют название 3',5'-циклических нуклеотид-специфических фосфодиэстераз (PDEs). Одиннадцать PDE генных семейств (PDE1-PDE11) были идентифицированы на основе их отдельных аминокислотных последовательностей, каталитических и регуляторных характеристик, и чувствительности к низкомолекулярным ингибиторам. Данные семейства кодируются 21 генами; и дополнительные множественные сплайсированные варианты транскрибируются из многих таких генов. Уровни экспрессии для каждого генного семейства отличаются. PDEs отличается по своей афинности по отношению к сАМР и cGMP. Активности различных PDEs регулируются различными сигналами. Например,PDE1 стимулируется Са 2+/кальмодулином. PDE2 активность стимулируется cGMP. PDE3 ингибируетсяcGMP. PDE4 является сАМР специфичным и специфично ингибируется ролипрамом. PDE5 являетсяPDE10 последовательности были идентифицированы путем применения биоинформатики и информации о последовательностях, взятых от других PDE генных семейств (Fujishige et al., J. Biol. Chem. 274:18438-18445, 1999; Loughney et al., Gene 234:109-117, 1999; Soderling et al., Proc. Natl. Acad. Sci. USA 96:7071-7076, 1999). PDE10 генное семейство различают, основываясь на его аминокислотной последовательности, функциональных свойствах и распределении в тканях. Человеческий PDE10 ген является большим, более 200 kb, содержащим до 24 экзонов, кодирующих каждый из вариантов сплайсинга. Аминокислотная последовательность характеризуется двумя GAF доменами (которые связывают cGMP), каталитическим участком, и альтернативно сплайсированными N и С концами. Возможны многочисленные варианты сплайсинга, поскольку по меньшей мере три альтернативных экзона кодируют N концы и два экзона кодируют С-концы. PDE10A1 является 779 аминокислотным белком, который гидролизует как сАМР, так и cGMP. Значения Km для сАМР и cGMP составляют 0,05 и 3,0 мкмоль, соответственно. В дополнение к человеческим вариантам, несколько вариантов с высокой гомологией были выделены как из крысиных и мышиных тканей, так и из банков последовательностей. Транскрипты PDE10 РНК были изначально детектированы в человеческих яичках и мозге. Последующий иммунногистохимический анализ обнаружил, что наивысшие уровни PDE10 экспрессировались в базальных ганглиях. Конкретно, стриарные нейроны в обонятельном узелке, хвостатом ядре и прилежащем ядре были обогащены в PDE10. Анализы вестерн-блоттинг не выявили экспрессию PDE10 в других мозговых тканях, хотя иммуноосаждение PDE10 комплекса было возможным в гиппокампальных и кортикальных тканях. Это предполагает, что уровень экспрессии PDE10 в таких других тканях в 100-раз меньше, чем в стриарных нейронах. Экспрессия в гиппокамп ограничена клеточными телами, принимая во внимание, что PDE10 экспрессируется в концах, дендритах и аксонах стриарных нейронов. Распределение в тканях PDE10 указывает на то, что PDE10 ингибиторы могут быть применены для повышения уровней сАМР и/или cGMP в клетках, которые экспрессируют PDE10 фермент, например, в нейронах, содержащих базальные ганглии, и поэтому могут использоваться при лечении множества нейропсихиатрических состояний, включающих базальные ганглии, например, ожирение, инсулиннезависимый диабет, шизофрению, биполярное расстройство, обсессивно-компульсивное расстройство и т.п. Сущность изобретения Соединения в соответствии с данным изобретением представлены следующей общей структурой формулы (I) или его любой фармацевтически приемлемой соли, где каждый из X1, X2, X3 и X4 независимо представляет собой N или С; где не более, чем два из X1, X2, X3 и X4 являются N;(б) насыщенного, частично насыщенного или ненасыщенного 3-, 4-, 5-, 6- или 7-членного моноцикла или насыщенного, частично насыщенного или ненасыщенного 8-, 9-, 10-, 11- или 12-членного бицикла, где каждый из указанных циклов содержит 0, 1, 2, 3 или 4 N атомов и 0, 1 или 2 атомов, выбранных из О и S, и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-NRaRa,-NRaRc,-N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb,-N(Ra)C(=O)NRaRa,-N(Ra)C(=NRa)NRaRa,a(в) группы -L-R7, где L представляет собой СН 2, NH, N(С 1-4 алк), О, S, S=O или S(=O)2; илиR4 независимо представляет собой в каждом случае F, Cl, СН 3, CN, CF3, CHF2, CH2F, ORa илиR7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7 членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк,С 1-4 галоалк, -ORa, -OC1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb,-OC(=O)NRaRa, -OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa,-N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb,-N(Ra)C(=O)NRaRa,-N(Ra)C(=NRa)NRaRa,-N(Ra)S(=O)2Rb,aRb независимо представляет собой в каждом случае фенил, бензил или С 1-6 алк, где указанный фе-2 019206 нил, бензил и C1-6 алк замещены 0, 1, 2 или 3 заместителями, выбранными из гало, С 1-4 алк, С 1-3 галоалк,-ОН, -ОС 1-4 алк, -NH2, -NHC1-4 алк, -ОС(=О)С 1-4 алк или -N(C1-4 алк)С 1-4 алк;Rc представляет собой С 0-4 алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, где указанный С 0-4 алк и указанный циклический фрагмент могут быть замещены 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк, С 1-4 галоалк, R7, -ORa,-ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa,-OC2-6 алк-NRaRa, -ОС 2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa, -C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -C1-6 алк-C(=O)ORa и оксо. Данное изобретение также включает фармацевтические композиции, содержащие соединения, способы лечения PDE10-опосредованных заболеваний и других болезней, например, шизофрения, биполярное расстройство и обсессивно-компульсивное расстройство, применение соединений и композиций в соответствии с данным изобретением и промежуточные соединения и процессы, которые можно применять для получения соединений в соответствии с данным изобретением. Представленное выше только резюмирует определенные аспекты данного изобретения и не должно быть предназначено или истолковано как ограничения данного изобретения каким-либо образом. Все патенты, патентные заявки и другие публикации, приведенные в данной заявке, полностью включены в данную заявку путем ссылок. Подробное описание изобретения Один аспект данного изобретения относится к соединениям, имеющим общую структуру формулы или его любой фармацевтически приемлемой соли, где каждый из X1, X2, X3 и X4 независимо представляет собой N или С; где не более чем два из X1, X2,3(б) насыщенного, частично насыщенного или ненасыщенного 3-, 4-, 5-, 6- или 7-членного моноцикла или насыщенного, частично насыщенного или ненасыщенного 8-, 9-, 10-, 11- или 12-членного бицикла, где каждый из указанных циклов содержит 0, 1, 2, 3 или 4 N атомов и 0, 1 или 2 атомов, выбранных из О и S, и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -ОС 2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-NRaRa,-NRaRc,-N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb,-N(Ra)C(=O)NRaRa,-N(Ra)C(=NRa)NRaRa,a(в) группы -L-R7, где L представляет собой СН 2, NH, N(C1-4 алк), О, S, S=O или S(=O)2; илиR4 независимо представляет собой в каждом случае F, Cl, СН 3, CN, CF3, CHF2, CH2F, ORa илиR7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7 членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк,С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa, -C1-6 алк-N(Ra)Rc представляет собой С 0-4 алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл; или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, где указанный С 0-4 алк и указанный циклический фрагмент могут быть замещены 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, С 1-6 алк, С 1-4 галоалк, R7, -ORa,-ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa,-OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa, -C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb,-C1-6 алк-C(=O)NRaRa, -C1-6 алк-C(=O)ORa и оксо. В другом варианте исполнения Y представляет собой NH или -С(=О). В другом варианте исполнения Z представляет собой NH или NR6. В другом варианте исполнения R1 выбирают из группы, состоящей из насыщенного, частично насыщенного или ненасыщенного 4-, 5-, 6- или 7-членного моноцикла, где каждый из указанных циклов содержит 0, 1, 2 или 3 N атомов и 0, 1 или 2 О атома, и где каждый из указанных циклов замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb,-C(=O)ORa, -NRaRa, -NRaRc, R7, R8 и оксо. В другом варианте исполнения R1 выбирают из группы, состоящей из насыщенного, частично насыщенного или ненасыщенного 8-, 9-, 10-, 11- или 12-членного бицикла, где каждый из указанных циклов содержит 0, 1, 2 или 3 N атомов и 0, 1, или 2 О атомов и где каждый из указанных циклов замещен 0,1, 2 или 3 группами, выбранными из F, Cl, Br, С 1-6 алк, С 1-4 галоалк, -ОRa, -ОС 1-4 галоалк, CN, -C(=O)Rb,-C(=O)ORa, -NRaRa, -NRaRc, R7, R8 и оксо. В другом варианте исполнения R1 выбирают из группы, состоящей из циклогексила, циклопентила,циклопентенила, циклогексенила, циклогептила, азетидинила, фенила, 2-пиридила, 3-пиридила, пиразолила, морфолинила, пиримидила, пиперазинила, пиперидинила, дигидропиранила, тетрагидропиранила,тетрагидрофуранила, тетрагидропиридинила, тетрагидротиопиранила, оксаспиро[3.5]нонила, азепанила,оксепанила, хинолинила, все из которых замещены 0, 1, 2 или 3 группами, выбранными из F, Cl, Br,С 1-6 алк, С 1-4 галоалк, -ORa, CN, -C(=O)Rb, -C(=O)ORa, -SRa, R7 и оксо. В другом варианте исполнения R1 выбирают из группы, состоящей из В другом варианте исполнения R3 представляет собой F. В другом варианте исполнения R4 представляет собой F. В другом варианте исполнения R5 представляет собой метил. В другом варианте исполнения R6 представляет собой метил. В другом варианте исполнения R7 представляет собой насыщенный 3-, 4-, 5- или 6-членный моноцикл, содержащий 0 или 1 N атом и 0 или 1 О атом, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa,-C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -ОС 2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa,-N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -С 1-6 алк-ORa,-C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -C1-6 алк-C(=O)ORa, R8 и оксо. В другом варианте исполнения R8 представляет собой С 1-6 алк, замещенный 0 или 1 -ORa. В другом варианте исполнения Ra представляет собой Н или C1-6 алк, замещенный 0 или 1 -ОН,-ОС 1-4 алк, -ОС(=О)С 1-4 алк, или -N(C1-4 алк)C1-4 алк. В другом варианте исполнения Rc представляет собой С 0-4 алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 5- или 6-членный моноцикл, содержащий 0 или 1 N атом и 0 или 1 атом, выбранный из О и S, который замещен 0 или 1 группами, выбранными из F, С 1-6 алк, С 1-4 галоалк,-ORa, R7 или R8. В другом варианте исполнения группу формулы Другой аспект данного изобретения относится к соединению, имеющему формулу (II) или его любой фармацевтически приемлемой соли, где Z представляет собой NH, NR6 или S;X5 представляет собой С; цикл А представляет собой связанный через углерод насыщенный, связанный через углерод частично насыщенный или связанный через углерод ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12 членный карбоцикл, содержащий 0, 1 или 2 N атомов и содержащий 0 или 1 S или О атомов; или связанный через азот насыщенный, связанный через азот частично насыщенный или связанный через азот ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12-членный гетероцикл, содержащий мостиковый азот и 0, 1 или 2 дополнительных N атомов и содержащий 0 или 1 S или О атомов;R4 независимо представляет собой в каждом случае F, Cl, СН 3, CN, CF3, CHF2, CH2F, ORa илиR7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7 членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2, 3 или 4 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br, С 1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa, -C1-6 алкN(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -C1-6 алк-C(=O)ORa, R8 и оксо;R9 независимо выбирают из группы, состоящей из Н, F, Cl, Br, C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алкNRaRa, -ОС 2-6 алк-ORа, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -NRaRc, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORа, -C1-6 алк-NRaRa, -С 1-6 алкORа, -C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -С 1-6 алкС(=О)ORa, R7, R8 и оксо;Ra независимо представляет собой в каждом случае Н или Rb;Rc представляет собой С 0-4 алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, который замещен 0, 1, 2 или 3 группами, выбранными изF, Cl, Br, C1-6 алк, C1-4 галоалк, R7, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa,-C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -ОС 2-6 алк-NRаRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb,-S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa,-N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa,-C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -С 1-6 алкС(=О)ORa и оксо. Другой аспект данного изобретения относится к соединению, имеющему формулу (III) или его любой фармацевтически приемлемой соли, где Z представляет собой NH, NR6 или S; m представляет собой 0, 1, 2, 3 или 4;X5 представляет собой С; цикл А представляет собой связанный через углерод насыщенный, связанный через углерод частично насыщенный или связанный через углерод ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11- или 12 членный карбоцикл, содержащий 0, 1 или 2 N атомов и содержащий 0 или 1 S или О атомов; или связанный через азот насыщенный, связанный через азот частично насыщенный, или связанный через азот ненасыщенный 4-, 5-, 6-, 7-, 8-, 9-, 10-, 11-, или 12-членный гетероцикл, содержащий мостиковый азот и 0, 1 или 2 дополнительных N атомов и содержащий 0 или 1 S или О атомов;R7 представляет собой насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7 членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2, 3 или 4 N атомов и 0 или 1 атомов, выбранных из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из F, Cl, Br,C1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa,-OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алк-NRaRa, -OC2-6 алк-ORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa,-NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb,-N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa, -C1-6 алк-N(Ra)R9 независимо выбирают из группы, состоящей из Н, F, Cl, Br, С 1-6 алк, С 1-4 галоалк, -ORa, -ОС 1-4 галоалк, CN, -C(=O)Rb, -C(=O)ORa, -C(=O)NRaRa, -C(=NRa)NRaRa, -OC(=O)Rb, -OC(=O)NRaRa, -OC2-6 алкNRaRa, -OC2-6 алкORa, -SRa, -S(=O)Rb, -S(=O)2Rb, -S(=O)2NRaRa, -NRaRa, -NRaRc, -N(Ra)C(=O)Rb,-N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa, -N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORа, -C1-6 алк-NRaRa, -С 1-6 алк-ORа, -C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb,-C1-6 алк-C(=O)NRaRa, -C1-6 алк-C(=O)ORa, R7, R8 и оксо;Ra независимо представляет собой в каждом случае Н или Rb;Rb независимо представляет собой в каждом случае фенил, бензил или C1-6 алк, где фенил, бензил и С 1-6 алк замещен 0, 1, 2 или 3 заместителями, выбранными из гало, С 1-4 алк, C1-3 галоалк, -ОН, -ОС 1-4 алк,-NH2, -NHC1-4 алк, -ОС(=О)С 1-4 алк, или -N(С 1-4 алк)С 1-4 алк;Rc представляет собой С 0-4 алк-связанный насыщенный, частично насыщенный или ненасыщенный 3-, 4-, 5-, 6- или 7-членный моноцикл или 8-, 9-, 10-, 11- или 12-членный бицикл, содержащий 0, 1, 2 или 3 N атомов и 0 или 1 атом, выбранный из О и S, который замещен 0, 1, 2 или 3 группами, выбранными из-S(=O)2NRaRa, -NRaRa, -N(Ra)C(=O)Rb, -N(Ra)C(=O)ORb, -N(Ra)C(=O)NRaRa, -N(Ra)C(=NRa)NRaRa,-N(Ra)S(=O)2Rb, -N(Ra)S(=O)2NRaRa, -NRaC2-6 алк-NRaRa, -NRaC2-6 алк-ORa, -C1-6 алк-NRaRa, -C1-6 алк-ORa,-C1-6 алк-N(Ra)C(=O)Rb, -C1-6 алк-OC(=O)Rb, -C1-6 алк-C(=O)NRaRa, -С 1-6 алк-C(=O)ORa и оксо. Другой аспект данного изобретения относится к соединению, выбранному из группы, состоящей из(S)-3-(3-(4-(бензо[d]тиазол-2-иламино)фенокси)пиразин-2-ил)циклогексанона; или их любой фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему формулу или его фармацевтически приемлемой соли. Другой аспект изобретения относится к способу лечения PDE10-опосредованных состояний, включающему стадию введения соединения по изобретению в терапевтически эффективном количестве. В одном варианте осуществления изобретения состояние выбирают из группы, состоящей из психозов, болезни Паркинсона, деменций, обсессивно-компульсивного расстройства, поздней дискенезии, хорей, депрессии, расстройств настроения, импульсивности, наркомании, дефицита внимания/гиперактивного расстройства (ДВГР), депрессии с паркинсоинальными состояниями, изменений личности с заболеванием хвостатой доли или скорлупы чечевицеобразного ядра, деменций и мании с заболеваниями хвостатой доли и паллидарными заболеваниями, и компульсивных влечений с паллидарными заболеваниями. В одном варианте осуществления изобретения состояние выбирают из группы, состоящей из шизофрении, биполярного расстройства и обсессивно-компульсивного расстройства. Другой аспект изобретения относится к фармацевтической композиции для лечения PDE10 опосредованных заболеваний, выбранных из группы, включающей шизофрению, биполярное расстройство и обсессивно-компульсивное расстройство, содержащей соединение по изобретению и фармацевтически приемлемый разбавитель или носитель. Другой аспект изобретения относится к фармацевтической композиции для лечения PDE10 опосредованных заболеваний, выбранных из группы, включающей шизофрению, биполярное расстройство и обсессивно-компульсивное расстройство, содержащей соединение по изобретению и фармацевтически приемлемый разбавитель или носитель. Соединения в соответствии с данным изобретением могут иметь, в общем, несколько ассиметричных центров и их обычно изображают в виде рацемических смесей. Данное изобретение включает также- 14019206 рацемические смеси, частично рацемические смеси и отдельные энантиомеры и диастереомеры. Данное изобретение включает все фармацевтически приемлемые изотопно-меченые соединения в соответствии с данным изобретением, где один или более атомов замещены атомами, имеющими тот же самый атомный номер, но атомная масса или массовое число отличаются от атомной массы или массового числа, которые доминируют в природе. Примеры изотопов, приемлемых для включения в соединения в соответствии с данным изобретением включают, не ограничиваясь приведенным, изотопы водорода, такие как 2 Н и 3 Н, углерод, например,11 С, 13 С и 14 С, хлор, например, 38 Сl, фтор, например, 18F, йод, например, 123I и 125I, азот, например, 13N и 15N, кислород, например, 15 О, 17 О и 18 О, фосфор, например, 32 Р и серу, например, 35S. Определенно изотопно-меченые соединения в соответствии с данным изобретением, например,включающие радиоактивный изотоп, являются эффективными в лекарственных средствах и/или исследованиях распределения в субстратных тканях. Особенно эффективными для этой цели являются радиоактивные изотопы тритий, т.е. 3 Н, и углерод-14, т.е.14 С, ввиду их легкости введения и простоты детекции. Замещение более тяжелыми изотопами,например, дейтерием, т.е. 2 Н, могут придавать определенный терапевтический полезный эффект, являющийся результатом большей метаболитической стабильности, например, повышенного периода полувыведения in vivo или уменьшенных требований к дозировкам, и поэтому могут быть преимущественными в некоторых обстоятельствах. Замещение позитронно-активными изотопами, например 11 С, 18F, 15O и 13N, может быть эффективным в исследовании позитронно-излучающей топографии (PET) для изучения занятости субстратного рецептора. Изотопно-меченые соединения в соответствии с данным изобретением могут быть, в общем, получены при помощи традиционных способов, известных специалистам в данной области, или при помощи способов, аналогичных описанным в примерах и способах получения, которые прилагаются, при помощи соответствующего изотопно-меченого реактива вместо не-меченого реактива, который применяли ранее. Фармацевтически приемлемые сольваты в соответствии с данным изобретением включают сольваты, в которых растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетоном, d6 ДМСО. Конкретные варианты исполнения в соответствии с данным изобретением включают соединения,проиллюстрированные в Примерах, приведенных ниже, и их фармацевтически приемлемые соли, комплексы, сольваты, полиморфы, стереоизомеры, метаболиты, прлекарства и другие их производные. Если не указано иное, следующие определения применяют для терминов, которые приведены в описании и формуле изобретения: "С-алк" означает группу, содержащую минимуми максимумуглеродных атомов в разветвленном, циклическом или линейном взаимоотношении, или любую комбинацию их всех,гдеиявляются целыми числами. Группы, описанные в данном разделе, могут также содержать одну или две двойных или тройных связей. Обозначение С 0 алк указывает на простую связь. Примеры С 1-6 алкила включают, не ограничиваясь приведенным, следующее:"Бензогруппа", отдельно или в комбинации, означает дивалентный радикал С 4 Н 4=, одно из представлений которого -СН=СН-СН=СН-, который при вицинальном присоединении к другому циклу образует подобный бензольному цикл, например тетрагидронафталин, индол и т.п. Термины "оксо" и "тиоксо" представляют группы =O (как в карбониле) и =S (как в тиокарбониле),соответственно."С-галоалк" означает алкильную группу, как описано выше, где любое количество, по меньшей мере один из атомов водорода, присоединенных к алкильной цепи, замещен на F, Cl, Br или I. Группа N(Ra)Ra и т.п. включает заместители, где две Ra группы вместе образуют цикл,необязательно содержащий N, О или S атом, и включает такие группы: Группа N(С-алк) С-алк, гдеиопределены выше, включает заместители, где две С-алк группы вместе образуют цикл, необязательно содержащий N, О или S атом, и включает такие группы:"Карбоцикл" означает цикл, отдельно или в комбинации с другими терминами представляющий собой, если не указано иное, циклическую версию "С-алк". Таким образом, термин "карбоцикл" предназначен для включения в термины "С-алк". Примеры карбоцикла включают циклопентил, циклогексил,1-циклогексенил, 3-циклогексенил, циклогептил, циклобутилен, циклогексилен и т.п."Гетероцикл" означает цикл, содержащий по меньшей мере один углеродный атом и по меньшей мере один другой атом, выбранный из N, О и S. Примеры гетероциклов, которые могут быть приведены в формуле изобретения, включают, не ограничиваясь приведенным, следующее:"Фармацевтически приемлемая соль" означает соль, полученную традиционным способом, хорошо известным специалисту в данной области. "Фармацевтически приемлемые соли" означают основные соли органических и неорганических кислот, включая, но не ограничиваясь приведенным, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, яблочную кислоту, уксусную кислоту, щавелевую кислоту, винную кислоту, лимонную кислоту, молочную кислоту, фумаровую кислоту, янтарную кислоту, малеиновую кислоту, салициловую кислоту, бензойную кислоту, фенилуксусную кислоту, миндальную кислоту и т.п. Если соединения в соответствии с данным изобретением содержат кислотную функциональную группу, такую как карбоксигруппа, то приемлемые фармацевтически приемлемые катионные пары для карбоксигруппы хорошо известны специалистам в данной области и включают щелочные, щелочно-земельные, аммонийные, четвертичные аммонийные катионы и т.п. Дополнительные примеры "фармацевтически приемлемых солей" см. выше и Berge et al., J. Pharm. Sci. 66:1 (1977)."Насыщенный, частично насыщенный или ненасыщенный" включает заместители, насыщенные водородами, заместители, полностью ненасыщенные водородами, и заместители, частично насыщенные водородами."Уходящая группа" в общем относится к группам, которые легко заменить нуклеофилом, например,амином, тиолом или спиртовым нуклеофилом. Такие уходящие группы хорошо известны из уровня техники. Примеры таких уходящих групп включают, не ограничиваясь приведенным, N-гидроксисукцинимид, N-гидроксибензотриазол, галиды, трифлаты, тозилаты и т.п. Преимущественные уходящие группы указаны в данной заявке там, где это целесообразно."Защитная группа" в общем относится к группам, хорошо известным из уровня техники, которые применяют для предотвращения выбранных реакционноспособных групп, например, карбокси, амино,гидрокси, меркапто и т.п, в результате нежелательных реакций, таких как нуклеофильные, электрофильные, окисления, восстановления и т.п. Преимущественные защитные группы указаны в данной заявке там, где это целесообразно. Примеры аминозащитных групп включают, не ограничиваясь приведенным,аралкил, замещенный аралкил, циклоалкенилалкил и замещенный циклоалкенил алкил, аллил, замещенный аллил, ацил, алкоксикарбонил, аралкоксикарбонил, силил и т.п. Примеры аралкила включают, не- 16019206 ограничиваясь приведенным, бензил, ортометилбензил, тритил и бензгидрил, которые могут быть необязательно замещены галогеном, алкилом, алкокси, гидрокси, нитро, асиламино, ацилом и т.п, и солями,такими как фосфониевая и аммонийная соли. Примеры арильных групп включают фенил, нафтил, инданил, антраценил, 9-(9-фенилфторфенил), фенантренил, дуренил и т.п. Примеры циклоалкенилалкильных или замещенных циклоалкиленилалкильных радикалов, преимущественно содержащие 6-10 углеродных атомов, включают, не ограничиваясь приведенным, циклогексенил, метил и т.п. Приемлемые ацильные,алкоксикарбонильные и аралкоксикарбонильные группы включают бензилоксикарбонил, tбутоксикарбонил, изобутоксикарбонил, бенозоил, замещенный бенозоил, бутирил, ацетил, трифторацетил, трихлорацетил, фталоил и т.п. А смесь защитных групп может быть применена для защиты тех же самых аминогрупп, например, первичная аминогруппа может быть защищена как аралкильной группой,так и аралкоксикарбонильной группой. Амино защитные группы могут также образовывать гетероцикл с азотом, к которому они присоединены, например, 1,2-бис(метилен)бензол, фталимидил, сукцинимидил,малеимидил и т.п., где данные гетероциклические группы могут дополнительно содержать примыкающие арильные и циклоалкильные циклы. Дополнительно, гетероциклические группы могут быть моно-,ди- или три-замещенными, например, нитрофталимидил. Амины могут быть также защищены от нежелательных реакций, таких как окисление, посредством образования солей присоединения, например, гидрохлорида, толуолсульфоновой кислоты, трифторуксусной кислоты и т.п. Многие из аминозащитных групп также приемлемы для защиты карбокси, гидрокси и меркапто групп. Например, аралкильные группы. Алкильные группы являются также приемлемыми группами для защиты гидрокси и меркапто группы, таких как трет-бутил. Силильные защитные группы являются атомами кремния, необязательно замещенными одной или более алкильной, арильной и аралкильной группами. Приемлемые силильные защитные группы включают, не ограничиваясь приведенным, триметилсилил, триэтилсилил, триизопропилсилил, третбутилдиметилсилил, диметилфенилсилил, 1,2-бис(диметилсилил)бензол, 1,2-бис(диметилсилил)этан и дифенилметилсилил. Силилирование аминогрупп обеспечивает моно- или ди-силиламиногруппы. Силилирование аминоспиртовых соединений может привести к образованию N,N,О-трисилильного производного. Удаление силильной функциональной группы из силильной эфирной функциональной группы легко достигается путем обработки, например, гидроксидом металла или аммоний фторидным реактивом,стадией отдельной реакции или реакцией дицикла A in situ со спиртовой группой. Приемлемыми силилирующими агентами являются, например, триметилсилил хлорид, трет-бутилдиметилсилил хлорид,фенилдиметилсилил хлорид, дифенилметил силил хлорид или продукты их комбинирования с имидазолом или ДМФ. Способы силилирования аминов и удаления силильных защитных групп хорошо известны специалистам в данной области. Способы получения таких аминопроизводных из соответствующих аминокислот, амидо амино кислот или эфиров аминокислот также хорошо известны специалистам в органической химии, включая химию аминокислот/эфиров аминокислот или аминоспиртов. Защитные группы удаляют в условиях, которые не будут влиять на оставшуюся часть молекулы. Такие способы хорошо известны из уровня техники и включают кислотный гидролиз, гидрогенолиз и т.п. Преимущественный способ включает удаление защитной группы, например, удаление бензилоксикарбонильной группы, гидрогенолиз с использованием палладия на углероде в подходящей системе растворителей, таких как спирт, уксусная кислота, и т.п., или их смеси, t-бутоксикарбонильная защитная группа может быть удалена с использованием неорганической или органической кислоты, такой как HCl или трифторуксусная кислота, в подходящей системе растворителей, такой как диоксан или метиленхлорид. Полученную в результате аминосоль легко нейтрализовать с получением свободного амина. Карбоксизащитная группа, такая как метил, этил, бензил, трет-бутил, 4-метоксифенилметил и т.п, может быть удалена в условиях гидролиза и гидрогенолиза, хорошо известных специалистам в данной области. Необходимо отметить, что соединения в соответствии с данным изобретением могут содержать группы, которые могут существовать в таутомерных формах, таких как циклические и ациклические амидиновые и гуанидиновые группы, замещенные гетероатомом гетероарильные группы (Y' = О, S, NR),и т.п, которые проиллюстрированы в следующих примерах:- 17019206 и хотя одна форма названа, описана, представлена и/или заявлена в данной заявке, все таутомерные формы предназначены для неотъемлемого включения в такое название, описание, представление и/или формулу данного изобретения. Пролекарства соединений в соответствии с данным изобретением также входят в состав данного изобретения. Пролекарство является активным или неактивным соединением, химически модифицированным посредством физиологического действия in vivo, например, гидролиза, метаболизма, и т.п., в соединение в соответствии с данным изобретением после введения пролекарства пациенту. Приемлемость и способы получения и применения пролекарств хорошо известны специалистам в данной области. Общее обсуждение пролекарств, включая эфиры, приведено в Svensson and Tunek Drug MetabolismReviews 165 (1988) and Bundgaard Design of Prodrugs, Elsevier (1985). Примеры замаскированного карбоксилатного аниона включают множество эфиров, таких как алкил (например, метил, этил), циклоалкил(например, циклогексил), аралкил (например, бензил, п-метоксибензил) и алкилкарбонилоксиалкил (например, пивалоилоксиметил). Амины были замаскированы как арилкарбонилоксиметил замещенные производные, которые расщепляются эстеразами in vivo, высвобождая свободное лекарственное средство и формальдегид (Bungaard J. Med. Chem. 2503 (1989. Также лекарственные средства, содержащие кислотную NH группу, такие как имидазол, имид индол и т.п, были замаскированы N-ацилоксиметильными группами (Bundgaard Design of пролекарственные средства, Elsevier (1985. Гидроксигруппы были замаскированы как сложные и простые эфиры. ЕР 039,051 (Sloan and Little, 4/11/81) описывает основанные на реакции Манниха пролекарства на основе гидроксамовой кислоты, их получение и применение. Описание и формула данного изобретения содержат список соединений с использованием выражений "выбраны изи " и "являетсяили " (иногда относятся к группам Маркуша). При использовании таких выражений в данной заявке, если не указано иное, подразумевают, что они включают группу в целом, или ее любые члены, или ее любые подгруппы. Данные выражения используют только для сокращения и оно не предназначено никоим образом для ограничения удаления отдельных элементов или подгрупп при необходимости. Эффективность и способы применения В данной заявке обеспечены способы лечения расстройства или заболевания путем ингибированияPDE10 фермента. Способы, в общем, включают стадию введения терапевтически эффективного количества соединений в соответствии с данным изобретением, или отдельного стереоизомера, смеси стереоизомеров, или их фармацевтически приемлемых солей или сольватов, пациенту, который нуждается в этом, для лечения расстройства или заболевания. В определенных вариантах исполнения, данное изобретение обеспечивает применение соединения,как описано в данной заявке, при изготовлении лекарственного средства для лечения расстройства или заболевания, которые можно лечить путем ингибирования PDE10. Соединения в соответствии с данным изобретением ингибируют ферментную активность PDE10 и поэтому повышают уровни сАМР или cGMP в клетках, которые экспрессируют PDE10. Соответственно,ингибирование ферментной активности PDE10 может быть эффективным при лечении заболеваний, вызванных различными количествами сАМР или cGMP в клетках. Ингибиторы PDE10 могут быть также полезными в случаях, когда увеличение количества сАМР или cGMP выше нормальных уровней приводит к терапевтическому эффекту. Ингибиторы PDE10 могут быть применены для лечения расстройств периферической и центральной нервной системы, сердечно-сосудистых заболеваний, рака, желудочнокишечных заболеваний, эндокринологических заболеваний и урологических заболеваний. Врачебные показания, которые могут быть вылечены ингибиторами PDE10, отдельно или в комбинации с другими лекарственными средствами, включают, не ограничиваясь приведенным, такие заболевания, которые рассматривают как опосредованные частично базальными ганглиями, префронтальной корой и гиппокампом. Такие показания включают психозы, болезнь Паркинсона, деменции, обсессивно-компульсивное расстройство, позднюю дискенезию, хореи, депрессии, расстройства настроения, импульсивность,наркоманию, дефицит внимания/гиперактивное расстройство (ДВГР), депрессии с паркинсоинальными состояниями, изменения личности с заболеванием хвостатой доли или скорлупы чечевицеобразного ядра, деменции и мании с заболеваниями хвостатой доли и паллидарными заболеваниями и компульсивные влечения с паллидарными заболеваниями. Психозы являются расстройствами, влияющими на восприятие индивидуумами реальности. Психозы характеризуются иллюзиями и галлюцинациями. Соединения в соответствии с данным изобретением являются приемлемыми для применения при лечении пациентов, страдающих от всех форм психозов,включая, не ограничиваясь приведенным, шизофрению, шизофрению взрослых, изоаффективные расстройства, продромальную шизофрению и биполярные расстройства. Лечение может быть проведено для позитивных симптомов шизофрении, а также для умственной недостаточности и негативных симптомов. Другие показания для ингибиторов PDE10 включают психозы, возникшие в результате наркомании(включая амфетамины и РСР), энцефалиты, алкоголизм, эпилепсию, волчанку, саркоидоз, опухоли мозга,рассеянный склероз, деменцию с тельцами Леви, или гипогликемию. Другие психиатрические расстройства, например, расстройства посттравматического стресса (РПСС), и шизоидные личности могут быть вылечены ингибиторами PDE10. Обсессивно-компульсивное расстройство (ОКС) было связано с дефи- 18019206 цитом во фронтально-стриарных нейрональных маршрутах (Saxena et al., Br. J. Psychiatry Suppl, 35:26-37,1998). Нейроны в таких маршрутах проходят в стриарные нейроны, экспрессирующие PDE10. Ингибиторы PDE10 приводят к повышению сАМР в таких нейронах; повышение сАМР приводит к повышению фосфорилирования CREB и таким образом улучшает функциональное состояние таких нейронов. Соединения в соответствии с данным изобретением являются поэтому приемлемыми для применения при показаниях ОКС. ОКС может возникать, в некоторых случаях, из-за стрептококковых инфекций, которые причиняют аутоиммунные реакции в базальных ганглиях (Giedd et al., Am J Psychiatry. 157:281-283,2000). Поскольку ингибиторы PDE10 могут служить в качестве нейропротекторов, то введение ингибиторов PDE10 может предотвращать повреждение базальных ганглий после повторной стрептококковой инфекции и таким образом предотвращать развитие ОКС. В мозге, уровень сАМР или cGMP в нейронах,как считают, относится к качеству памяти, особенно длительной памяти. Не желая быть связанными каким-либо конкретным механизмом, предлагают что, поскольку PDE10 разлагает сАМР или cGMP, уровень такого фермента влияет на память у животных, например, у людей. Соединение, ингибирующее сАМР фосфодиэстеразу (PDE), может таким образом повышать внутриклеточные уровни сАМР, которые, в свою очередь, активируют протеинкиназу, которая фосфорилирует фактор транскрипции (сАМР адаптивный связывающий белок). Фосфорилированный фактор транскрипции затем связывается с ДНК промоторной последовательностью для активации генов, важных для долговременной памяти. Чем более активны такие гены, тем лучше долговременная память. Таким образом, путем ингибирования фосфодиэстеразы может быть улучшена долговременная память. Деменции являются заболеваниями, которые включают потерю памяти и дополнительные ухудшения интеллекта, отдельно от памяти. Соединения в соответствии с данным изобретением являются приемлемыми для применения при лечении пациентов, страдающих от ухудшений памяти при всех формах деменции. Деменции классифицируют в соответствии с их причинами и они включают: нейродегенеративные деменции (например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болезнь Пика), сосудистые (например, инфаркт, кровоизлияние, сердечные расстройства), смешанные сосудистые и Альцгеймера, бактериальный менингит, болезнь Кройцфельда-Якоба, рассеянный склероз, травматические (например, субдуральная гематома или травматическое поражение мозга), инфекционные(например, ВИЧ), генетические (синдром дауна), токсические (например, тяжелые металлы, алкоголь,некоторые лекарственные средства), метаболические (например, недостаток витамина В 12 или фолатов),гипоксию ЦНС, болезнь Кушинга, психиатрические (например, депрессия и шизофрения) и гидроцефальные. Состояние ухудшения памяти проявляется ухудшением способности к обучению новой информации и/или неспособности вспомнить ранее выученную информацию. Данное изобретение включает способы лечения потери памяти отдельно от деменции, включая умеренное нарушение умственной деятельности (MCI) и возрастное ухудшение умственной деятельности. Данное изобретение включает способы лечения ухудшений памяти в результате заболевания. Ухудшение памяти является первичным симптомом деменции и может также быть симптомом, связанным с такими заболеваниями, как болезнь Альцгеймера, шизофрения, болезнь Паркинсона, болезнь Хантингтона, болезнь Пика, болезнь КройцфельдаЯкоба, ВИЧ, сердечно-сосудистое заболевание и травма головы, а также возрастное ухудшение умственной деятельности. Соединения в соответствии с данным изобретением являются приемлемыми при лечении ухудшений памяти, вызванных, например, болезнью Альцгеймера, рассеянным склерозом, амилолатеросклерозом (АЛС), множественной системной атрофией (МСА), шизофренией, болезнью Паркинсона,болезнью Хантингтона, болезнью Пика, болезнью Кройцфельда-Якоба, депрессией, старением, травмой головы, инсультом, травмой позвоночника, гипоксией ЦНС, угасанием мозга, ухудшениями мозговой деятельности, связанными с диабетом, дефицитом памяти вследствие раннего воздействия анестетиков,мультиинфарктной деменцией и другими неврологическими состояниями, включая острые нейрональные заболевания, а также ВИЧ и сердечно-сосудистые заболевания. Соединения в соответствии с данным изобретением также являются приемлемыми для применения в лечении класса расстройств, известных как полиглютамин-повторяющиеся расстройства. Такие заболевания имеют общую патогенную мутацию. Расширение повтора CAG, кодирующего аминокислотный глютамин в геноме, приводит к выработке мутантного белка, имеющего расширенный полиглютаминовый участок. Например, болезнь Хантингтона была связана с мутацией белка хантингтина. У индивидуумов, не имеющих болезни Хантингтона, хантингтин содержит полиглютаминовый участок, содержащий приблизительно 8-31 глютаминовых остатков. Для индивидуумов с болезнью Хантингтона, хантингтин содержит полиглютаминовый участок, содержащий более 37 глютаминовых остатков. Кроме болезни Хантингтона (БХ), другие известные полиглютамин-повторяющиеся заболевания и связанные с ними белки включают дентаторубральную-паллидолуизиарную атрофию, DRPLA (атропин-1); спинально-церебеллярную атаксию типа-1 (атаксин-1); спинально-церебеллярную атаксию типа-2 (атаксин-2); спинально-церебеллярную атаксию типа-3 (также имеющую название болезни Макадо-Джозефа, или БМД) (атаксин-3); спинально-церебеллярную атаксию типа-6 (альфа 1a-напряжение зависимый кальциевый канал); церебеллярную атаксию типа-7 (атаксин-7) и спинальную и клубочковую мышечную атрофию (СКМА, также известную как болезнь Кеннеди).- 19019206 Базальные ганглии важны для регуляции функции моторных нейронов; расстройства базальных ганглий приводят к двигательным расстройствам. Наиболее значительные из двигательных расстройств,которые относятся к функции базальных ганглий, представляют собой болезнь Паркинсона (Obeso et al.,Neurology. 62(1 Suppl l):S17-30, 2004). Другие двигательные расстройства, которые относятся к дисфункции базальных ганглий, включают позднюю дискенезию, прогрессивный супрануклеарный паралич и церебральный паралич, кортикобазальное вырождение, множественную системную атрофию, болезнь Вильсона, дистонию, тики и хорею. Соединения в соответствии с данным изобретением также являются приемлемыми для применения двигательных расстройств, которые относятся в дисфункции нейронов базальных ганглий. Ингибиторы PDE10 полезны для повышения сАМР или cGMP уровней для того, чтобы предотвратить апоптоз нейронов. Ингибиторы PDE10 могут быть противовоспалительными путем повышения сАМР в глиальных клетках. Комбинация антиапоптических и противовоспалительных свойств, а также позитивное влияние на синаптическую пластичность и нейрогенез, делает такие соединения полезными для лечения нейродегенерации, возникающей вследствие любого заболевания или повреждения, включая инсульт, травму позвоночника, болезнь Альцгеймера, рассеянный склероз, амилотатеросклероз (АЛС) и множественную системную атрофию (МСА). Аутоиммунные заболевания или инфекционные заболевания, которые влияют на базальные ганглии, могут приводить к возникновению расстройств базальных ганглий, включая ADBX, ОКС, тики, болезнь Туретта, болезнь Сиденхама, хорею. Дополнительно, любой инсульт мозга может потенциально повреждать базальные ганглии, включая инсульты, нарушения обмена веществ, заболевания печени, рассеянный склероз, инфекции, опухоли, передозировки лекарственных средств или побочные эффекты, и травму головы. Соответственно, соединения в соответствии с данным изобретением могут быть применены для остановки развития заболевания или восстановления поврежденного мозгового кровообращения путем комбинации эффектов, включая повышенную синаптическую пластичность, нейрогенез, противовоспалительное действие, восстановление нервных клеток и пониженный апопотоз. Рост некоторых раковых клеток ингибируется сАМР и cGMP. После трансформации клетки могут стать раковыми путем экспрессии PDE10 и уменьшения количества cAMP или cGMP в клетках. В таких видах раковых клеток ингибирование активности PDE10 ингибирует рост клеток путем повышения сАМР. В некоторых случаях, PDE10 может экспрессироваться в трансформированных раковых клетках,но не в родительской клеточной линии. В трансформированных почечных карциномных клетках экспрессируется PDE10 и ингибиторы PDE10 уменьшают скорость роста клеток в культуре. Аналогично,клетки рака молочной железы ингибируются путем введения ингибиторов PDE10. Многие другие типы раковых клеток могут быть также чувствительными к прекращению роста путем ингибирования PDE10. Поэтому соединения, описанные в данном изобретении, могут быть применены для остановки роста раковых клеток, экспрессирующих PDE10. Соединения в соответствии с данным изобретением также являются приемлемыми при лечении диабета и родственных заболеваний, таких как ожирение, путем направленности на регуляцию сигнальной системы сАМР. Путем ингибирования PDE-10, в особенности PDE-10A, внутриклеточные уровни сАМР повышаются, таким образом, повышая высвобождение инсулин-содержащих секреторных гранул и поэтому повышая секрецию инсулина. См., например, WO 2005/012485, которая полностью включена в данную заявку путем ссылки. Соединения формулы (I) могут быть также использованы для лечения заболеваний, описанных в публикации патентной заявки США 2006/019975, описание которой полностью включено в данную заявку путем ссылки. Анализ Ингибиторная активность PDE10 соединений в соответствии с данным изобретением может быть проанализирована, например, при помощи анализов in vitro и in vivo, описанных в Биологических примерах ниже. Способ введения и фармацевтические композиции В общем, соединения в соответствии с данным изобретением могут быть введены в терапевтически эффективном количестве посредством любого из приемлемых режимов введения агентов, которые имеют аналогичное применение. Фактическое количество соединения в соответствии с данным изобретением, т.е. активного ингредиента, зависит от многочисленных факторов, таких как тяжесть заболевания,которое необходимо лечить, возраст и относительное состояние здоровье пациента, эффективности использованного соединения, способа применения и формы введения, и других факторов. Терапевтически эффективные количества соединений формулы (I) могут находиться в диапазоне от приблизительно 0,1-1000 мг в день; преимущественно от 0,5 до 250 мг/день, более преимущественно 3,5 мг до 70 мг в день. В общем, соединения в соответствии с данным изобретением могут быть введены в виде фармацевтической композиции одним из следующих способов ведения: перорально, системно (например, трансдермально, интраназально или при помощи суппозитория), или перантерально (например, внутримышечно, внутривенно или подкожно). Преимущественный способ введения представляет собой пероральное введение с использованием традиционных режимов дозировок, которые могут быть отрегулированы в соответствии с тяжестью заболевания. Композиции могут также быть в форме таблеток, пилюль, кап- 20019206 сул, полутвердых веществ, порошков, композиций замедленного высвобождения, растворов, суспензий,эликсиров, аэрозолей или любых других соответствующих композиций. Выбор композиции зависит от различных факторов, таких как режим введения лекарственного средства (например, для перорального введения композиции в форме таблеток, пилюль или капсул являются преимущественными) и биодоступности лекарственного вещества. Недавно были разработаны фармацевтические композиции специально для лекарственных средств, которые проявляют низкую биодоступность, исходя из того принципа, что биодоступность может быть увеличена путем повышения площади поверхности, т.е., уменьшения размеров частиц. Например, в патенте США 4107288 описана фармацевтическая композиция, содержащая частицы в диапазоне размеров от 10 до 1,000 нМ, в которой подложкой активного материала является поперечно-сшитая матрица макромолекул. В патенте США 5145684 описано получение фармацевтической композиции, в которой лекарственное вещество размельчено до наночастиц (средний размер частицы 400 нМ) в присутствии модификатора поверхности, а затем диспергировано в жидкой среде с получением фармацевтической композиции, проявляющей значительно большую биодоступность. В общем композиции состоят из соединений в соответствии с данным изобретением в комбинации по меньшей мере с одним фармацевтически приемлемым эксципиентом. Приемлемые эксципиенты являются нетоксичными, способствуют введению и не оказывают неблагоприятное воздействие на терапевтический эффект соединений в соответствии с данным изобретением. Таким экспципиентом может быть любой твердый, жидкий, полутвердый или, в случае аэрозольной композиции, газообразный эксципиент, который в общем доступен специалисту в данной области. Твердые фармацевтические эксципиенты включают крахмал, целлюлозу, тальк, глюкозу, лактозу,сахарозу, желатин, мальт, пудру, мел, силикагель, стеарат магния, стеарат натрия, глицерил моностеарат,хлорид натрия, сухое снятое молоко и т.п. Жидкие и полутвердые эксципиенты могут быть выбраны из глицерина, пропиленгликоля, воды, этанола и различных масел, включая масло из нефти, животного,растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло, сезамовое масло, и т.п. Преимущественные жидкие носители, в особенности для растворов для инъекций, включают воду, солевой раствор, водную декстрозу и гликоли. Сжатые газы могут быть применены для диспергирования соединения в соответствии с данным изобретением в виде аэрозоля. Инертные газы, приемлемые для этого, представляют собой азот, диоксид углерода, и т.п. Другие приемлемые фармацевтические эксципиенты и их композиции описаны в Remington's Pharmaceutical Sciences, Gennaro, A. R. (Mack Publishing Company, 18th ed., 1995). Уровень соединения в композиции может варьироваться в полном диапазоне, который применят специалист в данной области. Типично, композиция содержит, исходя из массового процента (мас.%), от приблизительно 0,01-99,99 мас.% соединений в соответствии с данным изобретением, в расчете на всю композицию, где остаток составляют один или более фармацевтических приемлемых эксципиентов. Преимущественно соединение присутствует на уровне приблизительно 1-80 мас.%. Соединения могут быть введены как единственный активный агент или в комбинации с другими фармацевтическими агентами, такими как другие агенты, которые используют при лечении психозов, в особенности шизофрении и биполярного расстройства, обсессивно-компульсивного расстройства, болезни Паркинсона, болезни Альцгеймера, когнитивного расстройства и/или потери памяти, например, с агонистами никотина -7,ингибиторами PDE4, другими ингибиторами PDE10, блокаторами кальциевых каналов, мускариновыхm1 и m2 модуляторами, модуляторами аденозиновых рецепторов, ампакинами, HMDA-R модуляторами,mgluR модуляторами, модуляторами допамина, модуляторами серотонина, модуляторами каннабиноидов и ингибиторами холинэстеразы (например, донепизилом, ривастигимином и галантанамином). В таких комбинациях каждый активный ингредиент может быть введен либо в соответствии с его обычным диапазоном дозировок, или в дозе, меньшей его обычного диапазона дозировок, и может быть введен одновременно или последовательно. Лекарственные средства, примлемые с комбинации с соединениями в соответствии с данным изобретением, включают, не ограничиваясь приведенным, другие приемлемые лекарственные средства от шизофрении, например, клозарил, зипрекса, рисперидон и сероквел; лекарственные средства от биполярного расстройства, включая, не ограничиваясь приведенным, литий, зипрекса и депакот; лекарственные средства от болезни Паркинсона, включая, не ограничиваясь приведенным, леведопу, парлодель,пермакс, мирапекс, тасмар, контан, кемадин, артан и когентин; агенты, которые используют при лечении болезни Альцгеймера, включая, не ограничиваясь приведенным, реминил, когнекс, арицепт, экселон,акатинол, неотропин, элтедеприл, эстроген и кликинол; агенты, которые используют при лечении деменции, включая, не ограничиваясь приведенным, тиоридазин, галоперидол, рисперидон, когнекс, арицепт,и экселон; агенты, которые используют при лечении эпилепсии, включая, не ограничиваясь приведенным, дилантин, люминол, тегретол, депакот, депакен, заронтин, нейронтин, барбита, солфетон и фелбатол; агенты, которые используют при лечении рассеянного склероза, включая, не ограничиваясь приведенным, детрол, дитропан XL, оксиконтин, бетасерон, авонекс, азотиоприн, метотрексат и копаксон; агенты, которые используют при лечении болезни Хантингтона, включая, не ограничиваясь приведенным, амитриптилин, имипрамин, деспирамин, нортриптилин, парокстеин, флуокстеин, сетралин, терабе- 21019206 назин, галоперидол, хлорпромазин, тиоридазин, сульприд, кветиапин, клозапин и рисперидон; агенты,которые используют при лечении диабета, включая, не ограничиваясь приведенным, лиганды РАПП (рецептора, активируемого пролифератором пероксисом) (например, агонисты, антагонисты, например, розиглитазон, троглитазон и пиоглитазон), стимуляторы секреции инсулина (например, лекарственные средства на основе сульфонилмочевины, такие как глибурид, глимепирид, хлорпропамид, толбутамид, и глипизид, и несульфонильные стимуляторы секреции), ингибиторы -глюкозидазы (такие как акарбоза,миглитол и воглибоза), агенты, сенсибилизирующие инсулин (такие как РАПП- агонисты, например,глитазоны; бигуаниды, ингибиторы РТР-1B, ингибиторы DPP-IV и ингибиторы 11 бета-HSD), соединения, понижающие выработку глюкозы печенью (например, антагонисты глюкагона и метаформин, например, глюкофаг и глюкофаг XR), инсулин и производные инсулина (как формы длительного, так и формы короткого действия и композиции инсулина); и лекарственные средства против ожирения, включая, не ограничиваясь приведенным, -3 агонисты, СВ-1 агонисты, ингибиторы нейропептида Y5, цилиарный нейротрофический фактор и производные (например, аксокин), подавители аппетита (например,сибутрамин) и ингибиторы липаз (например, орлистат). Экспериментальная часть В следующих схемах, соединения в соответствии с данным изобретением, вместе с их определениями, например, m, n, p, R1, R2, R3, R4, X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11,Y и Z, являются такими,как описано ниже. Если не указано иное, все материалы получены от коммерческих постащиков и использованы без дополнительной очистки. Все части приведены по массе и температуры выражены в градусах Цельсия,если не указано иное. Все реакции с использованием сверхвысоких частот проводили на синтезатореSmith Synthesizer от Biotage. Все соединения имели НМР спектры, которые соответствовали их приписанным структурам. Точки кипения определяли на приборе Buchi и не корректировали. Данные массспектров определяли путем способа электроспрей ионизации. Все примеры были очищены до 90% чистоты в соответствии с данными высокоэффективной жидкостной хроматографии. Если не указано иное,реакции проводили при комнатной температуре. Использовали следующие сокращения: Все соединения были разделены на пять классов в зависимости от их значений IC50 по отношению к"+" обозначает IC50 значение в диапазоне, который начинается от 1,0 мкМ и заканчивается при 5,0 мкМ; обозначает IC50 значение в диапазоне, который начинается от 250 нМ и заканчивается при 1,0 мкМ; обозначает IC50 значение в диапазоне, который начинается от 100 нМ и заканчивается при 250 нМ; обозначает IC50 значение в диапазоне, который начинается от 25 нМ и заканчивается при 100 нМ; и(1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-МОРФОЛИНОПИРАЗИН-2-ИЛОКСИ)ФЕ СТАДИЯ 1. ЭТИЛ 4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)БЕНЗОАТ. К раствору этилового эфира 4-гидроксибензойной кислоты (55,21 г, 332,3 ммоль) и 2,3 дихлорпиразина (49,50 г, 332,3 ммоль) в ДМСО (300 мл) добавляли карбонат цезия (129,9 г, 398,7 ммоль). Смесь нагревали до 70 С до израсходования исходного вещества. Смесь охлаждали до комнатной температуры, разбавляли водой и ДХМ, слои разделяли и водный слой экстрагировали ДХМ (2). Соединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Неочищенный материал промывали большими количествами метанола и высушивали с получением этил 4-(3-хлорпиразин-2-илокси)бензоата. СТАДИЯ 2. (1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ)МЕТАНОН. Раствор бензол-1,2-диамина (1,5 г, 14 ммоль), триэтил ортоформиата (5,7 мл, 37 ммоль) и бензолсульфоновой кислоты (0,075 г, 0,47 ммоль) в толуоле (15 мл) нагревали с обратным холодильником в течение 4 ч и затем медленно перегоняли для удаления половины растворителя. Смесь затем охлаждали до комнатной температуры и нейтрализовали диизопропиламином, с последующим добавлением раствора этил 4-(3-хлорпиразин-2-илокси)бензоата (4,3 г, 15 ммоль) в ТГФ (15 мл). Смесь охлаждали до -78 С и добавляли 1,2 эквив. диизопропиламида лития (9,2 мл, 17 ммоль). После выдерживания при -78 С в течение 1,5 ч смесь нагревали до комнатной температуры через 1,5 ч и затем добавляли 2N HCl и смесь перемешивали в течение 30 мин. После этого смесь доводили до значения рН 9 и 1N NaOH. Этилацетат добавляли и слои разделяли, водный слой экстрагировали этилацетатом (3) и соединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. После обработки МеОН желтое твердое вещество измельчали, фильтровали и собирали с получением СТАДИЯ 3. (1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-МОРФОЛИНОПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ)МЕТАНОН. Раствор (1 Н-бензо[d]имидазол-2-ил)(4-(3-хлорпиразин-2-илокси)фенил)метанон (23,00 г, 65,6 ммоль) и морфолина (17,2 мл, 197 ммоль) нагревали до 90 С в ДМСО (165 мл). После полного израсходования исходного вещества, горячий раствор добавляли по каплям в ледяную воду, что приводило к осаждению желтого твердого вещества. Твердое вещество суспендировали в кипящем EtOH (600 мл) и достаточное количество тетрагидрофурана добавляли для полного растворения твердых веществ. Раствор переносили в низкотемпературный шкаф для кристаллизации. Твердое вещество собирали путем фильтрования и сушили на воздухе с получением (1H-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2 илокси)фенил)метанона. МС (ЭСИ, поз. ион) m/z: 402,1 (М+1). IC50 (мкМ) . СТАДИЯ 1. N-МЕТОКСИ-N-МЕТИЛПИПЕРИДИН-4-КАРБОКСАМИД. К смеси пиперидин-4-карбоновой кислоты (100 г, 775 ммоль) в 1,4-диоксане (400 мл) и воде (100 мл) добавляли триэтиламин (135 мл, 969 ммоль) при 25-30 С и перемешивали в течение 15 мин. Затем добавляли 110 г трет-бутоксикарбонильного ангидрида. Смесь перемешивали всю ночь при той же температуре. После завершения реакции растворитель удаляли в вакууме. Остаток очищали путем разбавления EtOAc и промывания Н 2 О (1000 мл). Органический слой высушивали над безводным сульфатом натрия и концентрировали в вакууме с получением продукта - 1-(трет-бутоксикарбонил)пиперидин-4 карбоновой кислоты. К раствору 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты (50 г, 218 ммоль) в ДХМ(500 мл) добавляли 1,1-карбонилдиимидазол (46 г, 284 ммоль) и реакционную смесь перемешивали в течение 1 ч при 25-30 С. N,O-Диметилгидроксиламин гидрохлорид (30 г, 306 ммоль) затем добавляли и полученную в результате смесь перемешивали в течение 15 ч при 25-30 С. После завершения реакции реакционную смесь разбавляли ДХМ и промывали водой, насыщенным NaHCO3 раствором и 10% NaOH раствором. Органический слой высушивали над безводным сульфатом натрия и концентрировали в вакууме с получением чистого продукта - трет-бутил 4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата. К раствору трет-бутил 4-(метокси(метил)карбамоил)пиперидин-1-карбоксилата (50 г, 182 ммоль) в ДХМ (400 мл) добавляли трифторуксусную кислоту (150 мл) и полученную в результате смесь перемешивали в течение 6 ч при 25-30 С. После завершения реакции растворитель удаляли при сниженном давлении с получением 40 г N-метокси-N-метилпиперидин-4-карбоксамидного продукта. [М+1] = 173,04. СТАДИЯ 2. 1-БЕНЗИЛ-N-МЕТОКСИ-N-МЕТИЛПИПЕРИДИН-4-КАРБОКСАМИД. К раствору N-метокси-N-метилпиперидин-4-карбоксамида (40 г, 232 ммоль) в ацетоне (400 мл) добавляли бензилбромид (42 мл, 349 ммоль) и K2CO3 (64 г, 465 ммоль) и реакционную смесь перемешивали при 80 С с обратным холодильником в течение 16 ч. После завершения реакции реакционную смесь фильтровали и ацетон удаляли при сниженном давлении. Остаток очищали при помощи колоночной хроматографии на силикагеле (элюировали 50% этилацетат в гексане) с получением 1-бензил-N-метокси- 24019206 СТАДИЯ 3. 1-(1-БЕНЗИЛПИПЕРИДИН-4-ИЛ)ЭТАНОН. К перемешанному раствору 1-бензил-N-метокси-N-метилпиперидин-4-карбоксамида (11,5 г, 44 ммоль) в диэтиловом эфире (150 мл) при 0 С добавляли метил магний бромид (15,7 г, 132 ммоль), по каплям более 10 мин. Полученную в результате смесь перемешивали при 25-30 С в течение 2 ч. После завершения реакции смесь обрабатывали EtOAc насыщенным раствором NH4Cl. Отделенный органический слой промывали солевым раствором и высушивали над безводным сульфатом натрия и концентрировали в вакууме с получением 1-(1-бензилпиперидин-4-ил)этанонового продукта. [М+1] = 218,1. СТАДИЯ 4. 2-(1-БЕНЗИЛПИПЕРИДИН-4-ИЛ)-1,1,1-ТРИФТОРПРОПАН-2-ОЛ. К перемешанному раствору ацетата калия (0,19 г, 1 ммоль) в диметилформамиде (2 мл) добавляли раствор 1-(1-бензилпиперидин-4-ил)этанона (0,5 г, 2,3 ммоль) в диметилформамиде (2 мл) и CF3SiMe3(0,67 мл, 4,6 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции реакционную смесь гасили насыщенным водным NH4Cl раствором. Смесь экстрагировали этилацетатом и высушивали над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле с получением 1-бензил-4-(1,1,1 трифтор-2-(триметилсилилокси)пропан-2-ил)пиперидинового продукта. К перемешанному раствору 1-бензил-4-(1,1,1-трифтор-2-(триметилсилилокси)пропан-2-ил)пиперидина (3 г, 8,3 ммоль) в ТГФ (30 мл) тетрабутиламмоний хлорид (3,2 г, 12,4 ммоль) медленно добавляли при комнатной температуре. Реакционную смесь перемешивали в течение 3 ч. После завершения реакции смесь гасили насыщенным раствором аммоний хлорида, экстрагировали этилацетатом. Органический слой промывали солевым раствором и высушивали над безводным сульфатом натрия и концентрировали в вакууме с получением 2-(1-бензилпиперидин-4-ил)-1,1,1-трифторпропан-2-ольного продукта. СТАДИЯ 5. 1,1,1-ТРИФТОР-2-(ПИПЕРИДИН-4-ИЛ)ПРОПАН-2-ОЛ. К перемешанному раствору 2-(1-бензилпиперидин-4-ил)-1,1,1-трифторпропан-2-ола в метаноле (25 мл) палладий на углероде (150 мг, 3,26 ммоль) добавляли в атмосфере азота. Полученную в результате смесь перемешивали с обратным холодильником в течение 6 ч при 65 С. После завершения реакции смесь фильтровали и концентрировали в вакууме с получением 1,1,1-трифтор-2-(пиперидин-4 ил)пропан-2-ола. [М+Н] = 198,06.(1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ)МЕ СТАДИЯ 1. ЭТИЛ 4-(4-МЕТОКСИБЕНЗИЛОКСИ)БЕНЗОАТ. К перемешанному раствору этил 4-гидроксибензоата (530 г, 3,19 моль) в ДМФ (6 л) добавляли порошок K2CO3 (1102 г, 7,97 моль, 2,5 экв.), NaI (1195 г, 7,97 моль, 2,5 экв.) и РМВ-С 1 (599,4 г, 3,83 моль,1,2 экв.) при температуре окружающей среды. Реакционную смесь нагревали при 50 С всю ночь в атмосфере азота. Реакционную смесь охлаждали до температуры окружающей среды и ледяную воду (9 л) добавляли в реакционную смесь. Полученное в результате твердое вещество фильтровали и промывали водой (5 л), высушивали при 40 С в вакууме с получением продукта. СТАДИЯ 2. (1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(4-МЕТОКСИБЕНЗИЛОКСИ)ФЕНИЛ)МЕТАНОН. Раствор бензимидазола (450 г, 3,81 моль), триэтил ортоформиата (1129,3 г, 7,62 моль, 2,0 экв.) и бензолсульфоновой кислоты (16 г) в толуоле (4 л) нагревали с обратным холодильником и половину растворителя удаляли путем перегонки. Снова добавляли толуол (3 л) добавляли и 2 л удаляли путем медленной перегонки. Реакционную смесь охлаждали, нейтрализовали диизопропиламином (55 мл), и к ней добавляли ТГФ (4 л) и 2 (1200 г, 4,2 моль, 1,1 экв.). Смесь охлаждали до -78 С и к ней добавляли диизопропиламид лития (2,2 л, 2 М в ТГФ/гексане/этилбензоле 4, моль, 1,2 экв.) по каплям в течение 3 ч. После добавления реакционную смесь перемешивали при -78 С в течение 2 ч. Затем ее нагревали до температуры окружающей среды, 2N водной HCl (3,9 л) добавляли и смесь перемешивали в течение 2 ч. Слои разделяли, органический слой промывали 10% водным NaHCO3 раствором и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением 2177 грамм неочищенного продукта в виде масла. К данному неочищенному веществу добавляли МТВЕ (3 л) и гексан (250 мл) и оставляли всю ночь в холодном помещении. Полученное в результате твердое вещество фильтровали и промывали МТВЕ, с последующим промыванием 10% EtOAC/гексаном с получением продукта. СТАДИЯ 3. (1H-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-ГИДРОКСИФЕНИЛ)МЕТАНОН. К суспензии соединения (1 Н-бензо[d]имидазол-2-ил)(4-(4-метоксибензилокси)фенил)метанона (268 г, 0,75 моль) в дихлорметане (2,7 л) при температуре окружающей среды добавляли ТФК (289 мл, 3,75 моль, 5,0 экв.) медленно при помощи воронки. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Анализ ЖХМС реакционной смеси выявил, что реакция прошла полно- 26019206 стью. Реакционную смесь нейтрализовали насыщенным водным раствором NaHCO3 до рН 7-8 и перемешивали в течение 20 мин. Полученное в результате твердое вещество фильтровали и промывали водой и высушивали в вакуумной печи при 45 С с получением продукта. СТАДИЯ 4. (1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ)МЕТАНОН. К раствору соединения (1 Н-бензо[d]имидазол-2-ил)(4-гидроксифенил)метанона (100 г, 0,42 моль) в безводном ДМФ (1,1 л) добавляли K2CO3 (145 г, 1,05 моль, 2,5 экв.) и 2, 3-дихлорпиразина (75,08 г, 0,50 моль, 1,2 экв.). Реакционную смесь перемешивали при 90 С в течение 18 ч. Анализ ЖХМС реакционной смеси показал, что реакция прошла полностью. Реакционную смесь охлаждали до температуры окружающей среды и ледяную воду (3 л) добавляли, перемешивали в течение 30 мин. Полученное в результате твердое вещество фильтровали и промывали водой (3 л) с последующим промыванием МТВЕ (2500 мл) и высушивали в вакууме. Твердое вещество обрабатывали 50% МТВЕ/ДХМ при 50 С в течение 1 ч и фильтровали в горячем состоянии, промывали 50% МТВЕ/ДХМ и высушивали в вакууме всю ночь с получением продукта. Материнский раствор перегоняли с обратным холодильником с 50% МТВЕ/ДХМ в течение 2 ч и фильтровали горячим и промывали 50% МТВЕ/ДХМ с получением другой партии продукта. МС (ЭСИ, поз. ион) m/z: 351,0 (М+1). IC50(мкМ) +. СХЕМА 3[4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ]-(6-ФТОР-1 Н-БЕНЗОИМИДАЗОЛ-2 СТАДИЯ 1. 6-ФТОР-1H-БЕНЗОИМИДАЗОЛ. К раствору 4-фторбензол-1,2-диамина (10 г, 79,4 ммоль) и триэтилортоформиата (117 мл, 793 ммоль) добавляли несколько капель этанола и реакционную смесь перегоняли с обратным холодильником при 150 С всю ночь. Реакционную смесь концентрировали и остаток непосредственно переносили на следующую стадию. [М+Н]=137.- 27019206 перемешивали при комнатной температуре всю ночь. Затем реакционную смесь разбавляли ДХМ (100 мл) и промывали водой (350 мл). Органический слой высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали при помощи силикагелевой колонки (100-200 меш) с использованием 5-10% этилацетат-гексана в качестве элюента с получением целевого соединения. [М+Н] = 237. СТАДИЯ 3. [4-(3-ХЛОРПИРАЗИН-2-ИЛОКСИ)ФЕНИЛ]-(6-ФТОР-1 Н-БЕНЗОИМИДАЗОЛ-2-ИЛ) МЕТАНОН. Раствор этилового эфира 4-(3-хлорпиразин-2-илокси)бензойной кислоты (20 г, 84,7 ммоль) и третбутилового эфира 6-фтор бензоимидазол-1-карбоновой кислоты (21,2 г, 76,3 ммоль) в свежевысушенном ТГФ (150 мл) охлаждали до -78 С. К нему медленно добавляли LiHMDS (106 мл, 106 ммоль), добавляли в течение около 1,2 ч. Реакционную смесь перемешивали при той же температуре в течение 3,5 ч. Реакционную смесь доводили до -20 С и медленно гасили путем добавления 2N HCl до достижения рН 3-4. Полученную в результате смесь перемешивали при комнатной температуре в течение 1 ч, экстрагировали этилацетатом (3200 мл) и промывали водой (2100 мл). Органический слой высушивали (Na2SO4) и концентрировали. В неочищенный продукт добавляли метанол (70 мл). После перемешивания в течение 1 часа, твердое вещество собирали путем фильтрования с получением целевого соединения. МС (ЭСИ,поз. ион) m/z: 369,2 (М+1). IC50 (мкМ) +. СХЕМА 4(1-МЕТИЛ-1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-МОРФОЛИНОПИРАЗИН-2 ИЛОКСИ)ФЕНИЛ)МЕТАНОН. К суспензии (1 Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)-метанона, полученного в соответствии со Схемой 3, (0,2 г, 0,5 ммоль) в ДМФ (1 мл) добавляли карбонат цезия (0,2 г, 0,7 ммоль) и йодметан (0,04 мл, 0,6 ммоль). Полученную в результате смесь перемешивали при комнатной температуре всю ночь. ЖХ/МС показывала полное превращение. Соединение измельчали в МеОН. Фильтровали полученное в результате оранжевое твердое вещество и промывали большими количествами МеОН. Твердые вещества высушивали при помощи вакуумного насоса всю ночь с получением (1 метил-1 Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона. МС (ЭСИ, поз. ион) m/z: 416,1. (М+1). IC50 (мкМ) . ПРИМЕР 6. (1-ИЗОПРОПИЛ-1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)(4-(3-МОРФОЛИНОПИРАЗИН-2 ИЛОКСИ)ФЕНИЛ)МЕТАНОН. Смесь (1H-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона (115 мг, 286 мкмоль), карбоната калия (79,2 мг, 573 мкмоль) и 2-йодпропана (97,4 мг, 573 мкмоль) в ДМФ (2 мл) перемешивали всю ночь. Дополнительный изопропил йодид добавляли до израсходования исходного материала. Смесь разбавляли водой и этилацетатом. Слои разделяли и водный слой экстрагировали этилацетатом и соединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи Biotage, 10-30% ацетон/гексановый градиент, с получением (1-изопропил-1H-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил) ПРИМЕР 7. 4-(3-(4-1 Н-БЕНЗО[D]ИМИДАЗОЛ-2-ИЛ)ДИФТОРМЕТИЛ)ФЕНОКСИ)ПИРАЗИН-2 ИЛ)МОРФОЛИН. Раствор (1 Н-бензо[d]имидазол-2-ил)(4-(3-морфолинопиразин-2-илокси)фенил)метанона (155 мг,0,387 ммоль) в хлороформе (15,500 мл) охлаждали до 0 С и добавляли DAST (1,023 мл, 7,74 ммоль). Ледяную баню удаляли и реакционной смеси позволяли нагреваться до комнатной температуры. Реакцию гасили водой и смесь разбавляли дихлорметаном. После разделения слоев водный слой экстрагировали ДХМ. Соединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи хроматографии на силикагеле с получением 4(3-(4-1H-бензо[d]имидазол-2-ил)дифторметил)фенокси)пиразин-2-ил)морфолина. МС (ЭСИ, поз. ион)
МПК / Метки
МПК: C07D 413/14, C07D 409/14, A61K 31/497, C07D 403/12, C07D 471/04, A61P 25/16, C07D 407/14, A61P 25/18, C07D 403/14, C07D 417/14
Метки: фосфодиэстеразы, пиразиновые, ингибиторов, соединения, качестве
Код ссылки
<a href="https://eas.patents.su/30-19206-pirazinovye-soedineniya-v-kachestve-ingibitorov-fosfodiesterazy-10.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразиновые соединения в качестве ингибиторов фосфодиэстеразы 10</a>
Предыдущий патент: Стопор рельсового колеса
Следующий патент: Передвижная дверь холодильной камеры
Случайный патент: Концентрированная гербицидная композиция