Соединения, эффективные в качестве агонистов &beta- 2 – адренорецептора и ингибиторов фосфодиэстеразы pde4
Номер патента: 5824
Опубликовано: 30.06.2005
Авторы: Ван-Дер-Лан Ивонне, Тиммерманн Хендрик, Стерк Герт, Эльтце Манфрид, Бундшу Даниела, Хатцельманн Армин, Брундель Паулус, Кристианс Йоханнес
Формула / Реферат
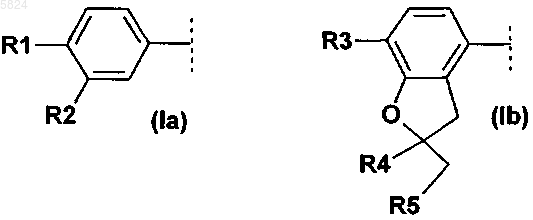
1. Соединения формулы I
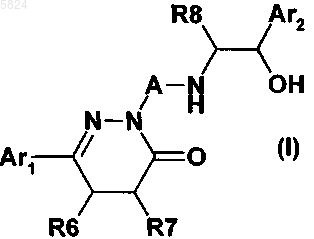
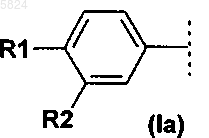
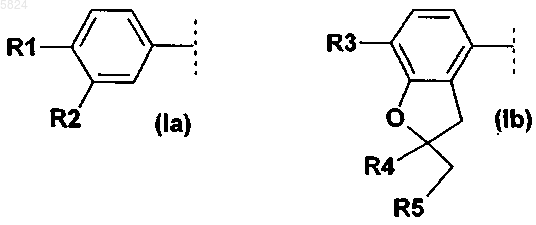
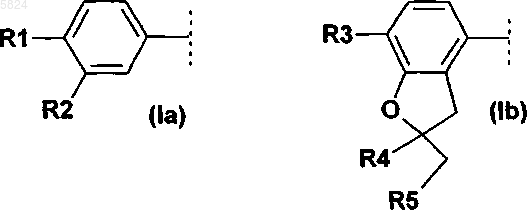
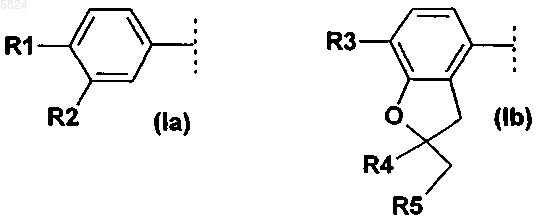
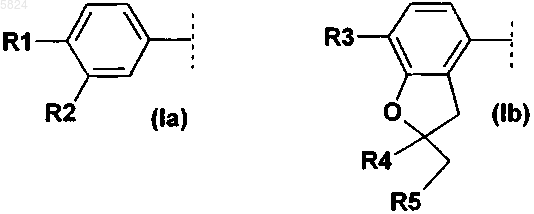
где Ar1означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5

где R1 означает C1-C4алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R2 означает C1-C8алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R3 означает C1-C4алкокси,
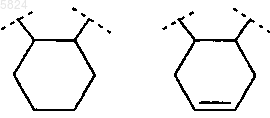
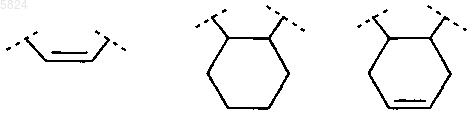
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанный 5-, 6- или 7-членный углеводородный цикл,
R6 и R7, независимо друг от друга, каждый означает водород или C1-C4алкил или
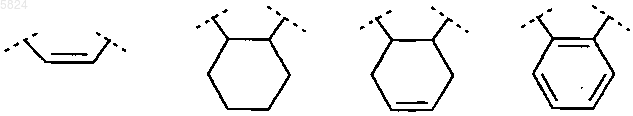
R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
где A означает -CmH2m-Y-X-CnH2n- или -Y-X-CmH2m-Z-CnH2n-, где
X означает химическую связь, -O- (кислород), -C(O)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,
Y означает химическую связь, фенилен или азациклоалкилен,
Z означает химическую связь, -S- или -S(O)2-,
m означает целое число от 0 до 4,
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил, амино или формиламино,
R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,
R11 означает водород или галоген, и соли указанных соединений.
2. Соединения формулы I по п.1, где Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
где R1 означает C1-C4алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R2 означает C1-C4алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R3 означает C1-C4алкокси,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое или циклогексановое кольцо,
R6 и R7, независимо друг от друга, каждый означает водород или C1-C4алкил, или
R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
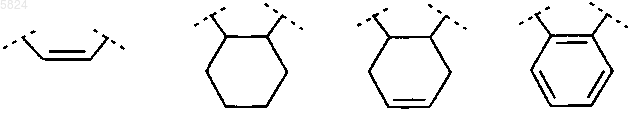
и A или означает -CmH2m-Y-X-CnH2n-, где
X означает химическую связь,
Y означает химическую связь,
m означает целое число от 1 до 4 и
n означает целое число от 1 до 4, или
X означает химическую связь, -O-, -C(O)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,
Y означает 1,4-фенилен,
m означает целое число от 0 до 4 и
n означает целое число от 1 до 4, или X означает химическую связь, -C(O)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,
Y означает 4,1-пиперидинилен,
m равно 0 и
n означает целое число от 1 до 4, или
A означает -Y-X-CmH2m-Z-CnH2n-, где
X означает химическую связь, -C(O)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,
Y означает 4,1-пиперидинилен,
Z означает химическую связь, -S- или -S(O)2-,
m означает целое число от 1 до 4 и
n означает целое число от 1 до 4, или
X означает химическую связь, -O-, -C(O)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,
Y означает 1,4-фенилен,
Z означает химическую связь, -S- или -S(O)2-,
m означает целое число от 1 до 4,
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил, амино или формиламино [-NH-C(O)H], R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,
R11 означает водород или галоген,
и соли указанных соединений.
3. Соединения формулы I по п.1, где
Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
где R1 означает C1-C2алкокси или C1-C2алкокси, который полностью или преимущественно замещен фтором,
R2 означает C1-C2алкокси или C1-C2алкокси, который полностью или преимущественно замещен фтором,
R3 означает C1-C2алкокси,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спираносвязанное циклопентановое или циклогексановое кольцо,
R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
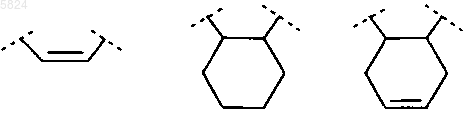
и A или означает -CmH2m-Y-X-CnH2n-, где или
X означает химическую связь,
Y означает химическую связь,
m означает целое число от 1 до 4,
n означает целое число от 1 до 4, или
X означает химическую связь, -O- или -C(O)-NH-,
Y означает 1,4-фенилен,
m означает целое число от 0 до 4 и
n означает целое число от 1 до 4, или
X означает химическую связь, -C(O)-, -S(O)2- или -C(S)-NH-,
Y означает 4,1-пиперидинилен,
m равно 0, и
n означает целое число от 1 до 4, или
A означает -Y-X-CmH2m-Z-CnH2n-, где
X означает химическую связь или -C(O)-,
Y означает 4,1-пиперидинилен,
Z означает химическую связь, -S- или -S(O)2-,
m означает целое число от 1 до 4 и
n означает целое число от 1 до 4, или
X означает химическую связь, -O- или -C(O)-NH-,
Y означает 1,4-фенилен,
Z означает химическую связь,
m означает целое число от 1 до 4 и
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенильный радикал, замещенный R9, R10 и R11, причем
R9 означает водород, гидроксил или амино,
R10 означает водород, галоген, циано, трифторметил или гидроксиметил,
R11 означает водород или галоген,
и соли указанных соединений.
4. Соединения формулы I по п.1, где
Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
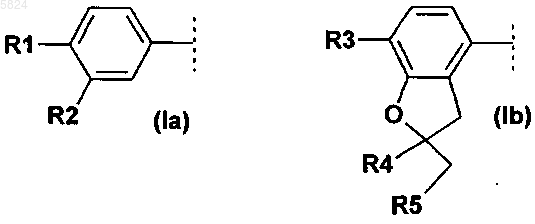
где R1 означает метокси или этокси,
R2 означает метокси или этокси,
R3 означает метокси,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое кольцо,
R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
и A или означает -CmH2m-Y-X-CnH2n-, где или
X означает химическую связь,
Y означает химическую связь,
m означает целое число от 1 до 4,
n означает целое число от 1 до 4, или
X означает химическую связь, -O- или -C(O)-NH-,
Y означает 1,4-фенилен,
m означает целое число от 0 до 1 и
n означрхт целое число от 1 до 4, или
X означает химическую связь, -C(O)-, -S(O)2- или -C(S)-NH-,
Y означает 4,1-пиперидинилен,
m равно 0, и
n означает целое число от 1 до 4, или
A означает -Y-X-CmH2m-Z-CnH2n-, где
X означает химическую связь или -C(O)-,
Y означает 4,1-пиперидинилен,
Z означает химическую связь, -S- или -S(O)2-,
m равно 2 или 3 и
n равно 2 или 3,
R8 означает водород,
Ar2 означает фенил, 4-амино-3-хлор-5-цианофенил, 4-амино-3-хлор-5-трифторметилфенил, 4-гидрокси-3-гидроксиметилфенил, 4-амино-3-цианофенил или 4-амино-3,5-дихлорфенил,
и соли указанных соединений.
5. Соединения формулы I по п.1, где
Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
где R1 означает C1-C4алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R2 означает C1-C8алкокси или C1-C4алкокси, который полностью или преимущественно замещен фтором,
R3 означает C1-C4алкокси,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосоединенное 5-, 6- или 7-членное углеводородное кольцо,
R6 и R7, независимо друг от друга, каждый означает водород или C1-C4алкил, или R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
где A означает -(CH2)m-Y-X-(CH2)n-, где
X означает химическую связь, -O- (кислород), -C(O)- или -C(O)-NH-,
Y означает химическую связь, фенилен или азациклоалкилен,
m означает целое число от 0 до 4,
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил, амино, формиламино,
R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,
R11 означает водород или галоген,
и соли указанных соединений.
6. Соединения формулы I по п.1, где
Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
где R1 означает C1-C2алкокси или C1-C2алкокси, который полностью или преимущественно замещен фтором,
R2 означает C1-C2алкокси или C1-C2алкокси, который полностью или преимущественно замещен фтором,
R3 означает C1-C2алкокси или C1-C2алкокси, который полностью или преимущественно замещен фтором,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое или циклогексановое кольцо,
R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда
A означает -(CH2)m-Y-X-(CH2)n-, где
X означает химическую связь или -C(O)-,
Y означает химическую связь, 1,4-фенилен или 4,1-пиперидинилен,
m означает целое число от 0 до 4,
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил или амино,
R10 означает водород, галоген, циано, трифторметил или гидроксиметил,
R11 означает водород или галоген,
и соли указанных соединений.
7. Соединения формулы I по п.1, где
Ar1 означает фенильный радикал формулы (Ia), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5
где R1 означает метокси, этокси или дифторметокси,
R2 означает метокси или этокси,
R3 означает метокси,
R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосоединенное циклопентановое кольцо,
R6 и R7 вместе, включая два атома углерода, к которым они присоединены,
образуют группу, выбранную из ряда

A означает -(CH2)m-Y-X-(CH2)n-, где
X означает химическую связь,
Y означает химическую связь или 1,4-фенилен,
m означает целое число от 0 до 4,
n означает целое число от 1 до 4,
R8 означает водород,
Ar2 означает фенил, 4-амино-3-хлор-5-цианофенил, 4-амино-3-хлор-5-трифторметилфенил, 4-гидрокси-3-гидроксиметилфенил, 4-амино-3-цианофенил или 4-амино-3,5-дихлорфенил,
и соли указанных соединений.
8. Фармацевтическая композиция, обладающая селективным PDE4-ингибирующим действием и агонистическим действием в отношении b2-адренорецептора, содержащая одно или более соединений формулы I по п.1 в смеси с обычными фармацевтическими добавками и /или носителями и предназначенная для лечения заболеваний воспалительного характера, например, дыхательных путей или для терапии обструктивных заболеваний дыхательных путей.
9. Применение соединений формулы I по п.1 для приготовления фармацевтической композиции, предназначенной для приготовления лекарственных средств для лечения заболеваний дыхательных путей.
Текст
005824 Область техники Изобретение относится к новым соединениям, которые действуют одновременно как агонист 2 адренорецептора и ингибитор фосфодиэстеразы PDE4. Указанные соединения используют в фармацевтической промышленности для получения лекарственных средств. Уровень техники В международных заявках WO 98/31674, WO 99/31071 и WO 99/31090 описаны производные фталазинона, обладающие свойствами селективных ингибиторов PDE4. В международной заявке WO 94/12461 и в европейской заявке ЕР 0763534 описаны 3-арилпиридазин-6-он и соответственно производные арилалкилдиазинона в качестве селективных ингибиторов PDE4. В международной заявке WO 98/37894 описано совместное применение ингибиторов PDE с агонистами аденилатциклазы. В связи с этим 3-симпатомиметические средства рассматриваются как первый возможный пример агониста аденилатциклазы. В международной заявке WO 00/12078 описано совместное применение ингибитора PDE4 с бетаадренергическим бронхолитическим средством для лечения астмы и хронического обструктивного заболевания легких (COPD). Описание изобретения В настоящее время установлено, что пиридазиноны, более подробно описанные ниже, обладают неожиданными и, прежде всего, полезными свойствами. Таким образом, изобретение относится к соединениям формулы IAr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5, гдеR1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 8 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором, R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосоединенное 5-, 6- или 7-членное углеводородное кольцо,R6 и R7 независимо друг от друга каждый означает водород или С 1-С 4 алкил, или R6 и R7 вместе,включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь, -О- (кислород), -С(О)-, -S(O)2-, -C(O)-NH-, или C(S)-NH-,Y означает химическую связь, фенилен или азациклоалкилен,Z означает химическую связь или -S-, или -S(O)2-,m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, гдеR11 означает водород или галоген; и к солям указанных соединений. Алкил с числом атомов углерода С 1-С 4 означает прямой или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода, примерами которого являются радикалы бутил, изобутил, вторбутил, трет-бутил, пропил, изопропил, этил и метил. Термин галоген, используемый в тексте заявке, означает хлор, бром или фтор. Алкоксил с числом атомов углерода С 1-С 4 означает радикал, который кроме атома кислорода, содержит прямой или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода. Примеры радикалов алкокси, содержащих от 1 до 4 атомов углерода, которые могут быть упомянуты в данном контексте, включают, например, радикалы бутокси, изобутокси, втор-бутокси, трет-бутокси, пропокси,изопропокси, этокси и метокси. С 1-С 4 алкокси, полностью или преимущественно замещенный фтором, означает, например, радикалы 2,2,3,3,3-пентафторпропокси, перфторэтокси, 1,2,2-трифторэтокси и, прежде всего, 1,1,2,2 тетрафторэтокси, 2,2,2-трифторэтокси, трифторметокси и дифторметокси, из которых предпочтителен радикал дифторметокси. В связи с этим термин преимущественно означает, что в С 1-С 4 алкоксигруппе более половины атомов водорода замещены атомами фтора. Примерами спирановоприсоединенных 5-, 6- и 7-членных углеводородных циклов являются циклопентан, циклогексан, циклогептан. Возможными радикалами -(СН 2)m-, в которых m может иметь значения 0, 1, 2, 3 или 4, являются двухвалентные алкиленовые радикалы с прямой или разветвленной цепью, примерами которых являются радикалы бутилен, изобутилен, втор-бутилен, трет-бутилен, пропилен, изопропилен, этилен и метилен. Если m равен 0, радикал -(СН 2)m- означает химическую связь. Возможными радикалами -CmH2m-, в которых m может иметь значения 0, 1, 2, 3 или 4, являются двухвалентные алкиленовые радикалы с прямой или разветвленной цепью, примерами которых являются радикалы бутилен, изобутилен, втор-бутилен, трет-бутилен, пропилен, изопропилен, этилен и метилен. Если m равен 0, радикал -CmH2m- означает химическую связь. Возможными радикалами -(СН 2)n-, в которых n может иметь значения 1, 2, 3 или 4, являются двухвалентные алкиленовые радикалы с прямой или разветвленной цепью, примерами которых являются радикалы бутилен, изобутилен, втор-бутилен, трет-бутилен, пропилен, изопропилен, этилен и метилен. Возможными радикалами -СnН 2n-, в которых n может иметь значения 1, 2, 3 или 4, являются двухвалентные алкиленовые радикалы с прямой или разветвленной цепью, примерами которых являются радикалы бутилен, изобутилен, втор-бутилен, трет-бутилен, пропилен, изопропилен, этилен и метилен. Радикал С 1-С 4 алкилкарбониламино означает, например, радикал пропиониламино [С 3 Н 7 С(О)NН-] и ацетиламино [СН 3 С(О)NН-]. Азациклоалкилен означает двухвалентный С 5-С 7 циклоалкиленовый радикал, в котором один или два атома углерода в цикле замещены на атом азота. Примерами являются радикалы 4,1-пиперидинилен,1,4-пиперидинилен, 1,4-гомопиперазинилен, 1,4-пиперазинилен и 3,1-пирролидинилен. Радикалы моно- или ди(С 1-С 4)алкиламино содержат, кроме атома азота, один или два вышеуказанных С 1-С 4 алкильных радикала. Примерами являются радикалы ди(С 1-С 4)алкиламино, прежде всего, радикалы диметиламино, диэтиламино и диизопропиламино. С 1-С 4 алкокси(С 1-С 4)алкил означает один из вышеупомянутых С 1-С 4 алкильных радикалов, который замещен одним из вышеупомянутых радикалов С 1-С 4 алкокси. Примерами являются радикалы метоксиметил, метоксиэтил и бутоксиэтил. Аr2 означает фенильный радикал, замещенный R9, R10 и R11. Примерами фенильного радикала, замещенного R9, R10 и R11, являются фенил, 4-амино-3-хлор-5 цианофенил, 4-гидрокси-3-гидроксиметилфенил, 4-амино-3-цианофенил, 4-амино-3,5-дихлорфенил, 4 амино-3-хлор-5-трифтометилфенил, 2-фторфенил, 4-аминофенил, 3,4-дигидроксифенил, 3,5-дигидроксифенил, 3,5-бис-толилкарбонилоксифенил, 3-формиламино-4-гидроксифенил, 4-гидроксифенил, 3 амино-5-гидроксифенил, 3-амино-5-гидроксиметилфенил, 3,5-ди-трет-бутилкарбонилоксифенил, 3,5 диизопропилкарбонилоксифенил, 2-хлор-4-гидроксифенил, 2-фтор-4-гидроксифенил, 3-фтор-4-гидроксифенил, 4-гидрокси-3-метоксифенил. Предпочтительным примерами Аr2 являются 4-амино-3-хлор-5-цианофенил, 4-гидрокси-3 гидроксиметилфенил, 4-амино-3-цианофенил, 4-амино-3-хлор-5-трифтометилфенил и 4-амино-3,5 дихлорфенил. Пригодными солями соединений формулы I в зависимости от степени замещения являются все кислотно-аддитивные соли или все соли с основаниями. Прежде всего, это соли с фармакологически приемлемыми неорганическими и органическими кислотами и основаниями обычно используемыми в фармацевтике. С одной стороны, этими пригодными растворимыми и нерастворимыми в воде солями являются кислотно-аддитивные соли с кислотами, такими, например, как хлористо-водородная кислота, бромисто-водородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4-гидроксибензоил)бензойная кислота,масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная ки-2 005824 слота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота,стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2 нафтоевая кислота, причем при получении солей кислоты используют в эквимолярном или ином соотношении в зависимости от их основности (моно- или полиосновные) или в зависимости от типа требуемой соли. С другой стороны, пригодными, в зависимости от степени замещения, являются соли с основаниями. Примерами солей с основаниями являются соли лития, натрия, калия, кальция, алюминия, магния,титана, аммония, меглумина или гуанидиния, причем основания также используют при получении солей в эквимолярном или ином соотношении. Фармакологически неприемлемые соли, которые могут быть получены, например, в качестве промежуточных продуктов при получении соединений по изобретению в производственных масштабах,превращают в фармакологически приемлемые соли способами, известными специалисту в данной области техники. Специалисту в данной области известно, что соединения по изобретению, а также их соли, например, при выделении в кристаллической форме могут содержать различные количества растворителей. Следовательно изобретение включает все сольваты и, прежде всего, все гидраты соединений формулы I,a также все сольваты и, прежде всего, все гидраты солей соединений формулы I. Следует отметить такие соединения формулы I, в которых Аr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановоприсоединенный циклопентан, циклогексан,R6 и R7 независимо друг от друга каждый означает водород или С 1-С 4 алкил, илиR6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда где А означает -CmH2m-Y-X-CnH2n-, где X означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4 иn означает целое число от 1 до 4, илиX означает химическую связь, -О-, -С(О)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,Y означает 1,4-фенилен,m означает целое число от 0 до 4 иn означает целое число от 1 до 4, илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь, -С(О)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,Y означает 4,1-пиперидинилен,Z означает химическую связь, -О-, -S- или -S(O)2-,m означает целое число от 1 до 4, иn означает целое число от 1 до 4, илиY означает 1,4-фенилен, 1,3-фенилен, 1,4-циклогексилен, 1,3-циклогексилен или 1,3 циклопентилен,Z означает химическую связь, -О-, -S(O)2- или -C(O)-NH-,m означает целое число от 1 до 4 иn означает целое число от 1 до 4, R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил,амино или формиламино [-NH-C(O)H], R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,R11 означает водород или галоген,и соли указанных соединений. Прежде всего, следует отметить такие соединения формулы I, в которых Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 2 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановый циклопентан или циклогексан,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда А означает -CmH2m-Y-X-CnH2n-, где X означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4,n означает целое число от 1 до 4, илиX означает химическую связь -О- или -C(O)-NH-,Y означает 1,4-фениленm означает целое число от 0 до 4, иn означает целое число от 1 до 4, илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, где X означает химическую связь или -С(О)-,Y означает 4,1-пиперидинилен,Z означает химическую связь, -S- или -S(O)2-,m означает целое число от 1 до 4, иn означает целое число от 1 до 4, илиX означает химическую связь, -О- или -C(O)-NH-,Y означает 1,4-фенилен,Z означает химическую связь,m означает целое число от 1 до 4, иn означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, причем R9 означает водород, гидроксил или амино,R10 означает водород, галоген, циано, трифторметил или гидроксиметил,-4 005824R11 означает водород или галоген, и соли указанных соединений. Предпочтительны такие соединения формулы I, в которых Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5R1 означает метокси или этокси,R2 означает метокси или этокси,R3 означает метокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановоприсоединенный циклопентан,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда А означает -CmH2m-Y-X-CnH2n-, где или X означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4 иn означает целое число от 1 до 4, илиX означает химическую связь -О- или -C(O)-NH-,Y означает 1,4-фенилен,m означает целое число от 0 до 1, иn означает целое число от 1 до 4, илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь или -С(О)-,Y означает 4,1-пиперидинилен,Z означает химическую связь, -S- или -S(O)2-,m равно 2 или 3 иn равно 2 или 3,R8 означает водород,Аr2 означает фенил, 4-амино-3-хлор-5-цианофенил, 4-амино-3-хлор-5-трифторметилфенил, 4 гидрокси-3-гидроксиметилфенил, 4-амино-3-цианофенил, или 4-амино-3,5-дихлорфенил, и соли указанных соединений. Одним из вариантов изобретения (вариант А) являются соединения формулы I, гдеAr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 8 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановоприсоединенный 5-, 6- или 7-членный углеводродный цикл,R6 и R7 независимо друг от друга каждый означает водород или С 1-С 4 алкил, илиR6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь, -О- (кислород), -С(О)-, -S(O)2, -C(O)-NH- ,m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает радикал фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород,гидроксил, амино, или формиламино [-NH-C(O)H], R10 означает водород, галоген, гидроксил, циано,трифторметил или гидроксиметил,R11 означает водород или галоген, и соли указанных соединений. Следует отметить такие соединения формулы I варианта А, в которых Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановый циклопентан, циклогексан,R6 и R7, независимо друг от друга, каждый означает водород или С 1-С 4 алкил, илиR6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь -О- (кислород), -С(О)- или -C(O)-NH-,Y означает химическую связь, фенилен, пиперидиниленm означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил,амино или формиламино [-NH-C(O)H], R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,R11 означает водород или галоген, и соли указанных соединений. Прежде всего, следует отметить такие соединения формулы I варианта А, в которых Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулыR1 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 2 алкокси, С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,-6 005824R3 означает С 1-С 2 алкокси, R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановый циклопентан или циклогексан,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь или -С(О)-,Y означает химическую связь или 1,4-фенилен, m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил или амино,R10 означает водород, галоген, циано, трифторметил или гидроксиметил, R11 означает водород или галоген, и соли указанных соединений. Предпочтительны такие соединения формулы I варианта А, в которых Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенныйR1 означает метокси, этокси или дифторметокси,R2 означает метокси или этокси,R3 означает метокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановый циклопентан,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда А означает -(CH2)m-Y-X-(CH2)n-, где X означает химическую связь, Y означает химическую связь или 1,4-фенилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенил, 4-амино-3-хлор-5-цианофенил, 4-амино-3-хлор-5-трифторметилфенил, 4 гидрокси-3-гидроксиметилфенил, 4-амино-3-цианофенил или 4-амино-3,5-дихлорфенил, и соли указанных соединений. Для целей настоящего изобретения в остатках фталазинона и, соответственно, пиридазинона, в соединениях формулы I, используют следующую нумерацию атомов. Нумерация в соединениях ряда пиридазинона Соединения формулы I являются хиральными соединениями, имеющими, в соответствии со значением Аr1, хиральный центр в радикале дигидробензофуранил, в том случае, если заместители -R4 и-CH2R5 не идентичны. Однако, предпочтительны соединения, в которых заместители -R4 и -CH2R5 идентичны или вместе, включая атомы углерода, к которым они присоединены, образуют спирановый 5-, 6 или 7-членный углеводородный цикл. Другие возможные хиральные центры в соединениях формулы I отмечены в следующей формуле I звездочкой : Изобретение включает все предположительно чистые диастереомеры и чистые энантиомеры, а также их смеси независимо от соотношения компонентов, включая рацематы. В тех случаях, когда R6 и R7 вместе, включая два атома углерода, к которым они присоединены,образуют группу, выбранную из ряда предпочтительными являются такие соединения, в которых атомы водорода в положениях 4 а и 8 а находятся в цис-конфигурации. В связи с этим, прежде всего, предпочтительны соединения, которые в положении 4 а имеют S конфигурацию (по правилами Кана, Ингольда, Прелога), а в положении 8 а имеют(4 а,8 а)-цис-Рацематы могут быть разделены на соответствующие энантиомеры методами, известными специалисту в данной области. Рацемические смеси предпочтительно разделяют на два диастереомера в процессе получения с использованием оптически активного разделяющего агента на стадии циклогексанкарбоновых кислот или 1,2,3,6-тетрагидробензойных кислот. В качестве разделяющих агентов используют, например, оптически активные амины, такие как (+)- и (-)-формы 1-фенилэтиламина [(R)(+)-1-фенилэтиламин = Dметилбензиламин или (S)-(-)-1-фенилэтиламин = Lметилбензиламин] и эфедрин, оптически активные алкалоиды: хинин, цинхонин, цинхонидин и бруцин. Получение 4-(3,4-диалкоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-онов или 4-(3,4-диалкоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-онов с конфигурацией (4aS, 8aR) описано, например, в международной заявке WO 98/31674. Получение 4-(2,3-дигидро-7-алкоксибензофуран-2-спиро-1'-циклопентан-4-ил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-онов с конфигурацией (4aS, 8aR) описано, например, в международной заявке WO 99/31090. Одной из предпочтительных групп соединений формулы I являются соединения, в которых двухвалентный радикал А включает непрерывную углеродную цепь, содержащую от приблизительно 4 до приблизительно 6 углерод-углеродных связей. Примеры, которые могут упомянуты в этом контексте, включают тетраметилен, пентаметилен, гексаметилен или фенилэтилен. Другой предпочтительной группой соединений формулы I являются соединения, в которых Y означает радикал 1,4-фенилен или 4,1-пиперидинилен. Кроме того, изобретение относится к способам получения соединений формулы I и их солей. Несколько альтернативных способов синтеза соединений формулы I показаны на схемах I-IX. Схема I Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означаетX означает химическую связь,Y означает химическую связь, фенилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4. На схеме I показано получение соединений формулы I из соединений ряда 2 Н-фталазин-1-она или 2 Н-пиридазин-1-она. На первой стадии эти соединения взаимодействуют с соответствующими дигалогеналканами (если А означает алкиленовую цепь) с получением соответствующих 2-(галогеналкил)фталазин-1-онов или 2-(-галогеналкил)пиридазинонов. Затем на второй стадии взаимодействием этих соединений с производными 2-амино-1-(фенил)этанола получают соединения формулы I. Аналогичным способом могут быть получены соединения формулы I, в которых А, кроме алкиленовой цепи, содержит другие группы, например, радикал 1,4-фенилен. Схема II Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, гдеX означает химическую связь,Y означает химическую связь, фенилен, С 4-С 8 циклоалкилен m означает целое число от 0 до 4,n означает целое число от 1 до 4. В качестве исходных соединений используют 2-(-галогеналкил)фталазин-1-оны или 2-(галогеналкил)пиридазиноны, описанные для схемы I. На первой стадии атом галогена замещают аминогруппой по реакции Габриэля (например, как описано в Angew. Chem., 80, 986-996). 1(Фенил)этанольный остаток соединений формулы I вводят в молекулу с использованием производного 2 бромацетофенона и последующего восстановления. Схема III Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, где X означает химическую связь,Y означает химическую связь, фенилен или С 4-С 8 циклоалкилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4. В качестве исходных соединений используют 2-(-галогеналкил)фталазин-1-оны или 2-(галогеналкил)пиридазиноны, описанные для схемы I. В этой схеме аминогруппу вводят по реакции с бензиламином. 1-(Фенил)этанольный остаток соединений формулы I вводят в молекулу также с использованием производного 2-бромацетофенона и последующего восстановления. На последней стадии бензильную группу удаляют, например, каталитическим гидрированием. Схема IV Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, гдеX означает -О- (кислород) или -S- (сера), Y означает фенилен или С 4-С 8 циклоалкилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4. На данной схеме X означает -О-, a Схема V Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, гдеX означает -С(О)- или -S(O)2-,Y означает азациклоалкилен,m равно 0,n означает целое число от 1 до 4. На данной схеме X означает -С(О)-, a Y означает 4,1-пиперидинилен. Схема VI Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, где X означает -S(O)2-, Y означает азациклоалкилен, m равно 0, n равно 2. На данной схеме Y означает 4,1-пиперидинилен. Схема VII Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь,Y означает азациклоалкилен,Z означает -S(O)2-,m означает целое число от 1 до 4,n равно 2. На данной схеме Y означает 4,1-пиперидинилен. Схема VIII Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает -С(О)-,Y означает азациклоалкилен,Z означает -О-, -S- или -S(O)2-,m означает целое число от 1 до 4,n означает целое число от 1 до 4. На данной схеме Y означает 4,1-пиперидинилен, a Z означает -S- или -S(O)2-.- 12005824 Схема IX Эта схема пригодна прежде всего для получения соединений формулы I, в которых А означает -CmH2m-Y-X-CnH2n-, гдеX означает -NH-C(O)-NH- или -NH-C(S)-NH-,Y означает фенилен или С 4-С 8 циклоалкилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4. На данной схеме X означает -NH-C(S)-NH-, a Y означает фенилен. Другие соединения формулы I, получение которых показано на вышеописанных схемах в неявной форме, могут быть получены с использованием методов, описанных в следующих примерах, или с использованием методов, известных специалисту в данной области. Все исходные соединения известны или могут быть получены обычными методами, известными специалисту в данной области. Получение соответствующих исходных соединений, содержащих остаток фталазинона, описано,например, в WO 98/31674, WO 99/31090 или ЕР 0934933. Получение соответствующих исходных соединений, содержащих остаток пиридазинона, описано,например, в ЕР 0163965. Соответственно, превращения проводят аналогично методам, известным специалисту в данной области, например, аналогично тому, как описано в следующих примерах. Кроме того, специалисту в данной области известно, что, если в исходном или промежуточном соединении имеется несколько реакционных центров, для проведения специфичной реакции по необходимому реакционному центру может оказаться необходимым временно блокировать один или более реакционных центров защитными группами. Подробное описание использования множества стандартных защитных групп содержится, например, в монографии Т. W.Green, Protective groups in organic Synthesis, John WileySohns(1991). Соединения по изобретению выделяют и очищают известными способами, например, выпариванием растворителя в вакууме и перекристаллизацией полученного соединения в соответствующем растворителе; или соединение подвергают очистке с использованием одного из обычных методов, такого как хроматография на колонке, заполненной соответствующим материалом. Соли получают, растворяя свободное соединение в соответствующем растворителе (например, в растворителе, содержащем кетогруппу, таком как ацетон, метилэтилкетон или метилизобутилкетон, в простом эфире, таком как диэтиловый эфир, тетрагидрофуран или диоксан, хлорированном углеводороде, таком как хлористый метилен или хлороформ, или в низкомолекулярном алифатическом спирте, таком как этанол, изопропанол), содержащем необходимую кислоту или основание, или к которому добавляют необходимую кислоту или основание. Соли выделяют фильтрованием, переосаждением, в случае аддитивной соли осаждением при добавлении осадителя или выпариванием растворителя. Полученные соли могут быть при использовании подщелачивания или подкисления превращены в свободные соединения, которые в свою очередь могут быть превращены в соли. Аналогичном образом, фармакологиче- 13005824 ски неприемлемые соли могут быть превращены в фармакологически приемлемые соли. Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Указанные в примерах соединения и их соли являются предпочтительными соединениями по изобретению. Примеры Конечные продукты 1. Фумарат(цис)-2-(4-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-бутил)-4-(3,4 диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 а и соединения А по реакции 2, tпл. 85-88C. 2. Полуфумарат (цис)-2-(6-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-гексил)-4-(3,4 диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 б и соединения А по реакции 2, tпл. 110-112 С. 3. Полуфумарат (цис)-2-(8-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-октил)-4-(3,4 диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 в и соединения А по реакции 2, tпл. 111-113 С. 4. Полуфумарат (цис)-2-(6-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-гексил)-4-(3,4 диэтоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 г и соединения А по реакции 2, tпл. 109-111 С. 5. Полуфумарат (цис)-2-4-(2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-этил)фенил-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 к и соединения А по реакции 2, tпл. 121-125 С. 6. Полуфумарат (цис)-2-(6-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-гексил)-4-(3,4 диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 д и соединения А по реакции 2, tпл. 119-122 С. 7. Полуфумарат (цис)-2-(6-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-гексил)-4-(3,4 диметоксифенил)-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 л и соединения А по реакции 2, tпл. 107-110 С. 8.(Цис)-2-(2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-этил)-4-(2,3-дигидро-7 метоксибензофуран-2-спиро-1'-циклопентан-4-ил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 1 и и соединения А по реакции 2, tпл.176-177C. 9. Полуфумарат (цис)-2-(4-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-бутил)-4-(2,3 дигидро-7-метоксибензофуран-2-спиро-1'-циклопентан-4-ил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 з и соединения А по реакции 2, tпл.120-123C. 10. Полуфумарат (цис)-2-(6-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]-1-гексил)-6-(3 метокси-4-дифторметоксифенил)-2 Н-пиридазин-3-она. Указанное соединение получают из соединения 1 м и соединения А по реакции 2, tпл. 80-85C. 11. Полуфумарат (цис)-2-(4-[2-(4-амино-3-хлор-5-цианофенил)-2-гидроксиэтиламино]-1-бутил)-4(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она Указанное соединение получают из соединения 3 б и соединения Г по реакции 5, tпл. 115-118 С. 12. Полуфумарат (цис)-2-(5-[2-(4-амино-3-хлор-5-цианофенил)-2-гидроксиэтиламино]-1-пентил)4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 3 в и соединения Г по реакции 5, tпл.121-123C. 13. Полуфумарат (цис)-2-(6-[2-(4-амино-3-хлор-5-цианофенил)-2-гидроксиэтиламино]-1-гексил)4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 3 а и соединения Г по реакции 5, tпл.168-170C. 14. Полуфумарат (цис)-4-(3,4-диметоксифенил)-2-(6-[2-(4-гидрокси-3-гидроксиметилфенил)-2 гидроксиэтиламино]-1-гексил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 б и соединения В по реакции 2, tпл. 99-103C. 15. s Фумарат (цис)-2-(8-[2-(4-гидрокси-3-гидроксиметилфенил)-2-гидроксиэтиламино]-1-октил)4-(3,4-диметоксифенил)-5,6,7,8,9,10-гексагидро-1-фталазинона. Указанное соединение получают из соединения 1 в и соединения В по реакции 2, tпл. 66-70C. 16. Полуфумарат (цис)-2-(6-[2-(4-гидрокси-3-гидроксиметилфенил)-2-гидроксиэтиламино]-1 гексил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 д и соединения В по реакции 2, tпл. 96-99C. 17. 3/4 Фумарат (цис)-2-(6-[2-(4-амино-3-хлор-5-трифторметилфенил)-2-гидроксиэтиламино]-1 гексил)-4-(3,4-диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 1 б и соединения Б по реакции 2, tпл. 102-105oC. 18. Полуфумарат (цис)-2-(6-[2-(4-амино-3-цианофенил)-2-гидроксиэтиламино]-1-гексил)-4-(3,4 диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 4 и соединения Д по реакциям 7, 8 и 9, tпл. l01103C. 19. 3/4 Фумарат (цис)-4-(3,4-диметоксифенил)-2-[6-(2-фенил-2-гидроксиэтил)амино-1-гексил]4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она.- 14005824 Указанное соединение получают из соединения 1 б и 2-амино-1-фенилэтанола по реакции 2, tпл. 110115 С. 20. Фумарат 2-амино-3-хлор-5-[2-(4-4-[(4 аS,8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Н-фталазин-2-ил]пиперидин-1-ил-4-оксобутиламино)-1-гидроксиэтил]бензонитрила. Указанное соединение получают из исходного соединения 5 а и исходного соединения Г по реакции 5, tпл. 212-216C. 21. Фумарат (4 аS,8 аR)-2-(4-4-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]бутоксифенил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 6 а и соединения А по реакции 2, tпл. 126-127C. 22. Фумарат (4 аS,8 аR)-2-(4-4-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]бутоксибензил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 7 а и соединения А по реакции 2, tпл. 119-120C. 23. Оксалат (4 аS,8 аR)-2-(4-2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]этоксифенил)4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 8 а и соединения А по реакции 2, tпл. 136-138C. 24. Фумарат (4aS,8aR)-2-[1-(2-2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]этансульфонилэтил)пиперидин-4-ил]-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она Указанное соединение получают из соединения 9 а и соединения А по реакции 10, tпл. l37-138C. 25. 4-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]бутиламид 4-[(4 аS,8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Н-фталазин-2-ил]-пиперидин-1-карботиокислоты. Указанное соединение получают из соединения 10 а и соединения 11 по реакции 5, tпл. 139-144C. 26. Фумарат (4 аS,8 аR)-2-(1-2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]этаноилпиперидин-4-ил)-4-(3,4-диэтоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 11 а и соединения А по реакции 2, tпл. 172-173 С. 27. Фумарат(4 аS,8 аR)-2-(1-2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]этансульфонил пиперидин-4-ил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 12 а и соединения А по реакции 2, tпл. 169-171 С. 28. Фумарат(4 аS,8 аR)-2-(1-(S)-2-[2-(3,4-диамино-5-хлорфенил)-2-гидроксиэтиламино]пропаноил пиперидин-4-ил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 13 а и соединения 11 по реакции 5, tпл. 130-131C. 29.(4aS,8aR-4-(3,4-Диметоксифенил)-2-(1-2-[2-гидрокси-2-(4-гидрокси-3-гидроксиметилфенил) этиламино]этансульфонилпиперидин-4-ил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 12 а и соединения В по реакции 10 и кристаллизуют в виде свободного основания из этилацетата, tпл. 97-99 С. 30. Гидрохлорид (4aS,8aR)-2-[1-(3-2-[2-(4-амино-3,5-дихлорфенил)-2-гидроксиэтиламино]этансульфанилпропаноил)пиперидин-4-ил]-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1 она. Указанное соединение получают из соединения П и соединения 14 а по реакции 5, tпл. 118-120C. 31. Фумарат (4aS,8aR)-4-(3,4-диметоксифенил)-2-(4-4-[2-гидрокси-2-(4-гидрокси-3-гидроксиметилфенил)этиламино]бутоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 6 а и соединения В по реакции 2, tпл. 126-127C. 32. 2-Амино-3-хлор-5-2-[2-(3-4-[(4aS,8aR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро 1 Н-фталазин-2-ил]пиперидин-1-ил-3-оксопропан-1-сульфонил)этиламино]-1-гидроксиэтилбензонитрил. Указанное соединение получают из соединения 15 а и соединения Г по реакции 5 и кристаллизуют в виде свободного основания из диэтилового эфира, tпл. 102-103C. 33. Гидрохлорид 2-амино-3-хлор-5-[2-S)-2-4-[(4 аS,8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 атетрагидро-1 Н-фталазин-2-ил]пиперидин-1-ил-1-метил-2-оксоэтиламино)-1-гидроксиэтил]бензонитрила. Указанное соединение получают из соединения 13 а и соединения Г по реакции 5 и кристаллизуют в виде гидрохлорида, tпл. 160-161 С. 34. Фумарат 2-амино-3-хлор-5-[2-(6-4-[(4aS,8aR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Н-фталазин-2-илпиперидин-1-ил]гексиламино)-1-гидроксиэтил]бензонитрила. Указанное соединение получают из соединения 16 а и соединения Г по реакции 5, tпл.142-143C. Основной синтез. Реакция 1. 2-(-Галогеналкил)фталазиноны (соединения 1 а-1 з, 1 л или 1 м). 25 ммолей гидрида натрия добавляют к перемешиваемому раствору 20 ммолей фталазинона или пиридазинона (соединения Е-Л) в 50 мл диметилформамида. Через 5 мин добавляют 60 ммолей а,дигалогеналкана и полученную смесь перемешивают в течение 60 мин. После добавления 200 мл воды смесь экстрагируют диэтиловым эфиром. Эфирный раствор сушат над сульфатом магния и упаривают. Остаток очищают хроматографией [этилацетат/петролейный эфир (60-80 С), 1:4]. Реакция 2. Производные аминоэтанола. Смесь 8 ммолей 2-(-галогеналкил)фталазинона, 10 ммолей производного первичного аминоэтанола (соединения А, Б или В) и 20 ммолей карбоната калия в 50 мл диметилформамида нагревают при 100 С в течение 1,5 ч. После охлаждения до комнатной температуры к полученной смеси добавляют смесь 100 мл воды и 200 мл этилацетата. Органический слой сушат над сульфатом магния и упаривают. Остаток очищают хроматографией (этилацетат/триэтиламин, 20:1). Производное аминоэтанола кристаллизуют в виде соли с фумаровой кислотой из тетрагидрофурана/диэтилового эфира. Реакция 3. Фталимиды (соединения 2 а, 2 б или 2 в). 15 ммолей 2-(-галогеналкил)фталазинона, 18 ммолей фталимида и 20 ммолей карбоната калия в 100 мл диметилформамида нагревают при 110 С в течение 5 ч. После охлаждения до комнатной температуры добавляют 300 мл воды и 300 мл этилацетата. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Соединение кристаллизуют из пригодного растворителя. Реакция 4. 2-(-аминоалкил)фталазинон (соединения 3 а, 3 б или 3 в). Раствор 20 ммолей фталимида (соединения 2 а, 2 б или 2 в) и 25 ммолей гидразингидрата в 200 мл этанола кипятят с обратным холодильником в течение 5 ч и затем упаривают. Остаток растворяют в этилацетате (200 мл), полученныйт раствор промывают водным раствором карбоната натрия, сушат над сульфатом магния, растворитель выпаривают, остаток кристаллизуют из пригодного растворителя. Реакция 5. Производные аминоэтанола. Раствор 6 ммолей производного 2-бромацетофенона (например, соединения Г или Д), 5 ммолей амина (например, соединения 3 а, 3 б или 3 в) и 10 ммолей диизопропилэтиламина в смеси 50 мл тетрагидрофурана и 50 мл метанола перемешивают при комнатной температуре. Через 3 ч добавляют 10 ммолей боргидрида натрия и полученную смесь перемешивают в течение еще 1 ч и затем упаривают. Остаток растворяют в воде (100 мл) и полученную смесь дважды экстрагируют 200 мл этилацетата. Органический раствор сушат над сульфатом магния и упаривают. Остаток очищают хроматографией (этилацетат/метанол/триэтиламин, 10:2:0,5). Соединение кристаллизуют в виде фумарата из тетрагидрофурана/диэтилового эфира. Реакция 6. Бензиламины. Смесь 25 ммолей 2-(-галогеналкил)фталазинона и 200 ммолей бензиламина нагревают при 120 С в течение 2 ч. После охлаждения до приблизительно 60 С к смеси добавляют 200 мл 2 н. бромистоводородной кислоты и после охлаждения до комнатной температуры полученную смесь дважды экстрагируют 200 мл дихлорметана. Органический раствор сушат над сульфатом магния и упаривают. Остаток промывают диэтиловым эфиром и высушивают. Реакции 7, 8, 9. Раствор 10 ммолей бензиламина (соединения, полученные по реакции 6), 10 ммолей производного 2-бромацетофенона и 20 ммолей диизопропилэтиламина в смеси 50 мл тетрагидрофурана и 50 мл этанола перемешивают при комнатной температуре в течение 18 ч, а затем добавляют 10 ммолей боргидрида натрия. Полученную смесь перемешивают в течение еще 30 мин и затем упаривают. Остаток растворяют в 200 мл диэтилового эфира, полученный раствор промывают водным раствором карбоната натрия, органический слой сушат над сульфатом магния и упаривают. Остаток растворяют в этаноле и после добавления 0,5 г 5%-ного Pd/C обрабатывают в потоке водорода. Через приблизительно 60 мин реакция дебензилирования завершена (по данным ТСХ). Катализатор отделяют фильтрованием, растворитель выпаривают, остаток очищают хроматографией на силикагеле (этилацетат/триэтиламин, 20:1). Производное аминоэтанола кристаллизуют в виде фумарата из тетрагидрофурана/диэтилового эфира. Реакция 10. Смесь 5 ммолей этенсульфонилпроизводного (соединения 9 а или 12 а) и 5 ммолей производного аминоэтанола (соединения А, Б или В) в 50 мл тетрагидрофурана перемешивают при комнатной температуре в течение 18 ч, затем растворитель выпаривают и остаток очищают хроматографией (при элюировании этилацетатом, содержащим 5% триэтиламина). Исходные и промежуточные соединения 1 а. (цис)-2-(4-Бром-1-бутил)-4-(3,4-диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-он. Указанное соединение получают в виде масла из соединения Е и 1,4-дибромбутана по реакции 1. 1H-ЯMP(CDCl3): 1,28-2,00 (m, 11H, 7 хциклогексан-Н, С-(СН 2)2-С); 2,50-2,61 (m, 1 Н, циклогексанН); 2,63-2,73 (m, 1 Н, циклогексан-Н); 3,00-3,15 (m, 1 Н, циклогексан-Н); 3,49 (t, J=6,4 Гц, 2 Н, СН 2-Вr); 3,72-4,12 (m, 8 Н, 2 хО-СН 3, N-СН 2); 6,87 (d, J=8,4 Гц, 1H, Аr-Н); 7,23 (dd, J=2,l, 8,5 Гц, 1 Н, Аr-Н); 7,47 (d,J=2,0 Гц, 1 Н, Аr-Н). 1 б. (цис)-2-(6-Бром-1-гексил)-4-(3,4-диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения Е и 1,6-дибромгексана по реакции 1 и кристаллизуют из диэтилового эфира, tпл.74-75C. 1 в. (цис)-2-(8-Бром-1-октил)-4-(3,4-диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения Е и 1,8-дибромоктана по реакции 1 и кристаллизуют из гексана, tпл.58-60C. 1 г. (цис)-2-(6-Бром-1-гексил)-4-(3,4-диэтоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 3 и 1,6-дибромгексана по реакции 1, tпл.47-51C. 1 д. (цис)-2-(6-Бром-1-гексил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он.- 17005824 Указанное соединение получают из соединения Ж и 1,6-дибромгексана по реакции 1 и кристаллизуют из метанола, tпл. 55-56 С. 1H-ЯMP(CDCl3): 1,37-2,26 (m, 11H, 3 х циклогексен-Н, С-(СН 2)4-С); 2,67-2,81 (m, 1 Н, циклогексенН); 2,97-3,07 (m, 1 Н, циклогексан-Н); 3,28-3,42 (m, 3 Н, СН 2-Вr, циклогексен-Н); 3,68-4,06 (m, 8 Н, 2 хОСН 3, N-CH2); 6,88 (d, J=8,5 Гц, 1 Н, Ar-H); 7,26 (dd, J=2,l, 8,5 Гц, 1 Н, Ar-H); 7,48 (d, J=2,0 Гц, 1 Н, Ar-H) 1e. (цис)-2-(4-Бром-1-бутил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения Ж и 1,4-дибромбутана по реакции 1 и кристаллизуют из метанола, tпл.102-103C. 1 ж. (цис)-2-(5-Бром-1-пентил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения Ж и 1,5-дибромпентана в виде масла по реакции 1. 1 Н-ЯМР(СDСl3): 1,38-2,28 (m, 11H, 3 х циклогексен-Н, С-(СН 2)3-С); 2,67-2,81 (m, 1 Н, циклогексенН); 2,97-3,07 (m, 1 Н, циклогексен-Н); 3,28-3,50 (m, 3 Н, СН 2-Вr, циклогексен-Н); 3,68-4,08 (m, 9 Н, 2 хОСН 3, N-CH2, циклогексен-Н); 5,60-5,87 (m, 2H, CH=CH); 6,88 (d, J=8,5 Гц, 1H, Аr-Н); 7,26 (dd, J=2,0, 8,5 Гц, Н, Аr-Н); 7,48 (d, J=2,0 Гц, 1 Н, Ar-H). 1 з.(цис)-2-(4-Бром-1-бутил)-4-(2,3-дигидро-7-метоксибензофуран-2-спиро-1'-циклопентан-4-ил)4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения И и 1,4-дибромбутана по реакции 1 и кристаллизуют из метанола, tпл. 86-88C. 1 и. (цис)-2-Бромэтил-4-(2,3-дигидро-7-метоксибензофуран-2-спиро-1'-циклопентан-4-ил)-4 а,5,8,8 атетрагидро-2 Н-фталазин-1-он. К раствору 3,1 г трифенилфосфина в CH2Cl2 при 0 С добавляют раствор 1,92 г Вr2 в CH2Cl2, а затем раствор 4,6 г соединения М в CH2Cl2. Полученный раствор перемешивают при комнатной температуре в течение 2 ч и последовательно промывают разбавленной соляной кислотой (2 х) и водным раствором карбоната натрия. Продукт реакции дважды кристаллизуют из метанола, tпл. 143-145 С. 1 к. (цис)-2-4-(2-Бромэтил)фенил-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения Н, как описано для промежуточного соединения 1 и,и кристаллизуют из метанола, tпл. 126-127 С. 1 л. 2-(6-Бром-1-гексил)-4-(3,4-диметоксифенил)-2 Н-фталазин-1-он. Указанное соединение получают из соединения К и 1,6-дибромгексана по реакции 1 и кристаллизуют из смеси этилацетата и гексана, tпл.83-84 С. 1 м. 2-(6-Бром-1-гексил)-4-(3-метокси-4-дифторметоксифенил)-2 Н-пиридазин-1-он. Указанное соединение получают из соединения Л и 1,6-дибромгексана по реакции 1 и кристаллизуют из диэтилового эфира, tпл.69-70C. 2 а.(цис)-[6-4-(3,4-Диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-2-илгексил]фталимид. Указанное соединение получают из соединения 1 д по реакции 3 и кристаллизуют из метанола, tпл. 104-105C. 2 б. (цис)-N-[4-4-(3,4-Диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-2-илбутил]фталимид. Указанное соединение получают из соединения 1 е по реакции 3 и кристаллизуют из метанола,tпл.139-140 С. 2 в.(цис)-N-[5-4-(3,4-Диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-2-илпентил] фталимид. Указанное соединение получают из соединения 1 ж по реакции 3 и кристаллизуют из диэтилового эфира, tпл. 126-129 С. 3 а. (цис)-2-(6-Амино-1-гексил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 2 а по реакции 4 и кристаллизуют в виде фумарата из тетрагидрофурана/диэтилового эфира, tпл.141-143 С. 3 б. (цис)-2-(4-Амино-1-бутил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 2 б по реакции 4 и кристаллизуют из диэтилового эфира, tпл. 108-109 оС. 3 в. (цис)-2-(5-Амино-1-пентил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 2 в по реакции 4 и кристаллизуют из диэтилового эфира, tпл. 88-89 оС. 4 а. Гидробромид (цис)-2-(6-бензиламино-1-гексил)-4-(3,4-диметоксифенил)-4 а,5,6,7,8,8 а-гексагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 16 по реакции 6, tпл.117-119 С. 5 а. Трифторацетат (4aS,8aR)-2-[1-(4-аминобутаноил)пиперидин-4-ил]-4-(3,4-диметоксифенил)4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. 15 ммолей соединения 5 б растворяют в 20 мл трифторуксусной кислоты, раствор выдерживают при комнатной температуре в течение 30 мин, а затем упаривают. Остаток затвердевает при обработке ди- 18005824 этиловым эфиром, tпл. 175-178 С. 5 б. Трет-бутиловый эфир (4-4-[(4aS,8aR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Нфталазин-2-ил]пиперидин-1-ил-4-оксобутил)карбаминовой кислоты. К раствору 20 ммолей соединения 5 в и 25 ммолей трет-бутилового эфира (4-оксопентил)карбаминовой кислоты в 100 мл дихлорметана добавляют 25 ммолей гидрохлорида (3-диметиламинопропил)этилкарбодиимида и полученную смесь перемешивают при комнатной температуре. Через 18 ч раствор последовательно промывают разбавленной соляной кислотой и водным раствором карбоната натрия, а затем сушат над сульфатом магния. После выпаривания растворителя соединение кристаллизуют из гексана, tпл.79-83C. 5 в. (4aS,8aR)-4-(3,4-Диметоксифенил)-2-пиперидин-4-ил-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Раствор 50 ммолей соединения 5 г в 150 мл дихлорметана промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом магния и упаривают. Остаток промывают диэтиловым эфиром и высушивают, tпл.260 С (разл.). 5 г. Гидрохлорид (4aS,8aR)-4-(3,4-диметоксифенил)-2-пиперидин-4-ил-4 а,5,8,8 а-тетрагидро-2 Нфталазин-1-она. Раствор 50 ммолей соли (S)-(-)метилбензиламина и (цис)-2-(3,4-диметоксибензоил)-1,2,3,6 тетрагидробензойной кислоты (соединение О), 55 ммолей дигидрохлорида пиперидин-4-илгидразина и 100 ммолей триэтиламина в 150 мл 1-пропанола кипятят с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры осадок отделяют фильтрованием и высушивают, tпл. 285288C. 5 д. Дигидрохлорид пиперидин-4-илгидразина. Смесь 0,1 моля трет-бутилового эфира 4-(N'-бутоксикарбонилгидразино)пиперидин-1-карбоновой кислоты (соединение 5 е) и 150 мл конц. соляной кислоты нагревают при 90 С в течение 60 мин, а затем полученный прозрачный раствор упаривают. Остаток промывают тетрагидрофураном, отделяют фильтрованием и высушивают в вакууме, tпл. 256-259 С. 5 е. Трет-бутиловый эфир 4-(N'-трет-бутоксикарбонилгидразино)пиперидин-1-карбоновой кислоты. К раствору 0,12 моля трет-бутилового эфира 4-(трет-бутоксикарбонилгидразоно)пиперидин-1 карбоновой кислоты (соединение 5 ж) в 100 мл сухого тетрагидрофурана медленно добавляют 150 мл раствора боргидрида в тетрагидрофуране (1,0 моль/л). Затем смесь перемешивают в течение еще 30 мин и добавляют 100 мл воды для разложения избытка боргидрида. Затем упаривают тетрагидрофуран и полученный водный раствор экстрагируют диэтиловым эфиром. После высушивания растворителя над сульфатом магния эфир выпаривают, tпл.112-115 С. 5 ж. Трет-бутиловый эфир 4-(трет-бутоксикарбонилгидразоно)пиперидин-1-карбоновой кислоты. Смесь 0,15 моля трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (коммерческий препарат) и 0,15 моля трет-бутилкарбазината в 250 мл гексана перемешивают при комнатной температуре в течение 18 ч. Осадок отделяют фильтрованием и высушивают в вакууме, tпл.172-174 С. 6 а.(4aS,8 аR)-2-[4-(4-Бромбутокси)фенил]-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Нфталазин-1-он. Смесь 10 ммолей соединения 6 б, 50 ммолей 1,4-дибромбутана и 40 ммолей карбоната калия в 50 мл диметилформамида перемешивают при комнатной температуре в течение 18 ч, а затем смесь выливают в 200 мл воды. После экстракции диэтиловым эфиром соединение очищают хроматографией (этилацетат/гексан, 1:5). Соединение кристаллизуют из гексана при -20 С, tпл. 38-43 С. 6 б. (4aS, 8 аR)-4-(3,4-Диметоксифенил)-2-(4-гидроксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1 он. Смесь 20 ммолей соединения 6 в, 50 мл этантиола и 20 мл эфирата бортрифторида выдерживают при комнатной температуре в течение 40 ч. После добавления 200 мл насыщенного раствора бикарбоната натрия, смесь экстрагируют этилацетатом. Органический раствор сушат над сульфатом магния и упаривают. Соединение кристаллизуют из диэтилового эфира, tпл.111-112 С. 6 в. (4aS, 8 аR)-2-(4-Бензилоксифенил)-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1 он. Раствор 50 ммолей соединения 6 г и 50 ммолей гидрохлорида 4-бензилоксифенилгидразина в 100 мл пиридина кипятят с обратным холодильником в течение 8 ч и затем упаривают. Остаток растворяют в этилацетате и раствор последовательно промывают разбавленной соляной кислотой и водным раствором карбоната натрия, и сушат над сульфатом магния. После выпаривания растворителя соединение кристаллизуют из метанола, tпл.104-105 С. 6 г. (1R,6S)-6-[1-(3,4-Диметоксифенил)метаноил]-1,2,3,6-тетрагидробензойная кислота. Раствор 50 ммолей соединения 6 д в 150 мл дихлорметана последовательно промывают 1 н. серной кислотой и водой (2 х). Раствор сушат над сульфатом магния и упаривают. Остаток кристаллизуют из диэтилового эфира, tпл.110-112 С. 6 д. Соль (1R,2S)-2-(3,4-диметоксифенил)метаноил-1,2,3,6-тетрагидробензойной кислоты и (-)-метилбензиламина. Смесь 10 ммолей соединения О и 5 ммолей Lметилбензиламина в 100 мл этилацетата перемешивают в течение 18 ч, осадок отделяют фильтрованием и высушивают. 7 а.(4aS,8 аR)-2-[4-(4-Бромбутокси)бензил]-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Нфталазин-1-он. Указанное соединение получают из соединения 7 б и 1,4-дибромбутана, как описано для соединения 6 а, tпл. 42-46C. 7 б. (4aS, 8 аR)-4-(3,4-Диметоксифенил)-2-(4-гидроксибензил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1 он. Указанное соединение получают из гидрохлорида 4-гидроксибензилгидразина и соединения 6 г, как описано для соединения 6 в, и кристаллизуют из диэтилового эфира, tпл.189-190C. 8 а. (4aS, 8 аR)-2-[4-(2-Бромэтокси)фенил]-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 6 б и 1,2-дибромэтана, как описано для соединения 6 а, tпл. 40-45 С. 9 а.(4aS,8 аR)-4-(3,4-Диметоксифенил)-2-[1-(2-этенсульфонилэтил)-пиперидин-4-ил]-4 а,5,8,8 атетрагидро-2 Н-фталазин-1-он Раствор 10 ммолей соединения 5 в, 10 ммолей 1-бром-2-(2-бромэтансульфонил)этана и 30 ммолей карбоната калия в 30 мл диметилформамида перемешивают при комнатной температуре. Через 18 ч смесь выливают в воду (150 мл) и экстрагируют этилацетатом, продукт реакции кристаллизуют из диэтилового эфира, tпл.165-166C. 10 а. Трифторацетат (4-аминобутил)амида 4-[(4aS, 8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 атетрагидро-1 Н-фталазин-2-ил]пиперидин-1-карботиокислоты. Указанное соединение получают из соединение 10 б, как описано для соединения 5 а, tпл.125-128C. 10 б. Трет-бутиловый эфир 4-[(1-4-[(4 аS,8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1-фталазин-2-ил]пиперидин-1-илметантиоил)амино]бутилкарбаминовой кислоты. Раствор 10 ммолей трет-бутилового эфира (4-изотиоцианатобутил)карбаминовой кислоты и 10 ммолей соединения 5 в в 100 мл дихлорметана перемешивают при комнатной температуре в течение 18 ч,последовательно промывают разбавленной соляной кислотой и водным раствором карбоната натрия,сушат над сульфатом магния и упаривают. Продукт реакции кристаллизуют из смеси этилацетата и гексана, tпл. 118-121 С. 11 а. (4 аS,8 аR)-2-[1-(2-Хлорэтаноил)пиперидин-4-ил]-4-(3,4-диэтоксифенил)-4 а,5,8,8 а-тетрагидро 2 Н-фталазин-1-он. Раствор 12 ммолей хлорацетилхлорида в 20 мл дихлорметана добавляют при 0 С к смеси 12 ммолей соединения 11 б и 40 ммолей триэтиламина в 50 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в течение 60 мин, последовательно промывают разбавленной соляной кислотой и водным раствором карбоната натрия, сушат над сульфатом магния, затем растворитель выпаривают и остаток очищают хроматографией (этилацетат/петролейный эфир (60-80 С), 2:1), tпл.135-136C. 11 б. Гидрохлорид (4aS, 8 аR)-4-(3,4-диэтоксифенил)-2-пиперидин-4-ил-4 а,5,8,8 а-тетрагидро-2 Нфталазин-1-она. Указанное соединение получают из соли (S)-(-)метилбензиламина и (цис)-2-(3,4 диэтоксибензоил)-1,2,3,6-тетрагидробензойной кислоты (соединение Р) и дигидрохлорида пиперидин-4 илгидразина в 2-пропаноле, как описано для соединения 5 г, tпл.248-250C. 12 а. (4aS, 8 аR)-4-(3,4-Диметоксифенил)-2-(1-этенсульфонилпиперидин-4-ил)-4 а,5,8,8 а-тетрагидро 2 Н-фталазин-1-он. Раствор 20 ммолей 2-хлорэтилсульфонилхлорида в 20 мл дихлорметана добавляют к раствору 15 ммолей соединения 5 в и 25 мл диизопропилэтиламина в 50 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в течение 18 ч, затем смесь промывают разбавленной соляной кислотой, насыщенным раствором бикарбоната натрия, сушат над сульфатом магния и выпаривают растворитель, соединение кристаллизуют из этилового эфира, tпл.89-90C. 13 а. (4aS, 8 аR)-2-[1-S)-2-Аминопропаноил)пиперидин-4-ил]-4-(3,4-диметоксифенил)-4 а,5,8,8 атетрагидро-2 Н-фталазин-1-он. Указанное соединение получают из соединения 13 б, как описано для соединения 5 а. После выпаривания трифторуксусной кислоты остаток распределяют между водным раствором карбоната натрия и дихлорметаном. Органический раствор сушат над сульфатом магния и упаривают. Остаток кристаллизуют из диэтилового эфира, tпл.101-103C. 13 б. 1-трет-Бутил-3-S)-2-4-[(4aS, 8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Нфталазин-2-ил]пиперидин-1-ил-1-метил-2-оксоэтил)мочевина. Указанное соединение получают из соединения 5 в и (R)-2-(3-трет-бутилуреидо)пропионовой кислоты (N-Boc-L-аланин), как описано для соединения 5 б, tпл.153-154C. 14 а. (4aS, 8 аR)-2-1-[3-(2-Аминоэтилсульфанил)пропаноил]пиперидин-4-ил-4-(3,4-диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-он.- 20005824 Указанное соединение получают из соединения 14 б, как описано для соединения 5 в. После выпаривания трифторуксусной кислоты остаток распределяют между водным раствором бикарбоната и дихлорметаном. Раствор в дихлорметане сушат над сульфатом магния и упаривают. Остаток кристаллизуют из этилацетата/гексана, tпл.137-139C. 14 б. Трет-бутиловый эфир [2-(3-4-[(4aS, 8 аR)-4-(3,4-диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро 1 Н-фталазин-1-ил]пиперидин-1-ил-3-оксопропил-сульфанил)этил]карбаминовой кислоты. Указанное соединение получают из 12 ммолей 3-(2-трет-бутоксикарбониламиноэтилсульфанил) пропионовой кислоты и 10 ммолей соединения 5 в, как описано для соединения 5 б, tпл.132-134C. 15 а. Гидрохлорид (4aS, 8 аR)-2-1-[3-(2-аминоэтансульфонил)пропаноил]-пиперидин-4-ил-4-(3,4 диметоксифенил)-4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. 20 ммолей 3-хлорнадбензойной кислоты добавляют к раствору 10 ммолей соединения 14 а в 50 мл дихлорметана. Полученную смесь перемешивают при комнатной температуре в течение 30 мин, промывают водным раствором карбоната натрия и сушат над сульфатом магния. Затем к раствору в дихлорметане добавляют раствор соляной кислоты в диэтиловом эфире. Осадок отделяют фильтрованием и высушивают, tпл. 149-150 С. 16 а. Гидрохлорид (4aS, 8 аR)-2-[1-(6-аминогексил)пиперидин-4-ил]-4-(3,4-диметоксифенил)4 а,5,8,8 а-тетрагидро-2 Н-фталазин-1-она. Указанное соединение получают из соединения 16 б по реакции 4 и кристаллизуют в виде гидрохлорида из этилацетата, tпл.176-177 С. 16 б. 2-(6-4-[(4aS,8 аR)-4-(3,4-Диметоксифенил)-1-оксо-4 а,5,8,8 а-тетрагидро-1 Н-фталазин-2 ил]пиперидин-1-илгексил)изоиндол-1,3-дион. Смесь 6 ммолей 2-(6-бромгексил)изоиндол-1,3-диона, 6 ммолей соединения 5 в и 3 г карбоната калия в 50 мл диметилформамида перемешивают при комнатной температуре в течение 18 ч. После выпаривания растворителя остаток распределяют между водой и этилацетатом. Органический слой сушат над сульфатом магния и упаривают. Остаток очищают хроматографией (этилацетат/гексан, 4:1), tпл. 39-44C. А. 2-Амино-1-(4-амино-3,5-дихлорфенил)этанол. Указанное соединение получают, как описано в статье J. Keck, G. Kruger, K. Noll и H. Machleidt, Arzneim.-Forsch. (Drug Res.), 22, 861-869 (1972). Б. 2-Амино-1-(4-амино-3-хлор-5-трифторметилфенил)этанол. Указанное соединение получают, как описано в статье G. Kruger, J. Keck, K. Noll и H. Pieper, Arzneim.-Forsch. (Drug Res.), 34, 1612-1624 (1984). В. 2-Амино-1 -(4-гидрокси-3-гидроксиметилфенил)этанол. Указанное соединение получают, как описано в статье D.T.Cullin, D.Hartley, L.H.C.Lunts, J.C.Press,A.C. Ritchie и P. Toon, J. Med. Chem., 13, 674-680 (1970). Г. 4'-Амино-3'-хлор-5'-циано-2-бромацетофенон. Указанное соединение получают, как описано в статье G.Kruger, J.Keck, K.Noll и H.Pieper, Arzneim.Forsch. (Drug Res.), 34, 1612-1624 (1984). Д. 4'-Амино-3'-циано-2-бромацетофенон. Указанное соединение получают, как описано в статье G.Kruger, J.Keck, K.Noll и H.Pieper, Arzneim.Forsch. (Drug Res.), 34, 1612-1624 (1984).P. (цис)-2-(3,4-Диэтоксибензоил)-1,2,3,6-тетрагидробензойная кислота. Указанное соединение получают, как описано для соединения О. Промышленная применимость-Симпатомиметики (агонисты 2-адренорецептора) являются предпочтительными лекарственными средствами для экстренного ослабления бронхоспазм у пациентов с бронхиальной астмой (см. статьюNelson H.S., -Adrenergic bronchodilators, The New England of Medicine, 333, 499-506 (1995. Хотя основным действием -симпатомиметиков на дыхательные пути является расслабление гладких мышц дыхательных путей, в литературе сообщается об их ингибирующем действии на воспалительные клетки (например, тучные клетки, эозинофилы, нейтрофилы, макрофаги и Т-лимфоциты) в экспериментах in vitro(см. статью Barns P.J., Effect of beta-agonists on inflammatory cells, Journal of Allergy and Clinical Immunology, 104, S10-S17 (1999. Однако, несмотря на наличие ингибирующего действия на воспалительные клетки in vitro, оказалось, что -симпатомиметики не снижают хроническое воспаление при астме. Десенсибилизация к действию -симпатомиметиков более легко проявляется в воспалительных клетках,чем в клетках гладких мышц дыхательных путей, и возможно это наблюдение объясняет вышеуказанное различие в действии -симпатомиметиков. Предполагают, что такой тип десенсибилизации можно объяснить ускоренной деградацией цАМФ фосфодиэстеразой 4 (PDE4) (см. статью Giembycz M.A., Phosphodiesterase 4 and tolerance to -adrenoreceptor agonists in astma, TIPS, 17, 331-336 (1996. Поэтому, заявляется, что совместное действие одной молекулы как ингибитора активности PDE4 и как активатора 2 адренорецептора предотвращает развитие толерантности к агонистам 2-адренорецептора in vivo. Кроме того, такие молекулы совместного действия должны способствовать известному противовоспатительному действию ингибиторов PDE4 (см. статью Torphy T.J., Phosphodiesterase isozymes -molecular targets fornovel antiasthma agents, Am. J. Respir. Crit. Care Med., 157, 351-370 (1998, или даже увеличивать эффективность действия компонента, ингибирующего PDE4 благодаря компоненту-агонисту 2 адренорецептора, в условиях, при которых для действия ингибитора PDE4 требуется дополнительный активатор в виде цАМФ. Одним из примеров такой системы является эозинофил человека, который после стимуляции компонентом комплемента С 5 а не чувствителен к действию ингибиторов PDE4, используемых отдельно, но ингибируется высокосинергичным образом при совместном действии ингибиторовfunction, Brit. J. Pharmacol., 114, 821-831 (1995. Соединения по изобретению обладают ценными фармакологическими свойствами, которые позволяют использовать их в качестве коммерческих препаратов. Поскольку соединения селективно ингибируют PDE4 и одновременно действуют как агонисты 2-адренорецептора, с одной стороны, они пригодны для бронхиальной терапии (для терапии обструкций дыхательных путей благодаря их расширяющим свойствам, а также благодаря стимуляции и увеличению скорости дыхания), а с другой стороны, прежде всего, для терапии нарушений, преимущественно воспалительного характера, например, дыхательных путей, кожи, центральной нервной системы, кишечника, глаз и суставов, которые опосредованы медиаторами, такими как гистамин, фактор активации тромбоцитов (PAF), метаболиты арахидоновой кислоты(такие, как лейкотриены и простагландины), цитокины, интерлейкины, хемокины, альфа-, бета- и гаммаинтерфероны, фактор нектроза опухолей (ФИО) или активные формы кислорода и протеазы. Благодаря ингибирующему действию на PDE4 соединения по изобретению могут быть использованы в медицине и ветеринарии, например, при терапии и профилактике следующих заболеваний: острые и хронические (прежде всего, воспалительные и индуцированные аллергеном) заболевания дыхательных путей различной этиологии (бронхит, аллергический бронхит, бронхиальная астма, эмфизема, COPD); дерматозы (прежде всего, пролиферативного, воспалительного и аллергического типа), такие например,как обычный псориаз, токсическая и аллергическая контактная экзема, атопический дерматит, себорейная экзема, лишай, солнечный ожог, зуд в области гениталиев, гнездная алопеция, гипертрофические рубцы, дискоидная (хроническая) красная волчанка, фоликулярная и обширная пиодермия, эндогенные и экзогенные угри, розовые угри и другие пролиферативные, воспалительные и аллергические заболевания кожи; заболевания, вызванные избыточным высвобождением ФНО и лейкотриенов, например, заболевания типа артрита (ревматоидный артрит, ревматоидный спондилит, остеоартрит и другие артритные состояния), заболевания иммунной системы (СПИД, рассеянный склероз), реакция "трансплантат против хозяина", реакции отторжения трансплантата, симптомы шока (септический шок, эндотоксиновый шок,грам-отрицательный бактериальный сепсис, синдром токсического шока и ARDS (респираторный дистресс-синдром взрослых (отек легких и разлитые воспаления желудочно-кишечного тракта ( болезнь Крона и язвенный колит); заболевания, вызванные аллергическими и/или хроническими патологическими иммунологическими реакциями в области верхних дыхательных путей (глотка, нос) и смежных областей (придаточные пазухи носа, уши), такие, например, как аллергический ринит/синусит, хронический ринит/синусит, аллергический конъюнктивит и носовые полипы; а также кардиологические заболе- 22005824 вания, которые можно лечить ингибиторами PDE, такие, например, как сердечная недостаточность, или заболевания, которые можно лечить благодаря расслабляющему действию ингибиторов PDE на ткани,такие, например, как эректильная дисфункция или боли в почках и мочеточнике в связи с камнями в почках. Кроме того, соединения по изобретению могут найти применение при лечении несахарного диабета и заболеваний, связанных с нарушениями обмена веществ в мозге, таких, например, как старение мозга, старческая деменция (деменция Альцгеймера), мультиинфарктная деменция или другие заболевания ЦНС, такие, например, как депрессии, артериосклеротическая деменция, болезнь Альцгеймера или рассеянный склероз. Другим объектом изобретения является способ лечения млекопитающих, включая человека, страдающих одним из вышеупомянутых заболеваний. Способ включает введение больному млекопитающему терапевтически эффективного и фармакологически приемлемого количества одного или более соединений по изобретению. Кроме того, изобретение относится к соединениям по изобретению для применения в терапии заболеваний млекопитающих, включая человека, страдающих одним из вышеупомянутых заболеваний. Способ включает введение больному млекопитающему терапевтически эффективного и фармакологически приемлемого количества одного или более соединений по изобретению. Изобретение также относится к соединениям по изобретению для применения при лечении и/или профилактике заболеваний, прежде всего, заболеваний, указанных выше. Изобретение также относится к применению соединений по изобретению для изготовления лекарственных средств, которые используются при лечении и/или профилактике заболеваний, указанных выше. Еще одним объектом изобретения являются лекарственные средства, которые содержат одно или более соединений по изобретению, для лечения и/или профилактики вышеуказанных заболеваний. Другим объектом изобретения является коммерческий продукт, включающий обычную внешнюю упаковку, первичную упаковку, содержащую лекарственное средство (например, ингалятор или блистер) и необязательно вкладыш-инструкцию, причем лекарственное средство оказывает совместное действие,как антагонист циклонуклеотид-фосфодиэстераз типа 4 (PDE4) и агонист 32-адренорецепторов, и приводит к ослаблению симптомов заболеваний, опосредованных циклонуклеотид-фосфодиэстеразами типа 4(PDE4) и 32-адренорецепторами, причем пригодность лекарственного средства для профилактики или терапии заболеваний, опосредованных циклонуклеотид-фосфодиэстеразами типа 4 (PDE4) и 32 адренорецепторами, указана на внешней упаковке и/или на вкладыше-инструкции по применению коммерческого продукта, а лекарственное средство содержит одно или более соединений формулы I по изобретению. Внешняя упаковка, первичная упаковка и вкладыш-инструкция соответствуют стандартам для лекарственных средств подобного типа, известным специалисту в данной области техники. Лекарственные средства получают способами, известными специалисту в данной области. В качестве лекарственных средств соединения по изобретению (активные соединения) используют как таковые(отдельно) или предпочтительно в комбинации с соответствующими фармацевтическими эксципиентами, например, в форме таблеток, капсул, суппозиториев, пластырей, эмульсий, суспензий, гелей или растворов, причем содержание активного соединения преимущественно составляет от 0,1% до 95%. Специалисту в данной области благодаря его квалификации известны эксципиенты, пригодные для необходимых фармацевтических составов. Кроме растворителей, желирующих агентов, основ мазей и других носителей активного соединения, возможно использование, например, антиоксидантов, диспергирующих агентов, эмульгаторов, консервантов, солюбилизаторов, активаторов проникновения через кожу или комплексообразователей. При лечении заболеваний дыхательного тракта соединения по изобретению предпочтительно также вводят ингаляцией. Если соединения по изобретению вводят ингаляцией, предпочтительно используют аэрозоль с размером частиц от 0,5 до 10 мкм, предпочтительно от 2 до 6 мкм, в твердой, жидкой или смешанной композиции. Образование аэрозоля инициируют, например, давлением, создаваемым в струйном или ультразвуковом распылителе, предпочтительно с использованием газа-вытеснителя, подающего отмеренную дозу аэрозоля, или газа-вытеснителя, высвобождающего микроизмельченные активные соединения из ингаляционных капсул. В соответствии с используемой системой ингаляции препараты, кроме активного вещества (или веществ), содержат другие необходимые эксципиенты, такие как газы-вытеснители (например, фреон) в отмеренной дозе ингалятора, поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы или наполнители (например, лактоза в порошкообразных составах для ингаляции). Для ингаляции пригодны разнообразные устройства, благодаря которым можно получать аэрозоли с оптимальными размерами частиц и вводить способом, оптимальным для пациента. Кроме адаптеров(содержащих прокладку, распылитель) и грушевидных контейнеров (например, Nebulator, Volumatic), a также автоматического импульсного спрея с затвором-прерывателем (Autohaler) для подачи отмеренной дозы аэрозоля, прежде всего, при использовании порошкообразных композиций, существует множество технических конструкции (например, Diskhaler, Rotadisk, Turbohaler или ингалятор, описанный в ЕР- 23005824 0505321), благодаря которым может быть обеспечено оптимальное введение активного вещества (или веществ). При лечении дерматозов соединения по изобретению используют, прежде всего, в форме лекарственных средств, пригодных для местного применения. При получении лекарственных средств соединения по изобретению (активные соединения) предпочтительно смешивают с соответствующими фармацетическими эксципиентами, а затем перерабатывают в соответствующие фармацевтичские составы. Пригодные фармацевтические составы включают, например, порошки, эмульсии, суспензии, спреи, масла,мази, мази на основе масел, кремы, пасты, гели или растворы. Лекарственные средства по изобретению получают известными способами. Дозировки активных соединений соответствуют величинам, обычным для ингибиторов PDE. Таким образом, формы местного применения (например, такие, как мази) для лечения дерматозов содержат активные соединения в концентрации, например, 0,1-99%. При введении ингаляцией доза обычно составляет от 0,1 до 3 мг в сутки. При системной терапии (введение перорально или внутривенно) стандартная доза составляет от 0,03 до 3 мг/кг в сутки. Биологические испытания При исследовании совместного действия соединений (ингибирования PDE4 и сродства к 2 адренорецептору) на клеточном уровне особое значение имеет активация воспалительных клеток. Например, можно упомянуть продуцирование супероксида, индуцированное компонентом комплемента С 5 а в эозинофильных гранулоцитах, которое можно измерить по хемилюминесценции, индуцированной люминолом (см. статью Hatzelmann A., Tenor H. и Schudt С, Differential effects of non-selective and selective phosphodiesterase inhibitors on human eosinophil function, Brit. J. Pharmacol., 114, 821-831 (1995. В данном эксперименте ингибиторы PDE4 неэффективны до тех пор, пока одновременно не стимулированы 2-адренорецепторы. Второй мессенджер, цАМФ, известен как ингибитор воспалительных клеток и иммунокомпетентных клеток. Изофермент PDE4 активно экспрессируется клетками, принимающими участие в инициации и развитии воспалительных процессов (см. статью Н. Tenor и С. Schudt, Phosphodiesterase inhibitors, 2140, в книге The Handbook of Immunopharmacology, Academic Press, (1996, и его ингибирование приводит к увеличению концентрации внутриклеточного цАМФ и следовательно, к ингибированию активации клеток (J.E. Souness и др., Immunopharmacology, 47, 127-162 (2000. Описано противовоспалительное действие ингибиторов PDE4 in vivo на различных моделях животных (см. статью М.М. Teixeira, TIPS, 18, 164-170 (1997. Для исследования ингибирования PDE4 на клеточном уровне (in vitro) можно измерять множество предвоспалительных ответов. Примерами являются продуцирование супероксида нейтрофильными (см. статью С.Schudt и др., Arch. Pharmacol., 344, 682-690(1991 или эозинофильными (см. статью A. Hatzelmann и др., Brit. J. Pharmacol., 114, 821-831 (1995 гранулоцитами, которое можно определить по хемилюминисценции, индуцированной люминолом, или синтез фактора- некроза опухоли в моноцитах, макрофагах или дендритных клетках (см. статьи Gantner и др., Brit. J. Pharmacol., 121, 221-231 (1997) и Pulmonary Pharmacol. Therap., 12, 377-386 (1999. Кроме того, в пользу иммуномодулирующего действия ингибиторов PDE4 свидетельствует ингибирование ответа Т-клеток в виде синтеза цитокинов или пролиферации (см. статью D.M. Essayan, Biochem.Pharmacol., 57, 965-973 (1999. Соединения, которые ингибируют секрецию вышеупомянутых предвоспалительных медиаторов, являются ингибиторами PDE4. Противовоспалительное действие соединений,содержащих компонент, ингибирующий PDE4, может быть усилено компонентом-агонистом 2 адренорецептора по аддитивному или синергичному механизму. а) Метод определения ингибируюшей активности в отношении PDE4. Активность PDE4 определяют по методу Thompson и др.(Adv. Cycl. Nucl. Res., 10, 69-92 (1979 в модификации Bauer and Schwabe (Naunyn-Schmiedeberg's Arch. Pharmacol., 311, 193-198 (1980. К реакционной смеси для анализа (конечный объем 200 мкл в лунках 96-луночного планшета), содержащей 20 мМ Трис-HCl (рН 7,4), 5 мМ MgCl2, 0,5 мкМ цАМФ, [3 Н]цАМФ (приблизительно 30000 имп./анализ),исследуемое соединение и аликвотную часть цитозоля нейтрофилов человека, которая обычно содержит активность PDE4 (см. статью Schudt и др., Naunyn-Schmiedeberg's Arch. Pharmacol., 344, 682-690 (1991,добавляли РDЕ 3-специфичный ингибитор Motapizone (1 мкМ) для подавления активности PDE3, которая содержится в примесных тромбоцитах. Образцы соединений, описанных в ряде примеров (1-19), готовили в виде исходных растворов (2 ммоля/л) в ДМСО и разбавляли 1:100 (об./об.) в вышеупомянутом буферном растворе Трис-HCl. Соответствующие разведения готовили в 1%(об./об.) ДМСО/Трис-HCl, а затем разбавляли при анализе в отношении 1:2 (об./об.) для получения конечной концентрации ингибиторов в присутствии 0,5% (об./об.) ДМСО, что не влияло на активность PDE. Чтобы свести к минимуму проблемы с растворимостью соединений, готовили 20 серийных разведений соединений непосредственно в ДМСО, а затем при анализе разбавляли 1:100 (об./об.), получая конечные концентрации ингибиторов в присутствии 1% ДМСО, что незначительно влияло на активность- 24005824 Предварительную инкубацию проводили при 37 С в течение 5 мин, затем инициировали реакцию добавлением субстрата (цАМФ) и образцы инкубировали при 37 С в течение еще 15 мин. Реакцию останавливали добавлением 50 мкл 0,2 н. НСl и образцы выдерживали на льду в течение приблизительно 10 мин. После инкубации в присутствии 25 мкг 5'-нуктеотидазы (из яда змеи Crotalus atrox) при 37 С в течение 10 мин образцы наносили на колонки с QAE сефадексом А-25 (объемом 1 мл). Колонки элюировали 2 мл 30 мМ формиата аммония (рН 6,0) и в элюатах измеряли радиоактивность. Результаты корректировали с использованием величин, полученных в контроле (в присутствии денатурированного белка),которые составляли менее 5% от общей радиоактивности. Количество гидролизованных циклических нуклеотидов не превышало 30% от исходной концентрации субстрата. Ингибирующую активность соединений по изобретению в отношении PDE4 определяли в виде величин IC50 , которые рассчитывали по графикам зависимости концентрация ингибирование с использованием нелинейного регрессионного анализа. Величины ингибирования PDE4 для соединений по настоящему изобретению (ингибирующая концентрация в виде -log IC50 (моль/л приведены в таблице А, где номера соединений соответствуют номерам примеров. б) Активность агониста 2-адренорецептора, определенная с использованием изолированной трахеи морских свинок. Самцов морских свинок (массой 350-450 г) забивали резким ударом по голове и обескровливали,затем отделяли трахею. После очистки от соединительной ткани трахею разрезали на отдельные кольца,которые связывали друг с другом, получая вплоть до шести 4-5-звенных цепей. Полученные цепи, суспендировали в бане для органов объемом 10 мл, содержащей буферный раствор Кребса следующего состава (мМ): NaCl 118, KСl 5,2, СаСl2 1,9, MgSO4 0,56, NaH2PO4 0,8, NaHCO3 25,0, и глюкозу 11,1, и выдерживали при 37 С при непрерывной аэрации смесью 95% О 2 и 5% СО 2. Концевую часть цепи привязывали к дну бани, соединяли с датчиком сил смещения (тип К-30, фирма Hugo Sachs Elektronik, Германия) для регистрации изменения статического напряжения и давали нагрузку от 1,5 до 2 г. После уравновешивания в течение 60 мин, в процессе которого препараты повторно промывали, а самопроизвольные сокращения достигали плато, каждый препарат трахеи подвергали предварительной обработке 3x10-7 М раствором RP73401 для полного ингибирования PDE4, что вызывало релаксацию ткани в интервале между 30% и 40% от максимальной величины (см. статью Harris и др., JPET, 251, 199-206 (1989. После стабилизации релаксации, вызванной RP73401, вводили анализируемые лекарственные средства накопительным методом (фактор 3), причем перед добавлением следующей более высокой концентрации каждая концентрация находилась в контакте с трахеей до тех пор, пока контрактильная реакция не достигала плато. По завершении введения исследуемого лекарственного средства, которое вызывало максимальную релаксацию ткани (что было подтверждено в контрольных экспериментах для каждого исследуемого лекарственного средства дополнительным введением 10-6 М (-)изопреналина), дополнительно вводили антагонист 2-адренорецептора, dl-солатол, в высокой концентрации (3-6x10-4 М). Таким способом определяли, не вызвана ли расслабляющая реакции трахеи на анализируемые соединения стимуляцией 2 адренорецептора. dl-Sotalol практически полностью обращал амплитуду релаксации в ответ на исследуемые соединения и был использован для доказательства их действия как агонистов 2-адренорецептора. Релаксирующий ответ на исследуемое соединение выражали в виде процента, определенного в интервале между амплитудой релаксации при действии RP73401 (0%) и максимальной релаксацией до введения dlсолатола (100%). Величины ЕС 50, половины максимальной релаксации при введении анализируемого соединения,определяли графической интерполяцией с использованием от 12 до 16 индивидуальных кривых зависимости концентрация-ответ. Полученные таким образом величины -log EC50 (моль/л) принимали за меру активности агониста 2-адренорецептора для исследуемых соединений. Величины -log EC50 (моль/л) для соединений по настоящему изобретению приведены в таблице А,где номера соединений соответствуют номерам примеров. в) Ингибирование хемилюминесценции, стимулированной С 5 а, в эозинофилах человека. Эозинофилы очищали в основном, как подробно описано в статье Hatzelmann A., Tenor H. andfunction, Brit. J. Pharmacol., 114, 821-831 (1995). Краткое описание методики: суммарную фракцию гранулоцитов сначала выделяли из крови (с добавлением в качестве антикоагулянта 0,3 маc./об.% цитрата натрия) осаждением декстраном, центрифугированием на слое фикола и лизисом остаточных эритроцитов в гипотонических условиях. Для дальнейшей очистки эозинофильной фракции использовали систему для магнитного разделения клеток (MACS, фирма Miltenyl Biotec, Бергиш-Гландбах, Германия). Эозинофилы отделяли от нейтрофилов негативной селекцией с использованием микрочастиц анти-СD16 по двухстадийной схеме с использованием D- и BS-колонок (ранее названных В 2-). Этот метод позволяет получить эозинофилы человека с чистотой 99% и жизнеспособностью 97%. Анализ с использованием хемилюминесценции (CL) в основном проводили, как описано в статье(140 мМ NaCl, 5 мМ KСl, 1 мМ MgCl2, 10 мМ HEPES, рН 7,4), содержащем 1 мМ СаСl2, 1 мг/мл глюкозы, 0,05% (маc./об.) БСА, 10 мкМ люминола и 4 мкМ микропероксидазы (все величины соответствуют конечной концентрации в реакционной смеси для анализа) в конечном объеме 0,5 мл при концентрации клеток 10 клеток/мл. Аликвотные части (0,4 мл) клеточной суспензии (содержащей люминол и микропероксидазу) предварительно инкубировали при 37 С в течение 5 мин в присутствии или в отсутствии ингибиторов (0,05 мл). Исходные растворы ингибиторов (10 мМ) готовили в ДМСО и разбавляли 1:100(об./об.) в буферном растворе CL; затем готовили серийные разведения в 1% ДМСО/буферный растворCL, при этом получали конечные концентрации лекарственных средств в реакционной смеси для анализа при концентрации ДМСО 0,1% (об./об.), при которой ДМСО оказывает только незначительное влияние на CL-ответ. В качестве дополнительного инициатора цАМФ в ходе предварительной инкубации клеток в смесь дополнительно вводили 0,01 мл салбутамола (конечная концентрация составляла 100 нМ, при которой салбутамол практически не оказывает влияния на CL-ответ). После предварительной инкубации образцы переносили в прибор для измерения хемилюминесценции Multi-Biolumat LB 9505C (фирмаBerthold, Вильдбад, Германия) и реакцию стимулировали добавлением 0,05 мл С 5 а (растворенного в CLбуферном растворе; при конечной концентрации 100 нМ). Величину CL регистрировали непрерывно через 1 мин (С 5 а) и рассчитывали величину AUC (площадь под кривой). Ингибирование CL соединениями по настоящему изобретению в данных условиях дано в виде -logIC30 (моль/л). Данные по ингибированию CL соединениями по изобретению приведены в виде величин -log IC30(моль/л) в таблице А, где номера соединений соответствуют номерам примеров. Таблица А где Ar1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 8 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанный 5-, 6- или 7-членный углеводородный цикл,R6 и R7, независимо друг от друга, каждый означает водород или С 1-С 4 алкил, илиR6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь, -О- (кислород), -С(О)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,Y означает химическую связь, фенилен или азациклоалкилен,Z означает химическую связь, -S- или -S(O)2-,m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил,амино или формиламино,R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,R11 означает водород или галоген,и соли указанных соединений. 2. Соединения формулы I по п.1, где Ar1 означает фенильный радикал формулы (Iа), замещенныйR1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое или циклогексановое кольцо,R6 и R7, независимо друг от друга, каждый означает водород или С 1-С 4 алкил илиR6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4 иn означает целое число от 1 до 4, илиY означает 1,4-фенилен,m означает целое число от 0 до 4 иn означает целое число от 1 до 4, илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь, -С(О)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,Y означает 4,1-пиперидинилен,Z означает химическую связь, -S- или -S(O)2-,m означает целое число от 1 до 4, иn означает целое число от 1 до 4, илиX означает химическую связь, -О-, -С(О)-, -S(O)2-, -C(O)-NH- или -C(S)-NH-,Y означает 1,4-фенилен,Z означает химическую связь, -S- или -S(O)2-,m означает целое число от 1 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил,амино или формиламино [-NH-C(O)H], R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,R11 означает водород или галоген,и соли указанных соединений. 3. Соединения формулы I по п.1, гдеAr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 2 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спираносвязанное циклопентановое или циклогексановое кольцо,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из ряда А или означает -CmH2m-Y-X-CnH2n-, где или X означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4,n означает целое число от 1 до 4, илиX означает химическую связь, -О- или -C(O)-NH-,Y означает 1,4-фенилен,m означает целое число от 0 до 4, иn означает целое число от 1 до 4 илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь или -С(О)-,- 28005824Y означает 4,1-пиперидинилен,Z означает химическую связь, -S- или -S(O)2-,m означает целое число от 1 до 4 иn означает целое число от 1 до 4, илиX означает химическую связь, -О- или -C(O)-NH-,Y означает 1,4-фенилен,Z означает химическую связь,m означает целое число от 1 до 4 иn означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, причемR9 означает водород, гидроксил или амино,R10 означает водород, галоген, циано, трифторметил или гидроксиметил,R11 означает водород или галоген,и соли указанных соединений. 4. Соединения формулы I по п.1, где Аr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает метокси или этокси,R2 означает метокси или этокси,R3 означает метокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое кольцо,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь,Y означает химическую связь,m означает целое число от 1 до 4,n означает целое число от 1 до 4, илиX означает химическую связь, -О- или -C(O)-NH-,Y означает 1,4-фенилен,m означает целое число от 0 до 1 иn означает целое число от 1 до 4, илиn означает целое число от 1 до 4, или А означает -Y-X-CmH2m-Z-CnH2n-, гдеX означает химическую связь или -С(О)-,Y означает 4,1-пиперидинилен,Z означает химическую связь, -S- или -S(O)2-,m равно 2 или 3 иAr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофу- 29005824 ранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 4 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 8 алкокси или С 1-С 4 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 4 алкокси,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосоединенное 5-, 6- или 7-членное углеводородное кольцо,R6 и R7, независимо друг от друга, каждый означает водород или С 1-С 4 алкил, или R6 и R7 вместе,включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь, -О- (кислород), -С(О)- или -C(O)-NH- ,Y означает химическую связь, фенилен или азациклоалкилен,m означает целое число от 0 до 4,n означает целое число от 1 до 4,R8 означает водород,Аr2 означает фенильный радикал, замещенный R9, R10 и R11, где R9 означает водород, гидроксил,амино, формиламино,R10 означает водород, галоген, гидроксил, циано, трифторметил или гидроксиметил,R11 означает водород или галоген,и соли указанных соединений. 6. Соединения формулы I по п.1, гдеAr1 означает фенильный радикал формулы (Iа), замещенный R1 и R2, или радикал дигидробензофуранил формулы (Ib), замещенный R3, R4 и R5 где R1 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R2 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R3 означает С 1-С 2 алкокси или С 1-С 2 алкокси, который полностью или преимущественно замещен фтором,R4 и R5 вместе, включая два атома углерода, к которым они присоединены, образуют спирановосвязанное циклопентановое или циклогексановое кольцо,R6 и R7 вместе, включая два атома углерода, к которым они присоединены, образуют группу, выбранную из рядаX означает химическую связь или -С(О)-,Y означает химическую связь, 1,4-фенилен или 4,1-пиперидинилен,m означает целое число от 0 до 4,- 30
МПК / Метки
МПК: A61P 11/06, C07D 237/14, A61K 31/50
Метки: фосфодиэстеразы, эффективные, адренорецептора, ингибиторов, соединения, beta, качестве, агонистов
Код ссылки
<a href="https://eas.patents.su/30-5824-soedineniya-effektivnye-v-kachestve-agonistov-beta-2-adrenoreceptora-i-ingibitorov-fosfodiesterazy-pde4.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, эффективные в качестве агонистов &beta- 2 – адренорецептора и ингибиторов фосфодиэстеразы pde4</a>
Предыдущий патент: Способ лечения с использованием конъюгатов лиганд-иммуноген
Следующий патент: Производные аминоалкоксибензоилбензофурана, способ их получения и содержащие их композиции
Случайный патент: Способ и устройство для извлечения кислого газа при сниженных энергозатратах












