Производные фталазина в качестве ингибиторов фосфодиэстеразы 4
Номер патента: 3702
Опубликовано: 28.08.2003
Авторы: Наполетано Мауро, Мораццони Габриеле, Гранчини Джанкарло, Норчини Габриеле, Пеллачини Франко
Формула / Реферат
1. Соединение формулы I
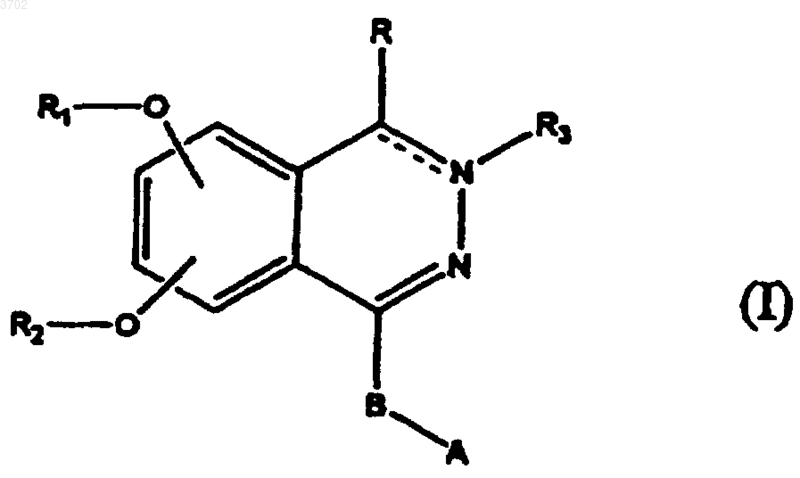
где ---- представляет одинарную или двойную связь;
B представляет метилен;
A представляет пиридин, замещенный одним заместителем или большим количеством заместителей;
R представляет два атома водорода или C = O группу, когда ---- представляет одинарную связь, или, когда ---- представляет двойную связь, R представляет водород, необязательно замещенный арил или гетероцикл, (C1-8)алкил, (C2-8)алкенил или (C2-8)алкинил, необязательно замещенный арилом или гетероциклом; арилокси, гетероциклилокси, арил-C1-4-алкокси, гетероциклил-C1-4-алкокси, аминогруппу, замещенную одной или двумя C1-4-алкильной(ыми) группой(ами), ариламино, гетероциклиламино, арил-C1-4-алкиламино, гетероциклил-C1-4-алкиламино;
R1 представляет C1-6-алкил или C4-7-циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем;
R2 представляет C1-6-алкил; полифторC1-6-алкильную группу;
R3 представляет водород;
C1-6-алкил, необязательно замещенный арилом, гетероциклом или COR5 группой, где R5 представляет гидрокси, C1-4-алкокси или гидроксиамино;
-COR6, где R6 представляет водород, арил, арил-C1-6-алкил, аминогруппу, необязательно алкилированную или моногидроксилированную, гидрокси, C1-4-алкокси, карбокси, C1-4-алкоксикарбонил,
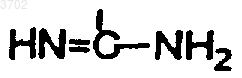
или C1-4-алкил, необязательно замещенный гетероциклом;
C1-4-алкилсульфонил;
NR O производные соединений формулы I и их фармацевтически приемлемые соли.
2. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 в смеси с соответствующим носителем.
3. Фармацевтическая композиция по п.2 для лечения аллергических и воспалительных патологий.
4. Фармацевтическая композиция по п.3 для лечения респираторных заболеваний.
Текст
1 Настоящее изобретение относится к производным фталазина, к фармацевтическим композициям, содержащим их и к их использованию в качестве ингибиторов фосфодиэстеразы 4. Фосфодиэстеразы представляют семейство изоферментов, которые составляют основу главного механизма гидролитической инактивации сАМР (циклического аденозин-3',5'монофосфата). Было показано, что сАМР является вторичным мессенджером, передающим биологический ответ многим гормонам, нейропередатчикам и лекарственным препаратам[Krebs Endocrinology Proceedings of the 4th International Congress Excerpta Medica, 17-29, 1973]. Когда соответствующий агонист связывается с поверхностью клетки, аденилированная циклаза активизирует и превращает Mg2+-ATP в сАМР. САМР модулирует активность большинства,если не всех клеток, влияющих на патофизиологию различных респираторных заболеваний, как аллергического происхождения, так и неаллергического происхождения. Это приводит к тому,что увеличение концентрации сАМР создает благотворные эффекты, такие как релаксация гладкой мышцы дыхательных путей, ингибирование высвобождения медиатора тучных клеток(базофильных клеток гранулзы), подавление нейтрофильной и базофильной дегрануляции,ингибирование моноцитной и макрофаговой активации. Таким образом, соединения, способные активировать аденилатциклазу или ингибировать фосфодиэстеразы, могут подавлять нежелательную активацию гладкой мышцы дыхательных путей и большое количество воспалительных клеток. В семействе фосфодиэстераз имеется отдельная группа изоферментов, фосфодиэстераз 4 (далее PDE 4) специфичных для гидролиза сАМР в гладкой мышце дыхательных путей и воспалительных клетках (Torphy, "Изоферменты фосфодиэстеразы: Потенциальные мишени для новых антиастматических агентов" ("Phosphodiesterase Isoenzymes: Potential Targets for NovelAnti-asthmatic Agents" в New Drugs for Asthma,Barnes, ed. IBC Technical Services Ltd, 1989). Исследования, проведенные по этому ферменту,показывают, что его ингибирование дает не только релаксацию гладкой мышцы дыхательных путей, но также подавляет мастоцитную,базофильную и нейтрофильную дегрануляцию так, что ингибирует моноцитную и нейтрофильную активацию. Таким образом, ингибиторыPDE 4 являются эффективными при терапии астмы. Такие соединения предлагают уникальный подход к терапии различных респираторных заболеваний, как аллергического происхождения, так и неаллергического происхождения,и обладают значительными терапевтическими преимуществами по сравнению с существующей в настоящее время терапией. 2 Избыточное или неравномерное продуцирование фактора некроза опухоли (далее TNF),цитокина с провоспалительной активностью,производимого различными типами клеток, вызывает передачу или обострение многих патологий, таких как, например, респираторного дистресс-синдрома у взрослых (ARDS) и хронического легочного воспалительного заболевания. Следовательно, соединения, способные контролировать негативные воздействия TNF, т.е. ингибиторы этого цитокина, должны рассматриваться как полезные против многих патологий. Патентная заявка ЕР-0017411 (Pfizer) иллюстрирует фталазины формулы(С 3-7)циклоалкилом. Эти соединения, как считают, являются ингибиторами фосфодиэстеразы с функцией стимулятора на сердечной мышце,следовательно, их активность не относится к где n=0-4; R1 представляет необязательно замещенный низший алкокси, необязательно замещенный циклоалкил, или -OR9 группу, где R9 представляет необязательно замещенную арилалкильную группу; Х представляет -N= или-NR6-, где R6 представляет водород, группу низшего алкила или необязательно замещенные арилалкильную или гетероарилалкильную группы; Y представляет -СО или -СВ=, где В представляет NR7R8, где один из R7 и R8 может быть Н, а другой - необязательно замещенной гетероарилалкильной группой, или В представляет водород или необязательно замещенный арил,гетероарил, арилалкил или гетероарилалкильную группу; А представляет водород или атом галоида, или необязательно моно- или дизамещенную аминогруппу, необязательно замещенный арил, гетероарил или гетероарилалкильную группу. Среди групп, необязательно замещающих вышеупомянутые остатки, приводят атомы галоидов. Эти соединения, как считают, являются активными в качестве ингибиторов cGMPPDE, т.е. PDE 5, фосфодиэстеразы действующей только посредством cGMP-зависимого мезанизма и чья область применения является, как отмечено, сердечно-сосудистой (Schudt С. и соавт., Ингибиторы фосфодиэстеразы (Phosphodiesterase Inhibitors), Academic Press). где Y и Y1 представляют низшие алкокси; Z представляет фенил, необязательно замещенный галоидом, или бензил; R представляет водород. Этим фталазинам приписывают седативную и гипотензивную активность без упоминания механизма действия. Патент США 3813384 (Asta-Werke) иллюстрирует, между прочим, бензилфталазиноны формулы где R1 и R2 представляют низший алкокси или галоид; Х представляет необязательно разветвленную алкиленовую цепь; m и n равняются 1-3; р равняется 0 или 1; и группа представляет С 3-8 моно-, ди- или трициклический остаток, содержащий один или два атом(а) азота. Такие соединения обладают гистаминолитическим действием и являются полезными, например, при лечении астмы. Патентная заявка NL 8005411 (Mitsubishi где X представляет кислород или NH; R1, R2 иR3 представляют, между прочим, (С 1-5)алкил,(С 1-5)алкокси, галоид или СF3, n, m и р равняются 0-3. Эти соединения используют в качестве ингибиторов пиастриновой (piastrinic) агрегации. Патентная заявка JP-56061365 (Showa где, между прочим, R представляет галоид и n равно 1-3, в качестве сосудорасширяющих факторов и противоязвенных средств. В настоящее время неожиданно был обнаружен новый класс производных фталазина,способный ингибировать PDE 4 и TNF. Следовательно, настоящее изобретение относится к соединениям формулы I гдепредставляет одинарную или двойную связь; В представляет NH, метилен, С 2-6 алкиленовую цепь, необязательно разветвленную и/или ненасыщенную и/или прерванную C5-7 циклоалкильным остатком; А представляет фенил или гетероцикл, необязательно замещенный одним заместителем или большим количеством заместителей, илиR представляет два атома водорода или С=O группу, когдапредставляет одинарную связь или когдапредставляет двойную связь,R представляет водород, необязательно замещенный арил или гетероцикл, (С 1-8)алкил, (С 28)алкенил или (С 2-8)алкинил, необязательно замещенный арилом или гетероциклом; арилокси,гетероциклилокси, арил-С 1-4-алкокси, гетероциклил-C1-4-алкокси, аминогруппу, замещенную одной или двумя С 1-4-алкильной(ыми) группой(ами), ариламино, гетероциклиламино, арилС 1-4-алкиламино,гетероциклил-С 1-4-алкиламино;R1 представляет C1-6-алкил, арил, арилС 1-10-алкил, С 4-7-циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем;R3 отсутствует, когдапредставляет двойную связь или когдапредставляет одинарную связь R3 представляет водород;-COR6, где R6 представляет водород, арил,арил-С 1-6-алкил, аминогруппу, необязательно алкилированную или моногидроксилированную, гидрокси, С 1-4-алкокси, карбокси, С 1-4 алкоксикарбонил,или С 1-4-алкил, необязательно замещенный гетероциклом; С 1-4-алкилсульфонил;NO производные соединений формулы I и их фармацевтически приемлемые соли; при условии, что, когдапредставляет двойную связь, А представляет фенил или азотсодержащий гетероцикл, и R1 представляет арил, арил-С 1-10-алкил, С 4-7-циклоалкил, необязательно содержащий атом кислорода и/или замещенный полярным заместителем; тогда R является отличным от водорода, фенила или(С 1-4)алкила, необязательно замещенного арилом. Условие, присутствующее в значениях формулы I, имеет целью исключить соединения,описанные в итальянской патентной заявкеМ 197 А 002806 под именем этого же заявителя. Предпочтительными соединениями формулы I являются соединения, гдепредставляет одинарную или двойную связь; В представляет метилен или С 2-6 алкиленовую цепь; А представляет фенил или гетероцикл, необязательно замещенный одним или большим количеством заместителей; R представляет два атома водорода или группу =O, когдапредставляет одинарную связь или когдапредставляет двойную связь R является водородом, необязательно замещенным арилом или гетероциклом,(С 1-8)алкилом, (C2-8)алкенилом или (С 2-8)алкинилом, необязательно замещенным арилом или гетероциклом; арилокси, гетероциклилокси,арил-С 1-4-алкокси, гетероциклил-С 1-4-алкокси,аминогруппой, замещенной одной или двумя С 1-4-алкильной,ариламино,гетероциклиламино, арил-С 1-4-алкиламино, гетероциклилС 1-4-алкиламиногруппами; R1 представляет C1-6 алкил, арил, арил-С 1-10-алкил, С 4-7-циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем; R2 представляет С 1-6-алкил; полифторС 1-6-алкильную группу; R3 отсутствует, когдапредставляет двойную связь, или, когдапредставляет одинарную связь, R3 представляет водород;-СОR6, где R6 представляет водород, арил,арил-С 1-6-алкил, необязательно алкилированный или моногидроксилированный амино, гидрокси,С 1-4-алкокси, карбокси, С 1-4-алкоксикарбонил,или C1-4-алкил, необязательно замещенный гетероциклом;NO производные соединений формулы I и их фармацевтически приемлемые соли; при условии, что когдапредставляет двойную связь, А представляет фенил или азотсодержащий гетероцикл, и R1 представляет арил, арил-С 1-10-алкил, С 4-7-циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем; тогда R является отличным от водорода,фенила или (С 4-7)алкила, необязательно замещенного арилом. Еще более предпочтительными соединениями формулы I являются соединения, где представляет двойную связь; В представляет метилен; А представляет пиридин, замещенный одним или большим количеством заместителей;R представляет необязательно замещенный арил или гетероцикл, (С 1-8)алкил, (С 2-8)алкенил или(С 2-8)алкинил, необязательно замещенный арилом или гетероциклом; арилокси, гетероциклилокси, арил-С 1-4-алкокси, гетероциклил-С 1-4 алкокси, аминогруппу, замещенную одной или двумя С 1-4-алкильной, ариламино, гетероциклиламино, арил-С 1-4-алкиламино, гетероциклилС 1-4-алкиламиногруппами; R1 представляет C1-6 алкил или С 4-7-циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем; R2 представляет С 1-6-алкил; полифторС 1-6-алкильную группу; R3 отсутствует; NO производные соединений формулы I и их фармацевтически приемлемые соли. Соединения формулы I могут иметь один или большее количество асимметрический(х) центр(ов) и, таким образом, находиться в форме стереоизомеров. Целью настоящего изобретения являются соединения формулы I в форме стереоизомерных смесей так же, как единичных стереоизомеров. Соединения формулы I являются активными в качестве ингибиторов PDE 4 и TNF и,таким образом, используются как терапевтические агенты при аллергических и воспалительных патологиях, таких как, например, эмфизема,хронические бронхиты, астма и аллергический ринит. В качестве гетероцикла особо имеют в виду имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, пиперазин, триазин, морфолин, пирролидин, пирролин, имидазолин, пиразолин, пиразолидин, имидазолидин, пиперидин,фуран, пиран, изотиазол, изоксазол, тиофен и им подобные. Заместителями, не обязательно присутствующими на А остатках, могут быть галоиды, в качестве которых имеются в виду атомы фтора, хлора, брома или иода, и заместители -оксо, нитро, карбокси, трифторметил,амино. Конкретными примерами алкильных групп являются метил, этил, н-пропил, изопропил, нбутил, втор-бутил, трет-бутил, 2-метилпропил,н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 3-метил-2-бутил, н-гексил и им подобные. В качестве (С 5-7)циклоалкильной группы имеют в виду циклопентил, циклогексил и циклогептил, и когда ее замещают атомом кислорода, имеют в виду, например, тетрагидрофуран или тетрагидропиран, в то время как арил и арил-С 1-10-алкил означают ароматическое кольцо или систему из 6-10 атомов углерода, такую как, например, фенил, бензил, фенетил, фенилпентил, нафтил, инданил, инданилпентил и им подобные. Окисленная форма NO, если присутствует, может включать как атомы азота фталазинового кольца, так и атомы азота присутствующие на А, когда А представляет гетероциклический заместитель. 7 Фармацевтически приемлемые соли соединений формулы I являются солями с органическими и неорганическими кислотами, такими как, например, хлористо-водородная, бромистоводородная, иодисто-водородная, азотная, серная, фосфорная, уксусная, бензойная, малеиновая, фумаровая, винная, лимонная, аспарагиновая, янтарная, метансульфоновая, 3,7-дитретбутилнафталин-1,5-дисульфоновая (дибудиновая кислота), или с неорганическими основаниями, такими как, например, гидроокись натрия или калия, бикарбонат натрия. Синтез соединений формулы I протекает согласно способам, известным специалистам в данной области. Например, кислота формулы II где R1 и R2 являются такими, как они определены выше, которую, например, обработкой галоидирующим агентом, например, тионилхлоридом, превращают в соответствующий ацилгалогенид формулы III где R1 и R2 являются такими, как они определены выше, а Х представляет хлор или бром. Это соединение подвергают взаимодействию с диэтиламином, по крайней мере, в эквимолярном количестве, с получением бензамида формулы где R1 и R2 являются такими, как они определены выше, который с диметилформамидом в присутствии сильного органического основания,такого как, например, бутиллитий, третбутиллитий, втор-бутиллитий, и, необязательно,в присутствии лиганда, такого как, например,тетраметилэтилендиамин, дает соединение формулы Vа где R1 и R2 являются такими, как они определены выше, a R1 представляет водород. Когда является желательным соединение формулы I, где R представляет водород, соединение Va подвергают взаимодействию с эквимолярным количеством трет-бутилкарбазата с получением соединения формулы VIa где R1, R1 и R2 являются такими, как они определены выше, и R' представляет защищающую группу карбоксильной функции, такую как, например, трет-бутил. Когда соединение формулы I, где R является отличным от водорода ипредставляетRII-литием, где RII представляет арил, арилалкил, арилалкенил, арилалкинил, гетероцикл,гетероциклилалкил, гетероциклилалкенил, гетероциклилалкинил, C1-8-алкил, С 2-8-алкенил или С 2-8-алкинил, линейный или разветвленный,необязательно прерванный гетероатомом, выбранным из кислорода и азота, и необязательно замещенный соответственно защищенной гидрокси или оксогруппой, с получением соединения формулы VII где RII, R1 и R2 являются такими, как они определены выше. Соединение VII подвергают взаимодействию с соответствующим окисляющим агентом, таким как, например, пиридинхлорхромат, и получают соединение формулы где R1, R2 и RII являются такими, как они определены выше, которое будучи обработано эквимолярным количеством трет-бутилкарбазата дает соединение формулы VIb где R1, R2, R' и RII являются такими, как они определены выше. Соединение VIa или VIb подвергают взаимодействию с трифторуксусной кислотой с получением фталазинона формулы VIII где R, R1 и R2 являются такими, как они определены выше. Этот фталазинон подвергают взаимодействию с галогенирующим агентом, таким как, например, фосфорил хлорид, с получением фталазина формулы IX где R, R1 и R2 являются такими, как они определены выше, а X' представляет атом галоида. Альтернативно, соединение формулы VIII можно получать непосредственно из соединения формулы Va или Vb путем обработки гидразином в уксусной кислоте. Соединение IX дает соединение I путем реакции с соединением формулы ХNa, Mg или комплекс переходного металла, дает соединение I, где R имеет приведенные выше значения, гдепредставляет двойную связь. Альтернативно, соединения I, где В является отличным от амино, можно получать исходя из кислоты формулы II, которая за счет реакции с формальдегидом/НСl дает соединение формулы XI где R1 и R2 являются такими, как они определены выше. Это соединение окисляют, например,бензоил пероксидом/N-бромсукцинимидом, и затем гидролизуют с получением соединения формулы ХII где R1 и R2 являются такими, как они определены выше, которое с галоидводородной кислотой и трифенилфосфином дает соединение формулы где R1 и R2 являются такими, как они определены выше, которое будучи обработано алдегидом формулы XIV А-В"-СНО(XIV),где А является таким, как определено выше и В" представляет метилен или С 2-5 алкиленовую цепь, необязательно разветвленную и/или ненасыщенную и/или прерванную C5-7 циклоалкильным остатком, или отсутствует, в присутствии органического основания, такого как, например,триэтиламин, дает соединение формулы XV где R1, R2, В" и А являются такими, как они определены выше. Это соединение подвергают взаимодействию с гидразином с получением соединения формулы XVI где R1, R2, и А являются такими, как они определены выше, а В является отличным от аминогруппы, которое обрабатывают галоидирующим агентом, таким как фосфорил хлорид или фосфорил бромид, с получением соединения формулы XVII где R1, R2, Х и А являются такими, как они определены выше, а В является отличным от аминогруппы. Это соединение, будучи подвергнуто реакции сочетания с соответствующим металло 003702 10 органическим производным в присутствии катализатора, например, палладиевого катализатора, или будучи подвергнуто нуклеофильному замещению, дает соединение формулы I, где представляет двойную связь и В является отличным от аминогруппы. Соединение формулы XVI, подвергнутое взаимодействию с соответствующим алкилгалогенидом или сульфонатом в присутствии основания, например, гидрида натрия, дает соединение формулы I, где R3 представляет заместитель отличный от водорода, и R представляет =O. Альтернативно, соединение формулы ХVII можно гидрировать, например Pd/C в присутствии основания, с получением соединения формулы XVIII где R1, R2 и А являются такими, как они определены выше, а В является отличным от аминогруппы, которое путем дальнейшего гидрирования, например РtO2, дает соединение формулы где R1, R2, В и А являются такими, как они определены выше, которое при последующей обработке соответствующим ацилирующим или сульфонирующим агентом дает соединение формулы I, гдепредставляет одинарную связь и R3 является отличным от водорода. Синтез N-оксидов соединений формулы I происходит путем обработки соединений формулы I надкислотами, такими как, например, мхлорбензойная кислота. Получение солей соединений I осуществляют согласно традиционным способам. Соединения формулы I являются ингибиторами PDE 4, как показано тестами in vitro на ферментативную активность ингибирования(пример 41), и они также способны ингибироватъ высвобождение TNF. Были сделаны сравнения со следующими соединениями: 6,7 диметокси-4-(пиридин-4-ил-метил)-2 Н-фталазин-1-он (ссылка 1) и 6,7-диметокси-4(пиперидин-4-илметил)-2 Н-фталазин-1-он(ссылка 2), входящим в состав общей формулы патентной заявки ЕР-0722936 (под именем Eisai) уже приведенной выше, выбранные ввиду их структурной близости с соединениями изобретения. Было показано, что соединения, на которые сделаны ссылки, хотя и обладают химической идентичностью, являются неактивными в качестве ингибиторов PDE 4. Является очевидным, как эти признаки селективности и специфичности, объединенные с отсутствием активности на сердечно-сосудистой системе, делают соединения формулы I конкретно пригодными для лечения патологий,включая PDE 4 и TNF, таких как астма, хрони 11 ческое закупоривающее легочное заболевание(COPD), респираторный дистресс-синдром у взрослых (ARDS), аллергический риноконъюнктивит, псориаз, атопический дерматит, ревматоидный артрит, септический шок, язвенный колит, даже если в настоящем контексте интерес особо сфокусирован на респираторных патологиях. Соединения изобретения являются особенно полезными при лечении аллергических и воспалительных заболеваний и прежде всего при терапии COPD, астмы и аллергических ринитов. Терапевтические дозы должны обычно составлять между 0,1 и 1000 мг в сутки и между 1 и 100 мг для орального способа применения при однократном введении. Кроме того, целью настоящего изобретения являются фармацевтические композиции,содержащие терапевтически эффективное количество соединений формулы I или их фармацевтически приемлемых солей в смеси с соответствующим носителем. Предметом фармацевтических композиций изобретения может быть жидкость, пригодная для энтерального или парентерального введения, и, предпочтительно, твердое вещество, такое как таблетки, капсулы, гранулы, пригодное для орального введения, или в форме пригодной для трансдермального введения и введения путем ингаляции. Приготовление предмета фармацевтических композиций изобретения можно осуществлять согласно обычным способам. Для лучшей иллюстрации изобретения даются следующие примеры. Пример 1. Синтез 3-циклопентилокси-4 метокси бензойной кислоты. Раствор тетрабутиламмоний бромида(111,68 г, 0,336 моля) в воде (400 мл) добавляли при перемешивании к раствору перманганата калия (53,1 г, 0,336 моля) в воде (1 л). Полученное твердое вещество отделяли путем фильтрования, промывали водой и растворяли в 500 мл пиридина. Этот раствор добавляли по каплям в раствор неочищенного 3-циклопентилокси-4 метокси бензальдегида (полученного как описано в J. Med. Chem., 1995, 38, стр. 4851) (74 г,0,336 моля) в пиридине (200 мл), при перемешивании в смеси вода/лед. По окончании реакции добавляли 3 л льда, и содержимое подкисляли добавлением по каплям 850 мл 12N НCl. Перемешивание продолжали в течение следующих 1,5 ч, затем твердое вещество отделяли путем фильтрования и экстрагировали при перемешивании в течение 30 мин этилацетатом (2 л). Остаточное твердое вещество удаляли, и маточные жидкости затем экстрагировали этилацетатом (2 х 700 мл). Органические фазы промывали водой, сушили над сульфатом натрия и концентрировали до небольшого объема с получением 53,2 г указанного в названии соединения (выход: 67%). Н-ЯМР (200 МГц, CDCl3)(миллионные доли, м.д.): 7,75-6,87 (m, 3 Н); 4,87-4,79 (m, 1 Н); 3,90 (s, 3 Н); 2,08-1,52 (m, 8H). Здесь и далее после(м.д.): m - мультиплет, s - синглет, broad s -широкий синглет, d дублет, dd - двойной дублет, t - триплет, broad t широкий триплет, broad signal-широкий сигнал,q - квартет. Пример 2. Синтез 3-циклопентилокси-4 метокси бензоил хлорида. Раствор 3-циклопентилокси-4-метокси бензойной кислоты (53 г, 0,224 моля), полученной как описано в примере 1, в тионил хлориде(200 мл) кипятили с обратным холодильником в течение 2 ч в атмосфере азота, упаривали досуха и дважды обрабатывали толуолом (100 мл) с получением 57 г указанного в названии соединения, которое использовали как таковое в следующей стадии. 1H-ЯМР (200 МГц, СDСl3)(м.д.): 7,817,72 (dd, 1H); 7,52-7,50 (d, 1H); 6,91-6,85 (d, 1H); 4,87-4,75 (m, 1H); 3,91 (s, 3 Н); 2,08-1,50 (m, 8H). Пример 3. Синтез 3-циклопентилокси-N,Nдиэтил-4-метоксибензамида. Диэтиламин (69,2 г, 0,672 моля) добавляли по каплям при 5-10 С к раствору 3 циклопентилокси-4-метокси бензоил хлорида(57 г, 0,224 моля), полученного как описано в примере 2, в метилен хлориде (250 мл). Смесь упаривали досуха, растворяли в этилацетате,промывали водой, 2% раствором бисульфата калия, снова промывали водой и раствором бикарбоната натрия, сушили над сульфатом натрия и приводили в сухое состояние. Остаток обрабатывали петролатумом (250 мл) с получением 61,2 г указанного в названии соединенияH-ЯМР (200 МГц, CDCl3)(м.д.): 6,946,78 (m, 3H); 4,80-4,70 (m, 1H); 3.82 (s, 3H); 3,503,22 (m. 4H); 1,98-1,50 (m, 8H); 1,17 (broad t,6H). Пример 4. Синтез 3-циклопентилокси-N,Nдиэтил-2-формил-4-метоксибензамида. При -75 С, при перемешивании, вторбутиллитий (195,76 мл, 0,231 моля) и, спустя 1 ч, при той же температуре, диметилформамид(53,66 мл, 0,693 моля) добавляли по каплям к раствору 3-циклопентилокси-N,N-диэтил-4 метоксибензамида (61,2 г, 0,21 моля), полученного как описано в примере 3, и тетраметилендиамина (34,86 мл, 0,231 моля) в безводном тетрагидрофуране (480 мл). После дальнейшего выдерживания в течение получаса при температуре -75 С, реакционную смесь выливали в фосфатный буфер с рН=7, этилацетат и концентрированную НСl. Далее экстракцию повторяли дважды свежим этилацетатом, затем экстракт промывали раствором 5% бисульфата калия,затем водой, затем сушили над сульфатом натрия и упаривали досуха. Остаток подвергали хроматографии на силикагеле (элюент : петро 13 латум/этилацетат 1:1) с получением 23,3 г указанного в названии соединения (выход: 35%). 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 10,44 (s,1H); 7,09-6,85 (m, 2H); 5,05-4,98 (m, 1H); 3,84 (s,3H); 3,59-3,47 и 3,05-2,92 (2q, 4H); 1,95-1,52 (m,8H); 1,28 и 0,95 (2t, 6H). Пример 5. Синтез трет-бутилового эфираN'-(2-циклопентилокси-6-диэтилкарбамоил-3 метоксибензилиден)гидразинкарбоновой кислоты. Раствор 3-циклопентилокси-N,N-диэтил-2 формил-4-метоксибензамида (21,7 г, 0,068 моля), полученного как описано в примере 4, и трет-бутилкарбазола (112,84 г, 0,1 моля) в абсолютном этаноле (217 мл) кипятили с обратным холодильником в течение 3 ч, приводили в сухое состояние, обрабатывали петролатумом и снова приводили в сухое состояние. Остаток обрабатывали этиловым эфиром (100 мл) и петролатумом (200 мл), отфильтровывали и маточные растворы приводили в сухое состояние с получением 27,45 г указанного в названии соединения (выход: 93%) 1 Н-ЯМР (200 МГц, СDCl3)(м.д.): 8,60 (m,1H); 8,05 (broad-s, 1H); 6,87 (s, 2H); 4,87-4,72 (m,1H); 3,82 (s, 3H); 3,58-3,25 (m, 4H); 1,90-1,50 (m,8H); 1,40 (s, 9 Н); 1,22-1,06 (2t, 6H). Пример 6. Синтез 5-циклопентилокси-6 метокси-2 Н-фталазин-1-она. Трет-бутилового эфир N'-(2-циклопентилокси-6-диэтилкарбамоил-3-метоксибензилиден)гидразинкарбоновой кислоты (27,35 г, 0,063 моля), полученный как описано в примере 5,добавляли к 150 мл трифторуксусной кислоты,при перемешивании, при 5-10 С, смесь выдерживали при перемешивании в течение 15 мин и приводили в сухое состояние. Остаток растворяли в метиленхлориде (750 мл) и выдерживали при комнатной температуре в течение 6 ч, затем промывали 5% раствором Na2CO3 вплоть до щелочной реакции, затем промывали водой,затем сушили над сульфатом натрия и упаривали досуха. Остаток обрабатывали 100 мл этилового эфира и отфильтровывали с получением 15,58 г указанного в названии соединения (выход: 95%). 1(7,5 г, 28,81 ммолей), полученного как описано в примере 6, в растворе РОСl3 (30 мл), выдерживали с перемешиванием при температуре 80 С, затем концентрировали досуха, остаток растворяли в этилацетате и промывали раствором К 2 СО 3 до шелочной реакции, затем промывали водой, сушили над Na2SO4 и упаривали(s, 3H); 2,00-1,60 (m, 8H). Пример 8. Синтез 1-(3,5-дихлорпиридин-4 илметил)-5-циклопентилокси-6-метоксифталазина. При перемешивании, 55%-й раствор гидрида натрия (3,73 г, 85,56 ммолей), в атмосфере азота, добавляли к раствору 3,5-дихлор-4-метилпиридина (13,86 г, 85,56 ммолей) в безводном ДМФА (100 мл). Смесь выдерживали при перемешиванием в течение 1 ч, затем добавляли раствор 1-хлор-5-циклопентилокси-6-метоксифталазина (7,95 г, 28,52 ммолей), полученного как описано в примере 7, в безводном диметилформамиде (70 мл). После пребывания в покое в течение ночи, смесь гасили водой, разбавляли водой и экстрагировали этилацетатом. Экстракт промывали водой и сушили над сульфатом натрия, затем упаривали досуха. Остаток подвергали флеш-хроматографии (элюент: петролатум/этилацетат 1:1) с получением 6,58 г указанного в названии соединения (выход: 57%). 1 Н-ЯМР (200 МГц, СDCl3)(м.д.): 8,92 (s,1H); 8,49 (s, 2H); 7,89 (d, 1H, JHH=9,1 Гц); 7,63(d, 1H); 5.21-5,14 (m, 1H); 4,86 (s, 2H) 4,03 (s,3H); 1,98-1,57 (m, 8H). Пример 9. Синтез N-3-ацетил-1-(3,5 дихлорпиридин-4-илметил)-5-циклопентилокси 6-метокси-4 Н-фталазина (соединение 1). Раствор 1-(3,5-дихлорпиридин-4-илметил)5-циклопентилокси-6-метокси-фталазина (1 г,2,47 ммолей), полученного как описано в примере 8, в ледяной уксусной кислоте (35 мл) и 10% Pd/C в каталитическом количестве, в атмосфере азота при комнатной температуре, загружали в Раrr гидрогенизатор под давлением 4,08 бар. Спустя 3 дня, раствор отфильтровывали на целите и маточные жидкости приводили в сухое состояние. Остаток подвергали флешхроматографии (элюент : гексан/этилацетат 6:4,затем 3:7) с получением 0,12 г указанного в названии соединения (выход: 10,9%). Темп. пл.: 128-130 С. 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 8,46 (s,2H); 7,21 (d, 1H, JHH=8,2 гц); 6,86 (d, 1H); 4,964,86 (m, 1H); 4,81 (s, 2H) 4,26 (s, 2H); 3,87 (s,3H); 1,81 (s, 3H); 1,91-1,48 (m, 8H). Пример 10. Синтез 5,6-диметокси-3Hизобензофуран-1-она. Суспензию 3,4-диметоксибензойной кислоты (353,5 г, 1,94 моля) в НСНО (1,7 л, 24,5 молей) готовили при перемешивании и охлаждали во льду, насыщали газообразной НСl (340 г, 9,32 молей), затем постепенно нагревали до 60 С. По прошествии одной ночи, температуру снижали до комнатной температуры и дополнительно барботировали в суспензию НСl (300 г),затем температуру доводили снова до 60 С в 15 течение одной ночи. Смесь частично упаривали,обрабатывали водой (1 л), нейтрализовали 28% раствором NH4OH (1,5 л) и выдерживали на холоде в течение 2 ч, затем отфильтровывали. Фильтрат промывали водой вплоть до нейтральной реакции, затем кристаллизовали из метанола (2 л) и сушили в вакууме при 60 С с получением 220 г указанного в названии соединения (выход: 58,65%) 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 7,28 и 6,28 (2s, 2H); 5,20 (s, 2H) 3,95 и 3,91 (2s, 6H). Пример 11. Синтез 2-формил-4,5-диметоксибензойной кислоты. В атмосфере азота, смесь 5,6-диметокси 3H-изобензофуран-1-она (10 г, 51,5 ммолей),полученного как описано в пример 10, в четырехлористом углероде (250 мл), N-бромсукцинимида (13,88 г, 77,25 ммолей) и бензоил пероксида (320 мг, 1,23 ммоля) доводили до флегмы в течение 2 ч, затем охлаждали, отфильтровывали и промывали 10% растворомNaOH, промывали этилацетатом и медленно снова подкисляли с получением осадка, который отфильтровывали и промывали водой и сушили над P2O5 в вакууме с получением 6,43 г указанного в названии соединения (выход: 60%) Пример 12. Синтез (5,6-диметокси-3-оксо 1,3-дигидроизобензофуран-1-ил)трифенилфосфоний бромида. В атмосфере азота, суспензию 2-формил 4,5-диметокси-бензойной кислоты (6,43 г, 30,62 ммолей), полученной как описано в примере 11,трифенил фосфина (8,3 г, 30,62 ммолей), 30% раствор НВr в уксусной кислоте (8,26 мл, 30,62 ммолей) и ледяной уксусной кислоты (20 мл) нагревали при 90 С в течение 4,5 ч. Смесь приводили в сухое состояние и снова растворяли в ацетонитриле (50 мл) и разбавляли этиловым эфиром вплоть до помутнения, затем охлаждали и отфильтровывали, и фильтрат промывали этиловым эфиром и сушили в вакууме с получением 13,6 г указанного в названии соединения(выход: 83%). 1 Н-ЯМР (200 МГц, DMSO)(м.д.): 8,35 и 7,31 (2s, 2H); 8,03-7,66 (m, 15H); 6,01 (s, 1H) 3,84 и 3,45 (2s, 6H). Пример 13. Синтез 5,6-диметокси-3-пиридин-4-илметилен-3H-изобензофуран-1-она. Триэтиламин (20 мл, 145 ммолей) добавляли по каплям к суспензии (5,6-диметокси-3 оксо-1,3-дигидроизобензофуран-1-ил)трифенилфосфоний бромида (78 г, 145 ммолей), полученного как описано в примере 12, и 4-пиридинкарбоксальдегида (13 мл, 145 ммолей) в метиленхлориде (1 л), при комнатной температуре,при перемешивании. Спустя 1,5 ч смесь от 003702 16 фильтровывали и упаривали, и остаток обрабатывали кипящим этанолом, охлаждали и отфильтровывали. Маточные жидкости подвергали хроматографии (элюент: метиленхлорид,затем 1% метанол) и остаток приводили в сухое состояние и соединяли с предыдущим фильтратом с получением 25 г указанного в названии соединения. Пример 14. Синтез 6,7-диметокси-4-пиридин-4-илметил-2 Н-фталазин-1-она. 5,6-диметокси-3-пиридин-4-илметилен-3Hизобензофуран-1-он, (25 г, 88,34 ммолей), полученный как описано в примере 13, подвергали взаимодействию с гидразин гидратом (500 мл) в течение 2 ч при комнатной температуре при перемешивании, затем кипятили в течение 1 ч. Смесь разбавляли водой (300 мл), охлаждали и отфильтровывали с получением 23 г указанного в названии соединения (выход: 87%). Пример 15. Синтез 1-хлор-6,7-диметокси 4-пиридин-4-илметилфталазина. Суспензию 6,7-диметокси-4-пиридин-4 илметил-2 Н-фталазин-1-она (10 г, 33,6 ммолей),полученного как описано в примере 14, в РОСl3(70 мл) нагревали при 90 С в течение 4 ч. РОCl3 упаривали и остаток растворяли в воде, насыщенном растворе NaHCO3 и NaOH вплоть до получения осадка, который отфильтровывали и суспендировали в метаноле, приводили в сухое состояние, снова суспендировали в ацетоне и снова отфильтровывали. Остаток сушили при 45 С в вакууме с получением 9,562 г указанного в названии соединения. Пример 16. Синтез 6,7-диметокси-1-пиридин-4-илметил-4-тиазол-2-илфталазина (соединение 2). В безводной среде, бромтиазол (831 мг,5,067 ммолей) и смесь 2:1 ТГФ/толуола (15 мл) добавляли по каплям к порошкообразному цинку (500 мг, 7,6 ммолей), при слабом нагревании. Смесь доводили до флегмы в течение 1,5 ч, затем добавляли 1-хлор-6,7-диметокси-4-пиридин-4-илметилфталазин (800 мг, 2,53 ммоля),полученный как описано в примере 15, ацетат палладия (28 мг) и трифенилфосфин (66 мг). Смесь кипятили с обратным холодильником в течение 3 ч, затем добавляли ацетат палладия(56 мг) и трифенилфосфин (133 мг) и кипятили с обратным холодильником в течение ночи. Далее добавляли ацетат палладия (56 мг) и трифенилфосфин (133 мг) и после 4 ч смесь выливали в смесь метиленхлорида/30% водного раствора аммиака. Фазы разделяли и органическую фазу промывали водой, сушили и приводили в сухое состояние с получением неочищенного продукта, который подвергали хроматографии (элюент: метиленхлорид/метанол 2,4%) с получением 354 мг указанного в названии соединения (выход: 38,4%) 1 Н-ЯМР (200 МГц, СDСl3)(м.д.): 9,31 (s,2H) 8,52-7,24 (m, 4H); 8,06 (d, 1H, JHH=3,4 Гц);(2s, 6H). Пример 17. Синтез 6,7-диметокси-1 пиридин-4-илметилфталазина. Раствор 1-хлор-6,7-диметокси-4-пиридин 4-илметилфталазина (3 г, 9,5 ммолей), полученного как описано в примере 15, в ДМФА (50 мл), 32% NaOH (1,32 мл, 14,3 ммоля) и 10%Pd/C (0,69 г) загружали в Раrr реактор и гидрировали при давлении 2,38 бар в течение 2 ч. Катализатор отфильтровывали и раствор, содержащий указанное в названии соединение, использовали как таковой в следующей стадии. Пример 18. Синтез 6,7-диметокси-1-пиридин-4-илметил-3,4-дигидрофталазина. Раствор 6,7-диметокси-1-пиридин-4-илметилфталазина (0,8 г, 28,44 ммолей), полученный как описано в примере 17, в смеси метанола/THF 3:2 (25 мл) и PtO2 (0,025 г) загружали в Parr реактор в атмосфере водорода при давлении 4,08 бар. После одной ночи смесь отфильтровывали через целит и приводили в сухое состояние с получением остатка, который подвергали флеш-хроматографии (элюент : метиленхлорид/ метанол 97:3 затем 95:5). Было получено 0,15 г указанного в названии соединения. 1 Н-ЯМР (200 МГц, СDСl3)(м.д.): 8,437,12 (m, 4H); 6,57 и 6,54 (2s, 2H); 4,07 (s, 2H); 4,00 (s, 2H); 3,80 и 3,65 (2s, 6H). Пример 19. Синтез 1-(6,7-диметокси-4 пиридин-4-илметил-1 Н-фталазин-2-ил)этанона(соединение 3). Раствор 6,7-диметокси-1-пиридин-4-илметил-3,4-дигидрофталазина (3,36 ммолей), полученного как описано в примере 18, в ДМФА (20 мл) фильтровали на целите в атмосфере азота и фильтрат сушили в вакууме и промывали ДМФА (5 мл). Триэтиламин (0,69 мл, 0,5 г, 4,9 ммолей) и, при температуре 0 С, уксусный ангидрид (0,44 мл, 0,47 г, 4,65 ммолей) добавляли в атмосфере азота к этому раствору. Температуре позволяли подняться до комнатной температуры и через 1 ч добавляли уксусный ангидрид(0,06 мл, 0,67 ммоля). После 30 мин выдерживания при комнатной температуре и в течение одной недели выдерживания при температуре 4 С, смесь концентрировали до малого объема,обрабатывали этилацетатом, промывали насыщенным раствором NaCl. Фазы разделяли и органическую фазу сушили и концентрировали с получением остатка, который подвергали флешхроматографии (элюент : метиленхлорид/метанол 98:2). Конечное твердое вещество растирали в этилацетате с получением 0,582 г указанного в названии соединения (выход: 48%). 1 Н-ЯМР (200 МГц, СDCl3)(м.д.): 8,537,21 (m, 4H); 6,71 и 6,63 (2s, 2H); 4,86 (s, 2H); 4,00 (s, 2H); 3,86 и 3,73 (2s, 6H), 2,26 (s, 3H). Пример 20. Синтез 2-метансульфонил-6,7 диметокси-4-пиридин-4-илметил-1,2-дигидрофталазина и 2-формил-6,7-диметокси-4-пири 003702 18 дин-4-илметил-1,2-дигидрофталазина (соединения 4 и 5). Работая аналогично тому, как описано в примере 19, используя 6,7-диметокси-1 пиридин-4-илметил-3,4-дигидрофталазин (3,36 ммолей), полученный как описано в примере 18,в ДМФА (20 мл), триэтиламин (0,69 мл, 0,5 г,4,9 ммолей) и СН 3SO2 Сl (0,36 мл, 0,53 г, 4,65 ммолей), получали смесь, которую обрабатывали как в примере 19, но CH2Cl2 вместо этилацетата. Остаток подвергали хроматографии (элюент: толуол/метанол от 95:5 до 87,5:12,5) с получением, после обработки изопропиловым эфиром, 0,199 г соединения 5 (элюированное первым) и 0,137 г соединения 4 (выход: 19% и 11%). Соединение 4: 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 8,69 (s, 1H); 8,54-8,51 и 7,25-7,22 (2m,4H); 6,69 и 6,63 (2s, 2H); 4,85 (s, 2H); 4,00 (s,2H); 3,88 и 3,71 (2s, 6H). Пример 21. Синтез 1-(6,7-диметокси-4 пиридин-4-илметил-1 Н-фталазин-2-ил)-1-имидазол-1-илметанона (соединение 6). В атмосфере азота, к раствору 6,7 диметокси-1-пиридин-4-илметил-3,4-дигидрофталазина (2,81 ммоля), полученного как описано в примере 18, в ДМФА (16,5 мл), добавляли 1,1'-карбонилдиимидазол (0,75 г, 4,65 ммолей). Через 1 ч при комнатной температуре и через одну неделю при температуре 4 С смесь концентрировали, обрабатывали этилацетатом,промывали насыщенным раствором NaCl. Фазы разделяли и органическую фазу сушили и концентрировали с получением остатка, который подвергали флеш-хроматографии (элюент : метиленхлорид/метанол 98:2). Конечное твердое вещество растирали в изопропиловом эфире с получением 0,135 г указанного в названии соединения (выход: 13%). 1 Н-ЯМР (200 МГц, СDCl3)(м.д.): 8,567,19 (m, 4H); 8.30 (broad-s, 1H); 7,56 и 6,97 (2m,2H); 6,80 и 6,71 (2s, 2 Н); 4,95 (s, 2H); 4,07 (s,2H); 3,91 и 3,77 (2s, 6H). Пример 22. Синтез 3-(4-гидроксибензилиден)-5,6-диметокси-3H-изобензофуран-1 она. Раствор (5,6-диметокси-3-оксо-1,3-дигидроизобензофуран-1-ил)трифенилфосфоний бромида (1 г, 1,87 ммоля), полученного как описано в примере 12, 4-гидроксибензальдегида (230 мг,1,87 ммолей) и триэтиламина (263 мкл) в СН 2 Сl2(10 мл), выдерживали в течение 1 ночи при комнатной температуре в атмосфере азота, промывали водой, сушили и приводили в сухое состояние. Остаток обрабатывали этанолом, кипятили с обратным холодильником в течение 3 ч,охлаждали, отфильтровывали и сушили в ва 19 кууме с получением 0,3 г указанного в названии соединения (выход: 54 %). 1 Н-ЯМР (200 МГц, DMSO)(м.д.): 9,82(s,1H); 7,63-6,82 (m, 4H); 7,63, 7,32 и 6,72 (3s, 3H) 3,95 и 3,87 (2s, 6H). Пример 23. Синтез 4-(4-гидроксибензил)6,7-диметокси-2 Н-фталазин-1-она (соединение 7). Раствор 3-(4-гидрокси-бензилиден)-5,6 диметокси-3H-изобензофуран-1-она (0,3 г, 1 ммоль), полученного как описано в примере 22,и гидразина (176 мкл, 3 ммоля) в метиленхлориде (10 мл), в атмосфере азота, кипятили с обратным холодильником в течение 3 ч, затем разбавляли водой, охлаждали, отфильтровывали и фильтрат сушили при нагревании с получением 120 мг указанного в названии соединения (выход: 38,46%). 1 Н-ЯМР (200 МГц, СDCl3)(м.д.): 12,37 (s,1H); 9,24 (s, 1H); 7,27 и 7,25 (2s, 3H); 7,14-6,64(m, 4 Н); 4,13 (s, 2H); 3,89 и 3,83 (2s, 6H). Пример 24. Синтез 3-фуран-2-илметилен 5,6-диметокси-3H-изобензофуран-1-она. Раствор (5,6-диметокси-3-оксо-1,3-дигидроизобензофуран-1-ил)трифенилфосфоний бромида (1 г, 1,87 ммоля), полученного как описано в примере 12, фурфурола (180 мг, 1,87 ммоля) и триэтиламина (263 мкл, 1,87 ммоля) в CH2Cl2(20 мл), выдерживали в течение 1 ночи при комнатной температуре в атмосфере азота, промывали водой, сушили и приводили в сухое состояние. Остаток обрабатывали этанолом и кипятили с обратным холодильником в течение 3 ч, охлаждали, отфильтровывали и сушили в вакууме с получением 250 мг указанного в названии соединения (выход: 49,2 %). Пример 25. Синтез 4-фуран-2-илметил-6,7 диметокси-2 Н-фталазин-1-она (соединение 8). Раствор 3-фуран-2-илметилен-5,6-диметокси-3H-изобензофуран-1-она, полученного как описано в примере 24, и гидразина (1,46 мл, 30 ммолей) в метаноле (30 мл), в атмосфере азота,кипятили с обратным холодильником в течение 4 ч, затем охлаждали, разбавляли водой, отфильтровывали и фильтрат сушили в вакууме с получением 1,9 г указанного в названии соединения (выход: 67%) 1H-ЯМР (200 МГц, СDCl3)(мл): 10,30 (s,1 Н); 7,77 (s, 1H); 7,14 (s, H); 7,32-6,10 (m, 3H); 4,26 (s, 2H); 4,01 и 3,93 (2s, 6H). Пример 26. Синтез 1-хлор-4-фуран-2 илметил-6,7-диметоксифталазина. Раствор 4-фуран-2-илметил-6,7-диметокси 2 Н-фталазин-1-она (2 г, 7 ммолей), полученного как описано в примере 25, и РОСl3 (7 мл, 70 ммолей) в ацетонитриле (20 мл), в атмосфере азота, кипятили с обратным холодильником в течение 3 ч, затем приводили в сухое состояние,обрабатывали метиленхлоридом, промывали раствором NаНСО 3, затем водой, сушили и приводили в сухое состояние. Неочищенный продукт подвергали хроматографии (элюент: бен 003702H-ЯМР (200 МГц, CDCl3)(мл): 7,46 и 7,35 (2s, 3H); 7,30-6,10 (m, 3H); 4,62 (s, 2H); 4,07 и 3,98 (2s, 6H). Пример 27. Синтез 1-фуран-2-илметил-6,7 диметокси-4-фенилфталазина (соединение 9). 2 М раствор фениллития (4,27 мл, 8,55 ммолей) в смеси циклогексана/этилового эфире 7:3 добавляли по каплям в 0,5 М раствор хлористого цинка в безводном ТГФ (20 мл, 8,9 ммолей) при 0-5 С. Смесь выдерживали при комнатной температуре в течение 1 ч, затем последовательно добавляли 1-хлор-4-фуран-2-илметил-6,7-диметокси-фталазин (1,3 г, 4,27 ммоля),полученный как описано в примере 26, ацетат палладия (20 мг, 0,0855 ммоля) и трифенилфосфин (45 мг, 0,17 ммоля). Смесь кипятили с обратным холодильникам в течение 1 ч, затем охлаждали, разбавляли этилацетатом, промывали раствором NH4 Сl, затем водой, сушили и приводили в сухое состояние. Остаток подвергали хроматографии (элюент : метиленхлорид/ метанол 95:4), затем кристаллизовали из этилового эфира и сушили в вакууме с получением 0,9 г указанного в названии соединения (выход: 61%). 1(5 г) в атмосфере азота кипятили в обратным холодильником при перемешивании в течение 2,5 ч, затем охлаждали, добавляли воду (900 мл). Осадок отфильтровывали и промывали водой, затем петролатумом, затем сушили в вакууме при 40 С с получением 159 г указанного в названии соединения, которое использовали в следующей стадии. Пример 29. Синтез 3-бензилокси-4-метоксибензойной кислоты. Раствор перманганата калия (103,83 г,0,657 моля) в воде (1,4 л) быстро добавляли при перемешивании к раствору тетрабутиламмоний бромида (218,37 г, 0,657 моля) в воде (800 мл). Перемешивание проводили в течение 30 мин,затем осадок отфильтровывали, промывали водой, отжимали и растворяли в пиридине (980 мл) и раствор по каплям добавляли к раствору 3-бензилокси-4-метоксибензальдегида (159 г,0,657 моля), полученного как описано в примере 28, в пиридине (400 мл), при перемешивании с охлаждением в смеси вода/лед. После пребывания в покое в течение ночи, смесь упаривали и остаток обрабатывали водой (3 л) и подкисляли концентрированной НСl (500 мл), поддерживая температуру около 20 С с помощью льда. По 21 окончании реакции, смесь выдерживали при перемешивании в течение 30 мин, затем отфильтровывали. Фильтрат обрабатывали смесью этилацетата/метанола 1:1 (3 л) при перемешивании в течение 30 мин при 40-50 С, затем отфильтровывали и маточные жидкости доводили до малого объема. Получали кристаллический продукт, отфильтровывали и промывали этилацетатом и петролатумом с получением 139,75 г указанного в названии соединения (выход: 82%). Пример 30. Синтез 3-бензилокси-4 метоксибензоил хлорида. 3-Бензилокси-4-метоксибензойную кислоту (136,84 г, 0,53 моля), полученную как описано в примере 29, и тионилхлорид (572 мл) кипятили с обратным холодильником и спустя 2 ч охлаждали и упаривали. Остаток обрабатывали несколько раз толуолом с получением 148,4 г указанного в названии соединения (количественный выход). Пример 31. Синтез 3-бензилокси-N,Nдиэтил-4-метоксибензамида. Раствор диэтиламина (548 мл, 5,3 молей) в СН 2 Сl2 (452 мл) добавляли по каплям к раствору 3-бензилокси-4-метоксибензоил хлорида (146,66 г, 0,53 моля), полученного как описано в примере 30, в метиленхлориде (640 мл), при 0 С в атмосфере азота, при постоянной температуре. По окончании реакции, температуре позволяли подняться до значения комнатной температуры. Через 2 ч смесь упаривали, обрабатывали этилацетатом и промывали водой. Органическую фазу сушили и концентрировали с получением твердого вещества, которое растирали дважды с гептаном и один раз с петролатумом, затем сушили при 45 С в вакууме полученные 150,62 г указанного в названии соединения (выход: 91%). Пример 32. Синтез 3-бензилокси-N,Nдиэтил-2-формил-4-метоксибензамида. 1,3 М раствор втор-бутиллития в смеси циклогексана/гексана (54 мл, 0,07 моля) вводили по каплям, в атмосфере азота, в раствор 3 бензилокси-N,N-диэтил-4-метоксибензамида (20 г, 0,064 моля), полученного как описано в примере 31, тетраметилэтилендиамина (10,56 мл,0,07 моля) в ТГФ (2,25 л) при перемешивании в бане с сухим льдом при температуре -70 С. После пребывания при постоянной температуре в течение 2 ч, добавляли ДМФА (21,75 мл, 0,28 моля). Температуру поддерживали постоянной в течение 4 ч, затем смесь оставляли на ночь. Смесь выливали в буферный растворNaH2PO4/Na2HPO4 (1 л) при рН=7, фазы разделяли, органическую фазу промывали водой (1 л), сушили и приводили в сухое состояние. Неочищенный продукт подвергали хроматографии 22 Пример 33. Синтез 5-бензилокси-6 метокси-2 Н-фталазин-1-она. Гидразин (8,54 мл, 175 ммолей) вводили по каплям в ледяную уксусную кислоту (250 мл) при 0-10 С и добавляли 3-бензилокси-N,Nдиэтил-2-формил-4-метоксибензамид (13 г, 38 ммолей), полученный как описано в примере 32. Смесь оставляли на 2 ч, затем упаривали, растворяли в CH2Cl2, промывали водой, сушили с помощью Na2SO4, упаривали досуха, и неочищенный продукт растирали в смеси бензола/этилового эфира 2:1 (150 мл), отфильтровывали, промывали бензолом и сушили в вакууме с получением 7 г указанного в названии соединения (выход: 78%). 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 10,61 (s,1H); 8,30 (s, 1H); 8,18-7,31 (m, 7H); 5,17 (s,2H); 4,03 (s, 3H). Пример 34. Синтез 5-гидрокси-6-метокси 2 Н-фталазин-1-она. Раствор 5-бензилокси-6-метокси-2 Н-фталазин-1-она (4 г, 14,16 молей), полученного как описано в примере 33, в концентрированной НСl (40 мл) и ледяной уксусной кислоте (40 мл) нагревали при 60 С в течение 1,5 ч, затем приводили в сухое состояние, обрабатывали ацетоном, снова приводили в сухое состояние и обрабатывали далее ацетоном, затем выдерживали при перемешивании в течение 30 мин, отфильтровывали и осадок сушили в вакууме при 30 С с получением 2,7 г указанного в названии соединения (выход: 99,2%). 1(broad signal, 1H); 10,06 (s, 1H); 8,36 (s, 1H); 7,68 и 7,49 (2d, 2H, JHH=8,6 Гц); 3,94 (s, 3H). Пример 35. Синтез 6-метокси-5-(тетрагидрофуран-2-илокси)-2 Н-фталазин-1-она. 3-Мезилокситетрагидрофуран (3,5 г, 21 ммолей) добавляли при перемешивании, в атмосфере азота при комнатной температуре, к раствору 5-гидрокси-6-метокси-2 Н-фталазин-1-она(2,7 г, 14 ммолей), полученного как описано в примере 34, и Na2CO3 (3 г, 28 ммолей), в безводном ДМФА (50 мл). Смесь нагревали при 90 С в течение 1 ночи, затем выливали в воду,экстрагировали дважды этилацетатом, органическую фазу промывали три раза водой, сушили и приводили в сухое состояние. Остаток обрабатывали этиловым эфиром (50 мл), растирали при перемешивании, отфильтровывали и сушили в вакууме с получением 2,1 г указанного в названии соединения (выход: 57,2%). 1 23 ДМФА (15 мл) и п-тиокрезол натрия (378,6 мг,2,6 ммоля) нагревали при 90 С в течение 10 ч,выливали в воду, подкисляли до рН 6-7 с помощью 1N HCl, упаривали досуха, обрабатывали водой и приводили снова в сухое состояние. Неочищенный продукт подвергали хроматографии (элюент : метиленхлорид/метанол 9:1) с получением 330 мг указанного в названии соединения (выход: 52%). 1 Н-ЯМР (200 МГц, DMSO)(м.д.): 12,41(s,1H); 11,07 (broad-s, 1H); 8,23 (s, 1H); 7,82 (d, 1H,JHH=8,8 гц); 7,4 (d, 1H); 5,25-5,20 (m, 1H); 4,033,59 (m, 4 Н); 2,11-2,00 (m, 2H). Пример 37. Синтез 6-дифторметокси-5(тетрагидрофуран-2-илокси)-2 Н-фталазин-1-она. 6-Гидрокси-5-(тетрагидрофуран-2-илокси)2 Н-фталазин-1-он (320 мг, 1,29 ммоля), полученный как описано в примере 36, в безводном ДМФА (80 мл) и К 2 СО 3 (267 мг, 1,93 моля) обрабатывали Frеоn-22 (5 г, 58 ммолей) при давлении 0,5 бар. Смесь доводили до температуры 115 С в течение 1 ночи, затем приводили в сухое состояние и подвергали хроматографии(d, 1H); 6,63 (t, 1H, JHF=72 Гц); 5,24-5,18 (m,1H); 4,18-3,75 (m, 4H); 2,29-2,09 (m, 2H). Пример 38. Синтез 1-хлор-6-дифторметокси-5-(тетрагидрофуран-2-илокси)фталазина. Раствор 6-дифторметокси-5-(тетрагидрофуран-2-илокси)-2 Н-фталазин-1-она (280 мг,0,94 ммоля), полученного как описано в примере 37, и РОСl3 (1,2 мл) нагревали при 90 С в течение 1,5 ч, затем приводили в сухое состояние, обрабатывали метиленхлоридом, промывали насыщенным раствором NаНСО 3, затем дважды водой, сушили и приводили в сухое состояние с получением 296 г указанного в названии соединения (выход: 99,7%). Пример 39. Синтез 1-(3,5-дихлорпиридин 4-илметил)-6-дифторметокси-5-(тетрагидрофуран-2-илокси)фталазина. В атмосфере азота, к раствору 3,5-дихлор 4-метилпиридина (457 мг, 2,82 ммоля) в безводном ДМФА (10 мл) добавляли отдельными порциями 60%-й раствор NaH (113 мг, 2,82 ммоля) и, после 1 ч выдерживания при комнатной температуре, добавляли по каплям при температуре 10 С 1-хлор-6-дифторметокси-5-(тетрагидрофуран-2-илокси)фталазин (296 мг, 0,937 ммоля),полученный как описано в примере 38, в безводном ДМФА. После 2 ч пребывания при комнатной температуре, смесь выливали в 0,4 М буферный раствор при рН=7 (50 мл), экстрагировали этилацетатом (2 х 50 мл) и органическую фазу промывали водой, сушили и концентрировали в вакууме. Остаток подвергали хроматографии (элюент : бензол : этилацетат 1:1, затем 24 только этилацетат) и затем кристаллизовали из смеси этилового эфира/бензола с получением 180 мг указанного в названии соединения (выход: 43,5%). 1 Н-ЯМР (200 МГц, CDCl3)(м.д.): 9,72 (s,1H); 8,52 (s, 2H); 7,96 (d, 1H, JHH=9,2 Гц); 7,80(соединение 10). Раствор 1-(3,5-дихлорпиридин-4-илметил)6-дифторметокси-5-(тетрагидрофуран-2-илокси) фталазина (190 мг, 0,43 ммоля), полученного как описано в примере 39, в ТГФ (50 мл) гидрировали в Раrr реакторе в присутствии РtO2 (15 мг) в течение 24 ч. Смесь отфильтровывали и приводили в сухое состояние, и остаток растворяли в метиленхлориде (10 мл). К раствору добавляли триэтиламин (0,179 мл, 1,29 ммоля) и СН 3SO2 Сl (0,1 мл, 1,29 ммоля). Спустя 1 ч смесь промывали водой, сушили над Na2SO4 и приводили в сухое состояние. Остаток подвергали хроматографии (элюент : метиленхлорид с 2% метанолом) и кристаллизовали из этилового эфира (5 мл), отфильтровывали и сушили в вакууме при 40 С с получением 102 мг указанного в названии соединения (выход: 45%). 1Va=4,35, Vb=4,30, JAB=16,5 Гц; 4,13-3,73 (m,4H); 2,76 (s, 3H); 2,18-2,05 (m, 2H). Пример 41. Ингибирование фермента РDЕ 4. Выделение полиморфоядерных лейкоцитов человека Полиморфоядерные лейкоциты (PMNs) выделяли из периферической крови добровольцев согласно Boyum A. (Scand. J. Immunol.,1976, 5th suppl., 9). Вкратце, PMNs очищали градиентным центрифугированием методом FicollPaque с последующим осаждением на декстране, и эритроцитное загрязнение устраняли гипотоническим лизисом. Очистка фермента PDE 4(100 мкМ) и лейпептин (1 мкМ), и гомогенизировали с помощью гомогенизатора Polytron. Гомогенат центрифугировали при 25000xg в течение 30 мин, при температуре 4 С, и фермент PDE 4 очищали с помощью ионнообменной хроматографии с использованием методики 334, 682). Надосадочную жидкость засевали наUNO Q12 колонке (Bio-Rad) и фермент элюировали линейным градиентом ацетата натрия от 50 мМ до 1 М, используя скорость потока 4,5 мл/мин. Фракции, содержащие вещество с ферментативной активностью, объединяли, диализировали по отношению к воде и концентрировали. Фермент PDE 4 хранили при температуре 20 С в присутствии этиленгликоля (30% объем/объем) до использования. Анализ активности PDE 4 Ферментативную активность оценивали с помощью набора Scintillation Proximity Assay(SPA) (Amersham). Ферментативную реакцию осуществляли в конечном объеме 100 мкл буфера TRIS/HCl (50 мМ, рН 7,5), MgCl2 (8,3 мМ),EGTA (1,7 мМ), сАМР(1 мкМ) и [3H]cAMP(100,000 dpm (число распадов в минуту в качестве изотопного индикатора. Соединения изобретения, эталонные соединения или носитель добавляли при различных концентрациях. В качестве эталонных соединений использовали соединения 6,7-диметокси-4-(пиридин-4-илметил)-2 Н-фталазин-1-он (эталон 1) и 6,7 диметокси-4-(пиперидин-4-илметил)-2 Н-фталазин-1-он (эталон 2), которые входят в общую формулу патентной заявки ЕР-0722936 (под именем Eisai). Реакцию начинали добавлением 1,5 мкг белка и инкубировали в течение 40 мин при 30 С.SPA гранулы (50 мкл), содержащие 18 мМ сульфата цинка, добавляли для прекращения реакции и спустя 20 мин при комнатной температуре измеряли радиоактивность, используя сцинтилляционный счетчик. Величина IC50 относится к наномолярной концентрации соединения, требуемого для ингибирования на 50% гидролиза циклического нуклеотида, и ее рассчитывали с помощью нелинейного регрессионного анализа. Соединения настоящего изобретения показали величины IC50 значительно более низкие,чем эталонные соединения: например, соединение 10 дало значение IС 50=80,5 нМ по сравнению с значениями IС 50100 мкМ обоих эталонных соединений. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I 26 гдепредставляет одинарную или двойную связь; В представляет метилен; А представляет пиридин, замещенный одним заместителем или большим количеством заместителей;R представляет два атома водорода или С = О группу, когдапредставляет одинарную связь, или, когдапредставляет двойную связь, R представляет водород, необязательно замещенный арил или гетероцикл, (С 1-8)алкил,(C2-8)алкенил или (С 2-8)алкинил, необязательно замещенный арилом или гетероциклом; арилокси, гетероциклилокси, арил-С 1-4-алкокси, гетероциклил-C1-4-алкокси, аминогруппу, замещенную одной или двумя С 1-4-алкильной(ыми) группой(ами), ариламино, гетероциклиламино,арил-С 1-4-алкиламино,гетероциклил-С 1-4 алкиламино;R1 представляет C1-6-алкил или С 4-7 циклоалкильную группу, необязательно содержащую атом кислорода и/или замещенную полярным заместителем;-COR6, где R6 представляет водород, арил,арил-С 1-6-алкил, аминогруппу, необязательно алкилированную или моногидроксилированную, гидрокси, С 1-4-алкокси, карбокси, C1-4 алкоксикарбонил,или С 1-4-алкил, необязательно замещенный гетероциклом; С 1-4-алкилсульфонил;NО производные соединений формулы I и их фармацевтически приемлемые соли. 2. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 в смеси с соответствующим носителем. 3. Фармацевтическая композиция по п.2 для лечения аллергических и воспалительных патологий. 4. Фармацевтическая композиция по п.3 для лечения респираторных заболеваний.
МПК / Метки
МПК: C07D 237/30, A61K 31/502
Метки: производные, ингибиторов, фосфодиэстеразы, фталазина, качестве
Код ссылки
<a href="https://eas.patents.su/14-3702-proizvodnye-ftalazina-v-kachestve-ingibitorov-fosfodiesterazy-4.html" rel="bookmark" title="База патентов Евразийского Союза">Производные фталазина в качестве ингибиторов фосфодиэстеразы 4</a>
Предыдущий патент: Применение глюкагоноподобного пептида-1 (glp-1) или его аналогов для устранения катаболических изменений после оперативного вмешательства
Следующий патент: Арилпиперазины, имеющие активность в отношении 1 а рецептора серотонина
Случайный патент: Соединение бензазепина и его применения












