Модуляторы аурора киназы, способы их получения и их применение
Номер патента: 18128
Опубликовано: 30.05.2013
Авторы: Геунс-Мейер Стефани Д., Сии Виктор Дж., Ромеро Карина, Ду Бингфэн, Ходоус Брайан Л., Шенкел Лори, Дик Холли Л., Патель Винод Ф., Оливиери Филип Р., Нгуйен Ханх Нхо
Формула / Реферат
1. Соединение формулы I
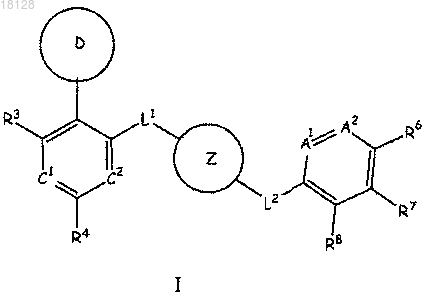
или его стереоизомер либо фармацевтически приемлемая соль, где
каждый из А1 и А2 независимо обозначает N;
С1 обозначает CR10, где R10 означает Н, галоген, С1-4галоалкил или С1-4алкил;
С2 обозначает N или СН;
D представляет собой пиримидин-4-ил, пирроло[2,3-b]пиридин-4-ил, триазин-2-ил, изоксазол-4-ил, 5,6,7,8-тетрагидронафтиридин-4-ил, каждый из которых необязательно замещен 1-4 заместителями из числа R1, R2 или R12, где
R1 представляет собой азетадин-1-ил, CH3NHCO, N-аланинил или RNH-, где R представляет собой Н, С1-4алкил, диметиламино(С1-5)алкил, 3-азетадин-1-илпропил, ОН, 3-(3-диметиламинопирролидин-1-ил)пропил, 3-(пиперизин-1-ил)пропил, 3-(пиперидин-1-ил)пропил, Н2РО4-пропил, 3-гидроксипропил, 3-сульфоксипропил, 3-карбоксипропил, 3-(2-гидроксиэтиламино)пропил, 3-(бис-(2-гидроксиэтил)амино)пропил, циклометилпропил;
R2 представляет собой Н, СН3, NH2, CONH2 и
R12 представляет собой Н, F или СН3;
L1 обозначает О или S;
L2 обозначает NH, N(СН3) или циклопропиламино;
каждый из R3 и R4 независимо обозначает Н или гало;
Z обозначает фенил или пиридил, причем Z является необязательно замещенным 1-4 заместителями из числа галогена, гидроксила или CN;
R6 представляет собой галоген, гидроксил, С1-3алкил, циклогексил, трет-бутилэтенил, циклопропилэтенил, бензил, карбоксил, метоксикарбонил, фенил, необязательно замещенный 1-2 заместителями из числа галогена, С1-3алкила, C1-3алкоксила, CF3, CN, метоксиметила, ОН, C1-3алкилена, ацетила, диметиламинометила, Н2РО4, H2PO4CH2, 3-диметиламинопропоксила, пирролидин-1-илметила, 1,2,6,7,8а-гексагидропирроло[1,2-а]пиразин-1-ила и частично или полностью насыщенного 5-7-членного гетероциклического или ароматического гетероарильного кольца, содержащего 1-3 гетероатома, выбранных из О, S и N, причем указанное кольцо является необязательно конденсированным с бензольным кольцом и необязательно замещенным 1-2 заместителями из числа C1-3алкила, галогена, амино, гидроксиметила или метоксиметила;
каждый из R7 и R8 независимо представляет собой Н, C1-3алкил, метоксиметил, фенил или 4-метилтиен-2-ил или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образуют конденсированнное бициклическое кольцо, выбранное из фталазинила, 5,6,7,8-тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7-ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила.
2. Соединение по п.1, отличающееся тем, что R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинил, необязательно замещенный, как определено в п.1.
3. Соединение по п.1, отличающееся тем, что R6 обозначает фенил, нафтил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил, тетрагидрофуранил, пирролил, пиразолил, тиенопиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил, оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3-дигидроиндолил, изоиндолил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, имидазопиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил, пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, циклопропил, циклобутил, азетидинил, циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещен, как определено в п.1.
4. Соединение по п.1, отличающееся тем, что оно имеет формулу II
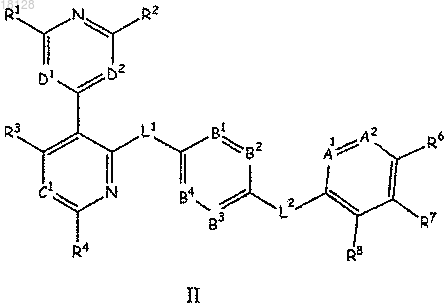
или его стереоизомер или фармацевтически приемлемая соль, где
каждый из А1 и А2 независимо обозначает N;
каждый из В1, В2, В3 и В4 независимо обозначает N или CR5 при условии, что не более чем один из В1, В2, В3 и В4 является N;
С1 обозначает N или CR10;
D1 обозначает N;
D2 обозначает СН;
L1 обозначает О или S;
L2 обозначает NH или NCH3;
R1 обозначает азетадин-1-ил, CH3NHCO, N-аланинил или RNH-, где R представляет собой Н, С1-4алкил, диметиламино(С1-5)алкил, 3-азетадин-1-илпропил, ОН, 3-(3-диметиламинопирролидин-1-ил)пропил, 3-(пиперизин-1-ил)пропил, 3-(пиперидин-1-ил)пропил, Н2РО4-пропил, 3-гидроксипропил, 3-сульфоксипропил, 3-карбоксипропил, 3-(2-гидроксиэтиламино)пропил, 3-(бис-(2-гидроксиэтил)амино)пропил, циклометилпропил;
R2 обозначает Н, СН3, NH2, CONH2;
каждый из R3 и R4 независимо обозначает Н или гало;
каждый R5 независимо обозначает Н, галоген, гидроксил или CN;
R6 обозначает фенил, нафтил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил, тетрагидрофуранил, пирролил, пиразолил, тиенопиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил, оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3-дигидроиндолил, изоиндолил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, имидазопиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил, пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, циклопропил, циклобутил, азетидинил, циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещен 1-2 заместителями из числа С1-3алкила, галогена, амино, гидроксиметила или метоксиметила;
каждый из R7 и R8 независимо обозначает Н, C1-3алкил, метоксиметил, фенил или 4-метилтиен-2-ил или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образуют конденсированнное бициклическое кольцо, выбранное из фталазинила, 5,6,7,8-тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7-ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила.
5. Соединение по п.4, отличающееся тем, что
С1 обозначает CR10;
L2 обозначает NH;
каждый из R3 и R4 независимо обозначает Н;
каждый R5 независимо обозначает Н, F, Cl, Br, CF3, ОН.
6. Соединение по п.4, отличающееся тем, что каждый из R3 и R4 независимо обозначает Н или гало.
7. Соединение по п.4, отличающееся тем, что R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, причем кольцо необязательно независимо замещено, как определено в п.4.
8. Соединение по п.4, отличающееся тем, что
C1 обозначает СН;
L2 обозначает NH;
R6 обозначает тиенил, необязательно замещенный 1-2 заместителями, выбранными из СН3, CF3, F, ОН или NH2; и
R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, необязательно независимо замещенное, как определено в п.4.
9. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что оно выбрано из группы, включающей
2-(4-(4-((4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)амино)-1-фталазинил)фенил)этанол;
N-(5-((3-(2-(метиламино)-4-пиримидинил)-2-пиридинил)окси)-2-пиридинил)-4-фенил-1-фталазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-фенилфуро[2,3-d]пиридазин-7-амин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(3-метил-5-изотиазолил)-1-фталазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(2,6-бис-(метилокси)фенил)-1-фталазинамин;
(1R)-1-(4-(4-((4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)амино)-1-фталазинил)фенил)этанол;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4,5-диметил-6-(4-метил-2-тиенил)-3-пиридазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-фенил-1-изохинолинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(4-метил-2-тиенил)-1-изохинолинамин;
4-фенил-N-(6-((3-(2-((3-(1-пиперидинил)пропил)амино)-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)-1-фталазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(6-метил-2-пиридинил)-1-фталазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-циклогексил-1-фталазинамин;
N-(4-((3-(2-((3-(4-метил-1-пиперазинил)пропил)амино)-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(6-метил-2-пиридинил)-1-фталазинамин;
4-(6-метил-2-пиридинил)-N-(4-((3-(2-((3-(1-пиперазинил)пропил)амино)-4-пиримидинил)-2-пиридинил)окси)фенил)-1-фталазинамин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(3-фтор-1-пиперидинил)-1-фталазинамин;
4-(2-((4-((4-фенил-1-фталазинил)амино)фенил)окси)-3-пиридинил)-1,3-дигидро-2Н-пиррол[2,3-b]пиридин-2-он;
4-(4-метил-1,3-тиазол-2-ил)-N-(4-((3-(5,6,7,8-тетрагидро-1,8-нафтиридин-4-ил)-2-пиридинил)окси)фенил)-1-фталазинамин;
N-(4-((3-(2,3-дигидро-1H-пиррол[2,3-b]пиридин-4-ил)-2-пиридинил)окси)фенил)-4-фенил-1-фталазинамин;
N-(6-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)-4-(5-метил-2-пиридинил)-1-фталазинамин;
N-(4-((3-(5-фтор-2-((3-(4-метил-1-пиперазинил)пропил)амино)-4-пиримидинил)-2-пиридинил)окси)фенил)-4-фенил-1-фталазинамин;
N-(4-((3-(3-амино-1Н-пиразол-4-ил)-2-пиридинил)окси)фенил)-4-(4-метилфенил)-1-фталазинамин;
N-(4-((3-(3-амино-1H-пиразол-4-ил)-2-пиридинил)окси)фенил)-4-(фенилметил)-1-фталазинамин;
N-(4-((3-(3-амино-1H-пиразол-4-ил)-2-пиридинил)окси)фенил)-4-фенилтиено[2,3-d]пиридазин-7-амин;
N-(4-((3-(3-амино-1Н-пиразол-4-ил)-2-пиридинил)окси)-3-фторфенил)-4-фенил-1-фталазинамин;
N-(6-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)-4-(3-(метилсульфонил)фенил)-1-фталазинамин;
N-(4-((3-(2-((3-((2S,5S)-2,5-диметил-4-морфолинил)пропил)амино)-4-пиримидинил)-2-пиридинил)окси)фенил)-4-фенил-1-фталазинамин;
N-(6-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)-4-(4-метил-2-тиенил)-1-фталазинамин;
1-(4-((4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)амино)-1-фталазинил)-3-пиперидинол;
2-(4-((6-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)амино)-1-фталазинил)фенол;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(4-метил-2-тиенил)-1-фталазинамин;
2-(4-((6-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)-3-пиридинил)амино)-1-фталазинил)фенилдигидрофосфат;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-4-(5-метил-2-пиридинил)-1-фталазинамин;
2-((4-((4-(4-метил-2-тиенил)-1-фталазинил)амино)фенил)окси)-3,4'-дипиридин-2'-амин;
2-((4-((4-этил-6-фенил-3-пиридазинил)амино)фенил)окси)-3,4'-дипиридин-2'-амин;
2-((4-((4-метил-6-(4-метил-1,3-тиазол-2-ил)-3-пиридазинил)амино)фенил)окси)-3,4'-дипиридин-2'-амин;
2-((4-((4-(2-(метилокси)фенил)-1-фталазинил)амино)фенил)окси)-3,4'-дипиридин-2'-амин;
N-(4-((3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)-6-фенил-4-пропил-3-пиридазинамин и
N-(4-((2-(метилокси)-6-(4-пиридинил)фенил)окси)фенил)-4-фенил-1-фталазинамин.
10. Лекарственное средство, содержащее соединение по любому одному из пп.1-9 и фармацевтически приемлемый носитель.
11. Применение соединения по любому из пп.1-9 для лечения рака у субъекта.
12. Применение соединения по любому из пп.1-9 для уменьшения размера твердой опухоли или для лечения гематологической опухоли у субъекта.
13. Применение соединения по любому из пп.1-9 для лечения одного или нескольких заболеваний, выбранных из (а) твердой или гематологической опухоли, выбранной из рака мочевого пузыря, груди, прямой кишки, почки, печени, мелкоклеточного рака легких, пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, простаты и кожи; (б) кроветворной опухоли лимфоидных тканей, выбранной из лейкемии, острой лимфоцитарной лейкемии, острой лимфобластной лейкемии, лимфомы В-клеток, лимфомы Т-клеток, лимфомы Ходжкина, неходжкинской лимфомы, лимфомы волосяных клеток и лимфомы Беркитта; (в) кроветворной опухоли миелоидной ткани, выбранной из острой и хронической миелогенных лейкемий, миелодиспластического синдрома и промиелоцитарной лейкемии; (г) опухоли мезенхимного происхождения, выбранной из фибросаркомы и рабдомиосаркомы; (д) опухоли центральной и периферической нервной системы, выбранной из астроцитомы, нейробластомы, глиомы и шванномы; или (е) меланомы, семиномы, тератокарциномы, остеосаркомы, ксеродермы пигментной, кератоакантомы, фолликулярного рака щитовидной железы или саркомы Капоши.
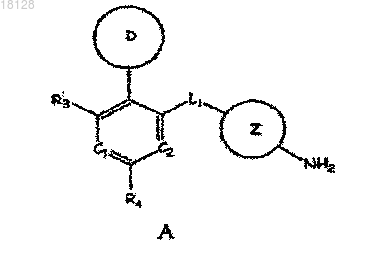
14. Способ получения соединения по п.1, включающий стадию взаимодействия соединения формулы А
с соединением формулы В
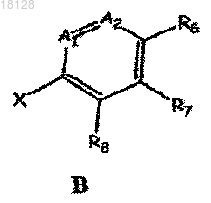
где значения С1, С2, D, L1, Z и R3, R4 для соединения формулы А; А1, А2 и R6, R7, R8 для соединения формулы В указаны в п.1 и X обозначает галоген,
с получением соединения формулы I.
15. Соединение или его фармацевтически приемлемая соль, которое имеет следующую химическую формулу:
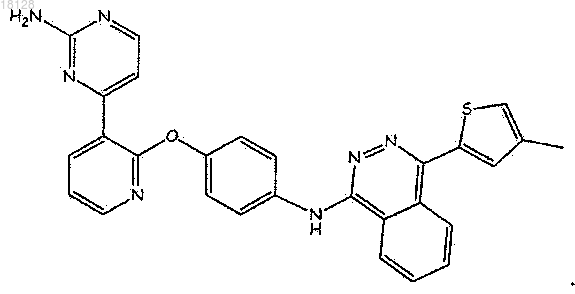
16. Соединение по п.15 в виде фармацевтически приемлемой соли.
17. Соединение по п.15 или 16 в виде соли сульфоновой кислоты.
18. Фармацевтическая композиция, включающая соединение по п.15 или его фармацевтически приемлемую соль и фармацевтически приемлемый наполнитель.
19. Фармацевтическая композиция, включающая соединение по любому из пп.15-17 и фармацевтически приемлемый наполнитель.
20. Применение соединения по любому из пп.15-17 для лечения одного или нескольких заболеваний, выбранных из рака мочевого пузыря, рака груди, рака прямой кишки, рака почки, рака печени, рака легких, немелкоклеточного рака легких, рака пищевода, рака желчного пузыря, рака яичника, рака поджелудочной железы, рака желудка, рака шейки матки, рака щитовидной железы, рака простаты и рака кожи.
Текст
МОДУЛЯТОРЫ АУРОРА КИНАЗЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ или их стереоизомерам или фармацевтически приемлемым солям, где A1, A2, C1, С 2, L1, L2, Z,D, R3-4 и R6-8 определены в описании, которые способны модулировать ауроракиназы, влияя при этом на процесс клеточного цикла и пролиферацию клеток с целью лечения рака и болезней,связанных с раком. Изобретение также предусматривает способ получения указанных соединений,фармацевтические композиции, включающие указанные соединения, и применение указанных соединений при лечений болезненных состояний, связанных с активностью ауроракиназы, в частности различных форм рака. Область техники, к которой относится изобретение Данное изобретение относится к области фармацевтических агентов и, более конкретно, к соединениям и композициям, пригодным для модулирования аурора киназы и к применению и способам регулирования пролиферации клеток и лечения рака. Сведения о предшествующем уровне техники Рак является одной из наиболее распространенных болезней, поражающих человечество и основной причиной смертных случаев во всем мире. Пытаясь найти эффективный способ лечения одного или более из многочисленных видов рака, в течение последних двух десятилетий многочисленные группы исследователей потратили очень много времени, усилий и финансовых вложений. Однако до настоящего времени только немногие из доступных способов лечения рака и лекарственных препаратов имеют достаточно успешные результаты. Рак часто характеризуется нерегулируемой пролиферацией клеток. Повреждение одного или более генов, отвечающих за клеточные пути, которые контролируют развитие пролиферации в течение клеточного цикла, обычно вызывает потерю нормального регулирования пролиферации клеток. Эти гены кодируют различные белки, которые принимают участие в каскаде событий, включая фосфорилирование,приводящее к развитию клеточного цикла и пролиферации клеток. Были идентифицированы различные белки киназы, которые играют роль в каскаде клеточного цикла и в фосфорилировании белков в частности. Один класс белков, которые, как установлено, играют роль в клеточном цикле и, следовательно, в пролиферации клеток, представляет собой семейство белков аурора киназ. Аурора киназы являются ферментами семейства серин-треонинкиназ, которые играют важную роль в фосфорилировании белков во время митотической фазы клеточного цикла. Имеются три известных члена семейства аурора киназ Аурора А, Аурора В и Аурора С, обычно называемые Ауророй 2, Ауророй 1 и Ауророй 3 соответственно. Была изучена специфическая функция каждого члена семейства аурора киназ в клеточном цикле млекопитающего. Аурора А локализована в центросоме во время внутренней фазы и является важной для созревания центросомы и для поддержания разделения во время сборки веретена. Аурора В локализована в кинетохоре в G2-фазе клеточного цикла до метафазы и перемещается в клеточную пластинку в плоскости экватора веретена после анафазы. Полагали, что Аурора С функционирует только во время меозиса, но недавно было установлено, что она более тесно связана с Ауророй В, обнаруживая некоторые перекрывающиеся функции и сходные образцы локализации во время митоза. Оказывается, что каждая аурора киназа имеет общую структуру, включая консервативный каталитический домен и очень короткий N-концевой домен, который отличается по размеру (см. R. Giet and С. Prigent, J. Cell. Sci., 112: 3591-3601 (1999. Аурора киназы оказались конкурентными мишенями при лечении рака. Аурора киназы переэкспрессируются при различных типах рака, включая рак прямой кишки, груди, легких, поджелудочной железы, простаты, мочевого пузыря, головы, шеи, шейки матки и яичника. Ген Ауроры А является частью ампликона, обнаруженного в ряде опухолей в груди, прямой кишке, яичнике, печени, желудке и поджелудочной железе. Установлено, что Аурора В также переэкспрессируется в большинстве основных типов опухолей. Переэкспрессия Ауроры В в фибробластах грызунов индуцирует трансформацию, что предполагает онкогенность Ауроры В. Недавно экспрессия мРНК Ауроры В была связана с хромосомной нестабильностью при раке груди у женщин (Y. Miyoshi et al., Int. J. Cancer, 92: 370-373 (2001. Кроме того, некоторыми исследователями было показано, что ингибирование одной или более аурора киназ приводит к ингибированию пролиферации клеток и запуску апоптоза в нескольких клеточных линиях. В частности, было обнаружено, что ингибирование Ауроры останавливает клеточный цикл и ускоряет запрограммированную гибель клеток путем апоптоза. Соответственно возник большой интерес к обнаружению ингибиторов аурора киназ. Таким образом, ингибирование аурора киназ рассматривается как многообещающий подход к созданию новых противораковых агентов. Например, в заявке WO 04/039774 описаны азахинозолиноны для лечения рака путем ингибирования аурора киназы, в заявке WO 04/037814 описаны индазолиноны для лечения рака путем ингибирования аурора киназы 2, а в заявке WO 04/016612 описаны 2,6,9-замещенные производные пурина для лечения рака путем ингибирования аурора киназы, в заявке WO 04/000833 предложены три- и тетразамещенные пиримидины, пригодные для лечения болезней, опосредованных аурора киназами, в заявке WO 04/092607 описаны кристаллы, используемые для скрининга, создания и оценки соединений как агонистов или антагонистов аурора киназы, и в патенте США 6919338 и в заявке WO 03/055491 описаны замещенные производные хинозолина в качестве ингибиторов аурора киназы-2. Сущность изобретения Данное изобретение предусматривает новый класс соединений, пригодных для модулирования одного или более ферментов аурора киназ и для лечения опосредованных аурора киназами состояний и/или болезней, включая рак. Согласно одному варианту изобретения соединения, включая их стереоизомеры или фармацевтически приемлемые соли, имеют формулу I где каждый из А 1 и А 2 независимо обозначает N; С 1 обозначает CR10, где R10 означает Н, галоген, С 1-4 галоалкил или С 1-4 алкил; С 2 обозначает N или СН;D представляет собой пиримидин-4-ил, пирроло[2,3-b]пиридин-4-ил, триазин-2-ил, изоксазол-4-ил,5,6,7,8-тетрагидронафтиридин-4-ил, каждый их которых необязательно замещен 1-4 заместителями из числа R1, R2 или R12, гдеZ обозначает фенил или пиридил, причем Z является необязательно замещенным 1-4 заместителями из числа галогена, гидроксила или CN;R6 представляет собой галоген, гидроксил, С 1-3 алкил, циклогексил, трет-бутилэтенил, циклопропилэтенил, бензил, карбоксил, метоксикарбонил, фенил, необязательно замещенный 1-2 заместителями из числа галогена, C1-3 алкила, C1-3 алкоксила, CF3, CN, метоксиметила, ОН, С 1-3 алкилена, ацетила, диметиламинометила, Н 2 РО 4, H2PO4CH2, 3-диметиламинопропоксила, пирролидин-1-илметила, 1,2,6,7,8 агексагидропирроло[1,2-а]пиразин-1-ила и частично или полностью насыщенного 5-7-членного гетероциклического или ароматического гетероарильного кольца, содержащего 1-3 гетроатома, выбранных из О, S и N, причем указанное кольцо является необязательно конденсированным с бензольным кольцом и необязательно замещенным 1-2 заместителями из числа С 1-3 алкила, галогена, амино, гидроксиметила или метоксиметила; каждый из R7 и R8 независимо представляет собой Н, C1-3 алкил, метоксиметил, фенил или 4 метилтиен-2-ил или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образуют конденсированнное бициклическое кольцо, выбранное из фталазинила, 5,6,7,8 тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7 ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила. В одном из воплощений в соединении формулы I R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинил, необязательно замещенный, как определено выше. В еще одном из воплощений в соединении формулы I R6 обозначает фенил, нафтил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил,изохинолинил, тетрагидроизохинолинил, хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил,тетрагидрофуранил, пирролил, пиразолил, тиено-пиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил, оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3-дигидроиндолил, изоиндолил, индазолил, бензофуранил,бензотиофенил, бензимидазолил, имидазо-пиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил, пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, циклопропил, циклобутил, азетидинил,циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещн, как определено выше. В следующем воплощении соединение формулы I имеет формулу II или является его стереоизомером или фармацевтически приемлемой солью, где каждый из А 1 и А 2 независимо обозначает N; каждый из В 1, В 2, В 3 и В 4 независимо обозначает N или CR5 при условии, что не более чем один из 1 2 В , В , В 3 и В 4 является N; С 1 обозначает N или CR10;R6 обозначает фенил, нафтил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил, тетрагидрофуранил, пирролил, пиразолил, тиенопиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил, оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3 дигидроиндолил, изоиндолил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, имидазопиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил, пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил,1,3-бензодиоксолил, циклопропил, циклобутил, азетидинил, циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещн 1-2 заместителями из числа С 1-3 алкила,галогена, амино, гидроксиметила или метоксиметила; каждый из R7 и R8 независимо обозначает Н, С 1-3 алкил, метоксиметил, фенил или 4-метилтиен-2-ил; или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образуют конденсированнное бициклическое кольцо,выбранное из фталазинила,5,6,7,8 тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7 ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила. В одном из воплощений в соединении формулы II С 1 обозначает CR10; L2 обозначает NH, каждый из 3R и R4 независимо обозначает Н; каждый R5 независимо обозначает Н, F, Cl, Br, CF3, ОН. Согласно еще одному из воплощений в соединении формулы II каждый из R3 и R4 независимо обозначает Н или гало. Согласно следующему воплощению в соединении формулы II R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, причем кольцо необязательно независимо замещено, как определено выше. В одном из воплощений в соединении формулы II С 1 обозначает СН; L2 обозначает NH; R6 обозначает тиенил, необязательно замещенный 1-2 заместителями, выбранными из СН 3, CF3, F, ОН или NH2; иR7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, независимо необязательно замещенное, как определено выше. В одном из воплощений соединение формулы I выбрано из группы, включающей 2-(4-(4-4-3-(2-амино-4-пиримидинил)-2-пиридинил)окси)фенил)амино)-1-фталазинил)фенил)этанол;N-(4-2-(метилокси)-6-(4-пиридинил)фенил)окси)фенил)-4-фенил-1-фталазинамин или их фармацевтически приемлемые соли. Изобретение предусматривает также способы получения соединений формулы I. Соединения, предусмотренные данным изобретением, имеют модулирующую активность в отношении киназ и, в частности, ингибирующую активность, включая, без ограничения, ингибирующую активность в отношении аурора киназ, в частности аурора киназ А, В и С. Наконец, данное изобретение предусматривает применение этих соединений, а также их фармацевтически приемлемых солей при получении и производстве лекарственного препарата для терапевтического, профилактического лечения острого или хронического рака. Таким образом, эти соединения пригодны для производства противораковых медикаментов. Более конкретно, эти соединения пригодны для производства лекарственного препарата для ослабления или предотвращения расстройств путем ингибирования активности аурора киназы. Например, согласно одному варианту изобретение предусматривает фармацевтическую композицию (называемую в данной заявке также лекарственным средством), содержащую терапевтически эффективное количество соединения формул I или II в сочетании по меньшей мере с одним фармацевтически приемлемым носителем, адъювантом или разбавителем. Также согласно одному из вариантов данное изобретение предусматривает применение этих соединений, а также их фармацевтически приемлемых солей для лечения рака у субъекта. В еще одном варианте данное изобретение предусматривает применение этих соединений, а также их фармацевтически приемлемых солей для уменьшения размера тврдой опухоли или для лечения гематологической опухоли у субъекта. В следующем варианте данное изобретение предусматривает применение этих соединений, а также их фармацевтически приемлемых солей для лечения одного или нескольких заболеваний, выбранных из(а) тврдой или гематологической опухоли, выбранной из рака мочевого пузыря, груди, прямой кишки,почки, печени, мелкоклеточного рака лгких, пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шейки матки, простаты и кожи; (б) кроветворной опухоли лимфоидных тканей, выбранной из лейкемии, острой лимфоцитарной лейкемии, острой лимфобластной лейкемии, лимфомы Вклеток, лимфомы Т-клеток, лимфомы Ходжкина, неходжкинской лимфомы, лимфомы волосяных клеток и лимфомы Беркитта; (в) кроветворной опухоли миелоидной ткани, выбранной из острой и хронической миелогенных лейкемий, миелодиспластического синдрома и промиелоцитарной лейкемии; (г) опухоли мезенхимного происхождения, выбранной из фибросаркомы и рабдомиосаркомы, (д) опухоли центральной и периферической нервной системы, выбранной из астроцитомы, нейробластомы, глиомы и шванномы или (е) меланомы, семиномы, тератокарциномы, остеосаркомы, ксеродермы пигментной, кератоакантомы, фолликулярного рака щитовидной железы или саркомы Капоши. В еще одном варианте данное изобретение относится к соединению или его фармацевтически приемлемой соли, которое имеет следующую химическую формулу В одном из воплощений данное соединение представлено в виде фармацевтически приемлемой соли. В еще одном из воплощений фармацевтически приемлемая соль представляет собой соль сульфоновой кислоты. В следующих вариантах настоящее изобретение относится к фармацевтической композиции, содержащей указанное выше соединение или его фармацевтически приемлемая соль и фармацевтически приемлемый наполнитель. В еще одном варианте настоящее изобретение относится к применению указанного выше соединения или его фармацевтически приемлемой соли для лечения одного или нескольких заболеваний, выбранных из рака мочевого пузыря, рака груди, рака прямой кишки, рака почки, рака печени, рака лгких,немелкоклеточного рака лгких, рака пищевода, рака желчного пузыря, рака яичника, рака поджелудочной железы, рака желудка, рака шейки матки, рака щитовидной железы, рака простаты и рака кожи. Сведения, подтверждающие возможность осуществления изобретения Согласно одному варианту изобретения соединения, пригодные для лечения расстройств, опосредованных аурора киназой, и родственных расстройств, включая рак и воспаление, имеют формулу I или его стереоизомер или фармацевтически приемлемая соль, где каждый из А 1 и А 2 независимо обозначает N; С 1 обозначает CR10, где R10 означает Н, галоген, С 1-4 галоалкил или С 1-4 алкил; С 2 обозначает N или СН;D представляет собой пиримидин-4-ил, пирроло[2,3-b]пиридин-4-ил, триазин-2-ил, изоксазол-4-ил,5,6,7,8-тетрагидронафтиридин-4-ил, каждый их которых необязательно замещен 1-4 заместителями из числа R1, R2 или R12, гдеZ обозначает фенил или пиридил, причем Z является необязательно замещенным 1-4 заместителями из числа галогена, гидроксила или CN;R6 представляет собой галоген, гидроксил, C1-3 алкил, циклогексил, трет-бутилэтенил, циклопропилэтенил, бензил, карбоксил, метоксикарбонил, фенил, необязательно замещенный 1-2 заместителями из числа галогена, C1-3 алкила, С 1-3 алкоксила, CF3, CN, метоксиметила, ОН, C1-3 алкилена, ацетила, диметиламинометила, Н 2 РО 4, H2PO4CH2, 3-диметиламинопропоксила, пирролидин-1-илметила, 1,2,6,7,8 агексагидропирроло[1,2-а]пиразин-1-ила и частично или полностью насыщенного 5-7-членного гетероциклического или ароматического гетероарильного кольца, содержащего 1-3 гетроатома, выбранных из О, S и N, причем указанное кольцо является необязательно конденсированным с бензольным кольцом и необязательно замещенным 1-2 заместителями из числа С 1-3 алкила, галогена, амино, гидроксиметила или метоксиметила; каждый из R7 и R8 независимо представляет собой Н, С 1-3 алкил, метоксиметил, фенил или 4 метилтиен-2-ил; или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образуют конденсированнное бициклическое кольцо,выбранное из фталазинила,5,6,7,8 тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7 ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила. Согласно одному варианту формула I включает соединения, где каждый из А 1 и А 2 независимо обозначают N, в сочетании с любым описанным ниже вариантом. Согласно еще одному варианту формула I включает соединения, где D обозначает пиримидин-4-ил,пирроло[2,3-b]пиридин-4-ил, триазин-2-ил, изоксазол-4-ил, 5,6,7,8-тетрагидронафтиридин-4-ил, каждый их которых необязательно замещен 1-4 заместителями из числа R1, R2 или R12, где R1 представляет собой азетадин-1-ил, CH3NHCO, N-аланинил или RNH-, где R представляет собой Н, С 1-4 алкил, диметиламино(С 1-5)алкил, 3-азетадин-1-илпропил, ОН, 3-(3-диметиламинопирролидин-1-ил)пропил, 3-(пиперизин-1 ил)пропил, 3-(пиперидин-1-ил)пропил, Н 2 РО 4-пропил, 3-гидроксипропил, 3-сульфоксипропил, 3 карбоксипропил, 3-(2-гидроксиэтиламино)пропил, 3-(бис-(2-гидроксиэтил)амино)пропил, циклометилпропил;R12 представляет собой Н, F или СН 3, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где С 1 обозначает CR10, где R10 означает Н, галоген, С 1-4 галоалкил или С 1-4 алкил, в сочетании с любым из описанных выше или ниже вариантов.-6 018128 Согласно еще одному варианту формула I включает соединения, где С 2 обозначает N или СН, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где С 1 обозначает CR10, С 2 обозначает N и R2 обозначает Н, СН 3, NH2 или CONH2, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где C1 обозначает CR10 и R10 обозначает Н, Н, галоген, С 1-4 галоалкил или С 1-4 алкил,С 2 обозначает N и R2 обозначает Н, СН 3, NH2 или CONH2 в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L1 обозначает О или S, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L2 обозначает NH, N(СН 3) или циклопропиламино, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L2 обозначает NH, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L1 обозначает О или S и R2 обозначает Н, СН 3, NH2 или CONH2, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где Z обозначает фенил или пиридил, причем Z является необязательно замещенным 1-4 заместителями из числа галогена, гидроксила илиCN, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L2 обозначает NH, N(СН 3) или циклопропиламино; каждый из R3 и R4 независимо обозначает Н; С 1 обозначает CR10 и Z обозначает фенил или пиридил, причем Z является необязательно замещенным 1-4 заместителями из числа галогена,гидроксила или CN в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где L1 обозначает О или S, L2 обозначает NH, N(CH3) или циклопропиламино, R2 обозначает Н, СН 3, NH2, или CONH2, каждый из R3 и R4 независимо обозначает Н и С 1 обозначает CR10 в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где R1 обозначает азетадин-1-ил,CH3NHCO, N-аланинил или RNH-, где R представляет собой Н, С 1-4 алкил, диметиламино(С 1-5)алкил, 3 азетадин-1-илпропил, ОН, 3-(3-диметиламинопирролидин-1-ил)пропил, 3-(пиперизин-1-ил)пропил, 3(пиперидин-1-ил)пропил, H2PO4-пропил, 3-гидроксипропил, 3-сульфоксипропил, 3-карбоксипропил, 3(2-гидроксиэтиламино)пропил, 3-(бис-(2-гидроксиэтил)амино)пропил, циклометилпропил, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где R2 обозначает Н, СН 3, NH2 илиCONH2, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где R2 обозначает Н, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где каждый из R3 и R4 независимо обозначает Н или галоген, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где каждый R6 обозначает галоген,гидроксил, C1-3 алкил, циклогексил, трет-бутилэтенил, циклопропилэтенил, бензил, карбоксил, метоксикарбонил, фенил, необязательно замещенный 1-2 заместителями из числа галогена, С 1-3 алкила,C1-3 алкоксила, CF3, CN, метоксиметила, ОН, С 1-3 алкилена, ацетила, диметиламинометила, Н 2 РО 4,H2PO4CH2, 3-диметиламинопропоксила, пирролидин-1-илметила, 1,2,6,7,8 а-гексагидропирроло[1,2 а]пиразин-1-ила и частично или полностью насыщенного 5-7-членного гетероциклического или ароматического гетероарильного кольца, содержащего 1-3 гетроатома, выбранных из О, S и N, причем указанное кольцо является необязательно конденсированным с бензольным кольцом и необязательно замещенным 1-2 заместителями из числа С 1-3 алкила, галогена, амино, гидроксиметила или метоксиметила, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где R6 обозначает фенил, нафтил,пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил, тетрагидрофуранил, пирролил, пиразолил, тиенопиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил, оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3-дигидроиндолил, изоиндолил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, имидазо-пиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил,пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил, 1,3-бензодиоксолил, циклопропил, циклобутил,азетидинил, циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещн, как определено выше, в сочетании с любым из описанных выше или ниже вариантов.-7 018128 Согласно еще одному варианту формула I включает соединения, где каждый из R7 и R8 независимо представляет собой Н, С 1-3 алкил, метоксиметил, фенил или 4-метилтиен-2-ил, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула I включает соединения, где R8 независимо, взятый вместе с 7R и атомами углерода, к которым они присоединены, образует конденсированнное бициклическое кольцо, выбранное из фталазинила, 5,6,7,8-тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7-ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин 7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту изобретение предусматривает соединения, обозначаемые общей формулой II или их стереоизомеры или фармацевтически приемлемые соли, где каждый из А 1 и А 2 независимо обозначает N; каждый из В 1, В 2, В 3 и В 4 независимо обозначает N или CR5 при условии, что не более чем один из 1 2 В , В , В 3 и В 4 является N; С 1 обозначает N или CR10;R6 обозначает обозначает фенил, нафтил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, хинолинил, дигидрохинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил,хиназолинил, изохиназолинил, фталазинил, тиофенил, фурил, тетрагидрофуранил, пирролил, пиразолил,тиенопиразолил, имидазолил, триазолил, тетразолил, тиазолил, тиадиазолил, бензотиазолил, оксазолил,оксадиазолил, бензоксазолил, бензоксадиазолил, изоксазолил, изотиазолил, индолил, азаиндолил, 2,3 дигидроиндолил, изоиндолил, индазолил, бензофуранил, бензотиофенил, бензимидазолил, имидазопиридинил, пуринил, бензотриазолил, оксазолинил, изоксазолинил, тиазолинил, пирролидинил, пиразолинил, морфолинил, пиперидинил, пиперазинил, пиранил, диоксозинил, 2,3-дигидро-1,4-бензоксазинил,1,3-бензодиоксолил, циклопропил, циклобутил, азетидинил, циклопентил, циклогексил, циклогептил или пиранил, каждый из которых необязательно независимо замещн 1-2 заместителями из числа С 1-3 алкила,галогена, амино, гидроксиметила или метоксиметила; каждый из R7 и R8 независимо обозначает Н, C1-3 алкил, метоксиметил, фенил или 4-метилтиен-2-ил; или же R8 независимо, взятый вместе с R7 и атомами углерода, к которым они присоединены, образует конденсированнное бициклическое кольцо,выбранное из фталазинила,5,6,7,8 тетрагидрофталазинила, изоиндол-1-ила, пиридин[2,3-d]пиридазин-8-ила, пирроло[2,3-d]пиридазин-7 ила, фуро[2,3-d]пиридазин-7-ила, тиено[2,3-d]пиридазин-7-ила и циклопентан[d]пиридазинила, каждый из которых необязательно замещен 1-2 заместителями из числа галогена или фенила. По другому варианту формула II включает соединения, где С 1 обозначает CR10;L2 обозначает NH; каждый из R3 и R4 независимо обозначает Н; каждый R5 независимо обозначает Н, F, Cl, Br, CF3, ОН. Согласно еще одному варианту формула II включает соединения, где каждый из R3 и R4 независимо обозначает Н или галоген. Согласно другому варианту формула II включает соединения, где R7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, причем кольцо необязательно независимо замещено, как определено выше, в сочетании с любым из описанных выше или ниже вариантов. Согласно еще одному варианту формула II включает соединения, где С 1 обозначает СН;R6 обозначает тиенил, необязательно замещенный 1-2 заместителями, выбранными из СН 3, CF3, F,ОН или NH2; иR7 и R8, взятые вместе с атомами углерода, к которым они присоединены, образуют фталазинильное кольцо, независимо необязательно замещенное, как определено, в сочетании с любым из приведенных выше или ниже вариантов. Согласно еще одному варианту формулы I и II включают соединения, их стереоизомеры и фармацевтически приемлемые соли, которые описаны ниже в примерах. Определения Для лучшего понимания изобретения, описанного в данной заявке, служат следующие определения. Термины "рак" и "раковый" применяются к или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Примеры рака включают, без ограничения, карциному, лимфому, саркому, бластому и лейкемию. Более конкретные примеры включают плоскоклеточный рак, рак легких, рак поджелудочной железы, рак шейки матки, рак мочевого пузыря, гепатому, рак груди, рак прямой кишки и рак головы и шеи. В то время как термин "рак", применяемый в данной заявке, не ограничен каким-либо конкретным видом болезни, считают, что способы по изобретению особенно эффективны для таких видов рака, которые сопровождаются нерегулируемым содержанием аурора киназы(-киназ) у млекопитающего. Термины "лечить" и "лечение", применяемые в данной заявке, относятся к терапии, включая, без ограничения, лечебную терапию, профилактическую терапию и предохранительную терапию. Профилактическое лечение обычно представляет собой или предотвращение начала расстройств, или задержку начала доклинической очевидной стадии расстройств у субъекта. Термин "млекопитающее" относится к любому млекопитающему, классифицируемому как таковое,включая людей, коров, лошадей, собак и кошек. Согласно одному варианту изобретения млекопитающее является человеком. Термин "фармацевтически приемлемое производное" обозначает любую соль (называемую также фармацевтически приемлемой солью), любое пролекарство, такое как фосфат или сложный эфир соединения по изобретению, или любое другое соединение, которое после введения пациенту способно обеспечить образование (прямо или косвенно) соединения по изобретению или его метаболита или остатка,характеризующихся способностью ингибировать аурора киназу. Термин "терапевтически эффективный" обозначает количество каждого агента, которое позволяет достичь цели улучшения расстройства и частоты возникновения при лечении каждым самим агентом при избегании побочных вредных эффектов, обычно связанных с альтернативной терапией. Термины "кольцо" и "кольцевая система" относятся к одному или нескольким кольцам, обычно конденсированным, когда содержится более одного кольца, содержащим определенное число атомов,причем эти атомы являются атомами углерода или, где указано, гетероатомами, такими как атомы азота,кислорода или серы. Само кольцо, а также любые заместители в этом кольце, могут быть присоединены к любому атому, если при этом образуется стабильное соединение. Термин "неароматические" кольцо или кольцевая система относятся к случаю, когда по меньшей мере одно, но не необходимо, все кольца в бициклической или трициклической кольцевой системе не являются полностью ненасыщенными. Термин "удаляемые группы", в общем, относится к группам, которые способны вытесняться нуклеофилом. Такие удаляемые группы известны. Примеры этих групп включают, но без ограничения, галоиды (например, I, Br, F, Cl), сульфонатные группы (например, мезилатную, тозилатную), альфидные(например, SCH3), N-гидроксисукцинимидную, N-гидроксибензотриазольную и т.п. Нуклеофилы представляют собой группы, которые способны действовать на молекулу в месте присоединения удаляемой группы, вызывая вытеснение удаляемой группы. Нуклеофилы известны из уровня техники. Примеры нуклеофильных групп включают, но без ограничения, аминные, тиольные, спиртовые группы, реактивы Гриньяра, анионные группы (например, алкоксидные, амидные, карбанионы) и т.п. Обозначение "Н" означает один атом водорода. Этот заместитель может быть присоединен, например, к атому кислорода с образованием гидроксильной группы. Когда используется термин "алкил" или сам по себе, или с другими терминами, например "галоидалкил" или "алкиламино", он охватывает линейные или разветвленные радикалы, предпочтительно содержащие - число атомов углерода. Например, C1-10 алкил обозначает алкил, содержащий 1-10 атомов углерода. Примеры таких радикалов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил,втор, бутил, трет-бутил, пентил, изоамил, гексил и т.п. В данной заявке подразумевается, что алкильные радикалы могут быть замещены различными заместителями, где это указано. Термин "алкенил", сам по себе или в комбинации, охватывает линейные или разветвленные радика-9 018128 лы, содержащие по меньшей мере одну углерод-углеродную двойную связь и два или более атомов углерода. Примеры алкенильных радикалов включают, без ограничения, этенил, пропенил, аллил, пропенил,бутенил и 4-метилбутенил. Термин "алкенил" охватывает радикалы, имеющие "цис" и "транс" ориентацию или же "Е" и "Z" ориентацию, как известно специалистам. Подразумевается, что алкенильные радикалы могут быть замещены различными заместителями, где это указано. Термин "алкинил", сам по себе или в комбинации, обозначает линейные или разветвленные радикалы, содержащие по меньшей мере одну углерод-углеродну тройную связь и два или более атомов углерода. Примеры алкинильных радикалов включают, но без ограничения, этинил, пропинил (пропаргил),бутинил и т.п. Подразумевается, что алкинильные радикалы могут быть замещены различными заместителями, где это указано. Термин "галоид", сам по себе или в сочетании, означает галогены, такие как фтор, хлор, бром или иод. Термин "галоидалкил", сам по себе или в комбинации, охватывает радикалы, в которых любой один или более атомов углерода в алкиле замещены галоидом, указанным выше. Например, этот термин включает моногалоидалкил, дигалоидалкил и полигалоидалкил, такой как пергалоидалкил. Моногалоидалкильный радикал, например, может содержать или атом иода, брома, хлора или фтора. Дигалоидалкильный и полигалоидалкильный радикалы могут содержать два или более одинаковых атомов галоида или комбинацию различных атомов галоида. Примеры галоидалкильных радикалов включают фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил, дихлорэтил и дихлорпропил. Термин "перфторалкил", используемый в данной заявке, относится к алкильным радикалам, в которых все атомы водорода замещены атомами фтора. Примеры включают трифторметил и пентафторэтил. Термин "гидроксиалкил", сам по себе или в комбинации, охватывает линейные или разветвленные алкильные радикалы, содержащие один или более атомов углерода, любой из которых может быть замещен одним или более гидроксильными радикалами. Примеры таких радикалов включают гидроксиметил,гидроксиэтил, гидроксипропил, гидроксибутил и гидроксигексил. Термин "алкокси", сам по себе или в комбинации, охватывает линейные или разветвленные оксисодержащие радикалы, каждый из которых содержит алкильные фрагменты, содержащие - атомов углерода. Например, C1-10 алкоксильный радикал обозначает алкоксид, содержащий 1-10 атомов углерода,расположенных линейным или разветвленным образом, присоединенный к атому кислорода. Примеры таких радикалов включают метокси, этокси, пропокси, бутокси и трет-бутокси. Алкоксильные радикалы могут быть далее замещены одним или более атомами галоида, такими как фтор, хлор или бром, с получением "галоидалкоксильных" радикалов. Примеры таких радикалов включают фторметокси, хлорметокси, трифторметокси, трифторэтокси, фторэтокси и фторпропокси. Термин "частично или полностью насыщенный" относится к фрагменту, линейному, разветвленному или циклическому по природе, не содержащему двойной или тройной связей (полностью насыщенный) или содержащему одну или более двойных или тройных связей, которые расположены такимобразом, что когда структурный фрагмент является циклическим, цикл не является полностью ненасыщенным (неароматическим), что очевидно для специалистов. Термин "полностью ненасыщенный" относится к фрагменту, содержащему двойные или тройные связи, расположенные так, что структура является ароматической по природе, что очевидно для специалистов. Термин "арил", сам по себе или в комбинации, относится к карбоциклическому ароматическому радикалу, содержащему одно, два или даже три кольца, причем такие кольца могут быть соединены вместе,то есть конденсированы. Так, термин "арил" охватывает ароматические радикалы, такие как фенил, нафтил, инденил, тетрагидронафтил, антраценил и инданил. Указанная арильная группа может содержать один или более заместителей, таких как низший алкил, гидроксил, галоид, галоидалкил, нитро, циано,алкокси и низший алкиламино и т.п. Фенил, замещенный -О-СН 2-О-, образует арил бензодиоксолильный радикал. Арил подразумевает в данной заявке полностью ненасыщенное кольцо. Термины "гетероциклы" или "гетероциклические радикалы", сами по себе или в комбинации, подразумевают насыщенные, частично насыщенные и частично ненасыщенные содержащие гетероатомы радикалы в виде колец, где гетероатомы могут быть выбраны из азота, серы и кислорода. Эти термины не включают кольца, содержащие группы -О-О-, -O-S- или -S-S-. Указанный "гетероцикл" может содержать один или более заместителей, таких как гидроксил, Boc, галоид, галоидалкил, циано, низший алкил,низший аралкил, оксо, низший алкокси, амино и низший алкиламино. Примеры насыщенных гетероциклических радикалов включают насыщенные 3-6-членные гетеромоноциклические группы, содержащие 1-4 атома азота (например, пирролидинил, имидазолинил, пиперидинил, пирролинил, пиперазинил); насыщенные 3-6-членные гетеромоноциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота (например, морфолинил); насыщенные 3-6-членные гетеромоноциклические группы, содержащие 1-2 атома серы и 1-3 атома азота (например, тиазолидинил). Примеры частично насыщенных (или частично ненасыщенных) гетероциклических радикалов включают дигидротиенил, дигидропиранил, дигидрофурил и дигидротиазолил. Термин "гетероарильные" радикалы, сам по себе или в комбинации, охватывает полностью ненасыщенные, содержащие гетероатомы радикалы в виде колец, где гетероатомы могут быть выбраны из азота, серы и кислорода. Примеры гетероарильных радикалов включают ненасыщенные 5-6-членные гетеромоноциклические группы, содержащие 1-4 атома азота, например пирролил, имидазолил, пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, пиримидил, пиразинил, пиридазинил, триазолил (например, 4H1,2,4-триазолил, 1 Н-1,2,3-триазолил, 2 Н-1,2,3-триазолил); ненасыщенные 5-6-членные гетеромоноциклические группы, содержащие атом кислорода, например пиранил, 2-фурил, 3-фурил и т.д.; ненасыщенные 5-6-членные гетеромоноциклические группы, содержащие атом серы, например 2-тиенил, 3-тиенил и т.д.; ненасыщенные 5-6-членные гетеромоноциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил, 1,3,4 оксадиазолил, 1,2,5-оксадиазолил); ненасыщенные 5-6-членные гетеромоноциклические группы, содержащие 1-2 атома серы и 1-3 атома азота, например тиазолил, тиадиазолил (например, 1,2,4-тиадиазолил,1,3,4-тиадиазолил, 1,2,5-тиадиазолил). Термины "гетероцикл" и "гетероарил" охватывают также радикалы, являющиеся конденсированными с арильными радикалами: ненасыщенные конденсированные гетероциклические или гетероарильные группы, содержащие 1-5 атомов азота, например индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил, тетразолопиридазинил (например, тетразол [1,5b]пиридазинил); ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота (например, бензоксазолил, бензоксадиазолил); ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома серы и 1-3 атома азота (например, бензотиазолил, бензотиадиазолил) и насыщенные, частично ненасыщенные и ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода или серы (например, бензофурил, бензотиенил, 2,3-дигидробензо[1,4]диоксинил и дигидробензофурил). Примеры гетероциклических радикалов включают 5-10-членные конденсированные или неконденсированные радикалы. Другие примеры гетероарильных радикалов включают хинолил, изохинолил, имидазолил, пиридил, тиенил, тиазолил, оксазолил, фурил и пиразинил. Другими примерами гетероарильных радикалов являются 5- или 6-членные гетероарилы, содержащие один или два гетероатома, выбранных из серы, азота и кислорода, такие как тиенил, фурил, пирролил, индазолил, пиразолил, оксазолил, триазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, пиридил, пиперидинил и пиразинил. Примеры гетероарилов, не содержащих атомы азота, включают, без ограничения, пиранил, 2 фурил, 3-фурил, 2-тиенил, 3-тиенил, бензофурил, бензотиенил и т.п. Примеры частично или полностью насыщенных гетероциклических радикалов включают, без ограничения, пирролидинил, имидазолинил, пиперидинил, пирролинил, пиразолидинил, пиперазинил, морфолинил, тетрагидропиранил, тиазолидинил, дигидротиенил, 2,3-дигидробензо[1,4]диоксанил, индолинил, изоиндолинил, дигидробензотиенил, дигидробензофурил, изохроманил, хроманил, 1,2 дигидрохинолинил,1,2,3,4-тетрагидроизохинолинил,1,2,3,4-тетрагидрохинолинил,2,3,4,4 а,9,9 агексагидро-1H-3-азафлуоренил,5,6,7-тригидро-1,2,4-триазол[3,4-а]изохинолил,3,4-дигидро-2 Нбензо[1,4]оксазинил, бензо[1,4]диоксанил, 2,3-дигидро-1H-1'-бензо[d]изотиазол-6-ил, дигидропиранил,дигидрофурил и дигидротиазолил и т.п. Термин "сульфонил", сам по себе или связанный с другими терминами, такими как алкилсульфонил, обозначает двухвалентный радикал -SO2-. Термин "карбонил", сам по себе или в составе других групп, таких как аминокарбонил, обозначает-(С=О)-. Термин "алкилтио" охватывает радикалы, содержащие линейный или разветвленный алкильный радикал, содержащий 1-10 атомов углерода, присоединенный к двухвалентному атому серы. Примером группы "алкилтио" является метилтио, (CH3S-). Термины "аминоалкил" или "диаминоалкил" охватывают "N-алкиламино" и "N,N-диалкиламино" соответственно, где аминогруппы независимо замещены одним алкильным радикалом и двумя алкильными радикалами соответственно. Примеры алкиламиногрупп включают "низший алкиламино", содержащий один или два алкильных радикала, включающих 1-6 атомов углерода, присоединенные к атому азота. Подходящие алкиламиногруппы могут быть моно- или диалкиламиногруппами, такими как Nметиламино, N-этиламино, N,N-диметиламино, N,N-диэтиламино и т.п. Термин "С 1-10 алкиламино" обозначает аминогруппы, которые замещены одним или двумя алкильными радикалами, например N-метиламино. Алкиламиногруппы могут быть далее замещены в алкильной части радикала. Термины "арилалкиламино" или "аралкиламино" обозначают аминогруппы, которые замещены одним или двумя арилзамещенными алкильными радикалами, такие как бензиламино. Аралкиламиногруппы могут быть далее замещены в арильной или алкильной части радикала. Термин "гетероциклилалкиламино" обозначает аминогруппы, которые замещены одним или двумя гетероциклилзамещенными алкильными радикалами, таким как пиперидилметиламино. Гетероциклилалкиламиногруппы могут быть далее замещены в гетероциклической или алкильной частях ради- 11018128 кала. Термин "ариламино" обозначает аминогруппы, которые замещены одним или двумя арильными радикалами, такие как N-фениламиногруппа. Ариламиногруппы могут быть далее замещены в арильной части радикала. Термин "гетероариламино" обозначает аминогруппы, которые замещены одним или двумя гетероарильными радикалами, такие как N-тиениламино. Гетероариламиногруппы могут быть далее замещены в гетероарильном кольце радикала. Термин "циклоалкил" обозначает насыщенные карбоциклические группы. Примеры циклоалкильных групп включают C3-C6 кольца, такие как циклопентил, циклопропил и циклогексил. Термин "циклоалкенил" включает карбоциклические группы, содержащие одну или более углеродуглерод двойных связей, в том числе "циклоалкилдиенильные" группы. Примеры циклоалкенильных групп включают С 3-С 6 кольца, такие как, без ограничения, циклопентенил, циклопентадиенил, циклогексенил и циклогептадиенил. Термин "содержащий" означает возможность наличия еще чего-либо, включая указанный(-е) компонент(-ы), но не исключая другие элементы. Термины "формула I" и "формула II" включают любые охватываемые ими формулы соединений. Данное изобретение предусматривает способы получения соединения формул I и II. Семейство соединений формул I включает их фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" охватывает соли, обычно используемые в виде солей щелочных металлов или солей присоединения свободных кислот или свободных оснований. Природа соли не является критической при условии, что она является фармацевтически приемлемой. Подходящие фармацевтически приемлемые соли присоединения соединений формул I, II могут быть получены из неорганической кислоты или из органической кислоты. Примеры таких неорганических кислот включают, без ограничения, соляную, бромисто-водородную, иодисто-водородную, азотную, угольную, серную и фосфорные кислоты. Примеры органических кислот включают, без ограничения, алифатические, циклоалифатические, ароматические, арилалифатические, гетероциклические, карбоксильные и сульфоновые органические кислоты,примерами которых являются муравьиная, уксусная, адипиновая, масляная, пропионовая, янтарная, гликолевая, глюконовая, молочная, малевая, винная, лимонная, аскорбиновая, глюкуроновая, малеиновая,фумаровая, пировиноградная, аспартовая, глутаминовая, бензойная, антраниловая, метилсульфоновая, 4 гидроксибензойная, фенилуксусная, миндальная, эмбоновая (памовая), метансульфоновая, этансульфоновая, этандисульфоновая, бензолсульфоновая, пантотеновая, 2-гидроксиэтансульфоновая, толуолсульфоновая, сульфаниловая, циклогексиламиносульфоновая, камфорная, камфорсульфоновая, диглюконовая, циклопентанпропионовая, додецилсульфоновая, глюкогептановая, глицерофосфоновая, гептановая,гексановая, 2-гидроксиэтансульфоновая, никотиновая, 2-нафталинсульфоновая, щавелевая, пальмитиновая, пектиновая, надсерная, 2-фенилпропионовая, пикриновая, триметилуксусная, пропионовая, янтарная, тиоциановая, метилсульфоновая, ундекановая, стеариновая, альгиновая, -оксимасляная, салициловая, галактаровая и галактуроновая кислоты. Подходящие фармацевтически приемлемые соли, основные присоединения соединений формул I, II включают, без ограничения, соли металлов, такие как соли алюминия, кальция, лития, магния, калия,натрия и цинка, или соли, полученные из органических оснований, включая первичные, вторичные или третичные амины и замещенные амины, в том числе циклические амины, такие как кофеин, аргинин,диэтиламин, N-этилпиперидин, гистидин, глюкамин, изопропиламин, лизин, морфолин, Nэтилморфолин, пиперазин, пиперидин, триэтиламин, триметиламин. Все соли, охватываемые данным изобретением, могут быть получены обычными методами из соответствующего соединения путем реакции, например, подходящей кислоты или основания с соединением формул I, II. Когда в одной и той же молекуле содержатся основная группа и кислая группа, соединение формул I, II может также образовать внутренние соли. Общие методы синтеза Соединения по изобретению могут быть синтезированы в соответствии со схемами 1-8, где заместители соответствуют указанным для формул I, II выше, за исключением тех, которые указаны далее. Методы синтеза, описанные ниже, являются только примерами, соединения по изобретению могут быть получены альтернативными способами, которые известны специалистам в данной области. По всему тексту описания используются следующие сокращения: Биарильная кольцевая система (3), включая замещенные или незамещенные пиридилпиридины (где кольца С и D, оба, являются пиридинами), пиридилпиримидины (где одно из колец С и D является пиридиновым, а другое пиримидиновым), пиридилтриазины (где D является триазиновым кольцом), пиримидилпиримидины и пиримидилтриазины (где кольцо D является триазиновым) и 5-членные D-кольцо-Скольцо, обычно называемые C-D-кольцевой частью соединений формул I, II, могут быть получены способом, показанным на схеме 1. Как показано на схеме, методика сочетания по Suzuki, использующая арилгалоидное соединение (1), где X обозначает галоид, такое как иодид, бромид или хлорид, и арилборинат (2) в присутствии палладия, такого как Pd(PPh3)4, и слабого основания, такого как Na2CO3, K2CO3 или NaHCO3 в среде полярного растворителя, такого как DME, может быть использована для синтеза соединения (3). LG обозначает известную удаляемую группу, такую как F, Br, I или Cl. Точно так же другие известные способы сочетания с использованием арильного соединения, например, с применением станнанов, цинкатов и метод сочетания с применением меди также подходят для получения соединения(3). Таким же образом согласно методу Suzuki или другим методам металлирования, где арилборинат(2) является замещенным фенилборинатом, как показано на схеме 1, могут быть получены фенилпиридины, фенилпиримидины и фенилтриазиновые C-D производные соединений формул I, II. Или же аминозамещенные пиридилпиримидиновые C-D-кольцевые системы (8) могут быть получены способом, показанным на схеме 2. Схема 2 Хлорангидриды хлорникотиновой кислоты (4) можно обработать диметилмалонатом в присутствии подходящего основания и MgCl2 с образованием промежуточного соединения (5). Соединение (5) может образовать цикл с получением гидроксилзамещенного пиримидилпиридинового соединения (6) в присутствии подходящего основания и формамида ацетата. Могут быть введены желательные амино-R1 группы в положении 3 4,6-пиримидинового D-кольца путем простой обработки соединения (7) первич- 14018128 ным или вторичным амином, получая нужное замещение, при нагревании при условиях, более мягких,чем условия, требуемые для вытеснения пиридилхлорида соединения (6). Затем соединение (6) может быть обработано п-толуолсульфонилхлоридом или другими похожими активирующими реагентами для введения гидроксильной группы пиримидина в подходящую удаляемую группу (LG) для вытеснения желательным достаточно реакционноспособным нуклеофилом, включая амины, серу и кислородсодержащие нуклеофилы. Соединение (6) может быть также обработано основанием, достаточно сильным для депротонирования гидроксильного протона, для алкилирования гидроксильной группы с образованием при этом простого эфира, алкоксильного фрагмента и т.п. Далее соединение (6) может быть превращено в соответствующий тиол с применением реакций и методик, известных из уровня техники. Этот тиол (не показан) затем может быть превращен в соответствующие тиосвязанные R1 группы. Кроме того, соединение (7) может быть обработано аммиаком с получением аминного аддукта, который затем можно алкилировать, ацилировать и иным образом замещать желательной группой. Такие методы известны специалистам и описаны в книге Jerry March's Advanced Organic Chemistry, 4th edition (1992), которая включена полностью в качестве ссылки в данную заявку. 2,4-Региоизомер вышеуказанных пиридилпиримидинов может быть также получен в соответствии со следующей схемой 3. Схема 3 Соединение (10) может быть получено путем обработки ацилхлорида соединения (9 а) (кольцо С) и превращения его в соответствующий метилкетон (9b) с последующей обработкой диметилацеталем диметилформамида с получением соответствующего енаминона (9 с). Затем замещенный гуанидин HCl может быть обработан подходящим основанием, таким как метоксид натрия, в течение определенного промежутка времени до воздействия на смесь гуанидина енаминоном (9 с) с образованием пиридилпиримидина (10). Этот способ позволяет ввести желательные группы R1 до замыкания кольца. Следует принять меры, чтобы ограничить группы R1 теми, которые не будут мешать или реагировать во время образования промежуточных соединений 9 а-9 с и также замыкания кольца с получением соединения (10), что очевидно для специалистов в данной области. Или же соединение (9c) может быть обработано гидрохлоридом гуанидина в присутствии NaOH в среде изопропанола с получением соответствующего 3 аминопиримидинового D кольца (не показано, где R1 обозначает NH2). Положение R1 этого промежуточного соединения можно модифицировать, используя восстановительное алкилирование соответствующими альдегидами, методы ацилирования и реакции других групп, известные специалистам в данной области, для введения нужных групп в указанное положение кольца D в соединениях формул I, II. Или же 3-аминопиримидин может быть превращен во 3-фторпиримидин с применением трет-бутилнитрата иHF пиридина и затем фторид может быть замещен желательной группой R1, такой как NH2R, OR или SR. Этот последний метод может быть также применен для превращения аминотриазинов в соответствующие фтортриазины. Точно так же могут быть получены пиридилтриазиновые C-D-диарильные системы в соответствии со схемой 4. Способом, показанным на схеме 2, желательные амино-R1-группы могут быть введены в положение 3 триазинового D-кольца путем обработки соединения (15) первичным или вторичным амином, имеющим желательные заместители, при нагревании при условиях, менее жестких, чем требуется для замещения пиридилхлорида соединения (15). Фрагмент C-D соединений формул I, II может быть присоединен к кольцу В соединения (17) (см. схему 5 ниже) с применением обычных известных из уровня техники методов, описанных, например, в книге March. Подходящие методы показаны на схемах 5 и 6. Схема 5 Как показано на схеме 5, соединение (18) или (18 а), представляющее собой биарильные эфиры и тиолы (где L1=О и S соответственно), может быть получено путем взаимодействия соединения (16) (гдеLG обозначает удаляемую группу, такую как галоид, например хлор или бром) с нуклеофильным фенильным соединением (17), где L1 является подходящим нуклеофилом, таким как NHR или NH2 (схема 6), ОН, SH или углеродсодержащим нуклеофилом, для замещения хлорида в кольце С соединения (16). Например, фенолы (L1=0) и тиолы (L1=S) могут сочетаться с активированными арилхлоридами с образованием диариловых эфиров и тиолов (соединение 18) с применением слабых оснований, таких как TEA,или неорганических оснований, таких как Cs2CO3, в среде DMSO при повышенных температурах, например от примерно 70 до примерно 130 С. Подобным образом это превращение можно также осуществить в среде NMP при температуре примерно 200 С и воздействии микроволн. Схема 6 Анилины (соединение 17 или 17 а) могут сочетаться с активированными арилхлоридами (соединение 16) с образованием диариланилинов (соединение 18 или 18 а) в присутствии Pd в качестве катализатора или NEt3TFA в подходящих условиях, при нагревании или без него. Или же, как показано на схеме 2, где группы R1 и/или R2 препятствуют или ограничивают способность к сочетанию кольца С с кольцом В путем нуклеофильного вытеснения, которое описано выше, сочетание кольца В-С можно проводить, исходя из промежуточного соединения (6) на схеме 2, как это видно на схеме 7. Как показано, соединение (16) вначале может реагировать с желательными нуклеофильными реагентами с кольцом В до превращения гидроксильной группы D-кольца в соответствующий хлорид для последующего замещения при помощи амина или другого соединения с желаемой группой R15. Соединения по изобретению (формул I, II), где С 1 обозначает CR10, могут быть получены по общему способу, показанному на схеме 8. Схема 8 Как показано на этой схеме, коммерчески доступная 2-оксиникотиновая кислота может быть иодирована и подвергнута реакции с тионилхлоридом в соответствии с методом, описанным в Elworthy et al.,J. Med. Chem., 40 (17): 2674-2687 (1997), содержание этой статьи полностью включено в качестве ссылки в данную заявку. Превращение этого иодированного промежуточного продукта (соединение 22) в соответствующий пиримидин (соединение 23) протекает, как указано выше на схеме 2. После замещения пиридилхлорида (соединение 23) анилином (соединение 17) с образованием соединения (24) вызванное Pd(0) сочетание с арилборонатом в присутствии мягкого основания, такого как карбонат натрия или калия, в среду толуола приводит к получению соединения (25), арилпиридилпиримидина. Соединение (25) может быть также получено с применением соответствующих станнанов или цинкатов, что известно для специалистов. Или же желательные группы R16 могут быть введены в кольцо С при помощи иода с использованием обычных методов (не показано), что также известно специалистам. Или же желательная арильная группа может быть введена в кольцо С (соединение 20) даже до получения кольцевого фрагмента D-С в соединениях формул I, II. Например, Church et al. описывает синтез 5-арил-2-хлорпиридинов из фенилуксусных кислот в J. Org. Chem., 60: 3750-3758 (1995), содержание этой статьи полностью включено в данную заявку в качестве ссылки. Примеры, описанные ниже, являются только иллюстративным описанием способов синтеза или получения желательных соединений формул I, II, промежуточных продуктов для них и получения частей этих соединений, включая кольца А, кольца В, кольца А-В, кольца С-D, кольца В-С-D и их фрагменты. Следует иметь в виду, что эти способы являются только примерами и можно применять другие обычные,известные или разработанные альтернативные способы. Кроме того, примеры соединений даны только для целей иллюстрации и не ограничивают никоим образом объем изобретения. Аналитические методы Если иное не указано, все анализы методом HPLC проводили в системе Agilent Model 1100 с колонкой с обращенной фазой Agilent Technologies Zorbax SB-C8 (5 мк) (4,6150 мм, Part N 883975-906) при температуре 30 С со скоростью потока, равной примерно 1,50 мл/мин. Подвижная фаза - растворитель А(Н 2 О/0,1% TFA) и растворитель В (AcCN/0,1% TFA) с градиентом 11 мин от 5% до 100% AcCN. Градиент сопровождался возвратом в течение 2 мин 5% AcCN и примерно 2,5-минутным уравновешиваниемAgilent Technologies XDB-C8 (3,5 мк) (4,675 мм) при температуре 30 С. Скорость потока была постоян- 17018128 ной и менялась от примерно 0,75 до примерно 1,0 мл/мин. Подвижная фаза - смесь растворителя А(Н 2 О/0,1% HOAc) и растворителя В (AcCN/0,1% HOAc) с градиентом 9 мин от 10 до 90% растворителя В. Затем следовал 0,5-минутный период для возврата к 10% растворителя В и 2,5 мин с 10% растворителя В для уравновешивания (промывки) колонки. Метод препаративной HPLC. Где указано, нужные соединения очищали методом HPLC с обращенной фазой, используя Gilson(H2O/0,1% TFA) и растворителя В (AcCN/0,1% TFA) с градиентом 10 мкм от 5 до 100% растворителя В. Затем в течение 2 мин возвращались к 5% AcCN. Протонные спектры ЯМР. Если иное не указано, все спектры 1 Н ЯМР снимали на приборе Varian Series Mercury 300 МГц или на приборе Bruker 400 МГц. Все протоны указаны в ч/млн (м.д.) в слабом поле от тетраметилсилана(TMS) или другого внутреннего стандарта в соответствующем указанном растворителе. Пример 1 Синтез 2-хлор-4-(2-хлорпиридин-3-ил)-[1,3,5]триазина. Стадия 1. Получение 2-хлорникотинамида. 2-Хлор-3-цианпиридин (5,0 г, 36 ммоль) растворяли в сухом EtOH (100 мл) при температуре 0 С. Пропускали через смесь HCl в течение 3 ч, затем герметизировали сосуд со смесью и охлаждали (примерно при 8 С) в течение ночи. После концентрирования остаток перемешивали с ацетатом аммония (5,5 г) в 100 мл IpOH. Через 12 ч величину рН регулировали до 9 (от 4), используя концентрированный раствор NH4OH, перемешивание продолжали еще в течение 2 дней. Смесь концентрировали и очищали методом флэш-хроматографии (10:1:0,1 CH2Cl2/MeOH/NH4OH). Растирание в порошок в нагретой смеси трет-BuOMe/IpOH позволило удалить побочный продукт, остаточный амид, с получением целевого продукта в виде белого твердого продукта. Стадия 2. Получение амино-(2-хлорпиридин-3-ил)метилцианамида. 2-Хлорникотинамид суспендировали в 10 мл IpOH вместе с 500 мг твердого цианамида и перемешиваемые твердые продукты растворяли при добавлении 5% водного NaHCO3 (30 мл). После перемешивания в течение 2 дней выделяли амино-(2-хлорпиридин-3-ил)метилцианамид путем экстракции при помощи EtOAc водной реакционной смеси с последующей флэш-хроматографией, используя смесь 95:5:0,5CH2Cl2/MeOH/NH4OH. MS m/z=181 [М+Н]+. Рассчитано для C7H6N4Cl: 181,03. Стадия 3. Получение 2-хлор-4-(2-хлорпиридин-3-ил)-[1,3,5]триазина. Амино-(2-хлорпиридин-3-ил)метилцианамид (3,5 г) добавляли в виде твердого продукта к перемешиваемому при 0 С раствору POCl3 (2,3 мл, 25 ммоль) и DMF (1,9 мл, 25 ммоль) в 100 мл AcCN. Прозрачный раствор перемешивали при rt в течение 1 ч. Добавляли толуол (40 мл) и концентрировали смесь. Остаток сразу же фильтровали через фильтр (200 г) двуокиси кремния (загрузка в 10:1 CH2Cl2/IpOH,элюирование 10:1-4:1 гексан/трет-BuOMe). Концентрирование обеспечило получение 2-хлор-4-(2 хлорпиридин-3-ил)-[1,3,5]триазина в виде белого твердого продукта. MS m/z=227 [М+Н]+. Рассчитано для C8H4Cl2N4: 225,98. Пример 2 Синтез [4-(2-хлорпиридин-3-ил)-[1,3,5]триазин-2-ил]метиламин. К 2-хлор-4-(2-хлорпиридин-3-ил)-[1,3,5]триазин (10,0 г, 44,0 ммоль) в 55 мл метиленхлорида добавляли метиламин (45 мл, 88,0 ммоль) в виде 2,0 М раствора в THF при температуре 0 С. После перемешивания при комнатной температуре в течение 18 ч смесь разбавляли ацетоном и фильтровали через слой силикагеля, после чего концентрировали с получением желаемого продукта. MS m/z=222 [М+Н]+. Рассчитано для C9H8ClN5: 221,65. Пример 3(42 г, 350 ммоль) нагревали под осушающей трубкой при температуре 85 С в течение 1,5 ч и концентрировали. Остаток очищали методом вакуумной фильтрационной хроматографии (используя 150 г двуокиси кремния в воронке Бюхнера, с быстрым сбором фракций, элюируя их смесью 10:1 и затем 5:1CH2Cl2/IpOH) с получением желтого твердого продукта. MS m/z=211 [М+Н]+. Рассчитано дляC10H11ClN2O: 210,66. Стадия 2. Получение 4-(2-хлорпиридин-3-ил)пиримидина. Метоксид натрия получали в течение 1,5 ч при прерывистом добавлении небольших кусочков металлического натрия (всего 8,3 г, 360 ммоль) к 400 мл сухого метанола в атмосфере N2 при комнатной температуре, используя баню с 500 мл IpOH как баню для погружения. Добавляли формамидинацетат(42,7 г, 410 ммоль) и через 10 мин енаминон (30,6 г, 146 ммоль). Смесь перемешивали в течение ночи в атмосфере N2 при температуре смеси 40 С. Через 20 ч смесь перемешивали при температуре, равной 48 С, в течение 4 ч. Добавляли снова формамидин ацетат (7,0 г) и перемешивали смесь в течение ночи при температуре 44 С. Смесь концентрировали в роторном выпаривателе, отбирали в этилацетате и экстрагировали насыщенным водным раствором NaHCO3. Водный слой экстрагировали EtOAc. Соединенные органические слои (1,2 л) высушивали над Na2SO4 и концентрировали. Остаток очищали вакуумной фильтрационной флэш-хроматографией (300 г двуокиси кремния) в 3:1-2:1 смеси гексан/EtOAc с получением твердого продукта белого цвета. MS m/z=192 [М+Н]+. Рассчитано для C9H6ClN3: 191,62. Пример 4 Синтез 4-(2-хлорпиридин-3 ил)-N-метилпиримидин-2-амина. Стадия 1. Получение 1-(2-хлорпиридин-3-ил)-3-диметиламинопропенона. Это соединение получали согласно способу по примеру 3, стадия 1. Стадия 2. Получение 4-(2-хлорпиридин-3-ил)-N-метилпиримидин-2-амина. Металлический натрий (3,40 г, 148 ммоль) добавляли в течение 10 мин к 180 мл МеОН при rt и перемешивали еще 30 мин для получения метоксида натрия. Метилгуанидин HCl (20,0 г, 182 ммоль) добавляли и полученную смесь перемешивали в течение 30 мин перед добавлением 1-(2-хлорпиридин-3 ил)-3-диметиламинопропенона (12,0 г, 57 ммоль). Присоединяли воздушный конденсатор и нагревали смесь до 50 С в течение 23 ч. Часть МеОН удаляли в роторном выпаривателе, полученный твердый продукт фильтровали и промывали насыщенным раствором бикарбоната натрия и водой. Полученный продукт после сушки представлял собой объемное твердое вещество белого цвета. MS m/z=221 [М+Н]+. Рассчитано для C10H9ClN4: 220,66. Пример 5. 4-(2,5-Дихлорпиридин-3-ил)-N-метилпиримидин-2-амин. Это соединение получали способом, аналогичным описанному в примере 4. MS m/z=255, 257[М+Н]+. Рассчитано для C10H8Cl2N4: 255,11. Пример 6. 4-(2-Хлорпиридин-3-ил)-5-фтор-N-метилпиримидин-2-амин. Это соединение получали способом, описанным в примере 4. MS m/z=238 [М+Н]+. Рассчитано для Синтез 4-(2-хлорпиридин-3-ил)-2-(метилтио)пиримидина. Реактор объемом 5 л промывали аргоном, затем загружали 4-хлор-2-метилтиопиримидин (111 мл,953 ммоль) и 2-хлорпиридин-3-бороновую кислоту (100 г, 635 ммоль). В реакторе создавали вакуум и заполняли его аргоном. Эту процедуру повторяли еще 2 раза. К смеси добавляли диметиловый эфир этиленгликоля (500 мл) и затем Pd(PPh3)4 (58,7 г, 50,8 ммоль). В реакторе создавали вакуум и заполняли аргоном. Это повторяли еще 2 раза, затем снова добавляли диметиловый эфир этиленгликоля (1500 мл). К перемешиваемой реакционной смеси добавляли раствор бикарбоната натрия (1 М раствор, 1300 мл). Наблюдалась небольшая экзотерма. Реакционную смесь подвергали перемешиванию и нагревали с обратным холодильником в течение 2,75 ч и затем постепенно охлаждали до 25 С. Смесь разбавляли этилацетатом (1500 мл) и энергично перемешивали. Слоям давали разделиться и удаляли водную фазу. Органическую фазу промывали водой (1000 мл), затем солевым раствором (1000 мл), сушили над сульфатом магния и отфильтровывали. Растворители удаляли под вакуумом, получая технический продукт в виде светло-желтого твердого вещества. Этот технический продукт выделяли колоночной хроматографией,используя смесь этанола и дихлорметана. Продукт представлял собой твердое вещество белого цвета, его суспендировали в этилацетате для удаления следов примесей. Полученный белый продукт был объемным. MS m/z=238 [М+Н]+. Рассчитано для C10H8ClN3S: 237,71. Пример 8 Синтез 2-хлор-4-(2-хлорпиридин-3-ил)пиримидина. К 2,4-дихлорпиримидину (2,0 г, 13,4 ммоль), 2-хлорпиридин-3-бороновой кислоте (3,16 г, 20,1 ммоль) и Pd(PPh3)4 (1,55 г, 1,30 ммоль) добавляли DME (30,0 мл) и 1 М NaHCO3 (1,30 мл). Полученную смесь нагревали до 90 С в течение 17 ч, затем разбавляли EtOAc и экстрагировали насыщенным раствором карбоната натрия, водой и солевым раствором. Органические слои высушивали над сульфатом натрия, фильтровали и концентрировали. Полученный твердый продукт растирали в порошок с простым эфиром и высушивали, получая желательное соединение. MS m/z=226 [М+Н]+. Рассчитано для Синтез 4-(2-хлорпиридин-3-ил)-N-(3-морфолинпропил)пиримидин-2-амина. К 2-хлор-4-(2-хлорпиридин-3-ил)пиримидину (100 мг, 0,44 ммоль) и карбонату калия (122 мг, 0,88 ммоль) добавляли DMSO (1,0 мл) и 3-морфолинпропан-1-амин (77 мг, 0,53 ммоль). Полученную смесь нагревали в течение 15 ч при температуре 80 С. Охлажденную реакционную смесь разбавляли EtOAc и экстрагировали водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали с получением желательного продукта в виде желтого масла. MS m/z=334 [М+Н]+. Рассчитано для Синтез 4-(2-хлорпиридин-3-ил)-1-(триизопропилсилил)-1-пиррол[2,3,b]пиридина. Стадия 1. Получение 4-хлор-1-(триизопропилсилил)-1H-пиррол[2,3-b]пиридина. Гидрид натрия (880 мг, 22 ммоль, 1,1 экв, 60% в минеральном масле) промывали 15 мл сухой смеси гексанов в атмосфере аргона. Затем гексаны удаляли и заменяли 40 мл THF. Порциями добавляли 4 хлор-7-азаиндол в суспензию гидрида натрия. Суспензию перемешивали до прекращения выделения газа. При помощи шприца добавляли триизопропилхлорсилан (3 г, 20 ммоль, 1 экв.). Реакционную смесь помещали в предварительно подогретую масляную баню при 80 С и осуществляли мониторинг реакции при помощи LC-MS и TLC. Через 3 ч реакционную смесь охлаждали до комнатной температуры. Реакцию медленно обрывали насыщенным раствором NH4Cl. Полученный продукт экстрагировали смесью гексанов и Et2O. Органические слои соединяли, промывали солевым раствором, сушили над MgSO4 и концентрировали. Остаток пропускали через слой силикагеля с помощью гексанов для вымывания пятен со старта. Фильтрат концентрировали и получали 4-хлор-1-(триизопропилсилил)-1H-пиррол[2,3-b]пиридин в виде вязкого бесцветного масла. 1 Н ЯМР (Varian, 300 МГц, CDCl3) ppm: 8.14 (d, J=5 Гц, 1H), 7.32 (d, J=3.6 Гц, 1H), 7.05 (dd, J=5, 0.8 Гц, 1H), 6.64 (dd, J=3.5, 0.8 Гц, 1 Н), 1.87 (sept, J=7.3 Гц, 3 Н), 1.10 (d, J=7.3 Гц, 18 Н). Стадия 2. Получение 4-(2-хлорпиридин-3-ил)-1-(триизопропилсилил)-1H-пиррол[2,3-b]пиридина. 4-Хлор-1-(триизопропилсилил)-1H-пиррол[2,3-b]пиридин (5,03 г, 16,3 ммоль, 1 экв.), 2 хлорпиридин-3-бороновую кислоту (4,36 г, 27,7 ммоль, 1,7 экв.), ацетат палладия (183 мг, 0,815 ммоль, 5 мол.%), 2-(дициклогексилфосфин) бифенил (571 мг, 1,63 ммоль, 10 мол.%) и мелкоизмельченный безводный K3PO4 (10,4 г, 48,9 ммоль, 3 экв.) добавляли в герметичную трубку. Трубку промывали аргоном в течение 5 мин. При помощи шприца добавляли диоксан (30 мл) в токе аргона. Трубку герметизировали и перемешивали реакционную смесь при rt в течение 5 мин. Затем трубку помещали в предварительное нагретую масляную баню при температуре 110 С на 2 ч. Реакционную смесь охлаждали до комнатной температуры. Содержимое фильтровали через слой целлита, используя диэтиловый эфир. Фильтрат концентрировали при пониженном давлении. Полученный продукт очищали методом колоночной хроматографии при помощи смеси 95:5 гексаны: Et2O в качестве элюента. Полученное соединение, 4-(2 хлорпиридин-3-ил)-1-(триизопропилсилил)-1H-пиррол[2,3-b]пиридин, представляло собой светложелтый твердый продукт. 1 Н ЯМР (Varian, 300 МГц, CDCl3) ppm: 8.35 (d, J=4.7 Гц, 1H), 8.30-8.28 (m, 1H), 8.10-8.03 (m, 1H),7.40-7.30 (m, 2H), 7.15 (dd, J=4.3, 1.7 Гц, 1H), 6.54 (dd, J=3.6, 1.9 Гц, 1H), 1.89 (sept, J=7.4 Гц, 3 Н), 1.15 (d,J=7.4 Гц, 18H). Пример 11 Синтез 2-хлор-2'-фтор-[3,4']бипиридинила. К 2-фтор-4-иодпиридину (9,45 г, 42,4 ммоль), 2-хлорпиридин-3-бороновой кислоте (10,0 г, 63,5 ммоль), Na2CO3 (13,5 г, 127 ммоль), Pd(OAc)2 (480 мг, 2,12 ммоль) и Р (трет-Bu)3HBF4 (1,23 мг, 4,24 ммоль) добавляли диоксан (125 мл) и воду (45 мл). Смесь нагревали при температуре 100 С в течение ночи в герметичной трубке. Полученную смесь разбавляли EtOAc и экстрагировали водой и рассолом. Органический слой высушивали над Na2SO4, фильтровали и концентрировали. Полученный твердый продукт растирали в порошок с н-гексанами и высушивали, получая 2-хлор-2'-фтор-[3,4']бипиридинил. Синтез (2-хлор-[3,4']бипиридинил-2'-ил)-метиламина. К 2-хлор-2'-фтор-[3,4']бипиридинилу (5,30 г, 25,4 ммоль), гидрохлориду метиламина (9,0 г, 133 ммоль) и K2CO3 (28,1 г, 203 ммоль) добавляли DMSO (70 мл). Смесь нагревали в герметичной трубке в течение ночи при температуре 80 С. Охлажденную смесь разбавляли водой (300 мл), полученный твердый продукт отфильтровывали, промывали водой и сушили, получая (2-хлор-[3,4']бипиридинил-2'-ил)метиламин. MS m/z=220 [М+Н]+. Рассчитано для C11H10ClN3: 219,68. Пример 13 Синтез 4-(2-фторпиридин-3-ил)пиридин-2-амина. В автоклав загружали 6,35 мл воды и дегазировали при помощи азота в течение 0,5 ч. В этот сосуд добавляли ацетат калия (2,31 г, 23,5 ммоль), 2-фторпиридин-3-бороновую кислоту (2,48 г, 17,6 ммоль), 4 хлорпиридин-2-амин (1,51 г, 11,7 ммоль), дихлор-бис-(ди-трет-бутилфенилфосфин) Pd(II) (0,146 г, 0,235 ммоль) и 58,5 мл CH3CN. Смесь промывали азотом еще несколько минут и герметизировали сосуд. Реакционную смесь нагревали до 85 С в течение 15 ч. При охлаждении происходило разделение слоев и органический слой сушили при помощи Na2SO4 и концентрировали. Полученный твердый продукт растирали в порошок при помощи смеси этилацетат/диэтиловый эфир и получали 4-(2-фторпиридин-3 ил)пиридин-2-амин в виде оранжевого твердого продукта. MS m/z=190 [М+Н]+. Рассчитано для Синтез 4-(2-хлорпиридин-3-ил)-1 Н-пиразоло[3,4-b]пиридина. Стадия 1. Получение 4-иод-1H-пиразоло[3,4-b]пиридина. К 2-фтор-4-иодникотиновому альдегиду (11,33 мг, 45,1 ммоль) в THF (200 мл) порциями добавляли гидразин (5,67 мл, 181 ммоль). Полученную смесь перемешивали при rt в атмосфере азота в течение 5 ч. Реакционную смесь концентрировали, разбавляли смесью 10:1 ацетон/МеОН и фильтровали через слой силикагеля. Удаляли большую часть растворителя в вакууме, затем разбавляли гексанами и отфильтровывали полученный твердый продукт. Его подвергали сушке, получая 4-иод-1H-пиразоло[3,4-b]пиридин в виде почти белого твердого вещества. MS m/z=246 [М+1]+. Рассчитано для C6H4IN3: 245,02. Стадия 2. Получение трет-бутил-4-иод-1H-пиразоло[3,4-b]пиридин-1-карбоксилата. К 4-иод-1H-пиразоло[3,4-b]пиридину (1,110 г, 4,53 ммоль), ди-трет-бутилдикарбонату (1,09 г, 4,98 ммоль) и N,N-диметилпиридин-4-амину (0,277 г, 2,27 ммоль) добавляли метиленхлорид (15 мл). Полученную смесь перемешивали при rt в атмосфере азота в течение 15 ч, разбавляли метиленхлоридом и экстрагировали насыщенным раствором бикарбоната натрия. Высушивали органические слои над сульфатом натрия, фильтровали через слой силикагеля, применяя смесь 1:1 EtOAc/CH2Cl2, и концентрировали, получая трет-бутил-4-иод-1H-пиразоло[3,4-b]пиридин-1-карбоксилат в виде светло-желтого твердого продукта. 1 Н ЯМР (Bruker, 400 МГц, DMSO-d6) ppm: 8.42 (m, 2H), 7.98 (m, 1H), 1.72 (s, 9H). Стадия 3. Получение 4-(2-хлорпиридин-3-ил)-1H-пиразоло[3,4-b]пиридина. К трет-бутил-4-иод-1H-пиразоло[3,4-b]пиридин-1-карбоксилату (1,00 г, 2,90 ммоль), 2 хлорпиридин-3-ил-бороновой кислоте (1,14 г, 7,24 ммоль) и карбонату натрия (1,23 г, 11,6 ммоль) добавляли диоксан (10 мл) и воду (4 мл). Смесь перемешивали при rt в течение 5 мин, затем добавляли тритрет-бутилфосфония тетрафторборат (0,084 г, 0,290 ммоль) и ацетат палладия(II) (0,033 г, 0,145 ммоль),смесь нагревали до 100 С в герметичной трубке в течение 23 ч. Реакционную смесь разбавляли EtOAc и экстрагировали 1 N бикарбонатом натрия. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Технический продукт очищали методом ISCO хроматографии на силикагеле(10-90% EtOAc/гексаны, колонка с 80 г), фракции продукта концентрировали с получением 4-(2 хлорпиридин-3-ил)-1 Н-пиразоло[3,4-b]пиридина в виде белого твердого вещества. MS m/z=231 [М+Н]+. Рассчитано для C11H7ClN4: 230,66. Пример 15 Синтез 4-(2-хлорпиридин-3-ил)пиримидин-2-амина. В промытую аргоном круглодонную колбу объемом 500 мл, помещенную в баню с изопропанолом,к метанолу (180 мл) вводили металлический натрий (3,40 г, 148 ммоль). Смесь перемешивали в течение примерно 30 мин при RT. К этой смеси добавляли гидрохлорид гуанидина (12,0 мл, 182 ммоль) и перемешивали при rt в течение 30 мин, затем добавляли (Е)-1-(2-хлорпиридин-3-ил)-3-(диметиламино)проп 2-ен-1-он (12,0 г, 57,0 ммоль), подсоединяли воздушный конденсатор, помещали смесь в масляную баню,где ее нагревали до примерно 50 С в течение 24 ч. При пониженном давлении выпаривали почти половину метанола и отфильтровывали под вакуумом твердый продукт, промывали его насыщенным раствором NaHCO3 и H2O, высушивали на воздухе с получением 4-(2-хлорпиридин-3-ил)пиримидин-2-амина в виде почти белого твердого продукта. MS m/z=207 [М+1]+. Рассчитано для C9H7ClN4: 206,63. Пример 16 Синтез 4-(2-хлорпиридин-3-ил)-1H-пиразол-3-амина. Стадия 1. Получение (2-хлорпиридин-3-ил)метанола. К перемешиваемому раствору 2-хлорникотиновой кислоты (8,0 г, 51,0 ммоль) в THF (120 мл) при температуре 0 С в атмосфере азота медленно добавляли тетрагидроалюминат лития (51 мл, 51 ммоль) в течение 5 мин. Реакционной смеси давали нагреться в течение 2 ч до rt и осуществляли мониторинг реакции при помощи TLC. Реакцию обрывали, добавляя мелкими порциями лед с последующим добавлением воды. Экстрагировали полученный продукт EtOAc, промывали 2 Н 2 О, 1NaCl, высушивали надMg2SO4, фильтровали через фритту и концентрировали раствор с получением (2-хлорпиридин-3-ил) метанола в виде масла оранжевого цвета. Его применяли без очистки. Стадия 2. Получение 3-(бромметил)-2-хлорпиридина. В круглодонной колбе объемом 250 мл растворяли (2-хлорпиридин-3-ил)метанол (6,7 г, 47 ммоль) вCH2Cl2 (100 мл). Реакционную смесь охлаждали до 0 С, затем медленно добавляли трибромфосфин (4,8 мл, 51 ммоль) и давали смеси нагреться в течение ночи до rt. Реакцию обрывали путем добавления льда,экстрагировали CH2Cl2, промывали 1NaHCO3, 2 Н 2 О, сушили над Mg2SO4, фильтровали через фритту в воронке и концентрировали фильтрат. Технический продукт очищали методом хроматографии на силикагеле, элюируя 15-45% смеси EtOAc/гексаны. Фракцию продукта концентрировали, получая 3(бромметил)-2-хлорпиридин в виде почти белого твердого продукта. MS m/z=206, 208 [М+1]+. Рассчитано для C6H5BrCN: 206,47. Стадия 3. Получение 2-(2-хлорпиридин-3-ил)ацетонитрила. В круглодонной колбе объемом 250 мл растворяли 3-(бромметил)-2-хлорпиридин (7,2 г, 35 ммоль) в МеОН (70 мл). К раствору добавляли цианид натрия (3,4 г, 70 ммоль), затем присоединяли обратный холодильник, перемешивали смесь при 80 С, проводя мониторинг реакции методом LCMS. Примерно через 1,5 ч реакционную смесь охлаждали до rt, концентрировали, разбавляли EtOAc, при этом выделялся твердый продукт белого цвета. Этот продукт отфильтровывали и промывали EtOAc. Фильтрат концентрировали, получая технический красновато-коричневый твердый продукт. Этот продукт растворяли вEtOAc и очищали методом хроматографии на силикагеле, элюируя 40-70% EtOAc/гексаны. Фракции продукта концентрировали и получали 2-(2-хлорпиридин-3-ил)ацетонитрил в виде почти белого вещества. MS m/z=153 [М+1]+. Рассчитано для C7H5ClN2: 152,58. Стадия 4. Получение 2-(2-хлорпиридин-3-ил)-3-оксопропаннитрила. Раствор 2-(2-хлорпиридин-3-ил)ацетонитрила (2,0 г, 13 ммоль) в THF (5 мл) медленно добавляли к суспензии гидрида натрия, 60% в минеральном масле (1,31 г, 33,0 ммоль) в THF (10 мл) при температуре 0 С. Смесь перемешивали в течение 15 мин и медленно добавляли этилформиат (1,1 мл, 13 ммоль). Смесь перемешивали при RT, осуществляя мониторинг реакции методом LCMS. После завершения реакции проводили экстракцию в EtOAc, промывали органический слой 2 Н 2 О, сушили над Mg2SO4,фильтровали через фритту и лиофилизировали, получая 2-(2-хлорпиридин-3-ил)-3-оксопропаннитрил в виде красновато-коричневого твердого продукта. Технический продукт применяли без очистки. MSm/z=181 [М+1]+. Рассчитано для C8H5ClN2O: 180,59. Стадия 5. Получение 4-(2-хлорпиридин-3-ил)-1H-пиразол-3-амина. В герметичную трубку объемом 150 мл добавляли 2-(2-хлорпиридин-3-ил)-3-оксопропаннитрил (2,5 г, 14 ммоль), воду (2,0 мл, 14 ммоль), уксусную кислоту (14 ммоль), 1,4-диоксан (14 мл) и безводный гидразин (0,40 мл, 14 ммоль). Смесь перемешивали в течение 20 мин при температуре 70 С. Реакционную смесь охлаждали до rt и концентрировали. Концентрат обрабатывали для экстракции EtOAc, промывали 1NaHCO3, 1 Н 2 О, сушили над Mg2SO4, фильтровали через фритту и концентрировали. Сырой продукт очищали, используя метод хроматографии с обращенной фазой. Продукт экстрагировали CH2Cl2,промывали 1NaHCO3, 1 Н 2 О, сушили над Na2SO4, фильтровали через фритту и концентрировали с получением 4-(2-хлорпиридин-3-ил)-1 Н-пиразол-3-амина в виде твердого продукта оранжевого цвета. MS Синтез 1,4-дихлор-5,8-дифторфталазина. Стадия 1. Получение 5,8-дифтор-2,3-дигидрофталазин-1,4-диона. К 4,7-дифторизобензофуран-1,3-диону (1,0 г, 5,43 ммоль) и ацетату натрия (0,535 г, 6,52 ммоль) добавляли воду (14 мл), уксусную кислоту (7,15 мл, 125 ммоль) и гидразин (0,205 мл, 6,52 ммоль) (медленно). Подсоединяли водяной конденсатор и нагревали смесь с обратным холодильником в течение 20 ч затем смесь охлаждали до rt и отфильтровывали полученный твердый продукт. Промывали его водой и сушили, получая 5,8-дифтор-2,3-дигидрофталазин-1,4-дион в виде белого продукта. MS m/z=199 [М+1]+. Рассчитано для C8H4F2N2O2: 198,13. Стадия 2. Получение 1,4-дихлор-5,8-дифторфталазина. К 5,8-дифтор-2,3-дигидрофталазин-1,4-диону (0,860 г, 4,34 ммоль) добавляли оксихлорид фосфора(4,05 мл, 43,4 ммоль). Присоединяли водяной конденсатор и нагревали смесь в течение 15,5 ч. Охлаждали реакционную смесь и концентрировали ее под вакуумом. Затем разбавляли метиленхлоридом и ледяной водой, обрывали реакцию твердым бикарбонатом натрия до достижения щелочного рН. Разделяли слои и сушили органический слой над сульфатом натрия, фильтровали и концентрировали с получением 1,4-дихлор-5,8-дифторфталазина в виде светло-желтого твердого продукта. MS m/z=235, 237 [М+1]+. Рассчитано для C8H2Cl2F2N2: 235,02. Способом, аналогичным описанному в примере 17, были получены следующие промежуточные продукты. Пример 18. 1,4-Дихлор-6,7-дифторфталазин. Синтез 5,8-дихлорпиразин[2,3-d]пиридазина. Стадия 1. Получение 6,7-дигидропиразин[2,3-d]пиридазин-5,8-диона. Это соединение получали в соответствии с известным методом (Paul D.B. Aust. J. Chem., 1974, 27,1331). Как там описано, 2,3-пиразиндикарбоновый ангидрид (5,0 г, 33,3 ммоль), гидразингидрат (2,8 г, 56 ммоль) и уксусную кислоту (40,4 мл, 33,3 ммоль) смешивали при RT. Выпадал белый осадок. Реакционную смесь нагревали с обратным холодильником в течение примерно 20 мин. Затем смесь охлаждали доrt и отфильтровывали твердый продукт, промывали его водой и сушили под вакуумом. Полученный 6,7 дигидропиразин[2,3-d]пиридазин-5,8-дион представлял собой продукт белого цвета. 1 Н ЯМР (Bruker, 400 МГц, D2O) м.д.: 8.87 (s, 2 Н). Стадия 2. Получение 5,8-дихлорпиразин[2,3-d]пиридазина. Это соединение получали в соответствии с методом, описанным в литературе (Patel, N.R., CastleR.N. J. Heterocyclic Chem., 1966, 3, 512). Смесь 6,7-дигидропиразин[2,3-d]пиридазин-5,8-диона (2,50 г,15,2 ммоль), пентахлорида фосфора (6,98 г, 33,5 ммоль), оксихлорида фосфора (39,8 мл, 42,7 ммоль) добавляли в круглодонную колбу, снабженную магнитной мешалкой. Осушающая трубка была прикреплена на верхней части конденсатора. Реакционную смесь нагревали с обратным холодильником в течение 8 ч. Образовывалась оранжевая суспензия. Реакционную смесь охлаждали до rt. Растворитель удаляли азеотропной перегонкой (толуол) при пониженном давлении для удаления избытка POCl3. Остаток черного цвета обрабатывали льдом и медленно подщелачивали твердым Na2CO3. Водный раствор экстрагировали несколько раз хлороформом, соединенные экстракты сушили над MgSO4, фильтровали и концентрировали, получая 5,8-дихлорпиразин[2,3-d]пиридазин. 1H ЯМР (Bruker, 400 МГц, CDCl3) м.д.: 9.24 (s, 2 Н). Пример 24 Синтез 3,6-дихлор-4,5-бис-(метоксиметил)пиридазина. Это соединение получали в соответствии со статьей Samaritoni J.G. Org. Prep. Proced. Int., 20, 117121, 1988. К слегка гетерогенной смеси метоксиуксусной кислоты (3,6 мл, 47 ммоль), нитрата серебра(0,57 г, 3,4 ммоль), 3,6-дихлорпиридазина (2,0 г, 13 ммоль) и концентрированной серной кислоты (1,7 мл,20 ммоль) в 30 мл воды при температуре 70 С добавляли по каплям раствор персульфата аммония (7,7 г,34 ммоль) в 15 мл воды в течение примерно 10 мин. Гетерогенная смесь подвергалась перемешиванию в течение 30 мин и затем ее выливали на лед. Получали резиноподобный продукт серого цвета. Водный продукт отфильтровывали и холодный фильтрат подщелачивали концентрированным раствором гидроокиси аммония. При рН 10 раствор становился темно-желтым. Водный продукт экстрагировали три раза дихлорметаном, сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Полученное желтое масло очищали методом хроматографии на силикагеле (0-40% EtOAc/гексаны),получая 3,6-дихлор-4,5-бис-(метоксиметил) пиридазин в виде белого твердого продукта. MS m/z=237 Синтез 1-хлор-4-(4-метилтиофен-2-ил)фталазина. 1,4-Дихлорфталазин (1,40 г, 7,03 ммоль), 4-метилтиофен-2-илбороновую кислоту (999 мг, 7,03 ммоль) и PdCl2 (DPPF) (721 мг, 985 мкмоль) добавляли в герметичную трубку. Трубку промывали аргоном. Затем добавляли карбонат натрия (2,0 М в воде) (7,74 мл, 15,5 ммоль) и 1,4-диоксан (35,2 мл, 7,03 ммоль). Трубку герметизировали, содержимое перемешивали при rt в течение 5 мин и помещали в предварительно нагретую масляную баню при температуре 110 С. Через 1 ч LC-MS показала образование целевого продукта и побочного продукта (двойное сочетание) и SM дихлорфталазин. Реакционную смесь охлаждали до rt, фильтровали через слой целлита с помощью EtOAc, концентрировали и загружали в колонку. Полученный продукт очищали методом колоночной хроматографии, используя Hex для удаления основного пятна и затем 80:20 Hex:EtOAc для сбора продукта. Этот продукт, 1-хлор-4-(4 метилтиофен-2-ил)фталазин, получали в виде желтого твердого продукта. LC-MS показала, что этот продукт был загрязнен небольшим количеством SM дихлорфталазина и побочного продукта бис-сочетания. Синтез 1-хлор-4-фенил-5,6,7,8-тетрагидрофталазина. Дихлорид 1,1'-бис-(дифенилфосфин)ферроценпалладия (0,270 г, 0,369 ммоль), фенилбороновую кислоту (0,900 г, 7,38 ммоль) и 1,4-дихлор-5,6,7,8-тетрагидрофталазин (2,25 г, 11,1 ммоль) помещали в герметизируемый сосуд объемом 150 мл в атмосфере аргона. Добавляли 15 мл диоксана и 2,0 М водный раствор карбоната натрия (7,38 мл, 14,8 ммоль). Сосуд герметизировали и нагревали до 80 С, получали гомогенную коричневую реакционную смесь. Через 30 мин смесь охлаждали до комнатной температуры и разбавляли EtOAc, водой и рассолом. Полученные слои разделяли, органический слой высушивали над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом с получением красного твердого вещества. Его растворяли в дихлорметане и очищали методом хроматографии на силикагеле (060% EtOAc в гексанах) с получением 1-хлор-4-фенил-5,6,7,8-тетрагидрофталазина в виде почти белого твердого вещества. MS m/z=245 [М+Н]+. Рассчитано для C14H13ClN2: 244,7. Пример 27 Синтез 4-4-фенилфталазин-1-ил)метил)фенола. Стадия 1. Получение 2-(2-(4-метоксифенил)ацетил)-N-метилбензамида. При температуре 0 С добавляли (4-метоксибензил)магнийхлорид (0,25 М в THF) (37 мл, 9,3 ммоль) к 2-метилизоиндолин-1,3-диону (1,00 г, 6,2 ммоль) в THF (3,0 мл) (ссылка: Synthetic Comm. 2004, 34 (7),1301-1308). Смесь перемешивали при температуре 0 С в течение 5 мин, затем охлаждали, добавляя 10 мл воды. Реакционную смесь нагревали до rt и концентрировали с получением 2-(2-(4 метоксифенил)ацетил)-N-метилбензамида. Это соединение применяли на следующей стадии без очистки.MS m/z=284 [М+1]+. Рассчитано для C17H17NO3: 283,33. Стадия 2. Получение 4-(4-метоксибензил)фталазин-1(2 Н)-она. К 2-(2-(4-метоксифенил)ацетил)-N-метилбензамиду (1,76 г, 6,20 ммоль) в EtOH (20 мл) добавляли гидразин (3,50 мл, 112 ммоль). Присоединяли водяной конденсатор и нагревали смесь с обратным холодильником в атмосфере азота в течение 5 дней. После концентрирования реакционную смесь разбавлялиEtOAc и экстрагировали водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Технический продукт очищали путем промывки твердого продукта диэтиловым эфиром и фильтровали с получением 4-(4-метоксибензил)фталазин-1(2 Н)-она в виде белого твердого вещества. MSm/z=267 [М+1]+. Рассчитано для C16H14N2O2: 266,30. Стадия 3. Получение 1-(4-метоксибензил)-4-хлорфталазина. К 4-(4-метоксибензил)фталазин-1(2 Н)-ону (1,18 г, 4,43 ммоль) добавляли оксихлорид фосфора (4,13 мл, 44,3 ммоль). Присоединяли водяной конденсатор и нагревали смесь с обратным холодильником в атмосфере азота в течение 15 ч. Реакционную смесь концентрировали под вакуумом, разбавляли метиленхлоридом и ледяной водой, затем обрывали реакцию твердым бикарбонатом натрия до достижения щелочного рН и прекращения выделения газа. Слои разделяли и высушивали органические слои над сульфатом натрия, фильтровали через слой силикагеля, используя EtOAc, и концентрировали с получением 1-(4-метоксибензил)-4-хлорфталазина в виде светло-оранжевого твердого продукта. MS m/z=285[М+1]+. Рассчитано для C16H13ClN2O: 284,75. Стадия 4. Получение 1-(4-метоксибензил)-4-фенилфталазина. К 1,1'-бис-(дифенилфосфин)ферроцин палладия дихлориду (0,046 г, 0,063 ммоль), 1-(4 метоксибензил)-4-хлорфталазину (0,360 г, 1,3 ммоль) и фенилбороновой кислоте (0,39 г, 3,2 ммоль) добавляли диоксан (4,0 мл) и карбонат натрия (2,0 М, водн.) (1,9 мл, 3,8 ммоль). Полученную смесь нагревали до 100 С в герметичной трубке в течение 1 ч. Реакционную смесь разбавляли EtOAc и экстрагировали водой и рассолом. Органические слои высушивали над сульфатом натрия, отфильтровывали, концентрировали и очищали технический продукт методом ISCO хроматографии на силикагеле (10-100%EtOAc/гексаны, колонка 40 г). Концентрирорвали фракции продукта с получением 1-(4-метоксибензил)4-фенилфталазина в виде светло-желтого твердого продукта. MS m/z=327 [М+1]+. Рассчитано дляC22H18N2O: 326,40. Стадия 5. Получение 4-4-фенилфталазин-1-ил)метил)фенола. К 1-(4-метоксибензил)-4-фенилфталазину (0,240 г, 0,735 ммоль) добавляли уксусную кислоту (1,5 мл) и затем бромисто-водородную кислоту, 48% (1,50 мл, 27,6 ммоль). Нагревали смесь с использовани- 25018128 ем обратного холодильника в течение 3 ч. Реакционную смесь разбавляли водой и нейтрализовали 6 NNaOH до достижения рН 6. Отфильтровывали полученный твердый продукт, промывали водой и высушивали, получая 4-4-фенилфталазин-1-ил)метил)фенол в виде почти белого продукта. MS m/z=313(1,35 мл, 43,1 ммоль). Реакционную колбу нагревали с обратным холодильником в атмосфере азота в течение 3,5 ч. Реакционную смесь охлаждали до комнатной температуры, полученный твердый продукт отфильтровывали и промывали водой, высушивали с получением 4-фенилтиен[2,3-d]пиридазин-7(6 Н)она в виде белого вещества. MS m/z=229 [М+1]+. Рассчитано для C12H8N2OS: 228,27. Стадия 2. Получение 7-хлор-4-фенилтиен[2,3-d]пиридазина. К 4-фенилтиен[2,3-d]пиридазин-7(6 Н)-ону (0,714 г, 3,13 ммоль) добавляли POCl3 (2,92 мл, 31,3 ммоль). Реакционную колбу нагревали с обратным холодильником в течение 15,5 ч. Реакционную смесь концентрировали и разбавляли CH2Cl2 и ледяной водой. Смесь подщелачивали твердым бикарбонатом натрия. Органические слои разделяли и высушивали над сульфатом натрия. К остатку после концентрации добавляли 50% EtOAc и раствор отфильтровывали через слой двуокиси кремния. Полученную фракцию концентрировали и получали 7-хлор-4-фенилтиен[2,3-d]пиридазин в виде светло-желтого твердого вещества. MS m/z=247 [М+1]+. Рассчитано для C12H7N2S: 246,71. Пример 29 Синтез 1-хлор-4-фенилфталазина. Смесь фосфорилтрихлорида (28,4 мл, 310 ммоль) и 4-фенилфталазин-1(2 Н)-она (13,8 г, 62,0 ммоль) нагревали с обратным холодильником и осушающей трубкой в течение ночи в бане с температурой 130 С. Полученный гомогенный раствор светло-оранжевого цвета охлаждали до rt и оставляли стоять на несколько дней. Затем смесь выливали осторожно при перемешивании в лед. Полученную смесь осторожно обрабатывали 6 N NaOH до достижения рН 8 при добавлении льда для контроля температуры. Полученный почти белый продукт собирали после фильтрования, сушили не воздухе и затем под вакуумом с получением светло-желтого вещества 1-хлор-4-фенилфталазина. MS m/z=241 [М+Н]+. Рассчитано для C14H9ClN2: 240,7. Пример 30 Синтез 4-(2-(4-аминофенокси)пиридин-3-ил)пиримидин-2-амина. В герметизируемую трубку добавляли 4-аминофенол (1,3 г, 12 ммоль), карбонат цезия (7,8 г, 24 ммоль) и DMSO (16 мл, 0,75 М). Смесь нагревали до 100 С в течение 5 мин и затем добавляли 4-(2 хлорпиридин-3-ил)пиримидин-2-амин (2,5 г, 12 ммоль) и смесь нагервали до 130 С в течение ночи. После завершения реакции по данным LC-MS давали реакционной смеси охладиться до rt и разбавляли водой. Полученный осадок отфильтровывали, твердый продукт промывали водой и диэтиловым эфиром. Затем продукт обрабатывали смесью 9:1 CH2Cl2:МеОН и раствор пропускали через слой силикагеля, используя в качестве элюента смесь CH2Cl2:МеОН, 9:1. Концентрировали раствор в вакууме, получая 4-(2(4-аминофенокси)пиридин-3-ил)пиримидин-2-амин. MS m/z=280 [М+1]+. Рассчитано для C15H13N5O: 279,30. Синтез 4-(2-4-аминофенил)сульфанил)-3-пиридинил)-N-метил-2-пиримидинамина. К 4-аминотиофенолу (1,70 г, 13,6 ммоль) и Cs2CO3 (8,90 г, 27,2 ммоль) добавляли DMSO (18 мл). Смесь перемешивали в течение 5 мин при температуре 100 С перед добавлением 4-(2-хлорпиридин-3 ил)-N-метилпиримидин-2-амина (3,00 г, 13,6 ммоль). Полученную смесь перемешивали в течение 16 ч при температуре 130 С, затем разбавляли водой и полученный твердый продукт отфильтровывали. После промывки продукта водой и Et2O его высушивали под вакуумом и получали желаемый продукт в виде вещества оранжевого цвета. MS m/z=310 [М+1]+. Рассчитано для C16H15N3S: 309,40. Пример 32 Синтез 4-(3-(1H-пиразол-4-ил)пиридин-2-илокси)бензоламин. Стадия 1. Получение 4-бром-1-тритил-1H-пиразола. В герметизируемую трубку объемом 75 мл добавляли 4-бромпиразол (1,0 г, 6,8 ммоль), пиридин(21,0 мл, 258 ммоль), трифенилметилхлорид (2,1 г, 7,5 ммоль) и 4-диметиламинопиридин (0,17 г, 1,4 ммоль). Смесь перемешивали при температуре 80 С в течение 24 ч. Смесь разбавляли водой, твердые вещества отфильтровывали, промывали водой и сушили на воздухе, получая 4-бром-1-тритил-1Hпиразол в виде белого твердого продукта. Стадия 2. Получение 2-хлор-3-(1-тритил-1H-пиразол-4-ил)пиридина. В промытый аргоном автоклав объемом 48 мл добавляли 1,4-диоксана (2,6 мл), 4-бром-1-тритил 1H-пиразол (1,0 г, 2,60 ммоль), фторид калия (0,492 г, 8,48 ммоль), 2-хлорпиридин-3-бороновую кислоту(0,808 г, 5,14 ммоль), трис-(дибензилиденацетон)дипалладий(0) (0,176 г, 0,193 ммоль) и три-третбутилфосфония тетрафторборат (0,168 г, 0,578 ммоль). Сосуд промывали аргоном и нагревали до 100 С в течение 5 ч. Смесь охлаждали до rt, фильтровали через слой силикагеля с EtOAc и концентрировали. Технический продукт очищали методом хроматографии на силикагеле, элюируя 15-70% EtOAc/гексаны. Фракции продукта концентрировали с получением 2-хлор-3-(1-тритил-1 Н-пиразол-4-ил)пиридина в виде почти белого вещества. MS m/z=422 [М+1]+. Рассчитано для C27H20ClN3: 421,92. Стадия 3. Получение 4-(3-(1-тритил-1H-пиразол-4-ил)пиридин-2-илокси)бензоламина. В четыре отдельных сосуда для воздействия микроволн добавляли равные количества следующих компонентов (все количество/4): 4-аминофенола (0,054 г, 0,498 ммоль), растворенного в 1-метил-2 пирролидиноне (4,7 мл), добавляли карбонат цезия (0,309 г, 0,948 ммоль). Каждую смесь перемешивали при температуре 20 С в течение 5 мин, после чего добавляли 2-хлор-3-(1-тритил-1H-пиразол-4 ил)пиридин (0,2 г, 0,474 ммоль) и нагревали до температуры 200 С при воздействии микроволн в течение 6 мин. Растворы соединяли и экстрагировали EtOAc, промывали 1 Н 2 О, 1NaCl, высушивали с помощью Mg2SO4, фильтровали через фритту и концентрировали. Технический остаток очищали методом хроматографии на силикагеле, используя 25-70% смеси EtOAc/гексаны. Полученную фракцию продукта концентрировали с получением 4-(3-(1-тритил-1H-пиразол-4-ил)пиридин-2-илокси)бензоламина в виде коричневого масла. MS m/z=495 [М+1]+. Рассчитано для C33H26N4O: 494,59. Стадия 4. Получение 4-(3-(1H-пиразол-4-ил)пиридин-2-илокси)бензоламина. В трубку объемом 25 мл добавляли 4-(3-(1-тритил-1H-пиразол-4-ил)пиридин-2-илокси)бензоламин(0,150 г, 0,303 ммоль), трифторуксусную кислоту (0,23 мл, 3,0 ммоль) и метанол (1,0 мл). Смесь перемешивали при температуре 80 С в течение 36 ч. Полученную смесь концентрировали. Остаток экстрагировали EtOAc, промывали 1NaHCO3, 1NaCl, органические слои соединяли и высушивали над MgSO4,фильтровали через фритту и концентрировали с получением 4-(3-(1H-пиразол-4-ил)пиридин-2 илокси)бензоламина в виде воскообразного вещества темно-коричневого цвета. MS m/z=253 [М+1]+. Рассчитано для C14H12N4O: 252,27. Пример 33(1,20 г, 9,83 ммоль), дихлорметана (67,8 мл) добавляли ди-трет-бутилдикарбонат (4,72 г, 21,6 ммоль). Полученную смесь перемешивали при rt в атмосфере азота. Через 18 ч LC-MS показала, что образовался единственный продукт (m/z=527, [М+Na]+). Реакционную смесь разбавляли CH2Cl2, промывали насыщенным раствором бикарбоната натрия и промывали рассолом. Органическую фазу высушивали над сульфатом магния, отфильтровывали и концентрировали. Технический продукт очищали, используяISCO колоночную хроматографию на силикагеле, элюируя смесью 90:10 Hex:EtOAc. Собирали фракции полученного продукта, концентрировали и масло помещали в вакуумную печь на ночь для удаленияEtOAc. Белый твердый продукт, трет-бутил-4-хлор-1H-пиррол-[2,3-b]пиридин-1-карбоксилат, образовывался медленно под вакуумом. MS m/z=527 [димер+Na]+. Рассчитано для C12H13ClN2O2: 252,07. Стадия 2. Получение 4-(3-бромпиридин-2-илокси)бензоламина. 3-Бром-2-хлорпиридин (10,3 г, 53,4 ммоль), 4-аминофенол (7,0 г, 64,1 ммоль), карбонат цезия (34,8 г, 107 ммоль) и DMSO (53 мл, 53,4 ммоль) добавляли в герметизируемую трубку. Трубку закрывали и помещали в предварительно нагретую масляную баню при температуре 130 С. Через 16 ч LC-MS показала наличие основного продукта. При перемешивании и охлаждении реакционной смеси в воде со льдом добавляли воду для осаждения полученного продукта из раствора. Получали твердое вещество серого цвета, промывали его водой, сушили под вакуумом при rt. MS m/z=265 [М+1]+. Рассчитано для(DPPF) (0,70 г, 1,00 ммоль) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1,3,2 диоксаборолан (13,0 г, 53,0 ммоль). Реакционную смесь перемешивали при rt в течение 0,5 ч до образования темно-коричневого раствора. Затем трубку помещали в предварительно нагретую масляную баню при 85 С. Через 18 ч LC-MS подтвердила, что реакция завершилась. Смесь охлаждали до rt и пропускали через слой целлита, элюируя EtOAc для удаления примесей черного цвета. Фильтрат концентрировали,получая коричневое масло, которое выдерживали в течение двух дней под вакуумом. Масло превращалось в твердый продукт 4-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2 илокси)бензоламин. MS m/z=313 [М+1]+. Рассчитано для C17H21BN2O3: 312,16. Стадия 4. Получение трет-бутил-4-(2-(4-аминофенокси)пиридин-3-ил)-1H-пиррол[2,3-b]пиридин-1 карбоксилата. В промытую аргоном трубку помещали трет-бутил-4-хлор-1H-пирол[2,3-b]пиридин-1-карбоксилат(5,14 г, 16,5 ммоль), карбонат натрия (3,49 г, 32,9 ммоль), 1,4-диоксан (32,3 мл), воду (11,7 мл). Реакционную смесь перемешивали 5 мин при rt. Затем добавляли ацетат палладия (0,246 г, 1,10 ммоль) и тритрет-бутилфосфония тетрафторборат (0,637 г, 2,19 ммоль). Трубку герметизировали и нагревали до 100 С. Через 1 ч 45 мин проводили мониторинг реакции и устанавливали, что реакция завершена. Реакционную смесь охлаждали до комнатной температуры и пропускали через слой целлита, промываяEtOAc. Фильтрат высушивали над MgSO4, отфильтровывали и концентрировали. Сырой продукт очищали методом колоночной хроматографии на колонке со 120 г силикагеля, используя DCM и 95:5DCM:(90:10:1 DCM:МеОН:NH4OH) для вымывания пятен неполярных веществ, затем 80:20DCM:(90:10:1 DCM:МеОН:NH4OH) для сбора Boc-продукта. Получали вязкое масло коричневого цвета. После выдержки масла при rt в течение нескольких часов образовывались небольшие количества кристаллов. Масло охлаждали до 0 С, осаждался светло-желтый продукт после добавления небольших количеств гексанов и простого эфира, кроме того соскабливали вещество со стенок трубки шпателем. Отфильтровывали светло-желтое твердое вещество, промывали его холодными гексанами и высушивали под вакуумом. Получали трет-бутил-4-(2-(4-аминофенокси)пиридин-3-ил)-1H-пиррол[2,3-b]пиридин-1 карбоксилат. MS m/z=403 [М+1]+. Рассчитано для C23H22N4O3: 402,17. Пример 34 Синтез 4-(2-(5-аминопиридин-2-илокси)пиридин-3-ил)-N-метилпиридин-2-амина. В микроволновый сосуд добавляли 5-аминопиридин-2-ол (125 мг, 1,14 ммоль), растворяли его вDMSO (0,910 мл, 0,228 ммоль) и вводили карбонат цезия (445 мг, 1,37 ммоль). Сосуд закрывали перегородкой и перемешивали реакционную смесь при rt в течение 25 мин до образования пасты. Затем добавляли 4-(2-хлорпиридин-3-ил)-N-метилпиридин-2-амин (50 мг, 0,23 ммоль), закрывали сосуд и нагревали до 180 С в Personal Chemistry Microware в течение 15 мин. Смесь экстрагировали EtOAc, промывали органические слои рассолом, высушивали над MgSO4, отфильтровывали и концентрировали. Полученный продукт очищали методом хроматографии на силикагеле, применяя 60:40 DCM:(90:10:1DCM:МеОН:NH4OH для вымывания основных пятен, затем 50:50 DCM:(90:10:1 DCM:МеОН:NH4OH) для сбора полученного продукта. Получали твердое вещество 4-(2-(5-аминопиридин-2-илокси)пиридин 3-ил)-N-метилпиридин-2-амин. MS m/z=294 [М+1]+. Рассчитано для C16H15N5O: 293,13. Пример 35 Синтез трет-бутил-4-(2-(4-аминофенокси)пиридин-3-ил)пиколиноил(метил)карбамата. Стадия 1. Получение трет-бутил-4-хлор-пиколиноил(метил)карбамата. Это соединение получали согласно методу, описанному в следующих ссылках: (а) Marino, J.P.;THF (11,7 мл, 5,86 ммоль) охлаждали до -78 С. Затем по каплям при температуре -78 С добавляли нBuLi (2,36 мл, 5,86 ммоль) в THF. Полученную густую суспензию желтого цвета перемешивали при температуре -78 С в течение 30 мин, затем нагревали до 0 С, перемешивали при этой температуре 10 мин и охлаждали снова до -78 С. По каплям добавляли ди-трет-бутилдикарбонат (2,30 мг, 10,6 ммоль) в 5 млTHF. Реакционную смесь перемешивали при температуре -78 С в течение 0,5 ч и затем в течение 20 мин при 0 С и нагревали в течение 10 мин до rt. Через 2 дня LC-MS показала, что получена смесь 1:1 продукт:SM. Реакционную смесь экстрагировали EtOAc, органические слои промывали рассолом, сушили над MgSO4, фильтровали и концентрировали. Полученный продукт очищали методом колоночной хроматографии с применением силикагеля, элюируя смесью 80:20 Hex:EtOAc. трет-Бутил-4-хлорпиколиноил(метил)карбамат собирали в виде светло-желтого твердого продукта. MS m/z=563 [димер+Na]+. Рассчитано для C12H15ClN2O3: 270,08. Стадия 2. Получение трет-бутил-4-(2-(4-аминофенокси)пиридин-3-ил)пиколиноил(метил)карбамата. В промытую аргоном герметизируемую трубку загружали трет-бутил-4-хлорпиколиноил(метил)карбамат (50 мг, 0,19 ммоль), 4-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)пиридин-2-илокси)бензоламин (173 мг, 0,554 ммоль), карбонат натрия (59 мг, 0,55 ммоль), ацетат палладия (4,0 мг, 0,018 ммоль) и три-трет-бутилфосфония тетрафторборат (11 мг, 0,037 ммоль) с последующим добавлением 1,4-диоксана (0,543 мл, 0,185 ммоль) и воды (0,196 мл, 0,185 ммоль). Смесь перемешивали при rt в течение 5 мин, затем трубку герметизировали и помещали в предварительно нагретую масляную баню при 100 С. Через 2,5 ч полученный продукт экстрагировали EtOAc, промывали рассолом, сушили над MgSO4 и концентрировали. Сырой продукт очищали методом хроматографии на силикагеле на колонке ISCO, элюируя смесью 80:20 DCM:(90:10:1 DCM:МеОН:NH4OH). Получали масло коричневого цвета, которое в основном содержало целевой продукт, трет-бутил-4-(2-(4 аминофенокси)пиридин-3-ил)пиколиноил(метил)карбамат. MS m/z=421 [М+1]+. Рассчитано для Синтез 4-(2-(4-аминофенокси)пиридин-3-ил)пиколинонитрила. В промытую аргоном герметизируемую трубку добавляли 4-бромпиколинонитрил (500 мг, 2,73 ммоль), 4-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-илокси)бензоламин (2,56 г, 8,20 ммоль), карбонат натрия (869 мг, 8,20 мкмоль) и три-трет-бутилфосфония тетрафторборат (159 мг, 546 мкмоль) с последующим добавлением 1,4-диоксана (8,04 мл, 2,73 ммоль) и воды (2,90 мл, 2,73 ммоль). Реакционную смесь перемешивали при rt в течение 5 мин. Трубку герметизировали и помещали в предварительно нагретую масляную баню при 100 С. Через 2 ч LC-MS показала наличие целевого продукта при времени удерживания 1,321 мин. Этот продукт экстрагировали EtOAc, промывали рассолом, сушили над MgSO4 и концентрировали. Полученное целевое соединение очищали хроматографией на силикагеле с применением колонки ISCO, элюируя смесью 80:20 DCM:(90:1:1 DCM:МеОН:NH4OH) и получали почти белый продукт. MS m/z=289 [М+1]+. Рассчитано для C17H12N4O: 288,10.
МПК / Метки
МПК: C07D 487/04, C07D 403/12, C07D 471/04, C07D 413/14, C07D 497/04, A61P 35/00, C07D 417/14, C07D 409/14, C07D 401/14, A61K 31/502, C07D 401/12
Метки: способы, модуляторы, получения, aurora, киназы, применение
Код ссылки
<a href="https://eas.patents.su/30-18128-modulyatory-aurora-kinazy-sposoby-ih-polucheniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы аурора киназы, способы их получения и их применение</a>












