Новые ингибиторы фарнезилтрансферазы, способы их получения, содержащие их фармацевтические композиции и их применение для получения медикаментов.
Номер патента: 2114
Опубликовано: 24.12.2001
Авторы: Мартэн Жан-Поль, Коммерсон Алан, Дере Норбер, Шев Мишель, Бурза Жан-Доминик, Суниго-Томсон Фабьенн, Майлие Патрик, Капе Марк
Формула / Реферат
1. Соединения формулы I
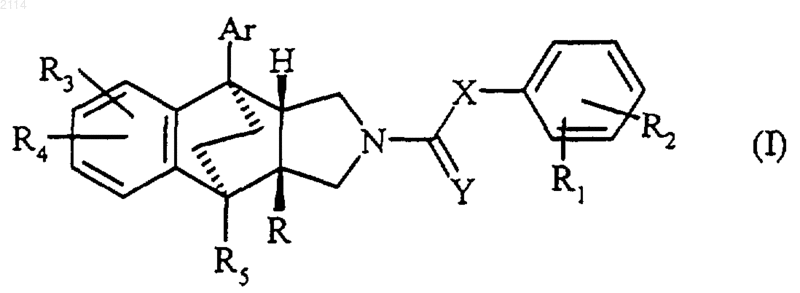
в которой Аr обозначает
фенил, замещенный одним или несколькими атомами галогена, радикалом алкил С1-С4, С1-С4 алкокси, которые могут в свою очередь быть замещены атомами галогена или радикалом гидрокси; радикалом 3-N,N-диметиламино или 4-N,N-диметиламино; радикалом 4-метилсульфанил или радикалом циано;
2,3-дигидро-1,4-бензодиоксин-6-ил;
дигидробензофуран;
дигидробензопиран;
нафтил или тетрагидронафтил;
инданил; тиенил или метилтиенил;
1,3-бензодиоксол-5-ил;
R обозначает карбокси, алкилкарбокси, алкилкарбоксиокси, алкил, амидино, замещенный группой пиридил или фенилсульфонил; бензоиламидино;
R1 обозначает атом водорода, атом галогена, радикал алкил, радикал алкокси, каждый из которых может быть замещен диалкиламино-радикалом, каждая из алкильных частей которого содержит 1-4 атома углерода или образует с атомом азота насыщенный 5- или 6-членный гетероцикл, радикалы алкилтио, алкоксикарбонил, или же находясь в орто-положении друг к другу, R1 и R2 образуют насыщенный или ненасыщенный гетероцикл с 1 или 2 гетероатомами, выбранными из атомов азота или кислорода, который может быть замещен атомом галогена или радикалом алкил или алкокси, причем во всех радикалах, содержащих алкильную группу, предлагаемых для определения R1 и R2, алкил содержит 1-4 атома углерода;
R3 обозначает атом водорода, галогена или радикал алкил, гидрокси, алкокси, алкилкарбонилокси, меркапто, алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, алкоксикарбониламино, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил, формил, алкилкарбонил, циано или трифторметил, причем во всех радикалах, содержащих алкильную группу, предлагаемых для определения R3 и R4, алкил содержит 1-4 атома углерода;
R5 обозначает атом водорода, радикал алкил или алкилтио, причем в определении для R5 алкил содержит 1-4 атома углерода;
R2 и R4 обозначают метоксигруппу,
Х обозначает метилен или винилдиил,
Y обозначает атом кислорода,
в рацемической форме или в форме их оптических изомеров, а также соли соединений общей формулы I.
2. Соединения по п.1, в которых, когда Аr является замещенным фенильным радикалом, радикал алкил является метилом.
3. Соединения по п.1, в которых, когда Аr является замещенным фенилом, радикал алкокси является метокси-радикалом.
4. Соединения по п.1, в которых, когда Аr является замещенным фенилом, радикал алкокси, алкильная часть которого пергалогенирована, является трифторметокси-радикалом.
5. Соединения по п.1, в которых R является радикалом метилкарбокси.
6. Соединения по п.1, в которых R является рaдикалом амидино, замещенным фенилсульфонильной группой.
7. Соединения по п.1, в которых R является радикалом бензоиламидино.
8. Соединения по п.1, в которых R является радикалом амидино, замещенным пиридильной группой.
9. Соединения по п.1, в котoрых Х является радикалом винилдиил.
10. Соединения по п.1, в которых Аr обозначает радикалы 2,3-дигидро-1,4-бензодиоксин-6-ил, 2,3-дигидробензофуран-5-ил, 2,3-дигидробензопиран-6-ил, 1- или 2-нафтил, 5-инданил или 1,2,3,4-тетрагидронафт-6-ил или радикал фенил, замещенный в положении 4 радикалом метил, трифторметил или метокси.
11. Соединения по любому из пп.1-10, в которых R обозначает радикал карбокси или метилкарбокси.
12. Соединения по любому из пп.1-11, в которых Аr обозначает радикал 2,3-дигидро-1,4-бензодиоксин-6-ил или 2,3-дигидробензофуран-5-ил или фенил, замещенный в положении 4 радикалом метил, трифторметил или метокси.
13. Соединения по любому из пп.1-12, в которых R1 обозначает атом водорода.
14. Соединения по любому из пп.1-13, в которых R3 обозначает атом водорода.
15. Соединения по любому из пп.1-14, в которых R5 является атомом водорода или метильным радикалом.
16. Соединение по п.1, отличающееся тем, что оно выбрано из следующих соединений:
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
4,9-этано-2-[(2-метоксифенил)ацетил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-метоксифенил)-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
4,9-этано-2-[(2-метоксифенил)ацетил]-9-(4-метилсульфанилфенил)-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-фторфенил)-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9a-гексагидpo-1H-бензо[f]изоиндол-3a-кapбoновaя кислота (3aRS, 4SR, 9SR,9aRS);
4,9-этано-2-[(2-метоксифенил)ацетил]-9-(3-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(3-метоксифенил)-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
метиловый эфир 9-(3,4-диметилфенил)-4,9-этано-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(3,4-диметилфенил)-4,9-этано-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
3а-N-бензилкарбамоил-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол (3aRS,4SR, 9SR,9aRS);
3а-карбамоил-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл (3aRS,4SR, 9SR,9aRS);
бензиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-гидроксамовой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-гидроксамовая кислота (3aRS,4SR, 9SR,9aRS);
N-(3-пиридилметил)амид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N-(4-пиридилметил)амид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-гидроксамовой кислоты (3aRS,4SR, 9SR,9aRS);
N',N'-диметилгидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9a-гексагидpo-1H-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N'-фенилгидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N',N'-пентаметиленгидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензo[f]изoиндoл-3a-кapбoнoвoй кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-3а-фенилсульфониламинокарбонил-2,3,3а,4,9,9а-гексагидро-1Н-бензo[f]изoиндoл (3aRS,4SR, 9SR,9aRS);
N-(N-оксо-3-пиридил)метиламид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N'-(4-метоксифенил)гидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR, 9aRS);
N'-метил-N'-фенилгидразиф 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N'-(2-метилфенил)гидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
N-(3-пиридилметил)амид 9-[2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл-3a-кapбoнoвoй кислоты (3aRS,4SR, 9SR,9aRS);
N-(2-тиенилметил)амид 9-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS, 4SR, 9SR,9aRS);
4,9-этано-2-[(2-метоксифенил)ацетил]-9-(3,4,5-триметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(2-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
N-(4-пиридилметил)амид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N'-бензоилгидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR, 9aRS);
N'-фенилгидразид 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(2-нафтил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(2-нафтил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(5-метил-2-тиенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(5-метил-2-тиенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(4-бромфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-бромфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
9-(3,4-дихлорфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-хлорфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-хлорфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метокси-3-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(3-индолил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-изопропилфенил)-2-[(2-метоксифенил)ацетил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-изопропилфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(3-тиенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-9-(4-этилфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-этилфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS, 4SR, 9SR,9aRS);
метиловый эфир 9-(2,3-дигидробензофуран-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(2,3-дигидробензофуран-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
N-(3-пиридилметил)амид 9-(2,3-дигидробензофуран-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1H-бензо[f]изoиндoл-3a-кapбoнoвoй кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-9-(4-фторфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(4-фторфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(4-хлор-3-фторфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-хлор-3-фторфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(3-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(3-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(1,3-бензодиоксол-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(3,4-диметилфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(3,4-диметилфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(4-метоксифенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-метоксифенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
амид 9-(4-метоксифенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N'-фенилгидразид 9-(4-метоксифенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-метоксифенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-гидроксамовая кислота (3aRS,4SR, 9SR,9aRS);
N'-(3-пиридил)гидразид 4,9-этано-9-(4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
N-(3-тиенилметил)амид 4,9-этано-9-(4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
2-{4,9-этано-9-(4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбониламино-(3aRS,4SR, 9SR,9aRS)}фенилуксусные кислоты (RS) и (SR);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметоксифенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(3-бромфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(3-бромфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-9-(3-фторфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(3-фторфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
N-(3-пиридилметил)амид 4,9-этано-9-(3-фторфенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(3-хлорфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(3-хлорфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-кapбoнoвaя кислота (3aRS,4SR, 9SR,9aRS);
N-(3-пиридилметил)амид 9-(3-хлорфенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(3-N,N-диметиламинофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(3-N,N-диметиламинофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
гидрохлорид 9-(3-аминофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(4-N,N-диметиламинофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
9-(4-цианофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 9-(3-цианофенил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-9-(3-гидрокси-4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS);
метиловый эфир 4,9-этано-5-метокси-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS);
4,9-этано-5-метокси-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9a-гексагидpo-1H-бензо[f]изоиндол-3a-кapбoновая кислота (3aRS,4SR, 9SR,9aRS);
4,9-этано-2-[2-(2-метоксифенил)пропеноил]-4-метил-9-(4-метоксифенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновая кислота (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме их оптических изомеров, а также в виде их солей.
17. Соединение по п.1, отличающееся тем, что оно является 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-кapбoнoвoй кислотой (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме ее оптических изомеров, а также ее солями.
18. Соединение по п.1, отличающееся тем, что оно является N-(3-пиридилметил)амидом 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме его оптических изомеров, а также его солями.
19. Соединение по п.1, отличающееся тем, что оно является N-(3-пиридилметил)амидом 9-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1H-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме его оптических изомеров, а также его солями.
20. Соединение по п.1, отличающееся тем, что оно является 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-трифторметилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислотой (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме ее оптических изомеров, а также ее солями.
21. Соединение по п.1, отличающееся тем, что оно является N-(3-пиридилметил)амидом 9-(2,3-дигидробензофуран-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1H-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме его оптических изомеров, а также его солями.
22. Соединение по п.1, отличающееся тем, что оно является 4,9-этано-9-(4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислотой (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме ее оптических изомеров, а также ее солями.
23. Соединение по п.1, отличающееся тем, что оно является 4,9-этано-5-метокси-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислотой (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме ее оптических изомеров, а также ее солями.
24. Соединение по п.1, отличающееся тем, что оно является 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-4-метил-9-(4-метоксифенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислотой (3aRS,4SR, 9SR,9aRS) в рацемической форме или в форме ее оптических изомеров, а также ее солями.
25. Соединения по любому из пп.1-24, отличающиеся тем, что они находятся в виде правовращающих изомеров.
26. Соединение по п.1, отличающееся тем, что оно является правовращающим энантиомером 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS).
27. Соединение по п.1, отличающееся тем, что оно является правовращающим энантиомером N-(3-пиридилметил)амида 9-(2,3-дигидро-1,4-бензодиоксин-6-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3а,4,9,9а-гексагидро-1Н-бензо[f]изоиндол-3а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS).
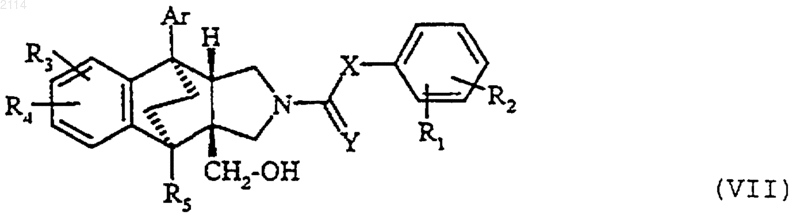
28. Способ получения соединений общей формулы I по одному из пп.1-27, в которой Y обозначает атом кислорода или серы, а Х обозначает группу -СО-, метилен, алкен-1,1-диил, например винилдиил, или циклоалкан-1,1-диил, содержащий 3-6 атомов углерода, отличающийся тем, что кислоту общей формулы

в которой R1 и R2 определены в п.1, Х определен выше и Y обозначает атом кислорода или серы, ее метиловый сложный эфир или производные этой кислоты, такие как галогенангидрид или ангидрид, вводят во взаимодействие с соединением общей формулы
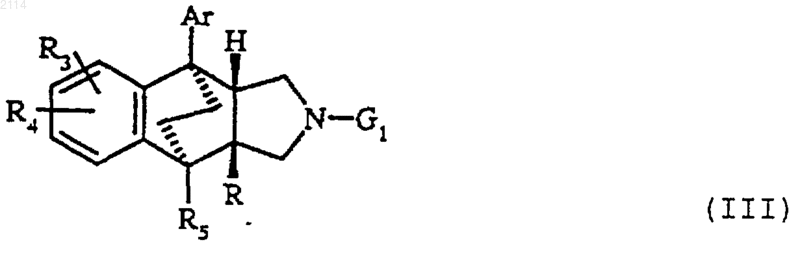
в которой Ar, R, R3, R4 и R5 определены в п.1, a G1 обозначает атом водорода.
29. Способ получения соединений общей формулы I по одному из пп.1-27, в которой Y обозначает атом кислорода или серы, а Х обозначает атом кислорода, отличающийся тем, что галогенформиат или галогентиоформиат общей формулы IV
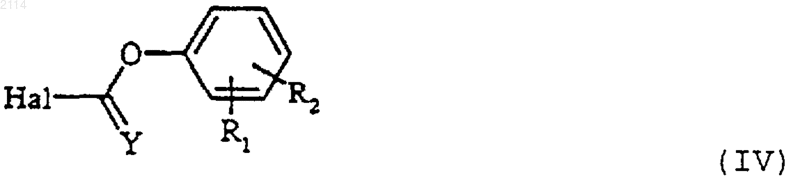
в которой Y обозначает атом кислорода или серы, R1 и R2 определены в п.1 и Hal обозначает атом галогена, вводят во взаимодействие с соединением общей формулы III по п.28.
30. Способ получения соединений общей формулы I по одному из пп.1-27, в которой Y обозначает атом кислорода или серы, а Х обозначает группу NH, отличающийся тем, что изоцианат или изотиоцианат общей формулы V

в которой Y обозначает атом кислорода или серы, a R1 и R2 определены в п.1, вводят во взаимодействие с соединением общей формулы III, определенной в п.28.
31. Способ получения соединений общей формулы I по одному из пп.1-27, в которой R обозначает радикал общей формулы
-(CH2)m-X1(CH2)n-Z,
в которой
X1, m и n определены выше и
Z обозначает радикал CON(R7)(R8), в котором
R7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода и
R8 обозначает
атом водорода,
гидрокси-радикал,
радикал арилсульфонил, например фенилсульфонил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из атомов галогена, алкильных или алкокси-радикалов, в которых алкил содержит 1-4 атома углерода,
5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из атомов азота, кислорода или серы, и который может быть присоединен через гетероатом,
аминогруппа, которая может быть замещена одним или двумя одинаковыми или различными радикалами, выбранными из группы радикалов:
алкил с 1-4 атомами углерода,
арил, например фенил, который может быть замещен одним или несколькими одинаковыми или различными радикалами, выбранными из радикалов алкил и алкокси, в которых алкил содержит 1-4 атома углерода,
5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода или серы,
арилкарбонил, например бензоил, который может быть замещен одним или несколькими одинаковыми или различными радикалами, выбранными из алкила и алкокси, в которых алкил содержит 1-4 атома углерода,
прямой или разветвленный алкокси-радикал с 1-6 атомами углерода, который может быть замещен фенилом,
прямой или разветвленный алкил с 1-6 атомами углерода, например метил, который может быть замещен радикалом амино, алкиламино, диалкиламино, гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкоксикарбонил, карбокси, циано, 5-12-членным моно- или полициклическим ароматическим радикалом, который может содержать один или несколько гетероатомов, выбранных из кислорода, азота или серы, и который может быть замещен или может быть также фенилом, возможно замещенным одним или несколькими атомами галогена или одной или несколькими группами: гидрокси, амино или трифторметильной, или одним или несколькими радикалами из группы: алкил, алкенил, алкокси, алкилтио, алкиламино, алкилкарбонил или алкоксикарбонил с 2-4 атомами углерода, карбамоил, алкилкарбамоил или диалкилкарбамоил с 1-8 атомами углерода в алкильной части, формил, а также 1- или 2-нафтил, отличающийся тем, что соединение общей формулы
HN(R7)(R8),
в которой R7 и R8 определены выше, вводят во взаимодействие с соединением общей формулы I, в которой Z обозначает карбокси-радикал.
32. Способ получения соединений общей формулы I по любому из пп.1-27, в которой R обозначает радикал NH-CO-T, в котором Т обозначает атом водорода или алкил с 1-6 атомами углерода, который может быть замещен радикалом амино, карбокси, алкоксикарбонил, гидрокси, алкокси, меркапто или алкилтио, отличающийся тем, что соединения общей формулы Т-СО-ОН, в которой Т определено выше, вводят во взаимодействие с соединениями общей формулы VI
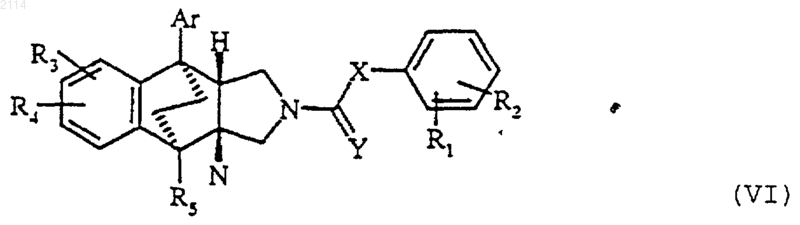
в которой Аr, R1, R2, R3, R4, R5, X и Y определены в п.1.
33. Способ получения соединений общей формулы I по любому из пп.1-27, в которой R обозначает радикал
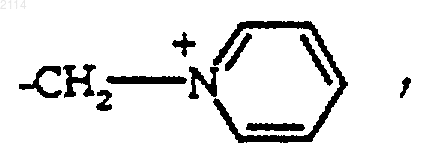
отличающийся тем, что избытком пиридина и сильной кислотой или ее производным действуют на соединение общей формулы
в которой Аr, R1, R2, R3, R4, R5, Х и Y определены в п.1.
34. Способ получения соединений общей формулы III
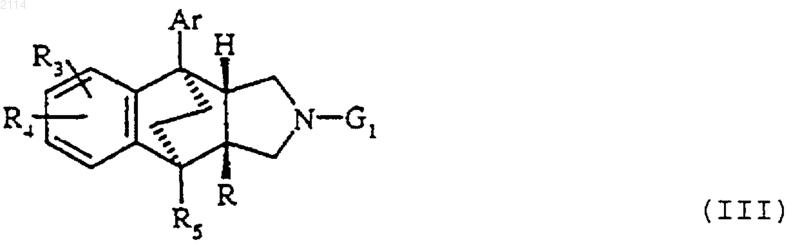
в которой R3, R4, R5, Ar и R определены в п.1, a G1 обозначает радикал бензил, из соединений общей формулы IX
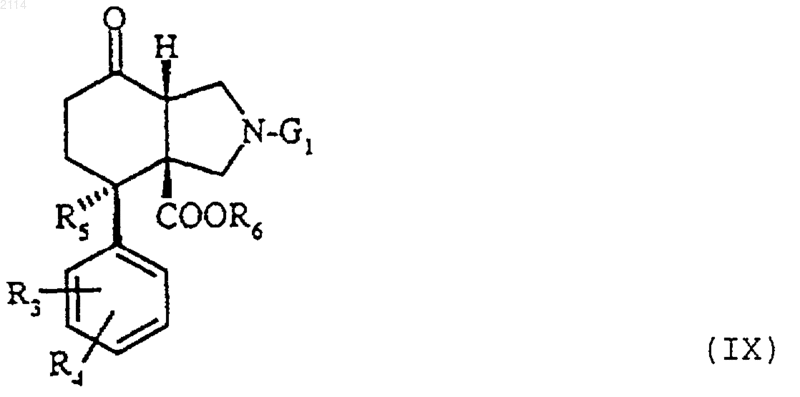
в которой R3, R4, R5, R6 и G1 определены выше, отличающийся тем, что синтез осуществляется через образование промежуточного соединения общей формулы XV
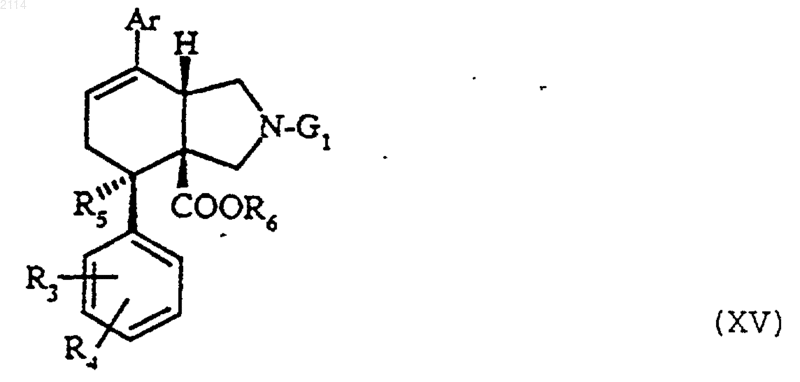
в которой R3, R4, R5, R6, Ar и G1 определены выше, которое подвергают внутримолекулярной циклизации типа Фриделя-Крафтса с получением соединения формулы III, описанной в п.28.
35. Соединения общей формулы XV
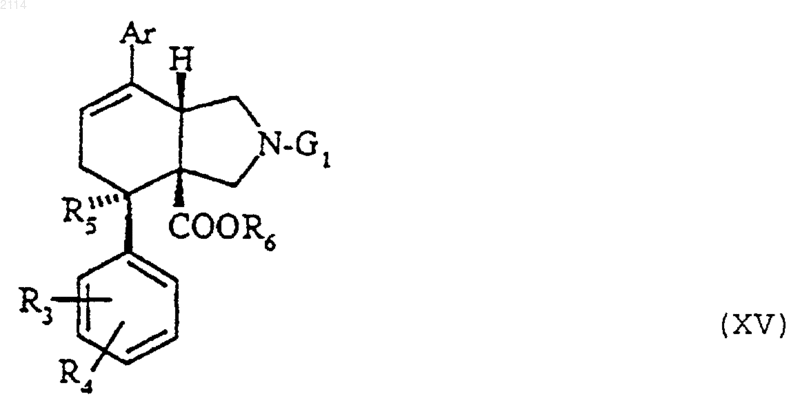
в которой R3, R4, R5 и Ar определены в п.1, G1 обозначает радикал бензил и R6 обозначает алкил с 1-3 атомами углерода, в рацемической форме, а также в форме их оптических изомеров.
36. Способ получения соединений общей формулы XV по п.40, отличающийся тем, что соединения общей формулы IX
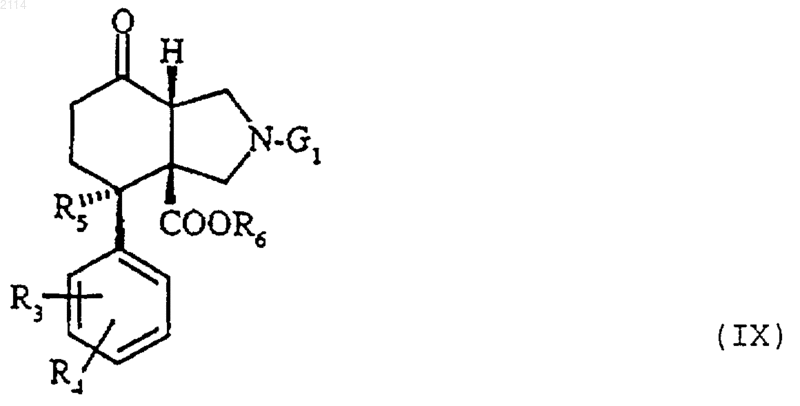
в которой R3, R4, R5 и Аr определены в п.1, G1 обозначает радикал бензил и R6 обозначает алкил с 1-3 атомами углерода, подвергают превращению по положению 7 либо в иодэтиленовое производное по реакции Бартона, либо в трифторметансульфонат енольной формы с последующей реакцией сочетания в присутствии палладия по так называемой реакции Сузуки с арилбороновой кислотой или по так называемой реакции Штилле с арилоловом.
37. Способ получения соединений общей формулы III по п.28, где Аr преимущественно обозначает
фенильный остаток, замещенный в положениях пара или мета-пара или мета-пара-мета электронодонорными группами, или
гетероциклический радикал, обогащенный электронами, или гетероциклический радикал, соответствующим образом замещенный электронодонорными группами,
отличающийся тем, что, используя реакции межмолекулярной и внутримолекулярной циклизации типа Фриделя-Крафтса, действуют ароматическим или гетероциклическим углеводородом Аr-Н на соединение общей формулы IX, в которой R3, R4, R5 и Аr определены в п.1, G1 обозначает бензил и R6 обозначает алкил с 1-3 атомами углерода, в органическом растворителе в присутствии избытка сильной кислоты или кислоты Льюиса.
38. Способ получения соединений общей формулы III
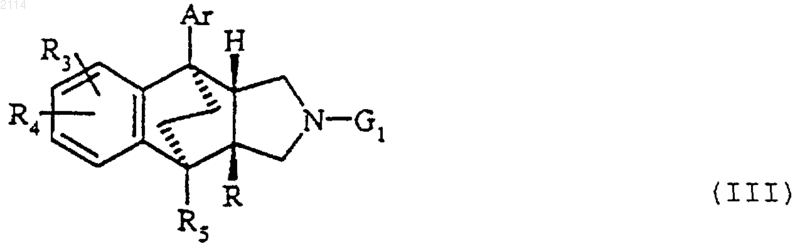
в которой R3, R4, R5 и Аr определены в п.1, G1 обозначает бензил и R обозначает карбоксигруппу или радикал общей формулы COOR6, где R6 обозначает алкил с 1-3 атомами углерода, отличающийся тем, что осуществляют внутримолекулярную циклизацию типа Фриделя-Крафтса, действуя трифторметансульфокислотой на соединения общей формулы VIII
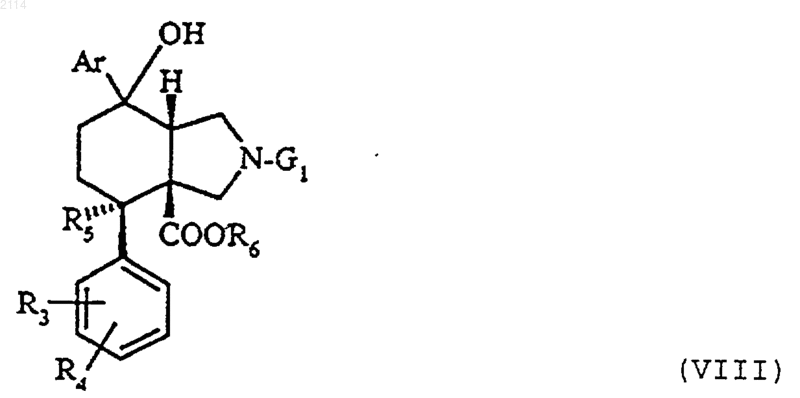
в которой Аr, R3, R4 и R5 определены в п.1, G1 обозначает бензил и R6 алкил с 1-3 атомами углерода,
с последующим замещением группы G1 атомом водорода либо гидрогенолизом с последующей, в случае необходимости, заменой атома водорода трет-бутоксикарбонильным радикалом, действуя трет-бутоксикарбонилангидридом в органическом растворителе или бензилоксикарбонильным радикалом яЁш действии бензилоксикарбонилхлорида, либо обработкой алкилхлорформиатом с последующим кислотным гидролизом промежуточно образовавшегося карбамата и, при необходимости, омылением полученного продукта.
39. Способ получения соединений общей формулы VIII, в которой Аr, R3, R4, R5, R6 и G1 определены в п.1, отличающийся тем, что на соединения общей формулы IX
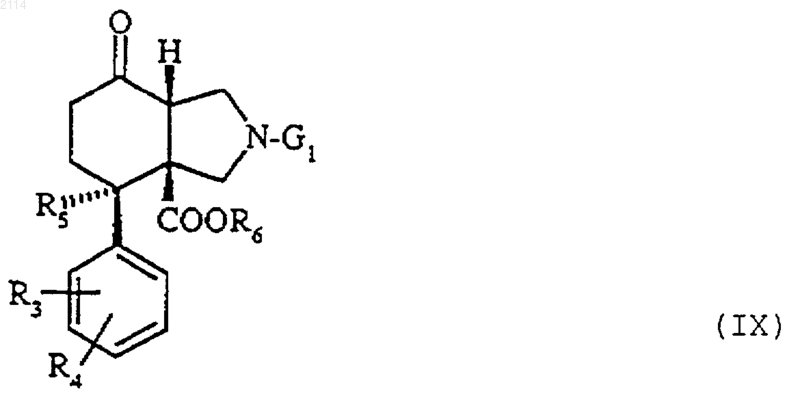
в которой R3, R4, R5, R6 и G1 определены в п.37, действуют либо магнийорганическими производными общей формулы Аr-МgХ, в которой Аr имеет определенное выше значение, а Х является атомом галогена, в присутствии безводного хлорида цезия III в органическом растворителе при температуре от 0шС до температуры дефлегмации реакционной смеси, либо литийорганическими соединениями общей формулы Ar-Li, в которой Аr определен в п.1, в органическом растворителе при температуре в пределах от -78 до -20шС.
40. Способ получения соединений общей формулы IX, определенной в п.36 или 39, в которых R3, R4, R5 и Аr определены в п.1, G1 обозначает бензил и R6 алкил с 1-3 атомами углерода, отличающийся тем, что подвергают взаимодействию N-триалкилсилилметил-N-алкокси-
метиламином, содержащим защитные группы аминофункций с производным циклогексенона общей формулы
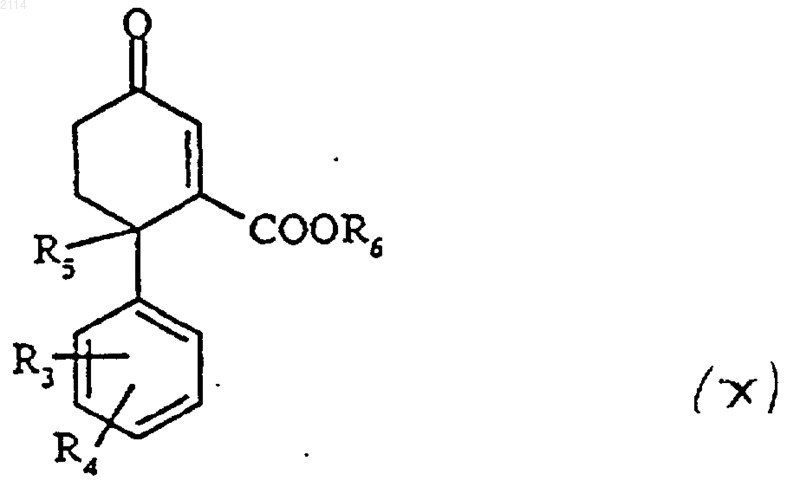
в которой R3, R4 и R5 определены в п.1, a R6 обозначает алкил с 1-3 атомами углерода.
41. Фармацевтическая композиция, отличающаяся тем, что она содержит, по меньшей мере, одно соединение по любому из предшествующих пп.1-27 в сочетании с одним или несколькими фармацевтически приемлемыми инертными или биологически активными разбавителями или наполнителями.
42. Применение соединений по любому из предшествующих пп.1-27 в качестве ингибитора для приготовления фармацевтических композиций, пригодных для ингибирования фарнезилтрансферазы.
43. Применение соединений по любому из предшествующих пп.1-27 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения болезней, связанных со злокачественными или доброкачественными клеточными пролиферациями, в которых участвуют клетки различных тканей и/или органов, включая мышечные, костные и соединительные ткани, кожу, мозг, легкие, половые органы, лимфатическую и почечную системы, клетки молочных желез и крови, печень, пищеварительный аппарат, ободочную кишку, поджелудочную, щитовидную и надпочечную железы, и включая следующие патологии: псориаз, рестеноз, солидные опухоли, саркомы Капоши, карциномы, холангиокарциному, хориокарциному, нейробластому, опухоль Уилмса, болезнь Ходжкина, меланомы, тератокарциномы, глиомы, множественные миеломы, хронические лимфоцитарные лейкемии, острые и хронические гранулоцитарные лимфомы, раки поджелудочной железы, ободочной кишки, легкого, яичника, молочной железы, мозга, простаты, печени, желудка, мочевого пузыря и яичек.
44. Применение соединений общей формулы I по любому из предшествующих пп.1-27 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения болезней, связанных с клеточными пролиферациями путем ингибирования фарнезилтрансферазы.
45. Применение соединений общей формулы I по любому из предшествующих пп.1-27 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения раковых заболеваний.
46. Применение соединения по п.26 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения раковых заболеваний.
47. Применение соединений общей формулы I по любому из предшествующих пунктов 1-27 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения рака ободочной кишки.
48. Применение соединений общей формулы I по любому из пп.1-27 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения рака поджелудочной железы.
49. Применение соединения по п.26 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения рака ободочной кишки.
50. Применение соединения по п.26 в качестве ингибитора фарнезилтрансферазы для приготовления фармацевтических композиций для лечения рака поджелудочной железы.
51. Синергитическая комбинация соединений по любому из пп.1-27 с одним или несколькими совместимыми и фармакологически приемлемыми соединениями и/или с радиотерапевтическим лечением.
Текст
1 Настоящее изобретение относится к производным бензопергидроизоиндола, к способу их получения, к фармацевтическим композициям на их основе, а также к применению указанных соединений для получения медикаментов. Белок фарнезилтрансфераза является ферментом, который катализирует перенос фарнезильной группы пирофосфата фарнезила (ПФФ) на концевой остаток цистеина тетрапептидной последовательности СААХ у ряда белков, в частности, белка p21Ras, экопрессирующего онкоген ras. Известно, что онкоген ras (H-, N- или Kras) играет ключевую роль в способах клеточной сигнализации и процессах клеточного деления. Мутация онкогена ras или его суперэкспрессия у человека часто ассоциируются с раком: мутированный белок p21Ras обнаруживается при многих типах рака человека и, в частности, при более чем 90% раков ободочной кишки и при более чем 90% раков поджелудочной железы (Kohl et al. Science, 260, 1834-1837,1993). Ингибирование фарнезилтрансферазы и,соответственно,фарнезилирование белкаp21Ras блокирует способность мутированного белка инициировать клеточную пролиферацию и превращать нормальные клетки в раковые. С другой стороны, было доказано, что ингибиторы фарнезилтрансферазы проявляют также активность в отношении опухолевых клеточных линий, не экспрессирующих мутированный или суперэкспрессирующийся ras, но в которых происходит мутация какого-либо онкогена или суперэкспрессия какого-либо онкопротеина,механизм сигнализации которого включает фарнезилирование какого-либо белка, как, например, нормальный ras (Nagasu et al., Canceral., Cancer Research 55, 5302-5309, 1995). Ингибиторы фарнезилтрансферазы являются ингибиторами клеточной пролиферации и,вследствие этого, противоопухолевыми и противолейкемийными агентами. В настоящем изобретении обнаружено, и это является предметом настоящего изобретения, что новые соединения приведенной ниже общей формулы I удивительным и неожиданным образом проявляют ингибирующую активность по отношению к фарнезилтрансферазе и оказались замечательными противоопухолевыми и противолейкемийными агентами. В частности, установлено, что биологическая активность соединений настоящего изобретения очень заметно улучшается, и это оказалось полной неожиданностью в случае присутствия в положении 9 бензопергидроизоиндола определенных замещенных групп (ниже обозначены Ar). Конкретно, соответствующие соединения проявляют активность, которая значительно превосходит таковую, обнаруживаемую у со 002114 2 единений, имеющих близкую структуру, но не содержащих заместителя Ar. Настоящее изобретение относится к новым соединениям общей формулы I в которой Ar обозначает радикал фенил, замещенный одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы, включающей атомы галогена и радикалы с 1-4 атомами углерода, такой как метил, алкенил с 2-4 атомами углерода, гидрокси, меркапто,алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино,формил, алкилкарбонил, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил, циано или трифторметил, алкокси с 1-4 атомами углерода, например, метокси,алкильная часть которых может быть пергалогенирована, например, трифторметокси, или радикал фенил, конденсированный с 4-7 членным гетероциклом, содержащим один или несколько гетероатомов, выбранных из атомов кислорода, азота и серы, а образованная таким образом бициклическая система может быть,более конкретно, выбрана из радикалов 2,3 дигидро-1,4-бензодиоксин-6-ил или 2,3-дигидробензофуран-5-ил или 2,3-дигидробензопиран 6-ил, или полициклический ароматический или неароматический радикал, такой как 1- или 2 нафтил, или 5-инданил, или 1,2,3,4-тетрагидронафт-6-ил, или 5-12-членный гетероциклический ароматический или неароматический радикал, содержащий один или несколько гетероатомов, выбранных из кислорода, азота или серы, связанный с конденсированным циклом через углеродуглеродную связь, который может быть, при необходимости, замещен одним или несколькими, одинаковыми или различными атомами или радикалами, выбранными из группы, включающей атомы галогена и алкильные радикалы, алкенильные радикалы с 2-4 атомами углерода,гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, формил, алкилкарбонил, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил, циано или трифторметил,предпочтительно Аr означает радикал 2,3 дигидро-1,4-бензодиоксин-6-ил,или 2,3 дигидробензофуран-5-ил, или радикал, замещенный в положении 4 (предпочтительно метилом, трифторметилом или метоксигруппой); в частности, радикал 2,3-дигидро-1,4-бензодиоксин-6-ил; особенно предпочтительно, когда Аr 3 означает фенильный радикал, замещенный в положении 4 метилом,причем в приведенных выше радикалах алкил содержит 1-4 атома углерода;R представляет собой радикал общей формулыX1 обозначает простую связь или атом кислорода или серы,m обозначает целое число 0 или 1,n обозначает целое число 0, 1 или 2,один или несколько метиленовых радикалов могут быть замещены радикалом карбокси,алкоксикарбонилом карбамоилом, алкилкарбомоилом, диалкилкарбамоилом, амино, алкиламино-, диалкиламиногруппой, причем во всех названных радикалах алкилы имеют 1-4 атомов углерода;Z обозначает карбоксирадикал,радикал-СООR6, в котором R6 обозначает прямой или разветвленный алкил с 1-3 атомами углерода, например метил, или радикал формулы СОN(R7)(R8), в которойR7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода иR8 обозначает атом водорода,гидроксирадикал,радикал арилсульфонил, например фенилсульфонил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы: атомы галогена, алкильные и алкокси радикалы, в которых алкил содержит 1-4 атома углерода,5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода или серы, и причем указанный гетероцикл может быть соединен через один гетероатом,аминогруппу, которая может быть замещена одним или двумя одинаковыми или различными радикалами, выбранными из группы радикалов: алкил с 1-4 атомами углерода, арил,например фенил, который может быть замещен одним или несколькими одинаковыми или различными радикалами, выбранными из группы радикалов алкил и алкокси, в которых алкил содержит 1-4 атома углерода, 5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода или серы, арилкарбонил, например бензоил, который может быть замещен одним или несколькими одинаковыми или различными радикалами, выбранными из группы: алкил и алкокси, в которых алкил содержит 1-4 атома углерода,прямой или разветвленный алкоксирадикал с 1-6 атомами углерода, который может быть замещен фенилом, 002114 4 прямой или разветвленный алкил с 1-6 атомами углерода, например метил, который может быть замещен одним радикалом из группы: амино, алкиламино, диалкиламино, гидрокси, алкокси с 1-4 атомами углерода, меркапто,алкилтио, алкоксикарбонил, карбокси, циано, 512-членный моно- или полициклический ароматический радикал, который может содержать один или несколько гетероатомов, выбранных из кислорода, азота или серы, возможно замещенный, причем таким ароматическим радикалом, в частности, могут быть 2-, 3- или 4 пиридил, предпочтительно 3- и 4-пиридил, или пиридин-N-оксид, или радикал фенил, который может быть замещен одним или несколькими атомами галогена или одной или несколькими группами: гидрокси, амино или трифторметильной, или одним или несколькими радикалами: алкил, алкенил, алкокси, алкилтио, алкиламино,алкилкарбонил или алкоксикарбонил с 2-4 атомами углерода, карбамоил, алкилкарбамоил или диакилкарбамоил с 1-8 атомами углерода в алкильной части, формил, а также 1- или 2- нафтил, илиR предпочтительно обозначает радикалы карбокси, -СООМе или -CON(R7)(R8), где R7 обозначает атом водорода, R8 обозначает метил,замещенный радикалом 3-пиридил, при этом предпочтительно, когда R является карбоксирадикалом; более предпочтительно, когда R имеет значение -CON(R7)(R8), где R7 является атомом водорода, a R8 метилом, замещенным радикалом 3-пиридил;Z обозначает радикал РО(ОR9)2, в котором R9 является атомом водорода или прямым или разветвленным алкилом с 1-6 атомами углерода, или радикал -NH-CO-T, в котором Т обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода, который может быть замещен радикалом амино, карбокси,алкоксикарбонил, гидрокси, алкокси, меркапто или алкилтио, или же радикал имеющий в качестве противоиона анион, такой как трифторметансульфонат,при этом во всех радикалах, содержащих алкильную группу, предлагаемых для определения Z, алкил содержит 1-4 атомов углерода;R1 и R2, одинаковые или различные, обозначают атом водорода, атом галогена, радикал алкил, радикал алкокси, например метокси, каждый из которых может быть замещен диалкиламино-радикалом, каждая из алкильных частей которого содержит 1-4 атомов углерода или образует с атомом азота насыщенный 5- или 6 членный гетероцикл, радикалы алкилтио, алкоксикарбонил, или же, находясь в орто-положении друг к другу, R1 и R2 образуют насыщенный или ненасыщенный гетероцикл с 1 или 2 гетероатомами, выбранными из азота и кислорода, кото 5 рый может быть замещен атомом галогена или радикалом алкил или алкокси,предпочтительно, один из символов R1 илиR3 и R4, одинаковые или различные, обозначают атом водорода, галоген или радикалы алкил, гидрокси, алкокси, алкилкарбонилокси,меркапто, алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, алкоксикарбониламино, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил, формил, алкилкарбонил,циано или трифторметил; причем предпочтительно, чтобы каждый из R3 и R4 был атомом водорода, или же чтобы один из символов R3 иR4 был атомом водорода, а другой метоксирадикалом, предпочтительно находящимся в положении 5 бензопергидроизоиндола; причем особенно предпочтительно, чтобы каждый из R3 и R4 был атомом водорода; причем во всех радикалах, содержащих алкильную группу, входящих в определение R3 и R4,алкил содержит 1-4 атомов углерода;R5 обозначает атом водорода, радикал алкил или алкилтио, причем в определении для R5 алкил содержит 1-4 атомов углерода,предпочтительно, чтобы R5 был атомом водорода или метильным радикалом и особенно предпочтительно, чтобы R5 был атомом водорода; Х обозначает атом кислорода или серы или группы -NH-, -СО-, метилен, алкен-1,1-диил,например винилдиил, или циклоалкан-1,1-диил,содержащий 3-6 атомов углерода,предпочтительными значениями Х являются метилен или винилдиил и особенно предпочтительна группа винилдиил; иY обозначает атом кислорода или серы,предпочтительно атом кислорода,в рацемической форме или в форме их оптических изомеров, а также к солям соединения общей формулы I. В приведенные выше и ниже определениях радикалы или их части, определяемые как "алкил с 1-8 атомами углерода", обозначают радикалы метил, этил, пропил, бутил, пентил, гексил, гептил, октил и соответствующие изоизомеры,радикалы или их части, определяемые как 6 термин "алкенилы с 2-4 атомами углерода" обозначают радикалы винил, аллил, пропен-2 ил, бутен-1- или -2- или -3-ил и соответствующие изо-изомеры,термин "алкокси с 1-4 атомами углерода" обозначает радикалы метокси, этокси, пропокси,бутокси и соответствующие изо-, втор- и третизомеры,термин "алкоксикарбонил с 2-4 атомами углерода" обозначает радикалы метоксикарбонил, этоксикарбонил, пропоксикарбонил и соответствующие изо-, втор- и трет-изомеры. Соединения настоящего изобретения преимущественно представляют собой соединения общей формулы I, в которой Аr обозначает радикал 2,3-дигидро-1,4 бензодиоксин-6-ил или 2,3-дигидробензофуран 5-ил или радикал фенил, замещенный в положении 4 преимущественно метильной, трифторметильной или метоксигруппой,R обозначает карбокси, радикал -СООМе или радикал -CON(R7)(R8), в котором R7 обозначает атом водорода, a R8 метильный радикал,замещенный 3-пиридилом,один из символов R1 или R2 обозначает атом водорода, а другой - радикал метокси, расположенный предпочтительно в положении орто фенильного цикла,или каждый из R3 и R4 обозначает атом водорода или же один из R3 и R4 обозначает атом водорода, а другой - радикал метокси, расположенный предпочтительно в положении 5 бензопергидроизоиндольного ядра,R5 обозначает атом водорода или метил,Х обозначает метиленовую или винилдииловую группу,Y обозначает атом кислорода,в рацемической форме или в форме их оптических изомеров, а также их солей. Согласно изобретению соединения общей формулы I преимущественно представлены в виде их правовращающих изомеров. Поскольку технический результат представленных здесь соединений, иными словами,их биологическая активность может быть обусловлена специфической природой заместителей Аr, определенных выше, соединения настоящего изобретения являются, в частности,соединениями общей формулы I, в которой R,R1, R2, R3, R4, R5, Х и Y имеют определенные выше значения и отличаются тем, что Аr обозначает радикал фенил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы атомы галогена, алкильные радикалы с 1-4 атомами углерода, например,метил, алкенилы с 2-4 атомами углерода, гидрокси, меркапто, алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, формил, алкилкарбонил, карбокси,алкоксикарбонил, карбамоил, алкилкарбамоил 7 или диалкилкарбамоил, циано или трифторметил, алкокси с 1-4 атомов углерода, например,метокси, алкильная часть которых может быть пергалогенирована, например, трифторметокси,или радикал фенил, конденсированный с 4-7 членным гетероциклом, содержащим один или несколько гетероатомов, выбранных из атомов кислорода, азота и серы, а образованная таким образом бициклическая система может быть,более конкретно, выбрана из радикалов 2,3 дигидро-1,4-бензодиоксин-6-ил,2,3-дигидробензофуран-6-ил или 2,3-дигидробензопиран-6 ил, или полициклический ароматический или неароматический радикал, такой как 1- или 2 нафтил,или 5-инданил,или 1,2,3,4 тетрагидронафт-6-ил, или гетероциклический ароматический или неароматический 5-12-членный радикал, включающий один или несколько гетероатомов, выбранных из кислорода, азота и серы, связанный с конденсированным циклом через углеродуглеродную связь, указанный радикал может быть, при желании, замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы,включающей атомы галогена и радикалы алкил,алкенил с 2-4 атомами углерода, гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, формил,алкилкарбонил, карбокси, алкоксикарбонил,карбамоил, алкилкарбамоил или диалкилкарбамоил, циано или трифторметил,причем Аr предпочтительно является 2,3 дигидро-1,4-бензодиоксин-6-илом или 2,3 дигидробензофуран-5-илом, или замещенным в положении 4 (предпочтительно метилом, трифторметилом или метоксигруппой) фенильным радикалом; в частности радикалом 2,3-дигидро 1,4-бензодиоксин-6-илом; и более предпочтительно, чтобы Аr был фенильным радикалом,замещенным в положении 4 метилом. Соединения общей формулы I, в которой Аr обозначает радикал фенил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы: атомы галогена, алкилы,алкенилы с 2-4 атомами углерода, гидрокси,алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкилсульфонил или алкилсульфинил,амино, алкиламино или диалкиламино, формил,алкилкарбонил, карбокси, алкоксикарбонил,карбамоил, алкилкарбамоил или диалкилкарбамоил, циано или трифторметил, или ароматический полициклический радикал,как например, 1-или 2-нафтил, или 5-индонил,или 5-12-членный ароматический гетероциклический радикал, содержащий один или не 002114 8 сколько гетероатомов, выбранных из кислорода,азота или серы, связанный с конденсированным циклом через углерод-углеродную связь, указанный радикал может быть замещен, при желании, одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы, включающей атомы галогена, алкильные радикалы и алкенильные радикалы с 2-4 атомами углерода, гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио,алкилсульфонил или алкилсульфинил, амино,алкиламино или диалкиламино, формил, алкилкарбонил, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил,циано или трифторметил,причем в приведенных выше радикалах радикал алкил содержит 1-4 атома углерода;R представляет собой радикал общей формулыX1 обозначает простую связь или атом кислорода или серы,m обозначает целое число 0 или 1,n обозначает целое число 0, 1 или 2,метиленовые радикалы могут быть замещены радикалом: карбокси, алкоксикарбонил,карбамоил, алкилкарбамоил, диалкилкарбамоил,амино, алкиламино или диалкиламино, причем,что в указанных радикалах алкил содержит 1-4 атомов углерода;Z обозначает карбокси-радикал,радикал COOR6, в котором R6 обозначает прямой или разветвленный алкил с 1-3 атомами углерода, или радикал формулы -CON(R7)(R8), в которойR7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода иR8 обозначает атом водорода,гидрокси-радикал,амино-, алкиламино- и диалкиламиногруппы, в которых алкил содержит 1-4 атомов углерода,прямой или разветвленный алкоксирадикал с 1-6 атомами углерода, который может быть замещен фенильным радикалом,прямой или разветвленный алкил с 1-6 атомами углерода и предпочтительно метилен,который может быть замещен радикалом амино,алкиламино, диалкиламино, гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкоксикарбонил, карбокси, циано; 5-12-членный моно- или полициклический ароматический радикал, который может содержать один или несколько гетероатомов, выбранных из кислорода, азота или серы, и которые могут быть замещены, причем ароматический радикал может быть фенильным радикалом, замещенным одним или несколькими атомами галогена или 9 группой гидрокси, амино или трифторметильной, или алкильным или алкенильным радикалом, группой: алкокси, алкилтио, алкиламино,алкилкарбонил, алкоксикарбонил с 2-4 атомами углерода, или карбамоил, алкилкарбамоил или диалкилкарбамоил с 1-8 атомами углерода,формил, а также 1- или 2-нафтил, илиZ обозначает радикал PO(OR9)2, в котором R9 является атомом водорода или прямым или разветвленным алкилом с 1-6 атомами углерода, или радикал -NH-CO-Т, в котором Т обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода, который может быть замещен радикалом амино, карбокси,алкоксикарбонил, гидрокси, алкокси, меркапто или алкилтио, или же радикал причем в указанных радикалах, содержащих алкильную группу, входящих в определение Z,алкил содержит 1-4 атомов углерода;R1 и R2, одинаковые или различные, обозначают атом водорода, атом галогена, радикал алкил, радикал алкокси, который может быть замещен диалкиламино-радикалом, каждая из алкильных частей которого содержит 1-4 атомов углерода или образует с атомом азота насыщенный 5- или 6-членный гетероцикл, радикалы алкилтио, алкоксикарбонил, или же, находясь в орто-положении друг к другу, R1 и R2 образуют насыщенный или ненасыщенный гетероцикл с 1 или 2 гетероатомами, выбранными из азота или кислорода, который может быть замещен атомом галогена или радикалом алкилом или алкокси,причем в указанных радикалах, содержащих алкильную группу, входящих в определение R1 и R2, алкил содержит 1-4 атомов углерода;R3 и R4, одинаковые или различные, обозначают атом галогена или радикал алкил, гидрокси, алкокси, алкилкарбонилокси, меркапто,алкилтио, алкилсульфонил или алкилсульфинил, амино, алкиламино или диалкиламино, алкилкарбонилоксиамино, карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил, формил, алкилкарбонил, циано или трифторметил,причем в указанных радикалах, содержащих алкильную группу, входящих в определение R3 и R4, алкил содержит 1-4 атомов углерода;R5 обозначает атом водорода; Х обозначает атом кислорода или серы или группу -NH-, -СО-, метилен, алкен-1,1-диил,например, винилдиил, или циклоалкан-1,1-диил,содержащий 3-6 атомов углерода, иY обозначает атом кислорода или серы,как в рацемической форме, так и в форме оптических изомеров общей формулы I, представляющих особенный интерес. 10 В качестве предпочтительных соединений настоящего изобретения можно назвать, в частности, те соединения общей формулы I, в которой R обозначает радикал формулы-(СН 2)m-Х 1-(CH2)n-CONH-CH2-Ar',где m, n и X1 имеют те же значения, что и выше,а Аr' обозначает преимущественно фенильный радикал, который может быть замещен одним или несколькими радикалами, выбранными из группы радикалов: алкокси с 1-4 атомов углерода, трифторметил, 1- или 2-нафтил, 2- или 3 фурил, 2- или 3-тиенил, 2- или 3-пирролил, 2 или 3-индолил, 2-, или 3-, или 4-хинолил, 1-,или 3-, или 4-изохинолил, 2- или 3-бензофурил,2- или 3-бензотиенил, 2-, или 4-, или 5 пиримидил, 2- или 3-пиразинил, 2- или 4 хиназолил, 1-фталазинил, 2-, или 3-, или 4 нафтиридинил, 2- или 4-имидазолил, 2- или 4 тиазолил, или 2-, или 3-, или 4-пиридил, инданил, хроманил или тиохроманил. В качестве не ограничивающей объема изобретения иллюстрации более конкретно могут быть названы следующие соединения: метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-(2-метоксифенил)пропеноил-9(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[(2-метоксифенил)ацетил]-9-(4 метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо(3aRS,4SR, 9SR,9aRS); 3 а-карбамоил-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол (3aRS,4SR,9SR,9aRS); бензиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-гидроксамовой кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9a-гeкcaгидpo-1H-бeнзo[f]изoиндoл-3a-гидpoкcaмoвaя кислота (3aRS,4SR, 9SR,9aRS); в рацемической форме, а также в форме их оптических изомеров. Можно также назвать любое соединение общей формулы I настоящего изобретения, выбранное индивидуально из следующего списка: метиловый эфир 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,2,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[( 2-метоксифенил)пропеноил]9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[(2-метоксифенил)ацетил]-9-(4 метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо 9-(3-N,N-диметиламинофенил)-4,9-этано 2-[2-(2-метоксифенил)пропеноил]-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); гидрохлорид метилового эфира 9-(3 аминофенил)-4,9-этано-2-[2-(2-метоксифенил) пропеноил]-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо(3aRS,4SR, 9SR,9aRS); метиловый эфир 9-(3-цианофенил)-4,9 этано-2-[2-(2-метоксифенил)пропеноил]2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-9-(3-гидрокси-4-метоксифенил)2-[2-(2-метоксифенил)пропеноил]-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); метиловый эфир 4,9-этано-5-метокси-2-[2(2-метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-5-метокси-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-4-метил-9-(4-метоксифенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); в рацемической форме или в форме их оптических изомеров, а также в виде их солей. В изложенном выше и последующем изложении выражение "оптический изомер" или оптически активная форма означают чистую форму оптического изомера или, в некоторых случаях, "обогащенную" смесь оптических изомеров, то есть смесь с преобладающим содержанием той или иной оптически изомерной формы. Более предпочтительные соединения общей формулы I настоящего изобретения могут быть индивидуально выбраны из следующего списка: 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновая кислотаN-(3-пиримидилметил)амид 9-(2,3-дигидробензофуран-5-ил)-4,9-этано-2-[2-(2-метоксифенил)пропеноил]-2,3,3 а,4,9,9 а-гексагидро-1Hбeнзo[f]изoиндoл-3a-кapбoнoвoй кислоты (3aRS,4SR, 9SR,9aRS); 4,9-этано-9-(4-метоксифенил)-2-[2-(2 метоксифенил)пропеноил]-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); 4,9-этано-5-метокси-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-4-метил-9-(4-метоксифенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновая кислота (3aRS,4SR, 9SR,9aRS); в рацемической форме или в форме их оптических изомеров, а также в виде их солей. В качестве оптических изомеров особенно предпочтительными соединениями общей формулы I настоящего изобретения являются соединения, индивидуально выбранные из следующего описка: правовращающий энантиомер 4,9-этано-2[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты[f]изoиндoл-3a-кapбoнoвoй кислоты (3aRS,4SR,9SR,9aRS); правовращающий энантиомер 4,9-этано-9(4-метоксифенил)-2-[2-(2-метоксифенил)пропеноил]-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); правовращающий энантиомер 4,9-этано-5 метокси-2-[2-(2-метоксифенол)пропеноил]-9-(4 метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); правовращающий энантиомер 4,9-этано-2[2-(2-метоксифенил)пропеноил]-4-метил-9-(4 метоксифенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS); или их соли. В особенности следует выделить правовращающий энантиомер 4,9-этано-2-[2-(2 метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) или его соли. Заявитель, кроме того, предлагает ниже, не ограничивая этим объема настоящего изобретения, методики синтезов, а также промежуточные продукты реакции, которые могут быть использованы для получения соединений общей формулы I. Само собой разумеется, используя эти методики и промежуточные продукты, специалисты могут разработать аналогичные методы с целью получения соединений. Согласно изобретению предложенные новые соединения общей формулы I, в которойY означает атом кислорода или серы и Х означает группу -СО-, метилен, алкен 1,1-диил, например, винилдиил или циклоалкан 1,1-диил, содержащий 3-6 атомов углерода, могут быть получены взаимодействием кислоты общей формулы (II) в которой R1 и R2 определены выше в отношении общей формулы I, X, как определено выше,иY обозначает атом кислорода или серы,ее метилового эфира или другого производного этой кислоты, например галогенангидрида или ангидрида, с соединением общей формулы III в которой Аr, R, R3, R4 и R5 определены ранее для формулы I иG1 обозначает атом водорода (которое может быть получено из соединения общей формулы III, в которой G1 обозначает защитную 20 группу для аминной функции, такую как радикал бензил,бензилоксикарбонил,третбутоксикарбонил или винилоксикарбонил, путем гидрогенолиза в присутствии катализатора,например палладия на угле, когда G1 - бензил или бензилоксикарбонил, или гидролиза в кислой среде, когда G1 - трет-бутоксикарбонил,винилоксикарбонил или бензилоксикарбонил). В приведенном ниже описании определение G1 как бензильного радикала приводится только в качестве иллюстрации, предоставляя специалисту возможность использовать различные методики с другими защитными группами для аминной функции, например радикалы бензилоксикарбонил, трет-бутоксикарбонил или винилоксикарбонил. Как правило, реакцию соединения общей формулы II в виде кислоты с соединением общей формулы III проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии конденсирующего агента, например гидрохлорида 1-этил-3-[3-(диметиламино) пропил]карбодиимида,1,1-дициклогексилкарбодиимида или гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония,и, при желании, в присутствии активирующего агента, такого как гидроксибензотриазол, при температуре от 0 С до температуры дефлегмации реакционной смеси. Как правило, реакцию соединения общей формулы II в форме метилового эфира с соединением общей формулы III проводят в органическом растворителе, таком как диоксан или галогенированный алифатический углеводород,например дихлорметан, при температуре от 0 С до температуры дефлегмации реакционной смеси. Как правило, реакцию соединения общей формулы II в галогенированной форме с соединением общей формулы III проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии основания (третичного алифатического амина) при температуре от 0 С до температуры кипения реакционной смеси. Как правило, реакцию соединения общей формулы II в форме ангидрида с соединением общей формулы III проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии основания (третичного алифатического амина, пиридина или 4 диметиламинопиридина) при температуре от 0 до 50 С. Кроме того, по завершении реакции между соединениями II и III в том случае, когда R представляет собой или включает радикал-COOR6 или РО(ОR9)2, где R6 и R9 представляют собой алкильные радикалы, 21- полученный продукт может быть омылен с целью получения продукта общей формулы I,в котором R представляет собой или включает карбоксильный радикал, или- полученный продукт может быть превращен с помощью нуклеофильного агента в продукт общей формулы I, в котором R представляет собой или включает радикал -РО 3 Н 2. Как правило, омыление продуктов общей формулы I, в которой R представляет собой или включает сложноэфирную группу общей формулы -COOR6, с образованием продуктов общей формулы I, в которой R представляет собой или включает карбоксильный радикал, осуществляют с помощью минерального основания, например гидроксида натрия, гидроксида калия или карбоната натрия, в органическом растворителе,таком как спирт, например метанол или этанол,или таком как простой эфир, например, диоксан,при температуре от 20 С до температуры дефлегмации растворителя. Как правило, превращение продуктов общей формулы I, в которой R представляет собой или включает радикал PO(OR9)2, в продукты общей формулы I, в которой R представляет собой или включает радикал РО 3 Н 2, осуществляют действием нуклеофильного агента, такого как галогенид (иодид) триалкилсилила (триметилсилила) или галогенид натрия или лития(иодид натрия) в присутствии триалкилгалогенсилана (триметилхлорсилана, триметилбромсилана) в растворителе, таком как четыреххлористый углерод или ацетонитрил, при температуре от 0 до 50 С, или путем нагревания с галогенидом щелочного металла (иодида натрия) с последующим гидролизом. Настоящее изобретение относится также к соединениям общей формулы III в которой Аr, R, R3, R4 и R5 определены ранее для формулы I иG1 обозначает атом водорода или защитную группу для аминной функции, например бензил. Согласно изобретению новые продукты общей формулы I, в которойY обозначает атом кислорода или серы, и Х обозначает атом кислорода,могут быть получены взаимодействием галогенформиата или галогентиоформиата общей формулы IVY обозначает атом кислорода или серы,R1 и R2 как определено выше иHal обозначает атом галогена,с соединением общей формулы III. Как правило, реакцию галогенида общей формулы IV с соединением общей формулы III проводят в органической или водноорганической среде, например в смеси диоксан-вода, в присутствии минерального основания (щелочь натрия) или органического основания (триэтиламин) при температуре от 0 до 50 С. Аналогичным предыдущему способом в том случае, когда R представляет или содержит радикал-СООН 6 или -PO(OR9)2, возможно произвести омыление полученного продукта с целью получения продукта общей формулы I, в которой R представляет собой или включает карбоксильный радикал, или превращение продукта с помощью нуклеофильного агента в соединение общей формулы I, в которой R представляет собой или включает радикал РО 3 Н 2. Согласно изобретению новые соединения общей формулы I, в которойY обозначает атом кислорода или серы, и Х обозначает группу NH,могут быть получены взаимодействием изоцианата или изотиоцианата общей формулы VY обозначает атом кислорода или серы, иR1 и R2 такие, как определены для общей формулы I, с определенным выше соединением общей формулы III. Как правило, реакцию соединения общей формулы V с соединением общей формулы III проводят в инертном органическом растворителе, например тетрагидрофуране или толуоле, в присутствии активирующего агента, такого как 4-диметиламинопиридин или 4-пирролидинопиридин, при температуре от 0 до 50 С. После реакции взаимодействия соединений формул V и II, когда R представляет собой или включает радикал -COOR6 или -РО(ОR9)2, в которых R6 и R9 обозначают алкильный радикал, может быть произведено омыление полученного продукта с целью получения продукта общей формулы I, в которой R представляет собой или включает карбоксильный радикал,или превращение полученного продукта с помощью нуклеофильного агента в соединение общей формулы I, в которой R представляет собой или включает радикал РО 3 Н 2. Возможное превращение радикалов -COOR6 и -PO(OR9)2,соответственно, в карбоксильный радикал и радикал РО 3 Н 2 производится в условиях, описанных выше. Согласно изобретению новые соединения общей формулы I, в которойR обозначает радикал общей формулыZ обозначает радикал -COOR6, где R6 прямой или разветвленный алкил с 1-3 атомами углерода,могут быть получены этерификацией соединения общей формулы I, в которой Z обозначает карбоксильный радикал. Как правило, этерификацию осуществляют спиртом общей формулы R6-OH, в которой R6 определен выше, в кислой среде или с помощью алкилгалогенидов общей формулы R6-Hal, в которой Hal обозначает атом галогена (иод), в щелочной среде (карбонат щелочного или щелочно-земельного металла, например карбоната цезия) в органическом растворителе, например диметилформамиде, при температуре от 0 до 50 С. Согласно изобретению новые соединения общей формулы I, в которойR обозначает радикал общей формулыR7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода и R8 обозначает атом водорода или прямой или разветвленный радикал алкил с 1-6 атомами углерода, который может быть замещен радикалом амино, алкиламино с 1-4 атомами углерода,диалкиламино, в котором каждый алкил содержит 1-4 атома углерода, алкокси с 1-4 атомами углерода, алкилтио с 1-4 атомами углерода, алкоксикарбонил, алкильная часть которого имеет 1-4 атома углерода, карбокси, циано, фенил,который может замещен одним или несколькими одинаковыми или различными радикалами,выбранными из числа алкокси-радикала с 1-4 атомами углерода или трифторметила, нафтил-1 или -2, фурил-2 или -3, тиенил-2 или 3, имидазолил-4 или 5, тиазолил-4 или 5, пиридил-2, -3 или -4, или радикал инданил или хроманил, или жеR7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода и R8 обозначает гидрокси, амино, прямой или разветвленный алкокси с 1-6 атомами углерода,который может быть замещен радикалом фенил,алкиламино или диалкиламино, алкильные части которых имеют 1-4 атома углерода, или,предпочтительно, в которомR7 обозначает атом водорода или прямой или разветвленный алкил с 1-6 атомами углерода иR8 обозначает атом водорода, гидроксирадикал, радикал арилсульфонил, например фенилcульфонил, который может быть замещен одним или несколькими одинаковыми или различными атомами или радикалами, выбранными из группы: атомы галогена и алкильные и алкокси радикалы, в которых алкил содержит 1-4 атома углерода, 002114 24 5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода или серы, и который может быть присоединен через один гетероатом,аминогруппу, которая может быть замещена одним или двумя одинаковыми или различными радикалами, выбранными из группы радикалов: алкил с 1-4 атомами углерода,арил, например фенил, который может бить замещен одним или несколькими одинаковыми или различными радикалами, выбранными из группы радикалов: алкил и алкокси, в которых алкил содержит 1-4 атома углерода,5-7-членный гетероцикл, содержащий один или несколько гетероатомов, выбранных из азота, кислорода или серы,алкилкарбонил, например бензоил, который может быть замещен одним или несколькими одинаковыми или различными радикалами, выбранными из группы: алкил и алкокси, в которых алкил содержит 1-4 атома углерода,прямой или разветвленный алкоксирадикал с 1-6 атомами углерода, который может быть замещен фенилом,прямой или разветвленный алкил с 1-6 атомами углерода, например метил, который может быть замещен радикалом из группы амино, алкиламино, диалкиламино, гидрокси, алкокси с 1-4 атомами углерода, меркапто, алкилтио, алкоксикарбонил, карбокси, циано, 5-12 членный моно- или полициклический ароматический радикал, который может содержать один или несколько гетероатомов, выбранных из кислорода, азота или серы, возможно замещенный,причем таким ароматическим радикалом, в частности, могут быть 2-, 3- или 4-пиридил, предпочтительно 3- или 4-пиридил, или пиридин-Nоксид, или радикал фенил, который может быть замещен одним или несколькими атомами галогена или одной или несколькими группами: гидрокси, амино или трифторметильной, или одним или несколькими радикалами: алкил, алкенил, алкокси, алкилтио, алкиламино, алкилкарбонил или алкоксикарбонил с 2-4 атомами углерода, карбамоил, алкилкарбамоил или диалкилкарбамоил с 1-4 атомами углерода в алкильной части, формил, а также нафтил-1 или-2,причем R7 предпочтительно обозначает атом водорода, a R8 радикал метил, замещенный радикалом 3-пиридил, могут быть получены взаимодействием соединения общей формулыHN(R7)(R8),в которой R7 и R8 определены выше,с соединением общей формулы I, в которой Z является карбокси-радикалом. Особенно предпочтительно, когда либо сначала вводят в реакцию оксалилхлорид с соединением общей формулы I, в которой R обозначает карбокси-радикал, в растворе дихлорметана с целью промежуточного по 25 лучения хлорангидрида кислоты с последующим вводом в реакцию соединения общей формулы HN(R7)(R8), возможно, в присутствии основания, например триэтиламина,либо соединение общей формулыHN(R7)(R8) вводят непосредственно в реакцию с соединением общей формулы I, в которой R карбокси-радикал, в органическом растворителе, например спирте (этаноле), или в галогенсодержащем растворителе, например дихлорметане, в присутствии конденсирующего агента,напримерN,N'-карбонилдиимидазола,1,1 дициклогексилкарбодиимида, гидрохлорида 1 этил-3-[3-(диметиламино)пропил]карбодиимида, гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония, при температуре от 0 до 50 С. В том случае, когда, по меньшей мере,один из радикалов R7 и R8 замещен аминогруппой, очень желательно, чтобы перед конденсацией амина общей формулы HN(R7)(R8) с соответствующей кислотой эта аминогруппа была защищена защитной группой, например третбутоксикарбонилом, бензилоксикарбонилом или бензилом, с последующей заменой защитной группы атомом водорода, например, путем гидрогенолиза водородом в присутствии катализатора типа палладия на угле, когда защитной группой является бензил или бензилоксикарбонил, или путем кислотного гидролиза, когда защитной группой является третбутоксикарбонил или бензилоксикарбонил. В том случае, когда, по меньшей мере,один из радикалов R7 и R8 замещен карбоксилом, очень желательно, чтобы перед конденсацией амина общей формулы HN(R7)(R8) с соответствующей кислотой эта карбоксигруппа была защищена защитной группой, такой как алкил,которая может быть замещена фенилом, например бензильной группой, с последующей заменой защитной группы атомом водорода, например, путем гидрогенолиза водородом в присутствии катализатора, такого как палладий на угле, или путем омыления в описанных выше условиях. В том случае, когда в соединении общей формулы I радикал R7 представляет собой атом водорода или алкил с 1-6 атомами углерода, а радикал R8 является замещенной фенилом алкоксигруппой, замена замещенной фенилом алкоксигруппы гидроксилом, осуществляемая либо гидрогенолизом в присутствии катализатора типа палладия на угле, либо обработкой хлористым алюминием в присутствии анизола в органическом растворителе, например нитрометане, при температуре от -20 С до комнатной,если замещенная фенилом алкоксигруппа является бензилом, позволяет получить продукт общей формулы I, в котором R7 является атомом водорода или алкильным радикалом с 1-4 атомами углерода, a R8 - гидроксильный радикал. 26 Согласно изобретению новые соединения общей формулы I, в которойR обозначает радикал общей формулы-NHCO-T,в которой Т обозначает атом водорода или алкильный радикал (с 1-6 атомами углерода), который может быть замещен радикалом амино,карбокси, алоксикарбонил, гидрокси, алкокси,меркапто или алкилтио, могут быть получены взаимодействием кислоты общей формулы Т-СО-ОН,в которой Т определен выше, с соединением общей формулы VI в которой Аr, R1, R2, R3, R4, R5, Х и Y определены выше для формулы I. Как правило, реакцию кислоты общей формулы Т-СО-ОН в форме кислоты с соединением общей формулы VI проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии конденсирующего агента,например гидрохлорида 1-этил-3-[3-(диметиламино)пропил]карбодиимида, 1,1-дициклогексилкарбодиимида или гексафторфосфата бензотриазол-1-илокси-трис(диметиламино)фосфония, и, при желании, в присутствии активирующего агента, такого как гидроксибензотриазол, при температуре от 0 до 50 С. Как правило, реакцию кислоты общей формулы Т-СО-ОН в галогенированной форме,когда Т отличен от атома водорода, с соединением общей формулы VI проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии основания (третичного алифатического амина) при температуре от 0 до 50 С. Как правило, реакцию кислоты формулы Т-СО-ОН в форме ангидрида с соединением общей формулы (VI) осуществляют в присутствии органического растворителя, такого как галогенированный алифатический углеводород,например дихлорметан, в присутствии основания (третичный алифатический амин, пиридин или 4-диметиламинопиридин) при температуре от 0 до 50 С. После реакции соединения Т-СО-ОН с соединением VI можно при необходимости осуществить замену защищенных сложноэфирных функций или аминофункций, содержащихся в Т,соответственно, карбоксильной и аминогруппой в условиях, описанных выше. В том случае, когда Т замещен одной аминогруппой, очень желательно, чтобы перед конденсацией кислоты общей формулы Т-СО-ОН с соответствующим амином эта аминогруппа была защищена защитной группой, например бен 27 зилоксикарбонилом или трет-бутоксикарбонилом, с последующей заменой защитной группы атомом водорода, например, путем гидрогенолиза водородом в присутствии катализатора типа палладия на угле или путем кислотного гидролиза. В том случае, когда Т замещен карбоксильной группой, очень желательно, чтобы перед конденсацией кислоты общей формулы ТСО-ОН с соответствующим амином карбоксильная группа была защищена такой защитной группой, как метил, этил или бензил, с последующей заменой защитной группы атомом водорода, например, путем гидрогенолиза водородом в присутствии катализатора типа палладия на угле или путем омыления в описанных выше условиях. Согласно изобретению новые соединения общей формулы I, в которой R обозначает радикал общей формулы могут быть получены взаимодействием избытка пиридина и сильной кислоты или ее производного с соединением общей формулы в которой Аr, R1, R2, R3, R4, R5, Х и Y определены выше для формулы I. Предпочтительной сильной кислотой является трифторметансульфокислота, которая может быть использована в присутствии ангидрида трифторметансульфокислоты. Согласно изобретению новые соединения общей формулы I, в которой Y является атомом серы, могут быть получены тионированием соединения общей формулы I, в которой Y является атомом кислорода. Как правило, тионирование проводят в стандартных условиях с использованием пятисернистого фосфора в органическом растворителе, например тетрагидрофуране, при температуре от 0 до 50 С. Согласно изобретению соединения общей формулы I, в которой один из символов R1 илиR2 обозначает алкоксикарбонилокси радикал,могут быть получены ацилированием соединение общей формулы I, в которой один из R1 илиR2 является гидроксильным радикалом, алифатической кислотой или ее производным, например, галогенангидридом или ангидридом, в обычных условиях этерификации. В том, что касается описанных выше промежуточных продуктов, ниже даются методики их получения, а также используемые для этой цели соединения. Соединения общей формулы III, в которойR является карбоксигруппой или радикалом общей формулы COOR6, традиционно получают 28 взаимодействием трифторметансульфокислоты с соединением общей формулы VIII в которой Аr, R3, R4 и R5 определены выше,G1 обозначает радикал бензил,R6 обозначает алкильный радикал с 1-3 атомами углерода с последующей заменой группы G1 атомом водорода,либо гидрогенолизом в описанных выше условиях с последующей, в случае необходимости,заменой атома водорода третбутоксикабонильным радикалом при действии трет-бутоксикабонилангидрида в органическом растворителе, или бензилоксикарбонильным радикалом при действии бензилоксикарбонилхлорида в органическом растворителе,либо действуя алкилхлорформиатом, например винил-, этил-, 2-хлорэтил- или 2,2,2 трихлорэтилхлорформиатом, в органическом растворителе, например в дихлорметане, при температуре от 0 С до комнатной температуры с последующим кислотным гидролизом промежуточно образовавшегося карбамата, обычно с помощью 1-6 М водяного раствора соляной кислоты, возможно в органическом растворителе,таком как спирт, например метанол или этанол,или простой эфир, например тетрагидрофуран или диоксан. Как правило, внутримолекулярная циклизация типа Фриделя-Крафтса соединения общей формулы VIII с образованием соединения общей формулы III может быть осуществлена действием избытка от 3 до 15 молярных эквивалентов сильной кислоты, например трифторметансульфокислоты, возможно в присутствии в каталитических количествах или, при необходимости, добавляемого последовательными порциями ангидрида трифторметансульфокислоты,в органическом растворителе, например, дихлорметане, при температуре от 0 С до температуры дефлегмации в течение от 15 мин до нескольких суток. Можно также осуществить внутримолекулярную циклизацию типа Фриделя-Крафтса действием кислоты Льюиса, например хлористого алюминия, четыреххлористого титана или трехфтористого бора, возможно в виде комплекса с диэтиловым эфиром, в органическом растворителе, например дихлорметане, нитрометане или нитробензоле. После этой реакции может быть, при необходимости, произведено омыление полученного продукта и, затем, при необходимости, может быть произведена замена бензильного радикала на атом водорода. 29 Что касается соединения общей формулыVIII, он может быть получен классическим методом при взаимодействии магнийорганического производного общей формулы Аr-Мg-Х, в которой Аr имеет определенное выше значение,а Х является атомом галогена, или литийорганического производного общей формулы Ar-Li,в которой Аr определен выше, с соединением общей формулы IX в которой R3, R4, R5, R6 и G1 определены выше, в обычных, условиях. Как правило, реакцию арилмагниевого соединения, получаемого классическим способом,возможно, в присутствии безводного хлорида церия(III), в условиях, описанных Imamoto (Tetrahedron Lett., 1985, p. 4763), с кетонным производным общей формулы IX проводят в органическом растворителе, например, в диэтиловом эфире или тетрагидрофуране, при температуре от 0 С до температуры дефлегмации реакционной смеси в течение от нескольких минут до 24 ч. Однако было обнаружено, что очень подходящим растворителем является толуол, возможно в смеси с диэтиловым эфиром или тетрагидрофураном. Как правило, реакцию ариллитиевого соединения, получаемого классическим способом,с кетонным производным общей формулы IX проводят в органическом растворителе, например, в диэтиловом эфире или тетрагидрофуране,при температуре от -78 до -20 С в течение от нескольких минут до 4 ч. Однако было найдено,что очень подходящим растворителем является толуол, возможно в смеси с диэтиловым эфиром или тетрагидрофураном. В рамках настоящего изобретения был разработан способ, позволяющий получать соединения общей формулы III, исходя из соединений общей формулы IX, через образование устойчивых промежуточных продуктов, характеризующихся общей формулой XV, и отличающихся тем, что в положении 7 имеется арилэтиленовая группа. Более конкретно, соединения общей формулы III в которой R3, R4, R5, Аr и R определены ранее для общей формулы I и G1 обозначает бензильный радикал, могут быть получены, исходя из соединения общей формулы IX в которой R3, R4, R5, R6 и G1 определены выше,через образование промежуточного продукта общей формулы XV в которой R3, R4, R5, R6, Аr и G1 определены выше. Условия осуществления способа предполагают следующую последовательность операций:- либо конденсацию по положению 7 кетонного производного общей формулы IX с гидразином с образованием гидразона и с последующей обработкой иодом с образованием,согласно реакции Бартона (Barton, J. Chem. Soc.,1962, р. 470) иодэтиленового производного; затем осуществляют реакцию сочетания на палладии с арилбороновой кислотой [реакция Сузуки(Susuki, Tetrahedron Lett. 1979, р. 3437)] общей формулы Аr-В(ОН)2 или, возможно, с гримерным ангидридом арилбороновой кислоты, в которой Аr определен выше, или с производным арилолова [реакция Штилле (Angew. Chem. Int.Ed. Engl., 1986, р.508)] общей формулы АrSnМе 3, в которой Аr определен выше, с образованием промежуточного арилэтиленового соединения общей формулы XV, внутримолекулярная циклизация которого по типу ФриделяКрафтса приводит к целевому продукту III;- либо реакцию кетонного производного общей формулы IX c ангидридом трифторметансульфокислоты с образованием трифторметансульфоната енола в положении 7 (Org.Synth., 1990, р.116), с последующей реакцией сочетания на палладии с арилборной кислотойEngl., 1986, р.508)] общей формулы Аr-SnМе 3, в которой Аr определен выше, с образованием промежуточного арилэтиленового соединения общей формулы XV, внутримолекулярная циклизация которого по типу Фриделя-Крафтса приводит к целевому продукту III. Как правило, кетонное производное общей формулы IX обрабатывают избытком 3-20 молярных эквивалентов гидразингидрата при кипячении с обратным холодильником в растворителе, например в этаноле, в течение от несколь 31 ких минут до нескольких часов. Полученный при этом гидразон перемешивают затем с избытком иода в присутствии третичного алифатического амина, например триэтиламина, при температуре, близкой к 20 С в течение нескольких часов, в результате чего образуется иодэтиленовое производное. Как правило, кетонное производное общей формулы IX обрабатывают- либо ангидридом трифторметансульфокислоты в присутствии органического основания,например 2,6-ди-трет-бутил-4-метилпиридина, в органическом растворителе, например в дихлорметане, при температуре, близкой к комнатной в течение нескольких часов (Stang,Synthesis, 1980, р.283). либо бис(трифторметилсульфонил) амидом, например, N,N-бис(трифторметилсульфонил)анилином (Mac Murry, Tetrahedron Lett.,1983, р. 979) или 2-[N,N-бис(трифторметилсульфонил)амино]пиридином (Comins, TetrahedronLett., 1992, р. 979) в присутствии такого основания как диизопропиламидат лития в органическом растворителе, таком как дихлорметан или 1,2-диметоксиэтан, в результате чего образуется трифторметансульфонат енола. Как правило, сочетание иод этиленового производного или полученного выше трифторметансульфонат енола с арилборной кислотой,получаемой традиционным способом и, возможно, выделенной в форме тримерного ангидрида, осуществляют путем перемешивания в двухфазной системе, состоящей из органического растворителя, предпочтительно, смесь толуола и метанола, и основного водного раствора,предпочтительно 2 н. раствор карбоната натрия,в присутствии каталитического количества производного палладия (0), предпочтительно тетракис(трифенилфосфин)палладия, при температуре, близкой к температуре дефлегмации в течение нескольких часов, в результате чего образуется арилэтиленовое соединение общей формулы XV. Как правило, сочетание иодэтиленового производного или трифторметансульфонат енола с получаемыми традиционным способом производными арилолова, проводят путем перемешивания в полярном апротонном органическом растворителе, предпочтительно в диметилформамиде или N-метилпирролидоне, в присутствии каталитического количества производного палладия (0), предпочтительно тетракис(трифенилфосфин)палладия, при температуре от 50 до 100 С в течение нескольких часов, в результате чего образуется арилэтиленовое соединение общей формулы XV. Как правило, внутримолекулярную циклизацию по типу Фриделя-Крафтса соединения формулы XV до соединения формулы III проводят в условиях, описанных выше для внутримолекулярной циклизации соединений общей формулы VIII. 32 В рамках настоящего изобретения был также успешно разработан второй способ, позволяющий получать определенные выше соединения общей формулы III, исходя из соединений общей формулы IX через промежуточные соединения общей формулы XV, которые могут быть выделены. Второй способ имеет особое преимущество в том случае, когда радикал Аr представляет собой фенил, замещенный в положениях пара или мета-пара или мета-пара-мета электронодонорными группами, или гетероциклический радикал с большим содержанием электронов, или гетероциклический радикал,соответствующим образом замещенный электронодонорными группами, причем второй способ заключается в непосредственном взаимодействии, согласно последовательным реакциям внутримолекулярной и затем межмолекулярной циклизации по типу Фриделя-Крафтса, ароматического или гетероциклического углеводорода Аr-Н с соединением общей формулы IX в органическом растворителе в присутствии избытка сильной кислоты, такой как трифторметансульфокислота, или, возможно, кислоты Льюиса, такой как хлорид алюминия. Разработанный способ состоит в конденсации соединения общей формулы с избытком трифторметансульфокислоты (от 5 до 20 молярных эквивалентов) в органическом растворителе, например дихлорметане, при температуре близкой к комнатной в течение от нескольких часов до нескольких суток. В зависимости от числа молярных эквивалентов и концентрации трифторметансульфокислоты, а также от природы радикала Аr и имеющихся в нем заместителей названная реакция приводит либо непосредственно к соединениям общей формулы III, либо через промежуточное образование соединений общей формулы XV, которые затем циклизуют в соответствии с приведенным выше описанием в соединения общей формулы III. Наряду с этим, соединения общих формулI и III могут быть получены путем функционализирования заместителей в цикле Аr соответствующих соединений общих формул I и III, с применением известных способов проведения обычных функционализирующих реакций, таких, например, как реакции функционального замещения (например, замещение атома галогена цианогруппой путем сочетания на палладии),реакции дезалкилирования (например, с помощью ВВr3), реакции алкилирования (в частности, реакции алкилирования-циклизации под действием ВВr2). Другим объектом изобретения являются соединения общей формулы XV в которой R3, R4, R5 и Аr определены ранее для общей формулы I, G1 обозначает радикал бензил и R6 - алкил с 1-3 атомами углерода, в рацемической форме или форме их оптических изомеров. Соединение общей формулы IX в рацемической форме или форме его оптических изомеров, где R3, R4, R5, R6 и Аr определены ранее для общей формулы I и G1 является бензилом, может быть получено действием N-триалкилсилилметил-N-алкоксиметиламина, аминогруппа которого защищена защитной группой, например бензильным радикалом, в частности, Nтриалкилсилилметил-N-н-бутоксиметилбензиламина, который может быть получен в условиях,описанных в Chem. Pharm. Bull., 276(1985), на производное циклогексенона общей формулы в которой R3, R4, R5 и R6 определены выше,в рацемической форме или форме его оптических изомеров. Как правило, реакцию проводят в органическом растворителе, таком как галогенированный алифатический углеводород, например дихлорметан, в присутствии сильной кислоты,такой как трифторметансульфокислота, при температуре от 0 С до температуры дефлегмации реакционной смеси. Соединения общей формулы Х могут быть получены этерификацией 3-оксо-6-фенилциклогекс-1-ен-1-карбоновых кислот, в которых R3,R4 и R5 определены выше, с использованием алифатического спирта, содержащего 1-3 атома углерода, в присутствии минеральной кислоты,такой как соляная или серная кислота, при температуре от 0 С до температуры дефлегмации реакционной смеси или с использованием алкилгалогенида (иодида) в присутствии, органического основания, например, 1,8-диазабицикло[5.4.0]ундец-7-ена, или минерального основания, например карбоната цезия, в органическом растворителе, таком как тетрагидрофуран,диметилформамид, ацетон и диоксан. 3-Oксо-6-фенилциклогекс-1-ен-1-карбоновые кислоты, в которых R3, R4 и R5 определены выше, могут быть получены из 3-оксо-6 фенилциклогексан-1-ол-1-карбоновых кислот, в 34 которых R3, R4 и R5 определены выше, либо термической дегидратацией последних при нагревании до температуры, близкой к 190 С по методу (J. Org. Chem., 1971, р. 3707) или кипячении с обратным холодильником в толуоле в присутствии п-толуолсульфокислоты, либо действием минерального основания, например натриевой щелочи, при температуре от 0 до 50 С. 3-Oксо-6-фенилциклогексан-1-ол-1-карбоновые кислоты, у которых R3, R4 и R5 определены выше, могут быть получены действием фенилпировиноградных кислот или, возможно,соответствующих сложных эфиров, более конкретно, в тех случаях, когда R5 не является атомом водорода, а фенильный остаток может быть замещен заместителями, определяемыми как R3 и R4, на метилвинилкетон обычно в водноспиртовой среде, например в среде метанолвода, в присутствии минерального основания,например гидроксида натрия, по методу (J. Org.Chem., 1971, p. 3707). Фенилпировиноградные кислоты, у которых фенильное кольцо может быть замещено заместителями, определенными как R3 и R4, и более конкретно, когда R5 - атом водорода, могут быть получены либо гидролизом соответствующих а-ацетамидокоричных кислот путем нагревания в соляной кислоте по методу (Org.Synth. 1943, р. 519), либо гидролизом соответствующих бензальгидантоинов путем нагревания в 20%-ном гидроксиде натрия по методу (Org.Synth. Coll. Vol. V, p. 627). а-Ацетамидокоричные кислоты, у которых фенильное кольцо может быть замещено заместителями, определяемыми как R3 и R4, могут быть получены из соответствующих бензальдегидов по методу (Org. Synth. 1939, р. 1) при действии на них N-ацетилглицином в кипящем с обратным холодильником уксусном ангидриде в присутствии ацетата натрия. Промежуточно получаемые при этом азлактоны затем гидролизуют до а-ацетамидокоричной кислоты путем кипячения с обратным холодильником в водном ацетоне. Бензальгидантоины, у которых фенильное кольцо может быть замещено заместителями,определяемыми как R3 и R4, могут быть получены нагреванием соответствующих бензальдегидов по методу (Org. Synth. Coll., Vol. V, р. 267) с гидантоином в присутствии органического основания, например пиперидина, при температуре, близкой к 130 С. Фенилпируваты, у которых фенильное кольцо может быть замещено заместителями,определяемыми как R3 и R4, и более конкретно,когда R5 не является атомом водорода, а представляет собой радикал алкил или тиоалкил,могут быть получены из 2-фенилалкановых кислот, у которых фенильное кольцо может быть замещено заместителями, определяемыми какR3 и R4, при действии на этилоксалат соответствующим дианионом (получаемым обычно при 35 действии на кислоту органическим основанием,например н-бутиллитием) при температуре,близкой к 70 С, вслед за чем производится декарбоксилирование в условиях, описанных вTetrahedron Lett., 1981, 2439-42. Соединения общей формулы III-CON(R7)(R8),могут быть получены из соединения общей формулы (VIII), в которой R обозначает карбоксигруппу, этерификацией и амидированием в условиях, описанных выше, с последующей циклизацией при действии трифторметансульфокислоты в условиях, описанных выше. Соединения общей формулы III, в которой-СОN(R7)(R8), или PO(OR9)2,могут быть получены из соединения общей формулы в которой Аr, R3, R4 и R определены выше, a G1 обозначает защитную группу для аминной функции (бензил, бензилоксикарбонил или третбутоксикарбонил) и G2 - удаляемая группа, например трифторметансульфонилоксигруппа. Более конкретно, для получения соединений общей формулы III, в которой R означает радикалZ обозначает радикалы карбокси, -COOR6,где R6 - алкильный радикал, или -CON(R7)(R8),особенно предпочтительно проводить синтез через промежуточный соответствующий нитрил, который может быть получен действием цианида щелочного металла на соединение об 002114 36 щей формулы XI в полярном органическом растворителе, таком как диметилсульфоксид, при температуре от 0 до 50 С, после чего нитрил гидролизуют до соответствующей кислоты, которая затем может быть этерифицирована или амидирована в обычных условиях. Еще более конкретно, для получения соединений общей формулы III, в которой R означает радикал -(CH2)m-X1(CH2)n-Z, в которомZ обозначает радикал -РО(ОR6)2,особенно предпочтительно действовать на соединение общей формулы XI триалкилфосфитом с последующим возможным превращением полученного фосфоната в соответствующую фосфоновую кислоту. Соединения общей формулы IIIR обозначает -(CH2)m-X1(CH2)n-Z, где m равно 1,X1 обозначает атом кислорода или серы,n равно 1 или 2,Z обозначает радикалы карбокси, -COOR6,где R6 - алкильный радикал или -CON(R7)(R8), иG1 обозначает защитную группу для аминной функции,могут быть получены действием сложного эфира или амида общей формулыH-X1(CH2)n-Z,в которой X1, n и Z определены выше,на соединение общей формулы XI в безводном органическом растворителе, таком как диоксан,в присутствии гидрида щелочного металла, такого как гидрид натрия, с последующим, при необходимости, омылением полученного таким образом соединения общей формулы III. Соединения общей формулы III, в которойm равно 1,X1 обозначает связь,n равно 1 и где метиленовая группа, может быть замещена радикалом карбокси, алкоксикарбонил, карбамоил, алкилкарбамоил или диалкилкарбамоил,G1 обозначает защитную группу для аминной функции,Z обозначает радикалы карбокси, -COOR6,где R6 - алкильный радикал или -CON(R7)(R8),могут быть получены действием предварительно ионизованной малоновой кислоты или производного малоновой кислоты, преимущественно диэфира, на соединения общей формулы XI в безводном органическом растворителе, таком как диоксан, в присутствии гидрида щелочного металла, такого как гидрид натрия, при темпе 37 ратуре от 0 С до температуры дефлегмации реакционной смеси с последующими возможным,при необходимости, омылением, этерификацией, амидированием или декарбоксилированием полученного таким образом продукта общей формулы III. Соединения общей формулы III, в которойR обозначает радикал -NH-CO-T, в котором Т определен выше,могут быть получены амидированием соединения общей формулы III, в которойR3 определен выше,G1 обозначает защитную группу для аминной функции иR обозначает аминогруппу,с помощью кислоты общей формулы Т-СО-ОН,в которой Т определен выше, в условиях, описанных выше для амидирования соединения общей формулы VI. Соединения общей формулы III, в которойR обозначает аминогруппу, или соединения общей формулы VI могут быть получены по методикам, которые позволяют превращение карбоксила в аминогруппу, не затрагивая остальную часть молекулы. Как правило, карбоксильную функцию соединений общих формул III и I превращают в аминогруппу через промежуточный изоцианат,получаемый путем пиролиза азида кислоты,который, в свою очередь, может быть получен при действии азида щелочного металла на галогенангидрид соответствующей кислоты. Получаемый таким образом промежуточный изоцианат обычно вводят в реакцию конденсации с бензиловым спиртом и затем образовавшийся бензилкарбамат превращают в аминогруппу либо гидрогенолизом, либо кислотным гидролизом в условиях, описанных выше. Соединения общей формулы III, в которойR обозначает радикал могут быть получены действием пиридина и сильной кислоты или ее производного на соединение общей формулы XII в которой Аr, R3, R4 и R5 определены выше, a G1 обозначает защитную группу для аминной функции. Соединения общей формулы VII или общей формулы XII могут быть получены, соответственно, восстановлением соединения общей формулы I или соединения общей формулы III,в которых R обозначает радикал общей формулы -COOR6, в которой R6 обозначает преимущественно алкил с 1-3 атомами углерода. Как правило, восстановление осуществляют с помощью смешанного гидрида лития и алюминия в органическом растворителе, таком 38 как простой эфир, например тетрагидрофуран,при температуре от 0 до 50 С. Согласно изобретению соединения общей формулы I, в которой Аr, R1, R2, R3, R4, R5, Х и-COOR6, в котором R6 определен выше, могут быть также получены из соединений общей формулы IX, в которой R3, R4, R5 и R6 определены выше и G1 обозначает атом водорода. Согласно изобретению соединение общей формулы IX в которой G1 обозначает атом водорода, получают из соединения общей формулы IX, в которой G1 обозначает защитную группу для аминной функции, в условиях, описанных выше для получения соединения общей формулы III, в которой G1 обозначает атом водорода. Соединение общей формулы IX, в которойG1 обозначает атом водорода, превращают в соединение общей формулы XIII в которой R1, R2, R3, R4, R5, R6, Х и Y определены выше, получают, в зависимости от значений Х и Y, следующим образом: соединения общей формулы XIII, в которой Y обозначает атом кислорода или серу, а Х группу -СО-, метилен, винилдиил, алкен-1,1 диил или циклоалкан-1,1-диил, могут быть получены действием кислоты общей формулы II или ее хлорангидрида или ангидрида на соединение общей формулы IX, в которой G1 обозначает атом водорода, в условиях, описанных выше для взаимодействия соединения общей формулы II с соединением общей формулы III, в которой G1 - атом водорода,соединения общей формулы XIII, в которой Y обозначает атом кислорода или серу, а Х атом кислорода, могут быть получены действием галогенформиата или галогентиоформиата общей формулы IV на соединение общей формулы IX, в которой G1 обозначает атом водорода, в условиях, описанных выше для взаимодействия соединения общей формулы IV с соединением общей формулы III, в которой G1 - атом водорода,соединения общей формулы XIII, в которой Y обозначает атом кислорода или серу, а Х группу NH, могут быть получены действием изоцианата или изотиоцианата общей формулыV на соединение общей формулы IX, в которойG1 обозначает атом водорода, в условиях, описанных выше для взаимодействия соединений общей формулы V с соединением общей формулы III, в которой G1 - атом водорода. Соединение общей формулы XIII превращают в соединение общей формулы XIV в которой Ar, R1, R2, R3, R4, R5, R6, X и Y определены выше действием производного металла общей формулы Аr-Мg-Х или Ar-Li, где Х обозначает атом галогена, на соединение общей формулы XIII в условиях, описанных выше для действия магнийорганическими или литийорганическими соединениями общей формулы АrМg-Х или Ar-Li на соединения общей формулыIX. Соединение общей формулы XIV превращают в соединение общей формулы I, в которойAr, R1, R2, R3, R4, R5, R6, Х и Y определены выше, действием трифторметансульфокислоты или кислоты Льюиса на соединение общей формулы XIV в условиях, описанных выше, для действия трифторметансульфокислотой или кислотой Льюиса на соединения общей формулы VIII. Взаимодействие ароматического углеводорода или ароматического гетероциклического соединения Аr-Н, определенных выше, в присутствии трифторметансульфокислоты или кислоты Льюиса с соединением общей формулыXIII, в которой R1, R2, R3, R4, R5, R6, Х и Y определены выше, приводит к соединению общей формулы I, в которой Ar определен выше, a R обозначает радикал-СООR6, в котором R6 является алкилом с 1-3 атомами углерода. Согласно изобретению, соединения общей формулы I, в которой-(CH2)m-X1(CH2)n-Z,в котором m, n, X1 и Z определены выше, могут быть получены из соединений общей формулыVII в условиях, описанных выше для получения соединений общей формулы III из соединений общей формулы XI, после замены гидроксильного радикала в соединении общей формулы VII удаляемой группой, такой как трифторметансульфонилоксигруппа. Реакционные смеси, получаемые выше, в результате различных операций обрабатывают традиционными физическими (например, упариванием, экстракцией, перегонкой, хроматографией, кристаллизацией) или химическими 40 Соединения общей формулы I могут быть при желании превращены в аддитивные соли с минеральными или органическими кислотами путем действия кислотой в органическом растворителе, например, спирте, кетоне, простом эфире или хлорсодержащем растворителе. Эти соли также составляют часть изобретения. Оптические изомеры соединений общей формулы I могут быть получены с использованием обычных способов расщепления соответствующих рацемических соединений. Особенно предпочтителен способ разделения с помощью высокоэффективной жидкофазной хроматографии с неподвижной хиральной фазой по модифицированному методу Пиркла (Pirkle) с использованием подходящего элюирующего растворителя. В качестве неподвижной хиральной фазы преимущественно используют фазу, в которой хиральный селектор, которым по преимуществу является 3,5-динитрофенилаланин, удален от двуокиси кремния с помощью боковой аминоалкильной группы, содержащей от 3 до 14 атома углерода, закрепленной на аминных функциях аминопропилдиоксиде кремния, свободные силанольные группы которого блокированы триалкилсилильными радикалами. Строение этой хиральной фазы может быть отображено следующей схемой в которой символы R', одинаковые или различные, и R", одинаковые или различные, обозначают алкильные радикалы, содержащие от 1 до 10 атомов углерода, С 3 обозначает электроноакцепторную группу и n целое число от 3 до 13 включительно, в то время как пористость фазы составляет величину близко к 100 . Хиральная фаза может быть приготовлена взаимодействием аминопропилдиоксида кремния с ангидридом аминоалкановой кислоты,содержащей 4-14 атомов углерода, аминная функция которой защищена защитной группой,такой как радикал трет-бутоксикарбонил, с последующим блокированием части силанольных функций радикалами Si(R')3, определенными выше, и, после удаления защитных групп с аминных функций, амидированием аминокислотой общей формулы в которой G3 определен выше, и, наконец, блокированием остаточных силанольных функций определенными радикалами Si(R")3. Обычно взаимодействие ангидрида защищенной аминоалкановой кислоты с аминопро 41 пилдиоксидом кремния проводят в безводном органическом растворителе, например диметилформамиде, при температуре, близкой к 20 С. Блокирование силанольных функций определенными выше группами -Si(R')3 осуществляется действием триалкилгалогенсилана на аминопропилдиоксид кремния с привитыми аминоалканоильными остатками, в органическом растворителе, например дихлометане, в присутствии основного агента, например пиридина. Удаление защитных групп с аминоалканоильных остатков в том случае, когда защитной группой является трет-бутоксикарбонил, осуществляется обычно действием трифторуксусной кислоты в органическом растворителе, например дихлометане. Амидирование с помощью фенилаланина с защищенной аминной функцией осуществляется в присутствии агента конденсации, такого как N-этоксикарбонил-2-этокси-1,2-дигидрохинолин, в безводном органическом растворителе,например диметилформамиде. Блокирование остаточных силанольных функций определенными выше остаточными радикалами Si(R)3 обычно производится с помощью триалкилсилилимидазола в безводном органическом растворителе, таком как ароматический углеводород, например толуол. Как показывают приведенные ниже примеры, новые соединения общей формулы I, которые ингибируют фарнезилтрансферазу и фарнезилирование белка Ras, обладают замечательными противоопухолевыми и противолейкемийными свойствами. Предметом настоящего изобретения является также фармацевтическая композиция, содержащая, по крайней мере, одно соединение общей формулы I в сочетании с одним или несколькими фармацевтически приемлемыми инертными или биологически активными разбавителями или наполнителями. Новые соединения общей формулы I могут находиться в форме нетоксичных и фармацевтически приемлемых солей. Такими нетоксичными солями являются, в частности, соли с минеральными кислотами (хлористо-водородной,серной, бромисто-водородной, фосфорной и азотной кислотами), или с органическими кислотами (уксусной, пропионовой, янтарной, малеиновой, гидроксималеиновой, бензойной, фумаровой, метансульфоновой, трифторуксусной и щавелевой кислотами), или с минеральными основаниями (гидроксидом натрия, калия, лития и кальция) или с органическими основаниями(третичными аминами, например триэтиламином, пиперидином и бензиламином) в зависимости от природы соединений общей формулыI. Настоящее изобретение относится также к использованию соединений общей формулы I 42 для приготовления фармацевтических композиций, пригодных для ингибирования фарнезилтрансферазы и, более конкретно, для ингибирования фарнезилирования онкогена rаs. Настоящее изобретение, в частности, касается использования соответствующих изобретению соединений общей формулы I в качестве активного агента для приготовления фармацевтических композиций, пригодных для лечения болезней, связанных с клеточной пролиферацией, путем ингибирования фарнезилтрансферазы и, в частности, для лечения болезней, связанных с клеточной пролиферацией, при которых имеет место суперэкспрессия какого-либо из онкопротеинов H-Ras, N-Ras или K-Ras или мутация какого-либо из соответствующих онкогенов ras. Изобретение, в частности, касается использования соответствующих изобретению соединений общей формулы I для приготовления фармацевтических композиций, пригодных для лечения болезней, связанных с доброкачественной или злокачественной клеточной пролиферацией, в которых участвуют клетки различных тканей и/или органов, включая мышечные,костные и соединительные ткани, кожу, мозг,легкие, половые органы, лимфатическую и почечную системы, клетки молочных желез и крови, печень, пищеварительный аппарат, ободочную кишку, поджелудочную, щитовидную и надпочечную железы, и включая следующие патологии: псориаз, рестеноз, твердые опухоли,саркомы Капоши, карциномы, холангиокарциному, хориокарциному, нейробластому, опухоль Уилмса, болезнь Ходжкина, меланомы, тератокарциномы, глиомы, множественные миеломы,хронические лимфоцитарные лейкемии, острые и хронические гранулоцитарные лимфомы, раки поджелудочной железы, ободочной кишки, легкого, яичника, молочной железы, мозга, простаты, печени, желудка, мочевого пузыря и яичек. Более конкретно, изобретение касается использования соединений общей формулы I и особенно соединения, описанного в примере 3,для приготовления фармацевтических композиций, пригодных для лечения рака, в частности,рака поджелудочной железы, ободочной кишки,легкого, яичников, молочной железы, мозга,простаты, печени, желудка, мочевого пузыря и яичек и, наиболее успешно, рака ободочной кишки и поджелудочной железы, в особенности,рака ободочной кишки. Соединения настоящего изобретения могут быть также использованы для приготовления медикаментов для лечения и/или профилактики патологических состояний, связанных с механизмами клеточных сигнализаций с участием фарнезилтрансферазы, или их последствий или симптомов. Преимущественно соединения настоящего изобретения могут быть использованы для приготовления медикаментов для лечения и/или профилактики болезней, связанных с механиз 43 мами клеточной сигнализации с участием Ras. Вследствие этого, соединения настоящего изобретения могут быть использованы для приготовления медикаментов для лечения и/или профилактики отторжения трансплантатов (таких как аллотрансплантаты) (O'Donnel et al., 1995,Kidney International, vol. 48, suppl.52, p.S.29-33). Равным образом, соединения настоящего изобретения могут быть использованы для приготовления медикаментов для подавления ангиогенеза и для воздействия на рост опухоли (J.Rak et al., Cancer Research, 55, 4575-4580, 1995),при этом противоангиогенезные свойства могут быть также использованы для лечения некоторых форм воспаления слепой кишки, обусловленных ретинальной васкуляризацией. Соединения настоящего изобретения могут быть использованы для приготовления медикаментов для лечения и профилактики- болезней, связанных с апоптотической дисфункцией (про- или анти-), включающих, в частности, названные выше формы рака;- дельта-гепатита и ассоциированных с ним вирусов (J.S. Glenn et al., 256, 1331-1333,1992), а также только в качестве примера вирусов герпеса, оспы, Эпштейна-барр, синдбис и адено;- воспалительных и/или аутоиммунных заболеваний, таких как, только в качестве примера, полиартриты, полиартикулярные ревматизмы, кишечные воспаления, легочные эдемы,инфаркты миокарда, фиброзы, красные волчанки типа болезни Калоши,иммуногломерулонефриты, аутоиммунные диабеты;- сердечно-сосудистых болезней (артериосклероз и другие артериальные нарушения),рестеноза после ангиопластики или сосудистой хирургии;- болезней, связанных с повышенным уровнем холестерина, таких как гиперхолестеринемия, гиперлипидемия, гиперпротеинемия,нефротическая гиперлипидемия или атеросклероз (Massy et al., Lancet, 347, IDS-103, 1996.);- нейродегенеративных нарушений, таких как болезнь Паркинсона, Aльцгеймера, амиотрофический боковой склероз, неврологические расстройства, обусловленные вирусными заболеваниями, такие как СПИД, ретиниты, спиноцеребральные атрофии и перерождения; а также для предупреждения и/или лечения следующих болезней: СПИД (в особенности и наряду с прочим), поликистозная почка (D.L. 44 а также миелодиспластические синдромы,апластическая анемия, обусловленные инфарктом ишемические нарушения, нарушения, связанные с церебрально-сосудистой недостаточностью и аритмиями, атеросклерозы, болезни печени, обусловленные токсинами и алкоголем,гематологические болезни, включающие, в частности, хроническую или апластическую анемию, дегенеративные заболевания мышечноскелетной системы, включая, в частности, остеопороз и артрит, кистозные фиброзы, рассеянные склерозы, болезни печени, раковые боли. Названное выше лечение может, в частности, осуществляться путем подавления опухолевого роста, а именно путем ингибирования фарнезилтрансферазы или подавления роста опухолей, экспрессирующих активированный онкогенras. Терапевтическое лечение может также проводиться одновременно с другими методами терапевтического воздействия, включая противоопухолевые препараты, моноклональные антитела, иммунологическую терапию или радиотерапию, или модификаторы биологических реакций. Модификаторы биологических реакций включают (только в качестве примера) лимфокины и цитокины, такие как интерлейкины, интерфероны (,или ) и TNF (фактор опухолевого некроза). Другие химиотерапевтические агенты, пригодные для лечения нарушений, обусловленных аномальной клеточной пролиферацией, включают, только в качестве примера, алкилирующие агенты: азотные горчицы, например мехлорэтамин, циклофосфамид,мелфалан и хлорамбуцил; алкилсульфонаты,например, бусульфан; нитрозомочевины, такие как кармустин, ломустин, семустин и стрептозоциы; триазены, такие как дикарбазин; антиметаболиты, такие как аналоги фолиевой кислоты(метотрексат), аналоги пиримидина (фторороурацил и цитарабин), аналоги пуринов (меркаптопурин и тиогуанин); природные продукты,такие как алкалоиды барвинка розового (винбластин, винкристин и виндезин), эпиподофиллотоксины (этопозид и тенипозид), антибиотики(дактиномицин, даунорубицин, доксорубицин,блеомицин, пликамицин и митомицин), ферменты (L-аспарагиназа); различные агенты, такие как координационные комплексы платины (цисплатина), замещенные мочевины (гидроксимочевина), производные метилгидразина (прокарбазин), адренокортикоидные суппресcоры (митотан и аминоглутетимид); гормоны и антагонисты, такие как адренокортикостеороиды(преднизон), прогестины (гидроксипрогестеронкапроат, метоксипрогестеронацетат и мегестролацетат), эстрогены (диэтилстилбестрон и этинилэстрадиол), антиэстрогены (тамоксифен) и андрогены (тестостеронпропионат и флюоксиместерон). Другим объектом настоящего изобретения является ассоциация соединения общей форму 45 лы I с одним или несколькими совместимыми и фармакологически активными соединениями и/или с радиотерапевтическим лечением с целью получения синергического терапевтического эффекта, причем названные соединения являются преимущественно активными началами,известными как ингибиторы в отношении клеточной пролиферации и особенно своей активностью в отношении лечения рака; они могут быть предпочтительно антипролиферативным соединениям, действующим на той или иной из стадий механизма сигнализации онкогена ras в качестве ингибитора тирозинкиназы или ингибитора фарнезилтрансферазы, или ингибитораHMG-Соредуктазы, или цитотоксическим соединениям, обычно используемым при лечении рака. Соединения настоящего изобретения могут быть использованы для предупреждения или отсрочки появления патологических состояний или же для лечения этих патологических состояний. Соединения настоящего изобретения могут вводиться перорально, парентерально, внутрибрюшинно или ректально, но преимущественно перорально. Композиции для перорального применения могут приготовляться в виде таблеток, пилюль,порошков или гранул. В этих композициях активное соединение настоящего изобретения смешано с одним или несколькими инертными разбавителями, такими как сахароза, лактоза или крахмал. Эти композиции могут содержать вещества, отличные от разбавителей, например смазочный компонент типа стеарата магния. В качестве жидких композиций для перорального введения могут применяться фармацевтически приемлемые эмульсии, растворы,суспензии, сиропы, эликсиры, содержащие такие инертные разбавители как вода или парафиновое масло. Эти композиции могут также содержать вещества, отличные от разбавителей,например увлажняющие, подслащивающие и ароматизирующие вещества. Композиции настоящего изобретения для парентерального применения могут приготовляться в виде стерильных водных растворов,суспензий и эмульсий. В качестве растворителя или связующего могут быть использованы пропиленгликоль, полиэтиленгликоль, растительные масла, особенно оливковое масло, и пригодные для инъекции органические сложные эфиры, например этилолеат. Эти композиции могут также содержать вспомогательные средства, особенно такие как смачивающие, эмульгирующие и диспергирующие вещества. Стерилизацию можно произвести несколькими способами, например с помощью бактериологического фильтра, введением в композицию стерилизующего агента или путем нагрева. Композиции могут также приготовляться в виде твердых стерильных смесей, которые могут быть раство 002114 46 рены перед употреблением в стерильной воде или другой пригодной для инъекций среде. Композиции для ректального применения представляют собой свечи, которые кроме активного начала могут содержать наполнители,подобные маслу какао. Дозы, используемые для осуществления настоящего изобретения, должны обеспечивать профилактическое лечение и максимальный терапевтический эффект. Дозы варьируют в зависимости от пути введения, от конкретного выбранного соединения и от собственных характеристик больного. Как правило, выбирают такие дозы, которые терапевтически эффективны при лечении нарушений, связанных с анормальной клеточной пролиферацией, и, в частности, при цитостатическом лечении. Соединения настоящего изобретения могут применяться настолько часто и настолько долго, как этого требует достижение желаемого терапевтического эффекта. Как правило, дозы для человека варьируют в пределах от 0,1 до 10000 мг на 1 кг веса в сутки и преимущественно от 100 до 2000 мг/кг в сутки, по преимуществу перорально. Само собой разумеется, что, выбирая наиболее подходящую дозу, следует принимать во внимание способ применения, вес больного, общее состояние его здоровья, его возраст и все факторы,которые могут повлиять на эффективность лечения. Обычно лечащий врач определяет соответствующую дозировку в зависимости от возраста, веса и других факторов, связанных с объектом лечения. Композиции настоящего изобретения иллюстрируются в примере 105. Ниже приведены примеры, служащие иллюстрацией, но не ограничивающие при этом объема изобретения. Пример 1. Получение метилового эфира 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1Hбензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). Стадия А. К раствору 428 г (1,98 моль) 3-оксо-6 фенилциклогекс-1-ен-1-карбоновой кислоты(RS), которая может быть получена по методу J.Org. Chem., 36, 3707, в 4,5 мл ацетона последовательно добавляют 358 г (2,52 моль) йодистого метила и 361 г (2,38 моль) 1,8-диазабицикло[5.4.0]ундец-7-ена и кипятят с обратным холодильником полученную смесь 5 ч. Затем отгоняют ацетон и остаток перемешивают с 2,5 л воды. После охлаждения до 10 С образовавшийся осадок отжимают, промывают ледяной водой и сушат при 30 С. Получают 423 г(м, 5 Н: ароматические). Стадия В. Раствор 170 г (0,77 моль) метилового эфира 3-оксо-6-фенилциклогекс-1-ен-1-карбоновой кислоты (RS) и 0,9 мл трифторуксусной кислоты в 880 мл дихлорметана нагревают до кипения с обратным холодильником и в течение 15 мин добавляют при кипении с обратным холодильником 256,3 г (0,913 моль) N-нбутоксиметил-N-[(триметилсилил)метил]бензиламина, который может быть получен по методу Chem. Pharm. Bull., 1985, 276. Реакционную смесь затем охлаждают до 20 С. После добавления 20 мл насыщенного водного раствора гидрокарбоната натрия органическую фазу отделяют декантацией, промывают водой и затем в течение 30 мин перемешивают с 900 г диоксида кремния (63-200 меш). Диоксид кремния после этого отфильтровывают и промывают 1,5 мл дихлорметана. После упаривания растворителя при пониженном давлении получают 270 г бурого масла, которое поглощает 800 мл циклогексана и 770 мл однонормального водного раствора метансульфокислоты. После декантации органическую фазу дважды промывают 200 мл воды. Объединенные водные фазы дважды промывают 200 мл циклогексана, затем нейтрализуют добавкой гидрокарбоната натрия и экстрагируют вначале 400 мл и затем дважды 200 мл этилацетата. Объединенные органические фазы промывают полунасыщенным раствором хлорида натрия, сушат над сульфатом натрия и упаривают при пониженном давлении. Получают 248 г (90%) метилового эфира 2-бензил-7-оксо 4-фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR,7aRS) в виде оранжевого масла со следующими характеристиками: спектр 1H ЯМР (300 МГц СDСl3, d в м.д.): 2,4-2,65 (м, 4 Н: Н в 5 и в 6); 2,85 (2 д, 2 Н: Н в 1); 3,02 (2 д, 2 Н: Н в 3); 3,2 (2 д, 1 Н: Н в 4); 3,35 (м 1 Н: Н в 7 а); 3,5 (2 д, 2 Н: Н бензильные); 7-7,3(м, 10 Н; ароматические). Стадия С. 5,1 мл 4-бромтолуола и 1 г магниевых стружек в 100 мл диэтилового эфира кипятят с обратным холодильником в течение 1 ч, добавляют 100 мл толуола и нагревают при 60 С в токе азота. После охлаждения до температуры,близкой к 5 С, добавляют раствор 10 г метилового эфира 2-бензил-7-оксо-4-фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR,7aRS) в 80 мл толуола. Реакционную смесь перемешивают в течение 1 ч при температуре около 20 С и затем гидролизуют 100 мл насыщенного водного раствора хлорида аммония. Водную фазу отделяют декантацией и дважды экстрагируют 75 мл этилацетата. Органические фазы объединяют, последовательно промывают 100 мл дистиллированной воды и 100 мл насы 002114 48 щенного водного раствора хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. После очистки флэшхроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексан-этилацетат(80/20 по объему) получают 9 г метилового эфира 2-бензил-7-гидрокси-7-(4-метилфенил)-4 фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR, 7RS,7aRS) в виде белого твердого вещества со следующими характеристиками: температура плавления 164 С спектр 1H ЯМР (250 МГц CDCl3, d в м.д.): 1,84 и 2,60 (д м и м, J=12,5 Гц, 1 Н каждый: СН 2 в 5); от 2,05 до 2,20 (м, 2 Н: 1 Н из СН 2 в 1 и 1 Н из СН 2 в 6); 2,32 (с, 3 Н: АrОН 3); 2,40 и 2,95 (2 д,J=10,5 Гц, 1 Н каждый: СН 2 в 3); 2,45 (м, 1 Н: другой Н из СН 2 в 6); 2,64 (м, 1 Н: другой Н из СН 2 в 1); 2,85 (м, 1 Н: Н в 7 а); 3,32 (с, 3 Н: СООСН 3); 3,40 и 3,70 (2 д, J= 12,5 Гц, 1 Н каждый:(3aRS,4SR,7RS,7aRS) в 200 мл дихлорметана при температуре около 0 С прибавляют по каплям смесь 29 мл трифторметансульфокислоты и 100 мл дихлорметана. Реакционную смесь перемешивают 30 мин при температуре, близкой к 0 С, затем 2 ч при температуре около 20 С и охлаждают до температуры, близкой к 0 С. После этого добавляют 50 мл дистиллированной воды и доводят рН водной фазы до величины между 8 и 9 добавкой водного 4 н. раствора гидроксида натрия. Органическую фазу отделяют декантацией, последовательно промывают 100 мл дистиллированной воды и 100 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. После перекристаллизации из изопропилового спирта получают 18,2 г метилового эфира 2-бензил-4,9-этано-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR,9SR,9aRS) в виде белого твердого вещества со следующими характеристиками: температура плавления 158 С спектр 1H ЯМР (300 МГц CDCl3, d в м.д.): 1,61-1,90 и 2,67 (3 м, соответственно 1 Н - 1 Н и 2 Н: СН 2 СН 2); от 2,50 до 2,60 (м, 2 Н: 1 Н из СН 2 в 1 и 1 Н СН 2 в 3); 2,57 (с, 3 Н: АrСН 3); 2,95 (д,J=10 Гц, другой Н из СН 2 в 1); 3,37 (Д, J=10 Гц,другой Н из СН 2 в 3); 3,44 (д уширенный, J=10 Гц, 1 Н: Н в 9 а); 3,54 и 3,85 (2 д, J=12,5 Гц, 1 Н каждый: NCH2Ar); 3,57 (с уширенный, 1 Н: Н в 4); 3,72 (с, 3 Н: СООСН 3); 6,70 (д уширенный,J=7,5 Гц, 1 Н: Н в 8); от 7,10 до 7,60 (м, 12 Н: Н в(3aRS,4SR,9SR,9aRS), растворенного в 250 мл метанола, восстанавливают с помощью 7,8 г формиата аммония в присутствии 2 г 10%-ного палладия на угле, нагревая смесь при кипении с-[4-[2-[гексагидро-1 Н-азепин-12 ч. После охлаждения катализатор отделяют фильтрованием, промывают трижды 50 мл метанола и упаривают фильтрат при пониженном давлении. Остаток растворяют в 200 мл этилацетата и органическую фазу последовательно промывают 100 мл насыщенного водного раствора гидрокарбоната натрия, 100 мл дистиллированной воды и 100 мл насыщенного водного раствора хлорида натрия,сушат над сульфатом магния и упаривают при пониженном давлении. Полученное масло кристаллизуют перемешиванием в 100 мл пентана. Отфильтровывают 13,2 г метилового эфира 4,9-этано-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества со следующими характеристиками: температура плавления 118 С спектр 1H ЯМР (250 МГц CDCl3, d в м.д.): 1,56-1,78 и 2,24 (3 м, соответственно 1 Н -1 Н и 2 Н: СН 2 СН 2); 2,42 (с, 3 Н: АrСН 3); 2,79 и 2,96 (2 дд, соответственно J=12,5 и 5,5 Гц и J=12,5 и 8 Гц, 1 Н каждый: СН 2 в 1); 3,10 и 3,39 (2 д, J=12,5 Гц, 1 Н каждый: СН 2 в 3); 3,30 (м, 1 Н: Н в 9 а); 3,51 (с уширенный, 1 Н: Н в 4); 3,60 (с, 3 Н: СООСН 3); 6,56 (д уширенный, J=7,5 Гц, 1 Н: Н в 8); от 6,95 до 7,45 (м, 7 Н: Н в 5 - Н в 6 - Н в 7 и Н в орто- и метаароматического ядра в 9). Стадия F. 36,6 г (2-метоксифенил)уксусной кислоты,суспендированной в 110 мл бис(диметиламино)метана, охлаждают до температуры,близкой к 0 С и прибавляют по каплям 110 мл уксусного ангидрида, следя чтобы температура реакционной смеси не превышала 40 С. После этого смесь перемешивают 24 ч при температуре 20 С и охлаждают до температуры, близкой к 0 С. Добавляют 500 мл дистиллированной воды и продолжают перемешивание в течение 2 ч при температуре, близкой к 0 С. Появившееся твердое вещество отфильтровывают, трижды промывают 100 мл дистиллированной воды и сушат при 40 С и пониженном давлении. Получают 23 г 2-(2-метоксифенил)пропеновой кислоты в виде кремового твердого вещества со следующими характеристиками: температура плавления 145 С спектр ЯМР 1H (200 МГц, ДМСО d6, d в м.д.): 3,74 (с, 3 Н: АrОСН 3); 5,71 и 6,15 (2 д, J=0,5 Гц, 1 Н каждый: =СН 2); от 6,90 до 7,50 (м, 4 Н: Н 50 ароматические); от 11,5 до 13,5 (м очень растянутый, 1 Н: СООН). Стадия G. К раствору 6,31 г 2-(2-метоксифенил) пропеновой кислоты в 150 мл дихлорметана,содержащего 5 капель N,N-диметилформамида,прибавляют по каплям раствор 3,05 мл оксалилхлорида в 150 мл дихлорметана. Реакционную смесь перемешивают еще 2 ч при температуре 20 С, затем охлаждают до температуры, близкой к 0 С и приливают по каплям в раствор 12,3 г метилового эфира 4,9-этано-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в 250 мл дихлорметана и 10 мл триэтиламина,поддерживая температуру, близкой к 0 С. Реакционную смесь перемешивают при этой температуре еще 1 ч, затем 1 ч при 20 С и выливают в 200 мл дистиллированной воды. Органическую фазу отделяют декантацией, дважды промывают 200 мл дистиллированной воды, затем 200 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. После очистки флэш-хроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексанэтилацетат (70/30 по объему) получают 14,9 г метилового эфира 4,9-этано-2-[2-(2-метоксифенил)пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества со следующими характеристиками: температура плавления 152 С спектр ЯМР 1H (250 МГц, ДМСО d6, при температуре 383 К, d в м.д.): 1,44-1,68 и от 2,00 до 2,30 (3 м, соответственно 1 Н -1 Н и 2 Н; СН 2 СН 2); 2,40 (с, 3 Н: АrСН 3); от 3,35 до 3,50 (м,3 Н: СН 2 в 1 и Н в 9 а); 3,46 (м, 1 Н: Н в 4); 3,55 (с,3 Н: СООСН 3); 3,60 и 4,10 (2 д, J=12,5 Гц, 1 Н каждый: СН 2 в 3); 3,73 (с, 3 Н: АrОСН 3); 5,54 и 5,70(2 с, 1 Н каждый: =СН 2); 6,46 (д уширенный,J=7,5 Гц, 1 Н: Н в 8); от 6,90 до 7,40 (м, 11 Н: Н в 5 - Н в 6 - Н в 7 - Н в орто и мета в ароматическом ядре в 9 и Н ароматические в орто, мета и пара к ОСН 3). Пример 2. Получение 4,9-этано-2-[2-(2 метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). 14,7 г метилового эфира 4,9-этано-2-[2-(2 метоксифенил)пропеноил]-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) кипятят с обратным холодильником в течение 6 ч в 400 мл этанола в присутствии 43,5 мл однонормального водного раствора гидроксида натрия. Затем реакционную смесь упаривают при пониженном давлении и остаток растворяют в 250 мл дистиллированной воды. Водную фазу трижды промывают 200 мл диэтилового эфира,затем подкисляют 4 н. соляной кислотой до рН 51 около 2. Появившиеся кристаллы отделяют фильтрацией, трижды промывают 400 мл дистиллированной воды, затем 200 мл петролейного эфира и сушат при пониженном давлении при 40 С. В результате получают 12,6 г 4,9 этано-2-[2-(2-метоксифенил)пропеноил]-9-(4 метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества со следующими характеристиками: температура плавления 142 С спектр ЯМР 1 Н (400 МГц, ДМСО d6, при температуре 413 К, d в м.д.): 1,42-1,65-2,00 и 2,15 (4 м, 1 Н каждый: СН 2 СН 2); 2,40 (с, 3 Н: АrСН 3); от 3,20 до 3,40 (м, 3 Н: СН 2 в 1 и Н в 9 а); 3,55 (м, 1 Н: Н в 4); 3,60 и 4,06 (2 д, J=12,5 Гц,1 Н каждый: СН 2 в 3); 3,68 (с, 3 Н: ОСН 3); 5,53 и 5,70 (2 с, 1 Н каждый: =СН 2); 6,45 (д уширенный,J=7,5 Гц, 1 Н: Н в 8); 6,95 (д уширенный, J=7,5 Гц, 1 Н: Н ароматический в пара и в ОСН 3); 7,03(д уширенный, J=7,5 Гц, 1 Н: Н ароматический в орто из ОСН 3); от 6,90 до 7,30 (м, 9 Н: Н в 5 - Н в 6 - Н в 7 и Н ароматические в мета к ОСН 3 и Н ароматические в орто- и метаароматического ядра в 9). Пример 3. Выделение правовращающего энантиомера 4,9-этано-2-[2-(2-метоксифенил) пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). 500 мг 4,9-этано-2-[2-(2-метоксифенил) пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) разделяют на колонке с хиральным диоксидом кремния, содержащим привитые группы (3,5-динитробензоил) S-фенилаланина, элюируя смесью дихлорметан/изопропиловый спирт/н-гептан(85/10/5 по объему). Отбирают вторую элюированную фракцию (время удерживания 60 мин),упаривают при пониженном давлении и получают 220 мг правовращающего энантиомера со следующими характеристиками: температура плавления 225 С масс-спектр (IE): M/Z = 493 (М+) и 449 (М+(с = 0,5/метанол) Хиральный диоксид кремния приготовляют следующим образом. В трехгорлой колбе объемом 6 л суспензируют 948 г аминопропилдиоксида кремния (100- 10 мкм - NH2; Macherey-Nagel) в 3 л N,Nдиметилформамида. Добавляют 180 г ангидридаN-трет-бутоксикарбониламино-11-ундекановой кислоты и перемешивают реакционную смесь 18 ч при температуре около 20 С. Диоксид кремния отфильтровывают и последовательно промывают 2 раза 2500 мл дихлорметана и 2 раза 2500 мл диметилформамида. Промытый диоксид кремния ресуспендируют в 3 л N,Nдиметилформамида и добавляют 180 г ангидри 002114 52 да N-трет-бутоксикарбониламино-11-ундекановой кислоты и перемешивают реакционную смесь в течение 18 ч при температуре около 20 С. Диоксид кремния отфильтровывают и последовательно промывают 2 раза 2500 мл дихлорметана, 2 раза 2500 мл тетрагидрофурана, 2 раза 2500 мл метанола и 2 раза 2500 мл диэтилового эфира, после чего сушат при пониженном давлении при температуре около 20 С. В результате получают 971 диоксида кремния,обозначаемого "БОК-С 11-С 3-диоксид кремния",в виде белого порошка, строение второго подтверждено ИК спектром и который имеет следующий элементный анализ (найдено): С% = 9,85; Н% = 2,05; N% = 1,05. В трехгорлой колбе объемом 6 л суспендируют 971 г диоксида кремния "БОК-С 11-С 3 диоксид кремния" в 2500 мл дихлорметана и 470 г имидазола. Прибавляют по каплям 850 мл диметилоктилхлорсилана и перемешивают реакционную смесь в течение 16 ч при температуре около 20 С. Полученный твердый продукт отфильтровывают и последовательно промывают 2 раза 2500 мл дихлорметана, 2 раза 2500 мл метанола, 2 раза 2500 мл тетрагидрофурана, 2 раза 2500 мл дихлорметана и 2 раза 2500 мл диэтилового эфира, после чего сушат при пониженном давлении при температуре около 20 С. Получают 1179 г диоксида кремния, обозначаемогоOSi(СН 3)2(СН 2)7 СН 3" в виде белого порошка,строение которого подтверждено ИК спектром и который имеет следующий элементный анализ (найдено): С% = 13,9; Н% = 2,83; N% = 1,16. В трехгорлой колбе объемом 6 л суспендируют 1178 г диоксида кремния "БОК-С 11-С 3 диоксид кремния O-Si(СН 3)2(СН 2)7 СН 3" в 2500 мл 5%-ного (по объему) раствора трифторуксусной кислоты в дихлорметане и перемешивают при 20 С. Диоксид кремния отфильтровывают и последовательно промывают 2 раза 2500 мл дихлорметана, 2 раза 2500 мл смеси дихлорметан/диизопропил-этиламин (70/30 по объему),2 paзa 2500 мл дихлорметана, 2 раза 2500 мл тетрагидрофурана, 2 раза 2000 мл метанола и 2 раза 2000 мл диэтилового эфира, после чего сушат при пониженном давлении при температуре около 50 С. Получают 1080,5 г диоксида кремния, обозначаемого "С 11-С 3-диоксид кремния-OSi(СН 3)2(СН 2)7 СН 3" в виде белого порошка,строение которого подтверждено ИК спектром и который имеет следующий элементный анализ (найдено): С% = 12,6; Н% = 2,44; N% = 1,05. В трехгорлой колбе объемом 6 л суспендируют 1080 г диоксида кремния "С 11-С 3-диоксид кремния-O-Si(СН 3)2(СН 2)7 СН 3" в 2500 мл N,Nдиметилформамида, высушенного на молекулярных ситах 4 . Добавляют 108 г N-бензоил 3,5-динитро-L-фенилаланина 75 г N-этоксикарбонил-2-этокси-1,2-дигидрохинолина и перемешивают реакционную смесь в течение ночи. Диоксид кремния отфильтровывают на фритти 53 рованном стекле и промывают 2 раза 2500 мл дихлорметана, 2 раза 2500 мл тетрагидрофурана, 2 раза 2500 мл N,N-диметилформамида и 2500 мл дихлорметана. Промытый диоксид кремния ресуспендируют в 2500 мл N,Nдиметилформамида, последовательно добавляют 108 г N-бензоил-3,5-динитро-L-фенилаланина и 75 г N-этоксикарбонил-2-этокси-1,2 дигидрохинолина и перемешивают в течение ночи при 20 С. Диоксид кремния отфильтровывают на фриттированном стекле и последовательно промывают 2 раза 2500 мл дихлорметана, 2 раза 2500 мл тетрагидрофурана, 2 раза 2500 мл метанола и 2 раза 2500 мл диэтилового эфира. После сушки при 60 С при пониженном давлении (2,7 кПа) получают 1093,6 г диоксида кремния, обозначаемого "ДНБ-L-РhеС 11-С 3 (диоксид кремния)-OSi(СН 3)2(СН 2)7 СН 3" в виде бледно-желтого порошка, строение которого подтверждено ИК спектром и который имеет следующий элементный анализ (найдено): С% = 14,5; Н% = 2,4; N% = 1,68. В трехгорлой колбе объемом 4 л суспендируют 519 г кремнезема "ДНБ-L-Рhе-С 11-С 3 (диоксид кремния)-OSi(СН 3)2(СН 2)7 СН 3" в 3000 млN,N-диметилформамида, высушенного на молекулярных ситах 4 . Добавляют в течение 15 мин 450 мл триметилсилилимидазола и перемешивают в течение ночи. Диоксид кремния отфильтровывают и последовательно промывают 2 раза 1500 мл тетрагидрофурана, 2 раза 1500 мл метанола, 2 раза 1500 мл ацетона и 2 раза 1500 мл дихлорметана. После сушки при температуре 60 С и пониженном давлении (2,7 кПа) получают 519 г диоксида кремния, обозначаемого "ДНБ-L-Рhе-С 11-С 3 (диоксид кремния)в виде[OSi(СН 3)2(СН 2)7 СН 3]-[O-Si(СН 3)3]" бледно-желтого порошка, строение которого подтверждено ИК спектром и который имеет следующий элементный анализ: С%=15,3; Н%= 1,8; N%=2,6. АнгидридN-трет-бутоксикарбонил-11 амино-ундекановой кислоты может быть получен следующим образом. 30,1 г N-трет-бутоксикарбонил-11-аминоундекановой кислоты растворяют в 480 мл этилацетата. Полученный раствор охлаждают до 5 С и затем, поддерживая эту температуру в течение 10 мин прибавляют раствор 10,63 г 1,3 дициклогексилкарбодиимида в 120 мл этилацетата. Реакционную смесь перемешивают 1 ч при 5 С и затем 16 ч при температуре около 20 С. Образовавшийся осадок отфильтровывают и промывают 30 мл этилацетата. Фильтрат досуха упаривают при пониженном давлении (2,7 кПа) при 30 С. Полученный твердый продукт сушат при 20 С и пониженном давлении (2,7 кПа). В результате получают при выходе, близком к 100%, 31 г ангидрида N-трет-бутоксикарбонил 11-амино-ундекановой кислоты.N-Трет-бутоксикарбонил-11-амино-ундекановая кислота может быть получена по методу J. Оrg. Chem., 41, 1350 (1976). Пример 4. Выделение левовращающего энантиомера 4,9-этано-2-[2-(2-метоксифенил) пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). 500 мг 4,9-этано-2-[2-(2-метоксифенил) пропеноил]-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) разделяют на колонке с хиральным диоксидом кремния, содержащим привитые группы (3,5-динитробензоил) S-фенилаланин, элюируя смесью дихлорметан/изопропиловый спирт/н-гептан(85/10/5 по объему). Отбирают первую элюированную фракцию (время удерживания 47 мин),упаривают при пониженном давлении и получают 240 мг левовращающего энантиомера со следующими характеристиками: температура плавления 225 С масс-спектр (IE): M/Z = 493 (М+) и 449 (М+= 0,5/метанол) Пример 5. Получение 4,9-этано-2-[(2 метоксифенил)ацетил]-9-(4-метилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). Стадия А. К раствору 755 мг (2,17 ммоль) метилового эфира 4,9-этано-9-(4-метилфенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS), полученного в стадии Е примера 1, в 20 мл дихлорметана последовательно добавляют 362 мг (2,17 ммоль) 2 метоксифенилуксусной кислоты, 456 мг (2,38 ммоль) гидрохлорида 1-этил-3-[(3-диметиламино)пропил]карбодиимида и 59 мг (0,43 ммоль) N-гидроксибензотриазолгидрата. После перемешивания в течение ночи при комнатной температуре добавляют 15 мл дихлорметана,дважды промывают 15 мл воды, сушат над сульфатом магния и упаривают растворитель при пониженном давлении. После очистки флэш-хроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексанэтилацетат (90/10 по объему) и последующим упариванием растворителя при пониженном давлении получают 820 мг (76%) метилового эфира 4,9-этано-2-[(2-метоксифенил)ацетил]-9(4-метилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 189 С масс-спектр (IE): M/Z = 495 (М+) Стадия В. Следуя процедуре примера 2, но, исходя из 819 мг (1,65 ммоль) метилового эфира 4,9 этано-2-[(2-метоксифенил)ацетил]-9-(4-метил 55 фенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR,9SR,9aRS), после кипячения с обратным холодильником в течение 18 ч в 17 мл однонормального водного раствора гидроксида натрия и 17 мл метанола и перекристаллизации из 25 мл диизопропилового эфира получают 720 мг(3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 182 С спектр ЯМР 1H (200 МГц, ДМСО d6, при температуре 423 К, d в м.д.): 1,40-1,64-1,95 и 2,10 (4 м, 1 Н каждый: СН 2 СH2); 2,41 (с, 3 Н: АrСН 3); от 3,30 до 3,65 (м, 6 Н: СН 2 в 1 NCOCH2Ar - 1 Н из СН 2 в 3 и Н в 9 а); 3,48 (м,1 Н: Н в 4); 3,75 (с, 3 Н: ОСН 3); 4,18 (д, J=12,5 Гц,1 Н; другой Н из СН 2 в 3); 6,46 (д уширенный,J=7,5 Гц, 1 Н: Н в 8); 6,90 (т уширенный, J=7,5 Гц, 1 Н: Н ароматический в пара к ОСН 3); 6,96 (д уширенный, J=7,5 Гц, 1 Н: Н ароматический в орто к ОСН 3); 7,00 7,35 (м, 5 Н: Н в 5 - Н в 6 - Н в 7 и Н ароматические в мета к ОСН 3); 7,30 (АВlimit, 4H: Н ароматические метаароматического ядра в 9). Пример 6. Получение 4,9-этано-9-(4 метоксифенил)-2-[(2-метоксифенил)ацетил]2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). Стадия А. 2,07 мл (16,5 ммоль) 4-броманизола и 402 мг (16,5 ммоль) магния в стружках в 20 мл диэтилового эфира кипятят 3 ч в атмосфере аргона. После охлаждения до 0 С добавляют 1,36 г(5,5 ммоль) безводного хлорида церия, вновь охлаждают, при температуре около 5 С в атмосфере аргона прибавляют по каплям раствор 2 г(5,5 ммоль) метилового эфира 2-бензил-7-оксо 4-фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR,7aRS), полученного в стадии В примера 1, в 5 мл сухого диэтилового эфира. Реакционную смесь перемешивают 1 ч при температуре около 0 С и затем в течение ночи при комнатной температуре. После охлаждения до 0 С реакционную смесь гидролизуют 15 мл насыщенного водного раствора хлорида аммония. Водную фазу отделяют декантацией и дважды экстрагируют 50 мл этилацетата. Органические фазы объединяют, последовательно промывают 25 мл дистиллированной воды и 25 мл насыщенного водного раствора хлорида натрия, сушат над сульфатом магния и упаривают при пониженном давлении. После очистки флэшхроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексан/этилацетат(60/40 по объему) получают 1,345 г (51%) метилового эфира 2-бензил-7-гидрокси-7-(4 метоксифенил)-4-фенилоктагидроизоиндол-3 акарбоновой кислоты (3aRS,4SR, 7RS,7aRS) в виде белого твердого вещества с т.пл. 136 С. 56 Стадия В. Следуя процедуре стадии D примера 1, но,исходя из 1,343 г (2,85 ммоль) метилового эфира 2-бензил-7-гидрокси-7-(4-метоксифенил)-4 фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR, 7RS,7aRS) и 4,56 мл трифторметансульфокислоты в 65 мл дихлорметана, в течение 30 мин при температуре около 0 С и затем в течение ночи при комнатной температуре,после очистки флэш-хроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексан-этилацетат (90/10 по объему), получают 863 мг (67%) метилового эфира 2 бензил-4,9-этано-9-(4-метоксифенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества с т.пл. 127 С. Стадия С. Следуя процедуре стадии Е примера 1, но исходя из 839 мг (1,85 ммоль) метилового эфира 2-бензил-4,9-этано-9-(4-метоксифенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) и 0,35 г(5,5 ммоль) формиата аммония в присутствии 0,27 г 10%-ного палладия на угле в 20 мл метанола, в течение 3 ч при кипячении с обратным холодильником получают после перемешивания полученной воздушной массы нагреваемых в 30 мл пентана, 559 мг (83%) метилового эфира 4,9 этано-9-(4-метоксифенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества с т.пл. 112 С. Стадия D. Следуя процедуре стадии А примера 5, но исходя из 548 мг (1,51 ммоль) метилового эфира 4,9-этано-9-(4-метоксифенил)-2,3,3 а,4,9,9 агексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS), 251 мг (1,51 ммоль) 2-метоксифенилуксусной кислоты, 318 мг (1,66 ммоль) гидрохлорида 1-этил-3-[(3 диметиламино)пропил]карбодиимида и 41 мг(0,3 ммоль) N-гидроксибензотриазолгидрата в 15 мл дихлорметана, после очистки флэшхроматографией на силикагеле (230-400 меш) с элюированием смесью циклогексан-этилацетат(90/10 по объему) получают 575 мг (75%) метилового эфира 4,9-этано-9-(4-метоксифенил)-2[(2-метоксифенил)ацетил]-2,3,3 а,4,9,9 а-гексагидро-1H-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 169 С масс-спектр (IE): M/Z = 511 (М+). Стадия Е. Следуя процедуре примера 2, но исходя из 566 мг (1,1 ммоль) метилового эфира 4,9-этано 9-(4-метоксифенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS), после кипячения с обратным холодильником в течение 18 ч в 11,5 мл однонормального водного раствора гидроксида 57 натрия с 7,5 мл метанола и перекристаллизации из 10 мл диизопропилового эфира получают 385 мг (70%) 4,9-этано-9-(4-метоксифенил)-2-[(2 метоксифенил)ацетил]-2,3,3 а,4,9,9 а-гексагидро 1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 163 С спектр ЯМР 1H (400 МГц, ДМСО d6, при температуре 393 К, d в м.д.): 1,36-1,61-1,90 и 2,07 (4 м, 1 Н каждый: CH2CH2); от 3,30 до 3,65(м, 6 Н: СН 2 в 1 - NCOCH2Ar - 1 Н из СН 2 в 3 и Н в 9 а); 3,46 (м, 1 Н: Н в 4); 3,73 (с уширенный, 3 Н; ОСН 3); 3,80 (с, 3 Н: ОСН 3 из ароматического ядра в 9); 4,15 (д, J=12,5 Гц, 1 Н: другой Н из СН 2 в 3); 6,45 (д уширенный, J=7,5 Гц, 1 Н: Н в 8); 6,90 (т уширенный, J=7,5 Гц, 1 Н: Н ароматический в пара к ОСН 3); 6,96 (д уширенный,J=7,5 Гц, 1 Н: Н ароматический в орто к ОСН 3); 7,06 (д, J=8 Гц, 2 Н: Н ароматические в орто к ОСН 3 в ароматическом ядре в 9); от 7,00 до 7,30(3aRS,4SR,9SR,9aRS). Стадия А. Следуя процедуре стадии А примера 6, но исходя из 1,34 г (6,6 ммоль) 4-бромтиоанизола и 161 мг (6,6 ммоль) магния в стружках, нагреваемых при кипячении с обратным холодильником в течение 3 ч в 4 мл диэтилового эфира и добавляемых последовательно 543 мг (2,2 ммоль) безводного хлорида церия и раствора 800 мг (2,2 ммоль) метилового эфира 2-бензил 7-оксо-4-фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR,7aRS), полученного в стадии В примера 1, в 2 мл диэтилового эфира,после очистки флэш-хроматографией на силикагеле (230-400 меш) с элюированием циклогексаном и затем смесью циклогексан-этилацетат(80/20 по объему), получают 679 г (63%) метилового эфира 2-бензил-7-гидрокси-7-(4-метилсульфанилфенил)-4-фенилоктагидроизоиндол 3 а-карбоновой кислоты (3aRS,4SR, 7RS,7aRS) в виде белого твердого вещества с т.пл. 124126 С. Стадия В. Следуя процедуре стадии D примера I, но исходя из 676 мг (1,39 ммоль) метилового эфира 2-бензил-7-гидрокси-7-(4-метилсульфанилфенил)-4-фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR, 7RS,7aRS) и 2,22 мл трифторметансульфокислоты в 34 мл дихлорметана,после реакции в течение 30 мин при температуре около 0 С и затем 70 ч при комнатной температуре с последующей очисткой флэшхроматографией на силикагеле (230-400 меш) с элюированием циклогексаном и затем смесью 58 циклогексан-этилацетат (90/10 по объему) получают 366 мг (56%) метилового эфира 2 бензил-4,9-этано-9-(4-метилсульфанилфенил)2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества с т.пл. 105107 С. Стадия С. Раствор 246 мг (0,52 ммоль) метилового эфира 2-бензил-4,9-этано-9-(4-метилсульфанилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR,9SR,9aRS) в 10 мл дихлорметана охлаждают до 0 С в атмосфере аргона, добавляют 115 мг (0,79 ммоль) 2-хлорэтилхлорформиата и перемешивают в течение ночи при комнатной температуре. Остаток, полученный после упаривания растворителя при пониженном давлении, кипятят с обратным холодильником 4 ч в 10 мл метанола,содержащего 1,5 мл 1 М метанольного раствора хлористого водорода. Образовавшиеся кристаллы отжимают, дважды промывают 1 мл ледяного метанола и затем нейтрализуют при перемешивании 10 мл децинормального раствора гидроксида натрия. После экстрагирования дихлорметаном и упаривания досуха получают 145 мг (62%) метилового эфира 4,9-этано-9-(4 метилсульфанилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белой массы с т.пл. 90-94 С. Стадия D. Следуя процедуре стадии А примера 5, но исходя из 145 мг (0,38 ммоль) метилового эфира 4,9-этано-9-(4-метилсульфанилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS), 64 мг(0,076 ммоль) N-гидроксибензотриазолгидрата в 5 мл дихлорметана, после очистки флэшхроматографией на силикагеле (230-400 меш) с элюированием смесями циклогексан-этилацетат(3aRS,4SR,9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 137 С масс-спектр (IE): M/Z = 527 (M+). Стадия Е. Следуя процедуре примера 2, но исходя из 180 мг (0,34 ммоль) метилового эфира 4,9 этано-2-[(2-метоксифенил)ацетил]-9-(4-метилсульфанилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS), после кипячения с обратным холодильником в течение 18 ч в 3,7 мл однонормального водного раствора гидроксида на 59 трия с 3,7 мл метанола и последующей перекристаллизации из 5 мл диизопропилового эфира получают 144 мг (81%) 4,9-этано-2-[(2 метоксифенил)ацетил]-9-(4-метилсульфанилфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR,9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 145 С спектр ЯМР 1H (250 МГц, ДМСО d6, при температуре 393 К, d в м.д.): 1,40-1,63-1,92 и 2,10 (4 м, 1 Н каждый: CH2CH2); 2,59 (с, 3 Н:(д, J=12,5 Гц, 1 Н другой Н и в СН 2 в 3); 6,48 (д уширенный, J=7,5 Гц, 1 Н: Н в 8); 6,92 (т уширенный, J=7,5 Гц, 1 Н: Н ароматический в пара к ОСН 3); 7,00 (д уширенный, J=7,5 Гц, 1 Н: Н ароматический в орто к ОСН 3); от 7,05 до 7,35 (м,5 Н: Н в 5 - Н в 6 - Н в 7 и Н ароматические в мета к ОСН 3); 7,35 и 7,45 (2 д уширенные, J=8 Гц, 2 Н каждый: Н ароматические в орто и мета ароматического ядра в 9). Пример 8. Получение 4,9-этано-9-(4 фторфенил)-2-[(2-метоксифенил)ацетил]2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS). Стадия А. Следуя процедуре стадии А примера 6, но исходя из 6,1 мл 1 М раствора 4-фторфенилмагнийбромида в диэтиловом эфире, к которому были последовательно добавлены 1,36 г (5,5 ммоль) безводного хлорида церия и раствор 2 г(230-400 меш) с элюированием циклогексаном и затем смесью циклогексан-этилацетат (60/40 по объему) получают 507 г (20%) метилового эфира 2-бензил-7-(4-фторфенил)-7-гидрокси-4 фенилоктагидроизоиндол-3 а-карбоновой кислоты (3aRS,4SR, 7RS,7aRS) в виде белого твердого вещества с т.пл. 163 С. Стадия В. Следуя процедуре стадии D примера 1, но исходя из 433 мг (0,94 ммоль) метилового эфира 2-бензил-7-(4-фторфенил)-7-гидрокси-4-фенилоктагидроизоиндол-3 а-карбоновой кислоты(3aRS,4SR, 7RS,7aRS) и 1,51 мл трифторметансульфокислоты в 20 мл дихлорметана, после реакции в течение 30 мин при температуре около 0 С и затем 70 ч при комнатной температуре с последующей очисткой флэш-хроматографией на силикагеле (230-400 меш) с элюированием циклогексаном и затем смесью циклогексанэтилацетат (90/10 по объему) получают 360 мг(3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества с т.пл. 157 С. Стадия С. Следуя процедуре стадии Е примера 1, но исходя из 358 мг (0,81 ммоль) метилового эфира 2-бензил-4,9-этано-9-(4-фторфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) и 153 мг(2,43 ммоль) формиата аммония в присутствии 120 мг 10%-ного палладия на угле в 20 мл метанола, после кипячения с обратным холодильником в течение 3 ч и перемешивания образовавшейся воздушной массы в 15 мл пентана получают 236 мг (83%) метилового эфира 4,9-этано 9-(4-фторфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Нбензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белого твердого вещества с т.пл. 163 С. Стадия D. Следуя процедуре стадии А примера 5, но исходя из 235 мг (0,67 ммоль) метилового эфира 4,9-этано-9-(4-фторфенил)-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол-3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS), 112 мг (0,67 ммоль) 2-метоксифенилуксусной кислоты, 142 мг (0,74 ммоль) гидрохлорида 1-этил-3-[(3 диметиламино)пропил]карбодиимида и 19 мг(0,076 ммоль) N-гидроксибензотриазолгидрата в 10 мл дихлорметана, после очистки флэшхроматографией на силикагеле (230-400 меш) с элюированием смесями циклогексан/этилацетат(90/10 и затем 80/20 по объему) получают 230 мг (68%) метилового эфира 4,9-этано-9-(4 фторфенил)-2-[(2-метоксифенил)ацетил]2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изоиндол 3 а-карбоновой кислоты (3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 216 С масс-спектр (IE); M/Z = 499 (М+). Стадия Е. Следуя процедуре примеру 2, но исходя из 228 мг (0,45 ммоль) метилового эфира 4,9 этано-9-(4-фторфенил)-2-[(2-метоксифенил)ацетил]-2,3,3 а,4,9,9 а-гексагидро-1 Н-бензо[f]изoиндол-3 а-карбоновой кислоты(3aRS,4SR,9SR,9aRS), после кипячения с обратным холодильником в течение 10 ч в 4,7 мл однонормального водного раствора гидроксида натрия и 5 мл метанола с последующей перекристаллизацией из 5 мл диизопропилового эфира получают 171 мг (77%) 4,9-этано-9-(4-фторфенил)-2-[(2 метоксифенил)ацетил]-2,3,3 а,4,9,9 а-гексагидро 1H-бензо[f]изоиндол-3 а-карбоновой кислоты(3aRS,4SR, 9SR,9aRS) в виде белого порошка со следующими характеристиками: температура плавления 250 С спектр ЯМР 1H (400 МГц, ДМСО d6, при температуре 423 К, d в м.д.): 1,40-1,64-1,95 и 2,10 (4 м, 1 Н каждый: CH2CH2); 2,41 (с, 3 Н: АrСН 3); от 3,30 до 3,65 (м, 6 Н: СH2 в 1 NCOCH2Ar - 1 Н из CH2 в 3 и Н в 9 а); 3,48 (м, 1
МПК / Метки
МПК: A61P 35/00, C07D 209/72, A61K 31/40
Метки: способы, композиции, медикаментов, фармацевтические, ингибиторы, новые, содержащие, применение, получения, фарнезилтрансферазы
Код ссылки
<a href="https://eas.patents.su/30-2114-novye-ingibitory-farneziltransferazy-sposoby-ih-polucheniya-soderzhashhie-ih-farmacevticheskie-kompozicii-i-ih-primenenie-dlya-polucheniya-medikamentov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ингибиторы фарнезилтрансферазы, способы их получения, содержащие их фармацевтические композиции и их применение для получения медикаментов.</a>
Предыдущий патент: Производные индазола и их использование в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и продуцирования фактора некроза опухоли (фно)
Следующий патент: Производные сахарин-5-карбонилциклогексан-1,3,5-трионов
Случайный патент: Производные пиразолов, способ их получения и применение в терапии












