Производные 2-адамантилмочевины в качестве селективных ингибиторов 11β-hsd1
Номер патента: 17923
Опубликовано: 30.04.2013
Авторы: Хок Бьёрн, Шарон Кристине, Карньято Денис, Глайтц Иоганнес, Роше Дидье
Формула / Реферат
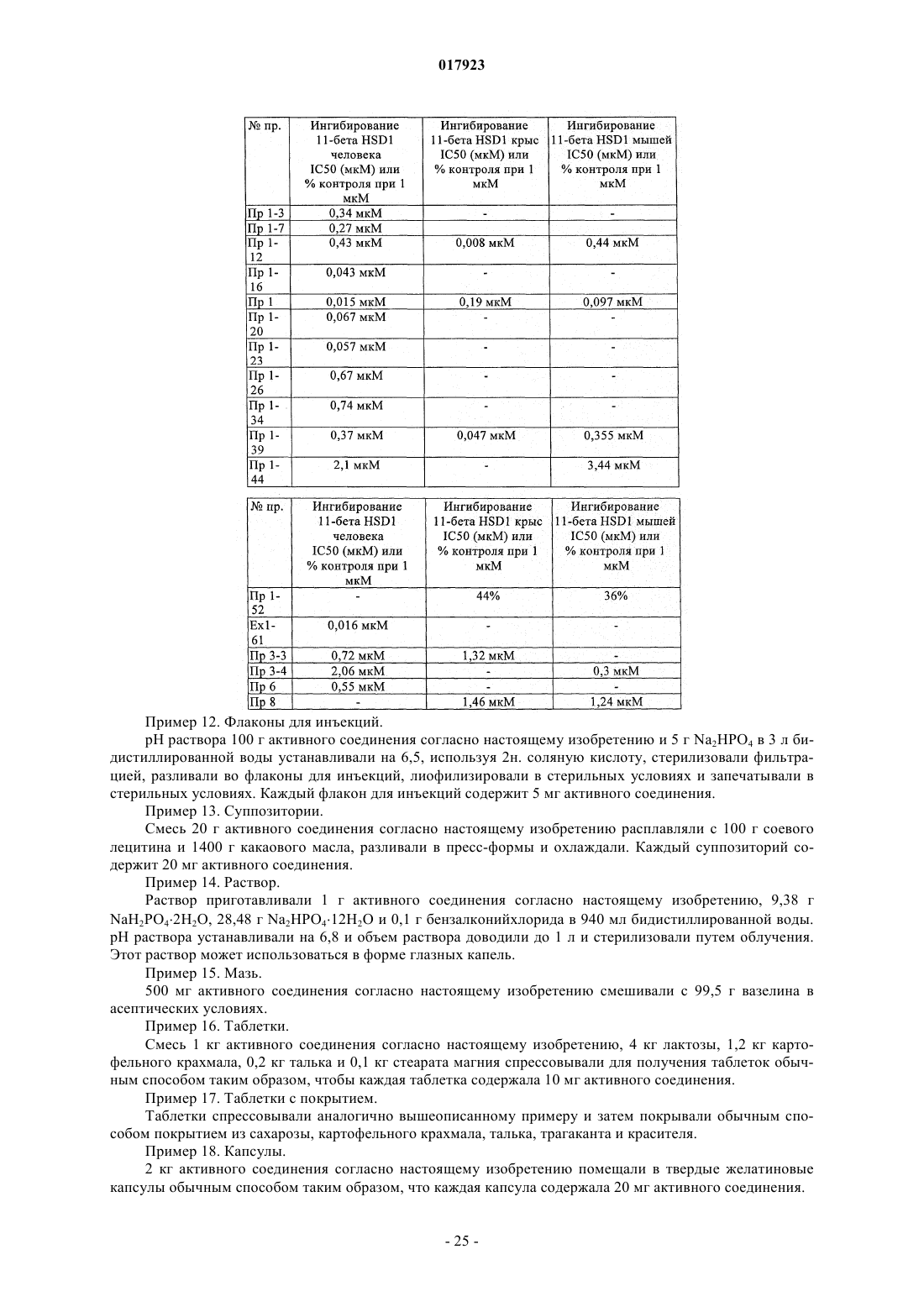
1. Соединение формулы I
в которой R1 представляет собой Н, ОН или OR8;
R2 представляет собой Н, метил, этил или изопропил, или R2, Y и атом N, к которому они присоединены, образуют насыщенное C5-C8 кольцо, необязательно замещенное R3, R4 и/или R5;
Y представляет собой простую связь или C1-C4-алкил или C1-C4-алкилокси;
W представляет собой циклопентил, фенил, нафтил, инданил, пиперидинил, пирролидинил, фуранил, имидазолил, пиридинил, тиофенил, триазолил, бенздиоксинил или изоксазолил, необязательно замещенный R3, R4 и/или R5;
R3, R4, R5 независимо друг от друга представляют собой Н, Hal, ОН, C1-C10-алкил, C1-C4-алкилокси, бензилокси, фенокси, фенил, трифторметил, дифторметокси, трифторметокси, трифторметилсульфанил, диметиламино, S(O)n(CH2)mCH3, C1-C4-алкилоксикарбонил, C1-C4-алкилкарбонил;
n представляет собой 0-2;
m представляет собой 1-3;
R8 представляет собой алкил, C(O)R9, C(O)NH2;
R9 представляет собой Н, C1-C8-алкил или C1-C8-циклоалкил,
и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях, при условии, что соединением формулы I не является 1-адамантил-2-ил-3-(3,5-дихлор-4-гидроксифенил)мочевина или N-(2-адамантил)-N'-2(фторфенил)мочевина.
2. Соединение по п.1, в котором R1 представляет собой Н, R2 представляет собой Н или метил, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях.
3. Соединение по п.1, в котором R1 представляет собой OR8, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях.
4. Соединение по любому из пп.1-3, в котором Y представляет собой простую связь, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях.
5. Соединение, выбранное из группы, включающей:
a) 1-адамантан-2-ил-3-(4-метокси-2-метилфенил)мочевину,
b) 1-адамантан-2-ил-3-(3-трифторметилфенил)мочевину,
c) 1-адамантан-2-ил-3-(3-хлорфенил)мочевину,
d) 1-адамантан-2-ил-3-(2-трифторметилфенил)мочевину,
e) 1-адамантан-2-ил-3-(2,3-дихлорфенил)мочевину,
f) 1-адамантан-2-ил-3-(3,5-бис-трифторметилфенил)мочевину,
g) этиловый эфир 2-(3-адамантан-2-ил-уреидо)бензойной кислоты,
h) 1-адамантан-2-ил-3-(3,5-диметоксифенил)мочевину,
i) 1-адамантан-2-ил-3-(4-хлор-2-трифторметилфенил)мочевину,
j) 1-адамантан-2-ил-3-(2,4,5-триметилфенил)мочевину,
k) 1-адамантан-2-ил-3-(4-бутоксифенил)мочевину,
l) бутиловый эфир 4-(3-адамантан-2-ил-уреидо)бензойной кислоты,
m) 1-адамантан-2-ил-3-фенетилмочевину,
n) диметиловый эфир 5-(3-адамантан-2-ил-уреидо)изофталевой кислоты,
о) 1-адамантан-2-ил-3-(2-метилсульфанилфенил)мочевину,
р) 1-адамантан-2-ил-3-бифенил-4-илмочевину,
q) 1-адамантан-2-ил-3-(2-тиофен-2-илэтил)мочевину,
r) 1-адамантан-2-ил-3-(4-бромфенил)мочевину,
s) 1-адамантан-2-ил-3-(3-хлор-4-метилфенил)мочевину,
t) 1-адамантан-2-ил-3-(3,4-диметилфенил)мочевину,
u) 1-адамантан-2-ил-3-(3-этилфенил)мочевину,
v) 1-адамантан-2-ил-3-(4-хлор-3-трифторметилфенил)мочевину,
w) 1-адамантан-2-ил-3-(4-йодфенил)мочевину,
х) 1-адамантан-2-ил-3-нафталин-2-илмочевину,
у) 1-адамантан-2-ил-3-(3-фтор-4-метилфенил)мочевину,
z) 1-адамантан-2-ил-3-(5-фтор-2-метилфенил)мочевину,
аа) 1-адамантан-2-ил-3-(2,6-дихлорпиридин-4-ил)мочевину,
bb) 1-адамантан-2-ил-3-(3,4-дифторфенил)мочевину,
cc) 1-адамантан-2-ил-3-(4-бензилоксифенил)мочевину,
dd) 1-адамантан-2-ил-3-(2-феноксифенил)мочевину,
ее) 1-адамантан-2-ил-3-(4-бром-2-фторфенил)мочевину,
ff) 1-адамантан-2-ил-3-(2,3,4-трифторфенил)мочевину,
gg) 1-адамантан-2-ил-3-(4-диметиламинофенил)мочевину,
hh) 1-адамантан-2-ил-3-(3-трифторметилсульфанилфенил)мочевину,
ii) 1-адамантан-2-ил-3-(3-метилбензил)мочевину,
jj) 1-адамантан-2-ил-3-(2-фтор-3-трифторметилфенил)мочевину,
kk) 1-адамантан-2-ил-3-(2,4-дибромфенил)мочевину,
ll) 1-адамантан-2-ил-3-(3,5-дихлор-2-гидрокси-4-метилфенил)мочевину,
mm) метиловый эфир 2-(3-адамантан-2-ил-уреидо)бензойной кислоты,
nn) 1-адамантан-2-ил-3-циклопентилмочевину,
оо) 1-адамантан-2-ил-3-(2-метоксифенил)мочевину,
рр) 1-адамантан-2-ил-3-(3-метилсульфанилфенил)мочевину,
qq) 1-адамантан-2-ил-3-(5-хлор-2-метоксифенил)мочевину,
rr) 1-(4-ацетилфенил)-3-адамантан-2-илмочевину,
ss) 1-адамантан-2-ил-3-фуран-2-илметилмочевину,
tt) 1-адамантан-2-ил-3-(4-метоксибензил)мочевину,
uu) 1-адамантан-2-ил-3-(4-хлорфенил)мочевину,
vv) 1-адамантан-2-ил-3-(4-метоксифенил)мочевину,
ww) 1-адамантан-2-ил-3-(2-фтор-5-метилфенил)мочевину,
хх) 1-адамантан-2-ил-3-(2,4-дифторфенил)мочевину,
уу) 1-(3-ацетилфенил)-3-адамантан-2-илмочевину,
zz) 1-адамантан-2-ил-3-(2-этоксифенил)мочевину,
ааа) метиловый эфир 4-(3-адамантан-2-ил-уреидо)бензойной кислоты,
bbb) 1-адамантан-2-ил-3-(2,4-диметоксифенил)мочевину,
ссс) 1-адамантан-2-ил-3-(2,5-диметоксифенил)мочевину,
ddd) 1-адамантан-2-ил-3-(3,4-диметоксифенил)мочевину,
еее) 1-адамантан-2-ил-3-(3-хлор-4-метоксифенил)мочевину,
fff) метиловый эфир 3-(3-адамантан-2-ил-уреидо)-2-метилбензойной кислоты,
ggg) 1-адамантан-2-ил-3-[2-(2,3-диметоксифенил)этил]мочевину,
hhh) 1-адамантан-2-ил-3-[2-(3,5-диметоксифенил)этил]мочевину,
iii) 1-адамантан-2-ил-3-(5-хлор-2,4-диметоксифенил)мочевину,
jjj) 1-адамантан-2-ил-3-((R)-1-фенилэтил)мочевину,
kkk) 1-адамантан-2-ил-3-(2-дифторметоксифенил)мочевину,
lll) 1-адамантан-2-ил-3-(4-дифторметоксифенил)мочевину,
mmm) 1-адамантан-2-ил-3-(6-фтор-4Н-бензо[1,3]диоксин-8-ил)мочевину,
nnn) 1-адамантан-2-ил-3-тиофен-3-илмочевину,
ооо) 1-адамантан-2-ил-3-(4-фторфенил)мочевину,
ррр) 1-адамантан-2-ил-3-(3-метоксифенил)мочевину,
qqq) 1-адамантан-2-ил-3-(4-фтор-3-метилфенил)мочевину,
rrrr) 1-адамантан-2-ил-3-(4-метилсульфанилфенил)мочевину,
sss) 1-адамантан-2-ил-3-(4-этоксифенил)мочевину,
ttt) метиловый эфир 3-(3-адамантан-2-ил-уреидо)бензойной кислоты,
uuu) 1-адамантан-2-ил-3-(3-метил-5-фенилизоксазол-4-ил)мочевину,
vvv) 1-адамантан-2-ил-3-(1-фенилэтил)мочевину,
www) 1-адамантан-2-ил-3-[1-(4-метоксифенил)этил]мочевину,
ххх) 1-(5-гидроксиадамантан-2-ил)-3-(4-метокси-2-метилфенил)мочевину,
ууу) 1-адамантан-2-ил-3-(2-гидрокси-1-фенилэтил)мочевину,
zzz) 1-адамантан-2-ил-3-индан-1-илмочевину,
аааа) адамантан-2-иламид пирролидин-1-карбоновой кислоты,
bbbb) адамантан-2-иламид пиперидин-1-карбоновой кислоты,
сссс) адамантан-2-иламид 3-метилпиперидин-1-карбоновой кислоты,
dddd) 1-адамантан-2-ил-3-(1Н-[1,2,4]триазол-3-ил)мочевину,
ееее) 3-адамантан-2-ил-1-метил-1-(2-пиридин-2-илэтил)мочевину,
ffff) 4-[2-(3-адамантан-2-ил-1-метилуреидо)этокси]бензойную кислоту,
ggggg) метиловый эфир 4-[2-(3-адамантан-2-ил-1-метилуреидо)этокси]бензойной кислоты,
hhhh) 3-(3-адамантан-2-ил-уреидо)-2-метилбензойную кислоту,
iiii) 2-(3-адамантан-2-ил-уреидо)бензойную кислоту,
jjjj) 4-(3-адамантан-2-ил-уреидо)бензойную кислоту,
kkkk) 1-адамантан-2-ил-3-(4-гидрокси-2-метилфенил)мочевину,
llll) 1-адамантан-2-ил-3-(2-метил-4-(2-пиперидин-1-илэтоксил)фенил)мочевину,
mmmm) 4-[((S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир уксусной кислоты,
nnnn) 4-[((S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир циклоциклогексанкарбоновой кислоты,
оооо) 4-[((S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир 2,2-диметилпропионовой кислоты,
и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях.
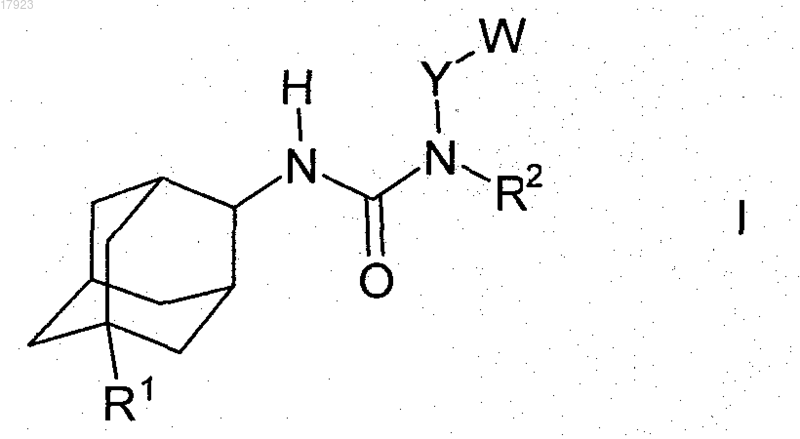
6. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с изоцианатом формулы III, в которой Y, R3, R4 и R5 имеют значения, указанные в п.1
где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли.
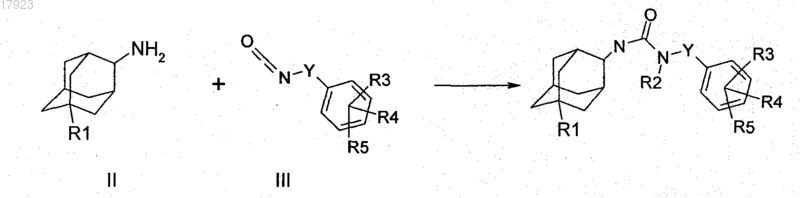
7. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантилизоцианат формулы IV, в которой R1 имеет значения, указанные в п.1, взаимодействует с амином формулы V, в которой Y, R2, R3, R4 и R5 имеют значения, указанные в п.1
где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли.
8. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с карбонилдиимидазолом, с получением соответствующего ацилимидазола формулы VI, и этот ацилимидазол взаимодействует с амином формулы V, в которой Y, R2, R3, R4 и R5 имеют значения, указанные в п.1
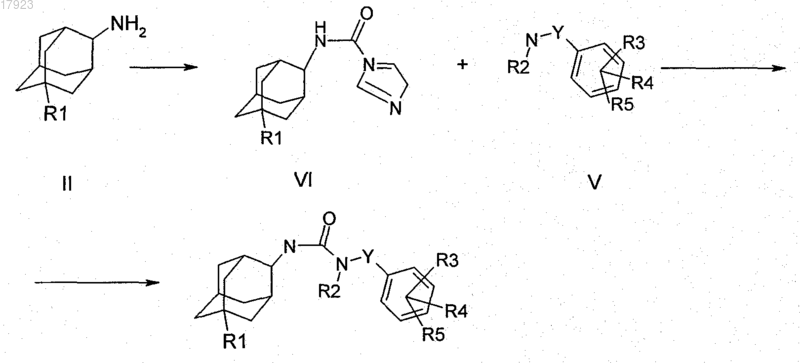
где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли.
9. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что производное адамантилмочевины формулы VII, в которой Y, R1, R2, R3 и R4 имеют значения, указанные в п.1, обрабатывают с получением соответствующего фенола
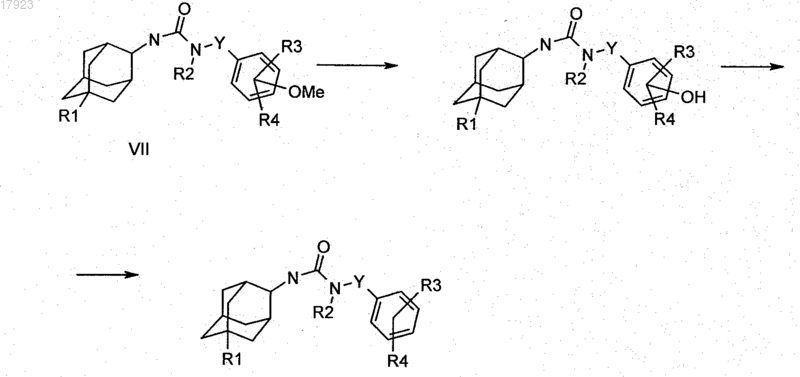
где при необходимости остаток R1, R2, R3 и/или R4 превращают в другой остаток R1, R2, R3 и/или R4, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли.
10. Применение соединения по любому из пп.1-5 в качестве ингибитора 11β-HSD1.
11. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства для лечения и/или профилактики заболеваний, которые вызываются, опосредуются и/или распространяются высокими уровнями кортизола.
12. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства для лечения и/или профилактики одного или нескольких заболеваний или состояний, выбранных из группы, включающей метаболический синдром, диабет, в особенности инсулиннезависимый сахарный диабет, преддиабет, резистентность к инсулину, низкую переносимость глюкозы, гипергликемию, ожирение и нарушения, связанные с избыточным весом, нарушения обмена липидов, такие как дислипидемия, гиперлипидемия, гипертриглицеридемия, гиперхолестеринемия, низкие уровни ЛВП или высокие уровни ЛНП, глаукому, остеопороз, опосредованные глюкокортикоидом действия на функцию нейронов, такие как познавательные расстройства, тревога или депрессия, нейродегенеративное заболевание, иммунные нарушения, такие как туберкулез, проказа или псориаз, гипертонию, атеросклероз и его последствия, рестеноз сосудов, сердечно-сосудистые заболевания, панкреатит, ретинопатию, невропатию и нефропатию.
13. Фармацевтическая композиция, отличающаяся тем, что она содержит терапевтически эффективное количество одного или более соединений по любому из пп.1-5.
14. Фармацевтическая композиция по п.11, отличающаяся тем, что она содержит одно или несколько дополнительных соединений, выбранных из группы, включающей физиологически приемлемые наполнители, вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные компоненты, отличающиеся от соединений по любому из пп.1-5.
15. Комплект (набор), состоящий из отдельных пакетов:
a) терапевтически эффективного количества одного или нескольких соединений по любому из пп.1-5 и
b) терапевтически эффективного количества одного или нескольких дополнительных фармацевтически активных компонентов, отличающихся от соединений по любому из пп.1-5.
16. Способ приготовления фармацевтической композиции, отличающийся тем, что одно или несколько соединений по любому из пп.1-5 и одно или несколько соединений, выбранных из группы, включающей твердые, жидкие или полужидкие наполнители, вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные компоненты, отличающиеся от соединений по любому из пп.1-5, превращают в подходящую дозированную форму.
Текст
ПРОИЗВОДНЫЕ 2-АДАМАНТИЛМОЧЕВИНЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ ИНГИБИТОРОВ 11-HSD1 Настоящее изобретение относится к производным 2-адамантилмочевины формулы I в качестве селективных ингибиторов фермента 11-бета-гидроксистероид-дегидрогеназа 1 типа (11-HSD1) и к применению таких соединений для лечения и профилактики метаболического синдрома, диабета, резистентности к инсулину, ожирения, нарушений обмена липидов,глаукомы, остеопороза, расстройств познавательной способности, тревоги, депрессии, иммунных нарушений, гипертонии и других заболеваний и состояний.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область техники, к которой относится изобретение Настоящее изобретение относится к производным 2-адамантилмочевины в качестве селективных ингибиторов фермента 11-бета-гидроксистероид дегидрогенеза 1 типа (11-HSD1) и к применению таких соединений для лечения и профилактики метаболического синдрома, диабета, резистентности к инсулину, ожирения, нарушений обмена липидов, глаукомы, остеопороза, расстройств познавательной способности, тревоги, депрессии, иммунных нарушений, гипертонии и других заболеваний и состояний. Предпосылки созданий изобретения Гидроксистероид дегидрогеназы (HSD) регулируют использование и активацию рецепторов стероидных гормонов путем превращения стероидных гормонов в их неактивные метаболиты. Для обзора последних исследований см. Nobel и др., Eur. J. Biochem. 2001, 268: 4113-4125. Существуют различные классы HSDs. 11-бета-Гидроксистероид дегидрогеназы (11-HSDs) катализируют взаимопревращение активных глюкокортикоидов (таких как кортизол и кортикостерон) и их инертных форм (таких как кортизон и 11-дегидрокортикостерон). Изоформа 11-бета-гидроксистероиддегидрогеназы 1 типа (11-HSD1) широко в большом количестве экспрессируется в печени, жировой ткани, головном мозге, легких и других глюкокортикоидных тканях, тогда как экспрессия изоформы 2(11-HSD2) ограничивается тканями, которые экспрессируют минералокортикоидный рецептор, такими как почки, кишка и плацента. Поэтому ингибирование 11-HSD2 связано с тяжелыми побочными действиями, такими как гипертония. Экспрессия кортизола связана с различными заболеваниями, включая диабет, ожирение, дислипидемию, резистентность к инсулину и гипертонию. Введение ингибиторов 11-HSD1 снижает уровень кортизола и других 11-гидроксистероидов в целевых тканях, уменьшая таким образом действия избыточных количеств кортизола и других 11-гидроксистероидов. Следовательно, 11-HSD1 является потенциальной мишенью для терапии, связанной с различными заболеваниями, которые могут быть облегчены путем уменьшения действия глюкокортикоидов. Таким образом, ингибирование 11-HSD1 можно использовать для предотвращения, лечения или контролирования заболеваний, опосредованных чрезмерно высокими уровнями кортизола и других 11-гидроксистероидов, таких как диабет, ожирение, гипертония или дислипидемия. Ингибирование активности 11-HSD1 в головном мозге, которое приводит к снижению уровня кортизола, также может быть полезным для лечения или уменьшения тревоги, депрессии, познавательных расстройств или возрастного нарушения познавательной функции (Seckl и др.,Endocrinology, 2001, 142: 1371-1376). Кортизол является важным и хорошо изученным противовоспалительным гормоном, который также действует как антагонист по отношению к действию инсулина в печени, уменьшая таким образом чувствительность к инсулину, что приводит к повышению глюконеогенеза и повышенным уровням глюкозы в печени. Для пациентов с нарушенной переносимостью глюкозы существует большая вероятность развития диабета 2 типа в присутствии чрезмерно высоких уровней кортизола (Long и др., J. Exp. Med. 1936, 63: 465-490; Houssay, Endocrinology, 1942, 30: 884-892). Дополнительно, было подробно доказано,что 11-HSD1 играет важную роль в регуляции локального действия глюкокортикоидов и образования глюкозы в печени (Jamieson и др., J. Endocrinol. 2000, 165: 685-692). В Walker и др., J. Clin. Endocrinol.Metab. 1995, 80: 3155-3159, было описано, что введение неспецифического ингибитора 11-HSD1 карбеноксолона приводит к улучшению чувствительности к инсулину в печени у людей. Кроме того, гипотетический механизм действия 11-HSD1 при лечении диабета был подтвержден в различных экспериментах, проведенных на мышах и крысах. В этих исследованиях было показано, что уровни мРНК и активности двух ключевых ферментов для образования глюкозы в печени, фосфоенолпируват-карбоксикиназы (PEPCK) и глюкозо-6-фосфатазы (G6P-азы) уменьшаются при введении ингибиторов 11-HSD1. Дополнительно, было показано, что уровни глюкозы в крови и образования глюкозы в печени уменьшены у мышей с "выключенной" 11-HSD1. Дополнительные данные, собранные с помощью мышиной "выключенной" модели, также подтверждают тот факт, что ингибирование 11-HSD1 не будет вызывать гипогликемии, поскольку исходные уровни PEPCK и G6P-азы регулируются независимо от глюкокортикоидов (Kotelevtsev и др., Proc. Natl. Acad. Sci. USA 1997, 94: 14924-14929). Таким образом, введение терапевтически эффективного количества ингибитора 11-HSD1 является эффективным для лечения, контролирования и облегчения симптомов диабета, в особенности инсулиннезависимого диабета (NIDDM, сахарный диабет 2 типа) и регулярное введение терапевтически эффективного количества ингибитора 11-HSD1 замедляет или предотвращает проявление диабета, в особенности у людей. Действие повышенных уровней кортизола также наблюдали у пациентов с синдромом ИценкоКушинга, который представляет собой нарушение обмена веществ, характеризующееся высокими концентрациям кортизола в кровотоке. У пациентов с синдромом Иценко-Кушинга часто развивается инсулиннезависимый сахарный диабет (NIDDM). Избыточные уровни кортизола также связаны с ожирением, возможно, вследствие повышения глюконеогенеза в печени. Абдоминальное ожирение тесно связано с непереносимостью глюкозы, диабетом,-1 017923 гиперинсулинемией, гипертриглицеридемией и другими факторами метаболического синдрома, такими как высокое кровяное давление, повышение ЛОНП и снижение ЛВП (Montague и др., Диабет, 2000, 49: 883-888). Также было описано, что ингибирование 11-HSD1 в преадипоцитах (стромальных клетках) приводит к снижению скорости дифференциации в адипоциты. Это прогнозированно приводит к снижению распространения (возможному уменьшению) сальникового жирового депо, что может приводить к снижению центрального ожирения (Bujalska и др., Lancet, 1997, 349: 1210-1213). Таким образом, введение эффективного количества ингибитора 11-HSD1 полезно для лечения или контролирования ожирения. Продолжительное лечение с помощью ингибитора 11-HSD1 также является полезным для замедления или предотвращения проявления ожирения, в особенности, если пациент использует ингибитор 11-HSD1 в комбинации с диетой и физической нагрузкой. Путем уменьшения резистентности к инсулину и поддержания нормальных концентраций глюкозы в сыворотке крови соединения согласно настоящему изобретению также являются полезными для лечения и предотвращения состояний, которые сопровождают диабет 2 типа и резистентность к инсулину,включая метаболический синдром, ожирение, реактивную гипогликемию и диабетическую дислипидемию. Ингибирование 11-HSD1 в зрелых адипоцитах, как ожидают, будет ослаблять секрецию ингибитора 1 активатора плазминогена (PAI-1), который является независимым фактором риска сердечнососудистых заболеваний, как описано в Halleux и др., J. Clin. Endocrinol. Metab. 1999, 84: 4097-4105. Дополнительно, было показано, что существует взаимосвязь между активностью глюкокортикоидов и определенными факторами риска сердечно-сосудистых заболеваний. Это подтверждает тот факт, что уменьшение действий глюкокортикоидов будет являться полезным для лечения или предотвращения определенных сердечно-сосудистых заболеваний (Walker и др., Hypertension 1998, 31: 891-895; и Fraser и др., Hypertension, 1999, 33: 1364 1368). Поскольку гипертония и дислипидемия способствуют развитию атеросклероза, а ингибирование активности 11-HSD1 и уменьшение количества кортизола являются благоприятными для лечения или контролирования гипертонии, то введение терапевтически эффективного количества ингибитора 11HSD1 согласно настоящему изобретению также может быть особенно благоприятным для лечения, контролирования или замедления проявления или предотвращения атеросклероза. 11-HSD1 также вовлечен в процесс контроля аппетита и, следовательно, полагают, что он играет дополнительную роль в нарушениях, связанных с избыточным весом. Известно, что адреналэктомия ослабляет влияние голодания как на повышение потребления пищи, так и на экспрессию нейтропептида Y в гипоталамусе. Это подтверждает тот факт, что глюкокортикоиды принимают участие в активации потребления пищи и что ингибирование 11-HSD1 в головном мозге может повышать сытость и таким образом приводить к снижению потребления пищи (Woods и др., Science 1998, 280: 1378-1383). Другое возможное терапевтическое действие, связанное с модуляцией 11-HSD1, относится к различным компонентам поджелудочной железы. Описано, что ингибирование 11-HSD1 в мышиных клетках поджелудочной железы повышает стимулированную глюкозой секрецию инсулина (Davani и др.,J. Biol. Chem. 2000, 275: 34841-34844). Это следует из вышеописанного открытия, что глюкокортикоиды отвечают за уменьшение высвобождения поджелудочной железой инсулина в условиях in vivo (Billaudel и др., Horm. Metab. Res. 1979, 11: 555-560). Таким образом, подтверждается тот факт, что ингибирование 11-HSD1 будет приводить к другим благоприятным действиям для лечения диабета, отличающимся от предсказанных действий на печень и уменьшение уровня липидов. Чрезмерные уровни кортизола в головном мозге также могут приводить к разрушению или нарушению функций нейронов путем потенцирования нейротоксинов. Введение эффективного количества ингибитора 11-HSD1 приводит к уменьшению, улучшению, контролированию или предотвращению познавательных расстройств, связанных со старением и нарушением функции нейронов. Познавательные расстройства связаны со старением и чрезмерными уровнями кортизола в головном мозге (см. J.R. Seckl и В.R. Walker, Endocrinology, 2001, 142: 1371 1376, и ссылки, процитированные в этом источнике). 11HSD1 также регулирует активность глюкокортикоидов в головном мозге и таким образом влияет на нейротоксичность (Rajan и др., Neuroscience 1996, 16: 65-70; Seckl и др., Necroendocrinol. 2000, 18: 49-99). Известно влияние стресса и/или глюкокортикоидов на познавательную функцию (de Quervain и др., Nature 1998, 394: 787-790), и неопубликованные результаты указывают на значительное улучшение памяти у крыс, которых лечили неспецифическим ингибитором 11-HSD1. Эти результаты, дополнительно к известным действиям глюкокортикоидов в головном мозге, свидетельствуют о том, что ингибирование 11-HSD1 в головном мозге может обладать положительным терапевтическим действием для лечения тревоги, депрессии и сходных состояний (Tronche и др., Nature Genetics, 1999, 23: 99-103). 11-HSD1 восстанавливает 11-дегидрокортикостерон до кортикостерона в гипокампальных клетках и может потенцировать нейротоксичность киназы, что приводит к нарушениям обучаемости, связанным со старением. Следовательно, полагают, что селективные ингибиторы 11-HSD1 защищают от снижения функции гипокампа при старении (Yau и др., Proc. Natl. Acad. Sci. USA, 2001, 98: 4716-4721). Следовательно, суще-2 017923 ствует гипотеза, что ингибирование 11-HSD1 в головном мозге человека будет защищать от опасных опосредованных глюкокортикоидами действий на функцию нейронов, таких как познавательные расстройства, депрессия и повышенный аппетит. Кроме того, полагают, что 11-HSD1 принимает участие в иммуномодуляции на основе общего представления о том, что глюкокортикоиды подавляют иммунную систему. Известно о существовании функционального взаимодействия между иммунной системой и осью НРА (гипоталамус-гипофизнадпочечники) (Rook, Baillier's Clin. Endocrinol. Metab. 2000, 13: 576-581), и глюкокортикоиды помогают поддержать равновесие между опосредованными клетками ответными реакциями и гуморальными ответными реакциями. Повышенная активность глюкокортикоидов, которая может быть индуцирована стрессом, связана с гуморальным ответом и, по существу, ингибирование 11-HSD1 может приводить к сдвигу ответной реакции по направлению к ответным клеточным реакциям. При определенных болезненных состояниях, таких как туберкулез, проказа и псориаз, и даже в условиях избыточного стресса,высокая активность глюкокортикоидов сдвигает ответную иммунную реакцию, если в действительности клеточная ответная реакция может быть более благоприятной для пациента. Ингибирование активности 11-HSD1 и сопутствующее уменьшение уровней глюкокортикоидов с другой стороны сдвигает ответную иммунную реакцию в направлении клеточной ответной реакции (D. Mason, Immunology Today, 1991,12: 57-60 и G.A.Vt. Rook, Baillier's Clin. Endocrinol. Metab., 1999, 13: 576-581). В таком случае, альтернативная полезность ингибирования 11-HSD1 будет проявляться в поддержке временной иммунной ответной реакции в ассоциации с иммунизацией для обеспечения получения клеточной ответной реакции. Результаты последних исследований свидетельствуют от том, что уровни рецепторов-мишеней глюкокортикоидов и HSD связаны с чувствительностью к глаукоме (J. Stokes и др., Invest. Ophthalmol. 2000, 41: 1629-1638). Дополнительно, недавно было сообщено о связи между ингибированием 11-HSD1 и снижением внутриглазного давления (Walker и др., постер Р 3-698 на Конференции эндокринологов 1215 июля, 1999 г., San Diego). Показано, что введение неспецифического ингибитора 11-HSD1 карбеноксолона приводит к уменьшению внутриглазного давления на 20% у нормальных пациентов. В глазах 11-HSD1 экспрессируется только в базальных клетках эпителия роговицы, непигментированном эпителии роговицы (участке продуцирования воды), ресничной мышце, сфинктере и расширяющих мышцах радужной оболочки. В отличие от этого отдаленный изофермент 11-гидроксистероид-дегидрогеназа 2 типа ("11-HSD2") значительно экспрессируется в непигментированном реснитчатом эпителии и эндотелии роговицы. В трабекулярной сети не было обнаружено HSD, которая является участком дренажа. Следовательно, установлено, что 11-HSD1 принимает участие в образовании воды и ингибирование активности 11-HSD1 полезно для уменьшения внутриглазного давления для лечения глаукомы. Глюкокортикоиды также имеют большое значение для развития и функционирования скелета, но их избыточное количество является вредным для такого развития и функционирования. Индуцированная глюкокортикоидами потеря костной массы частично обусловливается подавлением пролиферации остеобластов и синтеза коллагена, как описано в С.Н. Kim и др., J. Endocrinol. 1999, 162: 371-379. Было описано, что отрицательное воздействие глюкокортикоидов на образование костных узлов может уменьшаться при введении карбеноксолона, который является неспецифическим ингибитором 11-HSD1 (С.G. Bellows и др., Bone 1998, 23: 119-125). Дополнительные исследования подтверждают тот факт, что 11HSD1 может отвечать за повышенные уровни активного глюкокортикоида в остеокластах и, следовательно, за увеличение резорбции кости (М.S. Cooper и др., Bone 2000, 27: 375-381). Эти данные подтверждают, что ингибирование 11-HSD1 может иметь благоприятное воздействие при остеопорозе посредством одного или нескольких механизмов, которые могут действовать параллельно. Ингибиторы 11-HSD1 известны, например, из WO 0410629, WO 03065983, WO 04089896,WO 04089380, WO 04065351, WO 04033427 или WO 04041264. Однако производные 2 адамантилмочевины не описаны в качестве действующих ингибиторов 11-HSD1. Производные адамантилмочевины описаны, например, в US 4349552 или WO 03078400. Однако раскрытие этих публикаций не охватывает производных 2-адамантилмочевины согласно настоящему изобретению, а также не охватывает применения раскрытых соединений в качестве ингибиторов 11HSD1. Следовательно, поскольку существует настоятельная потребность в эффективных лекарственных средствах, то предпочтительным объектом настоящего изобретения является обеспечение новых фармацевтически активных соединений для лечения таких заболеваний, как диабет, ожирение, глаукома, остеопороз, расстройства познавательной способности, иммунные нарушения, депрессия, гипертония и другие. Цитирование любой ссылки в данном патенте не является подтверждением того, что эта ссылка относится к уже известному уровню техники. Сущность изобретения Неожиданно было обнаружено, что соединения согласно настоящему изобретению являются очень активными ингибиторами 11-HSD1. Следовательно, вариантом осуществления настоящего изобретения являются соединения формулы IY представляет собой простую связь или C1-C4-алкил или C1-С 4-алкилокси;R3, R4, R5 независимо друг от друга представляют собой Н, Hal, ОН, C1-С 10-алкил, C1-C4-алкилокси,бензилокси, фенокси, фенил, трифторметил, дифторметокси, трифторметокси, трифторметилсульфанил,диметиламино, S(O)n(CH2)mCH3, C1-C4-алкилоксикарбонил, C1-С 4-алкилкарбонил;R9 представляет собой Н, C1-C8-алкил или C1-C8-циклоалкил,и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. Предпочтительным вариантом осуществления настоящего изобретения являются соединения в соответствии с формулой I, в которойR1 представляет собой Н,R2 представляет собой Н или метил,и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения являются соединения в соответствии с формулой I, в которой R1 представляет собой OR8, и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения являются соединения в соответствии с формулой I, в которой Y представляет собой простую связь, и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. Другим особенно предпочтительным вариантом осуществления настоящего изобретения являются соединения формулы I, выбранные из группы, включающей:nnnn) 4-[S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир циклоциклогексанкарбоновой кислоты; оооо) 4-[S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир 2,2 диметилпропионовой кислоты и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. Номенклатура, применяемая в настоящем изобретении для обозначения соединений, в особенности соединений в соответствии с изобретением, в целом основывается на правилах Международного союза теоретической и прикладной химии (IUPAC) для химических соединений и, в особенности, для органических соединений."Алкил", а также другие группы, имеющие префикс "алк", такие как алкокси и алканоил, обозначает углеродные цепи, которые могут быть линейными или разветвленными, и их комбинации, если углеродная цепь не определена по-другому. Примерами алкильных групп являются метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил, октил, нонил и другие. Если указанное количество атомов углерода ограничено, например, от C3-C10, термин алкил также включает циклоалкильные группы, и комбинации линейных или разветвленных алкильных цепей в комбинации с циклоалкильными структурами. Если не указано количество атомов углерода, то подразумевается C1-C6. Особенно предпочтительный C1-C4-алкил. C1-C4-алкильный радикал представляет собой, например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил.C4-C8-циклоалкил представляет собой подкласс алкила и понимается как насыщенный моноциклический углеводород, содержащий от 4 до 8 атомов углерода. Примерами циклоалкила являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и другие. Циклоалкильная группа, как правило, является моноциклической, если специально не указано иначе. Циклоалкильные группы являются насыщенными, если специально не указано иначе. C1-C8-циклоалкильный радикал представляет собой, например, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил. Термин "C1-C4-алкилокси" обозначает алкоксигруппы прямоцепочечной или разветвленной конфигурации, имеющие указанное количество атомов углерода. C1-C4-алкилокси представляет собой, например, метокси, этокси, пропокси, изопропокси и другие. Термин " C1-C4-алкилоксикарбонил" относится к сложноэфирным производным прямоцепочечных или разветвленных карбоновых кислот согласно настоящему изобретению с 1-4 С атомами, т.е. метилоксикарбонилу (МеОСО-), этилоксикарбонилу или бутилоксикарбонилу. Термин " C1-C4-алкилкарбонил" относится к прямоцепочечному или разветвленному алкилу с 1-4 С атомами и группой карбоновой кислоты."Арил" обозначает моно- или полициклическую ароматическую кольцевую систему, содержащую кольцевые атомы углерода. Предпочтительные арилы представляют собой моноциклические или бициклические 6-10-членные ароматические кольцевые системы. Примерами "арильных" групп являются, но не ограничиваясь только ими, фенил, 2-нафтил, 1-нафтил, бифенил, инданил, а также их замещенные производные. Наиболее предпочтительным арилом является фенил."Гетероцикл" и "гетероциклил" относится к насыщенным или ненасыщенным неароматическим кольцам или кольцевым системам, содержащим по меньшей мере один гетероатом, выбранный из О, S иN, дополнительно включающим окисленные формы серы, а именно SO и SO2. Примерами гетероциклов являются тетрагидрофуран (ТГФ), дигидрофуран, 1,4-диоксан, морфолин, 1,4-дитиан, пиперазин, пиперидин, 1,3-диоксолан, имидазолидин, имидазолин, пирролин, пирролидин, тетрагидропиран, дигидропиран, оксатиолан, дитиолан, 1,3-диоксан, 1,3-дитиан, оксатиан, тиоморфолин и другие."Гетероарил" обозначает ароматический или частично ароматический гетероцикл, который содержит по меньшей мере один кольцевой гетероатом, выбранный из О, S и N. Таким образом, гетероарилы включают гетероарилы, сопряженные с кольцами других типов, таких как арилы, циклоалкилы и гетероциклы, которые не являются ароматическими. Примеры гетероарильных групп включают пирролил, изоксазолил, изотиазолил, пиразолил, пиридил, оксазолил, оксадиазолил, тиадиазолил, тиазолил, имидазолил, триазолил, тетразолил, фуранил, триазинил, тиенил, пиримидил, бензизоксазолил, бензоксазолил,бензотиазолил, бензотиадиазолил, дигидробензофуранил, индолинил, пиридазинил, индазолил, изоксазолил, изоиндолил, дигидробензотиенил, индолизинил, циннолинил, фталазинил, хиназолинил, нафтиридинил, карбазолил, бенздиоксинил, бенздиоксолил, хиноксалинил, пуринил, фуразанил, тиофенил, изобензилфуранил, бензимидазолил, бензофуранил, бензтиенил, хинолил, индолил, изохинолил, дибензофуранил и другие. Для гетероциклильных и гетероарильных групп охватываются кольца и кольцевые сис-6 017923 темы, содержащие 3-15 атомов, образующие 1-3 кольца. Термин "Hal" относится к фтору, хлору, брому и йоду. Более предпочтительными являются хлор и фтор. Наиболее предпочтительным является фтор, когда галогены являются заместителями на алкильной или алкоксигруппе (например, CF3 и CF3O). Термин "алкилсульфонил" относится к прямоцепочечным или разветвленным алкилсульфонам с указанным количеством атомов углерода (например, С 1-6 алкилсульфонил), или любым количеством в этом интервале [т.е. метилсульфонил (MeSO-), этилсульфонил, изопропилсульфонил и т.д.]. Термин "композиция", как используется в фармацевтической композиции, охватывает продукт, содержащий активный(е) компонент(ы) и инертный(е) компонент(ы), который(е) составляют носитель, а также любой продукт, который образуется, прямо или косвенно, при комбинации, комплексообразовании или агрегации двух или более компонентов, или при диссоциации одного или более компонентов, или при реакциях других типов или взаимодействий двух или более компонентов. Следовательно, фармацевтические композиции согласно настоящему изобретению охватывают любую композицию, получаемую при смешивании соединения согласно настоящему изобретению и фармацевтически приемлемого носителя. Термины "вводить" и "введение" соединения должны пониматься как обеспечение соединением по изобретению или пролекарством соединения по изобретению особи, которая в этом нуждается. Как используется в настоящем изобретении, термин "эффективное количество" обозначает то количество лекарства или фармацевтического средства, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которую пытаются достичь, например, исследователь или лечащий врач. Кроме того, термин "фармацевтически эффективное количество" обозначает любое количество, которое, по сравнению с соответствующим пациентом, которому не вводили такого количества, приводит к улучшению лечения, восстановления, профилактике или уменьшению интенсивности симптомов заболевания, расстройства или побочного действия, или уменьшению скорости распространения заболевания или расстройства. Термин также включает количества, эффективные для усиления нормальной физиологической функции. Соединения структурной формулы I могут содержать один или несколько ассиметричных центров и, следовательно, могут встречаться в виде рацематов и рацемических смесей, отдельных энантиомеров,диастереомерных смесей и индивидуальных диастереомеров. Настоящее изобретение охватывает все такие изомерные формы соединений структурной формулы I. Некоторые из соединений, описанных в настоящем патенте, содержат олефиновые двойные связи и, если специально не указано иначе, включают Е и Z геометрические изомеры. Некоторые из соединений, описанных в данном изобретении, могут существовать в виде таутомеров, таких как кето-енольные таутомеры. Отдельные таутомеры, а также их смеси подпадают под соединения структурной формулы I. Соединения структурной формулы I могут быть разделены на отдельные диастереоизомеры, например, путем фракционированной кристаллизации из подходящего растворителя, например метанола; или этилацетата или их смеси, или путем хиральной хроматографии, используя оптически активную неподвижную фазу. Абсолютная стереохимия может быть определена путем рентгеновской кристаллографии кристаллических продуктов или промежуточных кристаллических продуктов, которые являются производными, при необходимости, с реагентом,содержащим ассиметричный центр известной абсолютной конфигурации. Альтернативно, любой стереоизомер соединения общей структурной формулы I может быть получен путем стереоспецифичного синтеза, используя оптически чистые исходные вещества или реагенты с известной абсолютной конфигурацией. В другом аспекте изобретения предлагается фармацевтическая композиция I, содержащая соединение согласно структурной формуле I или его фармацевтически приемлемую соль либо сольват, в комбинации с фармацевтически приемлемым носителем. Под термином "сольват" понимают гидрат, алкоголят или другой сольват кристаллизации. Дальнейшим вариантом осуществления настоящего изобретения является способ получения соединений согласно настоящему изобретению, который характеризуется тем, что: а) адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с изоцианатом формулы III, в которой Y, R3, R4 и R5 имеют значения, указанные в п.1, или с) адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с карбонилдиимидазолом, с получением соответствующего ацилимидазола формулы VI, и ацилимидазол взаимодействует с амином формулы V, в которой Y, R2, R3, R4 и R5 имеют значения, указанные в п.1, илиd) производное адамантилмочевины формулы VII, в которой Y, R1, R2, R3, R4 и R5 имеют значения,указанные в п.1, обрабатывают с получением соответствующего фенола, и фенол алкилируют диалкиламиноэтилхлоридом, илиf) соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли. Все неочищенные продукты подвергают стандартной хроматографии, используя смеси растворителей, содержащие метанол, этанол, изопропанол, н-гексан, циклогексан или петролейный эфир соответственно. Более подробное описание способов получения приведено также в примерах и последующем общем описании предпочтительных условий. Физиологически приемлемая соль соединения в соответствии с формулой I также может быть получена путем выделения и/или обработки соединения формулы I, полученного с помощью описанной реакции с кислотой или основанием. Соединения формулы I, а также исходные вещества для их получения могут, кроме того, быть получены при помощи методов, описанных в примерах, или методов, известных per se, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der Organischen Chemie[Методы органической химии], Georg-Thieme-Verlag, Штутгарт; Organic Reactions, John WileySons,Inc., New York), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные модификации, которые известные per se, но о которых здесь подробно не упоминается. При необходимости, исходные вещества для заявленного способа также могут образовываться insitu таким образом, что они не выделяются из реакционной смеси, но затем они непосредственно преобразуются в соединения формулы I. С другой стороны, возможно поэтапное осуществление этой реакции. Предпочтительно взаимодействие соединений осуществляют в присутствии подходящего растворителя, который предпочтительно является инертным в соответствующих условиях реакции. Примерами подходящих растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, тетрахлорметан,хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран(ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир или этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА) или N-метилпирролидинон (NMP); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей или смеси с водой. Как правило, предпочтительными являются полярные растворители. Примерами подходящих полярных растворителей являются хлорированные углеводороды, спирты, гликолевые эфиры, нитрилы, амиды и сульфоксиды или их смеси. Более предпочтительными являются и амиды, в особенности диметилформамид (ДМФА). Как указано выше, температура реакции находится в интервале от -100 до 300 С в зависимости от стадии реакции и используемых условий. Время реакций обычно находится в интервале от нескольких минут до нескольких дней, в зависимости от реакционной способности соответствующих соединений и соответствующих условий реакций. Подходящие продолжительности реакций легко можно определить с помощью методов, известных в данной области, например, мониторинга реакций. Исходя из температур реакций, описанных выше, подходящие продолжительности реакций, как правило, находятся в интервале от 10 мин до 48 ч. Основание формулы I может быть превращено с применением кислоты в связанную кислотноаддитивную соль, например, путем реагирования эквивалентных количеств основания и кислоты предпочтительно в инертном растворителе, таком как этанол, с последующим упариванием. Приемлемыми кислотами для этой реакции являются, в частности, такие, которые образуют физиологически приемлемые соли. Таким образом, представляется возможным использовать неорганические кислоты, например серную кислоту, сернистую кислоту, дитионовую кислоту, азотную кислоту, галогеноводородные кислоты, такие как соляная кислота или бромисто-водородная кислота, фосфорные кислоты, такие как, например, ортофосфорная кислота, сульфаминовую кислоту, кроме того, органические кислоты, в частности алифатические, алициклические, аралифатические, ароматические или гетероциклические одноосновные или многоосновные карбоновые, сульфоновые или серные кислоты, например муравьиная кислота, уксусная кислота, пропионовая кислота, гексановая кислота, октановая кислота, декановая кислота, гескадекановая кислота, октадекановая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота,никотиновая кислота, изоникотиновая кислота, метан- или этансульфоновая кислота, этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, триметоксибензойная кислота, адамантанкарбоновая кислота, п-толуолсульфоновая кислота, гликолевая кислота, эмбоновая кислота,хлорфеноксиуксусная кислота, аспарагиновая кислота, глутаминовая кислота, пролин, глиоксиловая кислота, пальмитиновая кислота, парахлофеноксиизомасляная кислота, циклогексанакарбоновая кислота,глюкоза-1-фосфат, нафталинмоно- и дисульфоновые кислоты или лаурилсульфоновая кислота. Соли с физиологически неприемлемыми кислотами, например пикраты, могут применяться для выделения и/или очистки соединений формулы I. С другой стороны, соединения формулы I могут быть превращены в соответствующие соли металла, в особенности соли щелочного металла или щелочно-земельного металла, или в соответствующие аммониевые соли, используя основания (например, гидроксид натрия, гидроксид калия, карбонат натрия или карбонат калия). Подходящими солями, кроме того, являются замещенные аммониевые соли, например диметил-, диэтил- и диизопропиламмониевые соли, моноэтанол-, диэтанол- и диизопропаноламмониевые соли, циклогексил- и дициклогексиламмониевые соли, дибензилэтилендиаммониевые соли, а также, например, соли с аргинином или лизином. Если это является желательным, то свободные основания формулы I могут высвобождаться из их солей путем обработки сильными основаниями, такими как гидроксид натрия, гидроксид калия, карбонат натрия или карбонат калия, до тех пор, пока других кислотных групп не останется в молекуле. В тех случаях, когда соединения формулы I имеют свободные кислотные группы, соль можно образовывать также путем обработки основаниями. Подходящими основаниями являются гидроксиды щелочных металлов,гидроксиды щелочно-земельных металлов или органические основания в виде первичных, вторичных или третичных аминов. После каждой стадии реакции, описанной в настоящем изобретении, необязательно можно осуществлять одну или несколько обычных обработок или выделений. Методики, которые являются подходящими для такой обработки, известны в данной области техники, например, описаны в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Способы органической химии], GeorgThieme-Verlag, Штутгарт. Примерами таких методик являются, но не ограничиваясь только ими, выпаривание растворителя, перегонка, кристаллизация, фракционированная кристаллизация, экстракция, промывание, методики расщепления, фильтрация, хроматография, ВЭЖХ и методики обезвоживания, в особенности высушивание в вакууме и/или при повышенных температурах. Соединения, описанные в настоящем изобретении, являются селективными ингибиторами фермента 11-HSD1. Следовательно, настоящее изобретение относится к применению соединений согласно настоящему изобретению для ингибирования редуктазной активности 11-гидроксистероид-дегидрогеназы 1, которая отвечает за превращение кортизона в кортизол. Ингибиторы 11-HSD1 структурной формулы I обычно имеют константу ингибирования IC50 меньше чем приблизительно 500 нМ и предпочтительно меньше чем приблизительно 100 нМ. Как правило, IC50 соотношение 11-HSD2 к 11-HSD1 соединения составляет по меньшей мере около двух или больше и предпочтительно около десяти или больше. Еще более предпочтительными являются соединения с IC50 соотношением для 11-HSD2 к 11-HSD1 около 20 или больше. Например, соединения согласно настоящему изобретению идеально проявляют константу ингибирования IC50 по отношению к 11-HSD2 больше чем приблизительно 1000 нМ и предпочтительно больше чем 5000 нМ. Настоящее изобретение охватывает применение ингибитора 11-HSD1 для лечения, контролирования, улучшения, предотвращения, задержки начала или уменьшения риска развития заболеваний и состояний, которые описаны в настоящем изобретении, как опосредуемые чрезмерными или неконтролируемыми количествами кортизола и/или других кортикостероидов у пациента-млекопитающего, в особенности человека, путем введения эффективного количества соединения структурной формулы I или его фармацевтически приемлемой соли или сольвата. Ингибирование 11-HSD1 фермента ограничивает превращение кортизона, который обычно является инертным, в кортизол, который может вызывать или способствовать симптомам этих заболеваний и состояний, если он присутствует в чрезмерных количествах. Следовательно, предпочтительным вариантом осуществления настоящего изобретения является применение соединения согласно настоящему изобретению в качестве ингибитора 11-HSD1. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения является применение соединения согласно настоящему изобретению для приготовления лекарственного средства. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения является применение соединения согласно настоящему изобретению для приготовления лекарственного средства для лечения и/или профилактики заболеваний, которые вызываются, опосредуются и/или распространяются повышенными уровнями кортизола. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения является применение соединения согласно настоящему изобретению для приготовления лекарственного средства для лечения и/или профилактики одного или нескольких заболеваний или состояний, выбранных из группы,включающей метаболический синдром, диабет, в особенности инсулиннезависимый сахарный диабет,преддиабет, резистентность к инсулину, низкая переносимость глюкозы, гипергликемия, ожирения и нарушения, связанные с избыточным весом, нарушения обмена липидов, такие как дислипидемия, гиперлипидемия, гипертриглицеридемия, гиперхолестеринемия, низкие уровни ЛВП или высокие уровни ЛНП, глаукому, остеопороз, опосредованные глюкокортикоидом действия на функцию нейронов, такие как познавательные расстройства, тревога или депрессия, нейродегенеративное заболевание, иммунные нарушения, такие как туберкулез, проказа или псориаз, гипертония, атеросклероз и его последствия, рестеноз сосудов, сердечно-сосудистые заболевания, панкреатит, ретинопатия, невропатия и нефропатия. В другом варианте осуществления изобретения раскрыт способ лечения состояния, выбранного из группы, включающей гипергликемию, низкую переносимость глюкозы, резистентность к инсулину,ожирение, нарушения обмена липидов, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни MEL, высокие уровни ЛНП, атеросклероз и его последствия, рестеноз сосудов, панкреатит, абдоминальное ожирение, нейродегенеративное заболевание, ретинопатию,невропатию, нефропатию, метаболический синдром, гипертонию и другие состояния и расстройства,компонентом которых является резистентность к инсулину, у пациента-млекопитающего, нуждающегося в таком лечении, который включает введение пациенту соединения в соответствии со структурной формулой I в количестве, которое эффективно для лечения указанного состояния. В другом аспекте изобретения раскрыт способ замедления начала состояния, выбранного из группы, включающей гипергликемию, низкую переносимость глюкозы, резистентность к инсулину, ожирение, нарушения обмена липидов, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни EMIL, высокие уровни ЛНП, атеросклероз и его последствия, рестеноз сосудов, панкреатит, абдоминальное ожирение, нейродегенеративное заболевание, ретинопатию, невропа- 10017923 тию, нефропатию, метаболический синдром, гипертонию и другие состояния и расстройства, компонентом которых является резистентность к инсулину у пациента-млекопитающего, нуждающегося в таком лечении, который включает введение пациенту соединения в соответствии со структурной формулой I в количестве, которое эффективно для замедления начала указанного состояния. Дальнейшим предпочтительным вариантом осуществления настоящего изобретения является фармацевтическая композиция, характеризующая тем, что она содержит терапевтически эффективное количество одного или нескольких соединений в соответствии с изобретением. Дальнейший вариант осуществления настоящего изобретения относится к фармацевтической композиции, которая характеризуется тем, что она дополнительно содержит одно или несколько дополнительных соединений, выбранных из группы, включающей физиологически приемлемые наполнители,вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные компоненты, отличающиеся от соединений соединения в соответствии с изобретением. Дополнительным предпочтительным вариантом осуществления настоящего изобретения является комплект (набор), состоящий из отдельных пакетов:a) терапевтически эффективного количества одного или нескольких соединений в соответствии с изобретением иb) терапевтически эффективного количества одного или нескольких дополнительных фармацевтически активных компонентов, отличающихся от соединений в соответствии с изобретением. Соединения структурной формулы I могут применяться в комбинации с одним или несколькими другими лекарственными средствами для лечения, предотвращения, подавления или облегчения заболеваний или состояний, для которых являются полезными соединения структурной формулы I или другие лекарственные средства. Обычно комбинация лекарственных средств является более безопасной или более эффективной, чем отдельное применение любого лекарственного средства, или комбинация является более безопасной или более эффективной, по сравнению с предполагаемой, исходя из аддитивных свойств отдельных лекарственных средств. Такое(ие) другое(ие) лекарственное(ые) средство(а) может(могут) вводиться путем и в количестве, обычно используемом одновременно или последовательно с соединением структурной формулы I. Если соединение структурной формулы I используют одновременно с одним или несколькими другими лекарственными средства, то предпочтительным является комбинированный продукт, содержащий такое(ие) другое(ие) лекарственное(ые) средство(а) и соединение структурной формулы I. Тем не менее, комбинированная терапия также включает терапии, при которых соединение структурной формулы I и одно или несколько других лекарственных средств вводятся по различным перекрывающимся схемам. Также рассматривается вариант при использовании в комбинации с другими активными компонентами, когда соединение согласно настоящему изобретению или другой активный компонент или оба могут эффективно использоваться в более низких дозах по сравнению с отдельным применением каждого средства. Следовательно, фармацевтические композиции согласно настоящему изобретению включают композиции, содержащие один или несколько других активных компонентов, дополнительно к соединению структурной формулы I. Примерами других активных компонентов, которые могут вводиться в комбинации с соединением структурной формулы I, отдельно или в составе той же фармацевтической композиции, включают, но не ограничиваясь только ими: ингибиторы дипептидил пептидазы IV (DP-IV); средства, повышающие чувствительность к инсулину, включаяPPAR агонисты, такие как глитазоны (например, троглитазон, пиоглитазон, энглитазон, МСС-555, росиглитазон и др.) и другие PPAR лиганды, включая PPAR/ двойственные агонисты, такие как KRP-297,и PPAR агонисты, такие как гемфиброзил, клофибрат, фенофибрат и безафибрат, и бигуаниды, такие как метформин и фенформин; инсулин или миметики инсулина; сульфонилмочевины и другие стимуляторы секреции инсулина, такие как толбутамид, глипизид, меглитинид и родственные вещества; ингибиторы -глюкозидазы, такие как акарбоза; антагонисты рецептора глюкагона, такие как соединения, раскрытые в WO 98/04528, WO 99/01423, WO 00/39088 и WO 00/69810; GLP-1, GLP-1 аналоги, и агонисты рецептора GLP-1, такие как соединения, раскрытые в WO 00/42026 и WO 00/59887; GIP, миметики GIP,такие как соединения, раскрытые в WO 00/58360, и агонисты рецептора GIP; РАСАР, РАСАР миметики,и агонисты РАС АР рецептора 3, такие как соединения, раскрытые в WO 01/23420; средства, снижающие уровень холестерина, такие как ингибиторы HMG-CoA редуктазы (ловастатин, симвастатин, правастатин, церивастатин, флувастатин, аторвастатин, итавастатин, росувастатин и другие статины), стимуляции секреции желчных кислот (холестирамин, холестипол и диалкиламиноалкильные производные перекрестно-сшитого декстрана), никотиниловый спирт, никотиновая кислота или ее соль, ингибиторы абсорбции холестерина, такие как эзетимиб и бета-цитостерол, ингибиторы ацил СоА:холестерин ацилтрансферазы, такие как, например, авасимиб, и антиоксиданты, такие как пробукол; PPAR8 агонисты, такие как соединения, раскрытые в WO 97/28149; соединения для лечения ожирения, такие как фенфлурамин, декстенфлурамин, фентермин, сибутрамин, орлистат, антагонисты нейтропептида Y1 или Y5, обратные агонисты и антагонисты рецептора СВ 1, агонисты адренергического рецептора, агонисты рецептора меланокортина, в особенности агонисты рецептора меланокортина-4, антагонисты грелина, и антагонисты рецептора меланиноконцентрирующего гормона (МСН); ингибиторы переноса желчных кислот в под- 11017923 вздошной кишке; средства, предназначенные при применения при воспалительных состояниях, отличающиеся от глюкокортикоидов, такие как аспирин, нестероидные противовоспалительные лекарственные средства, азилфидин, и селективные ингибиторы циклооксигеназы-2; ингибиторы белковой тирозинфосфатазы 1 В (РТР-1B); гипотензивные средства, включая средства, действующие на системы ангиотензина или ренина, такие как ингибитор ангиотензинпревращающего фермента, антагонисты рецептора ангиотензина II или ингибиторы ренина, такие как каптоприл, цилазаприл, эналаприл, фозиноприл, лизиноприл, хинаприл, рамаприл, зофеноприл, кандесартан, цилексетил, эпросартан, ирбесартан, лосартан,тазосартан, телнисартан и валсартан; и ингибиторы белка-переносчика сложного эфира холестерина(СЕТР). Вышеописанные комбинации включают соединение структурной формулы I, или его фармацевтически приемлемую соль или сольват, с одним или несколькими другими активными соединениями. Неограничивающими примерами являются комбинации соединений структурной формулы I с двумя или более активными соединениями, выбранными из бигуанидов, сульфонилмочевин, ингибиторов HMGСоА редуктазы, PPAR агонистов, РТР-1 В ингибиторов, DP-IV ингибиторов и соединений для лечения ожирения. В другом аспекте изобретения раскрыт способ уменьшения риска развития состояния, выбранного из группы, включающей гипергликемию, низкую переносимость глюкозы, резистентность к инсулину,ожирение, нарушения обмена липидов, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни ЛВП, высокие уровни ЛНП, атеросклероз и его последствия, рестеноз сосудов, панкреатит, абдоминальное ожирение, нейродегенеративное заболевание, ретинопатию,невропатию, нефропатию, метаболический синдром, гипертонию и другие состояния и расстройства,компонентом которых является резистентность к инсулину у пациента-млекопитающего, нуждающегося в таком лечении, который включает введение пациенту соединения в соответствии со структурной формулой I в количестве, которое эффективно для уменьшения риска развития указанного состояния. В другом аспекте изобретения способ лечения состояния, выбранного из группы, включающей гипергликемию, низкую переносимость глюкозы, резистентность к инсулину, ожирение, нарушения обмена липидов, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкие уровни ЛВП, высокие уровни ЛНП, атеросклероз и его последствия, рестеноз сосудов, панкреатит, абдоминальное ожирение, нейродегенеративное заболевание, ретинопатию, невропатию, нефропатию, метаболический синдром, гипертонию и другие состояния и расстройства, компонентом которых является резистентность к инсулину, у пациента-млекопитающего, нуждающегося в таком лечении, который включает введение пациенту эффективного количества соединения, как определено в структурной формуле I, и соединения, выбранного из группы, включающей: ингибиторы дипептидил пептидазы-IV (DPIV); средства, повышающие чувствительность к инсулину, выбранные из группы, включающей PPAR агонисты, PPAR агонисты, PPAR/ двойственные агонисты и бигуаниды; инсулин и миметики инсулина; сульфонилмочевины и другие стимуляторы секреции инсулина; ингибиторы -глюкозидазы; антагонисты рецептора глюкагона; GLP-1, GLP-1 аналоги и агонисты GLP-1 рецептора; GIP, GIP миметики и агонисты GIP рецептора; РАСАР, РАСАР миметики и агонисты РАСАР рецептора 3; средства, снижающие уровни холестерина, выбранные из группы, включающей ингибиторы HMG-CoA редуктазы, секвестранты, никотиниловый спирт, никотиновая кислота и ее соли, ингибиторы абсорбции холестерина,ингибиторы ацил СоА:холестерин ацилтрансферазы, и антиоксиданты; PPARD агонисты; соединения для лечения ожирения; ингибиторы переноса желчных кислот в подвздошной кишке; противовоспалительные средства, исключая глюкокортикоиды; ингибиторы белковой тирозин-фосфатазы 1 В (РТР-1B); и гипотензивные средства, включая средства, действующие на системы ангиотензина или ренина, такие как ингибитор ангиотензин-превращающего фермента, антагонисты рецептора ангиотензина II или ингибиторы ренина, такие как каптоприл, цилазаприл, эналаприл, фозиноприл, лизиноприл, хинаприл, рамаприл, зофеноприл, кандесартан, цилексетил, эпросартан, ирбесартан, лосартан, тазосартан, телмисартан и валсартан; указанные соединения вводятся пациенту в количестве, которое эффективно для лечения указанного состояния. Ингибиторы дипептидил пептидазы-IV можно комбинировать с соединениями структурной формулы I, включая соединения, раскрытые в WO 03/004498, WO 03/004496; ЕР 1258476; WO 02/083128; WO 02/062764; WO 03/00025; WO 03/002530; WO 03/002531; WO 03/002553;WO 03/002593; WO 03/000180 и WO 03/000181. Специфическим соединением, ингибирующим DP-IV,является изолейцин тиазолидид; NVP-DPP728; Р 32/98 и LAF 237. Соединения для лечения ожирения, которые можно комбинировать с соединениями структурной формулы I, включают фенфлурамин, дексфенфлурамин, фентермин, сибутрамин, орлистат, антагонисты нейтропептида Y1 или Y5, антагонисты или обратные агонисты СВ 1 рецептора каннабиоида, агонисты рецептора меланокортина, в особенности, агонисты рецептора меланокортина-4, антагонисты грелина и антагонисты рецептора меланиноконцентрирующего гормона (МСН). Для обзора соединений для лечения ожирения, которые можно комбинировать с соединениями структурной формулы I, см. S. Chaki и др. Антагонисты нейтропептида Y5, которые можно комбинировать с соединениями структурной формулы I, включают соединения, раскрытые в патенте US6335345 и WO 01/14376; и специфические соединения идентифицируются как GW59884A; GW569180A; LY366377 и СОР-71683 А. Антагонисты рецептора СВ 1 каннабиоида, которые можно комбинировать с соединениями формулы I, включают соединения, описанные в РСТ публикации WO 03/007887; патенте US5624941, такие как римонабант; РСТ публикации WO 02/076949, такие как SLV-319; патент US6028084; РСТ публикации WO 98/41519; РСТ публикации WO 00/10968; РСТ публикации WO 99/02499; патентUS5532237 и патент US5292736. Агонисты рецептора меланокортина, которые можно комбинировать с соединениями формулы I,включают соединения, описанные в WO 03/009847; WO 02/068388; WO 99/64002; WO 00/74679;of melanocortin-4 receptor agonists", Expert Opin. Ther. Patents, 12: 1631-1638 (2002). В другом аспекте изобретения раскрыт способ лечения состояния, выбранного из группы, включающей гиперхолестеринемию, атеросклероз, низкие уровни ЛВП, высокие уровни ЛНП, гиперлипидемию, гипертриглицеридемию и дислипидемию, у пациента-млекопитающего, нуждающегося в таком лечении, который включает введение пациенту терапевтически эффективного количества соединения,как определено в структурной формуле I, и ингибитора HMG-CoA редуктазы. Более предпочтительно в другом аспекте изобретения раскрыт способ лечения состояния, выбранного из группы, включающей гиперхолестеринемию, атеросклероз, низкие уровни ЛВП, высокие уровни ЛНП, гиперлипидемию, гипертриглицеридемию и дислипидемию, у пациента-млекопитающего, нуждающегося в таком лечении, где ингибитор HMG-CoA редуктазы представляет собой статин. Еще более предпочтительно в другом аспекте изобретения раскрыт способ лечения состояния, выбранного из группы, включающей гиперхолестеринемию, атеросклероз, низкие уровни HAL, высокие уровни ЛНП, гиперлипидемию, гипертриглицеридемию и дислипидемию, у пациента-млекопитающего,нуждающегося в таком лечении, где ингибитор HMG-CoA редуктазы представляет собой статин, выбранный из группы, включающей ловастатин, симвастатин, правастатин, церивастатин, флувастатин,аторвастатин, итавастатин и росувастатин. В другом аспекте изобретения раскрыт способ уменьшения риска развития состояния, выбранного из группы, включающей гиперхолестеринемию, атеросклероз, низкие уровни ЛВП, высокие уровни ЛНП, гиперлипидемию, гипертриглицеридемию и дислипидемию и последствия таких состояний, который включает введение пациенту-млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения, как определено в структурной формуле I, и ингибитора HMG-CoA редуктазы. В другом аспекте изобретения раскрыт способ замедления появления или уменьшения риска развития атеросклероза у пациента-человека, нуждающегося в таком лечении, который включает введение указанному пациенту эффективного количества соединения, как определено в структурной формуле I, и ингибитора HMG-CoA редуктазы. Более предпочтительно раскрыт способ замедления появления или уменьшения риска развития атеросклероза у пациента-человека, нуждающегося в таком лечении, где ингибитор HMG-CoA редуктазы представляет собой статин. Еще более предпочтительно раскрыт способ замедления появления или уменьшения риска I развития атеросклероза у пациента-человека, нуждающегося в таком лечении, где ингибитор HMG-CoA редуктазы представляет собой статин, выбранный из группы, включающей ловастатин, симвастатин, правастатин, церивастатин, флувастатин, аторвастатин, итавастатин и росувастатин. Еще более предпочтительно раскрыт способ замедления появления или уменьшения риска развития атеросклероза у пациента-человека, нуждающегося в таком лечении, где статин представляет собой симвастатин. В другом аспекте изобретения раскрыт способ замедления появления или уменьшения риска развития атеросклероза у пациента-человека, нуждающегося в таком лечении, где ингибитор HMG-CoA редуктазы представляет собой статин и дополнительно включает введение ингибитора абсорбции холестерина. Более предпочтительно в другом аспекте изобретения раскрыт способ замедления появления или уменьшения риска развития атеросклероза у пациента-человека, нуждающегося в таком лечении, где ингибитор HMG-СоА редуктазы представляет собой статин и ингибитор абсорбции холестерина представляет собой эзетимиб. В другом аспекте изобретения раскрыта фармацевтическая композиция, которая содержит соединение согласно структурной формуле I, соединение, выбранное из группы, включающей DP-IV ингибиторы; средства, повышающие чувствительность в инсулину I, выбранные из группы, включающей PPAR агонисты; PPAR агонисты, PPAR/ двойственные агонисты и бигуаниды; инсулин и миметики инсулина; сульфонилмочевины и другие стимуляторы секреции инсулина; ингибиторы -глюкозидазы; антагонисты рецептора глюкагона; GLP-1, GLP-1 аналоги и агонисты GLP-1 рецептора; GIP, GIP миметики и агонисты GIP рецептора; РАСАР, РАСАР миметики и агонисты РАСАР рецептора 3; средства, снижающие уровень холестерина, выбранные из группы, включающей ингибиторы HMG-CoA редуктазы, секвестранты, (никотиниловый спирт, никотиновая кислота или ее соль, ингибиторы абсорбции холестерина,ингибиторы ацил СоА:холестерин ацилтрансферазы и антиоксиданты; PPARS агонисты; соединения для лечения ожирения; ингибиторы переноса желчных кислот в подвздошной кишке; противовоспалительные средства, отличающиеся от глюкокортикоидов; ингибиторы белковой тирозин-фосфатазы 1B (PTP1 В) ингибиторы и гипотензивные средства, включая средства, которые действуют на системы ангиотензина или ренина, такие как ингибитор ангиотензин-превращающего фермента, антагонисты рецептора ангиотензина II или ингибиторы ренина, такие как каптоприл, цилазаприл, эналаприл, фозиноприл, лизиноприл, хинаприл, рамаприл, зофеноприл, кандесартан, цилексетил, эпросартан, ирбесартан, лосартан,тазосартан, телмисартан и валсартан; ингибиторы белка-переносчика сложного эфира холестерина(СЕТР) и фармацевтически приемлемый носитель. Дальнейшим вариантом осуществления согласно настоящему изобретению является способ приготовления указанных фармацевтических композиций, который характеризуется тем, что одно или несколько соединений в соответствии с изобретением и одно или несколько соединений, выбранных из группы, включающей твердые, жидкие или полужидкие наполнители, вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные средства, отличающиеся от соединений в соответствии с изобретением, превращают в подходящую дозированную форму. Фармацевтические композиции согласно настоящему изобретению могут вводиться с помощью любых средств, предназначенных для этой цели. Например, введение может быть пероральным, парентеральным, местным, энтеральным, внутривенным, внутримышечным, ингаляционным, назальным, внутрисуставным, интраспинальным, транстрахеальным, трансглазным, подкожным, внутрибрюшинным,черескожным или буккальным. Альтернативно или одновременно, введение можно осуществлять пероральным путем. Вводимая доза будет зависеть от возраста, состояния здоровья и веса реципиента, вида одновременного лечения, если его используют, частоты лечения и природы желательного эффекта. Предпочтительным является парентеральное введение; особенно предпочтительным является пероральное введение. Подходящие дозированные формы включают, но не ограничиваясь только ими, капсулы, таблетки,пеллеты, драже, полутвердые формы, порошки, гранулы, суппозитории, мази, кремы, лосьоны, средства для ингаляции, инъекции, припарки, гели, ленты, глазные капли, раствор, сиропы, аэрозоли, суспензию,эмульсию, которые могут быть получены в соответствии со способами, известными в данной области,например, как описано в дальнейшем: таблетки: смешивание активного компонента или активных компонентов и вспомогательных веществ, прессование указанной смеси в таблетку (прямое прессование), необязательно грануляцию части смеси перед прессованием; капсулы: смешивание активного компонента или активных компонентов и вспомогательных веществ до получения сыпучего порошка, необязательно грануляцию порошка, наполнение порошком/гранулятом открытых капсул, запечатывание капсул; полутвердые формы (мази, гели, пасты): растворение/диспергирование активного компонента или активных компонентов в водном или жирном носителе, последующее смешивание водной/жирной фазы с дополняющей жирной, соответственно водной фазой, гомогенизацию (только для паст); суппозитории (ректальные и вагинальные): растворение/диспергирование активного компонента или активных компонентов в вещественосителе, которое расплавляется при нагревании (веществом-носителем для ректального введения обычно является воск, веществом-носителем для вагинального введения обычно является нагретый раствор загустителя), разливание указанной смеси в формы для суппозитория, отжиг и изъятие суппозиториев из форм; аэрозоли: растворение/диспергирование активного компонента или активных компонентов в пропелленте,разливание в бутылки указанной смеси на распылителе. Как правило, нехимические способы приготовления фармацевтических композиций и/или лекарственных средств, включающих стадии обработки при помощи подходящих механических устройств, известны в данной области техники, при осуществлении которых одно или несколько соединений в соответствии с изобретением переносят в дозированную форму, подходящую для введения пациенту, нуждающемуся в таком лечении. Как правило, перенос одного или нескольких соединений в соответствии с изобретением в такую дозированную форму включает добавление одного или нескольких соединений,выбранных из группы, включающей носители, наполнители, вспомогательные вещества и фармацевтически активные компоненты, отличающиеся от соединений в соответствии с изобретением. Подходящие стадии обработки включают, но не ограничиваясь только ими, сочетание, измельчение, смешивание, гра- 14017923 нуляцию, растворение, диспергирование, гомогенизацию, формировку и/или прессование соответствующих активных и неактивных компонентов. Механические средства для осуществления указанных стадий обработки известны в данной области, например, из Ullmann's Encyclopedia of Industrial Chemistry, 5-ое издание. В этом отношении активные компоненты предпочтительно представляют собой по крайней мере одно соединение в соответствии с настоящим изобретением и одно или несколько дополнительных соединений, отличающихся от соединений в соответствии сизобретением, которые обладают ценными фармацевтическими свойствами, предпочтительно те фармацевтически активные средства, отличающиеся от соединений в соответствии с настоящим изобретении, которые в нем перечислены. Особенно предпочтительными для перорального введения являются таблетки, пилюли, таблетки с покрытием, капсулы, порошки, гранулы, сиропы, соки или капли, подходящими для ректального введения являются суппозитории, подходящими для парентерального введения являются растворы, предпочтительно на масляной основе или водные растворы, а также суспензии, эмульсии или имплантаты, и подходящими для местного введения являются мази, кремы или порошки. Новые соединения также могут быть лиофилизированы и полученные лиофилизаты могут использоваться, например, для приготовления инъекционных препаратов. Указанные препараты могут стерилизоваться и/или включать вспомогательные вещества, такие как смазывающие вещества, консерванты, стабилизаторы и/или смачивающие вещества, эмульсификаторы, соли для модификации осмотического давления, буферные вещества, красители и ароматизаторы и/или один или несколько других активных компонентов, например один или несколько витаминов. Подходящими наполнителями являются органические или неорганические вещества, которые пригодны для энтерального (например, перорального), парентерального или местного введения и не взаимодействуют с новыми соединениями, например, вода, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, глицерилтриацетат, желатин, углеводороды, такие как лактоза, сахароза,маннит, сорбит или крахмал (кукурузный крахмал, пшеничный крахмал, рисовый крахмал, пшеничный крахмал), препараты целлюлозы и/или фосфатов кальция, например трикальцийфосфат или кальцийгидрофосфат, стеарат магния, тальк, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза,натрийкарбоксиметилцеллюлоза, поливинилпирролидон и/или вазелин. Если это является желательным, то можно добавлять дезинтеграторы, такие как вышеупомянутые крахмалы, а также карбоксиметил-крахмал, перекрестно-сшитый поливинилпирролидон, агар или альгиновую кислоту или ее соль, такую как альгинат натрия. Вспомогательные вещества включают, без ограничений, средства, регулирующие текучесть, и скользящие вещества, например диоксид кремния, тальк,стеариновую кислоту или ее соли, такие как стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Ядра драже можно покрывать подходящими оболочками, которые, если это является желательным,устойчивы к действию желудочного сока. С этой целью можно применяться концентрированные растворы сахаридов, которые необязательно могут содержать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, лаковые растворы и подходящие органические растворители или смеси растворителей. Для получения оболочек, устойчивых к действию желудочного сока, или для обеспечения дозированной формы, обеспечивающей благоприятное пролонгированное действие, таблетка,драже или пилюля может содержать внутренний дозированный и наружный дозированный компонент,при этом последний находится в виде оболочки вокруг шаблона. Два компонента могут быть отделены кишечным слоем, который служит для противодействия разложению в желудке и позволяет внутреннему компоненту проходить интактным в двенадцатиперстную кишку и замедленно высвобождаться. Для таких кишечных слоев и покрытий можно использовать различные вещества, такие как многие полимерные кислоты и смеси полимерных кислот с такими веществами, как шеллак, ацетиловый спирт, растворы подходящих препаратов целлюлозы, такие как фталат ацетил-целлюлозы, ацетат целлюлозы или фталат гидроксипропиметил-целлюлозы. К покрытиям таблеток и драже можно добавлять красящие вещества или пигменты, например, для идентификации или для характеристики комбинации доз активных соединений. Подходящими носителями являются органические или неорганические вещества, которые пригодны для энтерального (например, перорального) или парентерального введения или местного введения и не взаимодействуют с новыми соединениями, например, вода, растительные масла, бензиловые спирты,полиэтиленгликоли, желатин, углеводороды, такие как лактоза или крахмал, стеарат магния, тальк и вазелин. В частности, для энтерального введения используют таблетки, таблетки с покрытием, капсулы,сиропы, суспензии, капли или суппозитории, для парентерального введения используют растворы, предпочтительно масляные или водные растворы, кроме того, суспензии, эмульсии или импланты, и для местного введения используют мази, кремы или порошки. Новые соединения также могут быть лиофилизированы и полученные лиофилизаты могут использоваться, например, для приготовления инъекционных препаратов. Указанные препараты можно стерилизовать и/или они могут содержать наполнители, такие как смазывающие вещества, консерванты, стабилизаторы и/или смачивающие вещества, эмульсификаторы,соли для модификации осмотического давления, буферные вещества, красители, вкусовые вещества и/или ароматизаторы. Если это является желательным, то они также могут содержать дополнительные активные соединения, например, один или несколько витаминов. Другими фармацевтическими препаратами, которые можно использовать перорально, являются капсулы с плотной посадкой, сделанные из желатина, а также мягкие, запечатанные капсулы, сделанные из желатина и пластификатора, такого как глицерин или сорбит. Капсулы с плотной посадкой могут содержать активные соединения в форме гранул, которые могут быть смешаны с наполнителями, такими как лактоза, связующими, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния и, необязательно, стабилизаторами. В мягких капсулах активные соединения предпочтительно растворены или суспендированы в подходящих жидкостях, таких как жирные масла, или жидкий парафин. Дополнительно, можно добавлять стабилизаторы. Жидкие формы, в виде которых могут находиться новые композиции согласно настоящему изобретению, для перорального введения включают водные растворы, подходящие ароматизированные сиропы,водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и сходные фармацевтические носители. Подходящими диспергирующими или суспендирующими средствами для водных суспензий являются синтетические и натуральные смолы, такие как трагакант, гуммиарабик, альгинат, декстран, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Подходящими препаратами для парентерального введения являются водные растворы активных соединений в водорастворимой форме, например, водорастворимых солей и щелочных растворов. Дополнительно, можно вводить суспензии активных соединений в виде подходящих масляных суспензий для инъекций. Подходящими липофильными растворителями или носителями являются жирные масла, например кунжутное масло, или синтетические сложные эфиры жирных кислот, например этилолеат или триглицериды или полиэтиленгликоль -400 (соединения растворимы в ПЭГ-400). Водные суспензии для инъекций могут содержать вещества, повышающие вязкость суспензии,включая, например, натрийкарбоксиметилцеллюлозу, сорбит, и/или декстран, необязательно, суспензия также может содержать стабилизаторы. Для введения в виде аэрозоля для ингаляции является возможным использовать аэрозоли, в которых активный компонент растворен или суспендирован в газе-вытеснителе или в смеси газоввытеснителей (например, СО 2 или хлорфторуглеродах). При этом активный компонент благоприятно использовать в микронизированной форме, в таком случае могут присутствовать также один или несколько дополнительных физиологически приемлемых растворителей, например этанол. Растворы для ингаляции могут вводиться при помощи обычных ингаляторов. Подходящие фармацевтические препараты, которые можно использовать ректально, например суппозитории, состоящие из комбинации одного или нескольких активных соединений с основой для суппозиториев. Подходящими основами для суппозиториев являются, например, естественные или синтетические триглицериды, или предельные углеводороды. Дополнительно, также представляется возможным использовать желатиновые ректальные капсулы, состоящие из комбинации активных соединений с основанием. Возможными веществами для оснований являются, например, жидкие триглицериды, полиэтиленгликоли или предельные углеводороды. Для применения в медицине соединения согласно настоящему изобретению переводят в форму фармацевтически приемлемых солей. Также для приготовления соединений в соответствии с изобретением или их фармацевтически приемлемых солей могут быть полезными другие соли. Подходящие фармацевтически приемлемые соли соединений согласно настоящему изобретению включают соли присоединения кислоты, которые могут образовываться, например, путем смешивания раствора соединения в соответствии с изобретением с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, серная кислота, метансульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, щавелевая кислота, лимонная кислота, винная кислота,карбоновая кислота или фосфорная кислота. Кроме того, если соединения по изобретению несут кислотную часть, то их фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия; соли щелочно-земельных металлов, например соли кальция или магния; и соли,образованные с подходящими органическими основаниями, например четвертичные аммониевые соли. Под объем настоящего изобретения также подпадают пролекарства вышеописанных соединений согласно настоящему изобретению. Как правило, такие пролекарства будут являться функциональными производными соединений согласно настоящему изобретению, которые легко превращаются в условияхin vivo в требуемое соединение согласно настоящему изобретению. Общепринятые методики отбора и приготовления подходящих производных пролекарств описаны, например, в Design of Prodrugs, ed. H.Bundgaard, Elsevier, 1985. Фармацевтические препараты могут применяться в качестве лекарственных средств при лечении людей или в ветеринарии. Как используется в настоящем изобретении, термин "эффективное количество" обозначает то количество лекарства или фармацевтического средства, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которую пытаются достичь, например, исследователь или лечащий врач. Кроме того, термин "фармацевтически эффективное количество" обозначает любое количество, которое, по сравнению с соответствующим пациентом,- 16017923 которому не вводили такого количества, приводит к улучшению лечения, восстановлению, профилактике или уменьшению интенсивности симптомов заболевания, расстройства или побочного действия, или уменьшению степени распространения заболевания или расстройства. Термин также включает количества, эффективные для усиления нормальной физиологической функции. Указанное терапевтически эффективное количество одного или нескольких соединений в соответствии с изобретением известно для специалиста в данной области или легко может быть определено при помощи обычных способов, известных в данной области. Вещества в соответствии с изобретением обычно вводят аналогично коммерчески доступным препаратам. Обычно подходящие дозы, которые являются терапевтически эффективными, находятся в интервале от 0,0005 до 1000 мг, предпочтительно от 0,005 до 500 мг и в особенности от 0,5 до 100 мг на дозированную единицу. Суточная доза предпочтительно составляет приблизительно от 0,001 до 10 мг/кг веса тела. Специалист в данной области легко может оценить, что уровни дозы могут существенным образом зависеть от конкретного соединения, тяжести симптомов и чувствительности пациента к побочным действиям. Некоторые индивидуальные соединения являются более эффективными по сравнению с другими. Предпочтительную дозу данного соединения легко может определить специалист в данной области при помощи различных способов. Предпочтительным способом является определение физиологической эффективности данного соединения. Хозяин или пациент может представлять собой любой из видов млекопитающих, например видов приматов, в частности человека; грызунов, включая мышей, крыс и хомяков; кроликов; лошадей; коров; собак; кошек и др. Животные модели представляют интерес для экспериментальных исследований, обеспечивая модель для лечения заболеваний человека. Тем не менее, конкретная доза для каждого пациента зависит от многих факторов, например от эффективности конкретных применяемых соединений, от возраста, веса тела, общего состояния здоровья,пола, питания, времени и способа введения, от скорости выделения, вида введения и лекарственной формы, применяемой для введения, сочетания лекарственных средств и тяжести конкретного заболевания,которое поддается лечению. Конкретная терапевтически эффективная доза для каждого пациента легко может быть определена при помощи общепринятых экспериментов, например врачом или специалистом,который консультирует или курирует терапевтическое лечение. При многочисленных расстройствах чувствительность определенной клетки к лечению с помощью заявляемых соединений может быть определена при анализе in vitro. В общем случае культуру клеток соединяют с заявляемым соединением при различных концентрациях в течение периода времени, достаточного для того, чтобы позволить активным агентам проявить релевантную реакцию, обычно в интервале времени приблизительно от одного часа до одной недели. Для анализа in vitro можно использовать культивируемые клетки из образца биопсии. Даже без более подробного описания предполагается, что средний специалист в данной области техники может использовать вышеприведенное описание в самом широком объеме. Следовательно,представленные предпочтительные варианты осуществления следует рассматривать только как описательное раскрытие, которое никоим образом не ограничивает изобретение. При указании выше и ниже вся температура приведена в С. В последующих примерах "обычная обработка" обозначает, что при необходимости растворитель удаляют, воду добавляют при необходимости, значение рН устанавливают, при необходимости, в интервале от 2 до 10, в зависимости от состава конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу промывают насыщенным раствором NaHCO3, если является желательным, водой и насыщенным раствором NaCl, высушивают над сульфатом натрия, фильтруют и упаривают и продукт очищают путем хроматографии на силикагеле, препаративной ВЭЖХ и/или кристаллизации. Очищенные соединения, если это является желательным, лиофилизируют. Масс-спектрометрия (MS): ESI (ионизация электронным ударом) (М+Н)+. Перечень аббревиатур и сокращений. АсОН - уксусная кислота; безв. - безводный; атм - атмосфера(ы); ВОС - трет-бутоксикарбонил;Et3N - триэтиламин; ч - час(ы); МеОН - метанол; пет. эфир - простой петролейный эфир (диапазон кипения 30-60 С); темп. - температура; ТГФ - тетрагидрофуран; ТФУ - трифторАсОН;Tf - трифторметансульфонил. Пример 1. Методы получения. Соединения согласно настоящему изобретению могут быть получены с помощью общих методов А,В, С и D, приведенных ниже. Во всех методах получения все исходные вещества являются известными или легко могут быть получены из известных исходных веществ. Общий метод А: Путем сочетания адамантиламина, где R1 имеет значения, указанные выше, с изоцианатом, где Y,R , R и R5 имеют значения, указанные выше, в стандартных условиях (например, используя этанол или диметилформамид в качестве растворителя и в присутствии третичного основания, если используют гидрохлорид адамантиламина). Например 3 Путем взаимодействия адамантилизоцианата, где R1 имеет значения, указанные выше, и который может быть получен из адамантиламина согласно Angew. Chem. Itn; Ed. Engl. 1995, 34, 2497-2500, с амином, где Y, R2, R3, R4 и R5 имеют значения, указанные выше, в стандартных условиях. Общий метод С: Путем сочетания адамантиламина, где R1 имеет значения, указанные выше, с карбонилдиимидазолом в инертном растворителе, таком как ДХМ, получая соответствующий ацилимидазол, и путем взаимодействия этого полученного соединения с амином, где Y, R2, R3, R4 и R5 имеют значения, указанные выше, в стандартных условиях (например, ДХМ в качестве растворителя и в присутствии третичного основания, если используют гидрохлорид амина). Путем взаимодействия анизольной группы с таким агентом, как гидрохлорид пиридиния или трибромид бора, получая соответствующий фенол, и путем алкилирования этого фенола с хлоридом диалкиламиноэтила, где R6 и R7 имеют значения, указанные выше, в присутствии основания, такого как карбонат калия в полярном растворителе, таком как диметилформамид. Пример 2. Общий метод А. 1-Адамантан-2-ил-3-(4-метокси-2-метилфенил)мочевина. Смесь 2,5 г (13,3 ммоль) гидрохлорида 2-адамантиламина, 1,84 мл (13,3 ммоль) триэтиламина 50 мл этанола нагревали в колбе с обратным холодильником. После этого добавляли 1,94 мл (13,3 ммоль) 4 метокси-2-метилфенилизоцианата и смесь перемешивали в колбе с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры осадок фильтровали, промывали этанолом и высушивали в вакууме, получая 4,2 г (61%) белого твердого вещества. Тпл 186 С. ВЭЖХ-МС (М+Н+) 315,2. 1 Н ЯМР (ДМСО-d6) 1,5-1,9 (m, 14H), 2,15 (s, 3 Н), 3,39-3,47 (m, 1H), 3,67 (s, 3H), 6,59-6,71 (m, 3H),7,51 (s, 1H), 7,6 (d, 1H). Следующие соединения получали с помощью способа, аналогичного описанному в примере 1.Coll. Khim.Farm.Z.; 24(1), 29-31, 1990, в 20 мл этанола нагревали в колбе с обратным холодильником. После этого добавляли 0,594 мл (4 ммоль) 4-метокси-2-метилфенилизоцианата и смесь перемешивали в колбе с обратным холодильником в течение 2 ч, затем в течение ночи при комнатной температуре. Осадок фильтровали, промывали простым диэтиловым эфиром и высушивали в вакууме, получая 0,566 г в виде белого твердого вещества. Промывочный диэтилэфирный раствор концентрировали насухо, получая 0,800 г в виде бежевого твердого вещества. Очистку каждого твердого вещества осуществляли путем флэш-хроматографии на силикагеле (элюенты: 3-5% МеОН в CH2Cl2), получая указанные в заглавии соединения. Пример 2-1. 1-(цис-5-Гидроксиадамантан-2-ил)-3-(4-метокси-2-метилфенил)мочевина. Тпл 231-232C. М+Н = 331. 1 Н ЯМР (200 МГц, ДМСО-d6)1,4-2,05 (m, 13H), 2,17 (s, 3 Н), 3,64 (d, 1H), 3,70 (s, 3 Н), 4,48 (s, 1H),6,6-6,8 (m, 3 Н), 7,55 (s, 1H), 7,65 (d, 1H). Пример 2-2. 1-(транс-5-Гидроксиадамантан-2-ил)-3-(4-метокси-2-метилфенил)мочевина. Тпл 244-245C. М+Н = 331. 1 Н ЯМР (200 МГц, ДМСО-d6)1,35-2,1 (m, 13 Н), 2,19 (s, 3 Н), 3,72 (s, 4H), 4,45 (s, 1 Н), 6,55-6,80 (m,3 Н), 7,55 (s, 1H), 7,62 (d, 1H). Пример 2-3. 4-[S)-3-Метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир уксусной кислоты. Смесь (5-гидроксиадамантан-2-ил)амида(S)-3-метилпиперидин-1-карбоновой кислоты 0,15 г (0,51 ммоль), 0,109 мл ацетилхлорида, 3 мл пиридина в 1,5 мл метиленхлорида перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный раствор NaHCO3, органическую фазу экстрагировали метиленхлоридом, промывали 1 н. раствором HCl и высушивали над сульфатом натрия. При осуществлении флэш-хроматографии на силикагеле (элюент CH2Cl2/МеОН: 95/05) получали 75 мг указанного в заглавии соединения. М+Н = 335,2. 1 Н ЯМР (300 МГц, ДМСО-d6)0,69 (d, 3 Н), 0,85-2,25 (m, 22H), 2,53 (td, 1H), 3,47 (sl, 1H), 3,6-3,9 (m,2H), 5,75 (d, 1H). Следующие соединения получали с помощью способа, аналогичного описанному в примере 2-3. Пример 2-4. 4-[S)-3-Метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир циклоциклогексанкарбоновой кислоты. 1 Н ЯМР (300 МГц, ДМСО-d6)0,85 (d, 3 Н), 0,91-2,37 (m, 30 Н), 2,53 (td, 1H), 3,55 (sl, 1 Н), 3,8-3,97(m, 2 Н), 5,75 (d, 1H) Пример 4. Общий метод В. 1-Адамантан-2-ил-3-R)-2-гидрокси-1-фенилэтил)мочевина. Раствор гидрохлорида 2-адамантиламина 0,4 г (2,1 ммоль), триэтиламина 0,324 мл (2,3 ммоль), 4 диметиламинопиридина 0,286 г (2,3 ммоль) в 4 мл ДМФА охлаждали при -15 С. После этого добавляли раствор (Вос)2 О 511,5 мг (2,3 ммоль) в ДМФА, реакционную смесь перемешивали при -15 С в течение 45 мин и позволяли нагреться до комнатной температуры. Добавляли амин 0,321 г (2,3 ммоль) и смесь нагревали при 55 С в течение ночи. После охлаждения добавляли воду (15 мл), осадок фильтровали, промывали водой, простым диэтиловым эфиром и высушивали в вакууме, получая 350 мг (52%) в виде белого твердого вещества. М+Н = 315. Следующие соединения получали с помощью способа, аналогичного описанному в примере 3.(15,98 ммоль), триэтиламина 2,215 мл (15,98 ммоль) в CH2Cl2 100 мл перемешивали в течение ночи при комнатной температуре. Добавляли воду, органическую фазу отделяли, высушивали и концентрировали насухо, получая неочищенный указанный в заглавии продукт 3,69 г (94%) в виде белого твердого вещества. 1b) 3-Адамантан-2-ил-1-метил-1-(2-пиридин-2-илэтил)мочевина; гидрохлорид. Раствор адамантан-2-иламида 4N-имидазол-1-карбоновой кислоты 1 г (4,08 ммоль) и 2-(Nметиламиноэтил)пиридина 0,567 мл (4,08 ммоль) в метиленхлориде 10 мл перемешивали при комнатной температуре в течение 2 дней. Добавляли воду, органическую фазу экстрагировали, высушивали и концентрировали насухо. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент ДХМ/МеОН: 95/05), получая 1,13 г указанного в заглавии соединения в виде свободного основания. М+Н = 314. 1 Н ЯМР (200 МГц, CDCl3)1,45-1,9 (m, 14H), 2,8 (s, 3 Н), 2,97 (t, 2H), 3,61 (t, 2H), 3,77 (d, 1H), 5,3 (d,1H), 7,05-7,15 (m, 2H), 7,528 (t, 1H), 8,42 (d, 1H). Путем растирания в порошок вышеописанного основания 255 мг (0,81 ммоль) с раствором HCl 2 M в простом диэтиловом эфире получали 22,3 мг гидрохлоридной соли указанного соединения. 1 Н ЯМР (200 МГц, ДМСО-d6)1,35-2 (m, 14H), 2,52 (s, 2H), 2,93 (s, 3 Н), 3,26 (m, 2 Н), 5,5 (sl, 1H),7,95 (d1, 2H), 8,5 (t, 1H), 8,78 (d, 1H). Пример 6. Общий метод С. 4-[2-(3-Адамантан-2-ил-1-метилуреидо)этокси]бензойная кислота. а) Метиловый эфир 4-[2-(3-адамантан-2-ил-1-метилуреидо)этокси]бензойной кислоты. Раствор адамантан-2-иламида 4H-имидазол-1-карбоновой кислоты 0,5 г (2,04 ммоль) и метилового эфира 4-(2-метиламиноэтокси)бензойной кислоты 426,8 мг (2,04 ммоль) в метиленхлориде 10 мл перемешивали при комнатной температуре в течение 2 дней. Добавляли воду, органическую фазу экстрагировали, высушивали и концентрировали насухо. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент ДХМ/МеОН: от 100/0 до 95/05), получая 596 мг в виде белого твердого вещества. Тпл 126 С. М+Н = 387. 1b) 4-[2-(3-Адамантан-2-ил-1-метилуреидо)этокси]бензойная кислота. Раствор метилового эфира 4-[2-(3-адамантан-2-ил-1-метилуреидо)этокси]бензойной кислоты 562 мг(1,45 ммоль), NaOH 1 н. 3 мл в ТГФ 5 мл перемешивали при КТ в течение ночи. После этого добавлялиNaOH 1 н. 4 мл и реакционную смесь перемешивали в течение ночи. Добавляли воду и смесь подкисляли до достижения рН 2. Осадок фильтровали и высушивали в вакууме, получая указанное в заглавии соединение 305 мг (51%) в виде белого твердого вещества. Тпл 207 С. М+Н = 373. 1 Н ЯМР (200 МГц, CDCl3)1,2-2,1 (m, 14H), 2,96 (s, 3 Н), 3,72 (t, 2H), 3,8 (d, 1H), 4,14 (sl, 2 Н), 5 (sl,1H), 6,88 (d, 2H), 7,99 (d, 2H). Пример 7. Соединения 6-1 и 6-2. 3-(3-Адамантан-2-илуреидо)-2-метилбензойная кислота. Раствор метилового эфира 3-(3-адамантан-2-илуреидо)-2-метилбензойной кислоты 70 мг (0,204 ммоль), 0,408 мл NaOH 1 н. в 2 мл метанола перемешивали в течение ночи при 55 С. Смесь концентрировали, разводили водой и экстрагировали этилацетатом. Водную фазу подкисляли до рН 1 и осадок фильтровали и высушивали в вакууме, получая 53 мг (79%) в виде белого твердого вещества. М+Н = 329. Следующие соединения получали с помощью способа, аналогичного описанному в примере 5. Пример 8. Общий метод D. 1-Адамантан-2-ил-3-(4-гидрокси-2-метилфенил)мочевина. К суспензии 1-адамантан-2-ил-3-(4-метокси-2-метилфенил)мочевины 1,56 г (4,88 ммоль) в ДХМ 20 мл добавляли при -78 С в атмосфере аргона раствор трибромида бора 1 М в ДХМ 14,67 мл(14,67 ммоль). Реакционную смесь перемешивали при -78 С в течение 1 ч, затем позволяли достичь комнатной температуры. Добавляли воду 60 мл, осадок фильтровали, промывали водой и высушивали в вакууме, получая 1,36 г (92%) белого твердого вещества. Тпл 212-214C. М+Н = 301. 1 Н ЯМР (200 МГц, ДМСО-d6)1,5-1,95 (m, 14 Н), 2,08 (s, 3 Н), 3,71 (s, 1H), 6,4-6,55 (m, 3 Н), 7,37 (m,2 Н). Пример 9. Общий метод D. 1-Адамантан-2-ил-3-(2-метил-4-(2-пиперидин-1-илэтокси)фенил)мочевина. Суспензию соединения из примера 8 (700 мг, 2,33 ммоль), карбоната калия (966 мг 6,9 ммоль), гидрохлорида 2-хлорэтилпиперидина (643 мг, 3,49 ммоль) в ацетонитриле 20 мл нагревали в колбе с обратным холодильником в течение ночи. Реакционную смесь фильтровали, промывали ацетонитрилом. К органическому раствору добавляли воду и осадок фильтровали и высушивали, получая указанное в заглавии соединение 120 мг в виде белого твердого вещества. Тпл 196C. М+Н = 412. 1 Авторам было обнаружено, что соединения такой структуры являются эффективными и селективными ингибиторами 11-бета-HSD-1 человека. Пример 11. Исследования-измерения констант ингибирования. Рекомбинантные ферменты 11 бета-гидроксистероид-дегидрогеназа 1 типа (11 бета-HSD1) и 2 типа(11 бета-HSD2) человека экспрессировали в Е. coli. Микросомные фракции печени крыс и мышей получали от TEBU. Исследование фермента 11 бета-HSD1 осуществляли на микротитровальных планшетах на 96 лунок в общем объеме 100 мкл, содержащих 30 мМ HEPES буфера, рН 7,4 с 1 мМ EDTA, субстратную смесь кортизон/NADPH (200 нМ/200 мкМ), G-6-P (1 мМ) и ингибиторы в серийных разведениях. Реакции инициировали путем добавления 10 мкл 11 бета-HSD1 (3 мкг) из Е.coli в виде микросомной фракции печени крыс или мышей (2,5 мкг). После смешивания планшеты встряхивали в течение 150 мин при 37 С. Реакции останавливали с помощью стоп-раствора с 10 мкл 18 бета глицирретиновой кислоты. Определение уровней кортизола в препаратах 11 бета-HSD1 осуществляли с помощью HTRF (HTRF анализ кортизола от Cis bio international). Активность выражали в виде % контроля или концентрации, ингибирующей активность фермента на 50% (IC50). Это исследование подобным образом можно применить для 11 бета-HSD2, где кортизол, NAD и карбеноксолон используют в качестве субстрата, кофактора и стоп-агента соответственно. Пример 12. Флаконы для инъекций. рН раствора 100 г активного соединения согласно настоящему изобретению и 5 г Na2HPO4 в 3 л бидистиллированной воды устанавливали на 6,5, используя 2 н. соляную кислоту, стерилизовали фильтрацией, разливали во флаконы для инъекций, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного соединения. Пример 13. Суппозитории. Смесь 20 г активного соединения согласно настоящему изобретению расплавляли с 100 г соевого лецитина и 1400 г какаового масла, разливали в пресс-формы и охлаждали. Каждый суппозиторий содержит 20 мг активного соединения. Пример 14. Раствор. Раствор приготавливали 1 г активного соединения согласно настоящему изобретению, 9,38 гNaH2PO42H2O, 28,48 г Na2HPO412H2O и 0,1 г бензалконийхлорида в 940 мл бидистиллированной воды. рН раствора устанавливали на 6,8 и объем раствора доводили до 1 л и стерилизовали путем облучения. Этот раствор может использоваться в форме глазных капель. Пример 15. Мазь. 500 мг активного соединения согласно настоящему изобретению смешивали с 99,5 г вазелина в асептических условиях. Пример 16. Таблетки. Смесь 1 кг активного соединения согласно настоящему изобретению, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния спрессовывали для получения таблеток обычным способом таким образом, чтобы каждая таблетка содержала 10 мг активного соединения. Пример 17. Таблетки с покрытием. Таблетки спрессовывали аналогично вышеописанному примеру и затем покрывали обычным способом покрытием из сахарозы, картофельного крахмала, талька, трагаканта и красителя. Пример 18. Капсулы. 2 кг активного соединения согласно настоящему изобретению помещали в твердые желатиновые капсулы обычным способом таким образом, что каждая капсула содержала 20 мг активного соединения.Y представляет собой простую связь или C1-C4-алкил или C1-C4-алкилокси;R3, R4, R5 независимо друг от друга представляют собой Н, Hal, ОН, C1-C10-алкил, C1-C4-алкилокси,бензилокси, фенокси, фенил, трифторметил, дифторметокси, трифторметокси, трифторметилсульфанил,диметиламино, S(O)n(CH2)mCH3, C1-C4-алкилоксикарбонил, C1-C4-алкилкарбонил;R9 представляет собой Н, C1-C8-алкил или C1-C8-циклоалкил,и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях, при условии, что соединением формулы I не является 1-адамантил-2-ил-3-(3,5-дихлор-4 гидроксифенил)мочевина или N-(2-адамантил)-N'-2(фторфенил)мочевина. 2. Соединение по п.1, в котором R1 представляет собой Н, R2 представляет собой Н или метил, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. 3. Соединение по п.1, в котором R1 представляет собой OR8, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. 4. Соединение по любому из пп.1-3, в котором Y представляет собой простую связь, и его физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. 5. Соединение, выбранное из группы, включающей:nnnn) 4-[S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир циклоциклогексанкарбоновой кислоты,оооо) 4-[S)-3-метилпиперидин-1-карбонил)амино]адамантан-1-иловый эфир 2,2 диметилпропионовой кислоты,и их физиологически приемлемые соли, сольваты и стереоизомеры, включая их смеси во всех соотношениях. 6. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с изоцианатом формулы III, в которой Y, R3, R4 и R5 имеют значения, указанные в п.1 где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли. 7. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантилизоцианат формулы IV, в которой R1 имеет значения, указанные в п.1, взаимодействует с амином формулы V, в которой Y, R2, R3, R4 и R5 имеют значения, указанные в п.1 где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли. 8. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что адамантиламин формулы II, в которой R1 имеет значения, указанные в п.1, взаимодействует с карбонилдиимидазолом, с получением соответствующего ацилимидазола формулы VI, и этот ацилимидазол взаимодействует с амином формулы V, в которой Y, R2, R3, R4 и R5 имеют значения, указанные в п.1 где при необходимости остаток R1, R2, R3, R4 и/или R5 превращают в другой остаток R1, R2, R3, R4 и/или R5, определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли. 9. Способ получения соединения по любому из пп.1-5, который характеризуется тем, что производное адамантилмочевины формулы VII, в которой Y, R1, R2, R3 и R4 имеют значения, указанные в п.1, обрабатывают с получением соответствующего фенола где при необходимости остаток R1, R2, R3 и/или R4 превращают в другой остаток R1, R2, R3 и/или R4,определенный в п.1, или соединение формулы I выделяют и/или обрабатывают кислотой или основанием с получением его соли. 10. Применение соединения по любому из пп.1-5 в качестве ингибитора 11-HSD1. 11. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства для лечения и/или профилактики заболеваний, которые вызываются, опосредуются и/или распространяются высокими уровнями кортизола. 12. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства для лечения и/или профилактики одного или нескольких заболеваний или состояний, выбранных из группы,включающей метаболический синдром, диабет, в особенности инсулиннезависимый сахарный диабет,преддиабет, резистентность к инсулину, низкую переносимость глюкозы, гипергликемию, ожирение и нарушения, связанные с избыточным весом, нарушения обмена липидов, такие как дислипидемия, гиперлипидемия, гипертриглицеридемия, гиперхолестеринемия, низкие уровни ЛВП или высокие уровни ЛНП, глаукому, остеопороз, опосредованные глюкокортикоидом действия на функцию нейронов, такие как познавательные расстройства, тревога или депрессия, нейродегенеративное заболевание, иммунные нарушения, такие как туберкулез, проказа или псориаз, гипертонию, атеросклероз и его последствия,рестеноз сосудов, сердечно-сосудистые заболевания, панкреатит, ретинопатию, невропатию и нефропатию. 13. Фармацевтическая композиция, отличающаяся тем, что она содержит терапевтически эффективное количество одного или более соединений по любому из пп.1-5. 14. Фармацевтическая композиция по п.11, отличающаяся тем, что она содержит одно или несколько дополнительных соединений, выбранных из группы, включающей физиологически приемлемые наполнители, вспомогательные вещества, адъюванты, разбавители, носители и фармацевтически активные компоненты, отличающиеся от соединений по любому из пп.1-5. 15. Комплект (набор), состоящий из отдельных пакетов:a) терапевтически эффективного количества одного или нескольких соединений по любому из пп.15 иb) терапевтически эффективного количества одного или нескольких дополнительных фармацевтически активных компонентов, отличающихся от соединений по любому из пп.1-5. 16. Способ приготовления фармацевтической композиции, отличающийся тем, что одно или несколько соединений по любому из пп.1-5 и одно или несколько соединений, выбранных из группы,включающей твердые, жидкие или полужидкие наполнители, вспомогательные вещества, адъюванты,разбавители, носители и фармацевтически активные компоненты, отличающиеся от соединений по любому из пп.1-5, превращают в подходящую дозированную форму.
МПК / Метки
МПК: C07D 319/08, A61K 31/4409, C07C 275/26, C07C 275/34, C07C 275/30, C07D 213/75, A61K 31/24, C07D 333/36, A61K 31/381, A61K 31/17, C07C 321/28, A61P 3/04, A61P 3/10, C07C 275/28, C07D 261/14
Метки: ингибиторов, производные, селективных, 2-адамантилмочевины, качестве, 11β-hsd1
Код ссылки
<a href="https://eas.patents.su/30-17923-proizvodnye-2-adamantilmocheviny-v-kachestve-selektivnyh-ingibitorov-11beta-hsd1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-адамантилмочевины в качестве селективных ингибиторов 11β-hsd1</a>
Предыдущий патент: Арочный грунтозасыпной мост (варианты), плитно-ребристое пролетное строение арочного грунтозасыпного моста и применение пролетного строения
Следующий патент: Узел соединения крышки и шпинделя запорного клапана
Случайный патент: Шпренгельная башня-мачта