N- ациламинобензольные производные в качестве селективных ингибиторов моноаминооксидазы в
Номер патента: 9372
Опубликовано: 28.12.2007
Авторы: Томас Эндрью Уилльям, Холидон Синесе, Родригес Сармьенто Роса Мария, Виле Рене
Формула / Реферат
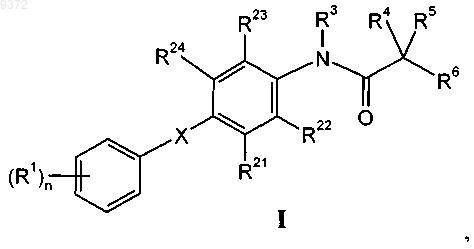
1. Соединения общей формулы
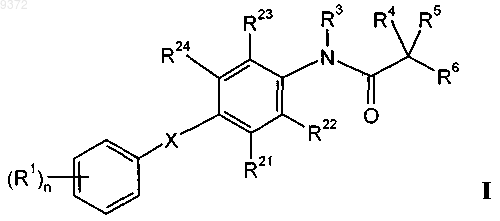
в которой R1 обозначает галоген, галоген-(С1-С6)алкил, цианогруппу, С1-С6алкоксигруппу или галоген-(С1-С6)алкоксигруппу;
R21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород, (С1-С6)алкил, галоген, галоген-(С1-С6)алкил, гидроксигруппу, С1-С6алкоксигруппу или -СНО;
R3 обозначает водород или С1-С3алкил;
R4, R5 независимо друг от друга выбраны из группы, содержащей водород, С1-С6алкил, С1-С6алкоксигруппу или -СОО(С1-С6)алкил; или
R4 и R5 совместно с С-атомом, к которому они присоединены, образуют С3-С7циклоалкильное кольцо;
R6 обозначает -CO-NR7R8, -СОО(С1-С6)алкил, -CN, -NR2 или -NHC(O)R;
R7 и R8 независимо друг от друга выбраны из группы, содержащей водород, С1-С6алкил, NH2 или гидроксигруппу;
R обозначает водород или С1-С6алкил;
n означает 0, 1, 2 или 3;
X обозначает -CHRO-, -OCHR-, -CH2S-, -SCH2-, -СН2СН2-, -СН=СН- или -СуС-,
и их фармацевтически активные кислые соли присоединения, при условии, что исключены следующие соединения:
N-(4-бензилокси-2,6-диметилфенил)-2-диэтиламиноацетамид и его гидрохлорид,
2-диэтиламино-N-[4-(4-метоксибензилокси)-2,6-диметилфенил]ацетамид,
N-[4-(4-хлорбензилокси)-2,6-диметилфенил]-2-диэтиламиноацетамид,
N-(4-бензилокси-2-метилфенил)-2-диэтиламиноацетамид,
N-(4-бензилокси-5-изопропил-2-метилфенил)-2-диэтиламиноацетамид,
N-(4-бензилоксифенил)-2-диэтиламиноацетамид,
N-(4-бензилокси-2,6-дихлорфенил)-2-диэтиламиноацетамид,
N-(4-бензилоксифенил)-2-диметиламиноацетамид, гидрохлорид,
N-(4-бензилоксифенил)-2-диметиламинопропионамид, гидрохлорид,
N-[4-(4-хлорбензилокси)фенил]-2-диметиламиноацетамид, гидрохлорид,
N-[4-(4-хлорбензилокси)фенил]-2-диметиламинопропионамид, гидрохлорид,
N-(4-бензилоксифенил)-2-диэтиламиноацетамид, гидрохлорид,
N-(4-бензилоксифенил)-2-диэтиламинопропионамид, гидрохлорид,
N-[4-(4-хлорбензилокси)фенил]-2-диэтиламиноацетамид, гидрохлорид,
N-[4-(4-хлорбензилокси)фенил]-2-диэтиламинопропионамид, гидрохлорид,
N-(4-бензилокси-2-метилфенил)-2-(бутиламино)ацетамид,
N-(4-бензилокси-2-метилфенил)-2-дибутиламиноацетамид,
N-(4-бензилокси-2-метилфенил)-2-дипропиламиноацетамид,
N-(4-бензилокси-2-метилфенил)-2-пропиламиноацетамид,
N-(4-бензилокси-2-метилфенил)-2-гексиламиноацетамид,
N-(4-бензилокси-2-метилфенил)-2-диэтиламинопропионамид,
N-(4-бензилокси-2-метилфенил)-2-бутиламинопропионамид,
N-(4-бензилокси-2-метилфенил)-2-пропиламинопропионамид,
N-(4-бензилокси-2,6-диметилфенил)-2-бутиламиноацетамид, гидрохлорид,
N-(4-бензилокси-2,6-диметилфенил)-2-дибутиламиноацетамид, гидрохлорид и
N-(4-бензилокси-2,6-диметилфенил)-2-дипропиламиноацетамид,
и соединения формулы I, в которой
n равно 0, 1, 2 или 3; и
R1 обозначает галоген, циано, С1-С6алкоксигруппу, -(СН2)m-С(галоген)3, где m находится в пределах от 0 до 3, или -O-(СН2)m-С(галоген)3, где m находится в пределах от 0 до 3;
R21, R22, R23 и R24 все обозначают водород;
X обозначает -(СН2)m- при том, что m равно 2, -СН=СН- или -С=С-, и
R3 обозначает водород или С1-С3алкил;
R6 обозначает -CN; а
R4, R5 - водород.
2. Соединения общей формулы
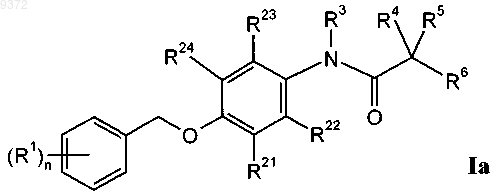
в которой R1 обозначает галоген, галоген-(С1-С6)алкил, цианогруппу, С1-С6алкоксигруппу или галоген-(С1-С6)алкоксигруппу;
R21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород и галоген;
R3 обозначает водород или С1-С3алкил;
R4 обозначает водород или С1-С6алкил;
R5 обозначает водород или С1-С6алкил;
или R4 и R5 совместно образуют С3-С7циклоалкильное кольцо;
R6 обозначает -CO-NR7R8, -COOR9 или -CN;
R7 и R8 независимо друг от друга обозначают водород, метил или этил;
R9 обозначает С1-С6алкил; и
n означает 1, 2 или 3,
и их фармацевтически активные кислые соли присоединения.
3. Соединения общей формулы I по п.1, где X обозначает СН2О, R1 обозначает фтор или трифторметил и R6 обозначает -COOCH3-.
4. Соединения по п.3, которые представляют собой
метиловый эфир N-[4-(3-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[3-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[4-(4-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[2-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[4-(2-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[4-(2,4,5-трифторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты,
метиловый эфир N-[4-(3,5-бис-трифторметилбензилокси)-2-фторфенил]малонамовой кислоты,
метиловый эфир N-[4-(3-фторбензилокси)-3-метилфенил]малонамовой кислоты или
метиловый эфир N-[3-хлор-4-(3-фторбензилокси)фенил]малонамовой кислоты.
5. Соединения формулы I по п.1, где X обозначает CH2O и R6 обозначает -CONH2.
6. Соединения по п.5, которые представляют собой
[4-(3-фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты,
амид N-[4-(3-фторбензилокси)фенил]малоновой кислоты,
амид N-[4-(3-фторбензилокси)фенил]-2-метилмалоновой кислоты,
амид N-[3-фтор-4-(3-фторбензилокси)фенил]малоновой кислоты,
амид N-[4-(4-фторбензилокси)фенил]малоновой кислоты,
амид N-[4-(2,4-дифторбензилокси)фенил]малоновой кислоты,
амид N-[4-(2,4,5-трифторбензилокси)фенил]малоновой кислоты,
амид N-[4-(2-фторбензилокси)фенил]малоновой кислоты,
амид N-(4-бензилоксифенил)малоновой кислоты,
амид N-[4-(4-хлорбензилокси)фенил]малоновой кислоты,
амид N-[4-(3-фторбензилокси)-2-гидроксифенил]малоновой кислоты,
амид N-[2-фтор-4-(4-фторбензилокси)фенил]малоновой кислоты,
амид N-[4-(3-фторбензилокси)-3-метилфенил]малоновой кислоты,
амид N-[3-хлор-4-(3-фторбензилокси)фенил]малоновой кислоты или
[2-фтор-4-(4-фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты.
7. Соединения формулы I по п.1, где X обозначает -ОСН2- и R6 обозначает -NHCOCH3 или -NHCOH.
8. Соединения по п.7, которые представляют собой
2-ацетиламино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамид,
2-ацетиламино-N-[2-фтор-4-(3-фторбензилокси)фенил]ацетамид,
N-[2-фтор-4-(4-фторбензилокси)фенил]-2-формиламиноацетамид или
N-[2-фтор-4-(3-фторбензилокси)фенил]-2-формиламиноацетамид.
9. Соединения формулы I по п.1, где X обозначает -OCH2- и R6 обозначрхт -NH2.
10. Соединения по п.9, где соединение представлено 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамидом.
11. Соединения формулы I по п.1, где X обозначает -СН=СН- и R6 обозначает -СООСН3 или -CONH2.
12. Соединения по п.11, которые представляют собой
метиловый эфир N-{4-[2-(4-фторфенил)винил]фенил}малонамовой кислоты,
амид N-{4-[2-(3-фторфенил)винил]фенил}малоновой кислоты,
амид N-{4-[2-(4-фторфенил)винил]фенил}малоновой кислоты или
метиловый эфир N-{4-[2-(3-фторфенил)винил]фенил}малонамовой кислоты.
13. Способ получения соединения формулы I, определенного в любом из пп.1-12, включающий взаимодействие соединения формулы
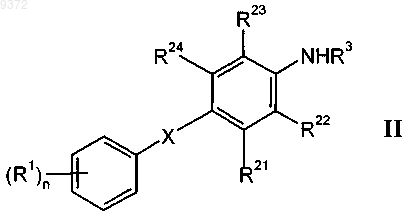
с соединением формулы
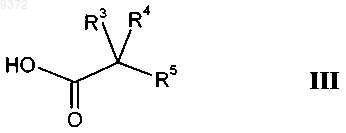
с получением соединения формулы
с последующим, при необходимости, превращением соединения формулы I в фармацевтически приемлемую соль.
14. Соединение формулы I по любому из пп.1-12, полученное способом по п.13.
15. Лекарственное средство, содержащее одно или несколько соединений, определенных в любом из пп.1-12, и фармацевтически приемлемый наполнитель, для лечения и профилактики заболеваний, опосредствованных ингибиторами моноаминооксидазы В.
16. Лекарственное средство по п.15 для лечения и профилактики болезни Альцгеймера и сенильной деменции.
17. Применение соединения формулы I, определенного в любом из пп.1-12, а также его фармацевтически приемлемых солей для производства лекарственных средств для лечения и профилактики заболеваний, опосредствованных ингибиторами моноаминооксидазы В.
18. Применение по п.17, в котором заболевание представлено болезнью Альцгеймера или сенильной деменцией.
Текст
009372 Настоящее изобретение относится к N-ациламиноарильным производным общей формулыR21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород, С 1-С 6 алкил,галоген, галоген-С 1-С 6 алкил, гидроксигруппу, C1-С 6 алкоксигруппу или -СНО;R3 обозначает водород или С 1-С 3 алкил;R4, R5 независимо друг от друга выбраны из группы, содержащей водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или -СОО(С 1-С 6)алкил; или R4 и R5 совместно с атомом углерода, к которому они присоединены, образуют С 3-С 7-циклоалкильное кольцо;R7 и R8 независимо друг от друга выбраны из группы, содержащей водород, C1-С 6 алкил, NH2 или гидроксигруппу;R обозначает водород или С 1-С 6 алкил;X обозначает -CHRO, -OCHR-, -CH2S-, -SCH2-, -CH2CH2-, -CH=CH- или -CС-; и к их фармацевтически активным кислым солям присоединения, за исключением описанных ранееR3 обозначает водород или С 1-С 3 алкил;R4, R5 - водород. Обнаружено, что соединения общей формулы I являются селективными ингибиторами моноаминооксидазы В.-1 009372 Моноаминооксидаза (МАО, ЕС 1.4.3.4) является флавинсодержащим ферментом, ответственным за окислительное дезаминирование эндогенных нейротрансмиттеров моноамина, таких как допамин, серотонин, адреналин или норадреналин, и остаточных аминов, например фенилэтиламина, а также ряда аминных ксенобиотиков. Фермент существует в двух формах, МАО-А и МАО-В, кодируемых различными генами (A.W. Bach и соавт., Proc. Natl. Acad. Sci. USA, 1988, т.85, cc.4934-4938) и различающихся по распределению в тканях, структуре и субстратной специфичности. МАО-А обладает более высоким сродством в отношении серотонина, октопамина, адреналина и норадреналина, в то время как природными субстратами МАО-В являются фенилэтиламин и тирамин. Считается, что допамин окисляется обеими изоформами. МАО-В широко распространена в различных органах, включая головной мозг.(A.M. Cesura и A. Pletscher, Prog. Drug Research, 1992, т.38, cc.171-297). С возрастом проявляется увеличение активности МАО-В головного мозга. Это увеличение объясняют глиозом, связанным со старением. (C.J. Fowler и соавт., J. Neural. Transm. 1980, т.49, cc.1-20). Кроме того, в головном мозге пациентов с болезнью Альцгеймера значительно более высокая активность МАО-В (P. Dostert и соавт., Biochem.Pharmacol., 1989, т.38, cc.555-561), и обнаружена ее высокая экспрессия в астроцитах вокруг сенильных бляшек (Saura и соавт., Neuroscience, 1994, т.70, cc.755-774). В этом плане, поскольку окислительное дезаминирование первичных моноаминов посредством МАО приводит к NH3, альдегидам и Н 2 О 2, веществам с установленной или потенциальной токсичностью, представляется обоснованным использовать селективные ингибиторы МАО-В для лечения деменции и болезни Паркинсона. Ингибирование МАО-В приводит к снижению ферментативной инактивации допамина и, таким образом, пролонгирует возможность использования нейротрансмиттеров допаминергических нейронов. Процессы дегенерации, ассоциированные с возрастом и болезнями Альцгеймера и Паркинсона, также могут объясняться окислительным стрессом в результате повышенной активности МАО и последующего увеличения образования Н 2 О 2 посредством МАО-В. Следовательно, ингибиторы МАО-В могут работать посредством как уменьшения образования кислородных радикалов, так и снижения уровней моноаминов в головном мозге. В связи с данной ролью МАО-В в упомянутых выше неврологических заболеваниях, существует значительный интерес в получении потенциальных и селективных ингибиторов, которые позволили бы контролировать ферментативную активность. Фармакология некоторых известных ингибиторов МАО-В обсуждается,например, в работе D. Bentu-Ferrer и соавт., CNS Drugs, 1996, т.6, cc.217-236. В то время, как главным ограничением активности необратимых и неселективных ингибиторов МАО является необходимость соблюдения мер предосторожности в отношении режима питания из-за опасности индуцирования гипертонического криза, когда принимается внутрь пищевой тирамин, а также потенциальное взаимодействие с другими лекарственными средствами. (D.M. Gardner и соавт., J. Clin. Psychiatry, 1996, т.57, cc.99-104),эти неблагоприятные эффекты имеют меньшее значение в отношении обратимых и селективных ингибиторов МАО, в особенности МАО-В. Таким образом, существует необходимость в высокоселективных ингибиторах МАО-В, не имеющих вредных побочных эффектов, типичных для необратимых ингибиторов МАО с низкой селективностью в отношении фермента. Следовательно, задачей данного изобретения является создание соединений, которые отвечают упомянутым выше критениям. Обнаружено, что соединения формулы I, соответствующие данному изобретению, являются потенциальными высокоселективными ингибиторами МАО-В. Объектами данного изобретения являются далее способ получения соединений формулы I, а также применение соединений формулы I для контролирования и профилактики заболеваний, опосредованных ингибиторами моноаминооксидазы В, и, соответственно, их применение для приготовления соответствующих лекарственных препаратов. В данной патентной заявке применяются следующие определения общих терминов, вне зависимости от того, встречаются ли эти термины по одному или в комбинации. Следует отметить, что, как использовано в данном описании и в прилагаемых пунктах патентных притязаний, формы единственного числа включают в себя и формы множественного числа, если в контексте прямо не указано противоположное. Термин "C1-С 6 алкил" ("низший алкил"), используемый в данной заявке, обозначает остатки насыщенных углеводородов с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода,предпочтительно от 1 до 3 атомов углерода, такие как метил, этил, н-пропил, изопропил, н-бутил, вторбутил, трет-бутил и т.п. Соответственно, термин "С 1-С 3 алкил" обозначает остатки насыщенных углеводородов с прямой или разветвленной цепью, содержащей от 1 до 3 атомов углерода. Термин "галоген" обозначает фтор, хлор, бром и йод."Галоген-(С 1-С 6)алкил" или "галоген-(С 1-С 6)алкоксигруппа" обозначает остатки низшего алкила или низшей алкоксигруппы, соответственно, определенные в данном контексте, которые замещены в любом положении одним или несколькими атомами галогена, определенными в данном контексте. Примеры остатков галогеналкила включают, без ограничения перечисленным, 1,2-дифторпропил, 1,2-дихлорпропил, трифторметил, 2,2,2-трифторэтил,2,2,2-трихлорэтил, 1,1,1-трифторпропил и т.п. "Галогеналкоксигруппа" включает в себя трифторметилоксигруппу."С 1-С 6 Алкоксигруппа" означает остаток -O-R, в котором R обозначает остаток низшего алкила, как определено в данном контексте. Примеры алкоксигрупп включают в себя, без ограничения перечисленным, метокси-, этокси-, изопропоксигруппы и т.п. Термин "С 3-С 7 циклоалкил" обозначает насыщенную карбоциклическую группу, содержащую от 3 до 7 атомов углерода. Например, циклоалкильная группа обозначает циклопропил, циклобутил, цикло-2 009372 пентил, циклогексил и циклогептил, и эти группы необязательно могут быть замещены одним или двумя С 1-С 4 алкильными заместителями, например метилом или этилом."Фармацевтически приемлемые соли" соединения обозначают соли, которые являются фармацевтически приемлемыми, т.е., как правило, безопасны, нетоксичны и не являются нежелательными ни в биологическом, ни в других аспектах, и которые обладают желаемой биологической активностью главного соединения. Эти соли получают из неорганических или органических кислот или оснований. По возможности, соединения формулы I могут быть превращены в фармацевтические соли. Следует понимать, что фармацевтически приемлемые соли включены в объем данного изобретения. Определенные соединения формулы I являются предпочтительными среди соединений данного изобретения, например соединения формулы IaR21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород и галоген;R3 обозначает водород или С 1-С 3 алкил;R4 обозначает водород или С 1-С 6 алкил;R5 обозначает водород или С 1-С 6 алкил; или R4 и R5 совместно образуют С 3-С 7-циклоалкильное кольцо;R7 и R8 независимо друг от друга обозначают водород, метил или этил;n означает 1, 2 или 3,и их фармацевтически активные кислые соли присоединения. Предпочтительными являются далее такие соединения формулы I, в которых X обозначает СН 2 О,R1 обозначает фтор или трифторметил и R6 обозначает -СООСН 3, например следующие соединения: метиловый эфир N-[4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[3-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(4-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[2-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2,4,5-трифторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(3,5-бис-трифторметилбензилокси)-2-фторфенил]малонамовой кислоты,метиловый эфир N-[4-(3-фторбензилокси)-3-метилфенил]малонамовой кислоты или метиловый эфир N-[3-хлор-4-(3-фторбензилокси)фенил]малонамовой кислоты. Далее, предпочтительными являются соединениями формулы I, в которых X обозначает СН 2 О и R6 обозначает -CONH2, например следующие соединения:[2-фтор-4-(4-фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты. Предпочтительными являются соединениями формулы I, в которых X обозначает -ОСН 2- и R6 обозначает -NHCOCH3 или -NHCOH. В качестве примеров таких соединений можно назвать следующие: 2-ацетиламино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамид,-3 009372 2-ацетиламино-N-[2-фтор-4-(3-фторбензилокси)фенил]ацетамид,N-[2-фтор-4-(4-фторбензилокси)фенил]-2-формиламиноацетамид илиN-[2-фтор-4-(3-фторбензилокси)фенил]-2-формиламиноацетамид. Также предпочтительными являются соединениями формулы I, в которых X обозначает -OCH2- иR6 обозначает -NH2. В качестве примеров таких соединений можно назвать следующее соединение: 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамид. Другая предпочтительная группа соединений формулы I представлена соединениями, в которых X обозначает -СН=СН- и R6 обозначает -COOCH3 или -CONH2, например следующими соединениями: метиловый эфир N-4-[2-(4-фторфенил)винил]фенилмалонамовой кислоты,амид N-4-[2-(3-фторфенил)винил]фенилмалоновой кислоты,амид N-4-[2-(4-фторфенил)винил]фенилмалоновой кислоты или метиловый эфир N-4-[2-(3-фторфенил)винил]фенилмалонамовой кислоты. Соединения общей формулы I могут быть получены взаимодействием соединения формулы при этом получают соединение формулы и, при необходимости, превращают соединение формулы I в фармацевтически приемлемую соль. Возможность получения соединений общей формулы I в соответствии с данным изобретением представлена на схеме I. Ключевые промежуточные соединения А получают посредством нуклеофильного замещения ароматических нитросоединений, содержащих в п-положении замещаемую удаляемую группу, бензиловыми спиртами или тиолами. В качестве примеров п-замещаемой удаляемой группы можно указать галогены (F, Cl, Br, I), тозилаты, мезилаты или трифлаты. Эти реакции замещения можно провести без разбавления или в инертных растворителях, таких как толуол или ксилол. Предпочтительная температура реакции находится в интервале между 50 и 150 С. Альтернативно, соединения А могут быть получены синтезом простых эфиров по Вильямсону, исходя из п-нитрофенолов и бензиловых галоидов, тозилатов, мезилатов или трифлатов с использованием в качестве оснований, например алкоголятов или карбонатов (карбонатов натрия,калия или цезия). В качестве предпочтительных растворителей используют низшие спирты, ацетонитрил или низшие кетоны при температуре между 20C и температурой нагревания с обратным холодильником. Другим подходом является реакция присоединения бензиловых спиртов и п-нитрофенолов по Мицунобу. Как правило, реакцию проводят в инертных растворителях, таких как, например, диэтиловый эфир или тетрагидрофуран (ТГФ), с использованием диалкилазодикарбоксилатов в присутствии фосфинов (например, трибутил- или трифенилфосфина). Ключевые промежуточные соединения А восстанавливают до аминосоединений В посредством каталитического гидрогенирования (например, над платиной или углем в низших спиртах, этилацетате или тетерагидрофуране). Альтернативным подходом является восстановление нитрогруппы металлами, такими как железо, олово или цинк в кислой среде, такой как разбавленная соляная или уксусная кислота. Металлы могут быть также заменены их солями (например, хлоридом олова-(II. Промежуточные соединения В могут быть ацилированы известными методами с получением желаемых соединений I-A. Эти реакции осуществляют с использованием хлоридов кислот и оснований (например, триалкиламинов, карбоната натрия или карбоната калия, гидрокарбоната натрия или гидрокарбоната калия), в присутствии катализатора ацилирования (например, от 1 до 10 мол.% N,N-диметил-4-аминопиридина) в таких растворителях, как дихлорметан, этилацетат или ацетонитрил, предпочтительно при комнатной температуре (к.т.). Альтернативный подход представлен хорошо известным присоединением кислоты к амину В с использованием таких связующих реагентов, как N,N'-дициклогексилкарбодиимид(ДЦГК), гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (ЭДЦ) или 1,1'-карбонилдиими-4 009372 дазол (КДИ), в таких растворителях, как дихлорметан, диэтиловый эфир или ТГФ, предпочтительно при температуре от 0 до 40C. Промежуточные соединения В могут быть также предварительно моноалкилированы известными методами (см., например, статьи Johnstone и соавт, J. Chem. Soc. (С) 1969, с.2233 илиKrishnamurthy и соавт., Tetrahedron Lett. 1982, т.23, с.3315) с получением соединений D, которые затем ацилируют, как описано выше, и получают требуемые соединения I-B. Соединения с переставленными эфирными или тиоэфирными связующими группами могут быть получены подобными реакциями, как показано на схеме 1 а. Затем ключевые промежуточные соединения А' далее трансформируют в конечные продукты посредством последовательных реакций, которые уже упоминались в схеме 1. Дополнительные манипуляции с функциональными группами на ацилированных соединениях можно производить стандартными методами с получением любых соединений общей формулы I (например, можно функционализировать группу малоновой кислоты посредством депротонирования и реакции с электрофильными заместителями). Схема 1-5 009372 Альтернативно, в соответствии с данным изобретением соединения В могут быть также получены алкилированием N-защищенных п-гидроксианилинов бензиловыми галоидами или посредством реакции присоединения по Мицунобу N-защищенных п-гидроксианилинов и бензиловых спиртов (схема 2) описанными ранее методами. В качестве примеров защитных групп PG можно упомянуть, например, N-Boc(N-трет-бутоксикарбонил) или N-ацетил. Удаление защитной группы соединения F приводит к промежуточным соединениям В. Очевидно, что соединения с переставленными эфирными и тиоэфирными связующими группами могут быть получены подобными последовательными реакциями посредством переставления местами групп заместителей на ароматических фрагментах. Схема 2 Другой метод получения соединений типа D или I-B включает реакции перекрестного сочетания арилоловинатов (Lam и соавт., Tetrahedron Lett., 2002, т.43, с.3091), арилборонатов (Lam и соавт., Synlett.,2000, т.5, с.674); Chan и соавт., Tetrahedron Lett., 1998, т.39, с.2933) или арилгалогенидов (Buchwald и соавт., J. Amer. Chem. Soc., 1996, т.118, с.7215) с соответствующими аминами или амидами (схема 3). Схема 3 Еще раз соединения с переставленными эфирными и тиоэфирными связующими группами могут быть получены подобными последовательными реакциями посредством переставления местами групп заместителей на ароматических фрагментах. Возможность получения соединений I, где X обозначает -СН 2 СН 2- или -СН=СН-, показана на схеме 4. Реакции Виттига или Виттиг-Хорнера между фосфорилидами и ароматическими альдегидами в стандартных условиях приводят к производным стирола G. Эти промежуточные соединения могут быть восстановлены до промежуточных соединений Н или J. Обычно восстановление соединения G в условиях типа реакции Бечампа приводит к соединениям Н, которые далее могут быть восстановлены до соединений J посредством каталитического гидрогенирования. Используя более жесткие условия гидрогенирования, соединения G могут быть восстановлены до соединений J в одну стадию. Затем соединения Н илиJ подвергают далее процессам, показанным на схеме 1, с получением конечных продуктов I. Другой спо-6 009372 соб получения соединений типа G включает нитрование производных стирола. Схема 4 Как уже было упомянуто выше, соединения формулы I представляют собой ингибиторы моноаминооксидазы В и их можно использовать для лечения или профилактики заболеваний, при которых могут быть полезны ингибиторы МАО-В. Эти заболевания включают острые и хронические неврологические болезни, расстройства познавательной способности и нарушения памяти. Неврологические болезни, которые можно лечить, включают в себя, например, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, другие виды деменции, минимальное нарушение когнитивной функции или болезнь Паркинсона. Другие показания включают в себя психиатрические болезни, такие как депрессия, страх, паническое расстройство, социофобия, шизофрения, заболевания,связанные с питанием и обменом веществ, например ожирение, а также профилактику и лечение синдромов отмены, вызванных неправильным употреблением алкоголя, никотина и других вызывающих зависимость лекарств. К другим излечимым показаниям могут относиться синдром дефицита значимости(G.M. Sullivan, международная патентная заявкаWO 01/34172 А 2), периферическая нейропатия, вызванная раковой химиотерапией (G. Bobotas, международная патентная заявкаWO 97/33572 А 1), или рассеянный склероз (R.Y. Harris, международная патентная заявкаWO 96/40095 А 1) и другие нейровоспалительные заболевания. Соединения формулы I особенно полезны для лечения и профилактики болезни Альцгеймера и старческого слабоумия. Фармакологическая активность соединений испытана с использованием следующего метода. кДНК, кодирующие человеческие МАО-А и МАО-В, временно трансфицируют в клетки EBNA (ядерный антиген Эпштейна-Барра) с использованием методики, описанной в статье E.-J. Schlaeger и K. Christensen Временная экспрессия генов в клетки млекопитающих, выращенные в суспензионной культуре без сыворотки (Transient Gene Expression in Mammalian Cells Grown in Serum-free Suspension Culture; Cytotechnology,1998, т.15, cc.1-13). После трансфицирования клетки гомогенизируют с помощью политронного гомогенизатора (Polytron) в 20 мМ буфере Tris HCl, рН 8,0, содержащем 0,5 мМ EGTA (этиленгликольтетрауксусная кислота) и 0,5 мМ фенилметансульфонилфторида. Клеточные мембраны получают центрифугированием при 45,000 х g и, после двухстадийного промывания 20 мМ буфером Tris HCl, рН 8,0, содержащим 0,5 мМ EGTA, мембраны в конечном итоге ресуспендируют в вышеуказанном буфере и аликвоты перед использованием хранят при -80C. Ферментативную активность МАО-А и МАО-В проверяют в 96-луночном планшете с использованием спектрофотометрического анализа, адаптированного из метода, описанного в статье М. Zhou и N.Panchuk-Voloshina Одностадийный фторметрический метод для непрерывного измерения активности моноаминооксидазы (A One-Step Fluorometric Method for the Continuous Measurement of MonoamineOxidase Activity, Analytical Biochemistry, 1997, т.253, cc.169-174). В нескольких словах, аликвоты мембран инкубируют в 0,1 М калий фосфатном буфере, рН 7,4, в течение 30 мин при 37C в присутствии со-7 009372 единений в различных концентрациях или без них. После этого начинают ферментативную реакцию добавлением субстрата МАО тирамина вместе с 1 ед./мл пероксидазы хрена (Roche Biochemicals) и 80 МN-ацетил-3,7,-дигидроксифеноксазина (Amplex Red, Molecular Probes (молекулярные пробы. Далее образцы инкубируют в течение 30 мин при 37C до конечного объема 200 л и затем определяют коэффициент поглощения при длине волны 570 нм с использованием планшетного ридера SpectraMax (MolecularDevices). Фоновый (неспецифический) коэффициент поглощения определяют в присутствии 10 М хлоргилина для МАО-А или 10 М L-депренила для МАО-В. Величину IC50 определяют по кривым ингибирования, полученным с использованием девяти ингибирующих концентраций в двух экземплярах, посредством подставления данных в четырехпараметрическое логистическое уравнение с помощью компьютерной программы. Соединения, соответствующие данному изобретению, являются специфическими ингибиторами МАО-В. Величина IC50 предпочтительных соединений формулы I, измеренная в анализе, описанном выше, находится в диапазоне 1000 нМ или менее, обычно 100 нМ или менее и в идеальном случае 50 нМ или менее. В таблице ниже представлены некоторые значения IC50 (нМ) предпочтительных соединений. Соединения формулы I могут применяться в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты могут быть введены перорально, например в виде таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно также осуществлять ректально, например в форме суппозиториев, или парентерально, например в виде растворов для инъекций. Соединения формулы I можно подвергать обработке совместно с фармацевтически инертными неорганическими или органическими носителями для производства фармацевтических препаратов. Например, в качестве таких носителей для таблеток, таблеток в оболочке, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п., однако, в зависимости от природы активного вещества, в случае мягких желатиновых капсул обычно не требуются какие-либо носители. Подходящие носители для приготовления растворов и сиропов представлены, например, водой, полиолами, сахарозой, нейтральным сахаром, глюкозой и т.п. Для водных инъекционных растворов водорастворимых солей соединений формулы I могут использоваться адъюванты, такие как спирты, полиолы, глицерин, растительные масла и т.п., но обычно они не являются необходимыми. Подходящие носители для суппозиториев представлены, например, природными или затвердевшими маслами, восками, жирами,полутвердыми или жидкими полиолами и т.п. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажнители, эмульгаторы, подсластители, красители, ароматизирующие вещества, соли для изменения осмотического давления, буферы, защитные вещества или антиоксиданты. Они могут также содержать другие терапевтически значимые вещества. Как указано выше, лекарственные средства, содержащие соединения формулы I и терапевтически нейтральные наполнители, также являются объектом данного изобретения, как и способ получения таких лекарственных средств, который включает в себя объединение одного или нескольких соединений формулы I и, при необходимости, одного или нескольких других терапевтически ценных веществ в галеновую лекарственную форму совместно с одним или несколькими терапевтически инертными носителями. Дозировка может варьировать в широких пределах и должна, конечно, подбираться в зависимости от индивидуальных требований в каждом конкретном случае. Вообще, эффективная дозировка для орального или парентерального введения находится в пределах 0,01-20 мг/кг/сутки, с предпочтительной-8 009372 дозой 0,1-10 мг/кг/сутки для всех описанных выше показаний. Суточная доза для взрослых людей весом 70 кг, соответственно, находится между 0,7-1400 мг в сутки, предпочтительно между 7 и 700 мг в сутки. Следующие примеры приведены для иллюстрации изобретения. Они не должны рассматриваться как ограничение объема притязаний изобретения, но просто представляющими его. Пример 1. Метиловый эфир N-[4-(3-фторбензилокси)фенил]малонамовой кислоты. а) 1-(3-Фторбензилокси)-4-нитробензол. Смесь 5,04 г (40 ммоль) 3-фторбензилового спирта и 1,29 г (4 ммоль) трис-(диокса-3,6-гептил)амина обрабатывают 2,47 г (44 ммоль) гидроксида калия. Смесь перемешивают 10 мин при комнатной температуре (к.т.), затем через капельную воронку медленно добавляют 5,55 г (44 ммоль) 4-фторнитробензола. Смесь выдерживают 45 мин при 80C, охлаждают до к.т. и разбавляют приблизительно 75 мл воды. Экстрагирование этилацетатом и промывание 2 М водной соляной кислотой приводит к желтоватой органической фазе, которую высушивают и упаривают. Остаток перекристаллизовывают из метанола и получают 6,07 г (61 %) соединения, указанного в заголовке, в виде кристаллов желтого цвета, т.пл.=104-105C. б) 4-(3-Фторбензилокси)фениламин. 3 г (12,1 ммоль) 1-(3-фторбензилокси)-4-нитробензола растворяют в 125 мл метанола. Добавляют 150 мг 5% Pt на угле и проводят гидрирование при атмосферном давлении в течение приблизительно 17 ч. Катализатор отфильтровывают и раствор упаривают с получением 2,51 г (95%) сырого коричневатого материала. МС: m/е=218,4 (МН). в) Метиловый эфир N-[4-(3-фторбензилокси)фенил]малонамовой кислоты. Раствор 242 мг (1,77 ммоль) метилового эфира хлоркарбонилуксусной кислоты в 2 мл дихлорметана добавляют по каплям к охлажденному льдом раствору 350 мг (1,61 ммоль) 4-(3-фторбензилокси)фениламина в 7 мл пиридина. Затем смесь перемешивают 2 ч при к.т., разбавляют водой, подкисляют разбавленной соляной кислотой и экстрагируют этилацетатом. Органический слой высушивают. Хроматографирование (силикагель, этилацетат/гексан, 1:1) приводит к 99 мг (19%) соединения, указанного в заголовке, в виде твердого вещества желтоватого цвета. МС: m/е=418,1 (МН). Пример 2. [4-(3-Фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты. Раствор 126 мг (1 ммоль) 1-(аминокарбонил)-1-циклопропанкарбоновой кислоты и 212 мг (1 ммоль) 4-(3-фторбензилокси)фениламина (полученного по примеру 16) в 10 мл дихлорметана охлаждают до 0C и обрабатывают 206 мг (1,1 ммоль) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI). Смесь дополнительно перемешивают 2 ч при к.т., упаривают и подкисляют разбавленной лимонной кислотой. Экстрагирование этилацетатом и перекристаллизация из метанола приводит к 178 мг (56%) соединения, указанного в заголовке, в виде твердого вещества желтоватого цвета. МС: m/e=329,3 (МН). Пример 3. N-[4-(3-Фторбензилокси)фенил]малонамид. 99 мг (0,31 ммоль) метилового эфира N-[4-(3-фторбензилокси)фенил]малонамовой кислоты (пример 1) растворяют в смеси 0,5 мл тетрагидрофурана (ТГФ) и 1,0 мл водного гидроксида аммония (25%). Реакционный сосуд закрывают и выдерживают при 60C в течение 2,5 ч. Реакционную смесь охлаждают,упаривают досуха и разбавляют водой. Фильтрация приводит к 48 мг (51%) соединения, указанного в заголовке, в виде твердого вещества светло-желтого цвета. МС: m/e=303,2 (МН). Пример 4. 2-Циано-N-[4-(3-фторбензилокси)фенил]ацетамид. Соединение, указанное в заголовке, получают по аналогии с примером 2, исходя из 4-(3-фторбензилокси)фениламина (полученного по примеру 1 б) и циануксусной кислоты. После перекристаллизации из метанола получают продукт с выходом 50% в виде бесцветных кристаллов, т.пл.=164-166C. Пример 5. Метиловый эфир N-[4-(3-фторбензилокси)фенил]-2-метилмалонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 2, исходя из 4-(3-фторбензилокси)фениламина (полученного по примеру 1 б) и монометилового эфира 2-метилмалоновой кислоты(Nader и соавт., Chem. Ber., 1986, т.119, с.1196). После экспресс хроматографии с использованием смеси дихлорметан/метанол, 98:2 получают продукт с выходом 40% в виде бесцветного твердого вещества,т.пл.=119C. Пример 6. N-[4-(3-Фторбензилокси)фенил]-2-метилмалонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[4(3-фторбензилокси)фенил]-2-метилмалонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества, т.пл.=206C. Пример 7. N-[4-(3-Фторбензилокси)фенил]-2,2-диметилмалонамид. а) Этиловый эфир N-[4-(3-фторбензилокси)фенил]-2,2-диметилмалонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 2, исходя из 4-(3-фторбензилокси)фениламина и моноэтилового эфира 2,2-диметилмалоновой кислоты (Holmes и соавт., J. Amer.Chem. Soc., 1984, т.106, с.2353). После экспресс-хроматографии с использованием смеси циклогексан/этилацетат, 7:3 получают продукт с выходом 79% в виде бесцветного масла. МС: m/e=359 (М+). б) N-[4-(3-Фторбензилокси)фенил]-2,2-диметилмалонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из этилового эфира N-[4(3-фторбензилокси)фенил]-2,2-диметилмалонамовой кислоты и гидроксида аммония в виде бесцветного(127 ммоль) карбоната калия в 200 мл метилэтилкетона нагревают в течение ночи при 80C. Добавляют воду и продукт экстрагируют этилацетатом, высушивают и упаривают. Перекристаллизация из диэтилового эфира/гексана приводит к 12,68 г (75%) твердого вещества бледно-желтого цвета. МС: m/e=265,1(М+). б) 3-Фтор-4-(3-фторбензилокси)фениламин. 12,68 г (47,8 ммоль) 3-фтор-4-(3-фторбензилокси)нитробензола в 150 мл этилацетата обрабатывают 1,27 г 5% платины на угле и гидрируют 6 ч при к.т. и атмосферном давлении. Катализатор отфильтровывают, и раствор упаривают с получением 11,03 г (98%) темно-коричневого масла. МС: m/e=235,1 (М+). в) Метиловый эфир N-[3-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из 3-фтор-4-(3-фторбензилокси)фениламина и метилового эфира хлоркарбонилуксусной кислоты в виде твердого вещества светло-желтого цвета. Выход: 65%. МС: m/e=336,2 (МН). Пример 9. N-[3-Фтор-4-(3-фторбензилокси)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[3 фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде твердого вещества светло-желтого цвета. МС: m/e=321,2 (МН). Пример 10. Метиловый эфир N-[4-(4-фторбензилокси)фенил]малонамовой кислоты. а) 4-(4-Фторбензилокси)нитробензол. Соединение, указанное в заголовке, получают по аналогии с 1-(3-фторбензилокси)-4-нитробензолом, исходя из 4-фторнитробензола и 4-фтор-бензилового спирта в виде твердого вещества бледножелтого цвета. Выход: 86%, т.пл.=124-126C. б) 4-(4-Фторбензилокси)фениламин. Получают по аналогии с 4-(3-фторбензилокси)фениламином путем гидрирования 4-(4-фторбензилокси)нитробензола в виде твердого вещества бледно-красного цвета. Выход: 100%. МС: m/e=218,2(МН). в) Метиловый эфир N-[4-(4-фторбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из 4-(4-фторбензилокси) фениламина и метилового эфира хлоркарбонилуксусной кислоты в виде бесцветного твердого вещества. Выход: 75%. МС: m/e=318,2 (МН). Пример 11. N-[4-(4-Фторбензилокси)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[4(4-фторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход: 80%. МС: m/e=303,2 (МН). Пример 12. Метиловый эфир N-[4-(4-трифторметилбензилокси)фенил]малонамовой кислоты. а) 4-(4-Трифторметилбензилокси)нитробензол. Получают по аналогии с 1-(3-фторбензилокси)-4-нитробензолом, исходя из 4-фторнитробензола и 4-трифторметилбензилового спирта в виде твердого вещества коричневатого цвета. Выход после перекристаллизации из метанола: 82%, т.пл.=80,5-81,5C. б) 4-(4-Трифторметилбензилокси)фениламин. Получают по аналогии с 4-(3-фторбензилокси)фениламином посредством гидрирования 4-(4-трифторметилбензилокси)нитробензола в виде твердого вещества бледно-желтого цвета. Выход: 98%. МС:m/e=268,3 (МН). в) Метиловый эфир N-[4-(4-трифторметилбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из 4-(4-трифторметилбензилокси)фениламина и метилового эфира хлоркарбонилуксусной кислоты в виде бесцветного твердого вещества. Выход: 71%. МС: m/e=368,1 (МН). Пример 13. N-[4-(4-Трифторметилбензилокси)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[4(4-трифторметилбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=65%. МС: m/e=353,1 (МН). Пример 14. Метиловый эфир N-[2-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты. а) 2-Фтор-4-(3-фторбензилокси)нитробензол. Получают по аналогии с 3-фтор-4-(3-фторбензилокси)нитробензолом, исходя из 3-фтор-4-нитрофенола и 3-фторбензилбромида в виде твердого вещества белого цвета. Выход после перекристаллизации из диэтилового эфира/гексана: 100%. МС: m/e=265,0 (М+). б) 2-Фтор-4-(3-фторбензилокси)фениламин. Соединение, указанное в заголовке, получают по аналогии с 3-фтор-4-(3-фторбензилокси)фенил- 10009372 амином посредством гидрирования 2-фтор-4-(3-фторбензилокси)нитробензола в виде темно-коричневого масла. Выход: 98%. МС: m/e=235,0 (М+). в) Метиловый эфир N-[2-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из 2-фтор-4-(3-фторбензилокси)фениламина и метилового эфира хлоркарбонилуксусной кислоты в виде твердого вещества коричневатого цвета. Выход: 47%. МС: m/e=336,1 (МН). Пример 15. N-[2-Фтор-4-(3-фторбензилокси)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[2 фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бледно-желтого твердого вещества. Выход: 87%. МС: m/e=321,3 (МН). Пример 16. Метиловый эфир N-[4-(3-фторфеноксиметил)фенил]малонамовой кислоты. а) 1-Нитро-4-(3-фторфеноксиметил)бензол. Раствор 2,0 г (13 ммоль) 4-нитробензилового спирта и 3,60 г (13,7 ммоль) трифенилфосфина в 30 мл ТГФ обрабатывают 1,54 г (13,7 ммоль) 3-фторфенола. Смесь охлаждают на ледяной бане и медленно добавляют 2,39 г (13,7 ммоль) диэтилазодикарбоксилата. Ледяную баню удаляют и реакционную смесь перемешивают в течение ночи при к.т. ТГФ упаривают, масляный остаток обрабатывают диэтиловым эфиром, фильтруют и концентрируют. Хроматографирование (силикагель, этилацетат/гексан, 1:9) приводит к 2,52 г (78%) соединения, указанного в заголовке, в виде твердого вещества бледно-желтого цвета. МС: m/e=247,1 (МН). б) 4-(3-Фторфеноксиметил)фениламин. 1,0 г (4 ммоль) 1-нитро-4-(3-фторфеноксиметил)бензола в 40 мл метанола обрабатывают 0,25 г 5% платины на угле и гидрируют 1 ч при к.т. и атмосферном давлении. Катализатор отфильтровывают и раствор упаривают с получением 0,98 г сырого соединения, указанного в заголовке, в виде желтого масла. МС: m/e=218,3 (МН). в) Метиловый эфир N-[4-(3-фторфеноксиметил)фенил]малонамовой кислоты. 211 мг (1 ммоль) сырого 4-(3-фторфеноксиметил)фениламина растворяют в 3 мл дихлорметана. Добавляют 110 мг (1,1 ммоль) триэтиламина и в реакционную смесь, охлажденную на ледяной бане, добавляют по каплям 132 мг (1 ммоль) метилмалонилхлорида. Реакционную смесь дополнительно перемешивают 30 мин на ледяной бане, затем 45 мин при к.т. Реакционную смесь обрабатывают водой, подкисленной лимонной кислотой, и экстрагируют 3 раза дихлорметаном. Органический слой сушат и упаривают. Хроматографирование (силикагель, этилацетат/гексан, 1:1) приводит к 98 мг (32%) соединения,указанного в заголовке, в виде бесцветного твердого вещества. МС: m/e=318,2 (МН). Пример 17. N-[4-(3-Фторфеноксиметил)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N-[4(3-фторфеноксиметил)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=37%. МС: m/e=303,2 (МН). Пример 18. [4-(3-Фторфеноксиметил)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 2 из 4-(3-фторфеноксиметил)фениламина и 1-(аминокарбонил)-1-циклопропанкарбоновой кислоты в виде бесцветного твердого вещества. Выход=42%. МС: m/e=329,3 (МН). Пример 19. Метиловый эфир N-[4-(3-фторбензилокси)фенил]-2-метоксималонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 2 из 4-(3-фторбензилокси) фениламина и монометилового эфира 2-метоксималоновой кислоты (Swan и соавт.; J. Chem. Soc. PerkinTrans. 1, 1985, cc.1757-1766) в виде бесцветного твердого вещества. Выход=41%. МС: m/e=348,2 (МН). Пример 20. Метиловый эфир N-[4-(3-фторбензилокси)-2-трифторметилфенил]малонамовой кислоты. а) 4-(3-Фторбензилокси)-1-нитро-2-трифторметилбензол. Получают по аналогии с примером 8 из 4-нитро-3-(трифторметил)фенола и 3-фторбензилбромида в виде твердого вещества желтоватого цвета. Выход=85%. МС (ISP): m/e=333,2 (MNH4). б) 4-(3-Фторбензилокси)-2-трифторметилфениламин. Получают по аналогии с примером 8 б посредством гидрирования 4-(3-фторбензилокси)-1-нитро-2 трифторметилбензола в виде бледно-желтого масла. Выход=93%. МС: m/e=286,1 (МН). в) Метиловый эфир N-[4-(3-фторбензилокси)-2-трифторметилфенил]малонамовой кислоты. 0,515 г (1,8 ммоль) 4-(3-фторбензилокси)-2-трифторметилфениламина растворяют в 20 мл этилацетата. Добавляют 0,38 г (4,51 ммоль) гидрокарбоната натрия и смесь охлаждают на ледяной бане. Затем медленно в течение приблизительно 15 мин добавляют 0,27 г (2,0 ммоль) метилмалонилхлорида, растворенного в 5 мл этилацетата. Полученную смесь перемешивают при к.т. в течение ночи. Добавляют 10 мл 2 М водной соляной кислоты, органический слой отделяют и сушат над сульфатом магния. Упаривание растворителя приводит к бледно-желтому твердому веществу, которое перекристаллизовывают из метанола, и получают бесцветное твердое вещество. Выход=58%. МС: m/e=386,1 (МН). Пример 21. N-[2,5-Дифтор-4-(3-фторбензилокси)фенил]малонамид. а) 1,4-Дифтор-2-(3-фторбензилокси)-5-нитробензол. Получают по аналогии с примером 1 а из 2,4,5-трифторнитробензола и 3-фторбензилового спирта в- 11009372 виде бесцветного твердого вещества. Выход=55%. МС: m/e=283,1 (М+). б) 2,5-Дифтор-4-(3-фторбензилокси)фениламин. Получают по аналогии с примером 8 б посредством гидрирования 1,4-дифтор-2-(3-фторбензилокси)5-нитробензола в виде твердого вещества коричневого цвета. Выход=96%. МС: m/е=253,2 (М+). в) Метиловый эфир N-[2,5-дифтор-4-(3-фторбензилокси)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 2,5-дифтор-4-(3-фторбензилокси)фениламина и метилмалонилхлорида в виде твердого вещества сероватого цвета. Выход=73%. МС: m/e=354,1 (МН). г) N-[2,5-Дифтор-4-(3-фторбензилокси)фенил]малонамид. Соединение, указанное в заголовке, получают по аналогии с примером 3 из метилового эфира N[2,5-дифтор-4-(3-фторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=56%. МС: m/e=339,3 (МН). Пример 22. Метиловый эфир N-[4-(3-фторбензилокси)фенил]-N-метилмалонамовой кислоты. а) [4-(3-Фторбензилокси)фенил]метиламин. 0,855 г (8,4 ммоль) уксусного ангидрида охлаждают до 0C и по каплям добавляют 0,475 г (10,3 ммоль) уксусной кислоты. Затем реакционную смесь нагревают до 55C в течение 2 ч. После охлаждения до к.т. смесь разбавляют 0,5 мл сухого тетрагидрофурана (ТГФ) и добавляют по каплям раствор 0,7 г (3,2 ммоль) 4-(3-фторбензилокси)фениламина в 2 мл тетрагидрофурана (ТГФ) при к.т. Полученную смесь перемешивают 3 ч и упаривают, а полученное твердое вещество вновь растворяют в 2 мл тетрагидрофурана (ТГФ) и охлаждают до 0C. При перемешивании и охлаждении медленно добавляют 0,64 г (8,1 ммоль) боранметилсульфидного комплекса CH3)2SВН 3). Смесь перемешивают 1 ч при 0C и 2 ч при к.т. После добавления 5 мл метанола продолжают перемешивать 1 ч. Смесь обрабатывают 10 мл 1 М водной соляной кислоты и перемешивают в течение ночи. Органические растворители удаляют в вакууме и водную фазу доводят до рН=10 добавлением карбоната калия. Экстрагирование диэтиловым эфиром, высушивание и упаривание приводят к бесцветному твердому веществу. Выход: 0,57 г (76%). МС: m/e=232,2 (МН). б) Метиловый эфир N-[4-(3-фторбензилокси)фенил]-N-метилмалонамовой кислоты. Получают по аналогии с примером 20 в из [4-(3-фторбензилокси)фенил]метиламина и метилмалонилхлорида в виде желтоватого масла. Выход=70%. МС: m/e=332,3 (МН). Пример 23. Метиловый эфир N-[4-(3-фторбензилсульфанил)фенил]малонамовой кислоты. а) 1-Фтор-3-(4-нитрофенилсульфанилметил)бензол. Получают по аналогии с примером 8 из 4-нитротиофенола и 3-фторбензилбромида в виде твердого вещества желтоватого цвета. Выход=54%. б) 4-(3-Фторбензилсульфанил)фениламин. 1,75 г (6,7 ммоль) 1-фтор-3-(4-нитрофенилсульфанилметил)бензола и 5,55 г (100 ммоль) железапорошка суспендируют в 35 мл воды и 0,2 мл уксусной кислоты. Смесь нагревают в течение ночи при 90C, затем охлаждают и обрабатывают насыщенным раствором карбоната натрия. Суспензию отфильтровывают, твердый остаток несколько раз промывают этилацетатом и водную фазу 3 раза экстрагируют этилацетатом. Объединенные органические фазы высушивают и упаривают с получением 1,18 г (76%) желтоватого воскообразного твердого вещества. МС: m/e=234,3 (МН). в) Метиловый эфир N-[4-(3-фторбензилсульфанил)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(3-фторбензилсульфанил)фениламина и метилмалонилхлорида в виде твердого вещества желтоватого цвета. Выход=64%. МС: m/e=334,2 (МН). Пример 24. N-[4-(3-Фторбензилсульфанил)фенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(3-фторбензилсульфанил)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=47%. МС:m/e=319,3 (МН). Пример 25. Метиловый эфир N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты. а) 2,4-Дифтор-1-(4-нитрофеноксиметил)бензол. Получают по аналогии с примером 8 из 4-нитрофенола и 2,4-дифторбензилбромида в виде бесцветного твердого вещества. Выход=86%. МС: m/e=265,1 (М+). б) 4-(2,4-Дифторбензилокси)фениламин. Получают по аналогии с примером 8 б посредством гидрирования 2,4-дифтор-1-(4-нитрофеноксиметил)бензола в виде твердого вещества коричневого цвета. Выход=99%. МС: m/e=235,1 (М+). в) Метиловый эфир N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(2,4-дифторбензилокси)фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=99%. МС: m/e=336,2 (МН). Пример 26. Метиловый эфир N-[4-(2-фторбензилокси)фенил]малонамовой кислоты. а) 1-Фтор-2-(4-нитрофеноксиметил)бензол. Получают по аналогии с примером 8 из 4-нитрофенола и 2-фторбензилбромида в виде бесцветного твердого вещества. Выход=74%. МС: m/e=247,1 (М+). б) 4-(2-Фторбензилокси)фениламин. Получают по аналогии с примером 8 б посредством гидрирования 1-фтор-2-(4-нитрофенокси)метил- 12009372 бензола в виде коричневого масла. Выход=99%. МС: m/e=217,2 (М+). в) Метиловый эфир N-[4-(2-фторбензилокси)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(2-фторбензилокси)фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=70%. МС: m/e=318,2 (МН). Пример 27. Метиловый эфир N-[4-(2,4,5-трифторбензилокси)фенил]малонамовой кислоты. а) 1,2,4-Трифтор-5-(4-нитрофеноксиметил)бензол. Получают по аналогии с примером 8 из 4-нитрофенола и 2,4,5-трифторбензилбромида в виде бесцветного твердого вещества. Выход=92%. МС: m/e=283,0 (М+). б) 4-(2,4,5-Трифторбензилокси)фениламин. Получают по аналогии с примером 8 б посредством гидрирования 1,2,4-трифтор-5-(4-нитрофеноксиметил)бензола в виде твердого вещества красноватого цвета. Выход=97%. МС: m/e=254,1 (МН). в) Метиловый эфир N-[4-(2,4,5-трифторбензилокси)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(2,4,5-трифторбензилокси)фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=91%. МС: m/e=352,2 (М+-Н). Пример 28. N-[4-(2,4-Дифторбензилокси)фенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=49%. МС:m/e=321,1 (МН). Пример 29. N-[4-(2,4,5-Трифторбензилокси)фенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(2,4,5-трифторбензилокси)фенил] малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=52%. МС:m/e=339,2 (МН). Пример 30. N-[4-(2-Фторбензилокси)фенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(2-фторбензилокси)фенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=30%. МС:m/e=303,2 (МН). Пример 31. N-4-[1-(3-Фторфенил)этокси]фенилмалонамид. а) 1-Фтор-3-(1-(4-нитрофенокси)этил)бензол. Получают по аналогии с примером 16 а из 1-(3-фторфенил)этанола (Balasubramanian и соавт., Synth.Commun., 1994, т.24 (8), с.1049) и 4-нитрофенола в виде желтого масла. Выход=77%. МС: m/e=261,2 (М+). б) 4-[1-(3-Фторфенил)этокси]фениламин. Получают по аналогии с примером 8 б посредством гидрирования 1-фтор-3-(1-(4-нитрофенокси) этил)бензола в виде желтоватого масла. Выход=95%. МС: m/e=232,2 (МН). в) Метиловый эфир N-4-[1-(3-фторфенил)этокси]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[1-(3-фторфенил)этокси]фениламина и метилмалонилхлорида в виде твердого вещества желтоватого цвета. Выход=30%. МС: m/e=332,4 (МН). г) N-4-[1-(3-Фторфенил)этокси]фенилмалонамид. Получают по аналогии с примером 3 из метилового эфира N-4-[l-(3-фторфенил)этокси]фенилмалонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=55%. МС:m/e=317,3 (МН). Пример 32. Метиловый эфир N-(4-бензилоксифенил)малонамовой кислоты. Получают по аналогии с примером 20 в из 4-бензилоксианилина и метилмалонилхлорида в виде твердого вещества желтоватого цвета. Выход=62%. МС: m/e=300,2 (МН). Пример 33. N-(4-Бензилоксифенил)малонамид. Получают по аналогии с примером 3 из метилового эфира N-(4-бензилоксифенил)малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=85%. МС: m/e=285,1 (МН). Пример 34. N-[4-(4-Хлорбензилокси)фенил]малонамид. а) N-(4-Гидроксифенил)малонамид. Суспензию 6,0 г (18,5 ммоль) N-(4-бензилоксифенил)малонамида в 150 мл метанола обрабатывают 0,8 г 5% палладия на угле. Гидрирование проводят при к.т. и атмосферном давлении в течение ночи. Затем реакционную смесь доводят до кипения и отфильтровывают в горячем виде. Охлаждение и фильтрация приводят к 3,56 г (99%) соединения, указанного в заголовке, в виде бесцветного твердого вещества. МС: m/e=285,1 (МН). б) N-[4-(4-Хлорбензилокси)фенил]малонамид. Получают по аналогии с примером 8 из N-(4-гидроксифенил)малонамида и 4-хлорбензилбромида в виде бесцветного твердого вещества. Выход=18%. МС: m/e=319,1 (МН). Пример 35. N-[4-(3-Фторбензилокси)фенил]-2-гидразинокарбонилацетамид. Суспензию 0,35 г (1,1 ммоль) метилового эфира N-[4-(3-фторбензилокси)фенил]малонамовой кислоты в 7 мл метанола обрабатывают 83 мг (1,7 ммоль) гидразингидрата. Реакционную смесь кипятят 2 ч,после чего добавляют другую порцию 300 мг (6 ммоль) гидразин гидрата и продолжают кипятить еще 8 ч. Смесь охлаждают и выдерживают в течение ночи в холодильнике. Осадок отфильтровывают и перекристаллизовывают из метанола с получением 0,043 г (12%) грязных бесцветных игл. МС: m/e=318,3 (МН).- 13009372 Пример 36. N-[4-(3-Фторбензилокси)фенил]-N'-гидроксималонамид. Раствор метилата натрия получают растворением 0,23 г (10 ммоль) натрия в 10 мл метанола. Этот раствор охлаждают до 0C и добавляют 0,25 г (5 ммоль) гидрохлорида гидроксиламина, а затем 0,317 г(1 ммоль) метилового эфира N-[4-(3-фторбензилокси)фенил]малонамовой кислоты. Смесь перемешивают 2 ч при к.т., разбавляют 25 мл воды и подкисляют до рН 3 добавлением лимонной кислоты. Осадок отфильтровывают и перекристаллизовывают из этилацетата, получая 0,123 мг (39%) бесцветного твердого вещества. МС: m/e=319,3 (МН). Пример 37. Диметиловый эфир 2-[4-(3-фторбензилокси)фенилкарбамоил]малоновой кислоты. 0,15 г (0,47 ммоль) метилового эфира N-[4-(3-фторбензилокси)фенил]малонамовой кислоты растворяют в 7 мл тетрагидрофурана (ТГФ) и охлаждают до 0C. Добавляют 38 мг (1 ммоль) гидрида натрия(55-65% в масле) и смесь перемешивают 45 мин при к.т. Затем смесь снова охлаждают до 0C и медленно через шприц добавляют раствор 56 мг (0,6 ммоль) метилхлорформиата в 0,5 мл тетрагидрофурана (ТГФ). Желтоватый раствор перемешивают при к.т. 2 ч, обрабатывают приблизительно 40 мл воды, подкисляют до рН 3 лимонной кислотой и экстрагируют трижды этилацетатом. Органический слой высушивают над сульфатом магния и концентрируют в вакууме с получением 212 мг смолы желтого цвета. Хроматографирование (силикагель, этилацетат/циклогексан, 1:1) приводит к 62 мг (35%) твердого вещества бледножелтого цвета. МС: m/e=376,3 (МН). Пример 38. N-[4-(3-Фторбензилокси)-2-гидроксифенил]малонамид. а) 3-(3-Фторбензилокси)фенол. Получают по аналогии с примером 8 из резорцинола и 3-фторбензилбромида в виде бесцветного масла. Выход=7%. МС: m/e=218,1 (М+). б) 5-(3-Фторбензилокси)-2-нитрофенол. 1,0 г (5 ммоль) 3-(3-фторбензилокси)фенола растворяют в 10 мл уксусной кислоты и охлаждают до 10C. 0,44 г (5 ммоль) 65% азотной кислоты растворяют в 10 мл уксусной кислоты и медленно добавляют к первому раствору. Окрашенную смесь перемешивают 15 мин при 10C и 2 ч при к.т. Добавляют 50 мл воды и продукт экстрагируют трижды этилацетатом. Хроматографирование (силикагель, дихлорметан/метанол, 98:2) приводит к 0,38 г (32%) указанного в заголовке продукта в виде твердого вещества желтого цвета. МС: m/e=262,1 (М+-Н). в) 2-Амино-5-(3-фторбензилокси)фенол. Получают по аналогии с примером 8 б посредством гидрирования 5-(3-фторбензилокси)-2-нитрофенола в виде твердого вещества сероватого цвета. Выход=95%. МС: m/e=234,3 (МН). г) Метиловый эфир N-[4-(3-фторбензилокси)-2-гидроксифенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 2-амино-5-(3-фторбензилокси)фенола и метилмалонилхлорида в виде твердого вещества желтоватого цвета. Выход=90%. МС: m/e=334,3 (МН). д) N-[4-(3-Фторбензилокси)-2-гидроксифенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(3-фторбензилокси)-2-гидроксифенил]малонамовой кислоты и гидроксида аммония в виде бесцветного твердого вещества. Выход=23%. МС: m/e=319,4 (МН). Пример 39. Метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты. а) 1-(2-Фтор-4-иодфенил)-2,5-диметил-1 Н-пиррол. Раствор 2-фтор-4-иоданилина (25,3 г, 107 ммоль), ацетонилацетона (14,9 г, 131 ммоль) и паратолуолсульфокислоты (203 мг, 1 ммоль) в сухом толуоле кипятят 1 ч с насадкой Дина-Старка. После охлаждения до к.т. смесь выливают в насыщенный раствор гидрокарбоната натрия. Органический слой отделяют, промывают солевым раствором, высушивают над сульфатом натрия, отфильтровывают и затем кипятят с активированным углем. Фильтрация для удаления активированного угля и последующее упаривание приводят к соединению, указанному в заголовке (3,2 г, 98%), в виде твердого вещества светлокоричневого цвета. МС: m/e=315,1 (МН). б) 1-[2-Фтор-4-(4-фторбензилокси)фенил]-2,5-диметил-1H-пиррол. Раствор 1-(2-фтор-4-иодфенил)-2,5-диметил-1 Н-пиррола (33,18 г, 105 ммоль), 4-фторбензилового спирта (26,6 г, 211 ммоль), карбоната цезия (68,6 г, 211 ммоль), иодида меди (I) (2,0 г, 11 ммоль) и 1,10 фенантролина (3,8 г, 21 ммоль) в толуоле (52 мл) нагревают при 100C в автоклаве в течение 48 ч. После охлаждения до к.т. смесь отфильтровывают и выливают в 1 н. раствор гидроксида натрия. Полученную смесь экстрагируют толуолом и органические экстракты промывают солевым раствором, высушивают и упаривают. Остаток растирают с кипящим гексаном с получением соединения, указанного в заголовке(24,7 г, 75%), в виде твердого вещества светло-коричневого цвета. МС: m/e=314,1 (МН). в) Гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1). Раствор 1-[2-фтор-4-(4-фторбензилокси)фенил]-2,5-диметил-1 Н-пиррола (23,7 г, 76 ммоль), гидроксида калия (8,5 г, 151 ммоль), гидрохлорида гидроксиламина (62,5 г, 899 ммоль) в воде (125 мл) и пропан-2-оле (250 мл) нагревают при 100C в течение 36 ч. После охлаждения до к.т. смесь выливают в воду и экстрагируют диэтиловым эфиром. Затем объединенные органические слои промывают солевым раствором, высушивают и полученный раствор разбавляют HCl в диэтиловом эфире. Образующийся осадок- 14009372 отфильтровывают с получением соединения, указанного в заголовке (15,2 г, 74%), в виде твердого вещества светло-коричневого цвета. МС: m/e=236,0 (М+-Cl). г) Метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из гидрохлорида 2-фтор-4(4-фторбензилокси)фениламина (1:1) в виде твердого вещества светло-желтого цвета. Выход=95%. МС:m/e=236,2 (МН). Альтернативно гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1) может быть получен следующим образом. д) 2-Фтор-4-(4-фторбензилокси)нитробензол. Раствор 3-фтор-4-нитрофенола (5,0 г, 32 ммоль) и 4-фторбензилбромида (6,3 г, 33 ммоль) в ацетоне(50 мл), содержащий карбонат калия (5,3 г, 38 ммоль), нагревают при кипении в течение 2 ч. После охлаждения до к.т. смесь фильтруют и упаривают с получением соединения, указанного в заголовке (7,3 г,86%), в виде твердого вещества светло-желтого цвета. МС: m/e=265,1 (МН). е) Гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1). Раствор 2-фтор-4-(4-фторбензилокси)нитробензола (7,3 г, 27 ммоль) в этилацетате (160 мл) гидрируют в присутствии Pt/C (5%, 1,1 г) при к.т. в течение 12 ч. Затем смесь фильтруют и добавляют HCl в диэтиловом эфире. Образующийся остаток отфильтровывают и сушат с получением соединения, указанного в заголовке (7,3 г, 99%), в виде твердого вещества белого цвета. МС: m/e=236,2 (М+-Cl). Пример 40. N-[2-Фтор-4-(4-фторбензилокси)фенил]малонамид. Раствор метилового эфира N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты (150 мг,0,45 ммоль) и гидроксида аммония (2,0 мл) в ТГФ (1,0 мл) в запаянной трубке нагревают при 55C в течение 6 ч. После охлаждения до к.т. смесь упаривают и соединение, указанное в заголовке (60 мг, 42%),очищают растиранием из диэтилового эфира. МС: m/е=321,2 (МН). Пример 41. Метиловый эфир N-[4-(3,5-бис(трифторметил)бензилокси)-2-фторфенил]малонамовой кислоты. а) 4-(3,5-бис(Трифторметил)бензилокси)-2-фторнитробензол. Как описано в примере 39 д, 3-фтор-4-нитрофенол (5 г, 32 ммоль) был преобразован в соединение,указанное в заголовке (12,2 г, 99%) [при использовании 3,5-бис(трифторметил)бензилбромида (10,3 г,33 ммоль) вместо 4-фторбензилбромида], которое получено в виде твердого вещества светло-желтого цвета. МС: m/e=383,0 (М+). б) Гидрохлорид 4-(3,5-бис(трифторметил)бензилокси)-2-фторфениламина (1:1). Как описано в примере 39 е, 4-(3,5-бис(трифторметил)бензилокси)-2-фторнитробензол (12,2 г, 32 ммоль) был преобразован в соединение, указанное в заголовке (8,3 г, 66%), которое получено в виде твердого вещества светло-розового цвета. МС: m/e=388,2 (М+-Н). в) Метиловый эфир N-[4-(3,5-бис(трифторметил)бензилокси)-2-фторфенил]малонамовой кислоты. Как описано в примере 39 г, гидрохлорид 4-(3,5-бис(трифторметил)бензилокси)-2-фторфениламина(1:1) (500 мг, 1 ммоль) был преобразован в соединение, указанное в заголовке (590 мг, 92%), которое получено в виде твердого вещества не совсем белого цвета. МС: m/e=454,2 (МН). Пример 42. N-[4-(3,5-бис(Трифторметил)бензилокси)-2-фторфенил]малонамид. Как описано в примере 40, метиловый эфир N-[4-(3,5-бис(трифторметил)бензилокси)-2-фторфенил] малонамовой кислоты (250 мг, 0,56 ммоль) был преобразован в соединение, указанное в заголовке (84 мг,35%), которое получено в виде твердого вещества белого цвета после очистки хроматографией на силикагеле с использованием смеси дихлорметан/метанол (9:1). МС: m/e=439,2 (МН). Пример 43. Метиловый эфир N-[2-фтор-4-(4-трифторметилбензилокси)фенил]малонамовой кислоты. а) 2-Фтор-4-(4-трифторметилбензилокси)нитробензол. Как описано в примере 39 д, 3-фтор-4-нитрофенол (5 г, 32 ммоль) был преобразован в соединение,указанное в заголовке (9,9 г, 99%) [при использовании 3-(трифторметил)бензилбромида (8,0 г, 33 ммоль) вместо 4-фторбензилбромида], которое получено в виде твердого вещества светло-желтого цвета. МС:m/e=315,0 (М+). б) Гидрохлорид 2-фтор-4-(4-трифторметилбензилокси)фениламина (1:1). Как описано в примере 39 е, 2-фтор-4-(4-трифторметилбензилокси)нитробензол (4,9 г, 15 ммоль) был преобразован в соединение, указанное в заголовке (3,0 г, 60%), которое получено в виде твердого вещества серого цвета. в) Метиловый эфир N-[2-фтор-4-(4-трифторметилбензилокси)фенил]малонамовой кислоты. Как описано в примере 39 г, гидрохлорид 2-фтор-4-(4-трифторметилбензилокси)фениламина (1:1)(500 мг, 1 ммоль) был преобразован в соединение, указанное в заголовке (700 мг, 98%), которое получено в виде твердого вещества не совсем белого цвета. МС: m/e=386,2 (МН). Пример 44. N-[2-Фтор-4-(4-трифторметилбензилокси)фенил]малонамид. Как описано в примере 40, метиловый эфир N-[2-фтор-4-(4-трифторметилбензилокси)фенил]малонамовой кислоты (250 мг, 0,65 ммоль) был преобразован в соединение, указанное в заголовке (94 мг,39%), которое получено в виде твердого вещества белого цвета после очистки хроматографированием на силикагеле с использованием смеси дихлорметан/метанол (9:1). МС: m/e=371,2 (МН).- 15009372 Пример 45. Метиловый эфир N-[4-(3-фторбензилокси)-3-метоксифенил]малонамовой кислоты. а) 1-(3-Фторбензилокси)-2-метокси-4-нитробензол. Получают по аналогии с примером 8 из 4-нитрогваякола и 3-фторбензилбромида в виде бесцветного масла. Выход=74 %. МС: m/e=277,1 (М+). б) 4-(3-Фторбензилокси)-3-метоксифениламин. Получают по аналогии с примером 8 б посредством гидрирования 1-(3-фторбензилокси)-2-метокси 4-нитробензола. Сырую реакционную смесь используют на следующей стадии без очистки. в) Метиловый эфир N-[4-(3-фторбензилокси)-3-метоксифенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(3-фторбензилокси)-3-метоксифениламина и метилмалонилхлорида в виде твердого вещества желтоватого цвета. Выход=89%. МС: m/e=348,2 (МН). Пример 46. N-[4-(3-Фторбензилокси)-3-метоксифенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(3-фторбензилокси)-3-метоксифенил]малонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=71%. МС: m/e=333,0 (МН). Пример 47. Метиловый эфир N-[4-(3-фторбензилокси)-3-метилфенил]малонамовой кислоты. а) 1-(3-Фторбензилокси)-2-метил-4-нитробензол. Получают по аналогии с примером 8 из 2-метил-4-нитрофенола и 3-фторбензилбромида в виде бесцветного масла. Выход=62%. МС: m/e=261,1 (М+). б) 4-(3-Фторбензилокси)-3-метилфениламин. Получают по аналогии с примером 8 б посредством гидрирования 1-(3-фторбензилокси)-2-метил-4 нитробензола. Сырую реакционную смесь используют на следующей стадии без очистки. с) Метиловый эфир N-[4-(3-фторбензилокси)-3-метилфенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 4-(3-фторбензилокси)-3-метилфениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=98%. МС: m/e=332,0 (МН). Пример 48. N-[4-(3-Фторбензилокси)-3-метилфенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[4-(3-фторбензилокси)-3-метилфенил] малонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=60%. МС: m/e=317,0 (МН). Пример 49. Метиловый эфир N-[3-хлор-4-(3-фторбензилокси)фенил]малонамовой кислоты. а) 2-Хлор-1-(3-фторбензилокси)-4-нитробензол. Получают по аналогии с примером 8 из 2-хлор-4-нитрофенола и 3-фторбензилбромида в виде бесцветного твердого вещества. Выход=84%. МС: m/e=281,0 (М+). б) 3-Хлор-4-(3-фторбензилокси)фениламин. Получают по аналогии с примером 8 б посредством гидрирования 2-хлор-1-(3-фторбензилокси)-4 нитробензола. Сырую реакционную смесь используют на следующей стадии без очистки. в) Метиловый эфир N-[3-хлор-4-(3-фторбензилокси)фенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 3-хлор-4-(3-фторбензилокси)фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=78%. МС: m/e=352,1 (МН). Пример 50. N-[3-Хлор-4-(3-фторбензилокси)фенил]малонамид. Получают по аналогии с примером 3 из метилового эфира N-[3-хлор-4-(3-фторбензилокси)фенил] малонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=100%. МС: m/e=337,1 (МН). Пример 51. [2-Фтор-4-(4-фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты. Смесь гидрохлорида 2-фтор-4-(4-фторбензилокси)фениламина (1:1) (272 мг, 1 ммоль), 1-карбоксициклопропанкарбоксамида (129 мг, 1 ммоль), гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI, 211 мг, 1,1 ммоль) и триэтиламина (111 мг, 1,1 ммоль) в дихлорметане (7 мл) перемешивают при к.т. в течение 2 ч. Затем смесь выливают в воду и экстрагируют дихлорметаном. Объединенные органические экстракты сушат и упаривают с получением соединения, указанного в заголовке (130 мг,38%) в виде твердого вещества светло-коричневого цвета после очистки хроматографированием на силикагеле с использованием смеси этилацетат:гептан (от 1:1 до 3:1). МС: m/e=347,0 (МН). Пример 52. Метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]-2,2-диметилмалонамовой кислоты. Смесь метилового эфира N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты (335 мг, 1 ммоль),гидрида натрия (55%, 873 мг, 2 ммоль) и иодометана (213 мг, 1,5 ммоль) перемешивают при к.т. в течение 3 ч. Затем смесь выливают в воду и экстрагируют этилацетатом. Объединенные органические экстракты сушат и упаривают с получением соединения, указанного в заголовке (83 мг, 23%) в виде твердого вещества светло-желтого цвета после очистки хроматографированием на силикагеле с использованием смеси этилацетат:гептан (от 1:1 до 3:1). МС: m/e=364,1 (МН). Пример 53. Этиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты. Соединение, указанное в заголовке, получают по аналогии с примером 1 из гидрохлорида 2-фтор-4(4-фторбензилокси)фениламина (1:1) [с использованием этилмалонил хлорида вместо метилмалонилхлорида] в виде твердого вещества светло-желтого цвета. Выход=84%. МС: m/e=350,3 (МН). Пример 54. Метиловый эфир N-[4-(3-фторбензилокси)-3-формилфенил]малонамовой кислоты.- 16009372 а) 2-(3-Фторбензилокси)-5-нитробензальдегид. Получают по аналогии с примером 8 из 2-гидрокси-5-нитробензальдегида и 3-фторбензилбромида в виде бесцветного твердого вещества. Выход=95%. МС: m/e=275,1 (М+). б) 5-Амино-2-(3-фторбензилокси)бензальдегид. Получают по аналогии с примером 8 б посредством гидрирования 2-(3-фторбензилокси)-5-нитробензальдегида. Сырую реакционную смесь используют на следующей стадии без очистки. в) Метиловый эфир N-[4-(3-фторбензилокси)-3-формилфенил]малонамовой кислоты. Получают по аналогии с примером 20 в из 5-амино-2-(3-фторбензилокси)бензальдегида и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=3%. МС: m/e=344,1 (М+-Н). Пример 55. 2-Этил-N-[4-(3-фторбензилокси)фенил]малонамид. Раствор этанолата натрия получают растворением 46 мг (2 ммоль) натрия в 5 мл этанола. Добавляют 302 мг (1 ммоль) N-[4-(3-фторбензилокси)фенил]малонамида с последующим добавлением 343 мг (2 ммоль) этилиодида. Реакционную смесь кипятят в течение 2,5 ч, гидролизуют и экстрагируют этилацетатом. Хроматографирование (силикагель; дихлорметан/метанол) приводит к 45 мг (14%) бесцветного твердого вещества. МС: m/e=331,3 (МН). Пример 56. Метиловый эфир N-4-[2-(4-фторфенил)винил]фенилмалонамовой кислоты. а) Диэтиловый эфир (4-нитробензил)фосфоновой кислоты. 10 г (46,3 ммоль) 4-нитробензилбромида и 10,03 г (60,3 ммоль) триэтилфосфита растворяют в 25 мл диметилформамида (ДМФА). Реакционную смесь выдерживают при 155C в течение 1,5 ч, разбавляют 20 мл воды и экстрагируют трижды этилацетатом. Органический слой сушат и концентрируют с получением 8,35 г (66%) сырого соединения, указанного в заголовке. МС: m/e=274,1 (МН). б) 4-[2-(4-Фторфенил)винил]-1-нитробензол. 2,63 г гидрида натрия добавляют в 50 мл ДМФА. Смесь охлаждают до 0C и порциями добавляют 16 г(58,6 ммоль) диэтилового эфира (4-нитробензил)фосфоновой кислоты. Раствор перемешивают при к.т. в течение 1,5 ч, затем охлаждают до -10C. К смеси при -10C медленно добавляют раствор 6,09 г (50 ммоль) 4-фторбензальдегида в 10 мл ДМФА. Перемешивание при к.т. в течение 45 мин с последующим добавлением 250 мл воды приводят к осадку, который отфильтровывают и перекристаллизовывают из смеси этанол/вода (85:15) с получением 10,81 г (91%) твердого вещества желтого цвета. МС: m/e=243,1 (М+). в) 4-[2-(4-Фторфенил)винил]фениламин. Раствор 7,3 г (30 ммоль) 4-[2-(4-фторфенил)винил]-1-нитробензола в 250 мл этанола обрабатывают 80 мл водной 25% соляной кислоты. Смесь нагревают до 110C и порциями добавляют 5 г (42 ммоль) олова. После перемешивания в течение 3 ч при 110C суспензию охлаждают до к.т., нейтрализуют добавлением водного гидроксида натрия и экстрагируют трижды дихлорметаном. Сушат над сульфатом магния и упаривают с получением 5,46 г (85%) бесцветного твердого вещества. МС: m/e=214,2 (МН). г) Метиловый эфир N-4-[2-(4-фторфенил)винил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(4-фторфенил)винил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=97%. МС: m/e=314,0 (МН). Пример 57. N-4-[2-(4-Фторфенил)винил]фенилмалонамид. Получают по аналогии с примером 3 из метилового эфира N-4-[2-(4-фторфенил)винил]фенилмалонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=89%. МС:m/e=299,2 (МН). Пример 58. Метиловый эфир N-4-[2-(3-фторфенил)винил]фенилмалонамовой кислоты. а) 4-[2-(3-Фторфенил)винил]-1-нитробензол. Получают по аналогии с примером 56 б из диэтилового эфира (4-нитробензил)фосфоновой кислоты и 3-фторбензальдегида в виде твердого вещества желтого цвета. Выход=82%. МС: m/e=243,0 (М+). б) 4-[2-(3-Фторфенил)винил 1 фениламин. 2,41 г (10 ммоль) 4-[2-(3-фторфенил)винил]-1-нитробензола растворяют в 25 мл этилацетата и обрабатывают 240 мг 5% платины на угле. Гидрирование проводят при к.т. и атмосферном давлении в течение 4 ч. Катализитор отфильтровывают и фильтрат концентрируют. Остаток кристаллизуют из смеси диэтиловый эфир/гептан с получением 1,32 г (62%) твердого вещества оранжевого цвета. МС: m/e=213,1 (М+). в) Метиловый эфир N-4-[2-(3-фторфенил)винил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(3-фторфенил)винил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=99%. МС: m/e=313,9 (МН). Пример 59. N-4-[2-(3-Фторфенил)винил]фенилмалонамид. Получают по аналогии с примером 3 из метилового эфира N-4-[2-(3-фторфенил)винил]фенилмалонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=68%. МС:m/e=299,2 (МН). Пример 60. Метиловый эфир N-4-[2-(4-фторфенил)этил]фенилмалонамовой кислоты. а) 4-[2-(4-Фторфенил)этил]фениламин. 3,46 г 4-[2-(4-фторфенил)винил]фениламина растворяют в 100 мл ТГФ, обрабатывают 350 мг 10% палладия на угле и гидрируют при к.т. и атмосферном давлении в течение приблизительно 4 ч. Катализа- 17009372 тор отфильтровывают и фильтрат концентрируют с получением 3,46 г (99%) твердого вещества желтого цвета. МС: m/e=216,9 (МН). б) Метиловый эфир N-4-[2-(4-фторфенил)этил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(4-фторфенил)этил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=99%. МС: m/e=316,0 (МН). Пример 61. N-4-[2-(4-Фторфенил)этил]фенилмалонамид. Получают по аналогии с примером 3 из метилового эфира N-4-[2-(4-фторфенил)этил]фенилмалонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=94%. МС:m/e=301,1 (МН). Пример 62. Метиловый эфир N-4-[2-(3-фторфенил)этил]фенилмалонамовой кислоты. а) 4-[2-(3-Фторфенил)этил]фениламин. Получают по аналогии с примером 60 а посредством гидрирования 4-[2-(3-фторфенил)винил]фениламина в виде твердого вещества желтого цвета. Выход=100%. МС: m/e=215,1 (М+). б) Метиловый эфир N-4-[2-(3-фторфенил)этил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(3-фторфенил)этил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=95%. МС: m/e=316,0 (МН). Пример 63. Метиловый эфир N-4-[2-(4-метоксифенил)винил]фенилмалонамовой кислоты. а) 4-[2-(4-Метоксифенил)винил]фениламин. Получают по аналогии с примером 56 б из диэтилового эфира (4-нитробензил)фосфоновой кислоты и 4-метоксибензальдегида в виде твердого вещества желтого цвета. Выход=69%. МС: m/e=225,9 (М+). б) Метиловый эфир N-4-[2-(4-метоксифенил)винил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(4-метоксифенил)винил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=66%. МС: m/e=326,1 (МН). Пример 64. Метиловый эфир N-4-[2-(4-хлорфенил)этил]фенилмалонамовой кислоты. а) 4-[2-(4-Хлорфенил)винил]-1-нитробензол. Получают по аналогии с примером 56 б из диэтилового эфира (4-нитробензил)фосфоновой кислоты и 4-хлорбензальдегида в виде твердого вещества желтого цвета. Выход=95%. МС: m/e=259,1 (М+). б) 4-[2-(4-Хлорфенил)этил]фениламин. Раствор 5,0 г (19,2 ммоль) 4-[2-(4-хлорфенил)винил]-1-нитробензола в 100 мл этилацетата обрабатывают 200 мг 5% платины на угле. Гидрирование проводят при к.т. и атмосферном давлении в течение ночи. Катализатор отфильтровывают и фильтрат упаривают с получением 3,17 г (71%) твердого вещества бледно-желтого цвета. МС: m/e=231,9 (МН). в) Метиловый эфир N-4-[2-(4-хлорфенил)этил]фенилмалонамовой кислоты. Получают по аналогии с примером 20 в из 4-[2-(4-хлорфенил)этил]фениламина и метилмалонилхлорида в виде бесцветного твердого вещества. Выход=99%. МС: m/e=332,1 (МН). Пример 65. N-4-[2-(4-Хлорфенил)этил]фенилмалонамид. Получают по аналогии с примером 3 из метилового эфира N-4-[2-(4-хлорфенил)этил]фенилмалонамовой кислоты и 7 М аммиака в метаноле в виде бесцветного твердого вещества. Выход=65%. МС:(трет-бутилоксикарбонилглицин) (263 мг, 1,5 ммоль), N,N'-дициклогексилкарбодиимида (206 мг, 1 ммоль) и пиридина (127 мг, 1,6 ммоль) в этилацетате (6 мл) перемешивают при к.т. в течение 3 ч. После этого реакционную смесь выливают в насыщенный раствор гидрокарбоната натрия и смесь экстрагируют этилацетатом. Объединенные органические слои промывают солевым раствором и сушат. Фильтрация и упаривание приводят к соединению, указанному в заголовке (180 мг, 46%), в виде твердого вещества светло-коричневого цвета после хроматографирования на силикагеле с использованием смеси этилацетат:гептан (от 1:1 до 4:1). МС: m/e=393,1 (МН). б) Гидрохлорид 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамида (1:1). Раствор трет-бутилового эфира [2-фтор-4-(4-фторбензилокси)фенилкарбамоил]метилкарбамовой кислоты (148 мг, 0,4 ммоль) в HCl в диоксане (4 М, 3 мл) перемешивают при к.т. в течение 1 ч. Образующийся осадок отфильтровывают с получением соединения, указанного в заголовке (112 мг, 90%), в виде твердого вещества белого цвета. МС: m/e=293,1 (М+-Cl). Пример 67. (R)-2-Амино-N-[2-фтор-4-(4-фторбензилокси)фенил]пропионамид. Как описано в примере 66 а и 66 б, гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1) (200 мг,0,7 ммоль) преобразовывают в соединение, указанное в заголовке (127 мг, 39%) [с использованием БОК-DAla-ОН вместо БОК-Gly], которое получают в виде твердого вещества белого цвета. МС: m/e=307,0 (М+-Cl). Пример 68. 2-Амино-N-[2-фтор-4-(4-фторбензилокси)фенил]пропионамид. Как описано в примере 66 а и 66 б, гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1) (200 мг,0,7 ммоль) преобразовывают в соединение, указанное в заголовке (41 мг, 15%) [с использованием БОК-DLAla-ОН вместо БОК-Gly], которое получают в виде твердого вещества белого цвета. МС: m/е=306,9 (МН).- 18009372 Пример 69. Хлорид 1-[2-фтор-4-(4-фторбензилокси)фенилкарбамоил]-2S-метилпропиламмония. Как описано в примере 66 а и 66 б, гидрохлорид 2-фтор-4-(4-фторбензилокси)фениламина (1:1) (200 мг,0,7 ммоль) преобразовывают в соединение, указанное в заголовке (47 мг, 12%) [с использованием БОКL-Val (валин) вместо БОК-Gly (глицин)], которое получают в виде твердого вещества белого цвета. МС:m/e=335,2 (МН). Пример 70. 2-Ацетиламино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамид. Раствор гидрохлорида 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамида (1:1) (50 мг,0,15 ммоль), ацетилхлорида (14,4 мг, 0,18 ммоль), триэтиламина (31 мг, 0,30 ммоль) перемешивают при 0C в течение 4 ч. Затем смесь разбавляют водой и экстрагируют дихлорметаном. Органический слой промывают солевым раствором, сушат, фильтруют и упаривают с получением соединения, указанного в заголовке (50 мг, 99%), в виде твердого вещества белого цвета. МС: m/e=335,2(МН). Пример 71. (R)-2-Ацетиламино-N-[2-фтор-4-(4-фторбензилокси)фенил]пропионамид. Как описано в примере 70, (R)-2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]пропионамид (50 мг,0,15 ммоль) преобразовывают в соединение, указанное в заголовке (43 мг, 76%), которое получают в виде твердого вещества белого цвета. МС: m/e=349,4 (МН). Пример 72. N-[2-Фтор-4-(4-фторбензилокси)фенил]-2-формиламиноацетамид. Стадия 1. Уксусный ангидрид (40 мг, 0,39 ммоль) и муравьиную кислоту (22 мг, 0,48 ммоль) смешивают при 0C и затем нагревают при 60C в течение 1 ч. Стадия 2. В это время гидрохлорид 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамида (1:1) (50 мг,0,15 ммоль) экстрагируют дихлорметаном и насыщенным раствором гидрокарбоната натрия и органический слой упаривают. Затем к смеси (ацетил)(формил)ангидрида (стадия 1) в сухом ТГФ (0,5 мл) добавляют раствор амина (стадия 2) в сухом ТГФ (1 мл) при к.т. и полученную смесь перемешивают 10 мин. Затем реакционную смесь упаривают с получением соединения, указанного в заголовке (44,1 мг, 91%), в виде твердого вещества белого цвета. МС: m/e=321,1 (МН). Пример 73. (R)-N-[2-Фтор-4-(4-фторбензилокси)фенил]-2-формиламинопропионамид. Как описано в примере 72, (R)-2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]пропионамид (50 мг,0,15 ммоль) преобразовывают в соединение, указанное в заголовке (16 мг, 30%), которое получают в виде твердого вещества белого цвета. МС: m/e=333,1 (М+-Н). Пример 74. Гидрохлорид 2-амино-N-[2-фтор-4-(3-фторбензилокси)фенил]ацетамида (1:1). Как описано в примере 66 а и 66 б, гидрохлорид 2-фтор-4-(3-фторбензилокси)фениламина (1:1) (500 мг,2,1 ммоль) преобразовывают в соединение, указанное в заголовке (300 мг, 44%), которое получают в виде твердого вещества белого цвета. МС: m/e=293,1 (М+-Cl). Пример 75. 2-Ацетиламино-N-[2-фтор-4-(3-фторбензилокси)фенил]ацетамид. Как описано в примере 70, гидрохлорид 2-фтор-4-(3-фторбензилокси)фениламина (1:1) (150 мг,0,45 ммоль) преобразовывают в соединение, указанное в заголовке (127 мг, 84%), которое получают в виде твердого вещества белого цвета. МС: m/e=335,2 (МН). Пример 76. N-[2-Фтор-4-(3-фторбензилокси)фенил]-2-формиламиноацетамид. Как описано в примере 72, гидрохлорид 2-фтор-4-(3-фторбензилокси)фениламина (1:1) (133 мг,0,4 ммоль) преобразовывают в соединение, указанное в заголовке (115 мг, 89%), которое получают в виде твердого вещества белого цвета. МС: m/e=321,1 (МН). Пример 77. Гидрохлорид 2-амино-N-[2-фтор-4-(4-трифторметилбензилокси)фенил]ацетамида (1:1). Как описано в примере 66 а и 66 б, гидрохлорид 2-фтор-4-(4-трифторметилбензилокси)фениламина(1:1) (600 мг, 2,1 ммоль) преобразовывают в соединение, указанное в заголовке (155 мг, 20%), которое получают в виде твердого вещества белого цвета. МС: m/e=343,1 (М+-Cl). Пример 78. 2-Ацетиламино-N-[2-фтор-4-(4-трифторметилбензилокси)фенил]ацетамид. Как описано в примере 70, гидрохлорид 2-фтор-4-(4-трифторметилбензилокси)фениламина (1:1)(120 мг, 0,32 ммоль) преобразовывают в соединение, указанное в заголовке (119 мг, 98%), которое получают в виде твердого вещества белого цвета. МС: m/e=385,2 (МН). Пример 79. Гидрохлорид 2-амино-N-[4-(3,5-бис(трифторметил)бензилокси)-2-фторфенил]ацетамида (1:1). Как описано в примере 66 а и 66 б, гидрохлорид 4-(3,5-бис(трифторметил)бензилокси)-2-фторфениламина (1:1) (500 мг, 1,4 ммоль) преобразовывают в соединение, указанное в заголовке (180 мг, 30%), которое получают в виде твердого вещества белого цвета. МС: m/e=411,2 (М+-Cl). Пример 80. 2-Ацетиламино-N-[4-(3,5-бис(трифторметил)бензилокси)-2-фторфенил]ацетамид. Как описано в примере 70, гидрохлорид 4-(3,5-бис(трифторметил)бензилокси)-2-фторфениламина(1:1) (130 мг, 0,29 ммоль) преобразовывают в соединение, указанное в заголовке (107 мг, 81%), которое получают в виде твердого вещества белого цвета. МС: m/e=453,2 (МН). Пример 81. Гидрохлорид 2-амино-N-[4-(3-(фторбензилокси)фенил]ацетамида. а) трет-Бутиловый эфир [4-(3-(фторбензилокси)фенилкарбамоил]метилкарбамовой кислоты.- 19009372 Смесь 0,345 г (1,59 ммоль) 4-(3-фторбензилокси)фениламина и 0,278 г (1,59 ммоль) N-трет-бутилоксикарбонилглицина (БОК-Gly) растворяют в 10 мл этилацетата, охлаждают до 0C и добавляют сразу 0,328 г (1,59 ммоль) N,N'-дициклогексилкарбодиимида. Полученный раствор дополнительно перемешивают в течение 3 ч при к.т. и фильтруют. Фильтрат промывают трижды насыщенным раствором карбоната натрия, сушат и концентрируют. Остаток растирают с 20 мл диэтилового эфира с получением 0,353 г(59%) соединения, указанного в заголовке, в виде бесцветного твердого вещества. МС: m/e=375,4 (МН). б) Гидрохлорид 2-амино-N-[4-(3-фторбензилокси)фенил]ацетамида. Раствор 0,166 г (0,44 ммоль) трет-бутилового эфира [4-(3-фторбензилокси)фенилкарбамоил]метилкарбамовой кислоты в 1 мл диэтилового эфира обрабатывают 3 мл насыщенного раствора газообразной хлористо-водородной кислоты в диэтиловом эфире. Смесь кипятят 4 ч, выливают в воду и подщелачивают добавлением насыщенного раствора карбоната натрия. Экстрагирование этилацетатом приводит к твердому веществу желтоватого цвета, которое растворяют приблизительно в 1 мл диэтилового эфира и обрабатывают несколькими каплями насыщенного раствора газообразной хлористо-водородной кислоты в диэтиловом эфире. Осадок отфильтровывают с получением 0,051 г (37%) бесцветного твердого вещества. МС: m/e=275,2 (МН). Пример А. Традиционным методом получают таблетки следующего состава. мг/таблетка Активный компонент 100 Порошкообразная лактоза 95 Белый кукурузный крахмал 35 Поливинилпирролидон 8Na-карбоксиметилкрахмал 10 Стеарат магния 2 Масса таблетки 250 Пример В. Традиционным методом получают таблетки следующего состава. мг/таблетка Активный компонент 200 Порошкообразная лактоза 100 Белый кукурузный крахмал 64 Поливинилпирролидон 12Na-карбоксиметилкрахмал 20 Стеарат магния 4 Масса таблетки 400 Пример С. Произведены капсулы следующего состава. мг/капсула Активный компонент 50 Кристаллическая лактоза 60 Микрокристаллическая целлюлоза 34 Тальк 5 Стеарат магния 1 Масса заполненной капсулы 150 Активные компоненты с подходящим размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу гомогенно смешивают друг с другом, просеивают и после этого примешивают тальк и стеарат магния. Полученной смесью заполняют твердые желатиновые капсулы подходящего размера. Пример D. Традиционным методом получают раствор для инъекций, который может иметь следующий состав. Активное вещество 1,0 мг 1 н. HCl 20,0 мкл Уксусная кислота 0,5 мгNaCl 8,0 мг Фенол 10,0 мг 1 н. NaOH Подведение до рН 5H2O Доведение объема до 1 млR21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород, (С 1-С 6)алкил,галоген, галоген-(С 1-С 6)алкил, гидроксигруппу, С 1-С 6 алкоксигруппу или -СНО;R3 обозначает водород или С 1-С 3 алкил;R4, R5 независимо друг от друга выбраны из группы, содержащей водород, С 1-С 6 алкил, С 1-С 6 алкоксигруппу или -СОО(С 1-С 6)алкил; илиR7 и R8 независимо друг от друга выбраны из группы, содержащей водород, С 1-С 6 алкил, NH2 или гидроксигруппу;R обозначает водород или С 1-С 6 алкил;X обозначает -CHRO-, -OCHR-, -CH2S-, -SCH2-, -СН 2 СН 2-, -СН=СН- или -СС-,и их фармацевтически активные кислые соли присоединения, при условии, что исключены следующие соединения:R3 обозначает водород или С 1-С 3 алкил;R21, R22, R23 и R24 независимо друг от друга выбраны из группы, содержащей водород и галоген;R3 обозначает водород или С 1-С 3 алкил;R4 обозначает водород или С 1-С 6 алкил;R5 обозначает водород или С 1-С 6 алкил; или R4 и R5 совместно образуют С 3-С 7 циклоалкильное кольцо;R7 и R8 независимо друг от друга обозначают водород, метил или этил;n означает 1, 2 или 3,и их фармацевтически активные кислые соли присоединения. 3. Соединения общей формулы I по п.1, где X обозначает СН 2 О, R1 обозначает фтор или трифторметил и R6 обозначает -COOCH3-. 4. Соединения по п.3, которые представляют собой метиловый эфир N-[4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[3-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(4-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[2-фтор-4-(3-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2,4-дифторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(2,4,5-трифторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[2-фтор-4-(4-фторбензилокси)фенил]малонамовой кислоты,метиловый эфир N-[4-(3,5-бис-трифторметилбензилокси)-2-фторфенил]малонамовой кислоты,метиловый эфир N-[4-(3-фторбензилокси)-3-метилфенил]малонамовой кислоты или метиловый эфир N-[3-хлор-4-(3-фторбензилокси)фенил]малонамовой кислоты. 5. Соединения формулы I по п.1, где X обозначает CH2O и R6 обозначает -CONH2. 6. Соединения по п.5, которые представляют собой[2-фтор-4-(4-фторбензилокси)фенил]амид амида циклопропан-1,1-дикарбоновой кислоты. 7. Соединения формулы I по п.1, где X обозначает -ОСН 2- и R6 обозначает -NHCOCH3 или -NHCOH. 8. Соединения по п.7, которые представляют собой 2-ацетиламино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамид,2-ацетиламино-N-[2-фтор-4-(3-фторбензилокси)фенил]ацетамид,N-[2-фтор-4-(4-фторбензилокси)фенил]-2-формиламиноацетамид илиN-[2-фтор-4-(3-фторбензилокси)фенил]-2-формиламиноацетамид. 9. Соединения формулы I по п.1, где X обозначает -OCH2- и R6 обозначает -NH2. 10. Соединения по п.9, где соединение представлено 2-амино-N-[2-фтор-4-(4-фторбензилокси)фенил]ацетамидом. 11. Соединения формулы I по п.1, где X обозначает -СН=СН- и R6 обозначает -СООСН 3 или -CONH2. 12. Соединения по п.11, которые представляют собой- 22009372 метиловый эфир N-4-[2-(4-фторфенил)винил]фенилмалонамовой кислоты,амид N-4-[2-(3-фторфенил)винил]фенилмалоновой кислоты,амид N-4-[2-(4-фторфенил)винил]фенилмалоновой кислоты или метиловый эфир N-4-[2-(3-фторфенил)винил]фенилмалонамовой кислоты. 13. Способ получения соединения формулы I, определенного в любом из пп.1-12, включающий взаимодействие соединения формулы с последующим, при необходимости, превращением соединения формулы I в фармацевтически приемлемую соль. 14. Соединение формулы I по любому из пп.1-12, полученное способом по п.13. 15. Лекарственное средство, содержащее одно или несколько соединений, определенных в любом из пп.1-12, и фармацевтически приемлемый наполнитель, для лечения и профилактики заболеваний, опосредствованных ингибиторами моноаминооксидазы В. 16. Лекарственное средство по п.15 для лечения и профилактики болезни Альцгеймера и сенильной деменции. 17. Применение соединения формулы I, определенного в любом из пп.1-12, а также его фармацевтически приемлемых солей для производства лекарственных средств для лечения и профилактики заболеваний, опосредствованных ингибиторами моноаминооксидазы В. 18. Применение по п.17, в котором заболевание представлено болезнью Альцгеймера или сенильной деменцией.
МПК / Метки
МПК: C07C 233/60, C07C 233/25, C07C 233/15, C07C 243/14, C07C 255/23, C07C 233/33, C07C 237/04, C07C 235/16, C07C 323/41, C07C 259/06, C07C 237/22
Метки: ациламинобензольные, моноаминооксидазы, качестве, производные, селективных, ингибиторов
Код ссылки
<a href="https://eas.patents.su/25-9372-n-acilaminobenzolnye-proizvodnye-v-kachestve-selektivnyh-ingibitorov-monoaminooksidazy-v.html" rel="bookmark" title="База патентов Евразийского Союза">N- ациламинобензольные производные в качестве селективных ингибиторов моноаминооксидазы в</a>
Предыдущий патент: Способ управляемой гиперстимуляции яичников и фармацевтический набор для использования в таком способе
Следующий патент: Производные 8-хлор-2,3-бензодиазепина
Случайный патент: Средство для лечения гинекологических заболеваний












