Производные ксантина в качестве селективных агонистов hm74a
Номер патента: 14556
Опубликовано: 30.12.2010
Авторы: Мэйсон Эндрю Макмертри, Хэтли Ричард Джонатан Дэниэл, Пинто Иван Лео
Формула / Реферат
1. Соединение формулы (I)
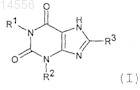
или его фармацевтически приемлемые соли или сольваты,
где R1представляет собой -(алкилен)m-Х-(алкилен)n-Y;
где m и n равны числу атомов углерода в алкиленовой цепи;
X представляет собой группу, выбранную из гетероарила и гетероциклила;
Y представляет собой группу, выбранную из арила, гетероарила и О-арила; которая может быть необязательно замещена одной или несколькими группами, независимо выбранными из C1-6 алкила, C2-6 алкенила, C2-6 алкинила, галогена, NH2, -(СН2)q-(О)р-(СН2)q-N(R5)С(О)OR8, -(СН2)q-N(R5)С(О)R8, -(СН2)q-(О)р-(СН2)q-С(О)NR5R6, -(СН2)q-N(R5)С(О)NR5R6, -(CH2)q-C(O)N((CH2)mOH)R5, -(CH2)q-N(R5)-S(O)2R8, -CH2-S(O)2NR5R6, -C1-6 галогеналкила, -OCF3, -OCH(F)2, -OCH2F, -C(O)OR5, -OR5, -R8CN, CN, -SO2R9, -(CH2)n гетероарила, -(CH2)n гетероциклила, -(CH2)n циклоалкила, -(CH2)n циклоалкенила и -(CH2)n арила;
R2 представляет собой С3-6 алкил;
R3 представляет собой галоген;
R5 и R6независимо выбраны из водорода и C1-4 алкила;
R8 представляет собой С1-4 алкил;
R9 представляет собой группу, выбранную из C1-6 алкил C2-6 алкенила, C2-6 алкинила, -(СН2)n циклоалкила,
-(СН2)n циклоалкенила, -(СН2)n гетероциклила, -(CH2)n арила, -(СН2)n гетероарила и CN;
m представляет собой целое число, выбранное из 3 и 4;
n представляет собой целое число, выбранное из 0 и 1;
р представляет собой целое число, выбранное из 0 и 1;
q представляет собой целое число, выбранное из 0, 1 и 2; и
где гетероарил относится к 5-6-членному моноциклическому ароматическому кольцу или конденсированному 8-10-членному бициклическому ароматическому кольцу, содержащему 1-4 гетероатома, независимо выбранных, каждый, из атома кислорода, азота и серы, причем в кольце могут быть один или несколько необязательных оксозаместителей атомов углерода;
гетероциклил относится к 4-7-членному моноциклическому кольцу или конденсированному 8-12-членному бициклическому кольцу, которое может быть насыщенным или частично ненасыщенным, содержащим 1-4 гетероатома, независимо выбранных, каждый, из атома кислорода, азота или серы, причем в кольце могут быть один или несколько необязательных оксозаместителей атомов углерода;
арил относится к С6-12моноциклическому, бициклическому или трициклическому углеводородному кольцу, где по меньшей мере одно кольцо является ароматическим;
циклоалкил относится к насыщенному моноциклическому углеводородному кольцу из 3-8 атомов углерода;
циклоалкенил относится к ненасыщенному неароматическому моноциклическому углеводородному кольцу из 3-8 атомов углерода, содержащему одну или несколько углерод-углерод двойных связей.
2. Соединение формулы (I)

или его фармацевтически приемлемые соли по п.1,
где R1представляет собой -(алкилен)m-Х-(алкилен)n-Y;
где m и n равны числу атомов углерода в алкиленовой цепи;
X представляет собой группу, выбранную из гетероарила и гетероциклила;
Y представляет собой группу, выбранную из арила, гетероарила и О-арила; которая может быть необязательно замещена одной или несколькими группами, независимо выбранными из C1-6 алкила, C2-6 алкенила, С2-6 алкинила, галогена, -NH2, -(СН2)q-(О)р-(СН2)q-N(R5)С(О)OR8, -(СН2)q-N(R5)С(О)R8, -(СН2)q-(О)р-(СН2)q-C(О)NR5R6, -(СН2)q-N(R5)С(О)NR5R6, -(CH2)q-C(O)N((CH2)mOH)R5, -(CH2)q-N(R5)-S(O)2R8, -CH2-S(O)2NR5R6, -C1-6 галогеналкила, -OCF3, -OCH(F)2, -OCH2F, -C(O)OR5, -OR5, -R8CN, CN, -SO2R9, -(CH2)n гетероарила, -(CH2)n гетероциклила, -(CH2)n циклоалкила, -(CH2)n циклоалкенила и -(CH2)n арила;
R2 представляет собой С3-6 алкил;
R3 представляет собой галоген;
R5 и R6независимо выбраны из водорода и C1-4 алкила;
R8 представляет собой С1-4 алкил;
R9 представляет собой группу, выбранную из C1-6 алкил C2-6 алкенила, C2-6 алкинила, -(СН2)n циклоалкила,
-(СН2)n циклоалкенила, -(СН2)n гетероциклила, -(СН2)n арила, -(СН2)n гетероарила и CN;
m представляет собой целое число, выбранное из 3 и 4;
n представляет собой целое число, выбранное из 0 и 1;
р представляет собой целое число, выбранное из 0 и 1;
q представляет собой целое число, выбранное из 0, 1 и 2.
3. Соединение формулы (I) или его фармацевтически приемлемые соли по п.2, где X представляет собой группу, выбранную из гетероарила.
4. Соединение формулы (I) или его фармацевтически приемлемые соли по п.2 или 3, где X представляет собой группу, выбранную из гетероарила, содержащую гетероатом азота.
5. Соединение формулы (I) или его фармацевтически приемлемые соли по п.4, где X представляет собой оксадиазолил или тетразол.
6. Соединение формулы (I) или его фармацевтически приемлемые соли по любому из пп.2-5, где Y представляет собой группу, выбранную из арила или гетероарила.
7. Соединение формулы (I) или его фармацевтически приемлемые соли по любому из пп.2-6, где Y необязательно замещен одним или несколькими галогеном и C1-6 галогеналкилом.
8. Соединение формулы (I) или его фармацевтически приемлемые соли по любому из пп.2-7, где R3представляет собой хлор.
9. Соединение формулы (I) или его фармацевтически приемлемые соли по любому из пп.2-8, где Y представляет собой фенил, m равно 3, и n равно 1.
10. Соединение формулы (I) или его фармацевтически приемлемые соли по п.2, где X представляет собой тетразолил, R2 представляет собой бутил и R3 представляет собой хлор.
11. Соединение формулы (I) или его фармацевтически приемлемые соли по п.2, где X представляет собой оксадиазолил, Y представляет собой пиридинил, R2 представляет собой бутил, R3 представляет собой хлор, m равно 4 и n равно 0.
12. Соединение формулы (I) по п.2, представляющее собой 3-бутил-8-хлор-1-(3-{5-[(4-фторфенил)метил]-2Н-тетразол-2-ил}пропил)-3,7-дигидро-1H-пурин-2,6-дион
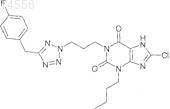
13. Соединение формулы (I) по п.2, представляющее собой 3-бутил-8-хлор-1-(3-{5-[(4-фторфенил)метил]-2Н-тетразол-2-ил}пропил)-3,7-дигидро-1H-пурин-2,6-дион

или его фармацевтически приемлемая соль.
14. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 при лечении человека или в ветеринарии.
15. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 при лечении диабетической дислипидемии, смешанной дислипидемии или гиполипопротеинемии.
16. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 при лечении сахарного диабета по типу II.
17. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 в лечении диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарный диабет по типу II, диабет по типу I, резистентность к инсулину, гиперлипидемию, нервную анорексию, ожирение, заболевание коронарных артерий, тромбоз, стенокардию, хроническую почечную недостаточность, заболевание периферических сосудов или инсульт.
18. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 в получении лекарственного средства для лечения диабетической дислипидемии, смешанной дислипидемии или гиполипопротеинемии.
19. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 в получении лекарственного средства для лечения сахарного диабета по типу II.
20. Применение соединения формулы (I) или его фармацевтически приемлемых солей по любому одному из пп.2-13 в получении лекарственного средства для лечения диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарный диабет по типу II, диабет по типу I, резистентность к инсулину, гиперлипидемию, нервную анорексию, ожирение, заболевание коронарных артерий, тромбоз, стенокардию, хроническую почечную недостаточность или инсульт.
21. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соли по любому из пп.2-13 и по меньшей мере один фармацевтически приемлемый разбавитель, наполнитель или носитель.
22. Способ получения соединения формулы (I) или его фармацевтически приемлемых солей по любому из пп.2-13 из соединения(ий) формулы (II)
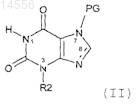
где PG - защитная группа,
включающей
(i) алкилирование у N1 N7 защищенного ксантина;
(ii) алкилирование у N3 N7 защищенного ксантина;
(iii) галогенирование у С8; и
(iv) удаление защитной группы N7;
в любом порядке при условии, что удаление защитной группы выполняют после алкилирования.
Текст
ПРОИЗВОДНЫЕ КСАНТИНА В КАЧЕСТВЕ СЕЛЕКТИВНЫХ АГОНИСТОВ HM74A Хэтли Ричард Джонатан Дэниэл, Мэйсон Эндрю МакМертри, Пинто Иван Лео (GB) Представитель: Изобретение относится к соединениям формулы (I), которые являются производными ксантина,способам получения указанных производных, фармацевтическим композициям, содержащим эти соединения, и применению соединений в терапии, например, в лечении заболеваний, при которых предактивация рецептора НМ 74 А могла бы иметь эффект в отношении заболевания или при которых активация рецептора будет эффективной. 014556 Изобретение относится к соединениям, которые являются производными ксантина, способам получения указанных производных, фармацевтическим средствам, содержащим эти соединения, и применению соединений в терапии, например, в терапии заболеваний, при которых предактивация рецептора НМ 74 А могла бы иметь эффект в отношении заболевания или при которых активация рецептора будет эффективной. Дислипидемия является общим термином, используемым для описания больных с абберантными липопротеиновыми комплексами. Клинически, основные классы соединений, используемые для лечения пациентов с дислипидемией, и соответственно с риском возникновения сердечно-сосудистого заболевания, представляют собой статины, фибраты, полимеры, связывающие желчные кислоты, и никотиновую кислоту. Никотиновую кислоту (ниацин, витамин В) клинически применяли для пациентов с различными формами дислипидемии в течение более 40 лет. Основным действием никотиновой кислоты является ингибирование гормончувствительной триглицеридлипазы (HSL), которое приводит к снижению уровня неэтерифицированных жирных кислот в плазме (NEFA), что в свою очередь изменяет жировой обмен в печени, снижая выработку LDL и VLDL (липопротеины низкой плотности и липопротеины очень низкой плотности). Пониженные уровни VLDL, как полагают, снижают активность белка, переносящего холестериновый эфир (СЕТР), повышая уровни HDL (липопротеины высокой плотности), что может вызывать видимые сердечно-сосудистые улучшения. Таким образом, никотиновая кислота дает весьма желательное изменение липопротеиновых профилей; снижение уровней VLDL и LDL при повышении HDL. Также, в нескольких исследованиях было показано, что никотиновая кислота оказывает благоприятные эффекты на течение заболевания, снижая прогрессирование и усиливая ремиссию атеросклеротических повреждений, и снижая количество сердечно-сосудистых приступов. Наблюдаемое ингибирование HSL при лечении никотиновой кислотой опосредовано снижением циклического аденозинмонофосфата в клетке (сАМР), вызванное G-белок-опосредованным ингибированием аденилилциклазы. В последнее время, связывающиеся с G-белком рецепторы НМ 74 и НМ 74 А определяли как рецепторы никотиновой кислоты (РСТ патентная заявка WO02/84298; Wise et al. J BiolChem., 2003, 278 (11), 9869-9874). Последовательность ДНК НМ 74 А человека можно найти в Genbank; номер доступа AY148884. Два других документа подтверждают это открытие (Tunaru et al. Nature Medicine, 2003, 9(3), 352-255 и Soga et al. Biochem Biophys Res Commun., 2003, 303 (1) 364-369), однако обозначения немного отличаются. В документе Tunaru обозначение НМ 74 человека, авторы обозначают как НМ 74 А, а в документе Soga HM74b соответствует НМ 74 А. Клетки, трансфецированные для экспрессии НМ 74 А и/или НМ 74, усиливают способность вызывать Gi G-белок опосредованные ответы после воздействия никотиновой кислоты. У мыши с недостатком гомолога никотиновой кислоты НМ 7 4 А (mPUMA-G) не происходит снижения уровней NEFA в плазме. Некоторые производные ксантина были синтезированы и описаны в предшествующем уровне техники. Например, в ЕР 0389282 описаны производные ксантина в качестве возможных медиаторов нарушений кровообращения в мозге. Ряд производных ксантина были определены Jacobson et al., J. Med.Chem., 1993, 36, 2639-2644, как антагонисты аденозинового рецептора. Авторы предлагают группу производных ксантина, которые являются селективными агонистами рецептора никотиновой кислоты НМ 74 А и которые, соответственно, являются потенциально эффективными для лечения, профилактики и ослабления заболеваний, при которых предактивация этого рецептора имеет эффект в отношении заболевания или при которых активация рецептора будет эффективной. Сущность изобретения Настоящее изобретение относится к производным ксантина и применению этих производных в терапии, например, в лечении заболеваний, при которых предактивация рецептора НМ 74 А могла бы иметь эффект в отношении заболевания или при которых активация рецептора будет эффективной. Например,для лечения заболеваний липидного обмена, включая дислипидемию или гиполипопротеинемию, таких как диабетическая дислипидемия и смешанная дислипидемия, сердечная недостаточность, гиперхолестеринемия, сердечно-сосудистое заболевание, включая атеросклероз, артериосклероз и гипертриглицеридемию. Как таковые, соединения также могут применяться в качестве лекарственных средств для лечения заболеваний коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности,заболевания периферических сосудов и инсульта, а также сердечно-сосудистых симптомов, связанных с сахарным диабетом по типу II, диабетом по типу I, резистентностью к инсулину, гиперлипидемией,нервной анорексией, ожирением. Также соединения могут применяться для лечения воспалительных заболеваний или состояний, как описано ниже. Промежуточные соединения, композиции, способы и процессы, описанные в настоящем описании,относятся к дополнительным вариантам осуществления изобретения. Подробное описание изобретения В соответствии с одним из аспектов изобретения авторы предлагают по меньшей мере одно химическое соединение, выбранное из соединений формулы (I) и его фармацевтически приемлемых производных, гдеR1 представляет собой -(алкилен)m-Х-(алкилен)n-Y; где m и n равны числу атомов углерода в алкиленовой цепи; где X представляет собой группу, выбранную из гетероарила и гетероциклила; где Y представляет собой группу, выбранную из арила, гетероарила и О-арила; которая может быть необязательно замещена одной или несколькими группами, независимо выбранными из C1-6 алкила, С 2-6 алкенила, С 2-6 алкинила, галогена, -(СН 2)qNR5R7, -(CH2)q-(O)p-(CH2)qN(R5)C(O)OR8, -(CH2)q-N(R5)C(O)R8, -(CH2)q-(О)р-(CH2)q-C(O)NR5R6, -(CH2)q-N(R5)C(O)NR5R6, -(СН 2)qC(О)NСН 2)mOH)R5, -(CH2)q-N(R5)-S(O)2R8, -CH2-S(O)2NR5R6, -C1-6 галогеналкила, -OCF3, -OCH(F)2,-OCH2F, -C(O)OR5, -OR5, -R8CN, CN, -SO2R9, -(CH2)n гетероарила, -(СН 2)n гетероциклила, -(СН 2)n циклоалкила, -(CH2)n циклоалкенила и -(СН 2)n арила;R2 представляет собой C1-6 алкил, который может быть необязательно замещен одной или несколькими группами, независимо выбранными из циклоалкила, C1-6 галогеналкила, галогена, -CN и -OR4;R5 и R6 независимо выбраны из водорода и C1-4 алкила;m представляет собой целое число, выбранное из 3 и 4;n представляет собой целое число, выбранное из 0 и 1; р представляет собой целое число, выбранное из 0 и 1;q представляет собой целое число, выбранное из 0, 1 и 2; иt представляет собой целое число, выбранное из 1 и 2. Предполагается, что соединение(ия) может(гут) быть использовано(ы) для лечения заболеваний,при которых предактивация рецептора НМ 74 А могла бы иметь эффект в отношении заболевания, или при которых активация рецептора будет эффективной. Например, в лечении заболеваний липоидного обмена, включая дислипидемию и гиполипопротеинемию, например диабетическую дислипидемию и смешанную дислипидемию, сердечную недостаточность, гиперхолестеринемию, сердечно-сосудистое заболевание, включая атеросклероз, артериосклероз и гипертриглицеридемию. Как таковые, соединения могут также применяться в качестве лекарственных средств для лечения заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, заболевания периферических сосудов и инсульта, а также сердечно-сосудистых симптомов, связанных с сахарным диабетом по типу II,диабетом по типу I, резистентностью к инсулину, гиперлипидемией, нервной анорексией, ожирением. Как таковые, соединения по настоящему изобретению могут найти применение в качестве агонистов или частичных агонистов рецептора НМ 74 А. Также соединения могут применяться в лечении воспалительных заболеваний или состояний, как описано далее ниже. В одном из вариантов осуществления настоящего изобретения X представляет собой гетероарил. В другом варианте осуществления X представляет собой гетероарил, содержащий гетероатом азота, например, триазолил, фуразанил, оксадиазолил, тетразолил, имидазолил или пиразолил. В следующем варианте осуществления X представляет собой группу, выбранную из оксадиазолила и тетразолила. В другом варианте осуществления Y представляет собой необязательно замещенную группу, выбранную из арила, например, фенила или нафтила, гетероарила, например, пиридинила, тиазолила, тиенила, бензофуранила или индолила и О-арила, например, О-фенила. В следующем варианте осуществления, Y представляет собой необязательно замещенную группу, выбранную из арила или гетероарила. В одном из вариантов осуществления Y выбран из арила. В одном из вариантов осуществления настоящего изобретения Y может быть необязательно замещен одним или несколькими: C1-6 алкилом, C2-6 алкенилом, C2-6 алкинилом, галогеном, -NH2, -(СН 2)q-(O)р(СН 2)q-N(R5)С(О)OR8, -(СН 2)q-N(R5)С(О)R8, -(СН 2)q-(О)р-(CH2)q-C(O)NR5R6, -(CH2)q-N(R5)C(O)N(R5)R6,-(CH2)q-C(O)NCH2)mOH)R5, -(CH2)q-N(R5)-S(O)2R8, -CH2-S(O)2N(R5)R6, -C1-6 галогеналкилом, -OCF3,-OCH(F)2, -OCH2F, -C(O)OR5, -OR5, -R8CN, CN-SO2R9, -(СН 2)n гетероарилом, -(СН 2)n гетероциклилом,-(СН 2)n циклоалкилом, -(CH2)n циклоалкенилом, -(СН 2)n арилом; В следующем варианте осуществления Y замещен одной или несколькими группами, выбранными-2 014556 из OR5, например ОН или OCH3, галогена, например F или Cl, арила, например фенила, C1-6 галогеналкила, например CF3 или CH2CF3, OCF3, R8CN, CN, (CH2)q-N(R5)-S(O)2R8, например NHSO2CH3, и SO2R9,например SO2CH3. В дальнейшем варианте осуществления Y замещен одной или несколькими группами, выбранными из OR5, галогена, C1-6 галогеналкила и -(СН 2)q-N(R5)С(О)R8. В другом варианте осуществления Y замещен одной или несколькими группами, выбранными из галогена и C1-6 галогеналкила. В другом варианте осуществления Y дополнительно не замещен. В одном из вариантов осуществления настоящего изобретения X и Y, каждый независимо, представляют собой гетероарил, содержащий гетероатом азота. В следующем варианте осуществления X представляет собой оксадиазолил и Y представляет собой пиридинил. В другом варианте осуществленияX представляет собой тетразолил и Y представляет собой фенил. В другом варианте осуществления настоящего изобретения X представляет собой оксадиазолил и Y представляет собой фенил. В одном из вариантов осуществления по изобретению m равно 4 и n равно 0. В следующем варианте осуществления m равно 3 и n равно 1. В одном из вариантов осуществления настоящего изобретения R2 выбран из С 3-6 алкила, например,бутила или пентила, например, н-бутила или н-пентила. В следующем варианте осуществления настоящего изобретения, R3 выбран из хлора и брома. В другом варианте осуществления R3 представляет собой хлор. В одном из вариантов осуществления настоящего изобретения R7 представляет собой группу, выбранную из C1-6 алкила, С 2-6 алкенила, C2-6 алкинила, -(СН 2)t циклоалкила, -(СН 2)n циклоалкенила, -(CH2)t гетероциклила, -(СН 2)t арила и -(СН 2)t гетероарила; В одном из вариантов осуществления настоящего изобретения X представляет собой оксадиазолил,Y представляет собой фенил, R2 представляет собой бутил, R3 представляет собой хлор, и m равно 4 и n равно 0. В отношении стереоизомеров соединения формулы (I) могут иметь один или несколько асимметричных атомов углерода и могут существовать в виде рацематов, смесей рацематов, и отдельных энантиомеров или диастереомеров. Все такие изомерные формы включены в объем по настоящему изобретению, включая их смеси. В том случае, когда соединение формулы (I) содержит алкениловую или алкениленовую группу,цис (Е) и транс (Z) изомерия может также иметь место. Настоящее изобретение включает отдельные стереоизомеры соединения по изобретению и, когда уместно, их отдельные таутомерные формы, вместе с их смесями. Выделение диастереоизомеров или цис- и транс- изомеров может быть выполнено обычными способами, например, фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси агента, который также может быть получен из соответствующего оптически чистого промежуточного соединения, или разделением, таким как с помощью ВЭЖХ, соответствующего рацемата, используя подходящий хиральныый носитель, или фракционной кристаллизацией диастереоизомерных солей, образованных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием, в зависимости от ситуации. Кроме того, некоторые кристаллические формы соединений формулы (I) могут существовать в полиморфных модификациях, которые включены в настоящее изобретение. Одна форма может иметь преимущество над другой формой, например, одна форма может быть более стабильна по сравнению с другой формой. Должно быть понятно, что настоящее изобретение включает любое сочетание конкретных вариантов осуществления и охватывает все сочетания конкретных заместителей, описанных в настоящем описании выше. По всему настоящему описанию и прилагаемых пунктах формулы изобретения, слова "включать" и"содержать" и варианты, такие как "включает", "включая", "содержит", "содержащий", должны пониматься как включая. То есть, если контекст позволяет, эти слова предназначены для передачи возможного включения других, конкретно не описанных, элементов или целых чисел. Используемый в настоящем описании термин "алкил" (когда используется в качестве группы или как часть группы) относится к прямой или разветвленной углеводородной цепи, если не указано иного,содержащей определенное количество атомов углерода. Например, С 3-С 6 алкил обозначает прямую или разветвленную углеводородную цепь, содержащую по меньшей мере 3 и максимально 6 атомов углерода. Примеры алкила, как используется в настоящем описании, включают, но ими не ограничиваются,метил (Me), этил (Et), н-пропил и изопропил. Используемый в настоящем описании термин "алкилен" обозначает как прямую, так и разветвленную насыщенную или ненасыщенную цепь, или циклические насыщенные углеводородные связывающие группы. Примеры алкиленовых групп включают метилен (-СН 2-), этилен (-СН 2 СН 2-), этен (-СН=СН-) или циклопропилен, и тому подобное. Например, как используется в настоящем описании, -(алкилен)m-,когда m равно 3, представляет собой -(СН 2)3-, -С(СН 3)2-, -СН 2 СН=СН- или -циклопропилен- и тому по-3 014556 добное. Например, как используется в настоящем описании, -(алк)m-, в тех случаях, когда m равно 4,представляет собой -(СН 2)4-, -СН 2 С(СН 3)2-, -СН 2 СН=СНСН 2- или -СН 2 циклопропилен- и тому подобное. Например, как используется в настоящем описании, -(алкилен)n, в тех случаях, когда n=1, обозначает-СН 2-. Как используется в настоящем описании, -(алкилен)n, когда n=0, обозначает, что в этом положение отсутствует алкиленовый связующий агент. Используемый в настоящем описании термин "алкенил" относится к прямой или разветвленной углеводородной цепи, содержащей определенное число атомов углерода, которая содержит одну или несколько двойных связей. Используемый в настоящем описании термин "алкинил" относится к прямой или разветвленной углеводородной цепи, содержащей определенное количество атомов углерода, которая содержит одну или несколько тройных связей. Используемый в настоящем описании термин "циклоалкил" относится к насыщенному моноциклическому углеводородному кольцу из 3-8 атомов углерода. Примеры таких групп включают циклопропил,циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Используемый в настоящем описании термин "циклоалкенил" относится к ненасыщенному неароматическому моноциклическому углеводородному кольцу из 3-8 атомов углерода, содержащему одну или несколько углерод-углерод двойных связей. Примеры таких групп включают циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и тому подобное. Используемый в настоящем описании термин "арил" относится к С 6-12 моноциклическому, бициклическому или трициклическому углеводородному кольцу, где по меньшей мере одно кольцо является ароматическим. Примеры таких групп включают фенил, нафтил или тетрагидронафталенил и тому подобное. Используемый в настоящем описании термин "гетероарил" относится к 5-6-членному моноциклическому ароматическому кольцу или конденсированному 8-10-членному бициклическому ароматическому кольцу, содержащему 1-4 гетероатома, независимо выбранных, каждый, из атома кислорода, азота и серы. Может быть один или несколько необязательных оксо заместителей атомов углерода на кольце. Примеры таких моноциклических ароматических колец включают тиенил, фурил, фуразанил, пирролил,триазолил, тетразолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил, тиадиазолил, пиранил, пиразолил, пиримидил, пиридазинил, пиразинил, пиридил, триазинил, тетразинил и тому подобное. Примеры таких конденсированных ароматических колец включают хинолинил, изохинолинил, хиназолинил, хиноксалинил, птеридинил, циннолинил, фталазинил, нафтиридинил, индолил, изоиндолил, азаиндолил, индолизинил, индазолил, пуринил, пирролопиридинил, фуропиридинил, бензофуранил, изобензофуранил, бензотиенил, бензоимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензоизотиаазолил, бензоксадиазолил, бензотиадиазолил и тому подобное. Используемый в настоящем описании термин "гетероциклил" относится к 4-7-членному моноциклическому кольцу или конденсированному 8-12-членному бициклическому кольцу, которое может быть насыщенным или частично ненасыщенным, содержащим 1-4 гетероатома, независимо выбранных, каждый, из кислорода, азота или серы. В кольце могут быть один или несколько необязательных оксо заместителей атомов углерода. Примеры таких моноциклических колец включают пирролидинил, азетидинил,пиразолидинил, оксазолидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, гидантоинил, валеролактамил, оксиранил, оксетанил, диоксоланил, диоксанил, оксатиоланил, оксатианил, дитианил, дигидрофуранил, тетрагидрофуранил, дигидропиранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил, диазепанил, азепанил и тому подобное. Примеры таких бициклических колец включают индолинил, изоиндолинил, бензопиранил, хинуклидинил, 2,3,4,5-тетрагидро-1 Н-3-бензазепин, тетрагидроизохинолинил и тому подобное. Используемые в настоящем описании термины "галоген" или "гало" относятся, например, к атому фтора, хлора, брома или йода. Используемый в настоящем описании термин "C1-6 галогеналкил" относится к C1-6 алкильной группе, как определено в настоящем описании, где по меньшей мере один атом водорода заменен галогеном. Примеры таких групп включают фторэтил, трифторметил, трифторэтил и тому подобное. Как используется в настоящем описании, в случае, когда группа указывается как "замещенная" другой группой или имеющая "один или несколько заместителей", если не определено конкретное положение для такого замещения, должно быть понятно, что замещение может иметь место в любом положении в группе. Используемый в настоящем описании термин "фармацевтически приемлемое производное" относится к любому фармацевтически приемлемому производному соединения по настоящему изобретению,например, к соли, сольватам или сложным эфирам, которое при введении млекопитающему, такому как человек, способно обеспечить (непосредственно или косвенно) такое соединение или его активный метаболит. Такие производные очевидны для специалиста в данной области без проведения дополнительных экспериментов, смотри обзор в Burger's Medicinal Chemistry And Drug Discovery, 5th Edition, VoI 1: Principles and Practice, включенный в настоящий документ в качестве ссылки. Используемый в настоящем описании термин "фармацевтически приемлемый", используемый в от-4 014556 ношении ингредиента (активный ингредиент, разбавитель, наполнитель или носитель), который может быть включен в фармацевтическую композицию для введения пациенту, относится к ингредиенту, который является приемлемым в смысле совместимости с любыми другими ингредиентами, присутствующими в фармацевтической композиции, и не является вредным для реципиента. Используемый в настоящем описании термин "сольват" относится к соединениям с различной стехиометрией, образованными растворенным соединением (в этом изобретении, соединение формулы (I) или его фармацевтически приемлемое производное) и растворителем. Такие растворители для целей по настоящему изобретению не могут препятствовать биологической активности раствора. Используемым растворителем может быть фармацевтически приемлемый растворитель. Примеры подходящих фармацевтически приемлемых растворителей включают воду, этанол и уксусную кислоту. Примером используемого растворителя является вода, при этом сольватом может называться гидрат рассматриваемого растворенного соединения. Следует учитывать тот факт, что для фармацевтического применения указанные выше "соль или сольват" будут представлять собой фармацевтически приемлемую соль или сольват. Однако могут найти применение и другие соли или сольваты, например, при получении соединения формулы (I) или при получении его фармацевтически приемлемой соли или сольвата. Фармацевтически приемлемые соли включают соли, описанные Berge, Bighley and Monkhouse, J.Pharm. Sci., 1977, 66, 1-19. Подходящие фармацевтически приемлемые соли включают соли щелочного металла, образованные добавлением оснований щелочного металла, таких как гидроксиды щелочного металла. Примеры подходящих солей щелочного металла включают соли натрия и соли калия. Другие подходящие фармацевтически приемлемые соли включают соли щелочно-земельного металла, такие как соли кальция и соли магния, соли аммония; или соли органических оснований, таких как этаноламин,триэтаноламин, этилендиамин, триэтиламин, холин и меглумин; или соли аминокислот, таких как аргинин, лизин и гистидин. Сложные эфиры могут быть активными сами по себе и/или быть гидролизуемыми в условиях invivo в организме человека. Подходящие фармацевтически приемлемые гидролизуемые in vivo сложноэфирные группы включают группы, которые разлагаются в организме человека с получением исходной кислоты или ее соли. Сложный эфир может быть образован группой карбоновой кислоты (-С(О)ОН),способами, хорошо известными в данной области, включая реакции с соответствующим спиртом. Например, сложные эфиры могут представлять собой сложные C1-6 алкиловые эфиры, например, сложные метиловые эфиры, сложные этиловые эфиры и тому подобное. Используемый в настоящем описании термин "соединения по изобретению" обозначает соединения в соответствии с формулой I и их фармацевтически приемлемые производные. Термин "соединение по изобретению" обозначает любое соединение по изобретению, как определено выше. Используемый в настоящем описании термин "по меньшей мере один химический объект" обозначает по меньшей мере одно химическое вещество, выбранное из группы соединений, состоящей из соединений формулы I и их фармацевтически приемлемых производных. В одном из аспектов настоящего изобретения предложен, по существу, кристаллический 3-бутил-8 хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-дион формы 1. В другом аспекте по изобретению предложен, по существу, кристаллический 3-бутил-8-хлор-1-4-[5-(2 пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 2. Был проведен термический анализ образцов по существу кристаллического 3-бутил-8-хлор-1-4-[5(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 1 и формы 2. Таким образом, предложен по существу кристаллический 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4 оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-дион (форма 1 или форма 2), имеющий точку начала плавления, определенную с помощью ДСК (дифференциальная сканирующая калориметрия) ( 0,5 С): 160 С или выше и 147 С или выше, соответственно. Образцы, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3 ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 1 и 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4 оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 2, полученные как описано в настоящем описании далее, давали порошковые рентгенограммы, представленные на фиг. 1-2. Дифракционная рентгенограмма индивидуальна для кристаллической формы. По существу, кристаллические формы демонстрируют дифракционные рентгенограммы с индивидуальным набором дифракционных пиков, которые могут быть выражены в 2 тета углах . 2 Тета углы дифракции определяют положения различных пиков на рентгенограмме. Небольшие отклонения в наблюдаемых 2 тета углах предположительно зависят от конкретно используемого дифрактометра и способа получения исследователем образца. По существу, кристаллические формы 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил] бутил-3,7-дигидро-1H-пурин-2,6-диона могут быть определены наличием характерного пика 2 тета угла, или множественных 2 тета углов, которые достоверно характеризуют конкретные кристаллические формы. При идентификации, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона (форма 1) эти пики имеются в следующих-5 014556 положениях, выраженных в 2 тета углах (0,1): 5,4, 6,7, 9,7, 11,1, 12,9, 14,0, 15,6, 16,3, 16,7, 23,1. При идентификации, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4 оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона (форма 2) эти пики имеются в следующих положениях, выраженных в 2 тета углах (0,1): 5,2, 6,6, 10,4, 11,2, 13,4, 15,6, 18,1, 19,5, 20,9. В одном из вариантов осуществления по меньшей мере один из вышеуказанных 2 тета углов используется для определения формы 1, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона и формы 2, по существу, кристаллического 3-бутил-8 хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона. В других вариантах осуществления по меньшей мере 2, 3, 4 или 5 (в тех случаях, когда применимо) из вышеуказанных 2 тета углов используются для определения формы 1, по существу, кристаллического 3-бутил-8 хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1 Н-пурин-2,6-диона, формы 2, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7 дигидро-1H-пурин-2,6-диона. Некоторый допустимый предел погрешности присутствует в каждом определении 2 тета угла. Предел погрешности в вышеуказанных 2 тета углах приблизительно равен 0,1 для каждого из вышеуказанных пиковых определений. Так как некоторый допустимый предел погрешности возможен в определении 2 тета углов, предпочтительный способ сравнения порошковых рентгенограмм, для идентификации конкретной кристаллический формы, представляет собой наложение порошковой рентгенограммы неизвестной формы на порошковую рентгенограмму известной формы. Например, специалист в данной области может наложить порошковую рентгенограмму неидентифицированной формы 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона, полученной способами, описанными в настоящем описании, например, смотри фиг. 3, и легко определить, является ли дифракционная рентгенограмма неидентифицированной формы в основном аналогичной порошковой рентгенограмме формы 1 или 2, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол 3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона. Если порошковая рентгенограмма является в основном аналогичной показанной на любой из фиг. 1-2, вышеуказанная форма может быть легко и точно определена. Используемый в настоящем описании термин "по существу, кристаллическая форма" обозначает,что она, по существу, лишена аморфной формы 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол 3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона. Термин "по существу свободный" обозначает содержание аморфной формы меньше чем 50%, в одном аспекте меньше чем 20% аморфной формы, в другом аспекте меньше чем 10% аморфной формы, в другом аспекте меньше чем 5% аморфной формы, в другом аспекте меньше чем 2% аморфной формы, в другом аспекте меньше чем 1% аморфной формы. Настоящее изобретение относится к способу получения формы, по существу, кристаллического 3 бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона, как описано в настоящем описании. Соединения формулы (I) обладают потенциальным терапевтическим эффектом в лечении и уменьшение интенсивности симптомов множества заболеваний липоидного обмена, включая дислипидемию и гиполипопротеинемию, такую как диабетическая дислипидемия и смешанная дислипидемия, сердечную недостаточность, гиперхолестеринемию, сердечно-сосудистое заболевание, включая атеросклероз, артериосклероз, и гипертриглицеридемию, сахарный диабет по типу II, диабет по типу I, резистентность к инсулину, гиперлипидемию, нервную анорексию, ожирение. Сами по себе, соединения могут также быть эффективными в терапии заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, заболевания периферических сосудов и инсульта. Было сделано сообщение, что рецепторы НМ 74 и НМ 74 А участвуют в воспалительном процессе(WO020842 98). Воспаление представляет собой группу сосудистых, клеточных и нейролигических реакций на травму. Воспаление может характеризоваться как движение клеток воспаления, таких как моноциты, нейтрофилы и гранулоциты, в ткани. Это обычно связано с ослабленной функцией эндотелиального барьера и отеком тканей. Воспаление, относящееся к заболеванию, обычно называется хроническим воспалением. Такое хроническое воспаление может проявлять себя посредством симптомов заболевания. Таким образом, целью противовоспалительной терапии является ослабление этого хронического воспаления и обеспечение развития физиологического процесса выздоровления и восстановления тканей. Примеры воспалительных заболеваний или состояний, для лечения которых соединения по настоящему изобретению могут применяться, включают заболевания или состояния суставов, например, артрит(например, ревматоидный артрит, остеоартрит, простетическое поражение суставов), или желудочнокишечного тракта (например, язвенный колит, болезнь Крона и другие воспалительные заболевания кишечника и желудочно-кишечного тракта, гастрит и воспаление слизистой оболочки в результате поражения инфекцией, интеропатия, вызванная применением нестероидных противовоспалительных препаратов), легкого (например, синдром расстройства дыхания у взрослых, астма, кистозный фиброз или хроническое деструктивное заболевание легкого), сердца (например, миокардит), нервной ткани (например,рассеянный склероз), поджелудочной железы (например, воспаление, связанное с сахарным диабетом и-6 014556 его осложнениями), почек (например, гломерулонефрит), кожи (например, дерматит, псориаз, экзема,крапивница, ожог), глаз (например, глаукома), а также трансплантированных органов (например, отторжение) и синдром полиорганной недостаточности (например, системная эритематозная волчанка, сепсис) и воспалительное осложнение в результате поражения вирусной или бактериальной инфекцией, и воспалительные состояния, связанные с атеросклерозом и последующим гипоксическим или ишемическим инсультами (с или без реперфузии), например, головного мозга или при ишемическом заболевании сердца. В одном из вариантов осуществления, соединения по изобретению применяют в лечении и профилактике воспаления, диабетов и сердечно-сосудистых заболеваний или состояний, включая атеросклероз,артериосклероз, гипертриглицеридемию и смешанную дислипидемию. Никотиновая кислота имеет профиль значительного побочного эффекта, вероятно из-за высокого уровня дозирования (несколько грамм в сутки). Наиболее распространенным побочным эффектом является сильная кожная гиперемия. В некоторых вариантах осуществления настоящего изобретения соединения могут демонстрировать пониженные побочные эффекты по сравнению с никотиновой кислотой. НМ 74 А был идентифицирован как рецептор с высоким сродством к никотиновой кислоте, в то время как НМ 74 представляет собой рецептор с более низким сродством. Соединения по настоящему изобретению демонстрирую более высокое сродство к НМ 74 А, чем к НМ 74, и поэтому могут применяться в качестве селективных агонистов НМ 74 А или частичных агонистов. Возможности соединений формулы (I) активировать НМ 74 А могут быть показаны, например, используя следующие in vitro анализы в цельной клетке. Анализ in vitro Для временной трасфекции клетки НЕК 293 Т (клетки НЕК 293, стабильно экспрессирующие большой Т-антиген SV40) поддерживали в DMEM, содержащем 10% фетальной телячьей сыворотки и 2 мМ глютамина. Клетки высеивали в 90 мм чашки для культивирования и выращивали до конфлюентности 60-80% (18-24 ч) перед трансфекцией. НМ 74 А человека (GenBank номер доступа AY148884) субклонировали в экспрессирующий вектор млекопитающего (pcDNA3; Invitrogen) и трасфецировали, используя реагент Lipofectamin. Для трансфекции 9 мкг ДНК смешивали с 30 мкл Lipofectamina в 0,6 мл OptiMEM (Life Technologies Inc.) и инкубировали при комнатной температуре в течение 30 мин перед добавлением 1,6 мл Opti-MEM. Клетки обрабатывали смесью Lipofectamin/ДНК в течение 5 ч и затем добавляли 6 мл 20% (объем/бъем) фетальной телячьей сыворотки в DMEM. Клетки собирали через 48 ч после трансфекции. Осуществляли обработку токсином коклюша, добавляя в среду в количестве 50 нгмл-1 в течение 16 ч. При всех исследованиях временной трансфекции проводили котрансфекцию рецептора иG-белка Gi/0, G01. Для получения стабильной клеточной линии описанный выше способ использовали для трансфекции клеток CHO-К 1, которые высевали в шестилуночные плашки с ростом до конфлюентности 30%. Эти клетки поддерживали в среде DMEM-Ham F-12 (доступна от Invitrogen), содержащей 10% фетальной телячьей сыворотки и 2 мМ глютамина. Через 48 ч после трансфекции в среду добавляли 400 мкг/мл генетицина (G418, Gibco) для отбора клеток, устойчивых к антибиотику. Клоналированные клеточные линии СНО-К 1, стабильно экспрессирующие НМ 74 А, подтверждали с помощью связывания с [35S]-GTPS,после добавления никотиновой кислоты. Препарат мембран Р 2 - Дисперсионные фракции, содержащие плазматические мембраны Р 2, получали из клеточных масс, замороженных при -80 С после сбора клеток. Все процедуры осуществляли при 4 С. Клеточные осадки ресуспендировали в 1 мл 10 мМ Tris-HCl и 0,1 мМ EDTA, рН 7,5 (буфер А) и гомогенизировали в течение 20 с на Ultra Turrax с последующим пропусканием (5 раз) через иголку 25 размера. Клеточные лизаты центрифугировали при 1000 g в течение 10 мин в микроцентрифуге с осаждением ядер и неразрушенных клеток и дисперсионные фракции Р 2 восстанавливали микроцентрифугированием при 16000g в течение 30 мин. Дисперсионные фракции Р 2 ресуспендировали в буфере А и хранили при -80 С перед анализом. Анализ связывания с [35S]-GTPS осуществляли при комнатной температуре в 384-луночном формате на основании способов, описанных ранее (Wieland, Т. and Jakobs, K.H. (1994) Method Enzymol. 237,3-13). Кратко, осуществляли разведение стандарта или исследуемых соединений и добавляли в 384 луночную плашку в объеме 10 мкл. Мембраны (НМ 74 А или НМ 74) разводили в аналитическом буфере(20 мМ HEPES, 100 мМ NaCl, 10 мМ MgCl2, рН 7,4), в который дополнительно добавляли сапонин (60 мкг/мл), бусы Leadseeker WGA (Amersham; 250 мкг/лунка) и 10 мкМ GDP, таким образом, в каждую лунку, содержащую 5 мкг мембран, добавляли объем 20 мкл. [35S]-GTPS (1170 Кю/ммоль, Amersham) разводили (1:1500) в аналитическом буфере и в каждую лунку добавляли 20 мкл. После добавления радиолиганда плашки герметизировали, быстро центрифугировали и инкубировали в течение 4 ч при комнатной температуре. В конце периода инкубирования плашки считывали на аппарате Leadseeker(VIEWLUX PLUS; Perkin-Elmer) для определения уровней специфического связывания. Эти анализы детализовали, снижая конечный объем анализа до 10 мкл. Для этого использовали уточненный протокол анализа для 10 мкл. При этом протоколе использовали только 100 нл стандартного-7 014556 или исследуемого соединения на лунку 384-луночной плашки и 1,5 мкг мембраны и 100 мкг бус Leadseeker WGA. В случае протокола для маленького объема, мембрану, бусы и [35S]-GTPS смешивали и затем 10 мкл этой смеси распределяли в каждую лунку. Инкубирование и считывание плашки были аналогичны анализам для 10 мкл и 50 мкл. Все соединения примеров исследовали в одном или обоих анализах связывания [35S]-GTPS, описанных выше (то есть в анализах для 10 мкл и 50 мкл). Данные анализировали с помощью вычерчивания по точкам кривой, используя логистическое уравнение с четырьмя параметрами, используя программное обеспечение ХС 50 (у каждой кривой исключали максимум 2 точки). Специфическое связывание выражали как рЕС 50 и в виде % эффективности по сравнению с максимальным ответом связывания никотиновой кислоты. Анализ in vivo Соединения по изобретению можно исследовать на самцах крыс Spague-Dawley (200-250 г), которых не кормили по меньшей мере 12 ч перед исследованием. Соединения внутривенно вводили с дозой либо 1, либо 3 мг/кг (5 мл/кг), или перорально с дозой в диапазоне от 1 до 30 мг/кг (10 мл/кг). Образцы крови (0,3 мл хвостовой вены) брали перед введением и три раза после введения соединений (время взятия колебалось от 15 мин до 6 ч после введения соединения). Каждый образец крови переносили в пробирку с гепарином (Becton Dickinson Microtainer, PST LH) и центрифугировали (10000 g в течение 5 мин) с получением образца плазмы. Образцы плазмы анализировали на уровни неэтерифицированных жирных кислот (NEFA), используя коммерчески доступный набор (Randox). Ингибирование уровней плазмыNEFA, по сравнению с уровнем до введения соединения, использовали как заменитель агонистической активности НМ 74 А. Для определения имеют ли соединения по изобретению активный ответ, связанный с никотиновой кислотой, их вводили морским свинками. Самцов морских свинок Dunkin Hartley (300-600 г; n=10-20 на группу) не кормили в течение по меньшей мере 12 ч, но не более чем за 24 ч перед экспериментом. Перед проведением исследования у каждого животного брали образцы крови (0,5 мл) пункцией сердца при обратимой анастезии (изофлуран 3,5% с добавлением O2 (1 л/мин. Измерение температуры в ухе проводили, помещая в левое ухо каждого животного инфракрасный температурный датчик. Измерение осуществляли с интервалами в одну минуту в период, начиная за 5 мин до введения и заканчивая 30 мин после введения. Измерение температуры затем проводили с 15-минутными интервалами и заканчивали через 2 ч после введения. Животным вводили исследуемые соединения с помощью перорального зонда(5 мл/кг). Образцы крови (0,5 мл) брали пункцией сердца под терминальной анастезией. Образцы крови у каждого животного брали с получением данных на 0,5, 1, 2, 3 и 4 ч после введения. Все образцы крови помещали в мешалку для крови на 5 мин, а затем хранили на льду до конца эксперимента. После центрифугирования (12000 g в течение 5 мин) плазму переносили в чистые пробирки и хранили при -20 С до проведения анализа с концентрациями NEFA. Некоторые соединения в соответствии с формулой (I) синтезировали (смотри примеры синтеза ниже) и исследовали в анализах связывания [35S]-GTPS, рассмотренных выше. Некоторые соединения в соответствии с формулой (I), включая 8-хлор-3-(3,3-диметилбутил)-1-[2(этилокси)этил]-3,7-дигидро-1H-пурин-2,6-дион; использовали в качестве промежуточных соединений в получении других соединений в соответствии с формулой (I). Значения рЕС 50 иллюстративных соединений (примеры 1-512) составляли 4,3 (+/-0,3 log единиц) или более, а эффективность в анализе связывания с [35S]-GTPS, описанном выше, с помощью которого их исследовали была 30% или более (относительно никотиновой кислоты). Общие способы очистки и расчета ЖХ/МС: Способ. Аналитическую ВЭЖХ выполняли на колонке Supelcosil ABZ+PLUS (Supelco) (3 мкМ, 3,3 см 4,6 мм ВД (внутренний диаметр, элюируя 0,1% НСО 2 Н и 0,01 М ацетатом аммония в воде (растворитель А), и 95% MeCN и 5% воды (содержащий 0,5% HCO2H) (растворитель В), используя следующий градиент элюирования 0-0,7 мин 0%В, 0,7-4,2 мин 0100%В, 4,2-4,6 мин 100%В, 4,6-4,8 мин 1000%В при скорости тока, равной 3 мл/мин. УФ-детектирование на диодной матрице выполняли в пределах 215330 нм. Масс-спектр (МС) регистрировали на масс-спектрометре Waters ZQ, используя способы положительной ионизации электрораспылением [ES+ve с получением МН+ и M(NH4)+ молекулярные ионы] или отрицательной ионизации электрораспылением [ES-ve с получением (М-Н)- молекулярного иона]. Оценивали только исходный ион основных изотопов. 1 Н ЯМР спектр регистрировали спектрометром Bruker DPX 400 М Гц, используя в качестве эталона тетраметилсилан.Biotage хроматография относится к очистке, выполняемой с использованием либо системы очистки Flash 40i, либо Flash 150i, приобретенной у фирмы Biotage AB, используя картриджи, наполненныеKPSil (оксид кремния). Система Companion относится к системе очистки Teledyne Isco Combiflash Companion. Это система очистки с изменяемым градиентом с УФ-детектированием интегральной, вариабельной длины вол-8 014556 ны со способностью запуска автоматического сбора фракций с помощью порога УФ-излучения.Mass directed autoprep (MDAP) относится к способам, в которых вещество очищают высокоэффективной жидкостной хроматографией, используя либо колонку Supelcosil ABZ + 5 мкМ (10 см 20 мм внутренний диаметр), либо колонку Supelcosil ABZ + 10 мкМ (15 см 30 мм внутренний диаметр) с подходящим градиентом растворителя А: 0,1% HCO2H в воде и растворителя В: 95% MeCN, 5% воды(содержащий 0,5% HCO2H). Waters 2767 inject/collector запускают с помощью MicroMass ZQ Mass Spectrometer при установлении представляющей интерес массы (используя программное обеспечение Micromass MassLynx). Препаративная ВЭЖХ (Autoprep ВЭЖХ или Autoprep) относится к способам, в которых вещество очищают высокоэффективной жидкостной хроматографией на колонке Supelcosil ABZ+ 5 мкМ (10 см 21,2 мм внутренний диаметр) с подходящим градиентом 0,1% HCO2H в воде и MeCN (с 0,5% HCO2H). Коллектор фракций Gilson 233 запускают при УФ-детектировании.SPE (экстракция твердой фазы) относится к применению полиэтиленовых картриджей, которые наполнены сорбентом, используемым для очистки. Сорбен, содержащийся в этих картриджах, будет точно определен. Используемые примеры представлены подробно ниже: С 18 SPE относится к применению картриджей, наполненных 40 мкМ С 18 сорбентом на основании функционализированного оксида кремния (приобретен у фирмы Varian Inc.). Соединение загружают,обычно в соотношении 50:50 ДМСО/МеОН, на картридж, предварительно обработанный MeCN и уравновешенный 5% MeCN в воде. Продукт элюируют с подходящим градиентом 0,1% НСО 2 Н в воде иMeCN (0,5% HCO2H). Аминопропил SPE или колонка относится к применению картриджей, наполненных 40-120 мкМ аминопропил функционализированным оксидом кремния (приобретенный у фирмы Varian Inc.). Сырой продукт обычно загружают в DCM/MeOH смеси на картридж, предварительно обработанный МеОН. Нейтральные комопненты элюируют МеОН и/или DCM (3 или 4 объема колонки), а кислотные компоненты обычно элюируют элюентом, содержащим часть АсОН (2-20%).Oasis Cartridges/Oasis SPE относятся к SPE картриджам, наполненным полимерным сорбентом,произведенным фирмой Waters Corporation. Их обычно обрабатывают 3 колоночными объемами МеОН и уравновешивают водой, перед загрузкой образца. Соли и неорганические вещества элюируют водой, а продукт обычно элюируют МеОН или MeCN.GreenHouse относится к 24 реакционной параллельной синтезаторной платформе, доступной отRDT Ltd, UK. Как описано выше, соединения формулы (I) могут найти применение в лечении человека или ветеринарии, например, в качестве активаторов НМ 74 А, в лечении дислипидемии и гиполипопротеинемии. Таким образом, другой вариант осуществления настоящего изобретения относится по меньшей мере к одному соединению формулы (I) или его фармацевтически приемлемому производному для применения в лечении человека или ветеринарии, например, в лечении расстройств липоидного обмена, включая дислипидемию и гиполипопротеинемию, такую как диабетическая дислипидемия и смешанная дислипидемия, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания,включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарный диабет по типу II, диабет по типу I, резистентность к инсулину, гиперлипидемию, нервную анорексию и ожирение. Как таковые, соединения также предусмотрены для применения в лечении заболевания коронарных артерий, тромбоза,стенокардии, хронической почечной недостаточности, заболевания периферических сосудов и инсульта. Дополнительный вариант осуществления настоящего изобретения относится по меньшей мере к одному соединению формулы (I) или его фармацевтически приемлемому производному для применения в получении лекарственного средства для лечения расстройств липоидного обмена, включая дислипидемию и гиполипопротеинемию, такую как диабетическая дислипидемия и смешанная дислипидемия, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарного диабета по типу II, диабета по типу I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения. Как таковые, соединения также предусмотрены для применения в лечении заболевания коронарных артерий, тромбоза, стенокардии,хронической почечной недостаточности, заболевания периферических сосудов и инсульта. Будет принят во внимание тот факт, что ссылки в настоящем описании на лечение распространяются и на профилактику, профилактику рецедива и ослабление симптомов, а также лечение определенных состояний. Один из вариантов осуществления по изобретению относится по меньшей мере к одному соединению формулы (I) или его фармацевтически приемлемому производному для применения в лечении расстройств липоидного обмена, включая дислипидемию и гиполипопротеинемию. Например, применение предусматривает по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемое производное в лечении диабетической дислипидемии, смешанной дислипидемии, сердечной недостаточности, гиперхолестеринемии, сахарного диабета по типу II, диабета по типу I, резистентности к инсулину, гиперлипидемии, нервной анорексии, ожирения, заболевания коронарных артерий, тромбоза, стено-9 014556 кардии, хронической почечной недостаточности, инсульта и сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию. Должно быть понятно, что этот вариант осуществления настоящего изобретения включает любое сочетание конкретных вариантов осуществления и охватывает все сочетания конкретных заместителей,описанных в настоящем описании выше, для соединений формулы (I). Кроме того, настоящее изобретение относится к применению по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемого производного в получении лекарственного средства для лечения воспалительных заболеваний или состояний сустава, например, артрита (например, ревматоидного артрита, остеоартрита, простетического поражения сустава), или желудочно-кишечного тракта(например, язвенного колита, болезни Крона и других воспалительных заболеваний кишечника и желудочно-кишечного тракта, гастрита и воспаления слизистой в результате поражения инфекцией, интеропатия, вызванная применением нестероидных противовоспалительных препаратов), легкого (например,синдром расстройства дыхания у взрослых, астма, кистозный фиброз, или хроническое деструктивное заболевание легкого), сердца (например, миокардит), нервной ткани (например, рассеянный склероз),поджелудочной железы (например, воспаление, связанное с диабетом и его осложнениями почек (например, гломерулонефрит), кожи (например, дерматит, псориаз, экзема, крапивница, ожог), глаз (например,глаукома), а также трансплантированных органов (например, отторжение) и синдрома полиорганной недостаточности (например, системная эритематозная волчанка, сепсис), и воспалительного осложнения в результате поражения вирусной или бактериальной инфекцией, и воспалительных состояний, связанных с атеросклерозом и последующим гипоксическим или ишемическим инсультами (с или без реперфузии),например, головного мозга или при ишемическом заболевании сердца. Дополнительные или альтернативные варианты осуществления относятся к способу лечения состояния человека или животного, в тех случаях, когда предактивация рецептора НМ 74 способствует состоянию или в которых активация рецептора будет эффективной, метод которого включает введение указанному человеку или животному эффективного количества по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемого производного. Более того, должно быть понятно, что этот вариант осуществления настоящего изобретения включает любое сочетание конкретных вариантов осуществления и охватывает все сочетания конкретных заместителей, описанных в настоящем описании выше для соединений формулы (I). В одном из вариантов осуществления настоящее изобретение относится к способу лечения расстройств липоидного обмена, включая дислипидемию и гиполипопротеинемию, такую как диабетическая дислипидемия и смешанная дислипидемия, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарного диабета по типу II, диабета по типу I, резистентности к инсулину, гиперлипидемии, нервной анорексии и ожирения, который включает введение указанному человеку или животному эффективного количества по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемого производного. Сами по себе эти соединения могут также применяться в способах лечения заболевания коронарных артерий, тромбоза, стенокардии, хронической почечной недостаточности, заболевания периферических сосудов и инсульта, которые включают введение указанному человеку или животному эффективного количества по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемого производного. Количество соединения формулы (I) или его фармацевтически приемлемого производного, которое необходимо для достижения желаемого биологического эффекта будет, конечно, зависеть от некоторых факторов, например, способа введения и точного клинического состояния реципиента. Обычно суточная доза будет в пределах 0,1 мг - 1 г/кг, обычно 0,1-100 мг/кг. Внутривенная доза может быть, например, в пределах 0,01 мг - 0,1 г/кг, обычно 0,01 мг - 10 мг/кг, которая может удобно вводиться вливанием от 0,1 мкг до 1 мг в минуту. Жидкости для вливания, подходящие для этой цели, могут содержать, например, от 0,01 мкг до 0,1 мг на миллилитр. Однократные дозы могут содержать, например, от 0,01 мкг до 1 г соединения по изобретению. Таким образом, ампулы для инъекций могут содержать, например, от 0,01 мкг до 0,1 г, и композиции для однократного перорального введения, такие как таблетки или капсулы, могут содержать, например, от 0,1 мг до 1 г, например, от 5 до 50 мг. Соединение формулы (I) или его фармацевтически приемлемое производное может применяться в качестве соединения как такового в лечении заболевания, в тех случаях, когда предактивация рецептора НМ 74 способствует заболеванию или в которых активация рецептора будет эффективной, пример этого имеет место быть в том случае, когда соединение по настоящему изобретению представлено с приемлемым носителем в форме фармацевтической композиции. Носитель должен, обязательно, быть приемлемым в смысле совместимости с другими ингредиентами комопозиции и не должен быть вредным для реципиента. Носитель может быть твердым или жидким, или как твердым, так и жидким, и может быть получен с соединением по изобретению в виде композиции для однократного приема, например, таблетки, которая может содержать от 0,05 до 95 мас.% соединения по изобретению. Композиции включают эти подходящие для перорального, ректального, местного, трансбуккального (например, подъязычного) и парентерального (например, подкожного, внутримышечного, внутрикож- 10014556 ного или внутривенного) способа введения. Также изобретение относится к способу получения такой фармацевтической композиции, который включает перемешивание ингредиентов. Композиции, подходящие для перорального введения, могут быть представлены в дискретных единицах, такие как капсулы, каше, пастилки или таблетки, содержащие, каждая, определенное количество соединения формулы (I) или его фармацевтически приемлемого производного; в виде порошка или гранул; в виде водного или неводного раствора или суспензии; или в виде эмульсии масло-в-воде или водав-масле. Обычно композиции получают равномерным и непосредственным смешиванием соединения формулы (I) или его фармацевтически приемлемого производного с жидким или мелко измельченным твердым носителем, или с обоими, и затем, если необходимо, приданием формы продукту. Например,таблетка может быть получена прессованием или формованием порошка или гранул соединения формулы (I) или его фармацевтически приемлемого производного, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть получены прессованием в соответствующем аппарате соединения в легкосыпучей форме, такой как порошок или гранулы, необязательно смешанные со связующим, смазывающим инертным разбавителем и/или поверхностно-активным/ диспергирующим агентом(ами). Формованные таблетки могут быть получены формованием в соответствующем аппарате, порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки и капсулы для перорального введения могут содержать обычные наполнители, такие как связующие агенты, например, сироп, гуммиарабик, желатин, сорбит, трагакант, клей на основе крахмала или поливинилпирролидона; наполнители, например, лактоза, микрокристаллический целлюлоза, сахар,кукурузный крахмал, фосфат кальция или сорбит; смазывающие вещества, например, стеарат магния,стеариновая кислота, тальк, полиэтиленгликоль или оксид кремния; разрыхляющие вещества, например,картофельный крахмал, натрий кросскармелоза или натрий крахмал гликолят; или увлажнители, такие как лаурилсульфат натрия. На таблетки может быть нанесено покрытие способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в виде, например, жидких или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для смешивания перед применением с водой или с другим подходящим носителем. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например, сироп сорбита, метилцеллюлоза, глюкозный/сахарный сироп, желатин, гидроксиметилцеллюлоза,гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия или гидрированные пищевые жиры; эмульгирующие агенты, например, лецитин, моно-олеат сорбитана или гуммиарабик; неводные носители (которые могут включать пищевые масла), например, миндальное масло, фракционированное кокосовое масло, жирные сложные эфиры, пропиленгликоль или этиловый спирт; или консерванты, например, метил или пропил п-гидроксибензоаты или сорбиновая кислота. Также препараты могут содержать буферирующие соли, ароматизаторы, красители и/или подслащивающие агенты (например, маннит), в зависимости от ситуации. Препараты, подходящие для трансбуккального (подъязычный) способа введения, включают пастилки, содержащие соединение по изобретению, находящиеся в ароматизированной основе, обычно сахароза и гуммиарабик или трагакант, и пастилки, содержащие соединение по изобретению в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик. Препараты по настоящему изобретению, подходящие для парентерального введения, удобно содержат стерильные водные препараты соединения формулы (I) или его фармацевтически приемлемого производного, композиция может быть изотоничной с кровью предполагаемого реципиента. Эти препараты могут вводиться внутривенно, хотя введение может также быть эффективным посредством подкожной, внутримышечной или внутрикожной инъекции. Такие препараты могут быть удобно получены путем смешивания соединения формулы (I) или его фармацевтически приемлемого производного с водой, и предоставления полученного раствора стерильным и изотоничным с кровью. Инъецируемые композиции по изобретению будут обычно содержать от 0,1 до 5% вес./вес. соединения формулы (I) или его фармацевтически приемлемого производного. Таким образом, композиции по настоящему изобретению, подходящие для парентерального введения, содержащие соединение формулы (I) или его фармацевтически приемлемое производное могут быть смешаны для парентерального введения путем болюсного вливания или непрерывной инфузии, и могут находиться в форме для однократного приема, например, в форме ампул, пузырьков, небольшого объема инфузии или предварительно заполненных шприцов, или в упаковках для многократного приема с добавлением консерванта. Композиции могут заполнять такие формы в виде растворов, суспензий или эмульсий в водных или неводных носителях, и могут содержать агенты для получения лекарственных композиций, такие как антиоксиданты, буферные агенты, противомикробные агенты и/или агенты регулирующие токсичность. Примеры композиций, подходящих для перорального введения, включают композиции, содержащие соединение формулы (I) или его фармацевтически приемлемое производное, в 10% ДМСО и 90% гидрокарбоната натрия в стерильном солевом растворе. Примеры композиций, подходящих, для внутривенного введения включают композиции, содержащие соединение формулы (I) или его фармацевтически приемлемое производное, в 5 или 10% ДМСО и 95 или 90% гидрокарбоната натрия в- 11014556 стерильной воде. Альтернативно, терапевтически активное средство может быть в форме порошка для смешивания с подходящим носителем, например стерильной апирогенной водой, перед применением. Сухие твердые формы могут быть получены наполнением стерильным порошком в асептических условиях контейнеров или наполнением стерильного раствора в асептических условиях каждого контейнера и лиофильной сушкой. Композиции, подходящие для ректального введения, могут быть представлены в виде свечей для однократного приема. Они могут быть получены смешиванием соединения формулы (I) или его фармацевтически приемлемого производного с одним или несколькими обычными твердыми носителями, например, масло какао или глицериды, с последующим приданием формы полученной смеси. Композиции, подходящие для местного нанесения на кожу, могут быть получены в форме мази,крема, лосьона, пасты, геля, спрея, аэрозоля или масла. Носители, которые могут быть использованы,включают вазелин, ланолин, полиэтиленгликоли, спирты и сочетания двух или более этих веществ. Обычно концентрация соединения формулы (I) или его фармацевтически приемлемого производного,равна от 0,1 до 15% вес./вес. композиции, например от 0,5 до 2%. При местном применение, как используется в настоящем описании, мы включаем введение путем инсуффляции и ингаляции. Примеры различных типов препаратов для местного применения включают мази, крема, лосьоны, порошки, пессарии, спреи, аэрозоли, капсулы или картриджи для применения в ингаляторе или инсуффляторе, или капли (например, капли глазные или для носа). Композиции мазей и крема могут, например, быть составлены на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов, и/или растворителей. Такие основы могут, таким образом, например, включать воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или касторовое масло, или растворитель, такой как полиэтиленгликоль. Загустители, которые могут применяться, включают мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Композиции лосьонов могут быть сформированы на водной или масляной основе, и также будут обычно содержать один или несколько эмульгирующих агентов, стабилизаторов, диспергаторов, суспендирующих агентов или загустителей. Порошки для наружного применения могут быть образованы с помощью любой подходящей порошковой основы, например талька, лактозы или крахмала. Композиции капель могут быть получены на водной или масляной основе, также содержащие один или несколько диспергаторов, солюбилизирующие агенты или суспендирующие агенты. Распыляемые композиции могут быть получены, например, в виде водных растворов или суспензий, или в виде аэрозолей высвобождаемых из герметично закрытых сосудов, с использованием подходящего газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана,1,1,1,2,3,3,3-гептафторпропана, 1,1,1,2-тетрафторэтана, углекислого газа или другого подходящего газа. Капсулы и картриджи для применения в ингаляторах или инсуффляторе, из, например, желатина,могут содержать порошковую смесь соединения по изобретению и подходящую порошковую основу,такую как лактоза или крахмал. Фармацевтические композиции по изобретению могут также применяться в сочетании с другими терапевтическими средствами, например, в сочетании с другими классами лекарственных препаратов для лечения дислипидемии (например, статины, фибраты, смолы, связывающие желчную кислоту или никотиновая кислота). Соединения по настоящему изобретению могут применяться в сочетании с одним или несколькими другими терапевтически активными средствами, например, в сочетании с другими классами лекарственных препаратов для лечения дислипидемии, такими как, ингибиторы 3-гидрокси-3-метилглутарилкоэнзим А редуктазы (статины) или фибраты или смолы, связывающие желчную кислоту, или никотиновая кислота. Таким образом, изобретение относится в следующем варианте осуществления к применению такого сочетания в лечении заболеваний в тех случаях, когда предактивация рецептора НМ 74 способствует заболеванию или в которых активация рецептора будет эффективной, и применению по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемого производного в получении лекарственного средства для комбинированной терапии расстройств липоидного обмена, включая дислипидемию и гиполипопротеинемию, такую как диабетическая дислипидемия и смешанная дислипидемия, сердечной недостаточности, гиперхолестеринемии, сердечно-сосудистого заболевания, включая атеросклероз, артериосклероз и гипертриглицеридемию, сахарный диабет по типу II, диабета по типу I,резистентности к инсулину, гиперлипидемии, нервной анорексии и ожирения. Когда соединения по настоящему изобретению применяются в сочетании с другими терапевтически активными средствами, соединения вводиться либо вместе или раздельно, последовательно или одновременно любым обычным способом введения. Указанные выше сочетания для удобства могут быть представлены для применения в форме фармацевтической композиции, и таким образом фармацевтические средства, содержащие сочетание, как определено выше, оптимальное вместе с фармацевтически приемлемым носителем или наполнителем,- 12014556 образуют дополнительный вариант осуществления по изобретению. Отдельные компоненты таких сочетаний могут вводиться либо вместе, либо раздельно, последовательно или одновременно в отдельных или комбинированных фармацевтических композициях. При сочетании в одной композиции будет учитываться тот факт, что два компонента должны быть стабильны и совместимы друг с другом и другими компонентами композиции и могут быть объединены в композицию для введения. При раздельном получении предусматривается, что они могут быть объединены в любой подходящей композиции способом, хорошо известным в данной области, подходящим для таких соединений. В случае сочетания со вторым терапевтическим средством, активным против того же заболевания,доза каждого компонента может отличаться от дозы, когда соединение применяется отдельно. Соответствующие дозы будут легко определены специалистом в данной области. Таким образом, изобретение относится в следующем варианте осуществления к сочетанию, содержащему по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемое производное вместе с другим терапевтически активным средством. Указанное выше сочетание может быть удобно представлено для применения в форме фармацевтической композиции, и таким образом фармацевтические средства, содержащие сочетание, как определено выше, вместе с его фармацевтически приемлемым носителем, представляют собой дополнительный вариант осуществления по изобретению. Соединения по настоящему изобретению и их фармацевтически приемлемые производные могут быть получены способами, описанными в настоящем описании далее, образуя дополнительный вариант осуществления по изобретению. В одном из вариантов осуществления настоящее изобретение относится к способу получения соединения(ий) формулы (I) из соответствующего исходного вещества, например соединения(ий) формулы(iv) удаление защитной группы N7; в любом порядке, обеспечивающем удаление защитной группы после алкилирования. Способ 1. Способ получения по изобретению соединения(ий) формулы (I), где R1 включает гетероциклил, гетероарил или арил, и R1 представляет собой Cl.ii) диазотирование нитритом натрия с последующим гидролизом с образованием ксантина;iv) алкилирование у N3 (примеры подходящих оснований включают Na2CO3, Cs2CO3, K2CO3);v) алкилирование у N1 (примеры подходящих оснований включают Na2CO3, Cs2CO3, K2CO3);vi) катализированное палладием удаление аллильной группы,где L представляет собой удаляемую группу, например галоген. Способ 2. Способ получения по изобретению промежуточных соединений, где R1 включает амид,карбамат или мочевину, которые могут использоваться для получения соединения(ий) формулы (I). где L представляет собой удаляемую группу, например, галоген, d представляет собой (m-1) (то есть d вместе с предшествующим метиленом = m), R представляет собой -(алкилен)n-Y и Q может присутствовать или может не присутствовать и, если присутствует, то представляет собой либо О, либо NR5. Способ 3. Способ получения промежуточных соединений, в которых R1 включает 'обратный' карбамат или сложный эфир, которые могут использоваться для получения соединения(ий) формулы (I) где L представляет собой удаляемую группу, например, галоген, d представляет собой (m-1), и R представляет собой -(алк)n-Y. Способ 4. Способ получения по изобретению промежуточных соединений, где R1 включает сложный эфир или амид, которые могут применяться для получения соединения(ий) формулы (I) где L представляет собой удаляемую группу, например галоген, d представляет собой (m-1), и R представляет собой -NR5R7 или -OR5. Способ 5. Способ получения по изобретению соединения(ий) формулы (I), где X включает пиразол,имидазол или тетразол где L представляет собой удаляемую группу, например, галоген, d представляет собой (m-1), и R представляет собой -(алк)n-Y. Способ 6. Способ получения по изобретению соединения(ий) формулы (I), в которой X включает оксадиазол где L представляет собой удаляемую группу, например, галоген, d представляет собой (m-1), R представляет собой алкильную группу и R' представляет собой -(алк)n-Y. Способ 7. Способ получения по изобретению соединения(ий) формулы (I), в которой X включает оксадиазол где L представляет собой удаляемую группу, например, галоген, d представляет собой (m-1), R представляет собой алкильную группу и R' представляет собой -(алк)n-Y. Способ 8. Способ получения по изобретению промежуточных соединений, где R3 представляет собой CN, которые могут быть использованы для получения соединения(ий) формулы (I). Он включает стадии (i) и (ii) способа 1, и последующееvii) катализированное палладием удаление аллильной группы,где L представляет собой удаляемую группу. Способ 9. Способ получения по изобретению соединения(ий) формулы (I), в которой R3 представляет собой Cl или Br, которое включает стадии (i)-(iv) способа 8, и последующееii) катализированное палладием удаление аллильной группы. Способ 10. Способ получения по изобретению соединения(ий) формулы (I), в которой R3 представляет собой Cl, который включаетiii) хлорирование у С 8,где L представляет собой удаляемую группу. Способ 11. Способ получения по изобретению соединения(ий) формулы (I), в которой R1 отличается от R2, и R3 представляет собой Cl, который включает стадии (i)-(v) способа 1 (в тех случаях, когда R2 из способа 1 представляет собой, в частности, SEM или MEM) и последующееvii) Алкилирование N3 с последующим катализируемым палладием удалением аллильной группы,где L представляет собой удаляемую группу. Способ 12. Способ получения по изобретению соединения(ий) формулы (I), в которой R3 представляет собой Cl, Br или I, который включает стадии (i)-(iv) способа 8, и последующееv) катализированное палладием удаление аллильной группы;vi) галогенирование у С 8, используя NCS, NBS или NIS. Способ 13. Способ получения по изобретению соединения(ий) формулы (I), который включаетiv) восстановление с использованием Na2S2O4 или аналогичного восстанавливающего агента;vi) галогенирование у С 8 с использованием NCS,где L представляет собой удаляемую группу. Способ 14. Способ получения по изобретению соединения(ий) формулы (I) где L представляет собой удаляемую группу. В качестве дополнительной стадии к общим способам, описанным выше, и, в частности, для использования в получении примеров, описанных ниже, существует несколько способов очистки получаемых соединений, один или несколько из которых могут быть использованы в настоящем изобретении,например, использование MDAP, перекристаллизация из одного или нескольких подходящих растворителей, таких как этилацетат, абсолютный этанол, ацетонитрил или метанол, или использование очистительной колонки, например картриджа Silica Redisep, и последующее элюирование подходящим растворителем, таким как дихлорметан, содержащим этилацетат. В тех случаях, когда это желательно или необходимо, в качестве конечной стадии любого из вышеуказанных способов синтеза, полученное соединение формулы (I) может быть применено преобразование в фармацевтически приемлемое производное, например, полученное соединение формулы (I) может быть преобразовано в форму соли, или наоборот, или преобразование одной соли в другую форму фармацевтически приемлемой соли. Эти способы хорошо известны специалистам в данной области. Сокращения: АсОН - уксусная кислота;SPE - картридж для экстрагирования твердой фазы;DMEM - среда, модифицированная по способу Дульбекко;Boc - трет-бутоксикарбонил; ТНР - тетрагидропиран. Краткое описание фигур Фиг. 1 - данные XRPD, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4 оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 1. Фиг. 2 - данные XRPD, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2-пиридинил)-1,2,4 оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 2. Фиг. 3 - наложение данных XRPD для, по существу, кристаллического 3-бутил-8-хлор-1-4-[5-(2 пиридинил)-1,2,4-оксадиазол-3-ил]бутил-3,7-дигидро-1H-пурин-2,6-диона формы 1 и формы 2. Следующие неограничивающие примеры иллюстрируют настоящее изобретение. Примеры синтеза Необходимо отметить, что определение расположения (Z)-стереохимии в соединениях, описанных ниже, не было подтверждено экспериментальными данными. Специалист в данной области также определит, что возможно взаимопревращение между изомерами Е и Z. (Dondoni, Alessandro; Lunazzi, Lodovico; Giorgianni, Patrizia; Macciantelli, Dante. Carbon-nitrogen rotational barrier as a stereochemical probe of(61 мг, 0,15 ммоль) в сухом ДМФ (2 мл) перемешивали с карбонатом натрия (64 мг, 0,6 ммоль) и 2-хлор 6-фторбензил бромидом (134 мг, 0,6 ммоль) и нагревали при 45 С в течение 18 ч в атмосфере азота. После охлаждения до комнатной температуры смесь дегазировали вакуумированием и повторно подавали азот, и перемешивали с тетракис(трифенилфосфин)палладием(0) (35 мг, 0,303 ммоль) и морфолином(0,13 мл) в течение 5,5 ч. Смесь распределяли между EtOAc и 2 М HCl, органическую фазу отделяли и- 18014556 упаривали, и остаток очищали аминопропиловым SPE (5 г, промывание ТГФ-МеОН (1:1) затем чистым МеОН, и наконец, элюируя DCM-MeOH (1:1), содержащим 5% АсОН) с получением указанного в заголовке соединения (57 мг) в виде твердого вещества. ЖХ/МС: m/z 507 [МН]+, RT 3,64 мин. 3-Пентил-8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-дион (5 г, 16,86 ммоль) и 3-(1 Нпиразол-4-ил)пропан-1-ол (2,12 г, 16,8 ммоль) перемешивали в сухом ТГФ (150 мл) при 3 С. Добавляли дибензил азодикарбоксилат (10,05 г, 33,7 ммоль), затем по каплям добавляли трифенилфосфин (8,83 г,33,7 ммоль) в сухом ТГФ (70 мл). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. Добавляли воду (1 мл) и растворители упаривали. Остаток помещали в Et2O (200 мл), из которого кристаллизовали белое твердое вещество, в основном трифенилфосфин оксид, и отфильтровывали. Фильтрат концентрировали и дополнительные побочные продукты кристаллизовали из смеси эфир-циклогексан. Оставшийся фильтрат концентрировали (19,2 г) и очищали на аппаратеBiotage (400 г), элюируя смесью EtOAc-циклогексан (2:1) с получением указанного в заголовке соединения в виде белого твердого вещества (2,89 г). ЖХ/МС: m/z 405 [МН]+, RT 3,19 мин. Следующие соединения (табл. 1) получали способом, аналогичным описанному в примере 1, из соответствующих бензилгалогенидов. Таблица 1 после дополнительной очистки с помощью MDAP.- 19014556 Данные ЯМР для выбранных примеров из табл. 1. Пример 2. 8-Хлор-3-пентил-1-(3-1-[(2,4,6-трифторфенил)метил]-1H-пиразол-4-илпропил)-3,7-дигидро-1H-пурин-2,6-дион. 1 Н ЯМР (ДМСО-d6) : 0,85 (т, 3 Н, J=7 Гц), 1,20-1,40 (м, 4 Н), 1,60-1,70 (м, 2 Н), 1,70-1,82 (м, 2 Н), 2,39(81 мг, 0,2 ммоль) и карбонат натрия (85 мг, 0,8 ммоль) перемешивали в сухом ДМФ (2 мл) с 2,4 дифторбензил бромидом (166 мг, 0,8 ммоль) при 45 С в течение 18 ч. Смесь дегазировали и перемешивали с тетракис(трифенилфосфин)палладием(0) (46 мг, 0,04 ммоль) и морфолином (176 мг, 2 ммоль) при комнатной температуре в течение 6 ч. Реакционную смесь обрабатывали и очищали с помощью аминопропилового SPE (5 г, промывание смесью ТГФ-МеОН (1:1), затем чистым МеОН, элюируя смесью после дополнительной очистки с помощью MDAP.- 20014556 Данные ЯМР для выбранных примеров из табл. 2. Пример 6. 1 Н ЯМР (ДМСО-d6) 0,85 (3 Н, т, J=7 Гц), 1,21-1,34 (4 Н, м), 1,58-1,68 (2 Н, м), 1,71-1,80 (2 Н,м), 2,41 (2 Н, т, J=8 Гц), 3,84-3,93 (4 Н, м), 5,26 (2 Н, с), 7,02-7,09 (1 Н, м), 7,15-7,29 (2 Н, м), 7,31 (1 Н, с), 7,61 Получали способом, описанным для 8-хлор-1-(3-1-[(2,4-дифторфенил)метил]-1H-пиразол-4-ил пропил)-3-пентил-3,7-дигидро-1H-пурин-2,6-диона, пример 6, но из 2-хлорбензил бромида (164 мг, 0,8 ммоль). Однако для того, чтобы выполнить стадию удаления защитной группы, дополнительно добавляли тетракис(трифенилфосфин)палладий(0) (40 мг) и морфолин (0,15 мл), и перемешивание продолжали в течение еще 5,5 ч. Очистка с помощью аминопропилового SPE, как описано выше, давала указанное в заголовке соединение в виде твердого вещества (42 мг). ЖХ/МС: m/z 489 [МН]+, RT 3,67 мин. Пример 12. 3-Бутил-8-хлор-1-3-[1-(фенилметил)-1H-имидазол-4-ил]пропил-3,7-дигидро-1 Н-пурин-2,6-дион. а) 3-Бутил-8-хлор-1-3-[1-(фенилметил)-1H-имидазол-4-ил]пропил-3,7-дигидро-1H-пурин-2,6-дион Раствор 3-бутил-8-хлор-1-[4-(1 Н-имидазол-4-ил)бутил]-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин 2,6-диона (300 мг, 0,77 ммоль) в безводном ТГФ (5 мл) обрабатывали бензилбромидом (144 мг, 0,84 ммоль) и DIPEA (147 мкл, 0,84 ммоль). Смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 4 дней. Смесь распределяли между EtOAc и 2 М HCl (водный). Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Сырой продукт очищали на SPE колонке с силикагелем, используя 0,5-5% градиентную смесь MeOH/DCM. Полученные фракции объединяли и концентрировали в высоком вакууме. Продукт растворяли в ТГФ (5 мл), затем добавляли Pd(PPh3)4 (88 мг, 0,077 ммоль) и морфолин (670 мкл, 7,67 ммоль), и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 ч. Добавляли 88 мг Pd(PPh3)4(0,077 ммоль), и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 16 ч. Смесь распределяли между EtOAc и Н 2 О. Органический слой отделяли и водный слой экстрагировли EtOAc (2). Органические слои объединяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Сырой продукт очищали MDAP с получением указанного в заголовке соединения в виде белого твердого вещества (9 мг, 2%). ЖХ/МС: m/z 441 [МН]+, RT 2,50 мин. 1 Н ЯМР (ДМСО-d6) : 0,89 (т, 3 Н, J=7,5 Гц), 1,28 (м, 2 Н), 1,60 (м, 2 Н), 1,79 (м, 2 Н), 2,48 (т, перекрытый ДМСО, 2 Н, J =7,5 Гц), 3,89 (м, 4 Н), 5,17 (с, 2 Н), 7,08 (с, 1 Н), 7,31, (м, 6 Н), 8,03 (с, 1 Н). Раствор 3-бутил-8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-диона (2,8 г, 9,9 ммоль) в безводном ТГФ (60 мл) обрабатывали 3-(1 Н-имидазол-4-ил)-1-пропанолом (1,5 г, 12 ммоль) в безводном ТГФ (10 мл) и PPh3 (3,4 г, 13 ммоль). Добавляли DBAD (2,9 г, 13 ммоль) одной частью, и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 18 ч. Смесь распределяли- 21014556 между EtOAc и H2O. Водный слой экстрагировли и промывали EtOAc. Органические слои объединяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Сырой продукт очищали с помощью SPE картриджа на силикагеле, используя градиентную смесь MeOH/EtOAc (0,5-7% МеОН). Полученные фракции объединяли и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (2,16 г, 55%). ЖХ/МС: m/z 391 [МН]+, RT 2,40 мин. с) 3-Бутил-8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-дион К раствору 3-бутил-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-диона (3,34 г, 13,4 ммоль) в безводном ДМФ (19 мл) добавляли NCS, (1,97 г, 14,8 ммоль) и оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 22 ч. Смесь концентрировали в вакууме с получением желтого твердого вещества, которое фильтровали и промывали МеОН с получением первой порции. Фильтрат концентрировали до твердого вещества и промывали МеОН с получением второй порции, и повторяли еще два раза с получением указанного в заголовке соединения. В конце промывания фильтрат дополнительно очищали с помощью картриджа SPE (Si, 20 г), элюируя смесью EtOAc:циклогексан (1:1). Объединенные твердые вещества сушили в вакууме с получением указанного в заголовке соединения (2,42 г,64%). ЖХ/МС: m/z 283 [МН]+. Пример 13. 3-Бутил-8-хлор-1-(3-1-[(2,3-дифторфенил)метил]-1H-имидазол-4-илпропил)-3,7 дигидро-1H-пурин-2,6-дион Раствор 3-бутил-8-хлор-1-[4-(1 Н-имидазол-4-ил)бутил]-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин 2,6-диона (150 мг, 0,38 ммоль) в безводном ДМФ (3 мл) обрабатывали 1-(бромметил)-2,4 дифторбензолом (54 мкл, 0,42 ммоль) и DIPEA (73 мкл, 0,42 ммоль). Смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 дней. Смесь распределяли между EtOAc и 2 МHCl (водный). Органический слой отделяли, промывали насыщенным солевым раствором, сушили(MgSO4) и концентрировали. Сырой продукт очищали на SPE колонке с силикагелем, используя DCM для загрузки вещества в колонку и последующей промывки примесей с градиентной смесью 0-5%MeOH/DCM для элюирования соединения. Полученные фракции объединяли и концентрировали и остатки растворяли в безводном ДМФ (3 мл). Раствор дегазировали, затем добавляли Pd(PPh3)4 (39 мг,0,034 ммоль) и морфолин (200 мкл, 2,3 ммоль), и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 ч. Сырой продукт очищали с помощью аминопропилового SPE,используя МеОН для загрузки соединения в колонку и последующей промывки примесей градиентной смесью 0-5% АсОН/МеОН для элюирования продукта. Полученные фракции объединяли и концентрировали в высоком вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (14 мг, 7%). ЖХ/МС: m/z 477 [МН]+, RT 2,54 мин. Пример 14. 3-Бутил-8-хлор-1-[3-(1-[2-(трифторметил)фенил]метил-1H-имидазол-4-ил)пропил]3,7-дигидро-1H-пурин-2,6-дион Раствор 3-бутил-8-хлор-1-[4-(1 Н-имидазол-4-ил)бутил]-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин 2,6-диона (150 мг, 0,38 ммоль) в безводном ДМФ (3 мл) обрабатывали 1-(хлорметил)-2-(трифторметил) бензолом (61 мкл, 0,42 ммоль) и DIPEA (73 мкл, 0,42 ммоль). Смесь оставляли перемешиваться при ком- 22014556 натной температуре в атмосфере азота в течение 3 дней. Смесь распределяли между EtOAc и 2 М HCl(водная). Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Сырой продукт очищали на SPE колонке с силикагелем, используя DCM для загрузки вещества в колонку и последующей промывки примесей градиентной смесью 0-5% MeOH/DCM для элюирования соединения. Полученные фракции объединяли и концентрировали, и остатки промывали в безводном ДМФ (3 мл). Раствор дегазировали, затем добавляли Pd(PPh3)4 (35 мг, 0,030 ммоль) и морфолин (174 мкл, 2,0 ммоль), и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 ч. Сырой продукт очищали с помощью аминопропилового SPE, используя МеОН для загрузки соединения в колонку и последующей промывки примесей градиентной смесью 0-5% АсОН/МеОН для элюирования продукта. Полученные фракции объединяли и концентрировали в высоким вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (50 мг,26%). ЖХ/МС: m/z 509 [МН]+, RT 2,64 мин. Пример 15. 3-Бутил-8-хлор-1-[3-(1-[3-(трифторметил)фенил]метил-1H-имидазол-4-ил)пропил]3,7-дигидро-1H-пурин-2,6-дион Раствор 3-бутил-8-хлор-1-[4-(1 Н-имидазол-4-ил)бутил]-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин 2,6-диона (150 мг, 0,38 ммоль) в безводном ДМФ (3 мл) обрабатывали 1-(хлорметил)-3-(трифторметил) бензолом (65 мкл, 0,42 ммоль) и DIPEA (73 мкл, 0,42 ммоль). Смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 дней. Смесь распределяли между EtOAc и 2 М HCl(водная). Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Сырой продукт очищали на SPE колонке с силикагелем, используя DCM для загрузки вещества в колонку и последующей промывки примесей градиентной смесью 0-5% MeOH/DCM для элюирования соединения. Полученные фракции объединяли и концентрировали, и остатки промывали в безводном ДМФ (3 мл). Раствор дегазировали, затем добавляли Pd(PPh3)4 (30 мг, 0,027 ммоль) и морфолин (156 мкл, 1,8 ммоль), и смесь оставляли перемешиваться при комнатной температуре в атмосфере азота в течение 3 ч. Сырой продукт очищали с помощью аминопропилового SPE, используя МеОН для загрузки соединения в колонку и последующей промывки примесей градиентной смесью 0-5% АсОН/МеОН для элюирования продукта. Полученные фракции объединяли и концентрировали в высоком вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (18 мг,9%). ЖХ/МС: m/z 509 [МН]+, RT 2,78 мин. Пример 16. 3-Бутил-8-хлор-1-(3-[3-(фенилметил)-1H-1,2,4-триазол-1-ил]пропил)-3,7-дигидро-1 Нпурин-2,6-дион. а) 3-Бутил-8-хлор-1-3-[3-(фенилметил)-1H-1,2,4-триазол-1-ил]пропил-3,7-дигидро-1H-пурин-2,6 дион Раствор 3-бутил-8-хлор-1-3-[3-(фенилметил)-1H-1,2,4-триазол-1-ил]пропил-7-(2-пропен-1-ил)3,7-дигидро-1H-пурин-2,6-диона (669 мг, 1,39 ммоль) в ТГФ (7 мл) дегазировали с применением вакуума и затем подавали азот. Добавляли Р (PPh3)4 (160 мг, 0,14 ммоль), и смесь повторно дегазировали. Добавляли морфолин (1,2 мл, 13,9 ммоль), и смесь перемешивали в атмосфере азота в течение 18 ч, затем распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, и водный слой повторно экстрагировали EtOAc. Объединенные экстракты вновь промывали насыщенным солевым раствором,сушили (MgSO4) и концентрировали с получением остатка желтого цвета. Добавляли МеОН, и затем продукт загружали на аминопропиловый SPE, элюируя смесью 2-3% АсОН/МеОН. Полученные фракции объединяли и концентрировали с получением светло-желтого твердого вещества (380 мг). Приблизительно четвертую часть вещества очищали с помощью autoprep ВЭЖХ, а оставшуюся часть кристаллизовали из смеси МеОН:ДМСО (1:1) с получением указанного в заголовке соединения в виде белого твердого вещества (125 мг, 31%). ЖХ/МС: m/z 442 [МН]+, RT 3,0 мин.NaOMe в МеОН (29 мл), затем 1,3-дибромпропаном (1,7 мл). После перемешивания в течение 5 ч при 50 С смесь распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали с получением маслянистого остатка(1,0 г). К нему добавляли бутил-8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1 Н-пурин-2,6-дион (917 мг, 3,2 ммоль) и Cs2CO3 (1,2 г, 3,6 ммоль). Добавляли ДМФ (15 мл), и смесь перемешивали при 50 С в течение 20 ч, затем распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Полученное масло (1,52 г) помещали на колонку с SPE силикагелем (50 г), элюируя смесями EtOAc/циклогексан. Получали два изомерных продукта триазола в виде смеси 2:1, вместо указанного в заголовке соединения, в виде желтого пастообразного вещества (697 мг, 67%, исходя из соотношения присутствующих изомеров). ЖХ/МС: m/z 482 Раствор 5-бензил-1H-тетразола (1,0 г, 6,24 ммоль) в МеОН (5 мл) обрабатывали 1-хлор-3 йодпропаном (1,0 мл, 9,36 ммоль) и раствором 0,5 М NaOMe в МеОН (4,7 мл, 9,36 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 18 ч, затем распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, и водный слой экстрагировали еще раз EtOAc. Объединенные экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали с получением желтого твердого вещества (796 мг). 700 мг этого вещества подвергали взаимодействию с 8-хлор-3 пентил-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-дионом (732 мг, 2,47 ммрль) и Cs2CO3 (967 мг, 3,0 ммоль) в ДМФ (20 мл) при 75 С в течение 24 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры, и смесь дегазировали с применением вакуума, и затем подавали азот. ДобавлялиPd(PPh3)4 (428 мг, 0,37 ммоль), и смесь повторно дегазировали. Добавляли морфолин (2,1 мл, 24,7 ммоль), и смесь перемешивали в атмосфере азота в течение 3 ч, затем распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, и водный слой экстрагировали повторно. Объединенные экстракты концентрировали с получением остатка желтого цвета. Добавляли МеОН, и затем продукт помещали на аминопропиловый SPE, элюируя смесью 2-3% АсОН/МеОН. Полученные фракции объединяли и концентрировали, затем очищали с помощью MDAP с получением указанного в заголовке соединения в виде белого твердого вещества (35 мг, 3%). ЖХ/МС: m/z 457 [МН]+, RT 3,5 мин. 1 Раствор 5-бензил-1H-тетразола (1,8 г, 11,2 ммоль) в МеОН (30 мл) обрабатывали 1,3-дибромпропаном (5,7 мл, 56,2 ммоль) и 0,5 М NaOMe в МеОН (31,5 мл), затем перемешивали при 40 С в атмосфере- 24014556 азота в течение 60 ч. Смесь распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли,промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали. Частичная очистка с помощью SPE (20 г оксид кремния, смесь циклогексан/EtOAc) и оборудованияCompanion (оксид кремния SPE, смесь циклогексан/EtOAc) давала масло (1,98 г, 62% смесь изомеров,2:1 вместо 2-(3-бромпропил)-5-(фенилметил)-2 Н-тетразола), которое использовали сырым на следующей стадии. Смесь 3-бутил-8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-диона (1,74 г, 6,1 ммоль),сырого 2-(3-бромпропил)-5-(фенилметил)-2 Н-тетразола) (1,9 г, 6,8 ммоль), Cs2CO3 (2,2 г, 6,8 ммоль) и ДМФ (60 мл) перемешивали при 45 С в атмосфере азота в течение 24 ч. Смесь дегазировали с применением вакуума и затем подавали азот. Добавляли Pd(PPh3)4 (705 мг, 0,61 ммоль) и смесь дегазировали повторно. Добавляли морфолин (5,4 мл, 61,4 ммоль), и смесь перемешивали в атмосфере азота в течение 4 ч, и затем распределяли между 2 М HCl (водная) и EtOAc. Органический слой отделяли, промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали с получением остатка желтого цвета. Добавляли МеОН, и затем продукт помещали на аминопропиловую колонку, элюируя смесью 2% АсОН/МеОН. Продукт дополнительно очищали с помощью оборудования Companion, используя смесиEtOAc/циклогексан. Полученное твердое вещество перемешивали в кипящем Et2O, и после охлаждения до комнатной температуры фильтровали. Указанное в заголовке соединение собирали в виде белого твердого вещества (1,01 г, 37%) и сушили при 50 С в вакууме. ЖХ/МС: m/z 443 [МН]+, RT 3,3 мин. 1 Н ЯМР (ДМСО-d6) : 0,89 (т, 3 Н, J=7 Гц), 1,29 (м, 2 Н), 1,61 (м, 2 Н), 2,22 (м, 2 Н), 3,89 (т, 2 Н, J=7 Гц), 3,97 (т, 2 Н, J=7 Гц), 4,17 (с, 2 Н), 4,67 (т, 2 Н, J=7 Гц), 7,20-7,32 (м, 5 Н), 14,5 (ушир.с, 1 Н). Пример 19. 8-Хлор-1-(3-(5-[(4-фторфенил)метил]-2 Н-тетразол-2-ил)пропил)-3-(4,4,4-трифторбутил)-3,7-дигидро-1 Н-пурин-2,6-дион. а) 8-Хлор-1-(3-5-[(4-фторфенил)метил]-2 Н-тетразол-2-илпропил)-3-(4,4,4-трифторбутил)-3,7 дигидро-1H-пурин-2,6-дион 5-[(4-Фторфенил)метил]-1H-тетразол (75 мг, 0,4 ммоль)обрабатывали карбонатом калия (100 мг, 0,7 ммоль) и ДМФ (3 мл). Смесь обрабатывали раствором 3-[8-хлор-2,6-диоксо-7-(2-пропен-1-ил)-3-(4,4,4 трифторбутил)-2,3,6,7-тетрагидро-1H-пурин-1-ил]пропил метансульфоната (100 мг, 0,2 ммоль) в ДМФ(0,5 мл). Смесь перемешивали и нагревали при 60 С в течение 3 ч, затем охлаждали и упаривали. Остаток распределяли между хлороформом (4 мл) и водой (2 см 3). К каждому добавляли 1 см 3 насыщенного водного бикарбоната натрия (3 мл). Смесь разделяли, и органическую фазу упаривали. Остаток растворяли в безводном ТГФ (3 мл), и смесь дегазировали с осторожным применением вакуума и последующей подачей азота к смеси. Смесь обрабатывали тетракис(трифенилфосфин)палладием(0) (10 мг, 0,008 ммоль) и морфолином (0,2 мл, 2,3 ммоль), и затем перемешивали в атмосфере азота в течение 2 ч. Смесь упаривали, и распределяли между хлороформом (4 мл) и насыщенным водным хлоридом аммония (3 мл). Смесь разделяли, и водную фазу повторно экстрагировали хлороформом. Органическую фазу упаривали,и остаток растворяли в МеОН (3 мл). Раствор помещали на верхушку 2-х г аминопропилового SPE и промывали МеОН (15 мл). Желаемый продукт элюировали из картриджа 3% объем/объем раствором АсОН в МеОН (20 мл). Продукт, содержащий фракции, объединяли и упаривали, и остаток подвергали очистке с помощью колоночной флэш-хроматографии (градиент элюирования от 10:1 циклогексан/EtOAc до EtOAc). Фракции, содержащие продукт, объединяли и упаривали с выходом продукта в виде бесцветного масла. Растирание с минимальным количеством диэтилового эфира позволяло отвердить продукт, и его тщательно высушивали с выходом указанного в заголовке соединения в виде белого твердого вещества (18,7 мг, 18%). ЖХ/МС: m/z 515 [МН]+, RT 3,31 мин. 1 Н ЯМР (CDCl3) : 2,06 (м, 2 Н), 2,21 (м, 2 Н), 2,45 (м, 2 Н), 4,17 (м, 4 Н), 4,24 (т, 2 Н, J=7,0 Гц), 4,70 (т,2 Н, J=7,2 Гц), 6,96 (м, 2 Н), 7,25 (м, 2 Н). 8-хлор-1-(3-гидроксипропил)-7-(2-пропен-1-ил)-3-(4,4,4-трифторбутил)-3,7-дигидро-1H- 25014556 пурин-2,6-диона (0,82 г, 2,1 ммоль) в DCM (20 мл) обрабатывали триэтиламином (0,42 мл, 3,1 ммоль) и ангидридом метансульфоновой кислоты (0,40 г, 2,3 ммоль). Через 1 ч смесь обрабатывали насыщенным водным раствором бикарбоната натрия (20 мл). Смесь разделяли, и органическую фазу сушили (MgSO4), фильтровали и упаривали с получением указанного в заголовке соединения (0,91 г), которое использовали без дополнительной очистки. ЖХ/МС: m/z 473 [МН]+, RT 3,17 мин. с) 8-Хлор-1-(3-гидроксипропил)-7-(2-пропен-1-ил)-3-(4,4,4-трифторбутил)-3,7-дигидро-1H-пурин 2,6-дион Раствор 8-хлор-7-(2-пропен-1-ил)-3-(4,4,4-трифторбутил)-3,7-дигидро-1H-пурин-2,6-диона (1,0 г,3,0 ммоль) в ДМФ (15 мл) обрабатывали карбонатом натрия (1,16 г, 3,6 ммоль) и 3-бром-1-пропанолом(0,3 мл, 3,3 ммоль). Смесь нагревали при 60 С в течение 4 ч и затем охлаждали и упаривали. Остаток распределяли между EtOAc (50 мл) и водой (50 мл). Органическую фазу сушили (MgSO4), фильтровали и упаривали. Продукт очищали флэш-хроматографией, используя градиент элюирования от циклогексана до EtOAc. Фракции, содержащие продукт, объединяли и упаривали с получением указанного в заголовке соединения в виде бесцветного масла (0,82 г, 75%). ЖХ/МС: m/z 395 [МН]+, RT 2,90 мин. Раствор 8-хлор-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-диона (2,0 г, 8,8 ммоль) в ДМФ (20 мл) обрабатывали карбонатом натрия (1,15 г, 10,8 ммоль) и 4-бром-1,1,1-трифторбутаном (1,86 г, 9,7 ммоль). Смесь перемешивали при 50 С в течение 18 ч, затем охлаждали и упаривали. Остаток распределяли между EtOAc (100 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Органическую фазу сушили (MgSO4), фильтровали и упаривали. Остаток растирали в смеси диэтилового эфира и циклогексана, затем продукт отфильтровывали и сушили с выходом указанного в заголовке соединения в виде белого твердого вещества (1,18 г, 40%). ЖХ/МС: m/z 337 [МН]+, RT 2,83 мин. е) 5-[(4-Фторфенил)метил]-1H-тетразол Смесь хлорида триэтиламмония (4,14 г, 30 ммоль) и азида натрия (1,95 г, 30 ммоль) обрабатывали раствором (4-фторфенил)ацетонитрила (1,35 г, 10 ммоль) в толуоле (14 мл), и смесь перемешивали и нагревали при 100 С в течение 5 ч. Охлажденную смесь обрабатывали водой (10 мл), и смесь разделяли. Водную фазу перемешивали и добавляли по каплям концентрированную соляную кислоту до осаждения продукта из раствора. Осажденный продукт отфильтровывали, промывали водой и сушили с выходом указанного в заголовке соединения в виде белого твердого вещества (1,27 г, 72%). ЖХ/МС: m/z 179 [МН]+, RT 2,24 мин. Соединения, указанные в табл. 3, получали способом, аналогичным описанному в примере 19: 8 хлор-1-(3-5-[(4-фторфенил)метил]-2 Н-тетразол-2-илпропил)-3-(4,4,4-трифторбутил)-3,7-дигидро-1Hпурин-2,6-дион, с соответствующим метансульфонатом и тетразолом. MDAP использовали для дополнительной очистки этих соединений, недостаточно очищенных после обычной фазовой хроматографии. Промежуточные соединения метансульфонатов и их исходные спирты получали в соответствии со следующими способами: 3-[8-Хлор-2,6-диоксо-7-(2-пропен-1-ил)-3-пропил-2,3,6,7-тетрагидро-1H-пурин-1-ил]пропил метансульфонат(1,99 г, 6,1 ммоль) в DCM (50 мл) обрабатывали триэтиламином (1,2 мл, 8,6 ммоль) и ангидридом метансульфоновой кислоты (1,2 г, 6,9 ммоль). Через 1,5 ч смесь обрабатывали водой (50 мл). Смесь разделяли,и водную фазу экстрагировали DCM (25 мл), объединенные органические фазы сушили (MgSO4), фильтровали и упаривали с получением указанного в заголовке соединения в виде светло-желтого масла (2,38 г), которое использовали без дополнительной очистки. ЖХ/МС: m/z 405 [МН]+, RT 2,93 мин. 3-[3-Бутил-8-хлор-2,6-диоксо-7-(2-пропен-1-ил)-2,3,6,7-тетрагидро-1H-пурин-1-ил]пропил метансульфонат Раствор 8-хлор-7-(2-пропен-1-ил)-3-пропил-3,7-дигидро-1H-пурин-2,6-диона (3,0 г, 11,1 ммоль) в ДМФ (20 мл) обрабатывали карбонатом натрия (3,7 г, 11,4 ммоль) и 3-бром-1-пропанолом (1,6 г, 11,5 ммоль). Смесь нагревали при 60 С в течение 4 ч и затем охлаждали и упаривали. Остаток распределяли между EtOAc (60 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Водную фазу экстрагировли EtOAc (60 мл), объединенные органические фазы сушили (MgSO4), фильтровали и упаривали. Продукт очищали, используя оборудование Companion и градиент элюирования от циклогексана доEtOAc. Продукт, содержащий фракции, объединяли и упаривали с получением указанного в заголовке соединения в виде бесцветного масла (2,6 г). ЖХ/МС: m/z 327 [МН]+, RT 2,62 мин. 3-Бутил-8-хлор-1-(3-гидроксипропил)-7-(2-пропен-1-ил)-3,7-дигидро-1H-пурин-2,6-дион Получали в соответствии со способом, используемым для 8-хлор-1-(3-гидроксипропил)-7-(2 пропен-1-ил)-3-пропил-3,7-дигидро-1 Н-пурин-2,6-диона, с получением указанного в заголовке соединения в виде бесцветного масла (2,3 г). ЖХ/МС: m/z 341 [МН]+, RT 2,85 мин.
МПК / Метки
МПК: C07D 473/06, A61K 31/495, A61P 3/00, C07D 473/04, A61P 9/00
Метки: селективных, производные, hm74a, агонистов, ксантина, качестве
Код ссылки
<a href="https://eas.patents.su/30-14556-proizvodnye-ksantina-v-kachestve-selektivnyh-agonistov-hm74a.html" rel="bookmark" title="База патентов Евразийского Союза">Производные ксантина в качестве селективных агонистов hm74a</a>
Предыдущий патент: Ингибитор bcrp/abcg2
Следующий патент: Связующее, способное свариваться антикоррозионное средство и деталь
Случайный патент: Т-образное соединение поперечного и стоечного профилей фасада или прозрачной крыши












