Циклические анилино-пиридинотриазины в качестве ингибиторов gsk-3
Номер патента: 17545
Опубликовано: 30.01.2013
Авторы: Ромбаутс Фредерик Ян Рита, Ву Тонгфей, Ван Эмелен Кристоф, Лав Кристофер Джон, Ван Брандт Свен Францискус Анна
Формула / Реферат
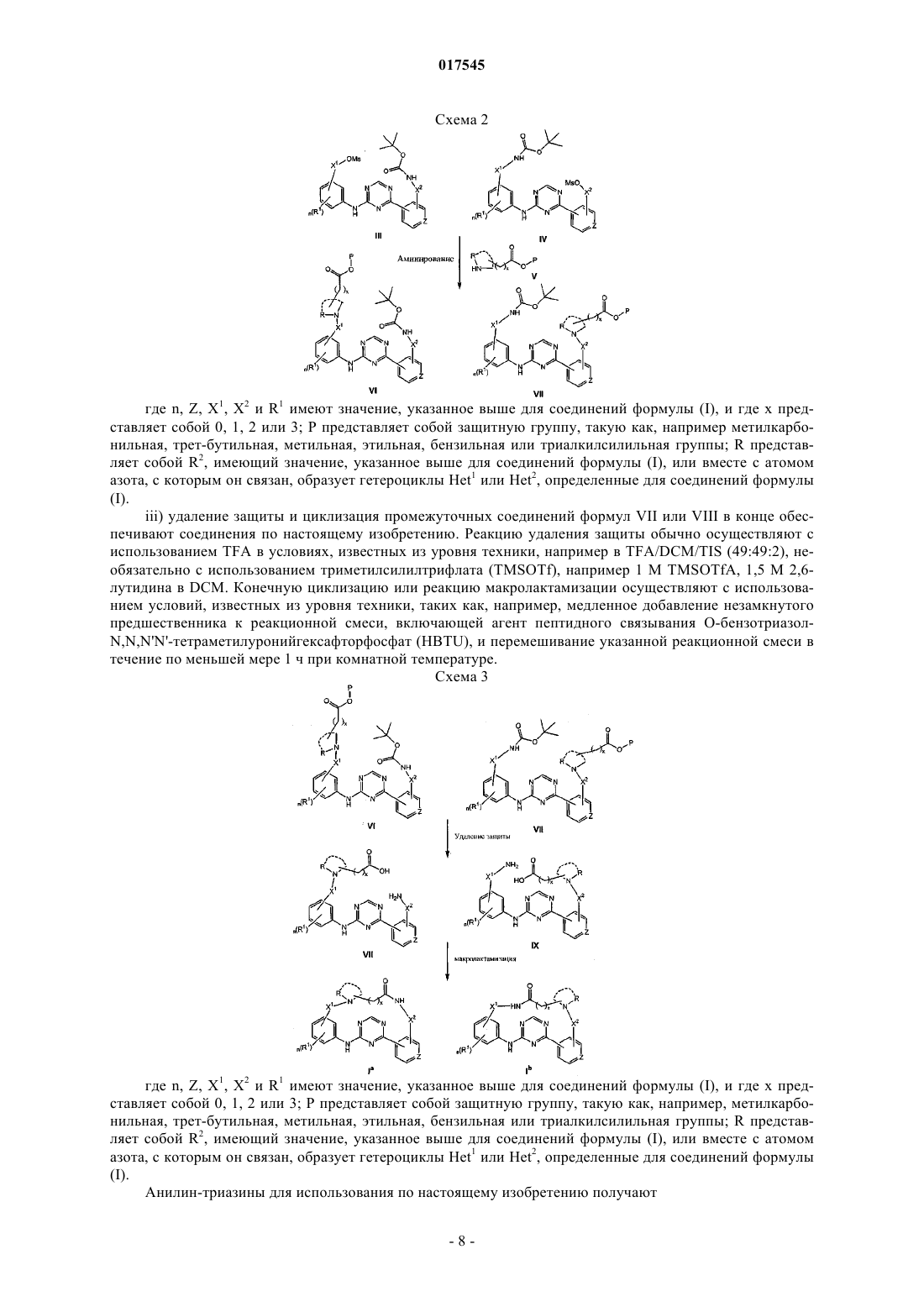
1. Соединение формулы (I)
его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,
где m представляет собой целое число, имеющее значение от 1 до 4;
n представляет собой целое число, имеющее значение от 1 до 4;
Z представляет собой N или С;
Y представляет собой -NR2-C1-6алкил-СО-NR4-, -C1-4алкил-NR9-C1-4алкил-, C1-6алкил-СО-Het10-, -Het11-СО-C1-6алкил-, -Het12-C1-6алкил-, -СО-Het13-C1-6алкил-, -СО-NR10-C1-6алкил-, -Het1-C1-6алкил-CO-NR5- или -Het2-CO-NR6-, где -C1-6алкильный линкер в -NR2-C1-6алкил-CO-NR4- или -Het1-C1-6алкил-СО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, фенила, индолила, метилсульфида, тиола, гидроксифенила, цианофенила, амино и гидроксикарбонила;
X1 представляет собой простую связь, C1-4алкил, C1-4алкилокси-, С1-4алкил-СО-, C2-4алкенил, C2-4алкинил или C1-4алкил-NR3-, где указанный C1-4алкил или C2-4алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;
X2 представляет собой простую связь, C1-4алкил, C1-4алкилокси, С1-4алкил-СО-, C2-4алкенил, C2-4алкинил или C1-4алкил-NR7-, где указанный C1-4алкил или C2-4алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;
R1 и R8, каждый независимо, представляют собой водород или галоген;
R2 и R9, каждый независимо, представляет собой водород, C1-4алкил, C2-4алкенил, Het4-C1-4алкил-, моно- или ди(C1-4алкил)амино-C1-4алкилкарбонил- или фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4алкилокси-;
R3 и R7, каждый независимо, представляют собой водород, C1-4алкил, C1-4алкенилсульфонил-, С1-4алкилокси-С1-4алкил- или фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4алкилокси-;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил, необязательно замещенный гидрокси или C1-4алкилокси;
Het1 и Het2, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанный Het1 или Het2 необязательно замещен гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het10, Het11, Het12 и Het13, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанные Het10, Het11, Het12 и Het13 необязательно замещены гидрокси.
2. Соединение по п.1, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N или С;
Y представляет собой -NR2-C1-6алкил-СО-NR4-, -C1-4алкил-NR9-C1-4алкил-, C1-6алкил-СО-Het10-, -Het11-СО-C1-6алкил-, -Het12-C1-6алкил-, -CO-Het13-C1-6алкил-, -CO-NR10-С1-6алкил-, -Het1-С1-6алкил-CO-NR5- или -Het2-CO-NR6-, где -C1-6алкильный линкер в группе -NR2-C1-6алкил-СО-NR4- или -Het1-C1-6алкил-CO-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;
X1 представляет собой простую связь, C1-4алкил-, С1-4алкилокси- или C1-4алкил-NR3;
X2 представляет собой простую связь, C1-4алкил, C1-4алкилокси-, С1-4алкил-СО-, C2-4алкенил, C2-4алкинил или C1-4алкил-NR7-, где указанный C2-4алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;
R1 представляет собой водород или галоген;
R2 представляет собой водород, C1-4алкил, C2-4алкенил или Het4-С1-4алкил-;
R3 и R7, каждый независимо, представляют собой водород или C1-4алкил;
R8 представляет собой водород;
R9 представляет собой водород или C1-4алкил;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил;
Het1 и Het2, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанный Het1 или Het2 необязательно замещен гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het10, Het11, Het12 и Het13, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанные Het10, Het11, Het12 и Het13 необязательно замещены гидрокси.
3. Соединение по п.1, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N;
Y представляет собой -NR2-C1-6алкил-СО-NR4-, -C1-4алкил-NR9-C1-4алкил-, C1-6алкил-CO-Het10-, -Het11-CO-C1-6алкил-, -Het12-C1-6алкил-, -CO-Het13-C1-6алкил-, -СО-NR10-C1-6алкил-, -Het1-C1-6алкил-CO-NR5-, -Het2-CO-NR6-, где -C1-6алкильный линкер в группе -NR2-C1-6алкил-CO-NR4- или -Het1-C1-6алкил-СО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;
X1 представляет собой простую связь, -C1-4алкил-, С1-4алкилокси- или C1-4алкил-NR3;
X2 представляет собой простую связь, C1-4алкил, С1-4алкилокси-, C1-4алкил-СО-, C2-4алкенил, C2-4алкинил или C1-4алкил-NR7-, где указанный С2-4алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;
R1 представляет собой водород или галоген;
R2 представляет собой водород, C1-4алкил, C2-4алкенил или Het4-C1-4алкил-;
R3 и R7, каждый независимо, представляют собой водород или C1-4алкил;
R8 представляет собой водород;
R9 представляет собой водород, метил, этил или изопропил;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил;
Het1 представляет собой пирролидинил или пиперазинил, а Het2 представляет собой пиперидинил, пиперазинил или пирролидинил, где указанный пирролидинил необязательно замещен гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het10, Het11, Het12 и Het13 представляют собой пиперазинил.
4. Соединение по п.1, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N;
Y представляет собой -NR2-C1-6алкил-СО-NR4-, -C1-4алкил-NR9-C1-4алкил-, C1-6алкил-СО-Het10-, -Het11-СО-C1-6алкил-, -Het12-C1-6алкил-, -CO-Het13-С1-6алкил-, -CO-NR10-С1-6алкил-, -Het1-C1-6алкил-CO-NR5- или -Het2-CO-NR6-, где -C1-6алкильный линкер в группе -NR2-C1-6алкил-СО-NR4- или -Het1-C1-6алкил-СО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;
X1 представляет собой простую связь, -C1-4алкил-, C1-4алкилокси- или C1-4алкил-NR3;
X2 представляет собой простую связь, C1-4алкил, С1-4алкилокси-, C1-4алкил-CO-, C2-4алкенил, C2-4алкинил или C1-4алкил-NR7-, где указанный C2-4алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;
R1 представляет собой водород или галоген;
R2 представляет собой водород, C1-4алкил, C2-4алкенил или Het4-С1-4алкил-;
R3 и R7, каждый независимо, представляют собой водород или C1-4алкил;
R8 представляет собой водород;
R9 представляет собой водород, метил или этил;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил;
Het1 представляет собой пирролидинил или пиперазинил, а Het2 представляет собой пиперидинил, пиперазинил или пирролидинил, где указанный пирролидинил необязательно замещен гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het10, Het11, Het12 и Het13 представляют собой пиперазинил.
5. Соединение по пп.1-4, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N или С;
Y представляет собой -NR2-C1-6алкил-СО-NR4-, -Het11-CO-C1-6алкил-, -CO-Het13-C1-6алкил-, -СО-NR10-C1-6алкил-, -Het1-C1-6алкил-CO-NR5- или -Het2-CO-NR6-, где -C1-6алкильный линкер в группе -NR2-C1-6алкил-CO-NR4- или -Het1-C1-6алкил-СО-NR5- необязательно замещен гидрокси;
X1 представляет собой -C1-4алкил-, -C1-4алкилокси- или С1-4алкил-NR3;
X2 представляет собой простую связь, C1-4алкил, C1-4алкилокси или C1-4алкил-NR7-;
R1 представляет собой водород или галоген;
R8 представляет собой водород или галоген;
R2 представляет собой водород, C1-4алкил или Het4-С1-4алкил-;
R3 и R7, каждый независимо, представляют собой водород или C1-4алкил;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил;
Het1 и Het2, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанные Het1 и Het2 необязательно замещены гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het11 представляет собой пиперидинил или пиперазинил;
Het13 представляет собой пиперидинил или пиперазинил.
6. Соединение по пп.1-4, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N;
Y представляет собой -NR2-С1-6алкил-СО-NR4-, -Het11-CO-C1-6алкил-, -СО-Het13-С1-6алкил-, -СО-NR10-С1-6алкил-, -Het1-С1-6алкил-CO-NR5- или -Het2-CO-NR6-, где -С1-6алкильный линкер в группе -NR2-С1-6алкил-CO-NR4- или -Het1-C1-6алкил-CO-NR5- необязательно замещен гидрокси;
X1 представляет собой -C1-4алкил-, -C1-4алкилокси- или C1-4алкил-NR3;
X2 представляет собой простую связь, С1-4алкил, C1-4алкилокси или C1-4алкил-NR7-;
R1 представляет собой водород или галоген;
R8 представляет собой водород или галоген;
R2 представляет собой водород, C1-4алкил или Het4-C1-4алкил-;
R3 и R7, каждый независимо, представляют собой водород или C1-4алкил;
R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4алкил;
Het1 и Het2, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанные Het1 и Het2 необязательно замещены гидрокси;
Het4 представляет собой пиперазинил, необязательно замещенный C1-4алкилом;
Het11 представляет собой пиперазинил;
Het13 представляет собой пиперазинил.
7. Соединение по п.1, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N или С;
Y представляет собой -C1-4алкил-NR9-C1-4алкил-, -NR2-C1-6алкил-CO-NR4-, -Het1-C1-6алкил-CO-NR5- или Het2-CO-NR6-, где C1-6алкильный линкер в -Y- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, галогена или фенила;
X1 представляет собой C1-4алкил или C1-4алкилокси-;
X2 представляет собой C1-4алкил, C1-4алкилокси, - C1-4алкил-NR7-;
R1 представляет собой водород, хлор, фтор или бром;
R2 представляет собой водород, C1-4алкил или C2-4алкенил;
R4 представляет собой водород;
R5 представляет собой водород или C1-4алкил;
R6 представляет собой водород или C1-4алкил;
R7 представляет собой водород или C1-4алкил;
R8 представляет собой водород, хлор, фтор или бром;
R9 представляет собой водород или C1-4алкил;
Het1 представляет собой пиперазинил или пиперидинил;
Het2 представляет собой пирролидинил, пиперидинил или пиперазинил, где указанный Het2 необязательно замещен гидрокси.
8. Соединение по п.1, где
m представляет собой 1;
n представляет собой 1;
Z представляет собой N или С;
Y представляет собой -C1-4алкил-NR9-C1-4алкил-, -NR2-C1-6алкил-CO-NR4-, -Het1-С1-6алкил-CO-NR5- или Het2-CO-NR6-, где C1-6алкильный линкер в -Y- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, галогена или фенила;
X1 представляет собой этил или этокси;
X2 представляет собой пропил, -NR7-этил- или NR7-пропил-;
R1 представляет собой водород, хлор, фтор или бром;
R2 представляет собой водород, C1-4алкил или C2-4алкенил;
R4 представляет собой водород;
R5 представляет собой водород или C1-4алкил;
R6 представляет собой водород или C1-4алкил;
R7 представляет собой водород или C1-4алкил;
R8 представляет собой водород, хлор, фтор или бром;
R9 представляет собой водород или C1-4алкил;
Het1 представляет собой пиперазинил или пиперидинил;
Het2 представляет собой пирролидинил, пиперидинил или пиперазинил, где указанный Het2 необязательно замещен гидрокси.
9. Соединение по п.1, где указанное соединение выбрано из группы, включающей
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8 (26),9,11,21,23-нонаен-19-ин-16-он;
(19Z)-19-хлор-14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,19,21,23-декаен-16-он;
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он;
1,8,10,12,17,22,26,32-октаазапентацикло-[24.2.2.1~3,7~.1~9,13~.1~14,18~]тритриаконта-3(33),4,6,9(32),10,12,14(31),15,17-нонаен-23-он;
1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаен-23-он;
17-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-15-он;
18-метил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он;
14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2 (27),3,5,8(26),9,11,21,23-нонаен-16-он;
14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он;
18-этил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он;
5-хлор-1,8,10,12,17,22,30-гептаазапентацикло-[22.2.2.1~3,7~.1~14,18~]гентриаконта-3(31),4,6,9(30),10,12,14(29),15,17-нонаен-23-он;
5-хлор-1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаен-23-он;
10-хлор-14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8 (26),9,11,21,23-нонаен-16-он;
10-хлор-14-этил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8 (26),9,11,21,23-нонаен-16-он;
включая их N-оксидные формы, фармацевтически приемлемые аддитивные соли и их стереохимически активные изомерные формы.
10. Соединение по п.1, где указанное соединение выбрано из солей трифторуксусной кислоты
18-этил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он;
14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он;
1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаен-23-он;
14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он;
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8 (26),9,11,21,23-нонаен-16-он или
1,8,10,12,17,22,26,32-октаазапентацикло-[24.2.2.1~3,7~.1~9,13~.1~14,18~]тритриаконта-3(33),4,6,9(32),10,12,14(31),15,17-нонаен-23-он.
11. Применение соединения по любому из пп.1-10 в качестве лекарственного средства.
12. Применение соединения по любому из пп.1-10 для получения лекарственного средства для профилактики или лечения заболеваний, опосредованных активностью GSK-3.
13. Фармацевтическая композиция, включающая соединение по любому из пп.1-10.
14. Промежуточное соединение формулы (XI)
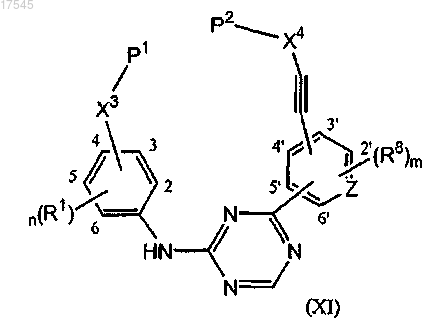
его фармацевтически приемлемые аддитивные соли и их стереохимически изомерные формы,
где n представляет собой целое число, имеющее значение от 1 до 4;
m представляет собой целое число, имеющее значение от 1 до 4;
Z представляет собой N или С;
P1 и Р2, каждый независимо, представляют собой гидрокси, галоген, гидроксикарбонил-, галогенкарбонил-, C1-6алкилоксикарбонил- или C1-6алкилоксикарбонил-C1-4алкил-;
X3 представляет собой C1-6алкил или C1-6алкил-NR20;
X4 представляет собой C1-6алкил или C1-6алкил-NR21;
R1 и R8, каждый независимо, представляют собой водород или галоген;
R20 и R21, каждый независимо, представляют собой водород, C1-4алкил, Het20, Het21-C1-4алкил-, C2-4алкенилкарбонил, необязательно замещенный группой Het22-C1-4алкиламинокарбонил-, C2-4алкенилсульфонил, C1-4алкилокси-С1-4алкил- или фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4алкилокси-;
Het20 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het20 необязательно замещен группой -C1-4алкил-, С3-6циклоалкил, гидрокси-C1-4алкил-, С1-4алкилокси-С1-4алкил- или полигидрокси-C1-4алкил-;
Het21 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het21 необязательно замещен группой C1-4алкил, С3-6циклоалкил, гидрокси-C1-4алкил- или полигидрокси-C1-4алкил-;
Het22 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het22 необязательно замещен группой C1-4алкил, С3-6циклоалкил, гидрокси-C1-4алкил-, С1-4алкилокси-С1-4алкил- или полигидрокси-C1-4алкил-.
15. Промежуточное соединение по п.14, где
n представляет собой 1;
m представляет собой 1;
Z представляет собой N или С;
P1 и Р2, каждый независимо, представляют собой гидрокси, C1-6алкилоксикарбонил или C1-6алкилоксикарбонил-C1-4алкил-;
X3 представляет собой -C1-4алкил- или C1-4алкил-NR20-;
X4 представляет собой -C1-4алкил- или C1-4алкил-NR21-;
R1 представляет собой водород или
R8 представляет собой водород;
R20 и R21, каждый независимо, представляют собой водород или C1-4алкил.
16. Промежуточное соединение по п.14, где
n представляет собой 1;
m представляет собой 1;
Z представляет собой N;
P1 и Р2, каждый независимо, представляют собой гидрокси, C1-6алкилоксикарбонил или C1-6алкилоксикарбонил-C1-4алкил-;
X3 представляет собой -С1-4алкил- или С1-4алкил-NR20-;
X4 представляет собой -C1-4алкил- или C1-4алкил-NR21-;
R1 представляет собой водород или
R8 представляет собой водород;
R20 и R21, каждый независимо, представляют собой водород или C1-4алкил.
Текст
Медведев В.Н. (RU) Изобретение относится к соединениям формулы (I), их N-оксидным формам, фармацевтически приемлемым аддитивным солям и их стереохимически изомерным формам, где m представляет собой целое число, имеющее значение от 1 до 4; n представляет собой целое число, имеющее значение от 1 до 4; Z представляет собой N или С; Y представляет собой -NR2C1-6 алкил-СО-NR4-, -C1-4 алкил-NR9-C1-4 алкил-, C1-6 алкил-CO-Het10-, -Het11-СО-C1-6 алкил-, Het12-C1-6 алкил-, -СО-Het13C1-6 алкил-, -СО-NR10-C1-6 алкил-, -Het1-С 1-6 алкил-CO-NR5- или -Het2-CO-NR6-, где -C1-6 алкильный линкер в -NR2-C1-6 алкилCO-NR4- или -Het1-C1-6 алкил-CO-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, фенила, индолила, метилсульфида, тиола,гидроксифенила, цианофенила, амино и гидроксикарбонила; X1 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси-, C1-4 алкил-СО-, C2-4 алкенил, C2-4 алкинил или C1-4 алкил-NR3-, где указанный C1-4 алкил или C2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями; X2 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси, C1-4 алкил-СО-, C2-4 алкенил, C2-4 алкинил или С 1-4 алкил-NR7-, где указанныйC1-4 алкил или C2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями; R1 и R8, каждый независимо, представляют собой водород или галоген; R2 и R9, каждый независимо,представляют собой водород, C1-4 алкил, C2-4 алкенил, Het4-C1-4 алкил-, моно- или ди(C1-4 алкил)амино-C1-4 алкилкарбонилили фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4 алкилокси-; R3 и R7, каждый независимо, представляют собой водород, C1-4 алкил,С 1-4 алкенилсульфонил-, С 1-4 алкилоксиС 1-4 алкил- или фенил, необязательно замещенный одним или, если это возможно,двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4 алкилокси-; R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4 алкил, необязательно замещенный гидрокси или C1-4 алкилокси; Het1 и Ромбаутс Фредерик Ян Рита, Лав Кристофер Джон, Ван Эмелен Кристоф, Ван Брандт Свен Францискус Анна, Ву Тонгфей (BE) 017545 Киназа-3 гликогенсинтазы (GSK-3) представляет собой серин/треонинпротеинкиназу, впервые обнаруженную как одну из многочисленных киназ, способных к фосфорилированию и инактивированию гликогенсинтазы, фермента, регулирующего синтез гликогена у млекопитающих (Embi et al., Eur. J. Biochem., 107, 519-527 (1980. Существуя в двух изоформах, GSK-3 и GSK-3, GSK-3 фосфорилирует широкий ряд различных белков in vitro. Разнообразие этих белков говорит о роли GSK-3 в контроле клеточного метаболизма, роста и развития. Диабет типа I характеризуется недостатком инсулина в результате разрушения инсулинпродуцирующих клеток в поджелудочной железе. Диабет типа II характеризуется нарушением секреции и действия инсулина. Связывание инсулина с его рецептором инициирует каскад событий, приводящих к фосфорилированию и ингибированию GSK-3, что способствует инсулин-индуцируемой стимуляции синтеза гликогена и белка. Ингибиторы GSK-3, как было показано, имитируют действие инсулина (Coghlanet al., Chem. Biol., 7, 793- 803, (2000, включая способность к снижению уровней глюкозы в крови in vivo(Norman, Drug News Perspect., 14, 242-247 (2001. Эти последние открытия говорят о том, что ингибиторы GSK-3 обладают потенциалом для лечения диабета. Болезнь Альцгеймера характеризуется связанным с микротрубочками белком Tau, существующим в аномально гиперфосфорилированном состоянии (Cohen and Frame, Nature Reviews: Molecular Cell Biology, 2, 769-776 (October 2001. GSK-3 фосфорилирирует множество гиперфосфорилированных участков в Tau in vitro, предотвращая его связывание с микротрубочками, что делает его доступным к аберрантной сборке структуры филамента, что может лежать в основе деградации нейронов, наблюдаемой при болезни Альцгеймера и других неврологических расстройствах. Было показано, что ингибиторы GSK-3, такие как инсулин и ионы лития, индуцируют частичное дефосфорилирование Tau в нервных клетках (Cross et al., J. Neurochem., 77, 94-102 (2001. Эти открытия говорят о том, что ингибиторы GSK-3 играют существенную роль в лечении нейродегенеративных расстройств, таких как болезнь Альцгеймера. Рост волос регулируется сигнальным путем Wnt, в частности Wnt-3. В модельных системах с использованием культуры тканей кожи экспрессия неразрушаемых мутантов -катенина ведет к огромному увеличению популяции предполагаемых стволовых клеток, обладающих огромным потенциалом к пролиферации. Такая популяция стволовых клеток экспрессирует более высокий уровень не связанного с кадерином -катенина, который может способствовать их более высокому пролиферативному потенциалу. Более того, у трансгенных мышей, в коже которых наблюдается сверхэкспрессия усеченного катенина, имеет место de novo морфогенез волосяных фолликул, который в нормальных условиях установлен только в фазе эмбриогенеза. Что касается -катенина, известно, что он фосфорилируется под действием GSK-3, следовательно, эктопическое применение ингибиторов GSK-3 может быть терапевтически полезным для лечения облысения и для восстановления роста волос после индуцированной химиотерапией алопеции. Одним из следующих белков, регулируемых фосфорилированием GSK-3, является сигнальный белок NF-В. Исследование фибробластов, полученных от мышей с выключенным GSK-3, показывают,что ингибирование GSK-3 может быть полезным при лечении воспалительных расстройств или заболеваний через отрицательную регуляцию активности NF-В. Такие заболевания включают аутоиммунные заболевания и воспалительные заболевания, такие как аллергии и астма, рассеянный склероз (MS), ревматоидный артрит (RA), артериосклероз, артрит или воспалительное заболевание кишечника (IBD). Хотя GSK-3 была изначально идентифицирована как пролин-направленная серин/треонинкиназа,которая фосфорилирует гликогенсинтазу, к настоящему времени было продемонстрировано, что GSK-3 фосфорилирует различные белки in vitro, такие как субъединица-11 сАМР-зависимой протеинкиназы, Gсубъединица фосфатазы-1, АТФ-цитратлиаза, ацетил-кофермент А карбоксилаза, основной белок миелина, связанный с микротрубочками белок, нейрофиламентный белок, молекула клеточной адгезии NCAM, рецептор фактора роста нервов, фактор транскрипции c-Jun, фактор транскрипции JunD, фактор транскрипции c-Myb, фактор транскрипции c-Мус, фактор транскрипции L-Myc, белок Tau и -катенин. Такое разнообразие белков, которые могут быть фосфорилированы при помощи GSK-3, предполагает,что GSK-3 участвует в различных метаболических и регуляторных процессах в клетках. Поэтому ингибиторы GSK-3 могут быть полезными для профилактики или лечения заболеваний,опосредованных активностью GSK-3, таких как биполярные расстройства (в частности, маниакальная депрессия), диабет, болезнь Альцгеймера, лейкопения, FTDP-17 (фронто-темпоральная деменция, связанная с болезнью Паркинсона), кортико-базальная дегенерация, прогрессивный супрануклеарный паралич, рассеянная системная атрофия, болезнь Pick, болезнь Niemann Pick типа С, Dementia Pugilistica, деменция, характеризующаяся только состоянием запутанности мышления, деменция, характеризующаяся состоянием запутанности мышления и кальцификацией, синдром Дауна, миотическая дистрофия, комплекс паркинсонизма-деменции Guam, деменция, связанная со СПИДом, постэнцефалический паркинсонизм, прион заболевания, характеризующиеся состоянием запутанности мышления, подострый склерозирующий лейкоэнцефалит, дегенерация лобных долей (FLD), аргирия, подострый склерозирующий лейкоэнцефалит (SSPE) (позднее осложнение вирусных инфекций в центральной нервной системе), вос-1 017545 палительные заболевания, депрессия, рак, дерматологические расстройства, такие как облысение, нейрозащита, шизофрения, боль, в частности невропатическая боль. Ингибиторы GSK3 также можно использовать для ингибирования подвижности сперматозоидов и поэтому их можно использовать в качестве мужских контрацептивов. В частности, соединения по настоящему изобретению являются полезными для профилактики или лечения болезни Альцгеймера; диабета, в частности диабета типа II (инсулин-независимого диабета); биполярных расстройств; рака; боли, в частности невропатической боли; депрессии; воспалительных заболеваний, включая аллергии и астму, MS, RA, артериосклероза, артрита или IBD. Более конкретно,соединения по настоящему изобретению являются полезными для профилактики или лечения диабета, в частности диабета типа II (инсулин-независимого диабета); боли, в частности невропатической боли; депрессии; воспалительных заболеваний, включая MS, RA или IBD. Настоящее изобретение относится к макроциклам на основе анилино(пиридино)триазинов формулы(I), которые, как было обнаружено, обладают активностью ингибирования киназы и, например, могут быть полезными для лечения клеточно-пролиферативных расстройств, включая рак, псориаз, доброкачественную гиперплазию предстательной железы, артериосклероз и рестеноз. В частности, было обнаружено, что соединения по настоящему изобретению обладают активностью ингибирования GSK3 и соответственно являются полезными в способах лечения человека или животных, например для получения лекарственных средств для применения для профилактики или лечения заболеваний, опосредованных активностью GSK-3 supra. Настоящее изобретение также относится к способам получения указанных производных анилино(пиридино)триазинов, к фармацевтическим композициям, включающим такие производные, и к их использованию для получения лекарственных средств, применяемых для профилактики или лечения заболеваний, опосредованных активностью GSK-3. Настоящее изобретение относится к соединениям формулы (I) его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеm представляет собой целое число, имеющее значение от 1 до 4;n представляет собой целое число, имеющее значение от 1 до 4;-Het -СО-С 1-6 алкил-, -Het12-С 1-6 алкил-, -СО-Het13-С 1-6 алкил-, -СО-NR10-С 1-6 алкил-, -Het1-С 1-6 алкил-СОNR5- или -Het2-CO-NR6-, где -С 1-6 алкильный линкер в -NR2-С 1-6 алкил-СО-NR4- или -Het1-С 1-6 алкил-СОNR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, фенила, индолила, метилсульфида, тиола, гидроксифенила, цианофенила, амино и гидроксикарбонила;X1 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси-, C1-4 алкил-CO-, C2-4 алкенил,C2-4 алкинил или C1-4 алкил-NR3-, где указанный С 1-4 алкил или С 2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;X2 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси, C1-4 алкил-СО-, C2-4 алкенил,C2-4 алкинил или C1-4 алкил-NR7-, где указанный С 1-4 алкил или С 2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;R1 и R8, каждый независимо, представляют собой водород или галоген;R2 и R9, каждый независимо, представляют собой водород, C1-4 алкил, С 2-4 алкенил, Het4-С 1-4 алкил-,моно- или ди(C1-4 алкил)амино-C1-4 алкилкарбонил- или фенил, необязательно замещенный одним или,если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино илиR3 и R7, каждый независимо, представляют собой водород, С 1-4 алкил, C1-4 алкенилсульфонил-,С 1-4 алкилокси-С 1-4 алкил- или фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или C1-4 алкилокси-;R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4 алкил, необязательно замещенный гидрокси или C1-4 алкилокси;Het14 представляет собой пирролидинил, пиперидинил или пиперазинил, где указанный Het14 необязательно замещен С 1-4 алкилом. Как используется в представленных выше определениях и далее,галоген представляет собой родовое название для фтора, хлора, брома и иода; С 1-4 алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2 метилпропил, 2,2-диметилэтил и т.п.;C1-6 алкил, как это подразумевается, должен включать С 1-5 алкил и его высшие гомологи, содержащие 6 атомов углерода, такие как, например гексил, 1,2-диметилбутил, 2-метилпентил и т.п.; С 2-4 алкенил означает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и содержащие от 2 до 4 атомов углерода, такие как, например, винил, 2-пропенил, 3 бутенил, 2-бутенил и т.п.;C2-6 алкинил означает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну тройную связь и содержащие от 2 до 6 атомов углерода, такие как, например, этинил, 2-пропинил,3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил и т.п.; С 3-6 циклоалкил представляет собой родовое название для циклопропила, циклобутила, циклопентила и циклогексила; С 1-4 алкилокси означает насыщенные углеводородные радикалы с прямой или разветвленной цепью,такие как метокси, этокси, пропилокси, бутилокси, 1-метилэтилокси, 2-метилпропилокси и т.п.;C1-6 алкилокси, как это подразумевается, должен включать С 1-4 алкилокси и высшие гомологи, такие как метокси, этокси, пропилокси, бутилокси, 1-метилэтилокси, 2-метилпропилокси и т.п.; полигидрокси-C1-4 алкил представляет собой родовое название для C1-4 алкила, определенного выше,содержащего два, три или, если это возможно, большее число гидроксизаместителей, такого как, например, тригидроксиметил; полигалоген-C1-4 алкил представляет собой родовое название для C1-4 алкила, определенного выше,содержащего два, три или, если это возможно, большее число галогензаместителей, такого как, например, трифторметил. Гетероциклы, указанные в определениях, представленных выше и далее, как это подразумевается,должны включать все возможные изомерные формы, например пирролил также включает 2 Н-пирролил. Кроме того, гетероциклы, указаннные в определениях, представленных выше и далее, могут присоединяться к остальной части молекулы формулы (I) через любой атом углерода кольца или гетероатом, как это является подходящим. Фармацевтически приемлемые аддитивные соли, указанные выше, как это подразумевается, включают терапевтически активные нетоксичные формы кислотно-аддитивных солей, которые могут образовывать соединения формулы (I). Последние удобным образом можно получить путем обработки основной формы такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например соляную или бромисто-водородную кислоту; серную; азотную; фосфорную и т.п. кислоты; или органические кислоты, такие как, например, уксусную,пропановую, оксиуксусную, трифторуксусную, молочную, пирувиновую, щавелевую, малоновую, янтарную (т.е. бутандиовую кислоту), малеиновую, фумаровую, яблочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, п-толуолсульфоновую, цикламиновую, салициловую, п-аминосалициловую, памовую и т.п. кислоты. Фармацевтически приемлемые аддитивные соли, указанные выше, как это подразумевается, включают терапевтически активные нетоксичные формы основно-аддитивных солей, которые могут образовывать соединения формулы (I). Примеры основно-аддитивных солей, например, представляют собой соли натрия, калия, кальция, а также соли с фармацевтически приемлемыми аминами, такими как, например, аммиак, алкиламины, бензатин, N-метил-D-глюкамин, гидрабамин, аминокислоты, например аргинин, лизин. И наоборот, указанные солевые формы могут быть преобразованы путем обработки подходящим основанием или кислотой в свободную кислотную или основную форму. Термин аддитивная соль, как он используется выше, также включает сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такие сольваты, например, представляют собой гидраты, алкоголяты и т.п. Термин стереохимически изомерные формы, как он использован выше, означает возможные различные изомерные, а также конформационные формы, которые могут иметь соединения формулы (I). Если не оговаривается или не указано иное, химическое название соединений означает смесь всех возможных стереохимически и конформационно изомерных форм, при этом указанные смеси содержат все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Все стереохимически изомерные формы соединений формулы (I) как в чистой форме, так и в смеси друг с другом, входят в объем настоящего изобретения.-3 017545 Некоторые из соединений формулы (I) также могут существовать в их таутомерных формах. Такие формы, хотя они конкретно не указаны в представленной выше формуле, входят в объем настоящего изобретения.N-оксидные формы соединений формулы (I), как это подразумевается, включают те соединения формулы (I), где один или несколько атомов азота являются окисленными до так называемого N-оксида. Первая группа соединений по настоящему изобретению состоит из тех соединений формулы (I), где применимо одно или несколько из следующих ограничений;m представляет собой целое число, имеющее значение от 1 до 4;n представляет собой целое число, имеющее значение от 1 до 4;-Het -CO-C1-6 алкил-, -Het12-C1-6 алкил-, -CO-Het13-C1-6 алкил-, -СО-NR10-C1-6 алкил-, -Het1-C1-6 алкил-СОNR5-, -Het2-CO-NR6-, где -C1-6 алкильный линкер в группе -NH2-C1-6 алкил-СО-NR4- или -Het1-C1-6 алкилСО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;X1 представляет собой простую связь, -C1-4 алкил-, С 1-4 алкилокси- или C1-4 алкил-NR3;X2 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси-, C1-4 алкил-СО-, C2-4 алкенил,С 2-4 алкинил или С 1-4 алкил-NR7-, где указанный C2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;R3 и R7, каждый независимо, представляют собой водород или C1-4 алкил;R9 представляет собой водород или C1-4 алкил;R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4 алкил;Het10, Het11, Het12 и Het13, каждый независимо, представляют собой пирролидинил, пиперидинил или пиперазинил, где указанные Het10, Het11, Het12 и Het13 необязательно замещены гидрокси. Вторая группа соединений по настоящему изобретению состоит из тех соединений формулы (I), где применимо одно или несколько из следующих ограничений;-Het -CO-C1-6 алкил-, -Het12-C1-6 алкил-, -СО-Het13-C1-6 алкил-, -СО-NR10-C1-6 алкил-, -Het1-C1-6 алкил-СОNR5-, -Het2-CO-NR6-, где -C1-6 алкильный линкер в группе -NR2-C1-6 алкил-СО-NR4- или -Het1-C1-6 алкилСО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;X1 представляет собой простую связь, -C1-4 алкил-, C1-4 алкилокси- или C1-4 алкил-NR3;X2 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси-, C1-4 алкил-CO-, C2-4 алкенил,C2-4 алкинил или C1-4 алкил-NR7-, где указанный С 2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;R3 и R7, каждый независимо, представляют собой водород или C1-4 алкил;R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4 алкил;Het1 представляет собой пирролидинил или пиперазинил, а Het2 представляет собой пиперидинил,пиперазинил или пирролидинил, где указанный пирролидинил необязательно замещен гидрокси;Het10, Het11, Het12 и Het13 представляют собой пиперазинил. Третья группа соединений по настоящему изобретению состоит из тех соединений формулы (I), где применимо одно или несколько из следующих ограничений;Y представляет собой -NR2-C1-6 алкил-CO-NR4-, -C1-4 алкил-NR9-С 1-4 алкил-, C1-6 алкил-СО-Het10-,-Het11-СО-С 1-6 алкил-, -Het12-C1-6 алкил-, -СО-Het13-C1-6 алкил-, -СО-NR10-C1-6 алкил-, -Het1-C1-6 алкил-СОNR5-, -Het2-CO-NR6-, где -C1-6 алкильный линкер в группе -NR2-C1-6 алкил-СО-NR4- или -Het1-С 1-6 алкил-4 017545 СО-NR5- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, метокси, аминокарбонила, галогена, цианофенила и фенила;X1 представляет собой простую связь, -C1-4 алкил-, C1-4 алкилокси- или C1-4 алкил-NR3;X2 представляет собой простую связь, C1-4 алкил, C1-4 алкилокси-, C1-4 алкил-CO-, C2-4 алкенил,C2-4 алкинил или C1-4 алкил-NR7-, где указанный C2-4 алкенил необязательно замещен одним или, если это возможно, двумя или более галогеновыми заместителями;R1 представляет собой водород или галоген;R3 и R7, каждый независимо, представляют собой водород или C1-4 алкил;R4, R5, R6 и R10, каждый независимо, представляют собой водород или C1-4 алкил;Het1 представляет собой пирролидинил или пиперазинил, а Het2 представляет собой пиперидинил,пиперазинил или пирролидинил, где указанный пирролидинил необязательно замещен гидрокси;Het10, Het11, Het12 и Het13 представляют собой пиперазинил. Целью настоящего изобретения также является обеспечение соединений формулы (I),где применимо одно или несколько из следующих ограничений;Y представляет собой -C1-4 алкил-NR9-C1-4 алкил-, -NR2-C1-6 алкил-CO-NR4-, -Het1-C1-6 алкил-CO-NR5 или Het2-CO-NR6-, где C1-6 алкильный линкер в -Y- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, галогена или фенила;X1 представляет собой C1-4 алкил или C1-4 алкилокси-, в частности этил или этокси;R5 представляет собой водород или C1-4 алкил;R6 представляет собой водород или C1-4 алкил;R7 представляет собой водород или C1-4 алкил;R9 представляет собой водород или C1-4 алкил;Het1 представляет собой пиперазинил или пиперидинил;Het2 представляет собой пирролидинил, пиперидинил или пиперазинил, где указанный Het2 необязательно замещен гидрокси. В следующем варианте воплощения настоящего изобретения соединения формулы (I) выбраны из группы, включающей 14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.12,6.18,12]гептакоза 1(25),2(27),3,5,8(26),9,11,21,23-нонаен-19-ин-16-он;-5 017545 5-хлор-1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.13,7.19,13.114,18]дотриаконта 3(32),4,6,9(31),10,12,14(30),15,17-нонаен-23-он; 10-хлор-14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.12,6.18,12]гептакоза 1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он; 10-хлор-14-этил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.12,6.18,12]гептакоза 1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он; включая их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически активные формы. Еще в одном варианте воплощения соединения формулы (I) выбраны из солей трифторуксусной кислоты следующих соединений: 18-этил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.12,6.18,12]октакоза 1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он; 14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло[20.3.1.12,6.18,12]октакоза 1(26),2(28),3,5,8(27),9,11,22,24-нонаен-16-он; 1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.13,7.19,13.114,18]дотриаконта 3(32),4,6,9(31),10,12,14(30),15,17-нонаен-23-он; 14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло[19.3.1.12,6.18,12]гептакоза 1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он; 14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.12,6.18,12]гептакоза 1(25),2(27),3,5,8(26),9,11,21,23-нонаен-16-он или 1,8,10,12,17,22,26,32-октаазапентацикло-[24.2.2.13,7.19,13.114,18]тритриаконта 3(33),4,6,9(32),10,12,14(31),15,17-нонаен-23-он. Другая особая группа соединений представляет собой соединения формулы (I), где -X1- представляет собой C1-4 алкил, в частности метил; соединения формулы (I), где -X1- представляет собой -C1-4 алкилокси-, в частности этокси или пропилокси; соединения формулы (I), где -X2- представляет собой -C1-4 алкил-, в частности пропил; соединения формулы (I), где -X2- представляет собой -C1-4 алкилокси-, в частности этокси или пропилокси; соединения формулы (I), где -X2- представляет собой -C1-4 алкил-NR7-, в частности -этил-NR7- и-пропил-NR7-; соединения формулы (I), где Y представляет собой C1-4 алкил-NR9-C1-4 алкил- и R9 представляет собой водород или этил; соединения формулы (I), где -Y- представляет собой -NR2-C1-6 алкил-СО-NR4-, где указанныйC1-6 алкильный линкер необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, галогена и фенила; в частности, те соединения формулы (I), где -Yпредставляет собой-NR2-C1-6 алкил-СО-NR4-; где R2 представляет собой водород, этил, изопропил, 2 пропенил или метил, и где R4 представляет собой водород или метил; более конкретно, те соединения формулы (I), где -Y- представляет собой -NR2-C1-6 алкил-СО-NR4-; R2 представляет собой водород, этил или метил и где R4 представляет собой водород или метил; соединения формулы (I), где -Y- представляет собой -Het1-С 1-6 алкил-CO-NR5-, где Het1 выбран из пиперазинила или пиперидинила; R5 представляет собой водород или метил и где C1-6 алкильный линкер необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси, галогена и фенила; в частности, Y представляет собой пиперазинилэтил-CO-NR5-; соединения формулы (I), где -Y- представляет собой -Het2-CO-NR6-, где Het2 выбран из пирролидинила, пиперазинила или пиперидинила, a R6 - из водорода или метила, в частности, Het2 представляет собой пирролидинил, где указанный пирролидинил необязательно замещен гидрокси; соединения формулы (I), где Het1 представляет собой пиперазинил или пиперидинил; соединения формулы (I), где Het2 представляет собой пирролидинил, пиперидинил или пиперазинил, где указанный Het2 необязательно замещен гидрокси; соединения формулы (I), где R1 представляет собой водород, хлор, фтор или бром; соединения формулы (I), где R8 представляет собой водород, хлор, фтор или бром; соединения формулы (I), где R2 представляет собой водород, -C1-4 алкил или C2-4 алкенил, в частности водород, этил, метил или 2-пропенил, или R2 представляет собой водород или -C1-4 алкил, более конкретно - водород, этил или метил; соединения формулы (I), где -C1-6 алкильный линкер в группе -Y- необязательно замещен одним или, если это возможно, двумя или более заместителями, выбранными из гидрокси и фенила. В следующем варианте воплощения настоящего изобретения заместитель X1 находится в положении 3, заместитель R1 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к содержащему Z кольцу в положении 4' и заместитель X2 находится в положении 2' структуры формулы (I). В следующем варианте воплощения настоящего изобретения для тех соединений формулы (I), где Z представляет собой С, заместитель X1 находится в положении 3, заместитель R1-6 017545 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', заместитель X2 находится в положении 2' и заместитель R8 находится в положении 1'. В следующем варианте воплощения настоящего изобретения заместитель X1 находится в положении 3, заместитель R1 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к содержащему Z кольцу в положении 5' и заместитель X2 находится в положении 3' структуры формулы (I). Еще в одном варианте воплощения настоящего изобретения для тех соединений формулы (I), где Z представляет собой С, заместитель X1 находится в положении 3, заместитель R1 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к содержащему Z кольцу в положении 5', заместитель X2 находится в положении 3' и заместитель R8 находится в положении 1'. Соединения по настоящему изобретению могут быть получены любым из нескольких стандартных способов синтеза, обычно используемых специалистами в области органической химии и включающих химические способы, осуществляемые как в фазе раствора, так и в твердой фазе. Как более подробно показано далее при помощи примеров, соединения по настоящему изобретению, как правило, получают из анилин-4-пиридилтриазинов формул II или III в 3-стадийной реакции, включающей Схема 1 где Z, n, X1, X2 и R1 имеют значение, указанное выше для соединений формулы (I);i) на первой стадии осуществляют преобразование спирта в более удобную удаляемую группу, например, путем мезитилирования при помощи MeSO2Cl (MsCl) с получением соответствующих мезилатов формул IV и V. Эту реакцию мезитилирования типично осуществляют в подходящем реакционноинертном растворителе, таком как, например, CH3CN или ДМФА, в присутствии основания, такого как пиридин или N,N-диизопропилэтиламин (DIPEA), путем перемешивания реакционной смеси в течение 530 мин, в частности 5-15 мин, при комнатной температуре;ii) аминирование такого полученного мезилата при помощи подходящего эфира аминокислоты общей формулы (V) дает промежуточные соединения общих формул VI или VII. Эту реакцию аминирования типично осуществляют в реакционно-инертном растворителе, таком как, например, CH3CN или ДМФА, в присутствии основания, такого как диметиламин или N,N-диизопропилэтиламин (DIPEA), и при перемешивании указанной реакционной смеси в течение ночи при повышенной температуре в пределах 50-70 С, типично 60-65 С. Избыток амина в конце удаляют из реакционной смеси с использованием нанесенных на полимерную подложку акцепторов амина, таких как нанесенный на полимерную подложку изоцианат (PS-NCO) или нанесенный на полимерную подложку метил-N-карбоксиантраниловый ангидрид (PM-MIA). где n, Z, X1, X2 и R1 имеют значение, указанное выше для соединений формулы (I), и где х представляет собой 0, 1, 2 или 3; Р представляет собой защитную группу, такую как, например метилкарбонильная, трет-бутильная, метильная, этильная, бензильная или триалкилсилильная группы; R представляет собой R2, имеющий значение, указанное выше для соединений формулы (I), или вместе с атомом азота, с которым он связан, образует гетероциклы Het1 или Het2, определенные для соединений формулыiii) удаление защиты и циклизация промежуточных соединений формул VII или VIII в конце обеспечивают соединения по настоящему изобретению. Реакцию удаления защиты обычно осуществляют с использованием TFA в условиях, известных из уровня техники, например в TFA/DCM/TIS (49:49:2), необязательно с использованием триметилсилилтрифлата (TMSOTf), например 1 М TMSOTfA, 1,5 М 2,6 лутидина в DCM. Конечную циклизацию или реакцию макролактамизации осуществляют с использованием условий, известных из уровня техники, таких как, например, медленное добавление незамкнутого предшественника к реакционной смеси, включающей агент пептидного связывания О-бензотриазолN,N,N'N'-тетраметилуронийгексафторфосфат (HBTU), и перемешивание указанной реакционной смеси в течение по меньшей мере 1 ч при комнатной температуре. Схема 3 где n, Z, X1, X2 и R1 имеют значение, указанное выше для соединений формулы (I), и где х представляет собой 0, 1, 2 или 3; Р представляет собой защитную группу, такую как, например, метилкарбонильная, трет-бутильная, метильная, этильная, бензильная или триалкилсилильная группы; R представляет собой R2, имеющий значение, указанное выше для соединений формулы (I), или вместе с атомом азота, с которым он связан, образует гетероциклы Het1 или Het2, определенные для соединений формулы(I). Анилин-триазины для использования по настоящему изобретению получают-8 017545 для тех соединений, где Z представляет собой N и триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', и заместитель X2 находится в положении 2' структуры формулы (I), исходя из описанного ранее 2-хлор-4-(2-хлор-4-пиридинил) 1,3,5-триазина [333737-06-7], и для других соединений, где Z представляет собой N и триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', и заместитель X2 находится в положении 2' структуры формулы (I),исходя из метилового эфира 4-(4-хлор-[1,3,5]триазин-2-ил)пиридин-2-карбоновой кислоты, который получают из коммерчески доступного метилового эфира 4-циано-пиридин-2-карбоновой кислоты, как показано в примере А 18 далее,для тех соединений, где Z представляет собой N и триазиновое кольцо присоединено к содержащему Z кольцу в положении 3', и заместитель X2 находится в положении 2' структуры формулы (I), исходя из описанного ранее 2-хлор-4-(2-хлорпиридин-3-ил)-[1,3,5]триазина [333736-95-1], и для тех соединений, где Z представляет собой N и триазиновое кольцо присоединено к содержащему Z кольцу в положении 5', и заместитель X2 находится в положении 3' структуры формулы (I), исходя из 2-(5-бромпиридин-3-ил)-4-хлор-[1,3,5]триазина, который получают из коммерчески доступного 5 бромникотинонитрила, как показано в примере А 26 далее,для тех соединений, где Z представляет собой С, X2 представляет собой C1-4 алкил- и триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', и заместитель X2 находится в положении 2' структуры формулы (I), исходя из 2-хлор-4-(2-бромфенил)-[1,3,5]триазина или 2-(3-бром-4 фторфенил)-4-хлор-[1,3,5]триазина, который получают из коммерчески доступного 3-бромбензонитрила или 3-бром-4-фторбензонитрила, как показано соответственно в примере А 9 или А 22 далее, и для тех соединений, где Z представляет собой С, X2 представляет собой C1-4 алкил-NH-, где NH непосредственно связан с триазиновым кольцом, триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', и X2 находится в положении 2' структуры формулы (I), исходя из 2- хлор-4-(3 нитрофенил)-[1,3,5]триазина, который получают из коммерчески доступного 1-циано-3-нитробензола,как показано соответственно в примере А 12 далее,для тех соединений, где Z представляет собой С, X2 представляет собой C1-4 алкилокси-, где О непосредственно связан с триазиновым кольцом, и триазиновое кольцо присоединено к содержащему Z кольцу в положении 4', и X2 находится в положении 1' структуры формулы (I), исходя из трет-бутилового эфира 2-[4-(4-хлор-[1,3,5]триазин-2-ил)фенокси]этилкарбаминовой кислоты, который получают из коммерчески доступного 4-гидроксибензонитрила, как показано соответственно в примере А 16 далее,путем введения подходящего анилина общей формулы (X) по высокореактивному хлору в триазине,в условиях, известных из уровня техники, например путем перемешивания в CHCl3 в присутствии 2 экв.Boc, как он здесь используется, соответствует группе трет-бутилоксикарбонил-; tBu, как он здесь используется, соответствует группе трет-бутил. Для соединений 3, где W представляет собой галоген, используют реакцию Сонагаши для синтеза промежуточных соединений формул II или III, где Х 2 представляет собой С 3-4 алкил. Реакция Сонагаши включает катализируемое палладием сочетание подходящего алкинила с арилгалогенидами с получением алкиниларенов формулы (4). Эту реакцию осуществляют в условиях, известных из уровня техники,таких как, например, нагревание подходящего алкинила в присутствии Pd(PPh3)2Cl2, PPh3, CuI и Et2NH при 60C, в течение 24 ч в атмосфере азота. Для тех соединений, где X2 еще более ограничен до С 3-4 алкила, полученные таким образом соединения общей формулы (4) восстанавливали в условиях, известных из уровня техники, типично с использованием гидрогенолиза с 10% Pd/C или 5% Pt/C в качестве катализатора, в щелочном растворителе, таком как MeOH/NEt3 или ТГФ/NEt3, до соединений общей формулы (5). Схема 6 Аминовое замещение для тех соединений формулы II, где триазиновое кольцо присоединено к содержащему Z кольцу в положении 4' и X2 представляет собой -C1-4 алкил-NR7 в положении 2', можно, например, получить путем перемешивания 2-хлорпиридила (3 а) в подходящем амине (6 а) в качестве растворителя в условиях кипячения с обратным холодильником, таких как в течение времени от 1 ч до в течение ночи при 100-180 С, более конкретные условия реакции указаны в представленных ниже примерах. Схема 7b) BoC2O, DCM/MeOH, 4 ч, где о имеет значение 0, 1, 2 или 3; где R1 и R10 имеют значения, определенные для промежуточных соединений формулы (X) выше, и где R12 соответствует R4, R5 или R6, определенным для соединений формулы (I) выше. Подобным образом, соединения формулы II, где триазиновое кольцо присоединено к содержащемуZ кольцу в положении 3' и X2 представляет собой -C1-4 алкил-NR7 в положении 2', можно, например, получить путем перемешивания 2-хлорпиридила (3k) в подходящем амине (6b) в качестве растворителя в условиях микроволнового облучения, таких как в течение времени от 1-3 ч до в течение ночи, при 100- 10017545 140 С, более конкретные условия реакции указаны в представленных ниже примерах. Схема 8R1 и R10 имеют значения, определенные для промежуточных соединений формулы (X) выше; де R12 соответствует R4, R5 или R6, определенным выше для соединений формулы (I). Альтернативно, для тех соединений формулы (I), где Z представляет собой С и X2 представляет собой -C1-4 алкил-NR7, анилин-триазиновые производные (10) получают из нитропроизводных (8) после гидрирования в условиях, известных из уровня техники, например при помощи гидрогенолиза с использованием 10% Pd/C или 5% Pt/C в качестве катализатора, в щелочном растворителе, таком какMeOH/NEt3 или ТГФ/NEt3, и восстановительного алкилирования с использованием подходящего альдегида (9) в условиях, известных из уровня техники, например с использованием NaBH4 и изопропоксида титана(IV) в качестве восстановителей, в этаноле или 1,2-дихлорэтане в качестве растворителя. Схема 8R имеют значения, определенные для промежуточных соединений формулы (X) ниже, и где R12 соответствует R4, R5 или R6, определенным выше для соединений формулы (I) выше. Конкретные промежуточные соединения, полученные в соответствии со схемой 8, представлены в примерах А 14 и А 15 ниже. Соединения формулы II, где X2 ограничен до С 2 алкила, получали при помощи реакции Стиле с преобразованием соединения 3 а в соединение 11, с последующей реакцией Михаэля присоединения подходящего амина, например моно-Вос-защищенного диамина, с получением соединения 12, как показано на схеме 9 и описано в А 19 ниже. Схема 9R6, с возможным взаимосвязыванием, когда R12 представляет собой метил и о=1, 2, как определено выше для соединений формулы (I). Соединения формулы II, где X2 ограничен до метилена, получали путем цианирования соединения 3 а в условиях, известных из уровня техники, таких как нагревание до 80 С в присутствии Pd2(dba)3, dppf,Zn и Zn(CN)2, в течение 2 ч, с последующим восстановлением нитрила в условиях, известных из уровня техники, таких как гидрирование в присутствии никеля Ренея в качестве катализатора и последующей защиты при помощи Вос-группы с получением соединения 14, как показано на схеме 10 и описано в A30 ниже. Схема 10(ii) (Boc)2O, CH2Cl21MeOH, Na2CO3 10%, комнатной температуре, 1 ч. Соединения формулы III, где X2 ограничен до метилена, получали путем восстановления соединения 3i до соответствующего спирта 15, как показано на схеме 11 и описано в А 18 ниже. где a) NaBH4, CaCl2, МеОН, от -15 до -10 С. Если это необходимо или желательно, можно осуществить любую одну или несколько из указанных ниже дополнительных стадий, в любом порядке:(i) удаление любой оставшейся защитной группы(групп);(ii) преобразование соединения формулы (I) или его защищенной формы в другое соединение формулы (I) или его защищенную форму;(iii) преобразование соединения формулы (I) или его защищенной формы в N-оксид, соль, четвертичный амин или сольват соединения формулы (I) или его защищенной формы;(iv) преобразование N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в соединение формулы (I) или его защищенную форму;(v) преобразование N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в другой N-оксид, формацевтически приемлемую соль, четвертичный амин или сольват соединения формулы (I) или его защищенной формы;(vi) когда соединение формулы (I) получают в виде смеси (R)- и (S)-энантиомеров, разделение смеси с получением желаемого энантиомера. Соединения формулы (I), N-оксиды, аддитивные соли, четвертичные амины и их стереохимически изомерные формы могут быть преобразованы в другие соединения по настоящему изобретению с использованием процедур, известных из уровня техники. Специалистам в данной области должно быть понятно, что в способах, описанных выше, может быть необходима защита функциональных групп промежуточных соединений при помощи защитных групп. Функциональные группы, которые желательно защитить, включают группы гидрокси, амино и карбоновой кислоты. Подходящие защитные группы для гидрокси включают триалкилсилильные группы(например, трет-бутилдиметилсилил, трет-бутилдифенилсилил или триметилсилил), бензил и тетрагидропиранил. Подходящие защитные группы для амино включают трет-бутилоксикарбонил или бензилоксикарбонил. Подходящие защитные группы для карбоновой кислоты включают C(1-6)алкиловые или бензилововые эфиры. Введение и удаление защиты функциональных групп можно осуществлять до или после стадии реакции. Использование защитных групп подробно описано в "Protective Groups in Organic Synthesis" 3rdedition, T.W. GreeneP.G.M. Wutz, Wiley Interscience (1999). Кроме того, N-атомы в соединениях формулы (I) могут быть метилированы способами, известными из уровня техники, с использованием CH3-I в подходящем растворителе, таком как, например, 2 пропанон, тетрагидрофуран или диметилформамид. Соединения формулы (I) также могут быть преобразованы одно в другое при помощи процедур, известных из уровня техники, для преобразования функциональных групп, некоторые примеры которых приведены ниже. Соединения формулы (I) также могут быть преобразованы в соответствующие N-оксидные формы при помощи методик, известных из уровня техники, для преобразовани трехвалентного азота в его Nоксидную форму. Указанную реакцию N-окисления, как правило, осуществляют путем взаимодействия исходного вещества формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, перекись водорода, перекиси щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты,такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота,например 3-хлорбензолкарбопероксикислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями, например, являются вода, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Некоторые соединения формулы (I) и некоторые промежуточные соединения по настоящему изобретению могут содержать асимметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений можно получить при помощи процедур,известных из уровня техники. Например, диастереоизомеры можно разделить такими физическими способами, как селективная кристаллизация, или хроматографическими методами, например распределительная хроматография, жидкостная хроматография и т.п. методы. Энантиомеры могут быть получены- 12017545 из рацемических смесей сначала путем преобразования указанных рацемических смесей при помощи подходящих агентов разделения, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем путем физического разделения указанных смесей диастереомерных солей или соединений, например, при помощи селективной кристаллизации или хроматографическими методами, например методами жидкостной хроматографии и т.п.; и, наконец, преобразования указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм подходящих промежуточных соединений и исходных веществ при условии, что сопутствующие реакции происходят стереоселективно. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной стационарной фазы. Некоторые из промежуточных соединений и исходных веществ, используемых в процедурах реакций, указанных выше, представляют собой известные соединения и могут быть коммерчески доступными или могут быть получены в соответствии с процедурами, известными из уровня техники. Однако при синтезе соединений формулы (I) настоящего изобретения также используют: а) промежуточные соединения формулы (X) их фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,где n представляет собой целое число, имеющее значение от 1 до 4;R1 представляет собой водород или галоген;R10 представляет собой водород или C1-4 алкил, необязательно замещенный гидрокси илиC1-4 алкилокси. В частности, промежуточные соединения формулы (X), где применимо одно или несколько из следующих ограничений:ii) R1 представляет собой водород или галоген, в частности водород или хлор;b) промежуточные соединения формулы (XI) их фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,где n представляет собой целое число, имеющее значение от 1 до 4;m представляет собой целое число, имеющее значение от 1 до 4; Р 1 и Р 2, каждый независимо, представляют собой гидрокси, галоген, гидроксикарбонил-, галогенкарбонил-, C1-6 алкилоксикарбонил- или C1-6 алкилоксикарбонил-C1-4 алкил-;R1 и R8, каждый независимо, представляют собой водород или галоген;R20 и R21, каждый независимо, представляют собой водород, C1-4 алкил, Het20, Het21-C1-4 алкил-,C2-4 алкенилкарбонил, необязательно замещенный группой Het22-C1-4 алкиламинокарбонил-, С 2-4 алкенилсульфонил, C1-4 алкилокси-С 1-4 алкил- или фенил, необязательно замещенный одним или, если это возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино, или C1-4 алкилокси-;Het20 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het20 необязательно замещен группой -C1-4 алкил-, С 3-6 циклоалкил, гидрокси-C1-4 алкил-, C1-4 алкилокси-С 1-4 алкил- или полигидрокси-C1-4 алкил-;Het21 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het21 необязательно замещен группой C1-4 алкил, С 3-6 циклоалкил, гидрокси-C1-4 алкил- или полигидрокси-C1-4 алкил-;Het22 представляет собой гетероцикл, выбранный из пирролидинила, пиперазинила или пиперидинила, где указанный Het22 необязательно замещен группой C1-4 алкил, С 3-6 циклоалкил, гидрокси-C1-4 алкил-, C1-4 алкилокси-С 1-4 алкил- или полигидрокси-C1-4 алкил-.- 13017545 В другом варианте воплощения настоящее изобретение обеспечивает промежуточные соединения формулы (XI), где применимо одно или несколько из следующих ограничений:R1 представляет собой водород илиR20 и R21, каждый независимо, представляют собой водород или C1-4 алкил. Другие группы специальных промежуточных соединений включают промежуточные соединения формулы (XI), где Z представляет собой N; промежуточные соединения формулы (XI), где X3 представляет собой метил, этил-NR20 или метил 20NR ; промежуточные соединения формулы (XI), где X4 представляет собой метил, этил-NR21 или метил 21NR ; промежуточные соединения формулы (XI), где Р 1 представляет собой гидрокси, C1-6 алкилоксикарбонил или C1-6 алкилоксикарбонил-С 1-4 алкил-, в частности гидрокси, трет-бутилоксикарбонил, третбутилоксикарбонилметил-; промежуточные соединения формулы (XI), где Р 2 представляет собой гидрокси, C1-6 алкилоксикарбонил или C1-4 алкилоксикарбонил-С 1-4 алкил-, в частности гидрокси, трет-бутилоксикарбонил, третбутилоксикарбонилметил-; промежуточные соединения формулы (XI), где R20 представляет собой водород или метил; промежуточные соединения формулы (XI), где R21 представляет собой водород или метил; промежуточные соединения формулы (XI), где R1 представляет собой водород, хлор, фтор или бром; промежуточные соединения формулы (XI), где R8 представляет собой водород. Особый интерес представляют те промежуточные соединения формулы (XI), где заместитель X3 находится в положении 3, заместитель R1 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к Z-содержащему кольцу в положении 4' и алкинил находится в положении 2' промежуточного соединения формулы (XI). Для тех промежуточных соединений формулы (XI), где Z представляет собой С, заместитель R8 находится в положении 1', заместитель X3 находится в положении 3, заместитель R1 представляет собой водород или галоген и находится в положении 5, триазиновое кольцо присоединено к Z-содержащему кольцу в положении 4' и алкинил находится в положении 2' промежуточного соединения формулы (XI). Промежуточные соединения формулы (XI) используют в синтезе макроциклического ингибитора киназы, например, для получения соединений формулы (I). Как описано ниже в экспериментальной части, эффект ингибирования киназы и эффект ингибирования GSK-3 соединений по настоящему изобретению был продемонстрирован in vitro в анализах фосфорилирования с использованием подходящего пептидного субстрата и радиомеченного АТФ, как показано более подробно ниже в примерах C1 и С 3. Помимо ферментных анализов, клеточная активность соединений по настоящему изобретению была продемонстрирована в анализе, основанном на способности GSK-3 инактивировать гликогенсинтазу в клетках печени. В этом анализе, пример C2 ниже, было показано, что соединения по настоящему изобретению повышают включение 14C-D глюкозы в гликоген клеток Chang. Соответственно настоящее изобретение обеспечивает соединения формулы (I) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы для применения в терапии. Более конкретно, для лечения или профилактики заболеваний, опосредованных серин/тирозинкиназой. Соединения формулы (I) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы далее могут быть указаны как соединения по настоящему изобретению. Расстройства, при которых соединения по настоящему изобретению являются особенно полезными,представляют собой указанные выше клеточно-пролиферативные расстройства, диабетические осложнения, болезнь Альцгеймера, аутоиммунные заболевания и воспалительные заболевания, включая аллергии и астму, рассеянный склероз (MS), ревматоидный артрит (RA), артериосклероз, артрит или воспалительное заболевание кишечника (IBD). Как правило, подходящая доза представляет собой такую, которая обеспечивает концентрацию ингибитора киназы на участке лечения в пределах от 0,5 до 200 мкМ и более типично от 5 нМ до 10 мкМ. Для получения таких концентраций пациенту, нуждающемуся в таком лечении, вероятно, следует вводить дозу в пределах от 0,01 до 500 мг/кг массы тела, в частности от 10 до 250 мг/кг массы тела. Как ука- 14017545 зано выше, эти количества могут варьировать в зависимости от конкретной ситуации. Соединения по настоящему изобретению предпочтительно формулируют перед приемом. Как описано ниже, подходящие фармацевтические композиции получают при помощи известных методик с использованием широко известных и легкодоступных ингредиентов. Еще в одном аспекте настоящее изобретение обеспечивает использование соединений по настоящему изобретению для получения лекарственного средства для лечения любых из перечисленных выше клеточно-пролиферативных расстройств или показаний. Количество соединения по настоящему изобретению, также указанного как активный ингредиент,которое необходимо для достижения терапевтического эффекта, конечно, варьирует в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента и конкретного расстройства или заболевания, подлежащего лечению. Подходящая суточная доза должна составлять от 0,01 до 500 мг/кг массы тела, в частности от 10 до 250 мг/кг массы тела. Способ лечения также может включать введение активного ингредиента по схеме в пределах от одного до четырех приемов в день. Хотя возможно введение только активного ингредиента, но предпочтительно, когда он представлен в фармацевтической композиции. Соответственно настоящее изобретение также обеспечивает фармацевтическую композицию, включающую соединение по настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть "приемлемым" в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не оказывать вредное действие на реципиента. Фармацевтические композиции по настоящему изобретению могут быть получены любыми способами, хорошо известными в области фармацевтики, например, с использованием способов, описанных вGennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, в частности см. часть 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения, в форме основания или в форме аддитивной соли, в качестве активного ингредиента объединяют с получением смеси с фармацевтически приемлемым носителем, который может принимать самые различные формы в зависимости от формы препарата, желательного для введения. Такие фармацевтические композиции желательно должны быть в стандартной лекарственной форме, подходящей предпочтительно для системного введения, такого как пероральное, чрескожное или парентеральное введение; или местного введения, такого как введение при помощи ингаляции, назального спрея, глазных капель или с использованием клемма, геля, шампуня или т.п. Например, при получении композиций в форме для перорального введения можно использовать любую обычную фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, разрыхлители и т.п.,в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения, таблетки и капсулы являются наиболее предпочтительными пероральными лекарственными формами, в этом случае очевидно использование фармацевтических носителей. Для парентеральных композиций носитель обычно включает старильную воду, по меньшей мере, составляющую его большую часть, хотя могут быть включены и другие ингредиенты, например вещества, способствующие растворению. Могут быть получены, например, растворы для инъекций, где носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены суспензии для инъекций, в этом случае можно использовать подходящие жидкие носители, суспендирующие вещества и т.п. В композициях, подходящих для чрескожного введения, носитель, необязательно, включает средство для усиления проникновения внутрь лекарственного средства и/или подходящее смачивающее вещество, необязательно в сочетании с подходящими добавками любой природы в небольших пропорциях, при этом такие добавки не должны оказывать какое-либо существенное вредное действие на кожу. Указанные добавки могут облегчать введение в кожу и/или могут способствовать получению желаемых композиций. Такие композиции можно вводить различными способами, например в виде чрескожного пластыря, путем локального нанесения или в виде мази. Особенно предпочтительно получение указанных выше фармацевтических композиций в стандартной лекарственной форме для простоты введения и равномерного дозирования. Стандартная лекарственная форма, как этот термин используется в настоящем описании и формуле изобретения, относится к физически дискретным единицам, подходящим для разового применения, при этом каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, препараты для дозирования чайными ложками, столовыми ложками и т.п. и их более мелкие дробные дозы. Экспериментальная часть Далее термин Р означает продукт, MP-NCO - макропористую изоцианатную смолу, DIPEA - Nэтил-N-(1-метилэтил)-2-пропанамин, ДМФА - N,N-диметилформамид, CH2Cl2 - означает дихлорметан,- 15017545- мононатриевую соль угольной кислоты, Na2CO3 - динатриевую соль угольной кислоты, NaCl - хлорид натрия. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 1 Раствор 2-хлор-4-(2-хлор-4-пиридинил)-1,3,5-триазина (0,02 моль) и 3-аминобензолметанола (0,02 моль) в трихлорметане (100 мл) перемешивали при комнатной температуре. Добавляли DIPEA (0,04 моль) и полученную реакционную смесь перемешивали в течение 5 ч при 60 С (происходило образование осадка желтого цвета). Добавляли DIPEA (100 мл) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Осадок отфильтровывали, промывали DIPEA, затем гексаном, затем сушилиb. Получение промежуточного соединения 2 К смеси промежуточного соединения 1 (0,001 моль), 1,1-диметилэтилового эфира 2 пропинилкарбаминовой кислоты (0,0011 моль), N-этилэтанамина (1,5 мл), дихлор-бис(трифенилфосфин)палладия (0,00005 моль), иодида меди(I) (0,00005 моль) и трифенилфосфина (0,0002 моль) в пробирке добавляли ДМФА (10 мл). Через смесь барботировали газообразный N2 в течение 5 мин. Пробирку герметично закрывали и смесь перемешивали при 60 С в течение 24 ч в атмосфере азота. После охлаждения добавляли воду и CH2Cl2. Органический слой отделяли, сушили и концентрировали. Остаток очищали хроматографией на колонке с короткой пробкой из силикагеля (элюент: CH2Cl2/MeOH 100/095/5). Содержащие продукт фракции собирали и растворитель выпаривали. Остаток кристаллизовали из CH3CN/MeOH. Осадок отфильтровывали и сушили с получением 0,3554 г (82%; т.пл.: 154,4156,2 С) промежуточного соединения 2. с. Получение промежуточного соединения 3 К перемешиваемой суспензии промежуточного соединения 2 (0,00075 моль) в безводном CH3CN(10 мл) добавляли метансульфонилхлорид (0,0009 моль) и DIPEA (0,0045 моль). Добавляли дополнительное количество метансульфонилхлорида (0,0002 моль) для осуществления полного мезилирования. Через 5 мин добавляли 1,1-диметилэтиловый эфир N-метилглицина гидрохлорид (0,0015 моль) и смесь перемешивали при 65 С в течение 3,5 ч. Добавляли 1-этенил-4-(изоцианатометил)бензол, полимер с этенилбензолом (0,0015 моль) и CH2Cl2 (10 мл) и реакционную смесь встряхивали в течение 5 ч при комнатной температуре. Смесь фильтровали и полученный при фильтровании остаток промывали CH2Cl2,затем МеОН и затем снова CH2Cl2. Растворитель фильтрата выпаривали с получением промежуточного соединения 3 (используемого на следующей стадии реакции без дополнительной очистки).d. Получение промежуточных соединений 4 а и 4b Смесь промежуточного соединения 3 (0,00075 моль) в TFA/CH2Cl2/TIS (49/49/2) (15 мл) перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали с получением промежуточного соединения 4 в виде соли TFA (.C2HF3O2) (количественный выход; ЖХМС 4 а: 70%, 4b: 30%; использовали на следующей стадии реакции без дополнительной очистки). Пример А 2.- 16017545 а. Получение промежуточного соединения 5 Смесь промежуточного соединения 2 (0,0092 моль) и Et3N (2 мл) в МеОН (150 мл) гидрировали в течение ночи с использованием Pd/C (10%) (1 г) в качестве катализатора в присутствии раствора тиофена(0,5 мл). После поглощения Н 2 (2 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток снова растворяли в CH2Cl2 и фильтровали через слой силикагеля (элюент: CH2Cl2/MeOH 100/0, затем 94/6). Фракции, содержащие желаемый продукт, собирали и растворитель выпаривали с получением 3,7406 г (93%, твердое вещество желтого цвета; т.пл.: 161,5-162,3 С) промежуточного соединения 5.b. Получение промежуточного соединения 6 К перемешиваемому раствору промежуточного соединения 5 (0,00025 моль) в безводном CH3CN (5 мл) добавляли DIPEA (6 экв.). Затем добавляли метансульфонилхлорид (1,2 экв.). Через 5-15 мин добавляли 1,1-диметилэтиловый эфир N-метилаланина, соль соляной кислоты (1:1) (3 экв.) и полученный раствор перемешивали в течение ночи при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли CH2Cl2 (5 мл) с последующим добавлением MP-NCO (4 экв.). После встряхивания в течение ночи смолу отфильтровывали и промывали CH2Cl2 (5 мл), МеОН (5 мл) и снова CH2Cl2 (5 мл). Затем смесь концентрировали с получением неочищенного промежуточного соединения 6 (используемого на следующей стадии реакции без дополнительной очистки). Промежуточное соединение 6 а получали аналогичным образом из промежуточного соединения 80 с использованием 1,1-диметилэтилового эфира 1-пиперазинкарбоновой кислоты, дигидрохлорида. Промежуточное соединение 6b получали аналогичным образом из промежуточного соединения 112 с использованием 1,1-диметилэтилового эфира N-метилглицина, гидрохлорида. Промежуточное соединение 6 с получали аналогичным образом из промежуточного соединения 114 с использованием 1,1-диметилэтилового эфира N-метилаланина, соли соляной кислоты. с. Получение промежуточного соединения 7 Промежуточное соединение 6 растворяли в TFA/CH2Cl2/TIS (49/49/2) (5 мл) и встряхивали в течение 5 ч при комнатной температуре. Затем растворитель выпаривали с получением промежуточного соединения 7 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Промежуточное соединение 7 а получали аналогичным образом из промежуточного соединения 6 а. Промежуточное соединение 7b получали аналогичным образом из промежуточного соединения 6b. Промежуточное соединение 7 с получали аналогичным образом из промежуточного соединения 6c. Пример A3. а. Получение промежуточного соединения 8 Промежуточное соединение 1 (0,0075 моль) растворяли в 1,2-этандиамине (100 мл). Раствор перемешивали при температуре кипения с обратным холодильником (117-118 С) в течение ночи. Растворитель выпаривали. К остатку добавляли ксилол, затем снова совместно упаривали дважды с получением промежуточного соединения 8, которое использовали как таковое для следующей стадии реакции.b. Получение промежуточных соединений 9 и 10 Неочищенное промежуточное соединение 8 (0,0075 моль) растворяли в CH2Cl2 (100 мл). Добавляли бис-(1,1-диметилэтиловый)эфир диугольной кислоты (0,01125 моль) и реакционную смесь перемешивали при комнатной температуре. Добавляли МеОН (100 мл) для достижения полного растворения. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли дополнительное количество бис-(1,1-диметилэтилового)эфира диугольной кислоты (0,01125 моль) и реакционную смесь перемешивали в течение выходных при комнатной температуре. Добавляли 7 н. раствор NH3/MeOH (100 мл). Растворитель выпаривали. Остаток очищали над слоем силикагеля на стеклянном фильтре (элюент:CH2Cl2/EtOAc 100/00/100). Желаемые фракции собирали и растворитель выпаривали. Остаток очищали далее при помощи обращено-фазовой высокоэффективной жидкостной хроматографии (буфер-ацетат аммония) с получением 0,62 г промежуточного соединения 9 (19%, т.пл. 315 С (разл. и 0,49 г промежуточного соединения 10 (14%, т.пл.: 184,6-184,8 С). с. Получение промежуточного соединения 11 К перемешиваемому раствору промежуточного соединения 9 (0,000125 моль) в ДМФА (5 мл) добавляли DIPEA (6 экв.). Затем добавляли метансульфонилхлорид (1,2 экв.). Через 5-15 мин добавляли 1,1-диметилэтиловый эфир N-метилглицина гидрохлорид (3 экв.) и полученный раствор перемешивали в течение ночи при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли MP-NCO (6 экв.). После встряхивания в течение ночи смолу отфильтровывали и промывали ДМФА (45 мл). Затем смесь концентрировали с получением неочищенного промежуточного соединения 11 (используемого на следующей стадии реакции без дополнительной очистки).d. Получение промежуточного соединения 12(5 мл) и встряхивали в течение 1 ч при 40 С. Затем растворитель выпаривали с получением неочищенного промежуточного соединения 12 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Пример А 4. а. Получение промежуточного соединения 13 Промежуточное соединение 1 (0,00768 моль) растворяли в 1,2-пропандиамине (100 мл). Раствор перемешивали в течение 2 ч при 160 С, затем охлаждали до комнатной температуры. Растворитель выпаривали. К остатку добавляли ксилол, затем совместно упаривали снова с получением промежуточного соединения 13, которое использовали как таковое для следующей стадии реакции.b. Получение промежуточного соединения 14 бис-(1,1-Диметилэтиловый) эфир диугольной кислоты (0,023 моль) добавляли к промежуточному- 18017545 соединению 13 (0,00768 моль), растворенному в CH2Cl2/MeOH (100 мл/100 мл). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Добавляли дополнительное количество бис-(1,1 диметилэтилового) эфира диугольной кислоты (0,023 моль) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Осадок удаляли фильтрованием. Фильтрат очищали над слоем силикагеля на стеклянном фильтре (элюент: CH2Cl2/EtOAc 100/00/100). Желаемые фракции собирали и растворитель выпаривали. Остаток подвергали дальнейшей очистке при помощи обращено-фазовой высокоэффективной жидкостной хроматографии (буфер ацетат аммония). Продукт осаждался из водного компонента элюента. Осадок отфильтровывали, промывали дистиллированной водой и сушили с получением 0,58 г промежуточного соединения 14 (17%; т.пл. 183,5-184,5 С). с. Получение промежуточного соединения 15 К перемешиваемому раствору промежуточного соединения 14 (0,000125 моль) в ДМФА (5 мл) добавляли DIPEA (6 экв.). Затем добавляли метансульфонилхлорид (1,2 экв.). Через 5-15 мин, добавляли 1,1-диметилэтилововый эфир N-метилглицина гидрохлорид (3 экв.) и полученный раствор перемешивали в течение ночи при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли MP-NCO (6 экв.). После встряхивания в течение ночи смолу отфильтровывали и промывали при помощи ДМФА (45 мл). Затем смесь концентрировали с получением неочищенного промежуточного соединения 15 (используемого на следующей стадии реакции без дополнительной очистки).d. Получение промежуточного соединения 16(5 мл) и встряхивали в течение 1 ч при 40 С. Затем растворитель выпаривали с получением неочищенного промежуточного соединения 16 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Пример А 5. а. Получение промежуточного соединения 17[2-(3-аминофенил)этил]карбаминовой кислоты (0,01 моль) в трихлорметане (30 мл) перемешивали при комнатной температуре. Добавляли DIPEA (0,02 моль) и полученную реакционную смесь перемешивали в течение ночи при 60 С. Добавляли DIPEA (90 мл) и реакционную смесь перемешивали в течение 2,5 ч при комнатной температуре. Осадок отфильтровывали, промывали гексаном, затем сушили (вакуум,65 С) с получением 4,46 г (100%; т.пл.: 144,1-147,0 С) промежуточного соединения 17.b. Получение промежуточного соединения 18 Смесь промежуточного соединения 17 (0,0095 моль), N-этилэтанамина (15 мл), дихлор-бис(трифенилфосфин)палладия (0,00048 моль), иодида меди(I) (0,00048 моль) и трифенилфосфина (0,00190 моль) в ДМФА (100 мл) перемешивали при комнатной температуре. Через смесь в течение 10 мин барботировали газообразный N2. Добавляли 2-пропин-1-ол (0,01425 моль) и реакционную смесь перемешивали- 19017545 при 60 С (в атмосфере азота) в течение 20 ч в атмосфере азота. После охлаждения добавляли воду (10 мл). Растворитель выпаривали и остаток снова растворяли в CH2Cl2. Раствор очищали на силикагеле(элюент: сначала CH2Cl2, затем EtOAc). Фракции, содержащие желаемый продукт, собирали и растворитель выпаривали. Остаток растворяли в CH3CN и выдерживали при 0 С в течение ночи, в результате происходило образование осадка в виде кристаллов коричневого цвета. Осадок отфильтровывали и сушили с получением 2,64 г (62%; т.пл.: 155,5-158,0 С) промежуточного соединения 18. с. Получение промежуточного соединения 19(0,0015 моль). Добавляли метансульфонилхлорид (0,000375 моль) при перемешивании. Добавляли 1,1 диметилэтиловый эфир N-метилглицина гидрохлорид (0,00075 моль) и реакционную смесь перемешивали в течение 4,5 ч при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли MP-NCO (6 экв.). После встряхивания в течение ночи смолу отфильтровывали и промывали при помощи ДМФА (45 мл). После выпаривания растворителя получали неочищенное промежуточное соединение 19 (ЖХМС: 93% Р) (используемое на следующей стадии реакции без дополнительной очистки).d. Получение промежуточного соединения 20 Смесь промежуточного соединения 19 (0,00025 моль) в ДМФА (q.s.) гидрировали в течение 4 ч при комнатной температуре (атмосферное давление) с использованием никеля Ренея (q.s.) в качестве катализатора. После поглощения Н 2 (2 экв.) катализатор отфильтровывали и фильтрат упаривали с получением неочищенного промежуточного соединения 20 (используемого на следующей стадии реакции без дополнительной очистки). е. Получение промежуточного соединения 21 Раствор промежуточного соединения 20 (0,00025 моль) в TFA/CH2Cl2/TIS (49/49/2) (10 мл) перемешивали в течение 45 мин при 45 С. Растворитель выпаривали и остаток снова растворяли в ДМФА с получением неочищенного промежуточного соединения 21 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Пример А 6. а. Получение промежуточного соединения 22 Раствор 2-хлор-4-(2-хлор-4-пиридинил)-1,3,5-триазина (0,01 моль), 1,1-диметилэтилового эфира [(3 аминофенил)метил]карбаминовой кислоты (0,01 моль) и DIPEA (0,02 моль) в трихлорметане (40 мл) перемешивали при 60 С. Добавляли дополнительное количество DIPEA (120 мл) и полученную реакционную смесь перемешивали в течение 75 мин при комнатной температуре. Осадок отфильтровывали, промывали DIPEA, затем гексаном, затем сушили (вакуум, 65 С) с получением 4,05 г (98%; желтые кристаллы; т.пл.: 144,0-145,6 С) промежуточного соединения 22.b. Получение промежуточного соединения 23- 20017545 Смесь промежуточного соединения 22 (0,0095 моль), 2-пропин-1-ола (0,01425 моль), Nэтилэтанамина (1,468 мл), дихлор-бис-(трифенилфосфин)палладия (0,00048 моль), иодида меди(I)(0,0004 8 моль) и трифенилфосфина (0,00190 моль) в ДМФА (100 мл) перемешивали при комнатной температуре. Через смесь в течение 15 мин барботировали газообразный N2. Реакционную смесь перемешивали при 60 С (в атмосфере азота) в течение 24 ч. Добавляли дополнительное количество 2-пропин-1-ола(0,01425 моль) и дихлор-бис-(трифенилфосфин)палладия (0,000048 моль). Добавляли дополнительное количество N-этилэтанамина (15 мл) и реакционную смесь перемешивали в течение ночи при 60 С. После охлаждения добавляли воду (15 мл) и растворитель выпаривали. Остаток очищали на силикагеле(элюент: CH2Cl2/MeOH градиент от 100/0 до 95/5), затем подвергали дальнейшей очистке над слоем силикагеля (элюент: CH2Cl2/(7 н. NH3/MeOH) 98/2). Фракции, содержащие желаемый продукт, собирали и растворитель выпаривали. Остаток кристаллизовали из МеОН, отфильтровывали и сушили с получением 2,22 г (54%; т.пл.: 129,1-130,5 С) промежуточного соединения 23. с. Получение промежуточного соединения 24 Промежуточное соединение 23 (0,00025 моль) растворяли в ДМФА (10 мл). Добавляли метансульфонилхлорид (0,000375 моль). Смесь перемешивали в течение 15 мин при комнатной температуре. Добавляли 1,1-диметилэтиловый эфир N-метилглицина гидрохлорид (0,000750 моль) при перемешивании. Добавляли DIPEA (0,0015 моль) и реакционную смесь перемешивали в течение 22 ч при 65 С. Получали желаемый продукт. Добавляли 1-этенил-4-(изоцианатометил)бензол, полимер с этенилбензолом (0,001 моль), и смесь встряхивали в течение 24 ч при комнатной температуре. Смолу отфильтровывали, промывали при помощи ДМФА (20 мл) и фильтрат, содержащий неочищенное промежуточное соединение 24,использовали как таковой на следующей стадии реакции. Промежуточное соединение 24 а получали аналогичным образом из промежуточного соединения 82 с использованием 1,1-диметилэтиловового эфира N-метилглицина гидрохлорида.d. Получение промежуточного соединения 25 Смесь промежуточного соединения 24 (0,00025 моль) в ДМФА (40 мл) гидрировали в течение ночи с использованием Pd/C (10%) (0,1 г) в качестве катализатора. После поглощения Н 2 (2 экв.) катализатор отфильтровывали и фильтрат упаривали с получением неочищенного промежуточного соединения 25(используемого на следующей стадии реакции без дополнительной очистки). Промежуточное соединение 25 а получали аналогичным образом из промежуточного соединения 24 а. е. Получение промежуточного соединения 26 Раствор промежуточного соединения 25 (0,00025 моль) в TFA/CH2Cl2/TIS (49/49/2) (10 мл) перемешивали в течение 60 мин при комнатной температуре, затем в течение 1 ч при 50 С. Растворитель выпаривали с получением промежуточного соединения 26 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Промежуточное соединение 26 а получали аналогичным образом из промежуточного соединения 25 а. Пример А 7. а. Получение промежуточного соединения 27(0,01374 моль), затем метансульфонилхлорид (0,00275 моль). Смесь перемешивали в течение 5 мин при комнатной температуре. Добавляли 1,1-диметилэтиловый эфир N-метилглицина гидрохлорид (0,00458 моль) и реакционную смесь перемешивали в течение ночи при 65 С. Смесь охлаждали до комнатной температуры. Добавляли MP-NCO (0,00458 моль) и смесь встряхивали в течение выходных при комнатной температуре. Смолу отфильтровывали, промывали при помощи ДМФА (45 мл) и растворитель фильтрата выпаривали с получением промежуточного соединения 27.b. Получение промежуточного соединения 28 Раствор промежуточного соединения 27 (0,00229 моль) в TFA/CH2Cl2/TIS (49/49/2) (20 мл) встряхивали в течение 60 мин при 40 С. Добавляли дополнительное количество TFA/CH2Cl2/TIS (49/49/2) (10 мл) и реакционную смесь встряхивали еще в течение 1 ч при 40 С. Растворитель выпаривали с получением неочищенного промежуточного соединения 28 в виде соли TFA (используемого как таковое на следующей стадии реакции). Пример А 9. а. Получение промежуточного соединения 31 Метоксид натрия (0,30 г, 0,0055 моль) добавляли к раствору 1-бром-3-цианобензола (10,00 г, 0,055 моль) в метаноле (55 мл) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. Затем добавляли цианамид (3,46 г, 0,082 моль) и смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли дихлорметан (200 мл) и полученный раствор промывали насыщенным солевым раствором (3200 мл). Сушка над MgSO4, фильтрация и выпаривание растворителя давали 10,62 г промежуточного соединения 31 (твердое вещество белого цвета, выход: 86%).b. Получение промежуточного соединения 32 К раствору промежуточного соединения 31 (2,63 г, 0,012 моль) в CH3CN (25 мл) медленно добавляли 2,25 г (0,018 моль) N-(хлорметилен)-N-метилметанаминийхлорида. После 5 мин перемешивания при комнатной температуре смесь становилась гомогенной, а через 30 мин появлялся осадок. Реакционную смесь перемешивали еще в течение 1 ч и затем гасили добавлением насыщенного водного раствора бикарбоната натрия. Водную фазу экстрагировали дихлорметаном (350 мл) и объединенные органические слои сушили над MgSO4. Фильтрация и выпаривание растворителя давали 2,98 г промежуточного соединения 32 (твердое вещество желтого цвета, выход: 94%), которое использовали как таковое для следующей стадии реакции. Пример А 10. а. Получение промежуточного соединения 33 3-Аминобензиловый спирт (0,27 г, 0,0022 моль) добавляли к раствору промежуточного соединения 32 (0,49 г, 0,0018 моль) в 1,4-диоксане (9 мл). Затем добавляли DIPEA (0,24 г, 0,0018 моль) и смесь перемешивали при комнатной температуре в течение 3 ч. Затем добавляли 20 мл CH2Cl2 и 20 мл воды и водную фазу экстрагировали при помощи CH2Cl2 (220 мл). Объединенные органические слои сушили надMgSO4. Фильтрация и выпаривание растворителя давали 0,53 г промежуточного соединения 33 (твердое вещество белого цвета, выход: 82%), которое использовали как таковое для следующей стадии реакции.b. Получение промежуточного соединения 34 Промежуточное соединение 33 (2,32 г, 0,0065 моль), 1,1-диметилэтиловый эфир 2 пропинилкарбаминовой кислоты [92136-39-5] (2,52 г, 0,016 моль), дихлор-бис-(трифенилфосфин)палладий 0,456 г, 0,0006 моль), иодид меди(I) (0,124 г, 0,0006 моль) и трифенилфосфин (0,681 г,- 22017545 0,0026 моль) растворяли в ДМФА (80 мл). Через смесь в течение 10 мин барботировали газообразный N2,после чего добавляли N-этилэтанамин (10,2 мл, 0,097 моль). Реакционную смесь затем перемешивали при 60 С в течение 18 ч в атмосфере азота. После охлаждения до комнатной температуры добавлялиCH2Cl2 (50 мл) и органический слой промывали 320 мл насыщенного солевого раствора и затем сушили над MgSO4. Растворитель выпаривали и остаток очищали колоночной флэш-хроматографией с использованием CH2Cl2/MeOH (9:1) в качестве элюента. Выпаривание объединенных содержащих продукт фракций давало 2,24 г промежуточного соединения 34 (желтое твердое вещество, 80%). Пример A11. а. Получение промежуточного соединения 35 Смесь промежуточного соединения 34 (5,44 г, 0,013 моль) и Et3N (2,5 мл, 0,018 моль) в МеОН (190 мл) гидрировали (1 атм Н 2) в течение 15 ч с использованием 10% Pd/C (0,544 г) в качестве катализатора. После поглощения Н 2 (2 экв.) реакционную смесь фильтровали через целит и фильтрат концентрировали. Промежуточное соединение 35 получали фильтрованием после растирания в порошок с диизопропиловым эфиром (бледно-желтое твердое вещество, 5,00 г, выход: 91%).b. Получение промежуточного соединения 36 К раствору промежуточного соединения 35 (1,85 г, 0,00425 моль) и DIPEA (4,33 мл, 0,0255 моль) в ДМФА (80 мл) добавляли 0,493 мл (0,00638 моль) мезилхлорида. Полученную смесь перемешивали в течение 30 мин. Затем 5 мл (0,00025 моль) этого раствора добавляли к эфиру аминокислоты, в данном случае к 1,1-диметилэтиловому эфиру глицина гидрохлориду (0,00125 моль), и полученную смесь перемешивали в течение ночи при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли 4 формилфеноксиполистирольную смолу (1,00 г, 0,0021 моль). После встряхивания в течение выходных смолу отфильтровывали и промывали при помощи МеОН и MeOH/CH2Cl2 поочередно (порции по 5 мл). Выпаривание растворителя давало промежуточное соединение 36, которое использовали как таковое для следующей стадии реакции. Промежуточное соединение 36 а получали аналогичным образом из промежуточного соединения 85 с использованием трет-бутилового эфира 2-амино-3-трет-бутоксипропионовой кислоты гидрохлорида. с. Получение промежуточного соединения 37(5 мл) и встряхивали в течение ночи при комнатной температуре. Затем растворитель выпаривали с получением промежуточного соединения 37 (соль TFA), которое использовали как таковое для следующей стадии реакции. Промежуточное соединение 37 а получали аналогичным образом из промежуточного соединения 36 а. Пример А 12. а. Получение промежуточного соединения 38 Метоксид натрия (0,35 г, 0,0064 моль) добавляли к раствору 1-циано-3-нитробензола (9,48 г, 0,064 моль) в метаноле (64 мл) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. Затем добавляли цианамид (4,00 г, 0,096 моль) и смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли диэтиловый эфир (200 мл). Образовавшийся в результате осадок отфильтровывали, промывали простым эфиром и сушили с получением 11,53 г промежуточного соединения 38b. Получение промежуточного соединения 39 К раствору промежуточного соединения 38 (11,53 г, 0,061 моль) в CH3CN (120 мл) медленно добавляли 11,60 г (0,091 моль) N-(хлорметилен)-N-метилметанаминийхлорида. После 5 мин перемешивания при комнатной температуре смесь становилась гомогенной и через 30 мин появлялся осадок. Реакционную смесь перемешивали в течение еще 1 ч и затем гасили добавлением насыщенного водного раствора бикарбоната натрия. Водную фазу экстрагировали дихлорметаном (350 мл) и объединенные органические слои сушили над MgSO4. Фильтрация и выпаривание растворителя давали 12,60 г промежуточного соединения 39 (твердое вещество бледно-желтого цвета, выход: 88%). Пример А 13. а. Получение промежуточного соединения 40 3-Аминобензиловый спирт (1,19 г, 0,0096 моль) добавляли к раствору промежуточного соединения 39 (1,90 г, 0,0080 моль) в 1,4-диоксане (40 мл). Затем добавляли DIPEA (1,05 г, 0,0081 моль) и смесь перемешивали при комнатной температуре в течение 5 ч. Затем смесь выливали в ледяную воду и образовавшийся в результате осадок промывали водой (50 мл) и затем охлажденным диэтиловым эфиром (50 мл). Сушка в вакууме давала 2,36 г промежуточного соединения 40 (твердое вещество бледно-желтого цвета, выход: 89%).b. Получение промежуточного соединения 41 К суспензии промежуточного соединения 40 (4,52 г, 0,014 моль) в МеОН (85 мл) добавляли Et3N(1,9 мл, 0,014 моль). Полученную смесь гидрировали (1 атм Н 2) в течение 48 ч с использованием 10%Pd/C (0,45 г) в качестве катализатора. После поглощения Н 2 (3 экв.) добавляли 100 мл 1,4 диоксана/МеОН (4:1) и полученный раствор фильтровали через слой целита. Выпаривание растворителя давало промежуточное соединение 41 в виде твердого вещества бледно-желтого цвета (3,07 г, выход: 75%). Пример А 14. а. Получение промежуточного соединения 42 Смесь промежуточного соединения 41 (5,00 г, 0,017 моль), трет-бутилового эфира (2 оксоэтил)карбаминовой кислоты (3,26 г, 0,020 моль) и изопропоксида титана(IV) (7,26 г, 0,026 моль) в 1,2-дихлорэтане (250 мл) перемешивали при комнатной температуре в течение 3,5 ч. Затем добавляли уксусную кислоту (3,07 г, 0,051 моль) с последующим добавлением 7,95 г (0,0375 моль) триацетоксиборогидрида натрия и полученную смесь перемешивали в течение 15 ч при комнатной температуре. Затем реакционную смесь гасили насыщенным водным растовром карбоната калия. Органический слой отделяли и водную фазу экстрагировали при помощи CHCl3 (350 мл). Объединенные органические слои промывали насыщенным солевым раствором (250 мл) и сушили над MgSO4. После удаления растворителя осуществляли очистку с использованием колоночной флэш-хроматографии (элюент:CH2Cl2/MeOH/Et3N, градиент 99:0:198:1:1). Упаривание объединенных содержащих продукт фракций давало неочищенное промежуточное соединение 42, которое растирали в порошок с диизопропиловым эфиром. Фильтрация и сушка полученного твердого вещества давали 3,00 г промежуточного соединения 42 (твердое вещество бледно-желтого цвета, выход: 40%).b. Получение промежуточного соединения 43- 24017545 К раствору промежуточного соединения 42 (0,982 г, 0,00225 моль) и DIPEA (2,30 мл, 0,0135 моль) в ДМФА (42 мл) добавляли 0,209 мл (0,00270 моль) мезилхлорида. Полученную смесь перемешивали в течение 30 мин. Затем 5 мл (0,00025 моль) этого раствора добавляли к эфиру аминокислоты, в данном случае 1,1-диметилэтиловому эфиру N-метилглицина гидрохлориду (0,00075 моль), и полученную смесь перемешивали в течение ночи при 65 С. Затем смесь охлаждали до комнатной температуры и добавляли МР-NCO (6 экв.). После встряхивания в течение ночи смолу отфильтровывали и промывали при помощи ДМФА (25 мл). Выпаривание растворителя давало промежуточное соединение 43, которое использовали как таковое для следующей стадии реакции. Промежуточное соединение 43 а получали аналогичным образом из промежуточного соединения 45 с использованием трет-бутилового эфира 2-амино-3-фенилпропионовой кислоты гидрохлорида. с. Получение промежуточного соединения 44(5 мл) и встряхивали в течение ночи при комнатной температуре. Затем растворитель выпаривали с получением промежуточного соединения 44 в виде соли TFA, которое использовали как таковое для следующей стадии реакции. Промежуточное соединение 44 а получали аналогичным образом из промежуточного соединения 43 а. Пример А 15. а. Получение промежуточного соединения 45 Смесь промежуточного соединения 41 (1,60 г, 0,0055 моль), трет-бутилового эфира (3 оксопропил)карбаминовой кислоты (2,38 г, 0,014 моль) и изопропоксида титана(IV) (3,21 г, 0,011 моль) в 1,2-дихлорэтане (82 мл) перемешивали при комнатной температуре в течение 3,5 ч. Затем добавляли уксусную кислоту (1,15 г, 0,019 моль) с последующим добавлением 3,14 г (0,015 моль) триацетоксиборогидрида натрия и полученную смесь перемешивали в течение 15 ч при комнатной температуре. Затем реакционную смесь гасили при помощи насыщенного водного раствора карбоната калия. Полученную в результате эмульсию с осажденными частицами фильтровали. Органический слой фильтрата отделяли и фильтровальную лепешку экстрагировали при помощи CH2Cl2/CHCl3 (350 мл). Объединенные органические слои промывали насыщенным солевым раствором (250 мл) и сушили над MgSO4. После удаления растворителя осуществляли очистку с использованием колоночной флэш-хроматографии (элюент:CH2Cl2/MeOH/NEt3, градиент 99:0:198,8:0,2:1). Упаривание объединенных содержащих продукт фракций давало неочищенное промежуточное соединение 45, которое растирали в порошок с диизопропиловым эфиром. Фильтрация и сушка полученного твердого вещества давали 0,67 г промежуточного соединения 45 (твердое вещество желтого цвета, выход: 27%). Пример А 16. а. Получение промежуточного соединения 46Cs2CO3 (0,250 моль) добавляли к раствору 4-гидроксибензонитрила (0,125 моль) в ДМФА (380 мл) при перемешивании при комнатной температуре. Смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли (2-бромэтил)-1,1-диметилэтиловый эфир карбаминовой кислоты (0,187 моль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Осадок отфильтровывали, промывали при помощи EtOAc, а затем добавляли смесь EtOAc и насыщенного солевого раствора. Слои разделяли. Органическую фазу промывали насыщенным солевым раствором, затем сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: гексан/EtOAc 10/1 до 6/1). Содержащие продукт фракции собирали и растворитель выпаривали с получением 23,44 г (выход 73%; твердое вещество белого цвета) промежуточного соединения 46.b. Получение промежуточного соединения 47NaOCH3 (0,0553 моль) добавляли к раствору промежуточного соединения 46 (0,0276 моль) в МеОН(83 мл). Смесь перемешивали в течение 2 ч при комнатной температуре. Добавляли одной порцией цианамид (0,0553 моль). Реакционную смесь перемешивали в течение 48 ч при комнатной температуре. В течение 7 дней каждый день добавляли дополнительное количество NaOCH3 (1 экв.), а также добавляли дополнительное количество цианамида (6 экв.). Образовавшийся в результате осадок отфильтровывали,затем промывали метанолом и диэтиловым эфиром. Растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: гексан/EtOAc 30/10 через 20/10 до 10/10). Содержащие продукт фракции собирали и растворитель выпаривали. Остаток сушили в вакууме при комнатной температуре с получением 2,8 г (выход 33%; твердое вещество белого цвета) промежуточного соединения 47. с. Получение промежуточного соединения 48 Промежуточное соединение 47 (0,0092 моль) растворяли в CH3CN (20 мл). Добавляли N(хлорметилен)-N-метилметанаминийхлорид (0,0138 моль) и реакционную смесь перемешивали в течение 1,5 ч при комнатной температуре. Реакционную смесь гасили добавлением воды. Добавляли CH2Cl2. Слои разделяли и водную фазу экстрагировали CH2Cl2. Органические слои объединяли, промывали насыщенным солевым раствором, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток сушили в вакууме при комнатной температуре с получением 1,5 г (желтое твердое вещество, использовали на следующей стадии реакции, без дополнительной очистки) промежуточного соединения 48.d. Получение промежуточного соединения 49 Промежуточное соединение 48 (0,004 3 моль) растворяли в 1,4-диоксане (20 мл). Добавляли 3 аминобензолметанол (0,0051 моль). Добавляли DIPEA (0,0086 моль) и реакционную смесь перемешивали в течение 15 ч при комнатной температуре. Добавляли CH2Cl2 (20 мл) и насыщенный солевой раствор (20 мл). Органическую фазу отделяли, затем промывали насыщенным солевым раствором, сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: гексан/EtOAc от 3/1 до 1/1). Содержащие продукт фракции собирали и растворитель выпаривали. Остаток сушили в вакууме при комнатной температуре с получением 1,5 г (38%) промежуточного соединения 49. е. Получение промежуточного соединения 50DIPEA (2,7 мл) добавляли к перемешиваемому раствору промежуточного соединения 49 (0,00265 моль) в ДМФА (50 мл). Добавляли метансульфонилхлорид (0,349 мл) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Добавляли дополнительное количество метансульфонилхлорида (0,103 мл) и реакционную смесь перемешивали в течение 1 ч при комнатной температуре с получением неочищенного реакционного раствора, содержащего промежуточное соединение 50, который использовали на следующей стадии реакции без дополнительной очистки.f. Получение промежуточного соединения 51 1,1-Диметилэтиловый эфир 4-пиперидинкарбоновой кислоты (0,0005 моль) добавляли к части (5 мл) неочищенного реакционного раствора промежуточного соединения 50 в ДМФА (50 мл) и DIPEA (2,7 мл). Реакционную смесь перемешивали в течение ночи при 70 С. Добавляли макропористый бензилизоцианатный акцептор (0,00075 моль) и смесь перемешивали в течение ночи при комнатной температуре. Смолу отфильтровывали, промывали метанолом, затем MeOH/CH2Cl2 1/10 и растворитель фильтрата выпаривали с получением промежуточного соединения 51, которое использовали как таковое на следующей стадии.g. Получение промежуточного соединения 52 Неочищенное промежуточное соединение 51 (макс. 0,000250 моль) поглощали в TFA/CH2Cl2/TIS 49/49/2 (5 мл). Смесь встряхивали в течение 5 ч при комнатной температуре. Растворитель выпаривали с получением неочищенного промежуточного соединения 52 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Пример А 17. а. Получение промежуточного соединения 53 Смесь 2-хлор-4-(2-хлор-4-пиридинил)-1,3,5-триазина (0,05 моль), (3-аминофенокси)-1,1-диметилэтилового эфира уксусной кислоты (0,05 моль), DIPEA (0,2 моль) в CHCl3 (500 мл) перемешивали 4 ч при 60 С. Реакционную смесь промывали 2 раза Н 2 О (250 мл; дистиллированная вода). Отделенный органический слой сушили (Na2SO4) и растворитель фильтрата выпаривали. Остаток перекристаллизовывали изb. Получение промежуточного соединения 54 Промежуточное соединение 53 (0,005 моль), 2-пропинил-1,1-диметилэтиловый эфир карбаминовой кислоты (0,006 моль), диэтиламин (0,075 моль), дихлор-бис-(трифенилфосфин)палладий (0,00025 моль),иодид меди(I) (0,00025 моль) и трифенилфосфин (0,001 моль) растворяли в ДМФА (50 мл) и в реакционную смесь в течение 5 мин барботировали N2. Реакционную смесь перемешивали в течение 16 ч при 60 С(в атмосфере азота). К реакционной смеси добавляли H2O (10 мл) и растворитель выпаривали. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/MeOH от 100/0 до 90/10). Содержащие продукт фракции собирали и растворитель выпаривали. Остаток перекристаллизовывали изDIPE с получением 1,8034 г (68%; т.пл.: 161,2-162,5 С) промежуточного соединения 54. с. Получение промежуточного соединения 55 Смесь промежуточного соединения 54 (0,0028 моль) в ТГФ (50 мл) гидрировали с использованием никеля Ренея (каталитическое количество) в качестве катализатора. Через 20 ч и после поглощения Н 2 (2 экв.; 140 мл), катализатор отфильтровывали. Растворитель фильтрата выпаривали. Остаток перекристаллизовывали из DIPE с получением 1,3161 г (88%; т.пл.: 146,5-148,4 С) промежуточного соединения 55.d. Получение промежуточного соединения 56 Промежуточное соединение 55 (0,002 моль) растворяли в смеси TFA/CH2Cl2/TIS (49/49/2, 20 мл) и перемешивали в течение 2,5 ч при комнатной температуре. Растворитель выпаривали и совместно упаривали 3 раза с CH3CN с получением (ЖХМС: 94%; неочищенное соединение использовали как таковое на следующей стадии реакции) промежуточного соединения 56 в виде соли TFA (.C2HF3O2). Пример А 18. а. Получение промежуточного соединения и промежуточного соединения 57 Раствор этилового эфира 4-циано-2-пиридинкарбоновой кислоты (0,090 моль) в МеОН (100 мл) перемешивали. NaOCH3 (0,00905 моль) перемешивали в течение 1 ч при комнатной температуре и смесь становилась гомогенной. Добавляли H2N-CN (0,135 моль) и реакционную смесь перемешивали в течение 5 ч при комнатной температуре. Добавляли дополнительное количество NaOCH3 (0,5 экв.) и H2N-CN(0,75 экв.) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь фильтровали. К фильтрату добавляли еще NaOCH3 (0,05 экв.), полученную смесь перемешивали в течение 3 ч и образовавшийся в результате осадок снова отфильтровывали. Фильтрат очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 30/1). Содержащие продукт фракции собирали и растворитель выпаривали с получением 9 г промежуточного соединения 57 (49%).b. Получение промежуточного соединения 58 Промежуточное соединение 57 (0,044 моль) суспендировали в CH2Cl2 (150 мл). Добавляли N(хлорметилен)-N-метилметанаминийхлорид (0,066 моль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь промывали насыщенным водным растворомNaHCO3, затем экстрагировали CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали с получением 10,42 г (95%) промежуточного соединения 58. с. Получение промежуточного соединения 59 Промежуточное соединение 58 (0,021 моль) растворяли в смеси 1,4-диоксана (90 мл) и CH2Cl2 (10 мл). Добавляли [2-(3-аминофенокси)этил]-1,1-диметилэтиловый эфир карбаминовой кислоты (0,024 моль). Добавляли DIPEA (0,042 моль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали. Остаток растворяли в CH2Cl2. Органический раствор промывали насыщенным водным раствором NaHCO3. Водную фазу экстрагировали CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/EtOAc от 1/1 до 0/1). Содержащие продукт фракции собирали и растворитель выпаривали с получением 8,50 г (87%) промежуточного соединения 59.d. Получение промежуточного соединения 60CaCl2 (0,012 моль) добавляли к MeOH (180 мл). Смесь перемешивали и охлаждали при -10 С в атмосфере азота. Добавляли NaBH4 (0,018 моль) и перемешивание продолжали в течение 20 мин. Раствор промежуточного соединения 59 (0,018 моль) в МеОН (90 мл) охлаждали до -10 С, затем добавляли кCaCl2/NaBH4MeOH при -10 С. Полученную реакционную смесь перемешивали, давая температуре повыситься до комнатной температуры. Добавляли 2-пропанон. Растворитель выпаривали. Остаток промывали в 1 М NaOH, затем экстрагировали дважды CH2Cl2. Отделенный органический слой сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: EtOAc/гексан 1/2, затем CH2Cl2/MeOH 30/120/1). Содержащие продукт фракции собирали и растворитель выпаривали с получением 5,205 г (66%) промежуточного соединения 60.e. Получение промежуточного соединения 61- 28017545 ДМФА (90 мл) добавляли к промежуточному соединению 60 (0,00450 моль) в DIPEA (4,59 мл). Добавляли метансульфонилхлорид (0,52 мл) и реакционную смесь перемешивали в течение 1 ч с получением неочищенного реакционного раствора, содержащего промежуточное соединение 61, которое использовали на следующей стадии реакции без дополнительной очистки.f. Получение промежуточного соединения 62 Неочищенное промежуточное соединение 61 в 5 мл ДМФА (0,00025 моль) и DIPEA (4,59 мл) добавляли к 1,1-диметилэтилововому эфиру N-метилглицина гидрохлориду (0,0005 моль). Реакционную смесь перемешивали в течение ночи при 65 С. Добавляли избыточное количество макропористого бензилизоцианатного акцептора и смесь перемешивали в течение ночи при комнатной температуре. Смолу отфильтровывали, промывали метанолом, затем метанолом/CH2Cl2 1/4 и растворитель фильтрата выпаривали с получением промежуточного соединения 62, которое использовали как таковое на следующей стадии.g. Получение промежуточного соединения 63 Неочищенное промежуточное соединение 62 (макс. 0,000250 моль) поглощали в TFA/CH2Cl2/TIS 49/49/2 (5 мл). Смесь встряхивали в течение ночи при комнатной температуре. Растворитель выпаривали с получением неочищенного промежуточного соединения 63 (соль TFA, использовали на следующей стадии реакции без дополнительной очистки). Пример А 19. а. Получение промежуточного соединения 64 К смеси промежуточного соединения 1 (0,016 моль) в сверхсухом ДМФА (240 мл) сначала добавляли Pd(PPh3)4 (0,0008 моль) и трифенилфосфин (0,0016 моль), а затем трибутилэтенилстаннан (0,024 моль). Реакционную смесь перемешивали в течение 48 ч при 80 С. Растворитель выпаривали, затем добавляли CH2Cl2 и воду. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт поглощали в CH3CN и образовавшийся в результате осадок отфильтровывали и сушили (вакуум) с получением 3,45 г (71%) промежуточного соединения 64.b. Получение промежуточного соединения 65 Смесь промежуточного соединения 64 (0,00984 моль) и 1,1-диметилэтилового эфира 1 пиперазинкарбоновой кислоты (0,074 моль) нагревали в течение 18 ч при 100 С (расплав). Затем продукт очищали колоночной хроматографией на силикагеле (элюент: градиент 010% MeOH/CH2Cl2). Содержащие продукт фракции собирали и растворитель выпаривали. Остаток растворяли в CH2Cl2 и промывали несколько раза H2O (всего 3 л). Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт затем очищали колоночной хроматографией на силикагеле (элюент: градиент CH2Cl210% MeOH/CH2Cl2). Содержащие продукт фракции собирали и растворитель выпаривали. Продукт растворяли в CH2Cl2 и добавляли MP-NCO (0,010 моль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Остаток отфильтровывали и растворитель выпаривали с получением 1 г (20%) промежуточного соединения 65. с. Получение промежуточного соединения 66
МПК / Метки
МПК: C07D 471/22, C07D 251/16, C07D 471/18, C07D 487/08, C07D 487/18, C07D 401/04, A61K 31/53
Метки: gsk-3, циклические, качестве, анилино-пиридинотриазины, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-17545-ciklicheskie-anilino-piridinotriaziny-v-kachestve-ingibitorov-gsk-3.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические анилино-пиридинотриазины в качестве ингибиторов gsk-3</a>
Предыдущий патент: Центрифуга
Следующий патент: Система привода рабочего транспортного средства
Случайный патент: 3-(4-гетероарилциклогексиламино) циклопентанкарбоксамиды в качестве модуляторов хемокиновых рецепторов