Ингибитор bcrp/abcg2
Номер патента: 14555
Опубликовано: 30.12.2010
Авторы: Хасимото Сусуке, Хатано Хироси, Мацузаки Такеси, Нисияма Йукико, Сугимото Йосиказу, Аийама Рицуо, Нагаока Масато, Ямазаки Риута, Йосида Ох, Фурута Томио
Формула / Реферат
1. Применение производного акрилонитрила, представленное формулой (1)
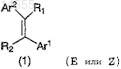
или его соли,
где один из R1 и R2означает цианогруппу и другой означает атом водорода;
Ar1 означает группу, выбранную из групп, представленных формулами (2)-(4):
![]()
где R7и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода, атом галогена, линейную или разветвленную C1-6алкоксигруппу или C3-6циклоалкилоксигруппу;
А означает атом кислорода, атом серы или NR9; и
R9 означает атом водорода или линейную или разветвленную С1-6алкильную группу;
Ar2 означает C10-14арильную группу, содержащую конденсированное кольцо, которое может быть замещено атомом галогена или группой, выбранной из групп, представленных формулами (5)-(15):
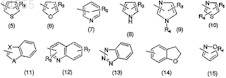
где R3означает атом водорода, атом кислорода (в виде N-оксида), линейную или разветвленную С1-6 алкильную группу, линейную или разветвленную C1-6алкоксигруппу, С3-6циклоалкилоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, линейную или разветвленную C1-6гидроксиалкильную группу, C6-14арильную группу, которая может содержать в качестве заместителя нитро или аминогруппу, или NR5(R6);
R5 и R6, которые могут быть одинаковыми или различными, каждый означает атом водорода, линейную или разветвленную C1-6алкильную группу, которая может содержать в качестве заместителя C1-6 алкиламиногруппу или ди(C1-6алкил)аминогруппу, линейную или разветвленную C1-6гидроксиалкильную группу, С6-14арильную группу, которая может содержать в качестве заместителя нитрогруппу или аминогруппу, или алициклическое или ароматическое гетероциклическое соединение, содержащее по меньшей мере один гетероатом в кольце; R5и R6 могут образовывать, вместе с соседним атомом азота, гетероциклическое кольцо, выбранное из группы, состоящей из пирролидина, имидазола, пиридина, пиперидина, пиримидина, пиперазина, морфолина, индола, бензимидазола, бензпиразола и хинолина, которое может содержать в качестве заместителя гидроксигруппу, линейную или разветвленную C1-6 алкильную группу или линейную или разветвленную C1-6гидроксиалкильную группу; и гидроксильная группа линейной или разветвленной C1-6гидроксиалкильной группы или гетероциклического кольца, замещенного гидроксильной группой или линейной или разветвленной C1-6гидроксиалкильной группой, могут образовывать сложноэфирную связь с группой фосфорной кислоты или ее солью, или с ацильной группой, которая может содержать в качестве заместителя ди(C1-6алкил)аминогруппу, фенилкарбамоильную группу, которая может содержать C1-6алкиламиногруппу или ди(C1-6алкил)аминогруппу в качестве заместителя; N-C1-6алкилкарбамоильную группу, которая может иметь C1-6алкиламиногруппу или ди(C1-6 алкил)аминогруппу в качестве заместителя, N,N-диС1-6алкилкарбамоильную группу, которая может иметь C1-6алкиламиногруппу или ди(С1-6алкил)аминогруппу в качестве заместителя, N-пиперидинокарбонильную группу, которая может содержать пирролидин, пиперидин или пиперазин в качестве заместителя, или 4-пиперидинопиперидин-1-ильную группу;
R4 означает атом водорода, линейную или разветвленную C1-6алкильную группу; фенильную группу, которая может содержать в качестве заместителя атом галогена, линейную или разветвленную C1-6 алкоксигруппу или C3-6циклоалкоксигруппу; или бензильную группу;
X означает атом углерода, СН или атом азота, при условии, что когда А означает атом кислорода, X не может быть атомом азота; и
A, R7, R8и R9 имеют значения, определенные выше;
в качестве ингибитора BCRP.
2. Применение агента для устранения резистентности к противораковому агенту, опосредованной BCRP, или агента для потенцирования противоракового эффекта агента при раке, который характеризуется наличием приобретенной лекарственной резистентности, опосредованной BCRP, который включает в качестве активного ингредиента производное акрилонитрила по п.1 или его соль.
3. Противораковая композиция, где рак характеризуется наличием приобретенной лекарственной резистентности, опосредованной BCRP, содержащая производное акрилонитрила по п.1 или его соль, и противораковый агент, который служит в качестве субстрата BCRP.
4. Применение производного акрилонитрила по п.1 или его соли для получения ингибитора BCRP в качестве агента для устранения резистентности к противораковому агенту, опосредованной BCRP, или агента для потенцирования противоракового эффекта агента, где рак характеризуется наличием приобретенной лекарственной резистентности, опосредованной участием BCRP.
5. Способ лечения рака, который характеризуется наличием приобретенной резистентности к лекарственному средству, опосредованной BCRP, включающий введение производного акрилонитрила по п.1 или его соли.
6. Применение производного акрилонитрила, представленного формулой (1а)
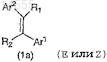
или его соли,
где один из R1 и R2означает цианогруппу и другой означает атом водорода;
Ar1 означает группу, выбранную из групп, представленных формулами (2)-(4):
![]()
где R7и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода, атом галогена, линейную или разветвленную C1-6алкоксигруппу или C3-6циклоалкилоксигруппу;
А означает атом кислорода, атом серы или NR9; и
R9 означает атом водорода или линейную или разветвленную C1-6алкильную группу;
Ar2 означает C10-14арильную группу, содержащую конденсированное кольцо, которое может быть замещено атомом галогена или группой, выбранной из групп, представленных формулами (5)-(15):
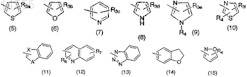
где R3a означает атом водорода (Ar1означает группу, представленную формулой (3) или (4)), линейную или разветвленную C1-6алкильную группу, линейную или разветвленную C1-6алкоксигруппу, C3-6 циклоалкилоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, линейную или разветвленную C1-6гидроксиалкильную группу, C6-14арильную группу, которая может быть замещена нитрогруппой или аминогруппой, или NR5(R6);
R3b означает атом водорода, линейную или разветвленную C1-6алкильную группу, линейную или разветвленную С1-6алкоксигруппу, C3-6циклоалкилоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, линейную или разветвленную C1-6гидроксиалкильную группу, C6-14арильную группу, которая может быть замещена аминогруппой, или NR5(R6);
R3c означает атом водорода (Ar1 означает группу, представленную формулой (3) или (4)), атом кислорода (в виде N-оксида), линейную или разветвленную C1-6алкильную группу, линейную или разветвленную C1-6 алкоксигруппу, C3-6циклоалкилоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, линейную или разветвленную C1-6гидроксиалкильную группу, C6-14арильную группу, которая может быть замещена нитрогруппой или аминогруппой, или NR5(R6);
каждый из R3d, R3e и R3f означает атом водорода, атом кислорода (в виде N-оксида), линейную или разветвленную C1-6алкильную группу, линейную или разветвленную C1-6алкоксигруппу, C3-6 циклоалкилоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, линейную или разветвленную С1-6гидроксиалкильную группу или C6-14арильную группу, которая может быть замещена аминогруппой, или NR5(R6);
R5 и R6, которые могут быть одинаковыми или различными, каждый означает атом водорода, линейную или разветвленную C1-6алкильную группу, которая может содержать в качестве заместителя C1-6 алкиламиногруппу или ди(C1-6алкил)аминогруппу, линейную или разветвленную C1-6гидроксиалкильную группу, C6-14арильную группу, которая может содержать нитрогруппу или аминогруппу в качестве заместителя, или алициклическое или ароматическое соединение, имеющее по меньшей мере один гетероатом в кольце; R5и R6 могут образовывать вместе со смежным атомом азота гетероциклическое кольцо, выбранное из группы, состоящей из пирролидина, имидазола, пиридина, пиперидина, пиримидина, пиперазина, морфолина, индола, бензимидазола, бензпиразола и хинолина, которое может содержать в качестве заместителя гидроксильную группу, линейную или разветвленную C1-6алкильную группу или линейную или разветвленную C1-6гидроксиалкильную группу; и гидроксильная группа линейной или разветвленной C1-6гидроксиалкильной группы или гетероциклическое кольцо, замещенное гидроксильной группой или линейной или разветвленной C1-6гидроксиалкильной группой, могут образовывать сложноэфирную связь с группой фосфорной кислоты или ее солью, или с ацильной группой, которая может содержать в качестве заместителя ди(C1-6алкил)аминогруппу, фенилкарбамоильную группу, которая может содержать C1-6алкиламиногруппу или ди(C1-6алкил)аминогруппу в качестве заместителя; N-C1-6 алкилкарбамоильную группу, которая может иметь C1-6алкиламиногруппу или ди(C1-6алкил)аминогруппу в качестве заместителя, N,N-ди-C1-6алкилкарбамоильную группу, которая может иметь C3-6алкиламиногруппу или ди(C1-6алкил) аминогруппу в качестве заместителя, N-пиперидинокарбонильную группу, которая может содержать пирролидин, пиперидин или пиперазин в качестве заместителя, или 4-пиперидинопиперидин-1-ильную группу;
R4 означает атом водорода, линейную или разветвленную С1-6алкильную группу, фенильную группу, которая может содержать в качестве заместителя атом галогена или линейную или разветвленную C1-6 алкоксигруппу или C3-6циклоалкилоксигруппу; или бензильную группу;
X означает атом углерода, СН или атом азота, при условии, что когда А означает атом кислорода, то X не может быть атомом азота; и
A, R7, R8и R9 имеют значения, определенные выше, в качестве ингибитора BCRP.
7. Применение производного акрилонитрила или его соли, выбраных из
(Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-пиридин-3-илакрилонитрила,
(Z)-3-(3,4-диметоксифенил)-2-пиридин-3-илакрилонитрила,
(Z)-3-(3,4-диметоксифенил)-2-пиридин-2-илакрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-пиридин-2-илакрилонитрила,
(Е)-3-(3,4-диметоксифенил)-2-тиофен-2-илакрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-хинолин-4-илакрилонитрила,
(Е)-2-бензотриазол-1-ил-3-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-хинолин-2-илакрилонитрила,
(Z)-2-пиридин-3-ил-3-хинолин-4-илакрилонитрила,
(Е)-3-бензо[b]тиофен-3-ил-2-тиофен-2-илакрилонитрила,
(Z)-3-бензофуран-2-ил-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-нафталин-2-илакрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-фенантрен-9-илакрилонитрила,
в качестве ингибитора BCRP.
8. Применение агента для устранения резистентности к противораковому средству, опосредованной BCRP, или агента для потенцирования противоракового эффекта в отношении рака, имеющего приобретенную лекарственную резистентность, опосредованную BCRP, который включает в качестве активного ингредиента производное акрилонитрила по п.6 или 7 или его соль.
9. Противораковая композиция, предназначенная для лечения рака, который характеризуется наличием приобретенной лекарственной резистентности, опосредованной BCRP, содержащая производное акрилонитрила по п.6 или 7 или его соль и противораковый агент, который служит субстратом для BCRP.
10. Применение производного акрилонитрила по п.6 или 7 или его соли для получения ингибитора BCRP в качестве агента для устранения резистентности к противораковому агенту, опосредованной BCRP, или агента для потенцирования противоракового эффекта агента в отношении рака, имеющего приобретенную лекарственную резистентность, опосредованную BCRP.
11. Способ лечения рака, который характеризуется наличием приобретенной лекарственной резистентности, опосредованной BCRP, включающий введение производного акрилонитрила по п.6 или 7 или его соли.
12. Производное акрилонитрила или его соль, выбранные из
(Z)-2-(3,4-диметоксифенил)-3-(5-нитротиофен-2-ил)акрилонитрила,
(Z)-3-(5-бромтиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-3-(5-аминотиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илтиофен-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илтиофен-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)тиофен-2-ил]акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-{5-[(2-гидроксиэтил)метиламино]тиофен-2-ил}акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)тиофен-2-ил]акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]тиофен-2-ил}акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-{5-[(2-диметиламиноэтил)метиламино]тиофен-2-ил}акрилонитрила,
моно-(1-{5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил}пиперидин-4-ил)фосфата,
моно-(1-{5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил}пиперидин-4-ил)сукцината,
(Z)-2-(3,4-диметоксифенил)-3-(5-нитрофуран-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(5-гидроксиметилфуран-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(3-нитрофенил)фуран-2-ил]акрилонитрила,
(Z)-3-[5-(3-аминофенил)фуран-2-ил]-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илфуран-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илфуран-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)фуран-2-ил]акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)фуран-2-ил]акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]фуран-2-ил}акрилонитрила,
N-оксида (Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(6-метоксипиридин-3-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(1Н-пиррол-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(3H-имидазол-4-ил)акрилонитрила,
(Z)-3-(3-бензил-2-метилсульфанил-3H-имидазол-4-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(4-метил-2-фенилтиазол-5-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-{5-[(2-диметиламиноэтил)метиламино]фуран-2-ил}акрилонитрила,
моно-(1-{5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фуран-2-ил}пиперидин-4-ил)сукцината,
моно-(1-{5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фуран-2-ил}пиперидин-4-ил)фосфата,
(Z)-3-(5-бромфуран-2-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-3-(3,4-диметоксифенил)-2-тиофен-3-илакрилонитрила,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил N-(2-диэтиламиноэтил) сукцинамата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил N-(3-диэтиламинопропил) сукцинамата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-илдиметиламиноацетата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил [1,4']бипиперидинил-1'-карбоксилата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил 4-[1,4']бипиперидинил-1'-ил-4-оксобутилата,
(Z)-3-бензо[b]тиофен-3-ил-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(1-метил-1Н-бензимидазол-2-ил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-(1-метил-1Н-индол-3-ил)акрилонитрила,
(Z)-3-(2-хлорхинолин-3-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-бензофуран-3-ил-3-(3,4-диметоксифенил)акрилонитрила,
(Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Е)-2-бензотиазол-2-ил-3-(3,4-диметоксифенил)акрилонитрила,
(Z)-3-(2,3-дигидробензофуран-5-ил)-2-(3,4-диметоксифенил)акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-фторфенил)изоксазол-3-ил]акрилонитрила,
(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метоксифенил)изоксазол-3-ил]акрилонитрила,
(Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-пиридин-2-илакрилонитрила,
(Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-пиридин-3-илакрилонитрила,
(Е)-3-(2-хлор-6-метоксихинолин-3-ил)-2-тиофен-2-илакрилонитрила,
(Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-тиофен-3-илакрилонитрила,
(Е)-2-бензотриазол-1-ил-3-(2-хлор-6-метоксихинолин-3-ил)акрилонитрила,
(Е)-2-бензотиазол-2-ил-3-(2-хлор-6-метоксихинолин-3-ил)акрилонитрила,
(Z)-2-пиридин-2-ил-3-хинолин-4-илакрилонитрила,
(Е)-3-хинолин-4-ил-2-тиофен-2-илакрилонитрила,
(Z)-3-хинолин-4-ил-2-тиофен-3-илакрилонитрила,
(Е)-3-бензо[b]тиофен-3-ил-2-бензотиазол-2-илакрилонитрила,
(Z)-3-бензофуран-2-ил-2-бензофуран-3-илакрилонитрила,
(Е)-2-бензотиазол-2-ил-3-(1-метил-1Н-индол-3-ил)акрилонитрила,
(Z)-3-(10-хлорантрацен-9-ил)-2-(3,4-диметоксифенил)акрилонитрила,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил диэтиламиноацетата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил диэтилкарбамата,
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил-N-(2-диэтиламиноэтил)-N-метилсукцинамата и
1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил N-(4-диэтиламинофенил)сукцинамата.
13. Лекарственное средство, включающее в качестве активного ингредиента соединение по п.12 или его соль.
14. Фармацевтическая композиция, содержащая соединение по п.12 или его соль и фармацевтически приемлемый носитель.
15. Применение соединения по п.12 или его соли для получения лекарственного средства.
Текст
(71)(73) Заявитель и патентовладелец: КАБУСИКИ КАЙСЯ ЯКУЛТ ХОНСА (JP)(57) Описан ингибитор белка, определяющего резистентность при раке молочной железы (BCRP/ABCG2). Ингибитор BCRP включает в качестве активного ингредиента производное акрилонитрила, представленное общей формулой (1), или его соль: (1) (Е или Z), где один из R1 и R2 означает цианогруппу, и другой означает атом водорода; Ar1 означает группу, выбранную из групп, представленных формулами (2)-(4),приведенными ниже; и Ar2 означает ароматическую углеводородную группу, которая содержит конденсированное кольцо, необязательно замещенное атомом галогена или группой, выбранной из групп,представленных формулами (5)-(15), приведенными ниже. 014555 Изобретение относится к ингибитору белка, определяющего резистентность при раке молочной железы (BCRP/ABCG2). Серьезные проблемы, ассоциированные с противораковой химиотерапией, включают присущую ей резистентность к противораковому агенту, которая в значительной мере снижает эффект противоракового агента с момента начала противораковой терапии и приводит к развитию приобретенной резистентности к противораковому агенту (то есть к снижению эффекта лекарственного препарата, которое вызывается его длительным непрерывным введением). В ходе изучения исследовались возможности преодоления такой резистентности к противораковым агентам, с целью повышения эффекта проводимой противораковой химиотерапии, и были предприняты попытки понять различные механизмы резистентности. В частности, экспрессия транспортера лекарственного препарата, который активно переносит противораковый агент за пределы раковых клеток, снижая, таким образом, уровень внутриклеточной аккумуляции лекарственного препарата, играет, как считается, важную роль в развитии такого рода механизма резистентности. В частности, П-гликопротеин, который представляет собой транспортер лекарственного средства,открытый в 1970-х годах, и который кодируется геном MDR1, рассматривается как мощная молекуламишень для агента, на основе которого можно преодолеть резистентность к множественным лекарственным препаратам, поскольку данный белок вызывает перекрестную резистентность к множеству противораковых агентов, имеющих различные химические структуры и механизмы действия. Однако постепенно выяснилось, что механизм резистентности к противораковому агенту не может быть объяснен на основе анализа одного только П-гликопротеина, таким образом, возникла потребность в разработке агента, способного преодолеть резистентность, мишенью которого будет другой транспортер лекарственного средства. При такой постановке вопроса в 1998 году был открыт белок, определяющий резистентность при раке молочной железы (BCRP, также называемый ABCG2, MXR или АВСР), который представляет собой транспортер лекарственного средства, принадлежащий к группе, называемой "суперсемейство транспортера кассеты связывания с АТФ (ABC)", к которой также принадлежит П-гликопротеин (см. не патентный документ 1). BCRP имеет структуру, включающую всего одну кассету связывания с АФТ, что отличает ее от структуры в случае П-гликопротеина или другого ABC транспортера, содержащих две кассеты связывания с АТФ. BCRP вовлекается в механизм резистентности к ингибитору топоизомеразы I(например, к гидрохлориду иринотекана (СРТ-11) или топотекана), к ингибитору топоизомеразы II (например, к митоксантрону) или к терапевтическому средству, действующему на определенную молекулу(например, к гефитинибу и иматинибу). В то же время, было показано, что BCRP демонстрирует субстратную специфичность, отличную от субстратной специфичности П-гликопротеина, поскольку BCRP не действует, например, на паклитаксел или винкристин, которые экскретируются П-гликопротеином, иBCRP вовлекается в экскрецию производного камптотецина (например, СРТ-11 или 7-этил-10-гидроксикамптотецин (SN-38: активный метаболит СРТ-11), который редко экскретируется во внутриклеточное пространство П-гликопротеином (см. не патентный документ 2). Кроме того, было сделано предположение, что BCRP вовлекается в процесс ограничения биодоступности перорально вводимого противоракового агента (см. не патентный документ 3). В связи с вышесказанным, возникла потребность в разработке ингибитора BCRP, способного демонстрировать эффект в направлении преодоления резистентности к противораковому агенту, которую не удается преодолеть традиционными агентами, направленными на устранение резистентности, и для повышения биодоступности противоракового агента. В этой связи, в настоящей работе, с целью преодоления резистентности к противораковым агентам,было разработано множество ингибиторов П-гликопротеина. Тогда как, напротив, имеется только несколько отчетов по результатам исследования ингибиторов BCRP, и выявленное ингибирующее действие не было удовлетворительным. В этой связи, предпринимались непрерывные попытки разработать более эффективные ингибиторы BCRP. Примеры известных по литературным сообщениям соединений, демонстрирующих ингибирующее действие в отношении BCRP, включают: производное FTC (фумитреморгин С) (см. не патентный документ 4), эстроген и антиэстроген (см. не патентный документ 5) и новобиоцин(см. не патентный документ 6). Авторы настоящего изобретения также обнаружили, что флавоноид (см. патентный документ 1) и производное дифенилакрилонитрила (см. патентный документ 2) обладают мощной активностью по ингибированию BCRP. При этом что касается производных акрилонитрилов, содержащих гетероциклическое кольцо, имеются сообщения о противораковом агенте, активируемом CYP1B1 (см. патентный документ 3) и ингибитором 12-липоксигеназы (патентный документ 4). Однако не найдено сообщений о производном акрилонитрила, содержащем гетероциклическое кольцо, которое может служить ингибитором BCRP, выполняя функцию агента для преодоления резистентности к противораковому агенту и агента для потенцирования эффекта противоракового агента. Патентный документ 1: WO 2004/069233. Патентный документ 2: WO 2004/069243. Патентный документ 3: WO 99/40056. Патентный документ 4: JP-A-7-48336.-1 014555 Не патентный документ 1: Proc. Natl. Acad. Sci. USA, 1998, 95: 15665-15670. Не патентный документ 2: Cancer Res., 1999, 59: 5938-5946. Не патентный документ 3: J. Clin. Oncol., 2002, 20: 2943-2950. Не патентный документ 4: Mol. Cancer Ther., 2002, 1: 417-425. Не патентный документ 5: Mol. Cancer Ther., 2003, 2: 105-112. Не патентный документ 6: Int. J. Cancer, 2004, 108: 146-151. Задачей настоящего изобретения является разработка лекарственного средства для ингибирования белка, который определяет резистентность при раке молочной железы (BCRP). В попытке разрешить указанные выше проблемы авторы настоящего изобретения провели скрининг соединений с использованием раковых клеток, которые обладают приобретенной резистентностью,опосредованной экспрессией BCRP, и обнаружили, что производные акрилонитрила, представленные приведенной ниже формулой (1), демонстрируют мощное BCRP-ингибирующее действие. Также было обнаружено, что указанные производные акрилонитрила, демонстрирующие BCRP-ингибирующее действие, включают новые соединения. Настоящее изобретение основано на указанных открытиях. Соответственно, настоящее изобретение относится к ингибитору BCRP, включающему в качестве активного ингредиента производное акрилонитрила, представленное формулой (1):[где один из R1 и R2 означает цианогруппу, и другой означает атом водорода;(где R7 и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода,атом галогена или низшую алкоксигруппу; А означает атом кислорода, атом серы или NR9; и R9 означает атом водорода или низшую алкильную группу; Ar2 означает ароматическую углеводородную группу, содержащую конденсированное кольцо, которое может быть замещено атомом галогена, или группу, выбранную из групп, представленных формулами (5)-(15):(где R3 означает атом водорода, атом кислорода (в виде N-оксида), низшую алкильную группу,низшую алкоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, низшую гидроксиалкильную группу, ароматическую углеводородную группу, которая может иметь заместитель, илиR5 и R6, которые могут быть одинаковыми или различными, каждый означает атом водорода, низшую алкильную группу, которая может содержать заместитель, низшую гидроксиалкильную группу или ароматическую углеводородную группу, которая может иметь заместитель, или гетероциклическую группу; R5 и R6 могут образовывать, вместе с соседним атомом азота, гетероциклическое кольцо, которое может содержать заместитель; и где гидроксильная группа в низшей гидроксиалкильной группе или гетероциклическое кольцо, замещенное гидроксильной группой или низшей гидроксиалкильной группой,могут образовывать сложноэфирную связь с группой фосфорной кислоты или ее солью, или с ацильной группой, которая может содержать заместитель;R4 означает атом водорода, низшую алкильную группу, фенильную группу, которая может содержать заместитель, или бензильную группу;X означает атом углерода, СН или атом азота, при условии, что когда А означает атом кислорода, тоX не может быть атомом азота); иA, R7, R8 и R9 имеют значения, определенные выше)] или его соль. Настоящее изобретение также относится к агенту для преодоления резистентности к противораковому агенту (называемому далее "агент для преодоления резистентности к противораковому агенту"),или к агенту для потенцирования эффекта противоракового агента (далее называемый "агент для потенцирования эффекта противоракового агента"), где указанный агент включает в качестве активного ингредиента указанное выше производное акрилонитрила или его соль.-2 014555 Настоящее изобретение также относится к композиции противоракового агента, содержащей указанное выше производное акрилонитрила или его соль и противораковый агент, который служит в качестве субстрата BCRP. Настоящее изобретение также относится к применению указанного выше производного акрилонитрила или его соли для получения ингибитора BCRP, в качестве агента для преодоления резистентности к противораковому агенту или агента для потенцирования эффекта противоракового агента. Настоящее изобретение также относится к способу лечения рака, который характеризуется наличием приобретенной резистентности к лекарственному средству по механизму, опосредованному BCRP,включающему введение указанного выше производного акрилонитрила или его соли. Среди соединений, представленных формулой (1), соединения, представленные приведенной ниже формулой (1 а), являются новыми соединениями. Таким образом, настоящее изобретение относится к производным акрилонитрила, представленным формулой (1 а):[где один из R1 и R2 означает цианогруппу, и другой означает атом водорода;(где R7 и R8, которые могут быть одинаковыми или различными, каждый означает атом водорода,атом галогена или низшую алкоксигруппу; А означает атом кислорода, атом серы или NR9; иR9 означает атом водорода или низшую алкильную группу);Ar2 означает ароматическую углеводородную группу, содержащую конденсированное кольцо, которое может быть замещено атомом галогена, или группу, выбранную из групп, представленных формулами (5)-(15)(где R3a означает атом водорода (Ar1 означает группу, представленную формулой (3) или (4, низшую алкильную группу, низшую алкоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу, низшую гидроксиалкильную группу или ароматическую углеводородную группу, которая может быть замещена нитрогруппой или аминогруппой, или NR5(R6);R3b означает атом водорода, низшую алкильную группу, низшую алкоксигруппу, атом галогена,нитрогруппу, метилсульфанильную группу, низшую гидроксиалкильную группу, ароматическую углеводородную группу, которая может быть замещена аминогруппой, или NR5(R6); R3c означает атом водорода(Ar1 означает группу, представленную формулой (3) или (4, атом кислорода (в виде N-оксида), низшую алкильную группу, низшую алкоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу,низшую гидроксиалкильную группу, ароматическую углеводородную группу, которая может быть замещена нитрогруппой или аминогруппой, или NR5(R6); каждый из R3d, R3e и R3f означает атом водорода, атом кислорода (в виде N-оксида), низшую алкильную группу, низшую алкоксигруппу, атом галогена, нитрогруппу, метилсульфанильную группу,низшую гидроксиалкильную группу, ароматическую углеводородную группу, которая может быть замещена аминогруппой, или NR5(R6);R5 и R6, которые могут быть одинаковыми или различными, каждый означает атом водорода, низшую алкильную группу, которая может содержать заместитель, низшую гидроксиалкильную группу или ароматическую углеводородную группу, которая может содержать заместитель, или гетероциклическую группу; R5 и R6 могут образовывать, вместе с соседним атомом азота, гетероциклическое кольцо, которое может содержать заместитель; и гидроксильная группа низшей гидроксиалкильной группы или гетероциклическое кольцо, замещенное гидроксильной группой или низшей гидроксиалкильной группой, могут образовывать сложноэфирную связь с группой фосфорной кислоты или ее солью, или с ацильной группой, которая может содержать заместитель;X означает атом углерода, СН или атом азота, при условии, что когда А означает атом кислорода, тоX не может быть атомом азота); иA, R7, R8 и R9 имеют значения, определенные выше)] или к их соли. Настоящее изобретение также относится к лекарственному средству, содержащему в качестве активного ингредиента соединение, представленное формулой (1 а), или его соль. Настоящее изобретение также относится к фармацевтической композиции, содержащей соединение, представленное формулой (1 а), или его соль и фармацевтически приемлемый носитель. Настоящее изобретение также относится к применению соединения, представленного формулой(1 а), или его соли для получения лекарственного препарата. Согласно настоящему изобретению BCRP-ингибирующий эффект производного акрилонитрила или его соли может устранить BCRP-ассоциированную резистентность к противораковому агенту. В дополнение, может быть потенцирован эффект противоракового агента в отношении раковых клеток, в которых экспрессируется BCRP. Кроме того, в соответствии с настоящим изобретением повышается биодоступность рассматриваемого противоракового агента, что ведет к повышению качества противораковой химиотерапии.[Фиг. 1] На графике показано воздействие некоторых соединений настоящего изобретения на резистентность клеток P388/BCRP к SN-38.[Фиг. 2] На графике показано действие некоторых соединений настоящего изобретения по усилению аккумуляции SN-38 в клетках K562/BCRP. Примеры ароматической углеводородной группы, содержащей конденсированное кольцо, которое может быть замещено атомом галогена, представленной Ar2 в формуле (1), включает С 10-С 14 арильные группы. Конкретные примеры включают нафтил, антраценил и фенантрил. Примеры атома галогена, которым ароматическая углеводородная группа Ar2 может быть замещена, включают атом фтора, атом хлора и атом йода. Примеры низших алкильных групп, представленных R3, R3a-R3f, R4 или R9 в формуле (1), включают линейные или разветвленные С 1-C6 алкильные группы. Конкретные примеры включают метил, этил, нпропил, изопропил и н-бутил. Из указанных групп особенно предпочтительным является метил. Примеры низших алкоксигрупп, представленных R3, R3a-R3f, R7 или R8, включают линейные или разветвленные С 1-С 6 алкоксигруппы и C3-C6 циклоалкоксигруппы. Конкретные примеры включают метокси, этокси, н-пропокси, изопропокси и н-бутокси. Из указанных групп особенно предпочтительным является метокси. Примеры атомов галогена включают атом фтора, атом хлора, атом брома и атом йода. Примеры низших гидроксиалкильных групп, представленных R3 или R3a-R3f, включают линейные или разветвленные С 1-С 6 гидроксиалкильные группы. Конкретные примеры включают гидроксиметил,гидроксиэтил и 1-гидроксипропил. Из указанных групп особенно предпочтительной является гидроксиметильная группа. Примеры ароматических углеводородных групп, представленных R3 или R3a-R3f, включают линейные или разветвленные С 6-С 14 арильные группы. Конкретные примеры включают фенил и нафтил. Примеры группы, которой ароматическая углеводородная группа R3 может быть замещена, включают аминогруппу и нитрогруппу. Конкретные примеры включают нитрофенильную группу и аминофенильную группу. Примеры группы, которой фенильная группа R4 может быть замещена, включают атомы галогена и низшие алкоксигруппы. Атом галогена и низшая алкоксигруппа имеют значения, определенные выше применительно к R3. Примеры низших алкильных групп, которые могут содержать заместители и которые представленыR5 и R6, включают линейные или разветвленные С 1-С 6 алкильные группы. Примеры группы, которой низшая алкильная группа может быть замещена, включают C1-C6 алкиламиногруппы и ди(С 1-С 6 алкил)аминогруппы. Конкретные примеры включают метиламино, этиламино, н-пропиламино, изопропиламино, циклопропиламино, диметиламино и диэтиламино. Низшая гидроксиалкильная группа, представленная R5 или R6, и ароматическая углеводородная группа, которая может содержать заместитель, имеют значения, определенные применительно к R3. Примеры гетероциклической группы, представленной R5 или R6, включают алициклические или ароматические гетероциклические соединения, каждое из которых содержит по меньшей мере один гетероатом в кольце. Конкретные примеры включают пиперазинил, пиперидино, морфолино, имидазол и пирролидинил. Примеры гетероциклического кольца, которое может содержать заместитель и которое может быть образовано из R5 или R6, вместе с соседним атомом азота, включают пирролидин, имидазол, пиридин,пиперидин, пиримидин, пиперазин, морфолин, индол, бензимидазол, бензопиразол и хинолин. Примеры группы, которой указанные гетероциклические кольца могут быть замещены, включают гидроксильную группу, низшие алкильные группы и низшие гидроксиалкильные группы. Указанные группы имеют значения, определенные выше.NR5(R6) метилэтаноламиногруппу (-N(CH3)СН 2 СН 2 ОН), сложный фосфатный эфир N-метилэтаноламиногруппы(-N(CH3)СН 2 СН 2 ОН) и их соль, моносукцинат N-метилэтаноламиногруппы (-N(CH3)CH2CH2OH), пирролидиногруппу, пиперидиногруппу, морфолиногруппу, 4-гидроксипиперидиногруппу, сложный фосфатный эфир 4-гидроксипиперидиногруппы и его соль, моносукцинат 4-гидроксипиперидиногруппы, 4 метилпиперазиногруппу, 4-этанолпиперазиногруппу, сложный фосфатный эфир 4-этанолпиперазиногруппы и его соль, моносукцинат 4-этанолпиперазиногруппы и N,N,N'-триметилэтилендиаминогруппу (N(CH3)CH2CH2N(CH3)2). Гидроксигруппа в низшей гидроксиалкильной группе, представленная R5 или R6, и гидроксигруппа в гидроксильной группе или низшей гидроксиалкильной группе, которой гетероциклическая группа может быть замещена, гетероциклическая группа, образуемая R5 или R6, вместе с соседним атомом азота,могут образовывать сложноэфирную связь с фосфатной группой или ее солью, или с ацильной группой,которая может содержать заместитель. Примеры ацильной группы включают С 1-С 8 низшие алканоильные группы. Конкретные примеры включают формил, ацетил, пропионил, малонил и сукцинил. Примеры группы, которой может быть замещена ацильная группа, включают низшие диалкиламиногруппы; фенилкарбамоильные группы, которые могут содержать заместитель, N-низшие алкилкарбамоильные группы, которые могут содержать заместитель, N-N-динизшие алкилкарбамоильные группы и N-гетероциклические карбамоильные группы, которые могут быть замещены алифатическим гетероциклическим кольцом. Низшая алкильная группа имеет значения, определенные выше. Примеры группы, которой фенилкарбамоильная группа, N-низшая алкилкарбамоильная группа илиN,N-ди-низшая алкилкарбомоильная группа могут быть замещены, включают низшие алкиламиногруппы, такие как метиламиногруппа и этиламиногруппа; и низшие диалкиламиногруппы, такие как диэтиламиногруппа и дипропиламиногруппа. Примеры N-гетероциклической карбамоильной группы, которая может быть замещена алифатическим гетероциклическим кольцом, включают N-пиперидинокарбонильные группы, каждая из которых замещена пирролидином, пиперидином, пиперазином или аналогичным гетероциклическим кольцом. Примеры ацильной группы, которая может содержать заместитель, включают диметиламиноацетильную группу, диэтиламиноэтиламинокарбонилпропионильную группу, диэтиламинопропиламинокарбонилпропионильную группу, диэтиламинофениламинокарбонилпропионильную группу, 4-пиперидинопиперидин-1-илкарбонильную группу и 4-пиперидинопиперидин-1-илкарбонилпропионильную группу. Производные акрилонитрила настоящего изобретения могут образовывать фармацевтически приемлемые соли указанных производных и такие соли включены в объем настоящего изобретения. Примеры солей включают неорганические соли, такие как гидрохлориды, сульфаты, нитраты и фосфаты; соли щелочного металла, такие как соли натрия и соли калия; соли щелочноземельного металла, такие как соли кальция и соли магния; соли органических кислот, такие как п-толуолсульфонаты, метансульфонаты, фумараты, сукцинаты и лактаты. Соединения по настоящему изобретению могут быть представлены в форме сольватов (гидратов). Гидраты также включены в объем настоящего изобретения. Производные акрилонитрила настоящего изобретения могут включать их изомеры и каждый из таких изомеров и смеси таких изомеров также включены в объем настоящего изобретения. Из указанных соединений наиболее предпочтительными являются следующие соединения и соли:(Z)-2-(3,4-диметоксифенил)-3-(5-нитротиофен-2-ил)акрилонитрил (соединение 1),(Z)-3-(5-бромтиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрил (соединение 2),(Z)-3-(5-аминотиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрил (соединение 3),(Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илтиофен-2-ил)акрилонитрил (соединение 4) или его соль хлористо-водородной кислоты (соединение 11),(Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илтиофен-2-ил)акрилонитрил (соединение 5),(Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)тиофен-2-ил]акрилонитрил (соединение 6) или его соль хлористо-водородной кислоты (соединение 12),(Z)-2-(3,4-диметоксифенил)-3-5-[(2-гидроксиэтил)метиламино]тиофен-2-илакрилонитрил (соединение 7),(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)тиофен-2-ил]акрилонитрил (соединение 8) или его соль хлористо-водородной кислоты (соединение 13),(Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]тиофен-2-илакрилонитрил(соединение 9) или его соль хлористо-водородной кислоты (соединение 14), его соль метансульфоновой кислоты (соединение 59), его кислая соль серной кислоты (соединение 100), его соль серной кислоты(соединение 101) или его соль азотной кислоты (соединение 102),(Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламиноэтил)метиламино]тиофен-2-илакрилонитрил(соединение 10) или его соль хлористо-водородной кислоты (соединение 15),моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил)фосфат(соединение 16) или его натриевая соль (соединение 17),-5 014555 моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил)сукцинат (соединение 18) или его натриевая соль (соединение 57),(Z)-2-(3,4-диметоксифенил)-3-(5-нитрофуран-2-ил)акрилонитрил (соединение 19),(Z)-2-(3,4-диметоксифенил)-3-(5-гидроксиметилфуран-2-ил)акрилонитрил (соединение 20),(Z)-2-(3,4-диметоксифенил)-3-[5-(3-нитрофенил)фуран-2-ил]акрилонитрил (соединение 21),(Z)-3-[5-(3-аминофенил)фуран-2-ил]-2-(3,4-диметоксифенил)акрилонитрил (соединение 22) или его соль хлористо-водородной кислоты (соединение 23),(Z)-2-(3,4-диметоксифенил)-3-(5-пиперидинил-2-илфуран-2-ил)акрилонитрил (соединение 24),(Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илфуран-2-ил)акрилонитрил (соединение 25),(Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)фуран-2-ил]акрилонитрил (соединение 26),(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)фуран-2-ил]акрилонитрил(соединение 27) или его соль хлористо-водородной кислоты (соединение 29),(Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фуран-2-илакрилонитрил (соединение 28) или его соль хлористо-водородной кислоты (соединение 50),(Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрил (соединение 30), его соль хлористоводородной кислоты (соединение 31) или его соль метансульфоновой кислоты (соединение 32),N-оксид (Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила (соединение 33),(Z)-2-(3,4-диметоксифенил)-3-пиридин-3-илакрилонитрил (соединение 34) или его соль хлористоводородной кислоты (соединение 36),(Z)-2-(3,4-диметоксифенил)-3-(6-метоксипиридин-3-ил)акрилонитрил (соединение 35) или его соль хлористоводородной кислоты (соединение 37),(Z)-2-(3,4-диметоксифенил)-3-пиридин-2-илакрилонитрил (соединение 38),(Z)-2-(3,4-диметоксифенил)-3-(1 Н-пиррол-2-ил)акрилонитрил (соединение 39) или его соль хлористоводородной кислоты (соединение 40),(Z)-2-(3,4-диметоксифенил)-3-(3H-имидазол-4-ил)акрилонитрил (соединение 41),(Z)-3-(3-бензил-2-метилсульфанил-3H-имидазол-4-ил)-2-(3,4-диметоксифенил) акрилонитрил (соединение 42),(Z)-2-(3,4-диметоксифенил)-3-(4-метил-2-фенилтиазол-5-ил)акрилонитрил (соединение 43),(Z)-3-(3,4-диметоксифенил)-2-пиридин-3-илакрилонитрил (соединение 44) или его соль хлористоводородной кислоты (соединение 46),(Z)-3-(3,4-диметоксифенил)-2-пиридин-2-илакрилонитрил (соединение 45) или его соль хлористоводородной кислоты (соединение 47),(Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламиноэтил)метиламино]фуран-2-илакрилонитрил (соединение 48) или его соль хлористо-водородной кислоты (соединение 49),моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фуран-2-илпиперидин-4-ил)сукцинат(соединение 51) или его натриевая соль (соединение 58),моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фуран-2-илпиперидин-4-ил) фосфат (соединение 52) или его натриевая соль (соединение 53),(Z)-3-(5-бромфуран-2-ил)-2-(3,4-диметоксифенил)акрилонитрил (соединение 54),(Е)-3-(3,4-диметоксифенил)-2-тиофен-2-илакрилонитрил (соединение 55),(Z)-3-(3,4-диметоксифенил)-2-тиофен-3-илакрилонитрил (соединение 56),соль хлористо-водородной кислоты 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2 ил]пиперидин-4-ил-N-(2-диэтиламиноэтил)сукцинамата (соединение 60),соль хлористо-водородной кислоты 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2 ил]пиперидин-4-ил-N-(3-диэтиламинопропил)сукцинамата (соединение 61),соль п-толуолсульфоновой кислоты 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2 ил]пиперидин-4-илдиметиламиноацетата (соединение 62) или его соль хлористо-водородной кислоты(соединение 103),его соль п-толуолсульфоновой кислоты (соединение 96) или его соль хлористо-водородной кислоты(соединение 105),1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-илдиэтилкарбамат (соединение 97),соль хлористо-водородной кислоты 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2 ил]пиперидин-4-ил-N-(2-диэтиламиноэтил)-N-метилсукцинамата (соединение 98) и 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-ил-N-(4 диэтиламинофенил)сукцинамата (соединение 99). Производные акрилонитрила настоящего изобретения и их соли могут быть получены с использованием, например, приведенных ниже реакционных схем (А) или (В): Схема (А)(где Ar1 и Ar2 имеют значения, определенные выше). В частности, в ходе реакции конденсации между ароматическим альдегидом (16) или (19) и ароматическим ацетонитрилом (17) или (18) может быть получено производное акрилонитрила (1-1) или (1-2). Более конкретно, реакция конденсации между ароматическим альдегидом (16) и 3,4-диметоксибензилцианидом (17) приводит к образованию производного акрилонитрила (1-1), и реакция конденсации между ароматическим ацетонитрилом (18) и 3,4-диметоксибензальдегидом (19) приводит к образованию производного акрилонитрила (1-2). Альтернативно, в ходе реакции конденсации между полициклическим ароматическим альдегидом(16) и 3,4-диметоксибензилцианидом (17) может быть получено производное акрилонитрила (1-1). В ходе реакции конденсации между гетероциклическим ацетонитрилом (18) и хинолинкарбоксальдегидом(19) может быть получено производное акрилонитрила (1-2). А также, в ходе реакции конденсации между бензотиофенкарбоксальдегидом, бензофуранкарбоксальдегидом или индолкарбоксальдегидом (19) и гетероциклическим ацетонитрилом (18) может быть получено производное акрилонитрила (1-2). Реакцию конденсации предпочтительно проводят в присутствии основания, такого как алкоксид натрия, гидроксид натрия или гидроксид калия. В том случае, когда используют алкоксид натрия, реакцию конденсации проводят в спиртовом растворителе, таком как метанол или этанол, при температуре, соот-7 014555 ветствующей примерно температуре охлаждения льдом и температуре кипения с обратным холодильником, тогда как в случае использования гидроксида натрия реакцию конденсации проводят в смеси растворителей, включающей воду и инертный растворитель, такой как метиленхлорид или хлороформ, в присутствии соли четвертичного аммония или аналогичного соединения, добавляемых в смесь. Каждое из производных акрилонитрила, содержащее гетероциклическое кольцо настоящего изобретения, или их соли могут быть введены как таковые. Альтернативно, указанные производные или их соли могут быть смешаны с фармацевтически приемлемым носителем, таким как диспергирующее вспомогательное вещество или эксципиент, и могут быть использованы в форме препаратов для инъекций или препаратов для перорального введения, такого как порошок, раствор, капсула, суспензия, эмульсия,сироп, эликсир, гранулы, пилюли, таблетки, леденцы или лимонад. Указанные продукты могут быть получены с помощью общепринятого способа. Примеры такого носителя включают водорастворимые моносахариды, олигосахариды и полисахариды, такие как маннит, лактоза и декстран; гелеобразующие или водорастворимые целлюлозы, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза и метилцеллюлоза; водопоглощающие и плохо растворимые в воде целлюлозы, такие как кристаллическая целлюлоза, такие как -целлюлоза,сшитая натрийкарбоксиметилцеллюлоза и ее производные; водопоглощающие и плохо растворимые в воде полисахариды, такие как гидроксипропилкрахмал, карбоксиметилкрахмал, сшитый крахмал, амилоза, амилопектин, пектин и их производные; водопоглощающие и плохо растворимые в воде камеди, такие как аравийская камедь, трагакант, глюкоманнан и их производные; сшитые винильные полимеры,такие как поливинилпирролидон, сшитая полиакриловая кислота и ее соли, сшитый поливиниловый спирт, полигидроксиэтилметакрилат и его производные; и липиды, образующие молекулярные агрегаты(например, липосомы), такие как фосфолипид и холестерин. В том случае, когда соединение настоящего изобретения имеет низкую растворимость, указанное соединение может быть солюбилизировано. Примеры метода солюбилизации включают такие, которые в основном применимы к лекарственным препаратам, таким как метод, в котором к данному соединению добавляют поверхностно-активное вещество (например, эфир полиоксиэтиленового спирта, сложный эфир полиоксиэтиленацила, сложный эфир сорбитанацила или сложный эфир полиоксиэтиленсорбитанацила), и метод, использующий водорастворимый полимер (например, полиэтиленгликоль). При желании, может использоваться, например, метод получения растворимой соли соединения или метод, использующий получение клатратного соединения на основе циклодекстрина или аналогичного материала. Подходящий метод солюбилизации может быть выбран в соответствии с природой нужного производного акрилонитрила или его соли. За счет мощного BCRP-ингибирующего эффекта, соединение настоящего изобретения может применяться в качестве агента для преодоления резистентности к противораковому агенту и в качестве агента для потенцирования эффекта противоракового агента. Ингибитор BCRP может использоваться в качестве агента для преодоления резистентности к противораковому агенту, в случае рака, при котором имеет место приобретенная BCRP-опосредованная резистентность к вводимому противораковому препарату. При этом ингибитор BCRP может использоваться в качестве агента для потенцирования эффекта противоракового агента, в случае рака, при котором экспрессируется BCRP и отмечается низкая чувствительность к противораковому препарату. Нет никаких ограничений в отношении противоракового средства, которое является мишенью для действия агента для преодоления резистентности к противораковому агенту или агента для потенцирования эффекта противоракового агента, содержащего в качестве активного ингредиента ингибитор BCRP настоящего изобретения, главное, чтобы противораковый препарат мог служить в качестве субстрата для BCRP или его аналога. Примеры такого противоракового средства включают ингибиторы топоизомеразы I, такие как гидрохлорид иринотекана/СРТ-11 (активный метаболит: SN-38) и топотекан; ингибиторы топоизомеразы II, такие как митоксантрон, доксорубицин, даунорубицин, бисантрен и этопозид; антифоляты,такие как метотрексат; и терапевтические препараты, действующие на целевые молекулы, такие как гефитиниб и иматиниб. Следует отметить, что нет каких-либо конкретных ограничений в отношении аналога BCRP, главное, чтобы он характеризовался такой же резистентностью к противораковому препарату, что и BCRP. Доза ингибитора BCRP настоящего изобретения может быть соответствующим образом определена с учетом, например, способа введения или имеющегося у пациента симптома. Дневная доза для взрослого человека составляет предпочтительно от 1 мг до 10 г, более предпочтительно от 100 мг до 10 г, и наиболее предпочтительно от 500 мг до 10 г. Нет каких-либо конкретных ограничений в отношении соотношения между противораковым препаратом и ингибитором BCRP, и предпочтительный коэффициент их соотношения может варьировать, в зависимости, например, от типа противоракового препарата или используемого ингибитора. В том случае, когда используют, например, гидрохлорид иринотекана в качестве противоракового препарата, массовое соотношение противоракового препарата к ингибитору BCRP составляет предпочтительно 1:1-1:500, особенно предпочтительно 1:1-1:100 и более предпочтительно от 1:1 до 1:10.-8 014555 Примеры Далее настоящее изобретение будет описано более подробно с помощью примеров, которые никоем образом не следует рассматривать как ограничивающие настоящее изобретение. Пример 1. Получение производного акрилонитрила, содержащего гетероциклическое кольцо (стадия получения 1). Введение амина в галогенсодержащий гетероциклический альдегид. В реактор, в котором находится галогенсодержащий гетероциклический альдегид, добавляют воду и амин (3 экв.). При кипячения с обратным холодильником смесь перемешивают в течение времени от десяти минут до одного дня. После охлаждения смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель выпаривают досуха. Образовавшийся остаток очищают хроматографией на колонке с силикагелем, получая представляющее интерес соединение.(Стадия получения 2. Способ А). Стадия реакции конденсации между ароматическим или полициклическим ароматическим альдегидом и 3,4-диметоксибензилцианидом. Равные количества (в эквивалентах) производного ароматического или полициклического ароматического альдегида и 3,4-диметоксибензилцианида вводят в реактор и добавляют этанол. Далее, к реактору подсоединяют трубку с хлоридом кальция и смесь в реакторе перемешивают до растворения. Отдельно взвешивают 1-2 эквивалента этоксида натрия и растворяют в этаноле, затем раствор добавляют по каплям к указанному выше раствору. Смесь перемешивают при температуре примерно от температуры охлаждения льдом до примерно температуры кипения с обратным холодильником. После завершения реакции к реакционной смеси добавляют воду и выпаривают досуха этанол. Смесь экстрагируют хлороформом и органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия. Растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем и перекристаллизовывают из этанола, получая представляющее интерес соединение.(Стадия получения 2: способ В). Стадия реакции конденсации между ароматическим ацетонитрилом и 3,4-диметоксибензальдегидом. Равные количества (в эквивалентах) производного ароматического ацетонитрила и 3,4-диметоксибензальдегида вводят в реактор и добавляют этанол. Далее, к реактору подсоединяют трубку с хлоридом кальция и смесь в реакторе перемешивают до растворения. Отдельно взвешивают 1-2 эквивалента этоксида натрия и растворяют в этаноле, затем раствор добавляют по каплям к полученному выше раствору. Смесь перемешивают при комнатной температуре. После завершения реакции к реакционной смеси добавляют воду и выпаривают досуха этанол. Смесь экстрагируют хлороформом и органический слой промывают насыщенным раствором соли, затем сушат над безводным сульфатом натрия. Растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем и перекристаллизовывают из этанола, получая представляющее интерес соединение.(Стадия получения 3: Способ В). Стадия реакции конденсации между гетероциклическим ацетонитрилом и хинолинкарбоксальдегидом, бензотиофенкарбоксальдегидом, бензофуранкарбоксальдегидом или индолкарбоксальдегидом. Эквимолярные количества производного гетероциклического ацетонитрила и производного альдегида вносят в реактор. С использованием методики, описанной в разделе "Стадия получения 2: Способ В", получают представляющее интерес соединение. Ниже описаны конкретные варианты способов получения указанных производных и результаты их анализа. Получение (Z)-2-(3,4-диметоксифенил)-3-(5-нитротиофен-2-ил)акрилонитрила (соединение 1). 5-Нитротиофен-2-карбоксальдегид (3,14 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (3,54 г) по способу А (стадия получения 2), получая целевой продукт (выход: 540 мг, 8,5%). Оранжевые кристаллы. МС (APCI, m/z): 316 (М)-. 1 Н-ЯМР (CDCl3) : 7,93 (1 Н, д, J=4,4), 7,56 (1 Н, д, J=4,4), 7,43 (1 Н, с), 7,30 (1 Н, дд, J=2,0, 8,3), 7,12(1 Н, д, J=2,0), 6,94 (1 Н, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с). Получение (Z)-3-(5-бромтиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 2). 5-Бромтиофен-2-карбоксальдегид (381 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (355 мг) по способу А (стадия получения 2), получая целевой продукт (выход: 359 мг, 51%). Светло-желтые кристаллы. МС (APCI, m/z): 349 (М)+. 1(1H, д, J=2,2), 6,90 (1H, д, J=8,5), 3,96 (3H, c), 3,93 (3H, c). Получение (Z)-3-(5-аминотиофен-2-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 3). Соединение 1 (316 мг) растворяют в этаноле (25 мл) и к раствору добавляют дигидрат хлорида кальция (132 мг) и порошок цинка (2,55 г) с последующим перемешиванием в течение 2-х часов при кипячении с обратным холодильником. Реакционную смесь фильтруют, используя рыхлый слой целита,что приводит к удалению цинкового порошка, и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (гексан-этилацетат), получая целевой продукт (выход: 35 мг,-9 014555 12%). Желтовато-коричневые кристаллы. МС (ESI, m/z): 287 (М+Н)+. 1(1 Н, д, J=8,3), 6,13 (1 Н, д, J=3,9), 4,34 (2 Н, уш.с), 3,94 (3H, с), 3,91 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илтиофен-2-ил)акрилонитрила (соединение 4). По методике, используемой на стадии получения 1, аминопроизводное, полученное из пиперидина(1,02 г), вводят в 5-бромтиофен-2-карбоксальдегид (764 мг) с получением 5-пиперидин-1-илтиофен-2 карбальдегида (выход: 500 мг, 64%). Полученный 5-пиперидин-1-илтиофен-2-карбальдегид (293 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (266 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 279 мг, 53%). Желтые кристаллы. МС (ESI, m/z): 355 (М+Н)+. 1(1 Н, д, J=8,5), 6,06 (1 Н, д, J=4,2), 3,94 (3H, с), 3,90 (3H, с), 3,29-3,43 (4 Н, м), 1,60-1,76 (6 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илтиофен-2-ил)акрилонитрила (соединение 5). По методике, используемой на стадии получения 1, аминопроизводное, полученное из морфолина(523 мг), вводят в 5-бромтиофен-2-карбоксальдегид (382 мг) с получением 5-морфолин-4-илтиофен-2 карбальдегида (выход: 176 мг, 45%). Полученный 5-морфолин-4-илтиофен-2-карбальдегид (172 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (154 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 46 мг, 15%). Желтые кристаллы. МС (ESI, m/z.): 357 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,38 (1 Н, с), 7,24 (1 Н, д, J=4,4), 7,14 (1 Н, дд, J=2,2, 8,3), 7,05 (1 Н, д, J=2,2), 6,88(1 Н, д, J=8,3), 6,08 (1 Н, д, J=4,4), 3,95 (3H, с), 3,91 (3H, с), 3,83-3,88 (4 Н, м), 3,28-3,33 (4 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)тиофен-2-ил]акрилонитрила (соединение 6). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 4 гидроксипиперидина (3,03 г), вводят в 5-бромтиофен-2-карбоксальдегид (1,91 г) с получением 5-(4 гидроксипиперидин-1-ил)тиофен-2-карбальдегида (выход: 1,36 г, 64%). Полученный 5-(4 гидроксипиперидин-1-ил)тиофен-2-карбальдегид (1,27 г) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (1,06 г) по способу А (стадия получения 2) с получением целевого продукта(2 Н, м), 1,98-2,06 (2 Н, м), 1,68-1,78 (2 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-5-[(2-гидроксиэтил)метиламино]тиофен-2-илакрилонитрила (соединение 7). По методике, используемой на стадии получения 1, аминопроизводное, полученное из N-метилэтаноламина (2,25 г), вводят в 5-бромтиофен-2-карбоксальдегид (1,91 г) с получением 5-[(2-гидроксиэтил)метиламино]тиофен-2-карбальдегида (выход: 991 мг, 53%). Полученный 5-[(2-гидроксиэтил) метиламино]тиофен-2-карбальдегид (682 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (654 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 300 мг,24%). Оранжевые кристаллы. МС (ESI, m/z): 345 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,35 (1 Н, с), 7,21 (1 Н, д, J=4,2), 7,12 (1 Н, дд, J=2,2, 8,3), 7,03 (1 Н, д, J=2,2), 6,87(соединение 8). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 1 метилпиперазина (6,01 г), вводят в 5-бромтиофен-2-карбоксальдегид (3,82 г) с получением 5-(4 метилпиперазин-1-ил)тиофен-2-карбальдегида (выход: 3,71 г, 88%). Полученный 5-(4-метилпиперазин-1 ил)тиофен-2-карбальдегид (2,10 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом(1,77 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 2,47 г, 67%). Желтовато-оранжевые кристаллы. МС (ESI, m/z): 370 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,37 (1 Н, с), 7,22 (1 Н, д, J=4,4), 7,13 (1 Н, дд, J=2,2, 8,5), 7,04 (1 Н, д, J=2,2), 6,87(Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]тиофен-2-илакрилонитрила (соединение 9). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 1- 10014555 пиперазинэтанола (7,81 г), вводят в 5-бромтиофен-2-карбоксальдегид (3,82 г) с получением 5-[4-(2 гидроксиэтил)пиперазин-1-ил]тиофен-2-карбальдегида (выход: 3,22 г, 67%). Полученный 5-[4-(2 гидроксиэтил)пиперазин-1-ил]тиофен-2-карбальдегид (1,85 г) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (1,37 г) по способу А (стадия получения 2) с получением целевого продукта(1 Н, д, J=8,3), 6,05 (1 Н, д, J=4,4), 3,95 (3H, с), 3,91 (3H, с), 3,67 (2 Н, м), 3,33-3,38 (4 Н, м), 2,65-2,70 (4 Н, м),2,60-2,65 (2 Н, м), 2,57 (1 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламиноэтил)метиламино]тиофен-2-илакрилонитрила (соединение 10). По методике, используемой на стадии получения 1, аминопроизводное, полученное из N,N,N'триметилэтилендиамина (6,13 г), вводят в 5-бромтиофен-2-карбоксальдегид (3,82 г) с получением 5-[(2 диметиламиноэтил)метиламино]тиофен-2-карбальдегида (выход: 3,26 г, 77%). Полученный 5-[(2 диметиламиноэтил)метиламино]тиофен-2-карбальдегид (2,12 г) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (1,77 г) по способу А (стадия получения 2) с получением целевого продукта(1 Н, д, J=8,3), 5,86 (1 Н, д, J=4,2), 3,94 (3H, с), 3,90 (3H, с), 3,48 (2 Н, т, J=7,1), 3,10 (3H, с), 2,56 (2 Н, т,J=7,1), 2,30 (6 Н, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илтиофен-2-ил)акрилонитрила (соединение 11). 0,1 н. Хлористо-водородную кислоту (7,0 мл) добавляют к соединению 4 (226 мг) и к полученной смеси добавляют очищенную воду (30 мл), ацетонитрил (30 мл) и хлороформ (3 мл) для растворения смеси. Раствор перемешивают при комнатной температуре в течение 1 ч и растворитель выпаривают досуха. Остаток суспендируют в смеси гексан-этилацетат и растворитель выпаривают досуха с последующей тщательной сушкой, получая целевой продукт (выход: 235 мг, 94%). Желтые кристаллы. МС (ESI, m/z): 355 (М-HCl+Н)+. 1H-ЯМР (CDCl3) : 7,37 (1 Н, с), 7,23 (1 Н, уш.с), 7,13 (1 Н, дд, J=2,0, 8,5), 7,04 (1 Н, д, J=2,0), 6,87 (1 Н,д, J=8,5), 6,15 (1 Н, уш.с), 3,94 (3H, с), 3,90 (3H, с), 3,30-3,37 (4 Н, м), 1,72-1,80 (4 Н, м), 1,60-1,68 (2 Н, м). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-[5-(4-гидроксипиперидин-1-ил)тиофен-2 ил]акрилонитрила (соединение 12). 0,1 н. хлористо-водородную кислоту (3,0 мл) добавляют к соединению 6 (100 мг) и к полученной смеси добавляют очищенную воду (5 мл), ацетонитрил (30 мл) и хлороформ (5 мл) для растворения смеси. Раствор перемешивают при комнатной температуре в течение 1 ч и растворитель выпаривают досуха,с последующей тщательной сушкой, получая целевой продукт (выход: 95 мг, 87%). Желтовато-оранжевый порошок. МС (ESI, m/z): 371 (М-HCl+Н)+. 1(Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)тиофен-2 ил]акрилонитрила (соединение 13). 0,1 н. Хлористо-водородную кислоту (14,9 мл) добавляют к соединению 8 (500 мг) для растворения и к полученному раствору добавляют очищенную воду (10 мл), с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 546 мг, 99%). Желтовато-оранжевый порошок. МС (ESI, m/z): 370 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,38 (1 Н, с), 7,21 (1 Н, д, J=4,1), 7,16 (1 Н, дд, J=2,2, 8,3), 7,05 (1 Н, д, J=2,2), 6,89(Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1 ил)тиофен-2-илакрилонитрила (соединение 14). 0,1 н. Хлористо-водородную кислоту (13,8 мл) добавляют к соединению 9 (500 мг) для растворения и к полученному раствору добавляют очищенную воду (10 мл), с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 540 мг, 99%). Желтовато-оранжевый порошок. МС (ESI, m/z): 400 (М-HCl+Н)+. 1(4 Н, м), 3,05-3,25 (4 Н, м). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламиноэтил)метиламино] тиофен-2-илакрилонитрила (соединение 15). 0,1 н. Хлористо-водородную кислоту (3,8 мл) добавляют к соединению 10 (100 мг) и к данной смеси добавляют очищенную воду (5 мл) и ацетонитрил (5 мл) для растворения смеси. Указанный раствор перемешивают при комнатной температуре в течение 1 ч и растворитель выпаривают досуха, с последующей тщательной сушкой, получая целевой продукт (выход: 100 мг, 91%). Оранжевый порошок. МС (ESI, m/z): 372 (М-HCl+Н)+. 1(1 Н, д, J=8,3), 6,09 (1 Н, д, J=4,1), 4,00-4,06 (2 Н, м), 3,95 (3H, с), 3,91 (3H, с), 3,24-3,30 (2 Н, м), 3,18 (3H, с),2,90 (3H, с), 2,88 (3H, с). Получение моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил) фосфата (соединение 16). Соединение 6 (400 мг) и бис(2,2,2-трихлорэтил)фосфорохлоридат (1,64 г) растворяют в пиридине (4 мл) и полученный раствор перемешивают при комнатной температуре в течение 2 ч. После завершения реакции к реакционной смеси добавляют метанол, с последующим перемешиванием в течение 30 мин. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем (этилацетат:гексан=7:13) с получением 1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил-бис-(2,2,2-трихлорэтил)фосфата (выход: 694 мг, 90%). Полученный 1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил-бис(2,2,2-трихлорэтил)фосфат (385 мг) растворяют в смеси растворителей (5 мл), содержащей пиридин и уксусную кислоту (4:1). К раствору добавляют порошок цинка (353 мг) и затем перемешивают при комнатной температуре в течение 4 ч. Нерастворимый порошок цинка удаляют фильтрованием и к фильтрату добавляют смолу IRC748 (NH4+) (11 г), с последующим перемешиванием при комнатной температуре в течение 30 мин. Смолообразное вещество удаляют фильтрованием и растворитель выпаривают досуха. Остаток промывают этанолом с получением целевого продукта (выход: 195 мг, 80%). Желтовато-коричневый порошок. МС (ESI, m/z): 449 (М-Н)-. 1H-ЯМР (ДМСО) : 1,71-1,77 (2 Н, м), 1,96-1,99 (2 Н, м), 3,23-3,28 (2 Н, м), 3,50-3,56 (2 Н, м), 3,77 (3H,с), 3,83 (3H, с), 4,27-4,30 (1 Н, м), 6,28 (1 Н, д, J=3,9), 7,01 (1 Н, д, J=8,8), 7,08 (1 Н, дд, J=2,0, 8,3), 7,16 (1 Н,д, J=2,0), 7,91 (1 Н, с), 8,58 (1 Н, д, J=3,9). Получение натриевой соли моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил)фосфата (соединение 17). К соединению 16 (100 мг) добавляют очищенную воду (10 мл) с образованием суспензии. К суспензии добавляют смолу IRC748 (Na) (2 г), с последующим перемешиванием при комнатной температуре. После растворения исходных веществ смолообразное вещество удаляют фильтрованием и растворитель выпаривают при пониженном давлении с получением целевого продукта (выход: 104 мг, 95%). Желтовато-коричневый порошок. МС (ESI, m/z): 449 (M-2Na+H)+. 1H-ЯМР (D2O) : 7,13 (1 Н, с), 6,90 (1 Н, д, J=2,2), 6,60-6,75 (3H, м), 5,96 (1 Н, д, J=4,1), 4,05-4,08 (1 Н,м), 3,64 (3H, с), 3,63 (3H, с), 3,42-3,45 (2 Н, м), 2,69-3,01 (2 Н, м), 1,91-1,92 (2 Н, м), 1,57-1,59 (2 Н, м). Получение моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил) сукцината (соединение 18). Соединение 6 (200 мг) растворяют в пиридине (2 мл) и к раствору добавляют янтарный ангидрид(270 мг), с последующим перемешиванием при кипячении с обратным холодильником в течение 2-х часов. После завершения реакции к реакционной смеси добавляют метанол с последующим перемешиванием в течение 30 мин. Растворитель выпаривают досуха и остаток экстрагируют хлороформом и очищенной водой. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток промывают гексаном с получением целевого продукта (выход: 212 мг, 95%). Желтый порошок. MC (ESI, m/z): 469 (M-H)-. 1 Н-ЯМР (CDCl3) : 7,36 (1 Н, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=2,2), 6,87(2 Н, м), 2,69-2,72 (2 Н, м), 2,64-2,67 (2 Н, м), 2,00-2,05 (2 Н, м), 1,83-1,89 (2 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-нитрофуран-2-ил)акрилонитрила (соединение 19). 5-Нитро-2-фуральдегид (1,41 г) повергают реакции конденсации с 3,4-диметоксибензилцианидом(1,77 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 88 мг, 2,9%). Оранжевые кристаллы. MC (APCI, m/z): 300 (М)-. 1 Н-ЯМР (CDCl3) : 7,53 (1 Н, д, J=3,9), 7,46 (1 Н, д, J=3,9), 7,36 (1 Н, с), 7,32 (1 Н, дд, J=2,4, 8,3), 7,13(1 Н, д, J=2,4), 6,95 (1 Н, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-гидроксиметилфуран-2-ил)акрилонитрила (соединение 20). 5-Ацетоксиметил-2-фуральдегид (505 мг) повергают реакции конденсации с 3,4 диметоксибензилцианидом (532 мг) по способу А (стадия получения 2) с получением целевого продукта(1 Н, д, J=8,5), 6,48 (1 Н, д, J=3,7), 4,49 (2 Н, д, J=6,3), 3,85 (3H, с), 3,80 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-[5-(3-нитрофенил)фуран-2-ил]акрилонитрила (соединение 21). 5-(3-нитрофенил)фурфурал (1,09 г) повергают реакции конденсации с 3,4-диметоксибензилцианидом (889 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 1,85 г, 98%). Желтовато-оранжевые кристаллы. МС (APCI, m/z): 376 (М)-. 1 Н-ЯМР (CDCl3) : 8,61 (1 Н, т, J=2,0), 8,17 (1 Н, дд, J=2,0, 8,1), 8,16 (1 Н, дд, J=2,0, 8,1), 7,64 (1 Н, т,J=8,1), 7,31 (1 Н, с), 7,30 (1 Н, дд, J=2,2, 8,5), 7,16 (1 Н, д, J=3,7), 7,15 (1 Н, д, J=2,2), 7,00 (1 Н, д, J=3,7), 6,94(1 Н, д, J=8,5), 3,99 (3H, с), 3,94 (3H, с). Получение (Z)-3-[5-(3-аминофенил)фуран-2-ил]-2-(3,4-диметоксифенил)акрилонитрила (соединение 22). К соединению 21 (1,00 г) добавляют уксусную кислоту (300 мл) с образованием суспензии. К суспензии добавляют порошок цинка (3,47 г), с последующим перемешиванием при комнатной температуре в течение 4-х часов. Реакционную смесь фильтруют через рыхлый слой целита и рыхлый слой целита промывают хлороформом. Фильтрат (раствор уксусная кислота-хлороформ) выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (хлороформ-метанол) с получением целевого продукта (выход: 184 мг, 24%). Желтые кристаллы. МС (ESI, m/z): 347 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,24-7,28 (2 Н, м), 7,18-7,23 (3H, м), 7,14 (1 Н, д, J=2,4), 7,08 (1 Н, д, J=3,9), 6,92(1 Н, д, J=8,8), 6,79 (1 Н, д, J=3,9), 6,65-6,68 (1 Н, м), 3,97 (3H, с), 3,93 (3H, с). Получение гидрохлорида (Z)-3-[5-(3-аминофенил)фуран-2-ил]-2-(3,4-диметоксифенил)акрилонитрила (соединение 23). 0,1 н. Хлористо-водородную кислоту (3,7 мл) добавляют к соединению 22 (117 мг) и к полученной смеси добавляют очищенную воду (30 мл), ацетонитрил (30 мл) и хлороформ (5 мл) для растворения смеси. Полученный раствор перемешивают при комнатной температуре в течение 1 ч и растворитель выпаривают досуха. Остаток суспендируют в смеси гексан-этилацетат и растворитель выпаривают досуха, с последующей тщательной сушкой, получая целевой продукт (выход: 124 мг, 96%). Желтовато-коричневый порошок. МС (ESI, m/z): 347 (М-HCl+Н)+. 1 Н-ЯМР (ДМСО-d6) : 7,88 (1 Н, с), 7,75 (1 Н, уш.д, J=7,9), 7,63 (1 Н, уш.с), 7,53 (1 Н, т, J=7,9), 7,35(1 Н, д, J=2,2), 7,22-7,28 (3H, м), 7,17 (1 Н, д, J=3,7), 7,09 (1 Н, д, J=8,8), 3,87 (3H, с), 3,82 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-пиперидин-1-илфуран-2-ил)акрилонитрила (соединение 24). По методике, используемой на стадии получения 1, аминопроизводное, полученное из пиперидина(выход: 650 мг, 73%). Полученный 5-пиперидин-1-илфуран-2-карбальдегид (179 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (177 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 100 мг, 30%). Оранжевые кристаллы. МС (ESI, m/z): 339 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,13 (1 Н, дд, J=2,2, 8,5), 7,05 (1 Н, д, J=2,2), 6,94 (1 Н, с), 6,87 (1 Н, д, J=8,5), 6,84(1 Н, д, J=3,4), 5,24 (1 Н, д, J=3,4), 3,94 (3H, с), 3,90 (3H, с), 3,37-3,42 (4 Н, м), 1,61-1,72 (6 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-(5-морфолин-4-илфуран-2-ил)акрилонитрила (соединение 25). По методике, используемой на стадии получения 1, аминопроизводное, полученное из морфолина(выход: 138 мг, 38%). Полученный 5-морфолин-4-илфуран-2-карбальдегид (137 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (135 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 102 мг, 40%). Желтые кристаллы. МС (ESI, m/z): 341 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,14 (1 Н, дд, J=2,2, 8,5), 7,05 (1 Н, д, J=2,2), 6,96 (1H, с), 6,88 (1H, д, J=8,5), 6,82(соединение 26). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 4-гидроксипиперидина (1,52 г), вводят в 5-бром-2-фуральдегид (875 мг) с получением 5-(4-гидроксипиперидин-1 ил)фуран-2-карбальдегида (выход: 660 мг, 68%). Полученный 5-(4-гидроксипиперидин-1-ил)фуран-2 карбальдегид (390 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (354 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 458 мг, 65%). Оранжевые кристаллы. МС (ESI, m/z): 355 (М+Н)+.(соединение 27). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 1-метилпиперазина (1,03 г), вводят в 5-бром-2-фуральдегид (602 мг) с получением 5-(4-метилпиперазин-1 ил)фуран-2-карбальдегида (выход: 447 мг, 67%). Полученный 5-(4-метилпиперазин-1-ил)фуран-2 карбальдегид (388 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (355 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 215 мг, 30%). Желтые кристаллы. МС (ESI, m/z): 354 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,14 (1 Н, дд, J=2,2, 8,5), 7,05 (1 Н, д, J=2,2), 6,95 (1 Н, с), 6,87 (1 Н, д, J=8,5), 6,83(Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фуран-2-илакрилонитрила (соединение 28). По методике, используемой на стадии получения 1, аминопроизводное, полученное из 1-пиперазинэтанола (3,91 г), вводят в 5-бром-2-фуральдегид (1,75 г) с получением 5-[(4-(2-гидроксиэтил)пиперазин-1-ил)фуран-2-карбальдегида (выход: 1,37, 61%). Полученный 5-[(4-(2-гидроксиэтил)пиперазин-1 ил)фуран-2-карбальдегид (1,12 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (888 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 1,32 г, 69%). Желтовато-коричневое масло. МС (ESI, m/z): 384 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,14 (1 Н, дд, J=2,2, 8,5), 7,05 (1 Н, д, J=2,2), 6,96 (1 Н, с), 6,87 (1 Н, д, J=8,5), 6,82(6 Н, м). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-[5-(4-метилпиперазин-1-ил)фуран-2-ил] акрилонитрила (соединение 29). 0,1 н. Хлористо-водородную кислоту (3,1 мл) добавляют к соединению 27 (100 мг) для растворения и к полученному раствору добавляют очищенную воду (5 мл), с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 109 мг, 99%). Желтовато-коричневый порошок. МС (ESI, m/z): 354 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,16 (1 Н, дд, J=2,2, 8,5), 7,05 (1 Н, д, J=2,2), 6,98 (1 Н, с), 6,89 (1 Н, д, J=8,5), 6,77(2 Н, м), 2,86 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-пиридил-4-илакрилонитрила (соединение 30). 4-Пиридинкарбоксальдегид (2,14 г) подвергают реакции конденсации с 3,4-диметоксибензилианидом (3,54 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 3,36 г,63%). Светло-желтые кристаллы. МС (ESI, m/z): 267 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,73 (2 Н, д, J=6,3), 7,69 (2 Н, д, J=6,3), 7,36 (1 Н, с), 7,31 (1 Н, дд, J=2,4, 8,8), 7,17(1 Н, д, J=2,4), 6,95 (1 Н, д, J=8,8), 3,97 (3H, с), 3,95 (3H, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила (соединение 31). 0,1 н. Хлористо-водородную кислоту (12,4 мл) добавляют к соединению 30 (300 мг) и к полученной смеси добавляют очищенную воду (25 мл) и ацетонитрил (20 мл) для растворения смеси. Полученный раствор перемешивают в темноте при комнатной температуре в течение 4 ч и растворитель выпаривают досуха. Остаток суспендируют в смеси гексан-этилацетат и растворитель выпаривают досуха, с последующей тщательной сушкой, получая целевой продукт (выход: 333 мг, 98%). Желтовато-оранжевый порошок. МС (ESI, m/z): 267 (М-HCl+Н)+. 1 Н-ЯМР (ДМСО-d6) : 8,94 (2 Н, д, J=5,4), 8,20 (3H, уш.с), 7,46 (1 Н, д, J=2,2), 7,39 (1 Н, дд, J=2,2, 8,5),7,15 (1 Н, д, J=8,5), 3,88 (3H, с), 3,85 (3H, с). Получение метансульфоната (Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила (соединение 32). Водный раствор метансульфоновой кислоты, 0,1 моль/л (10,0 мл), добавляют к соединению 30 (266 мг) и к полученному раствору добавляют очищенную воду (10 мл) и ацетонитрил (5 мл) для растворения смеси. Полученный раствор перемешивают в темноте при комнатной температуре в течение 3 ч и растворитель выпаривают досуха. Остаток суспендируют в метаноле и растворитель выпаривают досуха, с последующей тщательной сушкой, получая целевой продукт (выход: 350 мг, 97%). Желтовато-оранжевые кристаллы. МС (ESI, m/z): 267 (M-CH3SO3H+H)+. 1 Н-ЯМР (ДМСО-d6) : 9,01 (2 Н, д, J=6,8), 8,35 (2 Н, д, J=6,8), 8,22 (1 Н, с), 7,45 (1 Н, д, J=2,0), 7,39- 14014555 Получение N-оксида (Z)-2-(3,4-диметоксифенил)-3-пиридин-4-илакрилонитрила (соединение 33). Соединение 30 (266 мг) растворяют в безводном дихлорметане (50 мл). К полученному раствору добавляют по каплям м-хлорпероксибензойную кислоту (266 мг) при перемешивании на ледяной бане. Смесь перемешивают в течение 15 мин в атмосфере аргона, который вводят из баллона, заполненного аргоном. Далее смесь снова доводят до комнатной температуры и затем перемешивают в течение примерно 3 ч. Реакционную смесь экстрагируют очищенной водой и хлороформом. Органический слой промывают насыщенным раствором соли и промытый органический слой сушат над безводным сульфатом натрия. Растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем(хлороформ-метанол) с получением целевого продукта (выход: 265 мг, 94%). Желтые кристаллы. МС (ESI, m/z): 283 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,23 (2 Н, д, J=7,3), 7,79 (2 Н, д, J=7,3), 7,29 (1 Н, дд, J=2,4, 8,3), 7,26 (1 Н, с), 7,13(1 Н, д, J=2,4), 6,94 (1 Н, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-пиридин-3-илакрилонитрила (соединение 34). 3-Пиридинкарбоксальдегид (2,14 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (3,54 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 4,79 г,90%). Светло-желтые кристаллы. МС (ESI, m/z): 267 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,83 (1 Н, д, J=2,4), 8,64 (1 Н, дд, J=1,5, 4,9), 8,44-8,48 (1 Н, м), 7,40-7,45 (2 Н, м),7,30 (1 Н, дд, J=2,0, 8,3), 7,16 (1 Н, д, J=2,0), 6,94 (1 Н, д, J=8,3), 3,98 (3H, с), 3,95 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(6-метоксипиридин-3-ил)акрилонитрила (соединение 35). 6-Метокси-3-пиридинкарбоксальдегид (411 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (532 мг) по способу А (стадия получения 2) с получением целевого продуктаH-ЯМР (CDCl3) : 8,40-8,45 (1 Н, м), 8,42 (1 Н, с), 7,34 (1 Н, с), 7,25 (1 Н, дд, J=2,2, 8,5), 7,13 (1 Н, д,J=2,2), 6,92 (1 Н, д, J=8,5), 6,85 (1 Н, м), 4,00 (3H, с), 3,97 (3H, с), 3,93 (3H, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-пиридин-3-илакрилонитрила (соединение 36). 0,1 н. Хлористо-водородную кислоту (21,0 мл) добавляют к соединению 34 (500 мг) и к смеси добавляют очищенную воду (40 мл), ацетонитрил (50 мл) и хлороформ (1 мл) для растворения смеси. Полученный раствор перемешивают в темноте при комнатной температуре в течение 3 ч и растворитель выпаривают досуха. Осажденные кристаллы тщательно сушат с получением целевого продукта (выход: 550 мг, 97%). Желтые кристаллы. МС (ESI, m/z): 267 (М-HCl+Н)+. 1 Н-ЯМР (ДМСО-d) : 9,12 (1 Н, уш.с), 8,80 (1 Н, уш.д, J=4,8), 8,65 (1 Н, уш.д, J=8,3), 8,14 (1 Н, с), 7,88(соединение 37). 0,1 н. Хлористо-водородную кислоту (2,0 мл) добавляют к соединению 35 (50 мг) и к полученной смеси добавляют очищенную воду (8 мл) и ацетонитрил (8 мл) для растворения смеси. Полученный раствор перемешивают в темноте при комнатной температуре в течение 4 ч и растворитель выпаривают досуха. Осажденные кристаллы тщательно сушат с получением целевого продукта (выход: 55 мг, 98%). Желтые кристаллы. МС (ESI, m/z): 297 (М-HCl+Н)+. 1H-ЯМР (ДМСО-d6) : 8,63 (1 Н, д, J=2,4), 8,35 (1 Н, дд, J=2,4, 8,8), 7,33 (1 Н, д, J=2,2), 7,25 (1 Н, дд,J=2,2, 8,5), 7,08 (1 Н, д, J=8,5), 7,02 (1 Н, д, J=8,8), 3,93 (3H, с), 3,86 (3H, с), 3,81 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-пиридин-2-илакрилонитрила (соединение 38). 2-Пиридинкарбоксальдегид (2,14 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (3,54 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 3,77 г,71%). Светло-желтые кристаллы. МС (ESI, m/z): 267 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,73-8,77 (1 Н, м), 8,01 (1 Н, д, J=8,3), 7,81 (1 Н, м), 7,57 (1 Н, с), 7,36 (1 Н, дд, J=2,2,8,5), 7,31 (1 Н, дд, J=4,9, 7,8), 7,23 (1 Н, д, J=2,4), 6,94 (1 Н, д, J=8,3), 3,96 (3H, с), 3,94 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(1 Н-пиррол-2-ил)акрилонитрила (соединение 39). Пиррол-2-карбоксальдегид (951 мг) растворяют в дихлорметане (50 мл) и к раствору добавляют дитрет-бутилдикарбонат (2,40 г), 4-диметоксиаминопиридин (61 мг) и триэтиламин (1,01 г), затем полученную смесь перемешивают при комнатной температуре в течение 30 минут. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем (хлороформ) с получением третбутил-2-формилпиррол-1-карбоксилата (выход: 1,95 г, примерно 100%). Полученный трет-бутил-2 формилпиррол-1-карбоксилат (976 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (886 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 300 мг,- 15014555 24%). Желтый порошок. MC (ESI, m/z): 253 (М-Н)-. 1 Н-ЯМР (CDCl3) : 9,74 (1 Н, уш.с), 7,28 (1 Н, с), 7,15 (1 Н, дд, J=2,2, 8,3), 7,05 (2 Н, м), 6,90 (1 Н, д,J=8,3), 6,63-6,68 (1 Н, м), 6,32-6,36 (1 Н, м), 3,95 (3H, с), 3,92 (3H, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-(1 Н-пиррол-2-ил)акрилонитрила (соединение 40). 0,1 н. Хлористо-водородную кислоту (4,3 мл) добавляют к соединению 39 (100 мг) и к смеси добавляют ацетонитрил (20 мл) для растворения смеси. Полученный раствор перемешивают в темноте при комнатной температуре в течение 2,5 ч и растворитель выпаривают досуха. Осажденные кристаллы тщательно сушат с получением целевого продукта (выход: 100 мг, 88%). Желтый порошок. MC (ESI, m/z): 253 (М-HCl+Н)+. 1H-ЯМР (ДМСО-d6) : 11,38 (1 Н, уш.с), 7,63 (1 Н, с), 7,02-7,17 (5 Н, м), 6,28-6,32 (1 Н, м), 3,83 (3H, с),3,79 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(3H-имидазол-4-ил)акрилонитрила (соединение 41). 4(5)-имидазолкарбоксальдегид (285 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (532 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 75 г,10%). Светло-желтый порошок. MC (ESI, m/z): 256 (М+Н)+. 1 Н-ЯМР (ДМСО-d6) : 12,5 (1 Н, уш.с), 7,86 (1 Н, с), 7,75 (1 Н, д, J=3,9), 7,25 (1 Н, д, J=2,2), 7,18 (1 Н,дд, J=2,2, 8,5), 7,04 (1 Н, д, J=8,5), 3,84 (3H, с), 3,79 (3H, с). Получение (Z)-3-(3-бензил-2-метилсульфанил-3H-имидазол-4-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 42). 1-Бензил-2-(метилсульфанил)-1 Н-имидазол-5-карбальдегид (465 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (354 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 723 мг, 92%). Желтый порошок. MC (ESI, m/z): 392 (М+Н)+. 1H-ЯМР (CDCl3) : 8,24 (1 Н, с), 7,40-7,30 (3H, м), 7,14-7,10 (2 Н, м), 6,99 (1 Н, дд, J=2,2, 8,5), 6,94 (1 Н,д, J=1,0), 6,83 (1 Н, д, J=8,5), 6,78 (1 Н, д, J=2,2), 5,23 (2 Н, с), 3,89 (3H, с), 3,84 (3H, с), 2,72 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(4-метил-2-фенилтиазол-5-ил)акрилонитрила (соединение 43). 4-Метил-2-фенил-1,3-тиазол-5-карбальдегид (407 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (354 мг) по способу А (стадия получения 2) с получением целевого продуктаH-ЯМР (CDCl3) : 8,06-8,00 (2 Н, м), 7,56 (1 Н, с), 7,49-7,44 (3H, м), 7,25 (1 Н, дд, J=2,2, 8,5), 7,13 (1 Н,д, J=2,2), 6,93 (1 Н, д, J=8,5), 3,97 (3H, с), 3,94 (3H, с), 2,65 (3H, с). Получение (Z)-3-(3,4-диметоксифенил)-2-пиридин-3-илакрилонитрила (соединение 44). 3-Пиридинацетонитрил (1,18 г) подвергают реакции конденсации с 3,4-диметоксибензальдегидом(1,66 г) по способу В (стадия получения 2) с получением целевого продукта (выход: 1,96 г, 74%). Светло-желтые кристаллы. МС (ESI, m/z): 267 (М+Н)+. 1H-ЯМР (CDCl3) : 8,91 (1 Н, д, J=2,7), 8,61 (1 Н, дд, J=1,5, 4,9), 7,92-7,97 (1 Н, м), 7,74 (1 Н, д, J=2,2),7,49 (1 Н, с), 7,36-7,41 (2 Н, м), 6,95 (1 Н, д, J=8,5), 3,98 (3H, с), 3,96 (3H, с). Получение (Z)-3-(3,4-диметоксифенил)-2-пиридин-2-илакрилонитрила (соединение 45). 2-Пиридинацетонитрил (1,18 г) подвергают реакции конденсации с 3,4-диметоксибензальдегидом(1,66 г) по способу В (стадия получения 2) с получением целевого продукта (выход: 2,06 мг, 77%). Светло-желтые кристаллы. МС (ESI, m/z): 267 (М+Н)+. 1H-ЯМР (CDCl3) : 8,61-8,65 (1 Н, м), 8,41 (1H, с), 7,73-7,81 (3H, м), 7,52 (1 Н, дд, J=2,1, 8,3), 7,28 (1 Н,м), 6,96 (1 Н, д, J=8,3), 3,98 (3H, с), 3,96 (3H, с). Получение гидрохлорида (Z)-3-(3,4-диметоксифенил)-2-пиридин-3-илакрилонитрила (соединение 46). 0,1 н. хлористо-водородную кислоту (8,3 мл) добавляют к соединению 44 (200 мг) для растворения и к смеси добавляют очищенную воду (5 мл), с последующим перемешиванием при комнатной температуре в течение 20 минут. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 224 мг, 99%). Желтый порошок. МС (ESI, m/z): 267 (М-HCl+Н)+. 1(1 Н, дд, J=5,1, 8,1), 7,70 (1 Н, д, J=2,2), 7,60 (1 Н, дд, J=2,2, 8,5), 7,17 (1 Н, д, J=8,5), 3,85 (3H, с), 3,82 (3H, с). Получение гидрохлорида (Z)-3-(3,4-диметоксифенил)-2-пиридин-2-илакрилонитрила (соединение 47). 0,1 н. Хлористо-водородную кислоту (4,1 мл) добавляют к соединению 45 (100 мг) и к смеси добавляют ацетонитрил (20 мл) для растворения смеси. Раствор перемешивают в темноте при комнатной тем- 16014555 пературе в течение 1 ч и растворитель выпаривают досуха. Осажденные кристаллы тщательно сушат,получая целевой продукт (выход: 112 мг, 99%). Желтые кристаллы. МС (ESI, m/z): 267 (М-HCl+Н)+. 1H-ЯМР (ДМСО-d6) : 8,63-8,67 (1 Н, м), 8,41 (1 Н, с), 7,92-7,98 (1 Н, м), 7,82 (1 Н, д, J=8,3), 7,76 (1 Н,д, J=2,0), 7,66 (1 Н, дд, J=2,0, 8,3), 7,43 (1 Н, дд, J=4,8, 7,4), 7,16 (1 Н, д, J=8,3), 3,86 (3H, с), 3,83 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламино-этил)метиламино]фуран-2-илакрилонитрила (соединение 48). По методике, используемой на стадии получения 1, аминопроизводное, полученное из N,N,N'триметилэтилендиамина (3,06 г), вводят в 5-бром-2-фуральдегид (1,75 г) с получением 5-(4 метилпиперазин-1-ил)фуран-2-карбальдегида (выход: 1,18 г, 60%). Полученный 5-(4-метилпиперазин-1 ил)фуран-2-карбальдегид (1,18 г) подвергают реакции конденсации с 3,4-диметоксибензилцианидом(1,06 г) по способу А (стадия получения 2) с получением целевого продукта (выход: 2,06 г, 96%). Желтовато-коричневое масло. МС (ESI, m/z): 356 (М+Н)+. 1(1 Н, д, J=3,7), 5,16 (1 Н, д, J=3,7), 3,94 (3H, с), 3,90 (3H, с), 3,53 (2 Н, т, J=7,0), 3,07 (3H, с), 2,56 (2 Н, т,J=3,7), 2,31 (6 Н, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-5-[(2-диметиламиноэтил)метиламино]фуран-2-илакрилонитрила (соединение 49). 0,1 н. Хлористо-водородную кислоту (12,5 мл) добавляют к соединению 48 (404 мг) для растворения и к полученному раствору добавляют очищенную воду (20 мл), с последующим перемешиванием при комнатной температуре в течение 20 мин. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 400 мг, 90%). Желто-коричневый порошок. МС (ESI, m/z): 356 (М-HCl+Н)+. 1(1 Н, д, J=3,7), 5,24 (1 Н, д, J=3,7), 4,03 (2 Н, т, J=7,3), 3,94 (3H, с), 3,91 (3H, с), 3,44 (2 Н, т, J=7,3), 3,11 (3H,с), 2,89 (6 Н, с). Получение гидрохлорида (Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]фуран-2-илакрилонитрила (соединение 50). 0,1 н. Хлористо-водородную кислоту (11,8 мл) добавляют к соединению 28 (410 мг) для растворения и к раствору добавляют очищенную воду (20 мл), с последующим перемешиванием при комнатной температуре в течение 20 мин. Реакционную смесь лиофилизируют с получением целевого продукта (выход: 404 мг, 90%). Желтовато-коричневый порошок. МС (ESI, m/z): 384 (М-HCl+Н)+. 1(1 Н, д, J=3,7), 5,41 (1 Н, д, J=3,7), 4,05-4,12 (2 Н, м), 3,94 (3H, с), 3,91 (3H, с), 3,90-3,94 (6 Н, м), 3,49 (2 Н, с),3,18-3,22 (2 Н, м). Получение моно(1-5-[(Z)-2-циано-2(3,4-диметоксифенил)винил]фуран-2-илпиперидин-4-ил)сукцината (соединение 51). Соединение 26 (800 мг) растворяют в пиридине (4 мл) и к раствору добавляют янтарный ангидрид(1,13 г), с последующим перемешиванием при кипячении с обратным холодильником в течение 2 ч. После завершения реакции к реакционной смеси добавляют метанол, с последующим перемешиванием в течение 30 мин. Растворитель выпаривают досуха и остаток экстрагируют хлороформом и очищенной водой. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток промывают гексаном с получением целевого продукта (выход: 954 мг, 93%). Желтый порошок. МС (ESI, m/z): 453 (М-Н)-. 1(4 мл) и полученный раствор перемешивают при комнатной температуре в течение 2 ч. После завершения реакции к реакционной смеси добавляют метанол, с последующим перемешиванием в течение 30 мин. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем(2,2,2-трихлорэтил)фосфат (376 мг) растворяют в смеси растворителей (5 мл), содержащей пиридин и уксусную кислоту (4:1). К раствору добавляют порошок цинка (353 мг) и все перемешивают при комнатной температуре в течение 4 ч. Нерастворимый порошок цинка удаляют фильтрованием и к фильтрату добавляют смолу IRC748 (NH4+) (11 г), с последующим перемешиванием при комнатной температуре в- 17014555 течение 30 мин. Смолообразное вещество удаляют фильтрованием и растворитель выпаривают досуха. Остаток промывают этанолом с получением целевого продукта (выход: 192 мг, 82%). Желтовато-коричневый порошок. МС (ESI, m/z): 433 (М-Н)-. 1 Н-ЯМР (ДМСО) : 1,68-1,72 (2 Н, м), 1,93-1,99 (2 Н, м), 3,24-3,30 (2 Н, м), 3,60-3,63 (2 Н, м), 3,77 (3H,с), 3,82 (3H, с), 4,27-4,30 (1 Н, м), 5,58 (1 Н, д, J=3,7), 6,96 (1 Н, д, J=3,4), 6,99 (1 Н, д, J=8,5), 7,08 (1 Н, дд,J=2,0, 8,5), 7,15 (1 Н, д, J=2,0), 7,44 (1 Н, с). Получение натриевой соли моно(1-5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]фуран-2-илпиперидин-4-ил)фосфата (соединение 53). К соединению 52 (96 мг) добавляют очищенную воду (10 мл) с образованием суспензии. К полученной суспензии добавляют смолу IRC748 (Na) (2 г), с последующими перемешиванием при комнатной температуре. После растворения исходных веществ смолообразное вещество удаляют фильтрованием и растворитель выпаривают досуха, получая целевой продукт (выход: 93 мг, 96%). Желтовато-коричневый порошок. МС (ESI, m/z): 433 (M-2Na+H)+. 1 Н-ЯМР (D2O) : 1,50-1,53 (2 Н, м), 1,87-1,91 (2 Н, м), 2,96-2,99 (2 Н, м), 3,53-3,66 (2 Н, м), 3,64 (3H, с),3,66 (3H, с), 4,04-4,06 (1 Н, м), 5,31 (1 Н, д, J=3,7), 6,64 (1 Н, д, J=3,9), 6,69-6,72 (2 Н, м), 6,78-6,81 (1 Н, м),6,84 (1 Н, с). Получение (Z)-3-(5-бромфуран-2-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 54). 5-бром-2-фуральдегид (350 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом(354 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 558 мг, 84%). Светло-желтые кристаллы. МС (APCI, m/z): 334 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,23 (1 Н, с), 7,22 (1 Н, д, J=3,7), 7,22 (1 Н, дд, J=2,2, 8,5), 7,08 (1 Н, д, J=2,2), 6,91(1 Н, д, J=8,5), 6,51 (1 Н, д, J=3,7), 3,95 (3H, с), 3,93 (3H, с). Получение (Е)-3-(3,4-диметоксифенил)-2-тиофен-2-илакрилонитрила (соединение 55). 2-Тиофенацетонитрил (246 мг) подвергают реакции конденсации с 3,4-диметоксибензальдегидом(332 мг) по способу В (стадия получения 2) с получением целевого продукта (выход: 262 мг, 48%). Желтые кристаллы. МС (APCI, m/z): 272 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,64 (1 Н, д, J=2,0), 7,31-7,36 (2 Н, м), 7,31 (1 Н, с), 7,28 (1 Н, дд, J=1,2, 5,1), 7,07(1 Н, дд, J=3,7, 5,1), 6,92 (1 Н, д, J=8,5), 3,97 (3H, с), 3,95 (3H, с). Получение (Z)-3-(3,4-диметоксифенил)-2-тиофен-3-илакрилонитрила (соединение 56). 3-тиофенацетонитрил (246 мг) подвергают реакции конденсации с 3,4-диметоксибензальдегидом(332 мг) по способу В (стадия получения 2) с получением целевого продукта (выход: 354 мг, 65%). Светло-желтые кристаллы. МС (APCI, m/z): 272 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,66 (1 Н, д, J=2,0), 7,55 (1 Н, дд, J=1,4, 2,9), 7,40 (1 Н, дд, J=2,9, 5,1), 7,38 (1H, с),7,35 (1H, дд, J=1,4, 5,1), 7,33 (1H, дд, J=2,0, 8,0), 6,92 (1H, д, J=8,0), 3,97 (3H, c), 3,95 (3H, c). Получение натриевой соли моно(1-5-[(Z)-2-циано-2(3,4-диметоксифенил)винил]тиофен-2-илпиперидин-4-ил) сукцината (соединение 57). К соединению 18 (104 мг) добавляют очищенную воду (10 мл) с образованием суспензии. К суспензии добавляют смолу IRC748 (Na) (2 г), с последующим перемешиванием при комнатной температуре. После растворения исходных веществ смолообразное вещество удаляют фильтрованием и растворитель выпаривают досуха с получением целевого продукта (выход: 102 мг, 94%). Желтый порошок. МС (ESI, m/z): 469 (M-Na)-. 1 Н-ЯМР (D2O) : 1,42-1,48 (2 Н, м), 1,64-1,70 (2 Н, м), 2,28-2,32 (2 Н, м), 2,39-2,43 (2 Н, м), 2,72-2,78(2 Н, м), 3,05-3,10 (2 Н, м), 3,52 (3H, с), 3,62 (3H, с), 4,65-4,73 (1 Н, м), 5,67 (1 Н, д, J=3,4), 6,45 (1 Н, д, J=8,1),6,59-6,61 (2 Н, м), 6,83 (1 Н, д, J=3,9), 7,03 (1 Н, с). Получение натриевой соли моно(1-5-[(Z)-2-циано-2(3,4-диметоксифенил)винил]фуран-2-илпиперидин-4-ил)сукцината (соединение 58). К соединению 51 (101 мг) добавляют очищенную воду (10 мл) с образованием суспензии. К суспензии добавляют смолу IRC748 (Na) (2 г), с последующим перемешиванием при комнатной температуре. После растворения исходных веществ смолообразное вещество удаляют фильтрованием и растворитель выпаривают досуха с получением целевого продукта (выход: 96 мг, 91%). Желтый порошок. МС (ESI, m/z): 453 (M-Na)-. 1 Н-ЯМР (D2O) : 1,44-1,52 (2 Н, м), 1,68-1,72 (2 Н, м), 2,31-2,34 (2 Н, м), 2,40-2,45 (2 Н, м), 2,91-2,98(2 Н, м), 3,25-3,33 (2 Н, м), 3,56 (3H, с), 3,59 (3H, с), 4,68-4,76 (1 Н, м), 5,10-5,12 (1 Н, м), 6,44-6,49 (2 Н, м),6,56-6,57 (3H, м). Получение метансульфоната (Z)-2-(3,4-диметоксифенил)-5-[4-(2-гидроксиэтил)пиперазин-1-ил] тиофен-2-илакрилонитрила (соединение 59). К соединению 9 (500 мг) добавляют метансульфоновую кислоту (81,6 мкл) и этанол (10 мл) и смесь нагревают для растворения (наружная температура 70 С). Раствор снова доводят до комнатной температуры, с последующим перемешиванием в течение ночи. Осажденные кристаллы восстанавливают фильтрованием и восстановленные кристаллы промывают последовательно небольшим количеством этанола и- 18014555 гексана. Кристаллы тщательно сушат, получая целевой продукт (выход: 530 мг, 85%). Желтые кристаллы. МС (ESI, m/z): 400 (M-CH3SO3H+H)+. 1 Н-ЯМР (ДМСО-d6) : 7,98 (1 Н, с), 7,45 (1 Н, д, J=4,4), 7,19 (1 Н, д, J=2,2), 7,11 (1 Н, дд, J=2,2, 8,5),7,02 (1 Н, д, J=8,5), 6,42 (1 Н, д, J=4,4), 3,83 (3H, с), 3,78 (3H, с), 3,75-3,83 (4 Н, м), 3,57-3,64 (2 Н, м), 3,253,40 (6 Н, м), 2,30 (3H, с). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-ил-N-(2-диэтиламиноэтил)сукцинамата (соединение 60). Соединение 18 (235 мг) растворяют в метиленхлориде (10 мл) и к раствору добавляют 2-хлор-4,6 диметокси-1,3,5-триазин (105 мг) и N-метилморфолин (66 мкл), с последующим перемешиванием в течение 30 минут при охлаждении льдом. Затем к смеси добавляют N,N-диэтилэтилендиамин (85 мкл) и Nметилморфолин (110 мкл), с последующим перемешиванием при комнатной температуре в течение 17 часов. Растворитель выпаривают досуха и осадок очищают хроматографией на колонке с силикагелем(CHCl3-MeOH) с получением целевого продукта (выход: 287 мг, 95%). Желтый порошок. МС (ESI, m/z): 569 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,60 (1 Н, м), 7,37 (1 Н, с), 7,22 (1 Н, д, J=4,1), 7,13 (1 Н, дд, J=2,2, 8,3), 7,04 (1 Н, д,J=2,2), 6,87 (1 Н, д, J=4,1), 6,05 (1 Н, д, J=8,5 Гц), 4,96-5,00 (1 Н, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2 Н,м), 3,39-3,43 (2 Н, м), 3,25-3,31 (2 Н, м), 3,05-3,17 (6 Н, м), 2,65-2,69 (2 Н, м), 2,56-2,59 (2 Н, м), 2,02-2,12(2 Н, м), 1,97-2,01 (2 Н, м), 1,83-1,90 (2 Н, м), 1,39 (6 Н, т, J=7,3). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-ил-N-(3-диэтиламинопропил)сукцинамата (соединение 61). Соединение 18 (235 мг) растворяют в метиленхлориде (10 мл) и к раствору добавляют 2-хлор-4,6 диметокси-1,3,5-триазин (105 мг) и N-метилморфолин (66 мкл), с последующим перемешиванием в течение 30 мин при охлаждении льдом. Затем к смеси добавляют N,N-диэтил-1,3-диаминопропан (94 мкл) иN-метилморфолин (110 мкл), с последующим перемешиванием при комнатной температуре в течение 17 ч. Растворитель выпаривают досуха и осадок очищают хроматографией на колонке с силикагелем(CHCl3-MeOH) с получением целевого продукта (выход: 279 мг, 90%). Желтый порошок. МС (ESI, m/z): 583 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,60 (1 Н, м), 7,37 (1 Н, с), 7,22 (1 Н, д, J=4,1), 7,13 (1 Н, дд, J=2,2, 8,3), 7,04 (1 Н, д,J=2,2), 6,87 (1 Н, д, J=4,1), 6,05 (1 Н, д, J=8,5), 4,96-5,00 (1 Н, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2 Н, м),3,39-3,43 (2 Н, м), 3,25-3,31 (2 Н, м), 3,05-3,17 (6 Н, м), 2,65-2,69 (2 Н, м), 2,56-2,59 (2 Н, м), 2,02-2,12 (2 Н,м), 1,97-2,01 (2 Н, м), 1,83-1,90 (2 Н, м), 1,39 (6 Н, т, J=7,3).(5,15 г), с последующим перемешиванием при комнатной температуре в течение 1 ч. Далее к смеси добавляют п-толуолсульфонилхлорид (9,43 г), с последующим перемешиванием при кипячении с обратным холодильником в течение 12 ч. После завершения реакции растворитель выпаривают досуха. К остатку добавляют хлороформ (800 мл) и смесь промывают три раза водой. рН водного слоя проверяют по лакмусовой бумажке и доводят до 4-5 с использованием 1 н. водной хлористо-водородной кислоты. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (CHCl3-гексан) с получением целевого продукта (выход: 3,48 г, 76%). Желтый порошок. МС (ESI, m/z): 456 (М +Н)+. 1 Н-ЯМР (CDCl3) : 7,36 (1 Н, с), 7,22 (1 Н, д, J=4,1), 7,13 (1 Н, дд, J=2,2, 8,3), 7,04 (1 Н, д, J=2,2), 6,87(2) Получение п-толуолсульфоната 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил] пиперидин-4-илдиметиламиноацетата (соединение 62). Соединение 6 (370 мг) растворяют в толуоле (80 мл) и к раствору добавляют гидрохлорид N,Nдиметилглицина (140 мг) и моногидрат толуолсульфоновой кислоты (380 мг), с последующим перемешиванием при кипячении с обратным холодильником в течение 5 часов. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем (CHCl3-МеОН) с получением целевого продукта (выход: 38 мг, 7,7%). Желтый порошок. МС (ESI, m/z): 456 (М+Н)+. 1 Н-ЯМР (ДМСО) : 7,94 (1 Н, с), 7,49 (4 Н, д, J=7,8), 7,43 (1 Н, д, J=4,1), 7,17 (1 Н, д, J=2,2), 7,12 (4 Н,д, J=7,8), 7,09 (1 Н, дд, J=2,2, 8,5), 7,00 (1 Н, д, J=8,5), 6,32 (1 Н, д, J=4,1), 5,09-5,12 (1 Н, м), 4,26 (2 Н, с), 3,83- 19014555 Соединение 6 (2,00 г) растворяют в пиридине (50 мл) и к раствору добавляют 1-хлоркарбонил-4 пиперидинопиперидин (2,50 г), с последующим перемешиванием при кипячении с обратным холодильником в течение 2 ч. После завершения реакции к реакционной смеси добавляют метанол, с последующим перемешиванием в течение 30 мин. Растворитель выпаривают при пониженном давлении и остаток экстрагируют хлороформом и очищенной водой. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток перекристаллизовывают из этилацетата с получением целевого продукта (выход: 974 мг, 30%) Желтый порошок. МС (ESI, m/z): 565 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,37 (1 Н, с), 7,22 (1 Н, д, J=4,4), 7,13 (1 Н, дд, J=2,0, 8,3), 7,04 (1 Н, д, J=2,0), 6,87(2 Н, м), 2,74 (2 Н, м), 2,42-2,53 (7 Н, м), 2,01-2,06 (2 Н, м), 1,83-1,85 (4 Н, м), 1,60-1,61 (4 Н, м), 1,45 (4 Н, м). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-ил-4-[1,4']бипиперидинил-1'-ил-4-оксобутилата (соединение 64). Соединение 18 (1,00 г) растворяют в метиленхлориде (20 мл) и к раствору добавляют 2-хлор-4,6 диметокси-1,3,5-триазин (448 мг) и N-метилморфолин (258 мкл), с последующим перемешиванием в течение 30 мин при охлаждении льдом. Затем к смеси добавляют 4-пиперидинопиперидин (429 мг) и Nметилморфолин (430 мкл), с последующим перемешиванием при комнатной температуре в течение 17 часов. Растворитель выпаривают досуха и осадок перекристаллизовывают из этилацетата с получением целевого продукта (выход: 1,37 г, 98%). Желтый порошок. МС (ESI, m/z): 621 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,38 (1 Н, с), 7,22 (1 Н, д, J=4,4), 7,13 (1 Н, дд, J=2,4, 8,3), 7,04 (1 Н, д, J=2,4), 6,87(2 Н, м), 3,00-3,06 (2 Н, м), 2,50-2,72 (11 Н, м), 1,95-2,04 (2H, м), 1,87-1,90 (4 Н, м), 1,65-1,70 (4 Н, м), 1,421,55 (4 Н, м). Получение (Z)-2-(3,4-диметоксифенил)-3-хинолин-4-илакрилонитрила (соединение 65). 4-Хинолинкарбоксальдегид (500 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (564 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 522 мг,52%). Светло-желтые кристаллы. МС (ESI, m/z): 317 (М+Н)+. 1 Н-ЯМР (CDCl3) : 9,04 (1 Н, д, J=4,5), 8,20 (1 Н, д, J=8,5), 8,07 (1 Н, с), 7,99 (1 Н, д, J=8,5), 7,87 (1 Н, д,J=4,5), 7,77-7,81 (1 Н, м), 7,61-7,65 (1 Н, м), 7,39 (1 Н, дд, J=8,5, 2,3), 7,25 (1 Н, д, J=2,3), 6,98 (1 Н, д, J=8,5),4,00 (3H, с), 3,97 (3H, с). Получение (Z)-3-бензо[b]тиофен-3-ил-2-(3,4-диметоксифенил)акрилонитрила (соединение 66). Бензо[b]тиофен-3-карбоксальдегид (200 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (218 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 365 мг, 92%). Светло-желтые кристаллы. МС (APCI, m/z): 322 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,56 (1 Н, с), 7,93 (1 Н, д, J=7,3), 7,89 (1 Н, д, J=7,3), 7,72 (1 Н, с), 7,43-7,51 (2 Н, м),7,32 (1 Н, дд, J=2,3, 8,5), 7,20 (1 Н, д, J=2,3), 6,96 (1 Н, д, J=8,5), 3,99 (3H, с), 3,95 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(1-метил-1 Н-бензимидазол-2-ил)акрилонитрила (соединение 67). 1-Метил-2-формилбензимидазол (200 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (221 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 369 мг, 93%). Светло-желтые кристаллы. МС (ESI, m/z): 320 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,88-7,92 (1 Н, м), 7,37 (1H, с), 7,32-7,39 (4H, м), 7,24 (1 Н, д, J=2,3), 6,94 (1 Н, д,J=8,5), 3,98 (3H, с), 3,95 (3H, с), 3,89 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-(1-метил-1 Н-индол-3 ил) акрилонитрила (соединение 68). 1-Метилиндол-3-карбоксальдегид (200 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (223 мг) по способу А (стадия получения 2) с получением целевого продукта(выход: 292 мг, 73%). Светло-желтые кристаллы. МС (ESI, m/z): 319 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,29 (1 Н, с), 7,78 (1 Н, д, J=8,0), 7,74 (1 Н, с), 7,31-7,36 (1 Н, м), 7,37-7,42 (1 Н, м),7,22-7,28 (3H, м), 7,16 (1 Н, д, J=2,3), 6,93 (1 Н, д, J=8,5), 3,98 (3H, с), 3,93 (3H, с), 3,91 (3H, с). Получение (Z)-3-бензофуран-2-ил-2-(3,4-диметоксифенил)акрилонитрила (соединение 69). 2-Бензофуранкарбоксальдегид (166 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (201 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 265 мг,77%). Желтые кристаллы. МС (APCI, m/z): 306 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,65 (1 Н, уш.д, J=7,8), 7,55 (1 Н, уш.д, J=8,3), 7,48 (1 Н, уш.с), 7,36-7,42 (2 Н, м),7,31 (1 Н, дд, J=2,4, 8,5), 7,29 (1 Н, уш.д, J=7,8), 7,17 (1 Н, д, J=2,4), 6,94 (1 Н, д, J=8,5), 3,98 (3H, с), 3,94 (3H,- 20014555 с). Получение (Z)-2-(2-хлорхинолин-3-ил)-2-(3,4-диметоксифенил)-3-хинолин-4-илакрилонитрила (соединение 70). 2-Хлор-3-хинолинкарбоксальдегид (200 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (185) по способу А (стадия получения 2) с получением целевого продукта(3H, c). Получение (Е)-2-бензотриазол-1-ил-3-(3,4-диметоксифенил)акрилонитрила (соединение 71). 3,4-Диметоксибензальдегид (210 мг) подвергают реакции конденсации с 1 Н-бензотриазол-1 ацетонитрилом (200 мг) по способу В (стадия получения 2) с получением целевого продукта (выход: 133 мг, 34%). Белые кристаллы (бесцветные). МС (ESI, m/z): 307 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,15 (1 Н, уш.д, J=8,5), 7,90 (1 Н, уш.д, J=8,5), 7,83 (1 Н, с), 7,69 (1 Н, д, J=2,2),7,62-7,66 (1 Н, м), 7,47-7,51 (1 Н, м), 7,44 (1 Н, дд, J=2,2, 8,5), 6,99 (1 Н, д, J=8,5), 4,00 (3H, с), 3,99 (3H, с). Получение (Z)-2-бензофуран-3-ил-3-(3,4-диметоксифенил)акрилонитрила (соединение 72). 3,4-диметоксибензальдегид (106 мг) подвергают реакции конденсации с бензотриазол-3 ацетонитрилом (100 мг) по способу В (стадия получения 2) с получением целевого продукта (выход: 110 мг, 57%). Белые игольчатые кристаллы (бесцветные). МС (APCI, m/z): 306 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,97 (1 Н, с), 7,90-7,94 (1 Н, м), 7,69 (1 Н, д, J=2,0), 7,57 (1 Н, с), 7,56-7,58 (1 Н, м),7,35-7,43 (3H, м), 6,95 (1 Н, д, J=8,5), 3,99 (3H, с), 3,96 (3H, с). Получение (Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 73). 2-Хлор-6-метокси-3-хинолинкарбоксальдегид (500 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (400 мг) по способу А (стадия получения 2) с получением целевого продукта(выход: 784 мг, 91%). Светло-желтые кристаллы. МС (ESI, m/z): 381 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,78 (1 Н, с), 7,93 (1H, д, J=9,3), 7,82 (1H, с), 7,44 (1H, дд, J=2,9, 9,3), 7,36 (1H, дд,J=2,2, 8,5), 7,22 (1H, д, J=2,2), 7,19 (1H, д, J=2,9), 6,97 (1H, д, J=8,5), 4,00 (3H, c), 3,97 (3H, c), 3,96 (3H, c). Получение (Е)-2-бензотиазол-2-ил-3-(3,4-диметоксифенил)акрилонитрила (соединение 74). 3,4-Диметоксибензальдегид (191 мг) подвергают реакции конденсации с 2-бензотиазолацетонитрилом (200 мг) по способу В (стадия получения 2) с получением целевого продукта (выход: 330 мг, 89%). Желтый порошок. МС (ESI, m/z): 323 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,18 (1 Н, с), 8,05-8,08 (1 Н, м), 7,89-7,92 (1 Н, м), 7,83 (1 Н, д, J=2,2), 7,50-7,55 (2 Н,м), 7,40-7,44 (1 Н, м), 6,97 (1 Н, д, J=8,5), 3,99 (3H, с), 3,98 (3H, с). Получение (Z)-3-(2,3-дигидробензофуран-5-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 75). 2,3-Дигидробензофуран-5-карбоксальдегид (150 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (180 мг) по способу А (стадия получения 2) с получением целевого продукта(1 Н, д, J=2,2), 6,91 (1 Н, д, J=8,5), 6,85 (1 Н, д, J=8,5), 4,66 (2 Н, т, J=8,7), 3,96 (3H, с), 3,92 (3H, с), 3,29 (2 Н,т, J=8,7). Получение (Z)-2-(3,4-диметоксифенил)-3-[5-(4-фторфенил)изоксазол-3-ил]акрилонитрила (соединение 76). 5-(4-Фторфенил)изоксазол-3-карбоксальдегид (200 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (185 мг) по способу А (стадия получения 2) с получением целевого продукта(выход: 150 мг, 41%). Желтый порошок. МС (ESI, m/z): 351 (М+Н)+. 1 Н-ЯМР (CDCl3) : 3,95 (3H, с), 3,98 (3H, с), 6,95 (1 Н, д, J=8,5), 7,18-7,24 (3H, м), 7,35 (1 Н, дд, J=2,3,8,5), 7,44 (1 Н, с), 7,59 (1 Н, с), 7,87 (2 Н, дд, J=2,5, 9,5). Получение (Z)-2-(3,4-диметоксифенил)-3-[5-(4-метоксифенил)изоксазол-3-ил]акрилонитрила (соединение 77). 5-(4-Метоксифенил)изоксазол-3-карбоксальдегид (200 мг) подвергают реакции конденсации с 3,4 диметоксибензилцианидом (174 мг) по способу А (стадия получения 2) с получением целевого продукта Н-ЯМР (CDCl3) : 7,81 (1 Н, д, J=9,4), 7,59 (1 Н, с), 7,37 (1 Н, с), 7,35 (1 Н, дд, J=2,2, 8,5), 7,19 (1 Н, д,J=2,2), 7,01 (2 Н, д, J=9,4), 6,95 (1 Н, д, J=8,5), 3,97 (3H, с), 3,95 (3H, с), 3,89 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-хинолин-2-илакрилонитрила (соединение 78). 2-Хинолинкарбоксальдегид (200 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (225 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 252 мг, 63%). Желтый порошок. МС (ESI, m/z): 316 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,27 (1 Н, д, J=8,5), 8,18 (1 Н, д, J=8,5), 8,15 (1 Н, д, J=8,5), 7,86 (1 Н, уш.д, J=8,5),7,76 (1 Н, с), 7,74-7,80 (1 Н, м), 7,58-7,62 (1 Н, м), 7,43 (1 Н, дд, J=2,2, 8,3), 7,29 (1 Н, д, J=2,2), 6,96 (1 Н, д,J=8,3), 3,99 (3H, с), 3,96 (3H, с). Получение (Z)-2-(2-хлор-6-метоксихинолин-3-ил)-2-пиридин-2-илакрилонитрила (соединение 79). 2-Хлор-6-метоксихинолинкарбоксальдегид (222 мг) подвергают реакции конденсации с 2 пиридинацетонитрилом (118 мг) по способу В (стадия получения 3) с получением целевого продукта(выход: 311 мг, 97%). Светло-желтые кристаллы. MC (ESI, m/z): 322 (M+H)+. 1 Н-ЯМР (CDCl3) : 8,883 (1 Н, с), 8,875 (1H, с), 8,71-8,74 (1H, м), 7,94 (1H, д, J=9,1), 7,83-7,87 (2H, м),7,46 (1 Н, д, J=2,8, 9,1), 7,35-7,39 (1 Н, м), 7,21 (1H, д, J=2,8), 3,97 (3H, с). Получение (Z)-3-(2-хлор-6-метоксихинолин-3-ил)-2-пиридин-3-илакрилонитрила (соединение 80). 2-Хлор-6-метоксихинолинкарбоксальдегид (222 мг) подвергают реакции конденсации с 3 пиридинацетонитрилом (118 мг) по способу В (стадия получения 3) с получением целевого продукта(1 Н, с), 7,95 (1 Н, д, J=9,0), 7,44-7,50 (2 Н, м), 7,21 (1 Н, д, J=2,7), 3,97 (3H, с). Получение (Е)-3-(2-хлор-6-метоксихинолин-3-ил)-2-тиофен-2-илакрилонитрила (соединение 81). 2-Хлор-6-метоксихинолинкарбоксальдегид (222 мг) подвергают реакции конденсации с 2 тиофенацетонитрилом (123 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 301 мг, 92%). Светло-желтые кристаллы. MC (ESI, m/z): 327 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,77 (1 Н, с), 7,92 (1 Н, д, J=9,3), 7,79 (1 Н, с), 7,50 (1 Н, дд, J=1,2, 3,7), 7,44 (1 Н, дд,J=2,7, 9,3), 7,42 (1 Н, дд, J=1,5, 6,6), 7,18 (1 Н, д, J=2,7), 7,14 (1 Н, дд, J=3,7, 5,1), 3,96 (3H, с). Получение (Z)-2-(2-хлор-6-метоксихинолин-3-ил)-2-тиофен-3-илакрилонитрила (соединение 82). 2-Хлор-6-метоксихинолинкарбоксальдегид (222 мг) подвергают реакции конденсации с 3-тиофенацетонитрилом (123 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 273 мг, 83%). Светло-желтые кристаллы. МС (ESI, m/z): 327 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,78 (1 Н, с), 7,92 (1 Н, д, J=9,1), 7,85 (1 Н, с), 7,72-7,75 (1 Н, м), 7,46-7,48 (2 Н, м),7,44 (1 Н, дд, J=2,8, 9,1), 7,18 (1 Н, д, J=2,8), 3,96 (3H, с). Получение (Е)-2-бензотриазол-1-ил-3-(2-хлор-6-метоксихинолин-3-ил)акрилонитрила (соединение 83). 2-Хлор-6-метоксихинолинкарбоксальдегид (111 мг) подвергают реакции конденсации с 1 Нбензотриазол-1-ацетонитрилом (79 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 129 мг, 71%). Белый порошок. МС (ESI, m/z): 362 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,85 (1 Н, с), 8,21 (1 Н, д, J=8,3), 8,36 (1 Н, с), 8,00 (1 Н, т, J=9,3), 7,98 (1 Н, т, J=9,3),7,69-7,73 (1 Н, м), 7,53-7,57 (1 Н, м), 7,51 (1 Н, дд, J=2,8, 9,3), 7,24 (1 Н, д, J=2,8), 3,99 (3H, с). Получение (Е)-2-бензотриазол-2-ил-3-(2-хлор-6-метоксихинолин-3-ил)акрилонитрила (соединение 84). 2-Хлор-6-метокси-3-хинолинкарбоксальдегид (111 мг) подвергают реакции конденсации с 2 бензотиазолацетонитрилом (87 мг) по способу В (стадия получения 3) с получением целевого продукта(выход: 148 мг, 78%). Желтые кристаллы. МС (ESI, m/z): 378 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,99 (1 Н, с), 8,65 (1 Н, с), 8,17 (1 Н, д, J=8,1), 7,90-7,95 (2 Н, м), 7,55-7,61 (1 Н, м),7,46-7,52 (2 Н, м), 7,22 (1 Н, д, J=2,7), 3,98 (3H, с). Получение (Z)-2-пиридин-2-ил-3-хинолин-4-илакрилонитрила (соединение 85). 4-Хинолинкарбоксальдегид (157 мг) подвергают реакции конденсации с 2-пиридинацетонитрилом(118 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 138 мг, 54%). Светло-розовые кристаллы. MC (ESI, m/z): 258 (M+H)+. 1 Н-ЯМР (CDCl3) : 9,22 (1 Н, с), 9,06 (1H, д, J=4,4), 8,72-8,74 (1H, м), 8,21 (1H, Д, J=8,3), 8,10 (1H, д,J=8,3), 7,96 (1H, д, J=4,4), 7,80-7,83 (2H, м), 7,75-7,82 (1H, м), 7,62-7,67 (1H, м), 7,38-7,41 (1H, м). Получение (Z)-2-пиридин-3-ил-3-хинолин-4-илакрилонитрила (соединение 86).- 22014555 4-Хинолинкарбоксальдегид (157 мг) подвергают реакции конденсации с 3-пиридинацетонитрилом(118 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 76 мг, 29%). Белый порошок. MC (ESI, m/z): 258 (М+Н)+. 1 Н-ЯМР (CDCl3) : 9,08 (1 Н, д, J=4,6), 9,07 (1 Н, д, J=2,4), 8,74 (1 Н, д, J=1,6, 4,8), 8,27 (1 Н, с), 8,23(1 Н, д, J=7,8), 8,09 (1 Н, ддд, J=1,7, 2,4, 8,1), 7,98 (1 Н, д, J=8,5), 7,91 (1 Н, д, J=4,8), 7,80-7,84 (1 Н, м), 7,647,68 (1 Н, м), 7,49 (1 Н, дд, J=4,8, 8,1). Получение (Е)-3-хинолин-4-ил-2-тиофен-2-илакрилонитрила (соединение 87). 4-Хинолинкарбоксальдегид (157 мг) подвергают реакции конденсации с 2-тиофенацетонитрилом(123 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 175 мг, 67%). Светло-желтые кристаллы. MC (ESI, m/z): 263 (М+Н)+. 1 Н-ЯМР (CDCl3) : 9,03 (1 Н, д, J=4,4), 8,20 (1 Н, д, J=8,5), 8,03 (1 Н, с), 7,99 (1 Н, д, J=8,5), 7,89 (1 Н,дд, J=0,9, 4,4), 7,78-7,82 (1 Н, м), 7,63-7,67 (1 Н, м), 7,53 (1 Н, дд, J=1,2, 3,7), 7,45 (1 Н, дд, J=1,2, 5,1), 7,16(1 Н, дд, J=3,7, 5,1). Получение (Z)-3-хинолин-4-ил-2-тиофен-3-илакрилонитрила (соединение 88). 4-Хинолинкарбоксальдегид (157 мг) подвергают реакции конденсации с 3-тиофенацетонитрилом(123 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 81 мг, 31%). Желтый порошок. МС (ESI, m/z): 263 (М+Н)+. 1 Н-ЯМР (CDCl3) : 9,03 (1 Н, д, J=4,4), 8,20 (1 Н, д, J=8,4), 8,09 (1 Н, с), 7,98 (1 Н, д, J=8,4), 7,87 (1 Н, д,J=4,4), 7,76-7,82 (2 Н, м), 7,61-7,65 (1 Н, м), 7,50 (1 Н, с), 7,49 (1 Н, с). Получение (Е)-3-бензо[b]тиофен-3-ил-2-тиофен-2-илакрилонитрила (соединение 89). Бензо[b]тиофен-3-карбоксальдегид (81 мг) подвергают реакции конденсации с 2-тиофенацетонитрилом (62 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 40 мг, 30%). Желтый порошок. МС (ESI, m/z): 268 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,55 (1 Н, с), 7,91-7,93 (1 Н, м), 7,89 (1 Н, дд, J=1,2, 7,3), 7,67 (1 Н, с), 7,49 (1 Н, дд,J=1,2, 7,9), 7,46 (1 Н, дд, J=1,2, 7,9), 7,42 (1 Н, дд, J=1,2, 3,7), 7,34 (1 Н, дд, J=1,2, 5,1), 7,11 (1 Н, дд, J=3,7,5,1). Получение (Е)-3-бензо[b]тиофен-3-ил-2-бензотиазол-2-илакрилонитрила (соединение 90). Бензо[b]тиофен-3-карбоксальдегид (81 мг) подвергают реакции конденсации с 2-бензотиазолацетонитрилом (87 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 111 мг,69%). Желтый порошок. МС (ESI, m/z): 319 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,89 (1 Н, с), 8,60 (1 Н, с), 8,11 (1 Н, уш.д, J=8,2), 8,06 (1 Н, уш.д, J=7,8), 7,91-7,96(2 Н, м), 7,53-7,58 (2 Н, м), 7,43-7,52 (2 Н, м). Получение (Z)-3-бензофуран-2-ил-1-бензофуран-3-илакрилонитрила (соединение 91). 2-Бензофуранкарбоксальдегид (73 мг) подвергают реакции конденсации с бензофуран-3 ацетонитрилом (79 мг) по способу В (стадия получения 3) с получением целевого продукта (выход: 110 мг, 77%). Желтый порошок. МС (ESI, m/z): 319 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,06 (1 Н, с), 7,92-7,96 (1 Н, м), 7,66 (1 Н, уш.д, J=7,8), 7,58 (1 Н, с), 7,56-7,60 (2 Н,м), 7,47 (1 Н, с), 7,38-7,45 (3H, м), 7,28-7,32 (1 Н, м). Получение (Е)-2-бензотиазол-2-ил-3-(1-метил-1 Н-индол-3-ил)акрилонитрила (соединение 92). 1-Метилиндол-3-карбоксальдегид(79 мг) подвергают реакции конденсации с 2 бензотиазолацетонитрилом (87 мг) по способу В (стадия получения 3) с получением целевого продукта(выход: 157 мг, 99%). Желтый порошок. МС (ESI, m/z): 316 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,56 (1 Н, с), 8,50 (1 Н, с), 8,03-8,07 (1 Н, м), 7,90-7,94 (1 Н, м), 7,86-7,90 (1 Н, м),7,48-7,53 (1 Н, м), 7,33-7,45 (4 Н, м), 3,95 (3H, с). Получение (Z)-3-(10-хлорантрацен-9-ил)-2-(3,4-диметоксифенил)акрилонитрила (соединение 93). 10-Хлор-9-антральдегид (500 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом(368 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 466 мг, 56%). Желтый порошок. МС (APSI, m/z): 400 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,61 (2 Н, д, J=8,5), 8,27 (1 Н, с), 8,09 (2 Н, д, J=8,5), 7,62-7,68 (2 Н, м), 7,55-7,61(2 Н, м), 7,48 (1 Н, дд, J=2,2, 8,5), 7,35 (1 Н, д, J=2,2), 7,02 (1 Н, д, J=8,5), 4,01 (3H, с), 3,99 (3H, с). Получение (Z)-2-(3,4-диметоксифенил)-3-нафталин-2-илакрилонитрила (соединение 94). 2-Нафтальдегид (500 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом (567 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 872 мг, 86%). Желтый порошок. MC (APSI, m/z): 316 (M+H)+. 1 Н-ЯМР (CDCl3) : 8,27 (1 Н, с), 8,07 (1H, дд, J=1,7, 8,8), 7,84-7,93 (3H, м), 7,59 (1 Н, с), 7,51-7,58 (2 Н,м), 7,32 (1 Н, дд, J=2,2, 8,5), 7,20 (1 Н, д, J=2,2), 6,94 (1 Н, д, J=8,5), 3,99 (3H, с), 3,94 (3H, с). Получение (Z)-3-(3,4-диметоксифенил)-3-фенантрен-9-илакрилонитрила (соединение 95). Фенантрен-9-альдегид (250 мг) подвергают реакции конденсации с 3,4-диметоксибензилцианидом(214 мг) по способу А (стадия получения 2) с получением целевого продукта (выход: 278 мг, 63%). Желтый порошок. MC (APSI, m/z): 366 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,77 (1 Н, д, J=7,8), 8,70 (1 Н, д, J=7,8), 8,26 (1 Н, с), 8,15 (1 Н, д, J=1,2), 7,99-8,02(2 Н, м), 7,70-7,76 (2 Н, м), 7,63-7,68 (2 Н, м), 7,40 (1 Н, дд, J=2,4, 8,3), 7,28 (1 Н, д, J=2,4), 6,99 (1 Н, д, J=8,3),4,00 (3H, с), 3,97 (3H, с). Получение п-толуолсульфоната 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-илдиэтиламиноацетата (соединение 96). Соединение 6 (480 мг) растворяют в толуоле (100 мл) и к раствору добавляют натриевую соль N,N'диэтилглицина (296 мг) и моногидрат п-толуолсульфоновой кислоты (490 мг), с последующим перемешиванием при кипячении с обратным холодильником в течение 5 ч. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем (CHCl3-МеОН) с получением целевого продукта (выход: 237 мг, 37,7%). Желтый порошок. MC (ESI, m/z): 484 (М+Н)+. 1 Н-ЯМР (ДМСО) : 7,94 (1 Н, с), 7,49 (4 Н, д, J=7,8), 7,43 (1 Н, д, J=4,1), 7,17 (1 Н, д, J=2,2), 7,12 (4 Н,д, J=7,8), 7,09 (1 Н, дд, J=2,2, 8,5), 7,00 (1 Н, д, J=8,5), 6,32 (1 Н, д, J=4,1), 5,09-5,12 (1 Н, м), 4,26 (2 Н, с), 3,83(3H, с), 3,78 (3H, с), 3,51-3,55 (2 Н, м), 3,31-3,37 (2 Н, м), 3,22 (4 Н, кв, J=7,1), 2,29 (6 Н, с), 2,02-2,06 (2 Н, м),1,78-1,82 (2 Н, м), 1,21 (6 Н, т, J=7,1). Получение 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-илдиэтилкарбамата (соединение 97). Соединение 6 (150 мг) растворяют в пиридине (1 мл) и к раствору добавляют диэтилкарбамоилхлорид (55 мг), с последующим перемешиванием при кипячении с обратным холодильником в течение 2 ч. После завершения реакции к реакционной смеси добавляют метанол и затем перемешивают еще в течение 30 мин. Растворитель выпаривают досуха и остаток экстрагируют хлороформом и очищенной водой. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток перекристаллизовывают из этилацетата с получением целевого продукта (выход: 40,6 мг, 21,3%). Желтый порошок. МС (ESI, m/z): 470 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,37 (1 Н, с), 7,23 (1 Н, д, J=4,4), 7,13 (1 Н, дд, J=2,2, 8,5), 7,04 (1 Н, д, J=2,2), 6,87(6 Н, м), 2,01-2,08 (2 Н, м), 1,83-1,91 (2 Н, м), 1,14 (6 Н, т, J=7,1). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-ил-N-(2-диэтиламиноэтил)-N-метилсукцинамата (соединение 98). Соединение 18 (500 мг) растворяют в метиленхлориде (10 мл) и к раствору добавляют 2-хлор-4,6 диметокси-1,3,5-триазин (224 мг) и N-метилморфолин (129 мкл), с последующим перемешиванием при охлаждении льдом в течение 30 мин. Затем к смеси добавляют N,N-диэтил-N'-метилэтилендиамин (166 мкл) и N-метилморфолин (215 мкл), с последующим перемешиванием при комнатной температуре в течение 17 ч. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем (CHCl3-MeOH) с получением целевого продукта (выход: 503 мг, 76%). Желтый порошок. MC (ESI, m/z): 583 (M+H)+. 1 Н-ЯМР (CDCl3) : 7,60 (1 Н, м), 7,37 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3), 7,04 (1H, д,J=2,2), 6,87 (1H, д, J=4,1), 6,05 (1H, д, J=8,5 Гц), 4,96-5,00 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2 Н,м), 3,39-3,43 (2 Н, м), 3,25-3,31 (2 Н, м), 3,05-3,17 (6 Н, м), 3,13 (3H, с), 2,65-2,69 (2 Н, м), 2,56-2,59 (2 Н, м),2,02-2,12 (2 Н, м), 1,97-2,01 (2 Н, м), 1,83-1,90 (2 Н, м), 1,39 (6 Н, т, J=7,3). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-ил-N-(4- диэтиламинофенил)сукцинамата (соединение 99). Соединение 18 (500 мг) растворяют в метиленхлориде (10 мл) и к раствору добавляют 2-хлор-4,6 диметокси-1,3,5-триазин (224 мг) и N-метилморфолин (129 мкл), с последующим перемешиванием при охлаждении льдом в течение 30 мин. Затем к смеси добавляют N,N-диэтил-1,4-фенилендиамин (209 мкл) и N-метилморфолин (215 мкл), с последующим перемешиванием при комнатной температуре в течение 17 ч. Растворитель выпаривают досуха и остаток очищают хроматографией на колонке с силикагелем(CHCl3-MeOH) с получением целевого продукта (выход: 322 мг, 40%). Желтый порошок. MC (ESI, m/z): 617 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,91 (1 Н, с), 7,40 (1 Н, д, J=4,4), 7,30 (2 Н, д, J=8,5), 7,17 (1 Н, д, J=2,2), 7,09 (1 Н,дд, J=2,2, 8,3), 7,00 (1 Н, д, J=8,8), 6,57 (2 Н, д, J=8,8), 6,27 (1 Н, д, J=4,1), 4,91-4,95 (1 Н, м), 3,83 (3H, с), 3,78(3H, с), 3,44-3,49 (2 Н, м), 3,25-3,30 (6 Н, м), 2,57-2,60 (4 Н, м), 1,91-1,97 (2 Н, м), 1,71-1,74 (2 Н, м), 1,03 (6 Н,т, J=6,8). Получение кислого сульфата (Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1 ил]тиофен-2-илакрилонитрила (соединение 100). 0,1-моль/л серной кислоты (6,36 мл) и очищенную воду (18,65 мл) добавляют к соединению 9 (500 мг) и смесь нагревают для растворения (наружная температура: 90 С). Раствор снова доводят до комнатной температуры и оставляют выстаиваться в течение ночи. Осажденные кристаллы собирают фильтрованием и восстановленные кристаллы промывают последовательно небольшим количеством очищенной- 24014555 воды и гексана. Кристаллы тщательно сушат с получением целевого продукта (выход: 560 мг, примерно 100%). Желтовато-оранжевые кристаллы. МС (ESI, m/z): 400 (М-0,5H2SO4+H)+. 1 Н-ЯМР (ДМСО-d6) : 7,95 (1 Н, с), 7,43 (1 Н, д, J=4,4), 7,18 (1 Н, д, J=2,2), 7,10 (1 Н, дд, J=2,2, 8,5),7,01 (1 Н, д, J=8,5), 6,35 (1 Н, д, J=4,4), 3,83 (3H, с), 3,78 (3H, с), 3,62-3,68 (2 Н, м), 3,38-3,50 (4 Н, м), 2,853,05 (6 Н, м). Получение сульфата (Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]тиофен 2-илакрилонитрила (соединение 101). К соединению 9 (500 мл) добавляют 0,1-моль/л серной кислоты (12,70 мг) и очищенную воду (12,30 мл) и смесь нагревают для растворения (наружная температура: 90 С). Раствор снова доводят до комнатной температуры и оставляют выстаиваться в течение ночи. Осажденные кристаллы собирают фильтрованием и восстановленные кристаллы промывают последовательно небольшим количеством очищенной воды и гексана. Кристаллы тщательно сушат с получением целевого продукта (выход: 564 мг, 91%). Желтовато-оранжевые кристаллы. МС (ESI, m/z): 400 (M-H2SO4+H)+. 1 Н-ЯМР (ДМСО-d6) : 7,95 (1 Н, с), 7,43 (1 Н, д, J=4,4), 7,18 (1 Н, д, J=2,2), 7,10 (1 Н, дд, J=2,2, 8,5),7,01 (1 Н, д, J=8,5), 6,35 (1 Н, д, J=4,4), 3,83 (3H, с), 3,78 (3H, с), 3,62-3,68 (2 Н, м), 3,38-3,50 (4 Н, м), 2,833,07 (6 Н, м). Получение нитрата (Z)-2-(3,4-диметоксифенил)-3-5-[4-(2-гидроксиэтил)пиперазин-1-ил]тиофен-2 илакрилонитрила (соединение 102). К соединению 9 (500 мл) добавляют 0,1-моль/л серной кислоты (12,70 мг) и очищенную воду (12,30 мл) и смесь нагревают для растворения (наружная температура: 90 С). Раствор снова доводят до комнатной температуры и оставляют выстаиваться в течение ночи. Осажденные кристаллы собирают фильтрованием и восстановленные кристаллы промывают последовательно небольшим количеством очищенной воды и гексана. Кристаллы тщательно сушат с получением целевого продукта (выход: 530 мг, 91%). Желтые кристаллы. МС (ESI, m/z): 400 (M-HNO3+H)+. 1 Н-ЯМР (ДМСО-d6) : 9,67 (1 Н, уш.с), 7,98 (1 Н, с), 7,45 (1 Н, д, J=4,4), 7,20 (1 Н, д, J=2,2), 7,12 (1 Н,дд, J=2,2, 8,5), 7,02 (1 Н, д, J=8,5), 6,42 (1 Н, д, J=4,4), 5,42 (1 Н, уш.с), 3,84 (3H, с), 3,79 (3H, с), 3,75-3,83(4 Н, м), 3,57-3,64 (2 Н, м), 3,25-3,40 (6 Н, м). Получение 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин-4-илдиэтиламиноацетата (соединение 103). Соединение 6 (3,70 г) растворяют в пиридине (100 мл) и к раствору добавляют натриевую сольN,N'-диэтилглицина (7,66 г), с последующим перемешиванием при комнатной температуре в течение 1 ч. Затем к смеси добавляют п-толуолсульфонилхлорид (9,43 г), с последующим перемешиванием при кипячении с обратным холодильником в течение 12 ч. После завершения реакции растворитель выпаривают при пониженном давлении. К остатку добавляют хлороформ (1000 мл) и смесь промывают водой три раза. Проверяют рН водного слоя с помощью лакмусовой бумаги и доводят рН до 4-5 с использованием 1 н. водного раствора хлористо-водородной кислоты. Органический слой сушат над безводным сульфатом натрия и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (CHCl3-гексан) с получением целевого продукта (выход: 3,62 г, 75%). Желтый порошок. МС (ESI, m/z): 484 (М+Н)+. 1 Н-ЯМР (CDCl3) : 7,36 (1 Н, с), 7,22 (1 Н, д, J=4,6), 7,13 (1 Н, дд, J=2,2, 8,5), 7,04 (1 Н, д, J=2,2), 6,87(1 Н, д, J=8,5), 6,05 (1 Н, д, J=4,4), 5,03-5,07 (1 Н, м), 3,94 (3H, с), 3,91 (3H, с), 3,52-3,58 (2 Н, м), 3,34 (2 Н, с),3,25-3,31 (2 Н, м), 2,67 (4 Н, кв, J=7,1), 2,02-2,07 (2 Н, м), 1,82-1,90 (2 Н, м), 1,07 (6 Н, т, J=7,1). Получение гидрохлорида 1-[5-[(Z)-2-циано-2-(3,4-диметоксифенил)винил]тиофен-2-ил]пиперидин 4-илдиметиламиноацетата (соединение 104). К соединению 62 (150 мг) добавляют этанол (5 мл) и 12 н. хлористо-водородную кислоту (28 мкл) и смесь нагревают для растворения (наружная температура: 40 С). Раствор снова доводят до комнатной температуры и оставляют выстаиваться в течение ночи. Осажденные кристаллы отделяют фильтрованием и восстановленные кристаллы перекристаллизовывают из изопропанола с получением целевого продукта (выход: 78,7 мг, 48,6%). Желтый порошок. МС (ESI, m/z): 456 (М-HCl+Н)+. 1 Н-ЯМР (CDCl3) : 7,37 (1 Н, с), 7,22 (1 Н, д, J=4,1), 7,13 (1 Н, дд, J=2,2, 8,3), 7,04 (1 Н, д, J=2,2), 6,88(59 мкл) и смесь нагревают для растворения (наружная температура: 80 С). Раствор снова доводят до комнатной температуры и оставляют выстаиваться в течение ночи. Осажденные кристаллы собирают фильтрованием и восстановленные кристаллы перекристаллизовывают из изопропанола с получением целевого продукта (выход: 254,5 мг, 70,0%).(1 Н, д, J=8,5), 6,07 (1 Н, д, J=4,5), 5,10-5,15 (1 Н, м), 3,95 (3H, с), 3,91 (2 Н, с), 3,91 (3H, с), 3,54-3,60 (2 Н, м),3,39 (4 Н, кв, J=7,3), 3,26-3,32 (2 Н, м), 2,07-2,12 (2 Н, м), 1,88-1,96 (2 Н, м), 1,48 (6 Н, т, J=7,3). Пример 2. Эффект устранения резистентности клеток A549/SN-38-4 к противораковому агенту. Эффект соединения настоящего изобретения на BCRP-опосредованную резистентность к противораковому агенту исследуют с использованием клеток рака легкого человека A549/SN-38-4 (см. международную публикацию WO 2004/069233), которые имеют приобретенную резистентность к противораковому агенту за счет экспрессии BCRP. Клетки рака легкого человека А 549 или клетки A549/SN-38-4 суспендируют в среде Хэмса F-12, содержащей 10% FBS, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (10% FBS/среда Хэмса F-12), и полученную суспензию инокулируют в лунки 96-луночного микропланшета (2103 клеток/50 мкл/лунка) и затем культивируют в атмосфере 5% CO2 при температуре 37 С в течение ночи. Затем к каждой лунке добавляют раствор 10% FBS/среда Хэмса F-12 (25 мкл), содержащий соединения 1-102 настоящего изобретения, и добавляют SN-38, затем культивируют в атмосфере 5%CO2 при температуре 37 С в течение 48 ч. После завершения культивирования подсчитывают количество жизнеспособных клеток с использованием реагента для подсчета жизнеспособных клеток [TetraColorONE (торговая марка), продукт Seikagaku Corporation], в соответствии с инструкцией производителя. В таблицах 1-4 проиллюстрирован эффект каждого из производных акрилонитрила на устранение резистентности клеток SN-38, который представлен как показатель ЕС 50. Показатель "ЕС 50" соответствует концентрации производного акрилонитрила, необходимой для 50% снижения показателя относительной резистентности. Показатели относительно резистентности получают путем деления показателя ЕС 50 (то есть концентрации противоракового агента, необходимой для 50% ингибирования клеточного роста) для клеток A549/SN-38-4 на показатель ЕС 50 для клеток А 549 (исходные клетки). Чем выше показатель относительной резистентности, тем выше уровень приобретенной резистентности. Результаты проведенных тестов показали, что каждое из соединений настоящего изобретения демонстрирует мощный эффект по преодолению SN-38-резистентности клеток A549/SN-38-4. В том случае, когда каждый из производных акрилонитрила используют отдельно, в отсутствие SN-38, рост как А 549, так и A549/SN-38-4 не затрагивается. Это дает основание полагать, что производное акрилонитрила настоящего изобретения ингибирует BCRP, и в этой связи, дает возможность преодолеть резистентность раковых клеток к противораковому агенту или потенцировать чувствительность раковых клеток к противораковому агенту. Таблица 1 1 Пример 3. Эффект по преодолению резистентности к противораковому агенту клеток лейкоза мышей Р 388, трансдуцированных человеческим геном BCRP. Клетки лейкоза мыши Р 388 или клетки Р 388, трансдуцированные геном BCRP человека (клетки(P388/BCRP) (см. JP-A-2003-063989), суспендируют в 10% FBS/RPMI1640, где указанная среда содержит 2-меркаптоэтанол (50 мкМ), и полученную суспензию добавляют в лунки 96-луночного микропланшета(1104 клеток/50 мкл/лунка). После этого к ячейкам добавляют раствор каждого из соединений 1, 14, 21,31, 39 и 41 настоящего изобретения и SN-38 в 10% FBS/RPMI1640 (25 мкл) и затем культивируют в атмосфере 5% CO2 при температуре 37 С в течение 48 ч. После завершения культивирования подсчитывают количество жизнеспособных клеток с использованием реагента для подсчета жизнеспособных клетокTetraColor ONE, в соответствии с инструкцией производителя. Результаты показаны на фиг. 1. Каждое из исследованных соединений настоящего изобретения демонстрирует мощный эффект по устранению резистентности клеток P388/BCRP к SN-38, но не влияет на чувствительность клеток Р 388 к SN-38. Использование только одного производного акрилонитрила не влияет на пролиферацию клеток Р 388 и клеток P388/BCRP. Это указывает на то, что производное акрилонитрила настоящего изобретения обладаетBCRP-ингибирующим эффектом. Пример 4. Эффект на множественную лекарственную резистентность клеток лейкоза человекаK562, трансдуцированных MDR1 геном человека. Клетки лейкоза человека K562 или клетки K562, трансдуцированные геном MDR1 человека (клеткиK562/MDR) (см., Mutat. Res., 1998, 401: 133-141), суспендируют в 10% FBS/RPMI1640 и полученную суспензию добавляют в лунки 96-луночного микропланшета (1103 клеток/50 мкл/лунка). Затем в лунки добавляют раствор паклитаксела и каждого из соединений, перечисленных в табл. 5 и 6, в 10%FBS/RPMI1640 (25 мкл), с последующим культивированием в атмосфере 5% CO2 при температуре 37 С в течение 72 ч. После завершения культивирования подсчитывают количество жизнеспособных клеток с использованием технологии TetraColor ONE, в соответствии с инструкцией производителя. В табл. 5 и 6 проиллюстрирован эффект каждого из исследованных производных акрилонитрила на множественную лекарственную устойчивость, по результатам оценки EC50. Параметр ЕС 50 соответствуют концентрации производного акрилонитрила, необходимой для 50% снижения показателя относительной резистентности. В результате было показано, что большая часть производных акрилонитрила настоящего изобретения не влияет на резистентность клеток K562/MDR к паклитакселу. Кроме того, в том случае, когда концентрация производного акрилонитрила попадает в диапазон концентраций, используемых для данного теста, производное акрилонитрила per se не влияет на рост клеток K562 и клеток K562/MDR. Эти данные указывают на то, что производное акрилонитрила настоящего изобретения не действует на Пгликопротеин и обладает высокой специфичностью к BCRP.
МПК / Метки
МПК: A61K 31/4184, A61K 31/4164, A61K 31/381, A61K 31/426, A61K 31/345, A61K 31/404, A61K 31/42, A61K 31/341, C07D 207/337, A61K 31/277, A61K 31/40
Метки: ингибитор
Код ссылки
<a href="https://eas.patents.su/30-14555-ingibitor-bcrp-abcg2.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибитор bcrp/abcg2</a>
Предыдущий патент: 7- аминоалкилиденил-гетероциклические хинолоны и нафтиридоны
Следующий патент: Производные ксантина в качестве селективных агонистов hm74a
Случайный патент: Способ изготовления огнеупоров на основе смешанных вквс боксита и кварцевого стекла












