Новые замещенные 4-фенил-4-[1н-имидазол-2-ил] пиперидиновые производные и их применение в качестве селективных непептидных агонистов дельта-опиоидов
Номер патента: 6507
Опубликовано: 29.12.2005
Авторы: Янссенс Франс Эдуард, Ленартс Йозеф Элизабет, Мерт Тео Франс, Гомес-Санчес Антонио, Фернандес-Гадеа Франсиско Хавьер
Формула / Реферат
1. Соединение формулы (I)
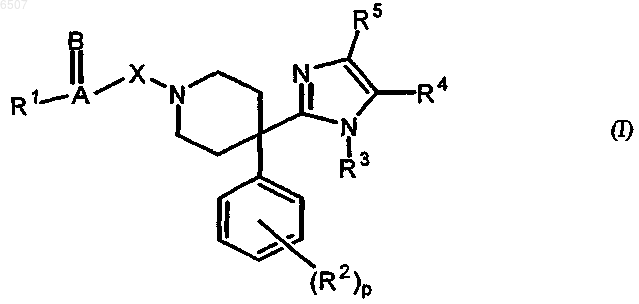
где A=B представляет собой двухвалентный радикал с p-связью;
X представляет собой ковалентную связь, -CH2- или CH2CH2-;
R1 представляет собой водород, гидрокси, алкилокси, алкилкарбонилокси, Ar-окси, Het-окси, Ar-карбонилокси, Het-карбонилокси, Ar-алкилокси, Het-алкилокси, алкил, полигалогеналкил, алкилоксиалкил, Ar-алкил, Het-алкил, Ar, Het, тио, алкилтио, Ar-тио, Het-тио или NR9R10, где R9 и R10, каждый независимо, представляют собой водород, алкил, Ar, Ar-алкил, Het, Het-алкил, алкилкарбонил, Ar-карбонил, Het-карбонил или алкилоксикарбонилалкил;
или A=B и R1 вместе образуют необязательно замещенный полуароматический или ароматический карбоциклический или гетероциклический радикал Het2 или Het3;
R2 представляет собой гидрокси, алкилокси, алкилкарбонилокси, фенилокси, фенилкарбонилокси, галоген, циано, алкил, полигалогеналкил, алкилоксиалкил, формил, карбокси, алкилкарбонил, алкилоксикарбонил, аминокарбонил, моно- или диалкиламинокарбонил, фенил, нитро, амино, моно- или диалкиламино, тио или алкилтио;
R3 представляет собой алкил, Ar, Ar-алкил, Ar-алкенил, Het, Het-алкил или Het-алкенил;
R4, R5, каждый независимо, представляет собой водород, алкил, карбокси, аминокарбонил, алкилоксикарбонил, галоген или гидроксиалкил;
р равен целому числу, равному нулю, 1, 2 или 3;
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал (циклоалкил) с 3-7 атомами углерода, или циклический насыщенный углеводородный радикал с 3-7 атомами углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу с 1-6 атомами углерода, где каждый атом углерода может быть, необязательно, замещен амино, нитро, тио, гидрокси, оксо, циано, формилом или карбокси;
алкенил представляет собой алкил, содержащий одну или несколько двойных связей;
Ar представляет собой гомоциклическое ядро, выбранное из группы, состоящей из фенила и нафтила, каждый из которых, необязательно, замещен одним или несколькими заместителями, где каждый заместитель независимо выбран из группы, состоящей из гидрокси, алкилокси, фенилокси, фенилкарбонилокси, полигалогеналкилокси, галогена, циано, алкила, полигалогеналкила, алкилоксиалкила, формила, галогенформила, карбокси, алкилкарбонила, алкилоксикарбонила, аминокарбонила, моно- или диалкиламинокарбонила, фенилалкила, фенила, нитро, амино, моно- или диалкиламино, тио, алкилтио или SO2-CH3;
галоген представляет собой заместитель, выбранный из фтора, хлора, брома и иода;
полигалогеналкил представляет собой линейный или разветвленный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-7 атомами углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена;
Het представляет собой гетероциклический радикал, выбранный из группы, состоящей из Het1, Het2 и Het3;
Het1 представляет собой алифатический моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, диоксила, морфолинила, дитианила, тиоморфолинила, пиперазинила и тетрагидрофурила;
Het2 представляет собой полуароматический моноциклический гетероциклический радикал, выбранный из группы, состоящей из 2H-пирролила, пирролинила, имидазолинила и пиразолинила;
Het3 представляет собой ароматический моноциклический гетероциклический радикал, выбранный из группы, включающей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил или триазинил; или ароматический бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый моноциклический и бициклический гетероциклический радикал может быть, необязательно, замещен по атому углерода и/или гетероатому галогеном, гидрокси, алкилокси, алкилом, Ar, Ar-алкилом или пиридинилом;
его фармацевтически приемлемая соль присоединения кислоты или основания, его стереохимически изомерные формы, их таутомерные формы и его N-оксиды.
2. Соединение по п.1, отличающееся тем, что A=B выбран из группы, состоящей из C=O, C=N-R6, где R6 представляет собой водород или циано, C=S, S=O, SO2 и C=CR7R8, где R7 и R8, каждый независимо, представляют собой водород, нитро или алкил.
3. Соединение по любому из пп.1 и 2, отличающееся тем, что R1 выбран из группы, включающей алкилокси, Ar-алкилокси, алкил, полигалогеналкил, алкилоксиалкил, Ar-алкил, Het-алкил, Ar, пиперазинил, пирролил, тиазолил, пирролидинил и NR9R10, где R9 и R10, каждый независимо, представляют собой водород, алкил, Ar, Ar-алкил, пиридинил или алкилоксикарбонилалкил.
4. Соединение по п.1, отличающееся тем, что A=B и R1 вместе образуют радикал, выбранный из группы, состоящей из Het2 и Het3.
5. Соединение по п.4, отличающееся тем, что A=B и R1 вместе образуют радикал, выбранный из группы, состоящей из бензоксазолила, тиазолила, бензотиазолила, бензимидазолила и пиримидинила.
6. Соединение по любому из пп.1-5, отличающееся тем, что X представляет собой ковалентную связь.
7. Соединение по любому из пп.1-6, отличающееся тем, что R2 представляет собой алкилокси или галоген.
8. Соединение по любому из пп.1-7, отличающееся тем, что R3 выбран из группы, состоящей из фенилалкила и нафтила, каждый из которых, независимо, замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, алкилоксикарбонила, гидрокси, алкилокси и диалкиламинокарбонила.
9. Соединение по п.1, отличающееся тем, что A=B представляет собой C=O или SO2, R1 представляет собой алкилокси, алкилоксиалкил, Ar или NR9R10, где R9 и R10, каждый независимо, представляют собой водород или Ar; или A=B и R1 вместе образуют радикал бензоксазолил; р равен нулю, R3 представляет собой бензил, необязательно замещенный гидрокси или алкилоксикарбонилом, и каждый из R4 и R5 представляет собой водород.
10. Соединение по п.1, выбранное из группы, включающей
1-этоксикарбонил-4-фенил-4-[1-(фенилметил)-1H-имидазол-2-ил]пиперидин;
1-пропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1H-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[(4-гидроксифенил)метил]-1H-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-(1-фенилэтил)-1H-имидазол-2-ил]пиперидин;
1-изопропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1H-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[[4-(метоксикарбонил)фенил]метил]-1H-имидазол-2-ил]пиперидин;
1-бензоил-4-фенил-4-[1-(фенилметил)-1H-имидазол-2-ил]пиперидин;
1-(метоксиацетил)-4-фенил-4-[1-(1-фенилэтил)-1H-имидазол-2-ил]пиперидин;
4-[[2-(1-бензоил-4-фенил-4-пиперидинил)-1H-имидазол-1-ил]метил]метилбензоат;
4-[[2-[1-(2-бензоксазолил)-4-фенил-4-пиперидинил]-1H-имидазол-1-ил]метил]метилбензоат;
1-бензоил-4-фенил-4-[1-(1-фенилэтил)-1H-имидазол-2-ил]пиперидин;
1-этоксикарбонил-4-фенил-4-[1-[1-[4-(этоксикарбонил)фенил]этил]-1H-имидазол-2-ил]пиперидин и
N,N-дифенил-4-[1-(фенилметил)-1H-имидазол-2-ил]пиперидинсульфонамид.
11. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и, в качестве активного ингредиентр, терапевтически эффективное количество соединения по любому из пп.1-10.
12. Применение соединения по любому из пп.1-10 для изготовления лекарственного средства для применения при лечении различных состояний боли, таких как, и в частности, боль, опосредуемая центральной нервной системой, боль, опосредуемая периферической нервной системой, боль, связанная с повреждением структурной или мягкой ткани, прогрессирующая боль, связанная с заболеванием, невропатическая боль и острая боль, такая как вызванная острым повреждением, травмой или хирургическим вмешательством, и хроническая боль, такая как вызванная невропатическими состояниями, диабетической периферической невропатией, постгерпетической невралгией, тригеминальной невралгией, болевыми синдромами после удара, "гистаминовой" головной болью или мигренью, артрита, псориаза, астмы, воспалительного заболевания кишечника, расстройства дыхательной функции, функциональной диареи, неязвенной диспепсии, недержания и синдрома раздраженной толстой кишки (IBS).
13. Применение фармацевтической композиции по п.11 для изготовления лекарственного средства для применения при лечении различных состояний боли, таких как, и в частности, боль, опосредуемая центральной нервной системой, боль, опосредуемая периферической нервной системой, боль, связанная с повреждением структурной или мягкой ткани, прогрессирующая боль, связанная с заболеванием, невропатическая боль и острая боль, такая как вызванная острым повреждением, травмой или хирургическим вмешательством, и хроническая боль, такая как вызванная невропатическими состояниями, диабетической периферической невропатией, постгерпетической невралгией, тригеминальной невралгией, болевыми синдромами после удара, "гистаминовой" головной болью или мигренью, артрита, псориаза, астмы, воспалительного заболевания кишечника, расстройства дыхательной функции, функциональной диареи, неязвенной диспепсии, недержания и синдрома раздраженной толстой кишки (IBS).
14. Способ лечения человека, страдающего от любого из состояний, указанных в п.13, включающий введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1-10 или фармацевтической композиции по п.12.
15. Соединение по любому из пп.1-10 где один или несколько атомов могут быть радиоактивным изотопом.
Текст
006507 Настоящее изобретение относится к новым 4-фенил-4-[1 Н-имидазол-2-ил]пиперидиновым производным, способам их получения и их применению в медицине, в частности, в качестве селективных непептидных агонистов d-опиоидов. В настоящее время установлено и подтверждено наличие по меньшей мере трех популяций опиоидных рецепторов (обычно называемых мю-, дельта(d)- и каппа-рецепторами, и оказывается, что все три популяции присутствуют в центральной и периферической нервной системе многих видов,включая человека (Lord J.A.H. et al., Nature, 1977, 267, 495). Модуляция одного или нескольких таких подтипов опиоидных рецепторов может привести к различным эффектам, наблюдаемым на животных моделях, причем возникают уникальные фармакологические профили для каждого рецептора. Например, оказывается, что d-агонисты проявляют аналгезирующее действие (как спинальное, так и супраспинальное) при различных болевых состояниях у мышей,крыс, грызунов, приматов и даже у человека (Moulin et al., Pain, 1985, 23, 213), усиливают высвобождение гормона роста и ингибируют высвобождение допамина, в то время как d-антагонисты не обладают аналгезирующим действием и снижают высвобождение гормона роста (Goodman and Gilman, The Pharmacological Basis of Therapeutics, 9th Edition, McGraw-Hill, 1996, 525). Некоторые эксперименты также наводят на мысль, что у d-аналгетиков также может отсутствовать побочное действие, связанное с активацией - и -рецепторов (Galligan et al., J. Pharm. Exp. Ther., 1984,229, 641). Животные модели также показали, что агонисты d-опиоидных рецепторов могут оказывать непосредственное действие на желудочно-кишечный тракт (например, подавляющее диарею) и дыхательные пути (например, стимулирующее действие на интенсивность дыхания). Кроме того, показано, что агонисты d-опиоидных рецепторов могут играть роль синергистов при различных фармакологических действиях. Действительно, они положительно модулируют центральную антиноцицепцию и противокашлевую активность -агонистов, что приводит к сокращению приема лекарственных средств, приостанавливая нежелательные побочные эффекты, связанные с такими наркотическими лекарственными препаратами. Интересно то, что иммуностимулирующая активность некоторых агонистов d-опиоидных рецепторов может быть полезна при разработке лечебных стратегий в случае иммунодефицитных расстройств у человека (Dondio et al., Review: Non-peptide d-opioid agonists and antagonists, Exp. Opin. Ther. Patents, 1997,10, 1075). С точки зрения их важной фармакологической ценности, существует потребность в агонистах dопиоидных рецепторов, селективных как по их действию в качестве агонистов (показывающих слабое антагонистическое действие или его отсутствие), так и в отношении d-рецептора (показывающих слабое предпочтение в отношении - или -подтипа опиоидных рецепторов). Кроме того, такие агонисты dопиоидных рецепторов по природе не должны являться пептидами, так как такие соединения неустойчивы при введении системными способами. В настоящее время известными непептидными дельта-опиоидными рецепторами являются индолои бензофураноморфинаны (US-5354863 (1994), SearleСо; WO-9531464 (1995), Astra AB), октагидроизохинолины (например, TAN-67, Toray Inc., в публикации JP-4275288 (1992), и в WO-9710216 (1997),Smithkline Beecham SPA), производные пиперазина (например, BW373U86 и SNC 80, The Welcome Foundation, в публикации WO-9315062 (1993, пирролооктагидроизохинолины (WO-9504734 (1995), Smithkline Beecham SPA), производные этиламина (WO-9622276 (1996), Nippon Shinyaku Co. Ltd.), триазаспиродеканоны (WO 0146192 (2001), Meiji Seika Kaisha Ltd.) и замещенные аминопроизводные (ЕР-864559(1998), Gruenenthal Gmbh). В WO-9828270 (1998) и WO-9828275 (1998), Astra AB описываются производные пиперидина с аналгезирующей активностью. Указанные соединения по структуре не являются родственными соединениям настоящего изобретения. В ЕР 1038872 А 1 (2000), Pfizer Products Inc. описываются некоторые 4-фенил-4 гетероарилпиперидины как лиганды опиоидных рецепторов. Указанные соединения структурно отличаются от соединений данного изобретения - среди прочего - по характеру заместителя по азоту в пиперидиниле, в котором отсутствует двухвалентный радикал с -связью. В WO/0037470 (2000), Janssen Pharmaceutica N.V. описывается общий путь синтеза антигистаминных спиросоединений с использованием некоторых соединений по изобретению. Однако указанные соединения не являются примерами соединений известного уровня техники для данной заявки и не делается какого-либо предположения, что они могут обладать свойствами агонистов d-опиоидных рецепторов. Целью настоящего изобретения является разработка нового класса высокоселективных агонистов dопиоидных рецепторов на основе пиперидиновой группы. Другой целью настоящего изобретения является разработка агонистов d-опиоидных рецепторов, используемых в качестве агонистов с пониженными побочными эффектами. Еще одной целью настоящего изобретения является разработка агонистов dопиоидных рецепторов, активных в случае заболеваний, опосредуемых d-опиоидными рецепторами. Настоящее изобретение относится к новым замещенным 4-фенил-4-[1 Н-имидазол-2-1 006507 ил]пиперидиновым производным общей формулы (I) где А=В представляет собой двухвалентный радикал с -связью;X представляет собой ковалентную связь, -СН 2- или СН 2 СН 2-;R1 представляет собой водород, гидрокси, алкилокси, алкилкарбонилокси, Аr-окси, Het-окси, Аrкарбонилокси, Het-карбонилокси, Аr-алкилокси, Het-алкилокси, алкил, полигалогеналкил, алкилоксиалкил, Аr-алкил, Het-алкил, Ar, Het, тио, алкилтио, Аr-тио, Het-тио или NR9R10, где R9 и R10, каждый независимо, представляют собой водород, алкил, Аr, Аr-алкил, Het, Het-алкил, Аr-карбонил, Het-карбонил или алкилоксикарбонилалкил; или А=В и R1 вместе образуют необязательно замещенный полуароматический или ароматический карбоциклический или гетероциклический радикал Het2 или Het3;R4, R5, каждый независимо, представляет собой водород, алкил, карбокси, аминокарбонил, алкилоксикарбонил, галоген или гидроксиалкил; р равен целому числу, равному нулю, 1, 2 или 3; их фармацевтически приемлемым солям присоединения кислот или оснований, их стереохимически изомерным формам, их таутомерным формам и их N-оксидам. В рамках данной заявки алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал(циклоалкил) с 3-7 атомами углерода, или он представляет собой циклический насыщенный углеводородный радикал с 3-7 атомами углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу с 1-6 атомами углерода, где каждый атом углерода может быть, необязательно, замещен амино, нитро, тио, гидрокси, оксо, циано, формилом или карбокси. Предпочтительно алкил представляет собой метил, этил, пропил, изопропил, бутил, трет-бутил,циклопропил, циклопентил, циклогексил, циклогексилметил и циклогексилэтил. В рамках данной заявки алкенил представляет собой алкил, имеющий указанное выше значение,содержащий одну или несколько двойных связей. Предпочтительно алкенил представляет собой этенил и пропенил. В рамках данной заявки Аr представляет собой гомоциклическое ядро, выбранное из группы, состоящей из фенила и нафтила, каждый из которых необязательно замещен одним или несколькими заместителями, где каждый заместитель выбран независимо из группы, состоящей из гидрокси, алкилокси,алкилкарбонилокси, фенилокси, фенилкарбонилокси, галогена, циано, алкила, полигалогеналкила, алкилоксиалкила, формила, галогенформила, карбокси, алкилкарбонила, алкилоксикарбонила, аминокарбонила, моно- или диалкиламинокарбонила, фенилалкила, фенила, нитро, амино, моно- или диалкиламино,тио, алкилтио или SO2-CH3. Предпочтительно Аr представляет собой нафтил или фенил, каждый из которых необязательно замещен гидрокси, метилокси, этилокси, фенилокси, тригалогенметилокси, галогеном, метилом, трифторметилом, хлорформилом, карбокси, метилоксикарбонилом, этилоксикарбонилом,диэтиламинокарбонилом, фенилом, нитро, метилтио, трифторметилокси или SO2-С 1-3 алкилом. В рамках данной заявки галоген представляет собой заместитель, выбранный из фтора, хлора, брома и иода, и полигалогеналкил представляет собой линейный или разветвленный углеводородный радикал с 1-6 атомами углерода или циклический насыщенный углеводородный радикал с 3-7 атомами углерода, где один или несколько атомов углерода замещены одним или несколькими атомами галогена. Предпочтительно галоген представляет собой бром, фтор или хлор, и предпочтительно полигалогеналкил представляет собой трифторметил. В рамках данной заявки Het представляет собой гетероциклический радикал, выбранный из группы,состоящей из Het1, Het2 и Het3. Het1 представляет собой алифатический моноциклический гетероциклический радикал, выбранный из группы, состоящей из пирролидинила, диоксолила, имидазолидинила, пиразолидинила, пиперидинила, диоксила, морфолинила, дитианила, тиоморфолинила, пиперазинила и тетрагидрофурила. Het2 представляет собой полуароматический моноциклический гетероциклический радикал, выбранный из группы, состоящей из 2 Н-пирролила, пирролинила, имидазолинила и пиразолинила.Het3 представляет собой ароматический моноциклический гетероциклический радикал, выбранный из группы, включающей пирролил, пиразолил, имидазолил, фурил, тиенил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил или триазинил; или ароматический бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; каждый моноциклический и бициклический гетероциклический радикал может быть необязательно замещен по атому углерода и/или гетероатому галогеном, гидрокси, алкилокси,алкилом, Аr, Ar-алкилом или пиридинилом. Группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы,их таутомерные формы и их N-оксиды, где А=В выбран из группы, состоящей из С=O, C=N-R6, где R6 представляет собой водород или циано, C=S, S=O, SO2 и C=CR7R8, где R7 и R8, каждый независимо,представляют собой водород, нитро или алкил. Другая группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где R1 выбран из группы, включающей алкилокси, Arалкилокси, алкил, полигалогеналкил, алкилоксиалкил, Аr-алкил, Het-алкил, Аr, пиперазинил, пирролил,тиазолил, пирролидинил и NR9R10, где R9 и R10, каждый независимо, представляют собой водород, алкил,Аr, Аr-алкил, пиридинил или алкилоксикарбонилалкил. Другая группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где А=В и R1 вместе образуют радикал, выбранный из группы, состоящей из Het2 и Het3. Более предпочтительно А=В и R1 вместе образуют радикал, выбранный из группы, состоящей из бензоксазолила, тиазолила, бензотиазолила, бензимидазолила и пиримидинила. Еще одна группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где X представляет собой ковалентную связь или группу-СН 2-. Предпочтительно X представляет собой ковалентную связь. Еще одна группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где R2 представляет собой алкилокси или галоген. Еще одна группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где R3 выбран из группы, состоящей из фенилалкила и нафтила, каждый из которых независимо замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, алкилоксикарбонила, гидрокси, алкилокси и диалкиламинокарбонила. Когда R3 представляет собой алкил, тогда, предпочтительно, алкил представляет собой циклогексилметил. Еще одна группа соединений, представляющих интерес, включает соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, где А=В представляет собой С=O или SO2, R1 представляет собой алкилокси, алкилоксиалкил, Аr или NR9R10, где R9 и R10, каждый независимо, представляют собой водород или Аr; или А=В и R1 вместе образуют радикал бензоксазолил; р равен нулю, R3 представляет собой бензил, необязательно замещенный гидрокси, алкилом или алкилоксикарбонилом, и каждый из R4 и R5 представляет собой водород. Конкретнее, наиболее предпочтительными являются следующие соединения: 1-этоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-пропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-[(4-гидроксифенил)метил]-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 1-изопропилоксикарбонил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-4-(метоксикарбонил)фенил]метил]-1 Н-имидазол-2-ил]пиперидин; 1-бензоил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидин; 1-(метоксиацетил)-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 4-2-(1-бензоил-4-фенил-4-пиперидинил)-1 Н-имидазол-1-ил]метил]метилбензоат; 4-2-[1-(2-бензоксазолил)-4-фенил-4-пиперидинил]-1 Н-имидазол-1-ил]метил]метилбензоат; 1-бензоил-4-фенил-4-[1-(1-фенилэтил)-1 Н-имидазол-2-ил]пиперидин; 1-этоксикарбонил-4-фенил-4-[1-[1-[4-(этоксикарбонил)фенил]этил]-1 Н-имидазол-2-ил]пиперидин иN,N-дифенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидинсульфонамид. Фармацевтически приемлемыми солями присоединения кислот называют соли, к которым относятся терапевтически активные нетоксичные кислотно-аддитивные соли, которые способны образовывать-3 006507 соединения формулы (I) . Указанные соли присоединения кислот можно получить, обрабатывая основания соединений формулы (I) подходящими кислотами, например неорганическими кислотами, например галогеноводородной кислотой, в частности, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой,фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, миндальной кислотой,метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, птолуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памовой кислотой. Соединения формулы (I), содержащие кислотные протоны, также можно превратить в их терапевтически активные нетоксичные соли присоединения оснований обработкой соответствующими органическими и неорганическими основаниями. Соответствующими формами солей оснований являются, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности, литиевые, натриевые, калиевые, магниевые и кальциевые соли, соли, образованные с органическими основаниями,например соли бензатина, N-метил-D-глюкамина, гидрамина, и соли, образованные с аминокислотами,например аргинином и лизином. Наоборот, указанные кислотно- или основно-аддитивные соли можно превратить в свободные формы обработкой соответствующим основанием или кислотой. Термин "соль присоединения", используемый в рамках данной заявки, также включает сольваты,которые способны образовывать соединения формулы (I), а также их соли. Такими сольватами являются,например, гидраты и алкоголяты. Термин "стереохимически изомерные формы", используемый в данном случае, определяет все возможные изомерные формы, которыми могут иметь соединения формулы (I). Если не упомянуто или не указано иное, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Конкретнее, стереогенные центры могут иметь R- или S-конфигурацию; заместители двухвалентных циклических (частично) насыщенных радикалов могут иметь или цис- или трансконфигурацию. Очевидно, предполагается, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Следуя договорам по CAS-номенклатуре, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, дескриптор R или S приписывают (на основании правила последовательности Кана-Инголда-Прелога) хиральному центру под наименьшим номером - базисному центру. Конфигурацию второго хирального центра указывают с использованием родственных дескрипторов[R,R] или [R,S], где R всегда указывают как базисный центр, и [R,R] указывает центры с одной и той же хиральностью, a [R,S] указывает центры с неодинаковой хиральностью. Например, если в молекуле хиральный центр под наименьшим номером имеет S-конфигурацию, а второй центр представляет собой R, стереодескриптор можно указать как S-[R,S]. Если используют и : положение самого старшего заместителя у асимметричного атома углерода в циклической системе под наименьшим номером в цикле произвольно всегда является -положением главной плоскости, обусловленной циклической системой. Положение самого старшего заместителя у другого асимметричного атома углерода в циклической системе относительно положения самого старшего заместителя у базисного атома обозначают , если он находится с той же стороны главной плоскости, обусловленной циклической системой,или , если он находится с другой стороны главной плоскости, обусловленной циклической системой. Отмечено, что замещенный атом углерода в положении 4 в пиперидинильной группе является ахиральным атомом; поэтому соединения формулы (I) могут иметь по меньшей мере только один стереогенный центр в своей структуре из-за хирального заместителя R1, R2, R3, R4 или R5. Подразумевается, что таутомерные формы соединений формулы (I) включают такие соединения формулы (I), где, например, енольная группа превращается в кетогруппу (кето-енольная таутомерия). Подразумевается, что N-оксиды соединений формулы (I) включают такие соединения формулы (I),где один или несколько атомов азота окислены до так называемого N-оксида, в частности, такие Nоксиды, в которых окислен азот пиперидиновой группы и/или имидазольной группы. Соединения формулы (I), которые получают способами, описанными ниже, можно синтезировать в форме рацемических смесей энантиомеров, которые можно отделить один от другого, следуя методикам разделения, известным в данной области. Рацемические соединения формулы (I) можно превратить в соответствующие диастереомерные соли взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные соли затем разделяют, например, селективной или фракционной кристаллизацией,и высвобождают из них энантиомеры с помощью щелочи. Другой способ разделения энантиомеров соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что взаи-4 006507 модействие происходит стереоспецифически. Предпочтительно, если нужен конкретный стереоизомер,указанное соединение следует синтезировать стереоспецифическими способами получения. В таких способах будет выгодно использовать энантиомерно чистые исходные вещества. Изобретение также относится к производным (как правило, называемым "пролекарства") фармакологически активных соединений по изобретению, которые распадаются in vivo с образованием соединений по изобретению. Пролекарства, как правило (но не всегда) имеют меньшую силу в отношении рецептора-мишени, чем соединения, до которых они распадаются. Пролекарства, в частности, применимы,когда нужное соединение имеет химические или физические свойства, которые делают его введение затруднительным или неэффективным. Например, нужное соединение может являться только плохо растворимым, оно может плохо переноситься через мышечный эпителий или оно может иметь нежелательно короткий период полувыведения из плазмы. Более детальное описание пролекарств можно найти уStella V.J. et al., в "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176, и в Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений по изобретению, вообще, будут представлять собой соединения формулы (I), их фармацевтически приемлемые соли присоединения кислот или оснований, их стереохимически изомерные формы, их таутомерные формы и их N-оксиды, содержащие кислотную группу, которая этерифицирована или амидирована. К числу таких этерифицированных кислотных групп относятся группы формулы -COORx, где Rx представляет собой C1-6 алкил, фенил, бензил или одну из групп К амидированным группам относятся группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил, и Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения по изобретению, содержащие аминогруппу, могут образовывать производные с кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Такое основание будет гидролизоваться в водном растворе с кинетикой реакции первого порядка. Неожиданно показано, что соединения по изобретению полезны в терапии, в особенности, для лечения различных состояний боли, таких как, и в частности, боль, опосредуемая центральной нервной системой, боль, опосредуемая периферической нервной системой, боль, связанная с повреждением структурной или мягкой ткани, прогрессирующая боль, связанная с заболеванием, невропатическая боль и острая боль, такая как вызванная острым повреждением, травмой или хирургическим вмешательством,и хроническая боль, такая как вызванная невропатическими состояниями, диабетической периферической невропатией, постгерпетической невралгией, тригеминальной невралгией, болевыми синдромами после удара и "гистаминовой" головной болью или мигренью. Соединения по изобретению также можно применять для лечения артрита, псориаза, астмы, воспалительного заболевания кишечника, расстройства дыхательной функции, функциональной диареи, неязвенной диспепсии и недержания. Такое применение также подтверждено в WO/9852929 (Pfizer Ltd., 1998). Наличие опиоидных дельта-рецепторов в толстой кишке человека также показано как методом связывания с радиолигандами, так и ауторадиографическими исследованиями. Наивысшая плотность связывания (80-90%) обнаружена на нейронах мышечно-кишечного сплетения, расположенного между круговым и продольным слоями гладкой мышечной ткани, с низкой плотностью рецепторов, расположенных в слоях гладкой мышечной ткани. При функциональных исследованиях дельта-опиоидные агонисты могут ингибировать как холинергическую, так и нехолинергическую передачу нервных импульсов раздражения в толстой кишке человека. На основании таких наблюдений можно ожидать, что агонисты дельтаопиоидных рецепторов будут ингибировать перистальтику толстой кишки у человека. Также на преклинических моделях показано, что периферически-действующий селективный дельта-опиоидный агонистUK-321130 обнаруживает сильное зависящее от дозы ингибирование перистальтики толстой кишки. Поэтому соединения настоящего изобретения также заявлены для лечения синдрома раздраженной толстой кишки (IBS). Таким образом, настоящее изобретение относится к соединениям формулы (I), приведенной выше,их фармацевтически приемлемым солям присоединения кислот или оснований, их стереохимическим изомерам, их таутомерам и их N-оксидам для применения в качестве лекарственного средства. Исследования in vitro сигнальной трансдукции рецепторов и нейротрансмиттеров можно использовать для оценки активностей агонистов дельта-, мю- и каппа-опиоидных рецепторов, как описано далее в данной заявке. Изобретение также относится к композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по изобретению. Соединения по изобретению можно ввести в состав различных фармацевтических форм для введения. В качестве подходящих композиций можно назвать все композиции, обычно используемые для сис-5 006507 темного введения лекарственных средств. Для того, чтобы получить фармацевтические композиции данного изобретения, эффективное количество определенного соединения, необязательно, в виде аддитивной соли, как активный ингредиент объединяют при тщательном перемешивании с фармацевтически приемлемым носителем, который может иметь самые разные формы, в зависимости от препарата, требуемого для введения. Такие фармацевтические композиции находятся, желательно, в стандартной лекарственной форме, подходящей, в частности, для введения путем парентеральной инъекции или инфузии. Например, при получении композиций можно использовать любые обычные фармацевтические среды. В случае парентеральных композиций носитель, как правило, будет содержать стерильную воду, по меньшей мере, в большей части, хотя могут включаться и другие ингредиенты, например, способствующие растворению. Например, можно получить растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получить суспензии для инъекций, и в таком случае можно использовать соответствующие жидкие носители, суспендирующие агенты и подобные вещества. К таким препаратам также относятся твердые препараты, предназначенные для превращения в форму жидкого препарата непосредственно перед применением. В зависимости от способа введения, фармацевтическая композиция будет, предпочтительно, содержать от 0,05 до 99 мас.%, более предпочтительно - от 0,1 до 70 мас.%, активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно - от 30 до 99,9 мас.%, фармацевтически приемлемого носителя, причем все проценты указаны относительно всей композиции. Фармацевтическая композиция также может содержать другие различные ингредиенты, известные в данной области, например, стабилизатор, буферирующее средство, эмульгатор, агент, регулирующий вязкость, поверхностно-активное вещество или консервант. Настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемых солей присоединения кислот или оснований, его стереохимических изомеров, его таутомеров и его N-оксидов, а также любых содержащих их указанных выше фармацевтических композиций для изготовления лекарственного средства для лечения различных состояний боли, таких как, и в частности, боль, опосредуемая центральной нервной системой, боль, опосредуемая периферической нервной системой, боль, связанная с повреждением структурной или мягкой ткани, прогрессирующая боль, связанная с заболеванием, невропатическая боль и острая боль, такая как вызванная острым повреждением, травмой или хирургическим вмешательством, и хроническая боль, такая как вызванная невропатическими состояниями, диабетической периферической невропатией, постгерпетической невралгией,тригеминальной невралгией, болевыми синдромами после удара, "гистаминовой" головной болью или мигренью, артрита, псориаза, астмы, воспалительного заболевания кишечника, расстройства дыхательной функции, функциональной диареи, неязвенной диспепсии, недержания и синдрома раздраженной толстой кишки (IBS). Соответственно, в другом аспекте изобретение относится к способу лечения человека, страдающего от какого-либо из указанных выше состояний, включающему введение человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения или фармацевтической композиции по изобретению. Соединения настоящего изобретения в форме, меченной радиоизотопом, полезны в качестве диагностического средства. Поэтому настоящее изобретение также относится к таким соединениям, меченным радиоизотопами, а также к способу диагностики с использованием соединений по изобретению,меченых радиоизотопами. Соединения по изобретению, вообще, можно получать, последовательно осуществляя стадии, каждая из которых известна специалистам в данной области техники. В частности, соединения формулы (I-а) можно получить взаимодействием промежуточного соединения формулы (II) согласно реакционной схеме (1), и такое взаимодействие осуществляют в подходящем реакционно-инертном растворителе, таком как толуол, в присутствии подходящего основания, такого как триэтиламин. На реакционной схеме (1) все переменные имеют значения, приведенные для формулы (I), и W1 вместе с группой, к которой он присоединен, равнозначен R1; примерами W1 являются алкил, Аr или Het. Примером W1OC(=O)Cl является хлорформиат. Соединения формул (I-a), (I-b), (I-c), (I-d), (I-е), (I-f), (I-g) и (I-h) также можно получить взаимодействием промежуточного соединения формулы (III) согласно любой реакции, отображенной на реакционной схеме (2). В указанных реакциях все переменные имеют значения, приведенные для формулы (I), иHet. Реакцию (а) осуществляют в подходящем растворителе, таком как дихлорэтан, с использованием ВОС 2 О. Взаимодействие обычно осуществляют в течение нескольких часов при кипячении с обратным холодильником. Реакцию (b) осуществляют в подходящем растворителе, таком как ТГФ. Взаимодействие обычно осуществляют в течение периода от одного часа до нескольких часов при комнатной температуре. Реакцию (с) осуществляют в подходящем растворителе, таком как дихлорметан, в присутствии подходящего основания, такого как Et3N, при комнатной температуре в течение одного часа. Реакцию (d) осуществляют в подходящем растворителе, таком как ТГФ или ДМФА, при комнатной температуре в течение нескольких часов, и основание не требуется. Реакцию (е) осуществляют или при кипячении с обратным холодильником в ацетоне или в ДМФА в присутствии подходящего основания, такого как карбонат калия, и обычно ее можно осуществлять при 80 С. Реакцию (f) осуществляют в подходящем растворителе, таком как дихлорметан, в присутствии подходящего основания, такого как триэтиламин, и при комнатной температуре в течение примерно 30-120 мин. Реакцию (g) осуществляют в подходящем растворителе, таком как ацетонитрил, при кипячении с обратным холодильником в течение 24 ч. Реакцию (h) осуществляют в различных условиях, в зависимости от R1; например, когда R1=CF3, реакцию проводят в присутствии триэтиламина в дихлорметане при -78 С в течение 1 ч. В случае R1=NH2 реакцию проводят в диоксане в течение 12 ч при температуре образования флегмы. В случае R1=CH3 реакцию проводят в дихлорметане при комнатной температуре в течение 3 ч в присутствии триэтиламина. Реакцию (i) осуществляют в подходящем растворителе, таком как изопропанол, при температуре образования флегмы в течение 12-36 ч. Реакцию (j) осуществляют в подходящем растворителе, таком как ацетонитрил, при температуре образования флегмы в течение 24 ч. Соединения формулы (I-c) также можно получить взаимодействием промежуточного соединения формулы (IV) с галогенидом. В указанной реакции все переменные имеют значения, приведенные для формулы (I). Взаимодействие осуществляют с таким основанием, как NaH (60% суспензия в минеральном масле), и в растворителе, реакционно-инертном, таком как ДМФА или ТГФ. Исходные вещества и промежуточные соединения формул (II), (III) и (IV) являются соединениями,которые или коммерчески доступны, или их можно получить согласно обычным реакционным методикам, как правило, известным в данной области. Промежуточные соединения формулы (II) можно получить согласно реакционной схеме (4), приве-8 006507 денной ниже, где переменные имеют значения, приведенные для формулы (I). Схема 4 Реакционная схема (4) включает стадию (а), на которой хлорангидрид указанного типа взаимодействует с замещенным первичным амином, например, бензиламином, в присутствии подходящего основания, такого как Et3N, и в подходящем реакционно-инертном растворителе, таком как дихлорметан. Реакцию обычно можно проводить при комнатной температуре. На следующей стадии (b) аддукт, полученный на стадии (а), кипятят с обратным холодильником в SOСl2, после чего полученный продукт подвергают взаимодействию с подходящим замещенным 2,2-диметоксиэтиламином в реакционно-инертном растворителе, таком как ДМФА, например, при комнатной температуре (стадия с). На стадии (d) аддукт,полученный на стадии (с), циклизуют в НСl и получают замещенную имидазольную группу. Промежуточные соединения формулы (III) можно получить из соединений формулы (I-c) селективным восстановлением алкилоксикарбонильной составляющей пиперидинильной группы согласно реакции Взаимодействие осуществляют в присутствии подходящего основания, такого как КОН, в подходящем реакционно-инертном растворителе, таком как 2-пропанол, и при температуре образования флегмы. Промежуточные соединения формулы (IV) можно получить гидрированием соединений формулы где все переменные имеют значения, приведенные для формулы (I). Взаимодействие осуществляют в присутствии катализатора, такого как Pd/C (10%), в метаноле при умеренно повышенной температуре. Очевидно, что продукты реакций, описанных выше и далее, можно выделить из реакционной среды и, при необходимости, очистить дополнительно согласно методологиям, обычно известным в данной области, таким как экстракция, кристаллизация и хроматография. Также очевидно, что продукты реакций, существующие в нескольких энантиомерных формах, можно выделить из их смеси известными методами, в частности, препаративной хроматографией, например, препаративной ВЭЖХ. Приведенные далее примеры иллюстрируют настоящее изобретение, не ограничивая его. Экспериментальная часть Для некоторых соединений абсолютная стереохимическая конфигурация относительно их стереогенного(ых) атома(ов) углерода экспериментально не определена. В таких случаях стереохимический изомер, который выделяют первым, обозначают "А", а второй - "В", без дополнительной ссылки на фактическую стереохимическую конфигурацию. Однако указанные изомерные формы "А" и "В" специалист в данной области техники может однозначно охарактеризовать, используя известные способы, такие как,например, рентгенография. Способ выделения описан подробно ниже. Далее аббревиатура "ДМФА" обозначает N,N-диметилформамид, "ТГФ" обозначает тетрагидрофуран, и "DIPE" обозначает диизопропиловый эфир. А. Получение промежуточных соединений Пример А 1. 1-Метил-4-фенил-4-пиперидинкарбонилхлорид (0,49 моль) при перемешивании при комнатной температуре добавляют по частям к смеси бензолметанамина (0,49 моль) и N,N-диэтилэтанамина (1,223 моль) в СН 2 Сl2 (2500 мл). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют К 2 СО 3 (150 г) и Н 2 О. Смесь перемешивают и разделяют на два слоя. Водный слой экстрагируют CH2Cl2. Объединенный органический слой сушат (MgSO4), фильтруют и выпаривают растворитель. Получают 144 г (95%) 1-метил-4-фенил-N-(фенилметил)-4-пиперидинкарбоксамида (промежуточное соединение 1). Пример А 2. Смесь промежуточного соединения 1 (0,47 моль) и SOCl2 (750 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают. Дважды добавляют и снова выпаривают толуол. Получают 190 г (100%) гидрохлорида N-[хлор(1-метил-4-фенил-4-пиперидинил)метилен]бензолметанамина (промежуточное соединение 2). Пример A3. Смесь промежуточного соединения 2 (0,47 моль) и ДМФА (750 мл) охлаждают на ледяной бане. Добавляют по каплям раствор 2,2-диметоксиэтанамина (0,54 моль) в ДМФА. Смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают. Получают 210 г (100%) дигидрохлорида N-(2,2-диметоксиэтил)-1-метил-4-фенил-N'-(фенилметил)-4-пиперидинкарбоксимидамида (промежуточное соединение 3). Пример А 4. Смесь промежуточного соединения 3 (0,47 моль) и 6 N НСl (1500 мл) перемешивают до тех пор,пока раствор не помутнеет, затем промывают CH2Cl2 (900 мл), перемешивают при 80 С в течение 1 ч,охлаждают, подщелачивают 50% раствором NaOH и экстрагируют CH2Cl2. Органический слой отделяют,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из CH3CN. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 38,3 г (25%) 1-метил-4-фенил-4-[1-(фенилметил)1 Н-имидазол-2-ил]пиперидина (промежуточное соединение 4). Пример А 5. Смесь соединения 1 (0,089 моль) и метанола (250 мл) гидрируют при 50 С с Pd/C, 10% (3 г), в качестве катализатора. После поглощения водорода (1 эквив.) катализатор отфильтровывают и фильтрат упаривают. Остаток кристаллизуют из CH3CN. Выпавшее в осадок вещество отфильтровывают и сушат. Получают 23,8 г (90%) этил 4-фенил-4-(1 Н-имидазол-2-ил)-1-пиперидинкарбоксилата (промежуточное соединение 5). Пример А 6. Смесь промежуточного соединения 5 (0,026 моль) и КОН (0,26 моль) в 2-пропаноле (150 мл) перемешивают и кипятят с обратным холодильником в течение 10 ч. Растворитель выпаривают. Остаток растворяют в Н 2 О и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат, фильтруют и выпари- 10006507 вают растворитель. Получают 9,4 г 4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]пиперидина (промежуточное соединение 6). Пример А 7. Реакцию проводят в атмосфере N2. Смесь промежуточного соединения 5 (0,0033 моль), ДМФА (5 мл) и ТГФ (5 мл) при перемешивании при комнатной температуре добавляют по каплям к раствору NaH,60% суспензия в минеральном масле (0,004 моль), в ТГФ (10 мл). Смесь перемешивают в течение одного часа при комнатной температуре. Затем добавляют по каплям раствор 4-(ацетилокси)бензолметанола(0,004 моль) в ТГФ и полученную реакционную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на короткой открытой колонке на силикагеле (элюент CH2Cl2/(CH3OH/NH3), 95/5). Чистые фракции собирают и выпаривают растворитель. Получают 1,33 г этил 4-фенил-4-[1-4-метилкарбокси)фенилметил)-1 Н-имидазол-2-ил]-1-пиперидинкарбоксилата (промежуточное соединение 7). В. Получение целевых соединений Пример В 1. Смесь промежуточного соединения 4 (0,05 моль) и N,N-диэтилэтанамина (0,15 моль) в толуоле (750 мл) перемешивают при 100 С. Добавляют по каплям этилхлорформиат (0,25 моль), реакционную смесь перемешивают и кипятят с обратным холодильником в течение 1 ч и затем охлаждают. Смесь выливают в водный раствор К 2 СО 3 (35 г К 2 СО 3). Слои разделяют. Водный слой экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают на силикагеле на стеклянном фильтре (элюент СН 2 Сl2/С 2 Н 5 ОН, 98/2). Нужные фракции собирают и выпаривают растворитель. Остаток кристаллизуют из CH3CN, отфильтровывают и сушат. Получают 16,7 г (86%) этил-4-фенил-4-[1-(фенилметил)-1 Н-имидазол-2-ил]-1-пиперидинкарбоксилата (соединение 1). Пример В 2. Получение соединения 2 К смеси промежуточного соединения 6 (0,0019 моль) и N,N-диэтилэтанамина (0,0024 моль) в СН 2 Сl2 (15 мл) при перемешивании при комнатной температуре добавляют бензоилхлорид (0,0023 моль). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют воду. Слои разделяют. Водный слой экстрагируют СН 2 Сl2. Объединенные органические слои сушат (Na2SO4),фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на короткой открытой колонке на силикагеле (элюент СН 2 Сl2/(CH3OH/NH3), 98/2). Чистые фракции собирают и выпаривают растворитель. Остаток перекристаллизовывают из н-гексана, отфильтровывают и сушат. Получают 0,42 г (52%) соединения 2; т.пл. 122,7 С. Пример В 3. Получение соединения 3 Реакцию проводят в атмосфере N2. Раствор промежуточного соединения 5 (0,0054 моль) в ДМФА(10 мл) и ТГФ (10 мл) добавляют по каплям к NaH (0,00624 моль) в ТГФ (30 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Затем добавляют по каплям метил-4-(бромметил)бензоат(0,00624 моль) в ТГФ (5 мл) и реакционную смесь перемешивают при 60 С в течение 3 ч. Добавляют воду и смесь экстрагируют СН 2 Сl2. Объединенные органические слои сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают хроматографией на короткой открытой колонке на силикагеле(элюент СН 2 Сl2/(СН 3 ОН/NH3), 98/2). Нужные фракции собирают и выпаривают растворитель. Остаток перекристаллизовывают из DIPE, отфильтровывают и сушат. Получают 1,7 г (70%) соединения 3; т.пл. 149,1 С. Смесь промежуточного соединения 6 (0,0059 моль) и(0,0059 моль) в CH3CN (70 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч. Растворитель выпаривают. Смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4, безводный), фильтруют и выпаривают растворитель. Остаток кристаллизуют из DIPE, отфильтровывают и перекристаллизовывают из CH3CN,отфильтровывают и сушат. Получают 0,33 г соединения 4; т.пл. 84,2 С. Пример В 5. Получение соединения 5 Смесь соединения 4 (0,0001 моль) и 6N НС 1 (22,8 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь подщелачивают и затем экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4, безводный), фильтруют и выпаривают растворитель. Остаток кристаллизуют из DIPE, отфильтровывают и сушат. Получают 0,24 г (62%) соединения 5. Пример В 6. Получение соединения 6 К промежуточному соединению 6 (0,0094 моль) в ТГФ (50 мл) добавляют по каплям изоцианатобензол (0,0094 моль) и реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют воду, и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат(Na2SO4), фильтруют и выпаривают растворитель. Твердый остаток промывают 2-пропаноном, отфильтровывают и сушат. Получают 2,7 г (68%) соединения 6. Пример В 7. Получение соединения 7 К промежуточному соединению 6 (0,0007 моль) в ТГФ (10 мл) добавляют метил-2 изоцианатобензоат (0,0007 моль) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Добавляют воду и полученную смесь экстрагируют СН 2 Сl2. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают ВЭЖХ на силикагеле (элюент СН 2 Сl2/СН 3 ОН, 98/2). Нужные фракции собирают и выпаривают растворитель. Получают 0,2 г (66%) соединения 7. Пример В 8. а) Получение соединения 8 Смесь соединения 3 (0,002 моль) и LiOH (0,02 моль) в ТГФ (11 мл) и Н 2O (11 мл) перемешивают при комнатной температуре в течение 24 ч. Добавляют Н 2 О. Доводят рН смеси до 6 и затем смесь экстра- 12006507 гируют CH2Cl2. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель. Остаток промывают CH2Cl2. Получают 0,72 г (83%) соединения 8; т.пл. 251,6 С. Реакцию проводят в атмосфере N2. Раствор NaH, 60% (0,000642 моль), в ДМФА (2 мл) перемешивают при комнатной температуре. Добавляют по каплям раствор соединения 6 (0,000642 моль) в ДМФА(8 мл) и реакционную смесь перемешивают в течение одного часа при комнатной температуре. Добавляют СН 3I (0,001284 моль) и реакционную смесь перемешивают при 60 С в автоклаве Парра в течение 2 ч. Растворитель выпаривают. Остаток очищают высокоэффективной жидкостной хроматографией на силикагеле (элюент CH2Cl2/CH3OH, 98/2). Нужные фракции собирают и выпаривают растворитель. Получают 0,14 г (49%) соединения 9. с) Получение соединения 10 К раствору соединения 7 (0,000404 моль) в ТГФ (5 мл) при перемешивании при 0 С добавляют по каплям 1 М раствор LiAlН 4 в ТГФ (0,000444 моль). Реакционную смесь перемешивают в течение 30 мин при 0 С. Смесь обрабатывают 10% водным раствором NH4Cl и экстрагируют EtOAc. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток очищают СС-ТСХ на хроматотроне (элюент CH2Cl2/CH3OH, 96/4). Нужные фракции собирают и выпаривают растворитель. Остаток кристаллизуют из СН 3 ОН/Н 2 О, отфильтровывают и сушат. Получают 0,020 г (10%) соединения 10.LiOH (0,001423 моль). Полученную суспензию перемешивают в течение 18 ч при комнатной температуре. Растворитель выпаривают. Остаток растворяют в воде и экстрагируют смесью EtOAc и 1-бутанола. Органический слой отделяют, сушат (Na2SO4), фильтруют и выпаривают растворитель. Остаток растворяют в 1N HCl и затем экстрагируют EtOAc. Органический слой отделяют, промывают рассолом, сушат(Na2SO4), фильтруют и выпаривают растворитель. Остаток кристаллизуют из Et2O/CH2Cl2, отфильтровывают и сушат. Получают 0,16 г (51%) соединения 11. Пример В 9. К смеси промежуточного соединения 7 (0,0018 моль), ТГФ (10 мл) и Н 2O (10 мл) добавляют по частям LiOH (0,018 моль). Реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Добавляют воду. Добавляют CH2Cl2. Реакционную смесь экстрагируют. Органический слой отделяют,сушат (Na2SO4), фильтруют и выпаривают растворитель. Белый твердый остаток промывают метанолом и CH2Cl2 и затем сушат. Получают 0,54 г этил 4-фенил-4-[1-(4-гидроксифенилметил)-1 Н-имидазол-2-ил]1-пиперидинкарбоксилата (соединение 12). Получают соединения, перечисленные далее в табл. 1-5. В. Фармакологические примеры Фармакологические свойства проверяют в анализах на связывание с радиолигандами и связывание с GTPS выбранных соединений на клонированных -, - и -опиоидных рецепторах человека, экспрессированных в клеточной линии млекопитающего. Вторую передачу сигнала посредником измеряют на мембранных препаратах через стимуляцию связывания [35S]GTPS. При таком функциональном анализе исследуют агонистические и антагонистические свойства соединений. В качестве эталонного агониста для -опиоидного рецептора используют DPDPE ( (D-Pen2,5) энкефалин), а в качестве эталонного антагониста используют налтриндол (Malatynska E., Wang Y., Knapp R.J.,Santoro G., Li X., Waite S., Roeske W.R., Yamamura H.I., Human 8 opioid receptor: a stable cell line for functional studies of opioids. NeuroReport, 6, 613-616, 1995) и (Portoghese P.S., Sultana M., Takemori A.E., Naltrindole, a highly selective and potent non-peptide 8 opioid receptor antagonist. Eur. J. Pharmacol., 146, 185186, 1988), и U69593 и норбиналторфимин (нор-BNI) используют в качестве эталонного агониста и антагониста для -опиоидного рецептора, соответственно. Для -опиоидного рецептора используют морфин в качестве эталонного агониста и налоксон в качестве эталонного антагониста (Alt A., Mansour A., Akilactivation in CHO cells on phospholipase C, [Ca2+]I and adenylyl cyclase. Br. J. Pharmacol. 120, 1165-1171,1997). Материалы и способы Клеточная культура Клетки СНО, перманентно трансфицированные - или -опиоидными рецепторами, культивируют в смеси (модифицированная по способу Дульбекко среда Игла (DMEM/(питательная смесь Хама F12)(соотношение 1:1) с добавлением 10% термоинактивированной фетальной телячьей сыворотки и раствора антибиотиков, содержащего 100 МЕ/мл пенициллина G, 100 мкг/мл сульфата стрептомицина, 110 мкг/мл пировиноградной кислоты и 300 мкг/мл L-глутамина. Для клеток глиомы С 6, перманентно трансфицированных -опиоидными рецепторами, требуется среда DMEM с добавлением 10% термоинактивированной фетальной телячьей сыворотки и раствора антибиотиков, описанного выше. Получение мембран Мембраны получают в виде общих фракций частиц. Все клеточные линии культивируют до 90% слияния в 145-мм чашках Петри и обрабатывают 5 мМ раствором бутирата натрия за 24 ч до сбора. Культуральную среду удаляют и клетки промывают охлажденным на льду забуференным фосфатом физиологическим раствором (PBS, без Са 2+ и Мg2+), соскребают с чашек в 50 мМ буфере трис-HCl, рН 7,4, и собирают центрифугированием (10 мин при 16000 об/мин при 4 С). Клеточный осадок ресуспендируют в гипотоническом буфере 5 мМ трис-HCl, рН 7,4, и регомогенизируют с помощью гомогенизатора UltraTurrax. Гомогенат центрифугируют при 18000 об/мин при 4 С. Конечный осадок ресуспендируют в 50 мМ буфере трис-HCl, рН 7,4, и хранят в аликвотах при -70 С. Белок определяют с использованием анализа на белки Biorad (Bradford) с использованием в качестве эталона бычьего сывороточного альбуминаutilizing the principle of protein-dye binding. Analytical Biochem., 72:248-254, 1976). Связывание с радиолигандами Осуществляют предварительные эксперименты по связыванию с радиолигандами для того, чтобы установить оптимальные условия анализа для указанных подтипов опиоидных рецепторов в соответст- 26006507 вующим им клеточных мембранах млекопитающих. Осуществляют конкурентное ингибирование [3H]DPDPE соединениями при концентрации радиолиганда 2 нМ (Кd=1,7 нМ) и различных концентрациях каждого из соединений, перекрывая по меньшей мере 3 порядка величины вокруг значения pIC50. В случае конкурентного связывания с рецепторамиииспользуют [3H]U69593 (Kd=0,4 нМ) и [3H]DAMGO (Kd=0,6 нМ), соответственно, в концентрации 1 нМ. Мембраны оттаивают на льду и разводят в 50 мМ буфере трис-HCl, рН 7,4. В случае 6-опиоидного рецептора к такому буферу для инкубации добавляют 2 мМ МgСl2, 1 мМ ЭДТК и 0,1% BSA. Неспецифическое связывание определяют в присутствии 1 мкМ налтриндола, спирадолина и декстроморамида в случае -, - и -опиоидных рецепторов, соответственно. Найдено, что инкубация в течение 1 ч при 25 С является оптимальной для анализов на конкурентное связывания для всех трех подтипов рецепторов. Анализы осуществляют в конечном объеме 500 мкл. Реакцию обрывают быстрой фильтрацией на UniFilter-96, GF/B, при пониженном давлении с использованием Filtermate 196 (Packard). Количество радиоактивности, связанной на фильтровальной установке, определяют после высушивания фильтра и добавления сцинтиллятора (Microscint-O; Packard), подсчитывая число сцинтилляций в жидкости. Связывание с [35S]GTPS 35 Определение связывания [ S]GTPS с G-протеинами осуществляют модифицированным методомBiol., 106, 231-243, 1999). В предварительных экспериментах по связыванию с [35S]GTPS оптимизируют условия анализа, которые приводят к выбору следующих буферов: 20 мМ Hepes со 100 мМ NaCl, содержащий 3 мкМ GDP и 1 мМ МgСl2 для мембран СНО с -опиоидными рецепторами, содержащий 10 мкМGDP и 1 мМ МgСl2 для мембран клеток глиомы С 6 с -опиоидными рецепторами и содержащий 10 мкМGDP и 0,3 мМ МgСl2 для мембран клеток СНО с -опиоидными рецепторами. Смеси для анализов содержат 10 мкг мембранного белка. К разведенным мембранам добавляют еще 10 мкг/мл сапонина в качестве детергента для максимизации пенетрации [35S]GTPS через мембраны. Для испытания агонистической активности 175 мкл разведенных мембран предварительно инкубируют в описанном выше буфере вместе с 25 мкл буфера и 25 мкл раствора соединения разных концентраций в общем объеме 225 мкл. В случае антагонистических активностей 25 мкл добавляемого буфера заменяют эталонным агонистом для симуляции базовых уровней. Для всех трех клеточных линий используют концентрацию 300 нМ DPDPE, U69593 и морфина для соответствующих им подтипов рецепторов. После предварительной инкубации в течение 20 мин при 37 С добавляют 25 мкл [35S]GTPS до конечной концентрации 0,25 нМ и смеси для анализа инкубируют еще в течение 20 мин при 37 С. Связанный и свободный [35S]GTPS разделяют быстрой фильтрацией на UniFilter-96, GF/B, при пониженном давлении с использованием Filtermate 196 (Packard). Количество радиоактивности, связанной на фильтровальной установке, определяют после высушивания фильтра и добавления сцинтиллятора (Microscint-O; Packard), подсчитывая число сцинтилляций в жидкости. Основное связывание [35S]GTPS определяют в отсутствие соединений. Стимуляцию агонистом вычисляют как превышение в процентах базовых уровней. Сигмоидальные кривые зависимости от концентрации агониста для возрастания связывания [35S]GTPS и кривые ингибирования антагониста для ингибирования связывания [35S]GTPS, стимулированного эталонным агонистом, анализируют методом нелинейной регрессии с использованием программы GraphPad Prism. Данные получают в независимых экспериментах и эксперименты с разными концентрациями повторяют дважды. Все соединения изобретения показывают величину рIС 50 для дельта-опиоидного рецептора, равную по меньшей мере 6, и величину рIС 50 для мю- и каппа-рецептора, равную 6 или меньшую. Соединения, перечисленные в табл. 6, показывают величину pIC50 между 7 и 8 для дельтаопиоидного рецептора и величину pIC50 для мю- и каппа-рецептора, равную 6 или меньшую. Соединения, перечисленные в табл. 7, показывают величину pIC50 более 8 для дельта-опиоидного рецептора и величину рIС 50 для мю- и каппа-рецептора, равную 6 или меньшую. Селективность в отношении дельтаопиоидного рецептора в 600 раз выше, чем в отношении мю-опиоидного рецептора.- 27006507 Таблица 6. Величина pIC50 для дельта-опиоидного рецептора, полученная при испытании агонистов- 28006507 Таблица 7. Результаты испытания на связывание с агонистом рецептора (рIС 50) и связывание переноса сигнала (рIС 50)н.о. - не определено
МПК / Метки
МПК: C07D 401/04, A61P 25/04, A61K 31/445
Метки: производные, пиперидиновые, замещенные, дельта-опиоидов, селективных, непептидных, 4-фенил-4-[1н-имидазол-2-ил, качестве, новые, агонистов, применение
Код ссылки
<a href="https://eas.patents.su/30-6507-novye-zameshhennye-4-fenil-4-1n-imidazol-2-il-piperidinovye-proizvodnye-i-ih-primenenie-v-kachestve-selektivnyh-nepeptidnyh-agonistov-delta-opioidov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые замещенные 4-фенил-4-[1н-имидазол-2-ил] пиперидиновые производные и их применение в качестве селективных непептидных агонистов дельта-опиоидов</a>
Предыдущий патент: Лиофилизованная композиция 2-метилтиенобензодиазепина
Следующий патент: Физиологически активные средства на основе вицинальных дитиогликолей и их применение












