Пролекарства ингибиторов киназы pi – 3
Номер патента: 12240
Опубликовано: 28.08.2009
Авторы: Дерден Дональд Л., Сур Роберт Г., Паттерсон Мэри, Гарлич Джозеф Р., Су Дзиндон
Формула / Реферат
1. Соединение представляет собой соединение формулы
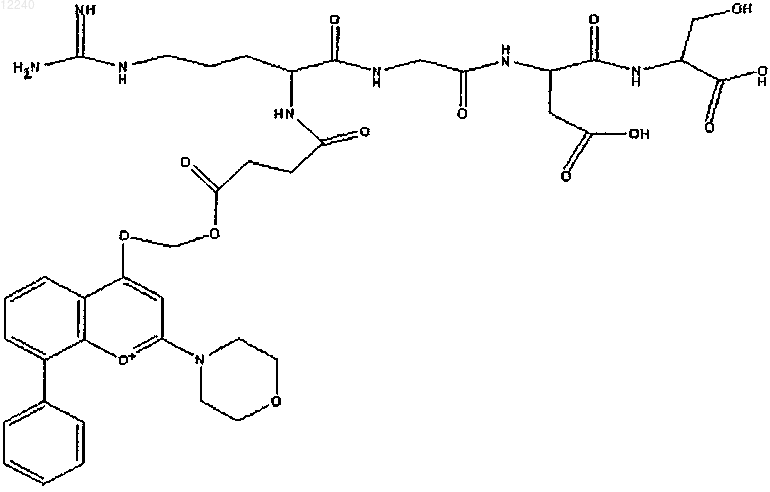
или его соль.
2. Применение соединения по п.1 в качестве активного терапевтического средства.
3. Применение соединения по п.1 для производства лекарственного средства, предназначенного для:
(a) лечения пациента, страдающего состоянием, ассоциируемым с активностью киназы PI-3;
(b) лечения воспалительных заболеваний, причем лекарственное средство необязательно включает один или несколько дополнительных терапевтических агентов, которые могут быть выбраны из группы, состоящей из алкилирующих агентов, антиметаболитов, аспарагиназы, винкристина, винбластина, антрациклинов, агентов, разрушающих микроканальцы, таксола, герцептина, гемцитабина и этопозидов;
(c) индуцирования апоптоза у пациента;
(d) повышения чувствительности к химиотерапии опухолевых клеток;
(e) повышения радиочувствительности опухолевых клеток;
(f) ингибирования индуцированного опухолью ангиогенеза;
(g) ингибирования ангиогенных процессов, ассоциируемых с нераковыми заболеваниями;
(h) лечения панкреатита;
(i) лечения язв;
(j) лечения рака желудка;
(k) лечения рака печени;
(l) улучшения функционирования стента;
(m) лечения возрастного желтого пятна;
(n) лечения состояний, ассоциируемых с мутантным PTEN;
(o) лечения гипертензии;
(p) разрушения функции лейкоцитов;
(q) подавления дифференцировки клеток-предшественников;
(r) ингибирования фосфотидилинозитол 3-киназы в центральной клетке млекопитающего.
Текст
012240 Данное изобретение относится к пролекарствам ингибиторов PI-киназ и способам использования указанных ингибиторов. Киназы PI-3 представляют собой большое семейство липидных киназ, которые фосфорилируют фосфатидилинозитол в положении D3, генерируя важный вторичный мессенджер, фосфатидилинозитол 3'-фосфат. Представители семейства киназ PI-3 делятся на три класса, исходя из гомологии последовательности и продукта, образуемого путем ферментативного катализа. Киназы PI-3 класса I состоят из 2 субъединиц: каталитической субъединицы 110 кДа и регуляторной субъединицы 85 кДа. Киназы PI-3 класса I вовлечены в важнейшие события передачи (трансдукции) сигнала, происходящие по механизму обратной связи с участием цитокинов, интегринов ростовых факторов и иммунорецепторов, что наводит на мысль, что контроль этого пути может привести к важнейшим терапевтическим эффектам. Ингибирование киназы PI-3 класса I индуцирует апоптоз, блокирует индуцированный опухолью ангиогенез in vivo, и увеличивает чувствительность к действию радиации (радиочувствительность) некоторых опухолей. LY294002 (2-(4-морфолинил)-8-фенил-4 Н-1-бензопиран-4-он) (соединение 1, которое также является соединением 1101) представляет собой общеизвестный специфический ингибитор киназ Однако противораковые применения LY294002 сильно ограничены его недостаточной растворимостью в воде и из-за его плохой фармакокинетики. Кроме того, LY294002 не имеет свойств, специфичных в отношении определенного типа ткани и, как было показано, быстро метаболизирует у животных. Из-за указанных факторов возникает необходимость во введении LY294002 через частые интервалы времени и, в связи с чем, возникает потенциал также ингибировать киназы PI-3 в нормальных клетках, что тем самым приводит к нежелательным побочным действиям. В настоящее время продолжает существовать потребность в новых ингибиторах киназ PI-3 класса I с улучшенными фармакокинетическими и фармакодинамическими свойствами. Настоящее изобретение реализует эти потребности и обеспечивает другие присущие ему преимущества. Настоящее изобретение относится к просоединениям, содержащим кватернизованный (четвертичный) азот, при этом одна связь кватернизованного азота является гидролизуемой и после гидролиза указанной связи образуется соединение формулы где R1 и R2 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гидроксил, галоген, алкокси, гетероцикл, циано, амино или, взятые вместе, образуют необязательно замещенный циклоалифатический радикал или необязательно замещенный арил;R3 представляет Н, необязательно замещенный алифатический радикал и необязательно замещенный арил;R4 и R5 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гетероцикл, арилокси, карбокси или, взятые вместе, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил. Просоединение может иметь формулу где кольцо А представляет собой бензольное кольцо;Z1 и Z2 независимо представляют собой S или О;R1 и R2 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гидроксил, галоген, алкокси, гетероцикл, циано, амино или, взятые вместе, образуют необязательно замещенный циклоалифатический радикал или необязательно замещенный арил;R3 представляет собой Н, необязательно замещенный алифатический радикал и необязательно замещенный арил;R4 и R5 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гетероцикл, арилокси, карбокси или, взятые вместе, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил;R6 представляет собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, алкокси, карбокси, амино, гетероцикл, арилокси и необязательно замещенное к тому же средство, обеспечивающее целенаправленную доставку активного вещества к ткани-мишени (в дальнейшем, "таргетирующее средство"); иL представляет линкерную группу (линкер). Таргетирующее средство может представлять собой витамин, пептид, белок, липосому, обладающее тропностью к костной ткани (остеотропное) средство или хрящищущее (в дальнейшем имеющее сродство к хрящевой ткани) средство, т.е. средство, нацеленное на диффузию в хрящевую ткань. Настоящее изобретение также относится к промежуточным соединениям формулыn=0, 1. Кроме того, настоящее изобретение относится к применению просоединений для лечения состояния, ассоциируемого с активностью киназ PI-3, воспалительного заболевания, возрастной дегенерации желтого пятна, состояний, ассоциируемых с мутантным PTEN, гипертензии, панкреатита, язв, рака; нарушения функции лейкоцитов; индуцирования апоптоза; повышения чувствительности опухолевых клеток к химиотерапии; увеличения чувствительности опухолевых клеток к воздействию радиации; ингибирования индуцированного опухолью ангиогенеза; ингибирования ангиогенных процессов, ассоциируемых с незлокачественными заболеваниями; улучшения функционирования стента; ингибирования фосфатидилинозитол 3-киназы в цельной клетке пациента, включающему введение пациенту, нуждающемуся в таком лечении, эффективного количества композиции, содержащей просоединения настоящего изобретения. Просоединения можно вводить пациенту путем медленного внутривенного (i.v.) вливания. Кроме того, настоящее изобретение относится к способу подавления дифференциации клетокпредшественников, включающему контактирование клеток-предшественников с эффективным количеством композиции, содержащей просоединение данного изобретения. Настоящее изобретение также относится к очистке просоединений данного изобретения путем добавления к раствору, содержащему по крайней мере 0,1% (об./об.) кислоты просоединений. Раствор, содержащий просоединение, хроматографируют, предпочтительно посредством ВЭЖХ, чтобы выделить просоединение. Краткое описание чертежей Фиг. 1 показывает химическую структуру EDTMP, DOTMP, ABDTMP, BAD, MTX-BP и CF-BP. Фиг. 2 показывает химические структуры потенциальных, имеющих сродство к костной ткани,средств. Фиг. 3 показывает химическую реакцию для модификации фосфоната в имеющем сродство к костной ткани средстве. Фиг. 4 показывает реакцию алкилирования для модифицирования фосфоната в имеющем сродство к костной ткани средстве. Фиг. 5 представляет концепцию для химической модификации EDTMP и DOTMP. Фиг. 6 показывает ингибирование фагоцитоза соединением LY294002 в клетках J774. Столбцы означают фагоцитарный индекс или процент клеток, позитивных в отношении фагоцитарного ответа. Фагоцитарный индекс представляет собой число sRBC's (овечьи эритроциты), обнаруживаемых в 100 клетках J774, и % фагоцитирующих клеток означает % J774 клеток, которые фагоцитировали по крайней мере 1 sRBC. Планки погрешностей представляют стандартное отклонение среднего. Фиг. 7 показывает УФ- и ELS-хроматограммы соединения 1126 (А 036-33). Фиг. 8 показывает масс-спектр положительных ионов соединения 1126 (А 036-33). Фиг. 9 показывает, что Av3-целенаправленные ингибиторы киназы PI-3 аннулировали образование трубок эндотелиальных клеток EDC-CBF1 на матригеле. Прежде чем будут раскрыты и описаны соединения, продукты, композиции и способы настоящего изобретения, необходимо понять, что используемая здесь терминология представлена только для описания конкретных вариантов осуществления и, как подразумевается, не является ограничивающей. На протяжении этого изобретения, где упомянуты публикации, раскрытия этих публикаций вклю-2 012240 чены в этот патент в полном объеме в виде ссылки, чтобы более полно описать состояние области, к которой относится данное изобретение. 1. Определения. Используемый здесь термин "разветвленный" относится к группе, содержащий от 1 до 24 атомов основной цепи, и эта основная цепь группы содержит одно или несколько побочных ответвлений от основной цепи. Предпочтительные разветвленные группы содержат от 1 до 12 атомов основной цепи. Примеры разветвленных групп включают, но не ограничиваются ими, изобутил, т-бутил, изопропил,-СН 2 СН 2 СН(СН 3)СН 2 СН 3, -СН 2 СН(СН 2 СН 3)СН 2 СН 3, -СН 2 СН 2 С(СН 3)2 СН 3, -СН 2 СН 2 С(СН 3)3 и т.п. Используемый здесь термин "неразветвленный" относится к группе, содержащей от 1 до 24 атомов основной цепи, и эта основная цепь группы простирается по прямой (линии). Предпочтительные неразветвленные группы содержат от 1 до 12 атомов основной цепи. Используемый здесь термин "циклический" или "цикло", один или в комбинации, относится к группе, содержащей одно или несколько замкнутых колец, насыщенных ли, или ненасыщенных, и эти циклические системы имеют от 3 до 12 атомов в своей (циклической) структуре, предпочтительно от 3 до 7 атомов в своей (циклической) структуре. Используемый здесь термин "низший" относится к группе с 1-6 атомами в основной цепи. Используемый здесь термин "насыщенный" относится к группе, в которой все имеющиеся валентные связи атомов основной цепи связаны с другими атомами. Типичные примеры насыщенной группы включают, но не ограничиваются ими, бутил, циклогексил, пиперидин и т.п. Используемый здесь термин "ненасыщенный" относится к группе, в которой по крайней мере одна имеющаяся валентная связь двух соседних атомов основной цепи не связана с другими атомами. Типичные примеры ненасыщенной группы включают, но не ограничиваются ими, -СН 2 СН 2 СН=СН 2, фенил,пиррол и т.п. Используемый здесь термин "алифатический" относится к неразветвленной (прямой), разветвленной или циклической углеводородной группе, которая может быть замещенной или незамещенной и которая может быть насыщенной или ненасыщенной, но которая не является ароматической. Термин алифатический дополнительно включает алифатические группы, которые включают атомы кислорода, азота,серы и фосфора, замещающие один или несколько углеродов углеводородной цепи. Используемый здесь термин "ароматический" относится к ненасыщенной циклической углеводородной группе, имеющей 4n+2 делокализованных (пи)-электронов, которая может быть замещенной или незамещенной. Термин ароматический дополнительно включает ароматические группы, которые включают атом азота, замещающий один или несколько углеродов основной углеводородной цепи. Примеры ароматических групп включают, но ими не ограничиваются, фенил, нафтил, тиенил, фуранил, пиридинил, (из)оксазоил и т.п. Используемый здесь термин "замещенный" относится к группе, в которой один или несколько атомов водорода или других атомов углерода или подходящего гетероатома замещены другой группой. Используемые здесь предпочтительные замещенные группы замещены одним-пятью, наиболее предпочтительно одним-тремя заместителями. Атом с двумя заместителями обозначают "ди", в то время как атом с больше чем двумя заместителями обозначают "поли." Типичные примеры указанных заместителей включают, но ими не ограничиваются, алифатические группы, ароматические группы, алкил, алкенил,алкинил, арил, алкокси, галоген, арилокси, карбонил, акрил, циано, амино, нитро, фосфатсодержащие группы, серосодержащие группы, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, ациламино, амидино, имино, алкилтио,арилтио, тиокарбоксилат, алкилсульфинил, трифторметил, азидо, гетероциклил, алкиларил, гетероарил,семикарбозидо, тиосемикарбазидо, малеимидо, оксимино, имидат, циклоалкил, циклоалкилкарбонил,диалкиламино, арилциклоалкил, арилкарбонил, арилалкилкарбонил, арилциклоалкилкарбонил, арилфосфинил, арилалкилфосфинил, арилциклоалкилфосфинил, арилфосфонил, арилалкилфосфонил, арилциклоалкилфосфонил, арилсульфонил, арилалкилсульфонил, арилциклоалкилсульфонил, их комбинации и вышеуказанные с заместителями. Используемый здесь термин "незамещенный" относится к группе, которая не содержит никаких других групп, связанных с ней, или замещений в ней. Используемый здесь термин "алкил", один или в комбинации, относится к разветвленной или неразветвленной (прямой), насыщенной алифатической группе. Типичные примеры алкильных групп включают, без ограничения, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, третбутил, октил, децил, тетрадецил, гексадецил, эйкозил, тетракозил и т.п. Используемый здесь термин "алкенил", один или в комбинации, относится к разветвленной или прямой ненасыщенной алифатической группе, содержащей по крайней мере одну углерод-углеродную двойную связь, которая может находиться в любой стабильной точке вдоль цепи. Типичные примеры алкенильных групп включают, но ими не ограничиваются, этенил, Е- и Z-пентенил, деценил и т.п. Используемый здесь термин "алкинил", один или в комбинации, относится к разветвленной или неразветвленной (прямой), ненасыщенной алифатической группе, содержащей по крайней мере одну угле-3 012240 род-углеродную тройную связь, которая может находиться в любой стабильной точке по цепи. Типичные примеры алкинильных групп включают, но не ограничиваются ими, этинил, пропинил, пропаргил, бутинил, гексинил, децинил и т.п. Используемый здесь термин "арил", один или в комбинации, относится к замещенной или незамещенной ароматической группе, которая может быть необязательно конденсирована с другими ароматическими или неароматическими циклическими группами. Типичные примеры арильных групп включают, но не ограниваются ими, фенил, бензил, нафтил, бензилидин, ксилил, стирол, стирил, фенетил, фенилен, бензотриил и т.п. Используемый здесь термин "алкокси", один или в комбинации, относится к алкильной, алкенильной или алкинильной группе, связанной через простую (ординарную) концевую эфирную связь. Примеры алкоксигрупп включают, но не ограничиваются ими, метокси, этокси, н-пропокси, изопропокси, нбутокси, 2-бутокси, трет-бутокси, н-пентокси, 2-пентокси, 3-пентокси, изопентокси, неопентокси, нгексокси, 2-гексокси, 3-гексокси, 3-метилпентокси, фторметокси, дифторметокси, трифторметокси,хлорметокси, дихлорметокси и трихлорметокси. Используемый здесь термин "арилокси", один или в комбинации, относится к арильной группе, связанной через простую концевую эфирную связь. Используемый здесь термин "галоген", "галогенид" или "гало", один или в комбинации, относится к фтору "F", хлору "Cl", брому "Br", йоду "I" и астату "At". Типичные примеры групп галогена включают,но не ограничиваются ими, хлорацетамидо, бромацетамидо, иодацетамидо и т.п. Используемый здесь термин "гетеро", один или в комбинации, относится к группе, которая включает один или несколько атомов любого элемента, отличного от углерода или водорода. Типичные примеры гетерогрупп включают, но ими не ограничиваются, те группы, которые содержат гетероатомы, включая, но не ограничиваясь ими, азот, кислород, серу и фосфор. Используемый здесь термин "гетероцикл" относится к циклической группе, содержащей гетероатом. Типичные примеры гетероциклов включают, но не ограничиваются ими, пиридин, пиперадин, пиримидин, пиридазин, пиперазин, пиррол, пирролидинон, пирролидин, морфолин, тиоморфолин, индол,изоиндол, имидазол, триазол, тетразол, фуран, бензофуран, дибензофуран, тиофен, тиазол, бензотиазол,бензоксазол, бензотиофен, хинолин, изохинолин, азапин, нафтопиран, фуранобензопиранон и т.п. Используемый здесь термин "карбонил" или "карбокси", один или в комбинации, относится к группе, которая содержит углерод-кислородную двойную связь. Типичные примеры групп, которые содержат карбонил, включают, но не ограничиваются ими, альдегиды (т.е. формилы), кетоны (т.е. ацилы) карбоновые кислоты (т.е. карбоксилы), амиды (т.е. амидо), имиды (т.е. имидо), сложные эфиры, ангидриды и т.п. Используемый здесь термин "акрил", один или в комбинации, относится к группе, представленной СН 2=С(Q)С(О)O-, где Q означает алифатическую или ароматическую группу. Используемый здесь термин "циано", "цианат" или "цианид", один или в комбинации, относится к двойной связи углерод-азот. Типичные примеры циано групп включают, но не ограничиваются ими, изоцианат, изотиоцианат и т.п. Используемый здесь термин "амино", один или в комбинации, относится к группе, содержащей атом азота в основной цепи. Типичные примеры аминогрупп включают, но не ограничиваются ими, алкиламино, диалкиламино, ариламино, диариламино, алкилариламино, алкилкарбониламино, арилкарбониламино, карбамоил, уреидо и т.п. Используемый здесь термин "фосфатсодержащая группа" относится к группе, содержащей по крайней мере один атом фосфора в окисленном состоянии. Типичные примеры включают, но не ограничиваются ими, фосфоновые кислоты, фосфиновые кислоты, фосфатные сложные эфиры, фосфинидены, фосфино, фосфинилы, фосфинилидены, фосфо, фосфоно, фосфоранилы, фосфоранилидены, фосфорозо и т.п. Используемый здесь термин "серосодержащая группа" относится к группе, содержащей атом серы. Типичные примеры включают, но не ограничиваются ими, сульфгидрилы, сульфено, сульфино, сульфинилы, сульфосульфонилы, тио, тиоксо и т.п. Используемый здесь термин "необязательный" или "необязательно" означает, что впоследствии описанное событие или обстоятельство может или не может иметь место и что описание включает примеры, в которых указанное событие или обстоятельство имеет место и примеры, где этого нет. Например, выражение "необязательно замещенный алкил" означает, что алкильная группа может быть как замещенной, так и незамещенной, и что описание включает как незамещенный алкил, так и замещенный алкил. Термин "эффективное количество, при использовании ссылаясь на соединение, продукт или композицию, предусмотренные здесь, означает количество соединения, продукта или композиции, достаточное для получения желаемого результата. Необходимое (для введения) точное количество обычно варьируется в зависимости от используемого конкретного соединения, продукта или композиции, способа его введения и т.п. Таким образом не всегда можно определить точное "эффективное количество." Однако соответствующее эффективное количество может быть установлено квалифицированным в данной области специалистом, информированном в отношении раскрытия существа данного изобретения,используя только рутинное экспериментирование.-4 012240 Используемый здесь термин "подходящий" относится к группе, которая совместима с соединениями, продуктами или композициями, предусмотренными здесь для достижения поставленной цели. Пригодность для заявленной цели может быть установлена квалифицированным в данной области специалистом, используя только рутинное экспериментирование. Используемый здесь термин "гидролизуемый" относится к группе, или способной, или склонной к гидролизу (т.е. расщеплению молекулы или группы на две или несколько новых молекул или группу). 2. Соединения. Настоящее изобретение предлагает соединение, которое после расщепления одной связи кватернизованного амина дает соединение формулыR1 и R2 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гидроксил, галоген, алкокси, гетероцикл, циано, амино или, взятые вместе, образуют необязательно замещенный циклоалифатический радикал или необязательно замещенный арил;R3 представляет собой Н, необязательно замещенный алифатический радикал и необязательно замещенный арил; иR4 и R5 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гетероцикл, арилокси, карбокси или, взятые вместе, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил. Предпочтительно расщепление одной связи кватернизованного амина дает LY294002 (соединение 1). Настоящее изобретение также предлагает соединение формулы где кольцо А представляет собой бензольное кольцо;Z1 и Z2 независимо представляют собой S или О;R1 и R2 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гидроксил, галоген, алкокси, гетероцикл, циано, амино или, взятые вместе, образуют необязательно замещенный циклоалифатический радикал или необязательно замещенный арил;R3 представляет собой Н, необязательно замещенный алифатический радикал и необязательно замещенный арил;R4 и R5 независимо представляют собой Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, гетероцикл, арилокси, карбокси или, взятые вместе, образуют необязательно замещенный гетероцикл или необязательно замещенный гетероарил; иR6 представляет Н, необязательно замещенный алифатический радикал, необязательно замещенный арил, алкокси, карбокси, амино, гетероцикл, арилокси и необязательно замещенное к тому же таргетирующее средство; иL представляет группу линкера. В предпочтительном варианте соединения 2, 3 настоящего изобретения представляют такие соединения, где R1-кольцо A-R2 выбран из группы, состоящей из нижеследующего: В предпочтительном варианте соединения 2, 3 настоящего изобретения представляют собой такие соединения, где R4-N-R5 выбран из группы, состоящей из нижеследующего: В другом варианте соединения 2, 3 настоящего изобретения представляют собой такие соединения,где R6 выбран из группы, состоящей из нижеследующего:a. Линкер. В другом варианте соединение 3 настоящего изобретения представляет собой такие соединения, где группа линкера является гидролизуемой. Группа линкера пролекарства может быть расщеплена ферментативным расщеплением или предпочтительно гидролизом в физиологических условиях, включая, но не ограничиваясь ими, водную среду в организме животных, с получением соединения 2. Скорость гидролиза группы-линкера при физиологических условиях составляет предпочтительно от около 1 мин полупериода существования до около 48 ч полупериода существования.b. Гидролиз. Используемый здесь термин "гидролизуемый" относится к группе, или способной, или склонной к гидролизу (т.е. расщеплению молекулы или группы на две или несколько новых молекул или группу вследствие net внедрения молекулы воды) со скоростью около 1 мин полупериода существования до 48 ч полупериода существования. Линкерная группа может быть любой группой, которая может гидролизоваться или расщепляться ферментативным путем с получением соединения 2. В предпочтительном варианте линкерная группа имеет формулуR7 представляет -СН 2-, -СН(СН 3)-, -CH(Ph)-, -С(СН 3)(СООН)- или СН(СН(СН 3)2)-. Типичный пример гидролиза группы-линкера пролекарства с получением соединения 2 представ-7 012240 лен на схеме 1, где Z3 и Z4 независимо представляют, каждый, О. Гидролиз или ферментативное расщепление R6 сложного эфира дает гемиаминаль, который схлопывается с выделением R7 альдегида, тем самым генерируя соединение 2, содержащее свободный третичный амин. Как R6, так и R7 можно подобрать таким образом, чтобы обеспечить различные скорости превращения обратно в свободный третичный амин. Например, введением замещения в R6 и R7, или их комбинации, можно повысить устойчивость к гидролизу. Кроме того, электрон-акцептирующие группы на R6-остатке снижают устойчивость. Помимо изменения R6 и R7, раскрытых здесь, дополнительные факторы, которые могут изменять стабильность кватернизованного амина, можно найти в N. Bodor, Journal of Medicinal Chemistry 1980, vol. 23 5 p. 469480 "Soft Drugs. 1. Labile Quaternary Ammonium Salts as Soft Antimicrobials"; and G. Brouillette et al.; Journal of Pharmaceutical Sciences, 1996, vol. 85 6, p. 620-623, содержание которых включено в настоящее описание в виде ссылки. Схема 1 с. Таргетирующее средство. В другом варианте соединения настоящего изобретения представляют соединения, где R6 дополнительно включает одно или несколько таргетирующих средств (Т), ковалентно связанных с ним. Таргетирующие средства дают возможность селективно доставить пролекарства настоящего изобретения в конкретные типы клеток, тканей, органов или внеклеточных структур. Как было обсуждено выше, лечение соединением 1 (LY 294002) осложняется его низкой биодоступностью, быстрым метаболизмом (превращением в организме) и побочными действиями, так как соединение не является специфичным в отношении ткани (тканеспецифичным). В соответствии с этим крайне желательно ограничить локализацию лекарственного средства в той области лечения или, по крайней мере, не допустить его доставку в ткани,где оно может вызвать побочные действия, и гарантировать использование эффективных, но нечрезмерных количеств лекарственного средства в любое конкретное время. Использование таргетирующих средств может позволить пролекарствам настоящего изобретения сконцентрироваться в месте лечения, а не равномерно распределиться по всему телу или подвергнуться преждевременному превращению или достаточно быстро экскретировать. Сразу после доставки к месту лечения линкер может быть отщеплен ферментативным путем или гидролизован, как описано выше, с получением соединения 2. Кроме того,использование таргетирующих средств может ограничить дозу, необходимую для введения, чтобы достичь эффективной концентрации лекарственного средства в месте лечения. Использование таргетирующих средств позволяет избежать частого введения доз или даже сделает возможным использование альтернативных способов введения для того, чтобы обеспечить эффективную концентрацию лекарственного средства в месте лечения. Таргетирующие средства предпочтительно связаны с соединениями по данному изобретению посредством ковалентной связи, которая может быть образована способами, включая, но не ограничиваясь ими, ковалентное взаимодействие нуклеофильной или электрофильной группы таргетирующего средства с электрофильной или нуклеофильной группой (соответственно) на линкере. В одном варианте настоящего изобретения соединения 2, 3 настоящего изобретения представляют собой соединения, где R6-T выбран из группы, состоящей из нижеследующего: Таргетирующие средства, которые могут быть подвергнуты взаимодействию с пролекарствами настоящего изобретения, включают, но не ограничиваются ими, углеводы, витамины, пептиды, белки, нуклеозиды, нуклеотиды, нуклеиновые кислоты, липосомы, липиды, остеотропные средства и имеющие сродство к хрящевой ткани средства. Таргетирующее средство может также представлять собой молекулу, которая связывается с рецептором в желаемой ткани и необязательно транспортируется в клетку рецептор-опосредованным способом. Типичные примеры таких таргетирующих средств включают, без ограничения, диазепины, которые связываются с переферическими бензодиазепиновыми рецепторами(PBRs), присутствующими в глиальных клетках в головном мозге. Типичные примеры указанных диазепинов рассмотрены в публикации G. Trapani, et al. Bioconjugate Chem. 2003, vol. 14, p. 830-839 "PeripheralTumors, содержание которой включено в настоящее описание путем ссылки. Типичные витамины, которые могут быть использованы в качестве таргетирующих средств, включают, без ограничения, фолат, витамин B12 или витамин С. Термин "фолат" охватывает производные фолиевой кислоты со способностью связываться с фолат-рецепторами. Типичные примеры фолатов, которые могут быть использованы в качестве таргетирующих средств, включают, но не ограничиваются ими,фолиевую кислоту, фолиновую кислоту, птерополиглутаминовую кислоту, и связывающиеся с фолатным рецептором птеридины, такие как тетрагидроптерины, дигидрофолаты, тетрагидрофолаты и их деаза- и дидеазааналоги. Другие подходящие фолаты представляют собой аналоги фолата, включая, но не ограничиваясь ими, аминоптерин, аметоптерин (метотрексат), N10-метилфолат, 2-дезаминогидроксифолат,деазааналоги, такие как 1-деазаметоптерин или 3-деазаметоптерин, и 3'5'-дихлор-4-амино-4-дезокси-N10 метилптероилглутаминовую кислоту (дихлорметотрексат). Способы конъюгирования молекул с фолатами, которые являются подходящими для ковалентного связывания с соединениями по данному изобретению, раскрыты в патентах США 6576239, 5820847, 5688488, 5108921, 5635382 и 5416016, содержание которых включено в настоящее описание в виде ссылки. Способы конъюгирования молекул с витамином С, которые пригодны для ковалентного связывания с соединением настоящего изобретения, раскрыты вS. Manfrdini J. Med. Chem. Vol. 45, p. 559-562, 2002, содержание которого включено в настоящее описа-9 012240 ние в виде ссылки. Типичные пептиды и пептидомиметики, которые могут быть использованы в качестве таргетирующих средств, включают, без ограничения, RGD-содержащий пептид, выбранный из группы, состоящей из RGD, c(RGDfK), витронектины, фибронектина, агонистов рецептора соматостатина и антагонистов рецептора соматостатина. Молекулы, которые связываются с рецептором avb3 интегрина и действуют в качестве антагонистов, могут быть использованы в качестве таргетирующих средств, как описано в патентах США 6552079, 6426353 В, международной публикации WO 2002/40505 A2, и публикациях патентов США 2002/0055499, 2002/0061885, 2002/0065291, 2002/0072500, U.S. 2002/0072518; W. Arap et al.DA Sipkins et al. Nature Medicine vol. 4, number 5, 1998 pp. 623-626; P.M. Winter et al. Cancer Research 2003, vol. 63, pp. 5838-5843; и J.D. Hood et al. Science vol. 296, p. 2404-2407; содержание которых входит в настоящее описание в виде ссылок. Типичные белки, которые могут быть использованы в качестве таргетирующих средств, включают, без ограничения, антитела или их фрагменты, такие как опухольспецифическое моноклональное антитело или его фрагмент. Типичные остеотропные средства, которые могут быть использованы в качестве таргетирующих средств, включают, без ограничения, фосфонат,фосфоновую кислоту, аминометилфосфоновую кислоту, фосфат, полифосфат и гидроксиапатитсвязывающие полипептиды. Другие пептиды включают хлортоксин (SU 6429187B1) и тканевый факторResonance Imaging Nanoparticle Contrast Agent"; Circulation, 2002, volume 106, p. 2842-2847). Другие подходящие таргетирующие средства включают антитела. Антитела могут представлять собой антитела классов IgG, IgM, IgA, IgD или IgE, или их фрагменты или их производные, включая Fab,F(ab')2, Fd, и одноцепочечные антитела, двухцепочечные антитела, биспецифические антитела, бифункциональные антитела и их производные. Антитело может быть моноклональным антителом, поликлональным антителом, антителом со сродством определенного типа, или их смесями, которое проявляет достаточную связывающую специфичность по отношению к желаемому эпитопу (антигенная детерминанта) или последовательности, полученной из него. Антитела могут также представлять собой химерное антитело. Антитела могут быть направлены против ряда антигенных детерминант, включая антигенные детерминанты, связанные с опухолями, гистосовместимостью, и других антигенов клеточной поверхности, бактерий, грибов, вирусов, ферментов, токсинов, лекарственных средств и других биологически активных молекул. Антигены, ассоциируемые с опухолями, по отношению к которым антитела могут быть специфично реакционноспособны, включают, но не ограничиваются ими, карциноэмбриональный антиген (СЕА), муцины, такие как TAG-72, глобулярные антигены жира человеческого молока, простатические сыворотные антигены (PSA), простатический специфический мембранный антиген (PSMA), PS(фосфатидилсерин), и рецепторы, включая, но не ограничиваясь ими, рецепторы IL-2, EGF, VEGF и трансферрина. Другие типичные антигены, ассоциируемые с опухолями, включают, без ограничения,ассоциируемые с опухолями антигены, описанные в Zaicberg and McKenzie, J. Clin. Oncology, Vol. 3; p. 876-82 (1985), WO 01/68709 A1 и публикации патента США 2004/0009122 А 1, содержание которых входит в настоящее описание в виде ссылки. Другие подходящие таргетирующие средства включают глюкозу, галактозу, маннозу, маннозо-6 фосфат, гормоны (например, инсулин, гормон роста и т.п.), ростовые факторы или цитокины (например,TGF, EGF, инсулиноподобный ростовой фактор и т.п.), YEE(GalNAcAH).sub.3 или производные, кобаламин, -2 макроглобулины, гликопротеин, несодержащий частей солевой кислоты, альбумин, тексафирин, металлотексафирин, антитела, фрагмента антител (например, Fab), вариабельную область одноцепочечного антитела (scFv), трансферрин, любой витамин и любой кофермент. Таргетирующее средство может также представлять собой средство, которое доставляет пролекарство в костные ткани. Средства, обеспечивающие доставку в костные ткани (остеотропные средства),включают, но не ограничиваются ими, EDTMP, DOTMP и ABEDTMP, которые раскрыты в патентах США 4937333, 4882142, 5064633 и международной публикации WO 94/00143, содержание которых входит в настоящее описание в виде ссылки. DOTMP и EDTMP могут быть присоединены к остатку линкера любым способом, включая, без ограничения, химию связывания, представленную на фиг. 3, и химию алкилирования, представленную на фиг. 4, где группа R может содержать соответствующую электрофильную или нуклеофильную группу, которая взаимодействует с нуклеофильной или электрофильной(соответственно) группой на остатке линкера. Дополнительные детали относительно химии связывания рассмотрены в публикации Tetrahedron 1999, 55, p. 12997-13010, содержание которой входит в настоящее описание в виде ссылки. Дополнительные детали относительно химии алкилирования представлены вProc. SPIE-Int. Soc. Opt. Eng. 1999, 3600; Biomedical Imagn. Reporters DyesInstrumental, p. 99-106; патенте США 5177054; J Med. Chem. 1994, 37, 498-511; Tetrahedron Letters, 1989, 30 51 pp. 7141-7144; и патенте США 5955453, содержание которых включено в настоящее описание в виде ссылки. Таргетирующее средство может быть использовано для доставки пролекарства в костные ткани в виде резервуара, медленно высвобождающего соединения настоящего изобретения. Таргетирующее средство может представлять собой обладающий тропностью к костной ткани (остеотропный) остаток,- 10012240 связанный с соединениями настоящего изобретения посредством расщепляемого кислотой линкера, присоединенного к кватернизованному амину. Примеры расщепляемого кислотой линкера включают, без ограничения, связь ортокислота-амид. При кислых условиях протеин-ACL-3 амидная связь легко расщепляется, высвобождая нативную аминогруппу амидной функциональности, как описано в международной публикации WO 94/00143, содержание которой включено в настоящее описание в виде ссылки. Во время резорбции остеокластической костной ткани, которая происходит по кислотно-опосредованному механизму, соединение, привязывающее пролекарство к костной ткани, может расщепляться, высвобождая соединения по данному изобретению. Таргетирующее средство, используемое для доставки пролекарств к костным тканям, может быть молекулой, которая связывается с Notch-рецепторами. Передача сигналов локуса notch играет ключевую роль в развитии и дифференциации различных гемопоэтических процессов (нарушений). Как обсуждено в Jundt et al., Blood, 102 (11): 928a (2003), лигандиндуцированная передача сигнала локуса Notch представляет собой новый ростовой фактор для клеток множественной миеломы и, предполагается, что эти взаимодействия способствуют лимфомагенезу множественной миеломы in vivo. Таргетирующее средство, используемое для доставки пролекарств к костным тканям (остеотропное средство), может иметь высокое сродство в отношении ионов кальция в гидроксиапатите, основная составляющая костной ткани. Соединение по данному изобретению может целенаправленно атаковать отложения кальция в областях тела других, чем костная ткань, как, например, отложения кальция в артериях, сердце, почке, желчном пузыре. Однако остеотропное средство идеально селективно связывается с костной тканью. Остеотропное средство притягивается к костной ткани субъекта, предпочтительно связывается с костной тканью при более высоком сродстве, чем с тканями некостной природы, и остается связанным в течение определенного периода времени, доставляя таким образом композицию в среду костной ткани. Другими словами, остеотропное средство предпочтительно связывается с костной тканью при сродстве, по крайней мере в 2 раза более высоком, (например, при сродстве по крайней мере в 3 раза,по крайней мере в 5 раз, по крайней мере в 10 раз или по крайней мере в 25 раз более высоком), чем остеотропное средство связывается с тканью некостной природы. Остеотропное средство обратимо связывается с костной тканью, что означает, в конечном счете, высвобождение остеотропного средства из костной ткани и выталкивание его из организма. Остеотропное средство может оставаться связанным с костной тканью в течение периода времени,достаточного для того, чтобы дать возможность кватернизованному пролекарству прогидролизоваться,тем самым, доставляя активное лекарственное средство в клетки-мишени (например, клетки костного мозга). Остеотропное средство может оставаться связанным с костной тканью в течение от около 1 дня(например, около 2 дней, около 3 дней или около 7 дней) до около 1 года (например, около 330 дней,около 365 дней или около 400 дней), и по истечении этого времени остеотропное средство выбрасывается из организма. Остеотропное средство может оставаться связанным с костной тканью в течение от около 7 дней (например, около 7 дней, около 14 дней или около 21 дней) до около 6 месяцев (например, около 90 дней, около 120 дней или около 150 дней). Например, остеотропное средство может оставаться связанным с костной тканью в течение от около 30 дней и в течение этого времени лекарственное средство высвобождается. По истечении около 45 дней остеотропное средство должно высвободиться из костной ткани и, в конечном счете, экскретировать. Таким образом, остеотропное средство для использования в данном изобретении может быть выбрано, исходя из кинетики связывания с костной тканью. Наиболее перспективные с этой точки зрения остеотропные средства могут быть скринированы in vitro, определяя сродство к костной ткани (например, гидроксиапатиту) в многолуночном формате. Наиболее перспективные с этой точки зрения остеотропные средства могут быть также скринированы in vivo, оценивая скорость и хронометраж экскреции наиболее перспективных остеотропных средств из организма. В этом отношении остеотропное средство предпочтительно выводится из организма через почки. Остеотропное средство, в соответствии с желанием, выбирают из фосфата, фосфоната, бифосфоната, гидроксибифосфоната, аминометиленфосфоновой кислоты и кислого пептида. Остеотропное средство данного изобретения может нести одну, больше чем одну или смесь указанных групп. Например, остеотропное средство может быть фосфонатом, что означает, что остеотропное средство может включать один фосфонат, два фосфоната или три или большее число фосфонатов. Одно подходящее остеотропное средство, используемое в настоящем изобретении, представляет собой EDTMP (этилендиамин-N,N,N',N'тетракисметиленфосфоновая кислота), химическая структура которой показана на фиг. 1, в настоящее время одобренное FDA (Quadramet) в виде радиоактивного комплекса 153Sm для доставки избирательной дозы облучения в метастаз в костную ткань для смягчения боли. EDTMP представляет собой фосфонат, который содержит четыре группы фосфоновой кислоты и, в соответствии с этим, представляет собой тетрафосфонат. Соединения, такие как 153Sm-EDTMP, селективно локализуются в костной ткани, где присутствуют опухоли, по сравнению с нормальной костной ткани, при соотношении, больше чем 10:1,вероятно, потому что метаболический оборот кальция очень высок в метастатической области. 153SmEDTMP, как сообщается, быстро поглощается скелетом в метастазах остеобластической костной ткани и уходит из плазмы. Та часть соединения, которая не аккумулируется в скелете, как сообщается, быстро экскретирует и экскреция почти полностью происходит в пределах 6 ч после введения. (Jimonet et al.,- 11012240Heterocycles, 36, 2745 (1993. Предполагается, что смягчение боли обусловлено облучением, исходящим от изотопа, связанного с метастазами остеобластической костной ткани, оказывающем некоторое действие на близлежащие метастические опухолевые клетки. Другой клинически полезной остеотропной системой является DOTMP, химическая структура которого представлена на фиг. 1 и который в настоящее время проходит клинические испытания фазы III (называемая STR, целенаправленная доставка облучения в скелет) в виде радиоактивного комплекса 166 Но, предназначенной для доставки больших доз облучения селективно в костный мозг для лечения множественной миеломы. Следует отметить, что радиоактивный комплекс 166Ho-DOTMP локализуется в скелетной системе и облучает близлежащий костный мозг, который вмещает злокачественные клетки миеломы. Аналогично 153Sm-EDTMP системе, фосфонат,который не локализуется в костной ткани, выводится из организма через мочу. В общем, поглощение скелетом составляет от около 20 до около 50% от введенной с помощью инъекции дозы, и локализация в областях скелета с опухолевым инфильтратом представлена на фиг. 7, Bayouth et al., J. Nucl. Med., 36,730 (1995). Предпочтительным остеотропным средством является полифосфоновая кислота. Полифосфоновая кислота, как было показано, с успехом целенаправленно доставляет биологически активные молекулы в костные ткани. Например, конъюгация (посредством изотиоцианато-химии) полиаминофосфоновых кислот, таких как ABDTMP, химическая структура которой представлена на фиг. 1, с ростовыми факторами(чтобы стимулировать остеогенез) успешно привела к целенаправленной доставке ростовых факторов в костную ткань крыс (см., например, международную патентную заявку WO 94/00145). Аналогично, остеотропные средства были связаны с белками. Например, биофосфонаты, которые были конъюгированы с человеческим сывороточным альбумином, успешно доставляли белок в костную ткань in vitro (Biotechnol. Prog., 16. 258 (2000 и in vivo (Biotechnol. Prog., 16, 1116 (2000. Использование остеотропных средств простирается за пределы доставки белков к костным тканям и включает, например, небольшие терапевтические молекулы. Конъюгат, содержащий обладающий тропностью к костной ткани бисфосфонат и алкилирующее средство, такой как BAD (химическая структура которого представлена на фиг. 1, был генерирован (см., например, Wingen et al., J. Cancer Res. Clin. Oncol., 111, 209 (1986. В этой молекуле, алкилирующее средство не является специфичным в своем взаимодействии с мишенью (ДНК,DNA), и поэтому нет необходимости в расщеплении между бисфосфонатом (т.е. остеотропным средством) и алкилирующим остатком. Бисфосфонат-алкилирующее средство проявило эффективность в модели остеосаркомы у крыс, используя BAD. Был проведен другой ряд исследований, используя антифолат противоопухолевое средство, метотрексат, которое было ковалентно связано с бисфосфонатами с получением конъюгата, обозначенного МТХ-ВР и представленного на фиг. 1 (см., например, Sturtz et al., Eur.J. Med. Chem., 27, 825 (1992); Sturtz et al., Eur. J. Med. Chem., 28, 899 (1993); и Hosain et al., J. Nucl. Med.,37, 105 (1996. Используя Тс-99m-меченый МТХ-ВР, было установлено, что около 15% введенной с помощью инъекции дозы локализуется в скелете через 4 ч после введения, при этом 61% дозы оказалось экскретировано (Hosain, см. выше). Кроме того, МТХ-ВР демонстрирует в пять раз более высокую противораковую активность по сравнению с метотрексатом, как таковым, на животных моделях трансплантированной остеосаркомы (Sturtz 1992, см. выше). Аналогичная работа была описана, используя конъюгат CF-BP, группа карбоксифлуоресцеина с бифосфонатом на конце, чья химическая структура показана на фиг. 1 (Fujisaki et al., Journal of Drug Targeting, 4, 117 (1994. В этой молекуле группа CF представляет собой флуоресцентную метку-индикатор для количественной оценки фармакокинетики и биораспределения, и она связана с остеотропным средством через сложноэфирную связь, которая чувствительна к гидролизу in vivo. Исследования на крысах, инъецированных внутривенно, показали, что CF-BP локализовался в костной ткани и служил механизмом медленного высвобождения CF, генерируемого посредством общего гидролиза сложноэфирной связи (Fujisaki, см. выше). В другом варианте остеотропное средство может быть пептидом, таким как (Asp)6 и (Glu)6. Обогащенная кислотой пептидная последовательность гликопротеин остеонектина, который имеется в избытке в костной ткани и дентине, имеет сильное сродство к гидроксиапатиту (Fujisawa et al., Biochimica et Biophysica Acta, 53, 1292 (1996. Таким образом, пептидные лиганды, содержащие кислые аминокислоты,являются идеальными кандидатами для остеотропных средств. Действительно, (Glu)10, при связывании с биотином, успешно доставлял меченый стрепавидин в гидроксиапатит (описано подробно в Chu and Orgel, Bioconjugate Chem., 8, 103 (1997), и международной патентной заявке WO 98/35703). Кроме того,период биологического полувыведения флуоресцеин-изотиоцианата, конъюгированного с (Asp)6, составлял 14 дней в бедренной кости (Kasugai et al., Journal of Bone and Mineral Research, 15(5), 936 (2000, который является приемлемым периодом полувыведения для остеотропного средства настоящего изобретения. Аналогично, доставка конъюгатов эстрадиол-(Asp)6 в костную ткань была продемонстрирована на животных, подвергнутых овариэктомии, с сопутствующим ингибированием остеопороза типа osteoporectic (Kasugai et al., Journal of Bone and Mineral Research (Suppi 1), 14, S534 (1999. Полагают, что связь(Asp)6 с костной тканью подвергается метаболизму во время процесса ресорбции костной ткани, опосредованного остеокластами. Поэтому, кислый пептидный лиганд обеспечивает не только средство вербовки соединений в костную ткань, но также обеспечивает механизм медленного высвобождения соединений в остеоциты и окружающую ткань.- 12012240 Другие примеры остеотропных средств включают, но не ограничиваются ими, амино- и гидроксиалкилфосфоновые кислоты и дифосфоновые кислоты; гидроксибисфосфоновые кислоты, включая алендронат, памидронат, 4-аминобутилфосфоновую кислоту, 1-гидроксиэтан-1,1-дифосфоновую кислоту и аминометиленбисфосфоновую кислоту; фосфаты, такие как фитиновая кислота; и аминометиленфосфоновые кислоты, такие как N,N-бис(метилфосфоно)-4-аминобензойная кислота и нитрилотри(метилфосфоновая кислота). Неограничивающие примеры некоторых остеотропных средств представлены на фиг. 2. Предпочтительно остеотропное средство представляет собой аминометиленфосфоновую кислоту. Под термином "аминометиленфосфоновая кислота" понимают соединение, которое содержит остаток-NCH2PO3H, где аминогруппа имеет одну, две или три присоединенные группы метиленфосфоновой кислоты, и может быть дополнительно замещена другими химическими остатками. Аминометиленфосфоновая кислота может включать одну или несколько групп фосфоновой кислоты и одну или несколько аминогрупп. Примеры указанных аминометиленфосфоновых кислот включают, но не ограничиваются ими, соединения "F-N", показанные на фиг. 2. Предполагается, что вышеуказанные остеотропные средства и другие остеотропные средства могут быть присоединены через один из гетероатомов или путем химической модификации, которая устанавливает дополнительную точку присоединения. Например, EDTMP может быть связана с линкером одним из оксидов фосфора, образуя фосфонатную связь, как иллюстрировано на фиг. 3 (см., например, Vieira deAlmedia et al., Tetrahedron, 55, 12997-13010 (1999. Фосфористый кислород может быть также алкилирован, как показано на фиг. 4, где группа R может иметь, например, боковую аминогруппу, обеспечивая точку вторичного присоединения для лигирования, например, с активированным ПЭГ (PEG). Другие типы алкилирования, которые могли бы быть использованы в данном изобретении, включают, без ограничения, примеры, аналогичные примеру, включающему DOTMP, как подробно было описано в Chavezet al., Biomedical Imaging: Reporters, Dyes.Instumentation, ContagSevick-Muracia, Eds., Proc. SPIE,Vol. 3600, 99-106 (July, 1999), или как показано для других фосфоновых кислот, подробно описанных,например, в патенте США 5177064, патенте США 5955453, de Lombaert et al., J. Med. Chem., 37, 498-511(1994), and Iyer et al., Tetrahedron Letters, 30(51), 7141-7144 (1989). Альтернативно, в случае химической модификации, EDTMP может быть, например, модифицирован с получением ABDTMP путем инсталляции группы анилина (как подробно показано, например, на фиг. 1 международной патентной заявкиWO 94/00145). Амин анилина впоследствии пригоден для образования, например, амидной связи. Аналогично может быть модифицирован DOMTP, как описано в общих чертах на фиг. 5. Подразумевается, что термины "фосфонат, фосфат и аминометиленфосфонат" охватывают фосфоновые кислоты, фосфорные кислоты и аминометиленфосфоновые, соответственно, а также их любые соли, гидролизуемые сложные эфиры и пролекарства на основе фосфорсодержащих кислот. При биологическом pH 7,4 в крови, или более кислом pH около кости, некоторая часть фосфата или фосфоната остеотропного средства может быть депротонирована и заменена противоионом. Кроме того, обмен протона на кальций - неотъемлемое событие для связывания остеотропного средства с гидроксиапатитом в настоящем изобретении. Однако получение и введение композиции, содержащей остеотропное средство,могут требовать или могут не требовать полной протонизации фосфористых кислот в нем. Поэтому фосфоновую кислоту, фосфорную кислоту и аминометиленфосфоновую кислоту изображают и используют взаимозаменяемо с фосфатом, фосфонатом и аминометиленфосфонатом. При отсутствии особого предпочтения, биологически гидролизуемые сложные эфиры на основе фосфорсодержащих кислот могут быть также использованы для in vivo использования остеотропных пролекарств. Аналогично, пролекарства на основе фосфорсодержащих кислот могут быть также использованы in vivo для маскировки кислотности композиции во время, например, изготовления и введения. Таргетирующее средство может также представлять собой средство, которое целенаправленно доставляет лекарственное средство, исходя из свойств конкретной ткани. Типичные примеры таких таргетирующих средств включают, но не ограничиваются ими, полимеры, которые селективно локализуются в опухолевых тканях вследствие эффекта EPR (повышенная проницаемость и удерживание), описанного в публикациях Н. Maeda et al. "Tumor vascular permeability and the EPR effect in macromolecular therapeutics:A Review"; Journal of Controlled Release, 2000, vol. 63, p. 271-284, содержание которых входит в настоящее описание в виде ссылки. Другие типичные полимеры представляют собой N-(2 гидроксипропил)метакриламид (НРМА) и (поли)L-глутаминовые кислоты. Таргетирующее средство может также включать остаток RGD. Как было обсуждено в Curnis et al.,Cancer Research, 64(2): 565-571 (2004), остатки RGD доставляют RGD-слитые белки в сосудистую сеть путем взаимодействия с клеточными адгезионными рецепторами, включая рецептор интегрина - v3. 3. Синтез. а. Основная циклическая система. Соединения настоящего изобретения могут быть синтезированы, используя LY294002 (соединение 1) в качестве исходного продукта. LY294002 (соединение 1) может быть получено коммерчески или синтезировано, как описано в примере 1 или как описано в патенте США 5703075, содержание которого включено в настоящее описание в виде ссылки. Квалифицированный специалист среднего уровня в дан- 13012240 ной области может также синтезировать соединения настоящего изобретения, используя соединение 2 в качестве исходного продукта.b. Получение производных основной циклической системы. Основная циклическая система соединений 2 и 3 может представлять собой производные основной циклической системы LY294002 (соединение 1). Производные основной циклической системы соединения 3 можно получить, как описано в патенте США 5703075, содержание которого включено в настоящее описание в виде ссылки, для получения основного цикла производных LY294002 (соединение 1). Производные основной циклической системы соединения 3 могут быть также получены, используя коммерчески доступные соединения, включая, но не ограничиваясь, замещенные 2-гидроксиацетофеноны.c. Получение производных морфолинового кольца. Аминовые производные соединения 3 можно получить замещением тиоалкильной группы в примере 1 в условиях, начиная от комнатной температуры и до форсирующих условий (избыток нуклеофила и нагревание до 110 С). Любой первичный или вторичный азотсодержащий нуклеофил может взаимодействовать с получением альтернативных замещений амина в кольцевой структуре морфолина (включая различные аналоги морфолина). Синтез типичных примеров таких аминовых производных соединения 3 описаны в примерах настоящего описания.d. Получение сложных эфиров. Как описано выше, сложные эфиры могут быть использованы для получения кватернизованных соединений настоящего изобретения. Кватернизованные соединения по данному изобретению предпочтительно получают, используя галогенсодержащие сложные эфиры. В одном предпочтительном варианте кватернизованные соединения по изобретению получают, используя хлорметиловые сложные эфиры. Многочисленные хлорметиловые сложные эфиры, используемые для получения соединений по изобретению, являются доступными от коммерческих источников. Кроме того, хлорметиловые сложные эфиры можно синтезировать, как описано в WO 02/42265, WO 94/23724 и патентах США 4444686, 4264765 и 4342768, содержание которых входит в настоящее описание.e. Кватернизация. Пролекарства настоящего изобретения могут быть получены кватернизацией третичного амина соединения 1 или соединения 2 галогенметиловым сложным эфиром, например, как описано в примере 4 и примере 6. Кватернизованные аминовые соединения обычно необратимы при умеренных условиях. Однако кватернизованные соединения по данному изобретению могут легко гидролизоваться, как описано выше. Галогенметиловые сложные эфиры, которые могут быть использованы для кватернизации третичного амина соединения 1 или соединения 2, коммерчески доступны или их можно получить, как описано в нижеследующих примерах.f. Линкеры. Пролекарства по данному изобретению могут быть также получены кватернизацией третичного амина соединения 1 или соединения 2 линкером, содержащим по крайней мере две функциональные группы. Линкер может быть любым природным или синтетическим линкером, который способен кватернизовать третичный амин и который также способен ковалентно связываться с таргетирующей молекулой или может уже быть связан с таргетирующей молекулой. Линкеры предпочтительно состоят из атома, такого как кислород или сера, части звена, такой как-NH-, -СН 2-, -С(О)-, -C(O)NH- или цепи из атомов. Молекулярная масса линкера, как правило, находится в диапазоне от около 14 до 200, предпочтительно в диапазоне от 14 до 96 при длине вплоть до около 6 атомов. Типичные примеры линкеров включают, но не ограничиваются ими, насыщенную или ненасыщенную алифатическую группу, которая является необязательно замещенной и в которой один или два насыщенных углерода цепи необязательно заменены на -С(О)-, -С(О)С(О)-, -CONH-, -CONHNH-,-С(O)O-, -ОС(О)-, -NHCO2-, -O-, -NHCONH-, -OC(O)NH-, -NHNH-, -NHCO-, -S-, -SO-, -SO2-, -NH-,-SO2NH- или -NHSO2-. Первую функциональную группу линкера используют для кватернизации третичного амина, как обсуждено выше. Предпочтительной первой функциональной группой является галогенметилсодержащий сложный эфир, включая, без ограничения, хлорметилсложный эфир и йодметилсложный эфир. Вторая функциональная группа линкера может быть использована для ковалентного присоединения таргетирующего средства. Вторая функциональная группа может быть электрофильной или нуклеофильной группой. Предпочтительные вторые функциональные группы для ковалентного присоединения таргетирующих групп представляют собой изотиоцианат, галогенацетамид, малеимид, имидосложный эфир, тиофталимид, Nгидроксисукцинимилсложный эфир, пиридилдисульфид, фенилазид, карбоксил (и его хлорангидриды),амино, ацилгидрозид, семикарбазид, тиосемикарбазид, диазоний, гидразин, азид, аминоалкилмочевину,аминоалкилтиомочевину, галогентриазин и мета(дигидроксиборил)фенилтиомочевину. Другие подходящие реакционноспособные остатки, которые могут быть подходящими для ковалентного присоединения пролекарств по данному изобретению к таргетирующим средствам, включают дисульфиды, нитрены,сульфонамиды, карбодиимиды, сульфонилхлориды, бензимидаты, -СОСН 3 и -SO3H. Выбор соответствующей второй функциональной группы обычно зависит от функциональной- 14012240 группы таргетирующего средства, с которым будет образовываться ковалентная связь, и от потери биологической активности таргетирующего средства в результате образования данного типа связи. Если таргетирующее средство является белком, вторая функциональная группа может быть реакционноспособной в отношении боковых цепных групп аминокислот, составляющих полипептидную основную цепь. Такие боковые цепные группы включают карбоксильные группы остатков аспарагиновой кислоты и глутаминовой кислоты, аминогруппы остатков лизина, ароматические группы тирозина и гистидина и сульфурильные группы остатков цистеина. Боковые карбоксильные группы, представленные таргетирующим средством, таким как полипептидная основная цепь, могут быть подвергнуты взаимодействию с аминовыми вторыми функциональными группами посредством реакции, протекающей в растворе с участием карбодиимида. Боковые аминогруппы, представленные таргетирующим средством, могут быть подвергнуты взаимодействию с изотиоцианат-, изоцианат- или галогентриазин-вторыми функциональными группами, чтобы осуществить связь с пролекарствами по изобретению. Альтернативно, боковые аминогруппы на таргетирующем средстве могут быть связаны с пролекарственными соединениями по данному изобретению, несущими аминовые реакционноспособные группы, посредством бифункциональных средств, таких как диальдегиды и имидосложные эфиры. Ароматические группы, представленные таргетирующим средством, могут быть связаны с пролекарствами по изобретению через производные диазония. Сульфгидрильные группы на молекулах таргетирующего средства могут быть подвергнуты взаимодействию с малеимидами или с галогеналкилсодержащими реакционноспособными группами таргетирующего средства, такими как иодацетамид. Свободные сульфгидрильные группы, подходящие для таких реакций, могут быть генерированы из дисульфидных связей белка-иммуноглобулина или могут быть введены химическим превращением в производные. Связь со свободными сульфгидрильными группами, генерированными в области интра-тяжелой цепи иммуноглобулинов, не мешает месту связывания иммуноглобулина с антигеном, но может сделать антитело неспособным к активации комплемента. Когда таргетирующее средство представляет собой гликозилированный белок, альтернатива для образования связи с соединением настоящего изобретения посредством полипептидной основной цепи состоит в образовании ковалентной связи с углеводными боковыми цепями гликопротеина согласно способам, таким как представлены в McKearn, et al., EPO 88695. Так, углеводные боковые цепи антител могут быть селективно окислены с получением альдегидов, которые затем могут быть подвергнуты взаимодействию либо с аминовыми реакционноспособными группами с образованием основания Шиффа,либо с гидразин-, семикарбазин или тиосемикарбазидными реакционноспособными группами с получением соответствующих гидразон-, семикарбозон- или тиосемикарбазоновых связей. Такие же способы могут быть использованы для связывания пролекарств по данному изобретению с таргетирующими средствами небелковой природы, такими как углеводы и полисахариды. Альтернативной реакционноспособной частью таргетирующего средства, используемой для связи с углеводами и полисахаридами без необходимости предшествующего окисления, является дигидроксиборильные группы, такие как присутствует в производных мета(дигидроксиборил)фенилтимочевины. Эта группа является реакционноспособной в отношении таргетирующих средств, содержащих 1,2-цис-диол,образуя 5-членный циклический боратный сложный эфир, и, поэтому имеет использование с теми углеводами, полисахаридами и гликопротеинами, которые содержат эту группу. Дигидроксиборилпроизводные могут быть использованы для присоединения пролекарств по данному изобретению к рибонуклеозидам, рибонуклеотидам и рибонуклеиновым кислотам, поскольку рибоза содержит 1,2-цисдиольную группу в 2',3'-положении, как было раскрыто Rosenberg, et al., Biochemistry, 11, 3623-28 (1972). Дезоксирибонуклеотиды- и ДНК-таргетирующие средства не могут быть связаны с пролекарствами по изобретению таким образом, поскольку 3'-гидроксильная группа отсутствует. Однако последние таргетирующие средства могут быть конъюгированы с изотиоцианатными производными пролекарств, образуя сначала аллиламиновое производное дезоксирибонуклеотида, как было раскрыто Engelhardt, et al.,ЕРО 97373. Когда таргетирующее средство, подлежащее связыванию с пролекарствами по изобретению, представляет собой интактную клетку, могут быть использованы либо полипептидные реакционноспособные остатки, либо углеводные реакционноспособные остатки. В публикации Hwang and Wase, Biochim. Biophys. Acta, 512, 54-71 (1978) раскрывается использование производного диазония бифункционального хелатора EDTA Sundberg, et al., J. Med. Chem., 17, 1304 (1974) для мечения эритроцитов и тромбоцитов индием-111. Дигидроксиборильная группа является реакционноспособной в отношении ряда бактерий, вирусов и микроорганизмов, см. Zittle, Advan. Enzym., 12 493 (1951) and Burnett, et al., Biochem. Biophys. Res.Comm., 96, 157-62 (1980). Предпочтительные линкеры, которые могут быть использованы для ковалентной кватернизации третичного амина соединения 1 или соединения 2, имеют формулу где X представляет собой группу галогена;n=0-4. В одном варианте соединение 4 настоящего изобретения представляет те соединения, гдеn=0. В другом варианте соединение 4 по изобретению представляет те соединения, гдеn=1. Соединение 4 представляет собой линкеры с основной цепью, содержащей как алкильную группу,так и арилкарбоновую группу, что обеспечивает возможность варьирования скоростью расщепления конечного кватернизованного азота. Линкеры соединения 4 можно получить, используя коммерчески доступные исходные продукты, как описано в примере 5.g. Очистка. Соединения по данному изобретению могут быть выделены, используя обычные методы очистки. Гидролизуемая связь соединений по изобретению может быть склонной к гидролизу во время очистки соединений. Настоящее изобретение также относится к способам очистки соединений по данному изобретению,включающим введение соединений в раствор, содержащий по крайней мере 0,1% кислоты (об./об.), чтобы сделать соединение растворимым. Затем соединение очищают, осуществляя хроматографию, предпочтительно ВЭЖХ.h. Испытание. Пролекарства по данному изобретению могут быть испытаны, определяя скорость гидролиза гидролизуемой связи и устанавливая продукты гидролиза посредством осуществления анализа методом ВЭЖХ пролекарства, экспонированного в условиях расщепления как функция времени. Биологическая активность соединений по данному изобретению может быть измерена способами, включая, но не ограничиваясь ими, блокирование фагоцитоза клеток J774 клеточной линии макрофага, как описано в примере 17. Биологическая активность соединений настоящего изобретения может быть также измерена путем определения активности фермента киназы PI-3, как описано в патенте 5480906; K. Fuchikami et al. J. Biomol Screen, 2002 Oct. p. 441-450; VI Silveria et al. J. Biomol. Screen, 2002, Dec. 7(6), 507-514; BE DreesCombinatorial Chemistry and Highthroughput Screening 2003, vol. 6, 321-330, содержания которых включены в настоящее описание в виде ссылки.i. Соли. Соединения по данному изобретению используют в различных фармацевтически приемлемых солевых формах. Термин "фармацевтически приемлемая соль" относится к солевым формам, которые должны быть очевидны для фармацевта, т.е. солевые формы, которые являются, по существу, нетоксическими и которые обеспечивают желаемые фармакокинетические характеристики, аппетитность, абсорбцию,распределение, метаболизм или экскрецию. Другие факторы, более практичные по природе, которые также важны при выборе, представляют собой стоимость исходных материалов, легкость кристаллизации, выход, стабильность, гигроскопичность и текучесть полученного сыпучего лекарственного средства. На практике, фармацевтические композиции могут быть получены из активных компонентов или их фармацевтически приемлемых солей в комбинации с фармацевтически приемлемыми носителями. Фармацевтически приемлемые соли соединений по данному изобретению, которые являются подходящими для использования в способах и композициях по изобретению, включают, но не ограничиваются ими, соли, образованные с рядом органических и неорганических кислот, таких как хлористоводородная кислота, гидроксиметансульфоновая кислота, бромисто-водородная кислота, метансульфоновая кислота, серная кислота, уксусная кислота, трифторуксусная кислота, малеиновая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, сульфаминовая кислота, гликолевая кислота, стеариновая кислота, молочная кислота, яблочная кислота, памовая кислота, сульфаниловая кислота, 2 ацетоксибензойная кислота, фумаровая кислота, этандисульфоновая кислота, щавелевая кислота, изэтионовая кислота, и включают различные другие фармацевтически приемлемые соли, такие как, например,- 16012240 нитраты, фосфаты, бораты, тартраты, цитраты, сукцинаты, бензоаты, аскорбаты, салицилаты и т.п. Катионы, такие как кватернизованные аммонийные ионы, предполагаются в качестве фармацевтически приемлемых противоионов для анионных остатков. Предпочтительные соли соединений по данному изобретению включают гидрохлоридные соли, соли метансульфоновой кислоты и соли трифторуксусной кислоты, при этом соли метансульфоновой кислоты являются более предпочтительными. Кроме того, фармацевтически приемлемые соли соединений по данному изобретению могут быть образованы с щелочными металлами, такими как натрий, калий и литий; щелочно-земельными металлами, такими как кальций и магний; органическими основаниями,такими как дициклогексиламин, трибутиламин и пиридин; и аминокислотами, такими как аргинин, лизин и т.п. Фармацевтически приемлемые соли по изобретению могут быть синтезированы обычными химическими способами. Как правило, соли получают взаимодействием свободного основания или кислоты со стехиометрическими количествами или с избытком желательной сольобразующей неорганической или органической кислоты или основания в подходящем растворителе или комбинации растворителей. В общем случае, противоионы солей соединений по изобретению определяются реагирующими веществами, используемыми для синтеза соединений. Может иметься смесь противоионов солей, в зависимости от реагентов. Например, в тех случаях, когда NaI добавляют для облегчения протекания реакции, противоин может представлять собой смесь противоанионов Cl и I. Кроме того, препаративная ВЭЖХ может вынудить первоначальный противоион обменяться на ацетат, если уксусная кислота присутствует в элюенте. Противоионы солей могут быть обменены на различный противоион. Противоионы предпочтительно обменивают на фармацевтически приемлемый противоион с образованием вышеописанных солей. Способы обмена противоионов описаны в WO 2002/042265, WO 2002/042276 and S.D.Clas, "Quatenized Colestipol, an improved bile salt adsorbent: In Vitro studies." Journal of Pharmaceutical Sciences, 80(2): 128-131 (1991), содержания которые входят в настоящее описание в виде ссылки. По причинам ясности, в химических структурах, представленных в настоящем описании, противоионы в явном виде не показаны и характеристика соединений основана на идентифицировании кватернизованного катиона. 4. Композиция. Настоящее изобретение также охватывает композицию, содержащую одно или несколько соединений по данному изобретению. Композиции по данному изобретению могут дополнительно содержать один или несколько фармацевтически приемлемых дополнительных компонента(ов), таких как квасцы,стабилизаторы, антимикробные средства, буферы, красители, ароматизаторы, адъюванты и т.п. а. Препарат. Композиции по изобретению могут быть в форме таблеток или леденцов, формированных обычным способом. Например, таблетки и капсулы для перорального введения могут содержать обычные наполнители, включая, но не ограничиваясь ими, связующие средства, наполнители, смазки, дезинтеграторы и увлажняющие средства. Связующие средства включают, но не ограничиваются ими, сироп, акацию, желатин, сорбит, трагакант, клейкое вещество крахмала и поливинилпирролидон. Наполнители включают,но не ограничиваются ими, лактозу, сахар, микрокристаллическую целлюлозу, рисовый крахмал, фосфат кальция и сорбит. Смазки включают, но не ограничиваются ими, стеарат магния, стеариновую кислоту,тальк, полиэтиленгликоль и диоксид кремния. Дезинтеграторы включают, но не ограничиваются ими,картофельный крахмал, натрий крахмал-гликолят. Смазки включают, но не ограниваются ими, лаурилсульфат натрия. Таблетки могут покрываться оболочкой, которая наносится общеизвестными в данной области способами. Композиции по изобретению могут также представлять собой жидкие препараты, включая, без ограничения, водные или маслянистые суспензии, растворы, эмульсии, сиропы и эликсиры. Композиции могут быть также формулированы в виде сухого продукта для составления с водой или другим подходящим наполнителем перед использованием. Такие жидкие препараты могут содержать добавки, включая,без ограничения, суспендирующие средства, эмульгирующие средства, неводные наполнители и консерванты. Суспендирующее средство включает, без ограничения, сироп сорбита, метилцеллюлозу, сироп глюкоза/сахар, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия и гидрогенизированные съедобные жиры. Эмульгирующие средства включают, без ограничения, лецитин,сорбитмоноолеат и акацию. Неводные наполнители включают, без ограничения, съедобные масла, миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, пропиленгликоль и этиловый спирт. Консерванты включают, без ограничения, метил- или пропил-п-гидроксибензоат и сорбиновую кислоту. Композиции по изобретению могут быть также формулированы в виде суппозиториев, которые могут содержать основы суппозитория, включая, без ограничения, кокосовое масло или глицериды. Композиции по данному изобретению могут быть также формулированы в лекарственную форму для ингаляции, которая может включать, без ограничения, раствор, суспензию или эмульсию, которая может быть введена в виде сухого порошка или в форме аэрозоля, используя пропеллент, такой как дихлордифторметан или трихлорфторметан. Композиции по изобретению могут быть также формулированы в виде ле- 17012240 карственной формы для трансдермального введения, содержащих водные или неводные наполнители,включая, без ограничения, кремы, мази, лосьоны, пасты, лечебный пластырь, повязку или мембрану. Композиции по данному изобретению могут быть также формулированы для парентерального введения, включая, без ограничения, введение путем инъекции или медленного введения вещества. Препараты для инъекций могут быть в форме суспензий, растворов или эмульсий в маслянистых или водных наполнителях, и могут содержать вспомогательные формообразующие средства, включая, без ограничения, суспендирующие, стабилизирующие и диспергирующие средства. Композиция может также быть представлена в форме порошка для восстановления с подходящим наполнителем, включая, без ограничения, стерильную, апирогенную воду. Композиции по данному изобретению могут быть также формулированы в виде препарата-депо,который можно вводить путем имплантации или путем внутримышечной инъекции. Композиции могут быть формулированы с подходящими полимерными или гидрофобными веществами (в виде эмульсии в приемлемом масле, например), ионообменными смолами (ионитами), или в виде труднорастворимых производных (в виде труднорастворимой соли, например). Композиции по изобретению могут быть также формулированы в виде липосомного препарата. Липосомный препарат может включать липосомы, которые проникают в представляющие интерес клетки или рогового слоя и сливаются с клеточной мембраной, приводя к доставке содержимого липосомы в клетку. Например, могут быть использованы липосомы, такие как описаны в патенте США 5077211Yarosh, патенте США 4621023 Redziniak et al. или патенте США 4508703 Redziniak et al. Композиции по данному изобретению, предназначенные для целенаправленного воздействия на состояния кожи, могут быть введены до, во время или после экспозиции кожи млекопитающего УФ-облучению или средствам,вызывающим окислительное повреждение. Другие подходящие препараты могут использовать ниосомы. Ниосомы представляют собой липидные везикулы, подобные липосомам, с мембранами, состоящими, в значительной степени, из неионных липидов, некоторые формы которых являются эффективными для транспортирования соединений сквозь роговой слой кожи. 5. Лечение. Настоящее изобретение также охватывает способ лечения пациента, страдающего состоянием, ассоциируемым с активностью киназы PI-3. Активность киназы PI-3 может быть анормальной, чрезмерной или конститутивно активной. Настоящее изобретение охватывает также способ лечения воспалительного заболевания, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Такие заболевания и неблагоприятные для здоровья воздействия, которые могут быть приписаны неадекватной активности передачи сигнала PI-3,были раскрыты в данной области, например, в US 2002/0150954A1; патенте США 5504103; US 6518277B1; патентах США 6403588, 6482623, 6518277, 6667300; U.S. 20030216389; U.S. 20030195211;U.S. 20020037276 и патенте США 5703075, содержания которых включены в настоящее описание в виде ссылки. Настоящее изобретение также охватывает способ увеличения р 53-опосредованной запрограммированной смерти клеток, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ повышения чувствительности к химиотерапии опухолевых клеток, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ повышения радиочувствительности опухолевых клеток, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ ингибирования индуцированного опухолью ангиогенеза, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ ингибирования ангиогенных процессов, ассоциируемых с нераковыми заболеваниями, включающий введение пациенту, нуждающемуся в таком лечении,терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ лечения рака, включающий введение пациенту,нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Соединение можно вводить одновременно или регулярно с другими противораковыми лечениями,такими как химиотерапия и лучевая терапия. Используемый здесь термин "одновременный" или "одновременно" означает, что другое противораковое лечение и соединение настоящего изобретения вводят в пределах 48 ч, предпочтительно 24 ч, более предпочтительно 12 ч, еще более предпочтительно 6 ч и наиболее предпочтительно 3 ч или меньше, относительно друг друга. Используемый здесь термин "регулярно" означает введение соединений временами, отличными от химиотерапии, с определенной частотой относительно повторного введения и/или программы химиотерапевтического лечения. Химиотерапевтическое лечение может включать введение цитотоксического средства или цитоста- 18012240 тического средства или их комбинации. Цитотоксические средства препятствуют размножению раковых клеток: (1) подавляя способность клеток к репликации ДНК и (2) индуцируя гибель клеток и/или апоптоз в раковых клетках. Цитостатические средства действуют через модуляцию, вмешательство или ингибирование процессов клеточной трансдукции сигнала, которые регулируют клеточную пролиферацию и иногда даже при низких непрерывных уровнях содержания. Классы соединений, которые могут быть использованы в качестве цитотоксических средств, включают нижеследующие: алкилирующие средства (включая, без ограничения, азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урацил, хлорметин, циклофосфамид (Cytoxan), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин и темозоломид; антиметаболиты (включая, без ограничения, антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндезаминазы): метотрексат, 5-фторурацил, флоксуридин, цитарабин, 6 меркатопурин, 6-тиогуанин, флударабинфосфат, пентостатин и гемцитабин; природные продукты и их производные (например, алкалоид барвинка, противоопухолевые антибиотики, ферменты, лимфокины и эпиподофиллотоксины): винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин,доксорубицин, эпирубицин, идарубицин, ара-с, паклитаксел (паклитаксел коммерчески доступен какTaxol), митрамицин, дезоксико-формицин, митомицин-с, 1-аспарагиназа, интерфероны (предпочтительно IFN-), этопозид и тенипозид. Другие пролиферативные цитотоксические средства представляют собой навелбен, СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифозамид и дролоксафин. Средства, воздействующие на микроканальцы, противодействуют клеточному митозу и являются общеизвестными в данной области благодаря своей цитотоксической активности. Средства, воздействующие на микроканальцы, используемые в данном изобретении, включают, но не ограничиваются ими,аллоколхинин (NSC 406042), галихондрин В (NSC 609395), колхицин (NSC 757), производные колхицина (например, NSC 33410), доластатин 10 (NSC 376128), майтанзин (NSC 153858), ризоксин (NSC 332598), паклитаксел (Taxol, NSC 125973), производные Taxol (например, производные (например,NSC 608832), тиоколхинин NSC 361792), тритилцистин (NSC 83265), винбластин-сульфат (NSC 49842),винкристин-сульфат (NSC 67574), природные и синтетические эпотилоны, включая, но не ограничиваясь ими, эпотилон А, эпотилон В и дискодермолид (см. Service, (1996) Science, 274:2009) эстрамустин, нокодазол, MAP4, и т.п. Примеры указанных средств описаны также в Bulinski (1997) J. Cell Sci. 110:3055 3064; Panda (1997) Proc. Natl. Acad. Sci. USA 94:10560-10564; Muhlradt (1997) Cancer Res. 57:3344-3346;Chem 271:29807-29812. Подходящими также являются такие цитотоксические средства, как эпидофиллотоксин; противоопухолевый (антибластомный) фермент; ингибитор топоизомеразы; прокарбазин; митоксантрон; координационные комплексы платины, такие как цисплатин и карбоплатин; модификаторы биологического ответа; ингибиторы роста; антигормональные терапевтические средства; лейковорин; тегафур; и гемопоэтические факторы роста. Цитостатические средства, которые могут быть использованы, включают, но не ограничиваются ими, гормоны и стероиды (включая синтетические аналоги): 17 этинилэстрадиол, диэтилстилбестрол,тестостерон, преднизон, флуоксиместерон, дромостанолонпропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон, триамцинолон, хлортрианизен, гидроксипрогестерон,аминоглутетимид, эстрамустин, медроксипрогестеронацетат, лейпролид, флутамид, торемифен, золадекс. Другими цитостатическими средствами являются антиангиогенные средства, такие как ингибиторы матриксной металлопротеиназы, и другие ингибиторы VEGF, такие как антитела против VEGF, и также сюда включены небольшие молекулы, такие как ZD6474 и SU6668. Могут быть также использованы антитела против Her-2 от Genetech. Подходящим ингибитором EGPR является ЕКВ-5 69 (необратимый ингибитор). Включены также Imclone антитело С 225, иммуноспецифичное в отношении EGFR и ингибиторы src. Также подходящим для использования в качестве цитостатического средства является Casodex(бикалутамид, Astra Zeneca), который делает андрогензависимые карциномы непролиферативными. Очередным примером цитостатического средства является антиэстроген Tamoxifen, который ингибирует пролиферацию или рост эстрогензависимого рака молочной железы. Ингибиторы трансдукции сигналов клеточной пролиферации представляют собой цитостатические средства. Типичные примеры включают ингибиторы эпидермального фактора роста, ингибиторы Her-2, ингибиторы киназы MEK-1, ингибиторы киназы MAPK, ингибиторы PI-3, ингибиторы киназы Src и ингибиторы PDGF. Целый ряд злокачественных новообразований можно лечить согласно настоящему изобретению,включая, но не ограничиваясь ими, нижеследующие: карциному, включая карциному мочевого пузыря(включая прогрессирующий и метастатический рак мочевого пузыря), молочной железы, ободочной кишки (включая колоректальный рак), почек, печени, легкого (включая мелкоклеточный и немелкокле- 19012240 точный рак легкого и аденокарциному легкого), яичника, простаты, яичков, мочеполовых путей, лимфатической системы, прямой кишки, гортани, поджелудочной железы (включая экзокринной карциномы поджелудочной железы), пищевода, желудка, желчного пузыря, шеи, щитовидной железы и кожи (включая плоскоклеточную (эпидермоидную) карциному); кроветворные опухоли лимфоидного происхождения, включая лейкоз, острый лимфолейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Тклеточную лимфому, лимфому Ходжкина, не-ходжкинскую лимфому, волосатоклеточная лимфома (лейкемический ретикулез) гистиоцитарная лимфома и лимфома Беркитта; кроветворные опухоли миелоидного происхождения, включая острые и хронические миелогенные лейкозы, миелодиспластический синдром, миелоидный лейкоз и промиелоцитарный лейкоз; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриномы; опухоли мезенхимального происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому; и другие опухоли, включая меланому, ретикулярный прогрессирующий меланоз, кератоакантому, семиному, фолликулярный рак щитовидной железы и тератокарциному. Наиболее предпочтительно изобретение используют для лечения прогрессирующих или метастатических злокачественных новообразований мочевого пузыря, рака поджелудочной железы, рака простаты,немелкоклеточного рака легкого, колоректального рака и рака молочной железы. Настоящее изобретение также охватывает способ лечения панкреатита, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Как обсуждено в Gukovsky et al., Gastroenterology, 126(2):554-66 (2004), ингибирование киназы PI-3 может предотвратить панкреатит. Настоящее изобретение также охватывает способ лечения язв, включающий введение пациенту,нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Настоящее изобретение также охватывает способ лечения желудочного рака, такого как рак желудка, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по изобретению. Как обсуждено в Bacon et al., Digestive Disease Week Abstracts and Itinerary Planner, Vol. 2003, Abstract No. M921 (2003) and Rokutan et al., Digestive Disease WeekAbstracts and Itinerary Planner, Vol. 2003, Abstract No. 354 (2003), киназа PI-3 вовлечена в адгезию Helicobacter pylori к желудочным клеткам. Кроме того, Osaki et al. Journal of Cancer Research and Clinical Oncology, 130(1): 8-14 (2004) указывает на то, что ингибитор киназы PI-3, такой как LY294002, может быть использован в качестве противоопухолевого средства в случае карциномы желудка. Настоящее изобретение также охватывает способ улучшения функционирования стента, включающий введение пациенту со стентом, таким как кардиоваскулярный стент, терапевтически эффективного количества соединения по данному изобретению. Как было обсуждено в Zhou et al., ArteriosclerosisThrombosis and Vascular Biology, 23(11): 2015-2020 (2003), ингибирование киназы PI-3 может предотвратить повреждение-"растягивание", которое сопровождает размещение стента в сосудах. Соединения по данному изобретению в стенте или его полимерном матриксе могут улучшить растворимость в покрывающем стент матриксе, улучшить водно/сывороточную растворимость или улучшить перфузию в клетки, непосредственно примыкающие к размещению стента. Настоящее изобретение также охватывает способ лечения возрастной дегенерации желтого пятна(AMD), включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Как обсуждено в Retina, February 18, 2004, ингибирование VEGF подавляет разрастание кровеносных сосудов, ассоциируемое с AMD. Соединения по данному изобретению могут лечить AMD, ингибируя ангиогенез. Настоящее изобретение также охватывает способ лечения гипертензии, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Как обсуждено в Northcott and Watts, Hypertension, 43(1): 125-130 (2004), ингибирование киназы PI-3 может не допустить возникновение низких внеклеточных концентраций Mg2+, которое связывают с гипертензией. Настоящее изобретение также охватывает способ подавления дифференцировки клетокпредшественников, таких как миелоидные клетки-предшественники, включающий введение эффективного количества соединения по данному изобретению в клетки-предшественники. Как было обсуждено вLewis et al., Experimental Hematology, 32(1): 36-44 (2004), ингибирование пути киназы PI-3 подавляет миелоидную клетку-предшественник. Настоящее изобретение также охватывает способ лечения рака печени, включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. Как обсуждено в Leng et al., Hepatology 38(4) Suppl 1: 401 A (2003), LY294002 ингибирует фосфорилирование Akt (серин/треонин протеинкиназа В), которая является определителем состояния человеческих печеночных тканей. Настоящее изобретение также охватывает лечение состояний, ассоциируемых с мутантным PTEN,включающий введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по данному изобретению. PTEN представляет собой опухолевый ген-супрессор, локализованный на хромосоме 10q23, который был идентифицирован у пациентов с болезнью Коудена. КакPTEN уменьшал способность ингибировать активацию прото-онкогена Akt. Ингибиторы киназы PI-3 могут ингибировать фосфорилирование Akt, тем самым ослабляя действие мутантного PTEN.a. Введение. Композиции по данному изобретению могут быть введены любым способом, включая, но не ограничиваясь ими, перорально, парентерально, сублингвально, трансдермально, ректально, трансмукозально, местно, посредством ингаляции, путем буккального введения или их комбинациями. Парентеральное введение включает, без ограничения, внутривенный, внутриартериальный, внутрибрюшинный, подкожный, внутримышечный, подоболочечный и внутрисуставный способы введения. Композиции по изобретению могут также вводиться в форме имплантата, который позволяет медленное высвобождение композиций, а также в виде медленного контролируемого в.в. (i.v.) вливания.b. Дозирование. Терапевтически эффективное количество соединения, необходимое для использования в лечении,варьируется в зависимости от природы состояния, подлежащего лечению; периода времени, на протяжении которого желательно проявление активности препарата, и возраста и состояния пациента, и, в конечном счете, определяется штатным врачом больницы. В общем, однако, дозы, используемые для лечения взрослого человека, обычно находятся в пределах от 0,001 до около 200 мг/кг в день. Доза может составлять от около 1 до 100 мкг/кг в день. Требуемую дозу можно вводить в виде однократной дозы или в виде множественных доз, вводимых через соответствующие интервалы времени, например в виде двух,трех, четырех и большего числа субдоз в день. Множественные дозы часто желательны или необходимы. Соединения по данному изобретению могут вводиться в широком диапазоне доз, величина используемой конкретной дозы зависит от ряда факторов. При введении в комбинации с другими лечениями,соединения по данному изобретению могут вводиться при относительно более низких дозах. Кроме того,использование таргетирующих средств может позволить сделать необходимую дозу относительно низкой. Некоторые соединения настоящего изобретения могут вводиться при относительно высоких дозах,что обусловлено рядом факторов, включая, но не ограничиваясь ими, низкую токсичность, высокий клиренс, низкие скорости отщепления третичного амина. В результате, доза соединения по изобретению может составлять от около 1 нг/кг до около 100 мг/кг. Доза соединения по данному изобретению может составлять любую дозу, включая, без ограничения, около 1, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250,275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700, 725, 750, 775, 800,825, 850, 875, 900, 925, 950, 975 мкг/кг, 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или 100 мг/кг. Настоящее изобретение имеет разнообразные аспекты, иллюстрируемые нижеследующими неограничивающими примерами. Пример 1. Получение LY294002. 10 г образца LY294002 получали согласно схеме 2, исходя из методики, описанной в Vlahos et al., J.Biol. Chem. 269(7): 5241 (1994), содержание которого входит в настоящее описание в виде ссылки. Замещение тиометильной группы тиохромонов, таких как 12, аминами, было описано ранее (Bantick et al., J.Heterocyclic Chem, 18:679 (1981), содержание которого входит в настоящее описание в виде ссылки), тогда как тиохромон получали циклизацией метилфенилкетонов, таких как 11, с дисульфидом углерода с сопутствующим алкилированием тиоланиона (Vlahos et al. and Bantick et al.). Получение метилкетонов(например, 11) одностадийной реакцией из карбоновой кислоты (10) осуществляли, используя способ,описанный в Rubottom et al., J. Org. Chem., 48:1550 (1983), содержание которого входит в настоящее описание в виде ссылки. Схема 2 Пример 2. Получение кватернизованных аналогов LY294002. Следуя способу схемы 3, третичный амин LY294002 кватернизуют, используя йодметан или бензилхлориды, при вынуждающих условиях, с получением соединений А 052-10 и соединения 13 В. Пример 56 описывает синтез метил-кватернизованного пролекарства А 052-10. Пример 57 описывает синтез фталимидо-кватернизованного пролекарства А 052-08. Пример 58 описывает синтез паракарбоксибензилкватернизованного А 044-78. [Пример 47] [Пример 58] описывает синтез пара-scn-бензилкватернизованного пролекарства А 044-80. Пример 3. Получение хлорметиловых сложных эфиров. Хлорметилсодержащие интермедиаты получают, следуя способу, описанному в Tsujihara, SynthCommun, 24, 767, 1994. Кратко, соответствующую карбоновую кислоту разбавляют в смеси 50/50 дихлорметан/вода. Смесь охлаждают на бане со смесью лед-вода и добавляют бикарбонат натрия (4 экв.) и гидросульфат н-тетрабутиламмония (0,05 экв.). После перемешивания в течение 5 мин, добавляют хлорметилхлорсульфат (1,1 экв.). Раствор энергично перемешивают на протяжении ночи. Смесь переносят в делительную воронку с дополнительным количеством дихлорметана и промывают насыщенным раствором хлорида натрия. Органику сушат над сульфатом натрия и растворитель удаляют, получая продукт. Вещество охарактеризовывают с помощью ЖХ-МС и в некоторых случаях с помощью 1 Н-ЯМРспектроскопии. Согласно этой общей методике из соответствующих карбоновых кислот получают нижеследующие типичные хлорметиловые сложные эфиры. Таблица 1 ВЭЖХ-МС (HPLC-MS), время удерживания, используя УФ-детектирование; ВЭЖХ-МС, время удерживания исходной карбоновой кислоты, используя УФ-детектирование;(НД)=недетектируемо из-за отсутствия УФ-поглощения и отсутствия ионизации при МС.LY294002 (соединение 1) растворяют в ацетонитриле и затем добавляют каждый из хлорметиловых сложных эфиров (1-1,5 экв.) из примера 3 вместе с 1-2 эквивалентами иодида натрия. При комнатной температуре реакция с хлорметиловыми сложными эфирами протекает исключительно медленно с получением очень незначительных количеств кватернизованного аминового продукта наряду с осаждением хлорида натрия. При 65 С реакция протекает до полного завершения обычно за 4 ч. Реакционную смесь по завершению реакции (оцениваемому анализом с помощью ЖХ-МС) фильтруют; концентрируют и затем очищают ВЭЖХ с обращенной фазой. Фракции собирают и лиофилизуют, получая требуемые продукты в виде рыхлых порошков. Полученные и очищенные таким способом примеры представлены в нижеследующей таблице (противоанионы не изображены, но включали хлорид, иодид, ацетат или их смесь). Таблица 2 Пример 5. Галогенметил-сложноэфирные линкеры. Исходя из результатов примера 3 и примера 4, получают галогенметил-сложноэфирные линкеры(схема 4 и диаграмма). Соединение В получают из соединения А (комммерчески доступное), как описано в примере 3. Это соединение превращают в более реакционноспособный иодметиловый сложный эфир(соединение С) по реакции Финкельштайна путем растворения в ацетоне или 2-бутаноне и затем растворения 2-5 эквивалентов иодида натрия, после чего осаждается хлорид натрия и в растворе получают иодметиловый сложный эфир (соединение С). Соединение С выделяют, удаляя растворитель и растворяя в несмешивающемся с водой растворителе, таком как метиленхлорид, и экстрагируя водой, чтобы удалить остаточный иодид натрия. Соединение Е получают из соединения D (коммерчески доступного). Соединения F и G получают способом, аналогичным получению соединений В и С соответственно. Схема 4 Пример 6. Кватернизация LY294402 галогенметилсодержащими линкерами. Галогенметиловые сложные эфиры, включая сложные эфиры примера 5, были использованы для кватернизации LY294002, используя условия, аналогичные методике в примере 4. Типичные пролекарства, содержащие линкер со свободной функциональной группой, включают нижеследующие: Соединение 1105 получают смешением соединения 1101 с соединением С в ацетонитриле, в котором оба растворимы, и продукт, соединение 1105, осаждается на протяжении трехдневного периода времени, затем его промывают небольшим количеством ацетонитрила, получая, по существу, чистое соединение 1105 (подтвержденное ЖХМС). Пример 7. Получение пролекарств, используя соединение 1111. Соединение 1111 получают способом, показанным на схеме 5, соединение 1110 обрабатывают беспримесной трифторуксусной кислотой в течение 1-3 ч и ТФУ (TFA) выдувают аргоном и сушат в вакууме, получая стекловидное твердое вещество, заключающее в себе соединение 1113. Затем соединение 1113 растворяют в 1-3 мл тионилхлорида и нагревают при 65 С в течение 3-8 ч. Тионилхлорид выдувают аргоном и затем сушат в высоком вакууме, получая соединение 1111 с хорошими выходами в виде стекловидного желтого твердого вещества. Соединение 1111 может быть подвергнуто взаимодействию в виде типичного хлорангидрида кислоты с различными азотсодержащими и гидроксилсодержащими нуклеофилами, например, путем простого растворения в метаноле, с получением соответствующего метилового сложного эфира соединения 1112. Пробу соединения 1111 растворяют в ацетонитриле и обрабатывают по крайней мере 5 экв. различных спиртов в отдельных пробирках. Через 1 ч пробы анализируют с помощью ВЭЖХ-МС, они демонстрируют хорошую конверсию 90% соединения 1111 в соответствующий сложный эфир, как показано и охарактеризовано в табл. 3. Таблица 3 УФ 214 нм Пример 8. Получение белок-конъюгированных пролекарств, используя соединение 1111. Белки конъюгируют в, значительной степени, водном растворе (pH 7-9) (фосфатный буфер до карбонатного буфера), используя 2-10-кратный избыток соединения 1111 относительно аминогрупп или гидроксильных групп, подлежащих модифицированию. Хлорангидрид кислоты соединения 1111 может быть введен в смешанном водно-органическом растворителе (таком как смесь 50/50 вода-ацетонитрил или 50/50 вода-ТГФ) или перемешен в метиленхлориде в двухфазной реакционной системе при комнатной температуре в течение 1-24 ч. Белок-конъюгаты могут быть очищены диализом или ультрафильтрацией и непосредственно использованы. 500-мкл аликвоту 5 мг/мл трансферринового белка (Sigma) в 50 мМ буфере бикарбоната натрия смешивают с 100 мкл 30 мМ А 024-79 (100 молярных эквивалентов), который получают согласно примеру 12, в ДМСО. Через 1 ч и 20 мин взаимодействия при комнатной температуре 50 мкл пробу извлекают и пропускают через колонку с Sephadex G-10 (отсечка молекулярной массы 700), чтобы отделить белок от маленьких молекул. Затем аликвоту элюента очищенного конъюгированного белка экстрагируют ацетонитрилом и согласно данным ЖХ-МС при этом не наблюдают даже следов соединения 1. Элюент очищенного конъюгированного белка выдерживают при комнатной температуре 39 ч, и по истечении этого времени смесь белка вновь экстрагируют ацетонитрилом и в этом случае обнаруживают 15% от максимального теоретического количества соединения 1. Эти результаты указывают на то, что, в молярном отношении, 15 молей пролекарства приходится на моль трансферрина. Эти результаты демонстрируют связывание пролекарства, несущего электрофильный линкер, с типичным белком и наглядно показывают, что на протяжении определенного времени значительное количество ингибитора киназы PI-3(соединение 1) высвобождается от белка в водных средах. Пример 9. Получение связанных со смолой пролекарств, используя соединение 1111. Пептид arg-gly-asp-ser (RGDS) получают на смоле Ванга (смоле), используя химию связывания пептидов FMOC/HOBT, используя все природные аминокислоты. Связанный со смолой пептид подвергают взаимодействию с соединением 1111 в ДМФА (DMF) в течение 1-24 ч, фильтруют и полимер промывают ДМФА и затем метиленхлоридом и затем обрабатывают трифторуксусной кислотой, чтобы отщепить конъюгированное соединение 1126 от смолы (схема 6). Пример 55 описывает, в увеличенном масштабе,получение соединения 1111. Схема 6 Пример 10. Получение пролекарств с фолат-таргетирующими средствами, используя соединение 1111. Соединение 1111 имеет электрофильную группу, которая может быть подвергнута взаимодействию- 27012240 с нуклеофильными аминогруппами в среде умеренно основных органических растворителей или водных условиях (т.е. буфер бикарбоната натрия с концентрацией от 20 до 500 мМ) с получением необратимой тиомочевиновой связи. Подходящие нуклеофильные аминогруппы присутствуют на таргетирующем биомолекулярном фолате. Молекулы фолата А и С конъюгируют с соединением 1111 через аминогруппу в ДМФА при смешении в грубо равных пропорциях в присутствии основания, триэтиламина или диизопропилэтиламина, с получением соединений В и D (схема 7). Схема 7 Пример 11. Получение пролекарств с антитело-таргетирующими средствами, используя соединение 1111. Соединение 1111 конъюгируют с моноклональными антителами в водном растворе, pH 7-9, и затем отделяют ультрафильтрацией или другими обычными методами разделения белковых конъюгатов от небольших молекул. Конъюгированное соединение можно получить согласно примеру 8. Пример 12. Получение пролекарств, используя N-гидроксисукцинимид сложные эфиры. Получают сложный эфир, менее реакционноспособный, чем соединение 1111, Nгидроксисукцинимид активный сложный эфир соединения 1113 (схема 8). 100 мг пробу соединения 1113(А 024-67) растворяют в 1 мл сухого ТГФ вместе с 53 мг N-гидроксисукцинимида (2 экв.). При перемешивании добавляют, всю сразу, 45 up-аликвоту 1 М дициклогексилкарбодиимида в метиленхлориде(2 экв.). В пределах 3 мин образуется тяжелый белый осадок, указывая на то, что реакция связывания имела место. После предоставления возможности реакционной смеси перемешиваться в течение 23 ч,реакционную смесь фильтруют и растворитель удаляют из фильтрата, получая 172 мг продукта, неочищенного активного сложного эфира, в виде густого желтого масла, обозначенного А 024-79 и показывающего время удерживания 2,334 мин с ожидаемой массой М+=535, найденной для этого пика. Схема 8- 28012240 Используя ту же самую химию, описанную выше для соединения 1111, А 024-79 используют для конъюгирования таргетирующих белков, как описано в примере 8, и используют для конъюгирования с полимером, как описано в примере 74. Пример 13. Получение пролекарств, используя соединение 1105. Соединение 1105 имеет электрофильную группу, которая может быть подвергнута взаимодействию с нуклеофильными аминогруппами в среде умеренно основных органических растворителей или водных условиях (т.е. буфер бикарбоната натрия с концентрацией от 20 до 500 мМ) с получением необратимой тиомочевиновой связи. Подходящие нуклеофильные аминогруппы присутствуют на таргетирующих биомолекулах, таких как пептиды, белки и небольших молекулах, несущих аминогруппы, таких как производные витамина (А и С схемы 7). Типичные примеры таких продуктов включают соединения В и D. Схема 9 Пример 14. Получение производных морфолинового кольца. Тиометилсодержащее соединение схемы 1 получают, как описано в примере 1. Это соединение нагревают в соответствующем растворителе с или без каталитического количества уксусной кислоты и с избытком нуклеофильного аминового соединения до тех пор, пока большая часть тиометилсодержащего соединения не израсходуется. Затем смесь подвергают препаративной ЖХ-МС с обращенной фазой, чтобы выделить желаемый аналог морфолина. Соединения, полученные таким способом, представлены в табл. 4 наряду с условиями их получения, идентификации и выделения, представленными в табл. 5. Данные ЯМР для вышеуказанных соединений представлены в табл. 6.
МПК / Метки
МПК: C07D 475/04, A61P 25/00, C07D 311/22, A61K 31/5377, C07D 407/12
Метки: киназы, пролекарства, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-12240-prolekarstva-ingibitorov-kinazy-pi-3.html" rel="bookmark" title="База патентов Евразийского Союза">Пролекарства ингибиторов киназы pi – 3</a>
Предыдущий патент: Способ изготовления фигурных кондитерских изделий (варианты), изделия, полученные этим способом (варианты), и форма для их изготовления
Следующий патент: 4-((феноксиалкил)тио)феноксиуксусные кислоты и их аналоги
Случайный патент: Способ замещения совместимых катализаторов полимеризации этилена












