4-((феноксиалкил)тио)феноксиуксусные кислоты и их аналоги
Номер патента: 12241
Опубликовано: 28.08.2009
Авторы: Диэнджелис Алан Р., Чжан Жуй, Ко Джи-Хун, Ван Айхуа
Формула / Реферат
1. Соединение формулы (I)
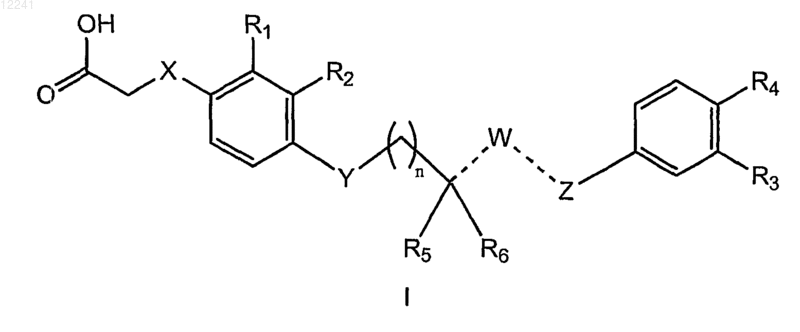
где X выбран из ковалентной связи или О,
Y представляет собой S или О;
---W--- представляет собой группу, выбранную из -CH=, -СН2-;
Z выбран из О, CH и СН2, при условии, что когда Y представляет собой О, Z представляет собой О;
R1 представляет собой H или C1-3алкил;
R2 представляет собой H или галоген;
R3 представляет собой H;
R4 представляет собой С1-5алкил, замещенный галогеном;
R5 представляет собой необязательно замещенный C1-9алкил, необязательно замещенный С1-8алкокси, необязательно замещенный С2-9алкенил, необязательно замещенный С2-9алкенилокси, необязательно замещенный С3-7циклоалкил, необязательно замещенный С3-7циклоалкокси, необязательно замещенный С1-6алкокси-С1-6алкил, необязательно замещенный C1-5алкокси-С1-5алкокси, необязательно замещенный С3-7циклоалкилокси-С1-6алкокси, необязательно замещенный фенокси, необязательно замещенный фенилС1-5алкокси, необязательно замещенный С2-5гетероарилокси, или необязательно замещенный С2-6гетероарил-C1-5алкокси, или необязательно замещенный С2-5 гетероциклилокси;
R6 представляет собой H и
n равно 1;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где X представляет собой О.
3. Соединение по п.1, где X представляет собой ковалентную связь.
4. Соединение по п.1, где Y представляет собой О.
5. Соединение по п.1, где Y представляет собой S.
6. Соединение по п.1, где Z представляет собой О.
7. Соединение по п.1, где Z представляет собой CH или CH2.
8. Соединение по п.1, где ---W--- представляет собой -CH2-.
9. Соединение по п.1, где ---W--- представляет собой -CH=.
10. Соединение по п.1, где R1 представляет собой H.
11. Соединение по п.1, где R1 представляет собой C1-3алкил.
12. Соединение по п.1, где R2 независимо выбраны из F, Br и Cl.
13. Соединение по п.1, где R2 представляет собой H.
14. Соединение по п.13, где R1 представляет собой метил.
15. Соединение по п.12, где R4 независимо выбран из трифторметила, фторметила, дифторметила, хлордифторметила, дихлорфторметила.
16. Соединение по п.1, где R5 выбран из необязательно замещенного С1-7алкила, необязательно замещенного С1-6алкокси, необязательно замещенного С2-7алкенила, необязательно замещенного C2-7алкенилокси, необязательно замещенного С3-7циклоалкила, необязательно замещенного С3-7циклоалкокси, необязательно замещенного С1-6алкокси-С1-6алкила, C1-5алкокси-C1-5алкокси и С3-7циклоалкилокси-С1-7алкокси.
17. Соединение по п.1, где R5 выбран из фенокси, (фенил)С1-5алкокси, (фенил)C1-5алкила, С2-5гетероарилокси, С2-5гетероарилС1-5алкокси, С2-5гетероциклилокси, С3-7циклоалкил-С1-7алкила, С3-7циклоалкил-С1-7алкокси и С3-7циклоалкилокси-C1-6алкила.
18. Соединение по п.1, где R1 представляет собой H и R2 представляет собой H.
19. Соединение по п.18, где X представляет собой ковалентную связь.
20. Соединение по п.18, где X представляет собой ковалентную связь, Y представляет собой S и Z представляет собой О.
21. Соединение по п.1, где X представляет собой O и Y представляет собой О.
22. Соединение по п.1, где X представляет собой О и Y представляет собой S.
23. Соединение по п.1, где Y представляет собой O и Z представляет собой О.
24. Соединение по п.1, где Y представляет собой S и Z представляет собой O.
25. Соединение по п.1, где R6 представляет собой H и R5 выбран и С1-7алкила, C1-6алкокси, С2-7алкенила, С2-7алкенилокси, C1-6алкокси-С1-6алкила и C1-5алкокси-C1-5алкокси.
26. Соединение по п.25, где R5 выбран из C1-5алкила, С1-4алкокси, С2-5алкенила, С2-5алкенилокси и C1-5алкокси-C1-5алкокси.
27. Соединение по п.25, где R5 выбран из C1-3алкила, C1-3алкокси, С2-4алкенила, С2-4алкенилокси и С1-3алкокси-С1-3алкокси.
28. Соединение по п.25, где R5 выбран из метокси, этокси, пропокси, изопропокси, пропенилокси, изопропенилокси, этоксиметокси, метоксиметокси, метоксиметила, метоксиэтила, этоксиметила и этоксиэтила.
29. Соединение по п.1, где R1 выбран из H и метила; R2 выбран из H или Cl и R4 выбран из трифторметила, фторметила и дифторметила.
30. Соединение по п.1, где X представляет собой О, Y представляет собой О и R4 представляет собой CF3.
31. Соединение по п.1, где X представляет собой О, Y представляет собой S и R4 представляет собой CF3.
32. Соединение по п.1, где X представляет собой ковалентную связь, Y представляет собой S и R4 представляет собой CF3.
33. Соединение по п.1, где Y представляет собой О, Z представляет собой О и R4 представляет собой CF3.
34. Соединение по п.1, где Y представляет собой S, Z представляет собой О и R4 представляет собой CF3.
35. Соединение по п.1, где R4 представляет собой CF3 и R5 выбран из С1-7алкила, C1-6алкокси, С2-7алкенила, С2-7алкенилокси, С1-6алкокси-С1-6алкила и C1-5алкокси-C1-5алкокси.
36. Соединение по п.1, где X представляет собой О,Y представляет собой О, R5 выбран из С1-3алкила, С1-3алкокси, С2-4алкенила, С2-4алкенилокси и С1-3алкокси-С1-3алкокси.
37. Соединение по п.1, где X представляет собой О, Y представляет собой S, R5 выбран из С1-3алкила, С1-3алкокси, С2-4алкенила, С2-4алкенилокси и С1-3алкокси-С1-3алкокси.
38. Соединение по п.1, где X представляет собой О, Y представляет собой О, R1 выбран из H и метила, R2 выбран из H и Cl, R4 представляет собой CF3.
39. Соединение по п.1, где X представляет собой О, Y представляет собой S, R1 выбран из H и метила, R2 выбран из H и Cl.
40. Соединение по п.1, которое выбрано из
[4-[[2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислоты;
[4-[[(2R)-2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислоты и
[4-[[(2S)-2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислоты.
41. Соединение по п.1, которое является [4-[[2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислотой.
42. Соединение по п.1, которое является [4-[[(2R)-2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислотой.
43. Соединение по п.1, которое является [4-[[(2S)-2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислотой.
44. Соединение по п.1, выбранное из
{2-метил-4-[2-(4-трифторметилфеноксиметил)бутилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[2-(4-трифторметилфеноксиметил)пентилсульфанил]фенокси}уксусной кислоты;
{4-[4-циано-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфенокси}уксусной кислоты;
(R)-{4-[2-аллилокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
(R)-{4-[2-метоксиметокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-этокси-4-(4-трифторметилфенил)бутилсульфанил]-2-метилфенокси}уксусной кислоты;
{3-хлор-4-[2-этокси-3-(4-трифторметилфенокси)пропилсульфанил]фенил}уксусной кислоты;
{4-[2-этоксиметил-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[4-этокси-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфенокси}уксусной кислоты и
{4-[2-(5-хлортиофен-2-илметокси)-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты.
45. Соединение по п.1, выбранное из
{4-[3-циано-2-(4-трифторметилфеноксиметил)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[5-циано-2-(4-трифторметилфеноксиметил)пент-4-енилсульфанил]-2-метилфенокси}уксусной кислоты;
{3-хлор-4-[2-(4-трифторметилфеноксиметил)бутилсульфанил]фенил}уксусной кислоты;
{2-метил-4-[3-(4-трифторметилфенокси)-2-(4-трифторметилфеноксиметил)пропилсульфанил]фенокси}уксусной кислоты;
{4-[2-бензилокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-бутирилфенокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[2-метилсульфанилметокси-4-(4-трифторметилфенил)бутилсульфанил]фенокси}уксусной кислоты;
{4-[2-этокси-4-(4-трифторметилфенил)бут-3-енилсульфанил]-2-метилфенокси}уксусной кислоты.
46. Соединение по п.1, выбранное из
{4-[2-(4-трифторметилфеноксиметил)бутилсульфанил]фенокси}уксусной кислоты;
{2-метил-4-[2-(4-трифторметилфеноксиметил)гептилсульфанил]фенокси}уксусной кислоты;
{4-[4-метокси-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[3-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусной кислоты.
47. Соединение по п.1, выбранное из (R)-{4-[2-этокси-3-(4-трифторметоксифенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты.
48. {2-Метил-4-[4-(4-трифторметилфенил)бут-3-енилсульфанил]фенокси}уксусная кислота.
49. Соединение, выбранное из группы, состоящей из
{2-метил-4-[2-метил-3-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусной кислоты;
{4-[2-метокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
(R)-{4-[2-этокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
(S)-{4-[2-этокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-этокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[2-пропокси-3-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусной кислоты;
{4-[2-бутокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-аллилокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
(S)-{4-[2-метоксиметокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-метоксиметокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{2-метил-4-[2-метилсульфанилметокси-3-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусной кислоты;
{4-[2-карбоксиметокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфенокси}уксусной кислоты;
{4-[2-(4-метоксифенокси-3-(4-трифторметилфенокси)пропилсульфанил] -2-метилфенокси}уксусной кислоты;
{2-метил-4-[3-(4-трифторметилфенокси)-2-(4-трифторметилфеноксиметил)пропилсульфанили]фенокси}уксусной кислоты;
{4-[4,4-диэтокси-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфенокси}уксусной кислоты;
или его фармацевтически приемлемая соль.
50. {2-Метил-4-[2-(4-трифторметилфенокси)пропилсульфанил]фенокси}уксусная кислота
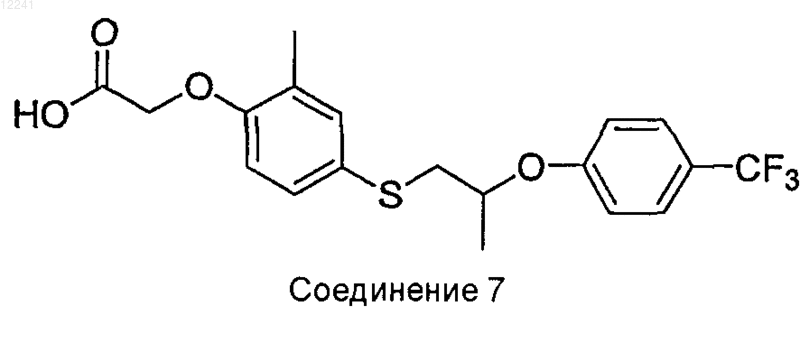
или ее фармацевтически приемлемая соль.
51. {2-Метил-4-[1-(4-метилфенокси)пропилсульфанил]фенокси}уксусная кислота
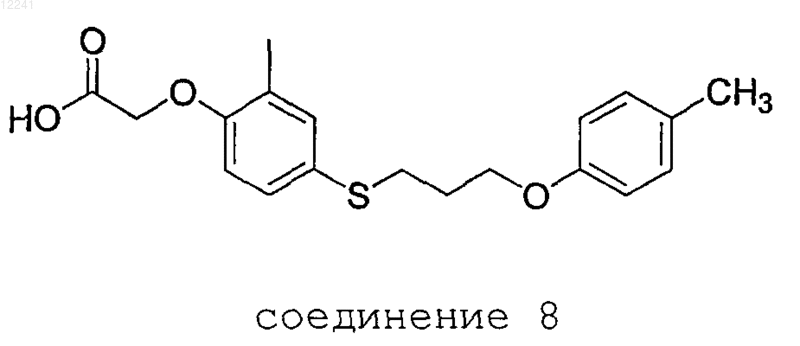
или его фармацевтически приемлемая соль.
52. {4-[2-Гидрокси-4-(4-трифторметилфенил)бут-3-енилсульфанил]-2-метилфенокси}уксусная кислота
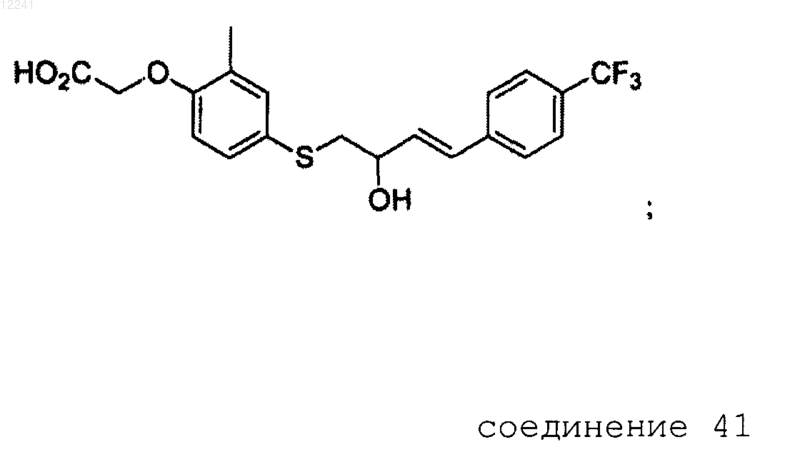
или ее фармацевтически приемлемая соль.
53. Фармацевтическая композиция, включающая соединение по любому из пп.1-51 или 52.
54. Способ лечения или ингибирования развития состояния, опосредованного PPAR-дельта, причем указанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции по п.53.
55. Соединение формулы (II)
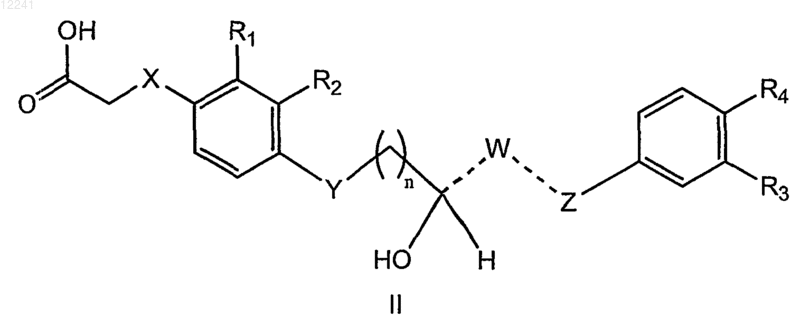
где X представляет собой О,
Y представляет собой S или О;
---W--- представляет собой группу, выбранную из -CH= и -CH2-,
Z выбран из О, CH, при условии, что когда Y представляет собой О, Z представляет собой О;
R1 представляет собой C1-3алкил,
R2 представляет собой H,
R3 представляет собой H,
R4 представляет собой C1-5алкил, замещенный галогеном,
и n равно 1;
или его фармацевтически приемлемая соль.
56. Соединение по п.55, где X представляет собой О.
57. Соединение по п.55, где Y представляет собой О.
58. Соединение по п.55, где Y представляет собой S.
59. Соединение по п.55, где Z представляет собой О.
60. Соединение по п.55, где Z представляет собой CH.
61. Соединение по п.55, где ---W--- представляет собой -CH2-.
62. Соединение по п.55, где ---W--- представляет собой -CH=.
63. Соединение по п.55, где R3 независимо выбран из H, F, Cl, метила и метокси.
64. Соединение по п.55, где R4 независимо выбран из трифторметила, фторметила, дифторметила, хлордифторметила, дихлорфторметила.
65. Соединение по п.55, где X представляет собой О и Y представляет собой О.
66. Соединение по п.55, где X представляет собой О и Y представляет собой S.
67. Соединение по п.55, где Y представляет собой О и Z представляет собой О.
68. Соединение по п.55, где Y представляет собой S и Z представляет собой О.
69. Соединение по п.55, где R4 независимо выбран из трифторметила, фторметила, дифторметила.
70. Соединение по п.57, которое выбрано из
{4-[(2R)-2-гидрокси-3-(4-(трифторметилфенокси)пропилсульфанил)]-2-метилфенокси}уксусной кислоты,
{4-[(2S)-2-гидрокси-3-(4-(трифторметилфенокси)пропилсульфанил)]-2-метилфенокси}уксусной кислоты и
{4-[2-этокси-3-(4-трифторметилфенокси)пропокси]-2-метилфенокси}уксусной кислоты.
71. Фармацевтическая композиция, включающая соединение по любому из пп. 55-69 и 70.
72. Способ лечения или ингибирования развития состояния, опосредованного PPAR-дельта, причем указанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества композиции по п.71.
Текст
012241 Данная заявка заявляет приоритет предварительной заявки на патент США 60/504146, зарегистрированной 19 сентября 2003 г., которая таким образом включена в качестве ссылки в полном объеме. Сердечно-сосудистые заболевания (CVD) превалируют во всем мире и часто ассоциируются с другими патологическими состояниями, такими как диабет и ожирение. Было предпринято много исследований популяций для установления факторов риска для CVD; установлено, что среди них наиболее важными являются высокие уровни в плазме холестерина липопротеинов низкой плотности (LDL-C), высокие уровни в плазме триглицеридов (200 мг/дл) и низкие уровни холестерина липопротеинов высокой плотности (HDL-C). В настоящее время имеется несколько терапий, объектом которых являются низкие уровни HDL-C и триглицериды. Рецепторы, активированные пероксисомным пролифератором (PPAR), являются метаболическими сенсорами, регулирующими экспрессию генов, вовлеченных в гомеостаз глюкозы и липидов. Агонисты подтипа PPAR, такие как LOPID (гемифиброзил) и TRICOR (фенофибрат), и агонисты подтипаPPAR, такие как AVANDIA (розиглитазона малеат), применяют для лечения дислипидемии и диабета,соответственно. Другой член этого семейства ядерных рецепторов, активированный пероксисомным пролифератором рецептор-дельта (PPAR-дельта или PPAR), также является необходимым фактором транскрипции, который как сообщается, принимает участие в регуляции генов, вовлеченных в метаболизм липидов и расход энергии. Обнаружено, что PPAR-дельта действует в качестве рецептора прохода (пути проникновения в клетку), модулирующего экспрессию других PPAR (Shi et al., 2002, Proc Natl.Acad. Sci USA, 99(5): 2613-2618). Каждый подтип рецептора имеет особое распределение в тканях: 1)PPAR обнаруживает самую высокую экспрессию в печени, 2) PPAR появляется главным образом в жировой ткани и 3) PPAR имеет самое широкое распространение - является вездесущим в организме взрослой крысы (Braissant et al., 1996, Endocrinology 137(1): 354-366) и во всех тканях человека, испытанных до сегодняшнего дня, включая печень, почки, абдоминальную жировую ткань и скелетную мышцу(Auboeuf et al., 1997, Diabetes 46(8): 1319-1327). Недавно опубликованы сильнодействующие лиганды для PPAR, обеспечивающие лучшее понимание его функции в метаболизме липидов. Основным действием этих соединений у мышей db/db (Leibowitz et al., 2000, FEBS Lett. 473(3): 333-336) и страдающих ожирением резус-обезьян (Oliver et al., 2001,Proc. Natl. Acad. Sci. USA 98(9): 5306-5311) было повышение уровня холестерина липопротеинов высокой плотности (HDL-C) и снижение уровня триглицеридов с небольшим влиянием на уровень глюкозы(хотя уровни инсулина снижались у обезьян). HDL-C удаляет холестерин из периферических клеток посредством процесса, названного обратным переносом холестерина. Первая и ограничивающая скорость стадия, перенос клеточного холестерина и фосфолипидов к аполипопротеиновому A-I-компоненту HDL,опосредуется АТФ-связывающим кассетным транспортером A1 (ABCA1) (Lawn et al., 1999, J. Clin. Investigation 104(8): R25-R31). Обнаружено, что активация PPAR повышает уровень HDL-C посредством транскрипционного регулятора ABCAl (Oliver et al., 2001, Proc. Natl. Acad. Sci. USA 98(9): 5306-5311). Посредством индукции экспрессии мРНК ABCA1 в макрофагах агонисты PPAR могут повышать уровни HDL-C у пациентов и удалять избыточный холестерин из нагруженных липидами макрофагов, тем самым подавляя развитие атеросклеротических повреждений. Существующая терапия для гиперхолестеринемии включает статиновые лекарственные средства, которые снижают уровень LDL-C, но проявляют небольшое влияние на HDL-C и фибраты, агонисты PPAR, которые обладают низкой активностью и вызывают только умеренное повышение уровня HDL-C. Кроме того, подобно фибратам, агонистыPPAR могут также снижать уровни триглицеридов, дополнительный фактор риска для сердечнососудистого заболевания и диабета. Обнаружено, что повышенный уровень свободных жирных кислот способствует инсулинорезистентности и развитию диабета (Boden, G. Proceedings of the Association ofAmerican Physicians (1999 May-Jun), 111(3), 241-8). Примеры известных агонистов PPAR-дельта, пригодных для лечения гиперлипидемии, диабета или атеросклероза, включают L-165041 (Leibowitz et al., 2000) и GW501516 (Oliver et al., Proceeding of the National Academy of Sciences of the United States of America (2001), 98(9), 5306-5311). Обработка дифференцированных моноцитов THP-1 GW501516 индуцировала экспрессию мРНК ABCA1 и повышенный отток холестерина из этих клеток. Изобретение относится к соединениям представленной ниже формулы (I): где X выбран из ковалентной связи, S или О,Y представляет собой S или О;R1 и R2 независимо выбраны из H, C1-3 алкила, C1-3 алкокси, галогена и NRaRb, где Ra и Rb независимо представляют собой H или C1-3 алкил;R3 и R4 независимо выбраны из H, галогена, циано, гидрокси, ацетила, C1-5 алкила, С 1-4 алкокси иNRcRd, где Rc и Rd независимо представляют собой H или C1-3 алкил, при условии, что R3 и R4 не являются оба H;n равно 1 или 2; или их фармацевтически приемлемым солям. Изобретение также относится к композициям, которые включают одно или несколько соединений формулы (I) и фармацевтический носитель или эксципиент. Упомянутые композиции и способы, указанные ниже, могут далее включать дополнительные фармацевтически активные агенты, такие как агенты, снижающие уровень липидов, или агенты, снижающие кровяное давление, или те и другие. Другой аспект изобретения включает способы применения описанных соединений или композиций в различных способах лечения, профилактики или ингибирования развития состояния, непосредственным или косвенным образом опосредованного PPAR-дельта. Такое состояние включает, но не ограничивается перечисленным, диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемию, гипо-HDL-холестеринемию, гипер-LDL-холестеринемию, дислипидемию, атеросклероз и ожирение. Одним вариантом осуществления настоящего изобретения является способ лечения опосредованного PPAR-дельта состояния, причем указанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества описанного в описании соединения или композиции. Другим вариантом осуществления настоящего изобретения является способ ингибирования начала и/или развития опосредованного PPAR-дельта состояния, причем указанный способ включает введение пациенту, нуждающемуся в лечении, фармацевтически эффективного количества описанного в описании соединения или композиции. Примерами состояний, которые можно лечить агонистом PPAR-дельта, являются, без ограничения,диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемия, гипоHDL-холестеринемия, гипер-LDL-холестеринемия, дислипидемия, атеросклероз и ожирение. Дислипидемия включает гипертриглицеридемию и смешанную гиперлипидемию. Например, дислипидемией(включая гиперлипидемию) может быть одно или несколько следующих состояний: низкий уровень HDL(35 или 40 мг/дл), высокий уровень триглицеридов (200 мг/дл) и высокий уровень LDL (150 мг/дл). Дополнительные признаки и преимущества изобретения станут очевидными из приведенного ниже подробного обсуждения, примеров и формулы изобретения. Изобретение относится к композициям, содержащим соединения формулы (I), описанные выше, и способам их применения. Предпочтительные соединения изобретения являются сильнодействующими агонистами PPARдельта, которые обладают по меньшей мере одной и предпочтительно двумя или тремя следующими характеристиками при введении пациентам с гиперхолестеринемией, гипертриглицеридемией, низким уровнем HDL-C, ожирением, диабетом и/или метаболическим синдромом X: 1) повышением уровняHDL-C, 2) снижением уровня триглицеридов, 3) снижением уровня свободных жирных кислот и 4) снижением уровней инсулина. Улучшение в уровнях HDL-C и триглицеридов является полезным для достижения здоровой сердечно-сосудистой системы. Кроме того, пониженный уровень триглицеридов и свободных жирных кислот способствует снижению ожирения и ослабляет или предотвращает диабет.PPAR-дельта, будучи экспрессированным во всем организме, может действовать в качестве рецептора прохода, который регулирует экспрессию/активность других ядерных рецепторов, таких как другиеPPAR. Например, обнаружено, что PPAR-дельта блокирует PPAR-опосредованный адипогенез и экспрессию ацил-СоА-оксидазы; обнаружено также, что он ассоциируется с сорепрессорами ядерного рецептора SMRT (заглушающий медиатор для рецепторов ретиноидных и тироидных гормонов), SHARP(SMART и белок-репрессор, ассоциированный с гистондеацетилазой) и HDAC (гистондеацетилаза). Та-2 012241 ким образом, состояния, непосредственно опосредованные этими ядерными рецепторами, такие как ожирение и диабет типа II, могут быть косвенным образом опосредованы PPAR-дельта (см., например,Shi et al., 2002, Proc. Natl. Acad. Sci. USA, 99(5): 2613-2618). Некоторые аспекты изобретения относятся к лечению гипертриглицеридемии, повышению уровнейHDL, понижению уровней LDL и/или понижению общего холестерина. Способы лечения предпочтительно ассоциированы с улучшениями в величине, продолжительности или степени побочных действий,таких как отек, обычно ассоциированный с другими существующими терапиями. Изобретение дополнительно описывается ниже. Описание классифицируется следующим образом: А) термины; В) соединения; С) синтез; D) препарат и введение; E) применение; F) биологические примеры; G) другие варианты осуществления и формула изобретения. А. Термины Термин субъект, применяемый в описании, относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который был объектом лечения, изучения или эксперимента. Термин терапевтически активное количество, применяемый в описании, означает такое количество активного соединения или фармацевтического агента, которое вызывает биологическую или медицинскую реакцию в тканевой системе, у животного или человека, который находится под наблюдением исследователя, ветеринара, врача или другого клинициста, причем такая реакция включает ослабление,профилактику, лечение или ингибирование появления или развития симптомов подвергаемого лечению заболевания или нарушения. Состояния, непосредственным или косвенным образом опосредованные PPAR-дельта, включают,но не ограничиваются перечисленным, диабет, сердечно-сосудистые заболевания, метаболический синдром X, гиперхолестеринемию, гипо-HDL-холестеринемию, гипер-LDL-холестеринемию, дислипидемию, атеросклероз и ожирение. Для терапевтических целей термин совместно эффективное количество, применяемый в описании, означает такое количество каждого активного соединения или фармацевтического агента, применяемого отдельно или в комбинации, которое вызывает биологическую или медицинскую реакцию в системе ткани у животного или человека, который находится под наблюдением исследователя, ветеринара, врача или другого клинициста, причем такая реакция включает ослабление симптомов подвергаемого лечению заболевания или нарушения. Для профилактических целей (т.е. ингибирования начала или развития нарушения) термин совместно эффективное количество относится к такому количеству каждого активного соединения или фармацевтического агента, применяемого отдельно или в комбинации, которое лечит субъекта или ингибирует у субъекта начало или развитие нарушения, которое находится под наблюдением исследователя, ветеринара, врача или другого клинициста. Таким образом, настоящее изобретение предлагает комбинации двух или более лекарственных средств, в которых, например, (а) каждое лекарственное средство вводят в независимо терапевтически или профилактически эффективном количестве; (b) по меньшей мере одно лекарственное средство в комбинации вводят в количестве, которое является субтерапевтическим или субпрофилактическим, если вводят только это средство, но является терапевтическим или профилактическим при введении в комбинации со вторым или дополнительным лекарственным средством в соответствии с изобретением, или с) оба (или больше) лекарственных средства вводят в количестве, которое является субтерапевтическим или субпрофилактическим, если их вводят по отдельности, но является терапевтическим или профилактическим, когда их вводят вместе. Если не оговорено особо, применяемый в описании, причем независимо от того, применяют ли его отдельно или как часть группы-заместителя, термины алкил и алкокси включают неразветвленные или разветвленные цепи, имеющие 1-8 атомов углерода, такие как C1-6, C1-4, С 3-8, С 2-5 или любого другого диапазона, и, если не оговорено особо, включает как замещенные, так и незамещенные радикалы. Например, C1-6 алкильные радикалы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2-метилбутил, неопентил, н-гексил, 2-гексил и 2-метилпентил. Алкоксирадикалы образуются из ранее описанных алкильных групп с неразветвленной или разветвленной цепью. Термины алкил и алкокси включают незамещенные или замещенные радикалы с одним или несколькими заместителями, например, 1-5, 1-3 или 2-4 заместителями. Заместители могут быть одинаковыми (дигидрокси, диметил), похожими (хлор, фтор) или разными (хлорбензил- или аминометилзаместители). Примеры замещенного алкила включают галогеналкил (такой как фторметил,хлорметил, дифторметил, перхлорметил, 2-бромэтил, трифторметил и 3-йодциклопентил), гидроксиалкил (такой как гидроксиметил, гидроксиэтил, 2-гидроксипропил), аминоалкил (такой как аминометил, 2 аминоэтил, 3-аминопропил и 2-аминопропил), алкоксиалкил, нитроалкил, алкилалкил, цианоалкил, фенилалкил, гетероарилалкил, гетероциклоалкил, феноксиалкил, гетероарилоксиалкил (такой как 2 пиридилоксиалкил), гетероциклилоксиалкил (такой как 2-тетрагидропираноксиалкил), тиоалкилалкил(такой как MeS-алкил), тиофенилалкил (такой как phS-алкил), карбоксиалкил и так далее. Термин ди(C1-3 алкил)аминогруппа включает независимо выбранные алкильные группы, которые образуют, например,метилпропиламино и изопропилметиламино, помимо этого, диалкиламиногруппы, имеющие две одинаковые алкильные группы, такие как диметиламино или диэтиламино.-3 012241 Термин алкенил включает необязательно замещенные углеводородные радикалы с неразветвленной или разветвленной цепью, как указано выше, по меньшей мере с одной углерод-углеродной двойной связью (sp2). Алкенилы включают этенил (или винил), проп-1-енил, проп-2-енил (или аллил), изопропенил (или 1-метилвинил), бут-1-енил, бут-2-енил, бутадиенилы, пентенилы, гекса-2,4-диенил и так далее. Углеводородные радикалы, имеющие сочетание двойных связей и тройных связей, такие как 2-пентен-4 инил, сгруппированы в описании как алкинилы. Алкенил включает циклоалкенил. В изобретение включены цис- и транс- или (E)- и (Z)-формы. Алкенил может быть замещен одним или несколькими заместителями, такие замещенные алкенилы включают, но не ограничиваются указанным, цианоалкенил и тиоалкенил. Термин алкинил включает необязательно замещенные углеводородные радикалы с неразветвленной и разветвленной цепью, как указано выше, по меньшей мере с одной углерод-углеродной тройной связью (sp). Алкинилы включают этинил, пропинилы, бутинилы и пентинилы. Углеводородные радикалы, имеющие сочетание двойных связей и тройных связей, такие как 2-пентен-4-инил, сгруппированы в описании как алкинилы. Алкинилы не включают циклоалкинил. Термин Ас, применяемый в описании независимо от того, применяют ли его отдельно или как часть группы-заместителя, означает ацетил (СН 3 СО-). Термин галоген должен включать йод, бром, хлор и фтор. Термин арил или Ar, применяемый в описании, относится к незамещенной или замещенной ароматической углеводородной циклической системе, такой как фенил и нафтил. Когда Ar или арильная группа является замещенной, она может иметь один-три заместителя, которые независимо выбраны из С 1-С 8 алкила, C1-С 8 алкокси, фторированного C1-С 8 алкила (например, трифторметила), фторированногоC1-С 8 алкокси (например, трифторметокси), галогена, циано, C1-С 8 алкилкарбонила, такого как ацетил,карбокси, гидрокси, амино, нитро, С 1-С 4 алкиламино (т.е. -NH-C1-С 4 алкила), С 1-С 4 диалкиламино (т.е. -N[С 1-С 4 алкил]2, где алкильные группы могут быть одинаковыми или разными) или незамещенный, моно-,ди- или тризамещенный фенил, где заместители на фениле независимо выбраны из C1-С 8 алкила, C1 С 8 алкокси, фторированного C1-С 8 алкила, фторированного C1-С 8 алкокси, галогена, циано, ацетила, карбоксила, гидрокси, амино, нитро, алкиламино, диалкиламино или пяти- или шестичленного гетероарила,имеющего 1-3 гетероатома, выбранных из N, О и S. Термин гетероарил, применяемый в описании, представляет собой стабильную незамещенную или замещенную пяти- или шестичленную моноциклическую или бициклическую ароматическую систему колец, которая состоит из атомов углерода и одного-трех гетероатомов, выбранных из N, O и S. Гетероарильная группа может быть присоединена у любого гетероатома или атома углерода, что приводит к созданию стабильной структуры. Примеры гетероарильных групп включают, но не ограничиваются перечисленным, бензимидазолил, бензизоксазолил, бензофуранил, бензопиразолил, бензотиадиазолил, бензотиазолил, бензотиенил, бензотриазолил, бензоксазолил, фуранил, фуразанил, фурил, имидазолил, индазолил, индолизинил, индолинил, индолил, изобензофуранил, изоиндолил, изотиазолил, изоксазолил,оксазолил, пуринил, пиразинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, хинолинил, хинолил, тиадиазолил, тиазолил, тиофенил или триазолил. Когда гетероарильная группа является замещенной, гетероарильная группа может иметь один-три заместителя, включающих, но не ограничивающихся перечисленным, С 1-С 8 алкил, галоген и арил. Термин гетероциклил включает необязательно замещенные неароматические кольца, имеющие атомы углерода и по меньшей мере один гетероатом (О, S, N) или гетероатомную группу (SO2, CO,CONH, COO) в кольце. Гетероциклил может быть насыщенным, частично насыщенным, неароматическим или конденсированным. Примеры гетероциклила включают циклогексилимино, имидазолидинил,имидазолинил, морфолинил, пиперазинил, пиперидил, пиридил, пиранил, пиразолидинил, пиразолинил,пирролидинил, пирролинил и тиенил. Если не оговорено особо, гетероарил и гетероциклил может иметь валентность, соединяющую его с остатком молекулы через атом углерода, такой как 3-фурил или 2-имидазолил, или через гетероатом,такой как N-пиперидил или 1-пиразолил. Моноциклический гетероциклил предпочтительно имеет 5-7 атомов в кольце или 5-6 атомов в кольце; здесь может быть 1-5 гетероатомов или гетероатомных групп в кольце и предпочтительно 1-3 или 1-2 гетероатома или гетероатомных группы. Термины гетероциклил и гетероарил включают также конденсированные, например, бициклические кольца, такие как кольца, необязательно конденсированные с необязательно замещенным карбоциклическим или гетероциклическим пяти- или шестичленным ароматическим кольцом. Например, гетероарил включает необязательно замещенное шестичленное гетероароматическое кольцо, содержащее 1, 2 или 3 атома азота, конденсированное с необязательно замещенным пяти- или шестичленным карбоциклическим или гетероциклическим ароматическим кольцом. Такое гетероциклическое пяти- или шестичленное ароматическое кольцо, конденсированное с указанным пяти- или шестичленным ароматическим кольцом, может содержать 1, 2 или 3 атома азота, когда оно является шестичленным кольцом, или 1, 2 или 3 гетероатома, выбранных из кислорода, азота и серы, когда оно является пятичленным кольцом. Предполагается, что определение любого заместителя или символа у конкретного положения в мо-4 012241 лекуле будет зависеть от его определений в других положениях в данной молекуле. Понятно, что заместители и картины замещения на соединениях данного изобретения могут быть выбраны средним специалистом в данной области для получения соединений, которые являются химически стабильными и которые могут быть легко синтезированы методиками, известными в данной области, а также теми методами,которые указаны в описании. Когда химические группы являются комбинированными, такими как этоксиметил или фенилэтил,термин описывается в направлении от периферии к месту соединения с остальной частью молекулы. Например, этоксиметилом является CH3CH2OCH2- и фенилэтилом является фенильная группа, соединенная через -CH2-CH2- с остальной частью молекулы (но не фенильная группа, присоединенная к молекуле группой CH3CH2 в качестве заместителя на фениле). Когда применяют скобки, они указывают на периферическое замещение. Применяемый в описании термин композиция предназначен для включения в него продукта,включающего определенные ингредиенты в определенных количествах, а также любой продукт, который является результатом, непосредственным или косвенным образом, сочетания определенных ингредиентов в определенных количествах. Соединения изобретения далее описываются в следующем разделе. В. Соединения Настоящее изобретение описывает композиции и способы, содержащие и применяющие соединения формулы (I), описываемые выше. Если не оговорено особо, в формуле (I) каждый углеводород (алкил, алкенил, алкинил, циклоалкил, циклоалкенил и т.д.) или гетерокарбил (гетероциклил, гетероарил,содержащая гетероатом группа, такая как сульфонил, амино, амидо и т.д.) может быть замещенным или незамещенным, например алкил включает замещенный и незамещенный алкил и гетероциклил, и арил, и алкокси и так далее могут быть замещенными или незамещенными. Примеры настоящего изобретения включают те соединения, у которых: (а) X представляет собой S или О; (b) X представляет собой ковалентную связь; (с) X представляет собой О; (d) Y представляет собой О; (е) Y представляет собой S; (f) Z представляет собой О; (g) Z представляет собой CH или CH2; (h)W представляет собой -CH2- или -CH2-CH2-; (i) W представляет собой -CH2-; (j) Wпредставляет собой =СН-, -CH=, =СН-СН 2-, -CH2-CH=, =СН-СН= или -CH=CH-; (k) R1 и R2 независимо выбраны из H, C1-3 алкила, C1-3 алкокси, F, Cl и Br; (l) R3 и R4 независимо выбраны из H, галогена, циано,С 1-4 алкила и C1-3 алкокси; (m) R1 и R2 независимо выбраны из H, метила, метокси, F и Cl; (n) R3 и R4 независимо выбраны из H, галогена, циано, гидрокси, С 2-4 ацила, С 1-4 алкила и C1-3 алкокси; (о) R3 независимо выбран из H, F, Cl, метила и метокси; (р) R4 независимо выбран из F, Cl, метила, метокси, трифторметила, фторметила, дифторметила, хлордифторметила, дихлорфторметила, фторметокси, дифторметокси,хлордифторметокси, дихлорфторметокси и трифторметокси; (q) R3 выбран из метила, метокси, H, Cl, Br,I, ОН, -CH(CF3)2, CF3, -OCF3, -N(CH3)2, -O-CH2COOH и -COCH3 и R4 выбран из H, Cl и метила; (r) R5 выбран из С 1-7 алкила, C1-6 алкокси, С 2-7 алкенила, С 2-7 алкенилокси, С 2-7 алкинила, С 2-7 алкинилокси, С 3-7 циклоалкила, С 3-7 циклоалкокси, С 1-6 алкокси-С 1-6 алкила, C1-5 алкокси-C1-5 алкокси и С 3-7 циклоалкилокси-С 1-7 алкокси; (s) R5 выбран из фенокси, (фенил) С 1-5 алкокси, (фенил) C1-5 алкила, С 2-5 гетероарилокси, С 2-5 гетероарилС 1-5 алкокси, С 2-5 гетероциклилокси, С 3-7 циклоалкил-С 1-7 алкил, С 3-7 циклоалкил-С 1-7 алкокси и С 3-7 циклоалкилокси-С 1-6 алкил; (t) R6 представляет собой H; (u) R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, фторметила, дифторметила, фторметокси, дифторметокси, трифторметила,трифторметокси и метокси; (v) R1 выбран из H, CF3, метила, Cl и метокси и R2 выбран из H, Cl и метила;(w) R1 выбран из H, CF3, метила, Cl и метокси и R2 выбран из H, Cl и метила и X представляет собой ковалентную связь; (х) R1 выбран из H, CF3, метила, Cl и метокси и R2 выбран из H, Cl и метила, X представляет собой ковалентную связь, Y представляет собой S и Z представляет собой O; (у) X представляет собой O и Y представляет собой O; (z) X представляет собой O и Y представляет собой S; (аа) Y представляет собой O и Z представляет собой O; (bb) Y представляет собой S и Z представляет собой O; (сс)R1 выбран из H, CF3, метила, Cl и метокси, R2 выбран из H, Cl и метила, R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, трифторметила, трифторметокси, фторметила, фторметокси, дифторметила, дифторметокси и метокси; (hh) X представляет собой О, Y представляет собой О, R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, CF3, OCF3 и метокси; (ii) X представляет собой О, Y представляет собой S, R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, CF3,OCF3 и метокси; (jj) X представляет собой ковалентную связь, Y представляет собой S, R3 выбран из H,F, Cl, метила и метокси и R4 выбран из F, Cl, метила, CF3, OCF3 и метокси; (kk) Y представляет собой О,Z представляет собой О, R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, CF3, OCF3 и метокси; (ll) Y представляет собой S, Z представляет собой О, R3 выбран из H, F, Cl, метила и метоксиS, R5 выбран из C1-3 алкила, С 1-3 алкокси, С 2-4 алкенила, С 2-4 алкенилокси и С 1-3 алкокси-С 1-3 алкокси и R6 представляет собой H; (рр) X представляет собой О, Y представляет собой О, R1 выбран из H, CF3, метила, Cl и метокси, R2 выбран из H, Cl и метила, R3 выбран из H, F, Cl, метила и метокси, R4 выбран из F,Cl, метила, CF3, OCF3 и метокси и n равно 1; (qq) X представляет собой О, Y представляет собой S, R1 выбран из H, CF3, метила, Cl и метокси, R2 выбран из H, Cl и метила, R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, CF3, OCF3 и метокси; (rr) X представляет собой О, Y представляет собой S, R1 выбран из H, CF3, метила, Cl и метокси, R2 выбран из H, Cl и метила, R3 выбран из H, F, Cl,метила и метокси, R4 выбран из F, Cl, метила, CF3, OCF3 и метокси и n равно 1 или (ss) X представляет собой О, Y представляет собой S, R1 выбран из H, CF3, метила, Cl и метокси, R2 выбран из H, Cl и метила, R3 выбран из H, F, Cl, метила и метокси, R4 выбран из F, Cl, метила, CF3, OCF3 и метокси, R5 выбран из C1-3 алкила, C1-3 алкокси, С 2-4 алкенила, С 2-4 алкенилокси и С 1-3 алкокси-С 1-3 алкокси, R6 представляет собой H и n равно 1, или комбинации указанных выше соединений. В соответствии с другим аспектом изобретения формула (I) модифицирована так, что W может также быть ковалентной связью и R6 представляет собой H, когда W представляет собой группу, выбранную из ковалентной связи, -CH=, -CH2-, -CH2-CH2-, -CH2-CH= и -CH=CH-, или R6 отсутствует,когда W представляет собой группу, выбранную из =СН-, =СН-СН 2- и =СН-CH=. В частности, примеры соединений формулы (I) включают те соединения, у которых (a) X представляет собой О и Y представляет собой О; (b) X представляет собой ковалентную связь и R1 выбран из H,CF3, метила, Cl и метокси и R2 выбран из H, Cl и метила; (с) X представляет собой О и Y представляет собой S; (d) X представляет собой ковалентную связь, Y представляет собой S и Z представляет собой О;(е) Y представляет собой S и Z представляет собой О; (f) Y представляет собой O и Z представляет собой О; (g) R1 выбран из H, CF3, метила, Cl и метокси и R2 выбран из H, Cl и метила; (h) R1 и R2 независимо выбраны из H, метила, метокси, F и Cl; (i) R3 независимо выбран из H, F, Cl, метила и метокси; (j) R4 независимо выбран из F, Cl, метила, метокси, трифторметила, фторметила, дифторметила, хлордифторметила, дихлорфторметила, фторметокси, дифторметокси, хлордифторметокси, дихлорфторметокси и трифторметокси; (k) R3 выбран из метила, метокси, H, Cl, Br, I, ОН, -CH(CF3)2, CF3, -OCF3, -N(CH3)2, -OCH2COOH и -COCH3 и R4 выбран из H, Cl и метила; (l) R3 выбран из H, F, Cl, метила и метокси и R4 выбран из F, Cl, метила, фторметила, дифторметила, фторметокси, дифторметокси, трифторметила, трифторметокси и метокси; (m) R5 выбран из С 1-7 алкила, С 1-6 алкокси, С 2-7 алкенила, С 2-7 алкенилокси, С 2-7 алкинила, С 2-7 алкинилокси, С 3-7 циклоалкила, С 3-7 циклоалкокси, C1-6 алкокси-С 1-6 алкила, C1-5 алкокси-C1-5 алкокси и С 3-7 циклоалкокси-С 1-7 алкокси; (n) R6 представляет собой H и R5 выбран из С 1-7 алкила, C1-6 алкокси, С 2-7 алкенила, С 2-7 алкенилокси, C1-6 алкокси-С 1-6 алкила и C1-5 алкокси-C1-5 алкокси; (о) R6 представляет собой H и R5 выбран из C1-5 алкила, С 1-4 алкокси, С 2-5 алкенила, С 2-5 алкенилокси и C1-5 алкокси-C1-5 алкокси; (р) R6 представляет собой H и R5 выбран из C1-3 алкила, C1-3 алкокси, С 2-4 алкенил, С 2-4 алкенилокси и С 1-3 алкокси-С 1-3 алкокси; (q) R6 представляет собой H и R5 выбран из метокси, этокси, пропокси,изопропокси, пропенилокси, изопропенилокси, этоксиметокси, метоксиметокси, метоксиметила, метоксиэтила, этоксиметила и этоксиэтила или W представляет собой ковалентную связь, или комбинацию указанных выше соединений. В другом примере соединения настоящего изобретения могут быть соединениями формулы (II) где X выбран из ковалентной связи, S или О,Y представляет собой S или О;R1 и R2 независимо выбраны из H, C1-3 алкила, C1-3 алкокси, галогена и NRaRb, где Ra и Rb независимо представляют собой H или C1-3 алкил;R3 и R4 независимо выбраны из H, галогена, циано, гидрокси, ацетила, С 1-5 алкила, С 1-4 алкокси иNRcRd, где Rc и Rd независимо представляют собой H или C1-3 алкил, при условии, что R3 и R4 не являются оба H; и-6 012241 или их фармацевтически приемлемыми солями. Соединения настоящего изобретения могут быть также выбраны из[4-(2S)-2-этокси-3-[4-(трифторметил)фенокси]пропил]тио]-2-метилфенокси]уксусной кислоты. В частности, соединения настоящего изобретения дополнительно включают 2-метил-4-[2-(4-трифторметилфеноксиметил)бутилсульфанил]феноксиуксусную кислоту; 2-метил-4-[2-(4-трифторметилфеноксиметил)пентилсульфанил]феноксиуксусную кислоту; 4-[4-циано-2-(4-трифторметилфеноксиметил)бутилсульфанил]-2-метилфеноксиуксусную кислоту;-7 012241 кислоту; 4-[(2R)-2-гидрокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфеноксиуксусную кислоту; 4-[(2S)-2-гидрокси-3-(4-трифторметилфенокси)пропилсульфанил]-2-метилфеноксиуксусную кислоту и 4-[2-этокси-3-(4-трифторметилфенокси)пропокси]-2-метилфеноксиуксусную кислоту. Настоящее изобретение предлагает также композиции, содержащие соединения формулы (I), и способы применения соединений формулы (I). В частности, настоящее изобретение предлагает композиции,содержащие соединения формулы (I), примеры которых указываются выше, и способы применения таких соединений формулы (I). Примеры предпочтительных соединений включают соединения, описанные в приведенной ниже табл. 1. Таблица 1 Когда соединения в соответствии с данным изобретением имеют по меньшей мере один хиральный центр, они могут существовать в виде энантиомеров. Когда соединения обладают двумя или более хиральными центрами, они могут дополнительно существовать в виде диастереомеров. Должно быть понятно, что в объем настоящего изобретения включены все такие изомеры и их смеси. Кроме того, некоторые кристаллические формы соединений могут существовать в виде полиморфов, и предполагается,что как таковые они включены в настоящее изобретение. Кроме того, некоторые соединения могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями, и предполагается, что такие сольваты также включены в объем данного изобретения. Изобретение предлагает описанные соединения и близко родственные фармацевтически приемлемые формы описанных соединений, такие как соли, сложные эфиры, амиды, гидраты или их сольватированные формы; маскированные или защищенные формы и рацемические смеси или энантиомерно или оптически чистые формы. Фармацевтически приемлемые соли, сложные эфиры и амиды включают карбоксилатные соли (например, C1-8 алкил, циклоалкил, арил, гетероарил или неароматический гетероциклил), аддитивные соли аминокислот, сложные эфиры и амиды, которые имеют приемлемое отношение польза/риск, являются фармакологически эффективными и подходящими для контактирования с тканями пациентов без чрезмерной токсичности, раздражения или аллергической реакции. Репрезентативные соли включают гидробромид, гидрохлорид, сульфат, бисульфат, нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат,лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат,мезилат, глюкогептаноат, лактобионат и лаурилсульфонат. Они могут включать катионы щелочных металлов и щелочно-земельных металлов, таких как натрий, калий, кальций и магний, а также нетоксичные катионы аммония, четвертичного аммония и амина, такие как катионы тетраметиламмония, метиламина,триметиламина и этиламина. См., например, публикацию S.M. Berge, et al., "Pharmaceutical Salts", J.Pharm. Sci., 1977, 66: 1-19, которая включена в описание в качестве ссылки. Репрезентативные фармацевтически приемлемые амиды изобретения включают амиды, полученные из аммиака, первичных C1-6 алкиламинов и вторичных ди(С 1-6 алкил)амидов. Вторичные амины включают 5- или 6-членные гетероциклические или гетероароматические части, содержащие по меньшей мере один атом азота и необязательно 1-2 дополнительных гетероатома. Предпочтительные амиды получают из аммиака, первичных C1-3 алкиламинов и ди(С 1-2 алкил)аминов. Репрезентативные фармацевтически приемлемые сложные эфиры изобретения включают С 1-7 алкиловые, С 5-7 циклоалкиловые, фениловые и фенил(C1-6)алкиловые эфиры. Предпочтительные сложные эфиры включают метиловые эфиры. Изобретение включает также соединения, имеющие одну или несколько функциональных групп(например, амино или карбоксил), маскированные защитной группой. Некоторые из этих маскированных или защищенных соединений являются фармацевтически приемлемыми; другие можно применять в качестве промежуточных продуктов. Синтетические промежуточные продукты и способы, описанные в описании, и небольшие их модификации также находятся в объеме изобретения.- 11012241 Гидроксилзащитные группы Защита для гидроксильной группы включает образование метиловых простых эфиров, замещенных метиловых простых эфиров, замещенных этиловых простых эфиров, замещенных бензиловых простых эфиров и силиловых простых эфиров. Замещенные метиловые простые эфиры Примеры замещенных метиловых эфиров включают метилоксиметиловый, метилтиометиловый,трет-бутилтиометиловый, (фенилдиметилсилил)метоксиметиловый, бензилоксиметиловый, п-метоксибензилоксиметиловый, (4-метоксифенокси)метиловый, гваяколметиловый, трет-бутоксиметиловый, 4 пентенилоксиметиловый, силоксиметиловый, 2-метоксиэтоксиметиловый, 2,2,2-трихлорэтоксиметиловый, бис-(2-хлорэтокси)метиловый, 2-(триметилсилил)этоксиметиловый, тетрагидропираниловый, 3 бромтетрагидропираниловый, тетрагидротиопираниловый, 1-метоксициклогексиловый, 4-метокситетрагидропираниловый, 4-метокситетрагидротиопираниловый, S,S-диоксидо-4-метокситетрагидротиопираниловый, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-иловый, 1,4-диоксан-2-иловый, тетрагидрофураниловый, тетрагидротиофураниловый и 2,3,3 а,4,5,6,7,7 а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-иловый эфиры. Замещенные этиловые простые эфиры Примеры замещенных этиловых простых эфиров включают 1-этоксиэтиловый, 1-(2-хлорэтокси) этиловый, 1-метил-1-метоксиэтиловый, 1-метил-1-бензилоксиэтиловый, 1-метил-1-бензилокси-2-фторэтиловый, 2,2,2-трихлорэтиловый, 2-триметилсилилэтиловый, 2-(фенилселенил)этиловый, третбутиловый, аллиловый, п-хлорфениловый, п-метоксифениловый, 2,4-динитрофениловый и бензиловый эфиры. Замещенные бензиловые простые эфиры Примеры замещенных бензиловых простых эфиров включают п-метоксибензиловый, 3,4 диметоксибензиловый,о-нитробензиловый,п-нитробензиловый,п-галогенбензиловый,2,6 дихлорбензиловый, п-цианобензиловый, п-фенилбензиловый, 2- и 4-пиколиловый, N-оксидо-3-метил-2 пиколиловый, дифенилметиловый, п,п'-динитробензгидриловый, 5-дибензосубериловый, трифенилметиловый, -нафтилдифенилметиловый, п-метоксифенилдифенилметиловый, ди-(п-метоксифенил)фенилметиловый, три-(п-метоксифенил)метиловый, 4-(4'-бромфенацилокси)фенилдифенилметиловый, 4,4',4"трис-(4,5-дихлорфталимидофенил)метиловый, 4,4',4"-трис(левулиноилоксифенил)метиловый, 4,4',4"трис(бензоилоксифенил)метиловый, 3-(имидазол-1-илметил)бис-(4',4"-диметоксифенил)метиловый, 1,1 бис-(4-метоксифенил)-1'-пиренилметиловый, 9-антриловый, 9-(9-фенил)ксантениловый, 9-(9-фенил-10 оксо)антриловый, 1,3-бензодитиолан-2-иловый и S,S-диоксидобензизотиазолиловый эфиры. Силиловые простые эфиры Примеры силиловых простых эфиров включают триметилсилиловый, триэтилсилиловый, триизопропилсилиловый, диметилизопропилсилиловый, диэтилизопропилсилиловый, диметилгексилсилиловый, трет-бутилдиметилсилиловый, трет-бутилдифенилсилиловый, трибензилсилиловый, три-п-ксилилсилиловый, трифенилсилиловый, дифенилметилсилиловый и трет-бутилметоксифенилсилиловый эфиры. Сложные эфиры Помимо простых эфиров гидроксигруппа может быть защищена в виде сложного эфира. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат,трифторацетат, метоксиацетат, трифенилметоксиацетат, феноксиацетат, п-хлорфеноксиацетат, п-Рфенилацетат, 3-фенилпропионат, 4-оксопентаноат (левулинат), 4,4-(этилендитио)пентаноат, пивалоат,адамантоат, кротонат, 4-метоксикротонат, бензоат, п-фенилбензоат, 2,4,6-триметилбензоат (мезитоат). Карбонаты Примеры карбонатов включают метил-, 9-флуоренилметил-, этил-, 2,2,2-трихлорэтил, 2(триметилсилил)этил-, 2-(фенилсульфонил)этил-, 2-(трифенилфосфонио)этил-, изобутил-, винил-, аллил-,п-нитрофенил-, бензил-, п-метоксибензил-, 3,4-диметоксибензил-, о-нитробензил-, п-нитробензил-, Sбензилтиокарбонат, 4-этокси-1-нафтил- и метилдитиокарбонат. Вспомогательное расщепление Примеры вспомогательного расщепления включают 2-йодбензоат, 4-азидобутират, 4-нитро-4 метилпентаноат, о-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этилкарбонат, 4-(метилтиометокси)бутират и 2-(метилтиометоксиметил)бензоата. Разнообразные сложные эфиры Примеры разнообразных сложных эфиров включают 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор 4-(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис-(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукцинат, (E)-2-метил-2-бутеноат (тиглоат), о-(метоксикарбонил)бензоат, п-Рбензоат, -нафтоат, нитрат, алкил-N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат, диметилфосфинотиоил и 2,4-динитрофенилсульфенат. Сульфонаты Примеры сульфонатов включают сульфат, метансульфонат (мезилат), бензилсульфонат и тозилат.- 12012241 АМИНОЗАЩИТНЫЕ ГРУППЫ Защита для аминогруппы включает карбаматы, амиды и специальные -NH-защитные группы. Примеры карбаматов включают метил- и этилкарбаматы, замещенные этилкарбаматы, карбаматы с вспомогательным расщеплением, карбаматы с фотолитическим расщеплением, производные типа мочевины и разнообразные карбаматы. Карбаматы Примеры метил- и этилкарбаматов включают метил и этил, 9-флуоренилметил, 9-(2 сульфо)флуоренилметил,9-(2,7-дибром)флуоренилметил,2,7-ди-трет-бутил-9-(10,10-диоксо-10,10,10,10-тетрагидротиоксантил)метил и 4-метоксифенацил. Замещенный этил Примеры замещенных этилкарбаматов включают 2,2,2-трихлорэтил, 2-триметилсилилэтил, 2 фенилэтил, 1-(1-адамантил)-1-метилэтил, 1,1-диметил-2-галогенэтил, 1,1-диметил-2,2-дибромэтил, 1,1 диметил-2,2,2-трихлорэтил, 1-метил-1-(4-бифенилил)этил, 1-(3,5-ди-трет-бутилфенил)-1-метилэтил, 2(2'- и 4'-пиридил)этил, 2-(N,N-дициклогексилкарбоксамидо)этил, трет-бутил, 1-адамантил, винил, аллил,1-изопропилаллил, циннамил, 4-нитроциннамил, 8-хинолил, N-гидроксипиперидинил, алкилдитио, бензил, п-метоксибензил, п-нитробензил, п-бромбензил, п-хлорбензил, 2,4-дихлорбензил, 4-метилсульфинилбензил, 9-антрилметил и дифенилметил. Вспомогательное отщепление Примеры вспомогательного отщепления включают 2-метилтиоэтил, 2-метилсульфонилэтил, 2-(птолуолсульфонил)этил,[2-(1,3-дитианил)]метил,4-метилтиофенил,2,4-диметилтиофенил,2 фосфониоэтил, 2-трифенилфосфониоизопропил, 1,1-диметил-2-цианоэтил, м-хлор-п-ацилоксибензил, п(дигидроксиборил)бензил, 5-бензизооксазолилметил и 2-(трифторметил)-6-хромонилметил. Фотолитическое отщепление Примеры фотолитического отщепления включают м-нитрофенил, 3,5-диметоксибензил, онитробензил, 3,4-диметокси-6-нитробензил и фенил-(о-нитрофенил)метил. Производные типа мочевины Примеры производных типа мочевины включают фенотиазинил-(10)-карбонилпроизводное, N'-птолуолсульфониламинокарбонилпроизводное и N'-фениламинотиокарбонилпроизводное. Разнообразные карбаматы Примеры разнообразных карбаматов включают трет-амил, S-бензилтиокарбамат, п-цианобензил,циклобутил, циклогексил, циклопентил, циклопропилметил, п-децилоксибензил, диизопропилметил, 2,2 диметоксикарбонилвинил, о-(N,N-диметилкарбоксамидо)бензил, 1,1-диметил-3-(N,N-диметилкарбоксамидо)пропил, 1,1-диметилпропинил, ди-(2-пиридил)метил, 2-фуранилметил, 2-йодэтил, изоборнил, изобутил, изоникотинил, п-(п'-метоксифенилазо)бензил, 1-метилциклобутил, 1-метилциклогексил, 1-метил 1-циклопропилметил, 1-метил-1-(3,5-диметоксифенил)этил, 1-метил-1-(п-фенилазофенил)этил, 1-метил 1-фенилэтил, 1-метил-1-(4-пиридил)этил, фенил, п-(фенилазо)бензил, 2,4,6-три-трет-бутилфенил, 4(триметиламмоний)бензил и 2,4,6-триметилбензил. Примеры амидов включают: АмидыN-Фталимид, N-дитиасукциноил, N-2,3-дифенилмалеоил, N-2,5-диметилпирролил, аддукт N-1,1,4,4 тетраметилдисилилазациклопентана, 5-замещенный 1,3-диметил-1,3,5-триазациклогексан-2-он, 5 замещенный 1,3-дибензил-1,3,5-триазациклогексан-2-он и 1-замещенный 3,5-динитро-4-пиридонил. СПЕЦИАЛЬНЫЕ -NH-ЗАЩИТНЫЕ ГРУППЫ Примеры специальных NH-защитных групп включают- 13012241 ЗАЩИТА ДЛЯ КАРБОКСИЛЬНОЙ ГРУППЫ Сложные эфиры Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, трихлорацетат, трифторацетат, метоксиацетат, феноксиацетат, п-хлорфеноксиацетат, бензоат. Замещенные метиловые сложные эфиры Примеры замещенных метиловых сложных эфиров включают 9-флуоренилметил, метоксиметил,метилтиометил, тетрагидропиранил, тетрагидрофуранил, метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, бензилоксиметил, фенацил, п-бромфенацил, -метилфенацил, п-метоксифенацил, карбоксамидометил и N-фталимидометил. 2-замещенные этиловые сложные эфиры Примеры 2-замещенных этиловых сложных эфиров включают 2,2,2-трихлорэтил, 2-галогенэтил, хлоралкил, 2-(триметилсилил)этил, 2-метилтиоэтил, 1,3-дитианил-2-метил, 2-(п-нитрофенилсульфенил) этил, 2-(п-толуолсульфонил)этил, 2-(2'-пиридил)этил, 2-(дифенилфосфино)этил, 1-метил-1-фенилэтил,трет-бутил, циклопентил, циклогексил, аллил, 3-бутен-1-ил, 4-(триметилсилил)-2-бутен-1-ил, циннамил,-метилциннамил, фенил, п-(метилмеркапто)фенил и бензил. Замещенные бензиловые сложные эфиры Примеры замещенных бензиловых сложных эфиров включают трифенилметил, дифенилметил, бис(о-нитрофенил)метил, 9-антрилметил, 2-(9,10-диоксо)антрилметил, 5-дибензосуберил, 1-пиренилметил,2-(трифторметил)-6-хромилметил, 2,4,6-триметилбензил, п-бромбензил, о-нитробензил, п-нитробензил,п-метоксибензил, 2,6-диметоксибензил, 4-(метилсульфинил)бензил, 4-сульфобензил, пиперонил, 4 пиколил и п-Р-бензил. Силиловые сложные эфиры Примеры силиловых сложных эфиров включают триметилсилил, триэтилсилил, третбутилдиметилсилил, изопропилдиметилсилил, фенилдиметилсилил и ди-трет-бутилметилсилил. Активированные сложные эфиры Примеры активированных сложных эфиров включают тиолы. Различные производные Примеры различных производных включают оксазолы, 2-алкил-1,3-оксазслины, 4-алкил-5-оксо-1,3 оксазолидины, 5-алкил-4-оксо-1,3-диоксоланы, ортоэфиры, фенильную группу и комплекс пентааминокобальт(III). Станниловые сложные эфиры Примеры станниловых сложных эфиров включают триэтилстаннил и три-н-бутилстаннил. С. Синтез Изобретение относится к способам получения описанных соединений традиционными органическими синтетическими способами, а также матричными или комбинаториальными синтетическими способами. На схемах 1-3 описаны предложенные синтетические пути. С применением этих схем, приведенных ниже руководств и примеров специалист в данной области может разработать аналогичные или сходные способы для данного соединения, которые находятся в объеме изобретения. Эти способы являются характерными для предпочтительных синтетических схем, но не должны истолковываться как ограничивающие объем изобретения. Специалисту в данной области должно быть известно, что синтез соединений настоящего изобретения можно проводить с применением купленных промежуточных или защищенных промежуточных соединений, описанных в любой из описанных в описании схем. Специалисту в данной области должно быть далее известно, что во время проведения любого из способов получения соединений в настоящем изобретении может быть необходимо и/или желательно защитить восприимчивые или реакционноспособные группы на любых из рассматриваемых молекул. Этого можно достичь при помощи общепринятых защитных групп, таких как защитные группы, описанные в "Protective Groups in Organic Synthesis",John WileySons, 1991. Эти защитные группы могут быть удалены на подходящей стадии с применением методов, известных в данной области. Когда способы получения соединений в соответствии с изобретением дают смесь стереоизомеров,эти изомеры можно разделить общепринятыми методиками, такими как препаративная хроматография. Соединения могут быть получены в рацемической форме или индивидуальные энантиомеры могут быть получены либо энантиоспецифическим синтезом, либо разделением. Соединения могут быть разделены на их компоненты - энантиомеры, например, стандартными методиками, такими как образование диастереомерной пары образованием соли. Соединения могут быть также разделены образованием диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хирального вспомогательного вещества. В альтернативном варианте соединения могут быть разделены ВЭЖХ с применением хиральной колонки. Примеры описанных синтетических путей включают примеры 1-9. Соединения, аналогичные целевым соединениям этих примеров, могут быть получены в соответствии со сходными путями. Описанные соединения являются применимыми в основном исследовании и в качестве фармацевтическихагентов,- 14012241 как описано в следующем разделе. Общее руководство Предпочтительный синтез соединений формулы (I) демонстрируется на схемах 1-9. Аббревиатуры или акронимы, пригодные в описании, включают AcOH (ледяная уксусная кислота);(триэтиламин); TFA (трифторуксусная кислота); ТГФ (тетрагидрофуран); TMEDA (N,N',N',N'-тетраметилэтилендиамин). Схема 1. Синтез промежуточного продукта 1-D В соответствии со схемой 1 фенол 1-А (многие из которых являются коммерчески доступными, такие как 3-метилфенол, 2-этилфенол, 2-пропилфенол, 2,3-диметилфенол, 2-хлорфенол, 2,3-дихлорфенол,2-бромфенол и 2-аминофенол), алкилируют с образованием этилового эфира феноксиуксусной кислоты 1-В подходящим эфиром галогенуксусной кислоты, таким как этиловый эфир бромуксусной кислоты, в присутствии подходящего основания, такого как Cs2CO3, K2CO3 или NaH, в подходящем растворителе,таком как CH3CN или ТГФ. Сульфирование этилового эфира феноксиуксусной кислоты 1-В подходящим сульфирующим агентом, таким как хлорсульфоновая кислота, происходит селективно в пара-положении с образованием этилового эфира 4-хлорсульфонилфеноксиуксусной кислоты 1-С. Превращение сульфонилхлорида 1-С в бензолтиол 1-D выполняют с применением металла в качестве восстанавливающего агента, такого как олово или цинк, в кислотной среде, такой как этанол или диоксан. Схема 2. Синтез соединения Ia На схеме 2 R5-замещенный диэтилмалонат 2-А восстанавливают в пропан-1,3-диол 2 В с применением подходящего восстанавливающего агента, такого как литийалюминийгидрид или диизобутилалюминийгидрид. Реакция Мицунобу 2-В с фенолом 2-С дает соединение 2-D при применении триарилфосфина, такого как трифенилфосфин, и азодикарбонильного реагента, такого как диизопропилазодикарбоксилат, в подходящем растворителе, таком как ТГФ. Этиловый эфир феноксиуксусной кислоты 2-Е получают в две стадии: (1) превращение спирта 2-D в мезилат в стандартных условиях с применением метансульфонилхлорида и триэтиламина в подходящем растворителе, таком как CH2Cl2, и (2) алкилирование бензолтиола 1-D, полученного по указанной выше схеме 1, мезилатным промежуточным продуктом с применением подходящего основания, такого как Cs2CO3, K2CO3 или NaH, в подходящем растворителе,таком как CH3CN или ТГФ, в атмосфере азота. В стандартных условиях омыления этиловый эфир феноксиуксусной кислоты 2-Е превращают в кислоту Ia в атмосфере азота. Предпочтительные условия гидролиза включают применение NaOH в качестве основания в системе водного спиртового растворителя, такой как вода-метанол, или применение LiOH в качестве основания в более слабой системе растворителей На схеме 3 энантиомерно чистую фенилуксусную кислоту 3-А (многие из которых являются коммерчески доступными, такие как (S)-(+)-2-фенилпропионовая кислота, (R)-(-)-2-фенилпропионовая кислота, (S)-(+)-2-фенилмасляная кислота, (R)-(-)-2-фенилмасляная кислота, (+)-3-метил-2-фенилмасляная кислота, (S)-(+)-2-фенилянтарная кислота и (R)-(-)-2-фенилянтарная кислота), восстанавливают в спирт с применением борана и спирт затем защищают в виде ацетата 3-В в стандартных условиях, известных в данной области. Окисление фенильной группы в 3-В в кислоту 3-С выполняют с применением каталитического количества хлорида рения и большого избытка периодата натрия в смешанной системе растворителей, такой как CH3CN-CCl4-H2O. Кислоту 3-С превращают в спирт 3-Е в четыре стадии: (1) метилирование кислоты 3-С с применением (триметилсилил)диазометана в качестве метилирующего агента, (2) и (3) замена гидроксилзащитной группы ацетата в 3-С на трет-бутилдиметилсилилокси в 3-Е в общепринятых условиях, хорошо известных в данной области, и (4) восстановление метилового сложного эфира с применением подходящего восстанавливающего агента, такого как диизобутилалюминийгидрид. Этиловый эфир феноксиуксусной кислоты 3-F получают в две стадии: (1) превращение спирта 3-Е в мезилат в стандартных условиях с применением метансульфонилхлорида и триэтиламина в подходящем растворителе, таком как CH2Cl2, и (2) алкилирование бензолтиола 1-D, полученного по указанной выше схеме 1, мезилатным промежуточным продуктом с применением подходящего основания, такого Cs2CO3,K2CO3 или NaH, в подходящем растворителе, таком как CH3CN или ТГФ, в атмосфере азота. После освобождения гидроксильной группы удалением трет-бутилдиметилсилилоксигруппы в 3-F спирт 3-G превращают в 3-Н взаимодействием с фенолом 2-С в условиях Мицунобу. Предпочтительные условия включают применение триарилфосфина, такого как трифенилфосфин, и азодикарбонильного реагента,такого как диизопропилазодикарбоксилат, в подходящем растворителе, таком как ТГФ. В стандартных условиях омыления этиловый эфир феноксиуксусной кислоты 3-Н превращают в кислоту Ia1 в атмосфере азота. Предпочтительные условия гидролиза включают применение NaOH в качестве основания в системе водного спиртового растворителя, такой как вода-метанол, или применение LiOH в качестве основания в более слабой системе растворителей вода-ТГФ. По схеме 4 бензолтиол 1-D димеризуют в фенилдисульфид 4-А в присутствии подходящего окисляющего агента, такого как манганат бария. Реакция Мицунобу 2-гидроксиметилпропан-1,3-диола 4-В с фенолом 2-С дает соединение 4 при применении триарилфосфина, такого как трифенилфосфин, и азодикарбонильного реагента, такого как диизопропилазодикарбоксилат, в подходящем растворителе, таком как ТГФ. Образование связи углеродсера в соединении 4-D проводят реакцией Мицунобу диола 4-С с фенилдисульфидом 4-А с применением три-н-бутилфосфина и пиридина. Третья реакция Мицунобу 4-D с цианогидрином ацетона превращает спирт 4-D в цианосоединение 4-Е в стандартных условиях реакции Мицунобу. Как обычно, основный гидролиз этилового эфира феноксиуксусной кислоты 4-Е дает кислоту Ia2. Схема 5. Синтез соединения Ia3 Как показано на схеме 5, где R представляет собой алкил или арил, алкиловый простой эфир, соединение 5-А, может быть получен алкилированием спирта 4-D, промежуточного продукта, полученного, как показано выше на схеме 4, различными алкилирующими агентами, такими как алкилтрифторметансульфонаты или алкилгалогениды, в присутствии подходящего основания, такого как гидрид натрия или бис(триметилсилил)амид натрия. Аналогично этому ариловый простой эфир может быть синтезирован реакцией Мицунобу 4-D со многими различными доступными замещенными фенолами. Наконец,омыление этилового сложного эфира, 5-А, в стандартных условиях дает кислоту Ia3. В соответствии со схемой 6 реакция Мицунобу (R)-(+)-глицидного спирта или (S)-(-)-глицидного спирта или рацемического глицидного спирта 6-А с фенолом 2-С дает эпоксид 6-В при применении триарилфосфина, такого как трифенилфосфин, и азодикарбонильного реагента, такого как диизопропилазодикарбоксилат, в подходящем растворителе, таком как ТГФ. Размыкание эпоксидного цикла 6-В бензолтиолом 1-D в присутствии каталитического количества фторида тетрабутиламмония дает спирт 6-С. Алкиловый простой эфир, соединение 6-D, может быть получено алкилированием спирта 6-С различными алкилирующими агентами, такими как алкилтрифторметансульфонаты или алкилгалогениды, в присутствии подходящего основания, такого как гидрид натрия или бис(триметилсилил)амид натрия в подходящем растворителе, таком как ТГФ или ДМФА. Аналогично этому ариловый простой эфир 6-D может быть синтезирован реакцией Мицунобу 6-С со многими различными доступными замещенными фенолами с применением трифенилфосфина и подходящего азодикарбонильного реагента, такого как 1,1'(азодикарбонил)дипиперидин или диэтилазодикарбоксилат. Наконец, омыление этилового сложного эфира 6-D в стандартных условиях дает кислоту Ia4. Схема 7. Синтез промежуточного продукта 7-E В соответствии со схемой 7 (4-гидроксифенил)уксусные кислоты 7-А, многие из которых являются коммерчески доступными (такие как 3-бром-4-гидроксифенилуксусная кислота, 3-хлор-4 гидроксифенилуксусная кислота,3-фтор-4-гидроксифенилуксусная кислота,4-гидрокси-3 метоксифенилуксусная кислота и 4-гидрокси-3-нитрофенилуксусная кислота), метилируют с образованием метилового эфира (4-гидроксифенил)уксусной кислоты 7-В в метаноле в присутствии каталитического количества подходящей кислоты, такой как серная кислота или хлористо-водородная кислота. Фенол 7-В превращают в метиловый эфир (4-диметилтиокарбамоилоксифенил)уксусной кислоты, 7-С,взаимодействием диметилтиокарбамоилхлорида в присутствии некоторых подходящих оснований, таких как триэтиламин и 4-(диметиламино)пиридин. При высокой температуре в предпочтительном диапазоне от 250 до 300C 7-С перегруппировывается в метиловый эфир (4-диметилкарбамоилсульфанилфенил)уксусной кислоты 7-D в растворителе с высокой точкой кипения, таком как тетрадекан. Обработкой подходящим основанием, таким как метоксид натрия 7-D превращается в метиловый эфир (4 меркаптофенил)уксусной кислоты 7-E. В соответствии со схемой 8, где R представляет собой алкил, эпоксид 8-В получают обработкой фенола 2-С подходящим основанием, таким как карбонат цезия, с последующим алкилированием 2 хлорметилоксираном 8-А. Размыкание эпоксидного цикла 8-В бензолтиолом 7-Е, полученным как показано выше на схеме 7, в присутствии каталитического количества фторида тетрабутиламмония дает спирт 8-С. Алкиловый простой эфир, соединение 8-D, может быть получено алкилированием спирта 8-С различными алкилирующими агентами, такими как алкилтрифторметансульфонаты или алкилгалогениды, в присутствии подходящего основания, такого как гидрид натрия или бис(триметилсилил)амид натрия, в подходящем растворителе, таком как ТГФ или ДМФА. Наконец, омыление метилового сложного эфира 8-D в стандартных условиях дает кислоту Ib1. Схема 9. Синтез соединения Ic1 По схеме 9, где R имеет значения, указанные выше, альдегид 9-В может быть получен в две стадии метилированием кислоты 9-А с применением (триметилсилил)диазометана в качестве метилирующего агента с последующим восстановлением промежуточного продукта, метилового сложного эфира, подходящим восстанавливающим агентом, таким как диизобутилалюминийгидрид. Альдегид 9-В превращают в эпоксид 9-С взаимодействием с метилидом диметилсульфония, который генерируют in situ обработкой иодида триметилсульфония сильным основанием, таким как анион ДМСО. Размыкание эпоксидного цикла 9-С бензолтиолом 1-D в присутствии каталитического количества фторида тетрабутиламмония дает спирт 9-D. Алкиловый простой эфир, соединение 9-Е, может быть получено алкилированием спирта 9-D различными алкилирующими агентами, такими как алкилтрифторметансульфонаты или алкилгалогениды, в присутствии подходящего основания, такого как гидрид натрия или бис(триметилсилил)амид натрия, в подходящем растворителе, таком как ТГФ или ДМФА. Наконец, омыление этилового сложного эфира, 9-Е в стандартных условиях дает кислоту Ic1. Примеры Пример А В соответствии со схемой A1 в колбу, содержащую хлорсульфоновую кислоту (15,0 мл, 226 ммоль),при 4 С медленно добавляют этил-(2-метилфенокси)ацетат A1a (10,0 г, 51,6 ммоль). Смесь перемешивают при 4C в течение 30 мин и при комнатной температуре в течение 2 ч и затем выливают в ледяную воду. Осажденное белое твердое вещество отфильтровывают, промывают водой и сушат в вакууме на протяжении ночи, получая при этом 14,0 г (93%) A1b в виде белого твердого вещества; 1H ЯМР (300 МГц, CDCl3)7,87-7,84 (м, 2H), 6,80 (д, J=9,5 Гц, 1H), 4,76 (с, 2H), 4,29 (кв, J=7,1 Гц, 2H), 2,37 (с, 3H),1,31 (т, J=7,1 Гц, 3H); MC (ES) m/z: 315 (M+Na+). К раствору A1b (4,70 г, 16,1 ммоль) в EtOH (20 мл) добавляют 4,0M раствор HCl в диоксане (20 мл) с последующим добавлением порциями порошка олова 100 меш (9,80 г, 82,6 ммоль). Смесь кипятят с обратным холодильником в течение 2 ч, выливают в смесь CH2Cl2/лед (100 мл) и фильтруют. Фильтрат отделяют и водный слой экстрагируют CH2Cl2. Объединенные органические фазы промывают водой,сушат и концентрируют, получая при этом 3,56 г (98%) A1c в виде желтого масла; 1H ЯМР (300 МГц,CDCl3)7,14-7,03 (м, 2H), 6,59 (д, J=8,4 Гц, 1H), 4,60 (с, 2H), 4,25 (кв, J=7,l Гц, 2H), 2,24 (с, 3H), 1,29 (т,J=7,1 Гц, 3H). Схема А 2 В соответствии со схемой А 2 к суспензии литийалюминийгидрида (152 мг, 4,00 ммоль) в ТГФ (3 мл) при 0C добавляют по каплям диэтилметилмалонат А 2 а (348 мг, 2,00 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 ч, гасят водой (0,2 мл) и 5 н NaOH (0,2 мл) и дополнительно разбавляют водой (0,6 мл). После перемешивания в течение 20 мин осажденное твердое вещество отфильтровывают через целит и промывают МеОН/CH2Cl2. Фильтрат сушат, концентрируют и очищают колоночной хроматографией, получая при этом 135 мг (75%) A2b; 1H ЯМР (300 МГц, CDCl3)3,68 (дд, 10,7, 4,5 Гц, 2H), 3,58 (дд, J=10,7, 7,6 Гц, 2H), 3,50 (с, 2H), 1,96-1,89 (м, 1H), 0,86 (д, J=7,0 Гц,3H); MC (ES) m/z: 113 (M+Na+). К смеси А 2b (113 мг, 1,26 ммоль) трифторметилфенола (156 мг, 0,963 ммоль) и трифенилфосфина- 20012241 ммоль). Смесь перемешивают при комнатной температуре на протяжении ночи и концентрируют. Остаток очищают колоночной хроматографией, получая при этом 149 мг (51%) А 2 с; 1H ЯМР (400 МГц,CDCl3)7,53 (д, J=8,8 Гц, 2H), 6,96 (д, J=8,7 Гц, 2H), 3,98 (м, 2H), 3,71 (м, 2H), 2,24-2,16 (м, 1H), 1,80 (с,1H), 1,05 (д, J=7,0 Гц, 3H); MC (ES) m/z: 235 (М+Н+). Общая методика 1 для получения простого тиоэфира К раствору А 2 с (135 мг, 0,577 ммоль) в CH2Cl2 (3 мл) при 0C добавляют Et3N (0,162 мл, 1,16 ммоль) и метансульфонилхлорид (93 мг, 0,81 ммоль). Смесь перемешивают при 0C в течение 30 мин и при комнатной температуре в течение 1 ч и разбавляют насыщенным NaHCO3. Органический слой отделяют и водный слой экстрагируют CH2Cl2 (3). Объединенные органические фазы сушат и концентрируют, получая при этом мезилат. Смесь упомянутого выше мезилата, этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты A1c (197 мг, 0,872 ммоль) и Cs2CO3 (472 мг, 1,45 ммоль) в CH3CN (5 мл) перемешивают при комнатной температуре в течение 3 ч. Добавляют воду и смесь экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/10), получая при этом 187 мг (73%, две стадии) A2d; 1H ЯМР (300 МГц, CDCl3)7,51 (д, J=8,6 Гц, 2H), 7,20 (д, J=1,7 Гц,1H), 7,15 (дд, J=8,4, 2,2 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H), 6,57 (д, J=8,4 Гц, 1H), 4,57 (с, 2H), 4,25 (кв, J=7,1 Гц, 2H), 3,94 (дд, J=5,7, 2,7 Гц, 2H), 3,04 (дд, J=13,6, 6,6 Гц, 1H), 2,86 (дд, J=13,3, 6,5 Гц, 1H), 2,24-2,16 (м,1H), 2,23 (с, 3H), 1,29 (т, J=7,1 Гц, 3H), 1,14 (д, J=6,8 Гц, 3H); MC (ES) m/z: 465 (M+Na+). Общая методика 2 для гидролиза этиловых и метиловых сложных эфиров К раствору A2d (130 мг, 0,294 ммоль) в ТГФ (2 мл) в атмосфере N2 добавляют 1,0 М LiOH (0,58 мл,0,58 ммоль). Смесь перемешивают в течение 2 ч, подкисляют 1M HCl и экстрагируют EtOAc (3). Экстракты сушат, концентрируют и очищают колоночной хроматографией (CH2Cl2/MeOH: 10/1), получая при этом 109 мг (90%) соединения 1; 1H ЯМР (400 МГц, CDCl3)7,50 (д, J=8,7 Гц, 2H), 7,18 (с, 1H), 7,14- 21012241 К раствору (S)-(+)-2-фенилмасляной кислоты Bl (352 мг, 2,14 ммоль) в ТГФ (3 мл) при 0C медленно добавляют 1,0 М раствор комплекса ВН 3 ТГФ в ТГФ (2,14 мл, 2,14 ммоль). Смеси дают возможность нагреться до комнатной температуры, перемешивают при комнатной температуре на протяжении ночи,гасят водой и затем 1,0 н HCl и экстрагируют Et2O (3). Экстракты сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 283 мг (88%) В 2; 1H ЯМР (300 МГц, CDCl3)7,34-7,29 (м,2H), 7,24-7,16 (м, 3H), 3,70 (м, 2H), 2,65 (м, 1H), 1,79-1,67 (м, 1H), 1,63- 1,48 (м, 2H), 0,82 (т, J=7,4 Гц, 3H);CH2Cl2 (3 мл) при 0C добавляют ацетилхлорид (369 мг, 4,70 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч, разбавляют 1,0 н HCl и экстрагируют CH2Cl2. Объединенные органические фазы промывают 1,0 н HCl (3) и насыщенным раствором соли, сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 34 3 мг (95%) В 3; 1H ЯМР (300 МГц, CDCl3)7,337,28 (м, 2H), 7,25-7,17 (м, 3H), 4,21 (м, 2H), 2,86-2,77 (м, 1H), 1,98 (с, 3H), 1,86-1,73 (м, 1H), 1,68-1,53 (м,1H), 0,82 (т, J=7,4 Гц, 3H); MC (ES) m/z: 215 (M+Na+). К раствору В 3 (160 мг, 0,833 ммоль) в смеси растворителей CCl4 (2 мл), CH3CN (2 мл) и воды (3 мл) добавляют NaIO4 (3,55 г, 16,6 ммоль) и RuCl3 (12 мг, 0,058 ммоль). После перемешивания при комнатной температуре на протяжении ночи смесь распределяют между водой и CH2Cl2. Объединенные органические слои сушат, фильтруют и концентрируют. Остаток снова растворяют в Et2O и фильтруют через целит. Фильтрат сушат и подвергают колоночной хроматографии (CH2Cl2/MeOH: 9/1), получая при этом 97 мг (73%) В 4; 1H ЯМР (300 МГц, CDCl3)4,24 (д, J=6,7 Гц, 2H), 2,67 (м, 1H), 2,06 (с, 3H), 1,77-1,56 (м,2H), 1,00 (т, J=7,5 Гц, 3H); MC (ES) m/z: 183 (M+Na+). К раствору В 4 (218 мг, 1,36 ммоль) в Et2O (4 мл) и MeOH (2 мл) медленно добавляют 2,0MTMSCHN2 (2,08 мл, 4,16 ммоль) в Et2O. После перемешивания при комнатной температуре в течение 3 ч растворители удаляют при пониженном давлении, получая при этом метиловый сложный эфир. К растворенному в MeOH (2 мл) остатку добавляют K2CO3 (188 мг, 1,36 ммоль) и образовавшуюся смесь перемешивают в течение 20 мин. После удаления растворителя при низкой температуре остаток распределяют между Et2O и водой. Органический слой сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/2), получая при этом 176 мг (98%) В 5; 1H ЯМР (300 МГц, CDCl3)3,82-3,73 (м,2H), 3,73 (с, 3H), 2,53 (м, 1H), 2,41 (ушир.с, 1H), 1,73-1,55 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); MC (ES) m/z: 155(290 мг, 4,26 ммоль) в ДМФ (1,7 мл) перемешивают в течение 14 ч и распределяют между водой и Et2O. Органический слой сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 385 мг (92%) В 6; 1H ЯМР (400 МГц, CDCl3)3,77 (дд, J=9,7, 7,8 Гц, 1H), 3,70-3,66 (м, 1H), 3,68 (с, 3H),2,52 (м, 1H), 1,64-1,51 (м, 2H), 0,91 (т, J=7,5 Гц, 3H), 0,87 (с, 9H), 0,03 (с, 6H); MC (ES) m/z: 269 (M+Na+). К раствору В 6 (350 мг, 1,42 ммоль) в CH2Cl2 (5 мл) при -78 С по каплям добавляют 1,0 М DIBAL-H(3,55 мл, 3,55 ммоль). После перемешивания при -78C в течение 15 мин смеси дают возможность медленно нагреться до 0C, перемешивают при такой же температуре в течение 10 мин, гасят MeOH. После перемешивания при комнатной температуре в течение 1 ч осажденное твердое вещество фильтруют через целит и промывают смесью CH2Cl2/MeOH. Фильтрат сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 273 мг (88%) В 7; 1H ЯМР (300 МГц, CDCl3)3,82 (дд, J=9,9, 4,0 Гц, 1H), 3,75 (дд, J=11,0, 3,3 Гц, 1H), 3,67-3,58 (м, 2H), 2,78 (ушир.с, 1H), 1,68-1,61 (м, 1H), 1,33-1,23 (м,2H), 0,93 (т, J=7,4 Гц, 3H), 0,90 (с, 9H), 0,08 (с, 6H); MC (ES) m/z: 219 (М+Н+). В 8 (61%) получают по общей методике 1 в примере A; 1H ЯМР (300 МГц, CDCl3)7,19 (д, J=1,8 Гц,1H), 7,15 (дд, J=8,4, 2,2 Гц, 1H), 6,62 (д, J=8,4 Гц, 1H), 4,60 (с, 2H), 4,26 (кв, J=7,1 Гц, 2H), 3,67 (дд, J=10,0,4,7 Гц, 1H), 3,57 (дд, J=10,0, 5,5 Гц, 1H), 2,97 (дд, J=12,9, 6,8 Гц, 1H), 2,79 (дд, J=12,9, 6,0 Гц, 1H), 2,26 (с,3H), 1,62-1,56 (м, 1H), 1,44 (м, 2H), 1,29 (т, J=7,1 Гц, 3H), 0,88 (т, J=7,4 Гц, 3H), 0,88 (с, 9H), 0,03 (с, 6H);MC (ES) m/z: 449 (M+Na+). Раствор В 8 (213 мг, 0,500 ммоль) в CH2Cl2 (2 мл) обрабатывают 1,0 М раствором фторида тетрабутиламмония (1,50 мл, 1,50 ммоль) в ТГФ в течение 3 ч и распределяют между водой и CH2Cl2. Органический слой сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 33 мг(150 мг, 0,573 ммоль) в ТГФ (3 мл) при 0C добавляют диизопропилазодикарбоксилат (115 мг, 0,569 ммоль). Смесь перемешивают при комнатной температуре на протяжении ночи и концентрируют. Остаток дважды очищают колоночной хроматографией (EtOAc/гексан: 1/10; CH2Cl2/гексан: 2/1), получая при этом 121 мг (69%) B10; 1H ЯМР (300 МГц, CDCl3)7,51 (д, J=8,7 Гц, 2H), 7,19 (д, J=1,8 Гц, 1H), 7,15 (дд,J=8,4, 2,3 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H), 6,56 (д, J=8,4 Гц, 1H), 4,56 (с, 2H), 4,25 (кв, J=7,1 Гц, 2H), 4,01 (м,- 22012241 2H), 3,00 (д, J=6,4 Гц, 2H), 2,21 (с, 3H), 1,96 (м, 1H), 1,59 (м, 2H), 1,28 (т, J=7,1 Гц, 3H), 0,94 (т, J=7,4 Гц,3H); MC (ES) m/z: 479 (M+Na+). Соединение 2 (88%) получают по общей методике 2 в примере A; 1H ЯМР (400 МГц, CDCl3)7,49 К суспензии литийалюминийгидрида (101 мг, 2,66 ммоль) в ТГФ (3 мл) при 0C по каплям добавляют диэтилэтилмалонат C1 (250 мг, 1,33 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, гасят водой (0,1 мл) и 5 н NaOH (0,2 мл), разбавляют водой (0,6 мл), фильтруют через целит и твердое вещество промывают смесью MeOH/CH2Cl2. Фильтрат сушат, концентрируют и очищают колоночной хроматографией, получая при этом 110 мг (80%) С 2. 1H ЯМР (300 МГц, CDCl3)3,79 (дд, J=10, 7, 3,9 Гц, 2H), 3,64 (дд, J=10,7, 7,5 Гц, 2H), 3,27 (с, 2H), 1,67 (м, 1H), 1,29 (м, 2H), 0,94 (т,J=7,5 Гц, 3H); MC (ES) m/z: 127 (M+Na+). К смеси С 2 (108 мг, 1,04 ммоль), трифторметилфенола (130 мг, 0,802 ммоль) и трифенилфосфина(210 мг, 0,802 ммоль) в ТГФ (3 мл) при 0C добавляют диизопропилазодикарбоксилат (162 мг, 0,802 ммоль). Смесь перемешивают при комнатной температуре на протяжении ночи, разбавляют водой и экстрагируют Et2O (3). Экстракты сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 134 мг (52%) С 3; 1H ЯМР (400 МГц, CDCl3)7,54 (д, J=8,8 Гц, 2H), 6,97 (д, J=8,8 Гц, 2H),4,05 (м, 2H), 3,80 (дд, J=10,8, 4,4 Гц, 1H), 3,74 (дд, J=10,8, 6,5 Гц, 1H), 1,94 (м, 1H), 1,50 (м, 2H), 1,00 (т,J=7,5 Гц, 3H); MC (ES) m/z: 249 (M+Na+). С 4 (81%) получают по общей методике 1 в примере A; 1H ЯМР (300 МГц, CDCl3)7,50 (д, J=8,6 Гц,2H), 7,19 (д, J=1,8 Гц, 1H), 7,15 (дд, J=8,4, 2,2 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H), 6,56 (д, J=8,4 Гц, 1H), 4,56 (с,2H), 4,25 (кв, J=7,1 Гц, 2H), 4,01 (м, 2H), 3,00 (д, J=6,4 Гц, 2H), 2,21 (с, 3H), 1,96 (м, 1H), 1,59 (м, 2H), 1,28C23H27F3O4S: С, 60,51; H, 5,96. Найдено: С, 60,69; H, 5,56. Соединение 3 (92%) получают по общей методике 2 в примере A; 1H ЯМР (300 МГц, MeOH-d4)7,53 (д, J=8,6 Гц, 2H), 7,18 (с, 1H), 7,15 (м, 1H), 6,96 (д, J=8,6 Гц, 2H), 6,66 (д, J=8,1 Гц, 1H), 4,55 (с, 2H),4,04 (м, 2H), 3,00 (д, J=6,3 Гц, 2H), 2,16 (с, 3H), 1,92 (м, 1H), 1,58 (м, 2H), 0,94 (т, J=7,5 Гц, 3H); MC (ES) Заменой этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты A1 c 4-меркаптофенолом и по общей методике 1 в примере А получают D1 (28%); 1H ЯМР (300 МГц, CDCl3)7,51 (д, J=8,6 Гц,2H), 7,28 (д, J=8,7 Гц, 2H), 6,91 (д, J=8,6 Гц, 2H), 6,72 (д, J=8,7 Гц, 2H), 4,84 (с, 1H), 4,02 (дд, J=5,2, 3,8 Гц,2H), 2,99 (д, J=6,0 Гц, 2H), 1,95 (м, 1H), 1,59 (м, 2H), 0,94 (т, J=7,5 Гц, 3H); MC (ES) m/z: 357 (М+Н+). Смесь D1 (86 мг, 0,24 ммоль), метилового эфира бромуксусной кислоты (55 мг, 0,36 ммоль) и(EtOAc/гексан: 1/6), получая при этом 99 мг (96%) метилового сложного эфира. По общей методике 2 вышеупомянутый метиловый эфир превращают в кислоту, соединение 4 (89%); 1H ЯМР (300 МГц,CDCl3)8,91 (ушир.с, 1H), 7,49 (д, J=8,7 Гц, 2H), 7,26 (д, J=8,3 Гц, 2H), 6,88 (д, J=8,6 Гц, 2H), 6,74 (д,J=8,5 Гц, 2H), 4,46 (с, 2H), 3,98 (м, 2H), 3,01-2,92 (м, 2H), 1,93 (м, 1H), 1,56 (м, 2H), 0,92 (т, J=7,4 Гц, 3H); К раствору 1,0M диизобутилалюминийгидрида (50 мл, 50 ммоль) в CH2Cl2 при -78C добавляют диэтилпропилмалонат E1 (2,02 г, 10,0 ммоль). Реакционной смеси дают возможность постепенно нагреться до 0C, перемешивают при 0C в течение 30 мин и гасят MeOH. Осажденное твердое вещество отфильтровывают через целит и промывают смесью МеОН/СН 2 Сl2. Фильтрат концентрируют и очищают колоночной хроматографией (EtOAc), получая при этом 709 мг (60%) Е 2; 1H ЯМР (300 МГц, CDCl3)3,80(дд, J=10,7, 3,8 Гц, 2H), 3,63 (дд, J=10,7, 7,7 Гц, 2H), 2,82 (с, 2H), 1,84-1,71 (м, 1H), 1,42-1,28 (м, 2H), 1,241,17 (м, 2H), 0,91 (т, J=7,2 Гц, 3H); MC (ES) m/z: 141 (M+Na+). К раствору Е 2 (300 мг, 2,54 ммоль) в CH2Cl2 (5 мл) при 0C добавляют Et3N (1,06 мл, 7,62 ммоль) и метансульфонилхлорид (729 мг, 6,36 ммоль). Смесь перемешивают при 0C в течение 2 ч и разбавляют насыщенным NaHCO3. Органический слой отделяют и водный слой экстрагируют CH2Cl2 (3). Объединенные органические фазы сушат, концентрируют и подвергают колоночной хроматографии(EtOA/гексан: 1/1), получая при этом 655 мг (94%) Е 3; 1H ЯМР (300 МГц, CDCl3)4,29 (дд, J=10,0, 4,3(ES) m/z: 297 (M+Na+). К суспензии NaH (80 мг, 2,0 ммоль, 60% в минеральном масле) в ТГФ (2 мл) добавляют раствор 4 трифторметилфенола (324 мг, 2,0 ммоль) в ТГФ (2 мл). После перемешивания при комнатной температуре в течение 30 мин добавляют раствор Е 3 (659 мг, 2,40 ммоль) в ТГФ (3 мл) и образовавшуюся смесь кипятят с обратным холодильником в течение 6 ч. Добавляют воду и смесь экстрагируют Et2O. Экстракты сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/4), получая при этом 170 мг (25%) Е 4; 1H ЯМР (300 МГц, CDCl3)7,54 (д, J=8,6 Гц, 2H), 6,96 (д, J=8,6 Гц, 2H), 4,37 (дд,J=9,9, 4,9 Гц, 1H), 4,32 (дд, J=9,9, 6,0 Гц, 1H), 4,04 (дд, J=9,4, 4,6 Гц, 1H), 3,98 (дд, J=9,3, 6,4 Гц, 1H), 2,97(с, 3H), 2,25 (м, 1H), 1,53-1,39 (м, 4H), 0,96 (т, J=7,0 Гц, 3H); MC (ES) m/z: 363 (M+Na+). Общая методика 3 для получения простого тиоэфира К раствору Е 4 (165 мг, 0,485 ммоль) в CH3CN (5 мл) добавляют Cs2CO3 (391 мг, 1,20 ммоль) с последующим добавлением раствора этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты A1c(163 мг, 0,721 ммоль) в CH3CN (3 мл). После перемешивания в течение 5 ч при комнатной температуре добавляют воду и смесь экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/10), получая при этом 158 мг (70%) Е 5; 1H ЯМР(т, J=7,1 Гц, 3H), 0,91 (т, J=7,2 Гц, 3H); MC (ES) m/z: 493 (M+Na+). Анал. вычислено для C24H29F3O4S: C,61,26; H, 6,21. Найдено: С, 61,49; H, 6,35. По общей методике 2 в примере А получают соединение 5 (94%); 1H ЯМР (400 МГц, CDCl3)7,50 К суспензии литийалюминийгидрида (114 мг, 3,00 ммоль) в ТГФ (3 мл) при 0C по каплям добав- 25012241 ляют диэтиловый эфир 2-пентилмалоновой кислоты F1 (346 мг, 1,50 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, гасят водой (0,1 мл) и 5 н NaOH (0,2 мл) при 0C и разбавляют водой (0,6 мл). Осажденное твердое вещество фильтруют через целит и промывают смесьюMeOH/CH2Cl2. Фильтрат сушат, концентрируют и очищают колоночной хроматографией (EtOAc/гексан: 1/1), получая при этом 181 мг (82%) F2; 1H ЯМР (300 МГц, CDCl3)3,79 (дд, J=10,7, 3,8 Гц, 2H), 3,62 (дд,J=10,7, 7,7 Гц, 2H), 3,16 (с, 2H), 1,75 (м, 1H), 1,34-1,18 (м, 8H), 0,88 (т, J=6,8 Гц, 3H); MC (ES) m/z: 169(472 мг, 1,80 ммоль) в ТГФ (3 мл) при 0C добавляют диизопропилазодикарбоксилат (195 мг, 1,80 ммоль). Смесь перемешивают при 0C в течение 30 мин и затем при комнатной температуре в течение 6 ч, разбавляют водой и экстрагируют Et2O. Экстракты сушат, концентрируют и очищают колоночной хроматографией, получая при этом 108 мг (31%) F3; 1H ЯМР (300 МГц, CDCl3)7,53 (д, J=8,6 Гц, 2H),6,96 (д, J=8,6 Гц, 2H), 4,03 (м, 2H), 3,75 (м, 2H), 2,04-1,95 (м, 1H), 1,44-1,36 (м, 4H), 1,31-1,25 (м, 4H), 0,89(т, J=6,8 Гц, 3H); MC (ES) m/z: 313 (M+Na+). По общей процедуре 1 в примере А получают F4 (78%); 1H ЯМР (300 МГц, CDCl3)7,50 (д, J=8,6 Гц, 2H), 7,19 (д, J=1,7 Гц, 1H), 7,14 (дд, J=8,4, 2,2 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H), 6,55 (д, J=8,4 Гц, 1H),4,56 (с, 2H), 4,25 (кв, J=7,1 Гц, 2H), 4,00 (м, 2H), 3,01 (д, J=6,8 Гц, 2H), 2,21 (с, 3H), 2,03 (м, 1H), 1,56-1,49(м, 2H), 1,37-1,22 (м, 6H), 1,28 (т, J=7,1 Гц, 3H), 0,87 (т, J=6,8 Гц, 3H); MC (ES) m/z: 521 (M+Na+). По общей процедуре 2 в примере А получают соединение 6 (91%); 1H ЯМР (300 МГц, CDCl3)9,23 К смеси 4-трифторметилфенола (1,00 г, 6,17 ммоль) и Et3N (871 мг, 8,63 ммоль) в CH2Cl2 (20 мл) при 4 С добавляют феноксиацетилхлорид (1,37 г, 7,42 ммоль). После перемешивания в течение 2 ч при комнатной температуре белое твердое вещество отфильтровывают и промывают Et2O. Фильтрат промывают водой, сушат, концентрируют и очищают колоночной хроматографией, получая при этом 1,79 г(94%) G1 в виде белого твердого вещества; 1H ЯМР (300 МГц, CDCl3)7,66 (д, J=8,7 Гц, 2H), 7,43-7,33(м, 5H), 7,25 (д, J=8,4 Гц, 2H), 4,73 (с, 2H), 4,37 (с, 2H). К раствору G1 (1,20 г, 3,87 ммоль) в ТГФ (20 мл) при -78 С вводят 0,5 М раствор реагента Теббе (9,3 мл, 4,7 ммоль) в толуоле. Смесь перемешивают при температуре от -78C до 2C в течение 2 ч и гасят прикапыванием воды. Образованное твердое вещество отфильтровывают и промывают Et2O. Фильтратконцентрируют и очищают колоночной хроматографией, получая при этом 890 мг (75%) G2 в виде прозрачного масла; 1H ЯМР (300 МГц, CDCl3)7,60 (д, J=8,5 Гц, 2H), 7,36-7,29 (м, 5H), 7,16 (д, J=8,6 Гц,2H), 4,70 (д, J=2,1 Гц, 1H), 4,63 (с, 2H), 4,39 (д, J=2,1 Гц, 1H), 4,12 (с, 2H).- 26012241 Смесь G2 (870 мг, 2,82 ммоль) и 10% Pd/C (100 мг) в EtOH (10 мл) и ТГФ (5 мл) дегазируют и три раза заполняют Н 2. После гидрирования при давлении 1 атм на протяжении ночи смесь фильтруют через целит. Фильтрат концентрируют и подвергают колоночной хроматографии, получая при этом 563 мг(91%) G3 в виде прозрачного масла; 1H ЯМР (300 МГц, CDCl3)7,54 (д, J=8,6 Гц, 2H), 7,99 (д, J=8,6 Гц,2H), 4,57 (м, 1H), 3,76 (м, 2H), 1,93 (т, J=6,3 Гц, 1H), 1,30 (д, J=6,2 Гц, 3H); MC (ES) m/z: 243 (M+Na+). По общей методике 1 в примере А получают G4 (11%, прозрачное масло); 1H ЯМР (400 МГц,CDCl3)7,47 (д, J=8,9 Гц, 2H), 7,24 (с, 1H), 7,21 (дд, J=8,5, 2,1 Гц, 1H), 6,76 (д, J=8,9 Гц, 2H), 6,63 (д,J=8,5 Гц, 1H), 4,64 (с, 2H), 4,46 (дд, J=12,0, 6,1 Гц, 1H), 4,27 (кв, J=7,1 Гц, 2H), 3,16 (дд, J=13,8, 5,3 Гц,1H), 2,90 (дд, J=13,8, 6,9 Гц, 1H), 2,26 (с, 3H), 1,43 (д, J=5,9 Гц, 3H), 1,30 (т, J=7,1 Гц, 3H); MC (ES) m/z: 451 (M+Na+). По общей методике 2 в примере А получают соединение 7 (62%, твердое вещество); 1H ЯМР (300 МГц, МеОН-d4)7,50 (д, J=8,6 Гц, 2H), 7,21 (м, 2H), 6,83 (д, J=8,7 Гц, 2H), 6,75 (д, J=7,4 Гц, 1H), 4,62 (с,2H), 4,54 (дд, J=11,8, 6,0 Гц, 1H), 3,12 (дд, J=13,9, 5,6 Гц, 1H), 2,96 (дд, J=14,0, 6,2 Гц, 1H), 2,21 (с, 3H),1,41 (д, J=6,2 Гц, 3H); MC (ES) m/z: 423 (M+Na+); FAB-HRMC (M+). Вычислено 400,0956, найдено 400,0944. Пример Н Смесь метилового эфира (3-хлор-4-меркаптофенил)уксусной кислоты H1 (758 мг, 3,48 ммоль; Sahoo, S.P., Preparation of arylthiazolidinediones as agonists of peroxisome proliferator activated receptor, WO 99/32465), 2-(4-трифторметилфеноксиметил)пентилового эфира метансульфоновой кислоты Н 2 (880 мг,2,70 ммоль) и Cs2CO3 (2,64 г, 8,10 ммоль) в CH3CN (8 мл) перемешивают в течение 2 ч, разбавляют водой и экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/7), получая при этом 205 мг (17%) Н 3; 1H ЯМР (400 МГц, CDCl3)7,51 (д, J=8,7 Гц, 2H), 7,29 (с, 1H), 7,27 (с, 1H), 7,08 (дд, J=8,l, 1,7 Гц, 1H), 6,93 (д, J=8,6 Гц, 2H), 4,09 (дд,J=9,3, 4,7 Гц, 1H), 4,00 (дд, J=9,3, 5,8 Гц, 1H), 3,69 (с, 3H), 3,53 (с, 2H), 3,14 (дд, J=13,0, 7,0 Гц, 1H), 3,06(дд, J=13,0, 5,7 Гц, 1H), 2,06 (м, 1H), 1,69-1,61 (м, 2H), 0,99 (т, J=7,4 Гц, 3H). По общей методике 2 в примере А получают соединение 9 (90%); 1H ЯМР (300 МГц, CDCl3)7,51 Смесь этилового эфира (4-меркапто-2-метилфенокси)уксусной кислоты A1c (453 мг, 2,00 ммоль) и манганата бария (513 мг, 2,00 ммоль) в CH2Cl2 (5 мл) перемешивают при комнатной температуре в течение 20 мин, фильтруют через силикагель и промывают смесью EtOAc/гексан (1/3). Фильтрат концентрируют, получая при этом 802 мг (89%) I1; 1H ЯМР (400 МГц, CDCl3)7,27 (с, 1H), 7,23 (дд, J=8,4, 2,3 Гц,1H), 6,61 (д, J=8,5 Гц, 1H), 4,62 (с, 2H), 4,26 (кв, J=7,1 Гц, 2H), 2,25 (с, 3H), 1,29 (т, J=7,1 Гц, 3H); MC (ES)m/z: 473 (M+Na+). К смеси 2-гидроксиметилпропан-1,3-диола (500 мг, 4,71 ммоль) в ДМФА (1,5 мл) и ТГФ (3 мл) добавляют трифторметилфенол (822 мг, 5,07 ммоль) и трифенилфосфин (1,02 г, 3,90 ммоль). После охлаждения смеси до 0C в нее вводят диизопропилазодикарбоксилат (789 мг, 3,91 ммоль). Смеси предоставляют возможность нагреться до комнатной температуры, перемешивают на протяжении ночи, концентрируют и подвергают колоночной хроматографии, получая при этом 200 мг (17%) I2; 1H ЯМР (300 МГц,CDCl3)7,50 (д, J=8,7 Гц, 2H), 6,93 (д, J=8,6 Гц, 2H), 4,05 (д, J=6,1 Гц, 2H), 3,90-3,80 (м, 4H), 3,42(ушир.с, 2H), 2,20 (м, 1H); MC (ES) m/z: 273 (M+Na+). К смеси I1 (97 мг, 0,22 ммоль) и I2 (81 мг, 0,32 ммоль) в пиридине (0,2 мл) добавляют трибутилфосфин (44 мг, 0,22 ммоль). Смесь перемешивают на протяжении ночи, разбавляют 1 н HCl и экстрагируют Et2O. Экстракты сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 2/5), получая при этом 54 мг (55%) I3; 1H ЯМР (400 МГц, CDCl3)7,52 (д, J=8,9 Гц, 2H), 7,22 (д, J=2,2 Гц, 1H), 7,18 (дд, J=8,4, 2,3 Гц, 1H), 6,92 (д, J=8,8 Гц, 2H), 6,59 (д, J=8,4 Гц, 1H), 4,59 (с, 2H), 4,26 (кв,J=7,1 Гц, 2H), 4,16-4,09 (м, 2H), 3,86 (д, J=5,3 Гц, 2H), 3,04 (д, J=6,8 Гц, 2H), 2,26-2,20 (м, 1H), 2,23 (с, 3H),1,29 (т, J=7,1 Гц, 3H); MC (ES) m/z: 481 (M+Na+). К смеси I3 (114 мг, 0,249 ммоль) и трифенилфосфина (98 мг, 0,37 ммоль) в ТГФ (2 мл) при 0C добавляют диизопропилазодикарбоксилат (75 мг, 0,37 ммоль) и цианогидрин ацетона (32 мг, 0,38 ммоль). Смесь перемешивают при комнатной температуре на протяжении ночи, концентрируют и подвергают колоночной хроматографии на колонке, получая при этом 57 мг (49%) I4; 1H ЯМР (400 МГц, CDCl3)7,54 (д, J=8,7 Гц, 2H), 7,23 (с, 1H), 7,20 (дд, J=8,4, 2,2 Гц, 1H), 6,91 (д, J=8,7 Гц, 2H), 6,60 (д, J=8,4 Гц, 1H),4,60 (с, 2H), 4,26 (кв, J=7,1 Гц, 2H), 4,13 (дд, J=9,5, 4,6 Гц, 1H), 4,08 (дд, J=9,5, 6,0 Гц, 1H), 3,08 (дд,J=14,0, 6,9 Гц, 1H), 3,00 (дд, J=13,9, 7,0 Гц, 1H), 2,73 (дд, J=6,3, 1,8 Гц, 2H), 2,37 (м, 1H), 2,25 (с, 3H), 1,30(т, J=7,1 Гц, 3H); MC (ES) m/z: 490 (M+Na+). Анал. вычислено для C23H24F3NO4S: С, 59,09; H, 5,17; N,3,00. Найдено: С, 59,11; H, 5,12; N, 2,93. По общей процедуре 2 в примере А получают соединение 10 (73%); 1H ЯМР (300 МГц, CD3OD)7,55 (д, J=8,6 Гц, 2H), 7,23 (м, 2H), 7,00 (д, J=8,6 Гц, 2H), 6,71 (д, J=8,2 Гц, 1H), 4,55 (с, 2H), 4,12 (д, J=5,2 Гц, 2H), 3,11 (дд, J =14,0, 7,0 Гц, 1H), 3,01 (дд, J=14,0, 6,7 Гц, 1H), 2,78 (д, J=6,3 Гц, 2H), 2,33 (м, 1H), 2,18 К смеси 2-(2,2-диэтоксиэтил)-1,3-пропандиола J1 (500 мг, 2,60 ммоль), трифторметилфенола (357 мг, 2,20 ммоль) и трифенилфосфина (525 мг, 2,00 ммоль) в ТГФ (5 мл) при 0C добавляют диизопропилазодикарбоксилат (384 мг, 1,90 ммоль). Смеси предоставляют возможность нагреться до комнатной температуры, перемешивают на протяжении ночи, разбавляют водой и экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии (EtOAc/гексан: 1/4),получая при этом 436 мг (53%) J2; 1H ЯМР (300 МГц, CDCl3)7,53 (д, J=8,7 Гц, 2H), 6,94 (дд, J=8,8, 2,2 Гц, 2H), 5,18 (м, 1H), 4,15-4,03 (м, 2H), 3,92-3,88 (м, 1H), 3,85-3,78 (м, 1H), 3,77-3,67 (м, 2H), 3,49-3,43 (м,1H), 2,95-2,86 (м, 1H), 2,28-2,18 (м, 1H), 2,15-2,07 (м, 1H), 1,88-1,79 (м, 1H), 1,23 (т, J=7,0 Гц, 6H); MC(ES) m/z: 359 (M+Na+). По общей методике 1 в примере А получают J3 (56%); 1H ЯМР (400 МГц, CDCl3)7,50 (д, J=8,8 Гц,2H), 7,19 (д, J=2,1 Гц, 1H), 7,15 (дд, J=8,4, 2,3 Гц, 1H), 6,88 (д, J=8,7 Гц, 2H), 6,54 (д, J=8,4 Гц, 1H), 4,59 (т,J=5,7 Гц, 1H), 4,56 (с, 2H), 4,25 (кв, J=7,1 Гц, 2H), 4,11 (дд, J=9,3, 4,6 Гц, 1H), 4,00 (дд, J=9,3, 5,6 Гц, 1H),3,65-3,58 (м, 2H), 3,48-3,43 (м, 2H), 3,06-3,04 (м, 2H), 2,26-2,20 (м, 1H), 2,20 (с, 3H), 1,88 (м, 2H), 1,29 (т,J=7,1 Гц, 3H), 1,16 (т, J=7,0 Гц, 3H), 1,15 (т, J=7,0 Гц, 3H); MC (ES) m/z: 567 (M+Na+). Анал. вычислено для C27H35F3O6S: С, 59,54; H, 6,48. Найдено: С, 59,75; H, 6,45. Смесь J3 (130 мг, 0,239 ммоль) в трифторуксусной кислоте (1,5 мл), воды (1,5 мл) и CHCl3 (6 мл) перемешивают при комнатной температуре в течение 3 ч, разбавляют водой и экстрагируют CHCl3. Органические фазы сушат, концентрируют и подвергают колоночной хроматографии (CH2Cl2), получая при этом 105 мг (93%) J4; 1H ЯМР (300 МГц, CDCl3)9,78 (с, 1H), 7,51 (д, J=8,6 Гц, 2H), 7,21 (д, J=1,7 Гц,1H), 7,16 (дд, J=8,4, 2,2 Гц, 1H), 6,88 (д, J=8,6 Гц, 2H), 6,58 (д, J=8,4 Гц, 1H), 4,58 (с, 2H), 4,25 (кв, J=7,1 Гц, 2H), 4,04 (д, J=4,9 Гц, 2H), 3,07 (дд, J=13,7, 6,6 Гц, 1H), 2,97 (дд, J=13,7, 6,1 Гц, 1H), 2,77-2,64 (м, 3H),2,23 (с, 3H), 1,29 (т, J=7,1 Гц, 3H); MC (ES) m/z: 493 (M+Na+).- 29012241 К раствору J4 (100 мг, 0,213 ммоль) в EtOH (1,2 мл) при 0C добавляют NaBH4 (48 мг, 1,3 ммоль). После перемешивания в течение 15 мин при такой же температуре смесь разбавляют Et2O, подкисляют 1 н HCl и экстрагируют Et2O. Объединенные органические слои сушат, концентрируют и подвергают колоночной хроматографии, получая при этом 93 мг (93%) J5; 1H ЯМР (300 МГц, CDCl3)7,51 (д, J=8,6 Гц,2H), 7,20 (д, J=1,8 Гц, 1H), 7,15 (дд, J=8,4, 2,2 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H), 6,56 (д, J=8,4 Гц, 1H), 4,57 (с,2H), 4,25 (кв, J=7,1 Гц, 2H), 4,05 (м, 2H), 3,73 (т, J=6,4 Гц, 2H), 3,03 (м, 2H), 2,29-2,21 (м, 1H), 2,21 (с, 3H),1,82 (кв, J=6,5 Гц, 2H), 1,29 (т, J=7,1 Гц, 3H); MC (ES) m/z: 495 (M+Na+). Анал. вычислено дляC23H27F3O5S: С, 58,46; H, 5,76. Найдено: С, 58,39; H, 5,53. С заменой I3 на J5 и по такой же методике, как при получении I4 в примере I, получают J6 (65%); 1H, 5,31; N, 2,93. По общей методике 2 в примере А получают соединение 11 (94%); 1H ЯМР (300 МГц, CDCl3)7,52CH2Cl2 (1 мл) кипятят с обратным холодильником на протяжении ночи, концентрируют и очищают колоночной хроматографией (EtOAc/гексан: 1/9), получая при этом смесь K1 и K2. K1: 1H ЯМР (300 МГц,CDCl3)7,54 (д, J=8,6 Гц, 2H), 7,20 (д, J=1,7 Гц, 1H), 7,16 (дд, J=8,4, 2,2 Гц, 1H), 6,89 (д, J=8,6 Гц, 2H),- 30
МПК / Метки
МПК: C07C 323/62, A61K 31/192, A61P 3/10, C07C 323/20, A61K 31/381, A61K 31/277, C07D 333/28, A61P 3/06
Метки: аналоги, 4-((феноксиалкил)тио)феноксиуксусные, кислоты
Код ссылки
<a href="https://eas.patents.su/30-12241-4-fenoksialkiltiofenoksiuksusnye-kisloty-i-ih-analogi.html" rel="bookmark" title="База патентов Евразийского Союза">4-((феноксиалкил)тио)феноксиуксусные кислоты и их аналоги</a>
Предыдущий патент: Пролекарства ингибиторов киназы pi – 3
Следующий патент: Обработка скважин
Случайный патент: Компактная ректификационная установка для разделения смешанных текучих сред и ректификационный способ разделения таких смешанных текучих сред












