Замещённые пирролопиразольные производные в качестве ингибиторов киназы
Номер патента: 10596
Опубликовано: 30.10.2008
Авторы: Певарелло Паоло, Браска Мария Габриелла, Амичи Раффаэлла, Нези Марчелла, Руссель Патрик, Орзини Паоло, Фанчелли Даниеле, Вульпетти Анна, Орци Фабрицио
Формула / Реферат
1. Способ лечения заболеваний, связанных с пролиферацией клеток, которые вызваны и/или связаны с измененной киназной активностью, зависящей от клеточного цикла, путем введения нуждающемуся в лечении млекопитающему эффективного количества соединения, представленного формулами (Ia) и (Ib)
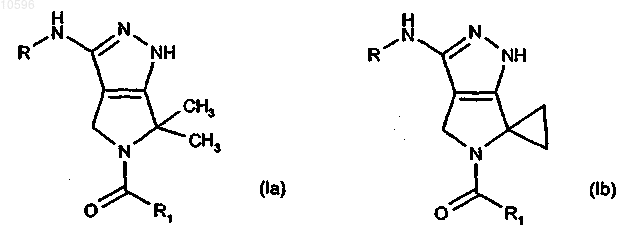
в которых R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означают водород или необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, C6-C12арильной, C7-C12арилалкильной, C3-C5гетероциклильной или С5гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;
R1 выбирают из группы, включающей:
a) C3-C4алкильную группу с прямой или разветвленной цепью;
b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4алкильную группу с прямой или разветвленной цепью;
c) 3-метилтиенил-2-ильную, 2-тиенильную, фенильную, 2,6-дифторфенильную, 4-(аминосульфонил)фенильную, 4-(диметиламинометил)фенильную, 4-(4-метилпиперазинил)метилфенильную группу;
d) группу формул (IIa) и (IIb)
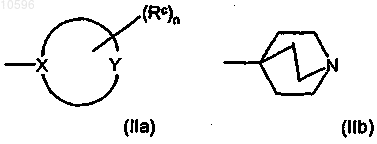
где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота, кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода;
группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, С6арильной, С7арилалкильной, C4-C5гетероциклильной, С6гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы или оксогруппы (=O);
n равно 0 или целому числу от 1 до 4;
е) группу формул (IIc) и (IId)

где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга означают атом водорода или C1-C6алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной (-CONH2) или метиламинокарбонильной (-CONHCH3) группы;
при условии, что в формуле (Ia), когда R1 означает группу формулы (IIc) и один из заместителей Rd или R'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, где Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную, 4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу;
а также при условии, что исключены соединения, в которых R1 означает C4-C6циклоалкил и Ra означает водород;
или его фармацевтически приемлемой соли.
2. Способ по п.1, где заболевание, связанное с пролиферацией клеток, выбирают из группы, включающей рак, болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные расстройства.
3. Способ по п.2, где рак выбирают из группы, включающей карциному, карциному сквамозных клеток, гемопоэтические опухоли миелоидной или лимфоидной клеточной линии, опухоли мезенхимного происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментную, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши.
4. Способ по п.1, где заболевание, связанное с пролиферацией клеток, выбирают из группы, включающей доброкачественную гиперплазию предстательной железы, семейный аденоматозный полипоз, неврофиброматоз, псориаз, пролиферацию гладких клеток сосудов, связанную с атеросклерозом, легочным фиброзом, артритом, гломерулонефритом и послехирургическим стенозом и рестенозом.
5. Способ по п.1, который обеспечивает подавление ангиогенеза и метастаза опухолей.
6. Способ по п.1, который обеспечивает терапию при отторжении органов при трансплантации и лечение болезни "хозяин против трансплантата".
7. Способ по п.1, который обеспечивает лечение и предупреждение облысения, вызванного радиотерапией или химиотерапией.
8. Способ по п.1, который включает также назначение нуждающемуся в лечении млекопитающему радиотерапевтических и химиотерапевтических схем лечения в сочетании по крайней мере с одним цитостатическим или цитотоксическим средством.
9. Способ по п.1, где нуждающимся в лечении млекопитающим является человек.
10. Способ ингибирования активности циклинзависимой киназы, который включает контактирование указанной киназы с эффективным количеством соединения по п.1.
11. Соединение, представленное формулами (Ia) и (Ib)
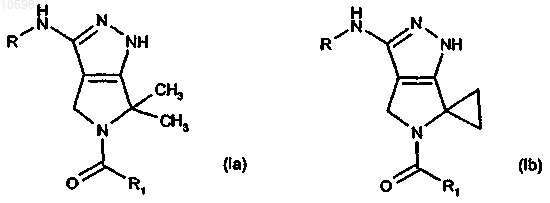
в которых R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, C6-C12арильной, C7-C12арилалкильной, C3-C5гетероциклильной или С5гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;
R1 выбирают из группы, включающей:
a) C3-C4алкильную группу с прямой или разветвленной цепью;
b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4алкильную группу с прямой или разветвленной цепью;
c) 3-метилтиенил-2-ильную, 2-тиенильную, фенильную, 2,6-дифторфенильную, 4-(аминосульфонил)фенильную, 4-(диметиламинометил)фенильную, 4-(4-метилпиперазинил)метилфенильную группу;
d) группу формул (IIa) и (IIb)
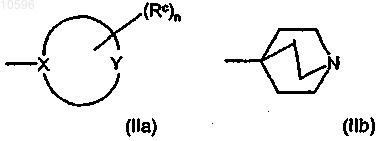
где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота, кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода;
группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, С6арильной, С7арилалкильной, С4-С5гетероциклильной, С6гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы или оксогруппы (=O);
n равно 0 или целому числу от 1 до 4;
е) группу формул (IIc) и (IId)
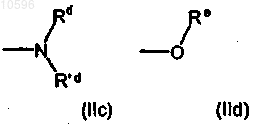
где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга означают атом водорода или C1-C6алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной (-CONH2) или метиламинокарбонильной (-CONHCH3) группы;
при условии, что в формуле (Ia), когда R1 означает группу формулы (IIc) и один из заместителей Rd или R'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, где Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную, 4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу;
а также при условии, что исключены соединения, в которых R1 означает C4-C6циклоалкил и Ra означает водород;
или его фармацевтически приемлемая соль.
12. Соединение формулы (Ia) или (Ib) по п.11, где R означает группу -CORa, где значения Ra определены в п.11, и R1 означает трет-бутильную группу.
13. Соединение формулы (Ia) или (Ib) по п.11, где R означает группу -CONHRa, где значения Ra определены в п.11, и R1 означает трет-бутильную группу.
14. Соединение формулы (Ia) или (Ib) по п.11, где R означает группу -CONRaRb, где значения Ra и Rb определены в п.11, и R1 означает трет-бутильную группу.
15. Соединение формулы (Ia) или (Ib) по п.11, где значения R определены в п.11, и R1 означает группу формулы (IIa), выбранную из
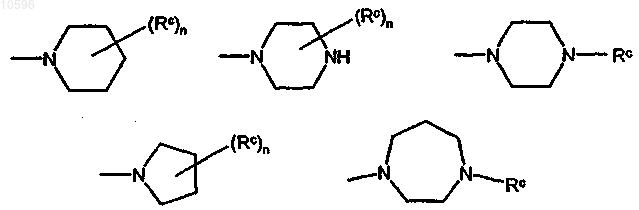
где значения n и Rc определены в п.11.
16. Соединение формулы (Ia) или (Ib) по п.11, где значения R определены в п.11 и R1 означает группу формулы (IIa), выбранную из
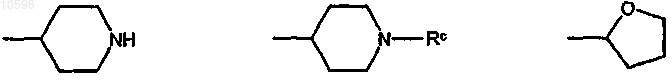
где значения Rc определены в п.11.
17. Соединение формулы (Ia) по п.11, где R означает группу -CORa, где Ra означает 4-фторфенильную или циклобутильную группу, и значения R1 определены в п.11.
18. Соединение формулы (Ia) по п.11, где значения R определены в п.11 и R1 означает группу, которую выбирают из трет-бутильной, 1-метилпиперидил-4-ильной, 1-метилпиперазинил-4-ильной, 2-(R,S)-тетрагидрофуранил-2-ильной, 2-(R)-тетрагидрофуранил-2-ильной или 2-(S)-тетрагидрофуранил-2-ильной группы.
19. Соединение формулы (Ia) или (Ib) по п.11, где любые из групп Ra, Rb и Rc, значения которых определены в п.11, необязательно дополнительно замещены, по одному или нескольким из своих свободных положений, группами, независимо выбранными из галогена, нитрогруппы, оксогрупп (=O), цианогруппы, алкильной, полифторалкильной, полифторалкокси, алкенильной, алкинильной, гидроксиалкильной, арильной, арилалкильной, гетероциклильной, циклоалкильной, гидрокси, алкоксигруппы, арилоксигруппы, гетероциклилоксигруппы, метилендиоксигруппы, алкилкарбонилоксигруппы, арилкарбонилоксигруппы, циклоалкенилоксигруппы, алкилиденаминооксигруппы, карбокси, алкоксикарбонильной, арилоксикарбонильной, циклоалкилоксикарбонильной, аминогруппы, уреидогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, диариламиногруппы, формиламиногруппы, алкилкарбониламиногруппы, арилкарбониламиногруппы, гетероциклилкарбониламиногруппы, алкоксикарбониламиногруппы, алкоксииминогруппы, алкилсульфониламиногруппы, арилсульфониламиногруппы, формильной, алкилкарбонильной, арилкарбонильной, циклоалкилкарбонильной, гетероциклилкарбонильной, аминокарбонильной, алкиламинокарбонильной, диалкиламинокарбонильной, алкилсульфонильной, арилсульфонильной, аминосульфонильной, алкиламиносульфонильной, диалкиламиносульфонильной, арилтиогруппы и алкилтиогруппы.
20. Соединение формулы (Ia) или (Ib), необязательно в форме фармацевтически приемлемой соли, выбранное из группы, включающей
N-{6,6-диметил-5-[(1-метилпиперидин-4-ил)карбонил]-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}циклобутанкарбоксамид;
N-[5-(2,2-диметилпропаноил)-6,6-диметил-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил]-4-фторбензамид;
N-[5-(2,2-диметилпропаноил)-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-6-спироциклопропан-3-ил]-4-фторбензамид;
N-{6,6-диметил-5-[(2R)-тетрагидрофуран-2-илкарбонил]-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}-4-фторбензамид;
N-{6,6-диметил-5-[(2S)-тетрагидрофуран-2-илкарбонил]-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}-4-фторбензамид;
N-{6,6-диметил-5-[(1-метилпиперидин-4-ил)карбонил]-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}-4-фторбензамид;
N-{5-[(1-метилпиперидин-4-ил)карбонил]-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}-4-фторбензамид;
N-{6,6-диметил-5-[(4-метилпиперазин-1-ил)карбонил]-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}-4-фторбензамид;
N-{5-[(4-метилпиперазин-1-ил)карбонил]-2,4,5,6-тетрагидропирроло[3,4-с]пиразол-6-спироциклопропан-3-ил}-4-фторбензамид;
4-хлор-N-{6,6-диметил-5-(4-пирролидин-1-илметилпиперидин-1-карбонил)-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-3-ил}бензамид.
21. Соединение формулы (Ia) или (Ib), необязательно в форме фармацевтически приемлемой соли, однозначно идентифицированное в табл. 3-6 экспериментальной части описания.
22. Соединение формулы
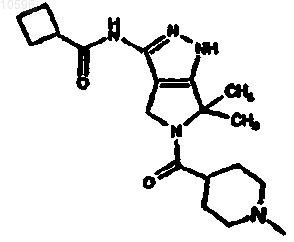
как в свободной форме, так и в форме гидрохлоридной или мезилатной соли.
23. Способ получения соединения формулы (Ia) или (Ib) по п.11 или его фармацевтически приемлемой соли, который включает:
а) взаимодействие соединения формулы (IIIa) или (IIIb)

с акрилонитрилом с образованием соответствующего производного формулы (IVa) или (IVb)
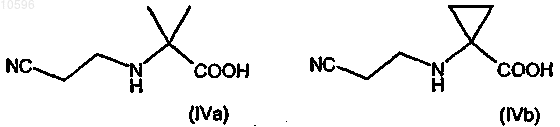
b) защиту аминогруппы соединения формулы (IVa) или (IVb) с образованием соответствующего производного формулы (Va) или (Vb)
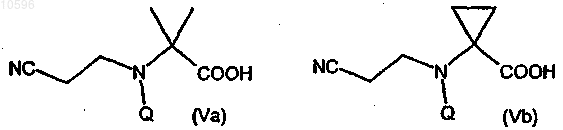
где Q означает подходящую аминозащитную группу;
с) взаимодействие соединения формулы (Va) или (Vb) с подходящим алкилирующим агентом с образованием соответствующего производного сложного эфира формулы (VIa) или (VIb)
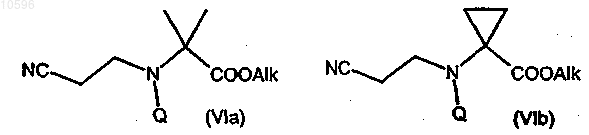
где Alk означает подходящую C1-C4алкильную группу;
d) взаимодействие соединения формулы (VIa) или (VIb) с гидридом натрия (NaH) с образованием соответствующего производного формулы (VIIa) или (VIIb)
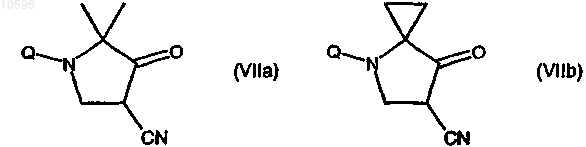
е) взаимодействие соединения формулы (VIIa) или (VIIb) с гидразингидратом с образованием соответствующего производного формулы (VIIIa) или (VIIIb)
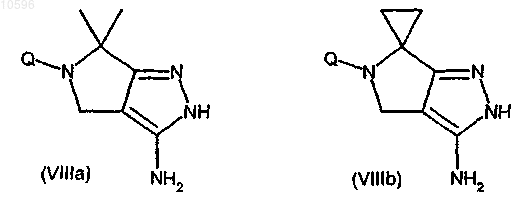
f) взаимодействие соединения формулы (VIIIa) или (VIIIb) с этилхлорформиатом с образованием соответствующего производного формулы (IXa) или (IXb), каждое из которых может быть в любой из двух региоизомерных форм
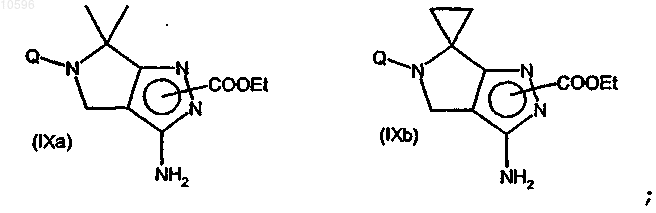
g) взаимодействие соединений формулы (IXa) или (IXb) с соединением формулы (X)
![]()
уфх значения Ra определены в п.11;
Z означает атом галогена,
с образованием соединения формулы (XIa) или (XIb)
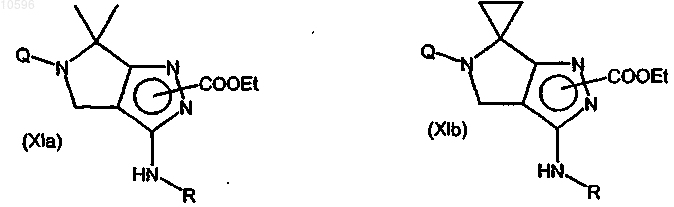
где R означает группу -CORa;
h) удаление защиты аминогруппы соединения формулы (XIa) или (XIb) с образованием соответствующего производного формулы (XIVa) или (XIVb)
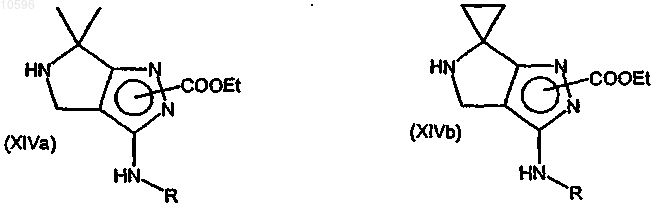
где значения R указаны выше;
i) взаимодействие соединений формулы (XIVa) или (XIVb) с производным ацилгалогенида формулы (XV)
![]()
где значения R1 определены в п.11 в группах (a), (b), (c), (IIa), где X означает атом углерода, и (IIb);
Z означает атом галогена,
с образованием соединения формулы (XVIa) или (XVIb)
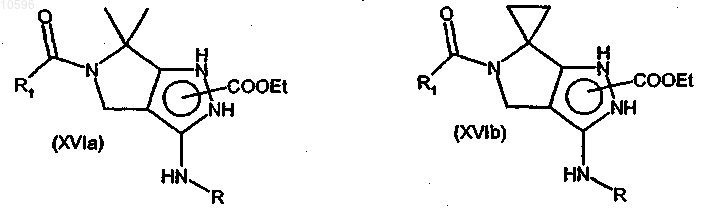
где значения R и R1 указаны выше; и
j) взаимодействие соединения формулы (XVIa) или (XVIb) в присутствии основания с образованием соответствующего производного формулы (Ia) или (Ib), где значения R и R1 определены выше; и, необязательно,
k) превращение их в другие соединения формулы (Ia) или (Ib), соответственно, и/или в их фармацевтически приемлемые соли.
24. Способ получения соединения формулы (Ia) или (Ib) по п.11 или его фармацевтически приемлемой соли, который включает:
а) взаимодействие соединения формулы (IIIa) или (IIIb)

с акрилонитрилом с образованием соответствующего производного формулы (IVa) или (IVb)
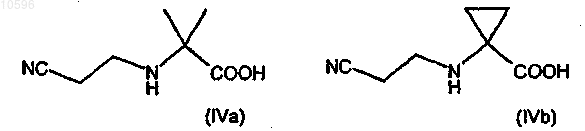
b) защиту аминогруппы соединения формулы (IVa) или (IVb) с образованием соответствующего производного формулы (Va) или (Vb)
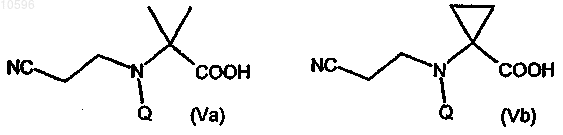
где Q означает подходящую аминозащитную группу;
с) взаимодействие соединения формулы (Va) или (Vb) с подходящим алкилирующим агентом с образованием соответствующего производного сложного эфира формулы (VIa) или (VIb)
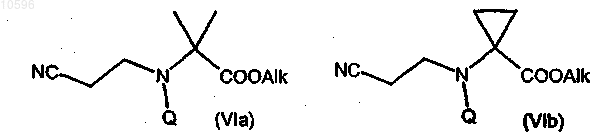
где Alk означает подходящую C1-C4алкильную группу;
d) взаимодействие соединения формулы (VIa) или (VIb) с гидридом натрия (NaH) с образованием соответствующего производного формулы (VIIa) или (VIIb)
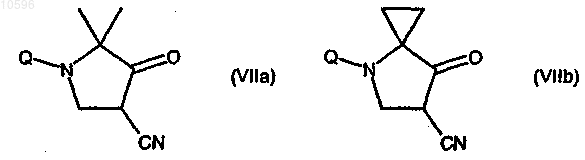
е) взаимодействие соединения формулы (VIIa) или (VIIb) с гидразингидратом с образованием соответствующего производного формулы (VIIIa) или (VIIIb)

f) взаимодействие соединения формулы (VIIIa) или (VIIIb) с этилхлорформиатом с образованием соответствующего производного формулы (IXa) или (IXb), каждое из которых может быть в любой из двух региоизомерных форм
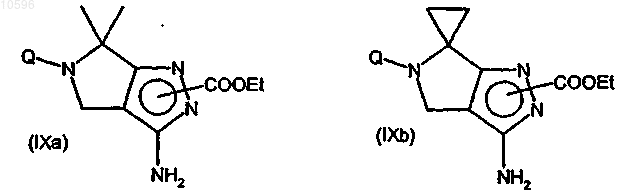
g) взаимодействие соединений формулы (IXa) или (IXb) с соединением формулы (X)
![]()
где значения Ra определены в п.11;
Z означает атом галогена,
с образованием соединения формулы (XIa) или (XIb)

где R означает группу -CORa;
h) удаление защиты аминогруппы соединения формулы (XIa) или (XIb) с образованием соответствующего производного формулы (XIVa) или (XIVb)
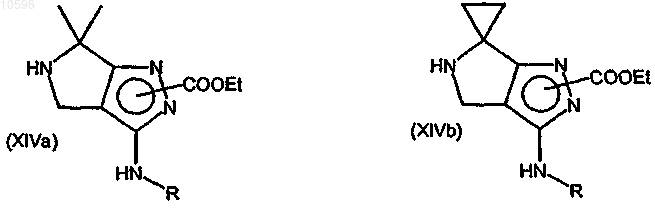
где значения R указаны выше;
i) взаимодействие соединений формулы (XIVa) или (XIVb) с карбоновой кислотой формулы (XIX) в присутствии подходящего конденсирующего агента
![]()
с образованием соединения формулы (XVIa) или (XVIb)
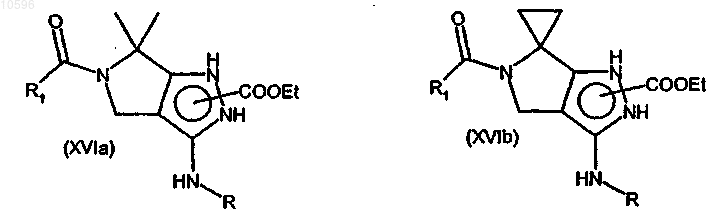
где значения R1 определены выше в формуле (Ia) или (Ib) в группах (а), (b), (с), или означает группу формулы (IIa), где X означает атом углерода, или группу формулы (IIb), и значения R, Y, Rc и n определены выше; и
j) взаимодействие соединения формулы (XVIa) или (XVIb) в присутствии основания с образованием соответствующего производного формулы (Ia) или (Ib), где значения R и R1 определены выше; и, необязательно,
k) превращение их в другие соединения формулы (Ia) или (Ib) соответственно и/или в их фармацевтически приемлемые соли.
25. Способ по п.23 или 24, где на стадии (b) Q означает трет-бутоксикарбонильную (boc) группу.
26. Способ по п.23 или 24, где на стадии (с) Alk означает метил.
27. Соединения формулы (VIIa) или (VIIb)
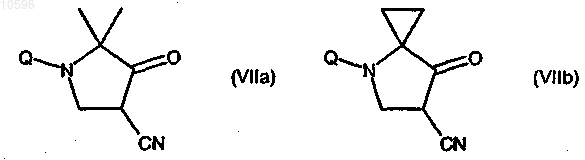
где Q означает подходящую защищающую азотгруппу, такую как трет-бутоксикарбонильная (boc) группа.
28. Библиотека, включающая два или более соединений формулы (Ia)
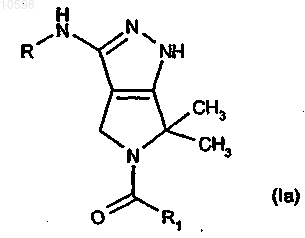
в которой R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, C6-C12арильной, C7-C12арилалкильной, C3-C5гетероциклильной или С5гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;
R1 выбирают из группы, включающей:
a) C3-C4алкильную группу с прямой или разветвленной цепью;
b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4алкильную группу с прямой или разветвленной цепью;
c) 3-метилтиенил-2-ильную, 2-тиенильную, фенильную, 2,6-дифторфенильную, 4-(аминосульфонил)фенильную, 4-(диметиламинометил)фенильную, 4-(4-метилпиперазинил)метилфенильную группу;
d) группу формул (IIa) и (IIb)
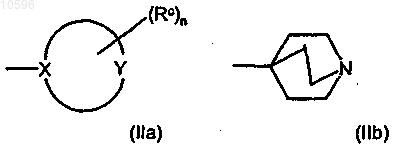
где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота, кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода;
группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, С6арильной, С7арилалкильной, C4-С5гетероциклильной, С6гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы или оксогруппы (=O); и n равно 0 или целому числу от 1 до 4;
е) группу формул (IIc) и (IId)
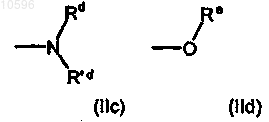
где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга, означают атом водорода или C1-C6алкильную группу с прямой или разветвленной цепью, необязательэю замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной (-CONH2) или метиламинокарбонильной (-CONHCH3) группы;
при условии, что в формуле (Ia), когда R1 означает группу формулы (IIc) и один из заместителей Rd или R'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, где Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную, 4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу;
а также при условии, что исключены соединения, в которых R1 означает C4-C6циклоалкил и Ra означает водород;
или их фармацевтически приемлемую соль.
29. Библиотека, включающая два или более соединений формулы (Ib)
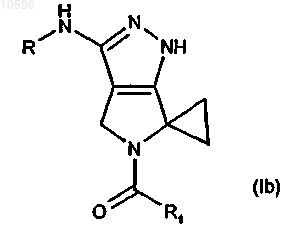
в которой R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6лкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, C6-C12арильной, C7-C12арилалкильной, C3-C5гетероциклильной или C5гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;
R1 выбирают из группы, включающей:
a) C3-C4алкильную группу с прямой или разветвленной цепью;
b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4алкильную группу с прямой или разветвленной цепью;
c) 3-метилтиенил-2-ильную, 2-тиенильную, фенильную, 2,6-дифторфенильную, 4-(аминосульфонил)фенильную, 4-(диметиламинометил)фенильную, 4-(4-метилпиперазинил)метилфенильную группу;
d) группу формул (IIa) и (IIb)
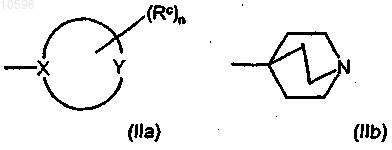
где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота, кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода;
группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6алкильной группы с прямой или разветвленной цепью, C3-C6циклоалкильной, С6арильной, С7арилалкильной, С4-С5гетероциклильной, С6гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы или оксогруппы (=O);
n равно 0 или целому числу от 1 до 4;
е) группу формул (IIc) и (IId)
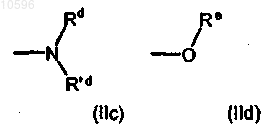
где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга, означают атом водорода или C1-C6алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной (-CONH2) или метиламинокарбонильной (-CONHCH3) группы;
при условии, что исключены соединения, в которых R1 означает C4-C6циклоалкил и Ra означает водород;
или их фармацевтически приемлемую соль.
30. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (Ia) или (Ib), которое определено в п.11, и по крайней мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
31. Фармацевтическая композиция по п.30, которая дополнительно содержит одно или несколько химиотерапевтических средств.
32. Продукт или набор, включающий соединение формулы (Ia) или (Ib), которое определено в п.11, или его фармацевтическую композицию, которая определена в п.30, и одно или несколько химиотерапевтических средств в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в противораковой терапии.
33. Применение соединения формулы (Ia) или (Ib), которое определено в п.11, в качестве лекарственного средства, обладающего противоопухолевой активностью.
34. Применение соединения формулы (Ia) или (Ib), которое определено в п.11, для изготовления лекарственного средства, обладающего противоопухолевой активностью.
Текст
010596 Предшествующий уровень техники Область техники, к которой относится изобретение Настоящее изобретение относится к пирролопиразольным производным, к способу их получения, к содержащим их фармацевтическим композициям и к их применению в качестве терапевтических средств, в частности, при лечении рака и заболеваний, связанных с пролиферацией клеток. Обсуждение предшествующего уровня техники Некоторые цитотоксические лекарства, такие как, например, фторурацил (5-FU), доксорубицин и камптотецины, повреждают ДНК или влияют на метаболический путь обмена веществ в клетках и, тем самым, во многих случаях вызывают непрямое торможение клеточного цикла. Поскольку они вызывают необратимое повреждение как нормальных, так и опухолевых клеток, то указанные агенты приводят к значительной токсичности и побочным эффектам. В связи с этим необходимы соединения, способные выполнять функции высоко специфичных противоопухолевых средств, которые могут вызывать селективное угнетение и апоптоз опухолевых клеток и при этом обладают сопоставимой эффективностью и меньшей токсичностью по сравнению с доступными в настоящее время лекарствами. Хорошо известно, что развитие клеточного цикла управляется серией контрольных точек, иначе называемых точками рестрикции, которые регулируются семейством ферментов, известных как циклинзависимые киназы (Cdk). В свою очередь, сами Cdk регулируются на многих уровнях, например, за счет связывания с циклинами. Координированная активация и инактивация различных комплексов Cdk/Cyclin необходима для нормального развития клеточного цикла. Оба критических перехода G1-S и G2-M контролируются активацией различных активностей Cdk/Cyclin. Полагают, что в G1 начало S-фазы опосредуется какCdk4/Cyclin D, так и Cdk2/Cyclin E. Дальнейшее развитие S-фазы требует активности Cdk2/Cyclin А, в то время как для начала митоза необходима активация Cdc2/Cyclin A (Cdk1) и Cdc2/Cyclin В. Общую ссылку на циклины и циклинзависимые киназы см., например, у Kevin R., в Webster et al., Exp. Opin. Invest.Drugs, 1998, vol. 7(6), 865-887. Контрольные точки в опухолевых клетках дефектны частично вследствие разрегулирования активности cdk. Например, в опухолевых клетках наблюдалась измененная экспрессия Cyclin E и различныхcdk и было показано, что делеция гена р 27 KIP ингибитора cdk у мышей приводит к более частой заболеваемости раком. Все большее подтверждение находит представление о том, что cdk являются ферментами, ограничивающими скорость развития клеточного цикла, и, таким образом, они представляют собой молекулярные цели для терапевтического воздействия. В частности, прямое ингибирование активности cdk/Cyclin киназ должно оказаться полезным при ограничении нерегулируемой пролиферации опухолевых клеток. Сущность изобретения Объектом изобретения являются соединения, которые применимы при лечении клеточных пролиферативных заболеваний, которые вызваны и/или связаны с измененной киназной активностью, зависящей от клеточного цикла. Другим объектом изобретения являются соединения, которые обладают ингибирующей активностью по отношению к cdk/Cyclin киназе. Авторы настоящего изобретения обнаружили, что некоторые пиразольные соединения обладают ингибирующей активностью по отношению к cdk/Cyclin киназе и, таким образом, применимы в терапии в качестве противоопухолевых средств, при этом у них отсутствуют, с точки зрения как токсичности, так и побочных эффектов, вышеуказанные недостатки, которые присущи имеющимся в настоящее время противоопухолевым лекарствам. В частности, пиразольные производные по настоящему изобретению применимы при лечении различных раковых заболеваний, включая, но, не ограничиваясь этим, карциному, такую как карцинома мочевого пузыря, груди, толстой кишки, почки, печени, легкого, включая мелкоклеточный рак легкого,рак пищевода, желчного пузыря, яичника, поджелудочной железы, желудка, шеи, щитовидной железы,предстательной железы и кожи, включая карциному сквамозных клеток; гемопоэтические опухоли лимфоидной клеточной линии, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластную лейкемию, лимфому B-клеток, лимфому T-клеток, лимфому Ходжкина, лимфому, отличную от лимфомы Ходжкина, лимфому ворсистых клеток и лимфому Буркета; гемопоэтические опухоли миелоидной клеточной линии, включая острые и хронические миелогенные лейкемии, миелодиспластический синдром и промиелоцитарную лейкемию; опухоли мезенхимного происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриному; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментную, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Благодаря ключевой роли, которые cdk играют в регулировании пролиферации клеток, указанные пиразольные производные полезны также при лечении различных заболеваний, вызванных пролиферацией клеток, таких как, например, доброкачественная гиперплазия предстательной железы, семейный аденоматозный полипоз, неврофиброматоз, псориаз, пролиферация гладких клеток сосудов, связанная с атеросклерозом, легочным фиброзом, артритом, гломерулонефритом и послеоперационным стенозом и-1 010596 рестенозом. Соединения по настоящему изобретению могут быть полезны при лечении болезни Альцгеймера,что подтверждается тем фактом, что cdk5 принимает участие в фосфорилировании тау-белка (J. Biochem. 117, 741-749, 1995). В качестве модуляторов апоптоза соединения по настоящему изобретению могут быть также применены при лечении рака, вирусных инфекций, для предотвращения развития синдрома приобретенного иммунодефицита (СПИД) у ВИЧ-инфицированных индивидов, при лечении аутоиммунных заболеваний и нейродегенеративных расстройств. Соединения по настоящему изобретению могут быть применены для подавления ангиогенеза и метастаза опухолей, а также для терапии при отторжении органов при трансплантации и лечения болезни хозяин против трансплантата. Соединения по настоящему изобретению могут также действовать как ингибиторы других протеинкиназ, в частности протеинкиназы C в различных изоформах, Met, PAK-4, PAK-5, ZC-1, STLK-2,DDR-2, Aurora 1, Aurora 2, Bub-1, PLK, Chk1, Chk2, HER2, raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R,IGF-R, PI3K, wee1-киназы, Src, Ab1, Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek; и, таким образом, эффективны при лечении заболеваний, связанных с другими протеинкиназами. Соединения по настоящему изобретению могут быть также применены для лечения и предупреждения облысения, вызываемого радиотерапией или химиотерапией. Таким образом, в настоящем изобретении предлагается способ лечения заболеваний, связанных с пролиферацией клеток, которые вызваны и/или связаны с измененной киназной активностью, зависящей от клеточного цикла, путем введения нуждающемуся в этом млекопитающему эффективного количества производного пиразола, представленного формулами (Ia) и (Ib) в которых R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью, C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной или гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;a) C3-C4 алкильную группу с прямой или разветвленной цепью;b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6 циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4 алкильную группу с прямой или разветвленной цепью; где в формуле (IIa) цикл означает (5-6)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота,кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода; группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью,C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной, гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы, оксогруппы (=O), алкоксикарбонильной, алкилкарбонильной или арилкарбонильной группы;n равно 0 или целому числу от 1 до 4; где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга означают атом водорода или C1-C6 алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной(-CONH2) или метиламинокарбонильной (-CONHCH3) группы; при условии, что в формуле (Ia), когда R1 означает группу формулы (IIc) и один из заместителей Rd илиR'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, где Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную,4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу; или его фармацевтически приемлемой соли. В предпочтительном варианте осуществления вышеуказанного способа заболевание, связанное с пролиферацией клеток, выбирают из рака, болезни Альцгеймера, вирусных инфекций, аутоиммунных заболеваний и нейродегенеративных расстройств. Конкретные типы рака, которые можно лечить, включают карциному, карциному сквамозных клеток, гемопоэтические опухоли миелоидной или лимфоидной клеточной линии, опухоли мезенхимного происхождения, опухоли центральной или периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментную, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. В другом предпочтительном варианте осуществления указанного выше способа заболевание, связанное с пролиферацией клеток, выбирают из группы, включающей доброкачественную гиперплазию предстательной железы, семейный аденоматозный полипоз, неврофиброматоз, псориаз, пролиферацию гладких клеток сосудов, связанную с атеросклерозом, легочным фиброзом, артритом, гломерулонефритом и послехирургическим стенозом и рестенозом. Кроме того, способ по настоящему изобретению обеспечивает подавление ангиогенеза и метастаза опухолей, а также терапию при отторжении органов при трансплантации и лечение хозяин против трансплантата. Способ по настоящему изобретению может также обеспечить подавление клеточного цикла или зависимое от cdk/Cyclin ингибирование. Помимо вышеизложенного, способ, являющийся объектом настоящего изобретения, обеспечивает лечение и предупреждение облысения, вызванного радиотерапией или химиотерапией. В настоящем изобретении предлагается также производное пиразола, представленное формулой (Ia) или (Ib) где R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью, C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной или гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;a) C3-C4 алкильную группу с прямой или разветвленной цепью;b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6 циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4 алкильную группу с прямой или разветвленной цепью; где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота,кислорода или серы или означает группу NH при условии, что по крайней мере один из X и Y отличен от атома углерода; группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью,C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной, гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы, оксогруппы (=O), алкоксикарбонильной, алкилкарбонильной или арилкарбонильной группы;n равно 0 или целому числу от 1 до 4; е) группу формулы (IIc) и (IId) где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга, означают атом водорода или C1-C6 алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной (-CONH2) или метиламинокарбонильной (-CONHCH3) группы; при условии, что в формуле (Ia), когда R1 означает группу формулы (IIc) и один из заместителей Rd или R'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, и Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную,4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу; или его фармацевтически приемлемая соль. Настоящее изобретение включает также способы синтеза производных пиразола, представленных формулами (Ia) или (Ib), которые, если не указано иное, могут быть для удобства объединены в одну группу и обозначены как соединения формулы (I). Фармацевтические композиции, содержащие производные пиразола формулы (I), также включены в настоящее изобретение. Более полное понимание настоящего изобретения и многих сопутствующих ему преимуществ можно получить после того, как изложенное станет более понятным благодаря приведенному ниже подробному описанию изобретения. Подробное описание изобретения В данной области известно несколько гетероциклических соединений, которые являются ингибиторами протеинкиназы. Например, 2-карбоксамидопиразолы и 2-уреидопиразолы и их производные раскрыты как ингибиторы протеинкиназы в публикациях международных патентных заявок WO 01/12189,WO 01/12188, WO 02/48114 и WO 02/70515, все поданы от имени заявителя настоящего изобретения. Конденсированные бициклические соединения, включающие паразольные фрагменты и обладающие ингибирующей активностью по отношению к киназам, раскрыты также в WO 00/69846 иWO 02/12242, а также в WO 03/028720 (РСТ/ЕР 02/10534, испрашивающая приоритет согласно заявке на патент США 09/962162 от 26 сентября 2001 г.) и одновременно поданной заявке РСТ/ЕР 03/04862 (испрашивающая приоритет согласно заявке на патент США 60/381092 от 17 мая 2002 г.), все поданы от имени заявителя настоящего изобретения. Соединения, которые являются объектом настоящего изобретения, подпадают под общую формулу вышеуказанной заявки WO 02/12242, которая включена в настоящее описание посредством ссылки, однако специально в ней не описаны. Если не указано иное, то при ссылке на сами соединения формулы (I), а также на любые их фармацевтические композиции или на любую терапию с их применением, настоящее изобретение включает все возможные гидраты, сольваты, комплексы, метаболиты и пролекарства соединений по настоящему изобретению. Пролекарствами являются любые ковалентно связанные соединения, которые in vivo высвобождают активное исходное лекарство, соответствующее формуле (I). Метаболитом соединения формулы (I) является любое соединение, в которое in vivo превращается это же самое соединение (I), например, после введения нуждающемуся в этом млекопитающему.-4 010596 Как правило, что не является ограничивающим настоящее изобретение примером, при введении соединения формулы (I) это же самое производное может превращаться в различные соединения, например, включающие более растворимые производные, такие как гидроксилированные производные, которые легче выводятся из организма. Таким образом, в зависимости от дальнейшего метаболического пути,любые из указанных гидроксилированных производных могут рассматриваться как метаболиты соединений формулы (I). Если в соединении по настоящему изобретению присутствует хиральный центр или иной тип центра изомерии, то предполагается, что настоящее изобретение охватывает все формы подобного изомера или изомеров, включая энантиомеры и диастереомеры. Соединения, содержащие хиральный центр, могут быть использованы в виде рацемической смеси, энантиомерно обогащенной смеси, или же рацемическая смесь может быть разделена с помощью хорошо известных методов и индивидуальные энантиомеры могут быть использованы самостоятельно. В тех случаях, когда соединения имеют ненасыщенные углерод-углеродные двойные связи, в объем настоящего изобретения входят как цис-изомеры (Z), так и транс-изомеры (Е). В тех случаях, когда соединения могут существовать в таутомерных формах, таких как кетоенольные таутомеры, предполагается, что каждая таутомерная форма входит в объем настоящего изобретения независимо от того, существует ли она в равновесной форме или преимущественно в одной форме. В настоящем изобретении, если не указано иное, под "термином C1-C6 алкильная группа с прямой или разветвленной цепью", который тем самым включает и C1-C4 алкильную группу, подразумевают любые группы, такие как, например, метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, трет-бутильная, втор-бутильная, н-пентильная, н-гексильная группа и т.д. Под термином "C3-C6 циклоалкильная группа", если не указано иное, подразумевают циклоалифатическое кольцо, такое как циклопропильная, циклобутильная, циклопентильная или циклогексильная группа. Термин "арильная группа" включает карбоциклические или гетероциклические углеводороды, содержащие от 1 до 2 кольцевых фрагментов как конденсированных, так и связанных друг с другом простыми связями, в которых по меньшей мере одно из колец является ароматическим; если он присутствует, то любой ароматический гетероциклический углеводород, который называют также гетероарильной группой, включает 5- или 6-членное кольцо, содержащее 1-3 гетероатома или гетероатомных групп, выбранных из N, NH, О или S. Примерами арильных групп в соответствии с настоящим изобретением являются, например, фенильная, бифенильная, - или -нафтильная, дигидронафтильная, тиенильная, бензотиенильная, фурильная, бензофуранильная, пирролильная, имидазолильная, пиразолильная, тиазолильная, изотиазолильная,оксазолильная, изоксазолильная, пиридильная, пиразинильная, пиримидинильная, пиридазинильная, индолильная, изоиндолильная, пуринильная, хинолильная, изохинолильная, дигидрохинолинильная, хиноксалинильная, бензодиоксолильная, инданильная, инденильная, триазолильная группа и т.д. Если не указано иное, термин "гетероцикл или гетероциклическая группа" включает 5- или 6-членные насыщенные, частично ненасыщенные или полностью ненасыщенные гетероциклы, содержащие 1-3 гетероатома или гетероатомных групп, выбранных из N, NH, О или S. Помимо полностью ненасыщенных гетероциклов, обозначенных выше как ароматические гетероциклы и охватываемых термином арильная группа, примерами насыщенных или частично ненасыщенных гетероциклов, в соответствии с настоящим изобретением, являются, например, пиран, пирролидин,пирролин, имидазолин, имидазолидин, пиразолидин, пиразолин, тиазолин, тиазолидин, дигидрофуран,тетрагидрофуран, 1,3-диоксолан, пиперидин, пиперазин, морфолин и т.п. В том случае, когда ссылаются на соединения по настоящему изобретению, где значения R1 приведено в группе (b), сам заместитель R1 может представлять собой указанную циклоалкильную группу,например циклопропильную группу; указанную циклоалкилалкильную группу, например циклопропилметильную группу; или даже указанную алкилциклоалкильную группу, например метилциклопропильную группу; все они имеют следующие формулы: В том случае, когда ссылаются на соединения по настоящему изобретению, где R1 является группой формулы (IIa), (5-7)-членное гетероциклическое кольцо непосредственно присоединено к остатку молекулы посредством атома X, как указано ниже Примеры этих (5-7)-членных гетероциклов включают (5-6)-членные гетероциклы, которые указаны выше, и дополнительно 7-членные гетероциклы, такие как, например, азепин, диазепин, оксазепин и т.п. Любая группа Rc, если она присутствует, может находиться в любом из свободных положений гетероциклического кольца в формуле (IIa) за счет замещения атома водорода. В том случае, когда ссылаются на соединения по настоящему изобретению, где R1 является группой формулы (IIc) или (IId), то таким образом могут быть обозначены уреидопроизводные и карбаматы,имеющие следующие подформулы: В соответствии с настоящем изобретении и если не указано иное, любые из указанные выше группRa, Rb и Rc необязательно могут быть замещены, по любому из своих свободных положений, одной или несколькими группами, например 1-6 группами, независимо выбранными из галогена, нитрогруппы, оксогруппы (=O), цианогруппы, алкильной, полифторалкильной, полифторалкокси, алкенильной, алкинильной, гидроксиалкильной, арильной, арилалкильной, гетероциклильной, циклоалкильной, гидрокси,алкоксигруппы, арилоксигруппы, гетероциклилоксигруппы, метилендиоксигруппы, алкилкарбонилоксигруппы, арилкарбонилоксигруппы, циклоалкенилоксигруппы, алкилиденаминооксигруппы, карбокси,алкоксикарбонильной, арилоксикарбонильной, циклоалкилоксикарбонильной, аминогруппы, уреидогруппы, алкиламиногруппы, диалкиламиногруппы, ариламиногруппы, диариламиногруппы, формиламиногруппы, алкилкарбониламиногруппы, арилкарбониламиногруппы, гетероциклилкарбониламиногруппы, алкоксикарбониламиногруппы, алкоксииминогруппы, алкилсульфониламиногруппы, арилсульфониламиногруппы, формильной, алкилкарбонильной, арилкарбонильной, циклоалкилкарбонильной, гетероциклилкарбонильной, аминокарбонильной, алкиламинокарбонильной, диалкиламинокарбонильной, алкилсульфонильной, арилсульфонильной, аминосульфонильной, алкиламиносульфонильной, диалкиламиносульфонильной, арилтиогрупы и алкилтиогруппы. В соответствии с этим под термином галоген подразумевают атом фтора, хлора, брома или йода. Под термином "алкенильная или алкинильная группа" подразумевают любые из указанных вышеC2-C6 алкильных групп с прямой или разветвленной цепью, которые дополнительно содержат двойную или тройную связь. Не ограничивающими настоящее изобретение примерами алкенильных или алкинильных групп являются, например, винильная, аллильная, 1-пропенильная, изопропенильная,1-бутенильная, 2-бутенильная, 3-бутенильная, 2-пентенильная, 1-гексенильная, этинильная,2-пропинильная, 4-пентинильная группа и т.п. Под термином "полифторалкильная или полифторалкоксигруппа" подразумевают любые из указанных выше C1-C6 алкильных или алкоксигрупп, которые замещены более чем одним атомом фтора, такие как, например, трифторметильная, трифторэтильная, 1,1,1,3,3,3-гексафторпропильная, трифторметоксигруппа и т.п. Под термином "алкоксигруппа, арилоксигруппа, гетероциклилоксигруппа и их производные" подразумевают любые указанные выше алкильные, арильные или гетероциклические группы, присоединенные к остальной молекуле через атом кислорода (-O-). Из изложенного выше для специалиста ясно, что любую группу, имеющую составное название, такую как, например, циклоалкилалкильная, арилалкильная, гетероциклилалкильная, алкоксигруппа, алкилтиогруппа, арилоксигруппа, арилалкилоксигруппа, алкилкарбонилоксигруппа, арилалкильная, гетероциклилалкильная группа и т.п., следует обычно рассматривать исходя из частей, из которых они составлены. В качестве примера такая группа, как гетероциклилалкилоксигруппа представляет собой алкоксигруппу, в частности алкилоксигруппу, в которой алкильный фрагмент дополнительно замещен гетероциклильной группой, где значения алкильной и гетероциклильной группы указаны выше. Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли с неорганическими или органическими кислотами, например азотной, хлористо-водородной, бромистоводородной, серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой,-6 010596 молочной, щавелевой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетионовой и салициловой кислотой. Кислотно-аддитивные соли соединений по настоящему изобретению преимущественно выбирают из гидрохлоридов и мезилатов. Фармацевтически приемлемые соли соединений формулы (I) включают также соли с неорганическими или органическими основаниями, например соли со щелочными или щелочно-земельными металлами, в частности с гидроксидами натрия, калия, кальция и магния, карбонатами или бикарбонатами,ациклическими или циклическими аминами, предпочтительно метиламином, этиламином, диэтиламином, триэтиламином, пиперидином и т.п. Первый класс предпочтительных соединений формулы (Ia) или (Ib) представлен производными, в которых R означает группу -CORa, где значения Ra указаны выше, и R1 означает трет-бутильную группу. Другой класс предпочтительных соединений формулы (Ia) или (Ib) представлен производными, в которых R означает группу -CONHRa, где значения Ra указаны выше, и R1 означает трет-бутильную группу. Еще один класс предпочтительных соединений формулы (Ia) или (Ib) представлен производными, в которых R означает группу -CONRaRb, где значения Ra и Rb указаны выше, и R1 означает трет-бутильную группу. Другой класс предпочтительных соединений формулы (Iа) или (Ib) представлен производными, в которых значения R указаны выше, и R1 означает группу формулы (IIa), выбранную из где значения Rc указаны выше. Еще один класс предпочтительных соединений формулы (Ia) или (Ib) представлен производными, в которых значения R указаны выше, и R1 означает группу формулы (IIa), выбранную из где значения n и Rc указаны выше. Из указанных выше классов соединений наиболее предпочтительными являются соединения формулы (Ia), где R означает группу -CORa, где Ra означает 4-фторфенильную или циклобутильную группу,и R1 имеет значения, приведенные в общей формуле. Кроме того, наиболее предпочтительными являются соединения формулы (Ia), где R имеет значения, приведенные в общей формуле, и R1 выбирают из трет-бутильной, 1-метилпиперидил-4-ильной,1-метилпиперазинил-4-ильной, 2-(R,S)-тетрагидрофуранил-2-ильной, 2-(R)-тетрагидрофуранил-2-ильной или 2-(S)-тетрагидрофуранил-2-ильной группы. Общие ссылки на какие-либо конкретные соединения формулы (I) по настоящему изобретению, необязательно в форме фармацевтически приемлемой соли, приведены в экспериментальном разделе описания. Как указано выше, еще одним объектом настоящего изобретения является способ получения соединений формулы (I). В соответствии с этим соединения формулы (I) и их фармацевтически приемлемые соли могут быть получены по способу, который включает: а) взаимодействие соединения формулы (IIIa) или (IIIb) с акрилонитрилом с образованием соответствующего производного формулы (IVa) или (IVb)b) защиту аминогруппы соединения формулы (IVa) или (IVb) с образованием соответствующего производного формулы (Va) или (Vb) где Q означает подходящую аминозащитную группу; с) взаимодействие соединения формулы (Va) или (Vb) с подходящим алкилирующим агентом с образованием соответствующего сложного эфира формулы (VIa) или (VIb)d) взаимодействие соединения формулы (VIa) или (VIb) с гидридом натрия (NaH) с образованием соответствующего производного формулы (VIIa) или (VIIb) е) взаимодействие соединения формулы (VIIa) или (VIIb) с гидразингидратом с образованием соответствующего производного формулы (VIIIa) или (VIIIb)f) взаимодействие соединения формулы (VIIIa) или (VIIIb) с этилхлорформиатом с образованием соответствующего производного формулы (IXa) или (IXb), каждое из которых может быть в любой из двух региоизомерных форм и взаимодействие соединений формулы (IXa) или (IXb) по одной из альтернативных стадий (g.1), (g.2) или (g.3):Z означает атом галогена, с образованием соединения формулы (XIa) или (XIb)Ra-NCO,(XII) где значения R указаны выше, с образованием соединения формулы (XIa) или (XIb), где R означает группу -CONHRa; илиg.3) с соответствующим амином формулы (XIII) в присутствии трифосгена или подходящего хлорформиатаb где значения R и R указаны выше, с образованием соединения формулы (XIa) или (XIb), где R означаетh) удаление защиты аминогруппы соединения формулы (XIa) или (XIb), полученного по любой из стадий с (g.1) по (g.3), с образованием соответствующего производного формулы (XIVa) или (XIVb) где значения R указаны выше; и взаимодействие соединений формулы (XIVa) или (XIVb) по любой из альтернативных стадий (i.1),(i.2), (i.3) или (i.4):i.1) с производным ацилгалогенида формулы (XV)Z означает атом галогена, с образованием соединения формулы (XVIa) или (XVIb)i.2) с (5-7)-членным гетероциклическим соединением формулы (XVII) или соответствующим амином формулы (XVIII) в присутствии трифосгена где X означает NH, и Y, Rc, n, Rd и R'd имеют указанное выше значение, с образованием соответствующих соединений формулы (XVIa) или (XVIb), где значения R указаны выше, и R1 означает либо группу формулы (IIa), где X означает атом азота, и значения R, Y, Rc и n указаны выше, либо группу формулыi.3) с карбоновой кислотой формулы (XIX) в присутствии подходящего конденсирующего агента(XIX) с образованием соединения формулы (XVIa) или (XVIb), где значения R1 указаны выше в формуле (Ia) или (Ib) под группами (а), (b), (с), или означает группу формулы (IIa), где X означает атом углерода, или группу формулы (IIb), и значения R, Y, Rc и n указаны выше;R1-COZ,(XX) где R1 означает группу формулы (IId) и Z означает атом хлора или брома, с образованием соединения формулы (XVIa) или (XVIb), где значения R указаны выше, и R1 означает группу формулы (IId); иj) взаимодействие соединения формулы (XVIa) или (XVIb), полученного в соответствии с одной из стадий (i.1)-(i.4), в присутствии основания с образованием соответствующего производного формулы (Ia) или (Ib), где значения R и R1 указаны выше; и, необязательно,k) превращение их в другие соединения формулы (Ia) или (Ib) соответственно и/или в их фармацевтически приемлемые соли. Приведенный выше способ представляет собой аналог, который можно осуществить с использованием методов, хорошо известных в данной области. Из изложенного выше для специалиста должно быть ясно, что если соединение формулы (Ia) или(Ib), полученное по приведенному выше способу, получено в виде смеси изомеров, то их разделение на индивидуальные изомеры формулы (Ia) или (Ib), которое проводят с использованием обычных методов,входит в объем настоящего изобретения. Аналогично, превращение соответствующей соли соединения формулы (Ia) или (Ib) в свободное соединение формулы (Ia) или (Ib) также входит в объем настоящего изобретения. В соответствии со стадией (а) настоящего способа, соединение формулы (IIIa) или (IIIb) подвергают взаимодействию с акрилонитрилом в присутствии подходящего основания, например гидроксида натрия.-9 010596 Реакцию преимущественно проводят в воде при температуре в интервале от приблизительно -10 С до комнатной температуры. В соответствии со стадией (b) настоящего способа аминогруппу соединения (IVa) или (IVb) защищают, используя обычные методы, например, с помощью ангидрида трет-бутоксикарбонила (Вос 2 О) и в присутствии подходящего растворителя, такого как ацетонитрил или дихлорметан, с получением соответствующего производного формулы (Va) или (Vb), где аминозащитная группа Q означает третбутоксикарбонильную группу (boc). В соответствии со стадией (с) настоящего способа карбоксильную группу формулы (Va) или (Vb) превращают в соответствующий алкиловый сложный эфир, например, в присутствии соответствующего алкилгалогенида, например метилйодида. Реакцию проводят в присутствии подходящего растворителя, такого как диметилформамид, и в присутствии основания, например, при использовании бикарбоната натрия или калия. В соответствии со стадией (d) настоящего способа соединение формулы (VIa) или (VIb) превращают в соответствующее циклическое производное формулы (VIIa) или (VIIb) по реакции с гидридом натрия. Реакцию проводят в присутствии подходящего растворителя, такого как диоксан или тетрагидрофуран при его температуре дефлегмации. В соответствии со стадией (е) настоящего способа соединение формулы (VIIa) или (VIIb) подвергают взаимодействию с гидразингидратом, предпочтительно с избытком моногидрата гидразина, например вплоть до 10 экв., в присутствии подходящего растворителя, такого как галогенсодержащие углеводороды, низшие спирты или их смеси. Реакцию предпочтительно проводят в присутствии этанола, добавляя гидразин к раствору соединения формулы (VIIa) или (VIIb) и перемешивая в течение соответствующего времени, например в течение приблизительно 48 ч, в диапазоне температур от приблизительно 20 до приблизительно 70 С. Вышеуказанную реакцию преимущественно проводят в присутствии ледяной уксусной кислоты. В соответствии со стадией (f) настоящего способа, соединение формулы (VIIIa) или (VIIIb) подвергают взаимодействию с этилхлорформиатом с получением соответствующего производного формулы(IXa) или (IXb). Реакцию осуществляют в хорошо известных условиях в присутствии подходящего основания, например, диизопропиламина, и в присутствии подходящего растворителя, такого как тетрагидрофуран. Очевидно, что этоксикарбонильная группа может быть присоединена к любому из атомов азота пиразола обоих соединений формулы (VIIIa) или (VIIIb) с образованием следующих региоизомеров формулы (IXa) или (IXb): В соответствии с изложенным каждая пара региоизомеров формулы (IXa) или (IXb) может быть подходящим способом разделена с помощью хорошо известных методов, например хроматографически,и затем каждый выделенный указанным способом региоизомер обрабатывают. В качестве альтернативы на последующих стадиях можно ввести в реакцию саму смесь региоизомеров, не проводя ее разделения. Фактически, поскольку этоксикарбонильная группа, которая приводит к двум различным региоизомерам, удаляется окончательно в конце процесса, то для специалиста должно быть ясно, что для получения соединений формулы (Ia) или (Ib) по настоящему изобретению могут использоваться оба из указанных путей. Тем не менее, предпочтительно способ сначала осуществляют, разделяя и выделяя региоизомеры формулы (IXa) или (IXb) из смеси, как указано в рабочих примерах, и затем превращают их в требуемые соединения. В соответствии со стадией (g.1) настоящего способа соединения формулы (IXa) или (IXb) подвергают взаимодействию с соответствующим соединением формулы (X), где Z означает атом галогена,предпочтительно хлор или бром. Конкретно, соединение формулы (IXa) или (IXb) растворяют в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран, диоксан и т.п., и добавляют подходящее основание,- 10010596 такое как триметиламин, диизопропилэтиламин, карбонат натрия и т.п. Затем добавляют соединение формулы (X) и смесь перемешивают в течение от приблизительно 2 до приблизительно 15 ч в интервале температур от приблизительно 20 до приблизительно 80 С. Необязательно может использоваться подходящий катализатор, такой как диметиламинопиридин. В соответствии со стадией (g.2) настоящего способа соединения формулы (IXa) или (IXb) подвергают взаимодействию с производным изоцианата формулы (XII) в тех же условиях, что и указанные на стадии (g.1) настоящего способа, за исключением того, что основание не требуется. В соответствии со стадией (g.3) настоящего способа соединения формулы (IXa) или (IXb) подвергают взаимодействию с амином формулы (XIII) в присутствии трифосгена или подходящего хлорформиата, например 4-нитрофенилхлорформиата, с образованием соответствующего уреидопроизводного. Реакцию проводят в тетрагидрофуране (ТГФ) или в подходящем галогенсодержащем углеводороде, преимущественно в дихлорметане (DCM), в присутствии подходящего амина, такого как диизопропилэтиламин или триэтиламин, при температуре в интервале от приблизительно -70 С до комнатной температуры. В соответствии со стадией (h) настоящего способа у защищенной аминогруппы в формуле (IXa) или(IXb) удаляют защиту в хорошо известных условиях проведения указанной операции, например в кислой среде в присутствии трифторуксусной или хлористо-водородной кислоты. Так, соединения формулы (IXa) или (IXb) суспендируют в подходящем растворителе, таком как дихлорметан или диоксан, и обрабатывают концентрированным раствором выбранной кислоты. Альтернативно, с успехом могут быть использованы коммерчески доступные растворы газообразного хлористого водорода в диоксане (4 М HCl). Затем смесь перемешивают в течение времени от приблизительно 2 до приблизительно 15 ч в интервале температур от приблизительно 20 до приблизительно 40 С. В соответствии с любой из стадий (i.1), (i.2), (i.3) или (i.4) настоящего способа соединение формулы(XIVa) или (XIVb) затем подвергают взаимодействию с подходящим производным с образованием соответствующего карбоксамидо-, уреидо- и карбаматного производного формулы (XVIa) или (XVIb). Стадию (i.1) проводят с использованием ацилгалогенида, преимущественно хлорида, формулы (XV) в подходящем растворителе, таком как дихлорметан, в присутствии основания, например в присутствии подходящего амина, такого как диизопропиламин. Реакция дает возможность получить карбоксамидопроизводное формулы (XVIa) или (XVIb), где значения R1 указаны в формуле (I) в группах (а)-(с), (IIa), где X означает атом углерода, и (IIb); для специалиста из изложенного выше должно быть понятно, что атом группы R1, который непосредственно соединен с карбонильным фрагментом формулы (XVIa) или (XVIb), является атомом углерода. Стадию (i.2) проводят с гетероциклическим производным формулы (XVII) или амином формулы(XVIII) в присутствии трифосгена, в основном как описано для стадии (g.3) настоящего способа. В соответствии с этим стадия (i.2) дает возможность получить уреидопроизводное формулы (XVIa) или (XVIb), где R1 означает группу формулы (IIa), где X означает атом азота, или формулы (IIc), где значения Y, Rc, n, Rd и R'd указаны выше. Аналогично, конденсацию на стадии (i.3) проводят с производным карбоновой кислоты формулы(XIX) в присутствии подходящего конденсирующего агента, такого как, например, дициклогексилкарбодиимидO-бензотриазолилтетраметилизоурония (TBTU), применяя хорошо известные способы получения карбоксамидопроизводных. В соответствии со стадией (i.4) настоящего способа соединение формулы (XIVa) или (XIVb) подвергают взаимодействию с подходящим производным формулы (XX), где R1 означает группу формулы(IId), и значения Re приведено в формуле (Ia) или (Ib), и получают соответствующее карбаматное производное формулы (XVIa) или (XVIb). В соответствии с указанным соединение формулы (XIVa) или (XIVb) растворяют в подходящем растворителе, таком как дихлорметан, диметилформамид, тетрагидрофуран, диоксан и т.п., и в полученную смесь добавляют подходящее основание, такое как триэтиламин, диизопропиламин, карбонат натрия и т.п. Затем добавляют соединение общей формулы (XX) и смесь перемешивают в течение времени от приблизительно 2 до приблизительно 15 ч в интервале температур от приблизительно 20 до приблизительно 80 С. В соответствии с предпочтительным вариантом осуществления изобретения необязательно может быть использован подходящий катализатор, такой как диметиламинопиридин. В соответствии со стадией (j) настоящего способа соединение формулы (XVIa) или (XVIb), полученное на любой из стадий (i.1)-(i.4), подвергают взаимодействию с подходящим основанием, например триэтиламином, в присутствии подходящего растворителя, такого как метанол или этанол, с получением требуемого соединения формулы (Ia) или (Ib). Наконец, что касается стадии (k) настоящего способа, то указанные выше соединения формулы (Ia) или (Ib) необязательно могут быть превращены в фармацевтически приемлемые соли, как указано выше,с использованием обычных способов или же превращены в дополнительные соединения формулы (Ia) или (Ib).- 11010596 В качестве не ограничивающего настоящее изобретения примера соединения формулы (Ia) или (Ib),содержащие карбоксиэфирную группу, могут быть превращены в различные производные с помощью хорошо известных в данной области способов превращения карбоксиэфирных групп в карбоксамиды,N-замещенные карбоксамиды, N,N-дизамещенные карбоксамиды, карбоновые кислоты и т.п. Условия проведения реакций те же, что и хорошо известные в данной области, и они могут включать, например, при превращении карбоксиэфирной группы в карбоксамидную группу, реакцию с аммиаком или гидроксидом аммония в присутствии подходящего растворителя, такого как низший спирт,диметилформамид или их смеси; предпочтительно реакцию проводят с гидроксидом аммония в смеси метанол/диметилформамид в интервале температур от приблизительно 50 до приблизительно 100 С. Аналогичные условия проведения реакции применяют при получении N-замещенных илиN,N-дизамещенных карбоксамидов, где вместо аммиака или гидроксида аммония используют соответствующий первичный или вторичный амин. Аналогично карбоксиэфирные группы могут быть превращены в производные карбоновых кислот в условиях основного или кислотного гидролиза, хорошо известных в данной области. В качестве дополнительного примера соединения формулы (Ia) или (Ib), содержащие аминогруппы,могут быть легко превращены в соответствующие карбоксамидопроизводные или уреидопроизводные. Из изложенного выше для специалиста должно быть понятно, что в соответствии со стадией (k) настоящего способа любое соединение формулы (Ia) или (Ib), содержащее функциональную группу, которая может быть далее преобразована в другую функциональную группу с помощью способов, хорошо известных в данной области, и, таким образом, превращено в другие соединения формулы (Ia) или (Ib),также входит в объем настоящего изобретения. В любом из вариантов способа получения соединений формулы (I) исходные вещества или любые другие реагенты хорошо известны или легко могут быть получены с помощью известных способов. Так, например, исходные соединения формулы (IIIa) или (IIIb) коммерчески доступны, и соединения формулы (X), (XII), (XIII), (XV), (XVII), (XVIII), (XIX) и (XX) известны или легко могут быть получены в соответствии с известными способами. Промежуточные соединения формулы (VIIa) или (VIIb) по настоящему способу где Q означает подходящую для атома азота защитную группу, например трет-бутоксикарбонильную группу (boc),являются новыми и, таким образом, являются еще одним объектом настоящего изобретения. Как легко понять, если соединения формулы (I), полученные в соответствии с вышеописанным способом, получают в виде смеси изомеров, то их разделение на индивидуальные изомеры формулы (I) с использованием обычных методов входит в объем настоящего изобретения. Обычные методы разделения рацематов включают, например, дробную кристаллизацию солей диастереоизомеров или препаративную хиральную ВЭЖХ. Кроме того, из изложенного выше должно быть понятно, что данное соединение формулы (Ia) или(Ib) может быть получено либо из смеси региоизомеров формулы (IXa) или (IXb), либо же из каждого из двух индивидуальных региоизомеров. При получении соединений формулы (I) в соответствии с одним из вышеуказанных вариантов осуществления настоящего способа возможные функциональные группы в исходном соединении или в их промежуточных соединениях, которые могут привести к нежелательным побочным реакциям, следует соответствующим образом защитить, используя обычные методы. Аналогично, превращение указанных защищенных производных в освобожденные от защиты соединения может быть проведено в соответствии с известными методиками. Кроме того, соединения формулы (I) по настоящему изобретению могут быть получены с помощью методов комбинаторной химии, хорошо известных в данной области, путем последовательного проведения вышеуказанных реакций между несколькими промежуточными соединениями в условиях твердофазного (SPS) синтеза. В качестве примера соединения формулы (XIa) и (XIb), которые получают в соответствии с одной из стадий (g.1), (g.2) или (g.3), можно нанести на подходящую полимерную смолу. В частности, этоксикарбонильную группу формулы (ХIа) и (XIb) можно удалить в присутствии основания, например в присутствии триэтиламина или диизопропиламина, и полученное соединение присоединить к указанной выше полимерной матрице непосредственно через атом азота пиразола. Полученное указанным способом иммобилизованное промежуточное соединение затем подергают взаимодействию в соответствии со стадией (h) или одной из стадий (i.1), (i.2), (i.3) или (i.4) настоящего способа и получают соответствующее соединение формулы (Ia) или (Ib) по настоящему изобретению, все еще связанной с полимерной смолой. Последующее расщепление связи со смолой, например, в основных или кислотных условиях с использованием известных методов дает возможность получить требуемые соединения формулы (Ia) или (Ib). Очевидно, что, последовательно проводя указанные выше реакции по настоящему способу, т.е. используя комбинаторный подход, аналогичный описанному выше, можно получить и выделить несколько соединений формулы (Ia) или (Ib). Таким образом, еще одной целью настоящего изобретения является библиотека, включающая два или более соединений формулы (Ia) где R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью, C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной или гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;a) C3-C4 алкильную группу с прямой или разветвленной цепью;b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6 циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4 алкильную группу с прямой или разветвленной цепью; где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота,кислорода или серы или означает группу NH, при условии, что по крайней мере один из X и Y отличен от атома углерода; группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью,C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной, гетероциклилалкильной, аминогруппы, аминокарбонильной, карбоксигруппы, оксогруппы (=O), алкоксикарбонильной, алкилкарбонильной или арилкарбонильной группы; и n равно 0 или целому числу от 1 до 4; е) группу формулы (IIc) и (IId) где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга означают атом водорода или C1-C6 алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной(-CONH2) или метиламинокарбонильной (-CONHCH3) группы; при условии, что в формуле (Ia), когда R1 означает группу формулы (Ia) и один из заместителей Rd илиR'd означает атом водорода, в то время как другой из Rd или R'd означает этильную или н-бутильную группу, то R отличен от -CORa, где Ra означает 3-бромфенильную, бензильную, 4-трет-бутилфенильную,4-трет-бутилфенилметильную, 4-фторфенилметильную, циклопропильную или 2-нафтилметильную группу; или их фармацевтически приемлемую соль. Аналогично, следующей целью настоящего изобретения является библиотека, включающая два или больше соединений формулы (Ib) где R означает группу -CORa, -CONHRa или -CONRaRb, где Ra и Rb, каждый независимо, означает водород или необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью, C3-C6 циклоалкильной, арильной, арилалкильной, гетероциклильной или гетероциклилалкильной группы; или вместе с атомом азота, к которому они присоединены, Ra и Rb могут образовывать необязательно замещенный 5- или 6-членный гетероцикл, необязательно содержащий один дополнительный гетероатом или гетероатомную группу, выбранную из N, NH, О или S;a) C3-C4 алкильную группу с прямой или разветвленной цепью;b) циклоалкильную, циклоалкилалкильную или алкилциклоалкильную группу, в которой циклоалкильный фрагмент включает любую C3-C6 циклоалкильную группу и в которой алкильный фрагмент включает любую C1-C4 алкильную группу с прямой или разветвленной цепью; где в формуле (IIa) цикл означает (5-7)-членное гетероциклическое кольцо, в котором X, непосредственно связанный с остальной молекулой, означает атом углерода или азота; Y означает атом углерода, азота,кислорода или серы или означает группу NH, при условии, что по крайней мере один из X и Y отличен от атома углерода; группы Rc, независимо друг от друга и в любом из свободных положений гетероциклического кольца формулы (IIa), означают атом галогена или гидроксильную группу или означают необязательно замещенную группу, выбранную из C1-C6 алкильной группы с прямой или разветвленной цепью, C3C6 циклоалкильной, арильной, арилалкильной, гетероциклильной, гетероциклилалкильной, аминогруппы,аминокарбонильной, карбоксигруппы, оксогруппы (=O), алкоксикарбонильной, алкилкарбонильной или арилкарбонильной группы; и n равно 0 или целому числу от 1 до 4; е) группу формул (IIc) и (IId)- 14010596 где Rd, R'd и Re, которые могут быть одинаковыми или различными, независимо друг от друга означают атом водорода или C1-C6 алкильную группу с прямой или разветвленной цепью, необязательно замещенную одной или несколькими группами, выбранными из гидрокси (-OH), аминокарбонильной(-CONH2) или метиламинокарбонильной (-CONHCH3) группы; или их фармацевтически приемлемую соль. Общая ссылка на вышеприведенные библиотеки соединений формулы (I) приведена в экспериментальной части. Из изложенного выше для специалиста будет очевидно, что как только указанным образом получена библиотека пирролопиразольных производных, например, включающая несколько сотен и даже несколько тысяч соединений формулы (Ia) или (Ib), то ее можно с успехом использовать, как уже сообщалось выше, для проведения скрининга по отношению к приведенным киназам. Общую ссылку на библиотеки соединений и их применение в качестве инструментов для тестирования биологической активности см. J. Med. Chem., 42, 2373-2382; и Bioorg. Med. Chem. Lett. 10 (2000),223-226. Фармакология. Соединения формулы (I) активны в качестве ингибиторов протеинкиназы и, таким образом, применимы, например, для ограничения нерегулируемой пролиферации опухолевых клеток. В терапии они могут быть использованы при лечении различных опухолей, таких как указано выше, а также при лечении других заболеваний, связанных с пролиферацией клеток, таких как псориаз,связанная с атеросклерозом пролиферация гладких клеток сосудов и послехирургический стеноз и рестеноз, а также при лечении болезни Альцгеймера. Ингибирующую активность предполагаемых ингибиторов Cdk/Cyclin и эффективность выбранных соединений определяют с помощью анализа, основанного на использовании метода SPA (AmershamPharmacia Biotech). Анализ заключается в переносе киназой содержащего радиоактивную метку фосфатного фрагмента к биотинилированному субстрату. Полученному 33 Р-меченному биотинилированному продукту дают связаться с покрытыми стрептавидином SPA шариком (содержание биотина 130 пмол/мг) и испускаемый свет измеряют с помощью сцинтиллятора. Анализ ингибирования активности Cdk2/Cyclin A. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 4 мкМ субстрата в виде биотинилированного самим изготовителем гистона H1 (SigmaН-5505), 10 мкМ АТФ (0,1 мкКи Р 33 АТФ), 4,2 нг комплекса Cdk2/Cyclin А, ингибитор в буфере (TRIS HCl 10 мМ, pH 7,5, MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл бычьего сывороточного альбумина [BSA]) с конечным объемом 30 мкл. Через 30 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл забуференного фосфатом солевого раствора (PBS)+32 мМ ЭДТУ+0,1% Triton X-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl, для стратификации шариков вверху планшета, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. Ингибиторы испытывают при разных концентрациях в диапазоне от 0,0015 до 10 мкм. Экспериментальные данные анализируют с помощью компьютерной программы GraphPad Prizm, используя четырехпараметрическое логистическое уравнение:y=низ+(верх-низ)/(1+10log IC50-x)тангенс наклона,где x означает логарифм концентрации ингибитора;y означает ответную реакцию; y начинается снизу и идет к верху по сигмовидной кривой. Расчет величины Ki. Экспериментальный метод. Реакцию проводят в буферном растворе (10 мМ Tris с pH 7,5, 10 мМMgCl2, 0,2 мг/мл BSA, 7,5 мМ DTT), содержащем 3,7 нМ фермента, гистона и АТФ (постоянное отношение немеченного/меченного АТФ 1/3000). Реакцию останавливают добавлением ЭДТУ и субстрат захватывают фосфомембраной (96 луночные планшеты Multiscreen от компании Millipore). После интенсивной промывки планшеты для мультианализа считывают с помощью прибора top-counter. Определяют контрольное значение (время ноль) для каждой концентрации АТФ и гистона. Планирование эксперимента. Скорости реакции определяют при четырех различных концентрациях АТФ, субстрата (гистона) и ингибитора. Строят матрицу концентраций, содержащую 80 точек, вокруг соответствующих значений АТФ и Km субстрата и значений IC50 ингибитора (кратные значениям 0,3; 1; 3; 9 Km или IC50). Предварительные эксперименты в зависимости от времени в отсутствие ингибитора и при различных концентрациях АТФ и субстрата позволяют провести отбор единого времени окончания(10 мин) в линейном диапазоне протекания реакции в эксперименте по определению величины Ki. Оценка кинетических параметров. Оценку кинетических параметров проводят с помощью одновременной нелинейной регрессии по методу наименьших квадратов с использованием уравнения [Eq.1](конкурентный ингибитор для АТФ, случайный механизм) и всего набора данных (80 точек)Ka, Kb, Ki - константы диссоциации АТФ, субстрата и ингибитора соответственно;и- кооперативный фактор, соответственно, между связыванием субстрата с АТФ и между связыванием субстрата с ингибитором связывания. Выбранные соединения дополнительно характеризуют с помощью панели серин/треонинкиназ,непосредственно связанных с клеточным циклом (Cdk2/Cyclin E, Cdk1/Cyclin B1, Cdk5/p25, Cdk4/CyclinD1), а также, с целью определения специфичности действия по отношению к MAPK, PKA, EGFR,IGF1-R, Aurora-2 и Akt. Анализ ингибирования активности Cdk2/Cyclin E. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 10 мкМ субстрата в виде биотинилированного самим изготовителем гистона H1 (SigmaH-5505), 30 мкМ АТФ(0,3 мкКи Р 33-АТФ), 4 нг комплекса GST-Cdk2/Cyclin E, ингибитор в буфере (TRIS HCl 10 мМ, pH 7,5,MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 60 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл PBS+32 мМ ЭДТУ+0,1%Triton X-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху планшета и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности Cdk1/Cyclin B1. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 4 мкМ субстрата в виде биотинилированного самим изготовителем гистона H1 (SigmaН-5505), 20 мкМ АТФ (0,2 мкКи Р 33-АТФ), 3 нг комплекса Cdk1/Cyclin В, ингибитор в буфере (TRIS HCl 10 мМ, pH 7,5,MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 20 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл PBS+32 мМ ЭДТУ+0,1%Triton X-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху Optiplate, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности Cdk5/p25. Анализ ингибирования активности Cdk5/p25 проводят по следующей методике. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 10 мкМ субстрата в виде биотинилированного гистона H1(SigmaH-5505), 30 мкМ АТФ (0,3 мкКи Р 33-АТФ),15 нг комплекса CDK5/p25, ингибитор в буфере (TRIS HCl 10 мМ, pH 7,5, MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 30 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл PBS+32 мМ ЭДТУ+0,1% Triton Х-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху планшета, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности Cdk4/Cyclin D1. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 0,4 мкМ субстрата мышиного GST-Rb (769-921) ( sc-4112 от компании Santa Cruz), 10 мкМ АТФ (0,5 мкКи Р 33 АТФ), 100 нг экспрессируемого бакуловирусом GST-Cdk4/Cyclin D1, подходящую концентрацию ингибитора в буфере (TRIS HCl10 мМ, pH 7,5, MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 50 мкл. Через 40 мин инкубирования при 37 С реакцию останавливают добавлением 20 мкл ЭДТУ 120 мМ. Захват. 60 мкл из каждой лунки переносят на планшет Multiscreen и дают субстрату связаться с фосфоцеллюлозным фильтром. Затем планшеты промывают 3 раза не содержащим Ca/Mg раствором PBS в количестве по 150 мкл на лунку и отфильтровывают с помощью фильтрующей системы- 16010596 Детектирование. Фильтрам дают высохнуть при 37 С, затем добавляют сцинтиллянт в количестве по 100 мкл на лунку и 33 Р-меченный фрагмент Rb определяют путем подсчета радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности MAPK. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 10 мкМ субстрата в виде биотинилированного самим изготовителем MBP (SigmaМ-1891), 15 мкМ АТФ(TRIS HCl 10 мМ, pH 7,5, MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 30 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мклPBS+32 мМ ЭДТУ+0,1% Triton Х-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху Optiplate, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности PKA. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 10 мкМ субстрата в виде биотинилированного самим изготовителем гистона H1 (SigmaН-5505), 10 мкМ АТФ(0,2 мкКи Р 33-АТФ), 0,45 ед. РКА (Sigma2645), ингибитор в буфере (TRIS HCl 10 мМ, pH 7,5, MgCl2 10 мМ, DTT 7,5 мМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 90 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл PBS+32 мМ ЭДТУ+0,1% TritonX-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху Optiplate, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности EGFR. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 10 мкМ субстрата в виде биотинилированного самим изготовителем MBP (SigmaМ-1891), 2 мкМ АТФ(0,04 мкКи Р 33-АТФ), 36 нг экспрессируемого клеткой насекомого GST-EGFR, ингибитор в буфере(Hepes 50 мМ, pH 7,5, MgCl2 3 мМ, MnCl2 3 мМ, DTT 1 мМ, NaVO3 3 мкМ+0,2 мг/мл BSA) с конечным объемом 30 мкл. Через 20 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл PBS+32 мМ ЭДТУ+0,1% Triton Х-100+500 мкМ АТФ, содержащего 1 мг SPA шариков. Затем объем 110 мкл переносят на Optiplate. Через 20 мин инкубирования, с целью захвата субстрата, добавляют 100 мкл 5 М раствора CsCl для стратификации шариков вверху Optiplate, и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности IGF1-R. Анализ ингибирования активности IGF1-R проводят по следующей методике. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном помещают 10 мкМ субстрата в виде биотинилированного MBP (SigmaМ-1891), 0-20 мкМ ингибитора, 6 мкМ АТФ,1 мкКи Р 33-АТФ и 22,5 нг GST-IGF1-R (предварительно инкубированного в течение 30 мин при комнатной температуре вместе с 60 мкМ меченного АТФ) в буфере (50 мМ Hepes, pH 7,9, 3 мМ MnCl2, 1 мМDTT, 3 мкМ NaVO3) с конечным объемом 30 мкл. Через 35 мин инкубирования при комнатной температуре реакцию останавливают добавлением 100 мкл буфера PBS, содержащего 32 мМ ЭДТУ, 500 мкМ холодного АТФ, 0,1% Triton Х-100 и 10 мг/мл SPA шариков, покрытых стрептавидином. Инкубируют в течение 20 мин, отбирают суспензию в количестве 110 мкл и переносят на 96-луночные планшеты Optiplate, содержащие 100 мкл 5 М раствора CsCl. Спустя 4 ч проводят подсчет радиоактивности с помощью измерителя радиоактивности Top-Count компании Packard. Анализ ингибирования активности Aurora-2. Киназная реакция. В каждую лунку 96-луночного планшета с U-образным дном добавляют 8 мкМ биотинилированного пептида (4 повтора LRRWSLG), 10 мкМ АТФ (0,5 мкКи Р 33-АТФ), 15 нг Aurora-2,ингибитор в буфере (HEPES 50 мМ, pH 7,0, MgCl2 10 мМ, 1 мМ DTT, 0,2 мг/мл BSA, 3 мкМ ортованадата) с конечным объемом 30 мкл. Через 30 мин инкубирования при комнатной температуре реакцию останавливают и биотинилированный пептид захватывают, добавляя 100 мкл суспензии шариков. Стратификация. В каждую лунку добавляют 100 мкл 5 М раствора CsCl и оставляют на 4 ч перед подсчетом радиоактивности с помощью прибора Top-Count. Определение величины IC50. См. выше. Анализ ингибирования активности Cdc7/dbf4.- 17010596 Анализ ингибирования активности Cdc7/dbf4 проводят по следующей методике. Субстрат Biotin-MCM2 транс-фосфорилируют с помощью комплекса Cdc7/Dbf4 в присутствии АТФ, меченного с помощью Р 33-АТФ. Фосфорилированный субстрат Biotin-MCM2 затем захватывают покрытыми стрептавидином SPA шариками и степень фосфорилирования оценивают путем подсчета-частиц. Анализ ингибирования активности Cdc7/dbf4 проводят на 96-луночном планшете по следующей методике. В каждую лунку планшета добавляют 10 мкл субстрата (биотинилированный МСМ 2, конечная концентрация 6 мкМ); 10 мкл фермента (Cdc7/Dbf4, конечная концентрация 12,5 нМ); 10 мкл тестируемого соединения (12 возрастающих концентраций в диапазоне от нМ до мкМ для построения кривой зависимости ответной реакции от дозы); 10 мкл смеси немеченного АТФ (конечная концентрация 10 мкМ) и радиоактивного АТФ (1/2500 молярное отношение к немеченному АТФ) затем используют для инициации реакции, которой дают протекать при температуре 37 С. Субстрат, фермент и АТФ разбавляют с помощью раствора 50 мМ Hepes с pH 7,9, содержащего 15 мМ MgCl2, 2 мМ DTT, 3 мкМ NaVO3, 2 мМ глицерофосфата и 0,2 мг/мл BSA. Растворитель, используемый для тестируемого соединения, также содержит 10% ДМСО. После инкубирования в течение 20 мин реакцию останавливают, добавляя в каждую лунку 100 мклPBS с pH 7,4, содержащего 50 мМ ЭДТУ, 1 мМ немеченного АТФ, 0,1% Triton X-100 и 10 мг/мл покрытых стрептавидином SPA шариков. После того как при комнатной температуре в течение 15 мин дают взаимодействовать биотинилированному МСМ 2 с покрытыми стрептавидином SPA шариками, шарики улавливают с помощью 96-луночных фильтрующих планшетов (Unifilter GF/B), используя устройство для сборки клеток компании Packard (Filtermate), промывают дистиллированной водой и затем проводят подсчет с помощью прибора Top Count (Packard). Из данных подсчета вычитают данные контрольной пробы и затем экспериментальные данные (для каждой точки проводят по три эксперимента) анализируют с целью определения величины IC50, используя нелинейный регрессионный анализ (Sigma Plot). В соответствии с вышеуказанными анализами на ингибирование было установлено, что соединения формулы (I) по настоящему изобретению обладают значительной ингибирующей активностью по отношению к cdk. См., например, следующие экспериментальные данные (IC50) двух типичных соединений по настоящему изобретению формулы (Ia) и (Ib), которые были тестированы по отношению кN-[5-(2,2-диметилпропаноил)-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-6 спироциклопропан-3-ил]-4-фторбензамид (IC50 0,025 мкМ). Неожиданно оказалось, что указанная ингибирующая способность значительно превышает ингибирующую способность самого близкого аналога, известного из предшествующего уровня техники вWO 02/12242, в настоящем описании называемого соединением сравнения (см. соединение 1143, внизу с. 76 и пример 19, соединение на развороте с. 242-3 в WO 02/12242), которое используют в целях сравнения и тестируют по отношению к Cdk2/Cyclin А, как указано выше. соединение сравнения: Таким образом, новые соединения по настоящему изобретению неожиданно обладают ингибирующей активностью по отношению к cdk, значительно превышающей ингибирующую активность структурно наиболее близкого аналога, приведенного в WO 02/12242 и, таким образом, обладают преимуществом при использовании в терапии против пролиферативных заболеваний, связанных с измененной киназной активностью, зависящей от клеточного цикла.- 18010596 Соединения по настоящему изобретению могут вводиться в виде индивидуального средства или же в комбинации с известными противораковыми методами лечения, такими как схемы радиационной терапии или химиотерапии вместе с цитостатическими или цитотоксическими средствами, антибиотиками,алкилирующими агентами, антиметаболическими средствами, гормональными средствами, иммунологическими средствами, агентами интерферонового типа, ингибиторами циклооксигеназы (в частности, ингибиторами СОХ-2), ингибиторами матричной металлопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, средствами против рецептора фактора роста, средствами против HER, средствами против EGFR, средствами против ангиогенеза (в частности, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами путей передачи сигнала ras-raf, ингибиторами клеточного цикла,другими ингибиторами cdk, средствами связывания тубулина, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и т.п. При получении в виде определенной дозы в указанной комбинации веществ используют соединения по настоящему изобретению с диапазоне доз, указанном ниже, и другое фармацевтически активное соединение в одобренном диапазоне доз. Соединения формулы (I) могут быть использованы последовательно с известными противораковыми средствами в том случае, когда комбинация в виде композиции невозможна. Соединения формулы (I) по настоящему изобретению, пригодные для введения млекопитающему, в частности людям, могут вводиться обычными способами, и уровень дозы зависит от возраста, массы,состояния пациента и пути введения. Например, подходящее дозирование, принятое для перорального введения соединения формулы (I),может составлять от 10 до 500 мг на дозу от 1 до 5 раз в день. Соединения по настоящему изобретению могут вводиться в виде различных дозированных форм, например перорально в виде таблеток, капсул,покрытых сахаром или пленкой таблеток, жидких растворов или суспензий; ректально в виде суппозиториев; парентерально, в частности внутримышечно или же посредством внутривенной и/или внутриоболочечной, и/или интраспикальной инъекции или вливания. Настоящее изобретение включает также фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым эксципиентом, который может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения по настоящему изобретению, получают обычными способами и вводят в подходящей фармацевтической форме. Например, твердые пероральные формы вместе с активным соединением могут содержать разбавители, в частности лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; лубриканты, в частности оксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие, в частности крахмалы, гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезинтегранты, в частности крахмал, альгиновую кислоту, альгинаты и гликолят натрия крахмала; шипучие смеси; красители; подсластители; смачивающие агенты, такие как лецитин, полисорбаты, лаурилсульфонаты; и в общем случае, нетоксичные и фармацевтически неактивные вещества, используемые в фармацевтических композициях. Указанные фармацевтические препараты могут быть изготовлены известными способами, например путем смешивания, гранулирования, таблетирования, нанесения покрытия из сахара и нанесения покрытия в виде пленки. Жидкие дисперсии для перорального введения могут быть, в частности, сиропами, эмульсиями и суспензиями. Например, сиропы могут содержать в качестве носителя сахарозу и сахарозу с глицерином и/или маннитом или сорбитом. Суспензии и эмульсии могут содержать, в качестве примера носителей, природную смолу, агар,альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут вместе с активным агентом включать фармацевтически приемлемый носитель, в частности стерильную воду, оливковое масло, этилолеат, гликоли, например, пропиленгликоль, и, если необходимо, подходящее количество гидрохлорида лидокаина. Растворы для внутривенной инъекции или внутривенного вливания могут содержать в качестве носителя стерильную воду, или же предпочтительно они могут быть в форме стерильных водных изотонических физиологических растворов, или содержать в качестве носителя пропиленгликоль. Суппозитории вместе с активным соединением могут содержать фармацевтически приемлемый носитель, в частности масло какао, полиэтиленгликоль, сложный эфир жирной кислоты и полиоксиэтилированного сорбитана в качестве поверхностно-активного вещества или лецитин.- 19010596 Следующие примеры приведены с целью лучшего пояснения настоящего изобретения, но не с целью внести в него какие-либо ограничения. Общие методы. Прежде чем рассмотреть методы синтеза конкретных соединений формулы (I) по настоящему изобретению, например, как указано в следующих примерах, следует обратить внимание на то, что некоторые соединения в настоящем описании приведены и обозначены в соответствии с их химическим названием, в то время как большинство других соединений для удобства и однозначности указаны с применением системы кодирования вместе с их данными 1H-ЯМР (см. табл. 3-5) и данными ВЭЖХ/массспектрометрии (см. табл. 6). Каждый код, в частности, идентифицирует единственное конкретное соединение формулы (Ia) или(Ib) и состоит из трех единиц A-M-B.A обозначает любой заместитель R [см. формулу (Ia) или (Ib)] и присоединен к остальной молекуле через группу -NH; каждая конкретная группа A приведена и последовательно пронумерована в приведенной ниже табл. 1. Аналогично, B обозначает любой заместитель R1 [см. формулу (Ia) или (Ib)] и присоединен к остальной молекуле через карбонильную (CO) группу; каждая конкретная группа B приведена и последовательно пронумерована в приведенной ниже табл. 2.M относится к центральному ядру двухвалентного фрагмента, замещенного группами A и B; в частности, M может варьировать от M1 или M2, как указано в приведенных ниже формулах, каждая из которых обозначает центральное ядро соединения, имеющего, соответственно, формулу (Ia) или (Ib) Для того чтобы проще ссылаться на соединения по изобретению, все группы A и B в табл. 1 и 2 идентифицированы с помощью соответствующей химической формулы, где также показаны точки присоединения по отношению к остальной части молекулы M. Таким образом, просто в качестве примера соединение A06-M1-B01 в табл. 3 обозначает соединение формулы (Ia), имеющее центральное ядро M1, которое замещено группой A06 и группой B01 в позициях, указанных стрелками; аналогично, соединение A04-M2-B08 в табл. 5 обозначает соединение формулы (Ib), имеющее центральное ядро M2, которое замещено группой A04 и группой B08 в позициях,указанных стрелками Пример 1. N-(2-Цианоэтил)-2-метилаланин. 50 г (0,48 моль) 2-метилаланина добавляют к охлажденному раствору (вода/лед) NaOH (19,6 г) в воде (100 мл). После того как раствор станет прозрачным, по каплям при охлаждении добавляют 34 мл(0,50 моль) акрилонитрила. Смесь оставляют на ночь. Через 18 ч при охлаждении (вода/лед) добавляют 28 мл уксусной кислоты; выпадает белый осадок; в колбу по каплям добавляют 200 мл 95%-ного этано- 26010596 ла, перемешивание продолжают в течение 1 ч и затем смесь оставляют на 2-3 ч в холодильнике. После фильтрования твердое вещество отделяют и сушат в сушильном шкафу при температуре 80 С. Фильтраты упаривают и остаток растворяют в этаноле (160 мл). При охлаждении получают дополнительное количество продукта, который отфильтровывают и сушат. После первого фильтрования получают 72 г указанного в заголовке соединения. Общий выход 95%.H-ЯМР (400 МГц, ДМСО-d6):7,47 (с, 1H), 2,70 (т, 2H), 2,48 (т, 2H), 1,18 (с, 6H). По аналогичной методике получают следующее соединение: 1-[(2-цианоэтил)амино]циклопропанкарбоновая кислота.H-ЯМР (400 МГц, ДМСО-d6):7,47 (с, 1H), 2,86 (т, 2H, J=6,6 Гц), 2,48 (т, 2H, J=6,6 Гц), 1,09 (дд,2H, J=6,9 Гц, J=4,1 Гц), 0,86 (дд, 2H, J=6,9 Гц, J=4,1 Гц). Пример 2. N-(трет-Бутоксикарбонил)-N-(2-цианоэтил)-2-метилаланин. 44,5 г (0,285 моль) N-(2-цианоэтил)-2-метилаланина и 51,7 г пентагидрата гидроксида тетраметиламмония растворяют в ацетонитриле (2 л) при температуре 40 С и после того, как раствор станет прозрачным, добавляют 112 г Boc2O. Смесь оставляют при 40 С на 24 ч. На следующий день, поддерживая температуру 40 С, дополнительно добавляют еще 20 г Boc2O. По 20 г Вос 2 О добавляют через каждые 8-12 ч, так что общее количество указанного реагента составляет 192 г. Через 4 дня растворитель упаривают, остаток растворяют в воде (1000 мл) и дважды промывают этиловым эфиром (500 мл). Доводят pH водной фракции до 3-4 с помощью лимонной кислоты и экстрагируют этилацетатом, промывают водойH-ЯМР (400 МГц, ДМСО-d6):3,52 (т, 2H, J=6,8 Гц), 2,68 (т, 2H, J=6,8 Гц), 1,18-1,38 (м, 15H). По аналогичной методике получают следующее соединение: 1-[(трет-бутоксикарбонил)(2-цианоэтил)амино]циклопропанкарбоновая кислота.H-ЯМР (400 МГц, ДМСО-d6):12,55 (шир. с, 1H), 3,33 (м, 2H), 2,71 (м, 2H), 0,97-1,63 (м, 13H). Пример 3. Метил-N-(трет-бутоксикарбонил)-N-(2-цианоэтил)-2-метилаланинат. 62 г (0,23 моль) N-(трет-бутоксикарбонил)-N-(2-цианоэтил)-2-метилаланина растворяют в 350 мл ДМФА и добавляют 50 г KHCO3. По прошествии нескольких минут по каплям добавляют 30 мл метилйодида (MeI) и смесь перемешивают при комнатной температуре в течение 6 ч. Затем дополнительно добавляют 15 мл MeI. Смесь оставляют на ночь при комнатной температуре. После разбавления 1,5 л воды раствор экстрагируют этилацетатом (3 раза). Органическую фазу промывают небольшим количеством воды, сушат над сульфатом натрия, упаривают и сушат с помощью механического насоса. Получают 60,5 г (97%) метил-N-(трет-бутоксикарбонил)-N-(2-цианоэтил)-2-метилаланината.H-ЯМР (400 МГц, ДМСО-d6):3,55 (м, 5H), 2,70 (т, 2H, J=6,7 Гц), 1,40 (с, 6H), 1,36 (с, 9H). По аналогичной методике получают следующее соединение: метил-1-[(трет-бутоксикарбонил)(2-цианоэтил)амино]циклопропанкарбоксилат.(240 мл) в атмосфере азота и добавляют 7,9 г гидрида натрия. Смесь кипятят с обратным холодильником в течение 6 ч (температура внутри 120 С) и затем оставляют на ночь при комнатной температуре (ТСХ:CH2Cl2/EtOH 90/10). Растворитель упаривают, добавляют воду (1000 мл) и доводят pH смеси до 3-4 с помощью лимонной кислоты. Водный слой четыре раза экстрагируют этилацетатом, экстракты промывают ограниченным количеством воды и упаривают. Остаток растворяют в гексане, упаривают и перекристаллизовывают из гексана. Получают 33,1 г трет-бутил-4-циано-3-гидрокси-2,2-диметил-2,5-дигидро-1H-пиррол-1 карбоксилата (выход: 85%).H-ЯМР (400 МГц, ДМСО-d6):4,06-4,10 (2c, 2H, конформеры), 1,48 (с, 6H), 1,47 (с, 9H). По аналогичной методике получают следующее соединение: трет-бутил-6-циано-7-оксо-4-азаспиро[2.4]гептан-4-карбоксилат.(0,134 моль) добавляют к 430 мл абсолютного этанола. К полученному раствору добавляют 9 мл(0,18 моль) гидразингидрата и затем 12 мл ледяной уксусной кислоты (1,5 экв.). Смесь перемешивают при температуре 60 С в течение 60 ч, этанол удаляют, остаток растворяют в 400 мл раствора бикарбоната натрия и несколько раз экстрагируют этилацетатом, чтобы полностью экстрагировать требуемый продукт. Органические фазы сушат и упаривают. После очистки флэш-хроматографией (элюент:H-ЯМР (400 МГц, ДМСО-d6):4,06-4,10 (2 с, 2H, конформеры), 1,48 (2 с, 6H, конформеры), 1,47 (с,9H, конформеры). По аналогичной методике получают следующее соединение: трет-бутил-3-амино-2,6-дигидропирроло[3,4-с]пиразол-6-спироциклопропан-5(4H)-карбоксилат.N,N-диизопропилэтиламином (50 мл) и затем по каплям добавляют ClCO2Et (4,65 мл, 1 экв.). По прошествии 90 мин растворитель разбавляют с помощью EtOAc (1 л), промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и упаривают. Неочищенный продукт очищают флэшхроматографией (гексан/EtOAc 2/8) и получают 7,3 г 5-трет-бутил-2-этил-3-амино-6,6 диметилпирроло[3,4-с]пиразол-2,5(4H,6H)-дикарбоксилата в виде основного соединения с выходом 38% вместе с 5,7 г 5-трет-бутил-1-этил-3-амино-6,6-диметил-4,6-дигидропирроло[3,4-с]пиразол-1,5 дикарбоксилата с выходом 30%. 5-трет-Бутил-2-этил-3-амино-6,6-диметилпирроло[3,4-с]пиразол-2,5(4H,6H)-дикарбоксилат.(м, 6H), 1,41-1,44 (2 с, 9H, конформеры), 1,27 (т, 3H, J=7,1 Гц). По аналогичной методике получают следующие соединения: 5-трет-бутил-2-этил-3-аминопирроло[3,4-с]пиразол-6-спироциклопропан-2,5(4H,6H)дикарбоксилат.(т, 3H, J=7,0 Гц). Пример 7. 5-трет-Бутил-1-этил-3-[(4-фторбензоил)амино]-6,6-диметил-4,6-дигидропирроло[3,4 с]пиразол-1,5-дикарбоксилат. 5-трет-Бутил-1-этил-3-амино-6,6-диметил-4,6-дигидропирроло[3,4-с]пиразол-1,5-дикарбоксилат (2,0 г,6,16 ммоль) растворяют в ТГФ (40 мл), сначала обрабатывают N,N-диизопропилэтиламином (5,4 мл,30,80 ммоль) и затем по каплям при 0 С добавляют 4-фторбензоилхлорид (800 мкл, 6,77 ммоль), растворенный в ТГФ (8 мл). Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, концентрируют и растворяют в DMC, промывают насыщенным водным раствором бикарбоната натрия и затем насыщенным раствором соли. Органическую фазу сушат над сульфатом натрия, упаривают и остаток очищают флэш-хроматографией (гексан/EtOA 80/20), получая 2,5 г указанного в заголовке соединения с выходом 90%.- 28010596 По аналогичной методике получают следующие соединения: 5-трет-бутил-2-этил-3-[(4 фторбензоил)амино]-6,6-диметилпирроло[3,4-с]пиразол-2,5(4H,6H)дикарбоксилат.H-ЯМР (400 МГц, ДМСО-d6):10,81 (с, 1H), 7,95-8,06 (м, 2H), 7,39-7,49 (м, 2H), 4,67 (ушир.с, 2H),4,41 (кв., 2H, J=7,1 Гц), 1,80-2,10 (м, 2H), 1,41 (с, 9H), 1,32 (т, 3H, J=7,1 Гц), 0,93-1,06 (м, 2H). Пример 8. 5-трет-Бутил-1-этил-3-([(3-фторфенил)амино]карбониламино)-6,6-диметил-4,6 дигидропирроло[3,4-c]пиразол-1,5-дикарбоксилат. 5-трет-Бутил-1-этил-3-амино-6,6-диметил-4,6-дигидропирроло[3,4-с]пиразол-1,5-дикарбоксилат (3,0 г,9,24 ммоль) растворяют в безводном ТГФ, добавляют при комнатной температуре 3-фторфенилизоцианат(1,4 г, 10,21 ммоль, 1,1 экв.) и перемешивают в течение ночи. На следующий день реакционную смесь упаривают, растворяют остаток в DCM и промывают насыщенным раствором соли. Органическую фазу сушат над сульфатом натрия и упаривают досуха. После очистки флэш-хроматографией (CH2Cl2/MeOH 90/10) получают 3,05 г (выход 71%) указанного в заголовке соединения.-40 С добавляют раствор 5-трет-бутил-1-этил-3-амино-6,6-диметил-4,6-дигидропирроло[3,4-с]пиразол 1,5-дикарбоксилата (1,5 г, 4,62 ммоль) в тетрагидрофуране (50 мл) и N,N-диизопропилэтиламин (1,8 мл,2,2 экв.). Через 3 ч добавляют раствор пиперидина (690 мкл, 1,5 экв.) и N,N-диизопропилэтиламина(1,2 мл, 1,5 экв.) в тетрагидрофуране (25 мл). Дают реакционной смеси в течение 2 ч нагреться до комнатной температуры (ТСХ: EtOAc/гексан 90/10). После выпаривания растворителя твердое вещество растворяют в DCM и раствор промывают насыщенным раствором соли, органическую фазу сушат над сульфатом натрия и концентрируют. Твердое вещество очищают флэш-хроматографией (элюент:EtOAc/гексан 50/50). Полученное твердое вещество растирают в диизопропиловом эфире и получают 1,45 г указанного в заголовке соединения с выходом 72%.H-ЯМР (400 МГц, ДМСО-d6):9,36 (с, 1H), 4,46 (м, 4H), 3,40 (м, 4H), 1,76 (2 с, 6H), 1,54 (м, 6H),1,44 (2 с, 9H, конформеры), 1,36 (т, 3H, J=7,1 Гц). Пример 10. Гидрохлорид этил-3-[(4-фторбензоил)амино]-6,6-диметил-5,6-дигидропирроло[3,4 с]пиразол-1(4H)карбоксилата. 5-трет-Бутил-1-этил-3-[(4-фторбензоил)амино]-6,6-диметил-4,6-дигидропирроло[3,4-с]пиразол-1,5 дикарбоксилат (2,5 г, 5,59 ммоль) растворяют в диоксане (50 мл) и обрабатывают 4 М раствором НСl в диоксане (28 мл, 20 экв.). После нагревания при 40 С в течение 2 ч (ТСХ: CH2Cl2/MeOH 90/10) реакционную смесь концентрируют, к остатку добавляют диэтиловый эфир и отфильтровывают, получая указанное в заголовке соединения (2,09 г) в виде твердого вещества с выходом 98%.H-ЯМР (400 МГц, ДМСО-d6):11,28 (с, 1H), 8,06-8,11 (м, 2H), 7,28-7,34 (м, 2H), 4,40 (кв., 2H, J=7,1 Гц), 3,92 (с, 2H), 1,42 (с, 6H), 1,33 (т, 3H, J=7,1 Гц). По аналогичной методике получают следующие соединения: гидрохлорид этил-3-[(4 фторбензоил)амино]-6,6-диметил-5,6-дигидропирроло[3,4-с]пиразол-2(4H)карбоксилата.H-ЯМР (400 МГц, ДМСО-d6):10,92 (с, 1H), 9,89 (с, 1H), 8,02 (м, 2H), 7,49 (м, 2H), 4,61 (с, 2H),4,51 (кв., 2H, J=7,1 Гц), 1,69 (с, 6H), 1,39 (т, 3H, J=7,1 Гц). По аналогичной методике получают следующее соединение: гидрохлорид этил-3-[(4-фторбензоил)амино]-5,6-дигидропирроло[3,4-с]пиразол-6-спироциклопропан-2(4H)карбоксилата.N,N-диизопропилэтиламин (1,6 мл, 9,2 ммоль, 1,6 экв.) и пивалоилхлорид (780 мкл, 6,3 ммоль, 1,1 экв.). Дают реакционной смеси постепенно нагреться до комнатной температуры и перемешивают в течение ночи (ТСХ: CH2Cl2/EtOAc 90/10). Реакционную смесь промывают насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органическую фазу сушат над сульфатом натрия, упаривают и очищают флэш-хроматографией (элюент: CH2Cl2/EtOAc 90/10), получая 2,03 г указанного в заголовке соединения с выходом 82%.(кв., 2H, J=7,1 Гц), 1,80 (с, 6H), 1,33 (т, 3H, J=7,1 Гц), 1,22 (с, 9H). По аналогичной методике получают следующее соединение: этил-5-(2,2-диметилпропаноил)-3-[(4-фторбензоил)амино]-5,6-дигидропирроло[3,4-с]пиразол-6 спироциклопропан-2(4H)карбоксилат.(ушир.с, 2H), 4,42 (кв., 2H, J=7,1 Гц), 2,33 (дд, 2H, J=6,8 Гц, J=4,2 Гц), 1,32 (т, 3H, J=7,1 Гц), 1,22 (с, 9H),0,90 (дд, 2H, J=6,8 Гц, J=4,2 Гц). Пример 12. N-[5-(2,2-Диметилпропаноил)-6,6-диметил-1,4,5,6-тетрагидропирроло[3,4-с]пиразол-3 ил]-4-фторбензамид. Этил-5-(2,2-диметилпропаноил)-3-[(4-фторбензоил)амино]-6,6-диметил-5,6-дигидропирроло[3,4-с]пиразол-1(4H)карбоксилат (2,0 г, 4,64 ммоль) растворяют в метаноле (60 мл), добавляют TEA (6,45 мл,46,4 ммоль, 10 экв.) и перемешивают в течение ночи при комнатной температуре (ТСХ: CH2Cl2/MeOH 95/5). После упаривания к полученному твердому веществу добавляют смесь диэтиловый эфир/гексан и отфильтровывают, получая 1,43 г указанного в заголовке соединения с выходом 86%.(м, 2H), 4,66-4,92 (шир. с, 2H), 1,64 (с, 6H), 1,21 (с, 9H). По аналогичной методике получают следующие соединения: N-[5-(2,2-диметилпропаноил)-2,4,5,6 тетрагидропирроло[3,4-с]пиразол-6-спироциклопропан-3-ил]-4-фторбензамид.D-25,9 (с=0,76, MeOH). Пример 13. Метиловый эфир 4-(1-метилпиперидин-4-илокси)бензойной кислоты. К раствору 1-метилпиперидин-4-ола (6,8 г, 59 ммоль), PPh3 (трифенилфосфин, 15,5 г, 59 ммоль) и метилового эфира 4-гидроксибензойной кислоты (6 г, 39 ммоль) в ТГФ (150 мл) при 0 С медленно добавляют раствор диэтилазодикарбоксилата (9,5 мл, 59 ммоль) в ТГФ (30 мл). В течение 24 ч дают реакционной смеси нагреться до комнатной температуры. Затем реакционную смесь упаривают и остаток вновь растворяют в 5%-ном водном растворе лимонной кислоты (700 мл). Раствор промывают этилацетатом (3250 мл), подщелачивают концентрированным раствором NH4OH (pH 8) и экстрагируют дихлорметаном (3250 мл). Дихлорметановые экстракты объединяют и промывают насыщенным раствором соли, сушат и упаривают, получая масло, которое очищают флэш-хроматографией на силикагеле,используя дихлорметан-MeOH (90:10) в качестве элюента, и получают указанное в заголовке соединение в виде масла желтого цвета (7,4 г, 75%).
МПК / Метки
МПК: A61P 25/28, A61K 31/4162, A61P 35/00, A61P 17/00, C07D 231/00, C07D 487/04, C07D 487/00
Метки: производные, пирролопиразольные, ингибиторов, качестве, киназы, замещённые
Код ссылки
<a href="https://eas.patents.su/30-10596-zameshhyonnye-pirrolopirazolnye-proizvodnye-v-kachestve-ingibitorov-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые пирролопиразольные производные в качестве ингибиторов киназы</a>
Предыдущий патент: Производные простагландинов
Следующий патент: Разделительное покрытие для модельной оснастки
Случайный патент: Молекулы распознавания на клеточной поверхности, содержащие иммуноглобулиновый домен












