Производные простагландинов
Номер патента: 10595
Опубликовано: 30.10.2008
Авторы: Дель Сольдато Пьеро, Бенедини Франческа, Онджини Эннио, Кироли Валерио
Формула / Реферат
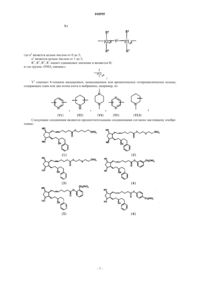
1. Соединение общей формулы (I), или его фармацевтически приемлемая соль, или стереоизомер

где R означает остаток простагландина формулы (II)
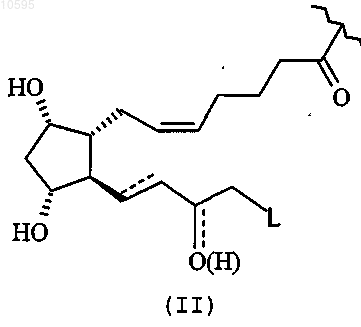
где символ ![]() означает одинарную связь или двойную связь;
означает одинарную связь или двойную связь;
L выбран из следующих групп:
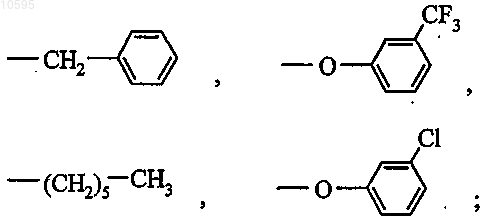
X означает -O-, -S- или -NH-;
Y означает двухвалентный радикал, имеющий следующее значение:
а) C1-C20алкилен с прямой или разветвленной цепью, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена, гидроксигруппы,
-ONO2 или T, где T означает -OC(O)(C1-C10алкил)-ONO2 или -О(C1-C10алкил)-ONO2;
циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10алкил с прямой или разветвленной цепью;
b)
d)
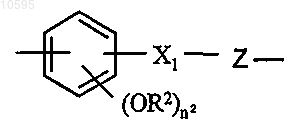
где X1=-OCO- или -COO- и R2 означает Н или CH3;
Z означает -(CH)n1- или двухвалентный радикал, определенный выше в п.b);
n1 имеет значение, определенное выше, и n2 является целым числом от 0 до 2;
e)
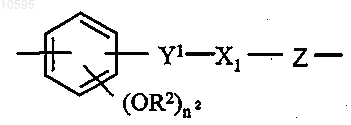
где Y1 означает -CH2-CH2-(CH2)n2- или -CH=CH-(CH2)n2-;
Z означает -(CH)n1- или двухвалентный радикал, определенный выше в п.b);
n1, n2, R2 и X1 имеют значения, определенные выше;
при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-е), группа -ONO2 связана с группой -(CH2)n1-;
g)
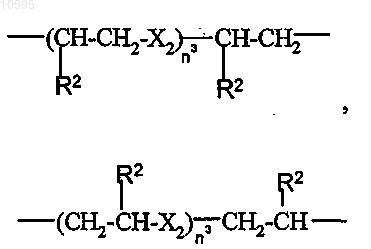
где Х2 означает -О- или -S-;
n3 является целым числом от 1 до 6 и R2 имеет значение, определенное выше.
2. Соединение общей формулы (I) по п.1 или его фармацевтически приемлемая соль или стереоизомер, в котором R, L, X имеют значения, определенные в п.1, и Y означает двухвалентный радикал, имеющий следующее значение:
а) C1-C20алкилен с прямой или разветвленной цепью, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена, гидроксигруппы,
-ONO2 или Т, где Т означает -OC(O)(C1-C10алкил)-ONO2 или -O(C1-C10алкил)-ONO2;
циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10алкил с прямой или разветвленной цепью;
b)

d)
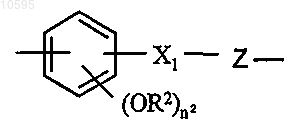
где n1 имеет значение, определенное выше, и n2 является целым числом от 0 до 2;
X1=-OCO- или -COO- и R2 означает Н или CH3;
e)
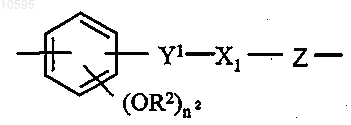
где n1, n2, R2 и X1 имеют значения, определенные выше;
Y1 означает -CH2-CH2- или -CH=CH-(CH2)n2-;
при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-e), группа -ONO2 связана с группой -(CH2)n1-;
g)
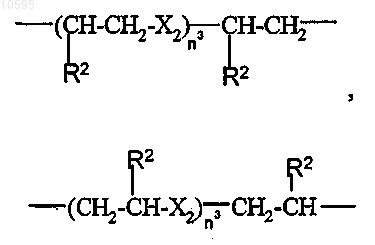
где Х2 означает -О- или -S-;
n3 является целым числом от 1 до 6 и R2 имеет значение, определенное выше;
3. Соединение общей формулы (I) по п.1 или 2, в котором L выбран из следующих групп:
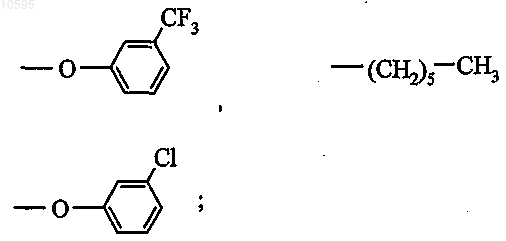
4. Соединение общей формулы (I) по любому из пп.1-3, в котором остаток R выбран из группы, состоящей из травопроста, унопростона и клопростенола.
5. Соединение общей формулы (I) по п.1 или 2, в котором остаток R означает латанопрост.
6. Соединение общей формулы (I) по любому из пп.1-5, в котором X означает -О- или -S-.
7. Соединение общей формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал, имеющий следующее значение:
а) C2-C6алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или Т, где Т имеет значение, определенное в п.1;
b)

где n является целым числом от 0 до 5 и n1 является целым числом от 1 до 5;
g)
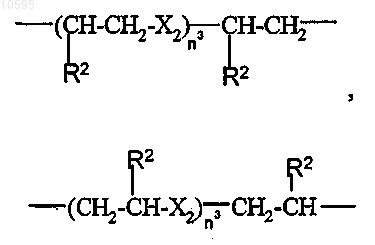
где Х2 означает -О- или -S-;
n3 равно 1;
R2 имеет значение, определенное в п.1.
8. Соединение общей формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал, имеющий следующее значение:
а) C2-C6алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или T, где T имеет значение, определенное в п.1;
b)

где n равно 0 и n1 равно 1;
g)
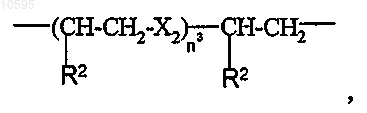
где Х2 означает -О- или -S-;
n3 равно 1;
R2 означает водород.
9. Соединение формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал, имеющий следующее значение:
d)
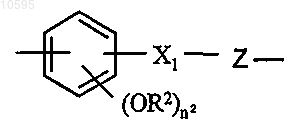
где X1=-OCO- или -COO- и R2 означает Н или CH3;
Z означает -(CH)n1- или двухвалентный радикал, определенный в п.1 (значение b), где n является целым числом от 0 до 5; n1 является целым числом от 1 до 5 и n2 является целым числом от 0 до 2;
e)
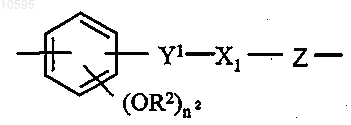
где Y1 означает -CH2-CH2-(CH2)n2- или -CH=CH-(CH2)n2-;
Z означает -(CH)n1-или двухвалентный радикал, определенный выше в п.b);
n1, n2, R2 и X1 имеют значения, определенные выше;
при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-е), группа -ONO2 связана с группой -(CH2)n1.
10. Соединение по п.1, выбранное из группы, состоящей из
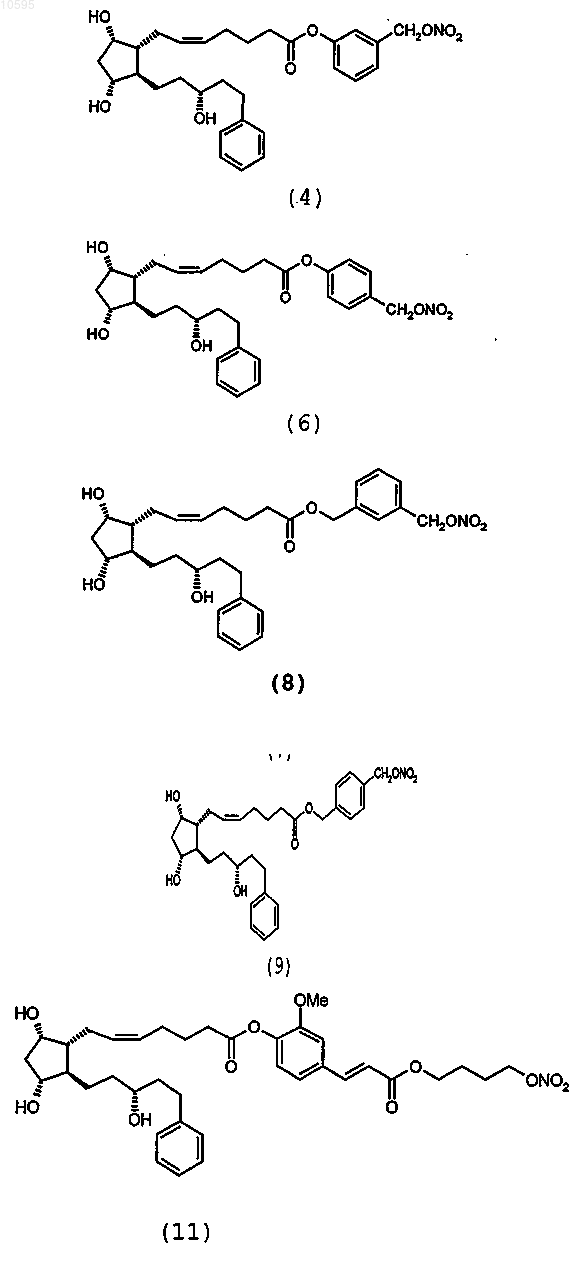

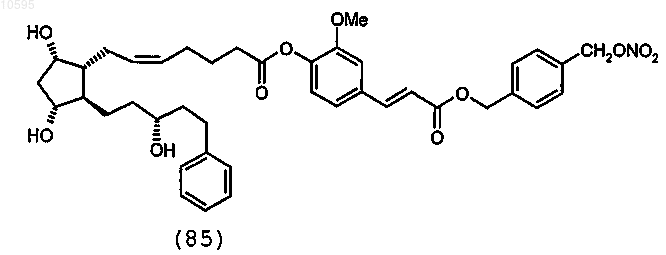
11. Способ получения соединения общей формулы (I) по п.1, включающий:
i) взаимодействие соединения формулы (III)
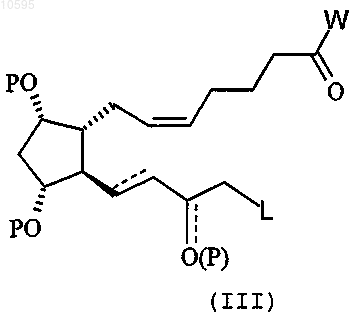
где L имеет значение, определенное в п.1;
P означает Н или защитную группу гидроксила;
W означает -OH, Cl или -OC(O)R1, где R1 означает линейный или разветвленэыщ C1-C5алкил;
с соединением формулы (IV) Z-Y-Q, где Y имеет значение, определенное в п.1, Z означает НХ или Z1, при этом X имеет значение, определенное в п.1, и Z1 выбран из группы, состоящей из хлора, брома, йода, мезила, тозила;
Q означает -ONO2 или Z1;
ii) когда Q означает Z1, превращение соединения, полученного на стадии i), в нитропроизводное в результате взаимодействия с источником нитрата и
iii) необязательно удаление защиты соединений, полученных на стадии i) или ii).
12. Соединение общей формулы (I) по пп.1-10, предназначенное для применения в качестве лекарственного средства.
13. Применение соединения по пп.1-10 для получения лекарственного средства для лечения глаукомы и гипертензии глаза.
14. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения общей формулы (I), и/или его соли, или стереоизомера по пп.1-10.
15. Фармацевтическая композиция по п.14 в форме, пригодной для местного введения.
16. Фармацевтическая композиция по пп.14, 15, предназначенная для лечения глаукомы и гипертензии глаза.
17. Фармацевтическая композиция по пп.15, 16, содержащая соединение общей формулы (I), форма введения которого представляет собой раствор, суспензию или эмульсию в офтальмологически приемлемом наполнителе.
18. Способ лечения глаукомы или гипертензии глаза, заключающийся в том, что осуществляют контакт глаза с эффективно снижающим внутриглазное давление количеством фармацевтической композиции по пп.14-17, чтобы уменьшить глазное давление и поддерживать указанное давление на пониженном уровне.
19. Фармацевтическая композиция, содержащая смесь соединения формулы (I) по п.1 и (i) b-блокатора, или (ii) ингибитора карбоангидразы, или (iii) адренергического агониста или его нитрооксипроизводного.
20. Фармацевтическая композиция, содержащая смесь соединения формулы (I) по п.1 и тимола или его нитрооксипроизводного.
Текст
010595 Настоящее изобретение относится к новым производным простагландинов. Более конкретно, настоящее изобретение относится к нитрооксипроизводным простагландинов, к содержащим их фармацевтическим композициям и их применению в качестве лекарственных средств для лечения глаукомы и гипертензии глаза. Глаукома представляет собой повреждение оптического нерва, часто связанное с повышенным внутриглазным давлением (IOP), которое приводит к прогрессирующей, необратимой потере зрения. Почти 3 млн человек в Соединенных Штатах и 14 млн человек во всем мире имеют глаукому; это третья основная причина слепоты в мире. Глаукома возникает в том случае, когда нарушение баланса выработки и оттока жидкости в глазу(водянистой влаги) приводит к увеличению глазного давления до опасных уровней. Известно, что повышенное IOP, по меньшей мере, частично можно регулировать введением лекарственных средств, которые либо уменьшают выработку водянистой влаги в глазу, либо увеличивают отток жидкости, такие как -блокаторы, -агонисты, холинергические агенты, ингибиторы карбоангидразы или аналоги простагландина. С лекарственными средствами, обычно используемыми для лечения глаукомы, связано несколько побочных эффектов. Использование -блокаторов для местного применения приводит к серьезным побочным эффектам в легких, депрессии, утомлению, спутанности сознания, импотенции, выпадению волос, сердечной недостаточности и брадикардии.-Агонисты для местного применения имеют довольно высокую частоту возникновения аллергических или токсических реакций; холинергические агенты для местного применения (миотические средства) могут вызывать зрительные побочные эффекты. Побочные эффекты, связанные с пероральными ингибиторами карбоангидразы, включают утомление, анорексию, депрессию, парестезию и аномалии уровня электролитов в сыворотке (The Merck Manualof Diagnosis and Therapy, Seventeenth Edition, M.H. Beers and R. Berkow Editors, Sec. 8, Ch. 100). Наконец, топические аналоги простагландинов (биматопрост, латанопрост, травопрост и унопростон), используемые при лечении глаукомы, могут вызывать офтальмологические побочные эффекты,такие как повышенная пигментация радужной оболочки, раздражение глаза, гиперемия конъюнктивы,воспаление радужной оболочки глаза, увеит и отек пятна (Martindale, Thirty-third edition, p. 1445). В патенте США 3922293 описаны монокарбоксиацилаты простагландинов F-типа и их 15-изомеры в положении C-9 и способы их получения; в патенте США 6417228 описаны 13-азапростагландины, обладающие функциональной активностью агонистов рецептора PGF2, и их применение при лечении глаукомы и гипертензии глаза. В заявке на выдачу патента WO 90/02553 описано применение производных простагландинов PGA,PGB, PGE и PGF, в которых омега-цепь содержит циклическую структуру, для лечения глаукомы или гипертензии глаза. В WO 00/51978 описаны новые нитрозированные и/или нитрозилированные простагландины, в частности новые производные PGE1, новые композиции и их применение для лечения половых дисфункций. В патенте США 5625083 описаны динитроглицериновые сложные эфиры простагландинов, которые могут быть использованы в качестве сосудорасширяющих средств, противогипертонических сердечно-сосудистых средств или бронхорасширяющих средств. В патенте США 6211233 описаны соединения общей формулы A-X1-NO2, где A содержит остаток простагландина, в частности PGE1, а X1 означает бивалентный связывающий мостик, и их применение для лечения импотенции. Объектом настоящего изобретения являются новые производные простагландинов, способные не только исключить или, по меньшей мере, уменьшить побочные эффекты, связанные с такими соединениями, но также обладающие улучшенной фармакологической активностью. Неожиданно обнаружено,что нитропроизводные простагландинов имеют значительно улучшенный общий профиль по сравнению с нативными простагландинами как в смысле более широкой фармакологической активности, так и улучшенной переносимости. В частности, установлено, что нитропроизводные простагландинов согласно настоящему изобретению могут быть использованы для лечения глаукомы и гипертензии глаза. Соединения согласно настоящему изобретению показаны для уменьшения внутриглазного давления у пациентов с открытоугольной глаукомой или с хронической закрытоугольной глаукомой, которые перенесли периферическую иридотомию или лазерную иридопластику. Поэтому объектом настоящего изобретения являются нитропроизводные простагландинов общей формулы (I) и их фармацевтически приемлемые соли или стереоизомеры где R означает остаток простагландина формулы (II) означает одинарную связь или двойную связь; где символL выбран из следующих групп:Y означает двухвалентный радикал, имеющий следующее значение: а) C1-C20 алкилен с прямой или разветвленной цепью, предпочтительно C1-C10, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена,гидроксигруппы, -ONO2 или T, где T означает -OC(O) (C1-C10 алкил)-ONO2 или -О(C1-C10 алкил)-ONO2; циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10 алкил с прямой или разветвленной цепью, предпочтительно CH3; где n является целым числом от 0 до 20 и n1 является целым числом от 1 до 20;Z означает -(CH)n1- или двухвалентный радикал, определенный выше в п.b),n1 имеет значение, определенное выше и n2 является целым числом от 0 до 2;R3 означает Н или -COCH3; при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-f), концевая группаn3 является целым числом от 1 до 6, предпочтительно от 1 до 4; где n4 является целым числом от 0 до 10;n5 является целым числом от 1 до 10;R4, R5, R6, R7 являются одинаковыми или разными и означают Н или C1-C4 алкил с прямой или разветвленной цепью, предпочтительно R4, R5, R6, R7 означают Н; где группа -ONO2 связана сY2 означает гетероциклическое насыщенное, ненасыщенное или ароматическое 5- или 6-членное кольцо, содержащее один или несколько гетероатомов, выбранных из азота, кислорода, серы, и выбран из Термин C1-C20 алкилен в контексте данного описания относится к C1-C20 углеводороду с разветвленной или прямой цепью, предпочтительно имеющему от 1 до 10 атомов углерода, такому как метилен,этилен, пропилен, изопропилен, н-бутилен, пентилен, н-гексилен и т.п. Термин C1-C10 алкил в контексте данного описания относится к алкильным группам с разветвленной или прямой цепью, содержащим от одного до десяти атомов углерода, включая метил, этил,н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил, октил и т.п. Термин циклоалкилен в контексте данного описания относится к циклу, имеющему от 5 до 7 атомов углерода, включая, но не ограничивая указанным, циклопентилен, циклогексилен, необязательно замещенный боковыми цепями, такими как (C1-C10)алкил с прямой или разветвленной цепью, предпочтительно CH3. Термин гетероциклический в контексте данного описания относится к насыщенному, ненасыщенному или ароматическому 5- или 6-членному циклу, содержащему один или несколько гетероатомов,выбранных из азота, кислорода, серы, такому как, например, пиридин, пиразин, пиримидин, пирролидин,морфолин, имидазол и т.п.-3 010595 Как указано выше, изобретение также относится к фармацевтически приемлемым солям соединений формулы (I) и их стереоизомерам. Примерами фармацевтически приемлемых солей являются либо соли неорганических оснований,таких как гидроксиды натрия, калия, кальция и алюминия, либо органических оснований, таких как лизин, аргинин, триэтиламин, дибензиламин, пиперидин и другие приемлемые органические амины. Соединения согласно настоящему изобретению в том случае, когда они содержат в молекуле один солеобразующий атом азота, могут быть преобразованы в соответствующие соли в результате взаимодействия в органическом растворителе, таком как ацетонитрил, тетрагидрофуран, с соответствующими органическими или неорганическими кислотами. Примерами органических кислот являются щавелевая, винная, малеиновая, янтарная, лимонная кислоты. Примерами неорганических кислот являются азотная, хлористоводородная, серная, фосфорная кислоты. Предпочтительны соли с азотной кислотой. Соединения согласно изобретению, которые имеют один или несколько асимметричных атомов углерода, могут существовать в виде оптически чистых энантиомеров, чистых диастереомеров, смесей энантиомеров, смесей диастереомеров, рацемических смесей энантиомеров, рацематов или рацемических смесей. В объем изобретения также входят все возможные изомеры, стереоизомеры и их смеси соединений формулы (I), включая смеси, обогащенные конкретным изомером. Предпочтительными соединениями формулы (I) являются соединения, в которых R, L, X имеют значения, определенные в п.1, и Y означает двухвалентный радикал, имеющий следующее значение: а) C1-C20 алкилен с прямой или разветвленной цепью, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена, гидроксигруппы,-ONO2 или T, где T означает -OC(O)(C1-C10 алкил)-ONO2 или -O(C1-C10 алкил)-ONO2; циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10 алкил с прямой или разветвленной цепью; где n является целым числом от 0 до 20 и n1 является целым числом от 1 до 20; где n1 имеет значение, определенное выше, и n2 является целым числом от 0 до 2;R3 означает H или -COCH3; при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-f), группа -ONO2 связана с группойn3 является целым числом от 1 до 6 и R2 имеет значение, определенное выше; где n4 является целым числом от 0 до 10;n5 является целым числом от 1 до 10;R4, R5, R6, R7 являются одинаковыми или разными и означают H или C1-C4 алкил с прямой или разветвленной цепью; где группа -ONO2 связана сY2 означает гетероциклическое насыщенное, ненасыщенное или ароматическое 5- или 6-членное кольцо, содержащее один или несколько гетероатомов, выбранных из азота, кислорода, серы, и выбран из Предпочтительными соединениями формулы (I) являются соединения, в которых остаток простагландина R выбран из группы, состоящей из латанопроста, травопроста, унопростона и клопростенола, предпочтительно R означает латанопрост.X предпочтительно означает -О- или -S-. Предпочтительной группой соединений общей формулы (I) являются соединения, в которых Y означает двухвалентный радикал, имеющий следующее значение: а) C2-C6 алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или T, где T имеет значение, определенное выше; где n является целым числом от 0 до 5;n1 является целым числом от 1 до 5;R2 имеет значение, определенное выше. Наиболее предпочтительными значениями Y являются: а) разветвленный C2-C6 алкилен или C2-C6 алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или T, где T имеет значение, определенное в п.1;R2 означает водород. Другой предпочтительной группой соединений общей формулы (I) являются соединения, в которыхZ означает -(CH)n1- или двухвалентный радикал, определенный выше в п.b), где n является целым числом от 0 до 5;n1 является целым числом от 1 до 5 и n2 является целым числом от 0 до 2; где n1 и R2 имеют значения, определенные выше, R3 означает H или COCH3; при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-f), группа -ONO2 связана с группой -(CH2)n1-; где n4 является целым числом от 0 до 3;n5 является целым числом от 1 до 3;R4, R5, R6, R7 имеют одинаковое значение и являются H; и где группа -ONO2 связана сY2 означает 6-членное насыщенное, ненасыщенное или ароматическое гетероциклическое кольцо,содержащее один или два атома азота и выбранное, например, из Следующие соединения являются предпочтительными соединениями согласно настоящему изобретению: Как указано выше, объектом настоящего изобретения также являются фармацевтические композиции, содержащие, по меньшей мере, соединение согласно настоящему изобретению формулы (I) вместе с нетоксичными адъювантами и/или носителями, обычно используемыми в области фармации. Предпочтительным путем введения является местное введение. Соединения согласно настоящему изобретению можно вводить в виде растворов, суспензий или эмульсий (дисперсий) в офтальмологически приемлемом наполнителе. Термин офтальмологически приемлемый наполнитель в контексте данного описания относится к любому веществу или комбинации веществ, которые не взаимодействуют с соединениями и подходят для введения пациенту. Предпочтительными являются водные наполнители, подходящие для местного применения на глазах пациента. Другие ингредиенты, которые могут быть необходимы для применения в офтальмологических композициях согласно настоящему изобретению, включают противомикробные агенты, консерванты, сорастворители, поверхностно-активные вещества и агенты для получения определенной вязкости. Изобретение также относится к способу лечения глаукомы или гипертензии глаза, при этом указанный способ заключается в осуществлении контакта эффективного количества композиции, снижающего внутриглазное давление, с глазом, чтобы уменьшить глазное давление и чтобы поддерживать указанное давление на пониженном уровне. Дозы нитропроизводных простагландинов могут быть определены стандартными клиническими способами и находятся в таком же диапазоне или ниже, чем дозы, описанные для соответствующих недериватизованных, коммерчески доступных соединений простагландинов, которые описаны в Physician's- 20010595 Композиции содержат 0,1-0,30 мкг, главным образом 1-10 мкг активного соединения в расчете на применение. Лечение преимущественно можно осуществлять, вводя в глаз пациента по одной капле композиции,соответствующей 30 мкг, примерно 1-2 раза в день. Дополнительно предполагается, что соединения согласно настоящему изобретению можно применять с другими лекарственными средствами, которые, как известно, полезны при лечении глаукомы или гипертензии глаза, либо отдельно, либо в комбинации. Например, соединения согласно настоящему изобретению можно комбинировать с (i) -блокаторами, такими как тимолол, бетаксолол, левобунолол и т.п. (см. патент США 4952581); (ii) ингибиторами карбоангидразы, такими как бринзоламид; (iii) адренергическими агонистами, включая производные клонидина, такие как апраклонидин или бримонидин(см. патент США 5811443). Также предполагается комбинация с нитрооксипроизводными указанных выше соединений, например нитрооксипроизводными -блокаторов, таких как соединения, описанные в патенте США 6242432. Соединения согласно настоящему изобретению могут быть синтезированы следующим образом. Способ синтеза. Соединения общей формулы (I), которые определены выше, могут быть получены:i) в результате взаимодействия соединения формулы (III)P означает H или защитную группу гидроксила, такую как силильные эфиры, такие как триметилсилил, трет-бутилдиметилсилил, или ацетил и группы, описанные в T.W. Greene "Protective groups in organic synthesis", Harvard University. Press, 1980, 2nd edition, p. 14-118;W означает -OH, Cl или -OC(O)R1, где R1 означает линейный или разветвленный C1-C5 алкил; с соединением формулы (IV) Z-Y-Q, где Y имеет значение, определенное выше, Z означает HX или Z1,при этом X имеет значение, определенное выше, и Z1 выбран из группы, состоящей из хлора, брома,йода, мезила, тозила;ii) в том случае, когда Q означает Z1, превращением соединения, полученного на стадии i), в нитропроизводное в результате взаимодействия с источником нитрата, таким как нитрат серебра, нитрат лития, нитрат натрия, нитрат калия, нитрат магния, нитрат кальция, нитрат железа, нитрат цинка или нитрат тетраалкиламмония (в котором алкил является C1-C10 алкилом), в подходящем органическом растворителе, таком как ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат, ДМФА, реакцию осуществляют в темноте при температуре от комнатной температуры до температуры кипения растворителя. Предпочтительным источником нитрата является нитрат серебра; иiii) необязательно удалением защиты соединений, полученных на стадии i) или ii), как описано вT.W. Greene "Protective groups in organic synthesis", Harvard University Press, 1980, 2nd edition, p. 68-86. Использование фторид-иона является предпочтительным способом удаления защитной группы в виде силильного эфира. Взаимодействие соединения формулы (III), в которой W=-OH, P и X1 имеют значение, определенные выше, с соединением формулы (IV), в котором Y и Q имеют значения, определенные выше, Z означает НХ, можно осуществить в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид (DCC) или гидрохлорид N'-(3-диметиламинопропил)-N-этилкарбодиимида (EDAC), и катализатора, такого как N,N-диметиламинопиридин (DMAP). Реакцию осуществляют в безводном инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол,диоксан, полигалогенированный алифатический углеводород, при температуре от -20 до 40C. Реакцию завершают в интервале времени от 30 мин до 36 ч. Соединения формулы (III), в которых W=-OH и P=H, являются коммерчески доступными. Соединения формулы (III), в которых W=-OH и P означает защитную группу гидроксила, могут быть получены из соответствующих соединений, в которых P=Н, как хорошо известно в данной области,например, как описано в T.W. Greene "Protective groups in organic synthesis", Harvard University Press,1980, 2nd edition, p. 14-118.- 21010595 Взаимодействие соединения формулы (III), в котором W=-OC(O)R1, где R1 имеет значение, определенное выше, и P=Н или является защитной группой гидроксила, с соединением формулы (IV), в котором Y имеет значение, определенное выше, Z означает -OH и Q означает -ONO2, можно осуществить в присутствии катализатора, такого как N,N-диметиламинопиридин (DMAP). Реакцию осуществляют в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20 до 40C. Реакцию завершают в интервале времени от 30 мин до 36 ч. Соединения формулы (III), в которых W=-OC(O)R1 и P=H, могут быть получены из соответствующих кислот, в которых W=-OH, в результате взаимодействия с хлорформиатом, таким как изобутилхлорформиат, этилхлорформиат, в присутствии ненуклеофильного основания, такого как триэтиламин, в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, полигалогенированный алифатический углеводород при температуре от -20 до 40C. Реакцию завершают в интервале времени от 1 до 8 ч. Взаимодействие соединения формулы (III), в котором W=-OH и P=Н, с соединением формулы (IV),в котором Y имеет значение, определенное выше, Z означает Z1 и Q означает -ONO2, можно осуществить в присутствии органического основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU),N,N-диизопропилэтиламин, диизопропиламин, или неорганического основания, такого как карбонат или гидроксид щелочно-земельного металла, карбонат калия, карбонат цезия, в инертном органическом растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, ацетон, метилэтилкетон, ацетонитрил,полигалогенированный алифатический углеводород, при температуре от -20 до 40C, предпочтительно от 5 до 25C. Реакцию завершают в интервале времени от 1 до 8 ч. Когда Z1 выбран из хлора или брома,реакцию осуществляют в присутствии соединения йода, такого как KI. Взаимодействие соединения формулы (III), в котором W=Cl и P имеет значение, определенное выше, с соединением формулы (IV), в котором Y имеет значение, определенное выше, Z означает -OH и Q означает -ONO2, можно осуществить в присутствии органического основания, такого как N,Nдиметиламинопиридин (DMAP), триэтиламин, пиридин. Реакцию осуществляют в инертном растворителе, таком как N,N'-диметилформамид, тетрагидрофуран, бензол, толуол, диоксан, полигалогенированный алифатический углеводород, при температуре от -20 до 40C. Реакцию завершают в интервале времени от 30 мин до 36 ч. Соединения формулы (III), в которых W=Cl, можно получить из соответствующих кислот, в которых W=-OH, в результате взаимодействия с тионил- или оксалилхлоридом, галогенидами PIII или Pv, в растворителях, таких как толуол, хлороформ, ДМФА. Соединения формулы HO-Y-ONO2, в которых Y имеет значение, определенное выше, могут быть получены следующим образом. Соответствующее производное диола, коммерчески доступное или синтезированное в результате хорошо известных реакций, превращают в HO-Y-Z1, где Z1 имеет значение,определенное выше, в результате хорошо известных реакций, например, в результате взаимодействия с тионил- или оксалилхлоридом, галогенидами PIII или Pv, мезилхлоридом, тозилхлоридом, в инертных растворителях, таких как толуол, хлороформ, ДМФА и т.д. Превращение в нитропроизводное осуществляют как описано выше. Альтернативно производное диола может быть нитрировано в результате взаимодействия с азотной кислотой и уксусным ангидридом в диапазоне температур от -50 до 0C согласно способам, хорошо известным в литературе. Соединения формулы Z1-Y-ONO2, в которых Y и Z1 имеют значения, определенные выше, можно получить из галогенпроизводного Z1-Y-Hal, коммерчески доступного или синтезированного согласно способам, хорошо известным в литературе, превращением в нитропроизводное как описано выше. Соединения формулы H-X-Y-Z1, в которых X, Y и Z1 имеют значения, определенные выше, можно получить из гидроксилпроизводного H-X-Y-OH, коммерчески доступного или синтезированного согласно способам, хорошо известным в литературе, в результате хорошо известных реакций, например, в результате взаимодействия с тионил- или оксалилхлоридом, галогенидами PIII или PV, мезилхлоридом, тозилхлоридом, в инертных растворителях, таких как толуол, хлороформ, ДМФА и т.д. Следующие примеры предназначены для дополнительной иллюстрации изобретения без его ограничения. Пример 1. Синтез 4-(нитроокси)бутилового эфира [1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси-2(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты (соединение 1).II. 1. Получение 4-бромбутанол. Тетрагидрофуран (12,5 г - 173 ммоль) в атмосфере азота загружали в реактор, охлажденный до 5-10C. Затем медленно добавляли бромистый водород (7,0 г, 8 6,5 ммоль) и реакционную смесь перемешивали в течение периода времени, составляющего 4,5 ч, при 5-10C. Смесь разбавляли 22,5 г холодной воды и pH полученного раствора доводили до 5-7 добавлением 27,65% гидроксида натрия (2,0 г),поддерживая температуру при 5-10C. Затем раствор дважды экстрагировали дихлорметаном (13,25 г). Объединенные органически фазы промывали 25% раствором соли (7,5 г), pH доводили до 6-7, используя 27,65% гидроксид натрия и сушили над сульфатом магния. Дихлорметан отгоняли и неочищенный 4-бромбутанол (10,3 г, 66,9 ммоль) получали с выходом примерно 77%.II.2. Получение 4-бромбутилнитрата. В реакторе, охлажденном до температуры от -5 до 5C, медленно добавляли дымящую азотную кислоту (8,5 г, 135 ммоль) к раствору 98% серной кислоты (13,0 г, 130 ммоль) в дихлорметане (18,0 г,212 ммоль). Затем к полученной смеси добавляли 4-бромбутанол (10,2 г, 66,6 ммоль) и реакционную среду перемешивали при температуре от -5 до 5C в течение периода времени 2-5 ч. Смесь быстро вливали в холодную воду (110 г), поддерживая температуру от -5 до 3C. После декантирования верхнюю водную фазу экстрагировали дихлорметаном и объединенные органические фазы промывали водой, доводили до pH 6-7 добавлением 27,65% гидроксида натрия, промывали насыщенным раствором соли и сушили над сульфатом магния. Дихлорметан отгоняли в вакууме и неочищенный 4-бромбутилнитрат(мас./мас.) в метиленхлориде, 1,02 ммоль). Реакционную смесь нагревали и перемешивали в роторном испарителе при 45-50C. Через 1,5 ч ТСХ (Si, CH2Cl2-MeOH, 5%) показала отсутствие исходной кислоты. Реакционную смесь разбавляли 100 мл этилацетата, промывали насыщенным раствором соли(350 мл), сушили над MgSO4 и выпаривали, получая желтоватое масло (420 мг). 1 Н-ЯМР/13C-ЯМР показал наличие целевой молекулы как основного продукта вместе с некоторым количеством исходного 4-бромбутилнитрата и ДМФА. ВЭЖХ показала отсутствие исходной кислоты. Остаточный растворитель, 4-бромбутилнитрат и целевой сложный эфир давали основные пики. Сложный эфир бутилнитрат имел сходный с латанопростом УФ-спектр и ожидаемое относительное время удерживания. Прибор: Bruker 300 МГц. Растворитель: CDCl3. 1A) Получение 4-(бром)бутилового эфира феруловой кислоты. К раствору феруловой кислоты (1 г, 5,15 ммоль) в тетрагидрофуране (40 мл) добавляли трифенилфосфин (2,7 г, 10,3 ммоль) и тетрабромметан (3,41 г, 10,3 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч. Смесь фильтровали и растворитель выпаривали в вакууме. Сырой остаток очищали хроматографией на силикагеле, элюент н-гексан/этилацетат 7/3. Получали продукт(0,77 г) в виде желтого твердого вещества (выход 46%).(50 мл) перемешивали при 40C в темноте в течение 16 ч. Осадок (соли серебра) отфильтровывали и растворитель выпаривали в вакууме. Остаток очищали флэш-хроматографией, элюент н-гексан/этилацетат 75/25. Получали продукт (0,4 г) в виде белого порошка (выход 53%). Т.пл.=63-64C.[1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси-2-(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты. К раствору кислоты латанопроста (0,2 г, 0,51 ммоль) в безводном тетрагидрофуране (10 мл) в инертной атмосфере добавляли 4-(нитроокси)бутиловый эфир феруловой кислоты (0,32 г, 1,02 ммоль) иDMAP (каталитическое количество). Реакционную смесь охлаждали до 0C и добавляли EDAC (0,14 г,0,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Раствор обрабатывали водой и хлороформом, органические слои обезвоживали сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией, элюент н-гексан/этилацетат 3/7. Получали продукт (0,2 г). 1 Н-ЯМР (CDCl3) : 7,55 (1 Н, д, CH=CHCO); 7,30-7,03 (8 Н, м, Ar); 6,35 (1 Н, д, CH=CHCO); 5,48 (2 Н,м, CH=CH); 4,52 (2 Н, т, CH2-ONO2); 4,25 (2H, т, COO-CH2); 4,17 (1 Н, м, CH-OH); 3,95 (1 Н, м, CH-OH); 3,85 (3 Н, с, OCH3); 3,65 (1 Н, м, CH-OH); 2,75 (2 Н, м); 2,61 (2 Н, т); 2,48-2,20 (5 Н, м); 1,9-1,20 (19 Н, м). 13C-ЯМР (CDCl3) м.д: 171,62 (C=О); 166,69 (C=О); 151,40; 144,36; 142,04; 141,55; 133,21; 129,62; 129,41; 128,40; 125,85, 123,27; 121,27; 117,96; 111,32; 78,81; 74,84; 72,64 (C-ONO2); 71,32; 63,61; 55,94; 52,99; 51,91; 42,54; 39,08; 35,79; 33,37; 32,12; 29,68; 27,03; 26,53; 25,09; 24,90; 23,73. Пример 3. Синтез 3-(нитрооксиметил)фенилового эфира [1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси-2-(3 гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты (соединение 4). 1. Получение 3-[(бром)метил]фенола. 3-[(Гидрокси)метил]фенол растворяли в ацетонитриле (300 мл) и дихлорметане (900 мл) и полученную в результате смесь вливали в колбу в атмосфере аргона, включали магнитную мешалку. Затем раствор охлаждали на бане со льдом и добавляли четырехбромистый углерод и трифенилфосфин. Последний добавляли небольшими порциями, чтобы поддерживать температуру примерно 2-3C. Раствор перемешивали в течение 1 ч при 2-3C и затем еще час при комнатной температуре. После указанного периода времени реакционное превращение (проверяемое по ТСХ с использованием в качестве элюента смеси EtOAc/петролейный эфир 3/7) было завершено. Полученную смесь упаривали при пониженном давлении и добавляли 500 мл петролейного эфира и 500 мл EtOAc к полученному в результате желтому густому маслу в круглой колбе объемом 2 л. Образовывалось смолистое твердое вещество. Смесь выдерживали при перемешивании при комнатной температуре в течение ночи и затем фильтровали и концентрировали при пониженном давлении, получая примерно 50 г маслянистого остатка. Масло очищали флэш-хроматографией на 600 г силикагеля, используя в качестве элюента смесьEtOAc/петролейный эфир 2/8. Дополнительную очистку осуществляли кристаллизацией полученного в результате бромида из петролейного эфира. Получали белое твердое вещество (24 г, 64%). Анализ. ТСХ: (EtOAc/петролейный эфир 3/7), Rf=0,4. Чистота по данным ВЭЖХ: 98%;FT-ИК (KBr, см-1): 3252, 1589, 1479, 1392, 1270, 1208, 1155, 952, 880, 791, 741, 686. 2. Получение 3-[(нитроокси)метил]фенола. 3-[(Бром)метил]фенол растворяли в 30 мл ацетонитрила и вливали в колбу, которая находилась вдали от источников света при 0-5C в атмосфере аргона; включали магнитную мешалку. Затем добавляли нитрат серебра при указанных условиях, поддерживая температуру ниже 5C. За ходом реакции следили с помощью ТСХ (EtOAc/петролейный эфир 3/7 в качестве элюента). Через 4 ч 30 мин превращение было завершено. Затем реакционную смесь фильтровали, осажденное твердое вещество промывали Et2O и фильтрат разделяли на две партии. Первую партию (15 мл) хранили в атмосфере аргона и в растворе ацетонитрила при -20C. Вторую партию (15 мл) обрабатывали следующим образом. Раствор ацетонитрила концентрировали при пониженном давлении и полученное в результате масло растворяли в дихлорметане (15 мл) и промывали насыщенным раствором соли (15 мл). Органическую фазу отделяли, а водную фазу дважды экстрагировали дихлорметаном (225 мл). Затем объединенные органические фазы сушили над MgSO4, фильтровали и упаривали. Остаток очищали флэш-хроматографией на 40 г силикагеля, используя в качестве элюента смесь EtOAc/петролейный эфир 2/8. Получали нитрат в виде масла (0,6 г,67%).- 24010595 Анализ. ТСХ: (EtOAc/петролейный эфир 3/7), Rf=0,35. Чистота по данным ВЭЖХ: 98%. МС (ESI-): 168 (М+-1).H-ЯМР (CDCl3, 300 МГц)5,31 (2 Н, с), 5,45 (1 Н, уш.с), 6,78-6,84 (2 Н, м), 6,87-6,92 (1 Н, м), 7,177,24 (1 Н, м). 3. Получение 3-(нитрооксиметил) фенилового эфира [1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси 2-(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты. К раствору кислоты латанопроста (0,11 г, 0,28 ммоль) в хлороформе (20 мл) в инертной атмосфере добавляли 3-(нитрооксиметил)фенол (0,01 г, 0,56 ммоль) и DMAP (каталитическое количество). Реакционную смесь охлаждали до 0C и добавляли EDAC (0,08 г, 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Раствор обрабатывали водой, органические слои обезвоживали сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали флэшхроматографией, элюент н-гексан/этилацетат 3/7. Получали продукт (0,1 г). 1A) 4-(Бромметил) бензиловый эфир [1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси-2-(3-гидрокси-5 фенилпентил)циклопентил]-5-гептеновой кислоты. К раствору кислоты латанопроста (0,5 г, 1,2 ммоль) в хлороформе (50 мл) в инертной атмосфере добавляли 4-(бромметил)бензиловый спирт (0,4 г, 1,92 ммоль) и DMAP (каталитическое количество). Реакционную смесь охлаждали до 0C и добавляли EDAC (0,37 г, 1,92 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Раствор обрабатывали водой, органические слои обезвоживали сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией, элюент н-гексан/этилацетат 3/7. Получали продукт[1R-[1(Z),2(R),3,5-7-[3,5-дигидрокси-2-(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты (соединение 85). Соединение синтезировали, используя способ, описанный в примере 2, начиная с кислоты латанопроста и 4-(нитрооксиметил)бензилового эфира феруловой кислоты. Пример 14. Синтез (4-нитрооксиметил)фенилового эфира [1R-[1(Z),2(R),3,5-7-[3,5 дигидрокси-2-(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты (соединение 6). Соединение синтезировали, используя способ, описанный в примере 4, начиная с 4-(хлорметил)фенилового эфира кислоты латанопроста. Пример 15. Синтез (3-нитрооксиметил)бензилового эфира [1R-[1(Z),2(R),3,5-7-[3,5 дигидрокси-2-(3-гидрокси-5-фенилпентил)циклопентил]-5-гептеновой кислоты (соединение 8). Соединение синтезировали, используя способ, описанный в примере 4, начиная с 4-(бромметил)бензилового эфира кислоты латанопроста. Пример 16. Получение офтальмологической композиции с использованием 4-(нитроокси)бутилового эфираqs. Пример 17. Оценка опосредованной оксидом азота активности. Образование циклического гуанозин-3',5'-монофосфата (cGMP) в клетках глаза вовлечено в регулирование потока водянистой влаги. Таким образом, повышение уровней cGMP приводит к пониженной выработке водянистой влаги и уменьшению внутриглазного давления. Авторы измеряли влияние тестируемых лекарственных средств на образованием cGMP в хорошо разработанном клеточном анализе. Использовали недифференцированные клетки феохромоцитомы (PC12). Клетки в монослое инкубировали в течение 45 мин в сбалансированном солевом растворе Хенка с добавлением 10 мМ Hepes,5 мМ MgCl2 и 0,05% аскорбиновой кислоты с конечным значением pH 7,4 и содержащем 100 мкМ ингибитора фосфодиэстеразы, изометилбутилксантина (IBMX), 30 мкМ ингибитора гуанилилциклазы YC-1 и тестируемые лекарственные средства в соответствующей концентрации. Реакцию останавливали удалением буфера для инкубации с последующим добавлением 50 мкл 100% ледяного этанола. Затем планшет сушили в потоке горячего воздуха и остаток растворяли, экстрагировали и анализировали, используя коммерчески доступный набор для ферментного иммуноанализа циклического cGMP. Результаты представлены в табл. 1. Сопутствующее применение разных концентраций различных нитропроизводных латанопроста (1-50 мкМ) вызывало накопление cGMP зависимым от концентрации образом.- 26010595 Полученные эффекты не являются общими с исходным лекарственным средством латанопростом,свидетельствуя, что такие эффекты зависят от высвобождения экзогенного NO. Таблица 1 Активность и эффективность латанопроста и соответствующих нитропроизводных в отношении накопления cGMP в клеткам феохромоцитомы крысEC50=эффективная концентрация, вызывающая половину максимального ответа. Пример 18. Оценка эффективности действия нитропроизводного латанопроста на внутриглазное давление. В данном исследовании использовали самцов кроликов NZW с массой тела в пределах 3-5 кг. Коротко, способность нитропроизводного латанопроста (соединение 4, пример 3) понижать внутриглазное давление (IOP) тестировали у животных, предварительно обработанных посредством инъекции внутрь камеры 0,25% инсталлирующего раствора карбомера, до тех пор пока не достигали стабильного увеличения внутриглазного давления. В данном конкретном исследовании тестируемые лекарственные средства вводили в один глаз по схеме дозирования 1 капля/глаз/сутки 5 дней в неделю, используя физиологический раствор, содержащий 0,005% контрольного или тестируемого соединений. IOP исследовали через 3 ч после применения лекарственного средства два-три раза в неделю всего в течение 4 недель. Указанную концентрацию выбрали потому, что она соответствует концентрации изопропилового эфира латанопроста, используемого в настоящее время в клинике для лечения повышения IOP, наблюдаемого у пациентов с глаукомой. Кроме того, при каждом посещении собирали примерно 200 мкл водянистой влаги, используя иглу 30 калибра, из обоих глаз при анестезии лидокаином для дальнейшей биохимической оценки содержания cGMP, cAMP и нитрита/нитрата. Инсталляция 0,25% раствора карбомера в глаз приводила к сильному увеличению IOP до примерно 40 мм Hg, которое после этого оставалось стабильным. Однако введение соединения 4 (пример 3) по схеме дозировании, указанной в разделе способы, снижало внутриглазное давление у указанных животных примерно на 50% за 7 дней повторяющихся обработок и более чем на 65% к концу исследования(см. табл. 2). В отличие от этого ни кислота латанопроста (данные не показаны), ни ее изопропильное производное не вызывали никакого заметного изменения (см. табл. 2). Учитывая имеющиеся в литературе документальные подтверждения того, что латанопрост фактически не эффективен у кроликов, наблюдаемые эффекты, по-видимому, связаны с присутствием компонента оксида азота (NO) в нитропроизводном латанопроста, а не исходного соединения. Биохимические измерения cGMP, cAMP и NOx во внутриглазной водянистой влаге дополнительно свидетельствуют о роли NO в снижении IOP у указанных животных. Действительно, как показано в табл. 3, количество cGMP и NOx увеличивалось после применения соединения 4 (пример 3) в ходе 4 недельной обработки. Указанные эффекты оказались высоко специфичными, так как количество внутриглазного cAMP оставалось неизменным у исследованных животных. Изопропиловый эфир латанопроста значимо не влиял ни на уровни cGMP, cAMP, ни на уровни нитритов при введении в эквимолярных дозах по отношению к дозам ответствующего нитропроизводного (см. табл. 3). Таблица 2 Реверсия вызванного карбомером увеличения IOP до (предварительная обработка) и после инсталляции глаза эквимолярными количествами изопропилового эфира латанопроста или соответствующего нитропроизводного Значения для предварительной обработки соответствовали исходному уровню IOP, вызванному внутрикамерной инсталляцией 0,25% раствора карбомера.- 27010595 Таблица 3 Влияние изопропилового эфира латанопроста и соответствующего нитропроизводного на содержание cGMP, cAMP и NOx у обработанных карбомером кроликов Значения для предварительной обработки соответствовали исходному уровню IOP, вызванному внутрикамерной инсталляцией 0,25% раствора карбомера ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I), или его фармацевтически приемлемая соль, или стереоизомер где R означает остаток простагландина формулы (II) означает одинарную связь или двойную связь; где символL выбран из следующих групп:Y означает двухвалентный радикал, имеющий следующее значение: а) C1-C20 алкилен с прямой или разветвленной цепью, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена, гидроксигруппы,-ONO2 или T, где T означает -OC(O)(C1-C10 алкил)-ONO2 или -О(C1-C10 алкил)-ONO2; циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10 алкил с прямой или разветвленной цепью;n1 имеет значение, определенное выше, и n2 является целым числом от 0 до 2;n1, n2, R2 и X1 имеют значения, определенные выше; при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-е), группа -ONO2 связана с группой -(CH2)n1-;n3 является целым числом от 1 до 6 и R2 имеет значение, определенное выше. 2. Соединение общей формулы (I) по п.1 или его фармацевтически приемлемая соль или стереоизомер, в котором R, L, X имеют значения, определенные в п.1, и Y означает двухвалентный радикал,имеющий следующее значение: а) C1-C20 алкилен с прямой или разветвленной цепью, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из атомов галогена, гидроксигруппы,-ONO2 или Т, где Т означает -OC(O)(C1-C10 алкил)-ONO2 или -O(C1-C10 алкил)-ONO2; циклоалкилен с 5-7 атомами углерода в цикле циклоалкилена, при этом цикл необязательно замещен боковыми цепями T1, где T1 означает C1-C10 алкил с прямой или разветвленной цепью; где n1 имеет значение, определенное выше, и n2 является целым числом от 0 до 2;Y1 означает -CH2-CH2- или -CH=CH-(CH2)n2-; при условии, что когда Y выбран из двухвалентных радикалов, указанных в пп.b)-e), группа -ONO2 связана с группой -(CH2)n1-;n3 является целым числом от 1 до 6 и R2 имеет значение, определенное выше;- 29010595 3. Соединение общей формулы (I) по п.1 или 2, в котором L выбран из следующих групп: 4. Соединение общей формулы (I) по любому из пп.1-3, в котором остаток R выбран из группы, состоящей из травопроста, унопростона и клопростенола. 5. Соединение общей формулы (I) по п.1 или 2, в котором остаток R означает латанопрост. 6. Соединение общей формулы (I) по любому из пп.1-5, в котором X означает -О- или -S-. 7. Соединение общей формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал, имеющий следующее значение: а) C2-C6 алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или Т, где Т имеет значение, определенное в п.1; где n является целым числом от 0 до 5 и n1 является целым числом от 1 до 5;R2 имеет значение, определенное в п.1. 8. Соединение общей формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал, имеющий следующее значение: а) C2-C6 алкилен с прямой или разветвленной цепью, необязательно замещенный -ONO2 или T, где T имеет значение, определенное в п.1;R2 означает водород. 9. Соединение формулы (I) по любому из пп.1-6, в котором Y означает двухвалентный радикал,имеющий следующее значение:Z означает -(CH)n1- или двухвалентный радикал, определенный в п.1 (значение b), где n является целым числом от 0 до 5; n1 является целым числом от 1 до 5 и n2 является целым числом от 0 до 2;
МПК / Метки
МПК: A61K 31/5575, A61P 27/06, C07C 405/00
Метки: производные, простагландинов
Код ссылки
<a href="https://eas.patents.su/30-10595-proizvodnye-prostaglandinov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные простагландинов</a>
Предыдущий патент: Слитые белки taci-иммуноглобулина
Следующий патент: Замещённые пирролопиразольные производные в качестве ингибиторов киназы
Случайный патент: Суспензия, содержащая микрочастицы эзетимиба