Способы производства ансамитоцинов
Формула / Реферат
1. Способ получения очищенных ансамитоцинов, включающий в себя стадии:
1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде;
2) твердофазной экстракции ансамитоцинов из культуральной среды на гидрофобную смолу;
3) изократического или градиентного элюирования ансамитоцинов из смолы с использованием органического растворителя или органического растворителя в комбинации с водой;
4) концентрирования экстрагированных ансамитоцинов и
5) необязательно очистки ансамитоцинов любым одним из способов а), b), с) и d):
a) адсорбционной хроматографией на силикагеле или оксиде алюминия,
b) кристаллизацией,
c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией и
d) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия,
и в котором упомянутые ансамитоцины имеют следующую структурную формулу:
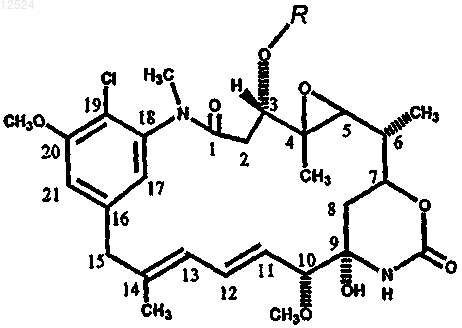
где R представляет собой H, COCH3, COCH2CH3, COCH(CH3)2, COCH2CH2CH3, COCH2CH(CH3)2 или COCH2CH2CH2CH3.
2. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema spp.
3. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum.
4. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum ATCC 31565 или полученный из него штамм.
5. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum PF4-4 (ATCC PTA-3921) или полученный из него штамм.
6. Способ по любому из пп.1-5, в котором экстракцию проводят при рН около 6-7.
7. Способ по любому из пп.1-5, в котором экстракцию проводят при температуре около 30-45шС.
8. Способ по любому из пп.1-5, в котором культивирование проводят в культуральной среде при рН в диапазоне примерно от 6 до примерно 8.
9. Способ по п.8, в котором диапазон рН составляет примерно от 7,0 до примерно 7,4.
10. Способ по п.9, в котором рН составляет около 7,2.
11. Способ по п.8, в котором температура составляет от примерно 15 до примерно 35шС.
12. Способ по п.8, в котором температура составляет от примерно 25 до примерно 30шС.
13. Способ по п.8, в котором температура составляет около 28шС.
14. Способ по п.13, в котором температура составляет примерно 25шС и рН составляет примерно 7,2.
15. Способ по любому из пп.1-5, в котором во время культивирования обеспечивается по меньшей мере одно дополнительное питательное вещество.
16. Способ по п.15, в котором дополнительным питательным веществом является источник углерода.
17. Способ по п.15, в котором дополнительным питательным веществом является источник углерода с последующим источником углерода и белковым питательным веществом.
18. Способ по п.15, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамитоцина.
19. Способ по п.16, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамитоцина.
20. Способ по п.17, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамитоцина.
21. Способ по п.16, в котором источник углерода представляет собой глюкозу.
22. Способ по п.17, в котором источник углерода представляет собой глюкозу.
23. Способ по п.17, в котором белковое питательное вещество представляет собой порошок из семян хлопчатника или соевую муку.
24. Способ по п.19, в котором альдегид или спирт выбирают из группы, состоящей из изобутанола, изобутиральдегида, н-бутанола, н-бутиральдегида, н-пропанола, н-пропиональдегида, изопропанола, изопропиональдегида, пентанола, валеральдегида, изопентанола и изовалеральдегида.
25. Способ по п.20, в котором альдегид или спирт выбирают из группы, состоящей из изобутанола, изобутиральдегида, н-бутанола, н-бутиральдегида, н-пропанола, н-пропиональдегида, изопропанола, изопропиональдегида, пентанола, валеральдегида, изопентанола и изовалеральдегида.
26. Способ по п.15, в котором культивирование проводят при рН около 6,5-8,0.
27. Способ по п.15, в котором культивирование проводят при рН около 7,0-7,4.
28. Способ по п.15, в котором культивирование проводят при рН около 7,2.
29. Способ по п.15, в котором культивирование проводят при температуре около 15-35шС.
30. Способ по п.15, в котором культивирование проводят при температуре около 25-30шС.
31. Способ по п.15, в котором культивирование проводят при температуре около 28шС.
32. Способ по п.15, в котором культивирование проводят при температуре около 28шС и рН примерно 7,2.
33. Способ по любому из пп.1-5, дополнительно включающий в себя одну или несколько из стадий:
(i) инактивирования микроорганизмов в культуральной среде химической или тепловой инактивацией;
(ii) обработки культуральной среды перед стадией 2 для облегчения экстракции ансамитоцинов растворителем и
(iii) промывки, где перед осаждением или после осаждения неочищенный раствор ансамитоцинов в органическом растворителе промывают водой, водным раствором соли, водным раствором кислоты или водным раствором основания в любой последовательности, которая может быть осуществлена во время очистки.
Текст
012524 Изобретение относится к способам производства ансамитоцинов. Название ансамитоцины относится к смеси ансамитоцинов, которые отличаются сложноэфирной боковой цепью в положении C-3. Ансамитоцины можно превратить в C-3 спирт мейтансинол (maytansinol). Уровень техники Ансамитоцины представляют собой высокоцитотоксичные соединения, получаемые ферментацией микроорганизмов, например Actinosynnema pretiosum. Ансамитоцины химическим путем превращают в тиолсодержащие мейтансиноиды (maytansinoids), терапевтическое применение которых в виде конъюгатов клеточно-связывающий агент/мейтансиноид описано в патентах США 5208020; 5416064; 6333410 и 6441163. Способ ферментации штаммами Actinosynnema spp, такими как Actinosynnema pretiosum, дает несколько видов ансамитоцинов, содержащих различные сложноэфирные заместители в положении C-3(см. фигуру). Различные сложноэфирные группы, получаемые в положении C-3, включают P-3 (изобутирил), P-3' (н-бутирил), P-2 (пропионил), P-4 (изовалерил), P-4' (н-валерил). Все упомянутые сложные эфиры можно подвергнуть восстановительному расщеплению и получить спирт C-3 мейтансинол (P-О),который является предшественником в синтезе тиолсодержащих мейтансиноидов. Кроме того, получены незначительные количества нежелательных ансамитоцинов, которые модифицированы по другим положениям, например N-диметил-, 20-О-диметил- и 19-дихлорпроизводные. Такие ансамитоцины не образуют мейтансинол при восстановительном деацилировании. Описаны способы производства ансамитоцинов ферментацией Actinosynnema spp (патенты США 4162940; 4450234; 4228239; 4331598 и 4356265). Выход продуцируемых ансамитоцинов варьируется,причем титры обычно изменяются от 12 до 100 мг/л. Ансамитоцины обычно извлекают и очищают многостадийным способом, включающим добавление вспомогательного фильтрующего вещества и органического растворителя к цельному ферментационному бульону с последующим концентрированием органического слоя и осаждением продукта петролейным эфиром. Осадок дополнительно очищают хроматографией на силикагеле и кристаллизацией с последующей дополнительной очисткой перекристаллизацией или хроматографией. Таким образом, способ является трудоемким и включает несколько стадий, на которых приходится работать с высокотоксичным веществом. Это делает очень трудным осуществление указанного способа в крупных масштабах. Кроме того, должна быть обеспечена безопасность человека-оператора в процессе выполнения различных технологических операций. Недавно поданная патентная заявка США (US 2002/0015984 А 1) претендует на некоторые усовершенствования способа производства ансамитоцинов. Титры ансамитоцина в ферментационном бульоне,как сообщается, составляют от 65 до 86 мг/л. Заявленные усовершенствования включают тепловую инактивацию бульона при 75 С, экстракцию ароматическим углеводородным растворителем, таким как толуол, хроматографирование на открытой колонке с силикагелем с последующей кристаллизацией. С целью снижения затрат для производства ансамитоцина получены новые штаммы Actinosynnema spp, которые дают значительно более высокие титры (до 400 мг/л в ферментерах), чем ранее описанные штаммы. Способы производства ансамитоцинов, описанные ранее, имеют некоторые недостатки, и, следовательно,они не могут быть адаптированы для новых высокопродуктивных штаммов, которые были разработаны. Например, тепловая инактивация при 75 С приводит в результате к некоторому разрушению ансамитоцина и 10-20% потере выхода. Экстракция ферментационного бульона с высоким содержанием ансамитоцинов ароматическими растворителями является недостаточной и неполной, так как ансамитоцины не обладают высокой растворимостью в таких растворителях. Очистка ансамитоцинов на открытых самоуплотняющихся колонках с силикагелем имеет два недостатка: 1) от партии к партии изменяется чистота и степень извлечения; и 2) значительное воздействие на человека, что вызывает озабоченность проблемами безопасности. Таким образом, существует потребность в производстве ансамитоцинов с высокими выходами и также в создании эффективного способа их выделения и очистки, при котором сводится к минимуму воздействие высокотоксичного препарата на работника. Сущность изобретения Один из аспектов изобретения представляет собой способ для крупномасштабной ферментации микроорганизмов, продуцирующих ансамитоцин, причем способ особенно подходит для нового высокопродуктивного штамма, продуцирующего ансамитоцин. Еще один из аспектов изобретения представляет собой способ выделения неочищенного ансамитоцина и получения очищенных ансамитоцинов, включающий в себя следующие стадии: 1) необязательная инактивация культуры, например, нагреванием при температуре примерно 5055 С или добавлением 1 об.% хлороформа; 2) экстракция неароматическим органическим растворителем; 3) концентрирование экстракта; 4) очистка концентрата на колонке с силикагелем или оксидом алюминия, предпочтительно на колонке-картридже, предварительно заполненном силикагелем; и-1 012524 5) кристаллизация продукта. Другие аспекты изобретения включают следующее. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) экстракции ансамитоцинов из культуральной среды неароматическим растворителем, несмешивающимся с водой; 3) концентрирования экстрагированных ансамитоцинов и 4) очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) экстрагирования ансамитоцинов из культуральной среды неароматическим растворителем, несмешивающимся с водой; 3) концентрирования экстрагированных ансамитоцинов и 4) очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) экстрагирования ансамитоцинов из культуральной среды неароматическим растворителем, несмешивающимся с водой; 3) концентрирования экстрагированных ансамитоцинов и 4) очистки ансамитоцинов адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) экстрагирования ансамитоцинов из культуральной среды неароматическим растворителем, несмешивающимся с водой; 3) фильтрации для удаления твердой фазы, позволяющей выделить органическую фазу; 4) концентрирования ансамитоцинов из органической фазы и 5) очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) экстрагирования ансамитоцинов из культуральной среды неароматическим растворителем, несмешивающимся с водой с применением различных методик центрифугирования; 3) концентрирования ансамитоцинов из органической фазы и 4) очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) центрифугирования бульона в присутствии одного или нескольких органических растворителей,смешивающихся с водой, для удаления твердой фазы при сохранении ансамитоцинов в растворе;-2 012524 3) прибавления неароматического растворителя, несмешивающегося с водой, чтобы сделать возможной экстракцию ансамитоцинов в органический слой. Возможно также прибавление различных солей или других компонентов к органической фазе во время экстракции. 4) концентрирования экстрагированных ансамитоцинов и 5) очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) необязательной обработки культуральной среды для того, чтобы облегчить экстракцию ансамитоцинов растворителем; 3) твердофазной экстракции ансамитоцинов из культуральной среды на смолу; 4) изократического или градиентного элюирования ансамитоцинов из смолы одним или несколькими органическими растворителями в комбинации с водой; 5) концентрирования экстрагированных ансамитоцино; и 6) необязательной очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия. В вышеупомянутые варианты осуществления изобретения могут необязательно быть включены:(i) химическая или тепловая инактивация микроорганизмов в ферментационном бульоне;(ii) обработка культуральной среды перед стадией 2, для того чтобы облегчить экстракцию ансамитоцинов растворителем перед стадией 2; или(iii) стадия промывки, на которой неочищенный раствор ансамитоцинов в органическом растворителе промывают водой, водным раствором соли, водным раствором кислоты или водным раствором основания в любой последовательной комбинации или перед осаждением, или после осаждения. Указанную промывку можно осуществить на различных стадиях очистки. Способ экстрагирования ансамитоцинов из ферментационного бульона, включающий в себя: 1) необязательную инактивацию микроорганизмов, продуцирующих ансамитоцин в ферментационном бульоне; 2) экстрагирование ансамитоцинов из ферментационного бульона неароматическим растворителем,несмешивающимся с водой. Вышеуказанный способ может также включать обработку культуральной среды перед стадией 2,чтобы облегчить экстракцию ансамитоцинов растворителем. Способ экстрагирования ансамитоцинов из ферментационного бульона, включающий в себя: 1) экстракцию ансамитоцинов из ферментационного бульона неароматическим растворителем, несмешивающимся с водой; 2) фильтрацию для удаления твердой фазы, позволяющую выделить органическую фазу. Вышеуказанный способ необязательно может включать в себя:(i) химическую или тепловую инактивацию микроорганизмов в ферментационном бульоне и/или(ii) обработку культуральной среды перед стадией 2, чтобы облегчить экстрагирование ансамитоцинов растворителем. Способ экстрагирования ансамитоцинов из ферментационного бульона, включающий в себя экстрагирование ансамитоцинов из ферментационного бульона неароматическим растворителем, несмешивающимся с водой, с помощью различных методик центрифугирования. Вышеуказанный способ может необязательно включать в себя:(i) химическую или тепловую инактивацию микроорганизмов в ферментационном бульоне и/или(ii) обработку культуральной среды до или во время центрифугирования для облегчения экстрагирования ансамитоцинов растворителем. Способ удаления твердого осадка из ферментационного бульона, включающий в себя 1) центрифугирование ферментационного бульона в присутствии органического растворителя, смешивающегося с водой, чтобы удалить твердую фазу, сохраняя ансамитоцины в растворе. Вышеуказанный способ может необязательно включать в себя:(i) химическую или тепловую инактивацию микроорганизмов в ферментационном бульоне и/или(ii) обработку культуральной среды до или во время центрифугирования для облегчения экстраги-3 012524 рования ансамитоцинов растворителем. В вышеописанных способах предпочтительно, чтобы микроорганизмом, продуцирующим ансамитоцин, являлся Actinosynnema spp., более предпочтительно Actinosynnema pretiosum. Микроорганизмом,продуцирующим ансамитоцин, может также быть Actinosynnema pretiosum ATCC 31565 или производные от него штаммы либо Actinosynnema pretiosum PF4-4 (ATCC PTA-3921) или производные от него штаммы. Как описано в патенте США 4450234, Actinosynnema pretiosum ATCC 31565 был задепонирован в (i) Institute for Fermentation (Osaka, 17-85, Juso-honmachi 2-chome, Yodogawa-ku, Osaka 532-8686, Japan) 20 августа 1979 г. под инвентарным номером IFO 13963; (ii) National Institute of Bioscience and Humanof International Trade and Industry (1-3, higashi 1-chome, Tsukuba-shi, Ibaraki-ken 305, Japan) 29 августа 1979 г. под инвентарным номером FERM-P NO. 5185; и (iii) в American Type Culture Collection (10801ATCC 31565. Кроме того, Actinosynnema pretiosum PF4-4 был задепонирован по условиям Будапештского договора в American Type Culture Collection (10801 University Blvd., Manassas, Virginia 20110-2209,USA) 11 декабря 2001 г., и ему был присвоен инвентарный номер ATCC PTA-3921. Краткое описание чертежей На фигуре показана структура различных ансамитоцинов со сложноэфирной группой в положенииC-3, которые могут быть получены ферментацией, а также структура C-3 спирта, мейтансинола (P-О). Подробное описание изобретения Способы предусмотрены для культивирования высокопродуктивного микроорганизма, для продуцирования ансамитоцинов в жидкой культуральной среде в больших ферментерах. Предусмотрены также способы экстракции ансамитоцина из культурального бульона и микроорганизма неароматическим органическим растворителем, несмешивающимся с водой, в котором ансамитоцин хорошо растворим, и способы очистки ансамитоцина путем пропускания через колонку с силикагелем или оксидом алюминия,если требуется, предпочтительно, чтобы такие колонки представляли собой предварительно заполненные картриджи, с последующей кристаллизацией продукта. Если необходимо, микроорганизм может быть инактивирован тепловой обработкой или обработкой хлороформом перед стадией экстракции. Очищенные ансамитоцины, которые могут включать смесь различных сложноэфирных производных по C-3, таких как ансамитоцины P-3, P-3', P-4, P-4', P-2 и P-1 (фиг. 1), могут быть обработаны восстанавливающим агентом, чтобы получить требуемое соединение с гидроксильной группой в положенииC-3 - мейтансинол (P-О). Очищенные ансамитоцины обычно содержат лишь незначительные количества нежелательных ансамитоцинов, которые являются модификациями не в C-3 положении, а в других местах молекулы. Предпочтительно, чтобы штамм, продуцирующий ансамитоцин, представлял собойActinosynemma spp. Более предпочтительно, чтобы микроорганизм представлял собой Actinosynnemapretiosum. Микроорганизм может также представлять собой Actinosynnema pretiosum PF4-4 (АТСС РТА-3921) и его производные и Actinosynnema pretiosum ATCC 31565 и его производные. Микроорганизм можно выращивать способами ферментационного культивирования, которые известны специалистам средней квалификации в данной области техники, используя конкретные среды, описанные в настоящем изобретении, или любые другие среды, которые описаны в предшествующем уровне техники(патенты США 4162940; 4450234; 4228239; 4331598 и 4356265). Один из вариантов осуществления способа по изобретению представляет собой культивирование микроорганизма в жидкой культуральной среде. Выращивание бактериального штамма PF4-4 осуществляют в регулируемых условиях и можно использовать широкий набор сред и условий. Например, штаммPF4-4 можно выращивать в условиях и на средах, которые аналогичны описанным для АТСС 31565 или АТСС 31281 в патентах США 4137230; 4162940; 4331598; 4356265 и 4450234 и описанным в работеHatano et al., Agric. Biol. Chew. 48, 1721-1729, 1984. Следовательно, штамм PF4-4 толерантен к широкому спектру источников углерода, которые также обеспечивают ферментативное производство ансамитоцинов. Типичные среды для выращивания представлены в табл. 1 и 2. В табл. 1 показаны среды, которые обеспечивают продуцирование ансамитоцинов микроорганизмами, продуцирующими ансамитоцин, такими как Actinosynnema pretiosum PF4-4, а в табл. 2 показаны дополнительные примеры сред, подходящих для размножения и/или роста Actinosynnema pretiosum PF4-4, и других микроорганизмов, продуцирующих ансамитоцин.-4 012524 Таблица 1 Состав сред для продуцирования (данные приведены в % (мас./об. Стерилизацию проводят при 121 С в течение 20 мин.-5 012524 Таблица 2 Совместимые среды Культура на скошенной и твердой среде, СМ 4-1 Agar, % (мас./об.) Предпочтительные способы для ферментационного производства ансамитоцинов из штамма PF4-4 дополнительно описаны ниже в примерах 1 и 2. Ферментация. Культивирование можно проводить в таких условиях, как стационарные, условия встряхивания,аэробные глубинные или любые другие. Для хорошего роста культуры с высоким продуцированием ансамитоцинов в ферментерах большой емкости предпочтительно аэробное глубинное культивирование. Продуцирование ансамитоцина может быть дополнительно увеличено подачей питательных веществ во время ферментации. Например, при культивировании организма в среде FM4-6 осуществляется дополнительная подача глюкозы в течение всего времени ферментации или подача глюкозы - в течение примерно первых 24-72 ч, предпочтительно в течение первых 48 ч с последующей подачей глюкозы и белкового питательного вещества, такого как порошок семян хлопчатника (например, марки Proflo или Pharmamedia от компании Trader's Protein, Memphis, TN) или соевая мука; и спирта или альдегида, чтобы способствовать образованию сложноэфирной боковой цепи в положении C-3, например изобутанола, изобутиральдегида, н-бутанола, н-бутиральдегида, н-пропанола, н-пропиональдегида, изопропанола, изопропиональдегида, пентанола, валеральдегида, изопентанола, изовалеральдегида до окончания ферментации,может в результате удвоить продуцирование ансамитоцина. Хотя условия культивирования зависят от используемых сред и масштабов производства, обычно предпочтительно проводить ферментацию при уровне рН в интервале от примерно 5 до примерно 9, предпочтительно, чтобы начальный уровень рН составлял примерно 6,5-8,0. Более предпочтительно, если уровень рН составляет примерно 7-8, даже более предпочтительно примерно 7,0-7,4. Наиболее предпочтительный уровень рН составляет 7,2. Температура может составлять от примерно 15 до примерно 35 С, причем предпочтительный интервал составляет примерно 25-30 С. Более предпочтительно, чтобы температура составляла примерно 28 С. Ферментацию продолжают до тех пор, пока не достигается максимальное накопление ансамитоцина. Время культивирования может варьироваться и зависит от нескольких факторов, в том числе от способа культивирования, состава среды и температуры. Обычно время ферментации составляет от 96 до 336 ч. Анализ ансамитоцинов. Патенты США 4331598 и 4450234 описывают родительский штамм АТСС 31565, как продуцирующий два класса ансамитоцинов, которые отличаются наличием метильной или гидроксиметильной группы в положении С-14 (см. фигуру). Для обоих классов продуцируются несколько различных ансамитоцинов, которые отличаются своей соответствующей ацильной боковой цепью, соединенной с атомом кислорода в положении C-3, и тем, какая группа - метильная или гидроксиметильная - находится в положении С-14 (или в более поздних исследованиях - N-диметил). Номенклатура, используемая в настоящем изобретении для пермутированных соединений, определена выше со ссылкой на фигуру. Ансамитоцин P-3 является основным продуктом штамма PF4-4 и родительского штамма АТСС 31565 в определенных условиях выращивания. Если бактерии выращивают в присутствии валина или изомасляной кислоты (см. патент США 4228239) либо изобутилового спирта или изобутиральдегида (см.-6 012524 патент США 4356265), другие производные ансамитоцина присутствуют только в незначительных количествах. Когда штамм PF4-4 выращивают в различных ферментационных средах (обозначаемых FM в табл. 1), в которых все среды содержат изобутиловый спирт, преобладающим продуцируемым ансамитоцином является ансамитоцин P-3. В одном из методов для анализа количества ансамитоцинов образцы ферментационного бульона разбавляют этанолом или ацетонитрилом, затем сильно встряхивают и в заключение центрифугируют. Затем проводят анализ супернатанта на содержание ансамитоцина P-3. Ансамитоцины предпочтительно фракционируют и анализируют обращенно-фазовой высокоэффективной жидкостной хроматографией (ВЭЖХ), но можно использовать любой подходящий метод,такой как, например, MALDI-TOF или тонкослойная хроматография. В одном из способов ферментационные бульоны экстрагируют такими органическими растворителями, как этилацетат, метиленхлорид или хлороформ, а содержание P-3 в органическом растворителе определяют методом ВЭЖХ, используя обращенную фазу на колонках С 18 или С 8. Экстракция ансамитоцинов. Ансамитоцины можно экстрагировать из ферментационного бульона способами, обычно применяемыми для извлечения вторичных метаболитов. Так как ансамитоцины легко растворяются в неароматических растворителях, их можно легко экстрагировать путем перемешивания с неароматическими растворителями, которые не смешиваются с водой, такими как, например, алкилацетаты, в которых алкильная цепь является линейной или разветвленной и содержит 1-5 атомов углерода, диалкилкетоны или галогенированные растворители. Примеры подходящих алкилацетатов включают н-бутилацетат, этилацетат и метилацетат. Примером подходящего диалкилкетона является метилизобутилкетон. Примером подходящего галогенированного растворителя является дихлорметан. Экстракция н-бутилацетатом является предпочтительной. Предпочтительно, чтобы отношение объема ферментационного бульона к объему неароматического растворителя, несмешивающегося с водой, составляло 1:1. Ансамитоцины также могут адсорбироваться из ферментационного бульона различными смолами,например, торговых марок Amberlite XAD-4, XAD-16, коммерчески доступными от Rohm and Haas Company, торговых марок Diaion HP20, НР 21, Sepabeads SP825, SP850, SP70, SP700, коммерческими доступными от Mitsubishi Chemical Industries Ltd. Приведенные примеры не ограничивают объем притязаний изобретения, для указанной выше цели можно использовать и другие смолы, известные специалисту средней квалификации в данной области техники. Смолу можно также использовать как покрытие на вторичной структуре, например как магнит или вещество с высокой плотностью, таким образом, чтобы полимер можно было извлечь из бульона магнитом или способами, основанными на плотности адсорбента, например хроматографией в расширяющемся слое. Как только ансамитоцины адсорбируются на смоле, их можно элюировать с помощью одного или нескольких органических растворителей в режиме изократического или градиентного элюирования. В одном из вариантов осуществления изобретения смолу можно прибавлять непосредственно в бульон для экстрагирования ансамитоцинов. Ансамитоцины могут быть извлечены из смолы несколькими способами. В первом варианте осуществления изобретения смолу можно отделить фильтрованием. Во втором варианте осуществления изобретения смолу можно извлечь центрифугированием и осадок затем элюировать одним или несколькими органическими растворителями в комбинации с водой. В третьем варианте осуществления изобретения водную фазу и твердые остатки можно удалять из смолы путем хроматографии в расширяющемся слое. Смолу затем прессуют в колонке с разрыхленным слоем и элюируют одним или несколькими органическими растворителями или одним или несколькими органическими растворителями в сочетании с водой в режиме изократического или градиентного элюирования. В четвертом варианте осуществления изобретения смола может извлечь ансамитоцины, будучи отделенной от ферментационного бульона частично проницаемой мембраной. Например, мембрану для диализа, заполненную смолой, можно перемешать с ферментационным бульоном, воду и компоненты с низкой молекулярной массой можно пропустить через мембрану, давая возможность ансамитоцинам связываться со смолой. Диализный мешок можно затем удалить из ферментационного бульона и извлеченную смолу можно затем элюировать, как описано выше. Перед экстракцией микробы в ферментационном бульоне можно инактивировать, если требуется,мягким нагреванием при температуре примерно 50-55 С в течение времени примерно от 30 мин до 2 ч или добавлением 1% (об./об.) хлороформа (Toru Hasegawa et al., 1983, Int. J. Syst. Bacteriol. 53:314-320). Способ также может включать в себя обработку культуральной среды до или во время экстрагирования, чтобы облегчить экстракцию ансамитоцинов растворителем. Такая обработка может включать (но не ограничивается перечисленным ниже) нагревание, регулирование рН или обработку ферментами или химическую обработку, например добавление полимерного сульфата железа, деэмульгирующих (расслаивающих эмульсию) агентов, коллоидального диоксида кремния или таких сорастворителей, как ацетон или спирты, например метанол. В случае экстракции органической фазы экстракцию проводят при рН от 2,0 до 13,0, но предпочтительно при рН примерно 6-7 и более предпочтительно при рН примерно 6,5-7,0 и предпочтительно н-бутилацетатом. Для повышения эффективности экстрагирования можно поддерживать температуру-7 012524 бульона во время процесса экстракции от 5 до 80 С, предпочтительно от 35 до 45 С. Время экстракции зависит от нескольких факторов, включающих состав бульона, температуру бульона и растворителя для экстракции, способ смешивания бульона и растворителя и растворитель, используемый для экстракции. Время экстракции составляет от 1 до 120 ч в зависимости от способа экстракции. Например, когда выбирают быстрый способ экстракции и фильтрации, время экстракции может составлять от 1 до 12 ч. Вспомогательные фильтрующие вещества можно использовать во время фильтрации. Такие вспомогательные вещества включают (но не ограничиваются перечисленными ниже) вещества марок CelpurePlOOO5 Celatom FW-80, Hyflo Super Cel и Celite. При желании, вспомогательные фильтрующие вещества можно добавлять прямо в бульон во время фильтрации. При желании, на фильтры можно также заранее наносить вспомогательные фильтрующие вещества. Методы фильтрации, которые можно использовать в указанном способе, включают в себя (но не ограничиваются перечисленным ниже) проточную фильтрацию вдоль потока, фильтрацию с помощью барабана со скребковой выгрузкой и с покрытием из вспомогательного фильтрующего вещества (материала) или периодическую фильтрацию. В случаях, когда фильтрацию проводят при крайних значениях рН (extremes), таких как рН 1-5 или рН 8-13, или при очень повышенной температуре, например от 60 до 90 С, экстракцию следует проводить со скоростью, которая не допускает избыточного разложения ансамитоцинов. Если необходимо,экстракцию можно осуществить чрезвычайно быстро непрерывным центрифугированием. В таком случае рН или температуру ферментационного бульона регулируют по мере того, как бульон поступает в центрифугу таким образом, чтобы не допустить продолжительного воздействия жестких условий. Примеры оборудования для центрифугирования, которое используют в процессах ферментации и которое могло бы использоваться для экстрагирования ансамитоцинов, включают, но не ограничиваются ими,центрифуги отстойного типа и многоярусные тарельчатые центрифуги. Оставшийся экстракт в органическом растворителе затем можно концентрировать при пониженном давлении и получить осадок, который содержит ансамитоцины. Альтернативно, растворитель, смешивающийся с водой, можно смешать с ферментационным бульоном и центрифугировать для удаления твердых веществ, получая однофазный раствор, свободный от твердых веществ. Затем полученный раствор можно обработать, например, прибавляя растворитель, несмешивающийся с водой, чтобы вызвать разделение органической и водной фаз и концентрировать органическую фазу. Водная промывка ансамитоцинов в растворе. Ансамитоцины в растворе органического растворителя, несмешивающегося с водой, можно промыть водой, водным раствором кислоты, водным раствором основания, частично или полностью насыщенным водным раствором соли или комбинацией любых из описанных водных жидкостей для промывки. Примеры водных растворов кислот включают, но не ограничиваются ими, водные растворы хлористо-водородной кислоты, серной кислоты, уксусной кислоты, муравьиной кислоты и фосфорной кислоты с уровнем рН от 1 до 6,9. В контексте настоящего изобретения водные растворы кислот также включают кислые водные буферные системы. Примеры кислых водных буферных систем включают, но не ограничиваются ими, фосфат натрия, фосфат калия, ацетат аммония и фосфат аммония, причем рН каждой отрегулирован для применения в определенных пределах, соответствующих кислотным буферам. Примеры водных растворов оснований включают, но не ограничиваются ими, водные растворы бикарбоната натрия, бикарбоната калия, карбоната натрия, гидроксида натрия, гидроксида аммония и фосфата натрия с рН 7,1-13. В контексте настоящего изобретения термин водное основание включает также основную водную буферную систему. Примеры основных водных буферных систем включают, но не ограничиваются ими, фосфат натрия, фосфат калия, ацетат аммония и фосфат аммония, причем рН каждой отрегулирован для применения в определенных пределах, соответствующих основным буферам. Промывки кислыми или основными буферными системами должны быть завершены без заметного разложения ансамитоцинов, что будет зависеть от изменений рН. Если необходимо, можно осуществить чрезвычайно быструю экстракцию, используя методы центрифугирования. Примеры частично или полностью насыщенных водных растворов соли включают, но не ограничиваются перечисленными ниже,водный раствор хлорида натрия с различной степенью насыщенности и водные растворы хлорида калия с различной степенью насыщенности. Водные жидкости для промывки, в которых смесь частично или полностью насыщенного водного раствора соли объединяют с водным основанием или водной кислотой,также можно приготовить. Фильтрация перед экстракцией. Альтернативно, перед экстракцией твердую фазу в ферментационном бульоне, содержащем ансамитоцины, можно отделить фильтрацией или центрифугированием. Ансамитоцины из твердой клеточной массы можно извлечь промыванием растворителем, таким как этанол, водный этанол или другие органические растворители, например этилацетат, бутилацетат, дихлорметан или ацетон, они являются хорошо известными специалисту средней квалификации в данной области техники. Ансамитоцины из фильтрата можно извлечь экстракцией известным ароматическим органическим растворителем, как описано ранее в настоящем изобретении.-8 012524 Очистка ансамитоцинов. Неочищенный продукт можно подвергать очистке, используя такие методики, как, например, адсорбционная хроматография на силикагеле или оксиде алюминия с последующей кристаллизацией, если необходимо. Предпочтительно, чтобы хроматографию проводили на предварительно заполненной колонке, на такой как Biotage silica gel cartridge, используя хроматографическую систему Biotage. Целевые ансамитоцины можно элюировать из колонки, используя градиент растворителя, начиная со смеси этилацетата и гексана и прибавляя увеличивающиеся количества метанола. Фракции, содержащие целевые ансамитоцины, можно объединять и концентрировать. Если требуется, ансамитоцины можно дополнительно очищать кристаллизацией, используя растворитель, например этилацетат, для растворения продукта и затем прибавляя неполярный растворитель, например гептан или гексан, для кристаллизации чистого продукта. Термин кристаллизация, используемый в настоящем изобретении, включает в себя также термин осаждение, так как твердая фаза, образующаяся из раствора, может иметь или аморфную, или четкую структуру. Комплексы клеточно-связывающий агент/мейтансиноид. Способ по изобретению может быть использован для получения комплексов клеточносвязывающий агент/мейтансиноид, которые применимы в качестве активных в отношении опухолей пролекарств. Ансамитоцины, полученные способом по изобретению, могут претерпевать восстановительное расщепление, образуя мейтансинол, который можно использовать, как описано в патентах США 5208020; 5416064; 6333410 и 6441163 для производства производных мейтансиноидов, содержащихN-метил-L-аланин. Такие производные затем образовывают конъюгаты с клеточно-связывающими агентами, предпочтительно с антителами, через различные линкеры, например дисульфидсодержащие линкеры. Теперь изобретение будет проиллюстрировано на примерах, не ограничивающих его объем. Пример 1. Производство ансамитоцинов. Первичный посев. Культуральную среду для посева VM4-1' (400 мл/на колбу), содержащую 2% растворимого крахмала, 1% глюкозы, 1% соевого шрота, 0,5% кукурузного экстракта (Roquette), 0,5% сои, 0,3% хлорида натрия и 0,5% карбоната кальция, наливают в каждую из 11 колб Эрленмейера (объемом 2 л). После стерилизации каждую колбу инокулируют культурой PF4-4 (АТСС РТА-3921). Колбы инкубируют при 28 С на ротационном шейкере при 230 об/мин в течение 48 ч. Вторичный посев. Содержимое колб для первичного посева объединяют. Ферментер объемом 300 л заполняют 100 л среды для посева VM4-1'. После стерилизации ферментер инокулируют объединенной культурой первичного посева (4 л). В ферментере поддерживают температуру 28 С и перемешивание со скоростью 80 об/мин. Уровень растворенного кислорода поддерживают выше 30% насыщения аэрацией и ускоренным перемешиванием, если необходимо. После инкубирования в течение 24 ч культура для вторичного посева готова для переноса в сосуды для производства. Производство. Каждый из двух промышленных ферментеров объемом 300 л заполняют 250 л среды FM4-6 (см. табл. 1). После стерилизации каждый ферментер инокулируют 15 л культуры для вторичного посева. В ферментере поддерживают температуру 28 С, перемешивание со скоростью 1075 об/мин и аэрацию при 0,4 vvm (vvm - отношение количества подводимого воздуха к емкости реактора). После 2 дней содержание растворенного кислорода выше 30% поддерживают путем увеличения скорости перемешивания до максимальной 1075 об/мин и аэрации до максимума 1 vvm. Ежедневно измеряют титр ансамитоцина,отбирая образец ферментационного бульона и разбавляя его этанолом с последующим количественным анализом методом ВЭЖХ. Ферментацию продолжают до 10-го дня, до момента, когда прирост ансамитоцина прекращается. Титр ансамитоцина на 10-й день в двух ферментерах составлял 251 и 244 мг/л соответственно. Доводят уровень рН ферментационного бульона до 6,5 добавлением фосфорной кислоты. Ферментеры нагревают до 55 С и поддерживают указанную температуру в течение 1 ч для инактивации микроорганизма. Ферментеры затем охлаждают до температуры окружающей среды для экстракции органическим растворителем. Пример 2. Производство ансамитоцинов периодическим способом с подпиткой. Промышленный ферментер объемом 1500 л заполняют 900 л среды для продуцирования FM4-6 (см. табл. 1). После стерилизации ферментер инокулируют 54 л культуры для вторичного посева, полученной, как описано выше. В ферментере поддерживают температуру 28 С, перемешивание со скоростью 1075 об/мин и аэрацию 0,4 vvm. В течение 0-48 ч подают 28,5% водный раствор глюкозы со скоростью 0,39 мл/л/ч. В течение 48-288 ч подачу переключают на исходный (основной) раствор, содержащий 21,5% глюкозы, 7,1% Proflo и 7,1% изобутанола, который подают со скоростью 0,51 мл/л/ч. После 2 дней содержание растворенного кислорода поддерживают выше 20% путем увеличения скорости перемешивания до максимальной 1705 об/мин и скорости аэрации до максимума 1 vvm. Титр ансамитоцина измеряют ежедневно путем отбора образца ферментационного бульона, разбавления его этанолом и последующим количественным анализом методом ВЭЖХ. Ферментацию продолжают до 13 дня, до момента,-9 012524 когда прирост ансамитоцина прекращается. Титр ансамитоцина в ферментере на 13-й день составлял 304 мг/л. Уровень рН ферментационного бульона доводят до 6,5, прибавляя фосфорную кислоту. Тепловая инактивация. Ферментер нагревают до 55 С и поддерживают такую температуру в течение 1 ч для инактивации микроорганизма. Затем ферментеры охлаждают до температуры от 30 до 40 С для экстрации органическим растворителем. Пример 3. Экстракция и хроматографическая очистка ансамитоцинов. Ферментационный бульон из примера 2 смешивают с равным объемом н-бутилацетата. Поддерживают температуру смеси в интервале от 30-40 до 45 С и слегка перемешивают таким образом, чтобы смешивание двух фаз происходило на границе раздела растворителей. Экстракцию продолжают в течение до 5 дней или до тех пор, пока ВЭЖХ-анализ органического слоя не покажет, что 80% ансамитоцинов экстрагировано. Затем органический слой отделяют и упаривают, используя выпарной аппарат с падающей пленкой жидкости, до конечного объема от 20 до 50 л. Концентрированный экстракт переносят в колбу, содержащую 2,2 кг силикагеля. Неочищенные ансамитоцины наносят на силикагель, упаривая растворитель досуха на роторном испарителе при пониженном давлении. Силикагель с нанесенными ансамитоцинами переносят в модуль для ввода образцов (SIM), полученный от компании "Biotage, Inc."(Charlotesville, VA). SIM промывают смесью циклогексана и гексана (2:1 об./об.) и затем соединяют с системой Biotage 150M, снабженной картриджем с силикагелем. Целевой продукт элюируют из колонки смесью этилацетат:гексан:метанол (29,4:68,6:2,0, об./об./об.). Фракции, содержащие ансамитоцины,объединяют и упаривают растворитель при пониженном давлении. Продукт дополнительно сушат в глубоком вакууме в течение 24 ч. Пример 4. Перекристаллизация ансамитоцинов. Сухой продукт, полученный на вышеуказанной стадии, растворяют в горячем этилацетате (23 мл/г остатка). Температуру смеси поддерживают в интервале от 60 до 75 С до тех пор, пока ансамитоцины полностью не растворятся. Медленно прибавляют гептан (80 мл/г остатка), поддерживая температуру партии 60-75 С. После прибавления всего гептана партии дают охладиться до комнатной температуры. Кристаллы отфильтровывают, затем сушат в глубоком вакууме и получают 221 г чистых ансамитоцинов. Пример 5. Экстракция ферментационного бульона с фильтрацией. Ферментационный бульон (200 мл), полученный, как описано в примере 2, энергично перемешивают в течение 5 мин в 200 мл н-бутилацетата (200 мл), получая эмульсию. Прибавляют вспомогательное фильтрующее вещество Cellatom FW-80 (20 г) и смесь фильтруют в вакууме через воронку Бюхнера, на которую предварительно нанесено вспомогательное фильтрующее вещество Cellatom FW-80. Слой на фильтре промывают 40 мл н-бутилацетата. Фильтрат, в котором теперь не имеется твердых загрязняющих веществ, содержащий чистые органический и водный слои, переносят в делительную воронку. Водную фазу отбрасывают. Органическую фазу, содержащую ансамитоцины, сохраняют. Пример 6. Экстракция ферментационного бульона путем центрифугирования с растворителем несмешивающимся с водой. Одну часть ферментационного бульона, полученного, как описано в примере 2, интенсивно перемешивают с одной частью н-бутилацетата в течение 2 мин. Полученную эмульсию центрифугируют в течение 1 мин и отбирают органический слой, содержащий ансамитоцины и несодержащий твердых загрязняющих веществ. Пример 7. Экстракция ферментационного бульона с центрифугированием растворителем, смешивающимся с водой. Одну часть ферментационного бульона, полученного, как описано в примере 2, интенсивно перемешивают с одной частью ацетона. Смесь центрифугируют в течение 1 мин, чтобы образовать осадок твердых веществ. Супернатант извлекают и смешивают с половинной частью смеси гексанов. Водный слой отделяется, оставляя прозрачную органическую фазу, содержащую ансамитоцины. Пример 8. Твердофазная экстракция ансамитоцинов с помощью XAD-16 гидрофобных гранул. 1 л ферментационного бульона, полученного, как описано в примере 2, перемешивают с 10 г гранулXAD-16 в течение 6 ч. Затем смесь центрифугируют и удаляют супернатант. Осадок переносят в небольшую колонку и элюируют деионизированной водой, затем деионизированной смесью вода:ацетонитрил (90:10). Фракции, содержащие ансамитоцины, объединяют и растворитель упаривают,получая 112 мг концентрированного экстракта. По данным ВЭЖХ анализа экстракт содержал 50 мг ансамитоцинов. Хотя изобретение подробно описано и имеются ссылки на конкретные варианты его осуществления, для специалиста средней квалификации в данной области техники должно быть очевидно, что могут быть сделаны различные изменения и модификации в пределах сути и объема притязаний настоящего изобретения. Все публикации, относящиеся к настоящему изобретению, специально включены путем ссылки.- 10012524 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения очищенных ансамитоцинов, включающий в себя стадии: 1) культивирования микроорганизма, продуцирующего ансамитоцин, в жидкой культуральной среде; 2) твердофазной экстракции ансамитоцинов из культуральной среды на гидрофобную смолу; 3) изократического или градиентного элюирования ансамитоцинов из смолы с использованием органического растворителя или органического растворителя в комбинации с водой; 4) концентрирования экстрагированных ансамитоцинов и 5) необязательно очистки ансамитоцинов любым одним из способов а), b), с) и d):a) адсорбционной хроматографией на силикагеле или оксиде алюминия,b) кристаллизацией,c) адсорбционной хроматографией на силикагеле или оксиде алюминия с последующей кристаллизацией иd) кристаллизацией с последующей адсорбционной хроматографией на силикагеле или оксиде алюминия,и в котором упомянутые ансамитоцины имеют следующую структурную формулу: где R представляет собой H, COCH3, COCH2CH3, COCH(CH3)2, COCH2CH2CH3, COCH2CH(CH3)2 или COCH2CH2CH2CH3. 2. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema spp. 3. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum. 4. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum ATCC 31565 или полученный из него штамм. 5. Способ по п.1, в котором микроорганизмом, продуцирующим ансамитоцин, является Actinosynnema pretiosum PF4-4 (ATCC PTA-3921) или полученный из него штамм. 6. Способ по любому из пп.1-5, в котором экстракцию проводят при рН около 6-7. 7. Способ по любому из пп.1-5, в котором экстракцию проводят при температуре около 30-45 С. 8. Способ по любому из пп.1-5, в котором культивирование проводят в культуральной среде при рН в диапазоне примерно от 6 до примерно 8. 9. Способ по п.8, в котором диапазон рН составляет примерно от 7,0 до примерно 7,4. 10. Способ по п.9, в котором рН составляет около 7,2. 11. Способ по п.8, в котором температура составляет от примерно 15 до примерно 35 С. 12. Способ по п.8, в котором температура составляет от примерно 25 до примерно 30 С. 13. Способ по п.8, в котором температура составляет около 28 С. 14. Способ по п.13, в котором температура составляет примерно 25 С и рН составляет примерно 7,2. 15. Способ по любому из пп.1-5, в котором во время культивирования обеспечивается по меньшей мере одно дополнительное питательное вещество. 16. Способ по п.15, в котором дополнительным питательным веществом является источник углерода. 17. Способ по п.15, в котором дополнительным питательным веществом является источник углерода с последующим источником углерода и белковым питательным веществом. 18. Способ по п.15, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамитоцина. 19. Способ по п.16, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамитоцина. 20. Способ по п.17, в котором во время культивирования дополнительно обеспечивается спирт или альдегид, который способствует образованию сложноэфирной боковой цепи в положении C-3 ансамито- 11012524 цина. 21. Способ по п.16, в котором источник углерода представляет собой глюкозу. 22. Способ по п.17, в котором источник углерода представляет собой глюкозу. 23. Способ по п.17, в котором белковое питательное вещество представляет собой порошок из семян хлопчатника или соевую муку. 24. Способ по п.19, в котором альдегид или спирт выбирают из группы, состоящей из изобутанола,изобутиральдегида, н-бутанола, н-бутиральдегида, н-пропанола, н-пропиональдегида, изопропанола,изопропиональдегида, пентанола, валеральдегида, изопентанола и изовалеральдегида. 25. Способ по п.20, в котором альдегид или спирт выбирают из группы, состоящей из изобутанола,изобутиральдегида, н-бутанола, н-бутиральдегида, н-пропанола, н-пропиональдегида, изопропанола,изопропиональдегида, пентанола, валеральдегида, изопентанола и изовалеральдегида. 26. Способ по п.15, в котором культивирование проводят при рН около 6,5-8,0. 27. Способ по п.15, в котором культивирование проводят при рН около 7,0-7,4. 28. Способ по п.15, в котором культивирование проводят при рН около 7,2. 29. Способ по п.15, в котором культивирование проводят при температуре около 15-35 С. 30. Способ по п.15, в котором культивирование проводят при температуре около 25-30 С. 31. Способ по п.15, в котором культивирование проводят при температуре около 28 С. 32. Способ по п.15, в котором культивирование проводят при температуре около 28 С и рН примерно 7,2. 33. Способ по любому из пп.1-5, дополнительно включающий в себя одну или несколько из стадий:(i) инактивирования микроорганизмов в культуральной среде химической или тепловой инактивацией;(ii) обработки культуральной среды перед стадией 2 для облегчения экстракции ансамитоцинов растворителем и(iii) промывки, где перед осаждением или после осаждения неочищенный раствор ансамитоцинов в органическом растворителе промывают водой, водным раствором соли, водным раствором кислоты или водным раствором основания в любой последовательности, которая может быть осуществлена во время очистки. Структуры ансамитоцинов
МПК / Метки
МПК: C12P 17/14, C12P 17/18, A61K 39/40, A61K 39/395, C12P 17/16, A61K 39/44
Метки: ансамитоцинов, способы, производства
Код ссылки
<a href="https://eas.patents.su/13-12524-sposoby-proizvodstva-ansamitocinov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы производства ансамитоцинов</a>