Применение производных бицикло [2.2.1] гептана для приготовления нейропротекторных фармацевтических композиций
Номер патента: 10868
Опубликовано: 30.12.2008
Авторы: Гачальи Иштван, Харшин Ласло Габор, Гиглер Габор, Мориц Кристина, Леваи Дьёрдь, Сенаши Габор, Шимо Аннамария
Формула / Реферат
1. Применение соединения формулы
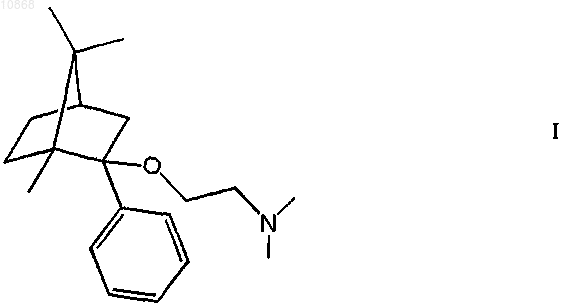
и его фармацевтически приемлемых кислотно-аддитивных солей для приготовления лекарственных препаратов для уменьшения последствий острых ишемических или травматических повреждений головного и спинного мозга, особенно различных типов инсульта или церебрального вазоспазма, тяжелой окклюзии сосудов головного мозга, потери нервных клеток и при повреждении головного и спинного мозга в результате несчастного случая, ее функциональных последствий, или для лечения болезни двигательных нейронов (бокового амиотрофического склероза), рассеянного склероза или болезни Крейтцфельдта-Якоба.
2. Применение по п.1, отличающееся тем, что кислотно-аддитивная соль соединения формулы I представляет собой (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат (дерамциклан-фумарат).
3. Применение по п.1, отличающееся тем, что соединение (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан или его фармацевтически приемлемая кислотно-аддитивная соль содержит не более 0,2% (1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1] гептан-2-она формулы II
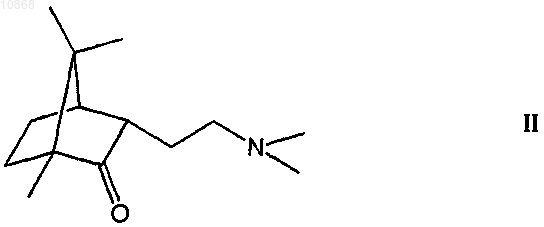
или его фармацевтически приемлемой кислотно-аддитивной соли.
4. Применение по п.3, отличающееся тем, что кислотно-аддитивная соль (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат содержит не более 0,2% (1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1]гептан-2-он-фумарата.
5. Применение по любому из пп.1-4, отличающееся тем, что лекарственные препараты представляют собой фармацевтические композиции, содержащие соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль в смеси с инертными твердыми или жидкими фармацевтическими носителями и/или вспомогательными веществами.
Текст
010868 Область техники, к которой относится изобретение Настоящее изобретение относится к новому терапевтическому применению производных бицикло[2.2.1]гептана. В частности, настоящее изобретение касается использования производных бицикло[2.2.1]гептана для приготовления фармацевтических композиций, обладающих нейропротекторным действием. Предшествующий уровень техники Известно, что производные 1,1,7-триметилдицикло[2.2.1]гептана, имеющие во 2 положении фенильный, фенилалкильный или тиенильный заместитель, обладают противосудорожным действием, ингибируют подвижность, усиливают действие гексобарбитального наркоза и обладают аналгетическим действием (GB 2065122). В патенте HU 212547 раскрыт один из представителей указанной группы соединений - (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан в форме свободного основания и его фармацевтически приемлемые соли, в частности фумарат. Дерамциклан показал значительные эффекты на различных животных моделях тревожности и стресса. В тесте наказуемого поведения по Вогелю (Vogel punished drinking test) дерамициклан был активным в дозах 1 и 10 мг/кг при пероральном приеме [Gacsalyi et al., Receptor binding profile and anxiolytic activity of deramciclane (EGIS-3886) in animal models (Профиль связывания с рецепторами и анксиолитическая активность дерамициклана (EGIS-3886) на животных моделях), Drug Dev. Res. 40: p. 338-348,(1997)]. В модели социального взаимодействия (social interaction model) соединение увеличивало время,затрачиваемое на внутригрупповые взаимодействия, после однократного перорального приема в дозе 0,7 мг/кг. В тесте свет-темнота (light-dark test) [Crawley, J.N. Neuropharmacological specifity of a simple(1981)] дерамциклан оказался активным при однократном пероральном приеме в дозе в 3 мг/кг подкожно. В тесте на зарывание шариков (marble burying test) [Broekkamp, С.L. et al., Major Tranquillizers Can BeDistinguished from Minor Tranquillisers on the Basis of Effects on Marble Burying and Swim-Induced Grooming in Mice. Eur. J. Pharmacol. 126: p. 223-229, (1986)] молекула была активной при пероральном введении в дозах 10 и 30 мг/кг. Дерамциклан оказался неэффективным в условиях теста приподнятого лабиринта (elevated plusmaze test), однако, при проведении этого теста он нейтрализовал тревогу, вызываемую CCK [Gacslyi etRes. 40: p. 338-348, (1997)]. Помимо такого анксиолитического действия дерамциклан продуцировал антидепрессантную активность в дозах 1 и 10 мг/кг, вводимых внутрибрюшинно, в тесте ученой беспомощности (learned helplessness test) - известной животной модели депрессии [Grial et al., Biol. Psychiatry, 23, 237-242 (1988)]. Исходя из своего рецепторного профиля, дерамциклан связывается, в первую очередь, с центральными 5-HT2C- и 5-HT2A-рецепторами. Анксиолитическое и антидепрессивное действия дерамциклана можно объяснить его сродством к этим 5-НТ-рецепторам. Дерамциклан высокой чистоты формулыN-Метильное производное дерамциклана формулы I описано в WO 98/17230. Данное соединение проявляет значительное анксиолитическое действие. Согласно одному аспекту настоящего изобретения предложено применение соединения формулы и его фармацевтически приемлемых кислотно-аддитивных солей для приготовления лекарственных препаратов, обладающих нейропротекторным действием. Настоящее изобретение основано на открытии того, что соединение формулы I защищает нервные клетки от повреждения, вызванного общей церебральной ишемией, и от последующих патологических изменений поведенческих параметров (спонтанная подвижность). Этот эффект не зависит от известного пути действия данного соединения, а также от его анксиолитических и снижающих стресс воздействий,ввиду того, что ритансерин, антагонист 5-HT2A/2C-рецепторов, т.е. соединение с подобным дерамциклану путем воздействия, не показал нейропротекторной активности на аналогичной модели ишемии (Piera,M.J., et al., Lack of efficacy of 5-HT2A receptor aritagonists to reduce brain damage after 3 minutes of transientglobal cerebral ischaemia in gerbils, Fundana. Clin. Pharmacol, 9: p. 562-568, 1995). Этот эффект соединения формулы I позволяет использовать его для лечения последствий острых повреждений головного и спинного мозга, например инсульта, церебрального вазоспазма и отмирания нервных клеток в результате повреждений головного и спинного мозга, вызванных несчастными случаями, а также позволяет использовать это соединение для улучшения поведенческих параметров, вызываемых потерей нервных клеток, и для лечения хронических нейродегенеративных расстройств, например рассеянного склероза, болезни двигательных нейронов (боковой амиотрофический склероз, БАС), болезни Крейтцфельдта-Якоба и др. Если не указано иначе, термины, использованные в данном описании изобретения, определены следующим образом. Термин "фармацевтически приемлемые кислотно-аддитивные соли" относится к солям, образованным с фармацевтически приемлемыми нетоксичными неорганическими или органическими кислотами. Для образования соли могут быть использованы, например, соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, уксусная кислота, муравьиная кислота, молочная кислота,винная кислота, малеиновая кислота, яблочная кислота, миндальная кислота, фумаровая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и т.д. Наиболее предпочтительны соли, образованные с фумаровой кислотой. Предпочтительным воплощением настоящего изобретения является применение соединения формулы I и его кислотно-аддитивных солей для приготовления лекарственных препаратов, подходящих для уменьшения последствий острых ишемических или травматических повреждений головного и спинного мозга, особенно различных типов инсульта или церебрального вазоспазма, тяжелых окклюзий сосудов головного мозга, потерь нервных клеток и их функциональных последствий при повреждении головного и спинного мозга в результате несчастного случая. Еще одним предпочтительным воплощением настоящего изобретения является применение соединения формулы I или его кислотно-аддитивных солей для приготовления лекарственных препаратов,подходящих для лечения нейродегенеративных расстройств. Еще одним предпочтительным воплощением настоящего изобретения является применение соединения формулы I или его кислотно-аддитивных солей для приготовления лекарственных препаратов,подходящих для лечения болезни двигательных нейронов (БАС), рассеянного склероза или болезни Крейтцфельдта-Якоба. Еще одним предпочтительным воплощением настоящего изобретения является применение соединения формулы I или его кислотно-аддитивных солей для приготовления лекарственных препаратов,подходящих для предупреждения инсульта; причем профилактическое лечение может быть начато после первого случая инсульта. Нейропротекторная доза соединения формулы I может варьироваться в широком интервале в зависимости от различных факторов, например активности данного активного ингредиента, массы тела, возраста и состояния пациента, тяжести заболевания, формы введения, и всегда определяется лечащим врачом. Предпочтительная суточная нейропротективная доза находится в интервале приблизительно от 0,1 до 150 мг/кг, в частности приблизительно от 1 до 150 мг/кг, особенно желательно от приблизительно 10 до 150 мг/кг. Соединение формулы I представляет собой (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7 триметилбицикло[2.2.1]гептан или его фармацевтически приемлемую кислотно-аддитивную соль, в частности (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат. При наиболее предпочтительном воплощении настоящего изобретения для приготовления нейропротекторных лекарственных препаратов может быть использован (1R,2S,4R)-(-)-2-(2-диметиламино-2 010868 этокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан формулы I или его фармацевтически приемлемые кислотно-аддитивные соли, в частности (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7 триметилбицикло[2.2.1]гептан-фумарат. Согласно особенно предпочтительному воплощению настоящего изобретения соединение формулы[2.2.1]гептан или его фармацевтически приемлемую кислотно-аддитивную соль, содержащие не более 0,2% (1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1]гептан-2-она формулы II или фармацевтически приемлемой кислотно-аддитивной соли. Согласно самому предпочтительному варианту указанного выше воплощения настоящего изобретения соединение формулы I представляет собой (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7 триметилбицикло[2.2.1]гептан-фумарат, содержащий не более 0,2% (1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1]гептан-2-он-фумарата. Настоящее изобретение также касается применения соединения формулы I или его фармацевтически приемлемых кислотно-аддитивных солей, где лекарственные препараты представляют собой нейропротекторные фармацевтические композиции, содержащие в качестве активного ингредиента соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль в смеси с фармацевтически приемлемыми твердыми или жидкими фармацевтическими носителями и/или вспомогательными веществами. Фармацевтические композиции по настоящему изобретению могут быть приготовлены известными в фармацевтической промышленности методами. Так, можно смешивать соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль с инертными твердыми или жидкими фармацевтическими носителями и/или вспомогательными агентами и изготавливать из этой смеси лекарственную форму. Нейропротекторные фармацевтические композиции согласно настоящему изобретению можно вводить перорально (в виде таблеток, таблеток с покрытием, твердых или мягких желатиновых капсул, растворов, суспензий и так далее), парентерально (например, в виде подкожных, внутримышечных, внутривенных инъекций), ректально (например, в суппозиториях) или назально (например, в виде аэрозолей). Активный ингредиент может быстро доставляться к месту действия из фармацевтических композиций, в этом случае продолжительность терапевтического воздействия на практике будет определяться длительностью действия активного ингредиента как такового. Однако нейропротекторные композиции настоящего изобретения также можно готовить в форме препаратов с замедленным высвобождением, в таком случае на продолжительность терапевтического воздействия будет влиять также и форма композиции(фармацевтические композиции с контролируемой, пролонгированной или замедленной доставкой активного ингредиента). Фармацевтические композиции настоящего изобретения могут быть приготовлены обычными методами фармацевтической промышленности. В качестве наполнителя таблетки и капсулы могут включать лактозу (моногидрат, безводную, порошкообразную, высушенную и т.д.), маннит, целлюлозу (порошкообразную, микрокристаллическую и т.д.). В качестве связующего агента можно использовать желатин, поливинилпирролидон (с различной молекулярной массой), целлюлоза эфирного типа (гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, метилцеллюлоза, этилцеллюлоза и т.д.), гидролизованный крахмал, растительная камедь(аравийская камедь, гуаровая камедь и т.д.) в водном растворе или в растворе, образованном с алифатическими спиртами, содержащими 1-4 атома углерода, в смеси с указанными растворителями. Подходящим дезинтегрантом может быть крахмал (картофельный крахмал, кукурузный крахмал, пшеничный крахмал и т.д.) или так называемый супердезинтегратор, например карбоксиметилцеллюлоза (коммерческое название Ac-di-sol), натрийкарбоксиметилкрахмал (коммерческое название Primojel, Ultraamilopektin, Explo-Tab), поливинилпирролидон (коммерческое название Poliplasdone) и т.д. В качестве смазывающих веществ могут использоваться стеараты (такие как стеарат магния, стеарат кальция), жирные кислоты (например, стеариновые кислоты), глицериды (коммерческое название Precirol, Cutina H), парафиновое масло, силиконовое масло, продукты (emergents) силиконового масла (тальк, диоксид кремния и т.д.). Активные ингредиенты и вспомогательные агенты могут быть обработаны влажной или сухой грануляцией или гомогенизацией отфильтрованного порошка для дальнейшего прессования и инкапсулирования. Твердые фармацевтические композиции с контролируемым или замедленным высвобождением могут быть приготовлены известными в фармацевтической промышленности методами. Такие композиции могут быть приготовлены в форме таблеток, содержащих различные замедляющие компоненты [например, гидрофильные полимеры, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза,карбоксиметилцеллюлоза, производные полиакрила, полисахарозы (например, гуаровая камедь, ксантановая камедь) и т.д., а также их смеси] или гидрофобные полимеры (например, этилцеллюлоза, сополимеры метакрилового эфира, поливинилацетат, поливинилбутирал и т.д.), а также их смеси. В других нейропротекторных композициях настоящего изобретения эффект замедления достигается за счет использования основы, включающей смесь гидрофильных и гидрофобных полимеров или смесь полимеров и жи-3 010868 ровых веществ. Кроме того, можно готовить многослойные таблетки, где активные ингредиенты включены в отдельные слои и, таким образом, профиль растворения активного ингредиента будет лучше отрегулирован в соответствии с его специфическими фармакокинетическими характеристиками. Нейропротекторные фармацевтические композиции с замедленным высвобождением согласно настоящему изобретению также могут быть приготовлены в виде гранул (pellets) с покрытием. Гранулы можно готовить отдельно от активного ингредиента или смеси, содержащей активный ингредиент. Гранулы могут быть приготовлены экструзией, или методами центробежного роторного гранулирования,или нанесением слоев на гранулы плацебо. Нанесение покрытий на гранулы может выполняться во вращающемся аппарате с псевдоожиженным слоем. В качестве покрывающего агента могут быть использованы растворы или дисперсии не растворимых в воде полимеров, образованные с органическими растворителями (предпочтительно с алифатическими спиртами, содержащими 1-3 атома углерода, и/или хлорированными углеводородами, содержащими 1-2 атома углерода, и/или ацетоном, и/или этилацетатом,либо с их смесями). Нейропротекторные фармацевтические композиции согласно настоящему изобретению также могут быть приготовлены и использованы в форме осмотических или диффузионно-осмотических препаратов. Готовят таблетки, содержащие активный ингредиент и гидрофильные полимеры (например, гидроксипропилметилцеллюлозу), и покрывают их слоем пленки, или полупроницаемой для активного ингредиента (например, из ацетата целлюлозы), или проницаемой для него (например, из сополимера аминометакрилата), после чего в указанном слое делают отверстие, через которое активный ингредиент визуально наблюдаемо выталкивается в водную среду. Нейропротекторное действие соединения формулы I продемонстрировано с помощью нижеприведенных тестов. В качестве соединения формулы I использован (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат (дерамциклан-фумарат). Нейропротекторное действие дерамциклана показано на модели обширной церебральной ишемии,индуцированной билатеральной окклюзией сонной артерии. В наших экспериментах использовали самцов монгольской песчанки массой 50-80 г. Дерамциклан вводили в дозе 330 мг/кг внутрибрюшинно за 60 мин до и через 30 и 90 мин после операции. Дерамциклан суспендировали в 0,4% растворе метилцеллюлозы. Под эфирным наркозом правую и левую общие сонные артерии обнажали путем цервикального рассечения по средней линии спереди и освобождали от блуждающих нервов и окружающих тканей. Полного перекрытия кровотока через сонную артерию достигали пережатием аневризмы с помощью зажима в течение 3 мин. Во время операции температуру тела животных поддерживали на индивидуальном предоперационном уровне (37,50,5 С) с помощью грелки-подстилки и нагревающей лампы. Поскольку известно, что общая церебральная ишемия индуцирует у животных гиперактивность,которая, как установлено, тесно связана со степенью тяжести поражения гиппокампа (Gerhardt, S.С. et al.,Motor activity changes following cerebral ischemia ingerbils are correlated with the degree of neuronal degeneration in hippocampus, Behav. Neurosci. 102: p. 301-303, 1988), через четыре дня после операции оценивали двигательную активность животных в симметричном Y-лабиринте (с длиной проходов 40 см, шириной - 10 см и высотой стенок - 21,5 см). Монгольских песчанок помещали в центр лабиринта, затем в течение 5 мин регистрировали количество их заходов в три прохода. По определению считалось, что животное зашло в проход, если оно зашло в него и прошло расстояние, равное, по меньшей мере, длине тела. Также считали, что песчанка вышла из прохода, если она покинула его полностью. Различия между группами оценивали статистически с помощью метода Kruskal-Wallis ANOVA. В случае р 0,05 для парных сравнений использовали значение Mann-Whitney U-теста. После изучения поведения животным делали наркоз 60 мг/кг пентобарбитала (10 мл/кг внутрибрюшинно) и заливали через сердце сначала физиологический раствор, затем фиксирующий раствор,содержащий 0,1% глутарового альдегида, 4% параформальдегида и 0,2% пикриновой кислоты в 0,1 М фосфатном буфере с рН 7,4, в течение 30 мин. Мозг извлекали из черепа и фиксировали в течение по меньшей мере 1 недели при температуре 4 С в том же фиксирующем растворе. Из различных уровней дорсального гиппокампа с помощью микротома вырезали перемежающиеся венечные срезы толщиной 60 мкм. Срезы многократно промывали в 0,1 М фосфатном буфере, а затем окрашивали, пропитывая серебром. Срезы изучали под световым микроскопом и оценивали полное повреждение нервных клеток в подобласти СА 1 обоих гиппокампов по шестибальной шкале: (0) без повреждений, (1) потеря клеток 10%,(2) потеря клеток 10-30%, (3) потеря клеток 30-50%, (4) потеря клеток 50-70%, (5) потеря клеток 70-90% и (6) потеря клеток 90-100%. Групповые различия между группами, принимавшими лекарственные препараты и принимавшими наполнитель, анализировали статистически с помощью Mann-Whitney U-теста. Полученные результаты представлены в табл. 1.-4 010868 Таблица 1 Эффект дерамциклана на гибель пирамидальных нейронов СА 1 гиппокампа и гиперподвижность животных после 3 мин билатеральной окклюзии сонной артерии (БОСА), приводящей к обширной ишемии р 0,01 статистическая значимость значение по сравнению с ложнооперированной группой (Mann-Whitney U-тест, затем Kruskal-Wallis ANOVA), р 0,01 статистическая значимость по сравнению с БОСА-группой (Mann-Whitney Uтест, затем Kruskal-Wallis ANOVA). Приведенные выше результаты подтвердили, что дерамциклан в использованной дозе значительно снижал долю погибших клеток в области СА 1 гиппокампа и уменьшал двигательную активность животных до нормального уровня с одновременным улучшением гистологической оценки. Дерамциклан не только предохранял от гибели нервные клетки, но был также эффективным в плане нормализации клинически важных поведенческих аномалий. Как показали результаты, полученные в опытах на животных, дерамциклан предохранял от потери нервных клеток в результате обширной церебральной ишемии, а также от поведенческих аномалий, приводящих впоследствии к гибели нервных клеток. Такой неожиданный эффект дерамциклана было невозможно предсказать, поскольку ритансерин, также воздействующий на 5-HT2A/2C и обладающий анксиолитическим действием в опытах на животных, не продуцировал нейропротекторного действия на этой модели. Заключение: согласно открытию, описанному в настоящем изобретения, дерамциклан обладает нейропротекторной активностью, поскольку данное соединение значительно уменьшало гибель нервных клеток в области СА 1 гиппокампа, а также снижало гиперактивность, являвшуюся следствием гибели нервных клеток, наблюдавшейся в течение четырех дней после обширной церебральной ишемии, вызванной билатеральной окклюзией общей сонной артерии у монгольских песчанок. На основании всего вышесказанного, терапевтическое применение дерамциклана может быть полезным для лечения острых ишемических или травматических повреждений головного или спинного мозга, например, различных форм инсультов, церебрального вазоспазма, тяжелого стеноза церебральных сосудов, повреждений головы и спинного мозга в результате несчастного случая и так далее, так как оно может снизить степень разрушения нервных клеток, а посредством этого - серьезность функциональной недостаточности, вызванной потерей нервных клеток; а также для лечения хронических нейродегенеративных расстройств,например бокового амиотрофического склероза (БАС), рассеянного склероза и болезни КрейтцфельдтаЯкоба и т.д., что позволит замедлить или остановить гибель нервных клеток, а посредством этого - развитие заболеваний при всех болезненных состояниях или статусах, при которых имеет место повреждение или гибель отдельных или всех нервных клеток либо их части. Дополнительные детали настоящего изобретения можно найти в следующих примерах без ограничения этими примерами объема защиты. Пример 1. Таблетки следующего состава готовили известными в фармацевтической промышленности методами: и его фармацевтически приемлемых кислотно-аддитивных солей для приготовления лекарственных препаратов для уменьшения последствий острых ишемических или травматических повреждений головного и спинного мозга, особенно различных типов инсульта или церебрального вазоспазма, тяжелой окклюзии сосудов головного мозга, потери нервных клеток и при повреждении головного и спинного мозга в результате несчастного случая, ее функциональных последствий, или для лечения болезни двигательных нейронов (бокового амиотрофического склероза), рассеянного склероза или болезни КрейтцфельдтаЯкоба. 2. Применение по п.1, отличающееся тем, что кислотно-аддитивная соль соединения формулы I представляет собой (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат (дерамциклан-фумарат). 3. Применение по п.1, отличающееся тем, что соединение (1R,2S,4R)-(-)-2-(2-диметиламиноэтокси)2-фенил-1,7,7-триметилбицикло[2.2.1]гептан или его фармацевтически приемлемая кислотно-аддитивная соль содержит не более 0,2% (1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1] гептан-2-она формулы II или его фармацевтически приемлемой кислотно-аддитивной соли. 4. Применение по п.3, отличающееся тем, что кислотно-аддитивная соль (1R,2S,4R)-(-)-2-(2 диметиламиноэтокси)-2-фенил-1,7,7-триметилбицикло[2.2.1]гептан-фумарат содержит не более 0,2%(1R,3S,4R)-3-[2-(N,N-диметиламиноэтил)]-1,7,7-триметилбицикло[2.2.1]гептан-2-он-фумарата. 5. Применение по любому из пп.1-4, отличающееся тем, что лекарственные препараты представляют собой фармацевтические композиции, содержащие соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль в смеси с инертными твердыми или жидкими фармацевтическими носителями и/или вспомогательными веществами.
МПК / Метки
МПК: A61P 25/28, A61K 31/135
Метки: нейропротекторных, приготовления, 2.2.1, фармацевтических, бицикло, композиций, применение, производных, гептана
Код ссылки
<a href="https://eas.patents.su/7-10868-primenenie-proizvodnyh-biciklo-221-geptana-dlya-prigotovleniya-nejjroprotektornyh-farmacevticheskih-kompozicijj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение производных бицикло [2.2.1] гептана для приготовления нейропротекторных фармацевтических композиций</a>
Предыдущий патент: Новая кристаллическая форма iv агомелатина, способ её получения и фармацевтические композиции, которые её содержат
Следующий патент: Производные 4-(2-фенилсульфанилфенил)пиперидина в качестве ингибиторов повторного поглощения серотонина
Случайный патент: Устройство для предотвращения загрязнения подземных вод











