Способ получения производных 2-азадигидроксибицикло[2.2.1]гептана и l-виннокислой соли производного
Номер патента: 2438
Опубликовано: 25.04.2002
Авторы: Дюран Тьерри, Леон Патрик, Пауэрз Мэттью, Ларго Дени, О`брайен Майкл
Формула / Реферат
1. Способ получения производного 2-азадигидроксибицикло-[2.2.1]гептана формулы

где * обозначает R-хиральность, *' обозначает S-хиральностъ, R представляет водород или, соответственно, группу формулы

где R1 обозначает С1-С4алкил и Аr представляет фенил или a-нафтил или b -нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, C1-С4алкил, С1-С4алкокси или нитро,
включающий бисгидроксилирование производного бицикло[2.2.1]-гептена формулы
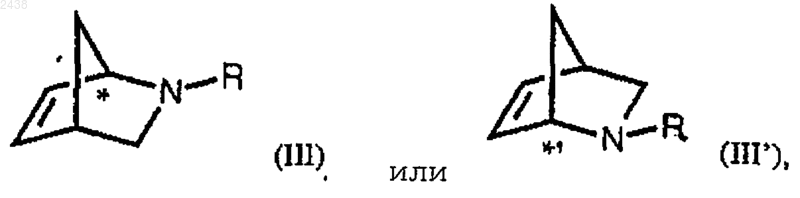
в присутствии от около 0,1 до около 5 мол.% осмата металла или от около 0,06 до около 0,07 мол.% тетроксида осмия и окислителя, способного регенерировать тетроксид осмия.
2. Способ по п.1, где R представляет собой группу формулы

3. Способ по п.2, где R1 представляет метил или этил и Аr представляет необязательно замещенный фенил, который, когда замещен, то замещен одним или несколькими метилом или метокси.
4. Способ по п.3, где R1 представляет метил и Аr представляет фенил.
5. Способ по п.1, где бисгидроксилирование осуществляют с использованием тетроксида осмия в количестве от около 0,06 до около 0,07 мол.%.
6. Способ по п.5, где тетроксид осмия присутствует в количестве около 0,06 мол.%.
7. Способ по п.1, где бисгидроксилирование осуществляют, используя осмат металла в количестве от около 0,1 до около 5 мол.%.
8. Способ по п.7, где осмат металла присутствует в количестве от около 0,2 до около 0,5 мол.%.
9. Способ по п.1, где осматом металла является К2OsO4ъ2Н2O.
10. Способ по п.1, где окислителем, способным регенерировать тетроксид осмия, является N-метилморфолиноксид.
11. Способ получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло [2.2.1]гептана по п.1, включающий обработку L-винной кислотой (1R) диастереомера производного 2-азадигидроксибицикло [2.2.1]гептана по п.1, где R представляет группу формулу
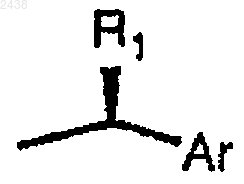
где R1 обозначает С1-С4алкил и Аr представляет фенил или a-нафтил или b-нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, C1-С4алкил, С1-С4алкокси или нитро.
12. Способ по п.11, где R1 представляет метил и Аr представляет фенил.
13. Способ по п.11, дополнительно включающий получение L-виннокислой соли (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана, по существу, в энантиомерно очищенном состоянии в присутствии (1S) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана.
14. Способ по п.11, где обработку осуществляют в смеси водно-органического растворителя.
15. Способ по п.14, где органическим растворителем является изопропанол.
16. Способ по п.14, где обработку осуществляют в смеси вода-изопропанол, имеющей объемное соотношение компонентов от около 30:70 до около 15:85.
17. Способ по п.16, где объемное соотношение составляет около 25:75.
18. Соединение формулы
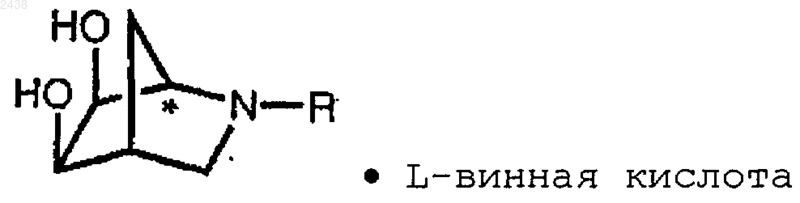
где R определен в п.11.
Текст
1 Область техники Настоящее изобретение относится к способу получения производного 2-азадигидроксибицикло[2.2.1]гептана. Изобретение относится также к L-виннокислой соли (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1] гептана и ее получению. Кроме того, изобретение относится к способу бис O-защиты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана и способу окисления производных (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана до соответствующего производного лактама. В патенте США 5284769 описывается,что производное лактама, которое охватывается производным лактама, полученным в соответствии с изобретением, может использоваться как синтон для получения фармацевтически активных средств. J.Chen et al., Tet. Lett., 30 5543(1989) описывают производное лактама, которое охватывается производным лактама, полученным согласно изобретению, как используемое для получения вещества, являющегося агонистом аденозина. Предшествующий уровень техникиC.K.-F. Chui, Syn. Comm., 26 (3), 577 (1996) описывает разделение смеси диастереомеров производных бициклогептенамина формул (i) иChui не описаны способы разделения бисгидроксилированных продуктов диастереомерной смеси.S.J.C. Taylor et al., Tetrahedron: Asymmetry,4 (6), 1117 (1993) описывают ферментативное разделение лактама формулы (iii) с получением энантиомеров формул (iv) и (v)S.J.C. Taylor et al. не описывают никаких способов разделения бисгидроксилированных продуктов лактама (III). В патенте США 5284769 описано ферментативное разделение лактама формулы (vi) с получением энантиомеров лактама. В патенте США 5284769 не описаны никакие способы 2 разделения бисгидроксилированных продуктов лактама (vi). Сущность изобретения Способ в соответствии с изобретением относится к получению производного 2-азадигидроксибицикло[2.2.1]гептана формулы где R1 представляет алкил и Аr представляет необязательно замещенный арил, которое заключается в бисгидроксилировании производного бицикло[2.2.1]гептена формулы где , ' и R указаны выше, в присутствии от около 0,1 до около 5 мол.% осмата металла или от около 0,06 до около 0,07 мол.% тетроксида осмия и окислителя, способного регенерировать тетроксид осмия. Данное изобретение относится также к обработке (1R) диастереомера производного 2 азадигидроксибицикло[2.2.1]гептана (I), где R представляет группу формулы II, L-винной кислотой и к его L-виннокислой соли. Кроме того,изобретение относится к применению (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана или его соли при катализируемой кислотой реакции ацетализации или кетализации, которая приводит к защите дигидрокси его частей в изопропаноле. Кроме того,изобретение относится к окислению бис О-защищенного производного (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана в соответствующее производное лактама в присутствии от около 0,01 до около 1 мол.% RuO2 или его гидрата приблизительно 3 эквивалентами окислителя с получением производного лактама с энантиомерным избытком ("эи"), более или равным 95%. Подробное описание изобретения Следует учесть, что, как здесь используется, следующие термины, используемые выше и на протяжении всего описания, если не оговорено особо, имеют следующие значения."Алкил" означает алифатическую углеводородную группу, которая может быть прямой или разветвленной, имеющей от 1 до 4 атомов углерода. Примеры алкильных групп включают метил, этил, изопропил и трет-бутил."Необязательно замещенный метилен" означает -CH2- или такую группу, где атомы водорода заменены, независимо, одной или двумя группами, которые могут быть одинаковыми или различными, выбранными из алкила или 3 фенила, или заменены таким образом, что вместе с углеродным атомом метилена образуют циклоалкил."Арил" означает необязательно замещенный фенил или необязательно замещенный или -нафтил. Замещенный арил замещен одним или несколькими заместителями арильной группы, которые могут быть одинаковыми или разными и включают галоген, алкил, алкокси или нитро."Алкокси" означает алкил-O-группу, где алкильная группа описана выше. Примеры алкоксигруппы включают метокси, этокси, изопропокси и трет-бутокси."Циклоалкил" означает алифатическое циклическое кольцо из 5-6 атомов углерода. Примером циклоалкильной группы является циклогексил."Ацил" означает алкил-СО-группу, где алкильная группа описана выше. Примеры ацильных групп включают ацетил и пропаноил."Ароил" означает арил-СО-группу, где арильная группа описана выше. Примером арильной группы является бензоил."Окислитель, способный регенерировать тетроксид осмия," означает окислитель, который будет окислять осмий в осмате металла(Оs+6) до тетроксида осмия (Os+8) или вновь окислять тетроксид осмия, восстанавливаемый в процессе бисгидроксилирования в тетроксид осмия (Os+8). Примеры окислителей, способных регенерировать тетроксид осмия, включают Nме-тилморфолиноксид или триэтиламиноксид и феррицианид калия К 3[Fе(СN)6], предпочтительным является N-метилморфолиноксид."Осмат металла" означает соль соединения, образованную Mn+, катионом металла, где n равно 1 или 2, и комплексом аниона оксида осмия [OsO4]-2, или гидраты соли. Препочтительными осматами металлов являются осматы щелочных или щелочно-земельных металлов, включая осматы натрия, калия, рубидия, цезия, кальция и бария, более предпочтителен К 2 ОsO4.2 Н 2O. Примеры способов, используемых для получения осматов металлов, описаны Б.Н. ИвановымЕминым и др., Ж. неорг. хим., 31 (5) 1238 (1986);"Его соль" означает соединение с основной частью, нейтрализованной кислотой с образованием соответствующей соли присоединения кислоты. Кислоты, которые можно использовать для получения солей присоединения кислот,включают, предпочтительно, кислоты, которые дают при взаимодействии со свободным основанием фармацевтически приемлемые соли, т.е. соли, анионы которых нетоксичны для пациен 002438 4 та, и поэтому последующее использование соли присоединения кислоты не ограничивается из-за проявления химически реакционной активности соли. Соль присоединения кислоты может использоваться, например, как источник для регенерации исходного основания путем обработки основанием, таким как щелочь, с целью очистки и/или идентификации или с целью взаимопревращения в другую соль присоединения кислоты путем ионнообменных методов. Примеры солей присоединения кислот включают охватывающие следующие кислоты: минеральные кислоты, такие как бромисто-водородная кислота,хлористо-водородная кислота, серная кислота,фосфорная кислота и сульфаминовая кислота; и органические кислоты, такие как уксусная кислота, лимонная кислота, молочная кислота,винная кислота, дибензоилвинная кислота, малоновая кислота, янтарная кислота, 2,3 диметоксиянтарная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфокислота,п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и тому подобное. Предпочтительные варианты осуществления изобретения Конкретным осуществлением способа бисгидроксилирования в соответствии с изобретением является такой, когда R представляет группу формулы II или II'. Предпочтительным осуществлением способа бисгидроксилирования в соответствии с изобретением является такой, когда R1 представляет метил или этил и Аr представляет необязательно замещенный фенил, который, когда замещен, то замещен одним или несколькими метилом или метокси. Более предпочтительным вариантом осуществления способа бисгидроксилирования в соответствии с изобретением является такой,когда R1 представляет метил и Аr представляет фенил. По предпочтительному варианту осуществления бисгидроксилирования используется тетроксид осмия в количестве от около 0,06 до около 0,07 мол.%., более предпочтительно около 0,06 мол.%. В другом предпочтительном варианте осуществления бисгидроксилирования используют осмат металла в количестве от около 0,1 до около 5 мол. % , более предпочтительно от около 0,2 до около 0,5 мол.%. В еще одном предпочтительном варианте осуществления бисгидроксилирования в качестве осмата металла используют осмат щелочного или щелочно-земельного металла, более предпочтителен К 2OsO4.2H2O. Конкретным примером получения соли Lвинной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана, т.е. в соответствии с изобретением является такой,когда R представляет собой группу формулы II. Предпочтительным вариантом осуществления способа получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана является такой,когда R1 представляет собой метил и Аr представляет фенил. Другой конкретный вариант осуществления по изобретению заключается в получении соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1] гептана, по существу, в энантиомерно чистом виде в присутствии (1S) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана. Предпочтительным вариантом получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1] гептана, в соответствии с изобретением, является такой, когда получение проводят в смеси водно-органического растворителя. Более предпочтительным вариантом получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана является такой, когда органическим растворителем является изопропанол(ИП). Еще одним предпочтительным вариантом получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана является такой, когда получение проводят в смеси вода-ИП с объемным соотношением от около 30:70 до около 15:85, более предпочтительно около 25:75. Основные параметры препаративных методов указаны выше и далее. Обычно бисгидроксилирование осуществляют в условиях, описанных V. VanRheenen etal., Tetrahedron Letters, vol.23, 1973-1976 (1976). Окислитель должен осуществлять бисгидроксилирование в экзоформе. Более конкретно, окисление может быть выполнено с помощью перманганата калия или тетроксида осмия или осмата металла и проводится в присутствии Nметилморфолиноксида или оксида триэтиламина или феррицианида калия К 3[Fе(СN)6]. В соответствии с изобретением, тетроксид осмия используют в каталитическом количестве, что приводит к более эффективному контролю за остатками осмия в продукте. Реакция с участием осмия может проходить уже при таком его небольшом содержании, как от около 0,06 до около 0,1 мол.%, что занимает, соответственно, от около 21 до около 5 ч. Предпочтительно,взаимодействие проходит в присутствии приблизительно 0,06 мол.% тетроксида осмия. Окисление может проходить в среде водноорганического растворителя, такого как вода 002438 6 трет-бутанол или вода-ацетон, более предпочтительна вода-ацетон. Эфирный растворитель,такой как трет-бутилметиловый эфир или диизопропиловый эфир, могут дополнительно присутствовать, когда окисление проходит в среде растворителя вода-ацетон. Предпочтительный диапазон объемных количеств в смеси эфир:ацетон:вода составляет от 1,9:16,7:1 до 11,1:7,4:1, более предпочтительно от 11,1:16,7:1 до 16,7;16,7:1. Бисгидроксилирование также может быть выполнено тем же способом с использованием смеси диастереомеров (I) и (I'), т.е. без необходимости их разделения перед проведением бисгидроксилирования.(1R) диастереомер формулы I, где R является группой формулы II, может быть выделен в виде солей оптически активных органических кислот и, более конкретно, из смеси диастереомерных соединений формул I и I' путем диастереоселективной кристаллизации с использованием таких оптически активных органических кислот. Одной из используемых оптически активных органических кислот является L-диметоксиянтарная кислота. Получение соли с использованием L-диметоксиянтарной кислоты проводят в подходящем органическом растворителе, таком как кетон или алифатический спирт, особенно предпочтителен ИП. В соответствии с изобретением, L-винная кислота представляет другую подходящую оптически активную органическую кислоту. Получение соли с использованием L-винной кислоты проводят в растворителе, таком как водно-органический растворитель, где органическим растворителем может быть алифатический спирт, такой как ИП. Благодаря использованию L-винной кислоты достигаются повышенный выход и энантиомерная чистота желаемого диастереомера (I). Настоящее изобретение также включает выделение (1S) диастереомера производного формулы I', используя оптически-активные органические кислоты противоположной конфигурации по отношению к тем, которые описаны для выделения (1R) диастереомера производного формулы I. Исходные продукты и промежуточные продукты получают с помощью известных методов или их адаптацией. Соединения формул где , ', R1 и Аr определены выше, могут быть получены реакцией Дильса-Альдера из смеси гомохиральных аминов формулP.A. Grieco в J. Am. Chem. Soc., vol.107, 17681769 (1985). Этот способ приводит к смеси двух диастереомеров. Диастереомеры могут быть разделены путем использованияChiu в Syn. Comm., 26 (3), 577 (1996). Соединения формул III и III', где R представляет водород, могут быть получены гидрированием соединений формул XIII и XIII' двухстадийным способом. Сначала соединения обрабатывают 2,2,2-трихлорэтоксикарбонил (Тrос) хлоридом или -(триметилсилил)этоксикарбонил (Теос) хлоридом с получением соответствующих Тrос- или Теос-производных (карбаматов), затем обрабатывают Zn в спиртовом расторителе, например этаноле, при нагревании или Zn в растворителе, органической кислоте,такой как уксусная кислота, при комнатной температуре. Настоящее изобретение далее иллюстрируется, но не ограничивается, следующими примерами получения соединений, в соответствии с данным изобретением. В спектрах ядерного магнитного резонанса(ЯМР) химические сдвиги выражены в м.д.(ррm) (миллионные доли) относительно тетраметилсилана. Сокращения имеют следующие значения: с=синглет, д=дублет, т=триплет,м=мультиплет, дд=дублет дублетов, ддд=дублет дублетов дублетов, дт=дублет триплетов,ш=широкий. Пример 1 а. Получение 2-(-S-метилбензил)-2-азабицикло-[2.2.1]гепт-5-ена. В 2 л реактор загружают 255 г (S)-(-)-метилбензиламина и 300 мл воды. Суспензию охлаждают до -5 С и в течение 1 ч при помешивании добавляют раствор 185 мл концентрированной НСl в 100 мл воды. рН смеси устанавливают между 5 и 6,5. Перемешивание продолжают в течение 30 мин и затем загружают 242 мл 37% раствора формальдегида. После перемешивания в течение еще 40 мин перегоняют (270 мл) циклопентадиен прямо в реакционную смесь. Полученную смесь энергично перемешивают в течение ночи при -5 С. Завершение реакции определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Образовавшиеся два слоя разделяют и водный слой промывают 250 мл гептана перед тем, как подщелочить до рН 11 с помощью 168 мл 50%-ного раствора NaOH и колотого льда. Органическую смесь затем экстрагируют 2 х 500 мл и 2 х 300 мл порциями EtOAc. Объединенные экстракты промывают 200 мл холодной воды, затем 200 мл насыщенного раствора NaCl,высушивают над безводным Na2SO4 и фильтруют. Прозрачный фильтрат концентрируют на роторном испарителе с получением 408,4 г(д, 2 Н), 7,33 (д, 2 Н); МC (EI, 70 эв) m/z (относительная интенсивность): 199 (М+, 70). Пример 1b. Получение 2-(-S-метилбензил)-2-азабицикло[2.2.1]гепт-5-ена. В 250 мл трехгорлую колбу, снабженную обратным холодильником и мешалкой, в атмосфере аргона загружают раствор, состоящий из 20 г (S)-(-)метилбензиламина (165 ммоль) в 60 мл воды, рН раствора которого доведен до 6,1 с помощью 17 мл 36% НСl (в/об). После охлаждения до 5 С добавляют 20 мл 37% водного раствора (в/об) формальдегида. Раствор перемешивают в течение 5 мин при 5 С; затем добавляют 21,8 г (330 ммоль) циклопентадиена. Смесь перемешивают в течение 16 ч при температуре от -5 до 0 С. Водную фазу отделяют декантацией и промывают 50 мл пентана. Нейтрализуют концентрированным раствором NaOH до рН 8. Затем проводят 2 экстракции EtOAc,каждая по 70 мл. рН водной фазы устанавливают равным 11 путем добавления концентрированного раствора NaOH. Затем проводят еще 2 экстракции EtOAc по 70 мл. Органические фазы объединяют и затем промывают два раза по 50 мл воды и высушивают над Na2SO4. После фильтрации и отгонки растворителя досуха при пониженном давлении получают 33,1 г 2-(-Sметилбензил)-2-азабицикло[2.2.1]гепт-5-ена в виде светло-желтого масла. Пример 2. Получение 5R,6S-дигидрокси-2(-S-метилбензил)-2-азабицикло[2.2.1]гептана. В 500 мл трехгорлую колбу, снабженную обратным холодильником и мешалкой, содержащую раствор 20 г 2-(-S-метилбензил)-2-азабицикло[2.2.1]гепт-5-ена (75,34 ммоль) в 220 мл трет-бутанола, добавляют 12 г N-метилморфолиноксида в 32 мл воды при температуре около 25 С и затем медленно добавляют 6,3 мл 25%(в/об) раствора тетроксида осмия (OsO4) в третбутаноле. Перемешивание продолжают в течение 2 ч при температуре приблизительно 20 С,после чего еще 3 ч при 65 С. После упаривания трет-бутанола при пониженном давлении остаток вновь растворяют в 350 мл ИП. После концентрирования досуха при пониженном давлении получают 24 г цис-5,6-дигидрокси-2-(-Sметилбензил)-2-азабицикло[2.2.1]гептана в виде масла. Путем кристаллизации в циклогексане получают 14 г 5R,6S-дигидрокси-2-(-3-метилбензил)-2-азабицикло[2.2.1]гептана с изомерной чистотой более 95%. ЯМР спектр, определенный в дейтерохлорофороме, показывает следующие химические сдвиги : 1,21 (3 Н, д), 1,38 (1 Н, д), 1,59 (1 Н, д), 9 2,22 (2 Н, м), 2,45 (1 Н, дд), 2,95 (1 Н, с), 3,99 (1 Н,к), 3,78 (1 Н, д), 3,90 (1 Н, д), 7,28 (5 Н, м). Пример 3 а. Получение 5R,6S-дигидрокси-2(-S-метилбензил)-2-азабицикло[2.2.1]гептана. Раствор 0,5 ммоль смеси (78/22 в моль) 5R,6S-дигидрокси-2-(-3-метилбензил)-2-азабицикло[2.2.1]гептана и 5S,6R-дигидрокси-2-(-Sметилбензил)-2-азабицикло[2.2.1]гептана и 0,5 ммоль L-диметоксиянтарной кислоты в 1 мл ИП перемешивают в течение 24 ч при температуре в пределах от 25 С вначале до 5 С. Полученные кристаллы отделяют фильтрацией и высушивают. Таким образом получают 110 мг 5R,6Sдигидрокси-2-(-S-метилбензил)-2-азабицикло[2.2.1]гептана с энантиомерным избытком 97%. Смесь 5R,6S-дигидрокси-2-(-S-метилбензил)-2-азабицикло[2.2.1]гептана и 5S,6R-дигидрокси-2-(-S-метилбензил)-2-азабицикло[2.2.1] гептана (78/22 в моль) может быть получена следующим образом. В 250 мл круглодонную трехгорлую колбу,снабженную обратным холодильником и мешалкой, содержащую раствор 7 г 2-(-S-метилбензил)-2-азабицикло[2.2.1]гепт-5-ена (35 ммоль) в 70 мл трет-бутанола, добавляют при температуре около 25 С 4,12 г N-метилморфолиноксида в 11 мл воды и затем медленно добавляют 360 мл 2,5% раствора (в/об) тетроксида осмия(OsO4) в трет-бутаноле. Смесь перемешивают в течение 1 ч при температуре около 20 С и затем в течение 4 ч при 65 С. После упаривания трет-бутанола при пониженном давлении остаток обрабатывают 150 мл ИП. После концентрирования досуха при пониженном давлении получают 8,27 г продукта, протонный ЯМР спектр которого показывает, что он состоит из смеси (78/22 в моль) 5R,6Sдигидрокси-2-(-S-метилбензил)-2 азабицикло[2.2.1]гептана и 5S,6R-дигидрокси-2(-S-ме-тилбензил)-2-азабицикло[2.2.1]гептана. Пример 3b. Получение 5R,6S-дигидрокси-2(-S-метилбензил)-2-азабицикло[2.2.1]гептана. В 50 мл одногорлую круглодонную колбу,снабженную магнитной мешалкой и обратным холодильником, загружают 1 г 2-(-S-метилбензил)-2-азабицикло[2.2.1]гепт-5-ена (5 ммоль),2,5 мл диизопропилового эфира, 2,5 мл ацетона,0,9 мл 58% маc. водного N-метилморфолиноксида и 0,15 мл воды. Смесь перемешивают в течение 5 мин и сразу загружают 9 мг твердогоK2OsO4.2H2O и продолжают перемешивание при комнатной температуре в течение 25 мин. Смесь затем перемешивают при кипячении с обратным холодильником в течение 7,5 ч. По истечении этого времени ВЭЖХ показывает 95%-ное завершение реакции окисления. К коричневой смеси, охлажденной до комнатной температуры, добавляют раствор 630 мг сульфита натрия в 4 мл воды. Двухфазную смесь перемешивают при комнатной температуре в 10 течение 1 ч. Большую часть органических растворителей упаривают при пониженном давлении, добавляют 5 мл диизопропилового эфира. Водную фазу отделяют декантацией и повторно экстрагируют 2 х 5 мл диизопропилового эфира. Объединенные органические фазы промывают водным насыщенным раствором хлорида натрия, высушивают над Na2SO4, фильтруют и перегоняют при пониженном давлении с получением 1,04 г (89%, скорректированный выход 86%) 5R,6S-дигидрокси-2-(-S-метилбензил)-2 азабицикло[2.2.1]гептана в виде масла, которое кристаллизуется при стоянии. Чистота продукта составляет 95 мол.% согласно данным 1H ЯМР в СDСl3 (содержит 4 мол.%. N-метилморфолина + 0,6 мол.% исходного продукта). Пример 3 с. Получение L-тартрата 5R,6Sдигидрокcи-2-(-S-метилбензил)-2-азабицикло[2.2.1]гептана. В 2 л реактор загружают 210 г 2-(-Sметилбензил)-2-азабицикло[2.2.1]гепт-5-ена,1200 мл 2-метил-2-пропана и 182 мл 4 метилморфолин N-оксида. К этой смеси по каплям добавляют 8 мл 2,5% раствора тетроксида осмия в трет-бутаноле. В атмосфере азота смесь нагревают до 62 С в течение 22 ч при энергичном перемешивании. Реакционную смесь концентрируют с помощью роторного испарителя при 60 С. Добавляют 300 мл ИП и раствор опять концентрируют при 60 С с получением 246 г 5R,6S-дигидрокси-2-(-S-метилбензил)-2 азабицикло[2.2.1]гептана в виде темнокоричневого сиропа. Неочищенный продукт суспендируют в 1,8 л 75%-ного ИП при 40 С. К этой суспензии добавляют при энергичном перемешивании 158,2 г L-винной кислоты. Перемешивание продолжают при 40 С в течение 2,5 ч. Смесь охлаждают до 30 С, фильтруют,промывают 500 мл 75%-ного ИП и 200 мл ИП,затем высушивают при 70 С в вакууме в течение 16 ч с получением 269,5 г желаемой соли Lтартрата в виде твердого продукта кремового цвета (т.пл. 143-145 С, соотношение диастереомеров 94,2:5.8). 1H ЯМР (500 МГц, CDCl3):1,3 (д, 3 Н),2,5 (м, 2 Н), 4,18 (с, 2 Н), 7,36 (т, 2 Н), 7,4 (т, 2 Н); МС (ЕI, 70 эв) m/z (относительная интенсивность): 233 (М+, 13). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производного 2 азадигидроксибицикло[2.2.1]гептана формулы где R1 обозначает С 1-С 4 алкил и Аr представляет фенил или -нафтил или -нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, C1-С 4 алкил, С 1-С 4 алкокси или нитро, включающий бисгидроксилирование производного бицикло[2.2.1]гептена формулы в присутствии от около 0,1 до около 5 мол.% осмата металла или от около 0,06 до около 0,07 мол.% тетроксида осмия и окислителя, способного регенерировать тетроксид осмия. 2. Способ по п.1, где R представляет собой группу формулы 3. Способ по п.2, где R1 представляет метил или этил и Аr представляет необязательно замещенный фенил, который, когда замещен, то замещен одним или несколькими метилом или метокси. 4. Способ по п.3, где R1 представляет метил и Аr представляет фенил. 5. Способ по п.1, где бисгидроксилирование осуществляют с использованием тетроксида осмия в количестве от около 0,06 до около 0,07 мол.%. 6. Способ по п.5, где тетроксид осмия присутствует в количестве около 0,06 мол.%. 7. Способ по п.1, где бисгидроксилирование осуществляют, используя осмат металла в количестве от около 0,1 до около 5 мол.%. 8. Способ по п.7, где осмат металла присутствует в количестве от около 0,2 до около 0,5 мол.%. 9. Способ по п.1, где осматом металла является К 2OsO4.2 Н 2O. 12 10. Способ по п.1, где окислителем, способным регенерировать тетроксид осмия, является N-метилморфолиноксид. 11. Способ получения соли L-винной кислоты (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана по п.1, включающий обработку L-винной кислотой (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана по п.1, где R представляет группу формулу где R1 обозначает С 1-С 4 алкил и Аr представляет фенил или -нафтил или -нафтил, которые могут быть необязательно замещены одним или несколькими заместителями, такими как галоген, C1-С 4 алкил, С 1-С 4 алкокси или нитро. 12. Способ по п.11, где R1 представляет метил и Аr представляет фенил. 13. Способ по п.11, дополнительно включающий получение L-виннокислой соли (1R) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана, по существу, в энантиомерно очищенном состоянии в присутствии (1S) диастереомера производного 2-азадигидроксибицикло[2.2.1]гептана. 14. Способ по п.11, где обработку осуществляют в смеси водно-органического растворителя. 15. Способ по п.14, где органическим растворителем является изопропанол. 16. Способ по п.14, где обработку осуществляют в смеси вода-изопропанол, имеющей объемное соотношение компонентов от около 30:70 до около 15:85. 17. Способ по п.16, где объемное соотношение составляет около 25:75. 18. Соединение формулы
МПК / Метки
МПК: C07D 209/52
Метки: 2-азадигидроксибицикло[2.2.1]гептана, производных, производного, l-виннокислой, получения, способ, соли
Код ссылки
<a href="https://eas.patents.su/7-2438-sposob-polucheniya-proizvodnyh-2-azadigidroksibiciklo221geptana-i-l-vinnokislojj-soli-proizvodnogo.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных 2-азадигидроксибицикло[2.2.1]гептана и l-виннокислой соли производного</a>
Предыдущий патент: Фармацевтические композиции, содержащие ламивудин и зидовудин.
Следующий патент: Нитробензамиды, полезные в качестве антиаритмических агентов
Случайный патент: Способ получения низкоконцентрированного этилена для химического применения











