Производные 4-(2-фенилсульфанилфенил)пиперидина в качестве ингибиторов повторного поглощения серотонина
Номер патента: 10869
Опубликовано: 30.12.2008
Авторы: Пюшль Аск, Банг-Андерсен Бенни, Руланд Томас, Брайан Стенсбей Тине, Йергенсен Мортен
Формула / Реферат
1. Соединение, представленное общей формулой I
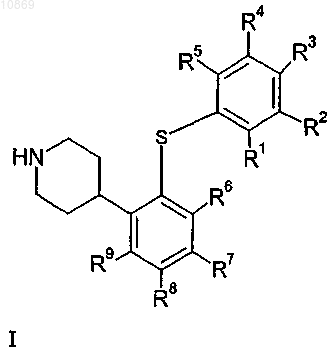
в которой
R1, R2, R3, R4, R5 независимо выбраны из водорода, галогена, С1-6алк(ен/ин)ила, C1-6алкилокси, гидрокси-С1-6алкила, галоген-C1-6алкила, галоген-С1-6алкилокси или NRxRy, где Rx и Ry независимо выбраны из водорода, С1-6алкила;
R6, R7, R8, R9 независимо выбраны из водорода, галогена, C1-6алкила, галоген-С1-6алкила;
при условии, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 отличается от водорода;
а также при условии, что когда R3 представляет собой метил, тогда по меньшей мере один из R1, R2, R4, R5, R6, R7, R8 и R9 отличается от водорода;
или его соль.
2. Соединение по п.1, где R1 выбран из водорода, галогена, C1-6алк(ен/ин)ила, C1-6алкилокси, галоген-С1-6алкила или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6алкила.
3. Соединение по п.2, где R1 выбран из водорода, C1-6алкила или галогена.
4. Соединение по любому из пп.1-3, где R2 выбран из водорода, галогена, C1-6алк(ен/ин)ила, C1-6алкилокси, галоген-C1-6алкила.
5. Соединение по п.4, где R2 выбран из водорода или C1-6алкилокси.
6. Соединение по любому из пп.1-5, где R3 выбран из водорода, галогена, C1-6алк(ен/ин)ила, C1-6алкилокси, галоген-C1-6алкила.
7. Соединение по п.6, где R3 выбран из водорода, галогена, C1-6алкила, C1-6алкилокси или галоген-С1-6алкила.
8. Соединение по п.6, где R3 выбран из водорода, C1-6алкила, C1-6алкилокси или галогена.
9. Соединение по любому из пп.1-8, где R4 выбран из водорода, галогена, С1-6алк(ен/ин)ила, C1-6алкилокси, галоген-C1-6алкила.
10. Соединение по п.9, где R4 выбран из водорода или C1-6алкилокси.
11. Соединение по любому из пп.1-10, где R5 выбран из водорода, галогена, C1-6алк(ен/ин)ила, C1-6алкилокси, галоген-C1-6алкила или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6алкила.
12. Соединение по п.11, где R5 выбран из водорода, C1-6алкила или галогена.
13. Соединение по любому из пп.1-12, где R6 выбран из водорода, галогена, C1-6алкила, галоген-С1-6алкила.
14. Соединение по п.13, где R6 выбран из водорода или галогена.
15. Соединение по любому из пп.1-14, где R7 выбран из водорода, галогена, C1-6алкила, галоген-С1-6алкила.
16. Соединение по п.15, где R7 выбран из водорода или галогена.
17. Соединение по любому из пп.1-16, где R8 выбран из водорода, галогена, C1-6алкила, галоген-С1-6алкила.
18. Соединение по любому из пп.1-17, где R9 выбран из водорода, галогена, C1-6алкила или галоген-С1-6алкила.
19. Соединение по п.18, где R9 представляет водород.
20. Соединение по любому из пп.1-19, где соединение формулы I имеет 1-4 заместителя в фенильном(ых) кольце(ах), выбранных из любого из R1-R9, которые отличаются от водорода, и остальные заместители представляют собой водород.
21. Соединение по п.1, представляющее собой
4-[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидин,
4-[2-(4-метоксифенилсульфанил)фенил]пиперидин,
4-[2-(2,4-диметилфенилсульфанил)-5-трифторметилфенил]пиперидин,
4-[2-(4-хлорфенилсульфанил)-4-фторфенил]пиперидин,
4-[2-(4-метоксифенилсульфанил)-4-фторфенил]пиперидин,
4-[2-(4-метилфенилсульфанил)-5-метилфенил]пиперидин,
4-[2-(2,4-диметилфенилсульфанил)-5-метилфенил]пиперидин,
4-[2-(4-метоксифенилсульфанил)-5-метилфенил]пиперидин,
4-[2-(4-хлорфенилсульфанил)фенил]пиперидин,
4-[2-(4-метоксифенилсульфанил)-5-фторфенил]пиперидин,
4-[2-(4-хлорфенилсульфанил)-5-фторфенил]пиперидин
или его фармацевтически приемлемую соль.
22. Фармацевтическая композиция, содержащая соединение по любому из пп.1-21 или его фармацевтически приемлемую аддитивную соль кислоты и по меньшей мере один фармацевтически приемлемый носитель или разбавитель.
23. Применение соединения по любому из пп.1-21 или его фармацевтически приемлемой аддитивной соли кислоты для получения лекарственного средства для лечения аффективных расстройств, таких как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство, посттравматическое стрессовое расстройство,обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию.
24. Способ лечения аффективных расстройств, таких как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию, в организме животного, включая человека, включающий введение терапевтически эффективного количества соединения по любому из пп.1-21 или его фармацевтически приемлемой аддитивной соли кислоты.
25. Применение соединения по любому из пп.1-21 в качестве лекарственного средства.
Текст
010869 Настоящее изобретение относится к новым соединениям, которые являются ингибиторами повторного поглощения серотонина и как таковые эффективны, например, в терапии депрессии и тревоги. Уровень техники Селективные ингибиторы повторного поглощения серотонина (далее в описании отнесены к SSRI) стали первоочередными лекарственными средствами в терапии депрессии, некоторых форм тревоги и социальной фобии, вследствие их эффективности, хорошей переносимости и благоприятного профиля безопасности по сравнению с классическими трициклическими антидепрессантами. Однако клинические исследования депрессии показывают значительное отсутствие реакции наSSRI, составляющее до 30%. Другим, часто не принимаемым во внимание фактором в терапии антидепрессантами является степень согласия больного с предписанным лечением, которое оказывает довольно глубокое действие на побуждение больного к продолжению фармакотерапии. Во-первых, следует отметить, что в терапевтическом действии SSRI имеется задержка. Иногда во время первых недель терапии симптомы заболевания даже усиливаются. Во-вторых, общим для всехSSRI является их побочное действие, выражающееся в сексуальной дисфункции. Без решения указанных проблем реальный прогресс в фармакотерапии депрессии и тревожных расстройств, по всей вероятности,не произойдет. Для того, чтобы справиться с отсутствием реакции, психиатры иногда используют стратегии усиления. Усиление антидепрессантной терапии может быть осуществлено через совместное введение стабилизаторов настроения, таких как карбонат лития или трииодтиронин, или за счет использования электрошока. Эффект от комбинированного введения соединения, которое ингибирует повторное поглощение серотонина, и антагониста 5-НТ 1 А-рецептора оценен в нескольких исследованиях (Innis et al. Eur. J. Pharmacol. 1987, 143, 1095-204 и Gartside Br. J. Pharmacol. 1995, 115, 1064-1070, Blier et al. Trends in Pharmacol. Science,1994, 15, 220). В данных исследованиях было установлено, что антагонисты 5-НТ 1 А-рецептора будут устранять первоначальное торможение нейротрансмиссии 5-НТ, вызванное ингибиторами повторного поглощения серотонина, и поэтому будут оказывать незамедлительную поддержку трансмиссии 5-НТ и вызывать быстрое начало терапевтического действия. Было подано несколько заявок на патент, которые предусматривают использование комбинации антагониста 5-HT1A и ингибитора повторного поглощения серотонина для терапии депрессии (см., например, ЕР-А 2-687472 и ЕР-А 2-714663). Другой подход к увеличению концевого 5-НТ состоит в блокаде ауторецептора 5-HT1B. Проводимые на крысах опыты с использованием микродиализа, в действительности, показали, что увеличение гиппокампального 5-НТ за счет циталопрама потенцируется GMC 2-29, экспериментальным антагонистом 5-НТ 1 В-рецептора. Были также поданы несколько заявок на патент, охватывающих комбинацию SSRI и антагониста или частичного агониста 5-HT1B (WO 97/28141, WO 96/03400, ЕР-А-701819 и WO 99/13877). Прежде было найдено, что комбинация ингибитора повторного поглощения серотонина с соединением, оказывающим антагонистическое или обратное агонистическое действие в отношении 5-HT2C (соединения, имеющие отрицательное действие на 5-HT2C-рецептор), обеспечивает заметное повышение уровня 5-НТ на концевых участках, которое было измерено в опытах с применением микродиализа (WO 01/41701). Это будет означать более короткую задержку начала антидепрессантного действия в клинических условиях и усиление или потенцирование терапевтического действия ингибитора повторного поглощения серотонина (SRI). В настоящем изобретении предложены соединения, которые являются ингибиторами повторного поглощения серотонина и предназначены для лечения аффективных расстройств, таких как депрессия,тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство,паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию. Некоторые из соединений оказывают также комбинированное действие, включающее ингибирование повторного поглощения серотонина и модуляцию 5-HT2C-рецептора, которое согласно WO 01/41701 будет означать ускоренное начало антидепрессантной активности. Сущность изобретения В настоящем изобретении предлагаются соединения общей формулы I-1 010869 в которой R1, R2, R3, R4, R5, R6, R7, R8 и R9 являются такими, как определено ниже. В настоящем изобретении вышеуказанное соединение предлагается для применения в качестве лекарственного средства. В данном изобретении предлагается фармацевтическая композиция, содержащая вышеуказанное соединение или его фармацевтически приемлемую аддитивную соль кислоты и по меньшей мере один фармацевтически приемлемый носитель или разбавитель. В данном изобретении предлагается применение вышеуказанного соединения или его фармацевтически приемлемой аддитивной соли кислоты для получения лекарственного средства для лечения аффективных расстройств, таких как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство, посттравматическое стрессовое расстройство,обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию. В настоящем изобретении предлагается способ лечения аффективных расстройств, таких как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство,паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию, в организме животного, в том числе человека, включающий введение терапевтически эффективного количества вышеуказанного соединения или его фармацевтически приемлемой аддитивной соли кислоты. Определение заместителей Галоген означает фтор, хлор, бром или иод. Выражение C1-6 алк(ен/ин)ил означает C1-6 алкильную,C2-6 алкенильную или C2-6 алкинильную группу. Термин C1-6 алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от 1 до 6 атомов углерода включительно, включающей, но без ограничения, метил, этил, 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. Аналогично, С 2-6 алкенил и С 2-6 алкинил означают, соответственно, такие группы, имеющие от 2 до 6 атомов углерода, включающие одну двойную связь и одну тройную связь, соответственно, и включающие, но без ограничения, этенил, пропенил, бутенил, этинил, пропинил и бутинил. Термины C1-6 алк(ен/ин)илокси, C1-6 алк(ен/ин)илсульфанил, гидрокси-С 1-6 алк(ен/ин)ил, галогенС 1-6 алк(ен/ин)ил, циано-C1-6 алк(ен/ин)ил, NRzRw-С 1-6 алк(ен/ин)ил, С 1-6 алк(ен/ин)илокси-C1-6 алк(ен/ин)ил и галоген-С 1-6 алк(ен/ин)илокси означают такие группы, в которых C1-6 алк(ен/ин)ил являются такими,как определено выше. Гало означает галоген. NRzRw-С 1-6 алк(ен/ин)ил означает группу Термин С 3-8 циклоалкил означает моноциклический или бициклический карбоцикл, имеющий от 3 до 8 С-атомов, включающий, но без ограничения, циклопропил, циклопентил, циклогексил и т.д. Термин С 3-8 циклоалкенил означает моноциклический или бициклический карбоцикл, имеющий от 3 до 8 С-атомов и включающий одну двойную связь. В термине С 3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил С 3-8 циклоалк(ен)ил и C1-6 алк(ен/ин)ил являются такими, как определено выше. Используемый в данном описании термин 3-7-членное кольцо, необязательно содержащее 1 дополнительный гетероатом, такой как N, О или S, относится к кольцевым системам, таким как 1-морфолинил,1-пиперидинил, 1-азепинил, 1-пиперазинил, 1-гомопиперазинил, 1-имидазолил, 1-пирролидинил, 1-азетидинил, 1-пирролил или пиразолил, все из которых могут быть дополнительно замещены группой, выбранной из С 1-6 алк(ен/ин)ила, гидрокси, гидрокси-С 1-6 алк(ен/ин)ила, С 1-6 алк(ен/ин)илокси-C1-6 алк(ен/ин)ила. Описание изобретения Настоящее изобретение относится к производным 4-(2-фенилсульфанилфенил)пиперидина, которые являются ингибиторами повторного поглощения серотонина и как таковые эффективны, например, в лечении депрессии и тревоги. Соответственно, настоящее изобретение относится к соединению, представленному общей формулой IR1, R2, R3, R4, R5 независимо выбраны из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, гидрокси-С 1-6 алкила, галоген-C1-6 алкила, галоген-С 1-6 алкилокси или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила;R6, R7, R8, R9 независимо выбраны из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила; при условии, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 отличается от водорода; а также при условии, что когда R3 представляет собой метил, тогда по меньшей мере один из R1, R2,4 5R , R , R6, R7, R8 и R9 отличается от водорода; или к его соли. В одном варианте соединения формулы I R1 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-C1-6 алкила или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила. В дополнительном варианте соединения формулы I R1 выбран из водорода, C1-6 алкила или галогена. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R1 является водород; другим вариантомR1 является C1-6 алкил, такой как метил; другим вариантом R1 является галоген, такой как фтор или хлор. В другом варианте соединения формулы I R2 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-C1-6 алкила. Обычно R2 выбран из водорода или C1-6 алкилокси. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R2 является водород; другим вариантом R2 является C1-6 алкилокси, такой как метокси; дополнительным вариантом R2 является галоген, такой как фтор или хлор; другим вариантом R2 является C1-6 алкил, такой как метил. В дополнительном варианте соединения формулы I R3 выбран из водорода, галогена, C1-6 алк(ен/ин)ила,C1-6 алкилокси, галоген-C1-6 алкила. Обычно R3 выбран из водорода, галогена, C1-6 алкила, C1-6 алкилокси или галоген-С 1-6 алкила. В другом варианте соединения формулы I R3 выбран из водорода, C1-6 алкила, C1-6 алкилокси или галогена. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R3 является водород; другим вариантом R3 является C1-6 алкил, такой как метил; дополнительным вариантомNRxRy, где Rx является водородом и Ry является C1-6 алкилом, таким как метиламино; дополнительным вариантом R3 является С 2-6 алкенил, такой как этенил. В дополнительном варианте соединения формулы I R4 выбран из водорода, галогена, С 1-6 алк(ен/ин)ила,C1-6 алкилокси, галоген-C1-6 алкила. Обычно R4 выбран из водорода или C1-6 алкилокси. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R4 является водород; другим вариантом R4 является C1-6 алкокси, такой как метокси; дополнительным вариантом R4 является галоген, такой как фтор или хлор; дополнительным вариантом R4 является C1-6 алкил, такой как метил. В дополнительном варианте соединения формулы I R5 выбран из водорода, галогена, С 1-6 алк(ен/ин)ила,C1-6 алкилокси, галоген-C1-6 алкила, или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила. В дополнительном варианте соединения формулы I R5 выбран из водорода, C1-6 алкила или галогена. В дополнительном варианте R5 представляет собой NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R5 является водород; другим вариантом R5 является C1-6 алкил, такой как метил; дополнительным вариантом R5 является галоген, такой как хлор или фтор. В дополнительном варианте соединения формулы I R6 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. Обычно R6 выбран из водорода или галогена. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R6 является водород; другим вариантом R6 является галоген, такой как фтор. В дополнительном варианте соединения формулы I R7 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. Обычно R7 выбран из водорода или галогена. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R7 является водород; другим вариантом R7 является галоген, такой как фтор. В дополнительном варианте соединения формулы I R8 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R8 является водород; другим вариантом R8 является галоген, такой как фтор или бром; дополнительным вариантомR8 является С 1-6 алкил, такой как метил; дополнительным вариантом R8 является галоген-С 1-6 алкил, такой как CF3. В дополнительном варианте соединения формулы I R9 выбран из водорода, галогена, C1-6 алкила или галоген-С 1-6 алкила. Для дополнительной иллюстрации, без ограничения изобретения, вариантом R9 является водород; другим вариантом R9 является галоген, такой как фтор. Обычно соединение формулы I имеет по меньшей мере 1 заместитель в фенильном(ых) кольце(ах),выбранный из любого из R1-R9, который отличается от водорода, как, например, 1, 2, 3 или 4 заместителя в фенильном(ых) кольце(ах), выбранные из любого из R1-R9, который(е) отличается(ются) от водорода, и остальные заместители представляют собой водород. Таким образом, в дополнительном варианте 1 заместитель, выбранный из любого из R1-R9, который отличается от водорода, присутствует в любом из-3 010869 двух фенильных колец, как, например, 1 заместитель, выбранный из R1-R5, или заместитель, выбранный из R6-R9. В дополнительном варианте 2 заместителя, выбранных из R1-R9, которые отличаются от водорода,присутствуют в любом из двух фенильных колец, как, например, 1 заместитель, выбранный из R1-R5, и другой, выбранный из R6-R9, или оба заместителя выбраны из R1-R5. В дополнительном варианте 3 заместителя, выбранных из R1-R9, которые отличаются от водорода, присутствуют в любом из двух фенильных колец, как, например, 2 заместителя, выбранных из R1-R5, и последний заместитель выбран изR6-R9. В каждом из вышеуказанных вариантов остальные заместители представляют собой водород. Для дополнительной иллюстрации, без ограничения изобретения, далее представлены некоторые типичные варианты. В дополнительном варианте соединения формулы I присутствует 1 заместитель, представляющий собой R2, определенный выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствует 1 заместитель, представляющий собой R3, определенный выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 2 заместителя, представляющих собой R3 и R8, при этом R3 и R8 являются такими, как определено выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 2 заместителя, представляющих собой R3 и R6, при этом R3 и R6 являются такими, как определено выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 2 заместителя, представляющих собой R3 и R7, при этом R3 и R7 являются такими, как определено выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 2 заместителя, представляющих собой R1 и R3,при этом R1 и R3 являются такими, как определено выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 2 заместителя, представляющих собой R2 и R3, при этомR2 и R3 являются такими, как определено выше, за исключением водорода. В дополнительном варианте соединения формулы I присутствуют 3 заместителя, представляющих собой R1, R3 и R8, при этом R1, R3 иR8 являются такими, как определено выше, за исключением водорода. В каждом из указанных вариантов остальные заместители представляют собой водород. В дополнительном варианте соединения формулы I указанное соединение выбрано из группы,включающей 4-[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидин,4-[2-(4-метоксифенилсульфанил)фенил]пиперидин,4-[2-(2,4-диметилфенилсульфанил)-5-трифторметилфенил]пиперидин,4-[2-(4-хлорфенилсульфанил)-4-фторфенил]пиперидин,4-[2-(4-метоксифенилсульфанил)-4-фторфенил]пиперидин,4-[2-(4-метилфенилсульфанил)-5-метилфенил]пиперидин,4-[2-(2,4-диметилфенилсульфанил)-5-метилфенил]пиперидин,4-[2-(4-метоксифенилсульфанил)-5-метилфенил]пиперидин,4-[2-(4-хлорфенилсульфанил)фенил]пиперидин,4-[2-(4-метоксифенилсульфанил)-5-фторфенил]пиперидин,4-[2-(4-хлорфенилсульфанил)-5-фторфенил]пиперидин или его фармацевтически приемлемую соль. Каждое из указанных соединений считается отдельным вариантом. Как указывалось выше, соединения формулы I настоящего изобретения являются ингибиторами повторного поглощения серотонина. Было также показано, что некоторые из тестируемых соединений обладают высокой аффинностью к 5-НТ 2 С-рецептору, обычно Ki75 нМ, измеренной в испытании, описанном в разделе Примеры, и такие соединения следует рассматривать в качестве дополнительных аспектов изобретения. Соответственно, в дополнительном аспекте настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из С 1-6 алкокси (такого, как метокси), галогена (такого, какCl) или галоген-C1-6 алкила (такого, как CF3) и все из R1, R2 и R4-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из галогена (такого, как Cl или F), и R3 выбран из галогена (такого,как F), и все из R2 и R4-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из галогена (такого, как Cl), и R7 выбран из галогена (такого, как F), и все из R2-R6 и R8-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из галогена (такого, как F), и R7 выбран из галогена(такого, как F), и все из R1-R2, R4-R6 и R8-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, гдеR1 выбран из галогена (такого, как фтор), и R9 выбран из галогена (такого, как F), и все из R2-R8 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R2 выбран из галогена (такого, как Cl или F), и R9 выбран из галогена (такого, как F), и все из R1 и R3-R8 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из C1-6 алкила (такого, как метил), С 1-6 алкокси (такого, как метокси) или галогена (та-4 010869 кого, как Cl или F), и R9 выбран из галогена (такого, как F), и все из R1, R2 и R4-R8 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из C1-6 алкокси (такого, как метокси), и R6 выбран из галогена (такого, как фтор), и все из R1, R2, R4, R5 и R7-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из C1-6 алкокси (такого, как метокси) или галогена (такого, как Cl), и R7 выбран из галогена (такого, как F), и все из R1, R2, R4-R6 и R8-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R3 выбран из C1-6 алкила (такого, как метил), C1-6 алкокси (такого, как метокси) или галогена (такого, как F или Cl), и R8 выбран из C1-6 алкила (такого, как метил), C1-6 алкокси (такого, как метокси) или галогена (такого, как F), и все из R1, R2, R4-R7 и R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из C1-6 алкила (такого, как метил), R3 выбран из C1-6 алкила (такого, как метил), и R6 выбран из галогена (такого, как F), и все из R2, R4-R5 и R7-R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из C1-6 алкила (такого, как метил) или галогена (такого, как F), R3 выбран изC1-6 алкокси (такого, как метокси) или галогена (такого, как F, Br или Cl), и R8 выбран из С 1-6 алкила (такого, как метил) или галогена (такого, как F), и все из R2, R4-R7 и R9 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из C1-6 алкила (такого, как метил) или галогена (такого, как F или Cl),R3 выбран из C1-6 алкила (такого, как метил), C1-6 алкокси (такого, как метокси) или галогена (такого, как F или Cl), и R9 выбран из галогена (такого, как F), и все из R2 и R4-R8 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R1 выбран из галогена (такого, как F), R2 выбран из галогена (такого, как Cl), иR9 выбран из галогена (такого, как F), и все из R3 и R4-R8 представляют собой водород. В соответствии еще с одним дополнительным аспектом настоящее изобретение относится к соединению формулы I или его соли, где R2 выбран из C1-6 алкокси (такого, как метокси) или галогена (такого, как F), R3 выбран из галогена (такого, как F) или C1-6 алкила (такого, как метил), и R9 выбран из галогена (такого, как F), и все из R4-R8 представляют собой водород. Предпочтительные соединения, которые являются ингибиторами повторного поглощения серотонина и показывают высокую аффинность к 5HT2C-рецептору, выбраны из 4-[2-(4-метоксифенилсульфанил)фенил]пиперидина,4-[2-(4-хлорфенилсульфанил)-4-фторфенил]пиперидина,4-[2-(4-метоксифенилсульфанил)-4-фторфенил]пиперидина,4-[2-(4-метилфенилсульфанил)-5-метилфенил]пиперидина,4-[2-(4-фтор-2-метилфенилсульфанил)-5-метилфенил]пиперидина,4-[2-(4-метоксифенилсульфанил)-5-метилфенил]пиперидина,4-[2-(4-хлорфенилсульфанил)фенил]пиперидина,4-[2-(4-метоксифенилсульфанил)-5-фторфенил]пиперидина,4-[2-(4-метоксифенилсульфанил)-3-фторфенил]пиперидина,4-[2-(4-хлорфенилсульфанил)-5-метилфенил]пиперидина,4-[2-(4-фторфенилсульфанил)-5-фторфенил]пиперидина,4-[2-(4-хлор-2-фторфенилсульфанил)-5-фторфенил]пиперидина,4-[2-(2-фтор-4-метилфенилсульфанил)-5-фторфенил]пиперидина,4-[2-(2,4-дифторфенилсульфанил)-5-фторфенил]пиперидина,4-[2-(2,4-диметилфенилсульфанил)-3-фторфенил]пиперидина,4-[2-(4-бром-2-фторфенилсульфанил)-5-фторфенил]пиперидина,4-[2-(2-фтор-4-метоксифенилсульфанил)-5-фторфенил]пиперидина,4-[2-(2-хлор-4-фторфенилсульфанил)фенил]пиперидина,4-[2-(2,4-дифторфенилсульфанил)фенил]пиперидина,4-[2-(4-фторфенилсульфанил)-5-метоксифенил]пиперидина,4-[2-(4-метокси-2-метилфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(3-фтор-4-метилфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(3-хлорфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(3-фторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(2-фторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-фтор-3-метоксифенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-хлор-2-фторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-трифторметилфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(3-хлор-2-фторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-метилфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-хлорфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(2-фтор-4-метилфенилсульфанил)-6-фторфенил]пиперидина,-5 010869 4-[2-(2-фтор-4-метоксифенилсульфанил)-6-фторфенил]пиперидина,4-[2-(2,4-дифторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(2-хлор-4-метоксифенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-метоксифенилсульфанил)-6-фторфенил]пиперидина,4-[2-(4-фторфенилсульфанил)-6-фторфенил]пиперидина,4-[2-(2-хлорфенилсульфанил)-4-фторфенил]пиперидина,4-[2-(4-фторфенилсульфанил)-4-фторфенил]пиперидина или его фармацевтически приемлемой соли. Настоящее изобретение включает также соли данных соединений, обычно фармацевтически приемлемые соли. Такие соли включают фармацевтически приемлемые аддитивные соли кислоты, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Аддитивные соли кислот включают соли неорганических кислот, а также соли органических кислот. Характерные примеры подходящих неорганических кислот включают хлористо-водородную, бромисто-водородную, иодисто-водородную, фосфорную, серную, сульфаминовую, азотную кислоты и подобные. Характерные примеры подходящих органических кислот включают муравьиную, уксусную,трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную,щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую,цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную,глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8-галогентеофиллины, например 8-бромтеофиллин, и подобные. Примеры солей металлов включает соли лития, натрия, калия, магния и подобные. Примеры солей аммония и алкилированного аммония включают соли аммония, метил-, диметил-,триметил-, этил-, гидроксиэтил-, диэтил-, н-бутил-, втор-бутил-, трет-бутил-, тетраметиламмония и подобные. Соединения данного изобретения могут, кроме того, существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные. Для целей данного изобретения сольватированные формы считаются эквивалентными несольватированным формам. Соединения настоящего изобретения могут иметь один или более асимметрических центров, и подразумевается, что в объем настоящего изобретения включены любые оптические изомеры (то есть энантиомеры или диастереоизомеры), такие как разделенные, чистые или частично очищенные оптические изомеры и их любые смеси, включая рацемические смеси. Рацемические формы могут быть разделены на оптические антиподы известными методами, например разделением их диастереоизомерных солей с использованием оптически активной кислоты и высвобождением оптически активного аминного соединения обработкой основанием. Другой метод разделения рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Рацемические соединения настоящего изобретения могут быть также разделены на их оптические антиподы, например, фракционной кристаллизацией d- или l-солей (тартратов, манделатов или камфорсульфонатов). Соединения настоящего изобретения могут быть также разделены путем образования диастереоизомерных производных. Могут быть использованы дополнительные методы разделения оптических изомеров, известные специалистам в данной области. Такие методы включают методы, которые обсуждены Collet и Wilen в руководстве Enantiomers, Racemates, and Resolutions, John Wiley and Sons, New York (1981). Оптически активные соединения могут быть также получены из оптически активных исходных продуктов или стереоселективным синтезом. Кроме того, когда в молекуле присутствует двойная связь или полностью или частично насыщенная кольцевая система, могут быть образованы геометрические изомеры. Считается, что в объем данного изобретения включены любые геометрические изомеры, такие как разделенные, чистые или частично очищенные геометрические изомеры или их смеси. Молекулы, имеющие связь с ограниченным вращением, могут также образовывать геометрические изомеры. Полагается, что они также включены в объем настоящего изобретения. Некоторые из соединений настоящего изобретения могут также существовать в различных таутомерных формах, и считается, что в объем настоящего изобретения включены любые таутомерные формы, которые соединения способны образовывать. Изобретение также включает в себя пролекарства данных соединений, которые при введении подвергаются химическому превращению за счет метаболических процессов перед тем, как стать фармакологически активными веществами. Такие пролекарства будут являться функциональными производными соединений общей формулы (I), которые легко способны превращаться in vivo в требуемые соединения формулы (I). Традиционные методики подбора и получения подходящих пролекарственных производных представлены, например, в руководстве Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985.-6 010869 Изобретение также включает в себя активные метаболиты соединений настоящего изобретения. Как указывалось выше, соединения формулы I являются ингибиторами повторного поглощения серотонина и, соответственно, могут быть полезны для лечения, включая профилактику, аффективных расстройств, таких как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, паническое расстройство и обсессивно-компульсивное расстройство. Соответственно, в дополнительном аспекте изобретение относится к соединению формулы I для применения в качестве лекарственного средства. Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение формулы I и фармацевтически приемлемый носитель или разбавитель. Композиция может включать один любой из вышеуказанных вариантов соединений формулы I. В варианте фармацевтической композиции соединение формулы I присутствует в количестве от около 0,001 до около 100 мг/кг массы тела в день. Настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения заболевания или расстройства, в котором является выгодным ингибитор повторного поглощения серотонина. Лекарственное средство может включать один любой из вышеуказанных вариантов соединения формулы I. Настоящее изобретение, в частности, также относится к применению соединения формулы I для получения лекарственного средства для лечения аффективных расстройств. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения депрессии. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения тревожных расстройств. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения генерализованного тревожного состояния. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения социального тревожного расстройства. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения посттравматического стрессового расстройства. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения обсессивно-компульсивного расстройства. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения панического расстройства. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения приступов паники. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения специфических фобий. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения социальной фобии. В дополнительном варианте настоящее изобретение относится также к применению соединения формулы I для получения лекарственного средства для лечения агорафобии. Дополнительный аспект изобретения относится к способу лечения заболевания или расстройства,выбранного из группы, состоящей из аффективного расстройства, такого как депрессия, тревожных расстройств, включающих генерализованное тревожное состояние, социальное тревожное расстройство,посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, паническое расстройство, приступы паники, специфические фобии, социальную фобию и агорафобию, в организме животного, включая человека, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I. В дополнительном аспекте настоящее изобретение относится к способу получения соединения формулы I, включающему: а) удаление защиты или отщепление от полимерного носителя соединения формулы II-7 010869 в которой R1-R9 являются такими, как указано выше, и R' представляет собой карбамат (такой, как метил-,этил-, трет-бутил-, аллил- или бензилкарбамат) или производную бензильную защитную группу, где защитные группы могут быть связаны с твердым носителем, например карбаматным линкером смолыb) химическое превращение соединения формулы III в соответствующее соединение диазония и последующее взаимодействие с тиофенолом формулы IV в которых R1-R9 являются такими, как указано выше; или с) взаимодействие в присутствии палладиевого или медного катализатора соединения формулы V с тиофенолом формулы IV в которых R1-R9 являются такими, как указано выше, и G представляет атом хлора, брома или иода или сложный сульфониловый эфир, где сульфониловый эфир получен из соответствующего фенола взаимодействием с 4-метилбензолсульфонилхлоридом, ангидридом трифторметансульфоновой кислоты,1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилхлоридом или родственными соединениями; илиd) гидрирование двойной связи в соединении формулы VI в которой R1-R9 являются такими, как указано выше. Фармацевтические композиции Соединения изобретения могут быть введены одни или в комбинации с фармацевтически приемлемыми носителями или эксципиентами однократными или многократными дозами. Фармацевтические композиции в соответствии с изобретением могут быть получены с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными адъювантами и эксципиентами в соответствии с традиционными методиками, которые раскрыты в руководстве Remington:The Science and Practice of Pharmacy, 19 Edition Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть конкретно получены для введения любым подходящим путем, таким как пероральный, ректальный, назальный, легочный, местный (включающий буккальный и подъязычный), чрескожный, внутрицистернальный, внутрибрюшинный, вагинальный и парентеральный(включающий подкожный, внутримышечный, внутриоболочечный, внутривенный и внутрикожный) путь, при этом предпочтителен пероральный путь введения. Понятно, что предпочтительный путь будет зависеть от общего состояния и возраста подвергаемого лечению субъекта, природы подвергаемого лечению заболевания и выбранного активного ингредиента. Фармацевтические композиции для перорального введения включают твердые дозированные формы, такие как капсулы, таблетки, драже, пилюли,лепешки, порошки и гранулы. Если необходимо, они могут быть приготовлены с покрытиями, такими как энтеросолюбильные покрытия, или они могут быть составлены таким образом, чтобы обеспечить регулируемое высвобождение активного ингредиента, как, например, замедленное или пролонгированное высвобождение, в соответствии с хорошо известными в данной области методиками. Жидкие дозированные формы для перорального введения включают растворы, эмульсии, суспен-8 010869 зии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы для инъекции, дисперсии, суспензии или эмульсии, а также стерильные порошки, восстанавливаемые в стерильные растворы для инъекций или дисперсии перед применением. Предполагается включение в объем настоящего изобретения инъецируемых депо-композиций. Другие подходящие для введения формы включают суппозитории, аэрозоли, мази, кремы, гели,формы для ингаляции, наносимый на кожу пластырь, имплантаты и т.д. Типичная дозировка для перорального введения находится в диапазоне от около 0,001 до около 100 мг/кг,предпочтительно от около 0,01 до 50 мг/кг и более предпочтительно от около 0,05 до около 10 мг/кг массы тела в день, вводимая 1 или несколькими дозами, как, например, 1-3 дозами. Точная дозировка будет зависеть от частоты и пути введения лекарственного средства, пола, возраста, массы тела и общего состояния здоровья подвергаемого лечению субъекта, природы и тяжести подвергаемого лечению состояния и сопутствующих заболеваний, подвергаемых лечению, и других факторов, очевидных для специалистов в данной области. Композиции могут быть удобно представлены в виде единичной дозированной формы с использованием известных специалистам в данной области методов. Типичная единичная дозированная форма для перорального введения - 1 или более раз в день, как, например, 1-3 раза в день, может содержать от 0,01 до около 1000 мг, предпочтительно от около 0,05 до около 500 мг и более предпочтительно от около 0,5 до около 200 мг. Для парентеральных путей введения, таких как внутривенное, внутриоболочечное, внутримышечное и подобное введение, дозы обычно составляют порядка около половины дозы, используемой для перорального введения. Соединения данного изобретения обычно используются в виде свободного вещества или в виде его фармацевтически приемлемой соли. Одним примером является кислотно-аддитивная соль соединения,имеющего полезность свободного основания. Когда соединение формулы (I) содержит свободное основание, такие соли получают традиционным способом, включающим обработку раствора или суспензии свободного основания формулы (I) химическим эквивалентом фармацевтически приемлемой кислоты. Характерные примеры представлены выше. Для парентерального введения могут быть использованы растворы новых соединений формулы (I) в стерильном водном растворе, водном пропиленгликоле, водном растворе витамина Е или в кунжутном или арахисовом масле. Такие водные растворы в случае необходимости должны быть подходящим образом забуферены, и жидкий разбавитель сначала делают изотоническим с использованием достаточного количества солевого раствора или глюкозы. Водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все используемые стерильные водные среды легко доступны стандартными методами, известными специалистам в данной области. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примеры твердых носителей включают лактозу, терраальбу, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, акацию, стеарат магния, стеариновую кислоту и простые низшие алкиловые эфиры целлюлозы. Примеры жидких носителей включают сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и воду. Аналогично, носитель или разбавитель может включать какое-либо вещество, замедляющее высвобождение, известное в данной области, такое как глицерилмоностеарат или глицерилдистеарат, один или в смеси с воском. Фармацевтические композиции, образованные объединением новых соединений формулы (I) и фармацевтически приемлемых носителей, затем легко вводят в виде разнообразных дозированных форм, подходящих для доступных путей введения. Композиции могут быть удобно представлены в виде единичной дозированной формы с использованием методик,известных в области фармации. Композиции настоящего изобретения, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит заданное количество активного ингредиента и которые могут включать подходящий зксципиент. Перорально пригодные композиции могут быть, кроме того, в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости или в форме эмульсии масло-в-воде или вода-в-масле. Если для перорального введения используется твердый носитель, препарат может представлять собой таблетку, помещенную в твердую желатиновую капсулу в форме порошка или гранулы, или он может быть в форме пастилки или лепешки. Количество твердого носителя будет изменяться в широких пределах, но обычно оно будет составлять от около 25 мг до около 1 г. Если используется жидкий носитель, препарат может быть в форме сиропа, эмульсии, мягкой желатиновой капсулы или стерильной жидкости для инъекций, такой как водная или неводная жидкая суспензия или раствор. Соединения изобретения получают следующими общими способами:-9 010869 а) удалением защиты или отщеплением от полимерного носителя соединения формулы II в которой R1-R9 являются такими, как указано выше, и R' представляет собой карбамат или производную бензильную защитную группу. Такие защитные группы могут быть связаны с твердым носителем, например, карбаматным линкером смолы Wang;b) химическим превращением соединения формулы III в соответствующее соединение диазония и последующим взаимодействием с тиофенолом формулы IV в которых R1-R9 являются такими, как указано выше; с) взаимодействием в присутствии палладиевого или медного катализатора соединения формулы V с тиофенолом формулы IV в которых R1-R9 являются такими, как указано выше, и G представляет собой атом хлора, брома или иода или сложный сульфониловый эфир. Сульфониловый эфир получают из соответствующего фенола взаимодействием с 4-метилбензолсульфонилхлоридом, ангидридом трифторметансульфоновой кислоты,1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилхлоридом или родственными соединениями; илиd) гидрированием двойной связи в соединении формулы VI в которой R1-R9 являются такими, как указано выше. Удаление защитной группы в соответствии со способом а) осуществляли стандартными методами,известными специалистам в данной области и подробно рассмотренными в руководстве Protective Groupsin Organis Synthesis, Greene and Wuts, Wiley Interscience (1991), ISBN 0471623016. Отщепление от полимерного носителя, как, например, от карбаматного линкера смолы Wang, в соответствии со способом а) осуществляли согласно известным методам, представленным в литературе (Zaragoza Tetrahedron Lett. 1995, 36, 8677-8678 and Conti et al. Tetrahedron Lett. 1977, 38, 2915-2918). Соединения формулы II могут быть получены дегидратацией соединения формулы VII в условиях,не приводящих к расщеплению N-R'-связи, с последующим гидрированием двойной связи. Альтернативно, соединения формулы VII могут быть дегидратированы с последующим или сопутствующим расщеплением N-R'-связи с получением соединений формулы VI; последующая защита аминогруппы и гидрирование двойной связи обеспечивают затем получение соединений формулы II. Восстановление двойной связи может быть осуществлено с использованием стандартных методов гетерогенного гидрирования или с использованием методов гомогенного гидрирования, например таких, где используются катализаторы Крабтри (Crabtree) или Уилкинсона (Wilkinson) (см., например, Encyclopedia of Reagents for OrganicSynthesis, Paquette (Ed.), Wiley (1995), ISBN 0471936235, p. 1447 и р. 1253, соответственно), или наоборот. Реакцию дегидратации и необязательное удаление защиты соединения формулы VII с получением соединения II или VI осуществляли аналогично способу, представленному Palmer et al. J. Med. Chem. 1997, 40, 1982-1989. Исходный продукт формулы VII, в которой R'=H, получали из соединения формулы VII, в которойR' представляет собой карбамат или производную бензильную защитную группу, удалением защиты в стандартных условиях, известных специалистам в данной области и подробно рассмотренных в руководстве Protective Groups in Organis Synthesis, Greene and Wuts, Wiley Interscience, (1991), ISBN 0471623016. Соединения формулы VII, в которой R' является трет-бутилоксокарбонилом (Boc), могут быть получены,как описано Palmer et al. в J. Med. Chem. 1997, 40, 1982-1989. Соединения формулы VII получали из соответствующих должным образом замещенных 1-бромфенилсульфанилбензолов или 1-иодфенилсульфанилбензолов формулы IX металл-галогеновым обменом с последующим добавлением соответствующего электрофила формулы VIII по аналогичной методике, описанной Palmer et al. J. Med. Chem. 1997, 40,1982-1989, или следуя методикам Kitagawa et al. Angew. Chem. Int. Ed. 2000, 39, 2481-2483, или Boymondet al. Angew. Chem. Int. Ed. 1998, 37, 1701-1703. В соединениях VII, VIII и IX R1-R9 и R' имеют вышеуказанные значения и G' представляет собой атом брома или иода. Должным образом замещенные 1-бромфенилсульфанилбензолы или 1-иодфенилсульфанилбензолы получали из тиофенолов формулы IV и должным образом замещенных арилиодидов или арилбромидов в соответствии с общими методикамиet al. Org. Lett. 2002, 4, 581-584. Исходные продукты формулы VII могут быть также получены сочетанием тиофенола формулы X с соединением формулы XI, катализируемым палладием или медью, в соответствии с Schopfer и SchlapbachTetrahedron 2001, 57, 3069-3073; Bates et al. Org. Lett. 2002, 4, 2803-2806 и Kwong et al. Org. Lett. 2002, 4,581-584. Соединения Х могут быть получены ортолитированием соединений формулы IV или металл-галогеновым обменом должным образом замещенных производных 2-бромтиофенола или 2-иодтиофенола с последующим добавлением электрофила формулы VIII, примеры которого приведены в экспериментальной части. В соединениях формулы X и XI R1-R9, R' и G имеют вышеуказанные значения. Сульфониловые эфиры могут быть получены из соответствующего фенола взаимодействием с 4-метилбензолсульфонилхлоридом, ангидридом трифторметансульфоновой кислоты, 1,1,2,2,3,3,4,4,4-нонафторбутан-1 сульфонилхлоридом или родственными соединениями, как описано, например, Cho et al. J. Org. Chem. 2003, 68, 3017-3025, Arnould et al. Tetrahedron Lett. 1996, 37, 4523-4524 и Anderson et al. J. Org. Chem. 2003, 68, 9563-9573. Фенол определенно может быть получен из аналогичного анизола или подходящим образом защищенного фенола стандартными методами, известными специалистам в данной области и подробно рассмотренными в руководстве Protective Groups in Organis Synthesis, Greene and Wuts, WileyInterscience (1991), ISBN 0471623016. Исходные продукты формулы V и XI могут быть получены диазотированием должным образом замещенных производных анилина с последующим добавлением или бромида меди, или иодида меди, как описано в руководстве Advanced Organic Chemistry March, John WileySons (1992), ISBN 0471601802,диазотированием соответствующего производного анилина с последующим добавлением иодида калия,как описано Tunney and Stille J. Org. Chem. 1987, 52, 748-753, или диазотированием в условиях, сообщенных Doyle et al. J. Org. Chem. 1977, 42, 2426-2431 и Doyle et al. J. Org. Chem. 1980, 45, 2570-2575. Альтер- 11010869 нативно, соединение V, в котором G представляет собой сульфониловый эфир, может быть получено из соответствующего фенола, как указано выше для соединения XI. Фенол определенно может быть получен из аналогичного анизола или подходящим образом защищенного фенола стандартными методами,известными специалистам в данной области и подробно рассмотренными в руководстве Protective Groups Соединения формулы II могут быть также получены удалением гидроксильной группы из соединений формулы VII с использованием стандартных методов дезоксигенирования (например, восстановление по типу Бартона). Одним примером является использование активации метилоксалилхлоридом с последующим восстановлением гидридом три-н-бутилолова и 2-[(цианодиметилметил)азо]-2-метилпропионитрилом (AIBN), как описано Hansen et al. Synthesis 1999, 1925-1930. Альтернативно, можно использовать трифторуксусную кислоту и триэтилсилан или использовать боргидрид натрия или родственные восстановители, которые описаны в руководстве Reductions in Organic Chemistry, Hudlicky, ACS Monograph 188, The American Chemical Society (1996), ISBN 0841233446. Соединения формулы II могут быть также получены взаимодействием соединения формулы XII с тиофенолом формулы IV в присутствии палладиевого или медного катализатора с использованием методов, описанных выше для соединений формулы X и XI. В соединении XII R6-R9, R' и G имеют определенные выше значения. Соединение XII может быть получено из соединения формулы III общими методами диазотирования, представленными ниже для соединений формулы V и IX, или из соединения формулы XX, как обсуждается ниже. Соединения формулы II могут быть также получены взаимодействием соединения формулы XIII с алкилметаллическими соединениями с последующим взаимодействием с дисульфидом формулы XIV,например, по методике, раскрытой Carreno et al. Tetrahedron, 1991, 47, 605-614. Альтернативно, металлированные соединения, полученные из соединений формулы XIII, можно гасить соединениями формулыXV согласно методике, представленной Marchand et al. Tetrahedron 2000, 56, 7331-7338. Соединения формулы XIV и XV являются или коммерчески доступными, или могут быть получены из тиофенолов формулы IV, например, по методикам, описанным в руководстве Advanced Organic Chemistry March, JohnWileySons (1992), ISBN 0471601802, или методиками, представленными Barnard J. Chem. Soc. 1957,4673-4675, Miller J. Chem. Soc. 1925, 224-233 или Evans et al. J. Org. Chem. 1990, 55, 2337-2344. Соединения формулы XIII могут быть получены с использованием аналогичных способов, которые указаны для соединений формулы XII. В соединениях XIII и XIV R1-R9, R' и G' являются такими, как определено выше. Диазотирование соединения формулы III с последующим взаимодействием с тиофенолом формулыIV с получением соединения формулы I может быть осуществлено добавлением диазониевой соли соот- 12010869 ветствующего анилина к раствору натриевой соли тиофенола в водной суспензии меди в условиях, аналогично описанным ниже для исходного продукта формулы XI. Исходный продукт формулы III является или коммерчески доступным, или может быть получен способами аналогично описанным в литературе(например, Berridge, M.S. et al. J. Med. Chem. 1993, 36, 1284-1290). Тиофенолы формулы IV являются или коммерчески доступными, или могут быть получены в соответствии со способами, описанными в руководствах Houben-Weyl, Methoden der organischen Chemie (Methods of Organic Chemistry), Georg-Thieme-Verlag,Stuttgart; Organic Reactions, John WileySons, Inc. New York, или из соединений формулы XI с использованием методик, описанных Arnould et al. Tetrahedron Lett. 1996, 37, 4523-4524 и Rane et al. TetrahedronLett. 1994, 35, 3225-3226, с последующим удалением защиты в стандартных условиях, известных специалистам в данной области и подробно рассмотренных в руководстве Protective Groups in Organic Synthesis,Greene and Wuts, Wiley Interscience (1991), ISBN 0471623016. Сочетание соединения формулы V с тиофенолом формулы IV в соответствии со способом с) осуществляли в присутствии палладиевого или медного катализатора, например, с использованием методики,описанной Schopfer and Schlapbach Tetrahedron 2001, 57, 3069-3070, Bates et al. Org. Lett. 2002, 4, 28032806 или Kwong et al. Org. Lett. 2002, 4, 581-584. Соединения формулы V могут быть получены из соединений формулы XII удалением защиты Nгруппы с использованием стандартных методик, известных специалистам в данной области и подробно рассмотренных в руководстве Protective Groups in Organic Synthesis, Greene and Wuts, Wiley Interscience(1991), ISBN 0471623016. Соединения формулы XVII могут быть получены из соединений формулы XVI катализируемой палладием реакцией с трет-бутиловым эфиром 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (или родственными производными бороновой кислоты) с использованием методики Eastwood Tetrahedron Lett. 2000, 41, 3705-3708 или с использованием условий реакции сочетания Suzuki, представленных Zhuravel and Nguyen Tetrahedron Lett. 2001, 42,7925-7928, как показано в качестве примера в экспериментальной части, с последующим восстановлением двойной связи, как описано выше. В соединениях формулы XVI R6-R9 и G имеют указанные выше значения, тогда как Y представляет собой или атом хлора, брома или иода, или гидроксильную группу,или метоксигруппу, или альтернативно защищенную гидроксильную группу, у которой может быть удалена защита в условиях, известных специалистам в данной области и подробно рассмотренных в руководстве Protective Groups in Organic Synthesis, Greene and Wuts, Wiley Interscience (1991), ISBN 0471623016,или сульфониловый эфир, как описано для соединений формулы XI. Соединения формулы II могут быть, кроме того, получены сочетанием соединений структурной формулы XVII, где R" представляет собой водород, и соединения формулы XI в присутствии подходящего палладиевого или медного катализатора, как описано Schopfer and Schlapbach Tetrahedron 2001, 57,3069-3070; Bates et al. Org. Lett. 2002, 4, 2803-2806 или Kwong et al. Org. Lett. 2002, 4, 581-584. В соединении формулы XVII R6-R9 и R' имеют определенные выше значения и R" представляет собой водород или триалкил-, диалкиларил-, алкилдиарилсилильную защитную группу. Соединения формулы XVII, у которых R" представляют собой силильную группу, могут быть получены из соединений формулы XII в условиях, указанных Arnould et al. Tetrahedron Lett. 1996, 37, 4523-4524 и Rane et al. Tetrahedron Lett. 1994,35, 3225-3226. Сочетание соединений XVII и XI, когда R" представляет собой силильную группу, может быть осуществлено с использованием медного или палладиевого катализатора в присутствии стехиометрического количества фторид-ионов, например, в форме фторида тетра-н-бутиламмония (TBAF), в условиях, близких соответствующим условиям, описанным Arnould et al. Tetrahedron Lett. 1996, 37, 4523-4524 иRane et al. Tetrahedron Lett. 1994, 35, 3225-3226, как подробно представлено в экспериментальной части. Соединения формулы II могут быть получены сочетанием соединений XVIII и XI в присутствии подходящего медного или палладиевого катализатора, как подробно указано выше для аналогичного сочетания соединений формулы XVII и XI, с последующим восстановлением двойной связи в условиях,указанных выше для соединения формулы VI. В соединениях формулы XVIII R6-R9, R' и R" имеют определенные выше значения. Соединения формулы XVIII, в которой R" представляет собой силильную группу, могут быть получены из соединений формулы XX, в которой R6-R9, R' и G являются такими, как определено выше, в условиях, описанных Arnould et al. Tetrahedron Lett. 1996, 37, 4523-4524 и Rane et al.Tetrahedron Lett. 1994, 35, 3225-3226. Соединение формулы XX может быть получено из соединения формулы XVI катализируемой медью или палладием реакцией с трет-бутиловым эфиром 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (или родственными производными бороновой кислоты), как описано Eastwood Tetrahedron Lett. 2000, 41, 3705-3708, или с использованием условий реакций сочетания Suzuki, представленных Zhuravel and Nguyen TetrahedronLett. 2001, 42, 7925-7928, как показано в качестве примера в экспериментальной части. Альтернативно,соединение XX может быть получено из соединения формулы XXI направленным ортолитированием (Lводород) или галогенид-литиевым обменом (L-иодид или бромид), захватом электрофилом формулыVIII, как указано ниже для соединения формулы XXII, с последующим элиминированием-удалением защиты, как описано выше для соединений формулы VII. В соединениях формулы XXI R6-R9 являются такими, как определено выше, тогда как J представляет собой метоксигруппу или аналогичное направляющее гидроксильное производное и L представляет собой водород, атом брома или иода. Соединение формулы X может быть получено из соединений формулы XXI направленным ортолитированием или галогенид-металлообменом в соответствии с методиками, описанными Palmer et al. J.al. Angew. Chem. Int. Ed. 1998, 37, 1701-1703, или в соответствии с методиками, представленными в руководстве Organometallics in Synthesis. A Manual, Schlosser (Ed), John WileySons, Ltd. (2002), ISBN 0471984167, с последующим гашением электрофилами формулы VIII. При дезоксигенировании или элиминировании-восстановлении, которое описано выше для соединения формулы VII, соединения формулы XXI могут быть превращены в соединения формулы XXII, для которой R6-R9 являются такими, как определено выше, и Q представляет собой сложный сульфониловый эфир, который описан для соединений формулы XI. Следовательно, соединения формулы XXII могут быть превращены в соединения формулы XVII в условиях, указанных для соединений формулы XVII. Продукт реакции литированного соединения XXI и электрофила VIII может быть активирован в виде сульфонилового эфира после превращения J в гидроксильную группу методами, известными специалистам в данной области и подробно рассмотренными в руководстве Protective Groups in Organic Synthesis, Greene and Wuts, Wiley Interscience(1991), ISBN 0471623016. Образовавшиеся сульфониловые эфиры могут быть превращены в соединения формулы X в условиях, указанных для соединений формулы XVII, с последующим отщеплением силильной защитной группы методами, известными специалистам в данной области и подробно рассмотренными в руководстве Protective Groups in Organic Synthesis, Greene and Wuts, Wiley Interscience (1991), ISBN 0471623016. Восстановление двойной связи в соответствии со способом d) обычно осуществляли каталитическим гидрированием при низком давлении (3 бар) в аппарате Парра. Исходный продукт формулы VI может быть получен из соединений формулы VII. Примеры Аналитические данные ЖХ-ТОФ получали на 4-канальном приборе Micromass LCT, снабженном- 14010869 источником электрораспыления MUX и системой Waters 1525 LC. Аналитические данные ЖХ-МС получали на приборе РЕ Sciex API 150EX, снабженном источником электростатического распыления и системой Shimadzu LC-8A/SLC-10A LC. Колонка: 304,6 мм, Waters Symmetry C18 с размером частиц 3,5 мкм; система растворителей: А=вода/ТФУ (100:0,05) и В=вода/ацетонитрил/ТФУ (5:95:0,03) (ТФУ=трифторуксусная кислота); метод: элюирование с линейным градиентом от 90% А до 100% В в течение 4 мин и со скоростью потока 2 мл/мин. Чистоту определяли УФ (254 нм) и анализом следов ELSD. Время удерживания (RT) выражали в минутах. Очистку препаративной ЖХ-МС осуществляли в таком же устройстве. Колонка: 5020 мм YMC ODS-A с размером частиц 5 мкм; метод: элюирование с линейным градиентом от 80% А до 100% В в течение 7 мин и со скоростью потока 22,7 мл/мин. Сбор фракций проводили по детектированию МС с разделением потоков. Спектр 1 Н ЯМР регистрировали при 500,13 МГц на приборе Bruker Avance DRX 500 или при 250,13 МГц на приборе Bruker AC 250. В качестве растворителей использовали хлороформ (99,8% D) или диметилсульфоксид (99,8% D). В качестве внутреннего эталона использовали тетраметилсилан (ТМС). Значения химического сдвига выражали в м.д. (миллионные доли). Для мультиплетности сигналов ЯМР использовались следующие сокращения: с=синглет, д=дублет, т=триплет, кв=квартет, квин=квинтет, геп=гептет,дд=двойной дублет; дт=двойной триплет; дкв=двойной квартет, тт=триплет триплетов, м=мультиплет и уш.=широкий синглет. Реакции проводили в инертной атмосфере и в сухой среде, если не указано иначе. Реакции осуществляли в высокочастотных условиях в устройстве для синтеза Смита от фирмы Personal Chemistry, работающем при 2450 МГц. Получение промежуточных продуктов 1-Бром-2-(4-хлорфенилсульфанил)-5-(трифторметил)бензол (промежуточный продукт для 1 а). К перемешиваемому раствору трис(дибензилиден)дипалладия(0) (Pd2dba3, 0,183 г, 0,2 ммоль) и бис(2-дифенилфосфинофенилового) эфира (DPEphos, 0,215 г, 0,2 ммоль) в толуоле (80 мл) добавляли при комнатной температуре (к.т.) 3-бром-4-иодбензотрифторид (7,02 г, 20 ммоль, полученный из 2-бром-4 трифторметилфениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org.Chem. 1987, 52, 748-753), 4-хлортиофенол (2,89 г, 20 ммоль) и трет-бутоксид калия (2,46 г, 22 ммоль). Реакционную смесь перемешивали в течение 2,5 ч при 100 С, затем охлаждали до комнатной температуры (к.т.) и фильтровали через целит. Выпаривали растворитель и неочищенный продукт очищали флэшхроматографией на силикагеле (элюент: этилацетат/гептан 2:8) с получением 4,53 г (81%) 1-бром-2-(4 хлорфенилсульфанил)-5-(трифторметил)бензола в виде масла. Аналогично получали следующие промежуточные продукты для 1b-1m и 2 а-2 х. 1-Бром-2-(4-метоксифенилсульфанил)бензол (промежуточный продукт для 1b). Получен из 4-метоксибензолтиола и 1-бром-2-иодбензола. 1-Бром-2-(2,4-диметилфенилсульфанил)-5-(трифторметил) бензол (промежуточный продукт для 1 с). Получен из 2,4-диметилбензолтиола и 2-бром-1-иод-4-трифторметилбензола. 1-Бром-2-(4-хлорфенилсульфанил)-4-фторбензол (промежуточный продукт для 1d). Получен из 4 хлорбензолтиола и 1-бром-4-фтор-2-иодбензола. 1-Бром-4-фтор-2-(4-метоксифенилсульфанил)бензол (промежуточный продукт для 1 е). Получен из 4-метоксибензолтиола и 1-бром-4-фтор-2-иодбензола. 1-Бром-2-(4-метилфенилсульфанил)-5-метилбензол (промежуточный продукт для 1f). Получен из 4 метилбензолтиола и 2-бром-1-иод-4-метилбензола. 1-Бром-2-(2,4-диметилфенилсульфанил)-5-метилбензол (промежуточный продукт для 1g). Получен из 2,4-диметилбензолтиола и 2-бром-1-иод-4-метилбензола. 1-Бром-2-(4-фтор-2-метилфенилсульфанил)-5-метилбензол (промежуточный продукт для 1h). Получен из 4-фтор-1-иод-2-метилбензола и 2-бром-4-метилбензолтиола (полученного из 2-бром-4-метилфениламина диазотированием в соответствии с методикой, представленной для конверсии 3-толуидина в 3-тиокрезол, Tarbell and Fukushima J. Am. Chem. Soc. 1946, 68, 1456-1460). 1-Бром-2-(4-метоксифенилсульфанил)-5-метилбензол (промежуточный продукт для 1i). Получен из 4-метоксибензолтиола и 2-бром-1-иод-4-метилбензола. 1-Бром-2-(4-хлор-2-метилфенилсульфанил)бензол (промежуточный продукт для 1j). Получен из 4 хлор-1-иод-2-метилбензола и 2-бромбензолтиола. 1-Бром-2-(4-хлор-2-фторфенилсульфанил)бензол (промежуточный продукт для 1k). Получен из 4 хлор-2-фтор-1-иодбензола и 2-бромбензолтиола. 1-Бром-2-(2,4-дихлорфенилсульфанил)бензол (промежуточный продукт для 1l). Получен из 2,4-дихлорбензолтиола и 2-бром-1-иодбензола. 1-Бром-2-(2-хлор-4-метоксифенилсульфанил)бензол (промежуточный продукт для 1m). Получен из 2-бромбензолтиола и 2-хлор-1-иод-4-метоксибензола (полученного из 4-амино-3-хлорфенола диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753, с последующим алкилированием метилиодидом в соответствии с общей методикой Uozumi et al. J. Org. Chem. 1993,58, 1945-1945).- 15010869 1-Бром-2-(4-хлорфенилсульфанил)бензол (промежуточный продукт для 2 а). Получен из 4-хлорбензолтиола и 1-бром-2-иодбензола. 2-Бром-5-фтор-1-(4-метоксифенилсульфанил)бензол (промежуточный продукт для 2b). Получен из 4-метоксибензолтиола и 2-бром-4-фтор-1-иодбензола (полученного из 2-бром-4-фторфениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753). 1-Бром-2-(4-хлорфенилсульфанил)-5-фторбензол (промежуточный продукт для 2 с). Получен из 4 хлорбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-3-фтор-2-(4-метоксифенилсульфанил)бензол (промежуточный продукт для 2d). Получен из 4-метоксибензолтиола и 1-бром-3-фтор-2-иодбензола (полученного из 2-бром-6-фторфениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753). 2,5-Дибром-2-(2,4-диметилфенилсульфанил)бензол (промежуточный продукт для 2 е). Получен из 2,4-диметилбензолтиола и 2,4-дибром-1-иодбензола (полученного из 2,4-дибромфениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753). 1-Бром-4-фтор-2-(4-метилфенилсульфанил)бензол (промежуточный продукт для 2f). Получен из 4 метилбензолтиола и 1-бром-4-фтор-2-иодбензола. 1-Бром-2-(4-хлорфенилсульфанил)-5-метилбензол (промежуточный продукт для 2g). Получен из 4 хлорбензолтиола и 2-бром-1-иод-4-метилбензола. 1-Бром-2-(4-метилфенилсульфанил)-5-трифторметилбензол (промежуточный продукт для 2h). Получен из 4-метилбензолтиола и 3-бром-4-иодбензотрифторида. 1-Бром-5-фтор-2-(2,4-диметилфенилсульфанил)бензол (промежуточный продукт для 21). Получен из 2,4-диметилбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(4-фторфенилсульфанил)-5-фторбензол (промежуточный продукт для 2j). Получен из 4 фторбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2-хлор-4-фторфенилсульфанил)-5-фторбензол (промежуточный продукт для 2k). Получен из 2-хлор-4-фторбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-5-фтор-2-(4-метилфенилсульфанил)бензол (промежуточный продукт для 2l). Получен из 4 метилбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-5-фтор-2-(3-метоксифенилсульфанил)бензол (промежуточный продукт для 2m). Получен из 3-метоксибензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2-хлор-4-метилфенилсульфанил)-5-фторбензол (промежуточный продукт для 2n). Получен из 2-хлор-4-метилбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2-хлор-4-метоксифенилсульфанил)-5-фторбензол (промежуточный продукт для 2 о). Получен из 2-хлор-1-иод-4-метоксибензола и 2-бром-4-фторбензолтиола (полученного из 2-бром-4-фторфениламина диазотированием в соответствии с методикой, рассмотренной для конверсии 3-толуидина в 3-тиокрезол, Tarbell and Fukushima J. Am. Chem. Soc. 1946, 68, 1456-1460). 1-Бром-2-(4-хлор-2-фторфенилсульфанил)-5-фторбензол (промежуточный продукт для 2 р). Получен из 4-хлор-2-фтор-1-иодбензола и 2-бром-4-фторбензолтиола. 1-Бром-2-(2-фтор-4-метилфенилсульфанил)-5-фторбензол (промежуточный продукт для 2q). Получен из 2-фтор-1-иод-4-метилбензола и 2-бром-4-фторбензолтиола. 1-Бром-2-(2-хлорфенилсульфанил)-5-фторбензол (промежуточный продукт для 2r). Получен из 2 хлорбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2,4-дихлорфенилсульфанил)-5-фторбензол (промежуточный продукт для 2s). Получен из 2,4-дихлорбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2,4-дифторфенилсульфанил)-5-фторбензол (промежуточный продукт для 2t). Получен из 2,4-дифторбензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(2,4-диметилфенилсульфанил)-3-фторбензол (промежуточный продукт для 2u). Получен из 2,4-диметилбензолтиола и 1-бром-3-фтор-2-иодбензола. 1-Бром-5-фтор-2-(фенилсульфанил)бензол (промежуточный продукт для 2v). Получен из бензолтиола и 2-бром-4-фтор-1-иодбензола. 1-Бром-2-(4-бром-2-фторфенилсульфанил)-5-фторбензол (промежуточный продукт для 2x). Получен из 4-бром-2-фтор-1-иодбензола и 2-бром-4-фторбензолтиола. трет-Бутиловый эфир 4-(5-фтор-2-меркаптофенил)-4-гидроксипиперидин-1-карбоновой кислоты-78 С медленно добавляли метиллитий (1 М в смеси кумол/ТГФ, 28,9 мл, 28,9 ммоль). Через 30 мин при-78 С добавляли трет-бутиллитий (1,7 М в ТГФ, 39,9 мл, 63,8 ммоль) и реакционную смесь перемешивали 30 мин при -78 С. Добавляли раствор трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты(5,77 г, 28,9 ммоль) в ТГФ (20 мл), реакционной смеси давали возможность нагреваться до к.т. и перемешивали в течение ночи. Добавляли воду (50 мл) и этилацетат (25 мл) и органическую фазу удаляли. Водную фазу экстрагировали этилацетатом (50 мл) и насыщенным водным раствором хлорида аммония (25 мл). Органическую фазу промывали насыщенным водным раствором хлорида аммония (25 мл), сушили над- 16010869 сульфатом магния и выпаривали с получением неочищенного продукта. Неочищенный продукт очищали флэш-хроматографией на силикагеле (элюент: увеличивающееся количество (0-20%) этилацетата в гептане). Выход: 4,67 г (49%). трет-Бутиловый эфир 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3 а 1-3 а 6). В микроволновую пробирку объемом 10 мл добавляли трет-бутиловый эфир 4-(2-гидроксифенил) пиперидин-1-карбоновой кислоты (0,30 г, 1,08 ммоль), N-фенил-бис(трифторметансульфонимид) (393 мг,1,1 ммоль) и карбонат калия (448 мг, 3,25 ммоль). Добавляли ТГФ (2,2 мл) и пробирку закрывали мембраной. Смесь нагревали в микроволновых условиях при 120 С в течение 10 мин. Реакционную смесь охлаждали до к.т. и разбавляли диэтиловым эфиром (10 мл). Смесь фильтровали через целит, выпаривали растворитель и неочищенный продукт очищали хроматографией на силикагеле (элюент: увеличивающееся количество (0-100%) этилацетата в гептане) с получением 349 мг трет-бутилового эфира 4-(2-трифторметансульфонилоксифенил)пиперидин-1-карбоновой кислоты. Часть этого вещества (92 мг, 0,22 ммоль) и три(изопропил)силантиол (59 мг, 0,31 ммоль) растворяли в сухом толуоле (1,1 мл) и добавляли к ацетату палладия(II) (5 мг, 0,022 ммоль), (3)-2,2'-бис(ди-п-толилфосфанил)[1,1']бинафталенилу (S-(-)-TolBINAP, 16 мг, 0,024 ммоль) и трет-бутоксиду натрия (30 мг, 0,31 ммоль), помещенным в микроволновую пробирку объемом 10 мл. Добавляли ТГФ (2,2 мл) и пробирку закрывали мембраной. Смесь нагревали в микроволновых условиях при 120 С в течение 30 мин. Реакционную смесь охлаждали до к.т. и выпаривали растворитель. Неочищенный продукт очищали флэш-хроматографией на силикагеле (элюент: увеличивающееся количество (0-100%) этилацетата в гептане). Выход трет-бутилового эфира 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты: 64 мг (65%). трет-Бутиловый эфир 4-(5-метил-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3b1-3b12) получали аналогичным способом из трет-бутилового эфира 4-(2-гидрокси-5-метилфенил)пиперидин-1-карбоновой кислоты. Указанное соединение получали из 2-бром-4-метилфенола по следующей методике: смесь 2-бром-4-метилфенола (1,12 г, 6,0 ммоль), третбутилового эфира 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты (1,86 г, 6,0 ммоль), аддукта дихлорметана и дихлор[1,1'-бис(дифенилфосфин)ферроцен]палладия(II) (0,245 г, 0,3 ммоль) и карбоната калия (2,48 г, 18,0 ммоль) суспендировали в 1,2-диметоксиэтане (DME, 23 мл) и воде (7 мл). Суспензию перемешивали в течение ночи при 90 С, охлаждали до к.т. и затем гасили при 5 С добавлением водного раствора хлористо-водородной кислоты (2 М, 18 мл). Добавляли диэтиловый эфир (18 мл), разделяли фазы и водную фазу экстрагировали диэтиловым эфиром(218 мл). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия (30 мл), сушили над сульфатом магния и выпаривали. Неочищенный продукт очищали хроматографией на силикагеле (элюент: увеличивающееся количество (0-100%) этилацетата в гептане). Выход промежуточного трет-бутилового эфира 4-(2-гидрокси-5-метилфенил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты составлял 1,03 г (59%). Полученное вещество растворяли в этаноле (35 мл), добавляли 20%Pd/C (0,1 г) и смесь обрабатывали газообразным водородом (3 бар) в течение ночи в аппарате Парра. Смесь фильтровали через целит и выпаривали растворитель с получением трет-бутилового эфира 4-(2 гидрокси-5-метилфенил)пиперидин-1-карбоновой кислоты. Выход: 0,91 г (91%). трет-Бутиловый эфир 4-(5-метокси-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3 с 1-3 с 4) получали аналогичным способом из трет-бутилового эфира 4-(2-гидрокси-5-метоксифенил)пиперидин-1-карбоновой кислоты. Указанное соединение получали из 2-бром-4-метоксифенола (полученного бромированием из 4-метоксифенола в соответствии с методикой Carreno et al. Synlett 1997, 1241-1242), подвергали сочетанию с трет-бутиловым эфиром 4-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты и продукт восстанавливали с использованием Pd/C и газообразного водорода, как указано для трет-бутилового эфира 4-(2-гидрокси-5-метилфенил)пиперидин-1-карбоновой кислоты. трет-Бутиловый эфир 4-(2-фтор-6-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3d1-3d27). Раствор 1-фтор-3-метоксибензола (10,0 г, 79,3 ммоль) в сухом ТГФ (100 мл) обрабатывали н-бутиллитием (1,6 М в гексане, 49,8 мл, 79,3 ммоль) при -78 С в течение 5 ч. Добавляли раствор трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (15,8 г, 79,3 ммоль) в ТГФ (50 мл) с такой скоростью,чтобы температура поддерживалась ниже -65 С, реакционной смеси давали возможность нагреваться до к.т. и перемешивали в течение ночи. Добавляли насыщенный водный раствор хлорида аммония (50 мл) и затем этилацетат (10 мл). Органический слой промывали насыщенным водным раствором хлорида аммония (50 мл), сушили над сульфатом магния и выпаривали в вакууме с получением неочищенного продукта. В результате очистки хроматографией на силикагеле (элюент: этилацетат/гептан 1:1) получали 7,80 г(31%) трет-бутилового эфира 4-(2-фтор-6-метоксифенил)-4-гидроксипиперидин-1-карбоновой кислоты. Раствор полученного соединения в уксусной кислоте (70 мл) обрабатывали концентрированным водным раствором хлористо-водородной кислоты (30 мл) при кипячении с обратным холодильником в течение ночи. Летучие компоненты удаляли в вакууме и остаток распределяли между метиленхлоридом (100 мл)- 17010869 и смесью насыщенного водного раствора бикарбоната натрия (100 мл) и водного раствора гидроксида натрия (10% для доведения рН до 11). Органический слой сушили над сульфатом магния и удаляли в вакууме летучие компоненты. Остаток кипятили с обратным холодильником в смеси 33% бромистого водорода в уксусной кислоте (10 мл) и концентрированного водного раствора бромисто-водородной кислоты (20 мл). Удаляли в вакууме примерно 15 мл растворителя и остаток охлаждали на бане со льдом в течение 3 ч, при этом осаждалось 4,10 г (в целом, 59%) 4-(5-фтор-2-метоксифенил)-1,2,3,6-тетрагидропиридина в виде соли бромисто-водородной кислоты. Суспензию полученного соединения (4,10 г, 14,2 ммоль) в 1,2-дихлорэтане (100 мл) и триэтиламине (2,3 мл) перемешивали при к.т. 30 мин перед добавлением Вос 2 О (2,78 г, 14,0 ммоль). После перемешивания в течение ночи осадок отфильтровывали и фильтрат промывали насыщенным водным раствором хлорида аммония (50 мл) и сушили над сульфатом магния. Удаляли в вакууме летучие компоненты с получением 1,02 г (23%) трет-бутилового эфира 4-(2-фтор-6 гидроксифенил)-1,2,3,6-тетрагидропиридин-1-карбоновой кислоты. Полученное вещество растворяли в смеси этилацетата (10 мл) и этанола (40 мл) и обрабатывали в течение ночи 5% Pd/C (0,1 г) и газообразным водородом (3 бар) с использованием аппарата Парра. Катализатор удаляли фильтрованием и летучие компоненты удаляли в вакууме. Остаток (1,0 г) суспендировали в 1,2-дихлорэтане (20 мл), обрабатывали этилдиизопропиламином (0,53 г, 4,1 ммоль) при 0 С в течение 30 мин перед добавлением 1,1,2,2,3,3,4,4,4 нонафторбутан-1-сульфонилхлорида (1,12 г, 3,7 ммоль) и продолжали перемешивание в течение ночи при к.т. Отфильтровывали осадок, фильтрат промывали водой (20 мл), сушили над сульфатом магния и выпаривали с получением неочищенного продукта. В результате очистки хроматографией на силикагеле(1,27 г, 2,2 ммоль) и трет-бутоксида натрия (0,27 г, 2,9 ммоль) в сухом толуоле (25 мл) добавляли к раствору Pd2dba3 (0,10 г, 0,11 ммоль) и DPEphos (0,12 г, 0,22 ммоль) в сухом толуоле (25 мл). Добавляли триизопропилсилантиол (0,42 г, 2,2 ммоль) и смесь перемешивали в течение 5 ч при 100 С. После охлаждения до к.т. неочищенную смесь промывали водой (50 мл), сушили над сульфатом магния и удаляли в вакууме летучие компоненты. Остаток очищали хроматографией на силикагеле (элюент: этилацетат/гептан 1:4) с получением 0,8 г (78%) трет-бутилового эфира 4-(2-фтор-6-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты. трет-Бутиловый эфир 4-(5-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3 е 1-3 е 10). К охлажденному раствору н-бутиллития (2,1 М в гексане, 101 мл, 212,1 ммоль) в сухом ТГФ (100 мл) добавляли смесь 2-бром-4-фтор-1-метоксибензола (36,2 г, 176,7 ммоль) и сухого ТГФ (25 мл) с такой скоростью, чтобы поддерживалась температура ниже -40 С. Смесь перемешивали в течение 30 мин при-78 С перед добавлением этилового эфира 4-оксопиперидин-1-карбоновой кислоты (30,4 г, 176,7 ммоль) с такой скоростью, чтобы поддерживалась температура ниже -50 С. Образовавшейся смеси давали возможность нагреваться до к.т. и продолжали перемешивание в течение ночи. Добавляли воду (100 мл) и этилацетат (100 мл). Органический слой промывали насыщенным водным раствором хлорида аммония(100 мл), сушили над сульфатом магния и выпаривали в вакууме с получением 52,3 г (95%) этилового эфира 4-(5-фтор-2-метоксифенил)-4-гидроксипиперидин-1-карбоновой кислоты, который был достаточно чистым для следующей стадии. Полученное вещество растворяли в триэтилсилане (100 мл) и ТФУ(200 мл) и перемешивали при к.т. в течение 3 дней. Удаляли в вакууме летучие компоненты и остаток очищали хроматографией на силикагеле (элюент: этилацетат/гептан 1:3) с получением 44,4 г (примерно 90%) этилового эфира 4-(5-фтор-2-метоксифенил)пиперидин-1-карбоновой кислоты. Данное вещество кипятили с обратным холодильником в течение ночи в смеси 33% бромистого водорода в уксусной кислоте (75 мл) и концентрированного водного раствора бромисто-водородной кислоты (75 мл). Неочищенную смесь охлаждали на бане со льдом, при этом осаждалось 18,9 г (43%) 4-фтор-2-пиперидин-4-илфенола в виде соли бромисто-водородной кислоты. Суспензию данного соединения (23,9 г, 86,5 моль) в дихлорметане (200 мл) обрабатывали триэтиламином (13,2 мл, 95,2 ммоль) в течение 1 ч перед добавлением Вос 2 О (18,9 г, 86,5 ммоль) и продолжали перемешивание в течение 30 мин. Неочищенную смесь промывали насыщенным водным раствором хлорида аммония (50 мл) и водой (25 мл). Органический слой сушили над сульфатом магния и летучие компоненты удаляли в вакууме. В результате кристаллизации остатка получали 14,2 г (55%) трет-бутилового эфира 4-(5-фтор-2-гидроксифенил)пиперидин-1 карбоновой кислоты. Полученное соединение превращали в трет-бутиловый эфир 4-(5-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты способом, аналогично описанному для трет-бутилового эфира 4-(2-фтор-6-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты. трет-Бутиловый эфир 4-(4-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 3f1-3f13). С использованием методики, описанной для трет-бутилового эфира 4-(2-гидрокси-5-метилфенил) пиперидин-1-карбоновой кислоты, 2-бром-5-фторфенол превращали в трет-бутиловый эфир 4-(4-фтор-2 гидроксифенил)пиперидин-1-карбоновой кислоты. Полученное соединение превращали в трет-бутило- 18010869 вый эфир 4-(4-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты в условиях, описанных для трет-бутилового эфира 4-(2-фтор-6-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты. трет-Бутиловый эфир 4-гидрокси-4-(2-меркаптофенил)пиперидин-1-карбоновой кислоты (промежуточный продукт для 4 а). Указанный промежуточный продукт получали из 2-бромбензолтиола и трет-бутилового эфира 4 оксопиперидин-1-карбоновой кислоты способом, аналогично описанному для трет-бутилового эфира 4(5-фтор-2-меркаптофенил)-4-гидроксипиперидин-1-карбоновой кислоты. Получение дополнительных промежуточных продуктов 1-трет-Бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидин-4-ол (промежуточный продукт для 1 а). Раствор н-бутиллития (2,5 М в гексане, 6,5 мл, 16,2 ммоль) медленно добавляли при -78 С к перемешиваемому раствору 1-бром-2-(4-хлорфенилсульфанил)-5-(трифторметил)бензола (5,96 г, 16,2 ммоль) в сухом ТГФ (40 мл) в атмосфере аргона. Раствор перемешивали в течение 10 мин перед добавлением одной порцией трет-бутилового эфира 4-оксопиперидин-1-карбоновой кислоты (3,23 г, 16,2 ммоль). Раствору давали возможность нагреваться до к.т. и затем перемешивали в течение ночи. Добавляли насыщенный водный раствор хлорида аммония (80 мл) и раствор экстрагировали этилацетатом (80 мл). Органическую фазу промывали насыщенным водным раствором хлорида натрия (50 мл), сушили над сульфатом магния и выпаривали растворитель. Неочищенный продукт очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан, 2:8) с получением указанного в заголовке соединения в виде белой пены, выход: 4,53 г (57%). Следующие промежуточные продукты для 1b-1m и 2 а-2 х получали аналогично из следующих указанных выше промежуточных продуктов: 1-трет-бутоксикарбонил-4-[2-(4-метоксифенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 1b); 1-трет-бутоксикарбонил-4-[2-(2,4-диметилфенилсульфанил)-5-(трифторметилфенил]пиперидин-4-ол(промежуточный продукт для 1 с); 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)-4-фторфенил]пиперидин-4-ол (промежуточный продукт для 1d); 1-трет-бутоксикарбонил-4-[2-(4-метоксифенилсульфанил)-4-фторфенил]пиперидин-4-ол (промежуточный продукт для 1 е); 1-трет-бутоксикарбонил-4-[2-(4-метилфенилсульфанил)-5-метилфенил]пиперидин-4-ол (промежуточный продукт для 1f); 1-трет-бутоксикарбонил-4-[2-(2,4-диметилфенилсульфанил)-5-метилфенил]пиперидин-4-ол (промежуточный продукт для 1g); 1-трет-бутоксикарбонил-4-[2-(4-фтор-2-метилфенилсульфанил)-5-метилфенил]пиперидин-4-ол (промежуточный продукт для 1n); 1-трет-бутоксикарбонил-4-[2-(4-метоксифенилсульфанил)-5-метилфенил]пиперидин-4-ол (промежуточный продукт для 1i); 1-трет-бутоксикарбонил-4-[2-(4-хлор-2-метилфенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 1j); 1-трет-бутоксикарбонил-4-[2-(4-хлор-2-фторфенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 1k); 1-трет-бутоксикарбонил-4-[2-(2,4-дихлорфенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для l); 1-трет-бутоксикарбонил-4-[2-(2-хлор-4-метоксифенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 1m); 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 2 а); 1-трет-бутоксикарбонил-4-[2-(4-метоксифенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2b); 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 с); 1-трет-бутоксикарбонил-4-[2-(4-метоксифенилсульфанил)-3-фторфенилфенил]пиперидин-4-ол (промежуточный продукт для 2d); 1-трет-бутоксикарбонил-4-[2-(2,4-диметилфенилсульфанил)-5-бромфенил]пиперидин-4-ол (промежуточный продукт для 2 е); 1-трет-бутоксикарбонил-4-[2-(4-метилфенилсульфанил)-4-фторфенил]пиперидин-4-ол (промежуточный продукт для 2f); 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)-5-метилфенил]пиперидин-4-ол (промежуточный продукт для 2g); 1-трет-бутоксикарбонил-4-[2-(4-метилфенилсульфанил)-5-трифторметилфенил]пиперидин-4-ол (про- 19010869 межуточный продукт для 2h); 1-трет-бутоксикарбонил-4-[2-(2,4-диметилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2i); 1-трет-бутоксикарбонил-4-[2-(4-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2j); 1-трет-бутоксикарбонил-4-[2-(2-хлор-4-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2k); 1-трет-бутоксикарбонил-4-[2-(4-метилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2l); 1-трет-бутоксикарбонил-4-[2-(3-метоксифенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2m); 1-трет-бутоксикарбонил-4-[2-(2-хлор-4-метилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2n); 1-трет-бутоксикарбонил-4-[2-(2-хлор-4-метоксифенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 о); 1-трет-бутоксикарбонил-4-[2-(4-хлор-2-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 р); 1-трет-бутоксикарбонил-4-[2-(2-фтор-4-метилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2q); 1-трет-бутоксикарбонил-4-[2-(2-хлорфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2r); 1-трет-бутоксикарбонил-4-[2-(2,4-дихлорфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2s); 1-трет-бутоксикарбонил-4-[2-(2,4-дифторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2t); 1-трет-бутоксикарбонил-4-[2-(2,4-диметилфенилсульфанил)-3-фторфенил]пиперидин-4-ол (промежуточный продукт для 2u); 1-трет-бутоксикарбонил-4-[2-(фенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2v); 1-трет-бутоксикарбонил-4-[2-(4-бром-2-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 х). Дополнительные промежуточные продукты для 2 а 1-2 а 6 получали из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин-1-карбоновой кислоты и соответствующим образом замещенных арилиодидов, которые подробно описаны ниже, методом сочетания, катализируемого палладием, описанным для 1-бром-2-(4-хлорфенилсульфанил)-5-(трифторметил)бензола. 1-трет-Бутоксикарбонил-4-[2-(3-хлорфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 1). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин-1-карбоновой кислоты и 1-хлор-3-иодбензола. 1-трет-Бутоксикарбонил-4-[2-(3-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 2). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин 1-карбоновой кислоты и 1-фтор-3-иодбензола. 1-трет-Бутоксикарбонил-4-[2-(2-фтор-4-метоксифенилсульфапил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 3). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин-1-карбоновой кислоты и 2-фтор-1-иод-4-метоксибензола (полученного из 3-фтор-4 нитрофенола восстановлением до 4-амино-3-фторфенола, как описано Hogdson and Nicholson J. Chem.Stille J. Org. Chem. 1987, 52, 748-753 и последующим алкилированием метилиодидом в соответствии с общей методикой Uozumi et al. J. Org. Chem. 1993, 58, 1945-1945). 1-трет-Бутоксикарбонил-4-[2-(4-метокси-2-метилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 4). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин-1-карбоновой кислоты и 1-иод-4-метокси-2-метилбензола (полученного из 4-метокси 2-метилфениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753). 1-трет-Бутоксикарбонил-4-[2-(2-метилфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 5). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин 1-карбоновой кислоты и 1-иод-2-метилбензола. 1-трет-Бутоксикарбонил-4-[2-(2-фторфенилсульфанил)-5-фторфенил]пиперидин-4-ол (промежуточный продукт для 2 а 6). Получен из трет-бутилового эфира 4-гидрокси-4-(2-меркапто-5-фторфенил)пиперидин 1-карбоновой кислоты и 2-фтор-1-иодбензола. 1-трет-Бутоксикарбонил-4-[2-(4-метоксикарбонилфенилсульфанил)фенил]пиперидин-4-ол (промежуточный продукт для 4 а) получали из трет-бутилового эфира 4-гидрокси-4-(2-меркаптофенил)пиперидин 1-карбоновой кислоты и метилового эфира 4-иодбензойной кислоты методом сочетания, катализируемо- 20010869 го палладием, описанным для 1-бром-2-(4-хлорфенилсульфанил)-5-(трифторметил)бензола. Соединения изобретения Способ А. 1 а. Соль фумаровой кислоты 4-[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидина. К перемешиваемому раствору 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидин-4-ола (0, 98 г, 2,0 ммоль) и диметилпиридин-4-иламина (DMAP, 0,44 г, 3,6 ммоль) в сухом ацетонитриле (6,4 мл) при 0 С в атмосфере аргона добавляли метиловый эфир хлороксоуксусной кислоты (1,37 г, 11,2 ммоль). Реакционной смеси давали возможность достигать комнатной температуры и затем перемешивали в течение ночи. Добавляли этилацетат (40 мл) и осажденные соли удаляли фильтрованием через целит. Органическую фазу промывали насыщенным водным раствором бикарбоната натрия(40 мл), насыщенным водным раствором хлорида натрия (40 мл) и сушили над сульфатом магния. Выпаривали летучие компоненты и неочищенное вещество сушили в вакууме. Полученное вещество растворяли в сухом толуоле (13 мл) в атмосфере аргона. Добавляли гидрид три-н-бутилолова (0,81 г, 3,0 ммоль) и 2-[(цианодиметилметил)азо]-2-метилпропионитрил (AIBN, 82 мг, 0,5 ммоль). Раствор перемешивали в атмосфере аргона при 90 С в течение 3,5 ч. Выпаривали растворитель и неочищенное вещество очищали хроматографией на силикагеле (элюент: этилацетат/гептан 1:9) с получением трет-бутилового эфира 4[2-(4-хлорфенилсульфанил)-5-трифторметилфенил]пиперидин-1-карбоновой кислоты в виде прозрачного масла (0,77 г, 82%). Полученное масло растворяли в метаноле (8 мл) и при 0 С добавляли хлористый водород в диэтиловом эфире (2 М, 8 мл). Реакционной смеси давали возможность нагреваться до комнатной температуры и перемешивали в течение ночи. Выпаривали растворитель и добавляли этилацетат (25 мл). Органическую фазу экстрагировали водным раствором гидроксида натрия (2 М, 8 мл) и промывали насыщенным водным раствором хлорида натрия (10 мл), сушили над сульфатом магния и выпаривали растворитель. Образовавшееся вещество (588 мг) растворяли в этилацетате (2,2 мл) и добавляли фумаровую кислоту (183 мг, 1,58 ммоль), растворенную в горячем этаноле (96%, 4,4 мл). Указанное в заголовке соединение собирали в виде белого твердого вещества. ЖХ/МС (m/z) 372,1 (МН+); RT=2,54; чистота (УФ,ELSD): 97%, 100%; выход: 0,187 г (19%). Следующие соединения изобретения 1b-1m получали аналогично из соответствующих указанных выше промежуточных продуктов. 1b. Соль щавелевой кислоты 4-[2-(4-метоксифенилсульфанил)фенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 299,9 (МН+); RT=2,04; чистота (УФ, ELSD): 95%, 97%; выход: 0,090 г (10%). 1 с. Соль щавелевой кислоты 4-[2-(2,4-диметилфенилсульфанил)-5-трифторметилфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 366,2 (МН+); RT=2,45; чистота (УФ, ELSD): 97%, 99%; выход: 0,61 г (45%). 1d. Соль щавелевой кислоты 4-[2-(4-хлорфенилсульфанил)-4-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 322,1 (МН+); RT=2,33; чистота (УФ, ELSD): 83%, 97%; выход: 0,385 г (51%). 1 е. Соль хлористо-водородной кислоты 4-[2-(4-метоксифенилсульфанил)-4-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 318,1 (МН+); RT=2,12; чистота (УФ, ELSD): 96%, 99%; выход: 0,308 г (30%). 1f. Соль щавелевой кислоты 4-[2-(4-метилфенилсульфанил)-5-метилфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 298,2 (МН+); RT=2,29; чистота (УФ, ELSD): 98%, 99%; выход: 0,233 г (33%). 1g. Соль щавелевой кислоты 4-[2-(2,4-диметилфенилсульфанил)-5-метилфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 312,0 (МН+); RT=2,41; чистота (УФ, ELSD): 98%,100%; выход: 0,233 г (33%). 1h. Соль щавелевой кислоты 4-[2-(4-фтор-2-метилфенилсульфанил)-5-метилфенил]пиперидина выделяли в виде белого твердого вещества. ЖХ/МС (m/z) 316,0 (МН+); RT=2,33; чистота (УФ, ELSD): 96%,100%; выход: 0,336 г (34%). 1i. Соль щавелевой кислоты 4-[2-(4-метоксифенилсульфанил)-5-метилфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 313,8 (МН+); RT=2,16; чистота (УФ, ELSD): 96%, 99%; выход: 0,375 г (34%).- 21010869 1j. Соль трифторуксусной кислоты 4-[2-(4-хлор-2-метилфенилсульфанил)фенил]пиперидина собирали в виде прозрачного масла. ЖХ/ТОФ (m/z) 318,0 (МН+); RT=2,36; чистота (УФ, ELSD): 99,7%, 99,0%. 1k. Соль трифторуксусной кислоты 4-[2-(4-хлор-2-фторфенилсульфанил)фенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 322,0 (МН+); RT=2,27; чистота (УФ, ELSD): 94,6%, 99,7%. 1l. Соль трифторуксусной кислоты 4-[2-(2,4-дихлорфенилсульфанил)фенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 337,9 (МН+); RT=2,37; чистота (УФ, ELSD): 94,9%, 99,6%. 1m. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-метоксифенилсульфанил)фенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 334,0 (МН+); RT=2,23; чистота (УФ, ELSD): 95,9%, 99,9%. Способ В. 2 а. Соль щавелевой кислоты 4-[2-(4-хлорфенилсульфанил)фенил]пиперидина. К перемешиваемому раствору 1-трет-бутоксикарбонил-4-[2-(4-хлорфенилсульфанил)фенил]пиперидин 4-ола (12,13 г, 28,9 ммоль) в уксусной кислоте (450 мл) добавляли концентрированный водный раствор хлористо-водородной кислоты (150 мл). Раствор кипятили с обратным холодильником в течение ночи,охлаждали до комнатной температуры и затем перемешивали на бане со льдом. Медленно добавляли насыщенный водный раствор гидроксида натрия (250 мл) и непрозрачный раствор экстрагировали этилацетатом (3450 мл). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия (450 мл), сушили над сульфатом магния и выпаривали растворители. Неочищенное вещество(8,02 г) растворяли в ТГФ (195 мл) и добавляли ди-трет-бутилдикарбонат (Вос 2 О, 6,96 г, 31,9 ммоль) и триэтиламин (5 мл). Смесь перемешивали в течение ночи и затем гасили добавлением насыщенного водного раствора хлорида аммония (200 мл). Органическую фазу сушили над сульфатом магния и выпаривали растворитель. Неочищенное вещество очищали хроматографией на силикагеле (элюент: увеличивающееся количество этилацетата (0-20%) в гептане) с получением трет-бутилового эфира 4-[2-(4-хлорфенилсульфанил)фенил]пиперидин-1-карбоновой кислоты в виде белого твердого вещества (5,63 г). Полученное вещество растворяли в метиленхлориде (130 мл). В раствор барботировали газообразный водород(3 бар) с использованием аппарата Парра, добавляли (1,5-циклооктадиен)(пиридин)(трициклогексилфосфин)-(гексафторфосфин)иридий(I) (катализатор Crabtree, 0,495 г, 1,40 ммоль) и давали возможность продолжаться гидрированию в течение ночи. Катализатор отфильтровывали и неочищенный продукт очищали хроматографией на силикагеле (элюент: увеличивающееся количество этилацетата (0-20%) в гептане) с получением трет-бутилового эфира 4-[2-(4-хлорфенилсульфанил)фенил]пиперидин-1-карбоновой кислоты (5,37 г). Полученное вещество растворяли в метаноле (70 мл), добавляли хлористый водород в диэтиловом эфире (2 М, 67 мл, 133 ммоль) и реакционную смесь перемешивали в течение ночи. Выпаривали растворитель и добавляли водный раствор гидроксида натрия (2 М, 200 мл) и этилацетат (400 мл). Разделяли фазы и водную фазу экстрагировали этилацетатом (400 мл). Объединенные органические фазы промывали насыщенным водным раствором хлорида натрия (300 мл), сушили над сульфатом магния и выпаривали растворитель. Остаток очищали хроматографией на силикагеле (элюент: увеличивающееся количество этанола (0-25%) в этилацетате, содержащем 5% триэтиламина) с получением 4-[2-(4-хлорфенилсульфанил)фенил]пиперидина (1,63 г). Полученное вещество растворяли в ТГФ при 50 С и медленно добавляли раствор щавелевой кислоты (0,48 г) в ТГФ. Собирали соль щавелевой кислоты 4-[2-(4-хлорфенилсульфанил)фенил]пиперидина в виде белого твердого вещества. ЖХ/МС (m/z) 304,0 (МН+); RT=2,29; чистота (УФ, ELSD): 96%, 96%; выход: 1,86 г (15%). Следующие соединения изобретения 2b-2 х и 2 а 1-2 а 6 получали аналогично из соответствующих указанных выше промежуточных продуктов. 2b. Соль щавелевой кислоты 4-[2-(4-метоксифенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 318,1 (МН+); RT=2,16; чистота (УФ, ELSD): 91%, 98%. 2 с. Соль щавелевой кислоты 4-[2-(4-хлорфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 321,9 (МН+); RT=2,33; чистота (УФ, ELSD): 94,96%; выход: 0,241 г. 2d. Соль щавелевой кислоты 4-[2-(4-метоксифенилсульфанил)-3-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 318,1 (МН+); RT=2,12; чистота (УФ, ELSD): 98,6%, 98,5%. 2 е. Соль фумаровой кислоты 4-[2-(2,4-диметилфенилсульфанил)-5-бромфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 378,0 (МН+); RT=2,50; чистота (УФ, ELSD): 99,3%, 98,5%. 2f. Соль трифторуксусной кислоты 4-[2-(4-метилфенилсульфанил)-4-фторфенил]пиперидина соби- 22010869 рали в виде прозрачного масла. ЖХ/МС (m/z) 302,1 (МН+); RT=2,12; чистота (УФ, ELSD): 73,3%, 97,9%. 2g. Соль трифторуксусной кислоты 4-[2-(4-хлорфенилсульфанил)-5-метилфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 317,0 (МН+); RT=2,41; чистота (УФ, ELSD): 94,9%, 99,8%. 2h. Соль трифторуксусной кислоты 4-[2-(4-метилфенилсульфанил)-5-трифторметилфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 352,2 (МН+); RT=2,49; чистота (УФ, ELSD): 95,0%, 99,8%. 2i. Соль щавелевой кислоты 4-[2-(2,4-диметилфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 316,1 (МН+); RT=2,38; чистота (УФ, ELSD): 95,1%, 100%. 2j. Соль щавелевой кислоты 4-[2-(4-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 306,0 (МН+); RT=2,10; чистота (УФ, ELSD): 88,1%, 97,6%. 2k. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 340,0 (МН+); RT=2,20; чистота (УФ, ELSD): 95,1%, 100%. 2l. Соль фумаровой кислоты 4-[2-(4-метилфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 302,0 (МН+); RT=2,26; чистота (УФ, ELSD): 96%, 99,7%. 2m. Соль щавелевой кислоты 4-[2-(3-метоксифенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 318,0 (МН+); RT=2,17; чистота (УФ, ELSD): 91,1%, 97,1%. 2n. Соль фумаровой кислоты 4-[2-(2-хлор-4-метилфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 335,9 (МН+); RT=2,24; чистота (УФ, ELSD): 95,8%, 99,6%. 2 о. Соль фумаровой кислоты 4-[2-(2-хлор-4 метоксифенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 352,2 (МН+); RT=2,27; чистота (УФ, ELSD): 95,8%, 97,2%. 2 р. Соль фумаровой кислоты 4-[2-(4-хлор-2-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 340,0 (МН+); RT=2,25; чистота (УФ, ELSD): 97,4%, 99,9%. 2q. Соль фумаровой кислоты 4-[2-(2-фтор-4-метилфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 320,0 (МН+); RT=2,22; чистота (УФ, ELSD): 92,7%, 97,1%. 2r. Соль бромисто-водородной кислоты 4-[2-(2-хлорфенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 321,9 (МН+); RT=2,14 мин.; чистота (УФ, ELSD): 72,0%, 96,6%. 2s. Соль фумаровой кислоты 4-[2-(2,4-дихлорфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 358,0 (МН+); RT=2,34; чистота (УФ, ELSD): 97%, 99%. 2t. Соль фумаровой кислоты 4-[2-(2,4-дифторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 324,0 (МН+); RT=2,11; чистота (УФ, ELSD): 97%, 100%. 2u. Соль трифторуксусной кислоты 4-[2-(2,4-диметилфенилсульфанил)-3-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 314,0 (МН+); RT=2,33; чистота (УФ, ELSD): 85,3%, 98,5%. 2v. Соль трифторуксусной кислоты 4-[2-(фенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 288,0 (МН+); RT=2,06; чистота (УФ, ELSD): 98,6%, 99,4%. 2 х. Соль трифторуксусной кислоты 4-[2-(4-бром-2-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 386,0 (МН+); RT=2,16; чистота (УФ, ELSD): 96,7%, 99,3%. 2a1. Соль щавелевой кислоты 4-[2-(3-хлорфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 322,0 (МН+); RT=2,22; чистота (УФ, ELSD): 95,4%, 89%. 2 а 2. Соль щавелевой кислоты 4-[2-(3-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 306,0 (MH+); RT=2,23; чистота (УФ, ELSD): 90%, 99%. 2 а 3. Соль фумаровой кислоты 4-[2-(2-фтор-4-метоксифенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 336,0 (МН+); RT=2,06; чистота (УФ, ELSD): 97,3%, 99,9%. 2 а 4. Соль трифторуксусной кислоты 4-[2-(2-метил-4-метоксифенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 332,0 (МН+); RT=2,16; чистота (УФ, ELSD): 96%, 100%. 2 а 5. Соль фумаровой кислоты 4-[2-(2-метилфенилсульфанил)-5-фторфенил]пиперидина собирали в виде белого твердого вещества. ЖХ/МС (m/z) 302,1 (МН+); RT=2,20; чистота (УФ, ELSD): 79,9%, 99,0%. 2 а 6. Соль бромисто-водородной кислоты 4-[2-(2-фторфенилсульфанил)-5-фторфенил]пиперидина собирали в виде прозрачного масла. ЖХ/МС (m/z) 306,0 (МН+); RT=2,17; чистота (УФ, ELSD): 86,7%, 94%. Способ С.- 23010869 3 а 1. Соль трифторуксусной кислоты 4-[2-(4-трифторметилфенилсульфанил)фенил]пиперидина. Смесь трет-бутилового эфира 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты (38 мг, 0,085 ммоль) и 1-иод-4-трифторметилбензола (23 мг, 0,085 ммоль) растворяли в сухом дегазированном толуоле (0,3 мл). Добавляли Pd2dba3 (1 мг) и DPEphos (1 мг), растворенный в сухом толуоле (0,2 мл). К полученному раствору добавляли трет-бутоксид калия (10 мг) и фторид тетра-н-бутиламмония (TBAF, 1M в ТГФ, 0,1 мл, 0,1 ммоль) и реакционную смесь перемешивали при 110 С в течение 1 ч в атмосфере аргона. Раствор фильтровали и выпаривали растворитель. Неочищенный продукт очищали хроматографией на силикагеле (элюент: увеличивающееся количество (0-100%) этилацетата в гептане) с получением трет-бутилового эфира 4-[2-(4-трифторметилфенилсульфанил)фенил]пиперидин-1 карбоновой кислоты (3 а 1) в виде прозрачного масла (22 мг, выход 59%). Полученное вещество растворяли в метаноле (1 мл), добавляли хлористый водород в диэтиловом эфире (2 М, 1 мл) и раствор перемешивали в течение ночи при к.т. Выпаривали растворитель и неочищенный продукт очищали ВЭЖХ (содержащий 0,1% ТФУ в стандартном элюенте) с получением 4-[2-(4-трифторметилфенилсульфанил)фенил] пиперидина 3 а 1 в виде соли трифторуксусной кислоты. Выход: 3,2 мг (общий 8%). ЖХ/ТОФ (m/z) 338,0(МН+); RT=2,29 мин.; чистота (УФ, ELSD): 98,3%, 97,1%. Следующие соединения изобретения 3 а 1-3 а 6 (полученные из трет-бутилового эфира 4-(2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты), 3b1-3b12 (полученные из трет-бутилового эфира 4-(2-триизопропилсиланилсульфанил-5-метилфенил)пиперидин-1-карбоновой кислоты),3 с 1-3 с 4 (полученные из трет-бутилового эфира 4-(2-триизопропилсиланилсульфанил-5-метоксифенил) пиперидин-1-карбоновой кислоты), 3d1-3d27 (полученные из трет-бутилового эфира 4-(2-фтор-6-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты), 3 е 1-3 е 10 (полученные из трет-бутилового эфира 4-(5-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты),3f1-3f13 (полученные из трет-бутилового эфира 4-(4-фтор-2-триизопропилсиланилсульфанилфенил)пиперидин-1-карбоновой кислоты) получали аналогично. 3 а 2. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-фторфенилсульфанил)фенил]пиперидина получали из 2-хлор-4-фтор-1-иодбензола и собирали в виде прозрачного масла (5,0 мг). ЖХ/ТОФ (m/z) 322,0(МН+); RT=2,27 мин.; чистота (УФ, ELSD): 98,4%, 97,7%. 3 а 3. Соль трифторуксусной кислоты 4-[2-(4-метокси-2-метилфенилсульфанил)фенил]пиперидина получали из 1-иод-4-метокси-2-метилбензола и собирали в виде прозрачного масла (5,8 мг). ЖХ/МС(m/z) 314,0 (МН+); RT=2,24 мин.; чистота (УФ, ELSD): 98,4%, 100%. 3 а 4. Соль трифторуксусной кислоты 4-[2-(2,4-дифторфенилсульфанил)фенил]пиперидина получали из 2,4-дифтор-1-иодбензола и собирали в виде прозрачного масла (3,7 мг). ЖХ/МС (m/z) 306,0 (МН+);RT=2,24 мин.; чистота (УФ, ELSD) : 97,9%, 100%. 3 а 5. Соль трифторуксусной кислоты 4-[2-(2,3-диметилфенилсульфанил) фенил]пиперидина получали из 1-иод-2,3-диметилбензола и собирали в виде прозрачного масла (6,0 мг). ЖХ/МС (m/z) 298,1(МН+); RT=2,37 мин.; чистота (УФ, ELSD): 95,9%, 95,9%. 3 а 6. Соль трифторуксусной кислоты 4-[2-(3,4-диметилфенилсульфанил)фенил]пиперидина получали из 4-иод-1,2-диметилбензола и собирали в виде прозрачного масла (4,2 мг). ЖХ/МС (m/z) 298,0(МН+); RT=2,37 мин.; чистота (УФ, ELSD): 96,6%, 100%. 3b1. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-метоксифенилсульфанил)-5-метилфенил]пиперидина получали из 2-хлор-1-иод-4-метоксибензола и собирали в виде прозрачного масла (3,8 мг). ЖХ/МС (m/z) 347,9 (МН+); RT=2,28 мин.; чистота (УФ, ELSD): 92,3%, 100%. 3b2. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-метилфенилсульфанил)-5-метилфенил]пиперидина получали из 2-хлор-1-иод-4-метилбензола и собирали в виде прозрачного масла (4,4 мг). ЖХ/МС(m/z) 331,9 (МН+); RT=2,39 мин.; чистота (УФ, ELSD): 97,3%, 100%. 3b3. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-метилфенилсульфанил)-5-метилфенил]пиперидина получали из 2-фтор-1-иод-4-метилбензола и собирали в виде прозрачного масла (4,3 мг). ЖХ/МС(m/z) 315,9 (МН+); RT=2,30 мин.; чистота (УФ, ELSD): 85,8%, 100%. 3b4. Соль трифторуксусной кислоты 4-[2-(4-фтор-3-метоксифенилсульфанил)-5-метилфенил]пиперидина получали из 2-фтор-4-иод-1-метоксибензола (полученного из 3-фтор-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (4,3 мг). ЖХ/МС (m/z) 332,0 (МН+); RT=2,20 мин.; чистота (УФ, ELSD): 88,1%, 100%. 3b5. Соль трифторуксусной кислоты 4-[2-(3-фтор-2-метилфенилсульфанил)-5-метилфенил]пиперидина получали из 1-фтор-3-иод-2-метилбензола и собирали в виде прозрачного масла (5,2 мг). ЖХ/МС(m/z) 315,9 (МН+); RT=2,34 мин.; чистота (УФ, ELSD): 88,9%, 97,5%. 3b6. Соль трифторуксусной кислоты 4-[2-(3-фтор-4-метилфенилсульфанил)-5-метилфенил]пиперидина получали из 2-фтор-4-иод-1-метилбензола и собирали в виде прозрачного масла (6,1 мг). ЖХ/МС(m/z) 316,0 (МН+); RT=2,34 мин.; чистота (УФ, ELSD): 99,1%, 100%. 3b7. Соль трифторуксусной кислоты 4-[2-(5-хлор-2-фторфенилсульфанил)-5-метилфенил]пиперидина получали из 4-хлор-1-фтор-2-иодбензола и собирали в виде прозрачного масла (5,8 мг). ЖХ/МС- 24010869 3b8. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-фторфенилсульфанил)-5-метилфенил]пиперидина получали из 2-хлор-4-фтор-1-иодбензола и собирали в виде прозрачного масла (6,0 мг). ЖХ/МС(m/z) 336,1 (МН+); RT=2,34 мин.; чистота (УФ, ELSD): 98,0%, 100%. 3b9. Соль трифторуксусной кислоты 4-[2-(3-метоксифенилсульфанил)-5-метилфенил]пиперидина получали из 1-иод-3-метоксибензола и собирали в виде прозрачного масла (4,0 мг). ЖХ/МС (m/z) 313,9(МН+); RT=2,18 мин.; чистота (УФ, ELSD): 92,6%, 99,9%. 3b10. Соль трифторуксусной кислоты 4-[2-(4-хлор-2-фторфенилсульфанил)-5-метилфенил]пиперидина получали из 4-хлор-2-фтор-1-иодбензола и собирали в виде прозрачного масла (6,1 мг). ЖХ/МС(m/z) 336,2 (МН+); RT=2,37 мин.; чистота (УФ, ELSD): 93,4%, 99,9%. 3b11. Соль трифторуксусной кислоты 4-[2-(3-хлор-2-фторфенилсульфанил)-5-метилфенил]пиперидина получали из 1-хлор-2-фтор-3-иодбензола и собирали в виде прозрачного масла (6,3 мг). ЖХ/МС(m/z) 336,0 (МН+); RT=2,35 мин.; чистота (УФ, ELSD): 97,8%, 99,8%. 3b12. Соль трифторуксусной кислоты 4-[2-(2,4-дифторфенилсульфанил)-5-метилфенил]пиперидина получали из 2,4-дифтор-1-иодбензола и собирали в виде прозрачного масла (3,7 мг). ЖХ/МС (m/z) 319,7(МН+); RT=2,22 мин.; чистота (УФ, ELSD): 92,5%, 99,9%. 3 с 1. Соль трифторуксусной кислоты 4-[2-(4-метилфенилсульфанил)-5-метоксифенил]пиперидина получали из 1-иод-4-метилбензола и собирали в виде прозрачного масла (2,6 мг). ЖХ/МС (m/z) 314,1(МН+); RT=2,21 мин.; чистота (УФ, ELSD): 89,2%, 100%. 3 с 2. Соль трифторуксусной кислоты 4-[2-(4-фторфенилсульфанил)-5-метоксифенил]пиперидина получали из 1-фтор-4-иодбензола и собирали в виде прозрачного масла (2,1 мг). ЖХ/МС (m/z) 318,1(МН+); RT=2,13 мин.; чистота (УФ, ELSD): 80,9%, 99,2%. 3 с 3. Соль трифторуксусной кислоты 4-[2-(2-метил-4-метоксифенилсульфанил)-5-метоксифенил]пиперидина получали из 4-иод-2-метил-1-метоксибензола (полученного из 2-метил-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (2,5 мг). ЖХ/МС (m/z) 344,1 (МН+); RT=2,17 мин.; чистота (УФ,ELSD): 93,6%, 99,8%. 3 с 4. Соль трифторуксусной кислоты 4-[2-(4-фтор-2-метилфенилсульфанил)-5-метоксифенил]пиперидина получали из 4-фтор-1-иод-2-метилбензола и собирали в виде прозрачного масла (2,2 мг). ЖХ/МС(m/z) 332,0 (МН+); RT=2,25 мин.; чистота (УФ, ELSD): 87,6%, 75,3%. 3d1. Соль трифторуксусной кислоты 4-[2-(3-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-3-метоксибензола и собирали в виде прозрачного масла (2,3 мг). ЖХ/МС (m/z) 332,0(МН+); RT=2,03 мин.; чистота (УФ, ELSD): 98,7%, 100%. 3d2. Соль трифторуксусной кислоты 4-[2-(2-метилфенилсульфанил)-6-фтор фенил]пиперидина получали из 1-иод-4-метилбензола и собирали в виде прозрачного масла (2,1 мг). ЖХ/МС (m/z) 302,1(МН+); RT=2,12 мин.; чистота (УФ, ELSD): 97,8%, 99,9%. 3d3. Соль трифторуксусной кислоты 4-[2-(3-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-3-метилбензола и собирали в виде прозрачного масла (3,6 мг). ЖХ/МС (m/z) 302,2(МН+); RT=2,14 мин.; чистота (УФ, ELSD): 97,4%, 100%. 3d4. Соль трифторуксусной кислоты 4-[2-(4-метокси-2-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 4-иод-2-метил-1-метоксибензола (полученного из 2-метил-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (2,2 мг). ЖХ/МС (m/z) 332,1 (МН+); RT=2,14 мин.; чистота (УФ,ELSD): 96,9%, 100%. 3d5. Соль трифторуксусной кислоты 4-[2-(2-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-2-метоксибензола и собирали в виде прозрачного масла (1,7 мг). ЖХ/МС (m/z) 317,9(МН+); RT=1,98 мин.; чистота (УФ, ELSD): 98,7%, 100%. 3d6. Соль трифторуксусной кислоты 4-[2-(4-фтор-2-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 4-фтор-1-иод-2-метилбензола и собирали в виде прозрачного масла (2,3 мг). ЖХ/МС(m/z) 332,0 (МН+); RT=2,16 мин.; чистота (УФ, ELSD): 96,3%, 100%. 3d7. Соль трифторуксусной кислоты 4-[2-(3-фтор-4-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 2-фтор-4-иод-1-метилбензола и собирали в виде прозрачного масла (1,9 мг). ЖХ/МС(m/z) 320,0 (МН+); RT=2,21 мин.; чистота (УФ, ELSD): 96,1%, 100%. 3d8. Соль трифторуксусной кислоты 4-[2-(2,3-диметилфенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-2,3-диметилбензола и собирали в виде прозрачного масла (1,7 мг). ЖХ/МС (m/z) 315,9(МН+); RT=2,23 мин.; чистота (УФ, ELSD): 95,8%, 100%. 3d9. Соль трифторуксусной кислоты 4-[2-(3-фтор-2-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 1-фтор-3-иод-2-метилбензола и собирали в виде прозрачного масла (1,8 мг). ЖХ/МС(m/z) 319,9 (МН+); RT=2,18 мин.; чистота (УФ, ELSD): 94,6%, 100%. 3d10. Соль трифторуксусной кислоты 4-[2-(3-хлорфенилсульфанил)-6-фтор фенил]пиперидина получали из 1-хлор-3-иодбензола и собирали в виде прозрачного масла (1,7 мг). ЖХ/МС (m/z) 321,9 (МН+);RT=2,15 мин.; чистота (УФ, ELSD): 94,1%, 99,6%. 3d11. Соль трифторуксусной кислоты 4-[2-(3-фторфенилсульфанил)-6-фторфенил]пиперидина по- 25010869 лучали из 1-фтор-3-иодбензола и собирали в виде прозрачного масла (3,4 мг). ЖХ/МС (m/z) 305,8 (МН+);RT=2,04 мин.; чистота (УФ, ELSD): 92,6%, 100%. 3d12. Соль трифторуксусной кислоты 4-[2-(2-фторфенилсульфанил)-6-фторфенил]пиперидина получали из 1-фтор-2-иодбензола и собирали в виде прозрачного масла (3,5 мг). ЖХ/МС (m/z) 305,9 (МН+);RT=2,00 мин.; чистота (УФ, ELSD): 92,5%, 99,9%. 3d13. Соль трифторуксусной кислоты 4-[2-(4-фтор-3-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 1-фтор-4-иод-2-метоксибензола (полученного из 4-фтор-3-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (1,2 мг). ЖХ/МС (m/z) 336,0 (МН+); RT=2,07 мин.; чистота (УФ, ELSD): 91,7%, 100%. 3d14. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 2-хлор-1-иод-4-метилбензола и собирали в виде прозрачного масла (2,5 мг). ЖХ/МС(m/z) 336,2 (МН+); RT=2,24 мин.; чистота (УФ, ELSD): 91,6%, 96,3%. 3d15. Соль трифторуксусной кислоты 4-[2-(4-хлор-2-фторфенилсульфанил)-6-фторфенил]пиперидина получали из 4-хлор-2-фтор-1-иодбензола и собирали в виде прозрачного масла (1,7 мг). ЖХ/МС(m/z) 340,0 (МН+); RT=2,20 мин.; чистота (УФ, ELSD): 91,5%, 99,9%. 3d16. Соль трифторуксусной кислоты 4-[2-(4-трифторметилфенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-4-трифторметилбензола и собирали в виде прозрачного масла (2,0 мг). ЖХ/МС(m/z) 356,2 (МН+); RT=2,29 мин.; чистота (УФ, ELSD): 91,5%, 93,4%. 3d17. Соль трифторуксусной кислоты 4-[2-(3-хлор-2-фторфенилсульфанил)-6-фторфенил]пиперидина получали из 1-хлор-2-фтор-3-иодбензола и собирали в виде прозрачного масла (1,2 мг). ЖХ/МС(m/z) 340,1 (МН+); RT=2,17 мин.; чистота (УФ, ELSD): 90,8%, 99,7%. 3d18. Соль трифторуксусной кислоты 4-[2-(4-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-4-метилбензола и собирали в виде прозрачного масла (3,2 мг). ЖХ/МС (m/z) 302,1(МН+); RT=2,15 мин.; чистота (УФ, ELSD): 89,9%, 98,7%. 3d19. Соль трифторуксусной кислоты 4-[2-(4-хлорфенилсульфанил)-6-фторфенил]пиперидина получали из 1-хлор-4-иодбензола и собирали в виде прозрачного масла (2,6 мг). ЖХ/МС (m/z) 321,7 (МН+);RT=2,19 мин.; чистота (УФ, ELSD): 89,3%, 100%. 3d20. Соль трифторуксусной кислоты 4-[2-(3,4-диметилфенилсульфанил)-6-фторфенил]пиперидина получали из 4-иод-1,2-диметилбензола и собирали в виде прозрачного масла (2,5 мг). ЖХ/МС (m/z) 316,0(МН+); RT=2,26 мин.; чистота (УФ, ELSD): 89,1%, 99,5%. 3d21. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-метилфенилсульфанил)-6-фторфенил]пиперидина получали из 2-фтор-1-иод-4-метилбензола и собирали в виде прозрачного масла (2,9 мг). ЖХ/МС(m/z) 319,9 (МН+); RT=2,13 мин.; чистота (УФ, ELSD): 89,0%, 100%. 3d22. Соль трифторуксусной кислоты 4-[2-(2,4-дихлорфенилсульфанил)-6-фторфенил]пиперидина получали из 2,4-дихлор-1-иодбензола и собирали в виде прозрачного масла (3,1 мг). ЖХ/МС (m/z) 356,1(МН+); RT=2,31 мин.; чистота (УФ, ELSD): 87,9%, 100%. 3d23. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 2-фтор-1-иод-4-метоксибензола и собирали в виде прозрачного масла (1,1 мг). ЖХ/МС (m/z) 336,1 (МН+); RT=2,05 мин.; чистота (УФ, ELSD): 86,0%, 100%. 3d24. Соль трифторуксусной кислоты 4-[2-(2,4-дифторфенилсульфанил)-6-фторфенил]пиперидина получали из 2,4-дифтор-1-иодбензола и собирали в виде прозрачного масла (1,0 мг). ЖХ/МС (m/z) 324,1(МН+); RT=2,05 мин.; чистота (УФ, ELSD): 85,8%, 99,9%. 3d25. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 2-хлор-1-иод-4-метоксибензола (полученного из 2-хлор-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (2,8 мг). ЖХ/МС (m/z) 352,2 (МН+); RT=2,16 мин.; чистота (УФ, ELSD): 85,3%, 98,9%. 3d26. Соль трифторуксусной кислоты 4-[2-(4-метоксифенилсульфанил)-6-фторфенил]пиперидина получали из 1-иод-4-метоксибензола и собирали в виде прозрачного масла (3,7 мг). ЖХ/МС (m/z) 318,1(МН+); RT=2,02 мин.; чистота (УФ, ELSD): 81,2%, 100%. 3d27. Соль трифторуксусной кислоты 4-[2-(4-фторфенилсульфанил)-6-фторфенил]пиперидина получали из 4-фтор-1-иодбензола и собирали в виде прозрачного масла (4,7 мг). ЖХ/МС (m/z) 306,1 (МН+);RT=2,05 мин.; чистота (УФ, ELSD): 74,2%, 100%. 3e1. Соль трифторуксусной кислоты 4-[2-(2,3-дихлорфенилсульфанил)-5-фторфенил]пиперидина получали из 1,2-дихлор-3-иодбензола и собирали в виде прозрачного масла (2,8 мг). ЖХ/МС (m/z) 356,1(МН+); RT=2,33 мин.; чистота (УФ, ELSD): 96,7%, 100%. 3 е 2. Соль трифторуксусной кислоты 4-[2-(2-метоксифенилсульфанил)-5-фторфенил]пиперидина получали из 1-иод-2-метоксибензола и собирали в виде прозрачного масла (3,0 мг). ЖХ/МС (m/z) 318,1(МН+); RT=2,02 мин.; чистота (УФ, ELSD): 96%, 99,8%. 3 е 3. Соль трифторуксусной кислоты 4-[2-(4-трифторметоксифенилсульфанил)-5-фторфенил]пиперидина получали из 1-иод-4-трифторметоксибензола и собирали в виде прозрачного масла (7,0 мг).- 26010869 ЖХ/МС (m/z) 371,9 (МН+); RT=2,38 мин.; чистота (УФ, ELSD): 94,7%, 98,7%. 3 е 4. Соль трифторуксусной кислоты 4-[2-(4-фтор-2-метилфенилсульфанил)-5-фторфенил]пиперидина получали из 4-фтор-1-иод-2-метилбензола и собирали в виде прозрачного масла (4,1 мг). ЖХ/МС(m/z) 320,0 (МН+); RT=2,21 мин.; чистота (УФ, ELSD): 94,1%, 99,8%. 3 е 5. Соль трифторуксусной кислоты 4-[2-(4-трифторметилфенилсульфанил)-5-фторфенил]пиперидина получали из 1-иод-4-трифторметилбензола и собирали в виде прозрачного масла (3,9 мг). ЖХ/МС(m/z) 356,1 (МН+); RT=2,33 мин.; чистота (УФ, ELSD): 92,6%, 100%. 3 е 6. Соль трифторуксусной кислоты 4-[2-(3-метилфенилсульфанил)-5-фторфенил]пиперидина получали из 1-иод-3-метилбензола и собирали в виде прозрачного масла (4,5 мг). ЖХ/МС (m/z) 302,1(МН+); RT=2,19 мин.; чистота (УФ, ELSD): 86,0%, 87,8%. 3 е 7. Соль трифторуксусной кислоты 4-[2-(4-хлор-2-метилфенилсульфанил)-5-фторфенил]пиперидина получали из 4-хлор-1-иод-2-метилбензола и собирали в виде прозрачного масла (6,1 мг). ЖХ/МС (m/z) 336,1 (МН+); RT=2,38 мин.; чистота (УФ, ELSD): 85,5%, 70,5%. 3 е 8. Соль трифторуксусной кислоты 4-[2-(2,3-диметилфенилсульфанил)-5-фторфенил]пиперидина получали из 1-иод-2,3-диметилбензола и собирали в виде прозрачного масла (6,1 мг). ЖХ/МС (m/z) 316,0(МН+); RT=2,28 мин.; чистота (УФ, ELSD): 75,3%, 74,4%. 3 е 9. Соль трифторуксусной кислоты 4-[2-(2,3-дигидробензо[1,4]диоксин-6-илсульфанил)-5-фторфенил]пиперидина получали из 6-иод-2,3-дигидробензо[1,4]диоксина и собирали в виде прозрачного масла(4,8 мг). ЖХ/МС (m/z) 346,0 (МН+); RT=2,04 мин.; чистота (УФ, ELSD): 74,7%, 86,3%. 3 е 10. Соль трифторуксусной кислоты 4-[2-(4-фтор-3-метоксифенилсульфанил)-5-фторфенил]пиперидина получали из 2-фтор-4-иод-1-метоксибензола (полученного из 3-фтор-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (3,7 мг). ЖХ/МС (m/z) 336,0 (МН+); RT=2,11 мин.; чистота (УФ, ELSD): 73,4%, 88,6%. 3f1. Соль трифторуксусной кислоты 4-[2-(2-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 1-иод-2-метилбензола и собирали в виде прозрачного масла (4,1 мг). ЖХ/МС (m/z) 302,1(МН+); RT=2,20 мин.; чистота (УФ, ELSD): 98,3%, 100%. 3f2. Соль трифторуксусной кислоты 4-[2-(2-хлорфенилсульфанил)-4-фторфенил]пиперидина получали из 1-хлор-2-иодбензола и собирали в виде прозрачного масла (4,1 мг). ЖХ/МС (m/z) 321,8 (МН+);RT=2,19 мин.; чистота (УФ, ELSD): 96,6%, 100%. 3f3. Соль трифторуксусной кислоты 4-[2-(4-фторфенилсульфанил)-4-фторфенил]пиперидина получали из 1-фтор-4-иодбензола и собирали в виде прозрачного масла (2,7 мг). ЖХ/МС (m/z) 305,8 (МН+);RT=2,14 мин.; чистота (УФ, ELSD): 87,6%, 99,8%. 3f4. Соль трифторуксусной кислоты 4-[2-(3,4-диметилфенилсульфанил)-4-фторфенил]пиперидина получали из 1-иод-3,4-диметилбензола и собирали в виде прозрачного масла (4,9 мг). ЖХ/МС (m/z) 315,9(МН+); RT=2,35 мин.; чистота (УФ, ELSD): 91,7%, 100%. 3f5. Соль трифторуксусной кислоты 4-[2-(2-хлор-4 метилфенилсульфанил)-4-фторфенил]пиперидина получали из 2-хлор-1-иод-4-метилбензола и собирали в виде прозрачного масла (4,9 мг). ЖХ/МС (m/z) 336,1 (МН+); RT=2,33 мин.; чистота (УФ, ELSD): 93,0%, 99,3%. 3f6. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 2-фтор-1-иод-4-метилбензола и собирали в виде прозрачного масла (4,4 мг). ЖХ/МС(m/z) 319,9 (МН+); RT=2,23 мин.; чистота (УФ, ELSD): 87,8%, 98,5%. 3f7. Соль трифторуксусной кислоты 4-[2-(5-хлор-2-фторфенилсульфанил)-4-фторфенил]пиперидина получали из 4-хлор-1-фтор-2-иодбензола и собирали в виде прозрачного масла (5,3 мг). ЖХ/МС (m/z) 340,1 (МН+); RT=2,24 мин.; чистота (УФ, ELSD): 93,1%, 99,7%. 3f8. Соль трифторуксусной кислоты 4-[2-(2-хлор-4-фторфенилсульфанил)-4-фторфенил]пиперидина получали из 2-хлор-4-фтор-1-иодбензола и собирали в виде прозрачного масла (5,1 мг). ЖХ/МС (m/z) 340,0 (МН+); RT=2,23 мин.; чистота (УФ, ELSD): 95,6%, 99,9%. 3f9. Соль трифторуксусной кислоты 4-[2-(2,3-диметилфенилсульфанил)-4-фторфенил]пиперидина получали из 1-иод-2,3-диметилбензола и собирали в виде прозрачного масла (5,6 мг). ЖХ/МС (m/z) 316,0(МН+); RT=2,34 мин.; чистота (УФ, ELSD): 97,4%, 99,8%. 3f10. Соль трифторуксусной кислоты 4-[2-(3-фтор-2-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 1-фтор-2-метил-3-иодбензола и собирали в виде прозрачного масла (4,0 мг). ЖХ/МС(m/z) 319,9 (МН+); RT=2,26 мин.; чистота (УФ, ELSD): 85,5%, 99,9%. 3f11. Соль трифторуксусной кислоты 4-[2-(4-метокси-2-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 4-иод-2-метил-1-метоксибензола (полученного из 2-метил-4-метоксифениламина диазотированием в соответствии с общей методикой Tunney and Stille J. Org. Chem. 1987, 52, 748-753) и собирали в виде прозрачного масла (4,5 мг). ЖХ/МС (m/z) 332,0 (МН+); RT=2,19 мин.; чистота (УФ,ELSD): 96,1%, 99,8%. 3f12. Соль трифторуксусной кислоты 4-[2-(3-фтор-4-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 2-фтор-4-иод-1-метилбензола и собирали в виде прозрачного масла (4,3 мг). ЖХ/МС- 27010869 3f13. Соль трифторуксусной кислоты 4-[2-(4-фтор-2-метилфенилсульфанил)-4-фторфенил]пиперидина получали из 4-фтор-1-иод-2-метилбензола и собирали в виде прозрачного масла (4,7 мг). ЖХ/МС 4 а. Соль хлористо-водородной кислоты 4-[2-(4-гидроксиметилфенилсульфанил)фенил]пиперидина. К перемешиваемому раствору 1-трет-бутоксикарбонил-4-[2-(4-метоксикарбонилфенилсульфанил) фенил]пиперидин-4-ола (1,25 г, 4 ммоль) в уксусной кислоте (12 мл) добавляли водный раствор концентрированной хлористо-водородной кислоты (38 мл). Раствор кипятили с обратным холодильником в течение 6 ч, охлаждали до комнатной температуры и затем гасили добавлением смеси воды со льдом (100 мл). Раствор экстрагировали этилацетатом (3100 мл). Объединенные органические фазы сушили над сульфатом магния и выпаривали растворители. Полученное неочищенное вещество растворяли в метаноле(25 мл) и добавляли хлористый водород в диэтиловом эфире (2 М, 25 мл). Смесь кипятили с обратным холодильником в течение 12 ч и выпаривали растворители. Остаток распределяли между водным раствором гидроксида натрия (2 М, 100 мл) и этилацетатом (2100 мл). Этилацетатную фазу сушили над сульфатом магния и выпаривали растворители. Полученное вещество (4-[2-(4-метоксикарбонилфенилсульфанил)фенил]пиперидин, 0,98 г, 3 ммоль) растворяли в метиленхлориде (25 мл) и добавляли Вос 2 О (0,66 г,3 ммоль). Реакционную смесь перемешивали в течение 2 ч и добавляли катализатор Crabtree (0,13 г,0,16 ммоль). Реакционную смесь обрабатывали газообразным водородом (1,5 бар) в течение ночи в аппарате Парра. Неочищенную смесь фильтровали через слой силикагеля и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (элюент: этилацетат/гептан 1:2) с получением твердого вещества (0,495 г). 0,285 г полученного вещества кипятили с обратным холодильником в течение 1 ч в смеси хлористого водорода в диэтиловом эфире (2 М, 25 мл) и метанола (25 мл). Выпаривали растворитель и добавляли водный раствор гидроксида натрия (2 М, 50 мл) и этилацетат (250 мл). Объединенные органические фазы сушили над сульфатом магния и выпаривали растворитель. Полученное вещество (0,15 г) растворяли в ТГФ (25 мл) и добавляли алюмогидрид лития (50 мг, 1,32 ммоль). Реакционную смесь перемешивали в течение ночи перед гашением ее водой (0,1 мл) и насыщенным водным раствором гидроксида натрия (0,2 мл). После перемешивания в течение 30 мин добавляли воду (1 мл) и отфильтровывали осадок. Органическую фазу сушили над сульфатом магния и выпаривали растворитель. Неочищенный продукт очищали хроматографией на силикагеле (элюент: этилацетат/триэтиламин/ метанол 8:1:2) с получением свободного основания, которое осаждалось в виде хлористо-водородной соли из хлористого водорода в диэтиловом эфире (2 М, 5 мл). Выход: 12,6 мг. ЖХ/МС (m/z) 300,0 (МН+); 5 а. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-метиламинфенилсульфанил)-5-фторфенил]пиперидина. 1-трет-Бутоксикарбонил-4-[2-(2-фтор-4-бромфенилсульфанил)-5-фторфенил]пиперидин (2 защищенный Вос-группой, 0,1 г, 0,21 ммоль) и трет-бутиловый эфир метилкарбаминовой кислоты (0,033 г,0,25 ммоль; полученный из метиламина и Boc2O в соответствии с методикой Lee at al. J. Am. Chem. Soc.,2003, 125, 7307-7312), растворенный в толуоле (2 мл), добавляли к перемешиваемому раствору бис(дибензилиденацетон)палладия(0) (Pddba2, 0,006 г, 0,011 ммоль) и рацемическому 2,2'-бис-дифенилфосфанил[1,1']бинафталенилу (BINAP, 0,009 г, 0,016 ммоль) в толуоле (1 мл). Добавляли трет-бутоксид натрия (0,028 г, 0,28 ммоль) и реакционную смесь перемешивали в течение ночи при 100 С. Реакцион- 28010869 ную смесь охлаждали до к.т. и фильтровали через слой целлита с использованием толуола (45 мл) для элюирования продукта. Выпаривали растворитель, остаток растворяли в метиленхлориде (3 мл), добавляли хлористый водород в диэтиловом эфире (4 М, 0,25 мл) и реакционную смесь перемешивали в течение ночи. Выпаривали растворитель и неочищенный продукт очищали ВЭЖХ с получением 4-[2-(4 метиламинфенилсульфанил)-5-фторфенил]пиперидина 5 а в виде соли трифторуксусной кислоты. Выход: 9,8 мг. ЖХ/МС (m/z) 335,2 (МН+); RT=1,98 мин.; чистота (УФ, ELSD): 75,9%, 96,7%. Способ F. 6 а. Соль трифторуксусной кислоты 4-[2-(2-фтор-4-винилфенилсульфанил)-5-фторфенил]пиперидина. К перемешиваемому раствору 1-трет-бутоксикарбонил 4-[2-(2-фтор-4-бромфенилсульфанил)-5 фторфенил]пиперидина (2 защищенный трет-бутилоксокарбонилом) (0,12 г, 0,25 ммоль) и Pd2dba3(0,007 г, 0,015 ммоль) в 1,4-диоксане (1 мл) добавляли фторид цезия (0,084 г, 0,055 ммоль), винил-три-нбутилолово (0,083 г, 0,26 ммоль) и трис-трет-бутилфосфин (0,091 мл, 10% в гексане, примерно 0,03 ммоль). Реакционную смесь перемешивали в течение ночи при 50 С. Реакционную смесь охлаждали до к.т., разбавляли ацетонитрилом (20 мл) и фильтровали. Фильтрат экстрагировали гептаном (220 мл) и ацетонитрильную фазу концентрировали в вакууме. Остаток растворяли в метиленхлориде (5 мл), добавляли хлористый водород в диэтиловом эфире (4 М, 0,25 мл) и реакционную смесь перемешивали в течение ночи. Выпаривали растворитель и неочищенный продукт (0,077 г) очищали ВЭЖХ с получением 4-[2-(2 фтор-4-винилфенилсульфанил)-5-фторфенил]пиперидина 6 а в виде соли трифторуксусной кислоты. ЖХ/МС (m/z) 332,0 (МН+); RT=2,30 мин.; чистота (УФ, ELSD): 80,9%, 89,3%. Измерения поглощения [3 Н]-5-НТ в кортикальные синаптосомы крыс Цельный головной мозг крыс-самцов Wistar (125-225 г), исключая мозжечок, гомогенизируют в 0,32 М сахарозе, дополняемой 1 мМ ниаламидом, в стеклянно-тефлоновом гомогенизаторе. Гомогенат центрифугируют при 600g в течение 10 мин при 4 С. Осадок после центрифугирования отбрасывают и супернатант центрифугируют при 20000g в течение 55 мин. Конечный осадок гомогенизируют (20 с) в указанном буфере для анализа (0,5 мг исходная ткань/лунка). Тестируемые соединения (или буфер) и 10 нМ[3 Н]-5-НТ добавляют в 96-луночные планшеты и быстро встряхивают. Состав буфера для анализа: 123 мМEDTA, 10 мМ глюкозы и 1 мМ аскорбиновой кислоты. Буфер насыщают кислородом с использованием смеси 95% О 2/5% СО 2 в течение 10 мин при 37 С и рН доводят до 7,4. Инкубацию начинают добавлением ткани в конечный объем буфера для анализа, равный 0,2 мл. Через 15 мин инкубации с радиолигандом при 37 С образцы непосредственно фильтруют на стекловолоконных фильтрах Unifilter GF/C (пропитанных в течение 1 ч в 0,1% полиэтиленимине) в вакууме и затем сразу промывают 30,2 мл буфера для анализа. Неспецифическое поглощение определяют с использованием циталопрама (конечная концентрация 10 мкм). Циталопрам включен в качестве эталона во все эксперименты в виде кривой зависимости доза-ответ. Предпочтительные соединения настоящего изобретения ингибируют повторное поглощение серотонина в вышеуказанном анализе при концентрации ниже 200 нМ (IC50). Более предпочтительны соединения, которые показывают ингибирование при концентрации ниже 100 нМ и наиболее предпочтительно при концентрации ниже 50 нМ. Связывание [3 Н]-мезулергина с 5-НТ 2 С-рецепторами Клеточные линии, экспрессирующие 10-20 пикомоль/мг белка человеческих 5-HT2C-VSV-рецепторов(Euroscreen), собирали в 50 мМ Трис буфера, охлажденного льдом, содержащего 125 мМ NaCl, pH 7,7, и хранили при -80 С. В день эксперимента клетки быстро оттаивали и гомогенизировали в 50 мМ Трис буфера, рН 7,7, с использованием Ultra-Thurax. Состоящие из 6-30 мкг белка аликвоты, [3 Н]-мезулергин(1 нМ) и тестируемое соединение инкубировали в течение 30 мин при 37 С. Общее связывание определяли с использованием буфера для анализа (50 мМ Трис, рН 7,7) и неспецифическое связывание определяли в присутствии 100 мкМ 5-НТ. Связанный и свободный [3 Н]-мезулергин разделяли вакуумным фильтрованием на фильтрах GF/B (предварительно пропитанных в 0,1% PEI в течение 1/2 ч) и количественно определяли в сцинтилляционном счетчике. Исследование аффинности к 5-НТ 2 с-рецептору, определяемой флуоромеарией Данный анализ осуществляли в соответствии с методикой Porter et al. British Journal of Pharmacology- 29010869 1999, 128, 13, с представленными ниже модификациями. За 2 дня до эксперимента СНО клетки, экспрессирующие 10-20 пикомоль/мг белка человеческих 5-HT2C-VSV-рецепторов (Euroscreen), высевали на чашки с плотностью, достаточной для получения слитого монослоя в день эксперимента. Клетки покрывали красителем при 37 С (Са 2+-комплект от фирмы Molecular Devices и в соответствии с их инструкцией) в инкубаторе в атмосфере, содержащей 5% СО 2 при влажности 95%. Уровень лазерной интенсивности устанавливали до значения, подходящего для получения базисных значений примерно 8000 RFU. Изменение базисных значений флуоресценции составляло менее 10%. Величины ЕС 50 оценивали с применением повышающихся концентраций испытуемых соединений в пределах 3 порядков. Величины IC50 оценивали посредством достижения значений EC85 для 5-НТ при концентрациях испытуемых соединений в пределах 3 порядков. Величины Ki вычисляли, используя уравнение Cheng-Prusoff. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное общей формулой IR1, R2, R3, R4, R5 независимо выбраны из водорода, галогена, С 1-6 алк(ен/ин)ила, C1-6 алкилокси, гидрокси-С 1-6 алкила, галоген-C1-6 алкила, галоген-С 1-6 алкилокси или NRxRy, где Rx и Ry независимо выбраны из водорода, С 1-6 алкила;R6, R7, R8, R9 независимо выбраны из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила; при условии, что по меньшей мере один из R1, R2, R3, R4, R5, R6, R7, R8 и R9 отличается от водорода; а также при условии, что когда R3 представляет собой метил, тогда по меньшей мере один из R1, R2,4 5R , R , R6, R7, R8 и R9 отличается от водорода; или его соль. 2. Соединение по п.1, где R1 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-С 1-6 алкила или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила. 3. Соединение по п.2, где R1 выбран из водорода, C1-6 алкила или галогена. 4. Соединение по любому из пп.1-3, где R2 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-C1-6 алкила. 5. Соединение по п.4, где R2 выбран из водорода или C1-6 алкилокси. 6. Соединение по любому из пп.1-5, где R3 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C16 алкилокси, галоген-C1-6 алкила. 7. Соединение по п.6, где R3 выбран из водорода, галогена, C1-6 алкила, C1-6 алкилокси или галогенС 1-6 алкила. 8. Соединение по п.6, где R3 выбран из водорода, C1-6 алкила, C1-6 алкилокси или галогена. 9. Соединение по любому из пп.1-8, где R4 выбран из водорода, галогена, С 1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-C1-6 алкила. 10. Соединение по п.9, где R4 выбран из водорода или C1-6 алкилокси. 11. Соединение по любому из пп.1-10, где R5 выбран из водорода, галогена, C1-6 алк(ен/ин)ила, C1-6 алкилокси, галоген-C1-6 алкила или NRxRy, где Rx и Ry независимо выбраны из водорода, C1-6 алкила. 12. Соединение по п.11, где R5 выбран из водорода, C1-6 алкила или галогена. 13. Соединение по любому из пп.1-12, где R6 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. 14. Соединение по п.13, где R6 выбран из водорода или галогена. 15. Соединение по любому из пп.1-14, где R7 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. 16. Соединение по п.15, где R7 выбран из водорода или галогена. 17. Соединение по любому из пп.1-16, где R8 выбран из водорода, галогена, C1-6 алкила, галоген-С 1-6 алкила. 18. Соединение по любому из пп.1-17, где R9 выбран из водорода, галогена, C1-6 алкила или галогенС 1-6 алкила. 19. Соединение по п.18, где R9 представляет водород.
МПК / Метки
МПК: A61P 25/00, C07D 407/12, C07D 211/24, A61K 31/451
Метки: производные, ингибиторов, качестве, повторного, 4-(2-фенилсульфанилфенил)пиперидина, серотонина, поглощения
Код ссылки
<a href="https://eas.patents.su/30-10869-proizvodnye-4-2-fenilsulfanilfenilpiperidina-v-kachestve-ingibitorov-povtornogo-pogloshheniya-serotonina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-(2-фенилсульфанилфенил)пиперидина в качестве ингибиторов повторного поглощения серотонина</a>
Предыдущий патент: Применение производных бицикло [2.2.1] гептана для приготовления нейропротекторных фармацевтических композиций
Следующий патент: Арилвинилазациклоалкановые соединения и способы их получения и применения
Случайный патент: Пиррольные соединения












