Активирующее ppar соединение и содержащая его фармацевтическая композиция
Номер патента: 9374
Опубликовано: 28.12.2007
Авторы: Ямазаки Юкийоси, Нисикава Масахиро, Араки Такааки, Абе Казутойо, Тома Цитому, Озава Хидефуми, Ода Соити, Окуда Аюму
Формула / Реферат
1. Соединение, общей формулы (1)
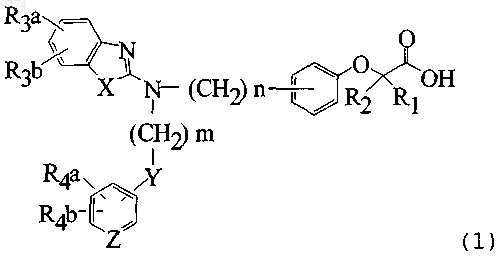
(где каждый из R1 и R2, которые могут быть одинаковыми или отличаются друг от друга, представляет собой атом водорода, метильную группу или этильную группу; каждый из R3a, R3b, R4a и R4b, которые могут быть одинаковыми или отличаются друг от друга, представляет собой атом водорода, атом галогена, нитрогруппу, гидроксильную группу, C1-4алкильную группу, трифторметильную группу, C1-4алкоксильную группу, C1-4алкилкарбонилоксигруппу, ди-С1-4алкиламиногруппу, C1-4алкилсульфонилоксигруппу, C1-4алкилсульфонильную группу, C1-4алкилсульфинильную группу или C1-4алкилтиогруппу, или R3a и R3b, или R4a и R4b могут быть связаны вместе с образованием алкилендиоксигруппы; X представляет собой атом кислорода, атом серы или N-R5 (R5 представляет собой атом водорода, C1-4алкильную группу, C1-4алкилсульфонильную группу или C1-4алкилоксикарбонильную группу); Y представляет собой атом кислорода, S(O)l (l представляет собой число от 0 до 2), карбонильную группу, карбониламиногруппу, аминокарбонильную группу, сульфониламиногруппу, аминосульфонильную группу или NH; Z представляет собой CH или N; n представляет собой число от 1 до 6 и m представляет собой число от 2 до 6) или его соль.
2. Соединение по п.1, где X представляет собой атом кислорода, Y представляет собой атом кислорода и Z представляет собой CH.
3. Соединение, выбранное из
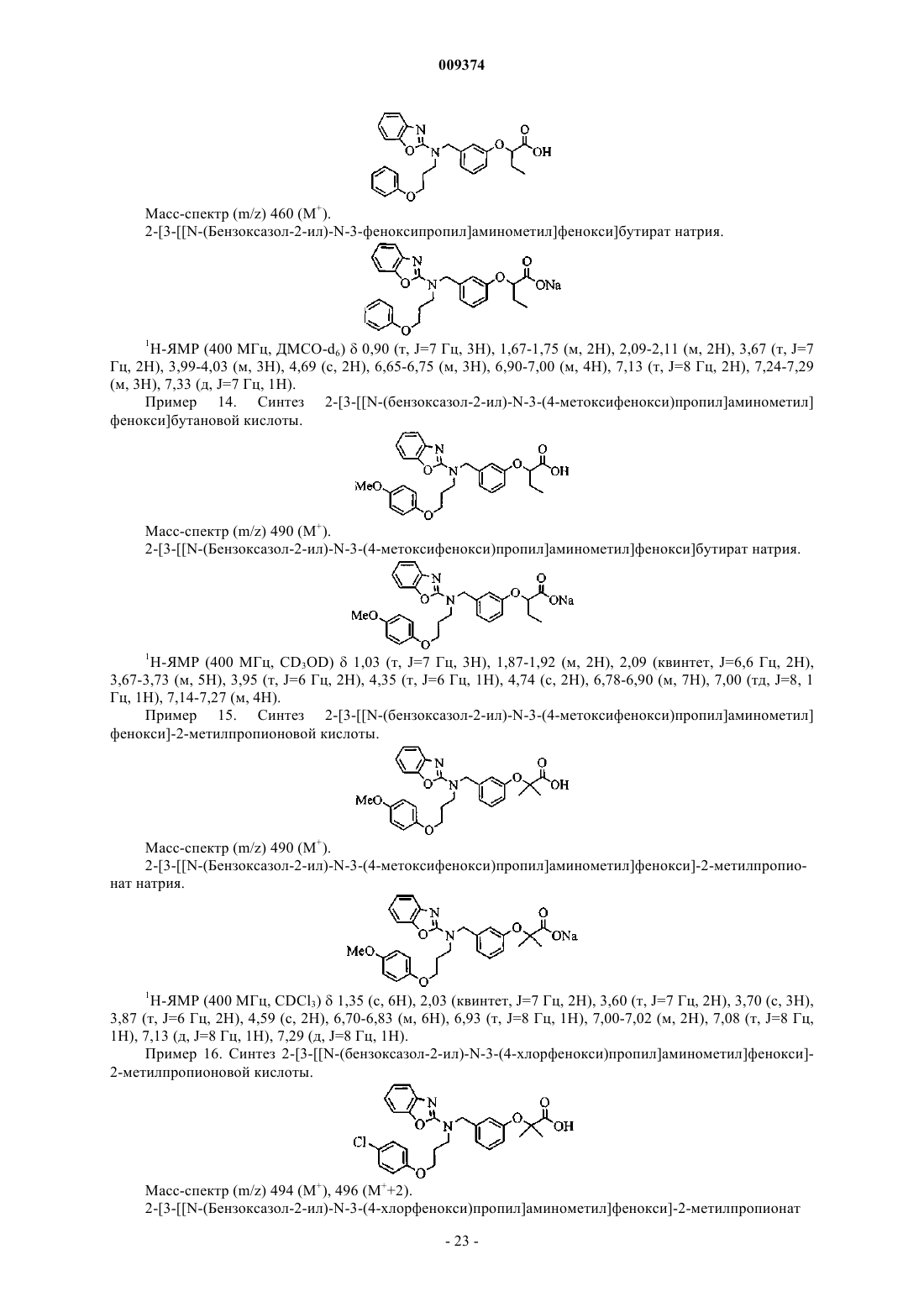
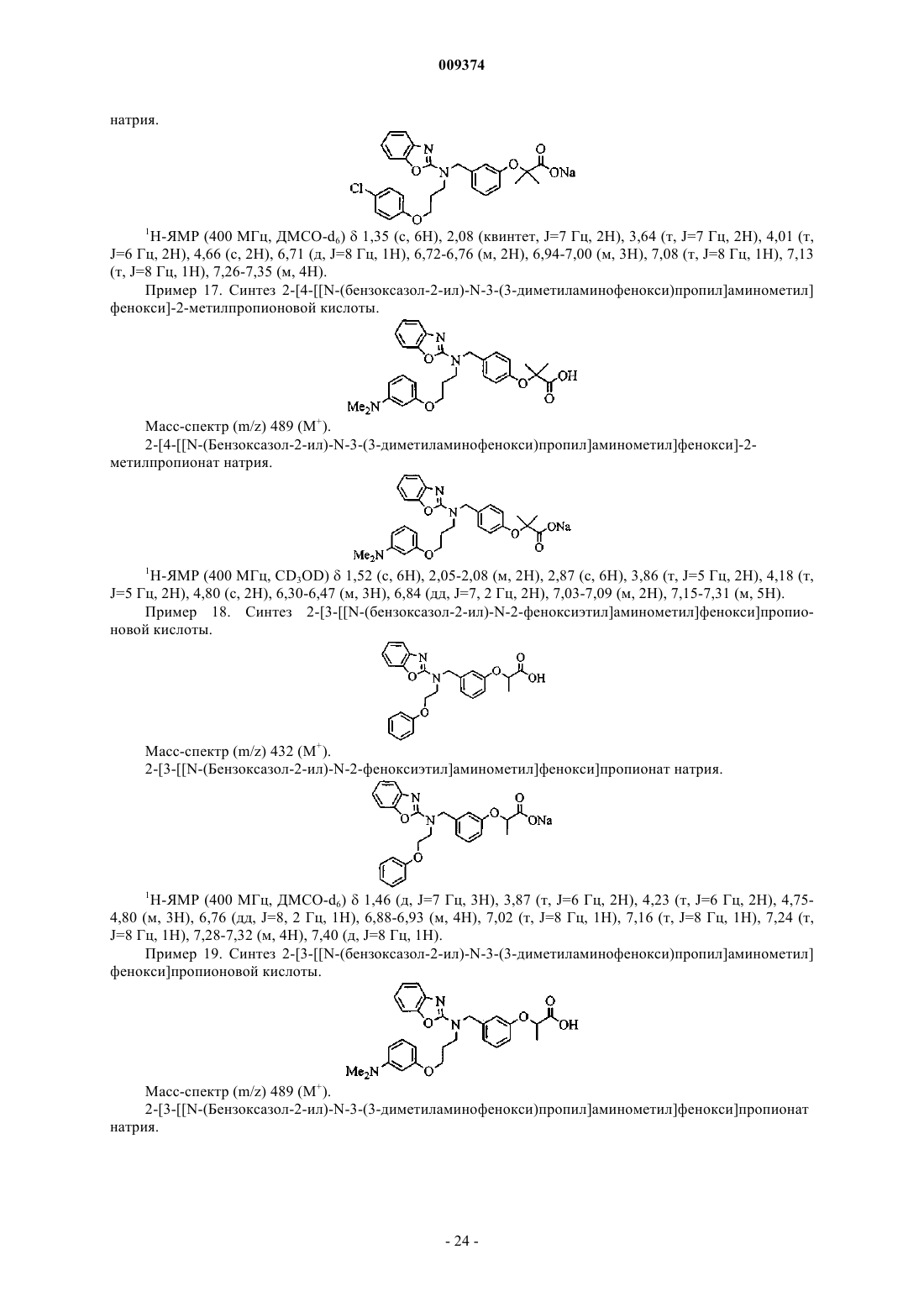
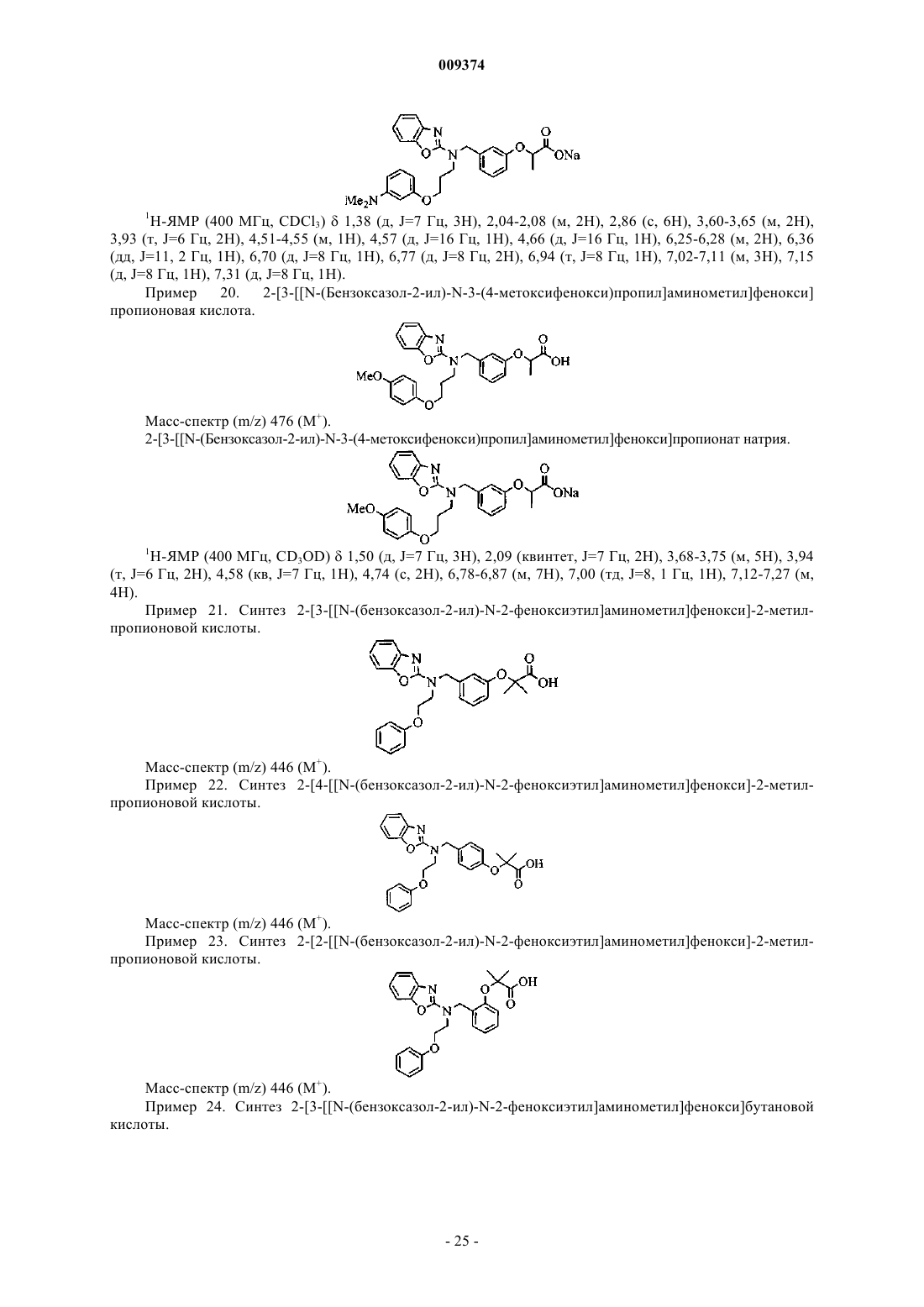
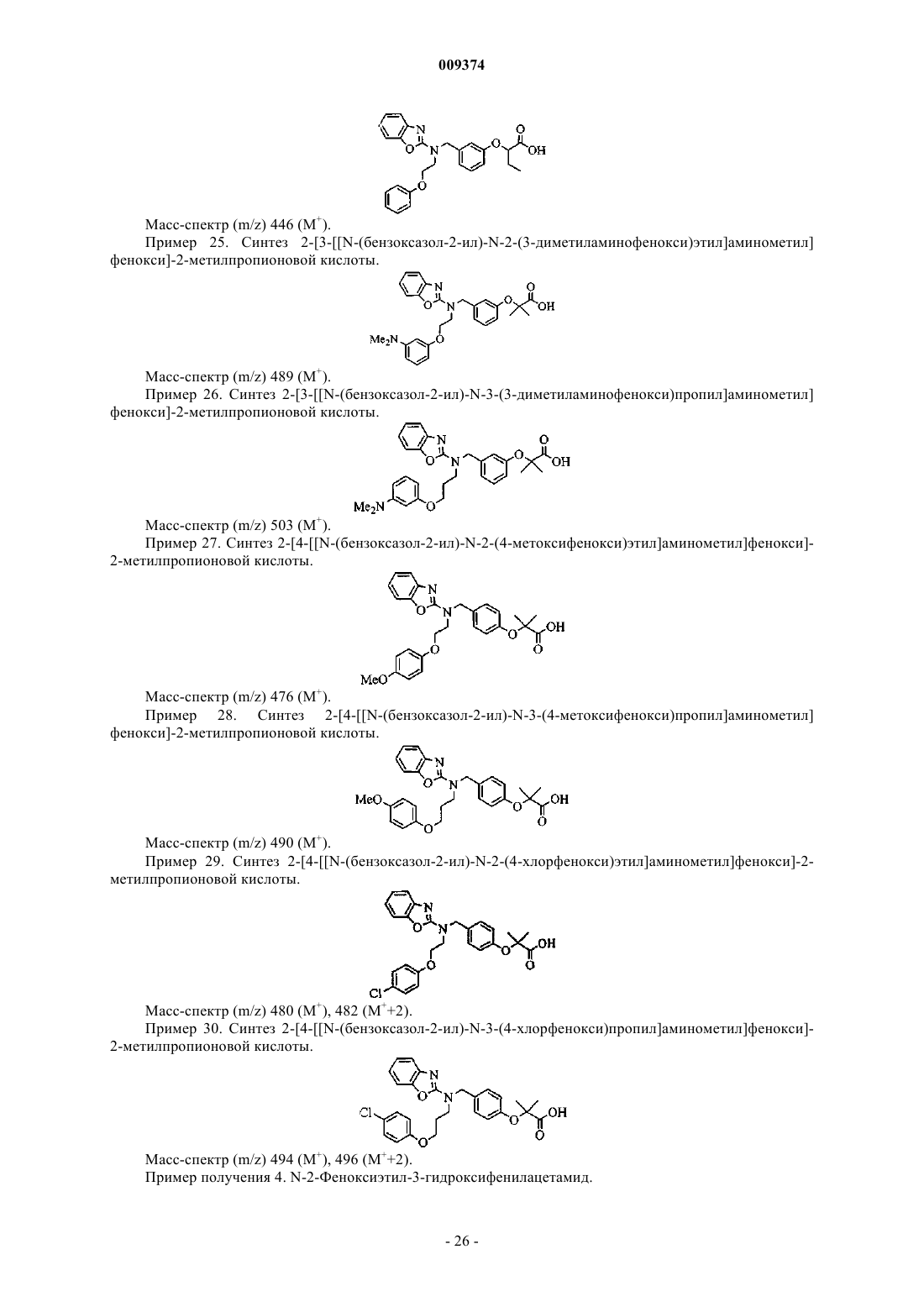
2-[3-[[N-(бензоксазол-2-ил)-N-3-(4-фторфенокси)пропил]аминометил]фенокси]бутановой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-2-(4-хлорфенокси)этил]аминометил]фенокси]бутановой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-2-(4-фторфенокси)этил]аминометил]фенокси]бутановой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]фенокси]пропионовой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]фенокси]уксусной кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]фенокси]бутановой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-3-(4-метоксифенокси)пропил]аминометил]фенокси]бутановой кислоты,
2-[3-[[N-(бензоксазол-2-ил)-N-3-(4-метоксифенокси)пропил]аминометил]фенокси]пропионовой кислоты.
4. Лекарственное средство, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
5. Терапевтическое лекарственное средство для лечения гиперлипидемии, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
6. Терапевтическое лекарственное средство для лечения артериосклероза, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
7. Терапевтическое лекарственное средство для лечения диабета, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
8. Терапевтическое лекарственное средство для лечения осложнений диабета, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
9. Терапевтическое лекарственное средство для лечения воспалений, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
10. Терапевтическое лекарственное средство для лечения сердечных заболеваний, включающее в качестве активного ингредиента соединение или его соль по любому из пп.1-3.
11. Фармацевтическая композиция, включающая соединение или его соль по любому из пп.1-3 и фармацевтически приемлемый носитель.
12. Применение соединения или его соли по любому из пп.1-3 для получения лекарственного средства.
13. Способ лечения патологического состояния, выбранного из гиперлипидемии, артериосклероза, диабета, осложнений при диабете, воспаления и сердечных заболеваний, включающий введение нуждающемуся в этом субъекту эффективного количества соединения или его соли по любому из пп.1-3.
Текст
009374 Настоящее изобретение относится к соединению, активирующему PPAR, которое селективно активирует в ряду рецепторов, активирующих пролифератор пероксисом (PPAR), рецепторы PPAR -типа(т.е. PPAR) и может использоваться в качестве лекарственного средства для профилактики и/или лечения патологического состояния, включая гиперлипидемию, артериосклероз, диабет, осложнения диабета,воспаления и сердечные заболевания. Изобретение также относится к фармацевтической композиции,содержащей данное соединение. Известно, что PPAR образуют семейство ядерных рецепторов и уже были идентифицированы три их подтипа ( , ) (Nature, 347, 645-650, 1990; Cell, 68, pp. 879-887, 1992; Cell, 97, pp. 161-163, 1999; Biochim. Biophys. Acta., 1302, pp. 93-109, 1996; и Journal of Medicinal Chemistry, 43, pp. 527-550, 2000). Среди данных трех подтипов PPAR экспрессируется главным образом в печени, и известно, что он активируется пластификаторами и/или фибратами, такими как Wy 14643, клофибрат, фенофибрат, безафибрат или гемфиброзил (Journal of the National Cancer Institute, 90, 1702-1709, 1998; Current Opinion inLipidology, 10, pp. 245-257, 1999). Известно, что активация PPAR у млекопитающих промотирует -окисление жирных кислот и понижает уровень триглицеридов в крови. У людей активация PPAR понижает уровень липидов в крови,таких как холестерин липопротеина низкой плотности (LDL) и холестерин липопротеина очень низкой плотности (VLDL). Таким образом, PPAR-активатор можно использовать в качестве лекарственного средства для профилактики и/или лечения заболевания, такого как гиперлипидемия. Дополнительно предполагается, что PPAR-активатор можно использовать в качестве лекарственного средства для профилактики и/или лечения патологических состояний, таких как артериосклероз, благодаря увеличению холестерина липопротеина высокой плотности (HDL) и подавления VCAM-1 (одна из клеточных адгезионных молекул). Кроме того, предполагается, что PPAR-активатор можно использовать в качестве лекарственного средства для профилактики и/или лечения патологических состояний, таких как диабет,воспалительное заболевание и сердечные заболевания (Journal of Atherosclerosis and Thrombosis, 3, pp. 81-89, 1996; Current Pharmaceutical Design, 3, pp. 1-14, 1997; Current Opinion in Lipidology, 10, pp. 151-159,1999; Current Opinion in Lipidology, 10, pp. 245-257, 1999; The Lancet, 354, pp. 141-148, 1999; Journal ofMedicinal Chemistry, 43, pp. 527-550, 2000; и Journal of Cardiovascular Risk, 8, pp. 195-201, 2001). Известно, что PPAR, который экспрессируется главным образом в адипоцитах, играет важную роль в дифференциации и пролиферации адипоцитов. Примеры известных активаторов для PPAR включают лекарственные средства, являющиеся производными тиазолидина, такие как троглитазон, пиоглитазон и розиглитазон. Известно, что данные лекарственные средства трансформируют полностью дифференцированные адипоциты, обладающие пониженной чувствительностью к инсулину, в небольшие адипоциты, обладающие высокой чувствительностью к инсулину, улучшая таким образом резистентность к инсулину (Journal of Biological Chemistry, 270, 12953-12956, 1995; Endocrinology, 137, pp. 41894195, 1996; Trends Endocrinol. Metab., 10, pp. 9-13, 1999; и J. Clin. Invest., 101, pp. 1354-1361, 1998). Однако сообщалось, что активация PPAR оказывает неблагоприятное действие на человека, повышая наличие жира и вес тела и вызывая ожирение. (The Lancet, 349, pp. 952, 1997). Недавно также сообщалось, что антагонизация PPAR, возможно, улучшает резистентность к инсулину (Proc. Natl. Acad. Sci., 96, pp. 6102-6106, 1999; The Journal of Biological Chemistry, 275, pp. 1873-1877, 2000; и J. Clin. Invest., 108, 10011013, 2001). Известно, что PPAR, присутствующий повсеместно в организме, играет роль в метаболизме жиров. Однако сообщалось только о высокоселективных активаторах PPAR и биологическая значимостьPPAR остается неясной. В настоящее время в многочисленных публикациях сообщалось о структурах активаторов PPAR (Diabetes, 46, 1319-1327, 1997; и Journal of Medicinal Chemistry, 43, pp. 527-550,2000). В недавнем сообщении описано, что активатор PPAR GW 501516 повышает уровень HDL у обезьян (Proc. Natl. Acad. Sci., 98, pp. 5306-5311, 2001). Более того, сообщалось, что адипоциты или клетки скелетных мышц, которые экспрессируют активированный PPAR, промотируют сжигание жира(Cell, 113, pp. 159-170, 2003). Однако соединение F, активатор PPAR, описанное в WO 97/28149, оказывает неблагоприятное действие, аккумулируя липиды в макрофагах человека (Journal of Biological Chemistry, 276, pp. 44258-44265, 2001). Помимо этого, эксперименты с использованием PPAR-дефицитных мышей показывают, что активация PPAR индуцирует накопление жира (Proc. Natl. Acad. Sci., 99, pp. 303-308, 2002). Данное явление представляет собой два конфликтующих действия в плане развития и облегчения артериосклероза. Таким образом, значимость PPAR на лечение артериосклероза все еще остается невыясненной. Как описано выше, предполагается, что PPAR-селективный активатор, обладающий низкой селективностью в отношении PPAR и PPAR, можно будет использовать для профилактики и/или лечения патологических состояний, таких как гиперлипидемия, артериосклероз, диабет, осложнения диабета,воспаление и сердечные заболевания, не вызывая ожирения и увеличения массы тела. В WO 02/46176 описан активатор PPAR, имеющий структуру, представленную следующей формулой:(где каждый из R1 и R2 представляет собой атом водорода, атом галогена, нитрогруппу, С 1-С 8 алкильную группу, С 1-С 8 алкоксильную группу или С 6-С 10 арильную группу, или R1 и R2, вместе с атомами углерода,с которыми они связаны, могут образовывать бензольное кольцо; X представляет собой атом кислорода,атом серы, -NR0- (R0 представляет собой атом водорода или С 1-С 8 алкильную группу), или -СН=СН-; G представляет собой простую связь или карбонильную группу; R3 представляет собой С 1-С 8 алкильную группу, С 2-С 8 алкенильную группу, С 2-С 8 алкинильную группу, С 3-С 7 циклоалкильную группу, С 1-С 8 алкильную группу, замещенную С 3-С 7 циклоалкильной группой, С 6-С 10 арильную группу, арилалкильную группу (образованную С 6-С 10 арильным фрагментом и алкильным фрагментом, имеющим 1-8 атомов углерода), гетероциклическую группу или гетероциклоалкильную группу (содержащую алкильный фрагмент, имеющий 1-8 атомов углерода); n представляет собой целое число от 0 до 5; Y представляет собой-СН 2-, карбонильную группу или -СН=СН-; Z представляет собой атом кислорода или атом серы; р представляет собой целое число от 0 до 5; каждый из R4 и R5 представляет собой атом водорода или С 1-С 8 алкильную группу; и W представляет собой карбоксильную группу, С 2-С 8 алкоксикарбонильную группу,группу сульфоновой кислоты, группу фосфоновой кислоты, цианогруппу или тетразолильную группу). В WO 04/00762 описан активатор PPAR, имеющий структуру, представленную следующей формулой:(где каждый из R1 и R2 представляет собой атом водорода или С 1-С 3 алкильную группу; X представляет собой простую связь, СН 2 или атом кислорода; каждый из R3 и R4 представляет собой атом водорода, С 1 С 6 алкильную группу, -ОСН 3-, -CF3, аллильную группу или атом галогена; X1 представляет собой СН 2,SO2 или С=O; R5 представляет собой С 1-С 6 алкильную группу (которая может быть замещена С 1 С 6 алкоксильной группой или С 1-С 6 алкилтиогруппой), С 2-С 6 алкенильную группу, С 0-С 6 алкилфенильную группу (фенильная группа может содержать один или несколько заместителей, выбранных из CF3, атомов галогена, С 1-С 3 алкильных групп и C1-С 3 алкоксильных групп), -СО-(С 1-С 6 алкил)группу или -SO2-(C1C6 алкил)группу; и R6 представляет собой фенильную группу или 6-членную гетероарильную группу,содержащую от одного до трех атомов азота (фенильная группа и гетероарильная группа могут быть замещены одной-тремя функциональными группами, выбранными из С 1-С 6 алкильных групп, атомов галогена, -О-(С 1-С 6 алкил)групп, -SO2-(C1-C3 алкил)групп и фенильной группы (которая может быть замещена одной или несколькими функциональными группами, выбранными из атомов галогена, CF3, C1C3 алкильных групп, -О-(С 1-С 3 алкил)групп, ацетильной группы и нитрильной группы. Однако соединения, описанные в WO 02/46176, действуют на любой подтип PPAR (т.е. PPAR,PPAR и PPAR) и, следовательно, не могут рассматриваться как PPAR-селективные активаторы, тогда как соединения, описанные в WO 04/00762, описаны как предпочтительно селективные в отношенииPPAR, и, принимая во внимание то, что данные по тестированию соединений не приведены в указанном описании, эти соединения не могут рассматриваться как селективные в отношении PPAR. Краткое изложение сущности изобретения Авторы настоящего изобретения провели интенсивные исследования для получения соединения,которое селективно активирует -тип PPAR среди других PPAR, и установили, что соединение, представленное следующей формулой (1), селективно активирует PPAR и может использоваться в качестве лекарственного средства для профилактики и/или лечения патологического состояния, включая гиперлипидемию, артериосклероз, диабет, осложнения диабета, воспаления и сердечные заболевания, не вызывая ожирения или увеличения массы тела. Настоящее изобретение осуществлено на основании данного открытия. Предметом настоящего изобретения является получение соединения, которое селективно активирует PPAR, и лекарственного средства, содержащего соединение. Соответственно, настоящее изобретение относится к соединению, представленному следующей формулой (1):(где каждый из R1 и R2, которые могут быть одинаковыми или отличаются друг от друга, представляет собой атом водорода, метильную группу или этильную группу; каждый из R3a, R3b,R4a и R4b, которые могут быть одинаковыми или отличаются друг от друга, представляет собой атом водорода, атом галогена,нитрогруппу, гидроксильную группу, C1-4 алкильную группу, трифторметильную группу, C1-4 алкоксильную группу, C1-4 алкилкарбонилоксигруппу, ди-С 1-4 алкиламиногруппу, C1-4 алкилсульфонилоксигруппу, C1-4 алкилсульфонильную группу, C1-4 алкилсульфинильную группу или C1-4 алкилтиогруппу, илиR3a и R3b, или R4a и R4b могут вместе образовывать алкилендиоксигруппу; X представляет собой атом кислорода, атом серы или N-R5 (R5 представляет собой атом водорода, C1-4 алкильную группу, C1-4 алкилсульфонильную группу или C1-4 алкилоксикарбонильную группу); Y представляет собой атом кислорода,C(O)l (l представляет собой число от 0 до 2), карбонильную группу, карбониламиногруппу, аминокарбонильную группу, сульфониламиногруппу, аминосульфонильную группу, NH; Z представляет собой СН или N; n представляет собой число от 1 до 6 и m представляет собой число от 2 до 6) или его соли. Настоящее изобретение также относится к лекарственному средству, включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой (1), или его соль. Настоящее изобретение также относится к терапевтическому лекарственному средству при гиперлипидемии, включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой (1), или его соль. Настоящее изобретение также относится к терапевтическому лекарственному средству при диабете,включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой(1), или его соль. Настоящее изобретение также относится к терапевтическому лекарственному средству при осложнениях диабета, включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой (1), или его соль. Настоящее изобретение также относится к терапевтическому лекарственному средству при воспалении, включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой (1), или его соль. Настоящее изобретение также относится к терапевтическому лекарственному средству при сердечных заболеваниях, включающему в качестве активного ингредиента соединение, представленное вышеуказанной формулой (1), или его соль. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение, представленное вышеуказанной формулой (1), или его соль и фармакологически приемлемый носитель. Настоящее изобретение также относится к применению для получения лекарственного средства соединения, представленного вышеуказанной формулой (1), или его соли. Настоящее изобретение также относится к способу лечения заболевания, выбранного из группы,состоящей из гиперлипидемии, артериосклероза, диабета, осложнений диабета, воспаления и сердечных заболеваний, включающему введение эффективного количества соединения, представленного вышеуказанной формулой (1), или его соли нуждающемуся в этом субъекту. Соединения по настоящему изобретению обеспечивают селективное активирующее действие наPPAR в ряду других PPAR и может использоваться в качестве терапевтических лекарственных средств для профилактики и/или лечения патологических состояний, таких как гиперлипидемия, артериосклероз,диабет, осложнения диабета, воспаление и сердечные заболевания, не стимулируя увеличение массы тела или ожирение. Краткое описание чертежей На фиг. 1 показан фактор активации соединения примера 1 по отношению к каждой изоформеPPAR,на фиг. 2 - фактор активации соединения примера 2 по отношению к каждой изоформе PPAR,на фиг. 3 - фактор активации соединения А по отношению к каждой изоформе PPAR,на фиг. 4 - фактор активации соединения В по отношению к каждой изоформе PPAR,на фиг. 5 - фактор активации соединения В по отношению к каждой изоформе PPAR. Подробное описание изобретения Как следует из формулы (1), соединения по настоящему изобретению характеризуются структурой,где группа связана с атомом азота. До осуществления настоящего изобретения тот факт, что соединение, имеющее вышеописанную структуру, селективно активирует PPAR, был не известен. Если R3a, R3b, R4a или R4b в формуле (1) представляют собой атом галогена, то атом галогена может представлять собой фтор, хлор или бром, где фтор и хлор являются предпочтительными. Если R3a, R3b, R4a, R4b или R5 представляют собой C1-4 алкильную группу, алкильная группа может представлять собой метил, этил, н-пропил, изопропил или бутил. Среди них метил является особенно предпочтительным. Если R3a, R3b, R4a или R4b представляют собой C1-4 алкоксильную группу, алкоксильная группа может представлять собой метокси, этокси, н-пропокси, изопропокси или бутокси. Среди них метоксигруппа является особенно предпочтительной. Если R3a, R3b, R4a или R4b представляют собой C1-4 алкилкарбонилоксигруппу, алкилкарбонилоксигруппа может представлять собой метилкарбонилокси, этилкарбонилокси, н-пропилкарбонилокси, изопропилкарбонилокси или бутилкарбонилокси. Среди них метилкарбонилоксигруппа является особенно предпочтительной. Если R3a, R3b, R4a или R4b представляют собой ди-С 1-4 алкиламиногруппу, диалкиламиногруппа может представлять собой диметиламино, диэтиламино или диизопропиламино. Среди них диметиламиногруппа является особенно предпочтительной. Если R3a, R3b, R4a или R4b представляют собой C1-4 алкилсульфонилоксигруппу, алкилсульфонилоксигруппа может представлять собой метилсульфонилокси или этилсульфонилокси. Среди них метилсульфонилоксигруппа является особенно предпочтительной. Если R3a, R3b, R4a, R4b или R5 представляют собой C1-4 алкилсульфонильную группу, алкилсульфонильная группа может представлять собой метилсульфонил или этилсульфонил. Среди них метилсульфонил является особенно предпочтительным. Если R3a, R3b, R4a или R4b представляют собой C1-4 алкилсульфинильную группу, алкилсульфинильная группа может представлять собой метилсульфинил или этилсульфинил. Среди них метилсульфинил является особенно предпочтительным. Если R3a, R3b, R4a или R4b представляют собой C1-4 алкилтиогруппу, алкилтиогруппа может представлять собой метилтиогруппу или этилтиогруппу. Среди них метилтиогруппа является особенно предпочтительной. Примеры алкилендиоксигруппы, которая образуется путем связывания R3a с R3b или путем связывания R4a с R4b, включают метилендиокси и этилендиокси. Среди них метилендиоксигруппа является особенно предпочтительной. Когда R5 представляет собой C1-4 алкилоксикарбонильную группу, алкилоксикарбонильная группа может представлять собой метилоксикарбонил или этилоксикарбонил. Среди них метилоксикарбонил является особенно предпочтительным. Что касается R1 и R2, следующие случаи являются особенно предпочтительными: они оба представляют собой атомы водорода; они оба представляют собой метильные группы; один представляет собой метильную группу, а другой представляет собой атом водорода; или один представляет собой этильную группу, а другой представляет собой атом водорода.X представляет собой атом кислорода, атом серы или N-R5, где атом кислорода является предпочтительным. Y представляет собой атом кислорода, C(O)l, карбонильную группу, карбониламиногруппу,аминокарбонильную группу, сульфониламиногруппу, аминосульфонильную группу или NH. Среди них атом кислорода является предпочтительным. Z представляет собой СН или N, где СН является предпочтительным; l представляет собой число от 0 до 2, где число 2 является предпочтительным; n представляет собой число от 1 до 6, где число от 1 до 3 является предпочтительным; m представляет собой число от 2 до 6, где число от 2 до 4 является предпочтительным и 2 или 3 являются особенно предпочтительными. Примеры солей соединений, представленных формулой (1) по настоящему изобретению, включают соли щелочных металлов, такие как соли натрия и соли калия; соли щелочно-земельных металлов, такие как соли кальция и соли магния; соли органических оснований, такие как соли аммония и соли триалкиламина; соли минеральных кислот, такие как соли соляной кислоты и соли серной кислоты; и соли органических кислот, такие как соли уксусной кислоты. Соединение по настоящему изобретению может находиться в виде сольвата, такого как гидрат, или в виде геометрического (цис-, транс-) изомера или оптического изомера. Данные изомеры также входят в объем настоящего изобретения. Среди соединений по настоящему изобретению примеры соединений, которые являются предпочтительными вследствие их высокой селективности в отношении PPAR, включают следующие соединения и их соли: 2-[3-N-(бензоксазол-2-ил)-N-3-(4-фторфенокси)пропил]аминометил]фенокси]бутановую кислоту,-4 009374 2-[3-N-(бензоксазол-2-ил)-N-2-(4-хлорфенокси)этил]аминоэтил]фенокси]бутановую кислоту,2-[3-N-(бензоксазол-2-ил)-N-2-(4-фторфенокси)этил]аминоэтил]фенокси]бутановую кислоту,2-[3-N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]фенокси]пропионовую кислоту,3-N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]феноксиуксусную кислоту,2-[3-N-(бензоксазол-2-ил)-N-3-феноксипропил]аминометил]фенокси]бутановую кислоту,2-[3-N-(бензоксазол-2-ил)-N-3-(4-метоксифенокси)пропил]аминометил]фенокси]бутановую кислоту,2-[3-N-(бензоксазол-2-ил)-N-3-(4-метоксифенокси)пропил]аминометил]фенокси]пропионовую кислоту. Соединения по настоящему изобретению могут быть получены в соответствии, например, со следующими способами получения, описанными на реакционных схемах А-K (на следующих схемах R1, R2,R3a, R3b, R4a, R4b R5, m, n, X, Y и Z имеют те же значения, как описано выше; R6 представляет собой заместитель, способный защищать гидроксильные группы, такой как C1-4 алкильная группа и триалкилсилильная группа (см., например, "Protective Groups in Organic Synthesis (John WileySons, Inc.)"); R7 представляет собой C1-4 алкильную группу; R3 представляет собой R3a и R3b; R4 представляет собой R4a иR4b; Hal представляет собой атом галогена; и р равно 1 или 2). Реакционная схема А Способ получения, представленный реакционной схемой А, включает следующие стадии: фенольное соединение (а) подвергают взаимодействию со сложным эфиром 2-галогеналкилкарбоновой кислоты(b), получая таким образом соединение с альдегидной группой (с); альдегидное соединение (с) подвергают взаимодействию с аминосодержащим соединением с последующим восстановлением; полученное таким образом аминосодержащее соединение (d) подвергают взаимодействию с 2-галогенбензоксазолом,получая таким образом сложноэфирное соединение (е); и сложноэфирное соединение (е) подвергают гидролизу, получая таким образом соединение (1 а) по настоящему изобретению. Первая стадия (А-1) протекает следующим образом. Фенольное соединение (а) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан или ацетонитрил. Добавляют к раствору необходимое количество неорганического основания, такого как карбонат калия(K2CO3), карбонат натрия (Na2CO3) или карбонат цезия (Cs2CO3), или органического основания, такого как триэтиламин или диизопропилэтиламин. Далее добавляют необходимое количество сложного эфира 2-галогеналкилкарбоновой кислоты (b), такого как сложный эфир 2-бромизобутановой кислоты, сложный эфир 2-бром-н-бутановой кислоты или сложный эфир 2-бромпропионовой кислоты, и полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и температурой кипения растворителя, при перемешивании в течение от нескольких часов до 24 ч. Сложный эфир подходящим образом выбирают из трет-бутиловых сложных эфиров, этиловых сложных эфиров,метиловых сложных эфиров и т.д. На второй стадии (А-2) соединение альдегида (с) растворяют в растворителе, таком как 1,2 дихлорпентан, хлороформ, дихлорметан, ДМФ, ТГФ, диоксан или ацетонитрил. Затем добавляют подходящий выбранный амин и кислоту, такую как уксусная кислота, с последующим восстановлением с использованием такого восстановителя, как триацетоксиборгидрид натрия (NaBH(ОАс)3). Реакцию проводят при перемешивании реакционной смеси при охлаждении или при комнатной температуре в течение от нескольких часов до 24 ч (в атмосфере инертного газа, если необходимо). Третья стадия (А-3) протекает следующим образом. Исходное аминосодержащее соединение (d) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к раствору 2 галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких часов до 24 ч (в атмосфере инертного газа, если необходимо). Четвертая стадия (А-4) протекает следующим образом. В том случае, если на первой стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко-5 009374 гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на четвертой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких часов до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, используется на первой стадии, полученное сложноэфирное соединение, которое служит исходным соединением на четвертой стадии, растворяют в растворителе,таком как дихлорметан или хлороформ, с последующим добавлением кислоты, такой как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких часов до 24 ч при охлаждении или при комнатной температуре. Реакционная схема B Способ получения, представленный на реакционной схеме B, включает следующие стадии: исходную карбоновую кислоту (f) подвергают взаимодействию с амином, получая амидофенольное соединение (g); амидофенольное соединение (g) подвергают взаимодействию с эфиром 2-галогеналкилкарбоновой кислоты (b), получая таким образом амидное соединение (h); амид (h) химически восстанавливают, получая таким образом соединение вторичного амина (i); соединение вторичного амина (i) подвергают взаимодействию с 2-галогенбензоксазолом, получая таким образом сложноэфирное соединение (j); сложноэфирное соединение (j) подвергают гидролизу, получая таким образом соединение (1b) по настоящему изобретению. Первая стадия (B-1) протекает следующим образом. Исходную карбоновую кислоту (f) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан, ацетонитрил или в смеси выбранных из них подходящим образом растворителей. Подходящим образом выбранный амин растворяют в растворителе и добавляют к смеси при охлаждении необходимое количество конденсирующего агента, такого как дициклогексилкарбодиимид или водорастворимый карбодиимид(WSCHCl) (например, 1-этил-3-(3-диметиламинопропил) карбодиимид HCl). Впоследствии, при необходимости, добавляют такое соединение как 1-гидрокси-1 Н-бензотриазол (HOBt) или диметиламинопиридин. Полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и температурой кипения растворителя в течение от нескольких часов до 24 ч. Вторая стадия (B-2) протекает следующим образом. Соединение фенола (g) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к раствору необходимое количество неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Впоследствии добавляют необходимое количество сложного эфира 2-галогеналкилкарбоновой кислоты, такого как сложный эфир 2-бромизобутановой кислоты,сложный эфир 2-бром-н-бутановой кислоты или сложный эфир 2-бромпропионовой кислоты, и полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких часов до 24 ч. Сложный эфир выбирают подходящим образом из трет-бутиловых сложных эфиров, этиловых сложных эфиров, метиловых сложных эфиров и т.д. Третья стадия (B-3) протекает следующим образом. Исходное амидное соединение (h) растворяют в растворителе, таком как ТГФ или диоксан. Впоследствии, если необходимо, в атмосфере инертного газа,добавляют к этому раствору необходимое количество восстановителя, такого как комплекс борана с тетрагидрофураном (BH3 ТГФ), и реакционную смесь перемешивают при комнатной температуре или при нагревании в течение от нескольких часов до 24 ч. Четвертая стадия (B-4) протекает следующим образом. Исходное соединение вторичного амина (i) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раство-6 009374 ру 2-галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя, при перемешивании в течение от нескольких часов до 24 ч (в атмосфере инертного газа, если необходимо). Пятая стадия (B-5) протекает следующим образом. В том случае, если на второй стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких часов до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир,который легко разлагается кислотой, используется на второй стадии, полученное сложноэфирное соединение, которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ, с последующим добавлением кислоты, такой как трифторуксусная кислота,и полученную смесь перемешивают в течение от нескольких часов до 24 ч при охлаждении или при комнатной температуре. Реакционная схема С Способ получения, представленный на реакционной схеме С, включает следующие стадии: карбоновую кислоту (k) подвергают взаимодействию с амином, получая таким образом амидное соединение(l); защитную группу гидроксила удаляют из амидного соединения (l), получая таким образом фенольное соединение (g); фенольное соединение (g) подвергают взаимодействию со сложным эфиром 2 галогеналкилкарбоновой кислоты; полученное соединение восстанавливают, получая таким образом аминосоединение (i); аминосоединение (i) подвергают взаимодействию с 2-галогенбензоксазолом и полученное соединение подвергают гидролизу, получая таким образом соединение по настоящему изобретению. Первая стадия (C-1) протекает следующим образом. Исходную карбоновую кислоту (k) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан, ацетонитрил или в смеси растворителей, выбранных из них подходящим образом. Подходящий выбранный амин растворяют в растворителе и добавляют к смеси при охлаждении необходимое количество реагента, такого как дициклогексилкарбодиимид или WSCHCl. Впоследствии, если необходимо, добавляют соединение,такое как HOBt или диметиламинопиридин. Полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя в течение от нескольких часов до 24 ч. Вторая стадия (C-2) протекает следующим образом. Амидное соединение (l), полученное на первой стадии, растворяют в растворителе, таком как дихлорметан, хлороформ или хлорбензол. После этого добавляют к этому раствору кислоту Льюиса, такую как трехбромистый бор или хлорид алюминия, и смесь перемешивают при охлаждении или примерно при температуре кипения растворителя в течение от нескольких часов до 24 ч. Если R6=H, реакция по второй стадии не требуется. Третья стадия (C-3) протекает следующим образом. Фенольное соединение (g) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раствору необходимое количество неорганического основания, такого как карбонат калия (K2CO3), карбонат натрия (Na2CO3) или карбонат цезия (Cs2CO3), или органического основания, такого как триэтиламин или диизопропилэ-7 009374 тиламин. Затем добавляют необходимое количество сложного эфира 2-галогеналкилкарбоновой кислоты,такого как сложный эфир 2-бромизобутановой кислоты, сложный эфир 2-бром-н-бутановой кислоты или сложный эфир 2-бромпропионовой кислоты, и полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких часов до 24 ч. Сложный эфир подходящим образом выбирают из трет-бутиловых сложных эфиров, этиловых сложных эфиров, метиловых сложных эфиров и т.д. Четвертая стадия (C-4) протекает следующим образом. Исходное амидное соединение (h) растворяют в растворителе, таком как ТГФ или диоксан. Затем, если необходимо, в атмосфере инертного газа добавляют к этому раствору необходимое количество восстановителя, такого как тетрагидрофурановый комплекс борана (BH3 ТГФ), и реакционную смесь перемешивают при комнатной температуре или при нагревании в течение от нескольких часов до 24 ч. Пятая стадия (C-5) протекает следующим образом. Исходное аминосоединение (i) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раствору 2 галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких часов до 24 ч (в атмосфере инертного газа, если необходимо). Шестая стадия (C-6) протекает следующим образом. В том случае, если на третьей стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на шестой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому раствору основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир,который легко разлагается кислотой, используется на третьей стадии, полученное сложноэфирное соединение, которое служит исходным соединением на шестой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ с последующим добавлением кислоты, такой как трифторуксусная кислота,и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Реакционная схема D Способ получения, представленный на реакционной схеме D, включает следующие стадии: фенольное соединение (m) подвергают взаимодействию с эфиром 2-галогеналкилкарбоновой кислоты, получая таким образом цианосоединение (n); цианосоединение (n) восстанавливают, получая таким образом аминосоединение (о); аминосоединение (о) подвергают взаимодействию с 2-галогенбензоксазолом,получая таким образом аминосоединение (р); и аминосоединение (р) подвергают взаимодействию с галогенидом и полученное в реакции соединение подвергают гидролизу, получая таким образом соединение(1b) по настоящему изобретению. Первая стадия (D-1) протекает следующим образом. Фенольное соединение (m) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан или ацетонитрил. Добавляют к этому раствору необходимое количество неорганического основания, такого как карбонат калия (K2CO3), карбонат натрия (Na2CO3) или карбонат цезия (Cs2CO3) или органического основания,такого как триэтиламин или диизопропилэтиламин. Затем добавляют необходимое количество сложного эфира 2-галогеналкилкарбоновой кислоты, такого как сложный эфир 2-бромизобутановой кислоты,-8 009374 сложный эфир 2-бром-н-бутановой кислоты или сложный эфир 2-бромпропионовой кислоты, и полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч. Сложный эфир подходящим образом выбирают из трет-бутиловых эфиров, этиловых эфиров, метиловых эфиров и т.д. Вторая стадия (D-2) протекает следующим образом. Исходное цианосоединение (n) растворяют в растворителе, таком как ТГФ или диоксан. Затем, если необходимо, в атмосфере инертного газа добавляют к этому раствору необходимое количество восстановителя, такого как комплекс борана и тетрагидрофурана (BH3 ТГФ), и реакционную смесь перемешивают при комнатной температуре или при нагревании в течение от нескольких до 24 ч. Третья стадия (D-3) протекает следующим образом. Исходное аминосоединение (о) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раствору 2 галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя, при перемешивании в течение от нескольких до 24 ч (в атмосфере инертного газа, если необходимо). Четвертая стадия (D-4) протекает следующим образом. Исходное аминосоединение (р) растворяют в инертном растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Подходящий выбранный галогенид добавляют к этому раствору в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч. Пятая стадия (D-5) протекает следующим образом. В том случае, если на первой стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, используется на первой стадии, полученное сложноэфирное соединение,которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ с последующим добавлением кислоты, такой как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Реакционная схема Е Способ получения, представленный на реакционной схеме Е, включает следующие стадии: исходную карбоновую кислоту (k) подвергают взаимодействию с аммиаком или солью аммония, получая таким образом амидное соединение (q); защитную группу гидроксила удаляют из амидного соединения (q),получая таким образом фенольное соединение (r); фенольное соединение (r) подвергают взаимодействию с эфиром 2-галогеналкилкарбоновой кислоты, получая таким образом амидное соединение (s); амидное соединение (s) восстанавливают, получая таким образом аминосоединение (t); аминосоединение (t) подвергают взаимодействию с 2-галогенбензоксазолом, получая таким образом аминосоединение (р); ами-9 009374 носоединение (р) подвергают взаимодействию с галогенидом, получая таким образом аминосоединение(j); и аминосоединение (j) подвергают гидролизу, при этом получают соединение (1b) по настоящему изобретению. Первая стадия (E-1) протекает следующим образом. Исходную карбоновую кислоту (k) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан, ацетонитрил или в смеси растворителей, выбранных из них подходящим образом. Добавляют к этому раствору неорганическое основание, такое как карбонат калия (K2CO3), карбонат натрия (Na2CO3) или карбонат цезия(Cs2CO3), или органическое основание, такое как триэтиламин, диизопропилэтиламин или пиридин. К смеси добавляют ангидрид, такой как ди(трет-бутил)дикарбонат, с последующим перемешиванием в течение от нескольких минут до 3 ч при охлаждении или при комнатной температуре. Добавляют к этой смеси аммиак или соль аммония (например, гидрокарбонат аммония). Полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Вторая стадия (E-2) протекает следующим образом. Амидное соединение (q), полученное на первой стадии, растворяют в растворителе, таком как дихлорметан, хлороформ или хлорбензол, по необходимости. После этого добавляют к этому раствору кислоту Льюиса, такую как трехбромистый бор или хлорид алюминия, и смесь перемешивают при охлаждении или примерно при температуре кипения растворителя в течение от нескольких до 24 ч. Если R6=H, реакции на второй стадии не требуется. Третья стадия (E-3) протекает следующим образом. Фенольное соединение (r) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раствору необходимое количество неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Затем добавляют необходимое количество сложного эфира 2-галогеналкилкарбоновой кислоты, такого как сложный эфир 2-бромизобутановой кислоты, сложный эфир 2-бром-н-бутановой кислоты или сложный эфир 2-бромпропионовой кислоты, и полученную смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя, при перемешивании в течение от нескольких до 24 ч. Сложный эфир подходящим образом выбирают из трет-бутиловых эфиров, этиловых эфиров,метиловых эфиров и т.д. Четвертая стадия (E-4) протекает следующим образом. Исходное амидосоединение (s) растворяют в растворителе, таком как ТГФ или диоксан. Впоследствии, если необходимо, в атмосфере инертного газа добавляют к этому раствору необходимое количество восстановителя, такого как комплекс борана и тетрагидрофурана (BH3 ТГФ), и реакционную смесь перемешивают при комнатной температуре или при нагревании в течение от нескольких до 24 ч. Пятая стадия (E-5) протекает следующим образом. Исходное аминосоединение (t) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к этому раствору 2 галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч (в атмосфере инертного газа, если необходимо). Шестая стадия (E-6) протекает следующим образом. Исходное аминосоединение (p) растворяют в инертном растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к нему подходящим образом выбранный галогенид в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч. Седьмая стадия (E-7) протекает следующим образом. В том случае, если на третьей стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на седьмой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, используется на третьей стадии, полученное сложноэфирное соединение,которое служит исходным соединением на седьмой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ с последующим добавлением кислоты, такой как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Способ получения, представленный на реакционной схеме F, включает следующие стадии: исходное соединение альдегида (u) подвергают взаимодействию с амином с последующим восстановлением; полученное таким образом аминосоединение (v) подвергают взаимодействию с 2-галогенбензоксазолом,получая таким образом соединение (w); защитную группу гидроксила удаляют из соединения (w), получая таким образом фенольное соединение (x); фенольное соединение подвергают взаимодействию с эфиром 2-гидроксикарбоновой кислоты, получая таким образом соединение (j); и соединение (j) подвергают гидролизу, получая таким образом соединение (1b) по настоящему изобретению. Первая стадия (F-1) протекает следующим образом. Исходное соединение альдегида (u) растворяют в растворителе, таком как 1,2-дихлорэтан, хлороформ, дихлорметан, N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан или ацетонитрил. Затем добавляют подходящим образом выбранное соединение амина и кислоту, такую как уксусная кислота, с последующим восстановлением с использованием восстановителя, такого как триацетоксиборгидрид натрия (NaBH(ОАс)3). Реакцию проводят при перемешивании смеси при охлаждении или при комнатной температуре в течение от нескольких до 24 ч(в атмосфере инертного газа, если необходимо). Вторая стадия (F-2) протекает следующим образом. Аминосоединение (v), полученное на первой стадии, растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. Добавляют к нему 2-галогенбензоксазол, такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3, или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч (в атмосфере инертного газа, если необходимо). Третья стадия (F-3) протекает следующим образом. В том случае, если R6 образует любой сложный эфир (например, CH3CO-), который легко гидролизуется щелочью, соединение (w) растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому раствору основание, такое как гидроксид лития, гидроксид натрия, гидроксид калия или карбонат калия, или их водный раствор; и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции, реакционную смесь нейтрализуют или подкисляют с использованием кислоты, такой как водный раствор хлорида аммония или разбавленная соляная кислота. В том случае, если сложный эфир легко гидролизуется кислотой, например, в случае сложного эфира, содержащего метоксиметильный фрагмент, соединение (w) растворяют в растворителе, таком как дихлорметан или хлороформ, и добавляют к раствору кислоту, такую как соляная кислота с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. В том случае, если R6 представляет собой силильную группу, такую как трет-бутилдиметилсилильная, соединение (w) растворяют в растворителе, таком как ТГФ, диоксан, ацетонитрил, дихлорметан или хлороформ, и добавляют к раствору фторсодержащее соединение, такое как фторид тетрабутиламмония с последующим перемешиванием смеси в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. В данном случае реакция может быть осуществлена путем растворения соединения (w) в растворителе, таком как ДМФ, этанол или метанол, добавления к раствору основания, такого как карбонат калия, карбонат цезия или гидроксид лития, и перемешивания смеси в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. Четвертая стадия (F-4) протекает следующим образом. Фенольное соединение (x), полученное на- 11009374 третьей стадии, и эфир 2-гидроксикарбоновой кислоты, такой как трет-бутил 2-гидроксибутират или этиллактат, растворяют в растворителе, таком как ТГФ, диоксан, ацетонитрил или толуол. В условиях реакции Мицунобу раствор перемешивают при температуре в диапазоне между комнатной температурой и температурой кипения растворителя в течение от нескольких до 24 ч. Альтернативно, эфир 2 гидроксикарбоновой кислоты, такой как трет-бутил 2-гидроксибутират или этилактат растворяют в растворителе, таком как ТГФ, диоксан, ацетонитрил, толуол или ДМФ. Затем добавляют к этой смеси неорганическое основание или органическое основание, такое как триэтиламин или диизопропилэтиламин. Затем добавляют к этому сульфонилхлорид, такой как метансульфонилхлорид или птолуолсульфонилхлорид. Полученную смесь и фенольное соединение (x), полученное на третьей стадии,смешивают вместе, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении льдом или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. Сложный эфир подходящим образом выбирают из трет-бутиловых сложных эфиров,этиловых сложных эфиров, метиловых сложных эфиров и т.д. Пятая стадия (F-5) протекает следующим образом. В том случае, если на четвертой стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, полученное сложноэфирное соединение, которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, используется на четвертой стадии, полученное сложноэфирное соединение,которое служит исходным соединением на пятой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ, с последующим добавлением кислоты, такой как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Такой путь синтеза позволяет успешно осуществить синтез соединений (1b), даже если R6 представляет собой атом водорода. В таком случае (R6=H), процесс по третьей стадии F-3 не требуется. Реакционная схема G Способ получения, представленный на реакционной схеме G, включает следующие стадии: соединение (z), полученное в ходе реакционной схемы A, окисляют и окисленное соединение подвергают гидролизу, получая таким образом соединение (1c) по настоящему изобретению. Первая стадия (G-1) протекает следующим образом. Соединение (z), полученное на четвертой стадии реакционной схемы А, растворяют в растворителе, таком как хлороформ или дихлорметан. Затем соединение (z) окисляют с использованием пероксида, такого как м-хлорпербензойная кислота или H2O2,при перемешивании в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Вторая стадия (G-2) протекает следующим образом. В том случае, если R7 образует метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, сложноэфирное соединение растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому раствору основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор; и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют с использованием кислоты,такой как соляная кислота. В том случае, если R7 образует трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, сложноэфирное соединение растворяют в растворителе, таком как дихлорметан или хлороформ, и добавляют к раствору кислоту, такую как трифторуксус- 12009374 ная кислота, с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Реакционная схема H Способ получения, представленный на реакционной схеме H, включает следующие стадии: галогенид (ab) подвергают взаимодействию с азидом натрия, получая таким образом соединение азида (ac); карбонильный фрагмент в азидном соединении (ac) защищают с помощью соединения, такого как ацеталь, получая таким образом ацетальное соединение (ad); ацетальное соединение (ad) восстанавливают,получая аминосоединение (ae); аминосоединение (ae) трансформируют в соединение (ag) способами,аналогичными описанным на реакционных схемах (A-2) и (A-3); соединение (ag) трансформируют в кетосоединение (ah) путем снятия защитной группы; и кетосоединение (ah) подвергают гидролизу, получая таким образом соединение (1d) по настоящему изобретению. Первая стадия (H-1) протекает следующим образом. Галогенид (ab) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), диоксан или ацетонитрил. Добавляют к этому раствору необходимое количество азида натрия, и полученную смесь перемешивают при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя в течение от нескольких до 24 ч. Вторая стадия (H-2) протекает следующим образом. Азидное соединение (ac) растворяют в растворителе, таком как бензол, толуол, хлороформ или дихлорметан. В присутствии кислотного катализатора,такого как п-толуолсульфоновая кислота или п-толуолсульфонат пиридиния (PPTS), раствор подвергают взаимодействию с этиленгликолем при перемешивании при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. Защитная группа в отношении карбонильного фрагмента не ограничена этилендиоксигруппой, и для защиты карбонильного фрагмента можно использовать подходящий алкандиол. Третья стадия (H-3) протекает следующим образом. Ацетальное соединение (ad) растворяют в смеси растворителя, такого как ТГФ или 1,4-диоксан, и воды или водного раствора гидроксида натрия. Добавляют к этому необходимое количество триарилфосфина, такого как трифенилфосфин, и смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч. Четвертую стадию (H-4) можно проводить способом, аналогичным описанному на реакционной схеме (A-2). Пятую стадию (H-5) можно проводить способом, аналогичным описанному на реакционной схеме(A-3). Шестая стадия (H-6) протекает следующим образом. Соединение (ag), полученное на пятой стадии,растворяют в растворителе, таком как диоксан, ТГФ или ацетон. Добавляют к этому раствору необходимое количество кислоты, такой как PPTS или соляная кислота, и смесь оставляют взаимодействовать при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя при перемешивании в течение от нескольких до 24 ч. Седьмая стадия (H-7) протекает следующим образом. В том случае, если на четвертой стадии используют метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, кетосоединение (ah), которое служит исходным соединением на седьмой стадии, растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапа- 13009374 зоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. С другой стороны, в том случае, если трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, используется на четвертой стадии, кетосоединение, которое служит исходным соединением на седьмой стадии, растворяют в растворителе, таком как дихлорметан или хлороформ, с последующим добавлением кислоты, такой как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Реакционная схема I Способ получения, представленный на реакционной схеме I, включает следующие стадии: альдегид(c), полученный на реакционной схеме (A-1), подвергают взаимодействию с аминоспиртом, и реакционную смесь восстанавливают, получая таким образом соединение аминоспирта (ai); соединение аминоспирта (ai) подвергают взаимодействию с 2-галогенбензоксазолом, получая таким образом спирт (aj); к спирту (aj) добавляют фталимид калия; полученное соединение подвергают взаимодействию с гидразином, получая таким образом аминосоединение (al); аминосоединение (al) преобразуют в сульфонамидное соединение (am); сульфонамидное соединение (am) гидролизуют и полученное соединение подвергают гидролизу, получая таким образом соединение (1e) по настоящему изобретению. Первая стадия (I-1) протекает следующим образом. Альдегид (c) растворяют в растворителе, таком как 1,2-дихлорпентан, хлороформ, дихлорметан, ДМФ, ТГФ, диоксан или ацетонитрил. Затем добавляют подходящий выбранный аминоспирт и кислоту, такую как уксусная кислота, с последующим восстановлением с использованием такого восстановителя как триацетоксиборгидрид натрия (NaBH(ОАс)3). Взаимодействие проводят при перемешивании при охлаждении или при комнатной температуре, в течение от нескольких до 24 ч (в атмосфере инертного газа, если необходимо). Вторая стадия (I-2) протекает следующим образом. Соединение аминоспирта (ai) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан или ацетонитрил. К раствору добавляют 2-галогенбензоксазол,такой как 2-хлорбензоксазол, в присутствии необходимого количества неорганического основания, такого как K2CO3, Na2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Реакционную смесь перемешивают при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя в течение от нескольких до 24 ч (в атмосфере инертного газа, если необходимо). Третья стадия (I-3) протекает следующим образом. Спирт (aj) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан, ацетонитрил или толуол. Затем к раствору добавляют фталимид калия. В условиях реакции Мицунобу смесь перемешивают при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя, в течение от нескольких до 24 ч. Четвертая стадия (I-4) протекает следующим образом. Фталимидное соединение (ak) растворяют в растворителе, таком как метанол, этанол или изопропанол. Затем к раствору добавляют гидразин и смесь перемешивают при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя в течение от нескольких до 24 ч. Пятая стадия (I-5) протекает следующим образом. Аминосодержащее соединение (al) растворяют в растворителе, таком как ДМФ, ацетонитрил, 1,4-диоксан, ТГФ или хлороформ. Добавляют к раствору арилсульфонилхлорид в присутствии органического основания, такого как триэтиламин или диизопро- 14009374 пилэтиламин, или неорганического основания, такого как Na2CO3, K2CO3 или Cs2CO3. Реакционную смесь перемешивают при охлаждении или при температуре кипения растворителя, в течение от нескольких до 24 ч. Шестая стадия (I-6) протекает следующим образом. Сульфонамидное соединение (am) растворяют в растворителе, таком как дихлорметан или хлороформ. Затем добавляют кислоту, такую как трифторуксусная кислота, и полученную смесь перемешивают в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Седьмая стадия (I-7) протекает следующим образом. Карбоновую кислоту (an) растворяют в растворителе, таком как метанол, этанол или ТГФ. Затем добавляют к раствору основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия, или водный раствор основания, и смесь перемешивают при охлаждении или при температуре между комнатной температурой и примерно температурой кипения растворителя в течение от нескольких до 24 ч. Реакционная схема J Способ получения, представленный на реакционной схеме J, включает следующие стадии: соединение (v), полученное на реакционной стадии F-1, подвергают взаимодействию с 2-галогенфенилизотиоцианатом, получая таким образом соединение тиомочевины (ao); соединение тиомочевины(ao) подвергают взаимодействию с палладием, получая таким образом соединение бензотиазола (ap); соединение бензотиазола (ap) преобразуют в соединение фенола (aq), которое затем преобразовывают в сложноэфирное соединение (ar); и сложноэфирное соединение (ar) подвергают гидролизу, получая таким образом соединение (1f) по настоящему изобретению. Первая стадия (J-1) протекает следующим образом. Соединение (v), полученное на реакционной стадии F-1, растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран(ТГФ), диоксан, ацетонитрил или хлороформ, и добавляют к раствору 2-галогенфенилизотиоцианат с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Примеры галогена включают бром и йод. Вторая стадия (J-2) протекает следующим образом. Соединение тиомочевины (ao) растворяют в растворителе, таком как ТГФ, диоксан, ДМФ, толуол или дихлорметан, и добавляют к раствору палладиевый катализатор, такой как Pd2(dba)3, Pd(Ph3P)4 или Pd(OAc)2, и, если необходимо, подходящим образом выбранный лиганд, такой как dppf, dppp, dppe или Ph3P, с последующим перемешиванием смеси в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя (в атмосфере инертного газа, если необходимо). Третья стадия (J-3) протекает следующим образом. В том случае, если R6 образует любой сложный эфир (например, CH3CO-), который легко гидролизуется щелочью, соединение (ap) растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития,гидроксид натрия, гидроксид калия или карбонат калия, или их водный раствор; и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь нейтрализуют или подкисляют с использованием кислоты, такой как водный раствор хлорида аммония или разбавленная соляная кислота. В том случае, если R6 образует метоксиметиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, соединение (ap) растворяют в растворителе, таком как дихлорметан или хлороформ, и добавляют к раствору кислоту, такую как соляная кислота, с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлажде- 15009374 нии или при комнатной температуре. В том случае, если R6 представляет собой силильную группу, такую как трет-бутилдиметилсилил, соединение (ap) растворяют в растворителе, таком как ТГФ, диоксан,ацетонитрил, дихлорметан или хлороформ, и добавляют к раствору фторсодержащее соединение, такое как фторид тетрабутиламмония с последующим перемешиванием смеси в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. В данном случае реакцию можно проводить путем растворения соединения (ap) в растворителе,таком как ДМФ, этанол или метанол, добавления к раствору основания, такого как карбонат калия, карбонат цезия или гидроксид лития, и перемешивания смеси в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. Четвертая стадия (J-4) протекает следующим образом. Исходное фенольное соединение (aq) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан, ацетонитрил или толуол, и затем подвергают взаимодействию со сложным эфиром 2-гидроксикарбоновой кислоты, таким как сложный эфир молочной кислоты или сложный эфир 2-гидроксибутановой кислоты, в условиях реакции Мицунобу. Альтернативно, уходящую группу, такую как метансульфонильная группа или п-толуолсульфонильная группа,вводят в исходное соединение фенола (aq), и продукт подвергают взаимодействию со сложным эфиром 2-гидроксикарбоновой кислоты при перемешивании в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя, в присутствии неорганического основания, такого как Na2CO3, K2CO3 или CS2CO3, или органического основания,такого как триэтиламин или диизопропилэтиламин. Альтернативно, исходное фенольное соединение (aq) растворяют в растворителе, таком как ДМФ, ТГФ, диоксан, ацетонитрил или толуол и раствор подвергают взаимодействию со сложным эфиром 2-галогенкарбоновой кислоты, таким как этил-2-бромпропионат или этил-2-бромбутират, при перемешивании в течение от нескольких до 24 ч при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя в присутствии неорганического основания, такого как Na2CO3, K2CO3 или Cs2CO3, или органического основания, такого как триэтиламин или диизопропилэтиламин. Пятая стадия (J-5) протекает следующим образом. В том случае, если R7 образует метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью,сложноэфирное соединение растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. В том случае, если R7 образует трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, сложноэфирное соединение растворяют в растворителе, таком как дихлорметан или хлороформ, и добавляют к раствору кислоту, такую как трифторуксусная кислота, с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Следует отметить, что, если используется реакционная схема J, целевое соединение (1f) может быть получено из исходного соединения (v), в котором R6 представляет собой атом водорода. В таком случае третья стадия (J-3) не требуется. Реакционная схема K Способ получения, представленный на реакционной схеме K, включает следующие стадии: амино- 16009374 соединение (d), полученное в соответствии с реакционной схемой A, подвергают взаимодействию с 2 нитрофенилизоцианатом, получая таким образом нитросоединение (as); нитросоединение восстанавливают, получая таким образом соединение мочевины (at); соединение мочевины (at) подвергают взаимодействию с кислотой, получая таким образом сложноэфирное соединение (au); если необходимо, сложноэфирное соединение (au) подвергают взаимодействию с галогенидом, получая таким образом Nзамещенное соединение (av); и соединение (av) гидролизуют, получая таким образом соединение (1g) по настоящему изобретению. Первая стадия (K-1) протекает следующим образом. Аминосоединение (d) растворяют в растворителе, таком как N,N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ), диоксан, ацетонитрил или хлороформ, и добавляют к раствору необходимое количество 2-нитрофенилизоцианата, который может иметь заместитель с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Вторая стадия (K-2) протекает следующим образом. Нитросоединение (as) растворяют в растворителе, таком как метанол, этанол, этилацетат или диоксан, и затем восстанавливают с использованием металлического катализатора, такого как палладий-на-угле, в атмосфере водорода или в присутствии муравьиной кислоты. Третья стадия (K-3) протекает следующим образом. Исходное соединение мочевины (at) растворяют в растворителе, таком как хлороформ или толуол, и раствор перемешивают в течение от нескольких до 24 ч в присутствии необходимого количества кислоты, такой как оксихлорид фосфора, трихлорид фосфора или пентахлорид фосфора при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. Четвертая стадия (K-4) протекает следующим образом. Сложноэфирное соединение (au) растворяют в растворителе, таком как ДМФ, ацетонитрил, 1,4-диоксан или ТГФ, и раствор подвергают взаимодействию с галогеналканом, таким как йодметан, сульфонилхлорид, такой как метансульфонилхлорид,или аналогичным соединением при перемешивании в течение от нескольких до 24 ч при охлаждении или примерно при температуре кипения растворителя в присутствии органического основания, такого как триэтиламин или диизопропилэтиламин, или неорганического основания, такого как Na2CO3, K2CO3 илиCs2CO3. Пятая стадия (K-5) протекает следующим образом. В том случае, если R7 образует метиловый сложный эфир, этиловый сложный эфир или любой сложный эфир, который легко гидролизуется щелочью, N-замещенное соединение (av) растворяют в растворителе, таком как метанол, этанол или ТГФ; добавляют к этому основание, такое как гидроксид лития, гидроксид натрия или гидроксид калия или их водный раствор, и смесь оставляют взаимодействовать в течение от нескольких до 24 ч при охлаждении или при температуре в диапазоне между комнатной температурой и примерно температурой кипения растворителя. После завершения реакции реакционную смесь подкисляют, используя кислоту, такую как соляная кислота. В том случае, если R7 образует трет-бутиловый сложный эфир или любой сложный эфир, который легко разлагается кислотой, соединение (av) растворяют в растворителе, таком как дихлорметан или хлороформ, и добавляют к раствору кислоту, такую как трифторуксусная кислота, с последующим перемешиванием смеси в течение от нескольких до 24 ч при охлаждении или при комнатной температуре. Следует отметить, что если R5 представляет собой атом водорода, четвертая стадия (K-4) не требуется. Соединения в соответствии с настоящим изобретением могут быть получены в соответствии с любым из вышеуказанных способов. Полученные таким образом продукты могут быть очищены при необходимости с использование обычных способов очистки, таких как перекристаллизация или колоночная хроматография. Соединения могут быть при необходимости преобразованы в вышеуказанные желаемые соли или сольваты с использованием общепринятых способов. Как описано в приведенном далее примере испытаний, полученные таким образом соединения по настоящему изобретению обладают селективным активирующим действием в отношении PPAR. Таким образом, данные соединения могут использоваться в качестве лекарственного средства для профилактики и/или лечения патологических состояний млекопитающих (включая человека), таких как гиперлипидемия, артериосклероз, диабет, осложнения диабета (например, диабетическая нефропатия), воспаление и сердечные заболевания, не вызывая увеличения массы тела или ожирения. Фармацевтические препараты по настоящему изобретению содержат в качестве активного ингредиента настоящее соединение (1) или его соль. Не имеется конкретных ограничений в отношении формы введения и форма введения может быть подходящим образом определена в соответствии с целью лечения и выбрана, например, из пероральных твердых форм, пероральных жидких форм, инъекций, суппозиториев, препаратов для наружного применения, офтальмологических растворов, назальных капель,ушных капель и пластырей. Данные формы введения могут быть получены путем смешивания активного ингредиента с фармакологически приемлемым носителем и с использованием любого способа получения, известного в данной области. Если получают твердую форму лекарственного средства для орального введения, настоящее соединение (1) смешивают с разбавителем (и, если необходимо, вспомогательной добавкой, такой как свя- 17009374 зующее вещество, дезинтегрант, лубрикант, краситель, подсластитель или ароматизатор) и полученную смесь обрабатывают обычным образом, получая твердое лекарственное средство для орального применения, такое как таблетки, гранулы, порошок или капсулы. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры разбавителя включают лактозу, хлорид натрия, глюкозу, крахмал, микрокристаллическую целлюлозу и кремниевую кислоту; примеры связующего вещества включают воду, этанол, пропанол, простой сироп, ожиженный желатин, гидроксипропилцеллюлозу, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция и поливинилпирролидон; примеры дезинтегранта включают порошкообразный агар, гидрокарбонат натрия,лаурилсульфат натрия и моноглицерилстеарат; примеры лубриканта включают очищенный тальк, стеаратную соль, боракс и полиэтиленгликоль; примеры красителя включают -каротин, желтый сесквиоксид железа и карамель; и примеры подсластителя включают сахарозу и апельсиновую цедру. Если получают жидкую форму лекарственного средства для орального введения, настоящее соединение (1) смешивают со вспомогательной добавкой, такой как подсластитель, буфер, стабилизатор или консервант, и полученную смесь обрабатывают обычным образом, получая таким образом жидкое лекарственное средство для орального применения, такое как раствор лекарственного средства для внутреннего применения, сироп или эликсир. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры подсластителя включают сахарозу,примеры буфера включают цитрат натрия, примеры стабилизатора включают трагакантовую камедь, и примеры консерванта включают п-гидроксибензоатный сложный эфир. Если готовят препарат для инъекции, настоящее соединение (1) смешивают с вспомогательной добавкой, такой как регулятор рН, стабилизатор или изотонический агент, и полученную смесь обрабатывают обычным образом, получая таким образом препарат для инъекции, такой как препарат для подкожной инъекции, внутримышечной инъекции или внутривенной инъекции. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры регулятора pH включают фосфат натрия, примеры стабилизатора включают пиросульфит натрия, и примеры изотонического агента включают хлорид натрия. Если готовят суппозитории, настоящее соединение (1) смешивают с вспомогательной добавкой, такой как носитель или поверхностно-активное вещество, и полученную смесь обрабатывают обычным образом, получая таким образом суппозиторий. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры носителя включают полиэтиленгликоль и твердый жир, и примеры поверхностно-активного вещества включают полисорбат 80. Если готовят продукты лекарственных средств для наружного применения, настоящее соединение(1) смешивают со вспомогательной добавкой, такой как основа, водорастворимый полимер, растворитель, поверхностно-активное вещество или консервант, и полученную смесь обрабатывают обычным образом, получая таким образом препарат для наружного применения, такой как жидкости или растворы,кремы, гели или мази. Примеры основы включают жидкий парафин, белый вазелин и очищенный ланолин; примеры водорастворимых полимеров включают карбоксивиниловый полимер; примеры растворителя включают глицерин и воду; примеры поверхностно-активного вещества включают полиоксиэтиленовые сложные эфиры жирных кислот; и примеры консерванта включают п-гидроксибензоатный сложный эфир. Если готовят офтальмологический раствор, настоящее соединение (1) смешивают с вспомогательной добавкой, такой как регулятор pH, стабилизатор, изотонический агент или консервант, и полученную смесь обрабатывают обычным способом, получая таким образом офтальмологический раствор. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры регуляторов pH включают фосфат натрия; примеры стабилизатора включают пиросульфит натрия и EDTA; примеры изотонического агента включают хлорид натрия и примеры консерванта включают хлорбутанол. Если готовят назальные капли, настоящее соединение (1) смешивают с вспомогательной добавкой,такой как регулятор pH, стабилизатор, изотонический агент или консервант, и полученную смесь обрабатывают обычным способом, получая таким образом назальные капли. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры регуляторов pH включают фосфат натрия; примеры стабилизатора включают пиросульфит натрия и EDTA; примеры изотонического агента включают хлорид натрия и примеры консерванта включают хлорид бензалкония. Если готовят ушные капли, настоящее соединение (1) смешивают с вспомогательной добавкой, такой как регулятор pH, буфер, стабилизатор, изотонический агент или консервант, и полученную смесь обрабатывают обычным способом, получая таким образом ушные капли. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры регуляторов pH и буферов включают фосфат натрия; примеры стабилизатора включают пиросульфит натрия и EDTA; примеры изотонического агента включают хлорид натрия и примеры консерванта включают хлорид бензалкония.- 18009374 Если готовят пластырь, настоящее соединение (1) смешивают с вспомогательной добавкой, такой как вещество для повышения клейкости, растворитель, сшивающий агент или поверхностно-активное вещество, и полученную смесь обрабатывают обычным способом, получая таким образом пластырь, такой как гидрасированный пластырь или клейкий пластырь. Вспомогательная добавка может представлять собой вспомогательную добавку, обычно применяемую в данной области. Примеры вещества для повышения клейкости включают частично нейтрализованную полиакриловую кислоту, полиакрилат натрия, поли(2-этилгексилакрилат) и блок-сополимер стирол-изопрен-стирол; примеры растворителя включают глицерин и воду; примеры сшивающего агента включают аминоацетат дигидроксиалюминия и высушенный гель гидроксида алюминия; и примеры поверхностно-активного вещества включают полиоксиэтиленовый эфир жирной кислоты. Доза лекарственного средства по настоящему изобретению зависит от возраста, веса тела и состояния пациента, способа и частоты введения и т.д. Дневная доза соединения (1) для взрослого человека обычно составляет от 1 до 1000 мг, и лекарственное средство предпочтительно вводят перорально или парентерально один раз в день или дробно несколько раз в день. Примеры Далее настоящее изобретение будет описано подробно с помощью примеров, которые не следует рассматривать как ограничивающие изобретение. Пример получения 1. Синтез этил-2-(3-формилфенокси)бутирата. 3-Гидроксибензальдегид (18,3 г, 0,150 моль) растворяли в N,N-диметилформамиде (150 мл). После этого добавляли карбонат калия (22,80 г, 0,165 моль) и затем этил-2-бромбутират (29,26 г, 0,150 моль), и полученную смесь перемешивали в течение ночи при 80 С. Температуру реакционной смеси доводили до комнатной температуры. Добавляли этилацетат. Последовательно промывали раствор водой и насыщенным раствором соли с последующей сушкой над сульфатом натрия. Реакционную смесь фильтровали, концентрировали при пониженном давлении и очищали колоночной хроматографией на силикагеле(н-гексан/этилацетат = 5/1), получая таким образом бесцветное масло (35,29 г, 0,149 моль, 99,6%). 1 Н-ЯМР (400 МГц, CDCl3) : 1,10 (т, J=7 Гц, 3H), 1,26 (т, J=7 Гц, 3H), 1,99-2,06 (м, 2 Н), 4,23 (кв, J=7 Гц, 2 Н), 4,65 (т, J=6 Гц, 1 Н), 7,17-7,22 (м, 1 Н), 7,35(с, 1 Н), 7,45-7,49 (м, 2 Н), 9,95 (с, 1 Н). Пример получения 2. Синтез этил-2-[3-[N-[3-(4-фторфенокси)пропил]аминометил]фенокси] бутирата. Этил-2-(3-формилфенокси)бутират (5,0 г, 21,2 ммоль) растворяли в 1,2-дихлорпентане (20 мл). Затем добавляли к раствору 3-(4-фторфенокси)пропиламин (4,65 г, 27,5 ммоль) и полученную смесь перемешивали в течение 20 мин. После этого добавляли триацетоксиборгидрид натрия (95%, 7,1 г, 31,8 ммоль) и небольшое количество уксусной кислоты и смесь перемешивали в течение ночи при комнатной температуре. Добавляли к смеси насыщенный водный раствор гидрокарбоната натрия. Реакционную смесь экстрагировали хлороформом и органический слой промывали насыщенным раствором соли. Полученную смесь сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (хлороформ/метанол = 30/1), получая при этом целевое соединение (6,7 г, 81%). 1 Н-ЯМР (400 МГц, CDCl3)1,07 (т, J=7 Гц, 3H), 1,24 (т, J=7 Гц, 3H), 1,93-2,01 (м, 4 Н), 2,80 (т, J=7 Гц, 2 Н), 3,77 (с, 2 Н), 4,00 (т, J=6 Гц, 2 Н), 4,21 (кв, J=7 Гц, 2 Н), 4,55 (т, J=6 Гц, 1 Н), 6,74-6,84 (м, 3H), 6,896,98 (м, 4 Н), 7,21 (т, J=8 Гц, 1 Н). Пример получения 3. Синтез этил-2-[3-N-(бензоксазол-2-ил)-N-3-(4-фторфенокси)пропил] аминометил]фенокси]бутирата. Этил 2-[3-[N-[3-(4-фторфенокси)пропил]аминометил]фенокси]бутират (6,2 г, 15,9 ммоль) растворяли в N,N-диметилформамиде (10 мл) и добавляли к нему по каплям N,N-диизопропилэтиламин (3,1 г,23,8 ммоль). Впоследствии добавляли 2-хлорбензоксазол (2,9 г, 19,0 ммоль) и полученную смесь перемешивали в течение 15 мин при комнатной температуре с последующим перемешиванием в течение ночи при 50 С. Затем добавляли к смеси насыщенный водный раствор гидрокарбоната натрия. Реакцион- 19009374 ную смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли. Полученную смесь сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (н-гексан/этилацетат = 4/1), получая таким образом целевое соединение (7,5 г, 93%). 1 Н-ЯМР (400 МГц, CDCl3)1,05 (т, J=7 Гц, 3H), 1,17 (т, J=7 Гц, 3H), 1,96 (квинтет, J=7 Гц, 2 Н), 2,14 Этил 2-[3-N-(бензоксазол-2-ил)-N-3-(4-фторфенокси)пропил]аминометил]фенокси]бутират (7,3 г,14,4 ммоль) растворяли в смеси растворителей метанол-тетрагидрофуран (25 мл) и добавляли к нему по каплям водный раствор гидроксида натрия с концентрацией 2 моль/л (21,6 мл, 43,2 ммоль). Полученную смесь перемешивали в течение 2 ч при 60 С и концентрировали при пониженном давлении. Добавляли насыщенный водный раствор гидрокарбоната натрия. Затем реакционную смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли. Полученную смесь сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (хлороформ/метанол = 60/1), получая таким образом целевое соединение (6,7 г, количеств.). 1 Н-ЯМР (400 МГц, CDCl3)1,04 (т, J=7 Гц, 3H), 1,95 (квинтет, J=7 Гц, 2 Н), 2,04 (квинтет, J=6 Гц,2 Н), 3,56-3,64 (м, 2 Н), 3,87 (т, J=6 Гц, 2 Н), 4,50 (т, J=6 Гц, 1 Н), 4,62 (д, J=16 Гц, 1 Н), 4,68 (д, J=16 Гц, 1 Н),6,73-6,93 (м, 7 Н), 6,99 (т, J=8 Гц, 1 Н), 7,10-7,20 (м, 3H), 7,34 (д, J=8 Гц, 1 Н). Способом, аналогичным описанному в примере 1, синтезированы соединения примеров 2-30. Пример 2. Синтез 2-[3-N-(бензоксазол-2-ил)-N-2-(4-хлорфенокси)этил]аминометил]фенокси] бутановой кислоты. 2-[4-N-(Бензоксазол-2-ил)-N-3-(4-метансульфонилоксифенокси)пропил]аминометил]фенокси]-2 метиллропионовую кислоту (5,96 г, 10,7 ммоль) растворяли в метаноле. Добавляли к раствору при комнатной температуре раствор NaOMe (580 мг, 10,7 ммоль) в метаноле и затем полученную смесь перемешивали в течение 1 ч. Затем реакционную смесь концентрировали при пониженном давлении и добавляли к полученному концентрату н-гексан. Полученное таким образом твердое вещество очищали, получая при этом белый аморфный порошок (5,2 г, 84%). 1 Н-ЯМР (400 МГц, CDCl3)1,61 (с, 6 Н), 2,03 (ушир. с, 2 Н), 3,08 (с, 3H), 3,56 (ушир. с, 2 Н), 3,88WSCHCl (2,82 г, 14,76 ммоль) и 2-феноксиэтиламин (1,5 г, 10,95 ммоль) и затем полученную смесь перемешивали в течение 4 ч при комнатной температуре. После завершения реакции к реакционной смеси добавляли воду. Полученную смесь экстрагировали хлороформом с последующей промывкой насыщенным раствором соли. Полученную смесь сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали хроматографией, при этом получали 2,85 г, стехиометрическое количество, целевого соединения в виде бледно-желтого масла. 1N-2-Феноксиэтил-3-гидроксифенилацетамид (1,4 г, 5,16 ммоль) растворяли в ацетонитриле (10 мл). Добавляли к раствору трет-бутил-2-бромпропионат (1,3 г, 6,19 ммоль) и карбонат калия (1,07 г, 7,74 ммоль) и затем полученную смесь перемешивали в течение ночи при 80 С. После завершения реакции реакционную смесь концентрировали при пониженном давлении. К смеси добавляли этилацетат. Смесь промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Высушенную смесь концентрировали при пониженном давлении и очищали хроматографией, получая таким образом 1,14 г целевого соединения в виде бледно-желтого масла (выход 54%). Пример получения 6. Синтез трет-бутил-2-[3-[2-(N-2-феноксиэтил)аминоэтил]фенокси]пропионата. трет-Бутил-2-[3-(2-феноксиэтиламинокарбонилметил)фенокси]пропионат (1,14 г, 2,86 ммоль) растворяли в тетрагидрофуране (5 мл) в атмосфере аргона. Смесь охлаждали до 0 С и затем добавляли к ней 1 М комплекс боран-ТГФ в растворе ТГФ (8,5 мл, 8,5 ммоль). Полученную смесь перемешивали в течение 30 мин с последующим перемешиванием в течение 3 ч при 50 С. После завершения реакции реакционную смесь оставляли охлаждаться. Затем добавляли к ней метанол и концентрировали при пониженном давлении. После этого к концентрату добавляли хлороформ. Смесь промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Высушенную смесь концентрировали при пониженном давлении и очищали хроматографией, получая таким образом 940 мг целевого соединения в виде бесцветного масла (выход 85%). 1 трет-Бутил-2-[3-[2-(N-2-феноксиэтил)аминоэтил]фенокси]пропионат (200 мг, 0,519 ммоль) растворяли в N,N-диметилформамиде. Затем к раствору добавляли 2-хлорбензоксазол (95 мг, 0,623 ммоль) и диизопропилэтиламин (0,1 мл, 0,623 ммоль) и смесь перемешивали в течение ночи при 80 С. После завершения реакции добавляли этилацетат. Осуществляли промывку водой и насыщенным раствором соли с последующей сушкой над сульфатом магния. Реакционную смесь концентрировали при пониженном давлении и очищали хроматографией, получая таким образом 266 мг, стехиометрическое количество,целевого соединения в виде желтого масла. 1 трет-Бутил-2-[3-[2-[N-(бензоксазол-2-ил)-N-2-феноксиэтил]аминоэтил]фенокси]пропионат (266 мг,0,530 ммоль) растворяли в дихлорметане (3 мл). Затем к раствору добавляли трифторуксусную кислоту(1 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции реакционную смесь концентрировали при пониженном давлении и остаток очищали препаративной ТСХ,получая таким образом 115 мг целевого соединения в виде желтого масла (выход 54%). 1
МПК / Метки
МПК: C07D 235/30, A61K 31/424, A61K 31/423, A61P 3/06, C07D 498/04, A61K 31/4184, C07D 263/58, A61K 31/428, A61P 3/10, C07D 277/82, C07D 413/12
Метки: активирующее, содержащая, фармацевтическая, соединение, композиция
Код ссылки
<a href="https://eas.patents.su/30-9374-aktiviruyushhee-ppar-soedinenie-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Активирующее ppar соединение и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Производные 8-хлор-2,3-бензодиазепина
Следующий патент: Исходные композиции для керамических продуктов
Случайный патент: Жидкие композиции солей 4-[2-(4-метилфенилсульфанил)фенил]пиперидина