Циклическое пептидное соединение и его применение, бициклопептидное соединение, пептидное соединение и его применение, фармацевтическая композиция
Формула / Реферат
1. Циклическое пептидное соединение формулы
X-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-Y,
или его фармацевтически приемлемая соль, или пролекарственный предшественник,
где Х выбирают из группы, состоящей из
(a) R1a-Ao-A1-A2-A3-A4-A5-A6-A7-A8-A9-,
(b) R1a-А2-А3-А4-А5-А6-А7-А8-А9-,
(c) R1b-А3-А4-А5-А6-А7-А8-А9-,
(d) R1a-A4-A5-A6-A7-A8-A9-,
(e) R1a-A5-A6-A7-A8-A9-,
(f) R1a-А6-А7-А8-А9-,
(g) R1a-A7-A8-A9-,
(h) R1a-A8-A9-,
(i) R1a-A9-, и
(j) R1a-;
Y выбирают из группы, состоящей из
(а) -R3,
(b) -A28-R3,
(c) -A28-A29-R3,
(d) -A28-A29-A30-R3,
(е) -А28-А29-А30-А31-R3,
(f) -А28-А29-А30-А31-А32-R3,
(g) -А28-А29-А30-А31-А32-А33-R3, и
(h) -А28-А29-А30-А31-А32-А33-А34-R3;
R1a представляет H; алифатическую углеводородную группу, которая может быть прямой или разветвленной и имеет от около 1 до около 20 атомов углерода в цепи (алкил), ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от 6 до около 14 (предпочтительно от около 6 до около 10) атомов углерода, связанную с основной молекулярной частью посредством двухвалентной группы, полученной из насыщенного углеводорода с прямой или разветвленной цепью путем удаления двух атомов водорода (аралкил); или -COR2;
R1b представляет R1a или группу формулы
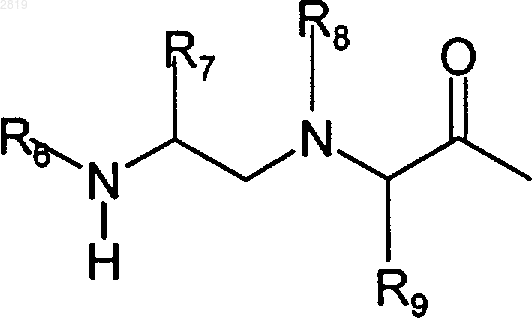
или
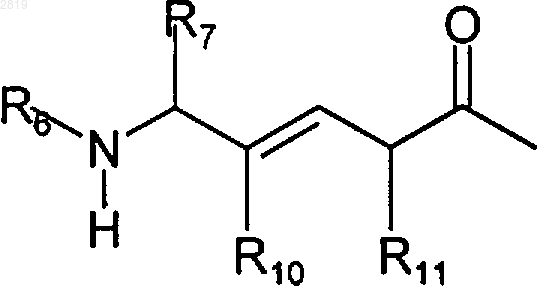
R2 представляет алкил; алифатическую углеводородную группу, которая содержит углерод-углеродную двойную связь и которая может быть прямой или разветвленной группой, имеющей от около 2 до около 20 атомов углерода в цепи (алкенил); алифатическую углеводородную группу, которая содержит углерод-углеродную тройную связь и которая может быть прямой или разветвленной группой, имеющей от около 2 до около 20 атомов углерода в цепи (алкинил), ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от 6 до около 14 (предпочтительно от около 6 до около 10) атомов углерода (арил); или аралкил;
R3 представляет группу формулы А35-ОR4 или A35-NR4R5;
R4 и R5 независимо представляют Н; или алифатическую углеводородную группу, которая может быть прямой или разветвленной и имеет около 1-4 атомов углерода в цепи (низший алкил);
R6 и R9 независимо представляют Н или алкил;
R7 представляет алкил;
R8 представляет Н, алкил или COR2;
R10 представляет Н или галоген;
R11 представляет алкил или аралкил;
Аo отсутствует или представляет пептид, имеющий от одного до шести аминокислотных остатков;
A1 представляет Ser, Ala, Gly или D-Pro или эквивалентную аминокислоту;
A2 представляет Ala, Val или Gly или эквивалентную аминокислоту;
А3 представляет Ala, Ser, Gly или D-Pro или эквивалентную аминокислоту;
А4 представляет Glu, Ala или Gly или эквивалентную аминокислоту;
А5 представляет Ile, His, Ala или Gly или эквивалентную аминокислоту;
А6 представляет Ala, Gln, Gly или D-Pro или эквивалентную аминокислоту,
А7 представляет Ala, Leu, Gly или эквивалентную аминокислоту;
А8 представляет Leu, Nle, Gly или D-Pro или эквивалентную аминокислоту;
А9 представляет His, Ala, D-Pro или Gly или эквивалентную аминокислоту;
А10 представляет Ala, Asn, Asp, Cys, гомо-Cys, Glu, Gly, Lys, Orn, Ser, Thr, D-Pro, -NHCH[(CH2)mNH2]CO- или -NHCH-[(CH2)n CO2H]-CO-;
A11 представляет Ala, Gly, Leu или Lys или эквивалентную аминокислоту;
A12 представляет Ala или Gly или эквивалентную аминокислоту;
А13 представляет Ala, Asn, Asp, Cys, гомо-Cys, Glu, Gly, Lys, Orn, Ser, Thr, -NHCH[(CH2)m NH2]CO- или -NHCH[(СН2)nCO2H]СО-;
A14 представляет Ala, Asn, Asp, Cys, гомо-Cys, Glu, Gly, His, Lys, Orn, Ser, Thr, D-Pro, -NHCH[(CH2)mNH2]CO- или -NHCH[(CH2)nCO2H]CO-;
A15 представляет Ala, Gly, Ile, D-Pro или Leu или эквивалентную аминокислоту;
А16 представляет Asn, Ala, Gly, D-Pro или Gln илиэквивалентную аминокислоту;
A17 представляет Ala, Asn, Asp, Cys, гомо-Cys, Glu, Gly, Lys, Orn, Ser, Thr, D-Pro, -NHCH[(СН2)mNH2]СО- или -NHCH[(CH2)n-CO2H]CO-;
A18 представляет Asp, Cys, гомо-Cys, Glu, His, Leu, Lys, Orn, Nle, Ser, Thr, -NHCH[(СН2)m NH2]СО- или -NHCH[(CH2)nCO2H]CO-;
A19 представляет Arg или Glu или эквивалентную аминокислоту;
A20 представляет Arg или эквивалентную аминокислоту;
A21 представляет Arg, Asp, Cys, гомо-Cys, Glu, Lys, Orn, Ser, Thr, Val, -NHCH[(CH2)m NH2]CO- или -NHCH[(СН2)nCO2H]CO-;
A22 представляет Asp, Cys, гомо-Cys, Glu, His, Lys, Orn, Phe, Ser, Thr, -NHCH[(CH2)m NH2]CO- или -NHCH[(CH2)nCO2H]CO-;
А23 представляет Leu, Phe или Trp или эквивалентную аминокислоту;
A24 представляет Leu или эквивалентную аминокислоту;
A25 представляет Arg, Asp, Cys, гомо-Cys, Glu, His, Lys, Orn, D-Pro, Ser, Thr, -NHCH [(CH2)mNH2]CO- или -NHCH[(CH2)nCO2H]CO-;
А26 представляет Asp, Cys, гомо-Cys, Glu, His, Lys, Orn, Ser, Thr, -NHCH(CH2)mNH2)CO- или -NHCH[(СН2)nСО2Н]СО-;
A27 представляет Leu или Lys или эквивалентную аминокислоту;
А28 представляет Ilе или Leu или эквивалентную аминокислоту;
А29 представляет Ala, Asp, Cys, гомо-Cys, Glu, Gln, Lys, Orn, Ser, Thr, -NHCH[(CH2)m NH2]CO- или -NHCH[(СН2)nСО2Н]СО-;
А30 представляет Asp, Cys, гомо-Cys, Glu, Gly, Lys, Orn, Ser, Thr, -NHCH[(CH2)mNH2]CO- или -NHCH[(CH2)nСО2Н]СО-;
m равно 1, 2 или 3;
n равно 3 или 4;
А31 представляет Ile, Leu или Val шыш эквивалентную аминокислоту;
А32 представляет His или эквивалентную аминокислоту;
А33 представляет Asn или Thr или эквивалентную аминокислоту; и
А34 представляет Аlа или Phe или эквивалентную аминокислоту;
А35 отсутствует или представляет пептид из 1-4 аминокислот; и
боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков А10 и A14, А13 и A17, А14 и A18, A17 и A21, A18 и А22, A21 и А25, А25 и A29, и А26 и А30 связаны посредством амидной, сложноэфирной, дисульфидной или лантиониновой связи с образованием мостика, а боковая цепь каждого из следующих аминокислотных остатков А10, А13, A14, A17, A18, A21, А22, A25, A26, А29 и А30 участвует, по большей части, в образовании единственного мостика; при условии, что если боковые цепи А13 и A17 или A26 и А30 связаны посредством амидной, дисульфидной или лантиониновой связи с образованием мостика, то боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков А10 и A14, А14 и A18, A17 и A21, A18 и А22, A21 и A25, и А25 и А29 также связаны посредством амидной, сложноэфирной, дисульфидной или лантиониновой связи.
2. Пептидное соединение по п.1 или его фармацевтически приемлемая соль или его пролекарственный предшественник, отличающееся тем, что мостик, образованный из боковых цепей одной пары аминокислотных остатков, не перекрывается с мостиком, образованным между боковыми цепями другой пары аминокислотных остатков.
3. Пептидное соединение по п.2, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что
А10 представляет Ala, Asn, Asp, Gly или Lys;
A13 представляет Ala, Gly или Lys;
A14 представляет Ala, Asp, Gly, His, Lys или Ser;
A17 представляет Ala, Asp, Gly, Lys или Ser;
A18 представляет Asp, Leu, Lys, Orn или Nle;
A21 представляет Arg, Asp, Lys или Val;
A22 представляет Asp, Glu, Lys, Orn или Phe;
А25 представляет Arg, Asp, Glu, His или Lys;
А26 представляет His или Lys;
A29 представляет Ala, Asp, Glu или Gln;
А30 представляет Asp, Glu или Lys и
боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков А10 и A14, А13 и A17, A14 и A18, A17 и A21, A18 и А22, A21 и А25, A25 и A29, А26 и А30 связаны посредством амидной связи с образованием мостика, а боковая цепь каждого из А10, А13, A14, A17, A18, A21, А22, A25, А26, A29 и А30 участвует, по большей части, в образовании единственного мостика; при условии, что
(a) если боковые цепи A13 и A17 связаны посредством амидной связи с образованием мостика, то боковые цепи, по крайней мере, одной из пар A18 и A22, A21 и A25 и A25 и А29 также связаны посредством амидной связи;
(b) если боковые цепи аминокислотных остатков А26 и А30 связаны посредством амидной связи с образованием мостика, то боковые цепи, по крайней мере, одной из пар А10 и A14, A14 и A18, A17 и A21, А18 и A22 и A21 и A25, также связаны посредством амидной связи и
(c) если боковые цепи аминокислотных остатков А13 и A17 и A26 и А30 связаны посредством амидной связи с образованием мостика, то боковые цепи A18 и A22 и A21 и A25 также связаны посредством амидной связи.
4. Пептидное соединение по п.3, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что R1a представляет Н, a Y представляет NН2.
5. Пептидное соединение по п.4, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что Х представляет
(a) R1a-A1-A2-A3-A4-A5-A6-A7-A8-A9-,
(b) R1a-A2-A3-A4-A5-A6-A7-A8-A9- или
(c) R1a-А3-А4-А5-А6-А7-А8-А9-.
6. Пептидное соединение по п.5, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что A1 представляет Аlа, Gly или D-Pro; A8 представляет Nle и А27 представляет Leu.
7. Пептидное соединение по п.6, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что
(i) боковые цепи А10 и A14 связаны посредством амидной связи с образованием мостика;
(ii) боковые цепи A14 и A18 связаны посредством амидной связи с образованием мостика;
(iii) боковые цепи A17 и A21 связаны посредством амидной связи с образованием мостика;
(iv) боковые цепи A18 и A22 связаны посредством амидной связи с образованием мостика;
(v) боковые цепи A21 и А25 связаны посредством амидной связи с образованием мостика; или
(vi) боковые цепи A25 и А29 связаны посредством амидной связи с образованием мостика.
8. Пептидное соединение по п.7, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asp или Lys; А13 представляет Lys; A14 представляет Asp или Lys; A17 представляет Asp или Ser; A18 представляет Nle; A21 представляет Arg или Val; A22 представляет Glu или Phe; A25 представляет Arg или His; A26 представляет Lys или His; A29 представляет Ala или Gln; и А30 представляет Asp или Glu, а боковые цепи А10 и A14 связаны амидной связью с образованием мостика.
9. Пептидное соединение по п.7, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; А13 представляет Lys; А14 представляет Asp или Lys; A17 представляет Asp или Ser; A18 представляет Nle; A21 представляет Arg или Val; A22 представляет Glu или Phe; A25 представляет Arg или His; А26 представляет His или Lys; А29 представляет Ala или Gln и А30 представляет Asp или Glu, а боковые цепи A14 и A18 связаны амидной связью с образованием мостика.
10. Пептидное соединение по п.7 или его фармацевтически приемлемая соль или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; А13 представляет Lys; A14 представляет His или Ser; A17 представляет Asp или Lys; A18 представляет Nle; A21 представляет Asp или Lys; A22 представляет Glu или Phe; A25 представляет Arg или His; A26 представляет His или Lys; А29 представляет Ala или Gln; и А30 представляет Asp или Glu, а боковые цепи A17 и A21 связаны амидной связью с образованием мостика.
11. Пептидное соединение по п.7, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; А13 представляет Lys; А14 представляет His или Ser; A17 представляет Asp или Ser; A18 представляет Asp, Lys или Orn; A21 представляет Arg или Val; A22 представляет Asp, Glu, Lys или Orn; A25 представляет Arg или His; А26 представляет His или Lys; А29 представляет Ala или Gln и А30 представляет Asp или Glu, а боковые цепи A18 и А22 связаны амидной связью с образованием мостика.
12. Пептидное соединение по п.7, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; A13 представляет Lys; A14 представляет His или Ser; A17 представляет Asp или Ser; A18 представляет Nle; A21 представляет Asp или Lys; А22 представляет Glu или Phe; A25 представляет Asp или Lys; А26 представляет His или Lys; A29 представляет Ala или Gln; А30 представляет Asp или Glu и боковые цепи A21 и A25 связаны амидной связью с образованием мостика.
13. Пептидное соединение по п.7, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; А13 представляет Lys; A14 представляет His или Ser; A17 представляет Asp или Ser; A18 представляет Nle; A21 представляет Arg или Val; A22 представляет Glu или Phe; A25 представляет Asp или Lys; A26 представляет His или Lys; А29 представляет Asp или Lys и А30 представляет Asp или Glu, а боковые цепи А25 и А29 связаны амидной связью с образованием мостика.
14. Пептидное соединение по п.6, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что
(i) боковые цепи А13 и A17 связаны амидной связью и боковые цепи A18 и A22 связаны амидной связью с образованием мостика; и
(ii) боковые цепи A18 и А22 связаны амидной связью и боковые цепи А26 и А30 связаны амидной связью с образованием мостика.
15. Пептидное соединение по п.14, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; A13 представляет Lys или Asp; A14 представляет His или Ser; A17 представляет Lys или Asp; A18 представляет Lys или Asp; A21 представляет Val или Arg; А22 представляет Glu, Lys или Asp; A25 представляет Arg или His; A26 представляет His или Lys, А29 представляет Ala или Gln; и А30 представляет Asp или Glu; и боковые цепи A13 и A17 связаны амидной связью; и боковые цепи A18 и A22 связаны амидной связью с образованием мостика.
16. Пептидное соединение по п.14, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; A13 представляет Lys; A14 представляет His или Ser; A17 представляет Ser или Asp; A18 представляет Lys или Asp; A21 представляет Val или Arg; A22 представляет Glu, Lys или Asp; A25 представляет Arg или His; A26 представляет Lys или Asp; A29 представляет Ala или Gln; и А30 представляет Lys или Asp; и боковые цепи A18 и A22 связаны амидной связью; и боковые цепи А26 и А30 связаны амидной связью с образованием мостика.
17. Пептидное соединение по п.6, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что боковые цепи A13 и A17 связаны амидной связью, боковые цепи A18 и А22 связаны амидной связью и боковые цепи А26 и А30 связаны амидной связью с образованием мостика.
18. Пептидное соединение по п.17, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; A13 представляет Lys или Asp; A14 представляет His или Ser; A17 представляет Lys или Asp; A18 представляет Lys или Asp; A21 представляет Val или Arg; A22 представляет Glu, Lys или Asp; A25 представляет Arg или His; A26 представляет Lys или Asp; А29 представляет Ala или Gln и А30 представляет Lys или Asp.
19. Пептидное соединение по п.4, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что Х представляет
(a) R1a-A4-A5-A6-A7-A8-A9-,
(b) R1a-A5-A6-A7-A8-A9-,
(c) R1a-A6-A7-A8-A9-,
(d) R1a-A7-A8-A9-,
(e) R1a-А8-А9-,
(f) R1a-A9-, и
(g) R1a-;
20. Пептидное соединение по п.19, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что A8 представляет Nle, а А27 представляет Leu.
21. Пептидное соединение по п.20, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что боковые цепи A18 и А22 связаны амидной связью с образованием мостика.
22. Пептидное соединение по п.21, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что А10 представляет Asn или Asp; A13 представляет Lys; А14 представляет His или Ser; A17 представляет Asp или Ser; A18 представляет Asp, Lys или Orn; A21 представляет Arg или Val; А32 представляет Asp, Glu, Lys или Orn; A25 представляет Arg или His; A26 представляет His или Lys; А29 представляет Ala или Gln; и А30 представляет Asp или Glu.
23. Пептидное соединение по п.1, выбранное из
цикло(К18-D22)[A1,Nle8,K18,D22,L27]hРТН(1-31)NН2 (SEQ ID No: 3);
цикло(K18-D22)[A1,2,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 5);
циклo(K18-D22)[A1,3,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 6);
цикло(K18-D22)[A1,4,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 7);
циклo(K18-D22)[A1,5,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 8);
цикло(K18-D22)[A1,6,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 9);
цикло(K18-D22)[A1,7,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 10);
цикло(K18-D22)[A1,9,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 11);
цикло(K18-D22)[A1,10,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 12);
цикло(K18-D22)[A1,11,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 13);
цикло(K18-D22)[A1,12,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 14);
цикло(K18-D22)[A1,13,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 15);
цикло(K18-D22)[A1,14,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 16);
цикло(K18-D22)[A1,15,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 17);
цикло(K18-D22)[A1,16,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 18);
цикло(K18-D22)[A1,17,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 19);
цикло(K18-D22)[G1,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 20);
цикло(K18-D22)[A1,G2,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 21);
цикло(K18-D22)[A1,G3,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 22);
цикло(K18-D22)[A1,G4,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 23);
цикло(K18-D22)[A1,G5,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 24);
цикло(K18-D22)[A1,G6,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 25);
цикло(K18-D22)[A1,G7,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 26);
цикло(K18-D22)[A1,G8,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 27);
цикло(K18-D22)[A1,G9,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 28);
цикло(K18-D22)[A1,G10,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 29);
цикло(K18-D22)[A1,G11,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 30);
цикло(K18-D22)[A1,G13,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 31);
цикло(K18-D22)[A1,G14,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 32);
цикло(K18-D22)[A1,G15,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 33);
цикло(K18-D22)[A1,G16,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 34);
цикло(K18-D22)[A1,G17,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 35);
цикло(K18-D22)[D-P1,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 36);
цикло(K18-D22)[A1,D-P3,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 37);
цикло(K18-D22)[A1,D-P6,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 38);
цикло(K18-D22)[A1,D-P7,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 39);
цикло(K18-D22)[A1,D-P9,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 40);
цикло(K18-D22)[A1,D-P10,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 41);
цикло(K18-D22)[A1,D-P14,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 42);
цикло(К18-D22)[A1,D-P15,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 43);
цикло(K18-D22)[A1,D-P16,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 44);
цикло(K18-D22)[A1,D-P17,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 45);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-34)NH2 (SEQ ID No: 46);
циклo(K18-D22)[A1,Nle8,D18,K22,L27]hPTH(1-31)NH2 (SEQ ID No: 47);
цикло(O18-D22)[A1,Nle8,O18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 48);
цикло(D18-O22)[A1,Nle8,D18,O22,L27]hPTH(1-31)NH2 (SEQ ID No: 49);
цикло(K18-E22)[A1,Nle8,K18,E22,L27]hPTH(1-31)NH2 (SEQ ID No: 50);
цикло(O18-E22)[A1,Nle8,O18,E22,L27]hPTH(1-31)NH2 (SEQ ID No: 51);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-30)NH2 (SEQ ID No: 52);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-29)NH2 (SEQ ID No: 53);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-28)NH2 (SEQ ID No: 54);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-27)NH2 (SEQ ID No: 55);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(3-31)NH2 (SEQ ID No: 63);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(2-31)NH2 (SEQ ID No: 64);
цикло(K10-D14)[A1,Nle8,18,K10,D14,L27]hPTH (1-31)NH2 (SEQ ID No: 66);
цикло(K14-D18)[A1,Nle8,K14,D18,L27]hPTH(1-31)NH2 (SEQ ID No: 67);
цикло(K17-D21)[A1,Nle8,18,K17,D21,L27]hPTH(1-31)NH2 (SEQ ID No: 68);
цикло(K21-D25)[A1,Nle8,18,K21,D25,L27]hPTH(1-31)NH2 (SEQ ID No: 69);
цикло(K25-D29)[A1,Nle8,18,K25,D29,L27]hPTH(1-31)NH2 (SEQ ID No: 70);
цикло(K18-D22)[K18,D22]hPTHrP(1-34)NH2 (SEQ ID No: 71);
цикло(K18-D22)[K18,26,30,D22,L23,28,31,E25,29]hPTHrP(1-34)NH2 (SEQ ID No: 72);
бицикло(K13-D17,K18-D22)[A1,Nle8,D17-22,K18,L27]hPTH(1-31)NH2 (SEQ ID No: 73);
бицикло(K18-D22,K26-D30)[A1,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 74) и
тpициклo(K13-D17,K18-D22,K26-D30)[A1,Nle8,K18,D17,22,L27]hPTH(1-31)NH2 (SEQ ID No:80),
или их фармацевтически приемлемые соли, или пролекарственные предшественники.
24. Пептидное соединение по п.1, выбранное из
циклo(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 3);
циклo(K18-D22)[A1,10,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 12);
циклo(K18-D22)[A1,G13,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 31);
цикло(D18-K22)[A1,Nle8,D18,K22,L27]hPTH(1-31)NH2 (SEQ ID No: 47);
цикло(K18-E22)[A1,Nle8,K18,E22,L27]hPTH(1-31)NH2 (SEQ ID No: 50);
цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(1-30)NH2 (SEQ ID No: 52);
цикло(K18-D22)[K18,D22]hPTHrP(1-34)NH2 (SEQ ID No: 71);
бициклo(K13-D17,K18-D22)[A1,Nle8,D17,22,K18,L27]hPTH(1-31)NH2 (SEQ ID No: 73);
бициклo(K18-D22,K26-D30)[A1,Nle8,K18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 74) и
трицикло(K13-D17,K18-D22,K26-D30)[A1,Nle8,K18,D17,22,L27]hPTH(1-31)NH2 (SEQ ID No: 80),
или их фармацевтически приемлемые соли, или пролекарственные предшественники.
25. Пептидное соединение по п.1, выбранное из
цикло(K18-D22)[K18,D22,L27]hPTH(10-31)NH2 (SEQ ID No: 56);
цикло(K18-D22)[K18,D22,L27]hPTH(9-31)NH2 (SEQ ID No: 57);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(8-31)NH2 (SEQ ID No: 58);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(7-31)NH2 (SEQ ID No: 59);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(6-31)NH2 (SEQ ID No: 60);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(5-31)NH2 (SEQ ID No: 61);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(4-31)NH2 (SEQ ID No: 62);
цикло(K18-D22)[Nle8,K18,D22,L27]hPTH(7-34)NH2 (SEQ ID No: 65) и
цикло(K18-D22)[K18,D22]hPTHrP(7-34)NH2 (SEQ ID No: 77),
или их фармацевтически приемлемая соль, или пролекарственный предшественник.
26. Пептидное соединение по п.1, которое представляет собой цикло(К18-D22)[D-Р1,Nle8,К18,D22,L27]hРТН(1-31)NH2 (SEQ ID No: 36), или его фармацевтически приемлемую соль, или пролекарственный предшественник;
27. Пептидное соединение по п.1, которое представляет собой цикло(D18-K22)[A1,Nle8,D18,K22,L27]hPTH(1-31)NH2 (SEQ ID No: 47), или его фармацевтически приемлемую соль, или пролекарственный предшественник.
28. Пептидное соединение по п.1, которое представляет собой циклo(K18-E22)[A1,Nle8,K18,E22,L27]hPTH(1-31)NH2 (SEQ ID No: 50), или его фармацевтически приемлемую соль, или пролекарственный предшественник.
29. Бициклопептидное соединение формулы бицикло(К13-D17,K26-D30)[A1,Nle8,18,D17,L27]hPTH(1-31)NH2 (SEQ ID No: 79), или его фармацевтически приемлемая соль, или пролекарственный предшественник.
30. Пептидное соединение формулы
X-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-Y,
или его фармацевтически приемлемая соли, или пролекарственный предшественник,
где Х выбирают из группы, состоящей из
(a) R1a-Ao-A1-A2-A3-A4-A5-A6-A7-A8-A9-,
(b) R1a-A2-A3-A4-A5-A6-A7-A8-A9-,
(c) R1b-А3-А4-А5-А6-А7-А8-А9-,
(d) R1a-A4-A5-A6-A7-A8-A9-,
(e) R1a-A5-A6-A7-A8-A9-,
(f) R1a-A6-A7-A8-A9-,
(g) R1a-A7-A8-A9-,
(h) R1a-A8-A9-,
(i) R1a-A9-, и
(j) R1a-;
Y выбирают из группы, состоящей из
(а) -R3,
(b) -A28-R3,
(c) -A28-A29-R3,
(d) -А28-А29-А30-R3,
(e) -А28-А29-А30-А31-R3,
(f) -А28-А29-А30-А31-А32-R3,
(g) -А28-А29-А30-А31-А32-А33-R3, и
(h) -А28-А29-А30-А31-А32-А33-А34-R3;
R1a представляет H, алкил, аралкил или -COR2;
R1b представляет R1a или группу формулы
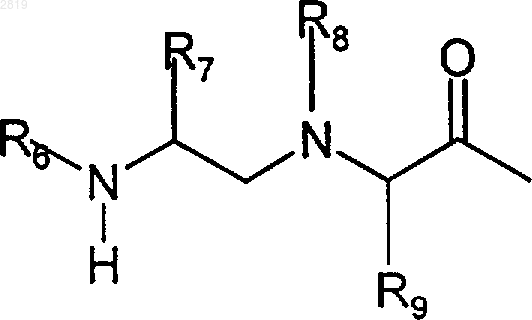
или
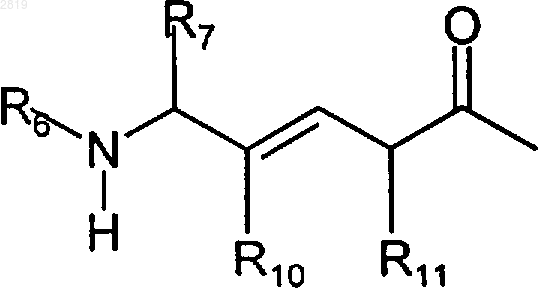
R2 представляет алкил, алкенил, алкинил, арил или аралкил;
R3 представляет группу формулы А35-ОR4 или A35-NR4R5;
R4 и R5 независимо представляют Н или низший алкил;
R6 и R9 независимо представляют Н или алкил;
R7 представляет алкил;
R8 представляет Н, алкил или COR2;
R10 представляет Н или галоген;
R11 представляет алкил или аралкил;
Аo отсутствует или представляет пептид, имеющий от одного до шести аминокислотных остатков;
A1 представляет Ser, Ala, Gly или D-Pro или эквивалентную аминокислоту;
А2 представляет Ala, Val или Gly или эквивалентную аминокислоту;
А3 представляет Ala, Ser, Gly или D-Pro или эквивалентную аминокислоту;
А4 представляет Glu, Ala или Gly или эквивалентную аминокислоту ;
A5 представляет Ile, His, Ala или Gly или эквивалентную аминокислоту;
A6 представляет Ala, Gln, Gly или D-Pro или эквивалентную аминокислоту;
А7 представляет Ala, Leu, Gly или эквивалентную аминокислоту;
A8 представляет Leu, Nle или Gly или D-Pro или эквивалентную аминокислоту;
А9 представляет His, Ala, D-Pro или Gly или эквивалентную аминокислоту;
А10 представляет Ala, Asn, Gly, Lys, Asp или D-Pro или эквивалентную аминокислоту;
А11 представляет Ala, Gly, Leu или Lys или эквивалентную аминокислоту;
A12 представляет Ala или Gly или эквивалентную аминокислоту;
А13 представляет Ala, Gly или Lys или эквивалентную аминокислоту;
A14 представляет Ala, Gly, His, Ser, Asp, Lys или D-Pro или эквивалентную аминокислоту;
A15 представляет Ala, Gly, Ile, D-Pro или Leu или эквивалентную аминокислоту;
A16 представляет Asn, Ala, Gly, D-Pro или Gln или эквивалентную аминокислоту;
A17 представляет Ala, Asp, Gly, Ser, Lys или D-Pro или эквивалентную аминокислоту;
A18 представляет Lys или эквивалентную аминокислоту;
А19 представляет Arg или Glu или эквивалентную аминокислоту;
А20 представляет Arg или эквивалентную аминокислоту;
A21 представляет Arg, Lys, Asp или Val или эквивалентную аминокислоту;
А22 представляет Asp, Lys, Orn или Glu или эквивалентную аминокислоту;
А23 представляет Leu, Phe или Trp или эквивалентную аминокислоту;
А24 представляет Leu или эквивалентную аминокислоту;
A25 представляет Arg, His, Asp, Lys или Glu или эквивалентную аминокислоту;
А26 представляет Lys или His или эквивалентную аминокислоту;
А27 представляет Leu или Lys или эквивалентную аминокислоту;
А28 представляет Ilе или Leu или эквивалентную аминокислоту;
А29 представляет Ala, Asp, Glu или Gln или эквивалентную аминокислоту;
А30 представляет Asp, Lys или Glu или эквивалентную аминокислоту;
А31 представляет Ile, Leu или Val или эквивалентную аминокислоту;
А32 представляет His или эквивалентную аминокислоту;
А33 представляет Asn или Thr или эквивалентную аминокислоту; и
А34 представляет Аlа или Phe или эквивалентную аминокислоту и
А35 отсутствует или представляет пептид из 1-4 аминокислот;
31. Пептидное соединение по п.30, которое представляет собой [А1,Nle8,К18,D22,L27]hPTH(1-31)NH2 (SEQ ID No: 4), или его фармацевтически приемлемую соль, или пролекарственный предшественник.
32. Пептидное соединение по п.30, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что R1a представляет Н, a Y представляет NH2.
33. Пептидное соединение по п.30, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что Х представляет
(a) R1a-А1-А2-А3-А4-А5-А6-А7-А8-А9-,
(b) R1a-А2-А3-А4-А5-А6-А7-А8-А9- или
(c) R1a-А3-А4-А5-А6-А7-А8-А9-.
34. Пептидное соединение по п.33, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что
A1 представляет Ser, Ala, Gly или D-Pro;
A2 представляет Ala, Val или Gly;
А3 представляет Ala, Ser, Gly или D-Pro;
A4 представляет Glu, Ala или Gly;
A5 представляет Ile, His, Ala или Gly;
A6 представляет Ala, Gln, Gly или D-Pro;
A7 представляет Ala, Leu, Gly;
A8 представляет Leu, Nle или Gly или D-Pro;
А9 представляет His, Ala, Gly или D-Pro;
A10 представляет Ala, Asn, Gly, Lys, Asp или D-Pro;
A11 представляет Ala, Gly, Leu или Lys;
A12 представляет Ala или Gly;
А13 представляет Ala, Gly или Lys;
A14 представляет Ala, Gly, His, Ser или D-Pro;
A15 представляет Ala, Gly, Ile или D-Pro;
A16 представляет Asn, Ala, Gly, D-Pro или Gln;
A17 представляет Ala, Asp, Gly, Ser или D-Pro;
A18 представляет Lys;
A19 представляет Arg или Glu;
A20 представляет Arg;
A21 представляет Arg или Val;
A22 представляет Asp, Lys, Orn или Glu;
А23 представляет Leu, Phe или Trp;
A24 представляет Leu;
A25 представляет Arg или His;
A26 представляет Lys или His;
A27 представляет Leu или Lys;
A28 представляет Ile или Leu или эквивалентную аминокислоту;
А29 представляет Ala или Gln;
А30 представляет Asp или Glu;
А31 представляет Ile, Leu или Val;
А32 представляет His;
А33 представляет Asn или Thr; и
А34 представляет Ala или Phe.
35. Пептидное соединение по п.34 или его фармацевтически приемлемая соль или его пролекарственный предшественник, отличающееся тем, что A1 представляет Ala, Gly или D-Pro; А8 представляет Nle; А22 представляет Asp и A27 представляет Leu.
36. Пептидное соединение по п.35, или его фармацевтически приемлемая соль, или его пролекарственный предшественник, отличающееся тем, что Х представляет R1a-A1-A2-A3-A4-A5-A6-A7-A8-A9-.
37. Фармацевтическая композиция, содержащая эффективное количество пептидного соединения по п.1 или 30, или его фармацевтически приемлемой соли, или его пролекарственного предшественника, и фармацевтически приемлемый носитель.
38. Применение пептидного соединения по любому из пп.1, 4, 5 или 30 или его фармацевтически приемлемой соли для получения лекарства для лечения болезненных состояний, связанных с регуляцией кальция.
39. Применение пептидного соединения по п.38, отличающееся тем, что заболевания, связанные с регуляцией кальция в организме, выбирают из гипокальциемии; остеопении; остеопороза; гиперпаратиреоза; гипопаратиреоза; остеопении, индуцированной глюкокортикоидами и иммунодепрессантами; перелома костей и повторного перелома костей.
40. Применение пептидного соединения по любому из пп.4, 5 или 30, или его фармацевтически приемлемой соли, или его пролекарственного предшественника для получения лекарства для лечения остеопении и остеопороза.
41. Применение пептидного соединения по п.19, или его фармацевтически приемлемой соли, или его пролекарственного предшественника для получения лекарства для лечения заболеваний, связанных с регуляцией кальция.
42. Применение пептидного соединения по п.41, отличающееся тем, что заболевания, связанные с регуляцией кальция в организме, выбирают из гиперпаратиреоза; гиперкальциемического криза, связанного с гиперпаратиреозом; гиперкальциенемии при злокачественных опухолях, почечной недостаточности и гипертонии.
43. Применение пептидного соединения по п.33, отличающееся тем, что лекарство предназначено для периодического подкожного или внутрилегочного введения.
Текст
1 Область к которой относится изобретение Настоящее изобретение относится к соединениям и к их получению, к фармацевтическим композициям, содержащим такие соединения, и к их использованию для лечения физиологических состояний, которые могут быть модулированы под действием агонистической или антагонистической активности, направленной на рецепторы паратиреоидного гормона. Более конкретно, настоящее изобретение относится к пептидным аналогам паратиреоидного гормона и к белковым аналогам, родственным пептидному паратиреоидному гормону. Предпосылки создания изобретения Паратиреоидный гормон человека (hPTH) представляет собой белок, состоящий из 84 аминокислот, который является главным регулятором гомеостаза кальция. Белок, родственный паратиреоидному гормону (hPTHrP), представляет собой белок, состоящий из 139-171 аминокислот и имеющий N-концевую гомологию с hPTH. N-концевые фрагменты hPTH иhPTHrP, а, в частности, фрагменты, состоящие из аминокислот 1-34, сохраняют полную биологическую активность исходного гормона.hPTH(1-34) имеет следующую аминокислотную последовательность:hPTHrP имеет следующую аминокислотную последовательность:Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-AspLys-Gly-Lys-Ser-Ile-GIn-Asp-Leu-Arg-Arg-ArgPhe-Phe-Leu-His-His-Leu-Ile-Ala-Glu-Ile-His-ThrAla (SEQ ID No: 2). Биологическая активность hPTH заключается в активации двух систем вторичного мессенджера: связанной с G-белком активности аденилилциклазы (АС) и связанной и не связанной с G-белком активности протеинкиназы С(РКС). Было продемонстрировано, что Nконцевые фрагменты hPTH(1-34)OH и hPTH(131)NH2 обладают анаболической активностью,направленной на формирование костей у человека и у овариэктомизованных крыс, соответственно. Было также продемонстрировано, что это увеличение роста кости связано со стимуляцией аденилилциклазной активности. Аналоги этихN-концевых фрагментов обладают значительной терапевтической активностью, которая может быть использована для лечения физиологических состояний, связанных с регуляцией кальция в клетках кости, включая: гипокальциемию; остеопороз; остеопению; и расстройства, связанные с остеопорозом и остеопенией, такие как гиперпаратиреоз, гипопаратиреоз и синдром Кушинга; для лечения остеопении, индуцированной глюкокортикоидами и иммунодепрессантами; и для сращивания кости после перелома и после повторного перелома.N-конца hPTH(1-34) вплоть до 6 аминокислотных остатков значительно снижает способность полученного аналога стимулировать аденилилциклазу, но, при этом, оказывает незначительное действие на связывание с рецептором. Таким образом, аналоги hPTH(1-34), укороченные у своего N-конца на вплоть до 6 аминокислотных остатков, ингибируют действие РТН и могут быть использованы для лечения расстройств, характеризующихся избытком РТН,таких как гиперпаратиреоз и гиперкальциемический криз, связанный с гиперпаратиреозом, гиперкальциемия при злокачественных опухолях,почечная недостаточность и гипертензия. Ациклические аналоги hPTH(1-27)-(1-34) описаны в патенте США 4086196. Ациклические аналоги hPTH(1-34) и hPTHrP(1-34) описаны в патенте США 5589452. [Nle8, NIe18,Туr34 или Phe34] hPTH (1-34) описаны в патенте США 4656250. [NIe8, NIe18, Туr34] hPTH(1-34) и их N-усеченные производные описаны в патентах США 4771124 и 4423037. Другие ациклические аналоги РТН(1-34) описаны в патентах США 5723577 и 5434246, WO 97/02834, ЕРА 561412-А 1, ЕРА 747817 А 2, WO 94/02510, WО 96/03437 и WO 95/11988-A1. Аналоги hPTH (1-28 )NH2-hPTH( 1-31 )NH2 и[Leu27hPTH(1-28)NH2-[Leu27]hPTH(1-33)NH2 описаны в патенте США 5556940. Ациклические антагонисты рецептора РТН, включая усеченные по N-концу аналоги РТН, описаны в патентах США 5446130, 5229489, 4771124 и 4423037. Были описаны циклические и бициклические аналоги hPTH и hPTHrP. Цикло(Lys26Asp30)[Leu27]hPTH(1-34)NH2 и цикло(Lys27Asp30) hPTH(1-34)NH2 описаны и патенте США 5556940. Цикло(Lys26-Asp30)[Leu27]hPTH(131)NH2,цикло(Glu22-Lys26)[Leu27]hPTH(1-31)NH2 и цикло(Lys27-Asp30)hPTH(1-31)NH2 описаны Barbier et al., J.Med. Chem., 1997, 40, 1373. Моноциклические и бициклические производные hPTH(1-34) или hPTHrP(1-34) описаны в патентных документах WO 96/40193, DE 19508672-A1 и A.Bisello et al., Biochemistry 1997, 36, 3293. Цикло(Lys13-Asp17)hPTHrP(734)NH2, сильный антагонист рецептора РТН,описан М. Chorev et al., Biochemistry 1991, 30,5698. Также, Kanmera и др. описали ряд амидсодержащих аналогов hPTHrP, Peptide Chemistry 1993: Okada Y. ed;Protein Research Foundation, Osaka 1994,321-324. Краткое описание изобретения Настоящее изобретение относится к циклическому пептидному соединению формулы I;(I) или к его фармацевтически приемлемой соли или пролекарственному предшественнику,гдеR3 представляет группу формулы А 35-ОR4 или A35-NR4R5;R11 представляет алкил или аралкил;n равно 3 или 4; Аo отсутствует или представляет пептид,имеющий от одного до шести аминокислотных остатков; 5 А 33 представляет Asn или Thr или эквивалентную аминокислоту; А 34 представляет Ala или Phe или эквивалентную аминокислоту; А 35 отсутствует или представляет пептид из 1-4 аминокислот, и боковые цепи, по крайней мере одной из следующих пар аминокислотных остатков А 10 и А 14, А 13 и A17, А 14 и А 18, А 17 и A21, A18 и A22, A21 и A25, A25 и А 29, и A26 и А 30 связаны посредством амидной, сложноэфирной, дисульфидной или лантиониновой связи с образованием мостика, а боковая цепь каждого из следующих аминокислотных остатков А 10, А 13, А 14, А 17, A18, A21, A22,A25, A26, А 29 и А 30 участвует, по большей части,в образовании одного мостика; при условии, что если боковые цепи следующих пар аминокислотных остатков А 13 и A17 или А 26 и А 30 связаны посредством амидной, дисульфидной или лантиониновой связи с образованием мостика, то боковые цепи, по крайней мере одной из следующих пар аминокислотных остатков А 10 иA14, A14 и A18, A17 и A21, A18 и A22, A21 и A25 и A25 и A29 также связаны посредством амидной,сложноэфирной, дисульфидной или лантиониновой связи. В другом своем аспекте настоящее изобретение относится к пептидному соединению формулы IIA21-A22-A23-A24-A25-A26-A27-Y или к его фармацевтически приемлемой соли или пролекарственному предшественнику:R3 представляет группу формулы A35-OR4 или А 35-NR4R5;R11 представляет алкил или аралкил; Аo отсутствует или представляет пептид,имеющий от одного до шести аминокислотных остатков;A29 представляет Ala, Asp, Glu или Gln или эквивалентную аминокислоту; А 30 представляет Asp, Lys или Glu или эквивалентную аминокислоту; А 31 представляет Ile, Leu или Val или эквивалентную аминокислоту; А 32 представляет His или эквивалентную аминокислоту; А 33 представляет Asn или Thr или эквивалентную аминокислоту; и А 34 представляет Аla или Phe или эквивалентную аминокислоту; и А 35 отсутствует или представляет пептид,состоящий из 1-4 аминокислот. Пептидные соединения настоящего изобретения обладают ценными свойствами, а более конкретно, фармацевтическими свойствами. Они являются особенно ценными для лечения патологических состояний, которые могут быть подвергнуты модулированию под действием соединений, связывающихся с рецепторами паратиреоидных гормонов с сопутствующей стимуляцией аденилилциклазной активности или без указаннной стимуляции. Поэтому настоящее изобретение также относится к фармацевтическому использованию пептидных соединений и фармацевтических композиций, содержащих эти пептидные соединения. Подробное описание изобретения Следует отметить, что, если это не оговорено особо, то нижеуказанные термины, используемые выше и во всем описании, имеют следующие значения. Определение терминов Термин "пациент" относится как к человеку, так и к другим млекопитающим. Термин "алкил" означает алифатическую углеводородную группу, которая может быть прямой или разветвленной и имеет от около 1 до около 20 атомов углерода в цепи. Термин "разветвленный" означает, что одна или несколько низших алкильных групп связаны с линейной алкильной цепью. Термин "низший алкил" означает цепь,имеющую около 1-4 атомов углерода, которая может быть прямой или разветвленной. Примерами алкильных групп являются метил, этил, ни изопропил, н-, втор-, изо- и трет-бутил и т.п. 8 Термин "алкенил" означает алифатическую углеводородную группу, которая содержит углерод-углеродную двойную связь и которая может быть прямой или разветвленной группой, имеющей от около 2 до около 20 атомов углерода в цепи. Термин "низший алкенил" означает группу, имеющую около 2-4 атомов углерода в цепи,которая может быть прямой или разветвленной. Примерами алкенильных групп являются этенил, пропенил, н-бутенил, изо-бутенил, 3 метилбут-2-енил, н-пентенил, гептенил, октенил, циклогексилбутенил и деценил. Термин "алкинил" означает алифатическую углеводородную группу, которая содержит углерод-углеродную тройную связь и которая может быть прямой или разветвленной группой, имеющей от около 2 до около 20 атомов углерода в цепи. Термин "низший алкинил" означает группу, имеющую около 2-4 атомов углерода в цепи,которая может быть прямой или разветвленной. Примерами алкинильных групп являются этинил, пропинил, н-бутинил, 3-метилбут-2-инил,н-пентинил, гептинил, октинил и децинил. Термин "алкилен" означает двухвалентную группу, полученную из насыщенного углеводорода с прямой или разветвленной цепью путем удаления двух атомов водорода, например метилен, 1,2-этилен, 1,1-этилен , 1,3-пропилен, 2,2 диметилпропилен и т.п. Термин "аралкил" означает арильную группу, связанную с основной молекулярной частью посредством алкилена. Предпочтительные аралкилы содержат низшую алкильную группу. Характерными аралкильными группами являются бензил, 2-фенэтил, нафталинметил и т.п Предпочтительной аралкильной группой является бензил. Термин "арил" означает ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от 6 до около 14 атомов углерода, а предпочтительно, от около 6 до около 10 атомов углерода. Арил необязательно замещен одним или несколькими заместителями, выбранными из алкила, гидрокси, галогена и галогеналкила. Характерными арильными группами являются фенил и нафтил. Термин "аминокислота" означает аминокислоту, выбранную из группы, состоящей из природных и неприродных аминокислот, определенных в данном описании. Аминокислоты могут быть нейтральными, положительными или отрицательными в зависимости от заместителей, присутствующих на боковой цепи. Термин "нейтральная аминокислота" означает аминокислоту, содержащую незаряженные заместители на боковой цепи. Примерами нейтральных аминокислот являются аланин, валин, лейцин,изолейцин, пролин, фенилаланин, триптофан,метионин, глицин, серин, треонин и цистеин. Термин "положительная аминокислота" означа 9 ет аминокислоту, у которой заместители на боковой цепи являются положительно заряженными при физиологическом рН. Примерами положительных аминокислот являются лизин,аргинин и гистидин. Термин "отрицательная аминокислота" означает аминокислоту, у которой заместители на боковой цепи несут суммарный отрицательный заряд при физиологическом рН. Примерами отрицательных аминокислот являются аспарагиновая кислота и глутаминовая кислота. Предпочтительными аминокислотами являются -аминокислоты. Наиболее предпочтительными аминокислотами являются аминокислоты, имеющие L-стереохимическую структуру у -углерода. Термин "природная аминокислота" означает -аминокислоту, выбранную из группы, состоящей из аланина, валина, лейцина, изолейцина, пролина, фенилаланина, триптофана, метионина, глицина, серина, треонина, цистеина,тирозина, аспарагина, глутамина, лизина, аргинина, гистидина, аспарагиновой кислоты и глутаминовой кислоты. Термин "неприродная аминокислота" означает аминокислоту, для которой не существует нуклеиновокислотного кодона. Примерами неприродных аминокислот являются, например,D-изомеры природных -аминокислот, таких как D-пролин (D-P, D-Pro), указанных выше;MeGly (N-метилглицин), EtGly (N-этилглицин) и EtASn (N-этиласпарагин); и аминокислоты, в которых -углерод имеет два заместителя на боковой цепи. Термины "пептид" и "полипептид" означают полимер, в котором мономерами являются аминокислотные остатки, связанные вместе посредством амидных связей. Предпочтительными пептидными соединениями настоящего изобретения являются соединения, включающие аминокислоты. Термин "пептидное соединение" означает соединение, содержащее пептид, определенный в настоящем описании. Термин "аминокислотный остаток" означает отдельные аминокислотные звенья, включенные в пептидные соединения настоящего изобретения. 10 Названия природных и неприродных аминокислот и их остатков, используемых в настоящем описании, соответствуют названиям,принятым Комиссией ИЮПАК по Номенклатуре органической химии и Комиссией ИЮПАКIUB по Биохимической номенклатуре, описанной в "Номенклатуре -аминокислот" ["Nomenclature of -Amino Acids (Recommendations,1974)" Biochemistry, 14(2), (1975)]. Те названия и аббревиатуры аминокислот и их остатков, используемых в настоящей заявке и в прилагаемой формуле изобретения, которые по своим названиям и аббревиатурам в какой-то степени отличаются от указанных аминокислот или их остатков, будут пояснены ниже. Термин "эквивалентная аминокислота" означает аминокислоту, которая может заменять другую аминокислоту в пептидных соединениях настоящего изобретения без какой-либо заметной потери их функции. При осуществлении таких изменений, замены подобных аминокислот проводят, исходя из относительного сходства заместителей боковой цепи, например исходя из размера, заряда, гидрофильности, гидропатичности и гидрофобности, как указано в настоящем описании. Выражение "или эквивалентная аминокислота", используемое в соответствующем списке отдельных аминокислот,означает аминокислоту, эквивалентную каждой отдельной аминокислоте, включенной в данный список. Как подробно описано в патенте США 4554101, который вводится в настоящее описание посредством ссылки, нижеследующие значения гидрофильности были присвоены аминокислотным остаткам: Arg(+3,0); Lys(+3,0); AspCys(-1,0); Met(-1,3); Val(-1,5); Leu(-1,8); Ile(-1,8); Туr(-2,3); Phe(-2,5); и Тrр(-3,4). При этом следует отметить, что аминокислотный остаток может быть заменен другим аминокислотным остатком, имеющим аналогичное значение гидрофильности (например в пределах, значений 2,0), с получением биологически эквивалентного полипептида. Аналогичным образом могут быть сделаны замены, исходя из сходства гидропатического индекса. Каждому аминокислотному остатку был присвоен гидропатический индекс, исходя из его гидрофобности и зарядовых характеристик. Такими величинами гидропатических индексов являются Ile(+4,5); Val(+4,2); Leu (+3,8);(-3,5); Asn(-3,5); Lys(-3,9); и Аrg(-4,5). При осуществлении замены на основе гидропатического индекса предпочтительными являются значения в пределах 2,0. 11 В пептидных соединениях настоящего изобретения сложноэфирная, амидная, дисульфидная или лантиониновая связь, посредством которой связываются два аминокислотных остатка, образуется между функциональными группами боковой цепи. Таким образом, амид представляет собой связь, образованную между карбоксильной группой боковой цепи кислотного аминокислотного остатка и аминогруппой боковой цепи основного аминокислотного остатка. Предпочтительными кислотными аминокислотными остатками являются Asp, Glu,-NHCH[(СН 2)3 СO2 Н]СО- и -NHCH[(CH2)4CO2H]CO-; причем,наиболее предпочтительным является Asp. Предпочтительными основными аминокислотными остатками являются His, Lys, Orn, -NHCH(CH2NH2)CO- и -NHCH[(CH2)2NH2] CO; прочем,наиболее предпочтительным является Lys. Сложноэфирные связи образуются между карбоксильной группой боковой цепи кислотного аминокислотного остатка, описанного выше,и гидроксильной группой боковой цепи аминокислотного остатка, такого как Ser, Thr, Туr и т.п.; причем особенно предпочтительными являются Ser и Thr. Дисульфиды образуются из аминокислотных остатков, содержащих сульфгидрильные группы боковой цепи. Для образования дисульфидных связей особенно предпочтительным является Суs. Лантиониновые мостики образуются посредством десульфуризации соответствующего дисульфида. Число атомов в мостике, полученном из амидной, сложноэфирной, дисульфидной или лантиониновой связи, образованной как описано выше, варьируется в зависимости от длины боковой цепи и типа связи (то есть амидной,сложноэфирной, дисульфидной или лантиониновой связи). Этот мостик предпочтительно содержит от 4 до 12 атомов, более предпочтительно от 6 до 10 атомов. Более предпочтительное число атомов, содержащихся в мостике,составляет 7; причем, этот мостик предпочтительно включает амидную связь между функциональными группами боковой цепи остатковLys и Asp. Характерным пептидным соединением настоящего изобретения является, например, цикло(K18-D22) [A1,Nle8, К 18, D22, L27]hPTH(1-31)NH2, где связанные аминокислотные остатки указаны в круглых скобках после "цикло", а замещенные аминокислоты из природной последовательности взяты в квадратные скобки.hPTH означает паратиреоидный гормон человека, a hPTHrP означает белок, родственный паратереоидному гормону человека. Цифры во вторых круглых скобках относятся к числу аминокислотных остатков в пептидном соединении,начиная с N-конца (то есть первые 31 аминокислоты hPTH). 12 В том случае, когда пептидное соединение настоящего изобретения замещено основной частью, образуются кислотно-аддитивные соли,которые являются просто более удобной формой для использования; и на практике, использование солевой формы, по существу, равноценно использованию свободной основной формы. Кислотами, которые могут быть использованы для получения кислотно-аддитивных солей, являются предпочтительно кислоты, которые образуют, при их взаимодействии со свободным основанием, фармацевтически приемлемые соли, то есть соли, анионы которых являются нетоксичными для пациента при использовании их в фармацевтических дозах, таких,при которых благоприятный эффект, свойственный свободному основанию, не снижается из-за побочных эффектов, приписываемых этим анионам. Хотя фармацевтически приемлемые соли указанных основных соединений являются предпочтительными, однако все кислотноаддитивные соли могут быть использованы в качестве источника свободного основания, даже когда данная конкретная соль, per se, требуется лишь в качестве промежуточного продукта, как,например, в том случае, когда данную соль получают лишь в целях очистки и идентификации,либо когда ее используют в качестве промежуточного соединения при получении фармацевтически приемлемой соли посредством ионообменной реакции. Фармацевтически приемлемыми солями, входящими в объем настоящего изобретения, являются соли, происходящие от следующих кислот: минеральных кислот, таких как хлористо-водородная кислота, серная кислота,фосфорная кислота и сульфаминовая кислота; и органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота,циклогексилсульфаминовая кислота, хинная кислота и т.п. Соответствующими кислотноаддитивными солями являются следующие соли: гидрогалогениды, например гидрохлорид и гидробромид, сульфат, фосфат, нитрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат,оксалат, салицилат, пропионат, сукцинат, фумарат, малеат, метилен-бисгидроксинафтоаты,гентизаты, мезилаты, изетионаты и ди-птолуоилтартратметансульфонат, этансульфонат,бензолсульфонат, п-толуолсульфонат, циклогексилсульфамат и хинат, соответственно. В соответствии с другим аспектом настоящего изобретения, кислотно-аддитивные соли пептидных соединений настоящего изобретения получают посредством реакции свободного основания с соответствующей кислотой путем применения или адаптации известных методов. Например, кислотно-аддитивные соли пептидных соединений настоящего изобретения получают либо путем растворения свободного осно 13 вания в водном или водноспиртовом растворе или в других подходящих растворителях, содержащих соответствующую кислоту, с выделением соли путем выпаривания раствора, либо посредством реакции свободного основания и кислоты в органическом растворителе, причем в данном случае соль выделяют непосредственно,или она может быть получена путем концентрирования раствора. Предпочтительными кислотно-аддитивными солями являются трифторацетат, ацетат и гидрохлорид. Особенно предпочтительными являются ацетатные и тетрагидрохлоридные соли. Пептидные соединения настоящего изобретения могут быть продуцированы из солей путем применения или адаптации известных методов. Например, исходные пептидные соединения настоящего изобретения могут быть получены из их кислотно-аддитивных солей путем обработки щелочью, например водным раствором бикарбоната натрия или водным раствором аммиака. В том случае, когда пептидное соединение настоящего изобретения замещено кислотной частью, то могут быть образованы основноаддитивные соли, которые представляет собой просто более удобную форму для использования; и на практике использование солевой формы, по существу, равноценно использованию свободной кислотной формы. Основаниями,которые могут быть использованы для получения основно-аддитивной соли являются, предпочтительно, основания, которые образуют при их взаимодействии со свободной кислотой фармацевтически приемлемые соли, то есть соли,катионы которых являются нетоксичными для организма животного при использовании их в фармацевтических дозах, таких, при которых благоприятный эффект, свойственный свободной кислоте, не снижается из-за побочных эффектов, приписываемых этим катионам. Фармацевтически приемлемыми солями, включая, например, соли щелочных и щелочноземельных металлов, входящими в объем настоящего изобретения, являются соли, происходящие из следующих оснований: гидрида натрия, гидроксида натрия, гидроксида калия, гидроксида кальция,гидроксида алюминия, гидроксида лития, гидроксида магния, гидроксида цинка, аммиака,триметиламмиака, триэтиламмиака, этилендиамина, н-метилглюкамина, лизина, аргинина,орнитина, холина, N,N'-дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина,н-бензилфенэтиламина, диэтиламина, пиперазина, трис(гидроксиметил)аминометана, гидроксида тетраметиламмония и т.п. Металлические соли пептидных соединений настоящего изобретения могут быть получены посредством взаимодействия гидрида,гидроксида, карбоната или аналогичного реакционноспособного соединения выбранного ме 002819 14 талла в водном или органическом растворителе со свободной кислотной формой пептидиого соединения. Используемый водный растворитель может представлять собой воду, либо он может представлять собой смесь воды с органическим растворителем, предпочтительно спиртом, таким как метанол или этанол; кетоном,таким как ацетон; алифатическим эфиром, таким как тетрагидрофуран; или сложным эфиром, таким как этилацетат. Такие реакции обычно проводят при комнатной температуре,но при желании их можно проводить и при нагревании. Аминовые соли пептидных соединений настоящего изобретения могут быть получены путем взаимодействия амина в водном или органическом растворителе со свободной кислотной формой пептидного соединения. Подходящими водными растворителями являются вода и смеси воды со спиртами, такими как метанол или этанол; эфирами, такими как тетрагидрофуран; нитрилами, такими как ацетонитрил; или кетонами, такими как ацетон. Аналогичным способом могут быть получены соли аминокислот. Основно-аддитивные соли пептидных соединений настоящего изобретения могут быть получены из солей путем применения или адаптации известных методов. Так, например, исходные пептидные соединения настоящего изобретения могут быть получены из их основноаддитивных солей путем обработки кислотой,например хлористо-водородной кислотой. При том, что эти соединения, как таковые,могут быть использованы в качестве активных соединений, соли пептидных соединений настоящего изобретения могут быть также использованы для очистки пептидных соединений,например, исходя из различий между растворимостью солей и исходных пептидных соединений, побочных продуктов и/или исходных материалов, с применением техники, хорошо известной специалистам. Термин "фармацевтически приемлемый сложный эфир" означает сложные эфиры, которые гидролизуются in vivo и легко расщепляются в организме человека, в результате чего высвобождается исходное пептидное соединение или его соль. Подходящими сложноэфирными группами являются группы, которые, например,происходят от фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановой, алкеновой, циклоалкановой и алкандионовой кислот, в которых каждая алкильная или алкенильная часть имеет преимущественно не более 6 атомов углерода. Примерами конкретных сложных эфиров являются формиаты,ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты. Термин "пролекарственное соединение" означает соединение, которое быстро трансформируется in vivo с получением основного 15 пептидного соединения, например путем гидролиза в крови. Термин "фармацевтически приемлемое пролекарственное соединение" означает соединение, которое по общепризнанным медицинским показателям является подходящим для фармацевтического применения на пациенте и не вызывает, при этом, нежелательного токсического действия, раздражения, аллергической реакции и т.п., а также является эффективным для целевого использования, включая фармацевтически приемлемую сложноэфирную форму и цвиттерионную форму, если она возможна,пептидных соединений настоящего изобретения. Фармацевтически приемлемые пролекарственные предшественники, согласно настоящему изобретению, описаны T.HiguchiV. Stella,Pro-drugs as Novel Delivery Systems, Vol.14 of thePharmaceutical Association and Pergamon Press,1987, обе эти работы вводятся в настоящее описание посредством ссылки. Термин "сольват" означает физическую ассоциацию соединения настоящего изобретения с одной или более молекулами растворителя. Эта физическая ассоциация включает различные степени ионного и ковалентного связывания,включая водородные связи. В некоторых случаях сольват может быть выделен, например, в случае, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого тела. Термин"сольват" включает в себя как сольваты в виде раствора, так и выделяемые сольваты. Типичными сольватами являются этанолаты, метанолаты и т.п. Термин "гидрат" означает сольват,где молекулой(ами) растворителя является/являются Н 2 О. Пептидные соединения настоящего изобретения в своем скелете могут, помимо хиральных центров, содержать асимметрические центры. Эти асимметрические центры могут независимо быть либо в R-, либо в Sконфигурации. Для каждого специалиста очевидно, что некоторые пептидные соединения формулы I могут обнаруживать геометрическую изомерию. Геометрические изомеры могут включать цис- и транс-формы пептидных соединений настоящего изобретения, имеющих алкенильные радикалы. Настоящее изобретение относится к отдельным геометрическим изомерам и к стереоизомерам, а также к их смесям. Такие изомеры могут быть выделены из их смесей путем применения или адаптации известных методов, например с использованием хроматографических методов или методов перекристаллизации, либо они могут быть отдельно получены из соответствующих изомеров их промежуточных соединений, например путем применения или адаптации известных методов. 16 Предпочтительные варианты осуществления настоящего изобрения Рассматриваемыми пептидными соединениями, входящими в объем настоящего изобретения, являются, но не ограничиваются ими,следующие соединения: цикло(К 18-D22)[A1,Nle8,K18,D22,L27]hРТН(131)NН 2 (SEQ ID NO: 3);K ,D ,L ]hPTH(1-31)NH2 (SEQ ID NO: 80) или их фармацевтически приемлемые соли или пролекарственные соединения. Предпочтительное циклическое пептидное соединение формулы 2 имеет вышеуказанную формулу I, где мостик, образованный из боковых цепей одной пары аминокислотных остатков, не перекрывается с мостиком, образованным между боковыми цепями другой пары аминокислотных остатков. Более предпочтительное пептидное соединение формулы 3 имеет формулу 2, где А 10 представляет Ala, Asn, Asp, Gly или Lys; А 13 представляет Ala, Gly или Lys; A14 представляетA29 представляет Ala, Asp, Glu или Gln; А 30 представляет Asp, Glu или Lys; и боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков, А 10 иA14, А 13 и A17, A14 и A18, A17 и A21, A18 и А 22, A21 и А 25, A25 и A29, и А 26 и А 30 связаны посредством амидной связи с образованием мостика, а боко 19 вая цепь каждого из следующих аминокислотных остатков А 10, А 13, A14, A17, A18, A21, А 22, А 25,А 26, A29 и А 30 участвуют, главным образом, в образовании единственного и неперекрывающегося мостика; при условии, что:(a) если боковые цепи пары аминокислотных остатков А 13 и A17 связаны посредством амидной связи с образованием мостика, то боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков A18 и A22,A21 и А 25, и А 25 и A29 также связаны посредством амидной связи с образованием мостика;(b) если боковые цепи пары аминокислотных остатков А 26 и А 30 связаны посредством амидной связи с образованием мостика, то боковые цепи, по крайней мере, одной из следующих пар аминокислотных остатков А 10 и A14,A14 и A18, A17 и A21, A18 и A22, и A21 и A25 также связаны посредством амидной связи с образованием мостика; и(с) если боковые цепи следующих пар аминокислотных остатков А 13 и A17 и А 26 и А 30 связаны посредством амидной связи с образованием мостика, то боковые цепи одной из следующих пар аминокислотных остатков A18 и А 22 и A21 и A25 также связаны посредством амидной связи с образованием мостика; Другое более предпочтительное пептидное соединение формулы 4 имеет формулу 3, указанную выше, где R1a представляет Н, a Y представляет NH2. Некоторые циклические пептидные соединения настоящего изобретения обладают агонистической активностью по отношению к рецептору паратиреоидного гормона, а поэтому, они могут быть использованы для лечения физиологических состояний, ассоциированных с регуляцией содержания кальция в клетках кости,включая гипокальциемию, остеопороз, остеопению; и расстройства, ассоциированные с остеопорозом и остеопенией, такие как гиперпаратиреоз, гипопаратиреоз и синдром Кушинга; остеопению, индуцированную глюкокортикоидами и иммунодепрессантами; и для сращивания переломов и повторных переломов кости. Предпочтительные циклические пептидные соединения-агонисты формулы 5 имеют формулу 4, указанную выше, где Х представляет(c) R1a-А 3-А 4-А 5-А 6-А 7-А 8-А 9-,Более предпочтительное циклическое пептидное соединение-агонист формулы 6 имеет формулу 5, указанную выше, где А представляет Ala, Gly или D-Pro; A8 представляет Nle, a A27 представляет Leu. Другое более предпочтительное циклическое пептидное соединение-агонист формулы 7 имеет формулу 6, указанную выше, где(i) боковые цепи А 10 и А 14 связаны посредством амидной связи с образованием мостика;(ii) боковые цепи A14 и A18 связаны посредством амидной связи с образованием мостика;(iii) боковые цепи A17 и A21 связаны посредством амидной связи с образованием мостика;(iv) боковые цепи A18 и А 22 связаны посредством амидной связи с образованием мостика;(v) боковые цепи A21 и A25 связаны посредством амидной связи с образованием мостика;(vi) боковые цепи А 25 и А 29 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (i), указанную выше, где А 10 представляетHis; A29 представляет Ala или Gln; и А 30 представляет Asp или Glu; a боковые цепи А 10 и А 14 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (ii), указанную выше, где А 10 представляетLys; A29 представляет Ala или Gln; и А 30 представляет Asp или Glu; a боковые цепи A14 и A18 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (iii), указанную выше, где А 10 представляетGlu, a боковые цепи А 17 и A21 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (iv), указанную выше, где А 10 представляетAla или Gln; и А 30 представляет Asp или Glu, а боковые цепи A18 и A22 связаны посредством амидной связи с образованием мостика. 21 Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (v), указанную выше, где А 10 представляетA25 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (vi), указанную выше, где А 10 представляетLys; А 29 представляет Asp или Lys; и А 30 представляет Asp или Glu, a боковые цепи A25 и А 29 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист формулы 8 имеет формулу 6, указанную выше, где(vii) боковые цепи А 13 и A17 связаны посредством амидной связи и боковые цепи A18 и А 22 связаны посредством амидной связи с образованием мостика; или(viii) боковые цепи A18 и А 22 связаны посредством амидной связи и боковые цепи A26 и А 30 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (vii), указанную выше, где А 10 представляет Asn или Asp; А 13 представляет Lys или Asp;Lys или Asp; A18 представляет Lys или Asp; A21 представляет Val или Arg; A22 представляет Glu,Lys или Asp; A25 представляет Arg или His; A26 представляет His или Lys; A29 представляет Ala или Gln; и А 30 представляет Asp или Glu; а боковые цепи А 13 и A17 связаны посредством амидной связи и боковые цепи A18 и А 22 связаны посредством амидной связи с образованием мостика; Другое более предпочтительное циклическое пептидное соединение-агонист имеет формулу (viii), указанную выше, где А 10 представляет Asn или Asp; А 13 представляет Lys; A14 представляет His или Ser; A17 представляет Ser или Asp; А 18 представляет Lys или Asp; A21 представляет Val или Arg; A22 представляет Glu,Lys или Asp; A25 представляет Arg или His; А 26 представляет Lys или Asp; А 29 представляет Ala или Gln; и А 30 представляет Lys или Asp; а боковые цепи A18 и А 22 связаны посредством амидной связи и боковые цепи A26 и А 30 связаны 22 посредством амидной связи с образованием мостика; Другое более предпочтительное циклическое пептидное соединение-агонист формулы 9 имеет формулу 6, указанную выше, где боковые цепи А 13 и A17 связаны посредством амидной связи; боковые цепи A18 и А 22 связаны посредством амидной связи; и боковые цепи А 26 и А 30 связаны посредством амидной связи с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-агонист формулы 10 имеет формулу 9, указанную выше, где А 10 представляет Asn или Asp; А 13 представляет Lys или Asp; A14 представляет His или Ser; A17 представляет Lys или Asp; A18 представляет Lys илиLys или Asp. Более предпочтительными циклическими пептидными соединениями-агонистами настоящего изобретения являются: цикло(К 18-D22)[A1,Nle8,K18,D22,L27]hРТН(131)NН 2 (SEQ ID NO: 3); цикло(K18-D22)[A1,2,Nle8,K18,D22,L27]hPTHK ,D ,L ]hPTH(1-31)NH2 (SEQ ID NO: 80) или их фармацевтически приемлемые соли или пролекарственные предшественники. Еще более предпочтительными циклическими пептидными соединениями-агонистами являются: цикло(К 18-D22)[A1,Nle8,K18,D22,L27]hРТНK ,D17,22,L27]hPTH(1-31)NH2 (SEQ ID NO: 80) или их фармацевтически приемлемые соли или пролекарственные предшественники. Еще более предпочтительными циклическими пептидными соединениями-агонистами являются: цикло(К 18-D22)[A1,Nle8,K18,D22,L27]hРТНK ,D ,L ]hPTH(1-31)NH2 (SEQ ID NO: 80) или их фармацевтически приемлемые соли или пролекарственные предшественники. Другим еще более предпочтительным циклическим пептидным соединением-агонистом является бицикло (K13-D17,K26-D30) [A1,Nle8,18,D17, L27]hPTH(1-31)NH2 (SEQ ID No: 79) или его фармацевтически приемлемая соль или пролекарственный предшественник. Некоторые циклические пептидные соединения настоящего изобретения ингибируют действие РТН. Такие циклические пептидные соединения-антагонисты могут быть использованы для лечения расстройств, характеризующихся избытком РТН, таких как гиперпаратиреоз и гиперкальциемический криз, ассоциированный с гиперпаратиреозом, гиперкальциемия при злокачественных опухолях, почечная недостаточность и гипертония. Предпочтительное циклическое пептидное соединение-антагонист формулы 10 имеет формулу 6, указанную выше, где Х представляет(g) R1b-; Более предпочтительное циклическое пептидное соединение-антагонист формулы 11 имеет формулу 10, указанную выше, где А 8 представляет Nle,a A27 представляет Leu. Другое более предпочтительное циклическое пептидное соединение-антагонист формулы 12 имеет формулу 11, указанную выше, где боковые цепи A18 и А 22 связаны амидной связью с образованием мостика. Другое более предпочтительное циклическое пептидное соединение-антагонист формулы 13 имеет формулу 12, указанную выше, где А 10 представляет Asn или Asp; A13 представляетArg или His; A26 представляет His или Lys; A29 представляет Ala или Gln; и А 30 представляет Asp или Glu. Более предпочтительными циклическими пептидными соединениями-антагонистами являются цикло(K18-D22)[K18,D22,L27]hPTH(10-31)NH2(SEQ ID NO: 77) или их фармацевтически приемлемая соль или пролекарственный предшественник. Некоторые ациклические пептидные соединения настоящего изобретения обладают агонистической активностью по отношению к рецептору паратиреоидного гормона, а поэтому они могут быть использованы для лечения физиологических состояний, ассоциированных с регуляцией содержания кальция в костных клетках, включая гипокальциемию, остеопороз,остеопению и расстройства, ассоциированные с остеопорозом и остеопенией, такие как гиперпаратиреоз, гипопаратиреоз и синдром Кушинга; остеопению, индуцированную глюкокортикоидами и иммунодепрессантами; и для сращивания кости при переломе кости и повторном переломе кости. Предпочтительным ациклическим пептидным соединением-агонистом формулы 14 явля 002819 28 ется пептидное соединение формулы II, где R1a представляет Н, a Y представляет NH2. Более предпочтительное ациклическое пептидное соединение-агонист формулы 15 имеет формулу 14, указанную выше, где Х представляет:(с) R1a-А 3-А 4-А 5-А 6-А 7-А 8-А 9-. Другое более предпочтительное ациклическое пептидное соединение-агонист формулы 16 имеет формулу 15, указанную выше, где A1 представляет Ser, Ala, Gly или D-Pro; A2 представляет Ala, Val или Gly; А 3 представляет Ala,Ser, Gly или D-Pro; A4 представляет Glu, Ala илиLeu или Lys; А 28 представляет Ile или Leu или его эквивалентную аминокислоту; А 29 представляет Ala или Gln; и А 30 представляет Asp илиGlu; А 31 представляет Ilе, Leu или Val; А 32 представляет His; А 33 представляет Asn или Thr; и А 34 представляет Ala или Phe. Другое более предпочтительное пептидное соединение-агонист формулы 17 имеет формулу 16, указанную выше, где A1 представляет Ala,Gly или D-Pro; А 8 представляет Nle; А 22 предcтавляет Asp, a A27 представляет Leu. Другое более предпочтительное ациклическое пептидное соединение-агонист формулы 18 имеет формулу 17, указанную выше, где Х представляет R1a-A1-A2-A3-A4-A5-A6-A7-A8-A9-. Еще более предпочтительным ациклическим пептидным соединением-агонистом является [A1,Nle8,K18,D22,L27]hPTH(1-31)NH2, (SEQID No: 4) или его фармацевтически приемлемая соль или пролекарственный предшественник. Следует отметить, что в настоящее изобретение входят все соответствующие комбинации предпочтительных аспектов настоящего изобретения, описанных в настоящей заявке. Синтез пептидных соединений Пептидные соединения настоящего изобретения могут быть синтезированы любыми методами, известными специалистам в области пептидного синтеза. В случае твердофазного синтеза, описание многих методов можно найтиSynthesis, W.H.Freeman Co. (San Francisco), 1963 и J.Meienhofer, Hormonal Proteins and Peptides,vol.2, p. 46, Academic Press (New York), 1973. Описание классического синтеза в растворе см.G. Schroder and K. Lupke, The Peptides, vol.1,Academic Press (New York), 1965. В основном, эти методы предусматривают последовательное присоединение одной или нескольких аминокислот или соответствующим образом защищенных аминокислот к растущей пептидной цепи. Обычно, либо амино-, либо карбоксильную группу первой аминокислоты защищают подходящей защитной группой. Защищенная или дериватизированная аминокислота может быть затем либо присоединена к инертному твердому носителю, либо использована в растворе путем присоединия следующей аминокислоты в последовательности, имеющей комплементарную (амино- или карбоксильную) группу, подходящим образом защищенную в условиях, подходящих для образования амидной связи. Затем защитную группу отщепляют от этого только что присоединенного аминокислотного остатка, после чего присоединяют следующую аминокислоту (соответствующим образом защищенную) и т.д. После присоединения всех нужных аминокислот в соответствующей последовательности любые оставшиеся защитные группы (и любой твердый носитель) удаляют последовательно или одновременно с получением конечного пептидного соединения. Посредством простой модификации этой общей методики можно присоединить к растущей цепи одновременно более чем одну аминокислоту,например путем связывания (в условиях, которые не приводят к рацемизации хирального центра) защищенного трипептида с соответствующим образом защищенным дипептидом с образованием, после деблокирования, пентапептида и т.д. Предпочтительным методом получения пептидных соединений настоящего изобретения является твердофазный пептидный синтез. В этом особенно предпочтительном методе функциональную альфа-аминогруппу защищают группой, чувствительной к кислотe или основанию. Такие защитные группы должны обладать стабильностью к условиям образования пептидной связи, но, при этом, они должны быть легко удаляемыми без нарушения растущей пептидной цепи или без рацемизации каких-либо содержащихся в ней хиральных центров. Подходящими защитными группами являются 9-флуоренилметилоксикарбонил (Fmос),трет-бутилоксикарбонил (Воc), бензилоксикарбонил (Cbz), бифенилизопропилоксикарбонил,трет-амилоксикарбонил, изоборнилоксикарбонил, (,)-диметил-3,5-диметоксибензилоксикарбонил, о-нитрофенилсульфенил, 2-цианотрет-бутилоксикарбонил и т.п. Предпочтитель 002819 30 ной защитной группой является 9-флуоренилметилоксикарбонил (Fmoc). Особенно предпочтительными защитными группами боковой цели для аминогрупп боковой цепи для лизина и аргинина являются: 2,2,5,7,8-пентаметилхроман-6-сульфонил(рmc), нитро, п-толуолсульфонил, 4-метоксибензолсульфонил, Cbz, Boc, Alloc (аллилоксикарбонил) и адамантилоксикарбонил; для тирозина: бензил, о-бромбензилоксикарбонил, 2,6 дихлорбензил, изопропил, трет-бутил (t-Bu),циклогексил, циклопентил и ацетил (Ас); для серина: трет-бутил, бензил и тетрагидропиранил; для гистидина: тритил, бензил, Gbz, птолуолсульфонил и 2,4-динитрофенил; для триптофана: формил и Воc; для аспарагина и глутамина: Trt (тритил); для аспарагиновой кислоты и глутаминовой кислоты: O-t-Bu и OAllyl. Циклические пептидные соединения настоящего изобретения предпочтительно получают методом с использованием фрагмента, где фрагмент нужного полного пептидного соединения, содержащего амидный, сложноэфирный,дисульфидный или лантиониновый мостик(циклический пептидный фрагмент) получают отдельно и очищают, а затем присоединяют к аминокислоте, связанной с полимером, или к пептидной части полного пептидного соединения. Циклический пептидный фрагмент получают классическим методом синтеза в растворе или методом твердофазного пептидного синтеза, описанного в настоящей заявке. Затем синтез полного пептидного соединения осуществляют путем последовательного присоединения остальных аминокислотных остатков к циклическому пептиду, связанному с полимером; путем присоединения дополнительных циклических или ациклических пептидных фрагментов к циклическому пептиду, связанному с полимером; или путем комбинации вышеуказанных методов. Получение циклических пептидных аналогов hPTH методом с использованием фрагментов описано в заявке США peг.60/081897, поданной 15 апреля 1998, которая вводится в настоящее описание посредством ссылки. Пептиды настоящего изобретения, где R1c представляет(1996), которая вводится в настоящее описание посредством ссылки. 31 Для дополнительной иллюстрации получения новых пептидов настоящего изобретения служат нижеследующие неограничивающие примеры. Общие методы Пептидные соединения получают в соответствии с технологией синтеза белков на синтезаторе для автоматического твердофазного синтеза пептидов (Protein Technologies, Inc. PS3Automated Solid Phase Peptide Synthesizer) с применением стандартной методики твердофазного пептидного синтеза (ТФПС) с использованием Fmoc. Fmoc-защищенные аминокислоты,закупленные либо у Advanced Chem. Tech.(Acm)-OH, Fmoc-Cys(Trt)-OH, Fmoc-Glu(OtBu)OH, Fmoc-Glu(OAllyl)-OH, Fmoc-Gln(Trt)-OH,Fmoc-Gly-OH, Fmoc-His(Trt)-OH, Fmoc-Ile-OH,Fmoc-Leu-OH,Fmoc-Lys(Alloc)-OH,FmocLys(Воc)-ОН, Fmoc-Orn-(Alloc)-OH, Fmoc-PheOH, Fmoc-Ser(tBu)-OH, Fmoc-Thr(tBu)-OH,Fmoc-Trp(Boc)-OH и Fmoc-Val-OH. Аминокислотный анализ осуществляли в соответствии с ВАСНЕМ Bioscience, King ofPrussia, PA и результаты анализа представлены как: аминокислотный остаток: найденная величина (ожидаемая величина). Анализ последовательности осуществляли на микрохимической установке в Emory University School of Medicine, Atlanta, GA. Получение амидного мостика Циклические пептидные соединения с амидной мостиковой связью получали путем образования амидной связи между карбоксильной группой боковой цепи кислотного аминокислотного остатка и аминогруппой боковой цепи основного аминокислотного остатка в присутствии активирующего агента, описанного выше. Предпочтительными кислотными аминокислотными остатками являются Asp, Glu,-NHCH[(СН 2)3 СО 2 Н]СО- и -NHCH[(СН 2)4 СО 2 Н] СО-; причем, наиболее предпочтительным является Asp. Предпочтительными основными аминокислотными остатками являются His, Lys,Orn, -NHCH-(CH2NH2)CO- и -NHCH[(CH2)2NH2]CO; причем наиболее предпочтительным является Lys. В тех случаях, когда пептидный предшественник циклического пептидного соединения содержит более одного кислотного или основного аминокислотного остатка, защитные группы для дополнительных кислотных или основных аминокислот выбирают так, чтобы циклизуемые аминокислоты могли быть селективно деблокированы. Предпочтительно, чтобы нужные кислотные или основные аминокислотные остатки были деблокированы одновременно. Кроме того, помимо стабильности к реагентам, 002819 32 используемым для деблокирования выбранных основных и кислотных аминокислотных остатков, защитные группы на остальных аминокислотных остатках выбирают так, чтобы они были стабильными к используемым условиям циклизации. Термин "ортогональность", используемый по отношению к защитным группам на боковой цепи, относится к случаю, описанному в настоящей заявке, где на молекуле имеются защитные группы двух или более классов, причем, группы каждого класса наиболее оптимально удаляются при специфических условиях,оставаясь при этом стабильными к используемым условиям для удаления защитных групп другого класса. Таким образом, можно удалить все защитные группы одного класса, но, при этом, все остальные группы останутся неудаленными. Предпочтительными защитными группами, имеющими нужную ортогональность, являются: для циклизуемого кислотного аминокислотного остатка: аллил; для циклизуемого основного аминокислотного остатка: аллилоксикарбонил (alloc); для любых дополнительных кислотных аминокислотных остатков: третбутил (tBu); и для любых дополнительных основных аминокислотных остатков: трет-бутилоксикарбонил (Воc). Аплильную и аллилоксикарбонильную защитные группы удаляют одновременно путем обработки палладием, предпочтительно тетракис(трифенилфосфин)палладием(0). Затем образование амидного мостика осуществляют, как описано в настоящей заявке для образования амидной связи. Получение сложноэфирного мостика Циклические пептидные соединения со сложноэфирной мостиковой связью получают путем образования сложноэфирной связи между карбоксильной группой боковой цепи кислотного аминокислотного остатка и гидроксильной группой боковой цепи гидроксилсодержащего аминокислотного остатка. Предпочтительными кислотными аминокислотными остатками являются Asp, Glu, -NHCH[(СН 2)3 СО 2 Н]-СО- и-NHCH[(CH2)4CO2H]CO-; причем наиболее предпочтительным является Asp. Предпочтительными аминокислотными остатками, содержащими гидроксильную группу боковой цепи,являются Ser, Thr, Туr и т.п. При этом особенно предпочтительными являются Ser и Thr. Образование сложноэфирной связи осуществляют с использованием методов и реагентов, описанных выше для образования амидного мостика. Получение дисульфидного мостика Циклические пептидные соединения с дисульфидной мостиковой связью получают путем образования дисульфидной связи между аминокислотными остатками, содержащими сульфгидрильные группы боковой цепи, из которых особенно предпочтительным является Cys. 33 Предпочтительными защитными группами для сульфгидрильных остатков боковой цепи является тритил (Trt) и ацетамидометил (Acm). Обработка полностью защищенного пептидного предшественника для циклического пептидного соединения с дисульфидным мостиком окислителем, например трифторацетатом таллия[Т 1(СF3 СO2)3] в диметилформамиде (ДМФ),приводит к селективному удалению защитной группы Trt или Acm и к одновременному образованию дисульфидной связи. Получение лантионинового мостика Лантионинсодержащие варианты вышеуказанных аналогов с дисульфидным мостиком получают из дисульфида методом десульфуризации, описанным HarpGleason (J. Org.Chem., 1971, 36, 73-80). После окислительного удаления Cys(Trt) или Cys (Acm) [или гомо-циспроизводных] и образования дисульфидного мостика этот пептид обрабатывают трис(диэтиламино)фосфином в подходящем растворителе. После рекомендуемых промывок оставшиеся защитные группы боковой цепи удаляют как описано выше. Затем неочищенное пептидное соединение очищают с помощью обращенно-фазовой жидкостной хроматографии. Пример 1. Цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(131)NH2 (SEQ ID No:3) Ala-Val-Ser-Glu-Ile-GlnLeu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-Asn-Ser(Lys-Glu-Arg-Val-Asp)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-амид. Метод А Амидную смолу MBHA Rink (Nova Biochem, La Jolla, CA, USA) (0,75 г, 0,41 ммоль) загружали в реакционный сосуд и оставляли на 10 мин для набухания с использованием ДМФFmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина в ДМФ (15 мл). Эту смолу шесть раз промывали ДМФ (15 мл), а затем в течение 20 мин обрабатывали раствором,содержащим Fmoc-Val-OH (0,34 г, 1,0 ммоль) иHBTU (0,38 г, 1,0 ммоль) в 0,4 М Nметилморфолине (NММ)/ДМФ (5 мл). После присоединения первой аминокислоты, смолу три раза прорывали ДМФ (15 мл). Процедуру деблокирования/присоединения повторяли с использованием следующих аминокислотных остатков: Fmoc-Asp(OtBu)-OH, Pmoc-Gln(Trt)ОН, Fmoc-Leu-OH, Fmoc-Leu-OH, FmocLys(Воc)-ОН, Fmoc-Arg(Pmc)-ОН, Fmoc-LeuOH, Fmoc-Trp(Boc)-OH, Pmoc-Asp(OAllyl)-OH,Fmoc-Val-OH,Fmoc-Arg(Pmc)-OH,FmocGlu(OtBu)-ОН и Fmoc-Lys(Allос)-ОН. Затем пептид, связанный со смолой, удаляли из аппарата и промывали пять раз ДМФ (50 мл), пять раз ТГФ (50 мл) и пять раз диэтиловым эфиром(50 мл). После сушки на воздухе, эту смолу суспендировали в атмосфере азота в смеси хлороформа/уксусной кислоты/NMM (37:2:1) (40 мл) Затем добавляли тетракис(трифенилфосфин) 34 палладий(0) (2,8 г, 2,4 ммоль) и гетерогенную смесь слегка помешивали в течение 2 ч при комнатной температуре. Полученный гомогенный раствор фильтровали и смолу последовательно промывали смесью 0,5% диизопропилэтиламина/ДМФ (100 мл), смесью 0,5% диэтилдитиокарбоната натрия/ДМФ (100 мл) и ДМФ(200 мл). Реакцию циклизации между боковыми цепями Lys18 и Asp22 осуществляли в течение 2 ч с использованием HBTU (0,26 г, 0,62 ммоль),НОВТ (0,08 г, 0,62 ммоль) и NMM (0,14 мл, 1,23 ммоль) в безводном ДМФ (20 мл); после чего осуществляли стадию циклизации во второй раз. Растворитель удаляли и смолу последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл) и сушили на воздухе. Часть связанного со смолой пептида (0,46 г, приблизительно 0,1 ммоль) возвращали в автоматический синтезатор и присоединяли остальные семнадцать аминокислотных остатков,как описано ранее, в следующем порядке: FmocSer(tBu)-ОН, Fmoc-Asn(Trt)-ОН, Fmoc-Leu-OH,Fmoc-His(Trt)-ОН, Fmoc-Lys(Воc)-ОН, FmocGly-OH,Fmoc-Leu-OH,Fmoc-Asn(Trt)-ОН,Fmoc-Hls(Trt)-ОН, Fmoc-Nle-OH, Fmoc-Leu-OH,Fmoc-GIn(Trt)-OH,Fmoc-Ile-OH,Fmoc-GluFmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (15 мл). Связанный со смолой пептид удаляли из аппарата и последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 10 мл TFA-содержащей воды (0,5 мл), тиоанизола (0,5 мл), фенола (0,75 г) и этандитиола(0,25 мл). Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (60 мл) при 0 С, в результате чего осаждался неочищенный пептид. Смолу промывали TFA (2 мл), которую добавляли к пептидной смеси. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (30 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде, содержащей 0,1% TFA (50 мл) и лиофилизовали досуха. Неочищенный пептид очищали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием ВЭЖХ-системы Rainin, снабженной полупрепаративной колонкой 1" с С 18 DYNAMAX-60A. Подвижную фазу инициировали водой (0,1%TFA) и выдерживали в течение 30 мин до достижения смеси 60% ACN (0,08% TFA)/воды(0,1% TFA). Чистые фракции, элюирующиеся приблизительно через 23 мин, объединяли и лиофилизовали с получением 40 мг очищенного пептида.Nle: 0,91(1); Lys: 2,75(3); His: 2,06(2): Arg: 2,09(2); Тrр: не определено (1). Положение амидного мостика подтверждалось расщеплением по Эдману и картированием путем гидролиза трипсином. Метод В Амидную смолу МВНА Rink (Nova Biochem, La Jolla, CA, USA) (0,75 г, 0,41 ммоль) загружали в реакционный сосуд и оставляли на 10 минут для набухания с использованием ДМФFmoc удаляли в течение 5 мин с использованием 20% раствора пиперидина в ДМФ (17 мл). Эту смолу шесть раз промывали ДМФ (17 мл), а затем в течение 20 мин обрабатывали раствором,содержащим Fmoc-Val-OH (0,34 г, 1,0 ммоль) иHBTU (0,38 г, 1,0 ммоль) в 0,4 М Nметилморфолине (NММ)/ДМФ (8 мл). После присоединения первой аминокислоты смолу три раза промывали ДМФ (17 мл). Процедуру деблокирования/присоединения повторяли с использованием следующих аминокислотных остатков: Fmoc-Asp(OtBu)-OH, Fmoc-Gln(Trt)-ОН,Fmoc-Leu-OH, Fmoc-Leu-OH, Fmoc-Lys(Воc)ОН, Fmoc-Arg (Рmс)-ОН, Fmoc-Leu-ОН, FmосТrp(Вос)-ОН, Fmoc-Asp(OAllyl)-ОН, Fmoc-ValOH, Fmoc-Arg-(Pmc)-OH, Fmoc-Glu(OtBu)-QH,Fmoc-Lys(Alloc)-OH, Fmoc-Ser(tBu)-OH, FmocAsn(Trt)-OH и Fmoc-Leu-OH. Затем пептид, связанный со смолой, удаляли из аппарата и промывали пять раз ДМФ (50 мл), пять раз ТГФ (50 мл) и пять раз диэтиловым эфиром (50 мл). После сушки на воздухе, эту смолу суспендировали в атмосфере азота в смеси хлороформа/уксусной кислоты/NММ (37:2:1) (40 мл). Затем добавляли тетракис(трифенилфосфин) палладий(0) (1,0 г, 0,86 ммоль) и гетерогенную смесь слегка помешивали в течение 2 ч при комнатной температуре. Полученный гомогенный раствор фильтровали и смолу последовательно промывали смесью 0,5% диизопропилэтиламина/ДМФ (100 мл), смесью 0,5% диэтилдитиокарбоната натрия/ДМФ (100 мл) и ДМФ(200 мл). Реакцию циклизации между боковыми цепями Lys18 и Asp22 осуществляли в течение 2 ч с использованием HBTU (0,23 г, 0,62 ммоль),Н 08 Т (0,08 г, 0,62 ммоль) и NММ (0,13 мл, 1,23 ммоль) в безводном ДМФ (20 мл), после чего осуществляли стадию циклизации во второй раз. Растворитель удаляли и смолу последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл), а затем сушили на воздухе. Связанный со смолой пептид (приблизительно 2,2 г) возвращали в автоматический синтезатор и присоединяли остальные четырнадцать аминокислотных остатков, как описано ранее в следующем порядке: Fmoc-His(Trt)-OH, 002819Fmoc-Lys(Воc)-ОН, Fmoc-Gly-ОН, Fmoc-LeuOH,Fmoc-Asn(Trt)-ОН,Fmoc-His(Trt)-ОН,Fmoc-Nle-OH, Fmoc-Leu-OH, Fmoc-Gln(Trt)-OH,Fmoc-Ile-OH,Fmoc-Glu(OtBu)-OH,FmocSer(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Nконцевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид удаляли из аппарата и последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFAсодержащей воды (2,0 мл), тиоанизола (2,0 мл),фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч растворTFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Смолу промывали TFA (2 мл), которую добавляли к пептидной смеси. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме,растворяли в воде, содержащей 0,1% TFA (100 мл) и лиофилизовали досуха. Неочищенный пептид очищали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии, как описано ранее, с получением 261 мг продукта, который, как было показано с помощью масс-спектроскопии и ВЭЖХ-анализа, был идентичен аутентичному образцу, полученному Методом А. Кроме того,как показал in vitro-анализ на сАМР с использованием клеток ROS 17,2/8 (см. выше), продукт,полученный Методом В был идентичен продукту, полученному Методом А. Метод С Амидную смолу МВНА Rink (Mova Biochem, La Jolla, CA, USA) (0,75 г, 0,41 ммоль) загружали в реакционный сосуд и оставляли на 10 мин для набухания с использованием ДМФFmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина в ДМФ (17 мл). Эту смолу шесть раз промывали ДМФ (17 мл), а затем в течение 20 мин обрабатывали раствором,содержащим Fmoc-Val-OH (0,34 г, 1,0 ммоль) иHBTU (0,38 г, 1,0 ммоль) в 0,4 М Nметилморфолине (NMM)/ДМФ (8 мл). После присоединения первой аминокислоты смолу три раза промывали ДМФ (17 мл). Процедуру деблокирования/присоединения повторяли с использованием следующих аминокислотных остатков: Fmoc-Asp(OtBu)-OH, Fmoc-Gln(Trt)-OH,Fmoc-Leu-OH, Fmoc-Leu-OH, Fmoc-Lys(Воc)ОН, Fmoc-Arg(Pmc)-ОН, Fmoc-Leu-OH, FmocTrp(Boc)-OH, Fmoc-Asp(OAllyl)-OH, Fmoc-ValOH, Fmoc-Arg-(Pmc)-OH, Fmoc-Glu(OtBu)-OH,Fmoc-Lys(Alloc)-OH, Fmoc-Ser(tBu)-OH, FmocAsn(Trt)-OH, Fmoc-Leu-OH, Fmoc-His(Trt)-OH, 37Fmoc-Lys(Boc)-OH, Fmoc-Gly-OH, Fmoc-LeuOH,Fmoc-Asn(Trt)-OH,Fmoc-His(Trt)-OH,Fmoc-Nle-OH, Fmoc-Leu-OH, Fmoc-Gln(Trt)-OH,Fmoc-Ile-OH,Fmoc-Giu(OtBu)-OH,FmocSer(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем пептид, связанный со смолой, удаляли из аппарата и промывали пять раз ДМФ (50 мл),пять раз ТГФ (50 мл) и пять раз диэтиловым эфиром (50 мл). После сушки на воздухе эту смолу суспендировали в атмосфере азота в растворе хлороформа/уксусной кислоты/NММ(37:2:1) (40 мл). Затем добавляли тетракис(трифенилфосфин)палладий(0) (1,0 г, 0,86 ммоль) и гетерогенную смесь слегка помешивали в течение 2 ч при комнатной температуре. Полученный гомогенный раствор фильтровали и смолу последовательно промывали смесью 0,5% диизопропилэтиламина/ДМФ (100 мл),смесью 0,5% диэтилдитиокарбоната натрия/ДМФ (100 мл) и ДМФ (200 мл). Реакцию циклизации между боковыми цепями Lys18 иAsp22 осуществляли в течение 2 ч с использованием HBTU (0,23 г, 0,62 ммоль), НОВТ (0,08 г,0,62 ммоль) и NММ (0,13 мл, 1,23 ммоль) в безводном ДМФ (20 мл), после чего осуществляли стадию циклизации во второй раз. Растворитель удаляли и смолу последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл), а затем сушили на воздухе.N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина в ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA-содержащей воды(2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Смолу промывали TFA (2 мл), которую добавляли к пептидной смеси. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл) и лиофилизовали досуха. Неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии, как описано ранее, с получением очищенного пептида, который, как было показано с помощью масс-спектроскопии и ВЭЖХанализа, был идентичен аутентичному образцу,полученному Методамм А и В. Кроме того, как показал in vitro-анализ на сАМР с использованием клеток ROS 17,2/8 (см. выше), продукт,полученный Методом С, был идентичен продукту, полученному методами А и В. 38 Метод D Синтез целевого соединения на основе фрагментов описан в заявке США peг.60/081897, поданной 15 апреля 1998, которая вводится в настоящее описание посредством ссылки. Пример 2.ID NO: 4) Ala-Val-Ser-Glu-Ile-Gln-Leu-Nle-HisAsn-Leu-Gly-Lys-His-Leu-Asn-Ser-Lys-Glu-ArgVal-Asp-Trp-Leu-Arg-Lys-Leu-Leu-Gln-Asp-Valамид. Амидную смолу МВНА Rink (Nova Biochem, La Jolla, CA, USA) (0,75 г, 0,41 ммоль) загружали в реакционный сосуд и оставляли на 10 минут для набухания с использованием ДМФFmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина в ДМФ (17 мл). Эту смолу шесть раз промывали ДМФ (17 мл), а затем в течение 20 мин обрабатывали раствором,содержащим Fmoc-Val-OH (0,34 г, 1,0 ммоль) иHBTU (0,38 г, 1,0 ммоль) в 0,4 М N-метилморфолине (NMM)/ДМФ (8 мл). После присоединения первой аминокислоты, смолу три раза промывали ДМФ (17 мл). Процедуру деблокирования/присоединения повторяли с использованием следующих аминокислотных остатков: FmocAsp(OtBu)-OH, Fmoc-Gln(Trt)-ОН, Fmoc-LeuOH, Fmoc-Leu-OH, Fmoc-Lys(Воc)-ОН, FmocArg(Pmc)-ОН, Fmoc-Leu-OH, Fmoc-Trp(Boc)OH, Fmoc-Asp(OAllyl)-OH, Fmoc-Val-OH, FmocArg(Pmc)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Gly-OH, Fmoc-Leu-OH, FmocAsn(Trt)-OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH,Fmoc-Leu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH,Fmoc-Glu(OtBu)-OH, Fmoc-Ser(tBu)-OH, FmocVal-OH и Fmoc-Ala-OH. Затем пептид, связанный со смолой, удаляли из аппарата и промывали пять раз ДМФ (50 мл), пять раз ТГФ (50 мл) и пять раз диэтиловым эфиром (50 мл). После сушки на воздухе часть смолы (1,5 г, 0,25 ммоль) суспендировали в атмосфере азота в растворе хлороформа/уксусной кислоты/NММ(37:2:1.) (20 мл). Затем добавляли тетракис(трифенилфосфин)палладий(0) (0,5 г, 0,43 ммоль) и гетерогенную смесь слегка помешивали в течение 2 ч при комнатной температуре. Полученный гомогенный раствор фильтровали и смолу последовательно промывали смесью 0,5% диизопропилэтиламина/ДМФ (100 мл),смесью 0,5% диэтилдитиокарбоната натрия/ ДМФ (200 мл), ДМФ (200 мл), ТГФ (100 мл),диэтиловым эфиром (100 мл) и сушили на воздухе.N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина в ДМФ (20 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым 39 эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 20 мл TFA, содержащей воды(1,0 мл), тиоанизола (1,0 мл), фенола (1,5 г) и этандитиола (0,5 мл). Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Смолу промывали TFA (2 мл), которую добавляли к пептидной смеси. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл) и лиофилизовали досуха. Неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии, как описано ранее, с получением 75 мг конечного очищенного пептида.Nle: 0,90(1); Lys: 3,06(3); His: 2,01(2); Arg: 2,04(2); Тrр: не определено(1). Первичную последовательность пептида подтверждали расщеплением по Эдману. Примеры 3-18. Часть связанного со смолой пептида, предварительно полученного методом А и оканчивающегося К 18-D22-амидным мостиком (0,46 г,0,1 ммоль), равномерно распределяли по 17 трехмиллилитровым лунках 96-луночного блока в аппарате Advanced Chem. Tech 496 MBS. В каждой лунке N-концевую защитную группуFmoc удаляли с использованием раствора 20% пипиридина/ДМФ (0,5 мл). Была использована программа синтеза, которая позволяла независимо получать все семнадцать аналогов РТН,где L-аланин был систематически замещен в каждом из семнадцати N-концевых положений с использованием стандартных условий Fmocприсоединения (0,5 ммоль Fmoc-аминокислоты на стадию присоединения; тройное присоединение на один остаток). После завершения программы синтеза аналоги РТН деблокировали и удаляли из смолы с использованием Реагента К(1,0 мл/лунка) в течение двух часов. Затем раствор для отщепления отдельно добавляли к диэтиловому эфиру (8 мл) при комнатной температуре. Затем полученные гетерогенные смеси осажденного пептида в диэтиловом эфире центрифугировали и супернатант декантировали из неочищенных пептидов. Твердые пептиды последовательно промывали пятью частями диэтилового эфира (8 мл), а затем сушили в вакууме. Белые твердые вещества растворяли в воде (2 мл), содержащей 0,1% TFA, замораживали и лиофилизовали. 40 Пептиды взвешивали, анализировали с помощью масс-спектрометрии методом ионного напыления, и анализировали на их способность стимулировать образование сАМР в клеткахIS-MS=3617 (M+). Примеры 19-34. Часть связанного со смолой пептида, предварительно полученного методом А и оканчивающегося К 18-D22-амидным мостиком (0,46 г,0,1 ммоль), равномерно распределяли по 17 трехмиллилитровым лунках 96-луночного блокаFmoc удаляли с использованием раствора 20% пипиридина/ДМФ (0,5 мл). Была использована программа синтеза, которая позволяла независимо получать все семнадцать аналогов РТН,где глицин был систематически замещен в каждом из семнадцати N-концевых положений с использованием стандартных условий Fmocприсоединения (0,5 ммоль Fmoc-аминокислоты на стадию присоединения; тройное присоединение на один остаток). После завершения программы синтеза аналоги РТН деблокировали и удаляли из смолы с использованием Реагента К(1,0 мл/лунка) в течение двух часов. Затем раствор для отщепления отдельно добавляли к диэтиловому эфиру (8 мл) при комнатной температуре. Затем полученные гетерогенные смеси осажденного пептида в диэтиловом эфире центрифугировали и супернатант декантировали из неочищенных пептидов. Твердые пептиды последовательно промывали пятью частями диэтилового эфира (8 мл), а затем сушили в вакууме. Белые твердые вещества растворяли в воде (2 мл), содержащей 0,1% TFA, замораживали и лиофилизовали. Пептиды взвешивали, анализировали с помощью масс-спектрометрии методом ионного напыления и анализировали на их способность стимулировать образование cAMP в клеткахIS-MS=3603 (M+). Примеры 35-51. Часть связанного со смолой пептида, предварительно полученного методом А и оканчивающегося К 18-D22-амидным мостиком (0,46 г,0,1 ммоль), равномерно распределяли по 17 трехмилли-литровым лункам 96-луночного блока аппарата Advanced Chem.Tech 496 MBS. В каждой лунке N-концевую защитную группуFmoc удаляли с использованием раствора 20% пиперидина/ДМФ (0,5 мл). Была использована программа синтеза, которая позволяла независимо получать все семнадцать аналогов РТН,где D-пролин был систематически замещен в каждом из семнадцати N-концевых положений с использованием стандартных условий Fmocприсоединения (0,5 ммоль Fmoc- аминокислоты на стадию присоединения; тройное присоединение на один остаток). После завершения программы синтеза аналоги РТН деблокировали и удаляли из смолы с использованием реагента К(11,0 мл/лунка) в течение двух часов. Затем раствор для отщепления отдельно добавляли к диэтиловому эфиру (8 мл) при комнатной температуре. Затем полученные гетерогенные смеси осажденного пептида в диэтиловом эфире центрифугировали и супернатант декантировали из неочищенных пептидов. Твердые пептиды последовательно промывали пятью частями диэтилового эфира (8 мл), а затем сушили в вакууме. Белые твердые вещества растворяли в воде (2 мл), содержащей 0,1% TFA, замораживали и лиофилизовали. Пептиды взвешивали, анализировали с помощью масс-спектрометрии методом ионного напыления и анализировали на их способность стимулировать образование сАМР в клеткахIS-MS=3643 (M+). Пример 52. Цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(134)NH2 (SEQ ID NO: 46) Ala-Val-Ser-Glu-IleGln-Leu-Nie-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Asp)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-His-Asn-Phe-амид. Пептид получали способом, аналогичным описанному ранее (метод В). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакцион 47 ный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Phe-OH, Fmoc-Asn(Trt)-OH,Fmoc-His(Trt)-OH, Fmoc-Val-OH, Fmoc-Asp(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Leu-OH,Fmoc-Leu-OH,Fmoc-Lys(Boc)-OH,FmocArg(Pmc)-OH, Fmoc-Leu-OH, Fmoc-Trp(Вос)ОН, Fmoc-Asp(OAllyl)-OH, Fmoc-Val-OH, FmocArg(Pmc)-OH,Fmoc-Glu-(tBu)-OH,FmocLys(Alloc)-OH,Fmoc-Ser(tBu)-OH,FmocAsn(Trt)-ОН и Fmoc-Leu-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) иAsp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". После описанных процедур обработки амидсодержащий связанный со смолой пептид возвращали в синтезатор для завершения синтеза и последовательно присоединяли следующие аминокислоты:Fmoc-His(Trt)-ОН,Fmoc-Lys(Воc)ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)OH, Fmoc-His(Trt)-ОН, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser-(tBu)-OH, Fmoc-ValOH и Fmoc-Ala-OH. Связанный со смолой пептид удаляли из аппарата и N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этан-дитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии с получением 320 мг конечного очищенного пептида в виде белого твердого вещества. 48 Пример 53. Циклo(K18-D22)[A1,Nle8,D18,K22,L27]hPTH(131)NH2 (SEQ ID NO: 47) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Asp-Glu-Arg-Val-Lys)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-OH, Fmoc-Asp(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Воc)-ОН, Fmoc-Arg(Pmc)-OH,Fmoc-Leu-OH, Fmoc-Trp(Воc)-ОН, Fmoc-Lys(Alloc)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)-OH,Fmoc-Glu(OtBu)-OH,Fmoc-Asp(OAllyl)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn-(Trt)-OH, FmocLeu-OH, Fmoc-His(Trt)-OH, Fmoc-Lys(Воc)-ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре paзa и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), лиофилизовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии, как описывалось ранее, с получением 252 мг конечного очищенного пептида в виде белого твердого вещества.Nle: 0,80(1); Lys: 2,90(3); His: 2,12(2); Arg: 2,05(2); Тrр: не определено(1) Пример 54. Цикло(O18-D22)[A1,Nle8,O18,D22,L27]hPTH(131)NH2 (SEQ ID NO: 48) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Orn-Glu-Arg-Val-Asp)-Trp-Leu-Arg-LysLeu-Leu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys (Boc)-OH, Fmoc-Arg(Pmc)-ОН,Fmoc-Leu-OH,Fmoc-Trp-(Boc)-OH,FmocAsp(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Рmс)ОН, Fmoc-Glu(OtBu)-OH, Fmoc-Orn(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH, FmocLeu-OH, Fmoc-His(Trt)-OH, Fmoc-Lys(Воc)-ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Orn(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержавшей 0,1% TFA (100 мл), и лиофилиэовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии с получением 251 мг конечного очищенного пептида в виде белого твердого вещества.(1-31)NH2 (SEQ ID NO: 49) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Orn)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (Метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pmc)-ОН,Fmoc-Leu-OH, Fmoc-Trp-(Boc)-OH, FmnocOrn(Alloc)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)OH, Fmoc-Glu(OtBu)-OH, Fmoc-Asp(OAllyl)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH, FmocLeu-OH, Fmoc-His(Trt)-OH, Fmoc-Lys(Boc)-ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trfc)OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Оrn(Alloc) и Asp(OAllyi) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии с получением 414 мг конечного очищенного пептида в виде белого твердого вещества.Nle: 0,79(1); Lys: 1,98(2); His: 1,97(2); Arg: 1,97(2): Тrр: не определено (1). Пример 56. Цикло(K18-E22)[A1,Nle8,K18,E22,L27]hPTH(131)NH2 (SEQ ID NO: 50) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Glu)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-OH, Fmoc-Asp(OtBu)-OH,Fmoc-GIn(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pmc)-OH,Fmoc-Leu-OH, Fmoc-Trp(Вос)-ОН, Fmoc-Glu(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)-ОН,Fmoc-Glu(OtBu)-OH,Fmoc-Lys(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn-(Trt)-OH, FmocLeu-OH, Fmoc-His(Trt)-OH, Fmoc-Lys(Воc)-ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) и Glu(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии с получением 95 мг конечного очищенного пептида в виде белого твердого вещества.Nle: 0,87(1); Lys: 2,99(3); His: 1,86(2); Arg: 1,90(2); Тrр: не определено (1). Пример 57. Цикло(O18-E22)[A1,Nle8,O18,E22,L27]hPTH(131)NH2 (SEQ ID NO: 51) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Orn-Glu-Arg-Val-Glu)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного (синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)OH, Fmoc-GIn(Trt)-ОН, Fmoc-Leu-OH, FmocLeu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pmc)ОН, Fmoc-Leu-OH, Fmoc-Trp-(Boc)-OH, FmocGlu(OAllyl)-OH, Fmoc-Val-OH, Pmoc-Arg(Pmc)OH, Fmoc-Glu(OtBu)-OH, Fmoc-Orn(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH, FmocLeu-OH, Fmoc-His(Trt)-OH, Fmoc-Lys(Воc)-ОН,Fmoc-Gly-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH, FmocLeu-OH, Fmoc-GIn(Trt)-OH, Fmoc-Ile-OH, FmocGlu(OtBu)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Рd-опосредованного деблокирования боковой цепи остатков Оrn(Alloc) и Glu(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем неочищенный пептид очищали с помощью обращенно-фазовой жидкостной хроматографии с получением 237 мг конечного очи 53 щенного пептида в виде белого твердого вещества.(1-30)NH2 (SEQ ID NO: 52) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Asp)-Trp-Leu-Arg-Lys-LeuLeu-Gln-Asp-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Asp-(OtBu)-OH, Fmoc-GlnFmoc-Ala-OH. Затем, как описано выше, пептид,связанный со смолой, удаляли из аппарата дляPd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA; содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем часть неочищенного пептида очищали с помощью обращенно-фазовой жидкост 002819 54 ной хроматографии с получением 53 мг конечного очищенного пептида в виде белого твердого вещества.(1-29)NH2 (SEQ ID NO: 53) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Asp)-Trp-Lеu-Аrg-Lуs-LеuLеu-Gln-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-GIn-(Trt)-OH, Fmoc-Leu-OH,Fmoc-Leu-OH, Fmoc-Lys(Boc)-ОН, Fmoc-Arg(Boc)-ОН, Fmoc-Gly-OH, Pmoc-Leu-OH, FmocAsn(Trt)-OH, Fmoc-His(Trt)-OH, Fmoc-Nle-OH,Pmoc-Leu-OH, Fmoc-Gln(Trt)-OH, Fmoc-Ile-OH,Fmoc-Glu(OtBu)-OH, Fmoc-Ser-(tBu)-OH, FmocVal-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) иAsp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь".N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA,содержащей воды (2,0 мл),тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл),центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде, содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем часть неочищенного пептида очищали с помощью обращенно-фазовой жидкост 55 ной хроматографии с получением 100 мг конечного очищенного пептида в виде белого твердого вещества.Nle: 0,97(1); Lys: 2,99(3); His: 2,09(2); Arg: 1,99(2); Trp: не определено (1). Пример 60. Цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(128)NH2 (SEQ ID NO: 54) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Asp)-Trp-Lеu-Аrg-Lуs-LеuLеu-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Leu-ОН, Fmoc-Leu-OH, FmocLys(Boc)-ОН, Fmoc-Arg(Рmс)-ОН, Fmoc-LeuOH, Fmoc-Trp(Boc)-OH, Fmoc-Asp(OAllyl)-ОН,Fmoc-Val-OH, Fmoc-Arg(Pmc)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Lys(Alloc)-OH, Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Leu-OH,Fmoc-His(Trt)-OH, Fmoc-Lys(Boc)-OH, FmocGly-OH,Fmoc-Leu-OH,Fmoc-Asn(Trt)-OH,Fmoc-His(Trt)-OH, Fmoc-Nle-OH, Fmoc-Leu-OH,Fmoc-Gln(Trt)-OH,Fmoc-Ile-OH,Fmoc-GluFmoc-Ala-OH. Затем, как описано выше, пептид,связанный со смолой, удаляли из аппарата дляPd-опосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь - боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл),ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл TFA, содержащей воды (2,0 мл), тиоанизола (2,0 мл), фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем часть неочищенного пептида очищали с помощью обращенно-фазовой жидкост 002819 56 ной хроматографии с получением 51 мг конечного очищенного пептида в виде белого твердого вещества.Nle: 0,92;(1); Lys: 2,88(3); His: 2,03(2); Arg: 1,93(2); Trp: не определено (1). Пример 61. Цикло(K18-D22)[A1,Nle8,K18,D22,L27]hPTH(127)NH2 (SEQ ID NO: 55) Ala-Val-Ser-Glu-IleGln-Leu-Nle-His-Asn-Leu-Gly-Lys-His-Leu-AsnSer-(Lys-Glu-Arg-Val-Asp)-Trp-Lеu-Аrg-Lуs-Lеuамид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Leu-ОН, Fmoc-Lys(Boc)-ОН,Fmoc-Arg(Рmc)-ОН,Fmoc-Leu-OH,FmocTrp(Boc)-OH, Fmoc-Asp(OAllyl)-OH, Fmoc-ValOH, Fmoc-Arg(Рmc)-ОН, Fmoc-Glu-(OtBu)-OH,Fmoc-Lys(Alloc)-OH, Fmoc-Ser(tBu)-OH, FmocAsn(Trt)-OH, Fmoc-Leu-OH, Fmoc-His(Trt)-OH,Fmoc-Lys(Boc)-OH, Fmoc-Gly-OH, Fmoc-LeuOH,Fmoc-Asn(Trt)-OH,Fmoc-His(Trt)-OH,Fmoc-Nle-OH, Fmoc-Leu-OH, Fmoc-Gln(Trt)-OH,Fmoc-Ile-OH,Fmoc-Glu(OtBu)-OH,FmocSer(tBu)-OH, Fmoc-Val-OH и Fmoc-Ala-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pdопосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (17 мл). Связанный со смолой пептид последовательно промывали ДМФ (100 мл), ТГФ (100 мл) и диэтиловым эфиром (100 мл). Осушенную на воздухе смолу суспендировали в 40 мл ТFA,содержащей воды (2,0 мл), тиоанизола (2,0 мл),фенола (3,0 г) и этандитиола (1,0 мл). Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (160 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендиро-вали в диэтиловом эфире (120 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде, содержащей 0,1% TFA (100 мл), и лиофилизовали досуха. Затем часть неочищенного пептида очищали с помощью обращенно-фазовой жидкостной хроматографии, как описано ранее, с полу 57 чением 65 мг конечного очищенного пептида в виде белого твердого вещества.NH2 (SEQ ID NO: 56) Asn-Leu-Gly-Lys-His-LeuAsn-Ser-(Lys-Glu-Arg-Val-Asp)-Trp-Leu-АrgLys-Leu-Leu-Gln-Аsр-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод С). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp-(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pmc)-OH,Fmoc-Leu-OH,Fmoc-Trp(Boc)-OH,FmocAsp(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)OH, Fmoc-Glu-(OtBu)-OH, Fmoc-Lys(Allос)-ОН,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH и FmocLeu-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pdопосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь - боковая цепь". После описанных процедур обработки амидсодержащий связанный со смолой пептид возвращали в синтезатор для завершения синтеза и последовательно присоединяли следующие аминокислоты: Fmoc-His(Trt)-ОН, Fmoc-Lys(Boc)-ОН, Fmoc-Gly-OH,Fmoc-Leu-OH и Fmoc-Asn(Trt)-ОН. Затем часть этого связанного со смолой пептида (50 мг) удаляли из аппарата и N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (1 мл). Связанный со смолой пептид последовательно промывали ДМФ (10 мл), ТГФ (10 мл) и диэтиловым эфиром (10 мл). Осушенную на воздухе смолу суспендировали в 2 мл TFA, содержащей воду, тиоанизол, фенол и этандитиол в количествах, указанных ранее. Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (8 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (10 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме,растворяли в воде, содержащей 0,1% TFA (10 мл), и лиофилизовали досуха.(SEQ ID No:57) His-Asn-Leu-Gly-Lys-His-LeuAsn-Ser-(Lys-Glu-Arg-Val-Asp)-Trp-Leu-ArgLys-Leu-Lеu-Gln-Аsр-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод В). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp-(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-ОН, Fmoc-Arg(Pmc)-ОН,Fmoc-Leu-OH,Fmoc-Trp(Boc)-OH,FmocAsp(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)OH, Fmoc-Glu-(OtBu)-OH, Fmoc-Lys(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH и FmocLeu-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pdопосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". После описанных процедур обработки амидсодержащий пептид, связанный со смолой, возвращали в синтезатор для завершения синтеза и последовательно присоединяли следующие аминокислоты: Fmoc-His(Trt)-ОН,Fmoc-Lys(Boc)-ОН, Fmoc-Gly-OH, Fmoc-LeuOH, Fmoc-Asn(Trt)-ОН, Fmoc-His(Trt)-ОН. Затем часть этого связанного со смолой пептида(50 мг) удаляли из аппарата и N-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (1 мл). Связанный со смолой пептид последовательно промывали ДМФ (10 мл), ТГФ(10 мл) и диэтиловым эфиром (10 мл). Осушенную на воздухе смолу суспендировали в 2 млTFA, содержащей воду, тиоанизол, фенол и этандитиол в количествах, указанных ранее. Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (8 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (10 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (10 мл), и лиофилизовали досуха.NH2 (SEQ ID NO: 58) Nle-His-Asn-Leu-Gly-LysHis-Leu-Asn-Ser-(Lys-Glu-Arg-Val-Asp)-Trp-LеuArg-Lуs-Lеu-Leu-Gln-Аsр-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод В). Амидную смолу 59 МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-OH, Fmoc-Arg(Pmc)-ОН,Fmoc-Leu-OH,Fmoc-Trp-(Boc)-OH,FmocAsp(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Рmc)ОН, Fmoc-Glu-(OtBu)-OH, Fmoc-Lys(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH и FmocLeu-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pdопосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". После описанных процедур обработки амидсодержащий пептид, связанный со смолой, возвращали в синтезатор для завершения синтеза и последовательно присоединяли следующие аминокислоты: Fmoc-His(Trt)-ОН,Fmoc-Lys(Boc)-ОН, Fmoc-Gly-OH, Fmoc-LeuOH, Fmoc-Asn(Trt)-OH, Fmoc-His(Trt)-ОН иFmoc-Nle-ОН. Затем часть этого связанного со смолой пептида (50 мг) удаляли из аппарата иN-концевую защитную группу Fmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (1 мл). Связанный со смолой пептид последовательно промывали ДМФ (10 мл), ТГФ (10 мл) и диэтиловым эфиром (10 мл). Осушенную на воздухе смолу суспендировали в 2 мл TFA, содержащей воду, тиоанизол, фенол и этандитиол в количествах, указанных ранее. Через 2 ч раствор TFA фильтровали в третбутилметиловый эфир (8 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (10 мл), центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде,содержащей 0,1% TFA (10 мл), и лиофилизовали досуха.NH2 (SEQ ID NO: 59) Leu-Nle-His-Asn-Leu-GlyLys-His-Leu-Asn-Ser-(Lys-Glu-Arg-Val-Asp)-TrpLeu-Arg-Lys-Leu-Leu-Gln-Asp-Val-амид. Пептид получали способом, аналогичным описанному ранее (метод В). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)-OH, 002819(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)-OH,Fmoc-Glu-(OtBu)-OH,Fmoc-Lys(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-ОН и FmocLeu-OH. Затем, как описано выше, пептид, связанный со смолой, удаляли из аппарата для Pdопосредованного деблокирования боковой цепи остатков Lys(Alloc) и Asp(OAllyl) с последующей внутримолекулярной циклизацией "боковая цепь-боковая цепь". После описанных процедур обработки амидсодержащий пептид, связанный со смолой, возвращали в синтезатор для завершения синтеза и последовательно присоединяли следующие аминокислоты: Fmoc-His(Trt)-ОН,Fmoc-Lys(Boc)-ОН, Fmoc-Gly-OH, Fmoc-LeuOH,Fmoc-Asn(Trt)-ОН,Fmoc-His(Trt)-ОН,Fmoc-Nle-OH и Fmoc-Leu-OH. Затем часть этого связанного со смолой пептида (50 мг) удаляли из аппарата и N-концевую защитную группуFmoc удаляли в течение 5 мин с использованием раствора 20% пиперидина/ДМФ (1 мл). Связанный со смолой пептид последовательно промывали ДМФ (10 мл), ТГФ (10 мл) и диэтиловым эфиром (10 мл). Осушенную на воздухе смолу суспендировали в 2 мл TFA, содержащей воду,тиоанизол, фенол и этандитиол в количествах,указанных ранее. Через 2 ч раствор TFA фильтровали в трет-бутилметиловый эфир (8 мл) при 0 С, в результате чего осаждался неочищенный пептид. Эту пептидную смесь центрифугировали при 2500 об/мин в течение 5 мин и декантировали. Неочищенное белое твердое вещество ресуспендировали в диэтиловом эфире (10 мл),центрифугировали и декантировали. Эту процедуру промывки повторяли четыре раза и полученный пептид сушили в вакууме, растворяли в воде, содержащей 0,1% TFA (10 мл), и лиофилизовали досуха.NH2 (SEQ ID NO: 60) Gln-Leu-Nle-His-Asn-LeuGly-Lys-His-Leu-Asn-Ser-(Lys-Glu-Arg-Val-Asp)Trp-Leu-Arg-Lys-Leu-Leu-Gln-Аsр-Val-амид. Пептид получали способом, аналогичным описанному ранее (Метод В). Амидную смолу МВНА Rink (0,5 ммоль) загружали в реакционный сосуд, который затем подсоединяли к автоматическому пептидному синтезатору (ProteinTechnologies PS3). Методом твердофазного пептидного синтеза (ТФПС) на основе Fmoc последовательно присоединяли нижеследующие аминокислоты: Fmoc-Val-ОН, Fmoc-Asp(OtBu)-OH,Fmoc-Gln(Trt)-ОН, Fmoc-Leu-OH, Fmoc-LeuOH, Fmoc-Lys(Boc)-ОН, Fmoc-Arg(Pmc)-ОН,Fmoc-Leu-OH,Fmoc-Trp-(Boc)-OH,FmocAsp(OAllyl)-OH, Fmoc-Val-OH, Fmoc-Arg(Pmc)OH, Fmoc-Glu(OtBu)-OH, Fmoc-Lys(Alloc)-OH,Fmoc-Ser(tBu)-OH, Fmoc-Asn(Trt)-OH и FmocLeu-OH. Затем, как описано выше, пептид, свя
МПК / Метки
МПК: A61P 19/00, C07K 7/64, A61K 38/12
Метки: бициклопептидное, циклическое, соединение, применение, фармацевтическая, пептидное, композиция
Код ссылки
<a href="https://eas.patents.su/30-2819-ciklicheskoe-peptidnoe-soedinenie-i-ego-primenenie-biciklopeptidnoe-soedinenie-peptidnoe-soedinenie-i-ego-primenenie-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Циклическое пептидное соединение и его применение, бициклопептидное соединение, пептидное соединение и его применение, фармацевтическая композиция</a>
Предыдущий патент: Новые циклические соединения, имеющие циклоалкиленовую цепь, способ их получения и включающие их фармацевтические композиции
Следующий патент: Сульфамоильные соединения и фунгициды для сельского хозяйства и садоводства
Случайный патент: Способ и система передачи сигналов с использованием скачкообразной перестройки частоты












