Производные триазола в качестве антагонистов рецептора тахикинина
Номер патента: 7720
Опубликовано: 29.12.2006
Авторы: Ремик Дэвид Майкл, Амегадзие Альберт Кудзови, Эмбре Эрик Джеймс, Мюль Брайан Стефен, Савин Кеннет Аллен, Юнгхайм Луи Николас, Робертсон Майкл Алан, Хонг Дзиан Эрик, Гардинье Кевин Мэттью
Формула / Реферат
1. Соединение формулы (I)
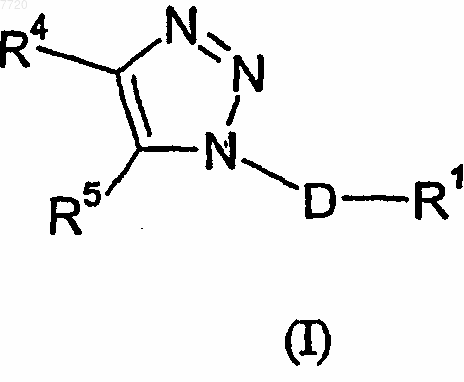
где
D означает (C1-C3)алкандиил;
R1 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила, цианогруппы, дифторметила, трифторметила и трифторметоксигруппы;
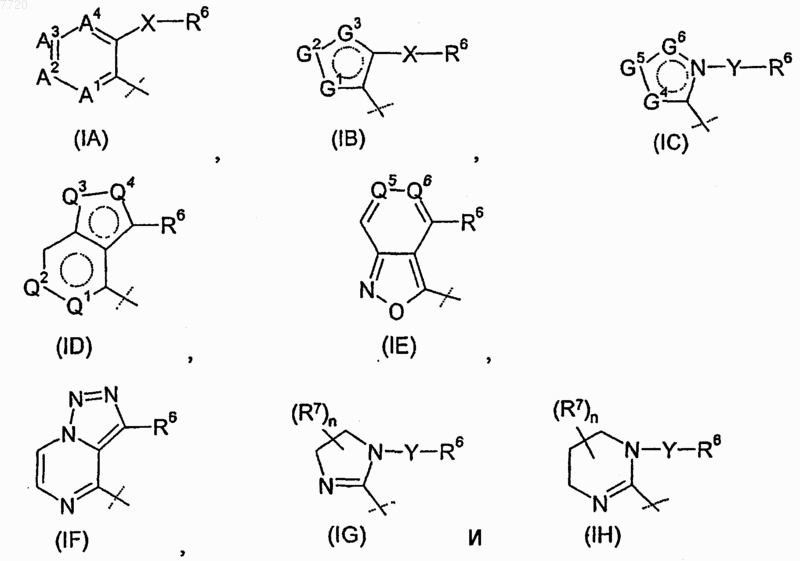
R4 означает радикал, выбираемый из группы, состоящей из

где -А1-А2-А3-А4- вместе с атомами, с которыми они связаны, образуют ароматический карбоцикл или гетероцикл, в котором каждый из А1, А2, А3 и А4 независимо означает -CR8- или атом азота, где по меньшей мере один из А1, А2, А3 и А4 должен означать -CR8-;
-G1-G2-G3- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G1, G2 и G3 независимо означает -CR8-, атом азота, кислорода или серы, где только один из G1, G2 и G3 может означать атом кислорода или серы;
-G4-G5-G6- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G4, G5 и G6 независимо означает -CR8- или атом азота;
каждый R8 независимо выбран из группы, состоящей из атома водорода, атома галогена, (C1-C4)алкила, замещенного (C1-C4)алкила, (С3-С6)циклоалкила, -NR12R13, трифторметила и трифторметоксигруппы;
R12 и R13, каждый независимо, означает атом водорода, (C1-C4)алкил или -С(O)-СН3, или R12 и R13 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
Q1, Q2, Q5 и Q6, каждый независимо, означают -СН- или атом азота;
Q3 и Q4, каждый независимо, означают атом кислорода или азота, где по меньшей мере один из Q3 и Q4 должен означать атом азота;
R6 означает (C1-C4)алкил, (С3-С6)циклоалкил, фенил или пиридил, причем фенил или пиридил необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;
R14 и R15, каждый независимо, означает атом водорода или (C1-C4)алкил, или R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
X означает связь, (С1-С3)алкандиил, -СН(ОН)-, -С(О)-, -O-, -S(O)p- или -C=N-OR9-;
Р означает 0, 1 или 2;
R9 означает атом водорода, (C1-C4)алкил или бензил;
Y означает связь, (C1-C3)алкандиил или -С(O)-;
N означает 0, 1 или 2;
каждый R7 независимо означает (C1-C4)алкил;
R5 означает атом водорода, атом галогена, трифторметил, (C1-C4)алкил, (С3-С6)циклоалкил, фурил, тиенил, пирролил, имидазолил, -NR16R17, пиридилоксигруппу, фенил, феноксигруппу, фенилтиогруппу, анилиногруппу, где фенил, феноксигруппа, фенилтиогруппа или анилиногруппа могут быть необязательно замещены в фенильном цикле одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила и -S(O)q[(C1-C4)алкила];
или радикал, выбираемый из группы, состоящей из

где W означает связь, -СН2-, -O-, -NR11- или -S(O)q-; q означает 0, 1 или 2;
R11 выбирают из группы, состоящей из атома водорода, (C1-C4)алкила, ацетила, фенила, бензила и
-S(O)2CH3;
Z1, Z2 и Z3, каждый независимо, означают -СН- или атом азота;
R16 и R17, каждый независимо, означают атом водорода или (C1-C4)алкил, при условии, что оба R16 и R17 не могут означать атом водорода;
или его фармацевтически приемлемая соль;
при условии, что соединение не является 5-(1-бензил-1,2,3-триазол-4-ил)фенилтетразолом.
2. Соединение по п.1, где
D означает метилен;
R1 означает фенил, который необязательно замещен одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, трифторметила и трифторметоксигруппы;
R4 означает радикал, выбираемый из группы, состоящей из
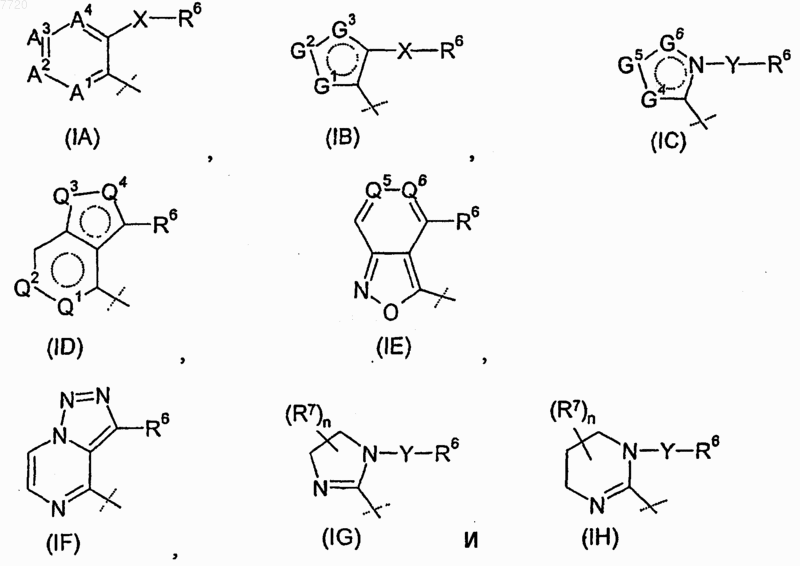
где -А1-А2-А3-А4- выбирают из группы, состоящей из -N-CR8-CR8-CR8-, -CR8-CR8-CR8-CR8-, -CR8-N-CR8-CR8-, -N-N-CR8-CR8-, -CR8-N-CR8-N-, -N-CR8-CR8-N- и -CR8-CR8-CR8-N-;
-G1-G2-G3- выбирают из группы, состоящей из -N-O-CR8-, -O-N-CR8-, -CR8-N-O-, -N-N-NH-, -NH-N-N-, -CR8-N-NH-, -N-CR8-NH- и -N-CR8-S-;
-G4-G5-G6- выбирают из группы, состоящей из -N-N-CR8-, -N-CR8-CR8- и -N-N-N-;
каждый R8 независимо выбирают из группы, состоящей из атома водорода, (C1-C4)алкила, замещенного (C1-C4)алкила, (С3-С6)циклоалкила, -NR12R13 и трифторметила; R12 означает атом водорода; R13 означает атом водорода или -С(O)-СН3; Q1 означает атом азота; Q2 означает -СН- или атом азота; Q3 означает атом азота или кислорода; Q4 означает атом азота или кислорода; Q5 означает -СН- или атом азота;
Q6 означает атом азота;
R6 означает фенил, причем фенил необязательно замещен одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила и морфолиногруппы;
X означает связь, (C1-C3)алкандиил, -СН(ОН)-, -С(О)- или -C=N-OR9-;
R9 означает атом водорода;
Y означает связь или (C1-C3)алкандиил;
n означает 0, 1 или 2;
каждый R7 независимо означает (C1-C4)алкил;
R5 означает атом галогена, (C1-C4)алкил, (С3-С6)циклоалкил, фенил, -NR16R17 или радикал, выбираемый из группы, состоящей из

где
W означает -O-, -NR11- или -S(O)q-; q означает 0, 1 или 2; R11 означает (C1-C4)алкил; Z1, Z2 и Z3, каждый независимо, означают -СН- или атом азота;
R16 означает (C1-C4)алкил; R17 означает (C1-C4)алкил;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, где R1 означает фенил, замещенный двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена и трифторметила.
4. Соединение по п.3, где R1 означает 3,5-бис-трифторметилфенил.
5. Соединение по любому из пп.1-4, где R6 означает фенил, причем фенил необязательно замещен одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила и морфолиногруппы.
6. Соединение по п.5, где R6 означает 2-хлорфенил.
7. Соединение по любому из пп.1-6, где X означает -С(О)-.
8. Соединение по любому из пп.1-7, где R5 означает фенил или радикал формулы (IK).
9. Соединение по п.8, где R5 означает фенил.
10. Соединение по п.8, где Z2 означает атом азота.
11. Соединение по п.10, где R5 означает пиридин-4-ил.
12. Соединение по любому из пп.1-11, где R4 означает радикал формулы (IA), (IB) или (IС).
13. Соединение по п.12, где R4 означает радикал формулы (IA).
14. Соединение по п.13, где -А1-А2-А3-А4- означает -N-CR8-CR8-CR8-, -CR8-CR8-CR8-N- или -N-N-CR8-CR8-.
15. Соединение по п.14, где -А1-А2-А3-А4- означает -N-CH-CH-CR8-.
16. Соединение по п.1, где соединение выбирают из группы, состоящей из
{4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанона;
{5-амино-3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридазин-4-ил}-(2-хлорфенил)метанона;
{2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанона;
{2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}фенилметанона;
{5-амино-3-[1-(3,5-бис-трифторметилбензил)-5-пиримидин-5-ил-1Н-[1,2,3]триазол-4-ил]пиридазин-4-ил}-(2-хлорфенил)метанона;
{4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанона;
{2-[1-(3,5-бис-трифторметилбензил)-5-пиразин-2-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанона;
{3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1Н-[1,2,3]триазол-4-ил]пиридазин-4-ил}-(2-хлорфенил)метанона;
{3-[1-(3,5-бис-трифторметилбензил)-5-пиримидин-5-ил-1Н-[1,2,3]триазол-4-ил]пиридазин-4-ил}-(2-хлорфенил)метанона;
{2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-трифторметилфенил)метанона;
{2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-фторфенил)метанона;
{3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-2-ил}-(2-хлорфенил)метанона;
[3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]-5-(1-гидрокси-1-метилэтил)изоксазол-4-ил]-(2-хлорфенил)метанона;
[3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1Н-[1,2,3]триазол-4-ил]-5-(1-гидрокси-1-метилэтил)изоксазол-4-ил]-(2-хлорфенил)метанона и
{2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанола.
17. Соединение, представляющее собой {2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанон.
18. Соединение, представляющее собой {4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанон.
19. Соединение, представляющее собой {5'-амино-3-[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]пиридазин-4-ил}-(2-хлорфенил)метанон.
20. Соединение, представляющее собой {4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]пиридин-3-ил}-(2-хлорфенил)метанонполугидрат.
21. Соединение, представляющее собой {5-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-ил]изоксазол-3-ил}метанол.
22. Соединение, выбранное из группы, состоящей из
[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]-[5-(2-хлорфенил)-3-(тетрагидропиран-2-илоксиметил)изоксазол-4-ил]метанона;
[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]-[5-(2-хлорфенил)-3-(2,2-диметоксиэтил)изоксазол-4-ил]метанона;
[1-(3,5-бис-трифторметилбензил)-5-фенил-1Н-[1,2,3]триазол-4-ил]-[5-(2-хлорфенил)-3-[1,3]диоксолан-2-илметилизоксазол-4-ил]метанона;
[1-(3,5-бис-трифторметилбензил)-5-пиразин-2-ил-1Н-[1,2,3]-триазол-4-ил]-[5-(2-хлорфенил)-3-(тетрагидропиран-2-илоксиметил)изоксазол-4-ил]метанона;
трет-бутилового эфира {2-[[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-карбонил]-(2-хлорбензил)амино]этил}карбаминовой кислоты;
трет-бутилового эфира {2-[[1-(3,5-бис-трифторметилбензил)-5-хлор-1Н-[1,2,3]триазол-4-карбонил] (2-хлорбензил)амино]этил}карбаминовой кислоты;
трет-бутилового эфира (2-{[1-(3,5-бис-трифторметилбензил)-5-хлор-1Н-[1,2,3]триазол-4-карбонил]-[1-(2-хлорфенил)этил]амино}этил)карбаминовой кислоты;
трет-бутилового эфира (2-{[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-карбонил]-[1-(2-хлорфенил)этил]амино}этил)карбаминовой кислоты;
трет-бутилового эфира {2-[[1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1Н-[1,2,3]триазол-4-карбонил]-(2-хлорбензил)амино]этил}карбаминовой кислоты;
трет-бутилового эфира (2-{[1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1Н-[1,2,3]триазол-4-карбонил]-[1-(2-хлорфенил)этил]амино}этил)карбаминовой кислоты;
(2-аминоэтил)-(2-хлорбензил)амиддигидрохлорида 1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-карбоновой кислоты;
(2-аминоэтил)-(2-хлорбензил)амидгидрохлорида 1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1Н-[1,2,3]триазол-4-карбоновой кислоты;
(2-аминоэтил)-[1-(2-хлорфенил)этил]амиддигидрохлорида 1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1Н-[1,2,3]триазол-4-карбоновой кислоты и
(2-аминоэтил)-[1-(2-хлорфенил)этил]амиддигидрохлорида 1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1Н-[1,2,3]триазол-4-карбоновой кислоты.
23. Фармацевтическая композиция, включающая соединение по п.1 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, эксципиентом или разбавителем.
24. Способ лечения состояния, ассоциированного с избытком тахикининов, включающий введение пациенту эффективного количества соединения формулы (I)
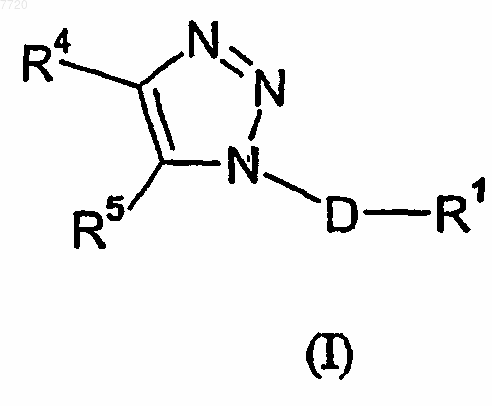
где D означает (C1-C3)алкандиил;
R1 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила, цианогруппы, дифторметила, трифторметила и трифторметоксигруппы;
R4 означает радикал, выбираемый из группы, состоящей из
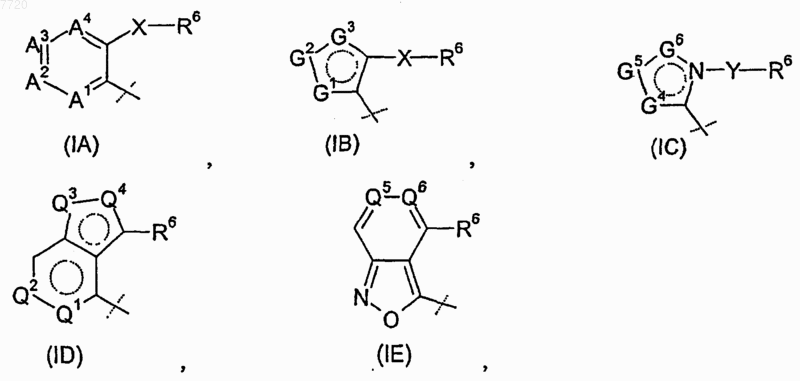
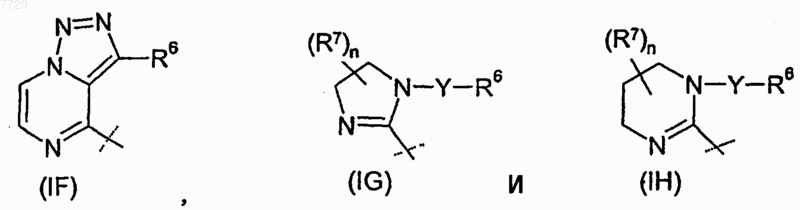
где
-А1-А2-А3-А4- вместе с атомами, с которыми они связаны, образуют ароматический карбоцикл или гетероцикл, в котором каждый из А1, А2, А3 и А4 независимо означает -CR8- или атом азота, где по меньшей мере один из А1, А2, А3 и А4 должен означать -CR8-;
-G1-G2-G3- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, т котором каждый из G1, G2 и G3 независимо означает -CR8-, атом азота, кислорода или серы, где только один из G1, G2 и G3 может означать атом кислорода или серы;
-G4-G5-G6- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G4, G5 и G6 независимо означает -CR8- или атом азота;
каждый R8 независимо выбран из группы, состоящей из атома водорода, атома галогена, (C1-C4)алкила, замещенного (C1-C4)алкила, (C3-C6)циклоалкила, -NR12R13, трифторметила и трифторметоксигруппы;
R12 и R13, каждый независимо, означает атом водорода, (C1-C4)алкил или -С(O)-СН3, или R12 и R13 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
Q1, Q2, Q5 и Q6, каждый независимо, означают -СН- или атом азота;
Q3 и Q4, каждый независимо, означают атом кислорода или азота, где по меньшей мере один из Q3 и Q4 должен означать атом азота;
R6 означает (C1-C4)алкил, (С3-С6)циклоалкил, фенил или пиридил, причем фенил или пиридил необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;
R14 и R15, каждый независимо, означает атом водорода или (C1-C4)алкил, или R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
X означает связь, (C1-C3)алкандиил, -СН(ОН)-, -С(О)-, -O-, -S(O)P- или -C=N-OR9-;
р означает 0, 1 или 2;
R9 означает атом водорода, (C1-C4)алкил или бензил;
Y означает связь, (C1-C3)алкандиил или -С(O)-;
n означает 0, 1 или 2;
каждый R7 независимо означает (C1-C4)алкил;
R5 означает атом водорода, атом галогена, трифторметил, (C1-C4)алкил, (С3-С6)циклоалкил, фурил, тиенил, пирролил, имидазолил, -NR16R17, пиридилоксигруппу, фенил, феноксигруппу, фенилтиогруппу, анилиногруппу, где фенил, феноксигруппа, фенилтиогруппа или анилиногруппа могут быть необязательно замещены в фенильном цикле одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила и -S(О)q[(C1-C4)алкила];
или радикал, выбираемый из группы, состоящей из

где W означает связь, -СН2-, -O-, -NR11- или -S(O)q-;
q означает 0, 1 или 2;
R11 выбран из группы, состоящей из атома водорода, (C1-C4)алкила, ацетила, фенила, бензила и
-S(O)2CH3;
Z1, Z2 и Z3, каждый независимо, означают -СН- или атом азота;
R16 и R17, каждый независимо, означают атом водорода или (C1-C4)алкил;
или его фармацевтически приемлемой соли.
25. Способ лечения депрессии, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I)
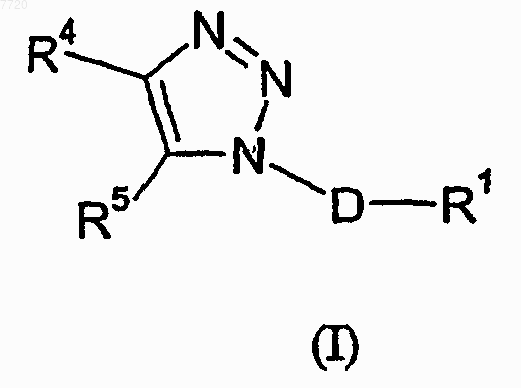
где D означает (C1-C3)алкандиил;
R1 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила, цианогруппы, дифторметила, трифторметила и трифторметоксигруппы;
R4 означает радикал, выбираемый из группы, состоящей из
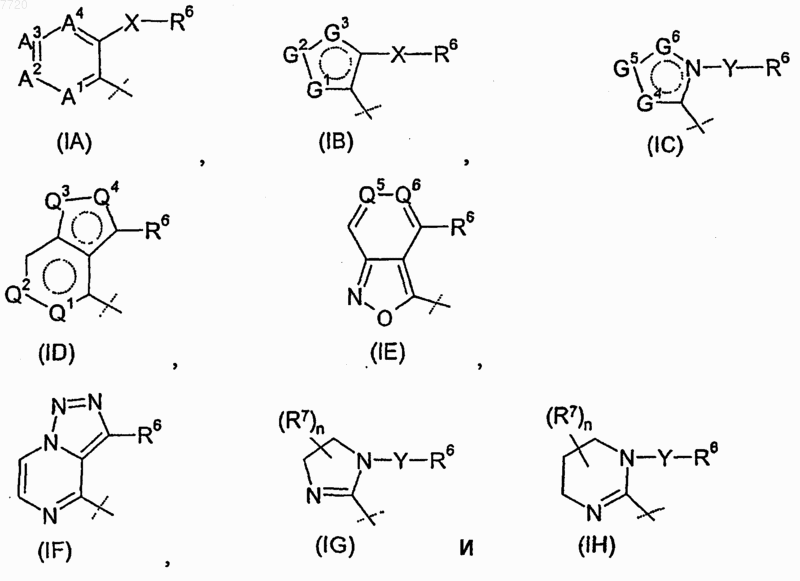
где -А1-А2-А3-А4- вместе с атомами, с которыми они связаны, образуют ароматический карбоцикл или гетероцикл, в котором каждый из А1, А2, А3 и А4 независимо означает -CR8- или атом азота, где по меньшей мере один из А1, А2, А3 и А4 должен означать -CR8-;
-G1-G2-G3- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G1, G2 и G3 независимо означает -CR8-, атом азота, кислорода или серы, где только один из G1, G2 и G3 может означать атом кислорода или серы;
-G4-G5-G6- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G4, G5 и G6 независимо означает -CR8- или атом азота;
каждый R8 независимо выбран из группы, состоящей из атома водорода, атома галогена, (C1-C4)алкила, замещенного (C1-C4)алкила, (С3-С6)циклоалкила, -NR12R13, трифторметила и трифторметоксигруппы;
R12 и R13, каждый независимо, означает атом водорода, (C1-C4)алкил или -С(O)-СН3, или R12 и R13 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
Q1, Q2, Q5 и Q6, каждый независимо, означают -СН- или атом азота;
Q3 и Q4, каждый независимо, означают атом кислорода или азота, где по меньшей мере один из Q3 и Q4 должен означать атом азота;
R6 означает (C1-C4)алкил, (С3-С6)циклоалкил, фенил или пиридил, причем фенил или пиридил необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;
R14 и R15, каждый независимо, означает атом водорода или (C1-C4)алкил, или R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
X означает связь, (C1-C3)алкандиил, -СН(ОН)-, -С(О)-, -O-, -S(O)p- или -C=N-OR9-;
р означает 0, 1 или 2;
R9 означает атом водорода, (C1-C4)алкил или бензил;
Y означает связь, (C1-C3)алкандиил или -С(О)-;
n означает 0, 1 или 2;
каждый R7 независимо означает (C1-C4)алкил;
R5 означает атом водорода, атом галогена, трифторметил, (C1-C4)алкил, (С3-С6)циклоалкил, фурил, тиенил, пирролил, имидазолил, -NR16R17, пиридилоксигруппу, фенил, феноксигруппу, фенилтиогруппу, анилиногруппу, где фенил, феноксигруппа, фенилтиогруппа или анилиногруппа могут быть необязательно замещены в фенильном цикле одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила и -S(O)q[(C1-C4)алкила];
или радикал, выбираемый из групяы, состоящей из

где
W означает связь, -СН2-, -O-, -NR11- или -S(O)q-; q означает 0, 1 или 2;
R11 выбран из группы, состоящей из атома водорода, (C1-C4)алкила, ацетила, фенила, бензила и
-S(O)2CH3;
Z1, Z2 и Z3, каждый независимо, означают -СН- или атом азота;
R16 и R17, каждый независимо, означают атом водорода или (C1-C4)алкил;
или его фармацевтически приемлемой соли.
26. Способ лечения состояния страха, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I)
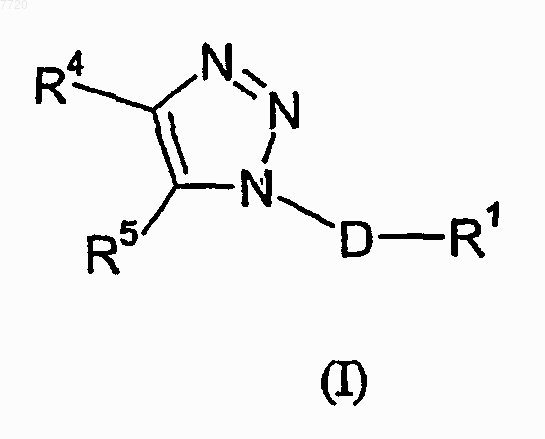
где
D означает (C1-C3)алкандиил;
R1 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила, цианогруппы, дифторметила, трифторметила и трифторметоксигруппы;
R4 означает радикал, выбираемый из группы, состоящей из
где -А1-А2-А3-А4- вместе с атомами, с которыми они связаны, образуют ароматический карбоцикл или гетероцикл, в котором каждый из А1, А2, А3 и А4 независимо означает -CR8- или атом азота, где по меньшей мере один из А1, А2, А3 и А4 должен означать -CR8-;
-G1-G2-G3- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G1, G2 и G3 независимо означает -CR8-, атом азота, кислорода или серы, где только один из G1, G2 и G3 может означать атом кислорода или серы;
-G4-G5-G6- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котоом каждый из G4, G5 и G6 независимо означает -CR8- или атом азота;
каждый R8 независимо выбран из группы, состоящей из атома водорода, атома галогена, (C1-C4)алкила, замещенного (C1-C4)алкила, (С3-С6)циклоалкила, -NR12R13, трифторметила и трифторметоксигруппы;
R12 и R13, каждый независимо, означает атом водорода, (C1-C4)алкил или -С(O)-СН3, или R12 и R13 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
Q1, Q2, Q5 и Q6, каждый независимо, означают -СН- или атом азота;
Q3 и Q4, каждый независимо, означают атом кислорода или азота, где по меньшей мере один из Q3 и Q4 должен означать атом азота;
R6 означает (C1-C4)алкил, (С3-С6)циклоалкил, фенил или пиридил, причем фенил или пиридил необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;
R14 и R15, каждый независимо, означает атом водорода или (C1-C4)алкил, или R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл;
X означает связь, (C1-C3)алкандиил, -СН(ОН)-, -С(О)-, -O-, -S(O)p- или -C=N-OR9-;
р означает 0, 1 или 2;
R9 означает атом водорода, (C1-C4)алкил или бензил;
Y означает связь, (C1-C3)алкандиил или -С(O)-;
n означает 0, 1 или 2;
каждый R7 независимо означает (C1-C4)алкил; R5 означает атом водорода, атом галогена, трифторметил, (C1-C4)алкил, (С3-С6)циклоалкил, фурил, тиенил, пирролил, имидазолил, -NR16R17, пиридилоксигруппу, фенил, феноксигруппу, фенилтиогруппу, анилиногруппу, где фенил, феноксигруппа, фенилтиогруппа или анилиногруппа могут быть необязательно замещены в фенильном цикле одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила и -S(O)q[(C1-C4)алкила];
или радикал, выбираемый из группы, состоящей из

где W означает связь, -СН2-, -O-, -NR11- или -S(O)q-;
q означает 0, 1 или 2;
R11 выбран из группы, состоящей из атома водорода, (C1-C4)алкила, ацетила, фенила, бензила и
-S(O)2CH3;
Z1, Z2 и Z3, каждый независимо, означают -СН- или атом азота;
R16 и R17, каждый независимо, означают атом водорода или (C1-C4)алкил;
или его фармацевтически приемлемой соли.
Текст
007720 Настоящее изобретение относится к соединениям формулы (I), содержащим их композициям и способу антагонизирования тахикининового рецептора подтипа NK-1, включающему введение пациенту эффективного количества соединения формулы (I). Кроме того, настоящее изобретение относится к способам получения соединений формулы (I) и их промежуточных продуктов. Тахикинины представляют собой семейство пептидов, которые широко распространены как в центральной, так и в периферической нервных системах. Эти пептиды вызывают ряд биологических эффектов из-за их воздействий на тахикининовые рецепторы. В настоящее время охарактеризованы три таких рецептора, в том числе подтипы NK-1, NK-2 и NK-3 тахикининового рецептора. В уровне техники вполне наглядно показана роль рецептора подтипа NK-1 в случае многочисленных нарушений центральной и периферической нервной системы. Например, считают, что рецепторыNK-1 задействованы в состояниях депрессии, страха и центральной регуляции различных автономных, а также сердечно-сосудистых и респираторных функций. Считают, что рецепторы NK-1 в спинном мозге задействованы в передаче боли, особенно боли, ассоциированной с мигренью и артритом. На периферии активация рецептора NK-1 причастна к многочисленным нарушениям, включая различные воспалительные нарушения, астму и расстройства желудочно-кишечного и мочеполового тракта. Существует все более широкое признание того, что селективные антагонисты рецептора NK-1 оказываются пригодными для лечения множества заболеваний центральной и периферической нервной системы. Несмотря на то, что многие из этих нарушений лечат с помощью новых лекарственных средств,по-прежнему имеется еще множество недостатков, связанных с существующими терапиями. Например,новейший класс антидепрессантов, селективных ингибиторов серотонина (SSRIs), все чаще назначают в случае лечения депрессии; однако, SSRIs обладают многочисленными побочными эффектами, включая тошноту, бессонницу, состояние страха и сексуальную дисфункцию. Это может существенно влиять на соблюдение больным режима и схемы лечения. В качестве другого примера, современные способы лечения в отношении провоцируемых химиотерапией тошноты и рвоты, такие как использование антагонистов рецептора 5-НТ 3, являются неэффективными вследствие замедленного устранения рвоты. Следовательно, получение антагонистов рецептора NK-1 значительно облегчит более эффективное лечение таких нарушений. Таким образом, настоящее изобретение относится к классу сильнодействующих непептидных антагонистов рецептора NK-1, композициям, включающим эти соединения, и способам применения соединений. Настоящее изобретение относится к соединениям формулы (I)R1 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1-C4)алкоксила, цианогруппы,дифторметила, трифторметила и трифторметоксигруппы;-А 1-А 2-А 3-А 4- вместе с атомами, с которыми они связаны, образуют ароматический карбоцикл или гетероцикл, в котором каждый из А 1, А 2, А 3 и А 4 независимо означает -CR8- или атом азота, где по меньшей мере один из А 1, А 2, А 3 и А 4 должен означать -CR8-;-G1-G2-G3- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G1, G2 и G3 независимо означает -CR8-, атом азота, кислорода или серы, где только один из G1, G2 и G3 может означать атом кислорода или серы;-G4-G5-G6- вместе с атомами, с которыми они связаны, образуют ароматический гетероцикл, в котором каждый из G4, G5 и G6 независимо означает -CR8- или атом азота; каждый R8 независимо выбран из группы, состоящей из атома водорода, атома галогена, (C1-C4)алкила, замещенного (C1-С 4)алкила, (С 3-С 6)циклоалкила, -NR12R13, трифторметила и трифторметоксигруппы;Q3 и Q4, каждый независимо, означают атом кислорода или азота, где по меньшей мере один из Q3 и 4Q должен означать атом азота;R6 означает (C1-C4)алкил, (C3-C6)циклоалкил, фенил или пиридил, причем фенил или пиридил необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;R14 и R15, каждый независимо, означает атом водорода или (C1-C4)алкил, или R14 и R15 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл; X означает связь, (C1-С 3)алкандиил,-СН(ОН)-, -С(О)-, -O-, -S(O)p- или -C=N-OR9-; р означает 0, 1 или 2;N означает 0, 1 или 2; каждый R7 независимо означает (C1-C4)алкил; R5 означает атом водорода, атом галогена, трифторметил, (C1-C4)алкил, (C3-C6)циклоалкил, фурил, тиенил, пирролил, имидазолил, -NR16R17, пиридилоксигруппу, фенил, феноксигруппу, фенилтиогруппу, анилиногруппу, где фенил, феноксигруппа, фенилтиогруппа или анилиногруппа могут быть необязательно замещены в фенильном цикле одним или двумя заместителями, независимо выбираемыми из группы, состоящей из атома галогена, (C1-C4)алкила, (C1C4)алкоксила и -S (О)q[(C1-C4)алкила]; или радикал, выбираемый из группы, состоящей изR11 выбирают из группы, состоящей из атома водорода, (C1-C4)алкила, ацетила, фенила, бензила иR16 и R17, каждый независимо, означают атом водорода или (C1-C4)алкил; или их фармацевтически приемлемой соли. Соединения формулы (I) являются антагонистами тахикининовых рецепторов. Конкретно, соединения формулы (I) являются антагонистами тахикининового рецептора подтипа NK-1. Так как эти соединения ингибируют физиологические эффекты, ассоциированные с избытком тахикининов, они пригодны для лечения многочисленных нарушений, связанных с активацией тахикининового рецептора. Эти нарушения включают: состояние страха, депрессию, психоз и шизофрению и другие психотические расстройства; нейродегенеративные нарушения, такие, как деменция, включая старческую деменцию типа Альцгеймера, болезнь Альцгеймера, ассоциированную со СПИДом деменцию и синдром Дауна; демиелинизирующие заболевания, такие, как рассеянный склероз и боковой амиотрофический склероз и другие невропатологические нарушения, такие, как периферическая невропатия, провоцируемая диабетом и химиотерапией невропатия, и невралгии после опоясывающего лишая и другие невралгии; острые и хронические обструктивные заболевания дыхательных путей, такие как респираторный дистресс-синдром у взрослых, бронхопневмония, бронхоспазм, хронический бронхит, сухой кашель и астма; воспалительные заболевания, такие как воспалительное заболевание пищеварительного тракта, псориаз, фиброз, остеоартрит и ревматоидный артрит; нарушения мышечно-скелетной системы, такие как остеопороз; аллергии, такие как экзема и ринит; связанные с повышенной чувствительностью (аллергические) нарушения,такие как "poison ivy"; офтальмические заболевания, такие как конъюнктивит, весенний конъюнктивит и тому подобное; кожные болезни, такие как контактный дерматит, атопический дерматит, крапивница и другие экзематоидные дерматиты; нарушения за счет аддикции, такие как алкоголизм; связанные со-2 007720 стрессом соматические расстройства; рефлекторную симпатическую дистрофию, такую как плечевой синдром; дистимические расстройства; побочные иммунологические реакции, такие как отторжение трансплантированных тканей и нарушения, связанные с иммунной активацией или супрессией, такие как системная красная волчанка; желудочно-кишечные расстройства или заболевания, ассоциированные с нейронной регуляцией внутренних органов, такие как неспецифический язвенный колит, болезнь Крона и синдром раздраженной толстой кишки; нарушения функции мочевого пузыря, такие как гиперрефлексия детрузора мочевого пузыря и недержание: атеросклероз; фиброзные и коллагеновые болезни, такие как склеродермия и эозинофильный фасциолез; раздражающие симптомы доброкачественной гипертрофии простаты; нарушения, ассоциированные с кровяным давлением, такие как гипертензия; или нарушения кровотока, вызываемые вазодилатацией, и вазоспастические заболевания, такие как ангина, мигрень и болезнь Рейно; рвоту, в том числе провоцируемую химиотерапией тошноту и рвоту; и боль или ноцицепцию, например, присущую какому-либо из вышеуказанных состояний или ассоциированную с ним. Согласно одному варианту осуществления, настоящее изобретение относится к фармацевтической композиции, включающей, в качестве активного ингредиента, соединение формулы (I) или его фармацевтически приемлемую соль, в комбинации с одним или более фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Согласно другому варианту осуществления, настоящее изобретение относится к способу получения соединения формулы (I) и его промежуточных продуктов. Согласно еще одному другому варианту осуществления настоящее изобретение относится к способу селективного антагонизирования рецептора NK-1 путем введения в контакт рецептора с соединением формулы (I) или его фармацевтически приемлемой солью. Согласно еще одному другому варианту осуществления, изобретение относится к способу лечения состояния, ассоциированного с избытком тахикининов, включающим введение пациенту, нуждающемуся в лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Таким образом, настоящее изобретение относится к применению соединения формулы (I) или композиции, содержащей его, для лечения нарушения, ассоциированного с избытком тахикининов. Согласно следующему аспекту настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для антагонизирования рецептора NK-1. Таким образом, настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения нарушения, ассоциированного с избытком тахикининов, с помощью вышеуказанного способа. Из вышеперечисленных нарушений имеют значение депрессия, состояние страха, шизофрения и другие психотические нарушения, рвота, боль, астма, воспалительное заболевание пищеварительного тракта, синдром раздраженной толстой кишки и дерматит. Из этих расстройств особое значение имеют депрессия и состояние страха. Таким образом, согласно предпочтительному варианту осуществления, настоящее изобретение относится к способу лечения основного депрессивного расстройства, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно другому предпочтительному варианту осуществления, настоящее изобретение относится к способу лечения расстройства, выраженного состоянием страха, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно следующему предпочтительному варианту осуществления, настоящее изобретение относится к способу лечения расстройства, выраженного состоянием паники, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно еще одному другому предпочтительному варианту осуществления, настоящее изобретение относится к способу лечения обсессивного компульсивного расстройства, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно еще одному другому предпочтительному варианту осуществления, настоящее изобретение относится к способу лечения социальной фобии, включающему введение пациенту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Подробное описание изобретения Термины и аббревиатуры, относящиеся к получению и к примерам в данном контексте, имеют обычные значения, если не указано иное. Например, "C" относится к градусам Цельсия; "н" (N) относится к термину "нормальный" или к нормальности; "моль" (mol) относится к молю или молям; "экв."(eq.) относится к эквиваленту; "г" (д) относится к грамму или граммам; "л" (L) относится к литру или литрам; "М" относится к термину "молярный" или к молярности; "рассол" (brine) относится к насыщенному водному раствору хлорида натрия; "МС" (MS) относится к масс-спектрометрии; "ЯМР" (NMR) относится к спектроскопии ядерного магнитного резонанса; "ТСХ" (TLC) относится к тонко-слойной хроматографии; "ACN" относится к ацетонитрилу; "ДМФА" (DMF) относится к N,N-диметилформамиду;-3 007720 к изопропанолу; "TEA" относится к триэтиламину; "ТФУК" (TFA) относится к трифторуксусной кислоте; "ТГФ" (THF) относится к тетрагидрофурану. Используемый в данном контексте, термин "(C1-C4)-алкил" относится к линейным или разветвленным, одновалентным насыщенным алифатическим цепям с 1-4 атомами углерода и включает, не ограничиваясь, метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Термин " (C1-C4)-алкил" включает " (C1-C3)алкил". Термин "замещенный (C1-C4)алкил" относится к линейной или разветвленной, одновалентной насыщенной алифатической цепи с 1-4 атомами углерода, подпадающей под вышеприведенное определение (C1-C4)алкила, которая, далее, замещена по любому из атомов углерода одним или вплоть до трех заместителями, независимо выбираемых из группы, состоящей из гидроксила, оксогруппы, атома галогена, (C1-C4)алкоксила, (C1-C4)алкоксикарбонила, =N(OH), морфолиногруппы и -NRaRb, где Ra означает Н или (C1-C4)алкил, Rb означает Н, (C1-C4)алкил или -С(O)-СН 3, или Ra и Rb вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл. Такие 4-7-членные циклы включают, не ограничиваясь,пирролидинил и пиперидиногруппу. Термин "(С 1-С 3)алкандиил" относится к линейной или разветвленной, двухвалентной насыщенной алифатической цепи с 1-3 атомами углерода и включает, но не ограничиваются, метилен, этилен, этан 1,1-диил, пропан-1,1-диил, пропан-1,2-диил, пропан-1,3-диил и пропан-2,2-диил. Термин "(C1-C4)алкоксил" означает линейную или разветвленную алкильную цепь с 1-4 атомами углерода, связанную с атомом кислорода. Типичные (C1-C4)алкоксильные группы включают метокси-,этокси-, пропокси-, изопропокси-, бутокси-, трет-бутоксигруппу, и тому подобное. Термин "(C1C4)алкоксил" включает "(C1-C3)алкоксил". Термин " (С 3-С 6)циклоалкил" означает насыщенную углеводородную циклическую структуру, содержащую от трех до шести атомов углерода. Типичные (С 3-С 6)циклоалкильные группы включают циклопропил, циклопентил, циклогексил, и тому подобное."Гало", "галоген" и "галогенид" означают атом хлора, фтора, брома или иода. Предпочтительными галогенами являются атомы хлора и фтора. Термин " (C1-C4)алкоксикарбонил" означает линейную или разветвленную (C1-C4)алкоксильную цепь, как определенная выше, которая связана через атом кислорода алкоксила с карбонильной частью. Типичные (C1-C4)алкоксикарбонильные группы включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил, и тому подобное. Термин "Рg" относится к защитной для спирта, карбоксила или аминогруппы группе. Типичные защитные группы включают тетрагидропиранил (ТНР), силаны, как триметилсилан (TMS), третбутилдиметилсилан (TBDMS) и трет-бутилдифенилсилан (TBDPS), метоксиметил (MOM), бензил (Вn),п-метоксибензил, формил, ацетил (Ас) и трет-бутоксикарбонил (t-BOC). Типичные, защитные для карбоксила группы могут включать метил, этил и трет-бутил. Выбор и использование защитных групп хорошо известны и указаны в уровне техники; см., например, Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience); Protecting Groups, Philip J. Kocienski, Thieme Medical Publishers, Inc.,Нью-Йорк, 1994, главы 2, 4, 6. Подразумевают, что, если R6 означает пиридил, радикал может представлять собой пиридин-2-ил,пиридин-3-ил или пиридин-4-ил. Если R5 означает фурил или тиенил, радикал может быть присоединен по положению 2 или 3. Когда R5 означает пирролил или имидазолил, радикал может быть присоединен по положению 1, 2 или 3. Соединения согласно настоящему изобретению могут находиться в виде стереоизомеров. Обозначения согласно Cahn-Prelog-Ingold (R)- и (S)- и обозначения L- и D- в стереохимии, соотносительно изомерам глицеральдегида, в настоящем контексте используют для указания конкретных изомеров. Конкретные изомеры могут быть получены путем стереоспецифического синтеза или могут быть разделены и извлечены известными из уровня техники методами, такими как хроматография на хиральных неподвижных фазах и фракционная перекристаллизация аддитивных солей, образуемых с реагентами, используемыми для этой цели. Пригодные методы разделения и извлечения индивидуальных стереоизомеров известны из уровня техники и описываются E.L. Eliel и S.H. Wilen, Stereochemistry of Organic Compounds,(Wiley-Interscience, 1994) и J. Jacques, A. Collet и S.H. Wilen, Enantiomers, Racemates and Resolutions,(Wiley-Interscience, 1981). Подразумевают, что настоящее изобретение охватывает все энантиомеры и смеси энантиомеров, включая рацематы. Специалисту в данной области понятно, что соединения согласно настоящему изобретению могут находиться в виде таутомеров. Подразумевают, что таутомерные формы соединений формулы (I) также входят в рамки настоящего изобретения. Настоящее изобретение включает фармацевтически приемлемые соли соединений формулы (I). Соединение согласно настоящему изобретению может содержать достаточно основную функциональную группу, которая может реагировать с любой из ряда неорганических и органических кислот с образованием фармацевтически приемлемой соли.-4 007720 Термин "фармацевтически приемлемая соль", используемый в данном контексте, относится к соли соединения вышеприведенной формулы (I). Должно быть понятно, что индивидуальный противоион,образующий часть любой соли согласно настоящему изобретению, обычно не имеет критической природы до тех пор, пока соль является фармацевтически приемлемой и пока противоион не придает нежелательные качества соли. Соединение формулы (I) и промежуточные продукты, описанные в настоящем контексте, образуют фармацевтически приемлемые аддитивные соли кислоты с большим разнообразием органических и неорганических кислот и включают физиологически приемлемые соли, которые часто используют в фармацевтической химии. Такие соли также составляют часть настоящего изобретения. Фармацевтически приемлемую аддитивную соль кислоты получают из фармацевтически приемлемой кислоты, как хорошо известно из уровня техники. Такие соли включают фармацевтически приемлемые соли, перечисленные вJornal of Pharmaceutical Science, 66, 2-19 (1977), которые известны специалисту в данной области. Типичные неорганичекие кислоты, используемые для получения солей, включают соляную, бромоводородную,иодоводородную, азотную, серную, фосфорную, гипофосфорную, метафосфорную, пирофосфорную кислоты и подобные. Также могут быть использованы соли, происходящие от органических кислот, таких,как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиовые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты. Такие фармацевтически приемлемые соли, таким образом, включают ацетат, фенилацетат,трифторацетат, акрилат, аскорбат, бензоат, хлорбензоат, динитробензоат, гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, гидроксибутират, бутин-1,4-дикарбоксилат, гексин-1,4-дикарбоксилат, капрат, каприлат, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат,манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, пропиолят, пропионат,фенилпропионат, салицилат, себацинат, сукцинат, суберат, бензолсульфонат, п-бромбензолсульфонат,хлорбензолсульфонат, этилсульфонат, 2-гидроксиэтилсульфонат, метилсульфонат, нафталин-1 сульофонат, нафталин-2-сульфонат, нафталин-1,5-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобные. Используемый в данном контексте термин "пациент" относится к млекопитающему, которое страдает одним или более нарушениями, ассоциированными с избытком тахикининов. Морские свинки, собаки, кошки, крысы, мыши, лошади, крупный рогатый скот, овцы и люди являются примерами млекопитающих. Подразумевают, что в высшей степени предпочтительным пациентом является человек. Также подразумевают, что настоящее изобретение относится конкретно к ингибированию рецептора NK-1 млекопитающего. Также известно, что специалист в данной области может воздействовать на нарушения путем лечения пациента, в данный момент страдающего расстройствами, или путем профилактической обработки пациента, страдающего расстройствами, с помощью эффективного количества соединения формулы (I). Таким образом, подразумевают, что термины "обработка" и "лечение" относятся к процессам, где они могут означать замедление, прерывание, задержку, регулирование или прекращение прогрессирования нарушений (расстройств), описываемых в данном контексте, и подразумевают, что профилактическая обработка в случае таких нарушений включает, однако, непременно не означает, полную ликвидацию всех симптомов нарушения. Используемый в данном контексте термин "эффективное количество" соединения формулы (I) относится к количеству, которое эффективно при лечении описанных в данном контексте нарушений. Что касается любой группы фармацевтически активных соединений, некоторые группы являются предпочтительными в отношении их целенаправленного применения. Предпочтительные варианты осуществления настоящего изобретения описываются ниже. Предпочтительными содинениями являются такие, в которых R4 означает радикал формулы (IA),(IB) или (IС). В высшей степени предпочтительной группой R4 является радикал формулы (IA). Предпочтительные варианты осуществления настоящего изобретения, где R4 означает радикал формулы (IA), приводятся ниже:(j) R1 означает фенил, замещенный двумя заместителями, выбираемыми из группы, состоящей из атома галогена и трифторметила;(l) R5 означает радикал формулы (IK), где Z2 означает атом азота;(r) R6 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)-алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;(t) предпочтительные соединения, в которых R4 означает радикал формулы (IA), включают: 2-[1(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил) метанон; 4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-фенил-1 Н-[1,2,3]триазол-4-ил]пиридин-3 ил(2-хлорфенил)метанон; 5-амино-3-[1-(3,5-бис-трифторметилбензил)-5-фенил-1 Н-[1,2,3]триазол-4-ил] пиридазин-4-ил-(2-хлорфенил)метанон; 4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил 1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил)метанон; 5-амино-3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридазин-4-ил-(2-хлорфенил)метанон; 2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил)метанон; 2-[1(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-илфенилметанон; 5 амино-3-[1-(3,5-бис-трифторметилбензил)-5-пиримидин-5-ил-1 Н-[1,2,3]триазол-4-ил]пиридазин-4-ил(2-хлорфенил)метанон; 4-амино-2-[1-(3,5-бис-трифторметилбензил)-5-морфолин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил)метанон; 2-[1-(3,5-бис-трифторметилбензил)-5-пиразин-2-ил-1 Н[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил)метанон; 3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1 Н-[1,2,3]триазол-4-ил]пиридазин-4-ил-(2-хлорфенил)метанон; 3-[1-(3,5-бис-трифторметилбензил)-5-пиримидин-5-ил-1 Н-[1,2,3]триазол-4-ил]пиридазин-4-ил-(2-хлорфенил)метанон; 2-[1-(3,5 бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-трифторфенил)метанон; 2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2 фторфенил)метанон; 3-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-2-ил-(2-хлорфенил)метанон; и 2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]пиридин-3-ил-(2-хлорфенил)метанол. Предпочтительные варианты осуществления настоящего изобретения, где R4 означает радикал формулы (IB), приводятся ниже:(d) R1 означает фенил, замещенный двумя заместителями, выбираемыми из группы, состоящей из атома галогена и трифторметила;(f) R5 означает радикал формулы (IK), где Z2 означает атом азота;(1) R6 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;(n) предпочтительные соединения, в которых R4 означает радикал формулы (IB), включают: [3-[1(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол-4-ил]-5-(1-гидрокси-1-метилэтил)изоксазол-4-ил]-(2-хлорфенил)метанон и [2-[1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1 Н-[1,2,3] триазол-4-ил]-5-(1-гидрокси-1-метилэтил)изоксазол-4-ил]-(2-хлорфенил)метанон. Предпочтительные варианты осуществления настоящего изобретения, где R4 означает радикал формулы (IС), приводятся ниже:(c) R1 означает фенил, замещенный двумя заместителями, выбираемыми из группы, состоящей из атома галогена и трифторметила;(e) R5 означает радикал формулы (IK);(h) R5 означает радикал формулы (IJ) , где W означает -О- или -NR11-;(l) R6 означает фенил, который необязательно замещен от одного до трех заместителями, независимо выбираемыми из группы, состоящей из атома галогена, цианогруппы, (C1-C4)алкила, (C1-C4)алкоксила, трифторметила, трифторметоксигруппы, морфолиногруппы и -NR14R15;(m) R6 означает 2-хлорфенил. Специалисту понятно, что дополнительные предпочтительные варианты осуществления могут быть подобраны путем комбинации вышеуказанных предпочтительных вариантов осуществления или путем ссылки на приведенные ниже примеры. Схемы Раскрываемые в данном контексте соединения могут быть получены согласно следующим схемам и примерам. Примеры никоим образом нельзя понимать с точки зрения ограничения объема притязаний изобретения, во всяком случае относительно получения соединений. Специалисту понятно, что введение некоторых заместителей может вызывать появление асимметрии в соединениях формулы (I). Настоящее изобретение относится ко всем энантиомерам и смесям энантиомеров, включая рацематы. Предпочтительно, чтобы соединения согласно изобретению, содержащие хиральные центры, являлись индивидуальными энантиомерами. Соединения согласно настоящему изобретению могут быть получены множеством способов, некоторые из которых проиллюстрированы нижеприводимыми схемами. Специалисту в данной области должно быть понятно, что отдельные стадии, представленные на нижеследующих схемах, можно варьировать для получения соединений формулы (I). Специфическая последовательность стадий, необходимых для получения соединений формулы (I), зависит от синтезируемого конкретного соединения, исходного соединения и относительной лабильности замещенных остатков. Схема 1 Согласно схеме 1, триазолы формулы (3) получают путем реакции сложного бета-кетоэфира формулы (2), такого, как бета-кето-(C1-C6)алкиловый или -бензиловый сложный эфир, с азидом формулы (1). Такого рода циклизации хорошо известны и представлены в уровне техники. См. Savini и др., Farmaco,49 (5), 363-370 (1994); Martini и др., J. Pharm. Sci., 77(11), 977-980 (1988); Sun и др., Magn. Reson. Chem.,36(6), 459-460 (1998); Settimo и др., Farmaco Ed. Sci., 38(10), 725-737 (1983); Olsen и др., J. Heterocycl.(3) может быть выделен и очищен способами, хорошо известными из уровня техники, такими как осаждение, фильтрация, экстракция, выпаривание, порошкование, хроматография и перекристаллизация. Азиды формулы (1) являются коммерчески доступными соединениями или могут быть синтезированы из соответствующих галогенидных или сульфонатных сложноэфирных производных путем реакции с донором азидогруппы, таким как NaN3, LiN3 или тетрабутиламмонийазид (BU4NN3), причем предпочтителен NaN3, в подходящей смеси растворителей, как ДМСО и вода. Альтернативно, специалисту также должно быть понятно, что в случае реакции на стадии "а" вместо сложного бета-кетоэфира может быть использовано малонатное производное. Как малонаты, так и сложные бета-кетоэфиры хорошо известны и представлены в уровне техники. См. Benetti S., RomagnoliR., De Risi С., Zanirato Z. "Mastering -Keto Esters", Chem. Rev., 95, 1065-1114 (1995). Если в качестве исходного реагента выбирают диалкилмалонаты, R5 в полученном продукте формулы (3) представляет собой гидроксильную группу. Гидроксильная группа может быть легко превра-7 007720 щена в соответствующий промежуточный галогенид. Этот тип превращения хорошо известен и представлен в уровне техники. См. Buckle D.R., Rockell C.J.M., J. Chem. Soc. Perkin I, 627-630 (1982). Стадия "b" представляет собой восстановление эфира 1 Н-[1,2,3]триазол-4-карбоновой кислоты формулы (3) с получением 1 Н-[1,2,3]триазол-4-илметанола формулы (4). Такие стадии восстановления хорошо известны и представлены в уровне техники. См. Larock R.C., Comprehensive Organic Transformations, второе издание, 1999, John Wiley and Sons, c. 1117-1120. Согласно одному варианту стадии "b", эфир 1 Н-[1,2,3]-триазол-4-карбоновой кислоты формулы (3) может быть восстановлен с помощью подходящего восстановителя, такого, как боргидрид натрия, литийалюминийгидрид, боргидрид лития или диизобутилалюминийгидрид, причем предпочтительным восстановителем является боргидрид натрия. Такие реакции восстановления обычно проводят в растворителе, таком как метанол, этанол, изопропанол, тетрагидрофуран, толуол, дихлорметан, или их смеси. Предпочтительным растворителем является абсолютный этанол. Продукт может быть выделен и очищен вышеописанными способами. Окисление алкилгидроксигруппы в соединении формулы (4) хорошо известно из уровня техники. Характерный пример представлен на стадии "с", согласно которой 1 Н-[1,2,3]триазол-4-ил-метанол формулы (4) можт быть окислен путем введения его во взаимодействие с окислителем, таким, как оксид марганца. Другие окислители включают комплекс триоксида серы с пиридином, 1,1,1-триацетокси-1,1 дигидро-1,2-бензиодоксол-3(1 Н)-он (реагент Dess-Martin), пиридинийхлорхромат, пиридинийдихромат и каталитический тетрапропиламмонийперрутенат (ТРАР) с N-метилморфолин-N-оксидом (NMO) в качестве соокислителя. Альдегиды формулы (5) могут быть выделены вышеописанными способами. Гидролиз эфиров карбоновых кислот формулы (3) с получением соответствующих карбоновых кислот формулы (6) представляет собой хорошо известную реакцию; см. Larock R.C., Comprehensive Organic Transformations, второе издание, 1999, John Wiley and Sons, c. 1959-1968. Например, соответствующий сложный эфир формулы (3) растворяют в подходящем растворителе, таком, как метанол или диоксан и вода, и обрабатывают подходящим основанием, таким, как NaOH или LiOH, получая соединение формулы (6). Реакция, представленная на стадии "е", согласно которой карбоновую кислоту, такую как кислота формулы (6), вводят в реакцию связывания с соответствующим амином в стандартных условиях реакции связывания пептидов, хорошо известна специалисту в данной области. Конкретно, амин и карбоновую кислоту вводят в реакцию связывания в присутствии реагента связывания пептидов, необязательно в присутствии катализатора. Подходящие реагенты связывания пептидов включают N,N'-карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC) и 1-(3-(1-пирролидинил)-3-этилкарбодиимид (РЕРС). Подходящие катализаторы для реакции связывания включают N,N-[диметил]-4-аминопиридин(DMAP). Такие реакции связывания хорошо известны и представлены в уровне техники. См. Larock R.C.,Comprehensive Organic Transformations, второе издание, 1999, John Wiley and Sons, с 1941-1949. Альтернативно, соединение формулы (6) может быть превращено в хлорангидрид кислоты, предпочтительно, путем реакции с оксалилхлоридом и диметилформамидом, и использовано для ацилирования соответствующего амина с получением соединения формулы (7). Такие реакции ацилирования хорошо известны и представлены в уровне техники. См. Larock R.C., Comprehensive Organic Transformations, второе издание, 1999, John Wiley and Sons, c. 1929-1930. Продукт может быть выделен и очищен вышеописанными способами. Специалист также может принимать во внимание получение амидов формулы (7) путем прямого взаимодействия эфира карбоновой кислоты формулы (3), при использовании триалкилалюминиевого реагента, с соответствующим амином, или при использовании амида магния, получая соединения формулы (7). Соединение формулы (7) затем можно подвергать восстановлению, на стадии "g", путем обработки подходящим восстановителем, таким, как диизобутилалюминийгидрид, литийалюминийгидрид или комплекс бора и метилсульфида, получая альдегиды формулы (5). См. Larock R., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк, 1999, с. 1269-1271. Схема 2 Алкинилкетоны формулы (9) могут быть синтезированы из альдегидов формулы (5) (см. схему 1) или производных N-метил-N-метоксиамида формулы (10).-8 007720 Стадия "h" представляет собой реакцию присоединения алкинил-аниона к альдегиду формулы (5) или N-метил-N-метоксиамиду формулы (9). Алкиниланион получают за счет обработки соответствующего алкина подходящим основанием, таким как метиллитий, н-бутиллитий, трет-бутиллитий, диизопропиламид лития, предпочтительно метил- или этилмагнийбромид. Когда используют альдегиды формулы(5), промежуточное гидроксильное соединение формулы (8) может быть окислено с образованием кетона формулы (9). Такие реакции хорошо известны из уровня техники. См. Larock R., Comprehensive OrganicTransformations, второе издание, Wiley-VCH: Нью-Йорк, 1999, с. 1234-1246. Альтернативно, если используют производные N-метил-N-метоксиамида формулы (10), получают непосредственно соединения формулы (9) . Схема 3 Станнаны формулы (13) могут быть получены путем реакции соответствующего азида формулы (1) с соответствующим станнилацетиленом формулы (12). Реагенты смешивают в подходящем растворителе, таком, как бензол, хлороформ, тетрагидрофуран, предпочтительно толуол, и нагревают до полного протекания реакции. Соединение формулы (13) выделяют и очищают способами, известными из уровня техники и описанными выше. Станнилацетилены формулы (12) коммерчески легко доступны или могут быть получены из соединений формулы (11) или (14). Соединение формулы (11) может быть растворено в соответствующем растворителе, таком, как тетрагидрофуран, с последующим добавлением бис(трибутил)оловооксида и соответствующего десилилирующего агента, такого, как тетрабутиламмонийфторид (TBAF) или триметилсиланолят калия. Альтернативно, соединение формулы (12) получают путем растворения алкина в соответствующем растворителе, таком, как простой эфир или тетрагидрофуран, при температуре от -15 до -10 С. К этой смеси добавляют н-бутиллитий, затем трибутилоловохлорид. Соединение формулы (12) может быть использовано непосредственно или выделено и очищено вышеописанными способами. Получение различных станнилацетиленов формулы (12) описано в разных источниках. Например,см. Международные заявки WO-00/51614, WO-00/01702, WO-98/46228; Lambert и др., Journal of the(2000). Силилацетилены формулы (11) легко коммерчески доступны. Альтернативно, специалист в данной области принимает во внимание, что соединения формулы (11) могут быть получены путем реакции соответствующего арилгалогенида с триметилсилилацетиленом, приводящей к образованию силилалкина. Реакцию проводят в присутствии иодида меди и палладиевого катализатора, такого как дихлорбис(трифенилфосфин)палладий-(II). Другими подходящими катализаторами являются Pd(Ph3)4,Pd2dba3CHCl3 или Pd(OAc)2. Схема 4-9 007720 Для получения соединения формулы (17), где L может означать атом галогена, триметилсилил(TMS) или трифторметансульфонат (трифлат), предпочтительно атом брома, гетероарил формулы (18) обрабатывают подходящим основанием, таким, как диизопропиламид лития (LDA) или литийтетраметилпиперидин (LiTMP), в подходящем растворителе, таком, как простой эфир или предпочтительно тетрагидрофуран, и затем вводят во взаимодействие с коммерчески доступным альдегидом, согласно стадии"n", получая замещенный гетероарил формулы (17), где X означает -СН(ОН)-. Соединения формулы (17) могут быть выделены и очищены вышеописанными способами. Альтернативно, в случае соединений формулы (17), где А 2 и А 4 оба означают атом азота, 5 бромпиримидин формулы (18) и коммерчески доступный альдегид растворяют в подходящем растворителе, таком как простой эфир, и нагревают до температуры кипения с обратным холодильником. Добавляют подходящее основание, такое как LDA, получая соединение формулы (17), которое может быть выделено и очищено вышеописанными способами. См. ссылку: Kress T.J., J. Org. Chem., 44(13), 20812082 (1979). Специалисту в данной области известно, что использование соответствующего замещенного дисульфидного соединения типа R6-X-X-R6 вместо альдегида также приводит к соединениям формулы(17), где X означает серу. Соединения формулы (17), где X означает -СН(ОН)-, могут быть окислены способами, хорошо известными из уровня техники, с получением кетона формулы (17), в которой X означает -С(О)-. Например, спирт может быть растворен в подходящем растворителе, таком, как толуол или СН 2 Сl2, после чего добавляют MnO2. Кетон может быть выделен и очищен способами, которые хорошо известны из уровня техники. Как правило, понятно, что для получения соединения формулы (17), где X означает -С(О)-, могут быть использованы другие окислительные условия. Например, окисление можно осуществлять путем использования периодинана Dess-Martin. Другие окислительные условия хорошо известны из уровня техники См. Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк,1999, с. 1234-1246. Как видно, в случае стадии "m", кетоны формулы (17), где А 1 и А 2 оба означают атом азота, альтернативно могут быть получены путем реакции дигидропиридазинона формулы (15) с соответствующим альдегидом формулы (19) в присутствии подходящего основания, такого, как NaOH или KОН, в подходящем растворителе, таком, как метанол или этанол. Предпочтительной комбинацией является KОН в этаноле. Соединение формулы (16), где X означает метилен, выделяют и очищают способами, хорошо известными из уровня техники и описанными выше. Метиленовую группу затем можно окислять, получая соединение формулы (16), где X означает -С(О)-, путем обработки раствором уксусной кислоты и бихромата натрия и при нагревании. Гидроксипиридазин формулы (16) затем вводят во взаимодействие с бромирующим агентом, таким, как оксибромид фосфора, получая соединение формулы (17), которое выделяют и очищают как описано выше. См. ссылки: Kandile N., Acta Chimica Hungarica, 829 (1990); Ismail M., Indian J. Chem., 1007 (1998); Ismail M. , Synthetic Communications, 3609 (1998). Схема 5 Согласно схеме 5, путь 1, соединения формулы (I), где каждый из А 1, А 2, А 3 и А 4 означает CR8, могут быть получены из соединений формулы (23), где X означает -С(О)-. Специалист в данной области- 10007720 знает, что условия получения таких арильных групп хорошо известны из уровня техники. Например, соединение формулы (23), где X означает -С(О)-, может быть введено во взаимодействие с пироном в хлорбензоле с получением соединений формулы (24), где А 1, А 2, А 3 и А 4, каждый, означают -СН-. Продукт формулы (I) очищают способами, хорошо известными специалисту в данной области, такими как хроматография на силикагеле. Соединения формулы (22) могут быть получены из альдегида формулы (5), который описывается в случае схемы 1. Альдегид вводят во взаимодействие со сложным эфиром, таким, как диметиловый эфир(1-диазо-2-оксопропил)фосфоновой кислоты, получая алкин формулы (23). Реакцию проводят в соответствующем растворителе, таком, как метанол или этанол. Специалисту в данной области известно, что соединение формулы (23), где X означает -СН(ОН)-, может быть получено из алкинов формулы (22) по реакции, подобной описанной в случае схемы 2, приведенной выше. Кроме того, соединение формулы (23), где X означает -СН(ОН)-, может быть подвергнуто окислению с получением соединения формулы (23), где X означает -С(О)-, способами, известными из уровня техники и описанными выше в случае схемы 4. Согласно схеме 5, путь 2, стадия "р", палладиевый катализатор, такой как Pd(PPh3)4, Pd2dba3. CHCl3,Pd(OAc)2 или дихлорбис(трифенилфосфин)палладий, добавляют к дегазированному раствору галогенида или трифлата формулы (17) и станнана формулы (13). Предпочтительным палладиевым катализатором для реакции на стадии "р" является Pd2dba3CHCl3. Реакцию проводят в подходящем растворителе, таком как бензол, толуол или, предпочтительно, диметилформамид, в герметически закрытом сосуде в атмосфере N2. Продукт формулы (24) может быть выделен и очищен как описано выше. Кетоны формулы (I) могут быть восстановлены с получением соединений, где X означает-СН(ОН)-, путем обработки литийалюминийгидридом. Продукт может быть выделен и очищен способами, описанными выше. Подобные превращения описаны и известны из уровня техники. Альтернативно, соединение формулы (I) может быть получено при использовании промежуточного продукта формулы (21), как показано в случае пути 3. Бромид формулы (17) растворяют в соответствующем растворителе, таком, как бензол или толуол, и добавляют алкин или алкинилстаннат. Реакцию проводят в присутствии палладиевого катализатора, такого, как Pd(PPh3)2Cl2, Pd2dba3CHCl3 или тетракис(трифенилфосфин)палладий, используемого индивидуально или в сочетании с CuI. Продукт, алкил формулы (21), затем вводят во взаимодействие с соответствующим азидом формулы (I), получение которого описывается схемой 1, в подходящем растворителе, таком как толуол, и при нагревании, получая соединение формулы (I). Соединения формулы (I) могут быть выделены и очищены способами, известными из уровня техники и описанными выше. Схема 6 Соединения формулы (I), где R4 означает радикал формулы (ID), получают как представлено на схеме 6, путь 1. В каждом из соединений формул (9), (25), (26) и (27) X означает связь. Соединения формулы (25) могут быть получены из алкинов формулы (9) (описано в случае схемы 2). Специалисту в данной области известна циклизация алкина формулы (9) с помощью нитрилоксида, получаемого путем соответствующего взаимодействия замещенного нитроалкана, в присутствии изоцианата, и основания, такого, как триэтиламин, или путем взаимодействия необязательно замещенного хлороксима в присутствии триэтиламина, с получением соединений формулы (25), где Q3 и Q4 означают N и О, соответственно. В отношении примеров такой циклизации см. Joule J.A., Mills K., Heterocyclic Chemistry, 4 издание,Blackwell Science, Inc.: Maiden, MA, 2000, c. 442-448; Hussein Ahmed Q., El-Abadelah Mustafa M., SabriWail S., Heterocycles from nitrile oxides I; J. Heterocycl. Chem., 20(2), 301-304 (1983). Специалисту в данной области известно, что из соединений формулы (25), где Pg означает защитную группу, такую, как ТНР или триметилсилан, можно удалять защитную группу, как представлено на стадии "u". Защищенный спирт растворяют в подходящем растворителе, таком как метанол или этанол, и обрабатывают кислотой,такой как п-толуолсульфокислота (p-TsOHH2O) или камфорсульфокислота (CSA). Альтернативно, спирт может быть высвобожден путем обработки смесью тетрагидрофурана, воды и уксусной кислоты. Продукт выделяют и очищают как описано выше или используют далее без очистки. В случае соединений формулы (25) или (26), где R5 означает атом галогена, такой как атом хлора, можно осуществлять замещение с помощью соответствующего нуклеофила, такого как, например, первичные амины, вторичные амины, спирты или тиолы, для расширения круга соединений, подпадающих под формулу (25) или (26). См. March J., Advanced Organic Chemistry, 1985, John Wiley and Sons, Inc., c. 255-446. Как представлено на стадии "v", содержащие гидроксильную группу соединения формулы (26) могут быть подвергнуты окислению с получением соединений формулы (27) при использовании способов,которые хорошо известны специалисту в данной области, как представлено на схеме 1, стадия "с". Например, спирт может быть окислен путем реакции со смесью из диметилсульфоксида, оксалилхлорида и триэтиламина в CH2Cl2. Те и другие окислительные условия описаны у Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк, 1999, с. 1234-1246. Специалист в данной области также может использовать ацетальную группу, вместо гидроксильной группы в соединении формулы (26), для получения альдегидов формулы (27) путем обработки содержащего ацетальную группу соединения в водных кислых условиях. Соединения формулы (I) , где оба Q1 и Q2 означают атом азота, могут быть получены из альдегидов формулы (27), где Rx означает связь, в условиях, хорошо известных в уровне техники. Конкретно, гидразин добавляют к альдегиду формулы (27) в подходящем растворителе, таком, как уксусная кислота. Другими подходящими растворителями являются метанол и этанол. Продукт формулы (I) может быть выделен и очищен способами, хорошо известными из уровня техники, такими как флэш-хроматография. Специалисту в данной области известно, что, когда Q1 означает атом азота и Q2 означает CR8, соединение формулы (I) может быть получено из соответствующего альдегида формулы (27) (где Rx означает метилен) путем обработки с помощью соответствующего источника аммиака, такого как ацетат аммония или аммиак, в соответствующем растворителе, таком как уксусная кислота, метанол или этанол. Продукт может быть выделен и очищен способами, которые хорошо известны из уровня техники. Соединения формулы (I) , где R4 означает бициклический радикал формулы (IF), могут быть получены как представлено в случае пути 2. В каждом из соединений формул (9), (29) и (30) X означает связь. Кетоальдегид формулы (30) может быть получен из соединений формулы (29) в условиях реакции, хорошо известных специалисту в данной области. Если Rx означает 2,2-диметоксиэтил или 2,2 диэтоксиэтил, ацеталь растворяют в смеси из ацетона и воды и добавляют подходящую кислоту, такую как п-толуолсульфокислота, камфорсульфокислота или НСl. Альтернативно, как известно специалисту в данной области, реакцию можно осуществлять в автоклаве в смеси уксусной кислоты и воды. Продукт формулы (30) выделяют и очищают способами, хорошо известными из уровня техники и описанными выше.Rx также может быть гидроксильной группой, защищенной с помощью подходящей защитной группы, такой как ТНР или триметилсилан. В случае таких соединений формулы (29), удаляют защитную группу от защищенной гидроксильной группы и затем окисляют на стадиях "u" и "v", рассмотрен- 12007720 ных выше в случае пути 1. Соединения формулы (29) могут быть синтезированы путем введения во взаимодействие соединений формулы (9) и азидов формулы (1) в реакционных условиях, описанных выше в случае схемы 3, стадия "k". Альдегид формулы (30) может быть превращен в соединение формулы (I), где R4 означает радикал формулы (IF), как представлено в случае стадии "у". Соответствующий источник аммиака, такой как ацетат аммония или аммиак, добавляют к раствору альдегида формулы (30) в соответствующем растворителе, таком как уксусная кислота. Другие подходящие растворители хорошо известны из уровня техники и включают безводный метанол, этанол или тетрагидрофуран. Соединение формулы (I) может быть выделено и очищено способами, хорошо известными из уровня техники. Схема 7 На схеме 7 наглядно показано, что соединения формулы (I), которые представлены соединениями формул (31)-(34), могут быть далее подвергнуты превращению для расширения круга соединений согласно изобретению. Специалисту в данной области известно, что бициклические соединения формулы(32) можно подвергать расщеплению по связи N-O, получая соединения формулы (31), где R4 означает радикал формулы (IA) и где А 3 означает -СН- и А 4 означает -CR8, причем R8 означает NH2. Такая реакция представлена на схеме 7, стадия "z". Конкретно, бициклический изоксазол растворяют в подходящем растворителе, таком как ацетонитрил. К реакционному раствору добавляют молибденгексакарбонил и воду. Специалисту в данной области известно, что для осуществления реакции раствор можно нагревать. Продукт формулы (32) очищают способами, известными из уровня техники, такими как хроматография на силикагеле или перекристаллизация. Такие реакции описаны в уровне техники. См. Nitta и др., J.Chem. Soc, Chem. Commun., 877 (1982). Альтернативно, расщепление связи N-O можно осуществлять при использовании H2/Pt-C в герметически закрытом автоклаве. Как представлено в случае стадии "аа", аминозамещенное соединение формулы (32) можно подвергать реакции деаминирования, получая соединение, в котором А 3 и А 4 оба означают -СН-. Амин растворяют в подходящем растворителе, таком как тетрагидрофуран, и к раствору добавляют нитрит, такой как изоамилнитрит или трет-бутилнитрит. Продукт реакции концентрируют и очищают способами, хорошо известными из уровня техники. Альтернативно, амин формулы (32) может быть далее замещен, как представлено в случае стадии"bb". Амин растворяют в пиридине и добавляют ацилирующий агент, такой, как уксусный ангидрид или ацетилхлорид. Другие пригодные сорастворители включают CH2Cl2, тетрагидрофуран и диэтиловый эфир. Продукт реакции может быть выделен и очищен способами, хорошо известными специалисту в данной области, включая хроматографию на силикагеле. Реакция хорошо известна в уровне техники, как описывается Greene и др., Protective Groups in Organic Synthesis, Нью-Йорк, John Wiley and Sons, c. 251253 (1981) . Схема 8- 13007720 Согласно схеме 8, альдегиды формулы (5) (описанные в случае схемы 1) могут быть обработаны гидроксиламингидрохлоридом и солью карбоновой кислоты, такой, как ацетат натрия, в подходящем растворителе, таком, как метанол, для получения соединений формулы (36). Такие реакции хорошо известны из уровня техники. См. Bousquet E.W., Org. Syn., II, 313 (1943). Соединения формулы (36) могут быть обработаны хлорирующим агентом, таким как Nхлорсукцинимид, в подходящем растворителе, таком как диметилформамид, с получением гидроксиимидоилхлоридов формулы (37). Эта реакция также хорошо известна в уровне техники. См. Torsell K.B.G.,Nitriles Oxides, Nitrones and Nitronates in Organic Synthesis, VCH: Weinheim, 1998. Соединения формулы(37) пригодны для получения соединений формулы (I), где R4 означает радикал формулы (IB), как указывается ниже на схеме 10. Схема 10 Согласно схеме 10, соединения формулы (I) могут быть обработаны нитроалкильным или замещенным нитроалкильным соединением и изоцианатом, таким как 1,4-фенилдиизоцианат, в присутствии подходящего основания, такого как триэтиламин. Реакцию обычно проводят в подходящем растворителе,таком как толуол или бензол, получая соединения формулы (I), где -G1-G2-G3- означает либо -O-N-CR8-,либо -CR8-N-O-. В случае соединений формулы (I), где R5 означает атом галогена, такой, как атом хлора,также известно, что можно осуществлять нуклеофильное замещение, как описывается в случае схемы 6,для дальнейшего расширения значений радикала R5. Если соединения формулы (I) содержат защитную для гидроксила группу, защитную группу можно отщеплять путем последующей обработки продукта реакции с помощью подходящей кислоты, такой как п-толуолсульфокислота, камфорсульфокислота (CSA) или НСl, в растворителе, таком как метанол, этанол или тетрагидрофуран. Продукты могут быть очищены способами, известными специалисту в данной области, такими, как колоночная хроматография. Нитроалканы и замещенные нитроалканы хорошо известны из уровня техники. Такие соединения являются коммерчески доступными или могут быть легко получены путем реакции нитрометана с карбонильным соединением, или, альтернативно, путем замещения галогенида, используя нитрит серебра или нитрит натрия. См. Simoni D. и др., Tetrahedron Lett., 3815, 2749-2752 (1997); Simoni D. и др., Tetrahedron Lett., 41(10), 1607-1610 (2000); Dauben H.J.Jr., Org. Synth., IV, 221 (1963). Соединения, в которых -G1-G2-G3- означает -CH-N-CH-, могут быть получены путем обработки соединений формулы (23) диазометаном, таким как триметилсилилдиазометан, в подходящем растворителе, таком, как толуол. Реакцию осуществляют главным образом в герметически закрытом автоклаве при нагревании. Полученный пиразол может быть концентрирован и очищен способами, известными из уровня техники. Смесь таутомерных форм соединения формулы (I), где -G1-G2-G3- означает -N-N-NH- и -NH-N-N-,получают путем взаимодействия соединений формулы (23) с триметилсилилазидом в подходящем растворителе, таком, как толуол. Реакцию обычно проводят в герметически закрытом автоклаве при нагревании. Смесь может быть очищена способами, известными специалисту в данной области, такими, как колоночная хроматография. Альтернативно, соединения формулы (I), где -G1-G2-G3-означает -N-O-CR8-, могут быть получены путем обработки соединений формулы (37) с помощью алкинов формулы (38), стадия "ее". Реакцию обычно проводят в присутствии основания, такого, как триэтиламин, в подходящем растворителе, таком. как этилацетат или простой эфир. См. Hussein А. и др., J. Heterocycl. Chem., 20(2), 301-304 (1983). Соединения формулы (38) могут быть получены в условиях, известных специалисту в данной области, таких, как добавление соответствующего алкинильного аниона к N-метил-N-метоксиамиду или к соответствующему альдегиду с последующим окислением промежуточно образующегося спирта. См.,например, основные способы у Suzuki K. и др., J. Org. Chem., 52, 2929 (1987). Условия для этой реакции описаны выше. Соединения формулы (I), в которых X означает -С(О)-, могут быть восстановлены с получением соединений, в которых X означает -СН(ОН)- или метиленовый остаток. Это восстановление может быть осуществлено путем реакции кетона с гидридом, таким как литийалюминийгидрид, в подходящем растворителе, таком, как тетрагидрофуран, с получением спирта. Спирт может быть далее восстановлен путем обработки триэтилсиланом и кислотой, такой как уксусная кислота или трифторуксусная кислота. Используют подходящий растворитель, такой как дихлорметан. Продукты этих реакций могут быть вы- 14007720 делены и очищены при использовании способов, хорошо известных из уровня техники. В отношении способов восстановления см. Larock R.C., Comprehensive Organic Transformations, второе издание, WileyVCH: Нью-Йорк, 1999, с. 44-46. Схема 11 Соединения формулы (I), в которых -G1-G2-G3- означает -N-CR8-S-, могут быть получены из соединения формулы (10), которое описывается в случае схемы 2. Конкретно, соединение формулы (10) может быть обработано енолятом, полученным из кетона, такого, как 1-(2-хлорфенил)этанон, и основанием, таким, как диизопропиламид лития, в подходящем растворителе, таком, как тетрагидрофуран, с получением соединения формулы (40). Соединение формулы(40) может быть обработано галогенирующим агентом, таким, как бром, в подходящем растворителе,таком, как смесь дихлорметана и воды, с получением соединения формулы (41). Соединение формулы (I) может быть получено путем обработки соединения формулы (41) с помощью подходящего конденсирующего агента, такого, как тиоамид или тиомочевина, в присутствии осушителя, такого, как молекулярные сита. Пригодными растворителями являются этанол, ацетон, метанол, СН 2 Сl2, тетрагидрофуран или диэтиловый эфир. Соединение формулы (I), где R8 означает -NH2, может быть деаминировано, как описано выше (см. схему 7). Кроме того, связывающий фрагмент -Х- в формуле (I) можно подвергать восстановлению, как описано выше. Схема 12 Соединения формулы (I), где -G4-G5-G6- означает -N-N-N-, могут быть получены путем обработки соединений формулы (43) с помощью пентахлорида фосфора в подходящем растворителе, таком как дихлорметан. После полного удаления растворителя, полученный остаток обрабатывают азидом, таким как азид натрия, в подходящем растворителе, таком как диметилформамид. Превращения типа, описываемого в случае схемы 12, хорошо известны из уровня техники. Например, см. Butler R.N., Advances in Heterocyclic Chemistry; под ред. Katrizky A.R., Boulton A.J.; Academic: Нью-Йорк, 1977, том 21, с.378; Thomas E., Synthesis, 767 (1993) и указанные там ссылки. Соединения формулы (I), где -G4-G5-G6- означает -N-N-CR8-, также могут быть получены из соединения формулы (43). Более конкретно, соединения формулы (43) обрабатывают пентахлоридом фосфора,затем соответствующим гидразидом, в подходящем растворителе, таком, как дихлорэтан или толуол. См.RFied W., Peters В., Liebigs Ann. Chem., 124 (1969). Вместо пентахлорида фосфора может быть использован оксихлорид фосфора (см. Amer A. и др., J. Heterocyclic Chem., 549 (1994. Альтернативно, соединения формулы (I), где -G4-G5-G6-означает -N-N-CR8-, могут быть получены из соединений формулы (45), которые в свою очередь могут быть получены из соединений формулы(43). Более конкретно, соединения формулы (43) могут быть обработаны вводящим меркаптогруппу агентом, таким, как реагент Lawesson [2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисуль- 15007720 фид], в подходящем растворителе, таком как толуол, с получением соединений формулы (45). См. Tanaka Н., Nakao Т., J. Heterocyclic Chem., 34, 921 (1997). Специалисту в данной области известно, что реагентLawesson может быть заменен другими, вводящими меркаптогруппу агентами, такими, как пентасульфид фосфора (Schwartz G., Org. Synth., III, с. 322 (1955. Соединения формулы (45) могут быть обработаны гидразином и ацилирующим агентом, таким, как ацилгалогенид, ангидрид или сложный ортоэфир, в подходящем растворителе, таком, как пиридин. Последующая обработка кислотой, такой, как п-толуол-сульфокислота, приводит к соединениям формулы На схеме 13 представлены дальнейшие превращения заместителя R8 в 1,2,4-триазолах, где R8 означает замещенный алкил. Специалисту в данной области известно, что подобные превращения могут быть осуществлены в случае любого заместителя R8 в радикалах формулы (IA), (IB) или (IС). Соединения формулы (47), которые подпадают под формулу (I), могут быть получены путем удаления защитной группы от защищенного первичного спирта формулы (46). Может быть использована защитная группа, такая, как TIPS. Такое введение защитных для спирта групп и их удаление легко осуществляют способами, хорошо известными из уровня техники ("Protecting Groups in Organic Synthesis",Theodora Greene (Wiley-Interscience. Соединения формулы (48), которые подпадают под формулу (I), могут быть получены путем окисления соответствующих спиртов формулы (47). Условия окисления могут включать использование комплекса триоксида серы с пиридином при добавлении основания, такого, как триэтиламин. Реакцию проводят в соответствующем растворителе, таком, как диметилсульфоксид. Другие условия окисления представлены Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк, 1999, с. 1234-1246. Соединения формулы (50), которые подпадают под формулу (I), также могут быть получены путем восстановительного аминирования альдегидов формулы (48) с помощью соответствующего амина. Подходящими восстановителями могут быть триацетилнатрийборгидрид, цианоборгидрид натрия и боргидрид натрия. Соответствующие растворители могут включать метанол, 1,2-дихлорэтан или этанол. Реакции восстановительного аминирования хорошо известны из уровня техники. Основной ссылкой является следующая: Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк,1999, с. 835-846. Продукт реакции может быть выделен и очищен при использовании способов, хорошо известных из уровня техники. Соединения формулы (50) могут быть получены в результате замещения галогена амином. Замещение галогена может быть осуществлено путем реакции хлорметиленового производного и соответствующего амина. Продукт реакции может быть выделен и очищен способами, хорошо известными из уровня техники. Эти способы включают экстракцию, выпаривание, хроматографию и перекристаллизацию. Согласно пути 2, соединения формулы (52), которые подпадают под формулу (I), могут быть синтезированы путем восстановления соответствующего сложного эфира до спирта. Сложный эфир растворяют в тетрагирофуране или другом соответствующем растворителе, таком как этанол или метанол, и добавляют восстановитель, такой как боргидрид лития, боргидрид натрия или литийалюминийгидрид. Продукт реакции может быть выделен и очищен способами, хорошо известными из уровня техники. Другие условия восстановления представлены Larock R.C., Comprehensive Organic Специалисту в данной области также известно получение соединений формулы (I), где -G1-G2-G3 означает -N-CR8-NH-. Характерный пример такого получения представлен на схеме 13. В случае стадии"рр" описывается конденсация альдегидов формулы (5) с промежуточным метилен(толуол-4-сульфонилметил)амином формулы (53) в присутствии цианида натрия в подходящем растворителе, таком какN,N-диметилформамид или этанол. Соответствующий промежуточный 4-(толуол-4-сульфонил)-4,5 дигидрооксазол формулы (54) может быть превращен в имидазольные соединения формулы (I) путем нагревания со смесью из спиртового раствора аммиака в высококипящем растворителе, таком как ксилолы, хлорбензол или толуол. Превращение в имидазол хорошо известно и представлено в уровне техники. См. Buchi G., Heterocycles, 139 (1994); Van Leusen A.M., Tetrahedron Lett., 2369 (1972). Соответствующий промежуточный метилен(толуол-4-сульфонилметил)амин формулы (53) может быть синтезирован путем реакции алкилирования тозилметил-изоцианида с соответствующим алкилгалогенидом и основанием,таким, как гидрид калия или гидрид натрия. Схема 15 Соединения формулы (56), которые подпадают под формулу (I), где R8 означает гидроксиметил или гидроксиэтил, могут быть получены путем удаления защитной группы из защищенного спирта, как описано выше. Такое удаление защитных групп легко осуществляют способами, хорошо известными из уровня техники. (Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Специалисту известно, что получаемая гидроксильная группа R8 может быть окислена при образовании соединений формулы (57), которые подпадают под формулу (I) , где Rx означает связь или метиленовую группу и где R8 означает замещенный оксогруппой алкил. Спирт может быть подвергнут окисле- 17007720 нию с помощью различных окислителей, таких как окисление под воздействием периодинана DessMartin или комбинации диметилсульфоксида и триэтиламина с оксалилхлоридом. Такие реакции окисления легко осуществляют способами, хорошо известными из уровня техники.(Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк, 1999,с. 1234-1246). Продукт реакции может быть выделен и очищен способами, хорошо известными из уровня техники. Соединения формулы (57), где R8 означает замещенный оксогруппой алкил, также могут быть получены путем удаления защитной группы из соответствующего ацеталя. Такое удаление защитных групп легко осуществляют способами, хорошо известными из уровня техники. (Protecting Groups in Organic(57), в котором R8 означает альдегидную или ацетальдегидную группу. Соединения формулы (I) могут быть синтезированы путем взаимодействия соответствующего, содержащего альдегидную группу соединения формулы (57) с ацетатом аммония или гидразином в кислых условиях, как, например, в уксусной кислоте. Когда Rx означает метиленовую группу и реагентом является ацетат аммония, получают соединения формулы (I), где Q5 означает -CR8-и Q6 означает атом азота,или при использовании гидразина в качестве реагента, когда Rx означает связь, получают соединения формулы (I), где Q5 и Q6 означают атом азота. Схема 16 Согласно пути 1 схемы 16 описывается получение соединений формулы (63), которые подпадают под формулу (I), путем введения во взаимодействие диамина формулы (60) и сложных эфиров формулы(3). Понятно, что если Rx означает либо связь, либо метиленовую группу, эта реакция может протекать с образованием соединений формулы (I), где R4 означает радикал формулы (IG) или (IH), соответственно. Реакцию можно осуществлять в присутствии соответствующего растворителя, такого, как толуол или бензол. Раствор диамина в толуоле обрабатывают с помощью триметилалюминия и затем добавляют соответствующий сложный эфир в виде раствора в соответствующем растворителе, таком, как толуол или бензол. Реакционную смесь нагревают до полного протекания реакции. Продукт реакции может быть выделен и очищен способами, хорошо известными из уровня техники. Эти способы включают экстракцию, выпаривание, хроматографию и перекристаллизацию. Соединения формулы (60) могут быть получены путем реакций восстановительного аминирования, обычно путем смешения N-защищенного аминоальдегида с соответствующим амином, или, альтернативно, специалист в данной области может осуществлять смешение монозащищенного диамина с соответствующим альдегидом и с подходящим восстановителем, таким как триацетоксиборгидрид натрия, цианоборгидрид натрия или боргидрид натрия. Соответствующими растворителями могут быть метанол, 1,2-дихлорэтан или этанол. Основной ссылкой,которая может быть рекомендована в отношении реакционных условий, является Larock R.C., Comprehensive Organic Transformations, второе издание, Wiley-VCH: Нью-Йорк, 1999, с. 835-846. Далее может следовать удаление защитных групп. Альтернативно, согласно представленному пути 2, соединения формулы (63), которые подпадают под формулу (I), могут быть получены путем алкилирования соединений формулы (62). Реакции алкилирования этого типа хорошо известны в литературе. Соответствующим растворителем для таких реакций является диметилформамид. Подходящее, не являющееся нуклеофильным, основание может представлять собой карбонат калия. Иодид натрия добавляют в каталитическом количестве.- 18007720 Соединения формулы (62) обычно получают путем реакции сложных эфиров формулы (3) и коммерчески доступных диаминов в присутствии триметилалюминия. Продукты могут быть очищены способами, описанными выше. Согласно пути 3, описывается получение соединения формулы (63) путем реакции соответствующего аминоамида формулы (64) в присутствии пентахлорида фосфора в подходящем растворителе, таком, как хлороформ, при кипячении с обратным холодильником; стадия "хх". Соединения формулы (63) могут быть очищены способами, описанными выше. Специалисту в данной области известно, что соединения формулы (64) могут быть получены путем превращения соединений формулы (43) согласно схеме 12. Специалисту в данной области известно, что имидазолины формулы (63) (где Rx означает связь) могут быть далее подвергнуты ароматизации с получением соединений формулы (63), где R4 означает радикал формулы (1 С) и -G4-G5-G6- означает -N-CR8-CR8-, которые подпадают под формулу (I). Условия дегидрирования включают растворение имидазолина в растворителе, таком, как ксилолы, и добавление палладиевого катализатора, такого, как 10%-ный палладий-на-угле. Реакцию дегидрирования осуществляют при нагревании вплоть до полноты протекания реакции. Ссылкой в отношении условий дегидрирования является следующая: Amemiya Y, Miller D.D., Hsu F.L., Synth. Comm., 20 (16), 2483-2489 (1990). Продукт реакции может быть выделен и очищен способами, хорошо известными из уровня техники. Эти способы включают экстракцию, выпаривание, хроматографию и перекристаллизацию. Общая методика получения А Смешивают соответствующий, коммерчески доступный галогенид (1 экв.) и азид натрия (3 экв.) в смеси диметилсульфоксида и воды (10:1; примерно 10 мл/г NaN3). Перемешивают в течение 2-12 ч при комнатной температуре, затем добавляют воду и экстрагируют диэтиловым эфиром. Органический слой промывают 2 раза водой и насыщенным водным раствором хлорида натрия. Сушат над сульфатом натрия, фильтруют и концентрируют досуха, получая целевое соединение, которое может быть использовано без дальнейшей очистки. По методике, подобной получению А, могут быть получены и выделены следующие соединения: Получение 20. (2-Бромпиридин-3-ил)-(2-хлорфенил)метанол. Диизопропиламид лития (LDA) (400 мл, 0,8 моль) добавляют к 2-бромпиридину (105 г, 0,667 моль) в тетрагидрофуране (3,2 л) при температуре -78 С и перемешивают. Спустя 2 ч добавляют 2-хлорбензальдегид (103 г, 0,733 моль) в тетрагидрофуране (300 мл) и реакционную смесь оставляют постепенно нагреваться до комнатной температуры. Реакционную смесь обрабатывают с помощью 1 н. НСl (1,7 л) и экстрагируют диэтиловым эфиром. Органические слои объединяют и промывают водой и рассолом. Сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Путем очистки- 20007720 флэш-хроматографией, элюирования смесью гексана и этилацетата (от 10:1 до 1:1) получают целевое соединение: 1 Н-ЯМР (300 МГц, CDCl3)(м.д.): 8,28 (дд, 1 Н, J = 1,83, 4,73); 7,67 (дд, 1 Н, J = 1,83, 7,63); 7,48-7,19 (м, 5 Н); 6,41 (с, 1 Н); 3,10 (уш., 1H); МС (IS) (IS = ионизация электронным распылением): m/z = 298,0 (М+1), 300,0 (М+1); Анализ для C12H9BrClNO: рассчитано, %: С 48,27; Н 3,04; N 4,69; найдено,%: С 49,06; Н 3,18; N 4,64; Rf = 0,29 (гептан:этилацетат = 2:1). По методике, аналогичной получению 20, при использовании соответствующих исходных веществ,могут быть получены и выделены следующие соединения: Получение 29. (3-Бромпиридин-4-ил)-(2-хлорфенил)метанол. н-Бутиллитий (48,2 мл, 77,1 ммоль, 1,6 н. в гексане) добавляют к охлажденному до температуры 70 С раствору диизопропиламина (10,8 мл, 77,1 ммоль) в тетрагидрофуране (130 мл) в колбе, высушенной путем обработки пламенем. Спустя 30 мин по каплям добавляют 3-бромпиридин (2,48 мл, 25,7 ммоль) и смесь перемешивают при температуре -70 С. Спустя 4 ч по каплям добавляют 2-хлорбензальдегид (2,95 мл, 26,2 ммоль), перемешивают при температуре -70 С. Спустя 1 ч реакционную смесь нагревают до комнатной температуры, реакцию гасят путем добавления по каплям 60 мл насыщенного раствора NH4Cl. Экстрагируют 3 раза диэтиловым эфиром, промывают рассолом, объединенные органические слои сушат над сульфатом магния и концентрируют. Путем очистки остатка флэшхроматографией на силикагеле при элюировании смесью 0-40% этилацетат/гексан получают целевое соединение: МС (IS): 299 (М+1); ТСХ (50 % этилацетат/гексаны): Rf = 0,23. Получение 30. (5-Бромпиримидин-4-ил)-(2-хлорфенил)метанол. Свежеприготовленный диизопропиламид лития (0,5 М в диэтиловом эфире) медленно добавляют к находящемуся при температуре кипения с обратным холодильником раствору 5-бромпиримидина (4,03 г,25,3 ммоль) и 2-хлорбензальдегида (3,55 г, 25,2 ммоль) в 100 мл диэтилового эфира. По окончании добавления перемешивают при температуре кипения с обратным холодильником в течение дополнительных 2 часов, затем реакцию гасят с помощью 50 мл 2 н. HCl. Органический слой промывают 4 раза по 50 мл водой, сушат, фильтруют и концентрируют. Путем очистки сырого вещества флэш-хроматографией при использовании линейного градиента от 100 % гексанов до смеси 50 % этилацетат/гексаны получают целевое соединение: МС (IS): 298,9 (М+1); 1 Н-ЯМР (400 МГц, CDCl3) ,9,19 (с, 1 Н) , 8,77 (с, 1 Н) , 7,40N,N,N',N'-Тетраметилэтилендиамин (8,3 мл, 55,0 ммоль) добавляют к раствору трет-бутилового эфира фенилкарбаминовой кислоты (4,83 г, 25,0 ммоль) в 50 мл тетрагидрофурана при температуре-40 С в колбе, высушенной путем обработки пламенем. Спустя 5 мин по каплям в течение 10 мин добавляют втор-бутиллитий (43 мл, 55,0 ммоль, 1,3 М в циклогексане). Раствор оставляют нагреваться до комнатной температуры. Спустя 30 мин добавляют насыщенный водный раствор NH4Cl (приблизительно 15 мл) и перемешивают в течение 30 мин. Концентрируют, распределяют между хлороформом с 20% изопропанола и насыщенным водным раствором NaHCO3 и разделяют. Органический слой промывают рассолом, сушат над сульфатом магния и концентрируют. Путем очистки остатка флэш-хроматографией на силикагеле, элюируя с помощью смеси 0-20% этилацетат/гексаны, получают целевое соединение: ТСХ(10 % этилацетат/гексаны): Rf = 0,20. Получение 32. (2-Бромпиридин-3-ил)-(2-хлорфенил)метанон. 85%-ный оксид марганца-(IV) (500 г, 5,75 моль) добавляют к суспензии (2-бромпиридин)-(2 хлорфенил)метанола (392 г, 1,131 моль) в 2,5 л толуола, нагревают до температуры кипения с обратным холодильником и перемешивают. Спустя один час охлаждают до комнатной температуры и фильтруют через целит. Раствор концентрируют при пониженном давлении. За счет очистки путем перекристаллизации из смеси метил-трет-бутилового эфира и гептана (2:1) получают целевое соединение в количестве 312,4 г (80 %). 1H-ЯМР (300 МГц, CDCl3)(м.д.): 8,50 (дд, 1 Н, J = 1,83, 4,73); 7,78 (дд, 1 Н, J = 1,83, 7,63); 7,60 (дд, 1 Н, J = 1,53, 7,63); 7,53-7,34 (м, 4 Н) ; МС (IS): m/z = 296,0 (M+l) , 298,0 (М+1); т. пл. = 76,3 С; Анализ для C12H7BrClNO: рассчитано, %: С 48,60; Н 2,38; N 4,72; найдено,%: С 48,71; Н 2,48; N 4,61; Rf = 0,40 (гексан:этилацетат = 2:1). По методике, подобной таковой получения 32, могут быть получены и выделены путем кристаллизации или хроматографии следующие соединения:- 22007720 Получение 44. (2-Аминофенил)-(2-хлорфенил)метанон. трет-Бутиловый эфир [2-(2-хлорбензоил)фенил]карбаминовой кислоты (850 мг, 2,6 ммоль) растворяют в насыщенном растворе HCl в уксусной кислоте (10 мл, примерно 3 н. раствор HCl) , перемешивают при комнатной температуре в течение 3 ч. Концентрируют, добавляют СHCl3 и концентрируют (3 раза) для удаления остающейся уксусной кислоты. Остаток растворяют в смеси 20% изопропанол/СHCl3, промывают 2 раза насыщенным раствором NaHCO3 и рассолом. Объединенные органические слои сушат над сульфатом магния и концентрируют, получая целевое соединение (495 мг, 83 %): MC (IS): 232 (М+1). Получение 45. (2-Хлорфенил)-(2-иодфенил)метанон. Концентрированную HCl (0,5 мл) добавляют к раствору (2-аминофенил)-(2-хлорфенил)метанона(495 мг, 2,14 ммоль) в ледяной уксусной кислоте (1,1 мл). Раствор охлаждают до температуры 10 С; по каплям в течение 30 мин добавляют раствор нитрита натрия (156 мг, 2,26 ммоль) в воде (1 мл). Спустя дополнительные 30 мин добавляют воду (4 С, 2 мл) и этилацетат (4 С, 4 мл). По каплям в течение 25 мин добавляют раствор KI (425 мг, 2,56 ммоль) и I2 (319 мг, 1,25 ммоль) в воде (2 мл). Перемешивают при температуре 5-15 С в течение 2,5 ч в атмосфере N2. Экстрагируют этилацетатом (3 раза), промывают 1 н. водным раствором Na2S2O3 (3 раза), насыщенным водным раствором NaHCO3 (3 раза) и рассолом. Объединенные органические слои сушат над сульфатом натрия и концентрируют. Путем очистки остатка флэш-хроматографией на силикагеле, элюируя с помощью смеси 0-10% этилацетат/гексаны, получают целевое соединение (498 мг, 68%): MC (IS): 343 (М+1); ТСХ (10% этилацетат/гексаны):Rf = 0,39. Получение 46. 4,5-Дигидро-2 Н-пиридазин-3-он. Неполный альдегид янтарной кислоты (15 % мас./Н 2O, 1 экв.) растворяют в смеси уксусная кислота/вода (1,5:1), добавляют шприцом гидразин (2,5 экв.). Присоединяют дефлегматор и помещают на баню с температурой 120 С, перемешивают. Спустя 2 ч нейтрализуют насыщенным водным растворомNaHCO3, экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме, получая целевое соединение: 1H-ЯМР (CDCl3)(м.д.): 8,56 (уш.с, 1 Н); 7,15 (с, 1 Н); 2,53 (м,4 Н). Общая методика получения В Смешивают соответствующий дигидропиридазинон (1 экв.) в растворе из 5% КОН/этанол и соответствующий бензальдегид. Присоединяют дефлегматор и нагревают при температуре 60 С при перемешивании. Спустя 1 ч добавляют концентрированный раствор HCl в воде до достижения значения рН = 3,экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и удаляют растворитель в вакууме. Путем очистки хроматографией на силикагеле получают целевое соединение. По методике, аналогичной получения В, могут быть получены и выделены следующие соединения: Общая методика получения С В герметически закрытом сосуде смешивают соответствующий бензилпиридазин (1 экв.) в виде раствора в уксусной кислоте и бихромат натрия (2 экв.). Нагревают при температуре 125 С при перемешивании. Спустя 24 ч концентрируют, нейтрализуют с помощью насыщенного водного раствора NaHCO3, экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и концентрируют. Путем очистки хроматографией на силикагеле получают целевое соединение. По методике, подобной получению С, могут быть получены и выделены следующие соединения: Общая методика получения D Смешивают соответствующий гидроксипиридазин (1 экв.) и оксибромид фосфора, марки "чистый",нагревают до температуры 100 С и перемешивают. Спустя 1 час горячую смесь выливают на лед, добавляют 5 н раствор NaOH до достижения рН = 10, экстрагируют этилацетатом. Сушат над сульфатом маг- 23007720 ния, фильтруют и концентрируют. Путем очистки хроматографией на силикагеле получают целевое соединение. По методике, подобной получению D, могут быть получены и выделены следующие соединения:K2 СO3 (3,32 г, 24,0 ммоль) добавляют к раствору 4-триметилсиланилэтинилпиридина (3,51 г, 20,0 ммоль) в метаноле (40 мл). Спустя 10 мин добавляют насыщенный водный раствор NH4Cl (приблизительно 10 мл) и перемешивают. Спустя 10 мин добавляют сульфат магния, фильтруют и концентрируют при комнатной температуре. Очистка путем перегонки в трубке с шаровым расширением (50-55 С) приводит к получению целевого соединения (1,31 г, 64%): MC (IS): 104 (М+1); 1H-ЯМР (400 МГц, CDCl3)(м.д.): 3,29 (с, 1 Н); 7,34 (д, 2 Н, J = 5,9 Гц); 8,59 (д, 2 Н, J = 5,9 Гц). Получение 54. 5-Триметилсиланилэтинилпиримидин. 5-Бромпиримидин (50,0 г, 314,4 ммоль) растворяют в 400 мл триэтиламина, добавляют иоид меди(I) (1,20 г, 6,2 ммоль) и смесь перемешивают в атмосфере азота. Спустя 15 мин добавляют триметилсилилацетилен (53,3 мл, 377,3 ммоль), затем дихлорбис(трифенилфосфин)палладий-(II) (8,81 г, 12,5 ммоль) и перемешивают при комнатной температуре. Спустя 3 ч раствор фильтруют через целит, промывают диэтиловым эфиром. Фильтрат концентрируют при пониженном давлении. Путем очистки флэшхроматографией на силикагеле, элюируя сначала гексанами (100%), затем смесью гексаны:этилацетат(3:1), получают целевое соединение: 1H-ЯМР (CDCl3)(м.д.): 9,10 (с, 1 Н); 8,77 (с, 2 Н); 0,27 (с, 9 Н). Получение 55. 4-Триметилсиланилэтинилпиридин. В течение 18 ч при температуре 70 С нагревают смесь 4-бромпиридингидрохлорида (1,0 экв.), этинилтриметилсилана (2,0 экв.), PdCl2(PPh3)2 (0,1 экв.), CuI (0,2 экв.) и диизопропилэтиламина (10 экв.) в диметилформамиде. Разбавляют дихлорметаном и промывают водой. Сушат над сульфатом магния,фильтруют и концентрируют в вакууме. Путем очистки остатка флэш-хроматографией на силикагеле получают целевое соединение. MC (IS): 176,0 (М+1); ТСХ (20 % диэтиловый эфир/гексаны): Rf = 0,1. По методике, подобной получению 55, при использовании 2-иодпиразина, может быть получено и выделено следующее соединение: Получение 57. 2-Трибутилстаннанилэтинилпиридин. 2-Этинилпиридин (7,14 г, 69,23 ммоль) растворяют в 350 мл тетрагидрофурана и раствор охлаждают до температуры -10 С (лед/метанол) в атмосфере азота. По каплям добавляют н-бутиллитий (1,6 М раствор в гексанах, 47,6 мл, 76,16 ммоль) и смесь перемешивают. Спустя 15 мин по каплям добавляют трибутилоловохлорид (20,7 мл, 76,2 ммоль). Смесь выдерживают в течение ночи при нагревании до комнатной температуры. Реакцию гасят водой, реакционную смесь разбавляют диэтиловым эфиром и промывают насыщенным раствором хлорида аммония, затем рассолом. Сушат над сульфатом натрия,фильтруют и концентрируют. Без необходимости дальнейшей очистки получают целевое соединение: 1H-ЯМР (CDCl3),(м.д.): 8,50-8,54 (м, 1 Н), 7,51-7,59 (м, 1 Н), 7,35-7,43 (м, 1 Н), 7,11-7,18 (м, 1 Н), 1,591,64 (м, 6 Н), 1,32-1,42 (м, 6 Н), 1,05-1,10 (м, 6 Н), 0,88-0,94 (м, 9 Н). Получение 58. Трибутилциклопропилэтинилстанннан. К раствору н-бутиллития (2,5 М в гексанах, 159 мл, 0,398 моль) в тетрагидрофуране (800 мл) при температуре -10 С и в атмосфере азота по каплям добавляют 5-хлорпентин (20 г, 0,195 моль), поддерживая температуру ниже 10 С. По окончании добавления реакционную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 6 ч, затем добавляют трибутилоловохлорид (70 г,0,215 моль) и перемешивают в течение ночи. Реакционную смесь выливают в гексаны (500 мл), промывают насыщенным раствором гидрокарбоната натрия (300 мл) и рассолом (300 мл), сушат над сульфатом натрия, фильтруют и концентрируют, получая целевое соединение (70 г, 100 %), которое используют без дальнейшей очистки: масс-спектр (m/e): 357 (М+Н+); 1H-ЯМР (CDCl3)(м.д.): 1,70-1,49 (м, 6 Н); 1,49-1,24- 24007720 Получение 59. 4-[3-(3,5-бис-Трифторметилбензил)-5-трибутилстаннанил-3 Н-[1,2,3]триазол-4-ил] морфолин. 1-Азидометил-3,5-бис-трифторметилбензол (1,21 г, 4,5 ммоль) добавляют к раствору 4-трибутилстаннанилэтинилморфолина (1,20 г, 3,0 ммоль) в 5 мл толуола. См. Berger D. и др., Helv. Chim. Acta,79(1), 179-191 (1996). Продувают азотом, реакционный сосуд герметически закрывают и нагревают при температуре 100 С в течение ночи. Концентрируют, остаток растворяют в хлороформе, сушат над сульфатом магния, концентрируют. Путем очистки флэш-хроматографией на силикагеле, элюируя смесью 030% этилацетат/гексаны, получают целевое соединение (710 мг, 66 %): МС (IS): 669 (М+1); ТСХ: Rf = 0,53 (25 % этилацетат/гексаны). Получение 60. 4-[3-(3,5-бис-Трифторметилбензил)-5-трибутилстаннанил-3 Н-[1,2,3]триазол-4-ил]пиридин. Триметилсиланолят калия (0,651 г, 4,56 ммоль, чистота 90 %) за один раз добавляют к раствору 4[(триметилсиланил)этинил] пиридина (40,0 г, 228 ммоль; Ziessel R. и др., J. Org. Chem., 61, 6535 (1996 и бис (трибутилолово) оксида (95,2 г, 160 ммоль) в тетрагидрофуране (400 мл) при поддерживании температуры в пределах 25-30 С с помощью водяной бани. Спустя приблизительно 1 ч раствор концентрируют путем выпаривания в роторном испарителе (50 С), получая масло, содержащее 78-85% 4-[(трибутилстаннанил)этинил]пиридина, 15-22 % 4-этинилпиридина и избыток бис(трибутилолово)оксида. К маслу добавляют 1-азидометил-3,5-бис(трифторметил)бензол (73,7 г, 274 ммоль) и нагревают при температуре 110 С, отгоняя возможные летучие компоненты, что необходимо для достижения желательной температуры. Раствор нагревают вплоть до полноты протекания реакции согласно анализу методом 1 Н-ЯМР(приблизительно 22 ч). После охлаждения до температуры 50 С реакционную смесь разбавляют гептаном (600 мл) и перемешивают при комнатной температуре. Смесь фильтруют для удаления твердых веществ. Смесь очищают путем выливания гептанового раствора в колонку с силикагелем (810 г силикагеля в воронке емкостью 2 л из фриттированного стекла) и элюируют последовательно с помощью гептана(5,2 л), смеси этилацетата и гептана в соотношении 1:10 (5,1 л) и смеси этилацетата и гептана в соотношении 1:3 (12,6 л). Фракции, содержащие продукт, объединяют и концентрируют путем выпаривания в роторном испарителе, получая 124 г (выход: 82 %) целевого соединения; т.пл.: 61,9-63,1 С. Анализ дляC28H36F6N4Sn: рассчитано, %: С 50,86; Н 5,49; N 8,47; найдено, %: С 51,08; Н 5,61; N 8,50. При использовании методики, подобной получению 60, и соответствующих исходных веществ, могут быть получены и выделены следующие соединения: Общая методика получения Е Смесь соответствующего этинилстаннана (1,0 экв.) и соответствующего бензилазида (1,0 экв.) в толуоле нагревают до полноты протекания реакции. Концентрируют для удаления растворителя в вакууме. Путем очистки остатка флэш-хроматографией на силикагеле получают целевой продукт. По методике, подобной получению Е, могут быть получены и выделены следующие соединения: Получение 69. Метиловый эфир 3-оксо-3-пиримидин-5-илпропионовой кислоты. К 40 мл толуола добавляют 25 мас.%, раствор метилата натрия в метаноле (4,5 мл, 19,8 ммоль) и нагревают до температуры 85 С в атмосфере азота. Этиловый эфир пиримидин-5-карбоновой кислоты (2,0 г, 13,2 ммоль) растворяют в 2,1 мл этилацетата и по каплям добавляют к толуольному раствору. Реакционную смесь нагревают в течение 1 ч и по каплям добавляют суспензию метилата натрия (715 мг, 13,2 ммоль) в 15 мл метилацетата. Реакционную смесь нагревают при температуре 85 С в течение ночи, охлаждают до комнатной температуры и выливают в раствор ледяной уксусной кислоты (12 мл) и воды(150 мл). После перемешивания в течение 1 ч при комнатной температуре экстрагируют этилацетатом (3 раза по 100 мл), органическую фазу промывают рассолом (200 мл), сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении, получая целевое соединение в виде смеси таутомеров: 1H-ЯМР (CDCl3) енольная форма(м.д.): 12,43 (с, 1 Н) , 9,26 (с, 1 Н), 9,10 (с, 2 Н), 5,76 (с, 1 Н), 3,86 (с,3H); кето-форма 9,42 (с, 1 Н), 9,30 (с, 2 Н), 4,06 (с, 3H), 3,74 (с, 2 Н). Получение 70. Метиловый эфир 3-оксо-3-пиразин-2-илпропионовой кислоты.NaOCH3 (1,5 экв.) растворяют в толуоле и нагревают до температуры 90 С. Добавляют по каплям раствор метилового эфира 2-пиразина (1,0 экв.) и метилацетата (2,0 экв.) в толуоле и нагревают при температуре 90 С. Спустя 20 ч концентрируют в вакууме при комнатной температуре. Суспендируют в избытке метилацетата и кипятят с обратным холодильником в течение 20 ч. Охлаждают до комнатной температуры. Добавляют воду. Экстрагируют этилацетатом, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, получая целевое соединение. ТСХ: Rf = 0,58 (этилацетат/гексаны = 1:1). Получение 71. Этиловый эфир 1-(3,5-бис-трифторметилбензил)-5-пиридин-4-ил-1 Н-[1,2,3]триазол 4-карбоновой кислоты. Раствор этилизоникотиноилацетата (2,52 г, 13,0 ммоль) и 3,5-бистрифторбензилазида (3,54 г, 13,1 ммоль) в диметилсульфоксиде (20 мл) обрабатывают с помощью измельченного K2 СO3 (5,72 г, 41,4 ммоль). Смесь нагревают при температуре 40 С и перемешивают в течение 18 ч, затем разбавляют водой и обрабатывают с помощью 1 н. HCl до достижения значения рН смеси, равного 7. Смесь экстрагируют этилацетатом (2 раза по 50 мл). Органические фазы объединяют и промывают водой (2 раза по 50 мл) и рассолом (50 мл), затем органический слой сушат, фильтруют и концентрируют. Сырое вещество третурируют в гексанах, затем твердое вещество перекристаллизуют из смеси 40% этилацетат/гексаны, получая целевое соединение (2,80 г, 48 %). МС (ионизация электронным ударом с образованием положительных ионов (EI+: 445,2 (М+1); 1H-ЯМР (400 Мгц, CDCl3),(м.д.): 8,74 (дд, 2 Н, J = 1,5, 4,4), 7,80 (с, 1 Н),7,45 (с, 2 Н), 7,13 (дд, 2 Н, J = 2,0, 4,4), 5,56 (с, 2 Н), 4,27 (кв, 2 Н, J = 7,3), 1,28 (т, 3H, J = 7,3). Анализ(C19H14F6N4O2): рассчитано, %: С 51,36; Н 3,18; N 12,61; найдено, %: С 51,35; Н 3,21; N 12,52. По методике, подобной получению 71, могут быть получены и выделены следующие соединения: Получение 78. Этиловый эфир 1-(3,5-бис-трифторметилбензил)-5-гидрокси-1 Н-[1,2,3]триазол-4 карбоновой кислоты. Смешивают раствор этилата натрия (5,5 мл, 21 мас.%, в этаноле) и диэтилмалоната (2,50 мл, 16,5 моль) в этаноле (26 мл) с раствором 1-азидометил-3,5-бис(трифторметил)бензола (4,40 г; 16,3 ммоль) в этаноле (6 мл) и нагревают при температуре 80 С. Спустя 7 ч охлаждают до комнатной температуры. Смесь концентрируют в вакууме и вязкое масло растворяют в воде (20 мл). Добавляют 1 н. раствор HCl в воде до достижения значения рН раствора, равного 2-3. Осадок белого цвета отфильтровывают и высушивают при пониженном давлении, получая целевое соединение: МС (IS): 384,0 (М+Н); МС (ионизация электронным ударом с образованием отрицательных ионов (ES-: 382,1 (М-Н); 1 Н-ЯМР (400 МГц,CDCl3),(м.д.): 8,05 (с, 1 Н), 7,92 (с, 2 Н), 5,41 (с, 2 Н), 4,15 (кв, 2 Н, J = 7,3), 1,22 (т, 3H, J= 7,3). Получение 79. Этиловый эфир 1-(3,5-бис-трифторметилбензил)-5-хлор-1 Н-[1,2,3]триазол-4 карбоновой кислоты. Смешивают PCl5 (5,73 г, 27,5 ммоль) с раствором этилового эфира 1-(3,5-бис-трифторметилбензил)5-гидрокси-1 Н-[1,2,3]-триазол-4-карбоновой кислоты (5,30 г, 13,8 ммоль) в толуоле (150 мл) и нагревают при температуре 50 С. Спустя 2 ч охлаждают до комнатной температуры, раствор концентрируют и сырое вещество растворяют в диэтиловом эфире (100 мл). Органический раствор промывают насыщенным раствором NaHCO3 (2 раза по 100 мл) и рассолом (100 мл), сушат, фильтруют и концентрируют. Сырое вещество очищают путем пропускания через небольшой слой силикагеля, используя линейный градиент смеси от 50 до 80% этилацетат/гексаны, затем путем перекристаллизации из смеси диэтилового эфира и петролейного эфира в соотношении 1:1 (150 мл). МС (IS): 402,0 (М+Н). 1H-ЯМР (400 МГц, CDCl3) , (м.д.): 7,88 (с, 1 Н), 7,76 (с, 2 Н), 5,67 (с, 2 Н), 4,43 (кв, 2 Н, J = 7,0), 1,40 (т, 3H, J = 7,0). Общая методика получения F Раствор LiOHH2O (10 экв.) в воде добавляют к раствору соответствующего сложного эфира (1 экв.) Перемешивают в атмосфере азота в течение ночи. Подкисляют до рН = 1-2 с помощью 5 н. раствора HCl и осадок отфильтровывают. Вещество высушивают в вакууме, получая целевой продукт. По методике, подобной получению F, при использовании соответствующих исходных веществ, могут быть получены и выделены следующие соединения:FAB = бомбардировка быстрыми атомами. Общая методика Получения G.N,O-Диметилгидроксиламин (1,3 экв.), EDCI (1,3 экв.) и DMAP (0,6-1,3 экв.) добавляют к раствору соответствующей карбоновой кислоты (1 экв.) в дихлорметане (0,3 М). Раствор перемешивают при комнатной температуре в течение 5-24 ч, затем разбавляют дихлорметаном и промывают водой, насыщенным раствором NaHCO3 и рассолом. Органический раствор сушат, фильтруют и концентрируют и сырое вещество очищают флэш-хроматографией или перекристаллизацией. По методике, подобной получению G, могут быть получены и выделены следующие соединения: Получение 96. [1-(3, 5-Бис-трифторметилбензил)-5-пиридин-3-ил-1 Н-[1,2,3]-триазол-4-ил]метанол. Метиловый эфир 1-(3,5-бис-трифторметилбензил)-5-пиридин-3-ил-1 Н-[1,2,3]триазол-4-карбоновой кислоты растворяют в метаноле. Добавляют NaBH4 (2,64 г, 3 экв.) и кипятят с обратным холодильником в течение ночи (70 С). Охлаждают до комнатной температуры и медленно выливают в делительную коронку, содержащую равный объем воды. Экстрагируют дихлорметаном. Концентрируют и перекристаллизуют из смеси этилацетата и гексанов, получая 7,0 г (75 %) целевого соединения. МС (IS): 403,2 (М+1); 1 Н-ЯМР (400 МГц, CD3OD),(м.д.): 8,65 (дд, J = 5,2, 1,6 Гц, 1 Н), 8,53-8,52 (м, 1 Н), 7,89 (с, 1 Н), 7,86-7,83(м, 1 Н), 7,60 (с, 2 Н), 7,56-7,53 (м, 1 Н), 5,83 (с, 2 Н) , 4,59 (с, 2 Н). Получение 97. 1-(3,5-бис-Трифторметилбензил)-5-хлор-1 Н-[1,2,3]триазол-4-карбальдегид. Раствор LiBH4 (65 мл; 2 М в тетрагидрофуране) добавляют к раствору этилового эфира 1-(3,5-бистрифторметилбензил)-5-хлор-1 Н-[1,2,3]триазол-4-карбоновой кислоты (15,0 г, 37,3 ммоль) в тетрагидрофуране (150 мл) при температуре 0 С. Осторожно гасят путем медленного добавления 5 н. HCl (50 мл). Перемешивают при комнатной температуре в течение 30 мин, затем нейтрализуют с помощью 5 н. раствора NaOH. Смесь разбавляют водой (100 мл) и экстрагируют этилацетатом (2 раза по 50 мл). Органи- 29007720 ческие фазы объединяют и промывают водой (100 мл) и рассолом (100 мл), после чего сушат, фильтруют и концентрируют, получая спирт, который без дальнейшей очистки используют в последующей реакции. Периодинан Dess-Martin (19,0 г, 44,8 ммоль) добавляют к охлажденному до температуры 0 С раствору вышеуказанного спирта в дихлорметане (100 мл) . Раствор перемешивают при температуре 0 С в течение 15 мин, затем при комнатной температуре в течение 2 ч. Добавляют дополнительное количество периодинана Dess-Martin (1,7 г, 4,0 ммоль) и перемешивают при комнатной температуре в течение 1 ч. Раствор выливают в холодный 5 н. раствор NaOH (70 мл) и экстрагируют диэтиловым эфиром (3 раза по 150 мл). Органические фазы объединяют и промывают 1 н раствором NaOH (100 мл), водой (100 мл) и рассолом (100 мл), затем сушат, фильтруют и концентрируют. Путем очистки сырого вещества флэшхроматографией получают целевое соединение. МС (IS): 358,1 (М+Н); 1H-ЯМР (400 МГц, CDCl3), (м.д.): 10,13 (с, 1 Н), 7,90 (с, 1 Н), 7,76 (с, 2 Н), 5,67 (с, 2 Н). Используя методику, подобную получению 97, при применении соответствующего сложного эфира, получают и выделяют следующее соединение: Получение 99. 1-[1-(3,5-бис-Трифторметилбензил)-5-хлор-1 Н-[1,2,3]триазол-4-ил]-3-(2-хлорфенил) проп-2-ин-1-ол. 1-Хлор-2-этинилбензол (22,1 г, 162 ммоль) растворяют в тетрагидрофуране (300 мл) и медленно добавляют метилмагнийбромид (50 мл, 3,0 М в диэтиловом эфире). Раствор перемешивают при комнатной температуре в течение 40 мин, затем добавляют раствор 1-(3,5-бис-трифторметилбензил)-5-хлор-1 Н[1,2,3]триазол-4-карбальдегида (29,6 г, 82,8 ммоль) в тетрагидрофуране (160 мл). Полученный раствор перемешивают при комнатной температуре в течение 2 ч, затем выливают в холодную воду (500 мл) и 1 н. HCl (150 мл) и экстрагируют этилацетатом (3 раза по 200 мл). Органические фазы объединяют и промывают насыщенным раствором NaHCO3 (200 мл) и рассолом (200 мл), затем сушат, фильтруют и концентрируют. Путем очистки сырого продукта третурированием с помощью смеси 30% диэтиловый эфир/гексаны получают целевое соединение. МС (IS): 494,0 (М+1); МС (ES-): 492,0 (М-1); 1H-ЯМР (400 МГц, CDCl3),(м.д.): 7,87 (С, 1 Н), 7,79 (с, 2 Н), 7,47 (дд, 1 Н, J = 1,9 7,3), 7,37 (дд, 1 Н, J = 1,4, 7,9), 7,25(дт, 1 Н, J =2,0, 7,3), 7,19 (дт, 1 Н, J = 1,5, 7,3), 5,92 (в, 1 Н, J = 6,7), 5,62 (с, 2 Н) , 2,79 (д, 1 Н, J = 6,4). Используя методику, подобную получению 99, при применении соответствующего альдегида, может быть получено и выделено следующее соединение:(33,5 г, 67,8 ммоль) растворяют в дихлорметане (300 мл) и обрабатывают с помощью MnO2 (50,0 г, 556 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, затем фильтруют через слой целита и фильтрат концентрируют. Сырой продукт очищают третурированием с помощью смеси 30% диэтиловый эфир/гексаны. МС (IS): 492,1 (М+1); 1H-ЯМР (400 МГц, CDCl3),(м.д.): 7,89 (с, 1 Н), 7,81 (с,2 Н), 7,47 (дд, 1 Н, J = 1,5, 7,8), 7,46 (дд, 1 Н, J = 1,4, 7,8), 7,40 (дт, 1 Н, J = 1,5, 7,4), 7,29 (дт, 1 Н, J = 1,5, 7,4),5,68 (с, 2 Н). Получение 102. 1-[1-(3,5-бис-Трифторметилбензил)-5-фенил-1 Н-[1,2,3]-триазол-4-ил]-3-(2-хлорфенил)пропинон. Раствор 1-хлор-2-этинилбензола (4,0 мл, 32,8 ммоль) в безводном тетрагидрофуране (25 мл) в атмосфере азота охлаждают до температуры 0 С. С помощью шприца добавляют этилмагнийбромид в виде 3,0 М раствора в диэтиловом эфире (9,7 мл, 29,3 ммоль) при перемешивании. Спустя 30 мин охлаждающую баню удаляют и с помощью шприца добавляют раствор метокси-N-метиламида 1-(3,5-бис-трифторметилбензил)-5-фенил-1 Н-[1,2,3]триазол-4-карбоновой кислоты (10,73 г, 23,4 ммоль) в тетрагидрофуране (35 мл). Спустя 2 ч реакцию гасят с помощью насыщенного водного раствора NH4Cl и реакционную смесь экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и концентрируют в вакууме.
МПК / Метки
МПК: A61K 31/4192, C07D 487/04, C07D 413/14, C07D 498/04, C07D 413/04, C07D 401/14, C07D 403/14, C07D 403/04, C07D 249/06, C07D 401/04, C07D 417/14
Метки: тахикинина, качестве, производные, триазола, рецептора, антагонистов
Код ссылки
<a href="https://eas.patents.su/30-7720-proizvodnye-triazola-v-kachestve-antagonistov-receptora-tahikinina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазола в качестве антагонистов рецептора тахикинина</a>
Предыдущий патент: 5-фенилпиримидины,способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами
Следующий патент: Гетеробиарильные производные в качестве ингибиторов матриксных металлопротеиназ
Случайный патент: Способ изменения проницаемости продуктивного пласта в прифильтровой зоне скважин












