Производные пиримидина в качестве антагонистов 5-нт2с- рецептора
Формула / Реферат
1. Соединение формулы
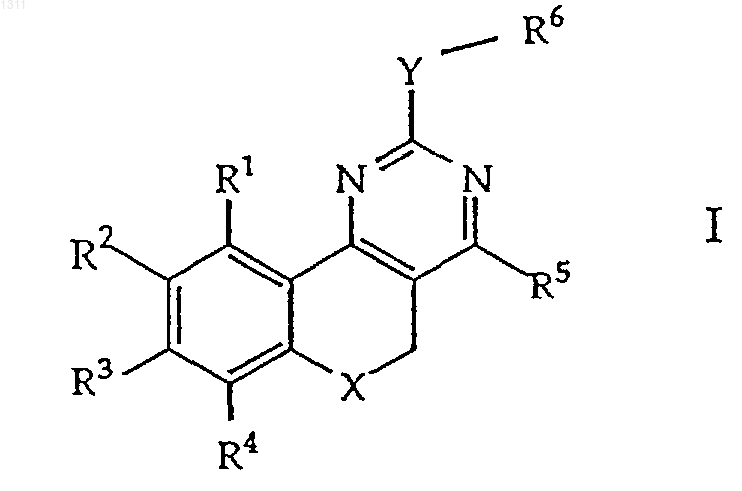
в котором
R1, R2, R3, R4 и R5 независимо друг от друга обозначают водород, C1-С8алкил, C1-С8алкокси, галоген или трифторметил,
Х обозначает кислород, серу, NR7 или СН2,
Y обозначает NR7; где
R7 обозначает водород или C1-С8алкил, и
R6 обозначает C1-С8алкил или необязательно замещенный арил, а именно, моноциклическое или бициклическое ароматическое кольцо, такое как фенил, нафтил, тиофен, фуран, имидазол, пиридин, пиримидин или индол, необязательно замещенное заместителем, выбранным из группы, включающей C1-С8алкил, C1-С8алкокси, гидрокси, нитро, трифторметил или галоген,
и его фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение по п.1, в котором Х обозначает СН2, или его фармацевтически приемлемая соль.
3. Соединение по п.2, в котором R5 обозначает водород, а R6 обозначает необязательно замещенный арил, или его фармацевтически приемлемая соль.
4. Соединение по п.3, в котором R7 обозначает водород, или его фармацевтически приемлемая соль.
5. Соединение по п.4, в котором R1, R2, R3 и R4 независимо друг от друга обозначают водород или C1-С8алкокси, или его фармацевтически приемлемая соль.
6. Соединение по п.5, в котором R1, R2 и R3 обозначают водород, а R4 обозначает C1-С8алкокси, или его фармацевтически приемлемая соль.
7. Соединение по п.6, в котором R6 обозначает фенил, необязательно моно-, ди- или тризамещенный C1-С8алкоксигруппой, или его фармацевтически приемлемая соль.
8. Соединение по п.7, выбранное из группы, включающей:
7-метокси-2-(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин, 7-метокси-2-(3,4,5-триэтоксианилино)-5,6-дигидробензо[h]хиназолин и 7-метокси-2-(3,5-диметокси-4-этоксианилино)-5,6-дигидробензо[h]хиназолин, или его фармацевтически приемлемая соль.
9. Соединение по п.1, в котором R6 обозначает индол, необязательно моно-, ди- или тризамещенный C1-С8алкилом, или его фармацевтически приемлемая соль.
10. Соединение по п.9, в котором R6 обозначает 1-метил-1Н-индол-5-ил, а именно, 7-метокси-2-[(1-метил-1Н-индол-5-ил)амино]-5,6-дигидробензо[h]хиназолин, или его фармацевтически приемлемая соль.
11. Лекарственное средство, содержащее терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли в смеси с одним или несколькими фармацевтически приемлемыми нетоксичными носителями и предназначенное для лечения заболеваний.
12. Лекарственное средство по п.11, предназначенное для лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ2C-рецептора, таких как нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с состоянием паники и обсессивно-компульсивное нарушение, алкоголизм, депрессия, мигрень, нарушение сна, нервная анорексия и приапизм.
13. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п.1, взаимодействием соединения формулы (5) или (5а)
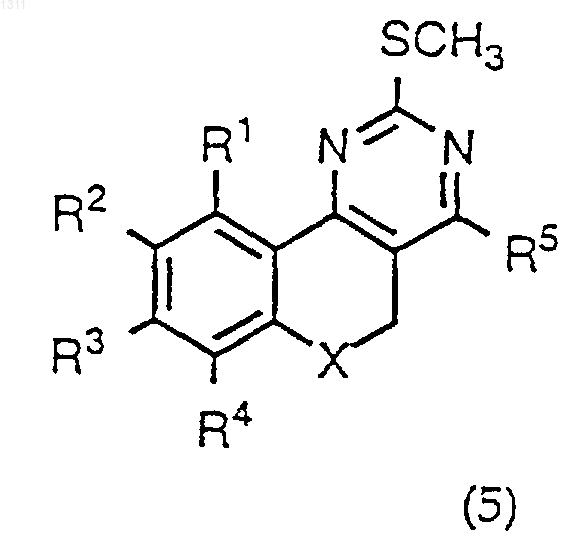
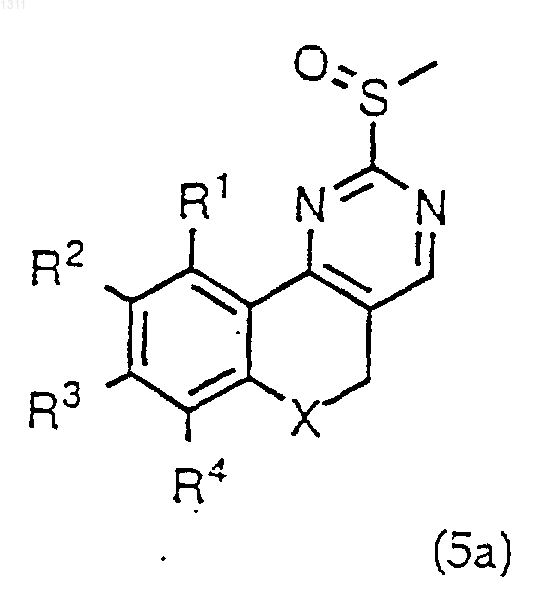
где R1-R5 и Х имеют вышеуказанные значения в п.1, с анионом соединения формулы R6YH, в котором R6 обозначает C1-С8алкил или необязательно замещенный арил, охарактеризованный в п.1, и Y обозначает NR7, где R7 обозначает водород или C1-С8алкил, с последующим выделением полученного соединения в свободном виде или переводом его в фармацевтически приемлемую кислотно-аддитивную соль.
14. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п.1, взаимодействием соединения формулы (4)
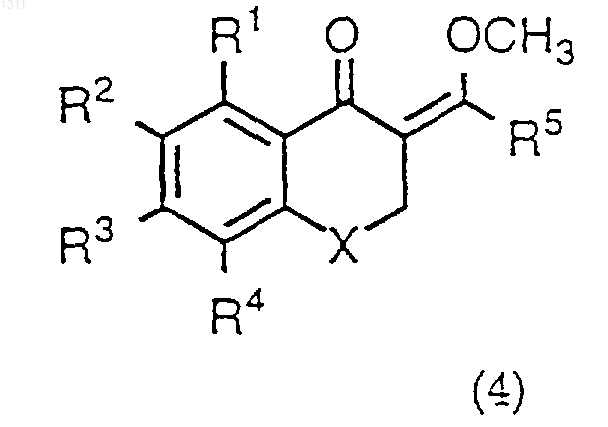
где R1-R5 и Х имеют вышеуказанные значения в п.1, с соединением формулы R6YC(NH)NH2 (7), в котором R6 и Y имеют указанные в п.13 значения, и при необходимости полученное в свободном виде соединение формулы I переводят в фармацевтически приемлемую кислотно-аддитивную соль.
15. Применение соединения по любому из пп.1-10 для лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ2C-рецептора, таких как нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с состоянием паники и обсессивно-компульсивное нарушение, алкоголизм, депрессия, мигрень, нарушение сна, нервная анорексия и приапизм, или для изготовления лекарства, содержащего такое соединение.
16. Способ лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ2C-рецептора, у пациентов, страдающих указанными заболеваниями, путем введения пациенту лекарственного средства, содержащего фармацевтически приемлемое соединение формулы I по п.1 и фармацевтически приемлемый носитель, причем соединение присутствует в лекарственном средстве в количестве, достаточном для лечения этих заболеваний.
Текст
1 Настоящее изобретение относится к новым производным пиримидина формулы I где R1, R2, R3, R4 и R5 независимо друг от друга обозначают водород, (низш.)алкил, (низш.) алкокси, галоген или трифторметил; Х обозначает кислород, серу, NR7 или СН 2,Y обозначает NR7,7 где R обозначает водород или (низш.)алкил, иR6 обозначает (низш.)алкил или необязательно замещенный арил,и к их фармацевтически приемлемым кислотноаддитивным солям, которые обладают полезными фармацевтическими свойствами, включая их применение в качестве антагонистов 5-НТ 2Cрецептора. Серотонин, нейромедиатор со смешанными и сложными фармакологическими характеристиками, был открыт в 1948 г. и в дальнейшем являлся объектом обширных исследований. Серотонин, который также называют 5 гидрокситриптамином (5-НТ), действует на дискретные 5-НТ-рецепторы как в центральной, так и в периферической нервной системе. 5-НТрецептор в настоящее время подразделяют на четыре основных подкласса: 5-НТ 1-, 5-НТ 2-, 5 НТ 3- и 5-НТ 4-рецепторы и их подтипы. Подтипы 5-НТ 1 и 5-НТ 2 также являются гетерогенными. 5-НТ 2C-рецептор, который первоначально был отнесен к подтипу 5-НТ 1C (см. Pazos и др.(1984), Eur. J. Pharmacol, 106, 539-546), а затем было установлено, что он принадлежит к семейству 5-НТ 2-рецепторов (см. Pritchett и др. (1988),ЕМВО J., 7, 4135-4140), широко распространен в головном мозге человека (см. Pazos и др.(1984), Neuroscience, 21, 97-122). Современные исследования убедительно доказали терапевтическую роль антагонистов 5-НТ 2C-рецептора при лечении страха (например, нарушения, связанного с генерализованным состоянием страха,нарушения, связанного с состоянием паники, и обсессивно-компульсивного нарушения), алкоголизма и привыкания к злоупотреблению другими лекарствами, депрессии, мигрени, нарушений сна, нарушений питания (например,нервной анорексии) и приапизма (см. Kennett(1993), Curr. Opin. Invest. Drugs, 2, 317-362). Эти терапевтические показания подтверждаются опубликованными данными клинической и экспериментальной фармакологии, касающимися 1-(3-хлорфенил)пиперазина, агониста 5-НТ 2 Срецептора,неселективных антагонистов 5-НТ 2 С/2A-рецептора и селективных антагонистов 5-НТ 2A-рецептора (см. Kennett (1993), см. выше, и Kennett и др. (1994), Br. J. Pharmacol.,111, 797-802). Дополнительным подтверждени 001311 2 ем описанных терапевтических показаний для применения антагонистов 5-НТ 2C-рецептора является то, что ингибиторы повторного поглощения 5-НТ, которые используются в современной терапии для лечения обсессивнокомпульсивного нарушения, алкоголизма и депрессии (и которые также начинают более широко применяться для лечения нарушения, связанного с паническим страхом, и мигрени) проявляют свою терапевтическую эффективность после постоянного введения, в результате чего происходит изменение(десенсибилизация) 5-НТ 2C-рецептора. Таким образом, селективные антагонисты 5-НТ 2C-рецептора могут обладать набором ярко выраженных терапевтически полезных свойств, сочетающим в себе эффективность, быстроту действия и отсутствие побочных проявлений (см. Kennett (1993), см. выше). Изобретение также относится к лекарственным средствам, содержащим терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли в смеси с одним или несколькими фармацевтически приемлемыми нетоксичными носителями. Изобретение относится далее к способу лечения млекопитающего, имеющего болезненное состояние, облегчаемое при лечении с помощью антагониста 5-НТ 2C-рецептора, путем введения млекопитающему при необходимости терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В контексте настоящего описания общепринятые понятия и термины имеют следующие значения."Алкил" означает разветвленную или неразветвленную насыщенную углеводородную цепь, содержащую от 1 до 8 атомов углерода,например, метил, этил, пропил, трет-бутил, нгексил, н-октил и т.п."(Низш.)алкил", соответственно "низший алкил" означает разветвленную или неразветвленную насыщенную углеводородную цепь,содержащую от 1 до 6 атомов углерода, например, метил, этил, пропил, изобутил, трет-бутил,бутил, н-гексил и т.п., если не указано иное."Галоген" означает фтор, хлор, бром или йод, если не указано иное. Понятие "арил" означает моноциклическое или бициклическое ароматическое кольцо и включает карбоциклы или гетероциклы. Примеры арильных групп включают фенил, нафтил,тиофен, фуран, имидазол, пиридин, пиримидин и индол. Арильная группа может быть присоединена к связывающей группе "Y" в любом положении ароматического кольца."Необязательный" или "необязательно" означают, что последовательно описываемое со 3 бытие или обстоятельство может иметь место или его может не быть и что описание включает случаи, когда событие или обстоятельство имеет место, и случаи, когда его нет. Например,"необязательно замещенный арил" означает, что арил, как он определен выше, может быть или не быть замещен заместителем, выбранным из группы, включающей (низш.)алкил, (низш.) алкокси, гидрокси, нитро, трифторметил и галоген, а также включает незамещенные арильные группы и все возможные изомерные арильные радикалы, которые являются моно-, ди- или тризамещенными. Понятия "инертный органический растворитель" или "инертный растворитель" означают растворитель, инертный в условиях связанной с ним описываемой реакции (и включает, например, бензол, толуол, ацетонитрил, тетрагидрофуран ("ТГФ"), диметилформамид ("ДМФ"),хлороформ "СНСl3", метиленхлорид (или дихлорметан или "CH2Cl2"), диэтиловый эфир,этилацетат, ацетон, метилэтилкетон, метанол,этанол, пропанол, изопропанол, трет-бутанол,диоксан, пиридин и т.п.). Если не указано иное,растворители, применяемые в реакциях по настоящему изобретению, являются инертными растворителями."Фармацевтически приемлемая кислотноаддитивная соль" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований и не являются нежелательными ни с биологической, ни с какой-либо иной точки зрения и которые образованы с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота,малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота,паратолуолсульфоновая кислота, салициловая кислота и т.п. Понятие "лечение" обозначает любое лечение болезненного состояния у млекопитающего, в частности, у человека, и включает:(I) предотвращение наступления заболевания у пациента, который может быть предрасположенным к заболеванию, но у которого оно еще не диагностировано,(II) ингибирование заболевания, т.е. задержка его развития, или(III) облегчение заболевания, т.е. обеспечение регресса заболевания. Понятие "терапевтически эффективное количество" означает такое количество соединения формулы I, которое, будучи введенным млекопитающему, нуждающемуся в таком ле 001311 4 чении, является достаточным для осуществления лечения, как определено выше. Терапевтически эффективное количество может изменяться в зависимости от пациента и болезненного состояния, подлежащего лечению, серьезности поражения и способа введения, и может быть определено обычным способом специалистом в данной области. Понятие "болезненное состояние, которое облегчается при лечении с помощью антагониста 5-НТ 2 С-рецептора" в контексте настоящего описания подразумевает все болезненные состояния, в отношении которых в данной области в целом известно, что они обычно успешно поддаются лечению с помощью соединений, в целом обладающих сродством к 5-НТ 2 Срецепторам, и те болезненные состояния, в отношении которых было подтверждено, что они успешно поддаются лечению с помощью определенных соединений по настоящему изобретению, т.е. соединений формулы I. Такие болезненные состояния включают, но не ограничены ими, страх (например, нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с паническим страхом и обсессивно-компульсивное нарушение), алкоголизм и привыкание к злоупотреблению другими лекарствами, депрессию, мигрень, нарушение сна,нарушение питания (например, нервную анорексию) и приапизм. Приведенные ниже соединения формулы I называют с использованием указанной системы нумерации"7-метокси-2-(3,4,5-триметоксианилино)5,6-дигидробензо[h]хиназолин". Среди семейства соединений по настоящему изобретению предпочтительная категория включает соединения формулы I, в которых Х обозначает СН 2. В этой категории предпочтительная группа включает соединения, в которыхR5 обозначает водород, а R6 обозначает необязательно замещенный арил. В этой группе предпочтительная подгруппа включает соединения,в которых R7 обозначает водород. В этой подгруппе предпочтительными являются соединения, в которых R1, R2, R3 и R4 обозначают(низш.)алкокси, в частности, в которых R4 обозначает метокси, а R1, R2 и R3 обозначают водород. Более предпочтительными являются соеди 3(низш.)алкоксигруппой, в частности, метоксиили этоксигруппой, или в которых R6 обозначает необязательно замещенный индол, в частности, замещенный N-метилом. Один из способов получения соединений формулы I приведен ниже на реакционной схеме I. Этот способ предпочтителен для получения соединений формулы I, в которых Y обозначает азот. Реакционная схема I где R1, R2, R3, R4, R5, R6, X и Y имеют значения,указанные в "Кратком изложении сущности изобретения". Соединения формулы (3) могут быть получены следующим образом. В качестве исходного продукта используют 1-тетралон формулы (2), который имеется в продаже,например производится фирмойChemical Co., Inc., или может быть получен в соответствии со способами, хорошо известными в данной области. Для получения соединений формулы (3) соединение формулы (2) обрабатывают приблизительно 1-1,5 молярными эквивалентами, предпочтительно 1,1-молярными эквивалентами ненуклеофильного основания, например, диизопропиламида лития, трет-бутоксида калия и т.п. Реакцию предпочтительно проводят в эфирном растворителе (например, диэтиловом эфире,диметоксиэтане, диоксане или тетрагидрофуране, предпочтительно в смеси диэтилового эфира и тетрагидрофурана) при температуре приблизительно 0 С в течение примерно 15 мин. После практически полного завершения образования соли добавляют ацилирующий агент, например,сложный эфир формулы R5C(O)R, где R обозначает (низш.)алкил, а R5 имеет указанные выше значения, за исключением галогена, например, 001311 6 этилформиат, метилацетат и т.п., и температуре дают повыситься до приблизительно комнатной в течение примерно 45 мин. Продукт формулы(3), производное 2-формил-1-тетралона, выделяют общепринятыми способами и предпочтительно подвергают взаимодействию на следующей стадии без дальнейшей очистки. Соединения формулы (4) могут быть получены по описанной ниже методике. Производное 2-формил-1-тетралона формулы (3) превращают в соответствующий 2 енольный простой эфир формулы (4) взаимодействием соединения формулы (3) со спиртом,предпочтительно с метанолом, в присутствии каталитического количества сильной кислоты,предпочтительно концентрированной серной кислоты. Реакцию предпочтительно проводят при температуре, близкой к температуре дефлегмации спирта, в течение примерно от 5 мин до 2 ч, предпочтительно в течение примерно 15 мин. Продукт формулы (4), производное 2 метоксиметилен-1-тетралона, выделяют общепринятыми способами, предпочтительно осаждением и фильтрацией, и подвергают взаимодействию на следующей стадии без дальнейшей очистки. Соединения формулы (5) могут быть получены следующим образом. Производное 2-метоксиметилен-1-тетралона формулы (4) подвергают взаимодействию с 2-метил-2-тиопсевдомочевиной, получая соответствующее хиназолиновое производное формулы (5). Реакцию предпочтительно проводят в эфирном растворителе (например, диэтиловом эфире, диметоксиэтане, диоксане или тетрагидрофуране, предпочтительно в тетрагидрофуране) при температуре дефлегмации растворителя,предпочтительно приблизительно при 70 С, в течение примерно 5-30 ч, более предпочтительно примерно 16 ч. Продукт формулы (5), производное 2-метилтио-5,6-дигидробензо[h]хиназолина, выделяют общепринятыми способами. Соединения по настоящему изобретению могут быть получены по описанной ниже методике. Производное 2-метилтио-5,6-дигидробензо[h]хиназолина формулы (5) подвергают взаимодействию с анионом соединения формулы (6), в котором R6 и Y имеют указанные выше значения. Анион предпочтительно получают взаимодействием с сильным основанием, например с н-бутиллитием или гидридом натрия. Реакцию предпочтительно проводят в эфирном растворителе (например, диэтиловом эфире, диметоксиэтане, диоксане или тетрагидрофуране, предпочтительно в тетрагидрофуране) при температуре дефлегмации растворителя, предпочтительно приблизительно при 70 С, в течение примерно 1-10 ч, более предпочтительно примерно 4 ч. Продукт формулы I, производное 2 замещенного-5,6-дигидробензо[h]хиназолина,выделяют общепринятыми способами. Это со 7 единение затем может быть превращено в соль кислоты, предпочтительно в гидрохлорид. Альтернативный способ получения соединений формулы I из соединений формулы (5) приведен ниже на реакционной схеме IA. Реакционная схема IA В соответствии с этой схемой соединение формулы (5 а) может быть получено следующим образом. Производное 2-метилтио-5,6-дигидробензо[h]хиназолина формулы (5) подвергают взаимодействию с окислителем, предпочтительно метахлорпербензойной кислотой, в инертном растворителе, предпочтительно в дихлорметане. Реакцию предпочтительно проводят при температуре приблизительно от -30 до -70 С, предпочтительно приблизительно при -50 С, в течение интервала времени примерно от 5 мин до 5 ч, более предпочтительно примерно в течение 30 мин. Продукт формулы (5 а), производное 2 метилсульфоксид-5,6-дигидробензо[h]хиназолина, выделяют общепринятыми способами и затем превращают в соединение формулы I с помощью способа, приведенного на реакционной схеме I, превращая соединение (5) в соединение формулы I. Альтернативный способ получения соединений формулы I приведен ниже на реакционной схеме II. Реакционная схема II Производное 2-метоксиметилен-1-тетралона формулы (4), полученное в соответствии с реакционной схемой I, подвергают взаимодействию с соединением формулы (7), в котором R6 и Y имеют указанные выше значения. Соединения формулы (7) имеются в продаже, например,производятся фирмой Aldrich, или могут быть получены методом, описанным в J. Org. Chem.Karo, Academic Press Inc. (1989). Реакцию предпочтительно проводят в эфирном растворителе(например, диэтиловом эфире, диметоксиэтане,диоксане или тетрагидрофуране, предпочтительно в тетрагидрофуране) при температуре дефлегмации растворителя, предпочтительно приблизительно при 70 С, в течение примерно 1-10 ч, более предпочтительно примерно 4 ч. Продукт формулы 8 замещенного-5,6-дигидробензо[h]хиназолина,выделяют общепринятыми способами. Это соединение затем может быть превращено в соль кислоты, предпочтительно в гидрохлорид. Выделение и очистка соединений и промежуточных продуктов, представленных в настоящем описании, могут быть осуществлены при необходимости любым пригодным способом разделения или очистки, например, фильтрацией, экстракцией, кристаллизацией, хроматографией на колонках, тонкослойной хроматографией, хроматографией в толстом слое, препаративной хроматографией низкого или высокого давления или с помощью сочетания этих способов. Конкретные примеры приемлемых способов разделения и выделения представлены ниже в разделах "Способы получения" и "Примеры" настоящего описания. Однако, очевидно,что можно использовать другие эквивалентные способы разделения и выделения. Соединения формулы I являются основаниями и поэтому могут быть превращены в соответствующую кислотно-аддитивную соль. Превращение осуществляют обработкой,по крайней мере, стехиометрическим количеством соответствующей кислоты, такой как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота,фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота,миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и т.п., и кислоту добавляют в таком же растворителе. Температуру поддерживают на уровне 0-50 С. Образовавшаяся соль осаждается самопроизвольно или может быть выделена из раствора менее полярным растворителем. Кислотно-аддитивные соли соединений формулы I могут быть превращены в соответствующие свободные основания обработкой, по крайней мере, стехиометрическим количеством пригодного основания, такого как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и т.п. В целом, соединения формулы I и их фармацевтически приeмлемые кислотноаддитивные соли могут быть получены в соответствии с настоящим изобретением следующим образом: а) взаимодействием соединения формулы с анионом соединения формулы R6YH, в котором R6 и Y имеют указанные выше значения,или б) взаимодействием соединения формулы с анионом соединения формулы R6YH, в котором R6 и Y имеют указанные выше значения,или в) взаимодействием соединения формулы с соединением формулы (7), т.е. R6YC(NH)NH2,в котором R6 и Y имеют указанные выше значения, и при необходимости г) превращением соединения формулы I в фармацевтически приемлемую кислотноаддитивную соль. Как описано выше, соединения по настоящему изобретению являются селективными антагонистами 5-HT2C-рецептоpa. Сродство к 5 НТ 2 С-рецептору измеряли с помощью метода связывания с клонированным 5-НТ 2 Срецептором крысы (более подробно см. в примере 11, ниже). Антагонистические свойства определяли на клетках линии NIH3T3, которые подвергали трансфекции клонированным 5 НТ 2 С-рецептором, измеряя способность соединений ингибировать 5-НТ-индуцируемое/5 НТ 2 С-медиируемое увеличение клеточной метаболической активности (более подробно см. в примере 12, ниже). В целом соединения по настоящему изобретению могут использоваться для лечения болезней, которые могут быть облегчены путем блокады 5-НТ 2 С-рецепторов. Например, клинические и экспериментальные данные подтверждают терапевтическую роль антагонистов 5-НТ 2 С-рецептора при лечении страха. Агонист 5-НТ 2 С-рецептора 1-(3-хлорфенил) пиперазин (mСРР) при введении пациентамдобровольцам вызывал чувство страха (см.Charney и др. (1987), Psychopharmacology, 92,14-24). mCPP также приводил к появлению симптомов страха у крыс на таких моделях чувства страха, как социальные взаимоотношения 10 неселективными антагонистами 5-НТ 2C/2Aрецептора, но не блокируются селективными антагонистами 5-НТ 2A-рецептора (см. Kennett и др. (1989), Eur. J. Pharmacol., 164, 445-454 иKennett (1993), см. выше). Кроме того, неселективные антагонисты 5-НТ 2C/2A-рецептора сами по себе вызывают анксиолитические воздействия в СВ-тестах и конфликтных тестах GellerSeifter, тогда как это свойство у антагонистов 5 НТ 2A-рецептора не обнаружено. Кроме того, введение mCPP пациентам,страдающим нарушением, связанным с состоянием паники, и обсессивно-компульсивным нарушением, приводило к увеличению уровней паники и/или страха (см. Charney и др. (1987),см. выше, и Zohar и др. (1987), Arch. Gen. Psychiat., 44, 946-951). Таким образом, современные данные подтверждают возможность применения селективных антагонистов 5-HT2Cрецептора для лечения нарушения, связанного с генерализованным состоянием страха, нарушения, связанного с состоянием паники, и обсессивно-компульсивного нарушения. Анксиолитическое действие может быть определено экспериментальным путем с помощью общепризнанной в данной области исследовательской двухкамерной модели Crowley иGoodwin (см., например, Kilfoil и др., (1989),Neuropharmacology, 28(9), 901-905). В целом данный метод заключается в оценке степени влияния соединения на естественный страх мышей в новой ярко освещенной зоне (более подробно см. в примере 13, ниже). Клинические экспериментальные данные подтверждают терапевтическую роль селективных антагонистов 5-НТ 2C-рецептора при лечении химической зависимости. Агонист 5-НТ 2Cрецептора mСРР индуцирует стремление к алкоголю у алкоголиков в состоянии абстиненции(см. Benkelfat и др.; (1991), Arch. Gen. Psychiat.,48, 383). В отличие от этого неселективный антагонист 5-НТ 2C/2A-рецептора ритансерин снижает пристрастие к алкоголю у крыс (см. Meert и др.,(1991), Drug Development Res., 24, 235-249), тогда как селективный антагонист 5-НТ 2Aрецептора кетансерин не влияет на пристрастие к алкоголю (см. Kennet и др., (1992), J. Psychopharmacol., Abstr. A26). Ритансерин также уменьшает как кокаиновую, так и фентаниловую зависимость, что было показано при использовании в качестве модели крыс, привыкших к наркотикам (см. Meert и др., (1991), DrugDevelopment Res., 25, 39-53 и Meert и др., (1991),Drug Development Res., 25, 55-66). Клинические исследования показали, что ритансерин снижает поглощение алкоголя у хронических алкоголиков (см. Monti и др., (1991), Lancet. 337, 60) и может использоваться при лечении пациентов при отказе от злоупотребления другими лекарственными средствами cм. Sadzot и др., (1989),Psychopharmacology, 98, 495-499). Таким обра 11 зом, современные данные подтверждают возможность применения селективных антагонистов 5-НТ 2C-рецептора при лечении алкоголизма и привыкания к злоупотреблению другими лекарственными средствами. Положительные действия соединений при отказе от злоупотребления лекарствами могут быть определены экспериментально на мышах с помощью теста на страх при отмене (например,см. Carboni и др., (1988), Eur.J. Pharmacol, 151,159-160). Этот метод основан на использовании описанной выше исследовательской модели для измерения степени уменьшения с помощью соединения симптомов синдрома отмены, которые возникают после постоянного лечения наркотическим веществом и затем резкого прекращения этого лечения (более подробно см. в примере 14, ниже). Клинические экспериментальные данные подтверждают терапевтическую роль селективных антагонистов 5-НТ 2C-рецептора при лечении депрессии. Например, подтверждено, что неселективные антагонисты 5-HT2C/2A-рeцeпторa проявляют клиническую эффективность при лечении депрессии (см. Murphy, (1978), Brit. J.Pharmacol, 5, 81S-85S; Klieser и др., (1988),Pharmacopsychiat:, 21, 391-393; и Camara (1991),Biol. Psychiat, 29, 201A). Кроме того, экспериментальные результаты позволяют предположить, что механизм, с помощью которого обычные антидепрессанты проявляют свою терапевтическую эффективность, связан с адаптивными изменениями в серотинэргической системе (см.Anderson (1983), Life Sci, 32, 1791-1801). Например, постоянное лечение ингибиторами монаминоксидазы снижаетmСРР-индуцируемые/5-HT2C-медиируемые функциональные реакции в различных характерных случаях. Аналогичные воздействия проявляют селективные ингибиторы повторного поглощения 5-НТ. Эти данные позволяют предположить, что лечение,которое приводит к увеличению экстранейронных уровней 5-НТ, десенсибилизирует функцию 5-НТ 2C-рецептора, что, в свою очередь, вызывает или способствует антидепрессивной активности (см. Kennett (1993), см. выше). Клинические данные подтверждают терапевтическую роль селективных антагонистов 5 НТ 2C-рецептора при лечении мигрени. Агонист 5-НТ 2C-рецептора mСРР при введении пациентам-добровольцам вызывает головные боли типа мигрени. В противоположность этому неселективные антагонисты 5-НТ 2C/2A-рецептора являются клинически эффективными средствами против мигрени, тогда как селективный антагонист 5-НТ 2 А-рецептора кетансерин не обладает таким свойством (см. Winther, (1985),Cephalalgia, 5, 402-403). Кроме того, экспериментальные результаты позволяют предположить, что клиническая эффективность ингибиторов повторного поглощения 5-НТ при постоянном применении в качестве средств для про 001311 12 филактики мигрени, обусловлена десенсибилизацией 5-НТ 2C-рецепторов (см. Kennett (1993),см. выше, и приведенное выше описание влияния десенсибилизации 5-НТ 2C-рецептора на депрессию). Клинические данные подтверждают терапевтическую роль селективных антагонистов 5 НТ 2C-рецептора при лечении нарушения сна. Агонист 5-НТ 2C-рецептора mCPP при введении пациентам-добровольцам приводит к уменьшению общего времени сна, эффективности сна,продолжительности фазы медленного сна(ФМС) и фазы быстрого сна, сопровождающегося быстрым движением глаз (см. Lawlor и др.,(1991), Biol. Psychiat., 29, 281-286). В противоположность этому неселективный антагонист 5 НТ 2C/2 А-рецептора ритансерин увеличивает ФМС, уменьшает латентный период наступления сна и улучшает субъективное качество сна у здоровых пациентов-добровольцев (см. Idzikowski и др., (1986), Brain Res., 378, 164-168; Idzikowski и др., (1987), Psychopharmacology, 93,416-420; Declerk и др., (1987), Curr. Therap. Res.,41, 427-432; и Adam и др., (1989), Psychopharmacology, 99, 219-221). Таким образом, принимая во внимание противоположные воздействия стимуляции 5-НТ 2C-рецептора и антагонизма(блокирования) 5-НТ 2C-рецептора, селективные антагонисты 5-НТ 2C-рецептора могут иметь важное терапевтическое значение при лечении нарушения сна (см. Kennett (1993), см. выше). Клинические данные подтверждают терапевтическую роль селективных антагонистов 5 НТ 2C-рецептора для лечения нарушений питания. Было установлено, что неспецифические антагонисты 5-НТ 2C/2A-рецептора вызывают повышенный аппетит и прибавление веса. Таким образом, существуют определенные клинические данные применения селективных антагонистов 5-НТ 2C-рецептора для лечения нервной анорексии. Клинические данные подтверждают терапевтическую роль селективных антагонистов 5 НТ 2C-рецептора при лечении приапизма. mCPP вызывает эрекции полового члена у крыс, причем это влияние блокируется неселективными антагонистами 5-НТ 2C/2A-рецептора, но не блокируется селективными антагонистами 5-НТ 2Aрецептора (см. Ноуеr, (1989), под ред. Fozard J.,Peripheral actions of 5-HT, Oxford UniversityPress, Oxford, 72-99). Общие способы введения При применении соединений по изобретению для лечения вышеуказанных состояний введение действующих веществ и их солей,представленных в настоящем описании, может осуществляться с помощью любого из приемлемых методов введения, включая оральный,парентеральный и другие системные пути введения. Может применяться любая фармацевтически приемлемая форма введения, включая твердые, полутвердые или жидкие дозируемые 13 формы, такие как, например, таблетки, суппозитории, пилюли, капсулы, порошки, растворы,суспензии или т.п., предпочтительно в виде стандартных дозируемых форм, пригодных для однократного введения точных доз, или в виде дозируемых форм с непрерывным или контролируемым высвобождением для пролонгированного введения соединения с заранее выбранной скоростью. Эти композиции обычно включают общепринятый фармацевтический носитель или эксципиент и действующее вещество формулы I или его фармацевтически приемлемые соли и дополнительно могут включать другие медицинские агенты, фармацевтические агенты, носители, адъюванты и т.д. Очевидно, что количество вводимого действующего вещества должно зависеть от субъекта, подлежащего лечению, серьезности поражения, способа введения и рекомендаций лечащего врача. Однако эффективная доза для орального, парентерального и другого системного пути введения составляет 0,01-20 мг/кг/день, предпочтительно 0,1-10 мг/кг/день. Для среднего человека весом 70 кг это количество должно составлять 0,7-1400 мг/день или предпочтительно от 7-700 мг/день. Специалист в области лечения таких заболеваний способен без проведения большого количества экспериментов и, полагаясь на собственные знания и описание настоящего изобретения, установить для данного заболевания терапевтически эффективное количество соединения формулы I. Для твердых композиций могут применяться обычные нетоксичные твердые носители,например, фармацевтически чистые маннит,лактоза, целлюлоза, производные целлюлозы,кросскармеллоза натрия, крахмал, стеарат магния, сахарин натрия, тальк, глюкоза, сахароза,карбонат магния и т.п. Действующее вещество,как оно определено выше, может быть изготовлено в форме суппозитория с использованием в качестве носителя, например, полиалкиленгликолей, ацетилированных триглицеридов и т.п. Жидкие композиции, применяемые в фармацевтических целях, могут, например, быть получены растворением, диспергированием и т.д. действующего вещества, как оно определено выше, и необязательно фармацевтических адъювантов в растворителе, таком как, например, вода, физиологический раствор, водная декстроза, глицерин, этанол и т.п., с образованием раствора или суспензии. При необходимости подлежащая введению фармацевтическая композиция может также содержать в небольших количествах нетоксичные вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, агенты для регулирования значения рН и т.п., например, ацетат натрия, сорбитанмонолаурат, триэтаноламинацетат натрия,триэтаноламинолеат т.д. Практические методы приготовления таких дозируемых форм извест 001311 14 ны или должны быть очевидны специалистам в данной области (см., например, Remington'sPharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania, 15-е изд., 1975). Композиция или препаративная форма, подлежащая введению, в любом случае должна содержать действующее(ие) вещество(ва) в количестве,эффективном для облегчения симптомов у пациента, подлежащего лечению. Могут быть изготовлены дозируемые формы или композиции с содержанием действующего вещества (соединения формулы I или их соли) в интервале от 0,25 до 95% с дополнением недостающего количества за счет нетоксичного носителя. Для орального введения фармацевтически приемлемую нетоксичную композицию изготавливают включением любого из обычно применяемых эксципиентов, таких как, например,фармацевтически чистые маннит, лактоза, целлюлоза, производные целлюлозы, кросскармеллоза натрия, крахмал, стеарат магния, сахарин натрия, тальк, глюкоза, сахароза, карбонат магния и т.п. Такие композиции могут иметь форму растворов, суспензий, таблеток, пилюль, капсул,порошков, композиций с постоянным высвобождением и т.п. Такие композиции могут содержать 1-95%, более предпочтительно 2-50%, наиболее предпочтительно 5-8% действующего вещества. Парентеральное введение обычно осуществляют путем подкожной, внутримышечной или внутривенной инъекции. Препараты для инъекций могут быть изготовлены в виде обычных форм, таких как жидкие растворы или суспензии, твердые формы, пригодные для растворения или суспендирования в жидкости перед инъекцией, или в виде эмульсии. Пригодными эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин,этанол и т.п. Кроме того, при необходимости подлежащие введению фармацевтические композиции могут также содержать в небольших количествах нетоксичные вспомогательные вещества, такие как смачивающие или эмульгирующие агенты, агенты для регулирования значения рН и т.п., такие как, например, ацетат натрия, сорбитанмонолаурат, триэтаноламинолеат,триэтаноламинацетат натрия и т.д. Разработанный в последнее время способ парентерального введения включает имплантацию системы с медленным высвобождением или с постоянным высвобождением для поддержания постоянного уровня дозы (см., например, патент США 3710795). Процентное содержание действующего вещества в таких композициях для парентерального введения в значительной степени зависит от его конкретной природы, а также от активности соединения и потребностей пациента. Обычно процентное содержание действующего вещества составляет от 0,1 до 10% в рас 15 творе, и это содержание может быть более высоким в случае, когда композиция является твердой и подлежит дальнейшему разбавлению до вышеуказанных пределов. Предпочтительно композиция должна содержать 0,2-2% действующего вещества в растворе. При применении соединений по изобретению для лечения заболеваний или повреждений глаз, связанных с аномально высоким внутриглазным давлением, введение может быть осуществлено с использованием любого фармацевтически приемлемого метода, обеспечивающего соответствующие местные концентрации для получения требуемой реакции. Они включают непосредственное введение в глаз в виде капель и применение вставок или имплантантов с контролируемым высвобождением лекарства, а также системное введение, как описано выше. Капли и растворы, вносимые непосредственно в глаз, обычно являются стерилизованными водными растворами, содержащими от 0,1 до 10%, наиболее предпочтительно от 0,5 до 1% действующего вещества вместе с пригодным буфером, стабилизатором и консервантом. Общая концентрация растворенных веществ должна быть такой, чтобы образовавшийся раствор был по возможности изотоничным по отношению к слезной жидкости (хотя это не является абсолютно обязательным) и имел эквивалентное значение рН, находящееся в интервале 6-8. Обычными консервантами являются фенилацетат ртути, тимерозал, хлорбутанол и хлорид бензалкония. Обычные буферные системы и соли основаны, например, на использовании цитрата, бората или фосфата, а приемлемые стабилизаторы включают глицерин и полисорбат 80. Водные растворы изготавливают простым растворением растворяемых веществ в соответствующем количестве воды, регулировкой значения рН до приблизительно 6,8-8,0,получением конечного объема с помощью дополнительной порции воды и стерилизацией препарата с использованием методов, хорошо известных в данной области. Очевидно, что уровень дозы образовавшейся композиции должен зависеть от концентрации капель, состояния пациента и индивидуального уровня реакций на лечение. Однако обычная композиция глазных капель может применяться из расчета2-10 капель, содержащих 0,5%-ный раствор действующего вещества,в день на глаз. Композиции по настоящему изобретению также могут быть изготовлены для введения любым общепринятым способом по аналогии с другими композициями для местного применения, адаптированными для использования на млекопитающих. Эти композиции могут быть предназначены для применения любым обычным способом с использованием любого из широкого спектра фармацевтических носителей или наполнителей. Для такого местного приме 001311 16 нения фармацевтически приемлемая нетоксичная композиция может использоваться в полутвердой, жидкой или твердой форме, такой как,например, гели, кремы, лосьоны, растворы, суспензии, мази, порошки или т.п. Например, действующее вещество может быть изготовлено в форме геля с использованием этанола, пропиленгликоля, пропиленкарбоната, полиэтиленгликолей, диизопропиладипата, глицерина, воды и т.д. с соответствующим гелеобразующим агентом, таким как карбомеры, клуцелы и т.д. При необходимости композиция может содержать в небольших количествах нетоксичные вспомогательные вещества, такие как консерванты, антиоксиданты, агенты для регулирования значения рН, поверхностно-активные вещества и т.п. Практические методы приготовления таких дозируемых форм известны или очевидны специалистам в данной области (см., например,Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania, 16-e изд.,1980). Предпочтительно фармацевтическую композицию вводят в виде однократной стандартной дозируемой формы для продолжительного лечения или в виде однократной стандартной дозируемой формы, принимаемой ad libitum (no желанию), когда специально требуется облегчение симптомов. Репрезентативные фармацевтические композиции, содержащие соединение формулы I, описаны в примерах 4-10. Ниже изобретение проиллюстрировано с помощью различных способов получения соединений и примеров, не ограничивающих его объем. Способ получения 1 Способ получения 3,5-диметокси-4 этоксианилина А. Способ получения 1,3-диметокси-2 этоксибензола. К перемешиваемому раствору 2,6 диметоксифенола (10 г) в диметилсульфоксиде(100 мл) в атмосфере азота добавляли раствор гидроксида натрия (3,2 г) в воде (20 мл). Смесь нагревали до 50 С, добавляли этилйодид (12,4 г) и перемешивание продолжали при 50 С в течение 4 ч. Продукт быстро сливали на 1 л воды и смесь экстрагировали диэтиловым эфиром. Экстракт промывали последовательно 20%-ным гидроксидом калия, водой и соляным раствором и затем сушили над сульфатом магния. После удаления растворителя при пониженном давлении получили 1,3-диметокси-2-этоксибензол в виде бесцветного масла (6,71 г). Б. Способ получения 3,5-диметокси-4 этоксинитробензола. Полученное в разделе А масло при комнатной температуре растворяли в уксусной кислоте (15 мл), перемешивали и добавляли по каплям 70%-ную азотную кислоту (4,1 мл), поддерживая температуру на уровне 30-50 С. Через 30 мин смесь быстро сливали на воду и от 17 фильтровывали выпавшие твердые частицы. Твердые частицы перекристаллизовывали из этанола, получая 3,5-диметокси-4-этоксинитробензол (3,5 г). Дополнительные 2,8 г продукта получили из фильтрата. В. Способ получения 3,5-диметокси-4 этоксианилина. Продукт, полученный в разделе Б (1,2 г),растворяли в абсолютном этаноле (50 мл), добавляли 10%-ный палладий на угле в качестве катализатора и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 8 ч. Катализатор отфильтровывали и растворитель удаляли из фильтрата при пониженном давлении, получая 3,5-диметокси-4 этоксианилин (1,02 г), tпл 88-89 С. Способ получения 2 Способ получения N-метил-3,4,5 триметоксианилина А. Способ получения этил-3,4,5 триметоксифенилкарбамата. К раствору 3,4,5-триметоксианилина (6 г) в тетрагидрофуране (125 мл) при комнатной температуре добавляли карбонат калия (5,42 г), а затем этилхлорформиат (3,55 г). Смесь перемешивали при комнатной температуре в течение 48 ч, а затем растворитель удаляли при пониженном давлении. Остаток перемешивали с диэтиловым эфиром и фильтровали. Твердый продукт, оставшийся на фильтре, экстрагировали ацетоном, органические экстракты объединяли,растворитель удаляли из объединенных экстрактов при пониженном давлении, получая остаток, представляющий собой этил-3,4,5 триметоксифенилкарбамат (6,05 г). Б. Способ получения N-метил-3,4,5 триметоксианилина. К раствору этил-3,4,5-триметоксифенилкарбамата (6,0 г) в тетрагидрофуране (150 мл) добавляли по каплям 1 М раствор алюмогидрида лития в тетрагидрофуране (23,5 мл). Смесь перемешивали при комнатной температуре в течение 1 ч, а затем при температуре дефлегмации в течение 1 ч. Продукт охлаждали и по каплям добавляли избыток 1 М гидроксида натрия. Осадок отфильтровывали и фильтрат распределяли между этилацетатом и водой. Органический слой сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Остаток повторно растворяли в этилацетате и промывали 2 М соляной кислотой. Водный слой промывали этилацетатом, затем подщелачивали 1 М гидроксидом натрия и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и растворитель удаляли при пониженном давлении, получая N-метил-3,4,5 триметоксианилин. Способ получения 3 Способ получения соединения формулы (3) А. Способ получения соединения формулы 18 К раствору 5-метокси-1-тетралона (10 г) в диэтиловом эфире (100 мл) при 0 С при перемешивании добавляли 1 М трет-бутоксида калия в тетрагидрофуране (68 мл). Через 15 мин одной порцией добавляли этилформиат (25 г) и реакционной смеси давали нагреться до комнатной температуры в течение 45 мин. Смесь быстро сливали на воду (500 мл), экстрагировали диэтиловым эфиром, эфирный экстракт сушили над сульфатом магния и растворитель удаляли при пониженном давлении, получая 2-формил 5-метокси-1-тетралон (10,2 г), tпл 67-68 С. Б. Способ получения соединений формулы(3) с разными значениями R1, R2, R3 и R4. Аналогичным образом, но заменяя 5 метокси-1-тетралон на 1-тетралон, 6-метокси-1 тетралон, 6-хлор-1-тетралон и 7-метокси-1 тетралон и работая аналогично способу получения, описанному выше в разделе 3 А, получали следующие соединения формулы (3): 2-формил 1-тетралон, 2-формил-6-метокси-1-тетралон, 2 формил-6-хлор-1-тетралон и 2-формил-7 метокси-1-тетралон. В. Способ получения соединения формулы(3) с разными значениями R1, R2, R3 и R4. Аналогичным образом, но заменяя 5 метокси-1-тетралон на другие соединения формулы (2) и работая аналогично способу получения, описанному выше в разделе 3 А, получали другие характерные соединения формулы (3). Способ получения 4 Способ получения соединения формулы (4) А. Способ получения соединения формулыR4 обозначает метокси. К раствору 2-формил-5-метокси-1 тетралона (10,1 г) в безводном метаноле (100 мл) добавляли три капли концентрированной серной кислоты и смесь кипятили с обратным холодильником в течение 15 мин. Раствор сливали на 500 мл ледяной воды, образовавшийся твердый продукт отфильтровывали, промывали водой и сушили под вакуумом, получая твердое вещество желтовато-коричневого цвета (9,78 г). 1H-ЯМР-спектр этого продукта показал, что он является требуемым продуктом 5-метокси-2 метоксиметилен-1-тетралоном, содержащим в виде примеси приблизительно 10% соответствующего ацетального производного; смесь использовали в следующей реакции без дальнейшей очистки. Б. Способ получения соединений формулы(4) с разными значениями R1, R2, R3 и R4. Аналогичным образом, но заменяя 2 формил-5-метокси-1-тетралон на другие соединения формулы (3) и работая аналогично способу получения, описанному выше в разделе 4 А,получали следующее соединение формулы (4): 6-метокси-2-метоксиметилен-1-тетралон. В. Способ получения соединений формулы 19 Аналогичным образом, но заменяя 2 формил-5-метокситетралон на другие соединения формулы (3) и работая аналогично способу получения, описанному выше в разделе 4 А, получали другие характерные соединения формулы (4): 2-метоксиметилен-1-тетралон,6-хлор-2 метоксиметилен-1-тетралон и 7-метокси-2 метоксиметилен-1-тетралон. Способ получения 5 Способ получения соединения формулы (5) А. Способ получения соединения формулы(5), в котором R1, R2, R3 обозначают водород, R4 обозначает метокси, а Х обозначает СН 2. К раствору 5-метокси-2-метоксиметилен 1-тетралoна (9,78 г) в тетрагидрофуране (200 мл) добавляли сульфат 2-метил-2 тиопсевдомочевины (8,34 г), а затем карбонат калия (9,7 г) и смесь кипятили с обратным холодильником в течение ночи. После этого растворитель удаляли при пониженном давлении, остаток перемешивали с диэтиловым эфиром и фильтровали. После концентрирования фильтрата получили твердое вещество коричневого цвета, из которого после перекристаллизации из этанола был получен 7-метокси-2-метилтио-5,6-дигидробензо[h]хиназолин (8,3 г) в виде твердого вещества светло-коричневого цвета. Небольшую часть (1,016 г) этого твердого вещества растворяли в горячем этаноле (50 мл) в присутствии обесцвечивающего древесного угля, фильтровали и к горячему фильтрату добавляли воду до помутнения раствора. После охлаждения до 0 С получили белое кристаллическое твердое вещество, которое отфильтровывали и сушили под вакуумом, tпл 106,1-106,8 С. Б. Способ получения соединений формулы(5) с разными значениями R1, R2, R3 и R4. Алалогичным образом, но заменяя 5 метокси-2-метоксиметилен-1-тетралон на другие соединения формулы (4) и работая аналогично способу получения, описанному выше в разделе 5 А, получали следующее соединение формулы (4): 8-метокси-2-метилтио-5,6-дигидробензо[h]хиназолин. В. Способ получения соединений формулы(5) с разными значениями R1, R2, R3 и R4. Аналогичным образом, но заменяя 5 метокси-2-метоксиметилен-1-тетралон на другие соединения формулы (4) и работая аналогично способу получения, описанному выше в разделе 5 А, получали другие характерные соединения формулы (5), например, 2-метилтио-1 тетралон, 8-хлор-2-метилтио-1-тетралон и 9 метокси-2-метилтио-1-тетралон. Способ получения 6 Способ получения соединения формулы (5 а) А. Способ получения соединения формулы 20 К раствору 8-метокси-2-метилтио-5,6 дигидробензо[h]хиназолина (300 мг) в метиленхлориде (25 мл), охлажденному до -50 С, добавляли метахлорпербензойную кислоту (400 мг). Смесь перемешивали при -50 С в течение 30 мин, затем при -30 С в течение 30 мин и экстрагировали 1 М водным раствором гидроксида натрия. Органический слой сушили над сульфатом магния и растворитель удаляли при пониженном давлении,получая 8-метокси-2 метилсульфоксид-5,6-дигидробензо[h]хиназолин. Пример 1. Способ получения соединения формулы I. А. Способ получения соединения формулы(0,401 г) в тетрагидрофуране при комнатной температуре в атмосфере азота порциями добавляли гидрид натрия (60%-ная масляная дисперсия, 0,16 г) в течение 2-3 мин. Смесь перемешивали в течение 15 мин, затем добавляли 7 метокси-2-метилтио-5,6 дигидробензо[h]хиназолин (0,258 г) и смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь быстро сливали на 300 мл воды и образовавшийся осадок желтого цвета отфильтровывали, промывали пентаном и сушили под вакуумом, получая 7-метокси-2(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин (0,3042 г). Способ получения гидрохлорида. Этот продукт (0,271 г) суспендировали в горячем этаноле (15 мл) и добавляли 1 мл 3 М соляной кислоты в этаноле. Образовывался раствор оранжевого цвета, из которого быстро выпадали кристаллы оранжевого цвета. Смесь охлаждали до 0 С, фильтровали и твердый продукт промывали простым эфиром, получая гидрохлорид 7-метокси-2-(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолина (0,265 г) в виде твердого вещества оранжевого цвета, tпл 228-229,5 С. Б. Способ получения соединений формулыI с разными значениями R1, R2, R3, R4, R5 и R6. Аналогичным образом, но заменяя 3,4,5 триметоксианилин на 3,4,5-триэтоксианилин или 4-этокси-3,5-диметоксианилин и работая аналогично способу получения, описанному выше в разделе 1 А, получали следующие соединения формулы I: 7-метокси-2-(3,4,5-триэтоксианилино)-5,6 дигидробензо[h]хиназолин, tпл 178,3-178,7C; гидрохлорид 7-метокси-2-(3,4,5-триэтоксианилино)-5,6-дигидробензо[h]хиназолина,tпл 233,7-234,6 С; 7-метокси-2-(3,5-диметокси-4-этоксианилино)-5,6-дигидробензо[h]хиназолин;[h]хиназолина, tпл 199-210 С. В. Способ получения соединений формулыI с разными значениями R1, R2, R3, R4, R5, R6, Х и Y. Аналогичным образом, необязательно заменяя 3,4,5-триметоксианилин на другие соединения формулы (6) и необязательно заменяя 7 метокси-2-метилтио-5,6-дигидробензо[h]хиназолин на другие соединения формулы (5) и работая аналогично способу получения, описанному выше в разделе 1 А, получали следующие соединения формулы I: гидрохлорид 8-метокси-10 Н-9-окса-3(3,4,5-триметоксианилино)-2,4-диазафенантрена, tпл 225,5-226,8 С; и гидрохлорид 7-метокси-2-[(1-метил-1 Ниндол-5-ил)амино]-5,6-дигидробензо[h]хиназолина, tпл 250-251,5 С. Пример 2. Альтернативный способ получения соединения формулы I. А. Способ получения соединения формулыR3 обозначает метокси, R6 обозначает 4 метоксифенил, Х обозначает СН 2, а n равно 0. К раствору гидрохлорида 4 метоксифениламидина (201 мг) в этаноле (4 мл) добавляли метоксид натрия (79 мг), а затем раствор 6-метокси-2-метоксиметилен-1-тетралона(200 мг) в этаноле (2 мл). Смесь кипятили с обратным холодильником в течение 2,5 ч, после чего перемешивали при комнатной температуре в течение ночи. Затем смесь сливали на диэтиловый эфир, экстрагировали водой, сушили над сульфатом магния и удаляли растворитель. Остаток растворяли в этаноле/соляной кислоте,после чего получали кристаллы. Добавляли небольшую порцию эфира и кристаллы отфильтровывали и сушили под вакуумом, получая гидрохлорид 8-метокси-2-(4-метоксифенил)-5,6 001311 22 дигидробензо[h]хиназолина (0,265 г), tпл 198205 С. Б. Способ получения соединений формулыI с разными значениями R1, R2, R3, R4, R5 и R6. Аналогичным образом, необязательно заменяя гидрохлорид 4-метоксифениламидина на другие соединения формулы (7) и необязательно заменяя 6-метокси-2-метоксиметилен-1 тетралон на другие соединения формулы (4) и работая аналогично способу получения, описанному выше в разделе 2 А, получили следующее соединение формулы I: гидрохлорид 8-метокси-2(4-пиридил)-5,6-дигидробензо[h]хиназолина, tпл 243,6-244,1 С. В. Способ получения соединений формулыI с разными значениями R1, R2, R3, R4, R5 и R6. Аналогичным образом, необязательно заменяя гидрохлорид 4-метоксифениламидина на другие соединения формулы (7) и необязательно заменяя 6-метокси-2-метоксиметилен-1 тетралон на другие соединения формулы (4) и работая аналогично способу получения, описанному выше в разделе 2 А, получали другие соединения формулы I. Пример 3. Альтернативный способ получения соединения формулы I. А. Способ получения соединения формулыI, в котором R1, R2, R4, R5 обозначают водород,R3 обозначает метокси, R6 обозначает 3,4,5 триметоксифенил, Х обозначает СН 2, a Y обозначает NR7, где R7 обозначает метил. К раствору N-метил-3,4,5-триметоксианилина (255 мг) в тетрагидрофуране (25 мл) при 0 С в атмосфере азота добавляли нбутиллитий (0,517 мл 2,5 М раствора в гексане) и смесь перемешивали в течение 15 мин. К этой смеси добавляли раствор 8-метокси-2 метилсульфоксид-5,6-дигидробензо[h]хиназолина (313 мг) в тетрагидрофуране (5 мл) и перемешивание продолжали еще в течение 15 мин при 0 С, а затем кипятили с обратным холодильником в течение 3 ч. Растворитель удаляли при пониженном давлении, остаток перемешивали с диэтиловым эфиром, фильтровали и растворитель удаляли из фильтрата. Остаток растворяли в метиленхлориде, промывали 1 М гидроксидом натрия, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Остаток превращали в гидрохлорид в смеси этанол/соляная кислота, осадок отфильтровывали и перекристаллизовывали из смеси этанол/циклогексан/диэтиловый эфир (1:5:15), получая 8-метокси-2-(N-метил-3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин, tпл 199201 С. Пример 4. В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции для орального введения, содержащей в качестве действующего вещества[h]хиназолин. Ингредиенты Действующее вещество Лактоза, высушенная распылением Стеарат магния Вышеуказанные ингредиенты смешивают и вводят в желатиновую капсулу с твердым покрытием. В качестве действующего вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулыI, например, полученные в соответствии с примерами 1-3. Пример 5. В этом примере проиллюстрировано приготовление другой репрезентативной фармацевтической композиции для орального введения,содержащей в качестве действующего вещества соединение формулы I, например, 7-метокси-2(3,4,5-триметоксианилино)-5,6-дигидробензо[h] хиназолин. Ингредиенты Действующее вещество Кукурузный крахмал Лактоза Стеарат магния Вышеуказанные ингредиенты тщательно смешивают и прессуют в виде отдельных таблеток с насечкой. В качестве действующего вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулыI, например, полученные в соответствии с примерами 1-3. Пример 6. В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции, содержащей в качестве действующего вещества соединение формулы I,например, 7-метокси-2-(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин. Суспензию для орального применения приготавливают на основе следующей композиции: Ингредиенты Действующее вещество Фумаровая кислота Хлорид натрия Метилпарабен Гранулированный сахар Сорбит (70%-ный раствор)Veegum К (фирма Vanderbilt Co.) Корригент Красители Дистиллированная вода В качестве действующего вещества при приготовлении композиций для орального введения в соответствии с данным примером могут быть использованы другие соединения формулыI, например, полученные в соответствии с примерами 1-3. Пример 7. В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции для орального введения, содержащей в качестве действующего вещества соединение формулы I, например, 7-метокси-2(3,4,5-триметоксианилино)-5,6-дигидробензо[h] хиназолин. Препарат для инъекции, забуференный до значения рН 4, приготавливают на основе следующей композиции: Ингредиенты Действующее вещество Буферный раствор ацетата натрия (0,4 М) НСl (1 н.) Вода (дистиллированная, стерильная) В качестве действующего вещества при приготовлении композиций для инъекций в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные в соответствии с примерами 1-3. Пример 9. В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции для местного применения,содержащей в качестве действующего вещества соединение формулы I, например, 7-метокси-2(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин. Ингредиенты Действующее вещество Спан 60 Твин 60 Минеральное масло Вазелиновое масло Метилпарабен Пропилпарабен БГА (бутилированный гидроксианизол) Вода Все вышеуказанные ингредиенты, за исключением воды, объединяют и нагревают до 60 С при перемешивании. Затем при интенсивном перемешивании при 60 С добавляют достаточное количество воды для эмульгирования ингредиентов и затем добавляют воду в количе 25 стве, необходимом для доведения массы до 100 г. В качестве действующего вещества при приготовлении композиций для местного применения в соответствии с данным примером могут быть использованы другие соединения формулы I, например, полученные в соответствии с примерами 1-3. Пример 10. В этом примере проиллюстрировано приготовление репрезентативной фармацевтической композиции, содержащей в качестве действующего вещества соединение формулы I,например, 7-метокси-2-(3,4,5-триметоксианилино)-5,6-дигидробензо[h]хиназолин. Суппозитории общей массой по 2,5 г приготавливают на основе следующей композиции: Ингредиенты Действующее вещество Witepsol( Триглицериды насыщенной жирной кислоты растительного происхождения; продукт фирмы В качестве действующего вещества при приготовлении композиций в виде суппозитория в соответствии с данным примером могут быть использованы другие соединения формулыI, например, полученные в соответствии с примерами 1-3. Пример 11. Анализ связывания клонированного 5-НТ 2C-рецептора крысы. Ниже описан анализ связывания in vitro с использованием клонированных 5-НТ 2Cрецепторов, радиоактивно меченных с помощью[3 Н]-мезулергина. Мышиные фибробласты линии NIH3T3,экспрессирующие клонированный 5-НТ 2Cрецептор, культивировали в модифицированной по способу Дульбекко среде Игла с добавлением 10%-ной фетальной телячьей сыворотки и 250-мкг/мл G418 в атмосфере 95% O2/5% СО 2. Клетки собирали, используя 2 мМ ЭДТК в забуференном фосфатом физиологическом растворе (свободном от кальция/магния) и центрифугировали (500xg). Клеточный дебрис гомогенизировали с использованием дезинтегратора типа Polytron P10 (установка 5,5 с) в буфере для гомогенизации (50 мМ трис; 5 мМ Na2 ЭДТК) и гомогенат центрифугировали при 19500 об/мин,используя центрифугу типа Sorvall/DupontRC5C с ротором типа SS34 (30000-48000xg, 15 мин). Дебрис гомогенизировали (установка 5,5 с) в буфере для гомогенизации и гомогенат центрифугировали (30000-48000xg, 15 мин). Дебрис гомогенизировали (установка 5,5 с) в ресуспендирующем буфере (50 мМ трис; 0,5 мМ ЭДТК) и гомогенат центрифугировали (30000-48000xg,15 мин). Дебрис гомогенизировали (установка 5,5 с) в небольшом объеме ресуспендирующего буфера, получая приблизительно 1 х 107 кле 001311 26 ток/мл. Мембраны разделяли на аликвоты объемом 1 мл и хранили при -70 С. Мембраны подвергали оттаиванию при комнатной температуре и разбавляли буфером для анализа (118 мМ NaCl; 4,5 мМ КСl; 1,2 мМ КН 2 РО 4; 2,5 мМ CaCl2H2O; 1 мМ MgCl2; 10 мМD-глюкоза; 25 мМ трис). Для каждой порции мембран предварительно определяли оптимальное соотношение для разбавления с таким расчетом, чтобы связывалось менее 10% 510-10 М[3 Н]-мезулергина, специфическое связывание,по крайней мере, в 10 раз превышало фон счетчика, составляющего 23 распада в минуту, и достигалось наилучшее соотношение между специфическим связыванием и общим связыванием. Мембраны гомогенизировали (установка 5,5 с) и затем гомогенат добавляли в пробирки для анализа, содержащие мезулергин (510-10M), тестируемое соединение (110-10-110-4M) и буфер для анализа (q.s. до 500 мкл). Анализируемую смесь инкубировали при 32 С в течение 60 мин и затем фильтровали через фильтры из стекловолокна, предварительно обработанные 0,1%-ным полиэтиленимином, используя харвестер клеток типа Brandel. Пробирки для анализа промывали холодным 0,1 М хлоридом натрия(33 с) и сушили, продувая воздух через фильтр в течение 10 с. Радиоактивность, сохранившуюся на фильтрах, определяли с помощью жидкостного сцинтилляционного счетчика. Аналогичным образом определяли общее связывание с помощью мезулергина (510-10 М) при отсутствии тестируемого соединения. Для каждого тестируемого соединения определяли концентрацию, вызывающую 50%-ное ингибирование связывания (IC50), с использованием итеративного метода аппроксимации кривой. С помощью методики, описанной в примере 11, установлено, что соединения по изобретению обладают сродством к 5-НТ 2C-рецептору. Пример 12. Анализ функциональной активности клонированного 5-НТ 2C-рецептора крысы. Ниже описан анализ функциональной активности in vitro, основанный на определении индуцированного 5-НТ/медиируемого 5-НТ 2C возрастания метаболической активности клеток линии NIH3T3. Мышиные фибробласты линии NIH3T3,экспрессирующие клонированный 5-НТ 2Cрецептор, культивировали в минимальной поддерживающей среде Дульбекко (DMEM) с высоким содержанием глюкозы, дополнительно содержащей глутамин, пируват натрия и 10%ную фетальную бычью сыворотку. Клетки собирали, используя 2 мМ ЭДТК в забуференном фосфатом физиологическом растворе, и переносили на 6,5-миллиметровые планшеты с транслуночными капсулами (размер пор 3 мкм), получая приблизительно 1105 клеток на капсулу. Клеткам давали закрепиться в течение ночи и 27 затем в каждую транслуночную капсулу добавляли транслуночные спейсеры и инсерты. Капсулы помещали в снабженные датчиками камеры, которые загружали в микрофизиометр. Антагонистические свойства тестируемых соединений по отношению к 5-НТ 2C-рецептору оценивали путем определения их влияния на индуцируемое 5-НТ возрастание метаболической активности клеток, которое выражали в виде процента увеличения скорости подкисления. Подвижную среду для микрофизиометра (средаDMEM с высоким содержанием глюкозы, свободная от бикарбоната натрия) прокачивали через транслуночные капсулы в течение 1,5 мин, из которых в течение 30 с в среде присутствовал 5-НТ, после чего следовал 45-минутный период промывки и восстановления. При такой методике клетки подвергали обработке 5-НТ способом, при котором не происходило накопление его концентрации, повышая концентрацию до тех пор, пока не наблюдали максимальную или близкую к максимальной реакцию. Строили кривые зависимости реакции от концентрации 5-НТ в присутствии тестируемого соединения и без него. Данные анализировали на основе итеративного метода аппроксимации кривой и определяли отношение концентраций(CR) 5-НТ, необходимых для получения одинаковых реакций при отсутствии и в присутствии тестируемого соединения. Для каждого тестируемого соединения на основе величины отношения концентраций, молярной концентрации тестируемого соединения с использованием зависимости: определяли отрицательный логарифм константы диссоциации (рКb). При исследовании этим методом обнаружено, что соединения по настоящему изобретению являются антагонистами 5 НТ 2C-рецептора. Пример 13. Анализ анксиолитического поведения. Ниже описан метод определения in vivo анксиолитической активности путем измерения степени влияния лекарства на естественный страх мышей, помещенных в новое, ярко освещенное окружение. Не подвергавшихся ранее обработке самцов мышей линии C5BI/6J весом 18-20 г содержали группами по 10 мышей в клетках с контролируемыми звуком, температурой и влажностью. Пищу и воду давали ad libitum. Мышей содержали при следующем световом цикле: 12 ч света и 12 ч темноты, причем свет включали в 6.00 часов утра, а выключали в 6.00 часов вечера. Все эксперименты начинали не ранее, чем через 7 дней после доставки животных на место. Автоматическую аппаратуру для определения изменений исследовательской активности получали от фирмы Omni-Tech Electronics Co 001311lumbus Ohio, и она аналогична таковой, которая использовалась Crawley и Goodwin (1980), как описано в указанной выше работе Kilfoil и др. В целом камера представляла собой плексигласовый ящик (442121 см), разделенный темной плексигласовой перегородкой на два отсека. В перегородке, разделяющей два отсека, имелось отверстие размером 135 см, через которое мышь могла легко проходить. Темный отсек имел прозрачные стенки и белый пол. Единственное освещение давала флуоресцентная лампа(40 Вт), помещенная над отсеками. Исследовательскую активность мышей внутри отсеков для опытов регистрировали с помощью прибораRXYZCM16 (фирма Omny-Tech Electronics). Перед началом опыта мышам давали акклиматизироваться к лабораторным условиям в течение 60 мин. После введения мыши путем внутрибрюшинной инъекции (в.б.) либо тестируемого соединения, либо наполнителя ее возвращали в клетку, в которой она ранее находилась, на 15 мин после обработки. Затем мышь помещали в центр освещенного отсека и регистрировали ее поведение в течение 10 мин. Анксиолитическое действие проявлялось в виде общего увеличения исследовательской активности в освещенной области. Увеличение исследовательской активности проявлялось в виде увеличения латентного состояния (промежутка времени, требуемого для начала движения мыши в темный отсек после того, как ее сначала помещали в центр освещенной области) в виде увеличения челночной активности, увеличения или отсутствия изменения локомоторной активности (количества пересеченных линий разметки) и в виде уменьшения времени,проведенного в темном отсеке. При исследовании этим методом обнаружено, что соединения по настоящему изобретению улучшают анксиолитическое поведение. Пример 14. Анализ страха при синдроме отмены. Ниже описан способ определения in vivo улучшения симптомов, вызванных отменой наркотических веществ, путем измерения степени воздействия лекарства на страх, который возникает у мышей после постоянного введения наркотического вещества и затем резкого прекращения этих обработок. Не подвергавшихся ранее обработке самцов мышей, линии BKW (весом 25-30 г) содержали группами по 10 особей в клетках с контролируемыми звуком, температурой и влажностью. Пища и вода были доступны ad libitym. Мышей содержали при следующем световом цикле: 12 ч света и 12 ч темноты, причем свет включали в 6.00 часов утра, а выключали в 6.00 часов вечера. Все эксперименты начинали не ранее, чем через 7 дней после доставки животных на место. 29 Степень страха определяли с помощью двухкамерной исследовательской модели Crawley и Goodwill (см. пример 13). Анксиолитическое действие проявлялось в виде общего увеличения исследовательской активности в освещенной области. Увеличение исследовательской активности проявлялось в виде увеличения латентного состояния (промежутка времени,требуемого для начала движения мыши в темный отсек после того, как ее сначала помещали в центр освещенной области) в виде увеличения или отсутствия изменения локомоторной активности (количества пересеченных линий разметки) и в виде увеличения случаев подъема на задние лапы и в виде уменьшения времени, проведенного в темном отсеке. Увеличение исследовательской активности в освещенной области индуцировали путем введения мышам в течение 14 дней этанола (8,0% в отношении массы к объему в воде для питья),никотина (0,1 мг/кг, в.б. дважды в день) или кокаина (1,0 мг/кг, в.б. дважды в день). Анксиолитическое действие оценивали через 1, 3, 7 и 14 дней после начала применения наркотика. Применение резко прекращали и через 8, 24 и 48 ч после этого определяли исследовательскую активность в освещенной области. Наполнитель или тестируемые соединения вводили во время фазы отмены путем внутрибрюшинной инъекции. Ответные реакции оценивали по ингибированию снижения анксиолитического поведения после прекращения введения этанола, кокаина или никотина. При исследовании этим методом обнаружено, что соединения по настоящему изобретению улучшают симптомы, вызванные отменой наркотических веществ. Хотя настоящее изобретение описано со ссылкой на конкретные примеры его осуществления, для специалистов в данной области техники очевидно, что в него могут быть внесены различные изменения и эквивалентные замены без отклонения от сущности и объема изобретения. Кроме того, могут быть внесены различные модификации для адаптации конкретной ситуации, материала, композиции по изобретению,способа, стадии или стадий способа к цели,сущности и объему настоящего изобретения. Подразумевается, что все такие модификации подпадают под объем приведенной ниже формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR1, R2, R3, R4 и R5 независимо друг от друга обозначают водород, C1-С 8 алкил, C1 С 8 алкокси, галоген или трифторметил,Х обозначает кислород, серу, NR7 или СН 2,Y обозначает NR7; гдеR7 обозначает водород или C1-С 8 алкил, иR6 обозначает C1-С 8 алкил или необязательно замещенный арил, а именно, моноциклическое или бициклическое ароматическое кольцо, такое как фенил, нафтил, тиофен, фуран, имидазол, пиридин, пиримидин или индол,необязательно замещенное заместителем, выбранным из группы, включающей C1-С 8 алкил,C1-С 8 алкокси, гидрокси, нитро, трифторметил или галоген,и его фармацевтически приемлемые кислотноаддитивные соли. 2. Соединение по п.1, в котором Х обозначает СН 2, или его фармацевтически приемлемая соль. 3. Соединение по п.2, в котором R5 обозначает водород, а R6 обозначает необязательно замещенный арил, или его фармацевтически приемлемая соль. 4. Соединение по п.3, в котором R7 обозначает водород, или его фармацевтически приемлемая соль. 5. Соединение по п.4, в котором R1, R2, R3 4 и R независимо друг от друга обозначают водород или C1-С 8 алкокси, или его фармацевтически приемлемая соль. 6. Соединение по п.5, в котором R1, R2 и R3 обозначают водород, а R4 обозначает C1 С 8 алкокси, или его фармацевтически приемлемая соль. 7. Соединение по п.6, в котором R6 обозначает фенил, необязательно моно-, ди- или тризамещенный C1-С 8 алкоксигруппой, или его фармацевтически приемлемая соль. 8. Соединение по п.7, выбранное из группы, включающей: 7-метокси-2-(3,4,5-триметоксианилино)5,6-дигидробензо[h]хиназолин,7-метокси-2(3,4,5-триэтоксианилино)-5,6-дигидробензо[h] хиназолин и 7-метокси-2-(3,5-диметокси-4 этоксианилино)-5,6-дигидробензо[h]хиназолин,или его фармацевтически приемлемая соль. 9. Соединение по п.1, в котором R6 обозначает индол, необязательно моно-, ди- или тризамещенный C1-С 8 алкилом, или его фармацевтически приемлемая соль. 10. Соединение по п.9, в котором R6 обозначает 1-метил-1 Н-индол-5-ил, а именно, 7 метокси-2-[(1-метил-1 Н-индол-5-ил)амино]-5,6 дигидробензо[h]хиназолин, или его фармацевтически приемлемая соль. 11. Лекарственное средство, содержащее терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли в смеси с одним или несколькими фармацевтически приемлемыми нетоксичными носителями и предназначенное для лечения заболеваний. 12. Лекарственное средство по п.11, предназначенное для лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ 2C-рецептора, таких как нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с состоянием паники и обсессивно-компульсивное нарушение, алкоголизм, депрессия, мигрень,нарушение сна, нервная анорексия и приапизм. 13. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п.1, взаимодействием соединения формулы где R1-R5 и Х имеют вышеуказанные значения в п.1, с анионом соединения формулы R6YH, в котором R6 обозначает C1-С 8 алкил или необязательно замещенный арил, охарактеризованный в п.1, и Y обозначает NR7, где R7 обозначает водород или C1-С 8 алкил, с последующим выделением полученного соединения в свободном виде или переводом его в фармацевтически приемлемую кислотно-аддитивную соль. 32 14. Способ получения соединения формулы I или его фармацевтически приемлемой соли по п.1, взаимодействием соединения формулы где R1-R5 и Х имеют вышеуказанные значения в п.1, с соединением формулы R6YC(NH)NH2 (7),в котором R6 и Y имеют указанные в п.13 значения, и при необходимости полученное в свободном виде соединение формулы I переводят в фармацевтически приемлемую кислотноаддитивную соль. 15. Применение соединения по любому из пп.1-10 для лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ 2C-рецептора, таких как нарушение, связанное с генерализованным состоянием страха, нарушение, связанное с состоянием паники и обсессивно-компульсивное нарушение,алкоголизм, депрессия, мигрень, нарушение сна,нервная анорексия и приапизм, или для изготовления лекарства, содержащего такое соединение. 16. Способ лечения заболеваний, имеющих терапевтические показания для применения антагонистов 5-НТ 2C-рецептора, у пациентов,страдающих указанными заболеваниями, путем введения пациенту лекарственного средства,содержащего фармацевтически приемлемое соединение формулы I по п.1 и фармацевтически приемлемый носитель, причем соединение присутствует в лекарственном средстве в количестве, достаточном для лечения этих заболеваний.
МПК / Метки
МПК: A61P 25/00, C07D 239/74, A61K 31/517
Метки: качестве, производные, антагонистов, 5-нт2с, пиримидина, рецептора
Код ссылки
<a href="https://eas.patents.su/17-1311-proizvodnye-pirimidina-v-kachestve-antagonistov-5-nt2s-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина в качестве антагонистов 5-нт2с- рецептора</a>
Предыдущий патент: Гербицидные смеси синергетического действия и способ подавления роста сорняков.
Следующий патент: Поли /9,9′ -спиробисфторены/, их получение и применение.
Случайный патент: Способ повышения добычи нефти и газа












