Производные циклопентена в качестве антагонистов рецептора мотилина
Номер патента: 3252
Опубликовано: 27.02.2003
Авторы: Биверз Мэри Пэт, Чен Роберт Х., Ксианг Мин, Мур Джон Б.Мл.
Формула / Реферат
1. Соединение формулы I
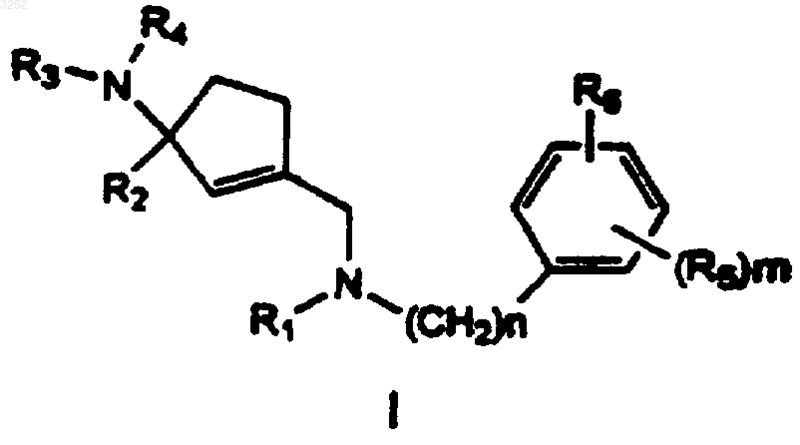
в которой R1 представляет H, C1-5-алкил, замещенный C1-5-алкил (где заместителями являются один или несколько галогенов), амино-C1-5-алкил, C1-5-алкиламино-C1-5-алкил, ди-C1-5-алкиламино-C1-5-алкил, RaRbN-C1-5-алкил (где Ra и Rb независимо выбраны из H и C1-5-алкила или вместе образуют морфолин, пиперазин, пиперидин или N-замещенный пиперидин, где N-заместитель представляет C1-5-алкил или фенил-C1-5-алкил), C1-5-алкилкарбонил, C1-5-алкоксикарбонил, аминокарбонил, C1-9-алкиламинокарбонил, цикло-C3-9-алкиламинокарбонил, пиридинилкарбонил, замещенный пиридинилкарбонил (где заместители у пиридинила выбраны из группы, включающей один или несколько галогенов и C1-5-алкилов), тиофенкарбонил, замещенный тиофенкарбонил (где заместители выбраны из группы, включающей один или несколько галогенов и C1-5-алкилов), фенил, фенил-C1-5-алкил, феноксикарбонил, фенилкарбонил, дифенилметилкарбонил, фениламинокарбонил, фенилтиокарбонил, фениламинотиокарбонил, замещенный фенил, замещенный фенил-C1-5-алкил, замещенный феноксикарбонил, замещенный фенилкарбонил, замещенный фениламинокарбонил, замещенный дифенилметилкарбонил, замещенный фенилтиокарбонил или замещенный фениламинотиокарбонил (где заместители у фенила выбраны из группы, включающей один или несколько галогенов, C1-5-алкил, тригалогенметил, C1-5-алкокси, амино, нитрил, нитро, C1-5-алкиламино, ди-C1-5-алкиламино, если присутствует более одного заместителя, то они могут вместе с фенильным кольцом образовать сконденсированное бициклическое 7-10-членное гетероциклическое кольцо, включающее один или два гетероатома, выбранных из кислорода, серы или азота, или заместители могут быть взяты вместе, образуя сконденсированное бициклическое 7-10-членное ароматическое кольцо);
R2 выбран из H, C1-5-алкила, C1-5-алкокси, фенила, замещенного фенила (где заместители у фенила выбраны из одной или более групп, включающих галоген и C1-5-алкил), фенил-C1-5-алкила, замещенного фенил-C1-5-алкила (где заместители у фенила выбраны из одной или более групп, включающих галоген, C1-5-алкил, C1-5-алкокси, галоген- и ди-C1-5-алкиламино);
R3 выбран из H, C1-5-алкилкарбонила, замещенного C1-5-алкилкарбонила (где заместители у алкила выбраны из одного или нескольких галогенов), фенилкарбонила и замещенного фенилкарбонила (где заместители выбраны из одной или более заместителей из группы, включающей галоген, C1-5-алкил, C1-5-алкокси, амино, C1-5-алкиламино и ди-C1-5-алкиламино);
R4 выбран из H, C1-5-алкилкарбонила, замещенного C1-5-алкилкарбонила (где заместители у алкила выбраны из одного или нескольких галогенов), фенилкарбонила и замещенного фенилкарбонила (где заместители у фенила выбраны из одной или более из группы, включающей галоген, C1-5-алкил, C1-5-алкокси, амино, C1-5-алкиламино и ди-C1-5-алкиламино);
n равно 0-3;
m равно 1-5;
R5 представляет
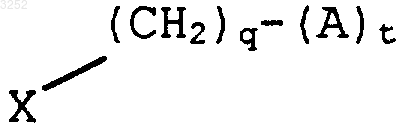
где q равно 0-2;
t равно 0-1;
X представляет O, CH2, S или NRc,
где Rc представляет H, C1-5-алкил, морфолино-C1-5-алкил, пиперидинил-C1-5-алкил, N-фенилметилпиперидинил или пиперазинил-C1-5-алкил;
при условии, что, если q и t равны 0, тогда X представляет гидрокси, тиол или амино;
A представляет C1-5-алкоксикарбонил, фенилкарбонил или R7R8N-,
где R7 независимо выбран из водорода, C1-5-алкила, цикло-C3-9-алкила, или R7 взят вместе с R8, образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами, выбранными из группы, состоящей из кислорода, азота или серы, и их N-оксидов;
R8 независимо выбран из водорода, C1-5-алкила, цикло-C3-9-алкила, или взят вместе с R7, образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами, выбранными из группы, состоящей из кислорода, азота или серы, и их N-оксидов;
R6 выбран из водорода, галогена, C1-5-алкокси, C1-5-алкиламино или ди-C1-5-алкиламино,
или их фармацевтически приемлемые соли.
2. Соединение по п.1, в котором
R1 выбран из фениламинокарбонила, фенилкарбонила, замещенного фениламинокарбонила, замещенного фенилкарбонила и H;
R2 представляет фенил-C1-5-алкил;
R3 представляет H;
R4 представляет трифторметилацетил;
R5 представляет O-(CH2)2-морфолин-1-ил;
R6 представляет H;
n равно 0 и
m равно 1.
3. Соединение по п.1 формулы
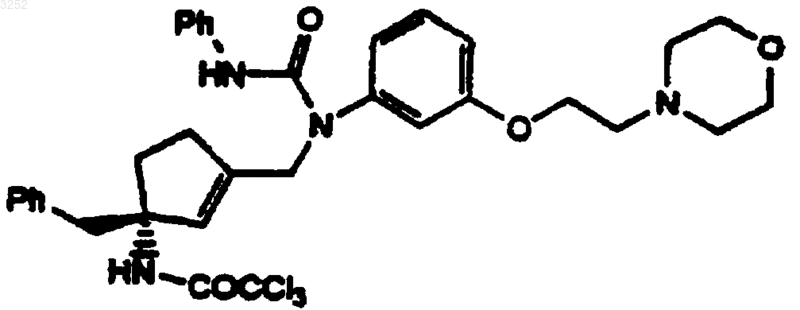
4. Соединение по п.1 формулы
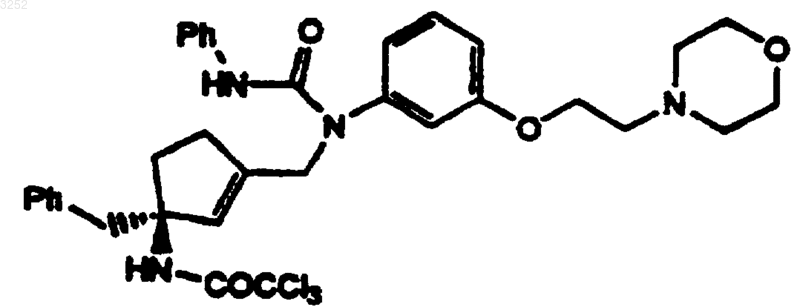
5. Соединение по п.1 формулы
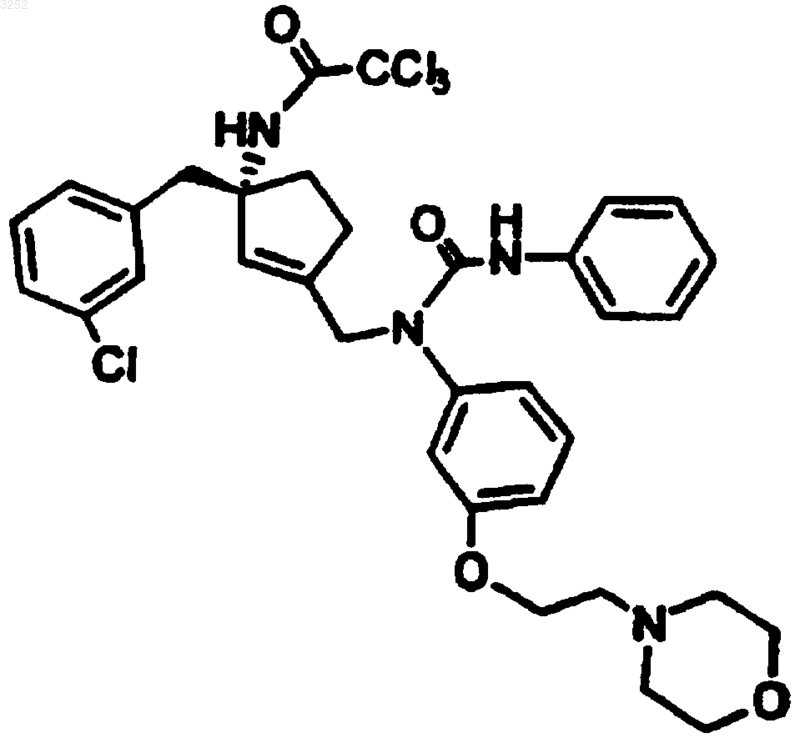
6. Соединение по п.1 формулы
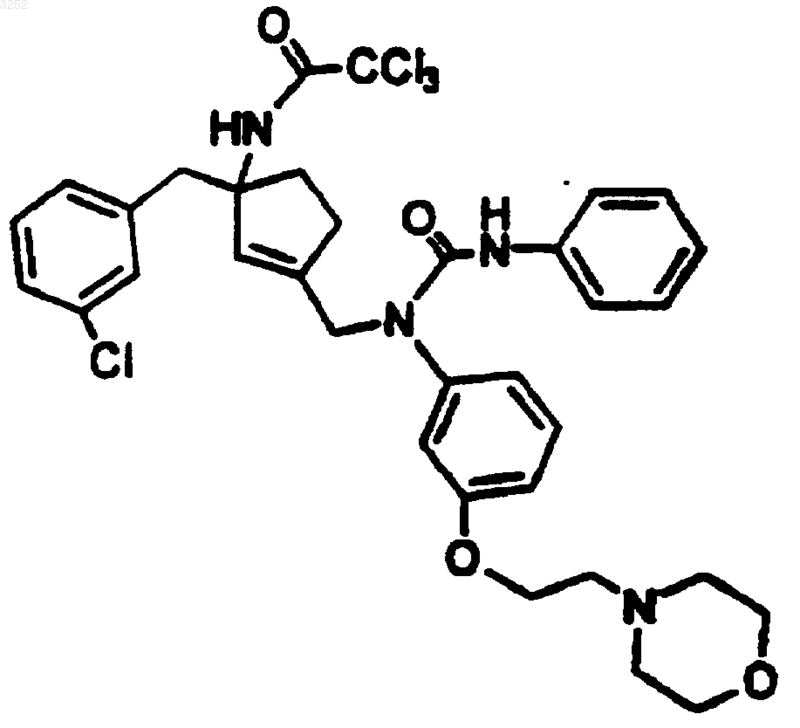
7. Соединение по п.1 формулы
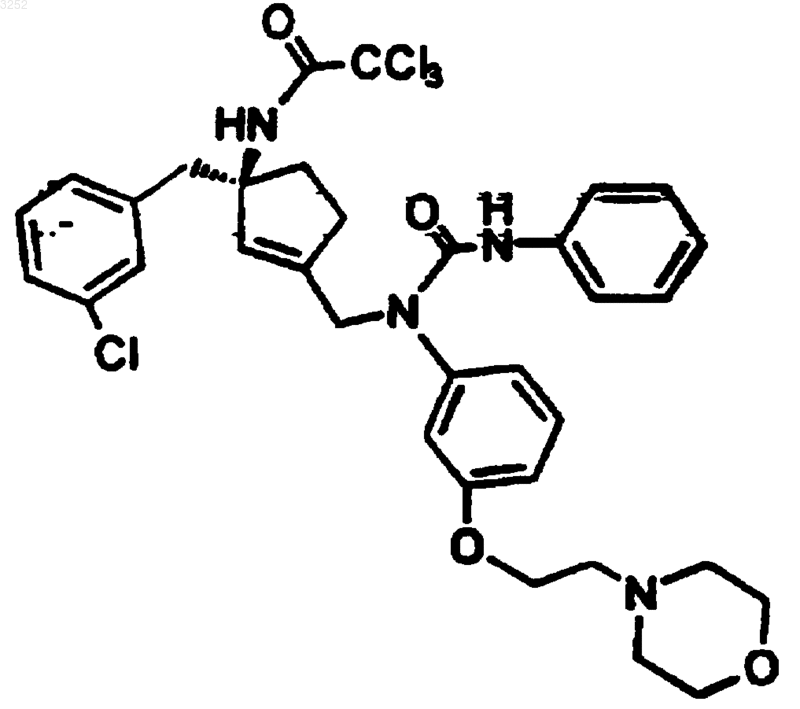
8. Фармацевтическая композиция для лечения расстройств, ассоциированных с рецептором мотилина, включающая эффективное количество соединения по п.1 в сочетании с одним или несколькими фармацевтически приемлемыми носителями.
9. Способ лечения расстройств, ассоциированных с рецептором мотилина, у людей, включающий введение человеку, нуждающемуся в таком лечении, эффективного количества соединения по п.1.
Текст
1 Ссылка на родственную заявку Настоящая заявка заявляет приоритет предварительной заявки 60/063669, поданной 28 октября 1997 г. Область изобретения Настоящее изобретение касается ряда новых производных циклопентена, содержащих их фармацевтических композиций и промежуточных соединений, используемых в их производстве. Соединения по настоящему изобретению полезны в качестве непептидных антагонистов рецептора мотилина. Кроме того, эти соединения проявляют эффективность и активность,которые сравнимы с таковыми известных антагонистов мотилина и эритромицина. Предпосылки У млекопитающих расщепление питательных веществ и удаление отходов пищеварения регулируется желудочно-кишечной системой. Данная система является, мягко говоря,сложной. Имеется ряд природных или нативных пептидов, лигандов, ферментов и рецепторов,которые играют жизненно важную роль в работе этой системы и являются потенциальными мишенями для разработки лекарственных средств. Модификация выработки этих эндогенных факторов или ответные реакции на них могут оказывать действие на такие физиологические ответные реакции, как диарея, тошнота и спазмы брюшной полости. Одним из примеров эндогенных веществ, которые воздействуют на деятельность желудочно-кишечной системы,является мотилин. Мотилин является пептидом из 22 аминокислот, который у ряда видов организмов продуцируется в желудочно-кишечной системе. Хотя последовательность данного пептида варьирует от вида к виду, имеется очень много сходств. Например, мотилин человека и мотилин свиньи идентичны, в то время как мотилин,выделенный из собаки и кролика, отличается от них соответственно пятью и четырьмя аминокислотами. Мотилин обусловливает сокращения гладкой мускулатуры в ткани желудка собак,кроликов и человека, равно как и в толстой кишке кролика. Помимо локальных желудочнокишечных и кишечных тканей мотилин и его рецепторы были обнаружены и в других областях. Например, мотилин был выявлен в циркулирующей плазме крови, где повышение концентрации мотилина ассоциируется с желудочными проявлениями, которые имеют место во время голодания собак и людей (Z. ItohG. Vantrappen et al., 1979, Dig. Dis. Sci., 24, 497500). Кроме того, когда мотилин внутривенно вводился человеку, было обнаружено, что он увеличивает опустошение желудка и секрецию кишечных гормонов (N.D. Christofides et al.,Gastroenterology, 1979, 76, 903-907). Помимо самого мотилина, существуют и другие вещества, являющиеся агонистами ре 003252 2 цептора мотилина, которые способствуют желудочно-кишечному опорожнению. Одним из таких агентов является антибиотик эритромицин. Даже хотя эритромицин является полезным лекарственным средством, значительное число пациентов страдает от побочных эффектов его действия на желудочно-кишечную систему. Исследования показали, что эритромицин способствует проявлению биологических ответов, или ответных реакций, которые сравнимы с таковыми самого мотилина и, следовательно, может быть полезен в лечении таких заболеваний, как хроническая идиопатическая ложная закупорка кишечника и гастропорез (паралич желудка) (F.Weber et al., 1993, The Amer. J. of Gastroenterol.,88: 4, 485-490). Хотя мотилин и эритромицин являются агонистами рецептора мотилина, имеется также потребность в антагонистах данного рецептора. Тошнота, судороги брюшной полости и диарея(понос), которые ассоциированы с агонистами мотилина, на всегда являются позитивными физиологическими проявлениями. Индуцируемая мотилином повышенная кишечная перистальтика причастна к таким заболеваниям, как синдром раздраженной толстой кишки (=слизистый колит) и желудочно-пищевой рефлюкс. Соответственно, исследователи сосредоточились на поиске антагонистов мотилина. Одним из таких антагонистов является препарат ОНМ-11526. Он является пептидом,производным мотилина свиньи, который конкурирует и с мотилином, и с эритромицином за рецептор мотилина у ряда видов, включая кроликов и человека. Кроме того, этот пептид является антагонистом сокращений гладкой мускулатуры, происходящих в ответ на мотилин и эритромицин в модели in vitro кролика (I. Depoortere et al., 1995, Eur. J. Pharmacol., 286, 241247). Хотя данное вещество активно в данной модели (IK50 1,0 нм), оно является пептидом и поэтому почти не дает надежд в качестве лекарства для перорального введения, поскольку оно чувствительно к ферментам пищеварительного тракта (Zen Itoh, 1990, Motilin, xvi). Следовательно, желательно найти другие агенты в качестве потенциальных антагонистов мотилина,которые не являются пептидами. Такими агентами и являются соединения данного изобретения. Соединения данного изобретения являются непептидными антагонистами мотилина,обладающими эффективностью и активностью,сравнимой с известными пептидами антагонистами мотилина. Данные соединения конкурируют с мотилином и эритромицином за сайт рецептора мотилина in vitro. Кроме того, эти соединения подавляют сокращения гладкой мускулатуры, индуцируемые мотилином и эритромицином, проявляя при этом активность и эффективность, сравнимые с ОНМ-11526 на модели in vitro. 3 Краткое содержание изобретения Настоящее изобретение направлено на соединения формулы I в которой R1 представляет Н, C1-5-алкил, замещенный C1-5-алкил (где алкильными заместителями являются один или несколько галогенов),амино-С 1-5-алкил, С 1-5-алкиламино-С 1-5-алкил,ди-С 1-5-алкиламино-С 1-5-алкил, RaRbN-C1-5-алкил(где Ra и Rb независимо выбраны из Н и C1-5 алкила или, взятые вместе, образуют морфолин,пиперазин, пипередин или N-замещенный пиперидин, где N-заместитель представляет C1-5 алкил или фенил-С 1-5-алкил), C1-5-алкилкарбонил, C1-5-алкоксикарбонил, аминокарбонил,C1-9-алкиламинокарбонил,цикло-С 3-9-алкиламинокарбонил, пиридинилкарбонил, замещенный пиридинилкарбонил (где пиридинильные заместители выбраны из группы, включающей один или несколько галогенов и C1-5-алкил),тиофенкарбонил, замещенный тиофенкарбонил(где тиофеновые заместители выбраны из группы, включающей один или несколько галогенов и C1-5-алкил), фенил, фенил-С 1-5-алкил, феноксикарбонил, фенилкарбонил, дифенилметилкарбонил, фениламинокарбонил, фенилтиокарбонил, фениламинотиокарбонил, замещенный фенил, замещенный фенил-С 1-5-алкил, замещенный феноксикарбонил, замещенный фенилкарбонил, замещенный фениламинокарбонил, замещенный дифенилметилкарбонил, замещенный фенилтиокарбонил и замещенный фениламинотиокарбонил (где фенильные заместители выбраны из группы, включающей один или несколько галогенов, C1-5-алкил, тригалогенметил,C1-5-алкокси, амино, нитрил, нитро, C1-5-алкиламино, ди-С 1-5-алкиламино, если присутствует более одного заместителя, они могут вместе с фенильным кольцом образовывать сконденсированное бициклическое 7-10-членное гетероциклическое кольцо, имеющее один или два гетероатома, выбранных из кислорода, серы или азота, или заместители могут быть взяты вместе,образуя сконденсированное бициклическое 710-членное ароматическое кольцо;R2 представляет водород, C1-5-алкил, C1-5 алкокси, фенил, замещенный фенил (где фенильные заместители выбраны из одной или более групп, включающих галоген и C1-5-алкил),фенил-С 1-5-алкил, замещенный фенил-С 1-5-алкил(где фенильные заместители выбраны из одной или более групп, включающих галоген, C1-5 алкил, C1-5-алкокси, галоген- и ди-C1-5 алкиламино);R3 представляет водород, C1-5-алкилкарбонил, замещенный C1-5-алкилкарбонил (где алкильные заместители выбраны из одного или 4 нескольких галогенов), фенилкарбонил, замещенный фенилкарбонил (где фенильные заместители выбраны из одной или более групп,включающих галоген, C1-5-алкил, C1-5-алкокси,амино, C1-5-алкиламино и ди-С 1-5-алкиламино);R4 представляет водород,C1-5 алкилкарбонил, замещенный C1-5-алкилкарбонил (где алкильные заместители выбраны из одного или нескольких галогенов), фенилкарбонил, замещенный фенилкарбонил (где фенильные заместители выбраны из одной или более групп, включающих галоген, C1-5-алкил, C1-5 алкокси, амино, C1-5-алкиламин и ди-С 1-5 алкиламино);X представляет О, CH2, S или NRc,где Rс представляет Н, C1-5-алкил,морфолино-C1-5-алкил, пиперидинил-С 1-5-алкил,N-фенилме-тилпиперидинил или пиперазинилС 1-5-алкил; при условии, что если q и t равны 0, тогда Х представляет гидрокси, тиол или амино; А представляет C1-5-алкоксикарбонил, фенилкарбонил или R7R8N-,где R7 независимо выбран из водорода, C1-5 алкила, цикло-С 3-9-алкила или R7 взят вместе сR8, образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами, выбранными из группы, состоящей из кислорода,азота или серы, и их N-оксидов;R8 независимо выбран из водорода, C1-5 алкила, цикло-С 3-9-алкила, или взят вместе с R7,образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами, выбранными из группы, состоящей из кислорода,азота или серы, и их N-оксидов;R6 представляет водород, галоген, C1-5 алкокси, C1-5-алкиламино или ди-С 1-5-алкиламино,или их фармацевтически приемлемым солям. Соединения формулы I полезны при лечении желудочно-кишечных расстройств, ассоциируемых с рецептором мотилина. Соединения конкурируют с эритромицином и мотилином за рецептор мотилина. Кроме того, соединения являются антагонистами ответной реакции сокращения гладкой мускулатуры на эти лиганды. Настоящее изобретение также представляет фармацевтические композиции, содержащие одно или более соединений формулы I, а также способы лечения заболеваний, связанных с пищеварительной системой, которые ассоциированы с рецептором мотилина. Такие заболевания включают слизистый колит, желудочнопищеводный рефлюкс и желудочно-кишечные побочные действия эритромицина. 5 Подробное описание изобретения Термины, используемые в описании настоящего изобретения, являются обычными и известны специалистам в данной области. Однако термины, которые могли бы иметь другие значения, определены. Понятие "независимо" означает, что, когда присутствует более одного заместителя, эти заместители могут быть различными. Термин "алкил" обозначает алкильные группы с прямой, циклической или разветвлнной цепью, а "алкокси" обозначает O-алкил,в котором алкил имеет определенные выше значения. Символ "Ph" определяет фенил, термин"сконденсированный бициклический ароматический" обозначает сконденсированные ароматические кольца, такие как нафтил и аналогичные. Термин "сконденсированный бициклический гетероцикл" обозначает бензодиоксолы и аналогичные. Поскольку соединения изобретения имеют хиральный центр, некоторые из соединений выделяются в виде энантиомеров. В этих случаях подразумевается абсолютная стереохимия. Когда соединения содержат основный фрагмент, могут быть получены кислотно-аддитивные соли и могут быть выбраны из солей соляной, бромисто-водородной, йодисто-водородной, перхлорной, серной, азотной, фосфорной, уксусной, пропионовой, гликолевой, молочной, пировиноградной, щавелевой, малоновой, янтарной, малеиновой,фумаровой, яблочной, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, птолуолсульфоновой, циклогексансульфаминовой,салициловой, 2-феноксибензойной, 2-ацетоксибензойной кислоты или сахарина и подобных. Такие соли могут быть получены по реакции свободных оснований соединений формулы I с кислотой с последующим выделением соли. Соединения изобретения могут быть получены по следующим ниже схемам, причем, некоторые схемы дают более одного варианта изобретения. В таких случаях выбор схемы является делом выбора, который находится в пределах знаний специалиста в данной области. Синтез соединений по изобретению показан на схеме 1. По сути, эта схема изображает две половины молекулы и сочетание их. Для одной "половины" 3-этокси-2-циклогексен-1-он,1 а, является исходным материалом. Соединение 1 а обрабатывают реактивом Гриньяра, 1b, таким как 4-фторбензилмагнийбромид, при комнатной температуре в инертной атмосфере, с использованием эфира в качестве растворителя с получением ,-ненасыщенного кетона, 1 с. В результате обработки 1 с восстановителем,таким как LAH, при температуре от 0 С до комнатной температуры в течение 16 ч получают спирт,1d. Этот спирт обрабатывают сильным основанием,таким как гидрид натрия и трихлорацетонитрил,при температуре от 0 С до комнатной температуры в течение 16 ч с получением амида 1 е. Этот 6 атомный кольцевой амид последовательно обраба 003252 6 тывают озоном при -78 С, диметилсульфидом и каталитическим количеством кислоты, такой как толуолсульфоновая кислота. После того как реакция присоединения завершена, реакционную смесь оставляют нагретой до комнатной температуры в течение 24-64 ч с получением 5-атомного кольцевого альдегида 1f в виде рацемической смеси. Для конструирования другой "половины" ароматический спирт 1g, такой как 3 гидроксианилин, обрабатывают слабым основанием, таким как карбонат калия, в подходящем растворителе, таком как этанол, при 60 С в течение 4-6 ч. Полученную смесь последовательно обрабатывают галогенидным производным 1h, таким как 3 хлорпропилморфолин, при комнатной температуре с получением амина 1i. Этот амин обрабатывают альдегидом 1f и NaCNBH3 в МеОН при комнатной температуре в течение 30 мин с получением соединения по настоящему изобретению 1j в виде рацемической смеси. Если желательным является выделение чистых энантиомеров, то они могут быть получены на любой из трех стадий данного синтеза. Спирт 1d, альдегид 1f и соединение 1j могут быть разделены с помощью ВЭЖХ на хиральных колонках или другими методами, известными специалистам в данной области. Что касается всех этих трх соединений, то они могут быть дополнительно преобразованы с получением других соединений по настоящему изобретению без нарушения их энантиомерной чистоты. Данная схема может быть использована для получения других соединений по настоящему изобретению. Например, для получения соединений, в которых Х представлен атомом серы, просто можно заменить реактив 1h на ароматический тиол,такой как 3-аминотиофенол, с последующим осуществлением всех остальных этапов данной схемы. Схема 1 7 Для получения других заместителей R3 или R4 могут быть использованы некоторые из продуктов схемы 1. Например, для получения соединения, в котором R3 представлен Н, а R4 представлен СН 3 С(О)-, 6-членное кольцевое промежуточное соединение 1 е обрабатывают основанием, таким как гидроокись бария, нагревая с обратным холодильником в этаноле, с получением свободного амина 2 а. Этот амин затем обрабатывают кислым ангидридом, таким как трифторуксусный ангидрид,с получением соединения 2b. Это промежуточное соединение может быть использовано на остальных этапах схемы 1 с получением желаемого соединения. Схема 2 Продукты схемы 1 могут быть использованы для получения других соединений по настоящему изобретению. Например, для получения соединений типа 3 а соединение 1j обрабатывают фенилизоцианатом при комнатной температуре в течение 24 ч. Для получения соединений типа 3b соединение 1j может быть обработано производными кислых хлоридов, такими как бензоилхлорид, при комнатной температуре. С целью получения тиолов 3c соединения типа 1j могут быть обработаны изотиоцианатами, такими как фенилизотиоцианат, при комнатной температуре. Как обсуждалось выше, если желательным является получение чистого энантиомера, то он может быть получен путeм хроматографической обработки реагента, соединения 1j или полученных продуктов. Схема 3 8 Еще одна схема (схема 4) нацелена на использование промежуточных соединений схемы 1. Обработка альдегида 1f производным нитроанилина 4 а и NaCNBH3 при комнатной температуре позволяет получить сочетанием промежуточное соединение 4b. Это промежуточное соединение может быть подвергнуто ацилированию с использованием бензоилхлорида и обработке слабого основания, такого как триэтиламин, с получением N-ацильного промежуточного соединения 4 с. Соединение 4 с может быть обработано восстановителем, таким как палладий на угле, с получением анилинового соединения 4d. Это соединение может быть включено в реакцию сочетания с галогенсодержащим производным 4 е, таким как 3-хлорпропилпиперидин, с использованием DBU и спиртового растворителя при нагревании с обратным холодильником в течение 4 ч с получением смеси моно- и диаминов. Схема 4 Для получения соединений по настоящему изобретению, в которых n равно 1-3, продукты реакций схемы 1 используют в схеме 5. Промежуточное соединение 1f обрабатывают 3(метагидроксифенил)пропиламином (ароматическим аминоспиртовым производным 5 а) иNaCNBH3 при комнатной температуре в течение 16 ч с получением амина 5b. В результате обработки 5b тиоцианатным производным 5 с и слабым основанием при комнатной температуре получают замещенный тиоамид 5d. Это соединение может быть обработано галогенидом 5 е и основанием, таким как DBU в спирте при нагревании с обратным холодильником с получениемO-замещенного соединения по настоящему изобретению. Соединения по настоящему изобретению были протестированы по их способности конкурировать с радиоактивно помеченным свиным мотилином за связывание на рецепторах мотилина, локализованных на клетках толстой кишки у половозрелых кроликов. У взрослых кроликов новозеландской породы удаляли толстую кишку, иссекали, освобождая от слизистой и серозной оболочек, и разрезали на небольшие кусочки. Мышечную ткань гомогенизировали в 10 объeмах буфера (50 мМ Трис-Cl, 10 мМ MgCl2,0,1 мг/мл бактрацина и 0,25 мМ Peflabloc - рН=7,5) в политроне (29000 об/мин, 4 раза по 15 с). Полученный гомогенат центрифугировали при 1000 g в течение 15 мин и удаляли надосадочную фракцию. Сгусток дважды промывали с последующим суспендированием в гомогенизационном буфере. Этот неочищенный гомогенат затем пропускали через иглу 19, затем через иглу 23 с последующим суспендированием полученного материала и хранением при -80 С. Для общего объема 0,50 мл тест на связывание включал следующие компоненты, добавляемые последовательно: буфер (50 мМ Трис-Cl, 10 мМMgCl2, 1 мМ EDTA, 15 мг/мл бычьего сывороточного альбумина, по 5 мкг/мл лейпептина,апротинина и пепстатина и 0,1 мг/мл бактрацина), меченный 125I-мотилин (Amersham: 5000070000 имп/мин, 25-40 пкМ), тестируемое соединение (исходная концентрация составляла 2 мМ на 100% ДМСО, которую разбавляли водой до конечной концентрации 10 мкМ) и мембранный белок (100-300 мкг). Спустя 30 мин при 30 С полученный материал охлаждали на льду и центрифугировали при 13000 g в течение 1 мин. Полученный сгусток промывали в 1 мл 0,9%ного солевого раствора и центрифугировали при 13000 g в течение 15 с. Сгусток промывали вновь охлажденным солевым раствором и удаляли полученную надосадочную фракцию. Сгусток обсчитывали на гамма-счетчике с определением доли несвязанного мотилина, тем самым определяя степень подавления тестируемого соединения. Показатель ИК 50 определяли для Отдельные соединения по настоящему изобретению оценивались по их способности подавлять сокращения гладкой мускулатуры двенадцатиперстной кишки кролика, индуцируемые действием мотилина и эритромицина. Кроликам не давали корма в течение 24-48 ч и затем умерщвляли. Делали брюшной надрез, начиная его приблизительно на 7,5 см выше пупка и доводя до мечевидного отростка грудины, открывая тем самым верхнюю часть брюшной полости. Ближайшие к пилорическому клапану 8 см двенадцатиперстной кишки быстро вырезали и помещали в раствор Кребса, содержащий NaCl (120 мМ), KСl (4,7 мМ), 13MgSO47H2O (1,2 мМ), CaCl22H2O (2,4 мМ),KН 2 РO4 (1 мМ), D-глюкозу (10 мМ) и NаНСО 3 (24 мМ). Просвет заполняли раствором Кребса и избыток ткани удаляли. Ткань разрезали вдоль кишечника, распластывали продольной мышцей кверху,отделяли продольную мышцу от кольцевой мышцы и изрезывали ее на полоски размером 3 х 30 см. Заранее завязанную шелковую нить 4-0 с петлей помещали на середину такой полоски так, чтобы она удерживалась на этой петле, став как бы вдвое короче. Ткань помещают в 10-мл тканевую ванну(Radnotti Glass Technology Inc., Monrovia, CA), содержащую раствор Кребса, насыщенный смесью кислорода (95%) и углекислоты (5%) при 37 С. Ткань подвергают воздействию замещающего трансдуктора (FT03, Grass Instruments, Quincy, MA) и остаточное натяжение медленно увеличивают до 1 г. Ткань оставляют для уравновешивания на 60-90 мин при 2-3 циклах промывки. Ткань уравновешивают двумя исходными сокращениями, индуцируемыми концентрацией ацетилхолина (1x10-4 M),которая обусловливает максимальное сокращение(0,1 мМ): наивысшая величина сокращения принята за 100% сократимости данной ткани. Фоновый показатель и величину ответа выражают в граммах,обусловливающих растяжение, и в процентах ответа на ацетилхолин. Тестируемые соединения растворяли в диметилсульфоксиде (2 мМ на 100% ДМСО) и применяли к приготовленным тканевым полоскам за 5-15 мин до добавления свиного мотилина. После его добавления постоянно контролировали растяжение в течение 5 мин и регистрировали его наибольшую величину. Процентный показатель сокращения измеряли для четырех увеличивающихся концентраций и рассчитывали соответствующий показатель ИК 50. Хотя заявленные соединения применимы в качестве модуляторов рецептора мотилина, некоторые из этих соединений более активны, чем другие. Эти соединения являются конкретно предпочтительными. В составе конкретных предпочтительных соединений:m равно 1. Для приготовления фармацевтических композиций по настоящему изобретению одно или большее число соединений или их солей в качестве активного компонента тщательно смешивают с фармацевтическим носителем в соответствии со стандартными фармацевтическими процедурами, при том, что такой носитель может иметь самые разнообразные формы, что зависит от формы приготавливаемого препарата, предназначенного для желательного способа введения, например, перорального или парентерального. В процессе приготовления композиций в виде доз для перорального введения могут быть использованы любые фармацевтические среды. Так, для жидких препаратов для перорального введения, таких как, например, суспензии, эликсиры и растворы, подходящие носители и добавки включают воду, гликоли,масла, спирты, ароматизаторы, консерванты,подкрашивающие агенты и подобное; для тврдых препаратов для перорального введения,таких как, например, порошки, капсулы и таблетки, подходящие носители и добавки включают крахмалы, углеводы, разбавители, грануляторы, смазывающие компоненты, связывающие агенты, дезинтегрирующие компоненты и 15 подобное. Благодаря простоте употребления,таблетки и капсулы представляют собой наиболее предпочтительные формы доз для перорального введения, в которых упомянутые выше фармацевтические носители, как правило, и используются. Если желательно, таблетки могут быть покрыты сахарами или оболочкой, растворимой в кишечнике, для чего применимы стандартные технологии. Для парентерального введения носитель обычно должен включать стерильную воду, хотя при этом могут быть включены и другие компоненты, например, преследующие такие цели, как повышение растворимости или консервация. Также могут быть приготовлены суспензии для инъекций, для чего могут быть использованы подходящие жидкие носители, суспендирующие агенты и подобное. Представляемые здесь фармацевтические композиции предпочтительно должны рассчитываться в виде стандартных доз, например, таких как таблетки, капсулы, порошки, дозы для инъекций, из расчeта одной чайной ложки и подобное: примерно от 5 до примерно 500 мг активного компонента, хотя могут быть использованы и другие дозировки. Для терапевтического применения в лечении заболеваний пищеварительной системы у млекопитающих соединения по настоящему изобретению могут быть введены в количестве от примерно 0,5 до 100 мг/кг 1-2 раза в сутки(перорально). Кроме того, эти соединения могут быть введены путем инъекции в количестве 0,110 мг/кг в день. Определение оптимальных дозировок в конкретной ситуации находится в компетенции фармацевтов. С целью иллюстрирования настоящего изобретения включены нижеследующие примеры. Эти примеры ни в чм не ограничивают настоящее изобретение. Они являются только иллюстративными и призваны продемонстрировать способ практической реализации настоящего изобретения. Хотя при этом существуют другие способы практического применения настоящего изобретения, и эти способы рассматриваются как входящие в объeм настоящего изобретения. Примеры Пример 1. Раствор 3-этокси-2-циклогексен-1-она (125 г, 0,89 моль) в эфире (500 мл) добавляли при комнатной температуре к раствору 2 М бензилмагнийхлорида (800 мл) в атмосфере азота и перемешивали в течение 6 ч. Полученную смесь выливали в раствор серной кислоты (30%) и перемешивали в течение 5 ч. Полученный органический слой отделяли, а водный слой экстрагировали несколькими порциями эфира. Объе 003252 16 диненную органическую фазу высушивали надLAH (33 г, 0,87 моль) и эфира (100 мл) при 0 С в атмосфере азота. Полученную в результате реакционную смесь перемешивали в течение ночи при температуре окружающей среды и охлаждали до 0 С. Для нейтрализации избыткаLAH добавляли насыщенный раствор K2 СО 3 и полученную смесь отфильтровывали на целите и несколько раз промывали эфиром. Объединнную органическую фазу высушивали над МgSO4 и концентрировали в вакууме с получением соединения 2 (150 г) в виде бесцветного маслянистого вещества. ЯМР (СDСl3): 3,23 (с,2 Н, бензильные протоны), 4,20 (шс, 1 Н, СНОН),5,52 (шс, 1 Н, олефиновый протон), 7,22 (м, 5 Н,ароматические протоны). Пример 3. Раствор соединения 2 (132 г, 0,7 моль) в эфире (500 мл) добавляли к суспензии промытого гексаном 60% NaH (27 г, 0,7 моль) в эфире(500 мл) при 0 С в атмосфере азота и перемешивали в течение 1 ч. Медленно добавляли трихлорацетонитрил (115 г, 0,8 моль) и полученную в результате смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение ночи. Растворитель удаляли в вакууме, добавляли гексан (1 л) и полученную смесь охлаждали до 0 С. Добавляли метанол(150 мл) и реакционную смесь отфильтровывали на целите. Органический растворитель удаляли в вакууме с получением неочищенного промежуточного соединения (215 г). Это промежуточное соединение растворяли в ксилоле (1 л) и нагревали с обратным холодильником в течение 3 ч в атмосфере азота. Растворитель удаляли в вакууме, добавляли эфир (3 л) и твердый остаток отфильтровывали с получением соединения 3 (106 г) в виде белого кристаллического вещества. Температура плавления 105-106 С. ЯМР-78 С до того момента, как раствор приобрел синий цвет. Избыток озона удаляли в потоке азота, добавляли диметилсульфид (5 мл) и полученную смесь оставляли нагреваться до комнатной температуры. Добавляли TsOH-H2O (3,0 г) и полученную реакционную смесь перемешивали в течение 48 ч. Растворитель удаляли в вакууме и остаток растворяли в метиленхлориде и обрабатывали гексаном. Полученную в результате смесь перемешивали в течение 2 ч и полученное твердое вещество отфильтровывали. Этот твердый остаток промывали гексаном и высушивали в вакууме в течение ночи с получением соединения 4 (21,8 г) в виде рацемической смеси: температура плавления 162 С. ЯМР(СDСl3): 3,20 (Ашкв, J=8 Гц, 2 Н), 6,85 (шс, 1 Н,NH), 7,05 (с, 1 Н, олефиновый протон), 7,22 (м,5 Н, ароматические протоны), 9,91 (с, 1 Н, СНО). Соединение 4 было разделено на чистые энантиомеры 4 а и 4b с использованием хиральной хроматографической колонки. Пример 5. Смесь 3-гидроксианилина (20,1 г, 190 ммоль), K2CO3 (38 г) и этанола (300 мл) перемешивали при 60 С в течение 6 ч в атмосфере азота. Эту смесь охлаждали до комнатной температуры и добавляли 2-хлорэтилморфолин (16 г,ммоль). Полученную в результате смесь нагревали с обратным холодильников в течение 7 ч, охлаждали до комнатной температуры, отфильтровывали и полученный фильтрат концентрировали в вакууме. Полученный остаток очищали методом хроматографии на силикагелевых колонках с использованием для элюции 3 МеОН/этилацетата с получением соединения 5 в виде маслянистого вещества бурого цвета (22,5 г). Пример 6.NaCNBH4 (1,0 г) добавляли тремя порциями к раствору соединения 4 (7,3 г, 21,0 ммоль),соединения 5 (6,2 г, 279 ммоль) и уксусной кислоты (5,5 мл) в метаноле (300 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 30 мин. Большую часть метанола удаляли в вакууме и полученный остаток разбавляли метиленхлоридом, промывали 1 NNaOH и высушивали. Растворитель удаляли в вакууме и остаток очищали методом хроматографии на силикагелевых колонках, используя для элюции смесь этилацетата и гексана (9:1) с получением соединения 6 (10,3 г) в виде маслянистого вещества светло-коричневого цвета. ЯМР (CDCl3): 3,20 (Ашкв, J=8 Гц, 2 Н), 5,63 (с,1 Н, олефиновый протон), 6,61 (шс, 1 Н, NH). Эту рацемическую смесь разделяли методом ВЭЖХ с использованием хиральной колонкиCHIRACELOD, используя в качестве элюента смесь изопропанола и гексана (1:1) с получением соединений 6 а и 6b. Получена соль щавелевой кислоты рацемической смеси соединения 6: температура плавления 90-92 С. Масс-спектр: МН+=552. Пример 7. 3-Бензил-3-трихлорацетиламино-1-(N-фе-ниламинокарбонил)-N-[(3-(2-морфолиноэтокси)фенил)амино]метилциклопентен. К раствору соединения 6 (10,1 г) и триэтиламина (0,1 мл) в метиленхлориде (300 мл) добавляли по каплям фенилизоцианат (7,8 г,ммоль) при комнатной температуре в атмосфере азота. Полученную в результате смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали методом хроматографии на силикагелевой колонке с использованием в качестве элюента смеси этилацетата и гексана(CDCl3): 3,17 (Ашкв, J=8 Гц, 2 Н), 3,73 (м, 4 Н,CH2NCH2), 4,08 (т, 2 Н, ОСН 2-), 5,92 (м, 2 Н, олефиновые протоны), 6,28 (шс, 1 Н, NH), 7,22 (м,5 Н, ароматические протоны). Обработка масла 1 N НСl в эфире дает указанное в заголовке соединение 7 (12,2 г) в виде К раствору соединения 6b (15 мг) и триэтиламина (1 капля) в метиленхлориде (5 мл) добавляли по каплям фенилизоцианат (16 мг) при комнатной температуре в атмосфере азота. Полученную в результате смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали методом препаративной ТСХ на силикагеле с использованием в качестве элюента смеси этилацетата и гексана (95:5) с получением масла. Обработка масла щавелевой кислотой (или соляной кислотой) в эфире дает указанное в заголовке соединение 8 (15 мг) в виде твердого вещества: температура плавления 92-94 С. Масс-спектр: МН+=671. Пример 9. 3-Бензил-3-трихлорацетиламино-1-(N-фениламинокарбонил)-N-[(3-(2-морфолиноэтокси)фенил)амино]метилциклопентен. К раствору соединения 6 а (14 мг) и триэтиламина (1 капля) в метиленхлориде (5 мл) добавляли по каплям фенилизоцианат (14 мг) при комнатной температуре в атмосфере азота. Полученную в результате смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали методом препаративной ТСХ на силикагеле с использованием в качестве элюента смеси этилацетата и гексана (95:5) с получением масла. Обработка данного масла щавелевой кислотой в эфире дает указанное в заголовке соединение 9 (14 мг) в виде твердого вещества. Пример 10. 3-Бензил-3-трихлорацетиламино-1-(N-фенилкарбонил)-N-[(3-(2-морфолиноэтокси)фенил)амино]метилциклопентен. Бензоилхлорид (31 мг) добавляли к раствору соединения 6 (55 мг) и триэтиламина (0,3 мл) в метиленхлориде (30 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 2 ч. Большую часть растворителя удаляли в вакууме и полученный маслянистый остаток очищали хроматографически на силикагелевой колонке 20 с использованием в качестве элюента этилацетата с получением светло-коричневого масла (53 мг). Данное масло обрабатывали щавелевой кислотой в эфире с получением указанного в заголовке соединения в виде не совсем белого порошка (47 мг): температура плавления 79-81 С. Масс-спектр: МН+=656. Пример 11. 3-Бензил-3-трихлорацетиламино-1-(N-фениламиносульфонил)-N-[(3-(2-морфолиноэтокси)фенил)амино]метилциклопентен. Фенилизоцианат (15 мг) добавляли по каплям к раствору соединения 6 (30 мг) и триэтиламина (1 капля) в метиленхлориде (5 мл) при комнатной температуре в атмосфере азота. Полученную в результате смесь перемешивали в течение 24 ч и бoльшую часть растворителя удаляли в вакууме. Маслянистый остаток очищали методом препаративной тонкослойной хроматографии на силикагеле с использованием в качестве элюента смеси этилацетата и гексана(95:5) с получением масла. Обработка данного масла 1 N НСl в эфире дает указанное в заголовке соединение 11 (33 мг) в виде твердого вещества: температура плавления 105-108 С. Масс-спектр: МН+=687. Пример 12. Смесь соединения 3 (3,5 г), гидроокиси бария (4 г) и этанола (100 мл) нагревали с обратным холодильником в течение ночи. Полученную смесь охлаждали до. комнатной температуры, фильтровали и концентрировали в вакууме. Остаток очищали методом хроматографии на силикагелевой колонке с использованием в качестве элюента 1%-ного триэтиламина в этилацетате с получением соединения 11 а в виде бледно-желтого масла (1,1 г). ЯМР: 2,72(шд, J=9 Гц, 1 Н, олефиновый протон во 2-м положении), 5,63 (дт, 1 Н, другой олефиновый протон), 7,23 (м, 5 Н, ароматические протоны). Пример 12 а. Смесь соединения 12 (350 мг), триэтиламина (200 мг), уксусного ангидрида (200 мг) и метиленхлорида (50 мл) перемешивали при комнатной температуре в атмосфере азота в течение 3 ч. Смесь разбавляли метиленхлоридом(50 мл) и выливали в охлажденный на льду 1 N-78 С до тех пор, пока раствор не становится синим. Избыток озона удаляли в токе азота, добавляли диметилсульфид (0,5 г) и смесь оставляли подогреваться до комнатной температуры. Добавляли TsOH-H2O (100 мг) и полученную в результате смесь перемешивали в течение 4 дней. Смесь выливали в охлажденную на льдуNaOH (1 N) (50 мл) и полученный органический слой отделяли и очищали хроматографически на силикагелевой колонке с использованием в качестве элюента этилацетата и гексана (1:5) с получением соединения 13 (273 мг) в виде масла. ЯМР (CDCl3): 1,96 (с, 3 Н, ацетил), 3,20NaCNBH4 (150 мг) добавляли тремя порциями к раствору соединения 13 (273 мг), соединения 5 (297 мг), уксусной кислоты (0,5 мл) в метаноле (50 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 30 мин. Большую часть метанола удаляли в вакууме и остаток разбавляли метиленхлоридом,промывали 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток подвергали хроматографической очистке на силикагелевой колонке с использованием для элюирования смеси этил-ацетат:МеОН:триэтиламин (100:1:0,5) с получением соединения 14 (303 мг) в виде светло-коричневого масла. ЯМР: 1,88 (с, 3 Н, ацетил), 3,13 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 4,10 (т, J=6 Гц, 2 Н, феноксиметиленовые протоны), 5,62 (шс, 1 Н, олефиновый протон). К раствору соединения 14 (25 мг) и триэтиламина (1 капля) в метиленхлориде (5 мл) добавляли фенилизоцианат (14 мг) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали с помощью препаративной ТСХ на силикагеле с использованием в качестве элюента смеси этилацетата и гексана (95:5) с получением масла. Обработка данного масла щавелевой кислотой в эфире давала указанное в заголовке соединение 15 (33 мг) в виде твердого вещества: температура плавления 85-89 С. Масс-спектр: МН+=569. Пример 16. Получение соединения 16. Раствор 1 N ВН 3/ТГФ (20 мл) добавляли к раствору 3-(3-аминофенил)пропионовой кислоты (1,5 г) в ТГФ (15 мл) при 0 С под азотом. После добавления смесь оставляли подогреваться до комнатной температуры и перемешивали в течение ночи. Аккуратно добавляли 2 N NaOH,полученную в результате смесь перемешивали в течение 4 ч и большую часть растворителя удаляли в вакууме. Остаток экстрагировали метиленхлоридом (200 мл) и органическую фазу сушили и концентрировали в вакууме с получением соединения 16 в виде светложелтого масла (1,1 г). ЯМР (CDCl3): 3,71 (т, J=6 Гц, 2 Н, CH2OH), 6,727,13 (м, 4 Н, ароматические протоны). Пример 17. Получение соединения 17.NaCNBH4 (30 мг) добавляли тремя порциями к раствору соединения 4 (150 мг), соединения 16 (100 мг) и уксусной кислоты (10 капель) в метаноле (25 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 30 мин. Большую часть метанола удаляли в вакууме и остаток разбавляли метиленхлоридом, промывали 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток подвергали хроматографической очистке на силикагеле с использованием для элюирования этилацетата/гексана (1:1) с получением соеди 23 нения 17 (201 мг) в виде бледно-желтого масла. ЯМР (СDСl3): 3,16 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 3,72 (т, J=6 Гц, 2 Н, CH2OH), 3,82 Мезилхлорид (46 мг) добавляли к раствору соединения 17 (2,01 мг) и триэтиламина (0,2 мл) в метиленхлориде (50 мл) при -5 С под азотом. Данную смесь перемешивали в течение 5 мин и добавляли МеОН (2 капли), а полученную реакционную смесь оставляли подогреваться до комнатной температуры и выливали в 1 N NaOH(10 мл). Отделяли органический слой, сушили и растворитель удаляли в вакууме с получением густого коричневого масла. Данное масло растворяли в ТГФ (10 мл) и морфолине (50 мг) и полученную смесь нагревали с обратным холодильником в течение 16 ч. Смесь охлаждали до комнатной температуры и удаляли растворитель в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования этилацетата/триэтиламина (100:0,5) с получением соединения 18 (85 мг) в виде бледно-желтого масла. ЯМР (CDCl3): 3,18 (Ашкв, J=8 Гц, 2 Н,бензильные протоны), 3,82 (с, 2 Н, CH2N), 5,62 К раствору соединения 18 (32 мг) и триэтиламина (1 капля) в метиленхлориде (5 мл) добавляли по каплям фенилизоцианат (25 мг) при комнатной температуре в атмосфере азота. Полученную в результате смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали препаративной ТСХ на силикагеле с использованием в качестве элюента смеси этилацетата и гексана (95:5) с получением масла (41 мг). Обработка данного масла щавелевой кислотой в эфире дает указанное в заголовке соединение 19 (40 мг) в виде твердого вещества: температура плавления 85-88 С. Масс-спектр: МН+=669. Смесь 3-аминотиофенола (1,25 г, 10,0 ммоль), 2-хлорэтил-морфолина (2,3 г, 12,0 ммоль) и K2 СО 3 (1,8 г) в ТГФ (150 мл) нагревали с обратным холодильником в течение 8 ч. Полученную смесь фильтровали и распределяли между Н 2 О и этилацетатом. Водный слой промывали несколькими порциями этилацетата и объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента 10% МеОН/этилацетат, получая соединение 20 в виде масла (600 мг). ЯМРNaCNBH4 (300 мг) добавляли тремя порциями к раствору соединения 4 (800 мг), соединения 20 (600 мг) и уксусной кислоты (2,0 мл) в метаноле (100 мл) при комнатной температуре в атмосфере азота. Реакционную смесь перемешивали в течение 30 мин и большую часть метанола удаляли в вакууме. Остаток разбавляли метиленхлоридом, промывали 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток подвергали хроматографической очистке на силикагелевой колонке с использованием для элюирования смеси этилацетат/МеОН/триэтиламин (100:2:0,1) с получением соединения 21 (735 мг) в виде бледножелтого масла. ЯМР (СDСl3): 3,18 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 3,82 (с, 2 Н,CH2N), 5,62 (с, 1 Н, олефиновый протон),6,507,25 (м, 9 Н, ароматические протоны). Масс-спектр: МН+=568. Пример 22. 3-Бензил-3-трихлорацетиламино-1-(N-фениламинокарбонил)-N-[(3-(2-морфолиноэтил)фенил)тио]метилциклопентен. К раствору соединения 21 (53 мг) и триэтиламина (1 капля) в метиленхлориде (30 мл) добавляли по каплям фенилизоцианат (38 мг) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 24 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали хромато 25 графически на силикагелевой колонке с использованием в качестве элюента этилацетата/триэтиламина (100:0,2) с получением масла(55 мг). Обработка данного масла щавелевой кислотой в эфире дает указанное в заголовке соединение 22 (57 мг) в виде белого твердого вещества: температура плавления 88-92 С. Масс-спектр: МН+=687. Пример 23.NaCNBH4 (589 мг) добавляли тремя порциями к раствору соединения 4 (2,0 г), 3 нитроанилина (1,59 г, 11,5 ммоль) и уксусной кислоты (2 мл) в метаноле (100 мл) при комнатной температуре под азотом и перемешивали в течение ночи. Большую часть метанола удаляли в вакууме и остаток разбавляли метиленхлоридом, промывали 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток подвергали хроматографической очистке на силикагелевой колонке с использованием для элюирования этилацетата/гексана (1:1) с получением соединения 23 (2,0 г) в виде бледно-желтого масла. ЯМР (СDСl3): 3,18 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 3,85 (д, J=6 Гц, 2 Н, CH2N), 5,62 Бензоилхлорид (125 мг, 0,89 ммоль) добавляли к раствору соединения 23 (350 мг, 0,748 ммоль) и триэтиламина (1,3 мг) в метиленхлориде (30 мл) при комнатной температуре в атмосфере азота и данную смесь перемешивали в течение 2 ч. Большую часть растворителя удаляли в вакууме и маслянистый остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента смеси этилацетата и гексана (1:4) с получением соединения 24 в виде светло-коричневого масла (350 мг). ЯМР (CDCl3): 3,18 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 4,65 (д, J=8 Гц, 2 Н, CH2N), 5,62 Смесь соединения 24 (350 мг, 0,61 ммоль),10% палладия на угле (5 мг) и уксусной кислотыpsi (3,515 кг/см 2) при комнатной температуре в течение 8 ч. Полученную в результате смесь фильтровали через целит и концентрировали в вакууме. Остаток обрабатывали метиленхлоридом (300 мл), промывали водой, сушили и растворитель удаляли в вакууме. Остаток подвергали хроматографической очистке на силикагелевой колонке с использованием в качестве элюента этилацетата с получением соединения 25 (200 мг) в виде масла. ЯМР(101 мг) в 2-пропаноле (25 мл) нагревали с обратным холодильником в течение 2 дней. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой сушили и концентрировали в вакууме. Остаток подвергали хроматографической очистке на силикагелевой колонке. Бисалкилированное соединение (84 мг) элюировали смесью этилацетата/МеОН (95:5). Данное соединение обрабатывали щавелевой кислотой и эфиром, получая соединение 23 а (70 мг) в виде твердого вещества: температура плавления 8692 С. Масс-спектр: МН+=655. Продолжали элюирование метиленхлоридом/МеОН/триэтиламином (85:10:5), получая моноалкилированный продукт 23b, который превращали в оксалатную соль обработкой щавелевой кислотой и эфиром (40 мг): температура плавления 88-96 С. Масс-спектр: MH+=768. Пример 27.NaCNBH4 (146 мг) добавляли тремя порциями к раствору 4-хлорбензальдегида (308 мг,2,2 ммоль), 3-аминофенола (200 мг, 1,83 ммоль) и уксусной кислоты (1,0 мл) в метаноле (100 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 30 мин. Большую часть 27 метанола удаляли в вакууме и остаток разбавляли метиленхлоридом, промывали в 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования этилацетата, получая соединение 27 (230 мг) в виде бледно-желтого масла. ЯМР (CDCl3): 4,26 (с, 2 Н, бензильные протоны), 6,107,24 (м,8 Н, ароматические протоны). Масс-спектр: МH+=234. Пример 28.NaCNBH4 (60 мг) добавляли тремя порциями к раствору соединения 4 (259 мг), соединения 27 (230 мг) и уксусной кислоты (1,0 мл) в метаноле (50 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 16 ч. Большую часть метанола удаляли в вакууме и остаток разбавляли метиленхлоридом, промывали в 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток очищали хроматографически на силикагелевой колонке с получением соединения 28 (100 мг) в виде масла. ЯМР (СDСl3): 3,18 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 4,00 (д, J=8 Гц, 2 Н, CH2N),4,42 (с, 2 Н, 4-хлорбензильные протоны), 5,42 (с,1 Н, олефиновый протон), 6,217,25 (м, 13 Н,ароматические протоны). Пример 29. Раствор соединения 28 (100 мг, 0,18 ммоль), хлорэтилморфолина (100 мг, 0,6 ммоль) и DBU (115 мг) в 2-пропаноле (50 мл) нагревали с обратным холодильником в течение 2 дней. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой сушили в вакууме. Полученный остаток очищали хроматографически на силикагелевой колонке с использованием смеси этилацетата и гексана (1:1) с получением масла(95 мг). Обработка данного масла щавелевой кислотой и эфиром дает указанное в заголовке соединение 29 в виде твердого вещества: температура плавления 134-136 С. Масс-спектр: МН+=676.NaCNBH4 (35,3 мг) добавляли тремя порциями к раствору соединения 4 (150 мг, 0,43 ммоль), 3-гидроксибензиламина (104,8 мг, 0,87 ммоль) и уксусной кислоты (1,0 мл) в метаноле(50 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 16 ч. Большую часть метанола удаляли в вакууме и остаток разбавляли метиленхлоридом, промывали в 1 NNaOH и сушили. Растворитель удаляли в вакууме и остаток очищали хроматографически на силикагелевой колонке с получением соединения 30 (160 мг) в виде масла. ЯМР (СDСl3): 3,18 Бензоилхлорид (69 мг, 0,5 ммоль) добавляли к раствору соединения 30 (150 мг, 0,33 ммоль) и триэтиламина (1,0 мл) в метиленхлориде (20 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 16 ч. Бoльшую часть растворителя удаляли в вакууме и маслянистый остаток очищали хроматографически на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:4), с получением соединения 31 в виде светлокоричневого масла (220 мг). ЯМР (СDСl3): 3,18(120 мг) в 2-пропаноле (100 мл) нагревали с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой концентрировали в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования этилацетата/МеОН (9:1), получая масло (95 мг). Обработка масла щавелевой кислотой и эфиром дает указанное в заголовке соединение 32 в виде твердого вещества: температура плавления 9095 С. Масс-спектр: МН+=670. Пример 33. ганический слой концентрировали в вакууме,получая соединение 35 в виде масла. ЯМР(2,0 мл) в метиленхлориде (30 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 2 ч. Бoльшую часть растворителя удаляли в вакууме и маслянистый остаток очищали хроматографически на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:4), получая соединение 33 в виде светло-коричневого масла (65 мг). ЯМР Смесь соединения 35 (500 мг, 1,84 ммоль),10% палладия на угле (5 мг) и уксусной кислотыpsi (3,9 кг/см 2) при комнатной температуре в течение 16 ч. Данную смесь фильтровали через целит и концентрировали в вакууме. Остаток обрабатывали метиленхлоридом (300 мл), промывали водой, сушили и растворитель удаляли в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента этилацетата/МеОН (95:5),получая соединение 36 (200 мг) в виде масла. ЯМР (CDCl3): 4,06 (т, J=6 Гц, 2 Н, феноксиметиленовые протоны), 6,357,10 (м, 3 Н, ароматические протоны). Пример 37. Раствор соединения 33 (265 мг, 0,46 ммоль), хлорэтилморфолина (173 мг, 0,8 ммоль) и DBU (107 мг) в 2-пропаноле (50 мл) нагревали с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме и полученный остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой концентрировали в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования смеси этилацетата и МеОН (95:5), получая масло (165 мг). Обработка масла щавелевой кислотой и эфиром дает указанное в заголовке соединение 34 в виде твердого вещества: температура плавления 126128 С. Масс-спектр: МН+=684. Пример 35. Раствор 4-хлор-3-нитрофенола (2,0 г, 11,53 ммоль), хлорэтилморфолина (2,57 г, 13,8 ммоль) и карбоната калия (5,0 г) в 2-пропаноле (200 мл) нагревали с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. ОрNaCNBH4 (53 мг) добавляли тремя порциями к раствору соединения 4 (243 мг, 0,7 ммоль), соединения 36 (200 мг, 0,78 ммоль) и уксусной кислоты (2,0 мл) в метаноле (75 мл) при комнатной температуре под азотом. Смесь перемешивали в течение 16 ч и большую часть метанола удаляли в вакууме. Полученный остаток разбавляли метиленхлоридом, промывали 1N NaOH и сушили. Растворитель удаляли в вакууме и остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента смеси этилацетата и МеОН К раствору соединения 37 (45 мг) и триэтиламина (1,0 мл) в метиленхлориде (25 мл) добавляли 4-бромбензоилхлорид (25 мг) при комнатной температуре в атмосфере азота. Ре 31 акционную смесь перемешивали в течение 16 ч и большую часть растворителя удаляли в вакууме. Маслянистый остаток очищали методом препаративной ТСХ с использованием в качестве элюента этилацетата с получением масла (25 мг). Обработка масла щавелевой кислотой в эфире дает соединение 38 (20 мг). Масс-спектр: МН+=768. Пример 39.NaCNBH4 (204 мг) добавляли тремя порциями к раствору соединения 4 (1,04 г, 3,0 ммоль), 3-гидрокси-4-метоксианилина (835 мг,6,1 ммоль) и уксусной кислоты (2,0 мл) в метаноле (100 мл) при комнатной температуре под азотом. Реакционную смесь перемешивали в течение 6 ч и большую часть метанола удаляли в вакууме. Остаток разбавляли метиленхлоридом, промывали 1 N NaOH и сушили. Растворитель удаляли в вакууме и остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента смеси этилацетата и гексана (1:1) с получением соединения 39 (1,2 г) в виде масла. ЯМР (CDCl3): 3,18 Раствор соединения 39 (500 мг, 1,06 ммоль), хлорэтилморфолина (394 мг, 2,12 ммоль) и DBU (490 мг) в 2-пропаноле (100 мл) нагревали с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой концентрировали в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования смеси этилацетата/МеОН/триэтиламина(85:10:5) с получением масла. Обработка масла щавелевой кислотой и эфиром дает указанное в заголовке соединение 40 в виде твердого вещества: температура плавления 92-95 С. Массспектр: МН+=695. Пример 41. 32 Бензоилхлорид (43 мг, 0,3 ммоль) добавляли к раствору соединения 40 (120 мг, 0,26 ммоль) и триэтиламина (1,0 мл) в метиленхлориде (50 мл) при комнатной температуре в атмосфере азота. Смесь перемешивали в течение 6 ч, выливали в 1 N NaOH и экстрагировали метиленхлоридом. Органические экстракты объединяли, сушили и концентрировали в вакууме. Маслянистый остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента смеси этилацетата и гексана (1:1) с получением соединения 41 в виде масла (100 мг). ЯМР (СDСl3): 3,18 (Ашкв, J=8 Гц, 2 Н, бензильные протоны), 3,81 (с, 3 Н,СН 3 О), 4,60 (д, J=8 Гц, 2 Н, CH2N), 5,62 (с, 1 Н,олефиновый протон), 6,607,38 (м, 13 Н, ароматические протоны). Пример 42. Раствор соединения 41 (100 мг, 0,17 ммоль), хлорэтилморфолина (64,7 мг, 0,35 ммоль) и DBU (300 мг) в 2-пропаноле (50 мл) нагревали с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме и остаток обрабатывали 0,5 N NaOH (100 мл) и экстрагировали несколькими порциями этилацетата. Органический слой концентрировали в вакууме. Остаток очищали хроматографически на силикагелевой колонке с использованием для элюирования этилацетата:МеОН (9:1) с получением масла. Обработка масла щавелевой кислотой и эфиром дает указанное в заголовке соединение 42 (81 мг) в виде твердого вещества: температура плавления 85-91 С. Масс-спектр: МН+=686. Пример 43.NaCNBH4 (250 мг) добавляли тремя порциями к раствору соединения 4 (510 мг, 1,6 ммоль), 3-аминофенола (515 мг, 4,9 ммоль) и уксусной кислоты (1,0 мл) в метаноле (200 мл) при комнатной температуре под азотом. Реакционную смесь перемешивали в течение 30 мин и большую часть метанола удаляли в вакууме. Остаток разбавляли метиленхлоридом, промывали 1 N NaOH, сушили и концентрировали в вакууме. Полученный остаток очищали хроматографически на силикагелевой колонке с использованием в качестве элюента этилацетата/гексана (1:2) с получением соединения 43 Смесь соединения 43 (251 мг), K2 СО 3 (1,1 г),этилбромацетата (200 мг) и ТГФ (70 мл) нагревали до 50 С в течение 8 ч. Полученную в результате смесь фильтровали через целит и концентрировали в вакууме. Остаток очищали на хроматографической силикагелевой колонке с использованием для элюирования смеси этилацетата и гексана (1:3) с получением соединения 44 в виде бледно-желтого масла (263 мг). Обработка масла концентрированной соляной кислотой и МеОН дает соединение 44 в виде белой пены (89 мг): температура плавления 64-66 С. Масс-спектр: MH+=525. Пример 45.(1 мл) в МеОН (5 мл) перемешивали при комнатной температуре в атмосфере азота в течение 3 ч. Большую часть МеОН удаляли в вакууме и остаток разбавляли водой (10 мл). Смесь подкисляли до рН=4 добавлением 0,1 N соляной кислоты и экстрагировали метиленхлоридом. Объединенные органические экстракты сушили и концентрировали в вакууме с получением указанного в заголовке соединения 45 в виде светло-коричневого порошка (35 мг): температура плавления 70-73 С. Масс-спектр: МН+=497. Пример 46. Бензоилхлорид (31 мг) добавляли к раствору соединения 44 (45 мг) и триэтиламина (0,1 мл) в метиленхлориде (30 мл) при комнатной температуре в атмосфере азота и перемешивали в течение 5 ч. Полученную в результате реакционную смесь переливали 1 N NaOH и экстрагировали в метиленхлориде. Объединенные органические экстракты сушили и концентрировали в вакууме. Большую часть растворителя удаляли в вакууме и маслянистый остаток очищали с использованием в качестве элюента смеси этилацетата и гексана (3:5) с получением соединения 46 в виде бледно-желтого масла (100 мг). Массспектр: МН+=629. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I в которой R1 представляет Н, C1-5-алкил, замещенный C1-5-алкил (где заместителями являются один или несколько галогенов), амино-С 1-5 ди-С 1-5 алкил,С 1-5-алкиламино-С 1-5-алкил,алкиламино-С 1-5-алкил, RaRbN-C1-5-алкил (где Ra и Rb независимо выбраны из Н и C1-5-алкила или вместе образуют морфолин, пиперазин, пиперидин или N-замещенный пиперидин, где Nзаместитель представляет С 1-5-алкил или фенилC1-5-алкил), C1-5-алкилкарбонил, C1-5-алкоксикарбонил, аминокарбонил, C1-9-алкиламинокарбонил, цикло-С 3-9-алкиламинокарбонил, пиридинилкарбонил, замещенный пиридинилкарбонил (где заместители у пиридинила выбраны из группы, включающей один или несколько галогенов и C1-5-алкилов), тиофенкарбонил, замещенный тиофенкарбонил (где заместители выбраны из группы, включающей один или несколько галогенов и C1-5-алкилов), фенил,фенил-С 1-5-алкил, феноксикарбонил, фенилкарбонил, дифенилметилкарбонил, фениламинокарбонил, фенилтиокарбонил, фениламинотиокарбонил, замещенный фенил, замещенный фенил-С 1-5-алкил, замещенный феноксикарбонил, замещенный фенилкарбонил, замещенный фениламинокарбонил, замещенный дифенилметилкарбонил, замещенный фенилтиокарбонил или замещенный фениламинотиокарбонил (где заместители у фенила выбраны из группы, включающей один или несколько галогенов, C1-5 алкил, тригалогенметил, C1-5-алкокси, амино,нитрил, нитро, C1-5-алкиламино, ди-С 1-5 алкиламино, если присутствует более одного заместителя, то они могут вместе с фенильным кольцом образовать сконденсированное бициклическое 7-10-членное гетероциклическое кольцо, включающее один или два гетероатома, выбранных из кислорода, серы или азота, или заместители могут быть взяты вместе, образуя сконденсированное бициклическое 7-10 членное ароматическое кольцо);R2 выбран из Н, C1-5-алкила, C1-5-алкокси,фенила, замещенного фенила (где заместители у фенила выбраны из одной или более групп,включающих галоген и C1-5-алкил), фенил-C1-5 алкила, замещенного фенил-С 1-5-алкила (где заместители у фенила выбраны из одной или более групп, включающих галоген, C1-5-алкил,C1-5-алкокси, галоген- и ди-C1-5-алкиламино);R3 выбран из Н, C1-5-алкилкарбонила, замещенного C1-5-алкилкарбонила (где заместители у алкила выбраны из одного или нескольких галогенов), фенилкарбонила и замещенного фенилкарбонила (где заместители выбраны из одной или более заместителей из группы, вклю 35R4 выбран из Н, C1-5-алкилкарбонила, замещенного C1-5-алкилкарбонила (где заместители у алкила выбраны из одного или нескольких галогенов), фенилкарбонила и замещенного фенилкарбонила (где заместители у фенила выбраны из одной или более из группы, включающей галоген, C1-5-алкил, C1-5-алкокси, амино, C1-5 алкиламино и ди-С 1-5-алкиламино);t равно 0-1; Х представляет О, CH2, S или NRc,где Rc представляет Н, C1-5-алкил, морфолино-C1-5-алкил, пиперидинил-С 1-5-алкил, Nфенилметилпиперидинил или пиперазинил-С 1-5 алкил; при условии, что, если q и t равны 0, тогда Х представляет гидрокси, тиол или амино; А представляет C1-5-алкоксикарбонил,фенил-карбонил или R7R8N-,где R7 независимо выбран из водорода, C15-алкила, цикло-С 3-9-алкила, или R7 взят вместе сR8, образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами,выбранными из группы, состоящей из кислорода, азота или серы, и их N-оксидов;R8 независимо выбран из водорода, C1-5 алкила, цикло-С 3-9-алкила или взят вместе с R7,образуя 5- или 6-членное гетероциклическое кольцо с одним или более гетероатомами, выбранными из группы, состоящей из кислорода,азота или серы, и их N-оксидов;R6 выбран из водорода, галогена, C1-5 алкокси, C1-5-алкиламино или ди-С 1-5-алкиламино,или их фармацевтически приемлемые соли. 2. Соединение по п.1, в котором 8. Фармацевтическая композиция для лечения расстройств, ассоциированных с рецептором мотилина, включающая эффективное количество соединения по п.1 в сочетании с одним или несколькими фармацевтически приемлемыми носителями. 9. Способ лечения расстройств, ассоциированных с рецептором мотилина, у людей, включающий введение человеку, нуждающемуся в таком лечении, эффективного количества соединения по п.1.
МПК / Метки
МПК: A61K 31/5375, A61P 1/00, C07D 295/08, C07C 233/41
Метки: циклопентена, мотилина, антагонистов, производные, рецептора, качестве
Код ссылки
<a href="https://eas.patents.su/19-3252-proizvodnye-ciklopentena-v-kachestve-antagonistov-receptora-motilina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклопентена в качестве антагонистов рецептора мотилина</a>












