5-фенилпиримидины,способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами
Номер патента: 7719
Опубликовано: 29.12.2006
Авторы: Райнхаймер Йоахим, Шивекк Франк, Гипзер Андреас, Гевер Маркус, Мюллер Бернд, Розе Инго, Гроте Томас, Аммерманн Эберхард, Штирль Райнхард, Штратман Зигфрид, Заутер Хуберт, Тормо И Бласко Хорди, Лоренц Гизела, Шэфер Петер
Формула / Реферат
1. 5-Фенилпиримидины формулы I
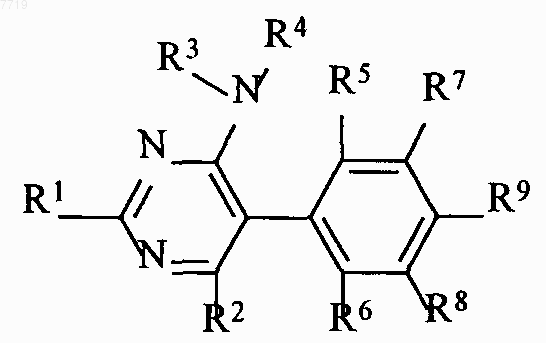
где заместители имеют следующие значения:
R1 означает пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, причем R1 может быть замещен одной до трех одинаковыми или различными группами Rа,
Rа означает галоген, гидрокси, циано, оксо, нитро, амино, меркапто, C1-С6-алкил, C1-C6-галогеналкил, С2-С6-алкенил, С2-С6-алкинил, С3-С6-циклоалкил, C1-C6-алкокси, C1-C6-галогеналкокси, карбоксил, С1-С7-алкоксикарбонил, карбамоил, С1-С7-алкиламинокарбонил, С1-С6-алкил-С1-С6-алкиламинкарбонил, морфолинокарбонил, пирролидинокарбонил, С1-С7-алкилкарбониламино, C1-С6-алкиламино, ди-(С1-С6-алкил)амино, C1-С6-алкилтио, C1-C6-алкилсульфинил, C1-С6-алкилсульфонил, гидроксисульфонил, аминосульфонил, С1-С6-алкиламиносульфонил, ди-(С1-С6-алкил)аминосульфонил;
R2 означает водород, галоген, циано, C1-С6-алкил, C1-C6-галогеналкил, C1-C6-алкокси, С1-С4-галогеналкокси или С3-С6-алкенилокси;
R3, R4 означают независимо друг от друга водород, C1-C6-алкил, C1-C6-галогеналкил, С3-С6-циклоалкил, С3-С6-галогенциклоалкил, С2-С6-алкенил, С2-С6-галогеналкенил, С3-С6-циклоалкенил, С2-С6-алкинил, С2-С6-галогеналкинил или С3-С6-циклоалкинил;
R3 и R4 совместно с атомом азота, с которым они связаны, могут образовывать пяти- или шестичленный цикл, который может быть прерван гетероатомом из группы, включающей О, N или S и/или может иметь один или несколько заместителей из группы, включающей галоген, C1-C6-алкил, C1-C6-галогеналкил и окси-С1-С3-алкиленокси или в котором два смежных С-атома или один N-атом и один смежный С-атом могут быть связаны С1-С4-алкиленовой цепью;
R5, R6 независимо друг от друга означают водород, галоген, C1-C6-алкил, C1-С6-галогеналкил или C1-C6-алкокси;
R7, R8 независимо друг от друга означают водород, галоген, C1-C6-алкил или C1-С6-галогеналкил;
R9 означает водород, галоген, C1-C6-алкил, C1-С6-алкокси, С3-С6-циклоалкокси, C1-C6-галогеналкокси, C1-C6-алкоксикарбонил или C1-С6-алкиламинокарбонил.
2. Соединения формулы I по п.1, причем заместители имеют следующие значения:
R1 означает пиразол, пиррол, имидазол, 1,2,3-триазол, 1,2,4-триазол или тетразол, которые связаны через С или N, или 2-пиримидмн, пиразин или 3-пиридазин, причем R1 имеет до трех заместителей Ra',
Ra' означает галоген, гидрокси, циано, нитро, амино, меркапто, C1-С6-алкил, C1-C6-галогеналкил, С2-С6-алкенил, С2-С6-акинил, С3-С6-циклоалкил, C1-С6-алкокси, C1-С6-галогеналкокси, карбоксил, С1-C7-алкоксикарбонил, карбамоил, С1-С7-алкиламинокарбонил, С1-С6-алкил-С1-С6-алкиламинокарбонил, морфолинокарбонил, пирролидинокарбонил, С1-С7-алкилкарбониламино, C1-C6-алкиламино, ди-(С1-С6-алкил)амино, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, гидроксисульфонил, аминосульфонил, C1-C6-алкиламиносульфонил или ди-(С1-С6-алкил)аминосульфонил;
R2 означает галоген, C1-C6-алкил или C1-С6-алкокси;
R3, R4 означают независимо друг от друга водород, C1-С6-алкил, C1-C6-галогеналкил, С3-С6-циклоалкил или С2-С6-алкенил;
R3 и R4 могут совместно с атомом азота, с которым они связаны, образовывать пяти-шестичленный цикл, который может быть прерван атомом кислорода и может иметь C1-C6-алкильный заместитель;
R5, R6 означают независимо друг от друга водород, галоген или C1-C6-алкил;
R7, R8 означают независимо друг от друга водород или галоген;
R9 означает водород, галоген, C1-C6-алкил или C1-C6-алкокси.
3. Соединения формулы I по пп.1 и 2, причем R2 означает хлор.
4. Соединения формулы I по пп.1-3, причем комбинация заместителей от R5 до R9 имеют следующие значения: 2-хлор, 6-фтор; 2,6-дифтор; 2,6-дихлор; 2-метил, 4-фтор; 2-метил, 6-фтор; 2-сртор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, 4-метокси; 2,4-диметил и пентафтор.
5. Способ получения 5-фенилпиримидинов формулы I по п.1, где R1 связан с азотом и R2 означает хлор, отличающийся тем, что тиомочевину циклизируют сложным фенилмалоналкильным эфиром формулы II
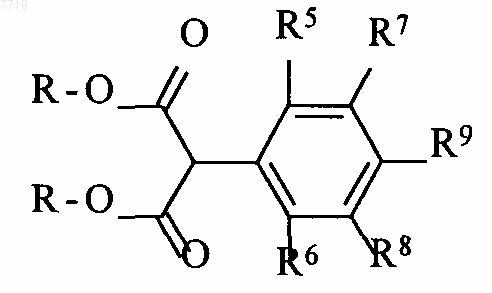
где R означает C1-C6-алкил, в соединения формулы III
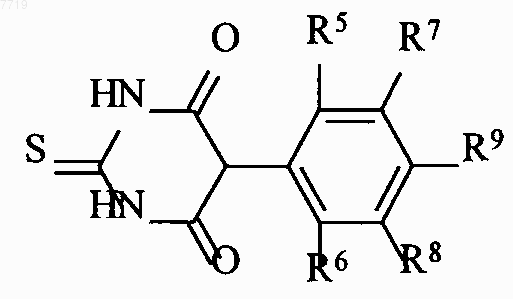
которые подвергают взаимодействию с агентом алкилирования формулы IV,
R_X,
где R означает C1-C6-алкил и Х нуклеофильно заменяемую группу, с получением соединений формулы V
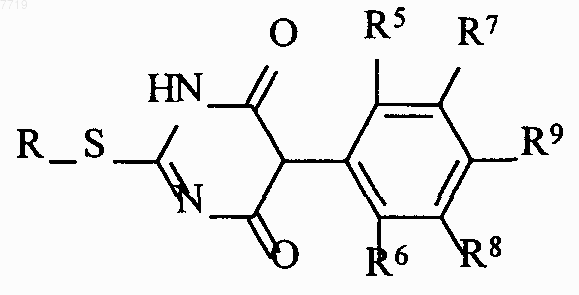
которые агентом хлорирования переводят в дихлорпиримидины формулы VI
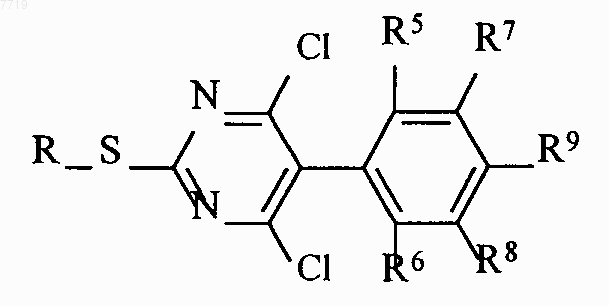
которые взаимодействием с аминосоединениями формулы VII
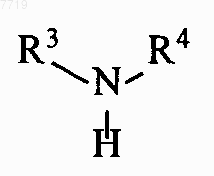
превращают в производные пиримидина формулы VIII
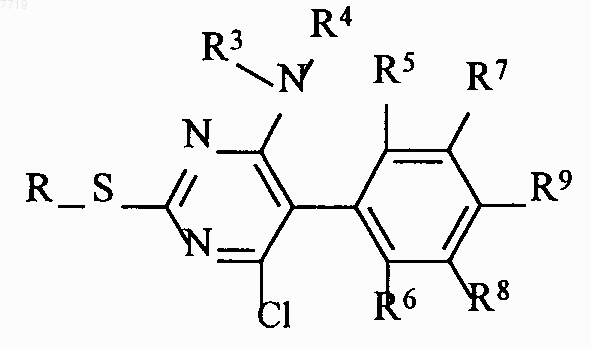
и соединения формулы VIII оксидируют с получением сульфонов формулы IX
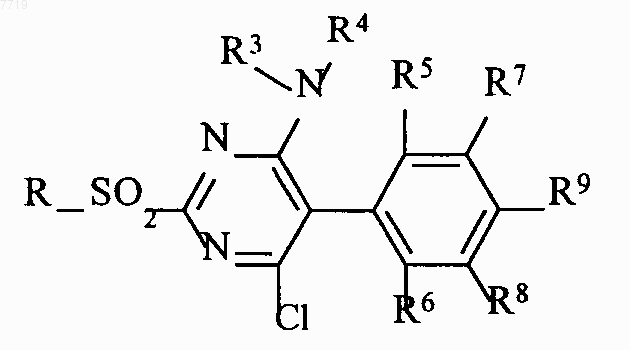
которые взаимодействием с гетероциклическими соединениями формулы Х

где цикл А означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, переводят в соединения формулы I.
6. Способ получения 5-фенилпиримидинов формулы I по п.1, причеь В означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, отличающийся тем, что дихлорпиримидин формулы IVa,
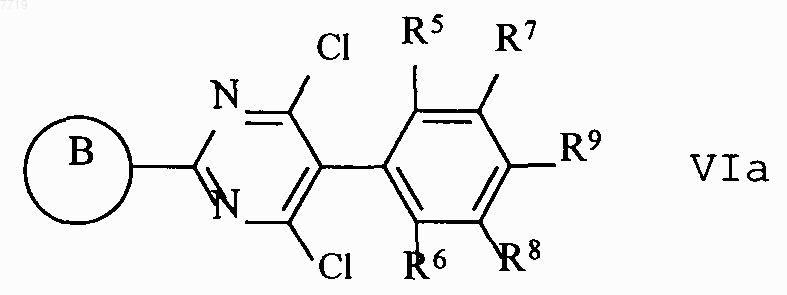
где заместители имеют приведенные в п.1 значения, подвергают взаимодействию с амином формулы VII по п.5.
7. Промежуточный продукт формул VI по п.5, в котором комбинации заместителей от R5 до R9 имеют значения согласно п.4.
8. Промежуточный продукт формул VIa по п.6, в котором комбинации заместителей от R5 до R9 имеют значения согласно п.4.
9. Пригодные для борьбы с фитопатогенными грибами средства, содержащие жидкий или твердый носитель и соединение общей формулы I по п.1.
10. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы и подлежащие защите от грибов материалы, растения, почву или посевной материал обрабатывают эффективным количеством соединения общей формулы I по п.1.
Текст
007719 Настоящее изобретение относится к 5-фенилпиримидины формулы I где заместители имеют следующее значения:R1 означает пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4 триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, причем R1 может быть замещен от одной до трех одинаковыми или различными группами Rа,Rа означает галоген, гидрокси, циано, оксо, нитро, амино, меркапто, C1-C6-алкил, C1-С 6 галогеналкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, C1-С 6-алкокси, C1-C6-галогеналкокси,карбоксил, С 1-С 7-алкоксикарбонил, карбамоил, С 1-С 7-алкиламинокарбонил, С 1-С 6-алкил-С 1-С 6 алкиламинкарбонил, морфолинокарбонил, пирролидинокарбонил, C1-C7-алкилкарбониламино, C1-C6 алкиламино, ди-(С 1-С 6-алкил)амино, C1-C6-алкилтио, C1-С 6-алкилсульфинил, C1-С 6-алкилсульфонил,гидроксисульфонил, аминосульфонил, C1-C6-алкиламиносульфонил, ди-(С 1-С 6-алкил)аминосульфонил;R3, R4 означают независимо друг от друга водород, C1-C6-алкил, C1-C6-галогеналкил, С 3-С 6 циклоалкил, С 3-С 6-галогенциклоалкил, С 2-С 6-алкенил, С 2-С 6-галогеналкенил, С 3-С 6-циклоалкенил, С 2-С 6 алкинил, С 2-С 6-галогеналкинил или С 3-С 6-циклоалкинил;R3 и R4 совместно с атомом азота, с которым они связаны, могут образовывать пяти- или шестичленный цикл, который может быть прерван гетероатомом из группы, включающей О, N или S и/или может иметь один или несколько заместителей из группы, включающей галоген, C1-С 6-алкил, C1-C6 галогеналкил и окси-С 1-С 3-алкиленокси или в котором два смежных С-атома или один N-атом и один смежный С-атом могут быть связаны C1-C4-алкиленовой цепью;R5, R6 независимо друг от друга означают водород, галоген, C1-C6-алкил, C1-С 6-галогеналкил илиR7, R8 независимо друг от друга означают водород, галоген, C1-С 6-алкил или C1-C6-галогеналкил;R9 означает водород, галоген, C1-C6-алкил, C1-C6-алкокси, С 3-С 6-цикпоалкокси, C1-С 6 галогеналкокси, C1-C6-алкоксикарбонил или C1-C6-алкиламинокарбонил. Заместители предпочтительных соединений формулы I могут иметь следующие значения:R1 означает пиразол, пиррол, имидазол, 1,2,3-триазол, 1,2,4-триазол или тетразол, которые связаны через С или N, или 2-пиримидин, пиразин или 3-пиридазин, причем R1 имеет до трех заместителей Ra',Ra означает галоген, гидрокси, циано, нитро, амино, меркапто, C1-C6-алкил, C1-С 6-галогеналкил, С 2 С 6-алкенил, С 2-С 6-акинил, С 3-С 6-циклоалкил, C1-C6-алкокси, C1-C6-галогеналкокси, карбоксил, С 1-С 7 алкоксикарбонил, карбамоил, C1-C7-алкиламинокарбонил, С 1-С 6-алкил-С 1-С 6-алкиоаминокарбонил, морфолинокарбонил, пирролидинокарбонил, С 1-С 7-алкилкарбониламино, C1-C6-алкиламино, ди-(С 1-С 6-алкил)амино, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-С 6-алкилсульфонил, гидроксисульфонил, аминосульфонил, C1-C6-алкиламиносульфонил или ди-(С 1-С 6-алкил)аминосульфонил;R3, R4 означают независимо друг от друга водород, C1-C6-алкил, C1-C6-галогеналкил, С 3-С 6 циклоалкил или С 2-С 6-алкенил;R3 и R4 могут совместно с атомом азота, с которым они связаны, образовывать пяти, шестичленный цикл, который может быть прерван атомом кислорода и может иметь C1-C6-алкильный заместитель;R5, R6 означают независимо друг от друга водород, галоген или C1-C6-алкил;R7, R8 означают независимо друг от друга водород или галоген;R9 означает водород, галоген, С 1-С 6-алкил или C1-С 6-алкокси. У предпочтительных заявленных соединений R2 может означать хлор. При этом комбинация заместителей R5 до R9 может иметь следующие значения: 2-хлор, 6-фтор; 2,6-дифтор; 2,6-дихлор; 2-метил, 4 фтор; 2-метил, 6-фтор; 2-фтор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, 4-метокси; 2,4-диметил и пентафтор. Еще одним объектом заявленного изобретения является способ получения 5-фенилпиримидинов формулы I, где R1 связан с азотом и R2 означает хлор, предусматривающий циклизацию тиомочевины сложным фенилмалоналкильным эфиром формулы II которые подвергают взаимодействию с агентом алкилирования формулы IVRX где R означает C1-C6-алкил, и Х - нуклеофильно заменяемую группу, с получением соединений формулы V которые агентом хлорирования переводят в дихлорпиримидины формулы VI превращают в производные пиримидина формулы VIII и соединения формулы VIII оксидируют с получением сульфонов формулы IX которые взаимодействием с гетероциклическими соединениями формулы Х где цикл А означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол,имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4 оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, переводят в соединения формулы I. Одним из предпочтительных вариантов осуществления заявленного способа получения 5-фенилпиримидинов формулы I является способ, в котором в означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол,изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, предусматривающий взаимодействие дихлорпиримидина формулы IVa с амином формулы VII. Объектом заявленного изобретения также является промежуточный продукт формулы VI, в котором комбинации заместителей от R5 до R9 имеют следующие значения: 2-хлор, 6-фтор; 2,6-дифтор; 2,6-2 007719 дихлор; 2-метил, 4-фтор; 2-метил, 6-фтор; 2-фтор, 4-метил; 2,4,6-трифтор; 2,6-дифтор, 4-метокси; 2,4 диметил и пентафтор. Предпочтительным промежуточным продуктом формулы VIa является продукт, у которого комбинации заместителей R5 до R9 имеют вышеуказанные значения. Объектами заявленного изобретения также являются пригодные для борьбы с фитопатогенными грибами средства, содержащие жидкий или твердый носитель и соединение общей формулы I, и способ борьбы с фитопатогенными грибами, при котором грибы и надлежащие защите от грибов материалы, растения, почву или посевной материал обрабатывают эффективным количеством указанного соединения. Производные 2-пиридил-4-аминопиримидина с фунгицидным действием известны из ЕР-А 407899,производные пиридилпиримидина описаны в DE-А 3937284, DE-A3937285, DE-A 4029649, DE-A 4034762, DE-A 4227811, ЕР-А 481405 и WO-A 92/10490. Описанные в вышеприведенных публикациях соединения пригодны в качестве средств защиты растений против фитопатогенных грибов. Их действие во многих случаях не удовлетворительно. Поэтому задачей настоящего изобретения является разработка соединений с более усовершенствованным действием. В соответствие с этим были разработаны вышеописанные производные фенилпиримидина формулыI, способ и промежуточные продукты, а также содержащие их средства для борьбы с фитопатогенными грибами и их применение в это смысле. Соединения формулы I имеют по сравнению с известными соединениями повышенную эффективность против фитопатогенных грибов. Соединения формулы I могут быть получены различным образом. Соединения формулы I, в которой R1 означает связанные азотом гетероциклы и R2 означает хлор,можно получать, например, следующим способом. Из циклоконденсации тиомочевины сложными алкиловыми эфирами фенилмалоновой кислоты фомулы II получают соединения формулы III причем в формуле II R означает C1-C6-алкил. Реакцию осуществляют обычно в протонном растворителе, таком, как спирты, в частности этанол. Она может проводиться также и в апротонном растворителе, таком как пиридин, N,N-диметилфоромамид, N,N-диметилацетамид или их смеси [ср. патент US 4,331,590; публикацию Org. Prep. and Proced. Int., том 10, стр. 21-27 (1978); Collect. Czech. Chem. Commun., том 48, стр. 137-143 (1983); Heteroat. Chem., Bd. 10, стр. 17-23 (1999); Czech. Chem. Commun., том 58, стр. 2215-2221 (1993)]. Может давать преимущество проведение реакции в присутствии основания,которое применяется в эквимолярном или же избыточном количестве. В качестве основания пригодны,например, карбонаты и гидрокарбонаты щелочных и щелочно-земельных металлов, например, калиевые и натриевые соли, в частности, Nа 2 СО 3 и NaHCO3, или же азотные основания как, например, пиридин и трибутиламин. Температура реакции составляет обычно от 20 С до 250 С, предпочтительно от 70 до 220 С. Обычно компоненты применяют в слегка стехиометрическом соотношении. Может давать преимущество применение тиомочевины в избыточном количестве. Требуемые арилмалоновые спирты известны (ср ЕР-А 1002 788) или могут быть получены известными из публикаций методами. Соединения формулы III превращаются алкилирующими агентами формулы IV в производные тиобарбитуровой кислоты. В этой формуле R означает C1-C6-алкил и Х - нуклеофильно отщепляемую группу. Формула IV в общем означает обычные алкилирующие агенты, такие как C1-C6-алкилгалогениды, в частности метилхлорид и метилбромид, сложные ди-(С 1-С 6-алкил)овые эфиры серной кислоты, такие как диметилсульфат или сложные C1-C6-алкиловые эфиры метансульфокислоты, такие как сложный метиловый эфир метансульфокислоты. Реакция может проводиться в воде или же в диполярном апротонном растворителе, таком как, например, N,N-диметилформамид [ср. патент US 5,250,689], предпочтительно она происходит в присутствии основания, которое может применяться в эквимолярном или же избыточном количестве. В качестве основания пригодны гидроксиды, гидрокарбонаты и карбонаты щелочных или щелочно-земельных металлов, как, например, KОН, NaOH, NаНСО 3 и Na2CO3, a также азотные основания, такие, как пиридин. Температура реакции составляет обычно от 0 до 100 С, предпочтительно от 10 до 60 С. Обычно компо-3 007719 ненты применяют в несколько стехиометрическом соотношении. Может давать преимущество применение алкилирующих агентов в избытке. Соединения формулы V превращаются в дихлорпиримидины формулы VI [ср. US 4,963,678; ЕР-А 745 593; DE-A 196 42 533; WO-A 99/32458; J.Org. Chem. Bd. 58, S. 3785-3786 (1993); Helv. Chim. Acta,том. 64, стр. 113-152 (1981)]. В качестве хлорирующих агентов [Cl] пригодны, например, РОСl3, PCl3/Cl2 или PCl5, или смеси этих реагентов. Реакция может проводиться с избыточным количеством холорирующего агента (РОСl3) или в инертном растворителе, например, ацетонитриле или 1,2-дихлорэтане. Проведение реакции в РОСl3 является предпочтительным. Это взаимодействие осуществляют обычно при температуре между 10 С и 180 С. Из практических соображений обычно температура реакции соответствует температуре кипения применяемого хлорирующего агента (РОСl3) или растворителя. Способ проводят предпочтительно с добавкой N,N-диметилформамида в каталитическом или подстехиометрическом количестве или азотного основания, например,N,N-диметиланилина. Аминированием соединение формулы VII дихлорсоединения формулы VI переводят в соединения формулы VIII Это взаимодействие осуществляют обычно при температуре от 0 до 150 С, предпочтительно от 20 до 120 С [ср. публикации J. Chem. Res. S (7), стр. 286-287 (1995), Liebigs Ann. Chem., стр. 1703-1705(1995)] в инертном растворителе, в случае необходимости в присутствии вспомогательного основания. В качестве растворителя пригодны протонные растворители, такие как спирты, например, этанол,или апротонные растворители, такие как ароматические углеводороды или простые эфиры, например толуол, о-, м- и п-ксилол, простой диэтиловый эфир, диизопропиловый эфир, трет.-бутилметиловый эфир, диоксан или тетрагидрофуран, в частности трет.-бутилметиловый эфир или тетрагидрофуран. В качестве вспомогательного основания пригодны, например, NaHCO3, Na2CO3, Na2HPO4, Na2B4O7, диэтиоанилин или этилдиизопропиламин. Обычно компоненты применяют приблизительно в стехиометрическом соотношении. Однако, амин может применяться также и в избытке. Амины формулы VII имеются в продаже или известны из публикаций и могут быть получены известными методами. Тиосоединения формулы VIII окисляют в сульфоны IX. Реакцию обычно осуществляют при температуре от 0 до 100 С, предпочтительно от 10 до 50 С в присутствии протонного или апротонного растворителя [ср. публикации: В. Kor. Chem. Soc., том 16, стр. 489-492 (1995); Z. Chem., том 17, стр. 63 (1977)]. В качестве растворителей пригодны при этом алкилкарбоновые кислоты, такие как уксусная кислота или спирты, такие как метанол, вода или галогенированные углеводороды, такие как дихлорметан или хлороформ. Могут применяться также и смеси приведенных растворителей. Предпочтительны уксусная кислота и смесь метанола с водой. Пригодными оксисляющими агентами являются при этом, например, перекись водорода, первольфрамовая кислота, перуксусная кислота, 3-хлорпербензойная кислота, перфталевая кислота, хлор, кислород и оксоны (KHSO5). Окисляющий агент обычно применяется в стехиометрическом соотношении. Можно работать также и с избыточным количеством окисляющего агента.-4 007719 Производные пиримидина формулы IX переводят взаимодействием с гетероциклами формулы Х в соединения формулы I. В формуле Х означает цикл А для пяти- до десятичленного насыщенного, частично ненасыщенного или ароматического азотсодержащего кольца. Эта реакция взаимодействия проводится обычно при температуре от 0 до 200 С, предпочтительно от 10 до 150 С в присутствии диполярного, апротонного растворителя, такого как N,Nдиметилформамид, тетрагидрофуран или ацетонитрил [ср. публикации DE-A 39 01 084; Chimia, том 50,стр. 525-530 (1996); Khim. Geterotsikl. Soedin, том 12, стр. 1696-1697 (1998)]. Обычно компоненты применяют приблизительно в стехиометрическом соотношении. Однако может давать преимущество применение гетероцикла азота формулы Х в избытке. Обычно реакцию осуществляют в присутствии основания, которое может быть в эквимолярном, а также избыточном количестве. В качестве основания пригодны гидрокарбонаты щелочных и щелочноземельных металлов, например, Nа 2 СО 3 и NaHCO3, азотные основания, такие как триэтиламин, трибутиламин и пиридин, алкоголяты щелочных металлов, такие, как метилят натрия или трет.-бутилат калия,амиды щелочных металлов, такие как NaNH2 или же гидриды щелочных металлов, такие как LiH илиNaH. Соединения формулы I, в которой R1 связан через атом углерода с пиридиновым кольцом, можно получать, например, следующим синтезом: В формулах Vb и XII цикл В означает связанный углеродом пяти- до десятичленный, насыщенный,частично ненасыщенный или ароматический цикл. Реакцию обычно осуществляют при температуре от 50 до 250 С, предпочтительно от 100 до 200 С в присутствии инертного растворителя [ср. публикации: Austr. J. Chem., том 32, стр. 669-679 (1979); J.Org. Chem., том 58, стр. 3785-3786 (1993); Arm. Xim. ZH, том 38, N11, стр. 718-719 (1985)]. В качестве растворителя пригодны протонные растворители, такие как спирты, предпочтительно метанол или этанол, апротонные растворители, такие как трибутиламин или простой этиленгликольдиметиловый эфир. Как правило, имеет преимущество применение основания, которое берется в эквимолярном или избыточном количестве. В качестве основания пригодны алкоголяты щелочных и щелочно-земельных металлов, такие как метанолят натрия, этанолят натрия, этанолят калия, трет.-бутанолят калия, в частности метилят натрия или же азотные основания, такие как триэтиламин, триизопропилэтиламин и Nметилпиперидин, в частности, пиридин и трибутиламин. Обычно компоненты применяют приблизительно в стехиометрическом соотношении. Однако может давать преимущество применение компонентов в избытке. Хлорирование соединения Vb в соединение VIb осуществляют при тех же условиях, что и хлорирование соединения V в соединение VI. Аминирование дихлорпиримидина VIb с получением соединения VII осуществляют при тех же условиях, что и аминирование соединения VI в соединение VIII. Соединения формулы I, где R2 означает алкокси, получают из соответствующих хлорных соединений формулы VI (R2 = Сl) взаимодействием с алкоголятами щелочных или щелочно-земельных металлов(1982); Geterotsikl. Soedin, стр. 400-402 (1991)]. Соединения формулы I, в которой R2 означает циано, получают из соответствующих хлорных соединений формулы VI (R2 = Cl) реакцией взаимодействия с цианидами щелочных, щелочно-земельных металлов или такими цианидами металлов, как NaCN, KCN или Zn(CN)2 [ср. публикации Heterocycles,Bd. 39, стр. 345-356 (1994); Collect. Czech. Chem. Commun. Bd. 60, стр. 1386-1389 (1995); Acta Chim.Scand, Bd. 50, стр. 58-63 (1996)]. Соединения формулы I, в которой R2 означает водород, получают из соответствующих хлорных соединений формулы VI (R2 = Cl) посредством каталитического гидрирования [сравните публикации: J.Fluorine Chem. Bd. 45, стр. 417-430 (1989); J. Heterocycl. Chem. Bd. 29, стр. 1369-1370 (1992)], или восстановлением цинка в уксусной кислоте [ср. публикации: Org. Prep. Proced. Int., Bd. 27, стр. 600-602 (1995); патент JP-A 09/165 379]. Соединения формулы I, в которой R2 означает C1-C6-алкил или C1-C6-галогеналкил, могут быть получены соответствующим превращением исходных материалов формулы II аналогично описанному синтезу с получением соединений формулы I, в которой R2 означает хлор. Вместо сложного фенилмалонового эфира формулы II сложный фенилкетоэфир формулы XIII, в которой R2 означает алкил, подвергают взаимодействию с тиомочевиной или амидином XII. Последующие реакции взаимодействия проводят аналогично соединениям с R2 = хлор. Реакционные смеси перерабатывают обычными методами, например смешением с водой, разделением фаз и, в случае необходимости, хроматографической очисткой сырых продуктов. Промежуточные и конечные продукты имеются в форме бесцветных или коричневатых, вязких масел, которые под сниженным давлением и по возможности при повышенной температуре освобождаются от летучих долей и очищаются. Если промежуточные и конечные продукты получают в виде твердого вещества, очистку можно производить перекристаллизацией или дигерированием. Если отдельные соединения формулы I не могут быть получены вышеописанным путем, их можно получить дериватизацией других соединений формулы I. Для приведенных в настоящих формулах символов применяются сборные понятия, которые действительны для нижеследующих заместителей: галоген означает фтор, хлор, бром и йод; алкил означает насыщенные, линейные или разветвленные углеводородные остатки с 1 до 4, 6 или 8 атомами углерода, например, C1-C6-алкил, такой как метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2 метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил,2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил; талогеналкил означает линейные или разветвленные алкильные группы с от 1 до 8 атомов углерода(приведенные выше), причем в этих группах атомы водорода могут быть частично или полностью заменены атомами галогена, например С 1-С 2-галогеналкил, такой как хлорметил, бромметил, дихлорметил,трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1-бромэтил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2 фторэтил, 2-хлор-2,2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил и 1,1,1 трифторпроп-2-ил; алкенил означает ненасыщенные, линейные или разветвленные углеводородные остатки с 2 до 4, 6 или 8 атомами углерода и двойной связью в любом положении, например, С 2-С 6-алкенил, такой как этилен, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2 метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2- пентенил, 3- пентенил, 4 пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-6 007719 бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2 пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1 гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3 метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4 метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1 метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил,1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-д и метил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1 бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил,1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3 бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1-этил-2 метил-2-пропенил; алкинил означает линейные или разветвленные углеводородные группы с 2 до 4, 6 или 8 атомами углерода и тройной связью в любом положении, например, С 2-С 6-алкинил, такой, какэтинил, 1-пропинил,2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил,4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 3-метил-1-бутинил, 1,1-диметил 2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4- гексинил, 5- гексинил, 1-метил-2 пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил, 2-метил-4-пентинил, 3-метил 1-пентинил, 3-метил-4-пентинил, 4-метил-1-пентинил, 4-метил-2-пентинил, 1,1-диметил-2-бутинил, 1,1 диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, З.3-диметил-1-бутинил, 1-этил-2 бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2-пропинил; циклоалкил означает моноцикличные, насыщенные углеводолродные группы с 3 до 6 углеродными членами кольца, такие как циклопропил, циклобутил, циклопентил и циклогексил; алкоксикарбонил означает алкоксигруппу с 1 до 6 атомов углерода (как приведено выше), которая через карбонильную группу (-СО-) связана со скелетом; оксиалкиленокси: двухвалентная, линейная цепь из 1 до 3 CH2-групп, причем обе валентности связаны через атом кислорода со скелетом, например ОСН 2O, ОСН 2 СН 2O и ОСН 2 СН 2 СН 2O; пяти до десятичленный, насыщенный или частично ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов из группы, включающей кислород, азот или серу моно- или бицикличные гетероциклы (гетероциклил), содержащие наряду с углеродными членами кольца от одного до трех атомов азота и/или атом кислорода или атом серы или один или два атома кислорода и/или серы, например: 2-тетрагидрофуранил, 3-тетрагидро-фуранил, 2-тетрагидротиенил, 3-тетрагидротиенил, 2-пирролидинил, 3-пирролидинил, 3-изоксазолидинил, 4-изоксазолидинил, 5-изоксазолидинил, 3-изотиазолидинил, 4-изотиазолидинил, 5-изотиазолидинил, 3-пиразолидинил, 4-пиразолидинил, 5-пиразолидинил,2-оксазолидинил, 4-оксазолидинил, 5-оксазолидинил, 2-тиазолидинил, 4-тиазолидинил, 5-тиазолидинил,2-имидазолидинил, 4-имидазолидинил, 1,2,4-оксадиазолидин-3-ил, 1,2,4-оксадиазолидин-5-ил, 1,2,4 тиадиазолидин-3-ил, 1,2,4-тиадиазолидин-5-ил, 1,2,4-триазолидин-3-ил, 1,3,4-оксадиазолидин-2-ил, 1,3,4 тиадиазолидин-2-ил,1,3,4-триазолидин-2-ил,2,3-дигидрофур-2-ил,2,3-дигидрофур-3-ил,2,4 дигидрофур-2-ил, 2,4-дигидрофур-3-ил, 2,3-дигидротиен-2-ил, 2,3-дигидротиен-3-ил, 2,4-дигидротиен-2 ил, 2,4-дигидротиен-3-ил, 2-пирролин-2-ил, 2-пирролин-3-ил, 3-пирролин-2-ил, 3-пирролин-3-ил, 2 изоксазолин-3-ил, 3-изоксазолин-3-ил, 4-изоксазолин-3-ил, 2-изоксазолин-4-ил, 3-изоксазолин-4-ил, 4 изоксазолин-4-ил, 2-изоксазолин-5-ил, 3-изоксазолин-5-ил, 4-изоксазолин-5-ил, 2-изотиазолин-3-ил, 3 изотиазолин-3-ил, 4-изотиазолин-3-ил, 2-изотиазолин-4-ил, 3-изотиазолин-4-ил, 4-изотиазолин-4-ил, 2 изотиазолин-5-ил, 3-изотиазолин-5-ил, 4-изотиазолин-6-ил, 2,3-дигидропиразол-1-ил, 2,3-дигидропиразол-2-ил, 2,3-дигидропиразол-3-ил, 2,3-дигидропиразол-4-ил, 2,3-дигидропиразол-5-ил, 3,4-дигидропиразол-1-ил, 3,4-дигидропиразол-3-ил, 3,4-дигидропиразол-4-ил, 3,4-дигидропиразол-5-ил, 4,5 дигидропиразол-1-ил, 4,5-дигидропиразол-3-ил, 4,5-дигидропиразол-4-ил, 4,5-дигидропиразол-5-ил, 2,3 дигидрооксазол-2-ил, 2,3-дигидрооксазол-3-ил, 2,3-дигидрооксазол-4-ил, 2,3-дигидрооксазол-5-ил, 3,4 дигидрооксазол-2-ил, 3,4-дигидрооксазол-3-ил, 3,4-дигидрооксазол-4-ил, 3,4-дигидрооксазол-5-ил, 3,4 дигидрооксазол-2-ил,3,4-дигидрооксазол-3-ил,3,4-дигидрооксазол-4-ил,2-пиперидинил,3 пиперидинил, 4-пиперидинил, 1,3-диоксан-5-ил, 2-тетрагидропиранил, 4-тетрагидропиранил, 2 тетрагидротиенил, 3-гексагидропиридазинил, 4-гексагидропирид-азинил, 2-гексагидропиримидинил, 4 гексагидропиримидинил, 5-гексагидро-пиримидинил, 2-пиперазинил, 1,3,5-гексагидротриазин-2-ил и 1,2,4-гексагидротриазин-3-ил; от пяти- до десятичленный ароматический гетероцикл, содержащий от одного до четырех гетероатомов из группы, включающей кислород, азот или серу; одно- или двуядерный гетероарил, например, -5-членный гетероарил, содержащий от одного до четырех атомов азота или от одного до трех атомов азота и один атом серы или кислорода: 5-членные гетероарильные группы, которые наряду с атомами углерода могут содержать от одно до четырех атомов азота или от одного до четырех атомов азота и один атом серы или кислорода в качестве членов кольца,например, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролли, 3-изоксазолил, 4-изоксазолил,5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-7 007719 оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-имидазолил, 4-имидазолил,1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,4-триазол-3 ил, 1,3,4-оксадиазол-2-ил, 1,3,4-тиадиазол-2-ил и 1,3,4-триазол-2-ил; бензоконденсированный 5-членный гетероарил содержащий от одного до трех атомов азота или один атом азота и один атом кислорода или серы 5-членные гетероарильные группы, которые наряду с атомами углерода могут содержать от одного до четырех атомов азота или от одного до трех атомов азота и один атом серы или кислорода в качестве членов кольца, и в которых два смежных углеродных члена кольца или один азотный и один смежный углеродный член кольца могут быть связаны посредством бута-1,3-диен-1,4-диилгруппу, в которой один или два атома углерода могут быть заменены атомами азота; связанный через азот 5-членный гетероарил, содержащий от одного до четырех атомов азота или связанный азотом бензоконденсированный 5-членный гетероарил содержащий от одного до трех атомов азота 5-членные гетероарильные группы, которые наряду с атомами углерода могут содержать от одного до четырех атомов азота, соответственно, от одного до трех атомов азота в качестве членов кольца, и в которых два смежных углеродных члена кольца или азотный и смежный углеродный член кольца могут быть связаны мостиком посредством бута-1,3-диен-1,4-дииловой группы, в которой один или два атома углерода могут быть заменены атомами азота, причем эти кольца связаны со скелетом через один из азотных членов кольца; 6-членный гетероарил, содержащий от одного до трех, соответственно, от одного до четырех атомов азота 6-членные гетероарильные группы, которые наряду с атомами углерода могут содержать от одного до трех, соответственно, от одного до четырех атомов азота в качестве членов кольца, например 3-пиридазинил, 4-пиридазинил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 2-пиразинил, 1,3,5 триазин-2-ил и 1,2,4-триазин-3-ил; Таблица 1. Соединения формулы I-1, в которых R5 означает фтор, R6 означает хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 2. Соединения формулы I-1, в которых R5 и R6 означают фтор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 3. Соединения формулы I-1, в которых R5 и R6 означают хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 4. Соединения формулы I-1, в которых R5 означает фтор и R6 - метил и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 5. Соединения формулы I-1, в которых R5, R6 и R9 означают фтор и R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 6. Соединения формулы I-1, в которых R5 и R6 означают фтор, R7 и R8 означают водород и 9R - метокси и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 7. Соединения формулы I-1, в которых R5, R6, R7, R8 и R9 означают фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 8. Соединения формулы I-1, в которых R5 означает метил, R6, R7 и R8 означают водород и 9R означает фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 9. Соединения формулы I-1, в которых R5 означает фтор, R6, R7 и R8 означают водород и R9f- метил и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 10. Соединения формулы I-1, в которых R5 и R9 означают метил и R6, R7 и R8 означают фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 11. Соединения формулы I-2, в которых R5 означает фтор, R6 означает хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 12. Соединения формулы I-2, в которых R5 и R6 означают фтор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 13. Соединения формулы I-2, в которых R5 и R6 означают хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А.-8 007719 Таблица 14. Соединения формулы I-2, в которых R5 означает фтор и R6 - метил и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 15. Соединения формулы I-2, в которых R5, R6 и R9 означают фтор и R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 16. Соединения формулы I-2, в которых R5 и R6 означают, R7 и R8 - водород и R9 - метокси и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 17. Соединения формулы I-2, в которых R5, R6, R7, R8 и R9 означают фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 18. Соединения формулы I-2, в которых R5 означает метил, R6, R7 и R8 означают водород и 9R - фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 19. Соединения формулы I-2, в которых R5 означает фтор, R6, R7 и R8 означают водород и 9R - метил и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 20. Соединения формулы I-2, в которых R5 и R9 означают метил и R6, R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 21. Соединения формулы 1-3, в которых R5 означает фтор, R6 означает хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 22. Соединения формулы 1-3, в которых R5 и R6 означают фтор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 23. Соединения формулы I-3, в которых R5 и R6 означают хлор и R7, R8 и R9 - водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 24. Соединения формулы I-3, в которых R5 означает фтор и R6 означает метил и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 25. Соединения формулы I-3, в которых R5, R6 и R9 означает фтор и R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 26. Соединения формулы I-3, в которых R5 и R6 означают фтор, R7 и R8 означает водород и 9R означает метокси и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 27. Соединения формулы I-3, в которых R5, R6, R7, R8 и R9 означают фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 28. Соединения формулы I-3, в которых R5 означает метил, R6, R7 и R8 означают водород и 9R означает фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 29. Соединения формулы I-3, в которых R5 означает фтор, R6, R7 и R8 означают водород и 9R означает метил и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 30. Соединения формулы I-3, в которых R5 и R9 означают метил и R6, R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 31. Соединения формулы I-4, в которых R5 означает фтор, R6 означает хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 32. Соединения формулы I-4, в которых R5 и R6 означают фтор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 33. Соединения формулы I-4, в которых R5 и R6 означаю хлор и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 34. Соединения формулы I-4, в которых R5 означает фтор и R6 означает метил и R7, R8 и R9 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 35. Соединения формулы I-4, в которых R5, R6 и R9 означают фтор и R7 и R8 означает водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 36. Соединения формулы I-4, в которых R5 и R6 означают фтор, R7 и R8 означают водород 9 и R - метокси и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 37. Соединения формулы I-4, в которых R5, R6, R7, R8 и R9 означают фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А.R означает фтор и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 39. Соединения формулы I-4, в которых R5 означает фтор, R6, R7 и R8 означают водород и 9R - метил и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. Таблица 40. Соединения формулы I-4, в которых R5 и R9 означают метил и R6, R7 и R8 означают водород и комбинация остатков R3 и R4 соответствует соединению одной строки таблицы А. 9- 13007719 Соединения I пригодны в качестве фунгицидов. Они отличаются прекрасной активностью против широкого спектра фитопатогенных грибов, в частности, из класса аскомецетов, дейтеромицетов, фикомицетов и базидиомицетов. Они являются частично систематически активными и могут применяться при защите растений в качестве почвенных и лиственных фунгицидов. Они имеют особое значение при борьбе с рядом фитопатогенных грибов на различных культурных растениях, таких как пшеница, рожь, ячмень, овес, рис, кукуруза, злаки, бананы, хлопчатник, соевые,кофе, сахарный тростник, виноград, плодовые и декоративные растения, и на овощных культурах, таких,как огурцы, бобовые, томаты, картофель и тыквенные, а также на семенах этих растений. Особенно они пригодны для борьбы против следующих болезней растений: виды Alternaria на овощных и плодовых растениях,Botrytis cinerea (серая гниль) на клубничных, овощных, декоративных культурах и на виноградных лозьяхCercospora arachidicola на земляных орехах,Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных,Erysiphe graminis (мучнистая роса) на зерновых культурах,виды Fusarium- и Verticillium на различных растениях,виды Helminthosporium на зерновых культурах,виды Mycosphaerella на бананах и земляных орехах,Phytophthora infestans на картофеле и томатах,Plasmopara viticola на виноградных лозах,Podosphaera leucotricha на яблоневых,Pseudocercosporella herpotrichoides на пшенице и ячмене,виды Pseudoperonospora на хмеле и огурцах,виды Puccinia на зерновых,Pyricularia oryzae на рисе,виды Rhizoctonia на хлопчатнике, рисе и дернине,Septoria nodorum на пшенице,Uncinula necator на виноградных лозьях,виды Ustilago на зерновых и сахарном тростнике, а также виды Venturia (парша) на яблоневых и грушевых. Кроме того, соединения 1 пригодны для борьбы с фитопатогенными грибами, такими как Paecilomyces variotii при защите материалов (например, древесины, бумаги, в дисперсия для покрытий, волокон,соответственно, тканей) и при защите складируемых запасов. Соединения 1 применяются таким образом, что грибы или подлежащие защиты от поражения ими растения, материалы или почву обрабатывают фунгицидно активным количеством действующего вещества. Применение может осуществляться как перед, так и после поражения грибами материалов, растений или семян. Фунгицидные средства содержат в общем между 0,1 и 95, предпочтительно между 0,5 и 90 мас.% действующего вещества. Нормы расхода составляют при применении для защиты растений в зависимости от желаемого эффекта между 0,01 и 2,0 кг действующего вещества на гектар. При обработке посевного зерна в общем требуется количества действующего вещества от 0,001 до 0,1 г, предпочтительно от 0,01 до 0,05 г на кг посевного материала. При применении для защиты материалов, соответственно, складируемых запасов норма расхода ориентируется на область применения и на желаемый эффект. Обычные нормы расхода при защите материалов составляют, например, от 0,001 г до 2 кг, предпочтительно от 0,005 г до 1 кг действующего вещества на кубометр обрабатываемого материала. Соединения I могут быть переведены в обычные препаративные формы, например, растворы,эмульсии, суспензии, тонкие порошки, порошки, пасты и гранулят. Препаративная форма зависит от цели применения, она должна в любом случае обеспечивать тонкое и равномерное распределение соединения по изобретению. Препаративные формы получают известным образом, например путем разбавления действующего вещества в растворителях и/или наполнителях, по желанию с применением эмульгаторов или диспергаторов, причем при применении в качестве разбавителя воды также и другие органические растворители могут применяться в качестве вспомогательных агентов. В качестве впомогательных агентов пригодны, в основном, растворители, такие как ароматы (например, ксилол), хлорированные ароматы (например,хлорбензолы), парафины (например, фракции нефти), спирты (например, метанол, бутанол), кетоны (например, циклогексанон), амины (например, этаноламин, диметилформамид) и вода; наполнители, такие как естественные измельченные породы (например, каолин, глинозем, тальк, мел) и искусственные измельченные породы (например, высокодисперсная кремниевая кислота, соли кремниевой кислоты); эмульгаторы, такие как неионогенные и анионные эмульгаторы (например, полиоксиэтиленовый эфир- 14007719 спирта жирного ряда, алкилсульфонаты и арилсульфонаты) и диспергаторы, такие как лигнинсульфитная отработанная щелочь и метилцеллюлоза. В качестве поверхностно-активных веществ применяются соли щелочных, щелочно-земельных металлов и аммониевые соли лигнинсульфокислоты, нафталинсульфокислоты, фенолсульфокислоты, дибутилнафталинсульфокислоты, алкиларилсульфонаты, алкилсульфаты, алкилсульфонаты, сульфаты спиртов жирного ряда, кислоты жирного ряда, а также их соли щелочных и щелочно-земельных металлов,соли сульфатированного гликолевого эфира жирного ряда, продукты конденсации сульфонированного нафталина и производных нафталина с формальдегидом, продукты конденсации нафталина, соответственно, нафталинсульфокислот с фенолом и формальдегидом, полиоксиэтиленоктилфенольный эфир,этоксилированный изооктилфенол, октилфенол, нонилфенол, алкилфенолполигликолевый эфир, трибутилфенил-полигликолевый эфир, алкиларилполиэфирные спирты, изотридециловый спирт, продукты конденсации этиленоксида жирных спиртов, этоксилированное касторовое масло, полиоксиэтиленалкиловый эфир, этоксилированный полиоксипропилен, ацеталь поликликолевого эфира лаурилового спирта жирного ряда, сложный эфир сорбита, лигнинисульфитные отработанные щелочи и метилцеллюлоза. Для получения предназначенный для непосредственного разбрызгивания растворов, эмульсий,паст, или масляных дисперсий применяются фракции минеральных масел со средней и высокой точками кипения, такие как керосин или дизельное топливо (масло), дегтярные масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например бензол,толуол, ксилол, парафин, тетрагидронафталин, алкилированные нафталины или их производные, метанол, этанол, пропанол, бутанол, хлороформ, тетрахлоруглерод, циклогексанол, циклогексанон, хлорбензол, изоформ, сильно полярные растворители, например, диметилформамид, диэтилсульфоксид, Nметилпирролидон, вода. Порошковые препараты, препараты для опыливания и опудривания могут быть изготовлены путем смешения или совместного перемешивания действующих веществ с твердым наполнителем. Гранулят, например оболочковый, импрегнированный или гомогенный гранулят, может быть получен путем связывания действующего вещества с твердыми наполнителями. Твердыми наполнителями могут быть, например, минеральные земли, такие как силикагель, кремниевые кислоты, силикаты, тальк,каолин, аттаклау, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния, окись магния, измельченная пластмасса, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевины и растительные продукты, такие как зерновая мука, мука древесной коры, древесная мука и мука ореховой скорлупы, порошок целлюлозы и другие твердые наполнители. Препаративные формы содержат в общем между 0,01 и 95 мас.%, предпочтительно между 0,1 и 90 мас.% действующего вещества. Действующие вещества имеют при этом чистоту от 90 до 100%, предпочтительно от 95 до 100% (по спектру ЯМР). Примеры препаративных форм:I. 5 вес. долей соединения согласно изобретению тщательно перемешивают с 95 вес. долями тонкого коалина. Таким образом получают средство опыливания, содержащее 5 мас.% действующего вещества.II. 30 вес. долей соединения согласно изобретению тщательно перемешивают с 92 вес. долями порошкового силикагеля и 8 вес. долями парафинового масла, которое напрыскивают на поверхность этого силикагеля. Таким образом получают препаративную форму действующего вещества с хорошей адгезионной способностью (содержание действующего вещества 23 мас.%).III. 10 вес. долей соединения согласно изобретению растворяют в смеси, которая состоит из 90 вес. долей ксилола, 6 вес. долей продукта присоединения 8 до 10 молей этиленоксида к 1 молю Nмоноэтаноламида олеиновой кислоты, 2 вес. доли кальциевой соли додецилбензолсульфокислоты и 2 вес. доли продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 9 мас.%).IV. 20 вес. долей соединения согласно изобретению растворяют в смеси, которая состоит из 60 вес. долей циклогексанона, 30 вес. долей изобутанола, 5 вес. долей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 5 вес. долей продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 16 мас.%).V. 80 вес. долей соединения согласно изобретению хорошо перемешивают с 3 вес. долями натриевой соли диизобутилнафталин-альфа-сульфокислоты, 10 вес. долями натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 7 вес. долями порошкового силикагеля и перемалывают в молотковой мельнице (содержание действующего вещества 80 мас.%).VI. Перемешивают 90 вес. долей соединения согласно изобретению с 10 вес. долями N-метил-пирролидона и получают раствор, который пригоден для применения в форме мельчайших капель (содержание действующего вещества 90 мас.%).VII. 20 вес. долей соединения согласно изобретению растворяют в смеси, состоящей из 40 вес. долей циклогексанона, 30 вес. долей изобутанола, 20 вес. долей продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 вес. долей продукта присоединения 40 молей этиленоксида к 1- 15007719 молю касторового масла. Путем концентрации и тонкого распределения раствора в 100 000 вес. долей воды получают водную дисперсию, содержащую 0,02 вес.% действующего вещества.VIII. 20 вес. долей соединения согласно изобретению хорошо перемешивают с 3 вес. долями натриевой соли диизобутилнафталинсульфокислоты, 17 вес. долями натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 60 вес. долями порошкового силикагеля и перемалывают в молотковой мельнице. Путем тонкого распределения смеси в 20000 вес. долях воды получают раствор для опрыскивания, который содержит 0,1 мас.% действующего вещества. Действующие вещества могут применяться как таковые, в их препаративной форме или же в приготовленной из них форме применения, например, в форме подлежащих непосредственному распылению растворов, порошков, суспензий или дисперсий, эмульсий, масляных дисперсий, паст, препаратов для опыливания, препаратов для опудривания, гранулятов путем опрыскивания, мелкокапельного опрыскивания, опыливания, опудривания или полива. Используемые формы зависят от цели применения, но во всех случаях должно быть обеспечено максимально тонкое распределение действующих веществ по изобретению. Водные препаративные формы могут быть приготовлены из концентратов эмульсий, паст или смачиваемых порошков (порошки для разбрызгивания, масляные дисперсии) путем добавки воды. Для изготовления эмульсий, паст или масляных дисперсий вещества как таковые, или же растворенные в масле,могут гомогенизироваться в воде с помощью смачивающих агентов, активаторов адгезии, диспергаторов или эмульгаторов. Могут также готовиться состоящие из действующего вещества, смачивающего агента,активатора адгезии, диспергатора или эмульгатора и, возможно, из растворителя и масла концентраты,которые можно разбавлять водой. Концентрация действующего вещества в готовых к применению препаратах может варьироваться в широких пределах. В общем она составляет от 0,0001 до 10%, предпочтительно от 0,01 до 1%. Действующие вещества могут применяться с успехом при особенно низких нормах расхода, причем имеется возможность использовать препараты с более чем 95 мас.% действующего вещества или даже применять действующее вещество без добавок. К действующим веществам могут добавляться масла различного типа, гербициды, фунгициды, другие средства борьбы с вредителями, бактерициды, в случае необходимости, также и непосредственно перед применением (смеси в баке). Эти средства могут примешиваться к соединениям по изобретению в весовом соотношении 1:10 до 10:1. Соединения по изобретению в форме применения как фунгициды могут применяться вместе с другими действующими веществами, например, гербицидами, инзектицидами, регуляторами роста, фунгицидами или же удобрениями. При смешении соединений I, соответственно, содержащих их фунгицидных средств с другими фунгицидами во многих случаях обеспечивается увеличение спектра фунгицидного действия. Нижеприведенный перечень фунгицидов, которые можно применять вместе с соединениями по изобретению, поясняет возможности их комбинирования, однако не ограничивает их. К таким фунгицидам относятся следующие: сера, дитиокарбонаты и их производные,такие как ферридиметилдитиокарбамат, цинкдиметилдитиокарбамат, цинкдиметилдитиокабамат, марганецэтиленбисдитиокарбамат, марганеццинкэтилендиаминбисдитиокарбамат, тетра-метилтиурамдисульфиды, аммиачный комплекс цинк(N,N-этиленбисдитиокарбамата), аммиачный комплекс цинк-(N,N'-пропиленбисдитиокарбамата), полимер цинк-(N,N'пропиленбисдитиокарбамата), N,N'-пропиленбис(тиокарбомоил)дисульфид; нитропроизводные, такие как динитро-(1-метилгептил)фенилкротонат, 2-втор.-бутил-4,6-динитрофенил-3,3-диметилакрилат, 2-втор.-бутил-4,6-динитрофенилизопропилкарбонат, диизопропиловый эфир 5-нитроизофталевой кислоты; гетероциклические соединения, такие как 2-гептадецил-2-имидазолинацетат, 2,4-дихлор-6-(о-хлоранилино)-s-триазин, O,O-диэтилфталимидофосфонотиоат, 5-амино-1-[бис-(диметиламино)фосфинил]-3 фенил-1,2,4-триазол, 2,3-дициано-1,4-дитиоантрахинон, 2-тио-1,3-дитиоло[4,5-b]хиноксалин, метиловый эфир 1-(бутилкарбамоил)-2-бензимидазолкарбаминовой кислоты,2-метоксикарбониламинобензимидазол, 2-(фурил-(2-бензимидазол, 2-(тиазолил-(4-бензимидазол, N-(1,1,2,2-тетрахлорэтилтио) тетрагидрофталимид, N-трихлорметилтиотетрагидрофталимид, N-трихлорметилтиофталимид, диамид Nдихлорфторметилтио-N',N'-диметил-N-фенилсерной кислоты, 5-этокси-3-трихлорметил-1,2,3-тиадиазол,2-роданметилтиобензтиазол, 1,4-дихлор-2,5-диметоксибензол, 4-(2-хлорфенилгидразоно)-3-метил-5 изоксазолон, пиридин-2-тио-1-оксид, 8-гидроксихинолин, соответственно его медная соль, 2,3-дигидро 5-карбоксанилидо-6-метил-1,4-оксатиин, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин-4,4-диоксид, анилид 2-метил-5,6-дигидро-4 Н-пиран-3-карбоновой кислоты, анилид 2-метилфуран-3-карбоновой кислоты, анилид 2,5-диметилфуран-3-карбоновой кислоты, анилид 2,4,5-триметилфуран-3-карбоновой кислоты, циклогексиламид 2,5-диметилфуран-3-карбоновой кислоты, амид N-циклогексил-N-метокси 2,5-диметилфуран-3-карбоновой кислоты, 2-анилид метилбензойной кислоты, анилид 2-йод-бензойной кислоты, N-формил-N-морфолин-2,2,2-трихлорэтилацеталь, пиперазин-1,4-диилбис-1-(2,2,2-трихлорэтил)формамид,1-(3,4-дихлоранилино)-1-формиламино-2,2,2-трихлорэтан,2,6-диметил-N- 16007719 тридецилморфолин, соответственно его соли, 2,6-диметил-N-циклододецилморфолин, соответственно,его соли, N-[3-(п-трет.-бутилфенил)-2-метилпропил]-цис-2,б-диметилморфолин, N-[3-(п-трет.-бутилфенил)-2-метилпропил]пиперидин, 1-[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, 1-[2-(2,4-дихлорфенил)-4-н-пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, N-(н-пропил)-N(2,4,6-трихлорфеноксиэтил)-N'-имидазолилмочевина, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанон, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанол, (2RS,3RS)-1[3-(2-хлорфенил)-2-(4-фторфенил)оксиран-2-илметил]-1 Н-1,2,4-триазол, -(2-хлорфенил)(4-хлорфенил)-5-пиримидинметанол, 5-бутил-2-диметиламино-4-гидрокси-6-метилпиримидин, бис-(п-хлорфенил)3-пиридинметанол,1,2-бис-(3-этоксикарбонил-2-тиоуреидо)бензол,1,2-бис-(3-метоксикарбонил-2 тиоуреидо)бензол, стробилурины, такие как метил-Е-метоксиимино-[-(о-толилокси)-о-толил]ацетат,метил-Е-2-2-[6-(2-цианофенокси)пиримидин-4-илокси]фенил-3-метоксиакрилат,метил-Е-метоксиимино-[-(2-феноксифенил)]ацетамид, метил-Е-метоксиимино-[-(2,5-диметилфенокси)-о-толил]ацетамид, анилинопиримидины, такие как N-(4,6-диметилпиримидин-2-ил)анилин, N-[4-метил-6-(1-пропинил) пиримидин-2-ил]анилин, N-[4-метил-6-циклопропил-пиримидин-2-ил]анилин, фенилпирролы, такие как 4-(2,2-дифтор-1,3-бензодиоксол-4-ил)пиррод-3-карбонитрил, амиды коричной кислоты, такие как морфолид 3-(4-хлорфенил)-3-(3,4-диметоксифенил)акриловой кислоты,а также различные фунгициды, такие как додецилнуанидинацетат, 3-[3-(3,5-диметил 1-2-оксициклогексил)-2-гидроксиэтил]глютаримид, гексахлорбензол, DL-метил-N-(2,6-диметилфенил)-N-фуроил(2) аланинат, метиловый эфир DL-N-(2,6-диметилфенил)-N-(2'-метоксиацетил)аланина, N-(2,6-диметилфенил)-N-хлорацетил-D,L-2-аминобутиролактон, метиловый эфир DL-N-(2,6-диметилфенил)-N(фенилацетил)аланина, 5-метил-5-винил-3-(3,5-диихлорфенил)-2,4-диоксо-1,3-оксазолидин, 3-[3,5-дихлорфенил(-5-метил-5-метоксиметил]-1,3-оксазолидин-2,4-дион,3-(3,5-дихлорфенил)-1-изопропилкарбамоилгидантоин, имид N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоновой кислоты, 2 циано-[N-(этиламинокарбонил)-2-метоксиимино]ацетамид, 1-[2-(2,4-дихлорфенил)пентил]-1 Н-1,2,4-триазол, 2,4-дифтор(1 Н-1,2,4-триазолил-1-метил)бензгидриловый спирт, N-(3-xnop-2,6-динитро-4 трифторметилфенил)-5-трифторметил-3-хлор-2-аминопиридин,1-бис-(4-фторфенил)метилсилил)метил)-1 Н-1,2,4-триазол. Примеры синтеза Приведенные в нижестоящих примерах стадии синтеза применяют при соответствующих изменениях исходных соединений для получения других соединений формулы I. Полученные таким образом соединения со своими физическими данными представлены в нижеследующих таблицах. Пример 1. 6-Хлор-5-(2-хлор-6-фторфенил)-4-изопропиламино-2-(1-пиразолил)пиримидин [I-1]. а) 5-(2-Хлор-6-фторфенил)-2-метилтио-4,6(1 Н,5 Н)-пиримидиндион. 60,0 г (208 ммоль) сложного этилового эфира 2-(2-хлор-6-фторфенил)малоновой кислоты и 19,0 г(249 ммоль) тиомочевины нагревают в 77 г (416 ммоль) н-трибутиламина в течение 2,5 ч до 150 С. Полученный этанол отгоняют. К охлажденному реакционному раствору подают 180 мл водного раствора 24,9 г (623 ммоль) NaOH. После смешения с 50 мл циклогексана и перемешивания приблизительно в течение 30 мин отделяют водную фазу, смешивают с 35,4 г (142 ммоль) метилйодида и перемешивают в течение 16 ч при температуре от 20 до 25 С. После подкисления разбавленным раствором HCl и перемешивания в течение 30 мин отфильтровывают осадок. После промывки и сушки получают 16,7 г приведенного в заголовке соединения в виде белых кристаллов с Тпл. 250 С (разл.). б) 4,6-Дихлор-5-(2-хлор-6-фторфенил)-2-метилтиопиримидин. Раствор из 48,8 г (170 ммоль) продукта стадии а) в 200 мл фосфороксихлорида нагревают с обратным холодильником после добавки 3 мл диметилформамида в течение 40 ч. После отгонки основного количества фосфороксихлорида и разбавления остатка сложным этиловым эфиром уксусной кислоты при перемешивании добавляют при температуре от 15 до 20 С воду. После разделения фаз органическую фазу промывают водой и разбавленным раствором NаНСО 3, потом сушат и отделяют растворитель. Получают 37,5 г приведенного в заголовке соединения в виде масла, которое без дальнейшей очистки применяют на стадии в). ИК (пленка):[см-1] = 1558, 1477, 1449, 1353, 1252, 900, 816, 783. в) 6-Хлор-5-(2-хлор-6-фторфенил)-4-изопропиламино-2-метилтиопиримидин. Раствор из 37,5 г (324 ммоль) продукта стадии 6 в 150 мл безводного дихлорметана смешивают с 24 г (406 ммоль) изопропиламина и перемешивают в течение 5 ч при приблизительно 20 до 25 С . Потом отгоняют растворитель. Остаток загружают в сложный этиловый эфир уксусной кислоты и промывают разбавленной HCl, водой и разбавленным раствором NаНСО 3, потом сушат и удаляют растворитель. Из остатка после хроматографии на силикагеле (циклогексан/метил-трет.бутиловый эфире от 100:1 до 19:1) получают 3,4 г приведенного в заголовке соединения в виде бесцветных кристаллов с Тпл. 94-98 С, которые без дальнейшей очистки применяют на следующей стадии. г) 6-Хлор-5-(2-хлор-6-фторфенил)-4-изопропиламино-2-метилсульфонилпиримидин. Раствор из 13,3 г (38,4 ммоль) продукта стадии в) в 240 мл безводного дихлорметана смешивают при 0 до 5 С с 17,2 г (76,8 ммоль) 3-хлорпербензойной кислоты. В течение 1 ч перемешивают при 0 до- 17007719 5 С и 14 ч при приблизительно от 20 до 25 С. После отгонки растворителя остаток загружают в этилацетат, потом промывают 10%-ым раствором NаНСО 3. После отделения фаз органическую фазу сушат и из нее удаляют растворитель. Остаток дигерируют смесью диизопропилового эфира и гексана. Получают 11,3 г приведенного в заголовке соединения в виде бесцветных кристаллов с Тпл. 145-149 С. д) 6-Хлор-5-(2-хлор-6-фторфенил)-4-изопропиламино-2-(1-пиразолил)пиримидин. Раствор из 180 мг (2,64 ммоль) пиразола в 4 мл безводного диметилформамида при охлаждении льдом смешивают с 106 мг (2,64 ммоль) NaH (с 60 %-ой суспензией в минеральном масле). После перемешивания в течение 1 ч к реакционной смеси добавляют 500 мг (1,32 ммоль) продукта стадии г) и смесь перемешивают в течение 14 ч при температуре от 20 до 25 С. Добавкой воды продукт осаждают. После фильтрации, промывки водой и сушки получают 450 мг приведенного в заголовке соединения в виде бесцветных кристаллов с Тпл. 185-187 С. Пример 2. (S)-6-Хлор-4-(2,2,2-трифтор-1-метилэтил)амино-5-(2,4,6-трифторфенил)-2-(1-пиразолил)пиримидин [I-2]. а) 5-(2,4,6-Трифторфенил)-2-метилтио-4,6(1 Н,5 Н)пиримидиндион. Аналогично примеру 1 (стадия а) из 200,0 г сложного диэтилового эфира 2-(2,4,6-трифторфенил)малоновой кислоты, 62,9 г тиомочевины и 117,4 г метилйодида получают 115 г белых кристаллов с Тпл. 275 С (разл.). б) 4,6-Дихлор-5-(2,4,6- трифторфенил)-2-метилтиопиримидин. Согласно примеру 1 (стадия б) из 64,8 г продукта стадии а) после хроматографии на силикагеле с циклогексаном получают 43 г белых кристаллов с Тпл. 75 С. в) (5)-6-Хлор-5-(2,4,6-трифторфенил)-4-(2,2,2-трифтор-2-метилэтиламино)-2-метилтиопиримидин. Раствор из 90,0 г (277 ммоль) продукта стадии б) и 120,0 г (113 ммоль) 2,2,2-трифтор-1-метилэтиламина перемешивают в течение пяти дней при 150 С. После разбавления метил-трет, бутиловым эфиром и промывки посредством 5M-соляной кислоты разделяют фазы. Органическую фазу после сушки освобождают от растврителя. После хроматографии на силикагеле (циклогексан, потом циклогексан/метил-трет.бутиловый эфир в соотношении 85:15) получают 90 г приведенного в заголовке соединения в виде бесцветных кристаллов с Тпл. 94-96 С. г) (S)-6-Хлор-5-(2,4,6-трифторфенил)-4-(2,2,2-трифтор-1-метилэтиламино)-2-метилсульфонилпиримидин. Аналогично примеру 1 (стадия г) из 90,0 г (424 ммоль) продукта стадии в) получают 89 г (92 % от теории) белых кристаллов с Тпл. 159 С. д) (S)-6-Хлор-4-(2,2,2-трифтор-1-метилэтил)амино-5-(2,4,6-трифторфенил)-2-(1-пиразолли)пиримидин. Аналогично примеру 1 (стадия д) из 17,0 г (39,2 ммоль) продукта стадии г) и 4,00 г (58,8 ммоль) пиразола получают 14,9 г (90 % от теории) приведенного в заголовке соединения в форме бесцветных кристаллов с Тпл. 209 С (по анализу ВСЖХ 97%-го). Пример 3. (S)-6-Хлор-4-(2,2,2-трифтор-1-метилэтил)амино-5-(2,4,6-трифторфенил)-2-(1-имидазолил)пиримидин [I-3]. Аналогично примеру 1 (стадия д) из 89,8 мг имидазола и 249,5 мг сульфона из примера 1, стадия г) получают 0,22 г (91% от теории) указанного в заголовке соединения в виде бесцветных кристаллов с Тпл. 172-173 С. Пример 4. (S)-6-Хлор-4-(2,2,2-трифтор-1-метилэтил)амино-5-(2,4,6-трифтор-фенил)-2-(1,2,4-триазол-1-ил)-пиримидин [I-4]. Аналогично примеру 1 (стадии д) из 91,1 мг 1,2,4-триазола и 24,95 г сульфона из примера 1, стадии г) получают 0,22 г (91% от теории) указанного в заголовке соединения в форме бесцветных кристаллов с Тпл. 176-177 С. Пример 5. 6-Хлор-5-(2,4,6-трифторфенил)-4-[(S)-1,2-диметилпропил]амино-2-(пиридазин-3-ил) пиримидин [1-5]. а) Пиридазин-3-карбоксамидин. Раствор из 1,60 г (0,068 моль) натрия в 300 мл безводного метанола смешивают с раствором из 53,5 г (0,510 моль) пиридазин-3-карбонитрила в 100 мл метанола и перемешивают в течение 8 ч при 35 С,затем к реакционной смеси добавляют 29 г хлорида аммония и нагревают с обратным холодильником приблизительно в течение 14 ч. Смесь отфильтровывают в горячем состоянии, и твердое вещество удаляют из охлажденного маточного раствора фильтрацией. Получают 53,3 г указанного в заголовке соединения. 1H-ЯМР:(имл.дол., ДМСО-d6) = 9,75 (bs); 9,6 (d); 8,6 (d); 8,1 (m). б) 4,6-Дигидрокси-5-(2,4,6-трифторфенил)-2-(3-пиридазинил)пиримидин. Смесь из 18,1 г (0,063 моля) сложного диэтилового эфира 2-(2,4,6-трифторфенил)малоновой кислоты, 12 г (0,063 моля) трибутиламина и 10,0 г (0,063 моля) амидина из примера 5 а нагревают приблизительно в течение 6 ч до 180 С, при этом отгоняют этанол. После охлаждения до 60-70 С реакционную смесь смешивают с 6,3 г (0,158 моля) гидроксида натрия, растворенного в 70 мл воды, и перемешивают еще в течение 30 мин. После охлаждения до 20-25 С реакционную смесь экстрагируют метилтрет.- 18007719 бутиловым эфиром и подкислением осаждают из водной фазы. Фильтрацией получают 6,0 г указанного в заголовке соединения. 1H-ЯМР:(мил.дол., ДМСО-d6) = 9,5 (d); 8,2 (d); 8,0 (dd); 7,2 (m). в) 4,6-Дихлор-5-(2,4,6-трифторфенил)-2-(3-пиридазинил)пиримидин. Суспензию из 5,7 г (0,018 моля) дигидроксипиримидина из примера 5 б в 37 г (0,23 моля) фосфороксихлорида нагревают в течение 8 ч до 120 С, потом концентрируют в вакууме. Остаток загружают в дихлорметан и воду, органическую фазу сушат и от нее удаляют растворитель. После хроматографии на силикагеле (циклогексан/этилацетат) получают 2,0 г указанного в заголовке соединения. 1H-ЯМР:(мил.дол., CDCl3) = 9,2 (d); 8,7 (d); 7,8 (dd); 6,9 (t). г) 6-Хлор-5-(2,4,6-трифторфенил)-4-[(S)-1,2-диметилпропил]амино-2-(пиридазин-3-ил)пиримидин. Раствор из 200 мг (0,568 ммоль) дихлорида из примера 5 в в 5 мл диметил-формамида после смешения в 100 мг (1,2 ммоля) (S)-3-метил-2-бутиламина перемешивают в течение 72 ч при 50 С, потом охлаждают до 20-25 С. Добавкой воды осаждают продукт реакции. Фильтрацией получают 200 мг (100% от теории) указанного в заголовке соединения. 1 Определение липофильных параметров logk'/logPow (таблица 1) осуществляют согласно правиламOECD (Межд. Соглашения по экономическому развитию) по методу обратнофазной ВСЖХ. Для этого составляют корреляционную кривую logk'/logPow, основанную на десяти опорных веществах и оценивают ее с помощью определенных методом экстракции липофильных параметров восьми сравнительных веществ. В качестве стационарной фазы применяют имеющуюся в продаже обратную фазу C18. Хроматофафическое отделение производят метанолом и буферным растворов в качестве подвижной фазы при значении рН 7,4 при условиях константного состава элюента. Время удержания опорных значений tR переводят согласно уравнению Ф в факторы емкости k',причем t0 в качестве времени удержания незамедленного на обратной фазе C18 растворителя представляет собой мертвое время хроматографической системы Линейная корреляция значения logk'- с опубликованными в приложении к правилам Европейского союза 92/69 значениям logPow опорных величин дает корреляционную кривую линейной регрессией. Липофильные параметры logPow аналитов интерполируют после расчета логарифмического фактора емкости logk' из корреляционной кривой опорных величин.- 23007719 Оценка описанных методов анализа и примененных опорных величин происходит с помощью восьми сравнительных веществ, распределение которых определяют с помощью экстракционного метода. Примеры действия против фитопатогенных грибов. Фунгицидное действие соединений общей формулы I можно показать с помощью следующих тестов. Действующие вещества подготавливались отдельно или совместно в виде 10%-ой эмульсии в смеси из 70 мас.% циклогексанона, 20 мас.% Nekanil LN (Lutensol AP6, смачивающий агент с эмульгирующим и диспергирующим действием на базе этоксилированных алкилфенолей) и 10 мас.% Wettol ЕМ(неионогенного эмульгатора на базе этоксилированного кастрового масла) и разбавляли водой в соответствии с желаемой концентрацией. Пример применения 1. Эффективность против Alternaria solani на томатах. Листья горшковых растений сорта "Крупные мясистые томаты St. Pierre" опрыскивают до образования капель водной суспензией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 27% эмульгатора. На следующий день листья инфицируют водной суспензией зооспор Alternaria solani в 2%-ом растворе биосолода 0,17 х 106 спор/мл. После этого растения помещают в паронасыщенную камеру с температурой между 20 и 22 С. Через 5 дней фитофтороз на необработанных инфицированных контрольных растениях развился настолько сильно, что поражение можно было определять визуально в процентах. В этом тесте обработанные 63 ч./млн действующего вещества I-1, I-4, I-12 до I-14, I-19 до I-23, I-29,I-31, I-32, I-35 до I-37, I-40, I-41, I-46, I-47, I-51, I-52, I-54 и I-60 растения вообще не имели поражения или имели поражение до 7 %, в то время как необработанные растения имели поражение в 100%. Пример 2. Действие против Puccinia recondita на пшенице (ржавчина пшеницы). Листья выращенных в горшках ростков пшеницы сорта Kanzler" опыливали спорами ржавчины(Puccinia recondita). После этого горшки помещали на 24 ч в камеру с высокой влажностью воздуха (90 до 95%) и с температурой от 20 до 22 С. В течение этого времени споры прорастали и ростковые трубочки проникали в ткань листьев. На следующий день инфицированные растения обильно до образования капель опрыскивали водной композицией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 27% эмульгатора. После подсыхания напрысканного слоя опытные растения культивировали в течение 7 дней в теплице с температурой между 20 и 22 С и с влажностью воздуха от 65 до 70%. После этого определяли степень развития грибов на листьях. Обработанные в этом опыте посредством 63 ч./млн действующего вещества I-1 и I-2 растения были поражены максимально на 7%, в то время как необработанные растения имели поражение в 90%. Пример применения 3. Эффективность против сетчатой пятнистости ячменя. Листья выращенных в горшках проростков ячменя сорта "Igri" обильно до образования капель опрыскивают водной композицией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 27% эмульгатора и 24 ч после подсыхания напрысканного слоя инокулируют водной суспензией Pyrenophora teres, возбудителя сетчатой пятнистости ячменя. Затем опытные растения помещают в теплицу с температурой между 20 и 24 С и относительной влажностью воздуха 95 до 100%. Через 6 дней определяют визуально в процентах степень развития болезни общей поверхности листьев. В этом тесте обработанные посредством 63 ч./млн действующего вещества I-1, I-4, I-12 до I-14, I-19 до I-23, I-29, I-32, I-35 до I-37, I-40, I-41, I-47, I-51, I-52, I-54 и I-60 растения не имели поражения или имели поражение до 10% , в то время как необработанные растения имели поражение 90%. Пример применения 4. Эффективность против Botrytis cinerea на листьях перца. Проростки перца сорта "Neusiedler Ideal Elite" после того, как они хорошо развили от 4 до 5 листьев,опрыскивают обильно до образования капель водной композицией действующего вещества, приготовленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 5% эмульгатора. На следующий день обработанные растения инокулируют суспензией спор Botrytis cinerea,содержащей 1,7 х 106 спор/мл 2%-го водного раствора биосолода. После этого опытные растения помещают в камеру с температурой от 22 до 24 С и высокой влажностью воздуха. Через 5 дней определяют степень поражения листьев визуально в %. В этом тесте обработанные 250 ч./млн действующего вещества I-1, I-3, I-4, 1-7 до 1-9, I-11 до I-14, I18 до I-23, I-29 до I-32, I-35 до I-37, I-40, I-47, I-51, I-52, I-54, I-60, I-77, I-78 и I-80 растения не имели поражения или имели поражение только до 7%, в то время как необработанные растения были поражены на 90%. Пример применения 5. Протективное действие против вызванной Sphaerotheca fuliginea мучнистой росы огурцов. Листья выращенных в горшках проростков огурцов сорта "Chinesische Schlange" в стадии семядолей опрыскивают обильно до образования капель водной композицией действующего вещества, приго- 24007719 товленной из исходного раствора, содержащего 10% действующего вещества, 63% циклогексанона и 5% эмульгатора. Через 20 ч после подсыхания напрысканного слоя растения инокулируют водной суспензией спор мучнистой росы огурцов (Sphaerotheca fuliginea). Затем растения культивируют в теплице с температурой между 20 и 24 С и относительной влажностью от 60 до 80% в течение 7 дней. Определяют визуально в % степень поражения поверхности листьев проростков. В этом тесте обработанные посредством 63 ч./млн действующего вещества I-1, I-4, I-12 до I-14, I-19 до I-23, I-29, I-31, I-32, I-35, I-36, I-41, I-47, I-52, I-54 и I-60 растения не имели поражения, в то время как необработанные растения были поражены на 100 %. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 5-Фенилпиримидины формулы I где заместители имеют следующие значения:R1 означает пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4 триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, причем R1 может быть замещен одной до трех одинаковыми или различными группами Rа,Rа означает галоген, гидрокси, циано, оксо, нитро, амино, меркапто, C1-С 6-алкил, C1-C6 галогеналкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 6-циклоалкил, C1-C6-алкокси, C1-C6-галогеналкокси,карбоксил, С 1-С 7-алкоксикарбонил, карбамоил, С 1-С 7-алкиламинокарбонил, С 1-С 6-алкил-С 1-С 6 алкиламинкарбонил, морфолинокарбонил, пирролидинокарбонил, С 1-С 7-алкилкарбониламино, C1-С 6 алкиламино, ди-(С 1-С 6-алкил)амино, C1-С 6-алкилтио, C1-C6-алкилсульфинил, C1-С 6-алкилсульфонил,гидроксисульфонил, аминосульфонил, С 1-С 6-алкиламиносульфонил, ди-(С 1-С 6-алкил)аминосульфонил;R3, R4 означают независимо друг от друга водород, C1-C6-алкил, C1-C6-галогеналкил, С 3-С 6 циклоалкил, С 3-С 6-галогенциклоалкил, С 2-С 6-алкенил, С 2-С 6-галогеналкенил, С 3-С 6-циклоалкенил, С 2-С 6 алкинил, С 2-С 6-галогеналкинил или С 3-С 6-циклоалкинил;R3 и R4 совместно с атомом азота, с которым они связаны, могут образовывать пяти- или шестичленный цикл, который может быть прерван гетероатомом из группы, включающей О, N или S и/или может иметь один или несколько заместителей из группы, включающей галоген, C1-C6-алкил, C1-C6 галогеналкил и окси-С 1-С 3-алкиленокси или в котором два смежных С-атома или один N-атом и один смежный С-атом могут быть связаны С 1-С 4-алкиленовой цепью;R5, R6 независимо друг от друга означают водород, галоген, C1-C6-алкил, C1-С 6-галогеналкил илиR7, R8 независимо друг от друга означают водород, галоген, C1-C6-алкил или C1-С 6-галогеналкил;R9 означает водород, галоген, C1-C6-алкил, C1-С 6-алкокси, С 3-С 6-циклоалкокси, C1-C6 галогеналкокси, C1-C6-алкоксикарбонил или C1-С 6-алкиламинокарбонил. 2. Соединения формулы I по п.1, причем заместители имеют следующие значения:R1 означает пиразол, пиррол, имидазол, 1,2,3-триазол, 1,2,4-триазол или тетразол, которые связаны через С или N, или 2-пиримидмн, пиразин или 3-пиридазин, причем R1 имеет до трех заместителей Ra',Ra' означает галоген, гидрокси, циано, нитро, амино, меркапто, C1-С 6-алкил, C1-C6-галогеналкил, С 2 С 6-алкенил, С 2-С 6-акинил, С 3-С 6-циклоалкил, C1-С 6-алкокси, C1-С 6-галогеналкокси, карбоксил, С 1-C7 алкоксикарбонил, карбамоил, С 1-С 7-алкиламинокарбонил, С 1-С 6-алкил-С 1-С 6-алкиламинокарбонил, морфолинокарбонил, пирролидинокарбонил, С 1-С 7-алкилкарбониламино, C1-C6-алкиламино, ди-(С 1-С 6 алкил)амино, C1-C6-алкилтио, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, гидроксисульфонил, аминосульфонил, C1-C6-алкиламиносульфонил или ди-(С 1-С 6-алкил)аминосульфонил;R3, R4 означают независимо друг от друга водород, C1-С 6-алкил, C1-C6-галогеналкил, С 3-С 6 циклоалкил или С 2-С 6-алкенил;R3 и R4 могут совместно с атомом азота, с которым они связаны, образовывать пяти-шестичленный цикл, который может быть прерван атомом кислорода и может иметь C1-C6-алкильный заместитель;R5, R6 означают независимо друг от друга водород, галоген или C1-C6-алкил;R7, R8 означают независимо друг от друга водород или галоген;- 25007719 4. Соединения формулы I по пп.1-3, причем комбинация заместителей от R5 до R9 имеют следующие значения: 2-хлор, 6-фтор; 2,6-дифтор; 2,6-дихлор; 2-метил, 4-фтор; 2-метил, 6-фтор; 2-сртор, 4 метил; 2,4,6-трифтор; 2,6-дифтор, 4-метокси; 2,4-диметил и пентафтор. 5. Способ получения 5-фенилпиримидинов формулы I по п.1, где R1 связан с азотом и R2 означает хлор, отличающийся тем, что тиомочевину циклизируют сложным фенилмалоналкильным эфиром формулы II которые подвергают взаимодействию с агентом алкилирования формулы IV,RX,где R означает C1-C6-алкил и Х нуклеофильно заменяемую группу, с получением соединений формулы V которые агентом хлорирования переводят в дихлорпиримидины формулы VI превращают в производные пиримидина формулы VIII и соединения формулы VIII оксидируют с получением сульфонов формулы IX которые взаимодействием с гетероциклическими соединениями формулы Х где цикл А означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол,имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4 оксадиазол, фуран, тиофен, тиазол, изотиазол, причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, переводят в соединения формулы I.- 26007719 6. Способ получения 5-фенилпиримидинов формулы I по п.1, причем В означает 5- или 6-членный гетероарил, содержащий от одного до четырех атомов, выбранных из азота, кислорода или серы, который выбирают из группы, включающей пиррол, пиразол, имидазол, 1,2,4-триазол, 1,2,3-триазол, тетразол, 1,2,3,-триазин, 1,2,4-триазин, оксазол, изоксазол, 1,3,4-оксадиазол, фуран, тиофен, тиазол, изотиазол,причем гетероцикл может быть соединен с пиримидиновым кольцом через С или N, пиридазин, пиримидин или пиразин, отличающийся тем, что дихлорпиримидин формулы IVa, где заместители имеют приведенные в п.1 значения, подвергают взаимодействию с амином формулы VII по п.5. 7. Промежуточный продукт формул VI по п.5, в котором комбинации заместителей от R5 до R9 имеют значения согласно п.4. 8. Промежуточный продукт формул VIa по п.6, в котором комбинации заместителей от R5 до R9 имеют значения согласно п.4. 9. Пригодные для борьбы с фитопатогенными грибами средства, содержащие жидкий или твердый носитель и соединение общей формулы I по п.1. 10. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы и подлежащие защите от грибов материалы, растения, почву или посевной материал обрабатывают эффективным количеством соединения общей формулы I по п.1.
МПК / Метки
МПК: C07D 239/42, C07D 403/04, C07D 487/04, A01P 3/00, C07D 473/00
Метки: получения, промежуточные, борьбы, 5-фенилпиримидины,способ, продукты, грибами, фитопатогенными, применение
Код ссылки
<a href="https://eas.patents.su/28-7719-5-fenilpirimidinysposob-i-promezhutochnye-produkty-dlya-ih-polucheniya-i-ih-primenenie-dlya-borby-s-fitopatogennymi-gribami.html" rel="bookmark" title="База патентов Евразийского Союза">5-фенилпиримидины,способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами</a>
Предыдущий патент: Новые соединения гетероциклического оксима, способ их получения и фармацевтические композиции, содержащие их
Следующий патент: Производные триазола в качестве антагонистов рецептора тахикинина
Случайный патент: Криостат












