Производные 3-азабицикло (3.1.0) гексана в качестве антагонистов опиоидного рецептора
Номер патента: 6708
Опубликовано: 24.02.2006
Авторы: Макхарди Стэнтон Ферст, Хек Стивен Дональд, Лирас Спирос
Формула / Реферат
1. Соединение, описываемое формулой I,
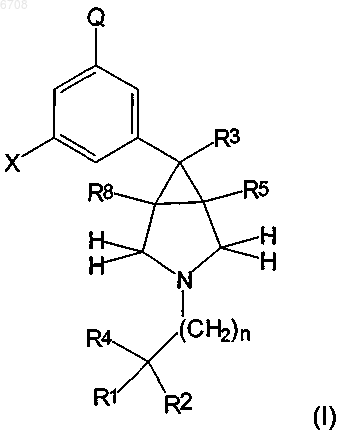
где X представляет собой H, галоген, -OH, -CN, -C1-C4алкил, замещенный атомами галогена в количестве от одного до трех, либо -O(C1-C4алкил), где C1-C4алкил в -O(C1-C4алкиле) необязательно замещен атомами галогена в количестве от одного до трех;
Q представляет собой галоген, -OH, -O(C1-C4алкил), -NH2, -N(C1-C4алкил)(C1-C4алкил), -C(=O)NH2, -C(=O)NH(C1-C4алкил), C(=O)N(C1-C4алкил) (C1-C4алкил) или -NHS(=O)2R11;
R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием C3-C7циклоалкила, где упомянутый циклоалкил необязательно образует конденсированную систему с C6-C14арильной группой; где упомянутый C3-C7циклоалкил, образованный с участием R1 и R2, может быть необязательно замещен группами R12 в количестве от одной до трех, а упомянутый арил, необязательно образующий конденсированную систему, может быть необязательно замещен независимо группами R12 в количестве от одной до шести, где группы R12 выбирают из R13, R16, -C1-C4алкила, содержащего одну или две ненасыщенные связи, галогена, -OR13, -NO2, -CN, -C3-C6циклоалкила, -NR13R14, -NR13C(=O)R14, -C(=O)NR13R14,
-OC(=O)R13, -C(=O)OR13, -C(=O)R13, -NR13C(=O)OR14, -NR13C(=O)NR14R15, -NR13S(=O)2R14 и -S(=O)2R13;
R3 представляет собой C1-C4 алкил, где упомянутый C1-C4алкил необязательно содержит одну либо две ненасыщенные связи;
R4 представляет собой -C1-C4алкил, который, необязательно, может содержать одну либо две ненасыщенные связи, -OH, -CN, NO2, -OR16, -CH2OH, -NH2, -NHR16, -NR16R17, -NHC(=O)CH3 либо -NHC(=O)R16;
каждый из R5 и R8 независимо представляет собой H либо метил;
R11 выбирают из C1-C4алкила, -(C1-C4алкилен)-O-(C1-C4алкила), 4-(1-метилимидазола), -(C1-C4алкилен)-NH2, -(C1-C4алкилен)-NH(C1-C4алкила), -(C1-C4алкилен)-N(C1-C4алкил)(C1-C4алкила);
каждый из R13, R14 и R15 независимо выбирают из группы, состоящей из H, R16, C1-C4алкила, галогена, -OH, -SH, -NH2, -NH(C1-C4алкила), -N(C1-C4алкил)(C1-C4алкила), -O(C1-C4алкила), -S(C1-C4алкила), -CN, -NO2, -C(=O)(C1-C4алкила), -C(=O)OH, C(=O)O(C1-C4алкила), -NHC(=O)(C1-C4алкила), -C(=O)NH2 и C(=O)N(C1-C4алкил)(C1-C4алкила);
каждый из R16 и R17 независимо выбирают из C6-C14арила, где упомянутый арил необязательно замещен заместителями в количестве от одного до трех, выбираемыми из C1-C4алкила, необязательно содержащего одну либо две ненасыщенные связи, галогена, -OH, -SH, -NH2, -NH(C1-C4алкила), -N(C1-C4алкил)(C1-C4алкила), -O(C1-C4алкила), -S(C1-C4алкила), -CN, -NO2, -C(=O)(C1-C4алкила), C(=O)OH, -C(=O)O(C1-C4алкила), -NHC(=O)(C1-C4алкила), -C(=O)NH2 и -C(=O)N(C1-C4алкил)(C1-C4алкила); и
n представляет собой целое число, выбираемое из нуля, 1, 2, 3, 4 и 5;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где указанное соединение формулы (I) имеет относительную стереохимическую структуру, описываемую формулой (II)

или его фармацевтически приемлемая соль.
3. Соединение по п.2, где R3 представляет собой метил, этил, изопропил либо нормальный (неразветвленный) пропил.
4. Соединение по п.2, где R4 представляет собой -CN, -NO2, -OH, -OCH3, -CH2OH, -NH2 или -NHC(=O)CH3.
5. Соединение по п.2, где Q представляет собой F, -OH, -C(=O)NH2, -NHS(=O)2CH3, -NHS(=O)2CH2CH3, -NHS(=O)2CH2CH2CH3, -NHS(=O)2CH(CH3)(CH3) или -NHS(=O)2CH2CH2OCH3.
6. Соединение по п.2, где X представляет собой H, F, -OH, -C(=O)NH2 или -CN.
7. Соединение по п.2, где Q представляет собой галоген, -OH, -O(C1-C4алкил), -NH2, -NH(C1-C4алкил), -N(C1-C4алкил)(C1-C4алкил), -C(=O)NH2, -C(=O)NH(C1-C4алкил), -C(=O)N(C1-C4алкил)(C1-C4алкил), -NHS(=O)2H или -NHS (=O)2R11.
8. Соединение по п.2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопропильной, циклобутильной, циклопентильной или циклогексильной группы, при этом каждая из них необязательно замещена одной либо двумя группами R12.
9. Соединение по п.2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопентильной группы либо циклогексильной группы, где указанные циклопентильная группа либо циклогексильная группа образуют конденсированную систему с бензольным кольцом, при этом каждая группа из упомянутых циклопентильной группы либо циклогексильной группы и упомянутого бензольного кольца необязательно замещена одной либо двумя группами R12.
10. Соединение по п.1 или 2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклобутильной группы, где указанная циклобутильная группа необязательно замещена R12, выбираемым из группы, состоящей из F, -CN либо необязательно замещенного фенила.
11. Соединение по п.2, в котором
X представляет собой H, галоген, или -CN;
Q представляет собой галоген, -OH, -C(=O)NH2 или -NHS(=O)2R11;
R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием C4-C6циклоалкила, где указанный C4-C6циклоалкил, образованный с участием R1 и R2, необязательно может быть замещен группами R12 в количестве от одной до трех, где указанные группы R12 выбирают из R13 или R16;
R3 представляет собой C1-C3алкил;
R4 представляет собой -OH, -CN, NO2, -CH2OH, -NH2, -NHC(=O)CH3 либо -NHC(=O)R16;
R11 выбирают из группы, состоящей шч C1-C4алкила и -(C2-C4алкилен)-O-(C1-C4 алкила);
R13 представляет собой H;
R16 представляет собой C6-арил, где упомянутый арил необязательно замещен заместителями-галогенами в количестве от одного до трех;
n представляет собой целое число, выбираемое из нуля, 1, 2 и 3;
или его фармацевтически приемлемая соль.
12. Соединение по п.2, выбираемое из группы, состоящей из следующих соединений:
экзо-N-(3-{6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{3-[3-(1-гидроксиметилциклопентил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-N-(1-{3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропил}циклогексил)ацетамид;
экзо-N-(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-1-{3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропил}циклогексанол;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}-5-фторфенил)метансульфонамид;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}-5-фторбензамид;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенол;
экзо-N-(3-{6-этил-3-[3-(1-нитроциклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-N-(3-{3-[3-(1-аминоциклогексил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-N-(3-{3-[3-(1-цианоциклогексил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
(3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-3-{3-[3-(1-цианоциклогексил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{3-[3-(1-цианоциклопентил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{3-[3-(1-цианоциклопентил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
(3-{3-[3-(1-цианоциклопентил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-(1-{3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропил}циклогексил)бензамид;
экзо-N-(3-{3-[3-(1-гидроксициклогексил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
3-{3-[3-(1-гидроксициклогексил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-{3-[6-этил-3-(цис-1-гидрокси-3-фенилциклобутилметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
экзо-3-[6-этил-3-(цис-1-гидрокси-3-фенилциклобутилметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
экзо-N-{3-[3-(цис-1-гидрокси-3-фенилциклобутилметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид; и
(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзоэтансульоновой кислоты;
или его фармацевтически приемлемая соль.
13. Соединение по п.11, в котором R4 представляет собой -OH; или его фармацевтически приемлемая соль.
14. Соединение по п.13, выбираемое из группы, состоящей из следующих соединений:
экзо-N-(3-{6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-1-{3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропил}циклогексанол;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метокситансульфоновой кислоты;
экзо-N-(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}-5-фторфенил)меансульфонамид;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}-5-фторбензамид;
экзо-3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенол;
экзо-3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метанульфонамид;
(3-{3-[3-(1-гидроксициклогексил)пропил]-6-пропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-(3-{3-[3-(1-гидроксициклогексил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)меансульфонамид;
3-{3-[3-(1-гидроксициклогексил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзо-2--токсиэтансульфоновой кислоты;
экзо-N-{3-[6-этил-3-(цис-1-гидрокси-3-фенилциклобутилметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
экзо-3-[6-этил-3-(цис-1-гидрокси-3-фенилциклобутилметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
экзо-N-{3-[3-(цис-1-гидрокси-3-фенилциклобутилметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид; и
(3-{6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)амид экзоэтансульфоновой кислоты;
или его фармацевтически приемлемая соль.
15. Соединение по п.2, в котором:
X представляет собой H, галоген, или -CN;
Q представляет собой -OH, -C(=O)NH2 или -NHS(=O)2R11;
R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием C5-C6циклоалкила, где указанный C5-C6циклоалкил образует конденсированную систему с C6-арильной группой;
R3 представляет собой C2-C3 алкил;
R4 представляет собой -OH, NO2, -CH2OH, -NH2 или -NHC(=O)CH3;
R11 выбирают из группы, состоящей из C1-C4алкила и -(C2-C4алкилен)-O-(C1-C4алкила);
n представляет собой целое число, выбираемое из нуля, 1, 2 и 3;
или его фармацевтически приемлемая соль.
16. Соединение по п.15, выбираемое из группы, состоящей из следующих соединений:
экзо-N-(3-{6-этил-3-[2-(2-гидроксиметилиндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{3-[3-(2-ацетиламиноиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(2-{3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропил}индан-2-ил)ацетамид;
экзо-N-(3-{6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{6-этил-3-[3-(2-нитроиндан-2-ил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{6-этил-3-[3-(2-нитроиндан-2-ил)пропил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-N-(3-{3-[3-(2-аминоиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}фенил)метансульфонамид;
экзо-3-{3-[3-(2-аминоиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-ил}бензамид;
экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]-5-фторбензамид;
экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил) -3-азабицикло[3.1.0]гекс-6-ил]бензамид;
{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]-5-фторфенил}метансульфонамид;
экзо-2-[6-этил-6-(3-гидроксифенил)-3-азабицикло[3.1.0]гекс-3-илметил]индан-2-ол;
(+/-)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
(+/-)-экзо-3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил] бензамид;
экзо-N-{3-циано-5-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
(+)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
(-)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил] фенил}метансульфонамид;
экзо-3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
экзо-N-{3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метасульфонамид;
{3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-{3-[3-(2-гидроксииндан-2-илметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
{3-[3-(2-гидроксииндан-2-илметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты и
{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзоэтансульфоновой кислоты
или его фармацевтически приемлемая соль.
17. Соединение по п.15, в котором R4 представляет собой -OH; или его фармацевтически приемлемая соль.
18. Соединение по п.17, выбираемое из группы, состоящей из следующих соединений:
экзо-N-(3-{6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}фенил)метан-сульфонамид;
экзо-3-{6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-ил}бензамид
экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]-5-фторбензамид;
экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]-5-фторфенил}метансульфонамид;
экзо-2-[6-этил-6-(3-гидроксифенил)-3-азабицикло[3.1.0]гекс-3-илметил]индан-2-ол;
(+/-)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
(+/-)-экзо-3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
экзо-N-{3-циано-5-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
(+)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
(-)-экзо-N-{3-[6-этил-3-(2-гидрокси-1,2,3,4-тетрагидронафталин-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
экзо-3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
экзо-N-{3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
{3-[3-(2-гидроксииндан-2-илметил)-6-пропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты;
экзо-N-{3-[3-(2-гидроксииндан-2-илметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
{3-[3-(2-гидроксииндан-2-илметил)-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзо-2-метоксиэтансульфоновой кислоты и
{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}амид экзоэтансульфоновой кислоты;
или его фармацевтически приемлемая соль.
19. Соединение по п.17, в котором X представляет собой H;
Q представляет собой -NHS (=O)2R11;
R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием C5-C6циклоалкила, где указанный C5-C6циклоалкил образует конденсированную систему с C6-арильной группой;
R3 представляет собой этил;
R11 представляет собой из C1-C4алкил; и
n имеет значение 1;
или его фармацевтически приемлемая соль.
20. Соединение по п.19, в котором R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием C5циклоалкила, где указанный C5циклоалкил образует конденсированную систему с C6-арильной группой;
или его фармацевтически приемлемая соль.
21. Соединение по п.20, которое представляет собой экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид; или его фармацевтически приемлемая соль.
22. Соединение по п.21, где указанная фармацевтически приемлемая соль представляет собой мезилат.
23. Фармацевтическая композиция, содержащая соединение по п.2 или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
24. Фармацевтическая композиция по п.23, где указанное соединение по п.2 представляет собой экзо-N-{3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенил}метансульфонамид;
или его мезилатную соль.
Текст
006708 Область техники Рассматриваемое изобретение относится к производным 3-азабицикло[3.1.0]гексана, фармацевтическим композициям, содержащим такие производные, и к способам использования таких производных при лечении нарушений и состояний, опосредованных опиоидным рецептором. Предмет изобретения, в частности, также относится к использованию таких производных при лечении определенных нарушений и состояний, например, слизистого колита (синдрома раздраженной толстой кишки), пристрастия к наркотическим средствам либо зависимости от них, в том числе пристрастия к алкоголю либо зависимости от него, депрессии и нарушений питания. Предпосылки изобретения Соединения настоящего изобретения связываются с опиатными (опиоидными) рецепторами (например, мю-, каппа- и дельта-опиоидными рецепторами). Соединения, которые связываются с такими рецепторами, вероятно, будут полезными при лечении заболеваний, модулируемых опиатными рецепторами, например, слизистого колита; запора; тошноты; рвоты; и зудящих дерматозов, таких как аллергический дерматит и атопия у животных и людей. На соединения, которые связываются с опиатными рецепторами, также указывали и при лечении нарушений питания, передозировок опиатов, депрессии, пристрастия к курению и алкоголю и зависимости от них, сексуальной дисфункции, шока, инсульта, повреждения спинного мозга и травмы головы. Некоторые соединения на основе 4-арилпиперидина описываются в европейских патентных заявках ЕР 287339, ЕР 506468 и ЕР 506478 как опиоидные антагонисты. В дополнение к этому международная патентная заявка WO 95/15327 описывает производные азабициклоалкана, полезные в качестве нейролептических средств. В WO 00/39089 также описываются и производные 3-азабицикло[3.1.0]гексана,полезные в качестве антагонистов опиоидного рецептора. Помимо этого, будет выгодно получить лекарственные препараты, например, лекарственные препараты, которые связываются с опиоидными рецепторами, которые не являются субстратами ферментаCYP2D6. Для популяции людей характерно непостоянство уровня наличия фермента CYP2D6, и поэтому легче было бы разработать схемы применения для лекарственного препарата, которые были бы в большей степени применимы для популяции людей, если бы в процессе метаболизма данного лекарственного препарата не принимал участия CYP2D6. Краткое изложение изобретения В рассматриваемом изобретении предлагается соединение, описываемое формулой I, где X представляет собой Н, галоген, -ОН, -CN, -С 1-С 4 алкил, замещенный атомами галогена в количестве от одного до трех, либо -O(С 1-С 4 алкил), где С 1-С 4 алкил в -O(С 1-С 4 алкиле) необязательно замещен атомами галогена в количестве от одного до трех;Q представляет собой галоген, -ОН, -O(С 1-С 4 алкил), -NH2, -NH(С 1-С 4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил),-C(=O)NH2, -C(=O)NH(С 1-С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкил), -NHS(=O)2H либо -NHS(=O)2R11; или Q может образовывать 5- либо 6-членный циклоалкильный либо гетероциклоалкильный цикл с любым из атомов углерода, соседствующих с тем атомом углерода, к которому он присоединен, тем самым образуя бициклическую систему конденсированных циклов с тем фенилом, к которому он присоединен, где упомянутый гетероциклоалкил содержит от одного до трех гетерозвеньев, выбираемых из О,S, -(С=O) и N, и где упомянутые циклоалкил либо гетероциклоалкил необязательно содержат одну либо две двойные связи;R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием С 3-С 7 циклоалкила либо 4-7-членного гетероциклоалкила, содержащего от одного до трех гетерозвеньев,выбираемых из О, S, -С(=O) и N; и где упомянутые циклоалкил либо гетероциклоалкил необязательно содержат одну либо две двойные связи; и где упомянутые циклоалкил либо гетероциклоалкил необязательно образуют конденсированную систему с С 6-С 14 арильной либо 5-14-членной гетероарильной группой; где каждый из упомянутых С 3-С 7 циклоалкила либо 4-7-членного гетероциклоалкила, образованных с участием R1 и R2, может быть необязательно замещен группами R12 в количестве от одной до трех, а каждый из упомянутых арила либо гетероарила, необязательно образующих конденсированную систему,необязательно может быть независимо замещен группами R12 в количестве от одной до шести, где группы R12-1 006708 выбирают из R13, R16, -С 1-С 4 алкила, содержащего одну либо две ненасыщенные связи, галогена, -OR13, -NO2,-CN, -С 3-С 6 циклоалкила, -NR13R14, -NR13C (=O)R14, -C(=O)NR13R14, -OC(=O)R13, -C(=O)OR13, -C(=O)R13,-NR13C(=O) OR14, -NR13C(=O)NR14R15, -NR13S(=O)2R14 и -S(=O)2R13;R3 представляет собой С 1-С 4 алкил, где упомянутый С 1-С 4 алкил необязательно содержит одну либо две ненасыщенные связи;R4 представляет собой -C1-C4 алкил, который необязательно может содержать одну либо две ненасыщенные связи, -ОН, -CN, NO2, -OR16, -NH2, -NHR16, -NR16R17 либо -NHC(=O)R16; каждый из R5 и R8 независимо представляет собой Н либо метил;R11 выбирают из С 1-С 4 алкила, -(С 1-С 4 алкилен)-О-(С 1-С 4 алкила), 4-(1-метилимидазола), -(С 1-С 4 алкилен)NH2, -(C1-C4 алкилен)-NH(С 1-С 4 алкила), -(С 1-С 4 алкилен)-N(С 1-С 4 алкил)(С 1-С 4 алкила); каждый из R13, R14 и R15 независимо выбирают из Н, R16, С 1-С 4 алкила, галогена, -ОН, -SH, -NH2,-NH(С 1-С 4 алкила), -N(C1-C4 алкил)(С 1-С 4 алкила), -O(С 1-С 4 алкила), -S(С 1-С 4 алкила), -CN, -NO2, -C(=O)(С 1 С 4 алкила), -С(=О)ОН, -С(=O)О(С 1-С 4 алкила), -NHC(=O)(С 1-С 4 алкила), -C(=O)NH2 и -С(=O)N(С 1 С 4 алкил)(С 1-С 4 алкила), либо R13 и R14 в случае -NR13R14 необязательно могут соединяться с образованием 4-6-членной гетероциклоалкильной либо гетероарильной группы, где данная гетероарильная группа необязательно содержит от 1 до 3 дополнительных гетерозвеньев, выбираемых из N, S, О и -С(=O); каждый из R16 и R17 независимо выбирают из С 6-С 14 арила и 5-14-членного гетероарила, где упомянутый гетероарил содержит от одного до трех гетерозвеньев, выбираемых из О, S, -С(=O) и N, и где упомянутые арил и гетероарил необязательно замещены заместителями в количестве от одного до трех, выбираемыми из С 3-С 4 алкила, необязательно содержащего одну либо две ненасыщенные связи, галогена,-ОН, -SH, -NH2, -NH(С 1-С 4 алкила), -N(С 1-С 4 алкил) (С 1-С 4 алкила), -O(С 1-С 4 алкила), -S(С 1-С 4 алкила), -CN,-NO2, -C(=O)(С 1-С 4 алкила), -С(=О)ОН, -С(=O)О(С 1-С 4 алкила), -NHC(=O)(С 1-С 4 алкила), -C(=O)NH2 и -С(=O)Nn представляет собой целое число, выбираемое из нуля, 1, 2, 3, 4 и 5; и его фармацевтически приемлемые соли. В одном варианте реализации изобретения предлагаются соединения, описываемые формулой I, гдеR3 представляет собой метил, этил или прямоцепной пропил. В еще одном варианте реализации R3 представляет собой метил, этил, изопропил либо прямоцепной пропил. В предпочтительном варианте реализации R3 представляет собой этил. В другом варианте реализации изобретения предлагаются соединения, описываемые формулой I,где R4 представляет собой -CN, -NO2, -ОН, -NH2, -O(С 1-С 4 алкил), - (С 1-С 4 алкилен)-ОН, -NHC(=O)(С 1 С 4 алкил), -NH(С 1-С 4 алкил) либо -N(С 1-С 4 алкил)(С 1-С 4 алкил). В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулойI, где R4 представляет собой -CN, -NO2, -ОН, -ОСН 3, -СН 2 ОН, -NH2 либо -NHC(=O)CH3. В другом варианте реализации R4 представляет собой -ОН, -ОСН 3, -СН 2 ОН, -NH2 либо -NHC(=O)CH3. В предпочтительном варианте реализации R4 представляет собой -ОН. В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулой(=O)2R11. В другом варианте реализации изобретения предлагаются соединения, описываемые формулой I,где Q представляет собой F, -ОН, -C(=O)NH2, -NHS(=O)2CH3, -NHS(=O)2 СН 2 СН 3, -NHS(=O)2 СН 2 СН 2 СН 3,-NHS(=O)2CH(CH3)(СН 3), -NHS(=O)2CH2CH2OCH3 либо -NHS(=O)2(4-(1-метилимидазол. В еще одном варианте реализации изобретения Q представляет собой F, -ОН, -C(=O)NH 2 ,-NHS(=O)2 СН 3, -NHS(=O)2 СН 2 СН 2 ОСН 3 либо -NHS(=O)2(4-(1-метилимидазол. В другом варианте реализации изобретения предлагаются соединения, описываемые формулой I,где X представляет собой Н, F, -ОН, -C(=O)NH2 либо -CN. В еще одном варианте реализации X представляет собой Н, F, -ОН либо -CN. В другом варианте реализации изобретения Q представляет собой F, -ОН, -C(=O)NH2, NHS(=O)2CH3, -NHS(=O)2 СН 2 СН 2 ОСН 3 либо -NHS(=O)2(4-1-метилимидазол, а X представляет собой Н,F, -ОН либо -CN. В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулойI, где n представляет собой целое число, выбираемое из нуля, одного, двух либо трех. Предпочтительно n представляет собой целое число, выбираемое из одного, двух либо трех. В другом варианте реализации изобретения предлагаются соединения, описываемые формулой I,где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопропильной, циклобутильной, циклопентильной либо циклогексильной группы, при этом каждая из них необязательно замещена одной либо двумя группами R12. В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулойI, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопентильной группы, необязательно замещенной одной либо двумя группами R12. В одном варианте-2 006708 реализации циклопентильная группа, образованная с участием R1 и R2, группой R12 не замещена. В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулойI, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклогексильной группы, необязательно замещенной одной либо двумя группами R12. В одном варианте реализации циклогексильная группа, образованная с участием R1 и R2, группой R12 не замещена. В другом варианте реализации изобретения цикл, образованный с участием R1 и R2, например, циклопентильный либо циклогексильный цикл, образует конденсированную систему с бензольным кольцом,и каждая группа, выбираемая из цикла, образованного с участием R1 и R2, и бензольного кольца, независимо замещена в соответствии с тем, что упоминается выше. В более конкретном варианте реализации каждая группа, выбираемая из бензольного кольца и/или цикла, образованного с участием R1 и R2, необязательно замещена одной либо двумя группами R12. В одном варианте реализации бензол никакой группой R12 не замещен. В еще одном более конкретном варианте реализации R1 и R2 образуют циклогексильную группу, где данная циклогексильная группа образует конденсированную систему с бензольным кольцом, либо R1 и R2 образуют циклопентильную группу, где данная циклопентильная группа образует конденсированную систему с бензольным кольцом. В любом случае (циклопентил, образующий конденсированную систему с бензолом, либо циклогексил, образующий конденсированную систему с бензолом) каждая из групп, выбираемых из упомянутых циклопентила либо циклогексила и/или образующего конденсированную систему бензольного кольца, необязательно замещена одним либо двумя R12 в соответствии с тем, что упоминается выше. В другом варианте реализации циклогексильная либо циклопентильная группа, которая образует конденсированную систему с бензолом, никакой группой R12 не замещена. В каждом из упомянутых выше вариантов реализации при наличии заместителя R12 в одном варианте реализации им является -CN либо галоген, например, группа фтора. В еще одном варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил, циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, a R3 представляет собой метил, этил, изопропил либо прямоцепной пропил. В другом таком варианте реализации R3 представляет собой метил, этил либо прямоцепной пропил. В предпочтительном варианте реализации R3 представляет собой этил. В еще одном варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил, циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, a R4 представляет собой -ОН, -ОСН 3, -СН 2 ОН, -NH2 либо -NHС(=О)СН 3. В другом таком варианте реализации R4 представляет собой -CN, -NO2, -ОН, -ОСН 3, -СН 2 ОН, -NH2 либо -NHC(=O)CH3. В еще одном таком варианте реализации R4 представляет собой -CN, -NO2, -ОН, -NH2, -O(С 1-С 4 алкил), -(С 1 С 4 алкилен)-ОН, -NHC(=O)(С 1-С 4 алкил), -NH(C1-C4 алкил) либо -N(С 1-С 4 алкил)(С 1-С 4 алкил). В предпочтительном варианте реализации R4 представляет собой -ОН. В еще одном варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил, циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, a Q представляет собой F, -ОН, -C(=O)NH2, -NHS(=O)2CH3, -NHS(=O)2CH2CH2OCH3 либо-NHS(=O)2(4-(1-метилимидазол. В другом таком варианте реализации Q представляет собой галоген,-ОН, -O(С 1-С 4 алкил), -NH2, -NH(C1-С 4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил), -C(=O)NH2, -С(=O)NH(С 1 С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкил), -NHS(=O)2H либо -NHS(=O)2R11. В еще одном таком варианте реализации Q представляет собой F, -ОН, -C(=O)NH2, -NHS(=O)2 СН 3,-NHS(=O)2CH2CH3, -NHS(=O)2CH2CH2CH3, -NHS(=O)2 СН(СН 3)(СН 3), -NHS(=О)2 СН 2 СН 2 ОСН 3 либо-NHS(=O)2(4-(1-метилимидазол. В другом варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил,циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, а X представляет собой Н, F, -ОН, -C(=O)NH2 либо -CN. В еще одном таком варианте реализации X представляет собой Н, F, -ОН либо -CN. В другом варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил, циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, Q представляет собой F, -ОН, -C(=O)NH2, -NHS(=O)2CH3, -NHS(=О)2 СН 2 СН 2 ОСН 3 либо -NHS(=O)2(4-1 метилимидазол, а X представляет собой Н, F, -ОН либо -CN. В еще одном варианте реализации изобретения, если R1 и R2 образуют циклогексил либо циклопентил, циклогексил либо циклопентил необязательно образуют конденсированную систему с бензольным кольцом, а n представляет собой целое число, выбираемое из одного, двух и трех. В другом варианте реализации n представляет собой целое число, выбираемое из одного, двух и трех, a Q представляет собой галоген, -ОН, -O(С 1-С 4 алкил), -NH2,-NH(С 1-С 4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил), -C(=O)NH2, -С(=O)NH (С 1-С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1 С 4 алкил), -NHS(=O)2H либо -NHS(=O)2R11. В еще одном варианте реализации изобретения предлагаются соединения, описываемые формулойI, где как R5, так и R8 представляют собой водород. Конкретные примеры соединений изобретения, описываемых формулой I, представляют собой: экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфе-3 006708 нил)метансульфонамид; экзо-N-(3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6 илфенил)метансульфонамид; экзо-N-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид; экзо-1-3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексанол; экзо-3-6-этил-3- [3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид;(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)амид экзо-1 метил-1 Н-имидазол-4-сульфоновой кислоты; экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенол; экзо-2-[6-этил-6-(3-гидроксифенил)-3-азабицикло[3.1.0]гекс-3-илметил]индан-2-ол; и экзо-3-(6-этил-3-индан-2-илметил-3-азабицикло[3.1.0]гекс-6-ил)фенол; и их фармацевтически приемлемые соли. Другие конкретные примеры соединений изобретения, описываемых формулой I, представляют собой: экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид цитрат; экзо-N-(3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-1-3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексанол; экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид;(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)амид экзоэтансульфоновой кислоты; и для приведенных выше соединений, которые не являются солевыми формами, их фармацевтически приемлемые соли. Термин алкил в соответствии с тем, как он используется в настоящем документе, если только не будет указано другого, включает насыщенные одновалентные углеводородные радикалы, содержащие прямоцепные либо разветвленноцепные звенья. Примеры алкильных групп включают следующие, но не ограничиваясь только ими: метил, этил, пропил, изопропил и трет-бутил. Термин циклоалкил в соответствии с тем, как он используется в настоящем документе, если только не будет указано другого, включает неароматические насыщенные циклические алкильные звенья, где алкил определен, как указано выше. Примеры циклоалкила включают следующие, но не ограничиваясь только ими: циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин арил в соответствии с тем, как он используется в настоящем документе, если только не будет указано другого, включает органический радикал, полученный из ароматического углеводорода в результате удаления одного водорода, такой как фенил, нафтил, инденил и флуоренил. Гетероарил в соответствии с тем, как он используется в настоящем документе, обозначает ароматические группы, содержащие один либо несколько гетероатомов (О, S либо N), предпочтительно от одного до четырех гетероатомов. Многоядерная группа, содержащая один либо несколько гетероатомов,где, по меньшей мере, один цикл в группе является ароматическим, представляет собой гетероарильную группу. Гетероарильные группы данного изобретения также могут включать циклические системы,замещенные одним либо несколькими оксо-звеньями. Примерами гетероарильных групп являются пиридинил, пиридазинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, хинолил, изохинолил,тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, триазинил, изоиндолил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотриазолил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, дигидрохинолил, тетрагидрохинолил, дигидроизохинолил, тетрагидроизохинолил, бензофурил, фуропиридинил, пирролопиримидинил и азаиндолил. Приведенные выше группы, являющиеся производными соединений, перечисленных выше, могут быть присоединены через атом С либо могут быть присоединены через атом N, где это возможно. Например, группа, получаемая из пиррола, может быть пиррол-1-илом (присоединение через атом N), либо пиррол-3-илом (присоединение через атом С). Термины, обозначающие группы, также включают и все возможные таутомеры. Соли соединений, описываемых формулой I, можно получить в результате образования солей с любой кислотной либо основной группой, присутствующей в соединении, описываемом формулой I. Примерами фармацевтически приемлемых солей соединений, описываемых формулой I, являются соли хлористоводородной кислоты, п-толуолсульфоновой кислоты, фумаровой кислоты, лимонной кислоты, янтарной кислоты, салициловой кислоты, щавелевой кислоты, бромисто-водородной кислоты, фосфорной кислоты, метансульфоновой кислоты, винной кислоты, малеиновой кислоты, ди-п-толуоилвинной кислоты, уксусной кислоты, серной кислоты, иодисто-водородной кислоты, миндальной кислоты, натрия, калия, магния, кальция и лития. Соединения, описываемые формулой I, могут иметь оптические центры, и поэтому они могут встречаться в различных энантиомерных и других стереоизомерных конфигурациях. Изобретение включает все энантиомеры, диастереомеры и другие стереоизомеры таких соединений, описываемых формулой I, а также их рацемические и другие смеси. Методы синтеза, описанные ниже в разделе Подробное описание и в примерах, приводят к получению, в первую очередь, соединений, описываемых формулой I, отличающихся относительной стереохимией, проиллюстрированной соединениями, описываемыми формулой II, приведенной ниже: где R1-4, Q, X и n определены, как указано выше. Соединения, описываемые формулой II, и их фармацевтически приемлемые соли представляют собой предпочтительные варианты реализации изобретения. Соединения, описываемые формулой II, представляют собой экзодиастереомеры по отношению к четвертичному атому углерода в системе конденсированных циклов циклопропана-пирролидина. Другими словами, фенил (с присоединенными к нему Q иX) в соединениях, описываемых формулой II, располагается на экзо-поверхности [3.1.0]бициклопирролидинового звена. Предпочтительными являются соединения, описываемые формулой II, где Q представляет собой галоген, -ОН, -O(С 1-С 4 алкил), -NH2, -NH(С 1-С 4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил), -C(=O)NH2,-C(=O)NH(С 1-С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкил), -NHS(=O)2H либо -NHS(=O)2R11. Рассматриваемое изобретение также включает соединения с изотопными метками, которые идентичны соединениям, описываемым формулой I, за исключением того, что один либо несколько атомов будут замещены атомом, атомная масса либо массовое число которого отличается от атомной массы либо массового числа, обычно встречающихся в природе. Примеры изотопов, которые можно ввести в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора,иода и хлора, такие как 3 Н, 11C, 14C, 18F, 123I и 125I. В объем данного изобретения входят соединения настоящего изобретения и фармацевтически приемлемые соли упомянутых соединений, которые содержат упомянутые выше изотопы и/или другие изотопы других атомов. Соединения настоящего изобретения с изотопными метками, например, те, в которые введены радиоактивные изотопы, такие как 3 Н и 14 С, пригодны для анализов распределения в тканях лекарственных препаратов и/или субстратов. Изотопы, представляющие собой тритий, то есть 3 Н, и углерод-14, то есть 14 С, в особенности предпочтительны вследствие легкости их получения и детектируемости. Изотопы 11C и 18F в особенности пригодны для ПЭТ(позитронно-эмиссионной томографии), а изотопы 125I в особенности пригодны для ОФЭКТ (однофотонной эмиссионной компьютерной томографии), причем все они пригодны для визуализации мозга. Кроме этого, замещение на более тяжелые изотопы, такие как дейтерий, то есть 2 Н, может позволить добиться определенных преимуществ при лечении, которые обусловлены более высокой стабильностью в процессах метаболизма, например, увеличенным периодом полувыведения из живого организма либо пониженными требованиями к дозировке, и, таким образом, в некоторых обстоятельствах это может оказаться предпочтительным. Меченные изотопами соединения формулы I данного изобретения в общем случае можно получить в результате использования методик, описанных в схемах и/или примерах, приведенных ниже, заменив реагент без изотопной метки на легко доступный реагент с изотопной меткой. В рассматриваемом изобретении также предлагаются соединения, описываемые формулой где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием С 5-С 7 циклоалкила либо С 5-С 7 гетероциклоалкила, содержащего от одного до трех гетероатомов, выбираемых из О, S, -С(=O) и N; и где упомянутые циклоалкил либо гетероциклоалкил необязательно содержат одну либо две двойные связи; и где упомянутые циклоалкил либо гетероциклоалкил необязательно образуют конденсированную систему с С 6-С 14 арильной либо С 5-С 14 гетероарильной группой; где каждый из упомянутых С 5-С 7 циклоалкила либо С 5-С 7 гетероциклоалкила, образованных с участием R1 и R2, необязательно может быть замещен группами R12 в количестве от одной до трех, а каждый из упомянутых необязательно образующих конденсированную систему арила либо гетероарила необязательно может быть независимо замещен группами R12 в количестве от одной до шести, где группы R12 выбирают из R13, галогена, -OR13, -NO 2, -CN, -С 3-С 6 циклоалкила, -NR13R14, -NR13C(=O)R14,-С(=O)NR13R14, -OC(=O)R13, -C(=O)OR13, -C(=O)R13, -NR13C(=O)OR14, -NR13C(=O)NR14R15, -NR13S(=O)2R14 и-7 006708 каждый из R13, R14 и R15 независимо выбирают из Н и С 1-С 4 алкила, где каждый С 1-С 4 алкил необязательно замещен заместителями в количестве от одного до трех, выбираемыми из галогена, -ОН, -SH,-NH2, -NH(С 1-С 4 алкила), -N(С 1-С 4 алкил)(С 1-С 4 алкила), -O(С 1-С 4 алкила), -S(С 1-С 4 алкила), -CN, -NO2,-C(=O)(C1-С 4 алкила), -С(=О)ОН, -C(=O)O(C1-C4 алкила), -NHC(=O)(С 1-С 4 алкила), -C(=O)NH2 иR18 представляет собой -О- либо -NH-. Соединения, описываемые формулой XXI, пригодны для получения соединений, описываемых формулой I. Рассматриваемое изобретение также предлагает соединения, описываемые формулой где X представляет собой Н, галоген, -ОН, -CN, -С 1-С 4 алкил, замещенный атомами галогена в количестве от одного до трех, либо -O(С 1-С 4 алкил), где С 1-С 4 алкил в -O(С 1-С 4 алкиле) необязательно замещен атомами галогена в количестве от одного до трех; иQ представляет собой галоген, -ОН, -O(С 1-С 4 алкил), -NH2, -NH(С 1-С 4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил), C(=O)NH2, -C(=O)NH(С 1-С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкил), -NHS(=O)2H либо -NHS(=O)2R11. Соединения, описываемые формулой IV, пригодны для получения соединений, описываемых формулой I. Соединения по изобретению, описываемые формулой I, полезны, поскольку они обладают фармакологической активностью в отношении животных, в особенности, млекопитающих, в том числе человека. Таким образом, в рассматриваемом изобретении также предлагается способ лечения нарушения либо состояния, опосредованных опиоидным рецептором либо рецепторами, у млекопитающего, в том числе человека, которому это необходимо, где данный способ включает введение упомянутому млекопитающему соединения, соответствующего формуле I, в количестве, эффективном для подавления опиоидного рецептора либо рецепторов. В рассматриваемом изобретении также предлагается способ лечения нарушения либо состояния,опосредованных опиоидным рецептором либо рецепторами, у млекопитающего, в том числе человека,которому это необходимо, где данный способ включает введение упомянутому млекопитающему соединения, соответствующего п.1 формулы изобретения, в количестве, эффективном для лечения упомянутых нарушения либо состояния. В рассматриваемом изобретении также предлагается способ лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, выбираемого из слизистого колита; запора; тошноты; рвоты; зудящих дерматозов, в том числе аллергического дерматита и контактного дерматита; псориаза; экземы; укуса насекомого; нарушения питания, в том числе анорексии, булимии и ожирения; депрессии, пристрастия к курению; пристрастия к наркотическим средствам, в том числе пристрастия к алкоголю, пристрастия к амфетамину, пристрастия к кокаину и пристрастия к опиату, например морфину, опиуму либо героину; опиатной передозировки; сексуальной дисфункции, в том числе эректильной дисфункции и импотенции; инсульта; травмы головы; черепно-мозговой травмы; повреждения спинного мозга; болезни Паркинсона; болезни Альцгеймера, возрастного ослабления когнитивной функции; и синдрома дефицита внимания с гиперактивностью; где данный способ включает введение упомянутому млекопитающему соединения, описываемого формулой I, в количестве, эффективном для подавления опиоидного рецептора либо рецепторов. В рассматриваемом изобретении также предлагается способ лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, выбираемого из слизистого колита; запора; тошноты; рвоты; зудящих дерматозов, в том числе аллергического дерматита и контактного дерматита; псориаза; экземы; укуса насекомого; нарушения питания, в том числе анорексии, булимии и ожирения; депрессии, пристрастия к курению; пристрастия к наркотическим средствам, в том числе пристрастия к алкоголю, пристрастия к амфетамину, пристрастия к кокаину и пристрастия к опиату, например, морфину, опиуму либо героину; опиатной передозировки; сексуальной дисфункции, в том числе эректильной дисфункции и импотенции; инсульта; травмы головы; черепно-мозговой травмы; повреждения спинного мозга; болезни Паркинсона; болезни Альцгеймера, возрастного ослабления когнитивной функции; и синдрома дефицита внимания с гиперактивностью; где данный способ включает введение упомянутому млекопитающему соединения, описываемого формулой I, в количестве, эффективном для лечения упомянутых нарушения либо состояния.-8 006708 В рассматриваемом изобретении также предлагается фармацевтическая композиция для лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, опосредованных опиоидным рецептором либо рецепторами, где данная композиция содержит соединение, соответствующее формуле I, в количестве, эффективном для подавления опиоидного рецептора либо рецепторов, и фармацевтически приемлемый носитель. В рассматриваемом изобретении также предлагается фармацевтическая композиция для лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, опосредованных опиоидным рецептором либо рецепторами, где данная композиция содержит соединение, соответствующее формуле I, в количестве, эффективном для лечения упомянутых нарушения либо состояния, и фармацевтически приемлемый носитель. В рассматриваемом изобретении также предлагается фармацевтическая композиция для лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, выбираемого из слизистого колита; запора; тошноты; рвоты; зудящих дерматозов, в том числе аллергического дерматита и контактного дерматита; псориаза; экземы; укуса насекомого; нарушения питания, в том числе анорексии, булимии и ожирения; депрессии, пристрастия к курению; пристрастия к наркотическим средствам, в том числе пристрастия к алкоголю, пристрастия к амфетамину, пристрастия к кокаину и пристрастия к опиату, например, морфину, опиуму либо героину; опиатной передозировки; сексуальной дисфункции, в том числе эректильной дисфункции и импотенции; инсульта; травмы головы; черепномозговой травмы; повреждения спинного мозга; болезни Паркинсона; болезни Альцгеймера, возрастного ослабления когнитивной функции; и синдрома дефицита внимания с гиперактивностью; где данная композиция содержит соединение, описываемое формулой I, в количестве, эффективном для подавления опиоидного рецептора либо рецепторов, и фармацевтически приемлемый носитель. В рассматриваемом изобретении также предлагается фармацевтическая композиция для лечения у млекопитающего, в том числе человека, которому это необходимо, нарушения либо состояния, выбираемого из слизистого колита; запора; тошноты; рвоты; зудящих дерматозов, в том числе аллергического дерматита и контактного дерматита; псориаза; экземы; укуса насекомого; нарушения питания, в том числе анорексии, булимии и ожирения; депрессии, пристрастия к курению; пристрастия к наркотическим средствам, в том числе пристрастия к алкоголю, пристрастия к амфетамину, пристрастия к кокаину и пристрастия к опиату, например, морфину, опиуму либо героину; опиатной передозировки; сексуальной дисфункции, в том числе эректильной дисфункции и импотенции; инсульта; травмы головы; черепномозговой травмы; повреждения спинного мозга; болезни Паркинсона; болезни Альцгеймера, возрастного ослабления когнитивной функции; и синдрома дефицита внимания с гиперактивностью; где данная композиция содержит соединение, описываемое формулой I, в количестве, эффективном для лечения упомянутых нарушения либо состояния, и фармацевтически приемлемый носитель. Термины лечение, излечение и тому подобные, обозначают обращение, облегчение либо подавление развития нарушения либо состояния, в отношении которых такой термин используется, или одного либо нескольких симптомов таких нарушения либо состояния. В соответствии с тем, как они используются в настоящем документе, данные термины также включают, в зависимости от состояния пациента, предотвращение начала развития нарушения или состояния либо симптомов, связанных с нарушением или состоянием, в том числе уменьшение тяжести нарушения либо состояния или симптомов,связанных с ними, до возникновения упомянутых нарушения либо состояния. Таким образом, лечение в соответствии с тем, как это используется в настоящем документе, может обозначать введение соединения изобретения субъекту, у которого на момент введения не возникли данные нарушение либо состояние. Таким образом, излечение также включает предотвращение рецидива нарушения либо состояния либо симптомов, связанных с ними. Млекопитающее в соответствии с тем, как это используется в настоящем документе, и если не будет указано другого, обозначает любое млекопитающее. Термин млекопитающее включает, например, но не ограничиваясь только ими, собак, кошек и людей. Ссылки в настоящем документе на нарушения и состояния, опосредованные опиоидным рецептором либо рецепторами, указывают на нарушения либо состояния, которые вызываются, по меньшей мере, частично, в результате связывания эндогенных лигандов с опиоидным рецептором, например, связывания эндогенного лиганда с мю-, каппа- и/или дельта-опиоидным рецептором. Примеры нарушений и состояний, которые опосредованы опиоидным рецептором либо рецепторами, включают следующее, но не ограничиваются только им: слизистый колит, нарушения питания, сексуальная дисфункция, депрессия, пристрастия к курению и наркотическим средствам, а также и другие специфические нарушения и состояния, приведенные выше. Подробное описание изобретения Соединения, описываемые формулой I, приведенной выше, и их фармацевтически приемлемые соли можно получить в соответствии со следующими рассматриваемыми схемами реакций от I до VIII. Если только не будет указано другого, Q, X, n и от R1 до R15 определены, как указано выше. L представляет собой уходящую группу. Выделение и очистку продуктов проводят по стандартным методикам,которые известны химику-специалисту в соответствующей области.-9 006708 В соответствии с тем, как это используется в настоящем документе, выражение инертный для реакции растворитель означает систему растворителя, в которой компоненты не взаимодействуют с исходными веществами, реагентами либо промежуточными соединениями в реакции получения продуктов таким образом, который оказал бы негативное влияние на выход желательного продукта. В ходе реализации любой из следующих далее последовательностей синтеза может оказаться необходимой и/или желательной защита нестойких либо реакционноспособных групп на любой из рассматриваемых молекул. Этого можно добиться при использовании обычных защитных групп, таких как те,что описываются в работах Т. W. Greene, Protective Groups in Organic Chemistry, John WileySons, 1981; и Т. W. Greene and P. G. M. Wuts, Protective Groups in Organic Chemistry, John WileySons, 1991. Схема I иллюстрирует способ получения соединений с базовой структурой, описываемой формулойI, где Х=Н, F, Cl, Br, Q=F, Cl, Br, NO2, OCH3, R3=этил, R5, R8=водород, R6, R7, R9, R10=C=O, a R1, R2 и R4 описываются, как указано выше. Обращаясь к схеме I, можно сказать, что кетон, описываемый формулой (II), можно обрабатывать действием гидразина в спиртовом растворителе, таком как метанол, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, до получения желательного гидразона, описываемого формулой (III). Окисление гидразона, описываемого формулой (III), под действием подходящего окислителя, такого как MnO2, в растворителях, таких как диоксан либо тетрагидрофуран, при комнатной температуре приводит к получению промежуточного соединения иона диазония (не показан). Обработка данного промежуточного соединения действием малеимидного реагента, такого как N-бензилмалеимид в диоксане, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, приводит к получению желательного соединения, описываемого формулой (IV). Схема I Приведенные ниже схемы II-VI иллюстрируют способы получения соединений с базовой структурой, описываемой формулой I, где Х=Н, F, Br, Q=NHSO2R11, F, Br, CN, CONH2, OCH3, ОН, R3=этил, R5,R8, R6, R7, R9, R10=водород, a R1, R2 и R4 описываются, как указано выше. Согласно схеме II, обработка соединения, описываемого формулой (V), действием газообразного водорода (при давлениях в диапазоне от атмосферного до 50 фунт/дюйм 2) в присутствии подходящего катализатора, такого как палладий-на-угле, в растворителях, таких как этилацетат, при температурах в диапазоне от комнатной температуры до 60 С, предпочтительно приблизительно при 60 С, приводит к получению соединения, описываемого формулой (VI). Обработка анилина, описываемого формулой (VI),действием подходящим образом замещенного сульфонилхлорида, такого как метансульфонилхлорид, в присутствии подходящего основания, такого как пиридин либо триэтиламин, в растворителе, таком как этилацетат, при температурах в диапазоне от 0 С до комнатной температуры, предпочтительно приблизительно при комнатной температуре, приводит к получению желательного сульфонамида, описываемого формулой (VII). Обработка соединения, описываемого формулой (VII), действием восстановителя,такого как боргидрид натрия, в присутствии комплекса диэтилового эфира и трифторида бора в растворителях, таких как диэтиловый эфир либо тетрагидрофуран, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, приводит к получению желательного соединения, описываемого формулой (VIII). В альтернативном варианте соединения, описываемые формулой (VIII), также можно получить в соответствии с последовательностью химических реакций, изображенной на схеме III. Согласно приведенной ниже схеме III, соединения, описываемые формулой (X), можно получить в результате обработки соединения, описываемого формулой (IX), действием восстановителя, такого как боргидрид натрия, в присутствии комплекса диэтилового эфира и трифторида бора. Данную реакцию проводят в растворителях, таких как диэтиловый эфир либо тетрагидрофуран, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы. Обработка соединения, описываемого формулой (X), бензофенонимином в присутствии подходящего катализатора, такого как ацетат палладия (II) и BINAP (2,2'бис(дифенилфосфино)-1,1'-бинафтил), и основания, такого как трет-бутоксид натрия, в толуоле при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы приводит к получению желательного соединения, описываемого формулой (XI) . Обработка анилина,описываемого формулой (XI), действием подходящим образом замещенного сульфонилхлорида, такого как метансульфонилхлорид, в присутствии подходящего основания, такого как пиридин либо триэтиламин, в растворителе, таком как этилацетат, при температурах в диапазоне от 0 С до комнатной температуры, предпочтительно приблизительно при комнатной температуре, приводит к получению желательного сульфонамида, описываемого формулой (VIII). Схема III Согласно приведенной ниже схеме IV, обработка бромида, описываемого формулой (X), действием цианида цинка в присутствии подходящего катализатора, такого как тетракистрифенилфосфинпалладий(0) , в растворителях, таких как диметилформамид, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при 85 С,приводит к получению соответствующего нитрила, описываемого формулой (XII). Окисление нитрила,описываемого формулой (XII), под действием разбавленного пероксида водорода в присутствии подходящего основания, полученного с использованием щелочного металла, такого как карбонат натрия, в растворителях, таких как диметилформамид либо диметилсульфоксид, при температурах в диапазоне от 0 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной тем- 11006708 пературе, приводит к получению соответствующего амида, описываемого формулой (XIII). Схема IV Согласно приведенной ниже схеме V, обработка соединения, описываемого формулой (XIV), действием восстановителя, такого как боргидрид натрия, в присутствии комплекса диэтилового эфира и трифторида бора в растворителях, таких как диэтиловый эфир либо тетрагидрофуран, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, приводит к получению желательного соединения, описываемого формулой (XV). Обработка соединения, описываемого формулой (XV), действием трихлорида бора в присутствии соли тетраалкиламмония, такой как иодид тетрабутиламмония, в растворителях, таких как дихлорметан либо дихлорэтан, при температурах в диапазоне от -78 С до приблизительно комнатной температуры, предпочтительно приблизительно при комнатной температуре,приводит к получению соответствующего фенола, описываемого формулой (XVI). Альтернативные условия проведения реакции для упомянутого выше превращения также могут включать обработку действием водных бромисто-водородной кислоты и уксусной кислоты приблизительно при температуре образования флегмы. Схема V Как показано ниже в схеме VI, соединения, описываемые формулой (XVIII), можно получить в результате обработки соединений, описываемых формулой (XVII), действием формиата аммония в присутствии подходящего катализатора, такого как палладий-на-угле, в спиртовых растворителях, таких как метанол либо этанол, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы. В альтернативном варианте обработка соединения, описываемого формулой (XVII), действием газообразного водорода (при давлениях в диапазоне от атмосферного до 50 фунт/дюйм 2) в присутствии подходящего катализатора, такого как палладий-на-угле, в спиртовых растворителях, таких как метанол, при температурах в диапазоне от комнатной температуры до 60 С, предпочтительно приблизительно при 60 С, также приводит к получению соединения, описываемого формулой (XVIII). Схема VI Согласно схеме VII, обработка соединения, описываемого формулой (XVIII), действием подходящим образом замещенного альдегида, описываемого формулой (XIX), и восстановителя, такого как триацетоксиборгидрид натрия, в присутствии уксусной кислоты в растворителях, таких как дихлорметан либо дихлорэтан, при температурах в диапазоне от 0 С до приблизительно комнатной температуры,предпочтительно приблизительно при комнатной температуре, приводит к получению соответствующих соединений, описываемых формулой (XXII). В альтернативном варианте соединения, описываемые формулой (XXII), можно также получить в результате обработки соединения, описываемого формулой(XVIII) , действием подходящего алкилирующего реагента, описываемого формулой (XX). Данная реакция должна быть проведена в присутствии подходящего основания, такого как карбонат калия, в растворителях, таких как ацетонитрил, при температурах в диапазоне от комнатной температуры до приблизи- 12006708 тельно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, что приведет к получению желательных соединений, описываемых формулой (XXII). Реагенты XIX и XX можно получить при использовании способов, которые известны специалисту в соответствующей области. Схема VII Согласно приведенной ниже схеме VIII, можно сказать, что соединения, описываемые формулой(XXIII), можно получить в результате обработки соединения, описываемого формулой (XVIII), действием реагента, описываемого формулой (XXI), где R18 представляет собой кислород либо -NH-. Данная реакция должна быть проведена в присутствии подходящего основания, такого как триэтиламин, в спиртовых растворителях, таких как этанол, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы, предпочтительно приблизительно при температуре образования флегмы, с получением желательного соединения, описываемого формулой (XXIII). В альтернативном варианте соединения, описываемые формулой (XXIII), также можно получить в результате обработки соединения, описываемого формулой (XVIII), действием подходящим образом замещенного хлорангидрида кислоты, описываемого формулой (XXIV). Реакцию необходимо проводить в присутствии подходящего основания, такого как Et3N либо пиридин, в растворителях, таких как тетрагидрофуран либо метиленхлорид, при температуре в диапазоне от 0 С до комнатной температуры, предпочтительно приблизительно при комнатной температуре. Амидные продукты, получаемые в результате данной реакции (не показаны), после этого восстанавливают под действием подходящего восстановителя, такого как литийалюминийгидрид, в растворителях, таких как диэтиловый эфир либо тетрагидрофуран, при температурах в диапазоне от комнатной температуры до приблизительно температуры образования флегмы,предпочтительно приблизительно при температуре образования флегмы, что приведет к получению желательных продуктов, описываемых формулой (XXIII). Реагенты XXI и XXIV можно получить при использовании способов, которые известны специалисту в соответствующей области. Схема VIII Другие соединения, описываемые формулой I, приведенные в настоящем документе, можно получать в результате превращений при использовании способов, которые хорошо известны специалисту в соответствующей области.- 13006708 Стереохимию соединений, описываемых формулой I, синтезированных в соответствии со способами, описанными выше, можно определить при использовании стандартных спектроскопических способов. Выделение экзодиастереомера соединения, описываемого формулой I, из экзоэндосмеси можно провести при использовании стандартных способов разделения, известных специалисту в соответствующей области, например, кристаллизации либо хроматографических способов. Фармацевтически приемлемые соли соединения, описываемого формулой I, можно получить обычным образом в результате обработки раствора либо суспензии соответствующих свободных основания либо кислоты одним химическим эквивалентом фармацевтически приемлемых кислоты либо основания. Для выделения солей можно использовать обычные методики концентрирования либо кристаллизации. Иллюстрациями подходящих кислот являются уксусная, молочная, янтарная, малеиновая, винная, лимонная, глюконовая, аскорбиновая, бензойная, коричная, фумаровая, серная, фосфорная, хлористоводородная, бромисто-водородная, иодисто-водородная, сульфаминовая, сульфоновые кислоты, такие как метансульфоновая, бензолсульфоновая, п-толуолсульфоновая и родственные им кислоты. Иллюстративными основаниями являются натрий, калий и кальций. Соединение данного изобретения можно вводить индивидуально либо в комбинации с фармацевтически приемлемыми носителями, в виде либо одной, либо нескольких доз. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции, полученные в результате комбинирования соединения, описываемого формулой I, или его фармацевтически приемлемой соли, можно затем легко вводить в виде широкого разнообразия лекарственных форм, таких как таблетки, порошки,пастилки, сиропы, растворы для инъекций и тому подобное. Данные фармацевтические композиции могут при желании содержать и дополнительные ингредиенты, такие как вкусовые добавки, связующие,среды для лекарства и тому подобное. Таким образом, для целей перорального введения можно использовать таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и фосфат кальция, наряду с различными разрыхлителями, такими как крахмал, метилцеллюлоза, альгиновая кислота и некоторые сложные силикаты, наряду со связующими, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. В дополнение к этому для целей таблетирования зачастую полезными оказываются смазки, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах. Предпочтительные материалы для данной цели включают лактозу, или молочный сахар, и высокомолекулярные полиэтиленгликоли. Когда для перорального введения будут желательны водные суспензии либо эликсиры, существенный активный ингредиент в них можно будет скомбинировать с различными подсластителями либо вкусовыми добавками, красящим веществом либо красителями и при желании эмульгирующими либо суспендирующими агентами, наряду с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их комбинации. Для парентерального введения можно использовать растворы, содержащие соединение данного изобретения либо его фармацевтически приемлемую соль, в сезамовом либо арахисовом масле, водном пропиленгликоле либо в стерильном водном растворе. Если потребуется, то такие водные растворы в подходящем случае необходимо получать в виде буферных растворов, а жидкий разбавитель сначала должен быть сделан изотоническим с помощью достаточного количества физиологического раствора либо глюкозы. Данные конкретные водные растворы в особенности подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все используемые стерильные водные среды легко можно получить по стандартным методикам, известным специалисту в соответствующей области. Соединение, описываемое формулой I, либо его фармацевтически приемлемую соль можно вводить перорально, трансдермально (например, при использовании наклейки), парентерально (например, внутривенно), ректально, локально либо при использовании ингаляции. В общем случае суточная дозировка при лечении нарушения либо состояния, описанного в настоящем документе, с использованием соединения, описываемого формулой I, будет находиться в диапазоне от приблизительно 0,01 до приблизительно 100 мг на один кг, предпочтительно от приблизительно 0,1 до приблизительно 10 мг на один кг массы тела животного, подвергнутого лечению. В качестве примера соединение, описываемое формулой I, либо его фармацевтически приемлемую соль можно применять при лечении взрослого человека средней массы (приблизительно 70 кг) в виде дозы в диапазоне от приблизительно 0,5 мг вплоть до приблизительно 10 г в день, предпочтительно от приблизительно 10 мг до приблизительно 1 г в день, в виде одной порции либо дробных (то есть нескольких) порций. Медиком-специалистом в соответствующей области могут быть сделаны вариации на основе приведенных выше диапазонов дозировок при учете известных заслуживающих внимания моментов, таких как масса, возраст и состояние животного, подвергнутого лечению, тяжесть состояния и конкретный выбранный способ применения. Найдено, что соединения, описываемые формулой I настоящего изобретения, проявляют активность в анализах на связывание опиоидного рецептора, селективных для мю-, каппа- и дельта-опиоидных рецепторов. Анализы на связывание мю-, каппа- и дельта-опиоидного рецептора можно провести в соответствии со следующей далее методикой. Сродство соединения к дельта-опиоидному рецептору можно оценить, используя связывание ли- 14006708 ганда дельта-опиоидного рецептора [3 Н]-налтриндола с клетками нейробластомы-глиомы NG108-15 в соответствии с модификацией протокола, описанной в работе Law et al. (Law, P. Y., Koehler, J. E. and Loh,H. H., "Comparison of Opiate Inhibition of Adenylate Cyclase Activity in Neuroblastoma N18TG2 and Neuroblastoma X Glioma NG108-15 Hybrid Cell Lines", Molecular Pharmacology, 21: 483-491 (1982. Работа Lawet al. во всей своей полноте включается в настоящий документ для справки. Сродство соединения к каппа-опиоидному рецептору можно оценить при использовании связывания [3 Н]-бремазоцина с каппарецепторами, как это описывается в работе Robson, L. E., et al., "Opioid Binding Sites of the Kappa-type inGuinea-pig Cerebellum", Neuroscience (Oxford), 12 (2): 621-627 (1984). Работа Robson et al. во всей своей полноте включается в настоящий документ для справки. Для оценки соединения на предмет активности в отношении мю-опиоидного рецептора лиганд мю-рецептора [3H]-DAMGO (Perkin Elmer Life Sciences,Boston, Mass.; удельная активность 55 Ки/ммоль, 1,5 нМ) использовали для ткани переднего мозга крысы. Говоря вкратце, связывание инициируют добавлением сырого препарата мембран ткани переднего мозга крысы в 96-луночные полипропиленовые планшеты, содержащие радиолиганд [3 Н]-DAMGO и тестируемое соединение, и проводят инкубирование в течение приблизительно 90 мин приблизительно при 25 С. Анализ завершают, проводя быстрое фильтрование при помощи 50 мМ Трис-НСl, рН 7,4 на WallacFiltermat В и выполняя подсчет с использованием планшет-ридера Betaplate (Wallac). Полученные данные можно проанализировать, воспользовавшись программным обеспечением для проведения анализа с определением IС 50, в системе Graphpad Prism. Значения Ki (константы ингибирования) можно рассчитать при использовании Graphad Prism в соответствии со следующей формулой:Ki=IC50/1+ [3 Н-лиганд]/KD,где IC50 представляет собой концентрацию, при которой 50% 3 Н-лиганда будут вытеснены тестируемым соединением, a KD представляет собой константу диссоциации для 3 Н-лиганда на активном центре рецептора. Биологическая активность Значения Ki для конкретных соединений, описываемых формулой I, из примеров 7, 8 и 9 (см. ниже) определяли в анализе со связыванием мю-опиоидного рецептора для ткани мозга так, как это описывается выше. Обнаружили, что все данные соединения характеризуются значениями Ki, приблизительно равными для мю-рецептора 200 нМ или менее. Соединения, описываемые формулой I, имеют преимущество в биологическом отношении, потому что они не метаболизируются под действием изофермента CYP2D6 р 450. Поскольку для популяции людей характерно непостоянство уровня наличия CYP2D6, выгодно иметь лекарственный препарат, в метаболизме которого CYP2D6 участия не принимает, потому что эффективные дозировки по всей популяции людей не будут зависеть от различий в уровне наличия CYP2D6. Определить, будет ли CYP2D6 принимать участие в метаболизме соединения, можно при использовании CYP2D6, например, приобретаемого у компании PanVera Corporation (Madison, Wisconsin). Идентификацию соединений, которые являются субстратами CYP2D6, можно провести, например, в соответствии со следующим далее анализом. Соединения инкубируют вместе рекомбинантным CYP2D6 человека BACULOSOMES (PanVeraCorporation; Madison, Wisconsin). Говоря более конкретно, при 37 С инкубируют соединение (1 мкМ),rCYP2D6 (2,8 пмоль/мл), буфер (100 мМ, фосфатный, рН=7,4) и НАДФН (1,67 мг/мл, Sigma Aldrich 201210). На 0, 5, 10, 20 и 30 мин отбирают аликвоты (50 мкл) и реакцию быстро прекращают, проводя добавление ледяного буфера, содержащего карбонат натрия (50 мкл, 20 мМ, рН=10,5, с внутренним стандартом). Получающийся в результате раствор экстрагируют (10 х-объем трет-бутилметилового эфира), а образцы анализируют при помощи ЖХ/МС. Отслеживают уменьшение содержания исходного соединения и при помощи WinNonlin рассчитывают период полувыведения для уменьшения содержания исходного соединения. Следующие далее примеры иллюстрируют настоящее изобретение. Однако необходимо понимать,что изобретение, полностью описанное в настоящем документе и изложенное в формуле изобретения, не предполагает наложения ограничений в виде подробностей следующих далее примеров. Примеры Получение 1. 1-(3,5-дифторфенил)пропилиденгидразин К перемешиваемому раствору 1-(3,5-дифторфенил)пропан-1-она (5,00 г, 29,40 ммоль) в 5,0 мл СН 3 ОН добавляли раствор гидразина (35% в Н 2 О, 42,00 мл, 29,40 ммоль). После этого смесь нагревали до 75 С в течение 1 ч, охлаждали до комнатной температуры и выливали в равные количества CH2Cl2 и Н 2 О. После этого органический слой собирали и промывали при помощи насыщенного раствора NaCl. Затем органический слой высушивали над MgSO4 и концентрировали при пониженном давлении до получения смеси гидразоновых изомеров с составом 8:1 (5,53 г, 95%) в виде желтого масла. (Основной изомер) 400 МГц 1 Н ЯМР (CDCl3)7,11-7,16 (м, 2 Н) , 6,65-6,71 (м, 1 Н), 5,52 (ушир.с, 2 Н), 2,53 (кв,J=7,88 Гц, 2 Н), 1,18 (т, J=7,05 Гц, 3 Н). Следующие далее соединения получали при использовании методики получения 1.(ушир.с, 2 Н), 2,44-2,48 (м, 2 Н), 1,45-1,49 (м, 2 Н), 0,91-0,94 (м, 3 Н). 1-(3-бромфенил)-2-метилпропилиденгидразин 400 МГц 1 Н ЯМР (CDCl3)7,46-7,50 (м, 1 Н), 7,25-7,31 (м, 2 Н), 7,07-7,09 (м, 1 Н), 4,92 (ушир.с, 2 Н),2,61-2,68 (м, 1 Н), 1,03 (д, J=6,6 Гц, 6 Н); МС (М+1) 241,1. Получение 2 Экзо-3-бензил-6-(3,5-дифторфенил)-6-этил-3-азабицикло [3.1.0]гексан-2,4-дион К перемешиваемому раствору 1-(3,5-дифторфенил)пропилиденгидразина (полученного так, как описывается в получении 1, 5,40 г, 29,40 ммоль) в 60,0 мл диоксана при комнатной температуре добавляли МnО 2. Смесь перемешивали в течение 45 мин и черную суспензию, которая образовывалась к данному моменту, отфильтровывали через прокладку из целита, которую после этого промывали при помощи 20,0 мл диоксана. Получающийся в результате темно-красный раствор затем обрабатывали порциями 1 бензилпиррол-2,5-диона в течение периода времени продолжительностью в 20 мин. Смесь перемешивали при комнатной температуре в течение 1,75 ч. После этого ее нагревали до 100 С в течение 21 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. После этого светло-желтое масло обрабатывали действием теплого СН 3 ОН, а белый осадок отфильтровывали. Твердую фазу перекристаллизовывали из СН 3 ОН и получали желательный продукт (6,46 г, 64 %) в виде белой твердой фазы. 400 МГц 1 Н ЯМР (CDCl3)7,37-7,40 (м, 2 Н), 7,22-7,30 (м, 3 Н), 6,77-6,82 (м, 2 Н), 6,67-6,72 (м, 1 Н),4,58 (с, 2 Н), 2,69 (с, 2 Н), 1,39 (кв, J=7,47 Гц, 2 Н), 0,67 (т, J=7,47 Гц, 3 Н). Следующие далее соединения получали при использовании методики получения 2. Экзо-3-бензил-6-(3-бром-5-фторфенил)-6-этил-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CDCl3)7,37-7,40 (м, 2 Н), 7,25-7,31 (м, 4 Н), 7,12-7,15 (м, 1 Н), 6,91-6,95 (м, 1 Н),4,58 (с, 2 Н), 2,69 (с, 2 Н), 1,39 (кв, 7,47, 2 Н), 0,67 (т, J=7,47 Гц, 3 Н). Экзо-3-бензил-6-этил-6-(3-метоксифенил)-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CDCl3)7,38-7,41 (м, 2 Н), 7,17-7,30 (м, 4 Н), 6,83-6,85 (м, 1 Н), 6,75-6,79 (м, 2 Н),4,58 (с, 2 Н), 3,76 (с, 3 Н), 2,72 (с, 2 Н), 1,41 (кв, J=7,47 Гц, 2 Н), 0,67 (т, J=7,47 Гц). Экзо-3-бензил-6-(3-бромфенил)-6-этил-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CDCl3)7,36-7,43 (м, 4 Н), 7,15-7,30 (м, 5 Н), 4,58 (с, 2 Н), 2,70 (с, 2 Н), 1,40 (кв,J=7,47 Гц, 2 Н), 0,66 (т, J=7,47 Гц, 3 Н). Экзо-3-бензил-6-этил-6-(3-нитрофенил)-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CD3OD)8,18-8,21 (м, 2 Н), 7,77-7,79 (м, 1 Н), 7,61 (т, 1 Н), 7,38-7,41 (м, 2 Н), 7,237,33 (м, 3 Н), 4,62 (с, 2 Н), 2,95 (с, 2 Н), 1,46 (кв, 2 Н), 0,67 (т, 3 Н). Экзо-3-бензил-6-(3,5-дибромфенил)-6-этил-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CDCl3)7,55 (с, 1 Н), 7,25-7,40 (м, 7 Н), 4,58 (с, 2 Н), 2,68 (с, 2 Н), 1,37 (кв, 2 Н),0,66 (т, J=7,47 Гц, 3 Н). Экзо-3-бензил-6-(3-бромфенил)-6-пропил-3-азабицикло[3.1.0]гексан-2,4-дион 400 МГц 1 Н ЯМР (CD3OD)7,46-7,47 (м, 1 Н), 7,36-7,41 (м, 3 Н), 7,20-7,30 (м, 5 Н), 4,57 (с, 2 Н), 2,82(с, 2 Н), 1,18-1,25 (м, 1 Н), 0,67 (д, J=6,6 Гц, 6 Н); МС (М+1) 400,0. Получение 3. Экзо-6-(3-аминофенил)-3-бензил-6-этил-3-азабицикло[3.1.0]гексан-2,4-дион Раствор экзо-3-бензил-6-этил-6-(3-нитрофенил)-3-азабицикло[3.1.0]гексан-2,4-диона, полученного так, как описывается в получении 2, 15,2 г, 43,4 ммоль, в 150 мл этилацетата обрабатывали действием 30- 16006708 фунт/дюйм 2 Н 2 и 10% Pd (С) (750 мг) в течение 6 ч при комнатной температуре. Смесь отфильтровывали через прокладку из целита и концентрировали с получением 14 г желательного продукта. 400 МГц 1 Н ЯМР (CD3OD)7,38-7,40 (м, 2 Н), 7,23-7,35 (м, 3 Н), 7,14 (т, 1 Н), 6,67 (с, 1 Н), 6,58-6,61 (м, 2 Н), 4,60 (с,2 Н), 2,79 (с, 2 Н), 1,36-1,42 (м, 2 Н), 0,65-0,71 (м, 3 Н); МС (М+1) 362,2. Экзо-N-[3-(3-бензил-6-этил-2,4-диоксо-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид К перемешиваемому раствору экзо-6-(3-аминофенил)-3-бензил-6-этил-3-азабицикло[3.1.0]гексан 2,4-диона (полученного так, как описывается выше, 25 г, 78,1 ммоль) в этилацетате добавляли метансульфонилхлорид (6,35 мл, 82,2 ммоль) и триэтиламин (13,1 мл, 93,8 ммоль). Раствор нагревали до комнатной температуры и перемешивали в течение 16 ч. Образовавшийся твердый осадок отфильтровывали,а оставшийся раствор обрабатывали действием 1 н. НСl, насыщенного солевого раствора и воды. Органический слой высушивали при помощи MgSO4, отфильтровывали и концентрировали. Оставшийся сырой материал растирали с Et2O с получением 30 г желательного продукта. 400 МГц 1 Н ЯМР (CDCl3)7,407,46 (м, 2 Н), 7,22-7,37 (м, 5 Н), 7,11-7,20 (м, 2 Н), 4,60 (с, 2 Н), 3,05 (с, 3 Н), 2,77 (с, 2 Н), 1,38-1,42 (м, 2 Н),0,65-0,71 (м, 3 Н): МС (М+1) 399,2. Пример 1. Экзо-N-[3-(3-бензил-6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид К охлажденной суспензии экзо-N-[3-(3-бензил-6-этил-2,4-диоксо-3-азабицикло[3.1.0]гекс-6 ил)фенил]метансульфонамида (полученного так, как описывается выше, 30 г, 75,4 ммоль) в ТГФ при -5 С добавляли боргидрид натрия (6,0 г, 158,3 ммоль) с последующим медленным добавлением комплекса диэтилового эфира и трифторида бора (26,8 мл, 211,1 ммоль). Смесь оставляли разогреваться до комнатной температуры и перемешивали в течение 2 ч. После этого ее нагревали до температуры образования флегмы в течение 16 ч. После этого смесь охлаждали до 0 С и осторожно по каплям добавляли пиперазин (30 г) в 300 мл Н 2O. Смесь перемешивали при комнатной температуре в течение 2 ч и разбавляли при помощи Et2O. Слои разделяли, водный слой экстрагировали при помощи Et2O и объединенные органические слои высушивали и концентрировали. После очистки получали 19,2 г желательного продукта. 400 МГц 1 Н ЯМР (CD3OD)7,28-7,33 (м, 4 Н), 7,19-7,23 (м, 2 Н), 7,15 (с, 1 Н), 7,05-7,11 (м, 2 Н), 3,64(с, 2 Н), 2,91-2,97 (м, 2 Н), 2,90 (с, 3 Н), 2,82-2,88 (м, 2 Н), 1,96-2,05 (м, 2 Н), 1,79-1,82 (м, 2 Н), 0,83 (т, 3 Н). Пример 2. Экзо-3-бензил-6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гексан В высушенной в пламени стеклянной емкости в атмосфере N2 в 100 мл безводного ТГФ объединяли экзо-3-бензил-6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0] гексан-2,4-дион (полученный так, как описывается в получении 2, 2,95 г, 8,64 ммоль) и боргидрид натрия (689 мг, 18,15 ммоль). Смесь охлаждали до -5 С и по каплям добавляли комплекс диэтилового эфира и трифторида бора (2,67 мл, 24,19 ммоль). Смесь оставляли разогреваться до комнатной температуры и перемешивали в течение 2 ч. После этого ее нагревали до температуры образования флегмы в течение 3 ч. После этого смесь охлаждали до 0 С и осторожно по каплям добавляли пиперазин (4,46 г, 51,85 ммоль) в 30 мл Н 2 О. Затем реакционную смесь нагревали до температуры образования флегмы в течение 18 ч. После этого смесь оставляли охлаждаться до комнатной температуры, после чего ее разбавляли, используя Н 2 О, и два раза экстрагировали при помощи этилацетата. Объединенные экстракты два раза промывали при помощи Н 2 О, один раз промывали, используя насыщенный раствор NaCl, и высушивали над MgSO4. После этого жидкость концентрировали при пониженном давлении и получали желательный продукт (2,62 г, 97%) в виде прозрачного бесцветного масла. 400 МГц 1 Н ЯМР (CDCl3)7,27-7,32 (м, 5 Н), 6,70-6,76 (м, 2 Н), 6,55-6,60 (м, 1 Н), 3,65(ушир.с, 2 Н), 3,03 (д, 2 Н), 2,79 (ушир.с, 2 Н), 2,00-2,07 (м, 2 Н), 1,74 (с, 2 Н), 0,83 (т, 3 Н). Следующие далее соединения получали в соответствии с методикой примера 2. Экзо-3-бензил-6-(3-бром-5-фторфенил)-6-этил-3-азабицикло[3.1.0]гексан 400 МГц 1 Н ЯМР (CDCl3)7,23-7,32 (м, 4 Н), 7,15-7,22 (м, 2 Н), 6,96-7,03 (м, 1 Н), 6,85-6,88 (м, 1 Н),3,64 (с, 2 Н), 3,04 (д, J=10,0 Гц, 2 Н), 2,76-2,78 (м, 2 Н), 2,02-2,08 (м, 2 Н), 1,73 (д, J=l,6 Гц, 2 Н), 0,83 (т, 3 Н). Экзо-3-бензил-6-(3-бромфенил)-6-этил-3-азабицикло[3.1.0]гексан 400 МГц 1 Н ЯМР (CDCl3)7,39-7,40 (м, 1 Н), 7,21-7,34 (м, 6 Н), 7,09-7,18 (м, 2 Н), 3,66 (с, 2 Н), 3,05(полученного так, как описывается в примере 2, 3,2 г, 8,98 ммоль) в 25 мл безводного толуола при комнатной температуре добавляли бензофенонимин (1,81 мл, 10,8 ммоль), BINAP (8 мг, 0,013 ммоль), ацетат палладия (II) (2,0 мг, 0,009 ммоль) и трет-бутоксид натрия (1,2 г, 12,57 ммоль). Смесь охлаждали до-78 С и из нее удаляли кислород, используя вакуум/продувку N2. Смесь нагревали при осторожной дефлегмации в течение 16 ч и охлаждали до комнатной температуры. Смесь после этого обрабатывали действием 7 мл концентрированной НСl и 30 мл воды и нагревали при температуре образования флегмы в течение 4 ч. Смесь охлаждали до 0 С, а рН доводили до 12 действием 1 н NaOH. Слои разделяли, водный слой экстрагировали при помощи CH2Cl2 (3x30 мл) и объединенные органические слои высушивали и концентрировали до получения 1,87 г продукта. Сырой анилин использовали на следующей стадии без очистки. К перемешиваемому раствору анилина (1,0 г, 3,4 2 ммоль), полученному выше, в 10 мл безводного пиридина при 0 С добавляли 2-метоксиэтансульфонилхлорид (814 мг, 5,13 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Добавляли холодный насыщенныйNaHCO3 и смесь разбавляли при помощи этилацетата. Слои разделяли, водный слой экстрагировали, используя этилацетат, и объединенные органические слои высушивали над MgSO4 и концентрировали. Сырой материал подвергали очистке с помощью флэш-хроматографии, используя 70%-ный этилацетат/гексаны, и получали 1,1 г чистого продукта. 400 МГц 1H ЯМР (CDCl3)7,23-7,30 (м, 5 Н), 7,13-7,20 (м, 2 Н), 7,01-7,08 (м, 2 Н), 3,78 (т, J=5,6 Гц,2 Н), 3,64 (с, 2 Н), 3,36 (с, 3 Н), 3,21 (т, J=5,6 Гц, 2 Н), 3,19 (Д, J=9, 9 Гц, 2 Н), 2,76-2,79 (м, 2 Н), 2,02-2,07 (м,2 Н), 1,73-1,75 (м, 2 Н), 0,83 (т, 3 Н); МС (М+1) 415,1. Следующие далее соединения получали в соответствии с методикой примера 3.(полученного так, как описывается в примере 2, 5,0 г, 14,0 ммоль) в 75 мл безводного ДМФА при комнатной температуре добавляли цианид цинка (2,5 г, 21,0 ммоль) и тетракистрифенилфосфинпалладий(0)(8,1 г, 7,0 ммоль). Смесь охлаждали до -78 С и из нее удаляли кислород, используя вакуум/продувку N2. Смесь нагревали до комнатной температуры, а после этого нагревали при 85 С в течение 3 ч. Смесь охлаждали до комнатной температуры и разбавляли, используя этилацетат и воду. Слои разделяли, водный слой экстрагировали при помощи этилацетата, объединенные органические слои высушивали над MgSO4 и фильтровали через небольшую прокладку из силикагеля. Раствор концентрировали и получали сырой нитрил (3,4 г), который использовали без очистки. К перемешиваемому раствору нитрила, полученного выше, (3,4 г, 11,2 ммоль) в 90 мл ДМСО при комнатной температуре добавляли 30% Н 2 О 2 (5,7 мл, 56 ммоль) и карбонат калия (216 мг, 1,57 ммоль). После перемешивания в течение 3,5 ч смесь разбавляли, используя воду, и экстрагировали при помощи этилацетата. Объединенные органические слои высушивали над MgSO4 и концентрировали до получения- 18006708 3,17 г продукта. 400 МГц 1H ЯМР (CDCl3)7,30-7,39 (м, 5 Н), 7,09 (т, 1 Н), 6,70-6,71 (м, 1 Н), 6,61-6,63 (м,1 Н), 6,49-6,51 (м, 1 Н), 3,70 (с, 2 Н), 3,56 (ушир.с, 2 Н), 3,04-3,10 (м, 2 Н), 2,82-2,87 (м, 2 Н), 2,04-2,10 (м,2 Н), 1,77-1,79 (м, 2 Н), 0,85-0,89 (м, 3 Н). Следующее далее соединение получали в соответствии с методикой примера 4. Экзо-3-(3-бензил-6-этил-3-азабицикло[3.1.0] гекс-6-ил)-5-фторбензамид 400 МГц 1 Н ЯМР (CDCl3)7,47 (с, 1 Н), 7,21-7,34 (м, 6 Н), 7,07-7,10 (м, 1 Н), 6,07 (ушир.с, 1 Н), 5,90(полученного так, как описывается в примере 2, 2,63 г, 8,55 ммоль) в 42 мл безводного метиленхлорида при -78 С добавляли TBAI (7,9 г, 21,4 ммоль) и 1 М раствор трихлорида бора (38,5 мл, 38,5 ммоль). Реакционную смесь нагревали до 0 С и перемешивали в течение 3 ч. Добавляли холодный водный NaHCO3,реакционную смесь разбавляли при помощи метиленхлорида и слои разделяли. Водный слой экстрагировали, используя метиленхлорид, объединенные органические слои высушивали над безводным MgSO4 и концентрировали. Сырой материал очищали, используя флэш-хроматографию, и получали желательный фенол. 400 МГц 1H ЯМР (CDCl3)7,21-7,38 (м, 5 Н), 7,05 (т, J=7,9 Гц, 1 Н), 6,73 (д, J=7,5 Гц, 1 Н), 6,666,68 (м, 1 Н), 6,59-6,61 (м, 1 Н), 6,00 (ушир.с, 1 Н), 3,67 (с, 2 Н), 2,79-2,95 (м, 4 Н), 1,82-1,88 (м, 2 Н), 1,771,80 (м, 2 Н), 0,81-0,85 (м, 3 Н); МС (М+1) 294,5. Пример 6. Экзо-6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гексан К перемешиваемому раствору экзо-3-бензил-6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гексана (полученного так, как описывается в примере 2, 459 мг, 1,465 ммоль) и формиата аммония (277 мг, 4,395 ммоль) в 14,0 мл СН 3 ОН добавляли палладий-на-угле (10% Pd, 184 мг). После этого смесь нагревали до температуры образования флегмы в течение 4 ч, охлаждали до комнатной температуры и фильтровали через прокладку из целита, промывая при помощи СН 3 ОН. После этого фильтрат концентрировали при пониженном давлении и получали маслянистые белые твердые частицы (343 мг). Затем твердые частицы растворяли в CH2Cl2, подщелачивали при помощи 1 М NaOH (водный) и нейтрализовали, используя НСl (водный) и NаНСО 3 (водный). Водный слой после этого экстрагировали три раза при помощи СН 2 Сl2. Объединенные экстракты высушивали над MgSO4 и концентрировали при пониженном давлении до получения желательного продукта (105 мг, 32%) в виде прозрачного, бесцветного масла. 400 МГц 1H ЯМР (CD3OD)6,83-6,90 (м, 2 Н), 6,68-6,77 (м, 1 Н), 3,46-3,58 (м, 3 Н), 3,19 (д, J=12,4 Гц, 1 Н), 2,10-2,17 (м, 1 Н), 1,86-1,87 (м, 1 Н), 1,60-1,67 (м, 2 Н), 0,78-0,85 (м, 3 Н). Альтернативные условия проведения реакции для данного способа описываются согласно примеру,приведенному ниже. Экзо-3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)-5-фторбензамид В колбе Парра объемом 500 мл в 60 мл метанола при комнатной температуре растворяли экзо-3-(3 бензил-6-этил-3-азабицикло[3.1.0]гекс-6-ил)-5-фторбензамид (полученный так, как описывается в примере 7, 1,40 г, 4,14 ммоль). К данному раствору добавляли 350 мг 10% Pd (С). Смесь гидрировали при 50 фунт/дюйм 2 Н 2 при 60 С в течение 18 ч. Смесь охлаждали до комнатной температуры и фильтровали через прокладку из целита, а прокладку промывали несколько раз метанолом. Получающийся в результате раствор концентрировали при пониженном давлении и получали 1,3 г желательного продукта. 400 МГц 1 Н ЯМР (CD3OD)7,63 (с, 1 Н), 7,46 (д, J=8,7 Гц, 1 Н), 7,25 (д, J=8,7 Гц, 1 Н), 3,78-3,82 (м, 2 Н), 3,23-3,31(м, 2 Н), 2,33 (ушир.с, 2 Н), 1,63-1,69 (м, 2 Н), 0,85 (т, 3 Н); МС (М+1) 249,1. Следующие далее соединения получали в соответствии с двумя методиками примера 6. Экзо-N-[3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)-5-фторфенил]метансульфонамид 400 МГц 1H ЯМР (CD3OD)6,89 (с, 1 Н), 6,79-6,81 (м, 1 Н), 6,69-6,72 (м, 1 Н), 3,21-3,28 (м, 2 Н), 3,053,08 (м, 2 Н), 2,92 (с, 3 Н), 1,92-1,94 (м, 2 Н), 1,61-1,67 (м, 2 Н), 0,83 (т, 3 Н); МС (М+1) 299,1. Экзо-3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенол 400 МГц 1H ЯМР (CD3OD)7,05 (т, J=7,5 Гц, 1 Н), 6,66-6,70 (м, 2 Н), 6,57-6,59 (м, 1 Н), 3,37-3,41 (м,2 Н), 3,11-3,16 (м, 2 Н), 2,00-2,02 (м, 2 М), 1,57-1,62 (м, 2 Н), 0,79-0,84 (м, 3 Н); МС (М+1) 204,3. Экзо-N-[3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенил]метансульфонамид 400 МГц 1H ЯМР (CD3OD)7,29 (т, 1 Н), 7,19-7,22 (м, 1 Н), 7,09-7,12 (м, 1 Н), 3,71-3,78 (м, 2 Н), 3,283,31 (м, 2 Н), 2,95 (с, 3 Н), 2,30-2,38 (м, 2 Н), 1,59-1,64 (м, 2 Н), 0,86 (т, 3 Н). Экзо-3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)бензамид 400 МГц 1 Н ЯМР (CD3OD)7,61-7,80 (м, 2 Н), 7,26-7,41 (м, 2 Н), 3,21-3,33 (м, 2 Н), 3,12-3,20 (м, 2 Н),- 19006708 1,88-1,97 (м, 2 Н), 1,77-1,83 (м, 2 Н), 0,79 (т, 3 Н); МС (М+1) 231,3.[3-(6-этил-3-азабицикло[3.1.0]гекс-6-ил)фенил]амид экзоэтансульфоновой кислоты 400 МГц 1 Н ЯМР (CD3OD)7,01-7,21 (м, 4 Н), 3,18-3,21 (м, 2 Н), 2,99-3,05 (м, 4 Н), 1,88-1,90 (м, 2 Н),1,63 (кв, J=7,5 Гц, 2 Н), 1,25 (т, J=7,5 Гц, 3 Н), 0,81 (т, J=7,5 Гц, 3 Н); МС (М+1) 295,2. Пример 7. Общая методика восстановительного алкилирования с получением соединений, описываемых формулой (XXII) К перемешиваемому раствору 1,0 эквивалента соединения, описываемого формулой XVIII, в метиленхлориде (0,2 М) при комнатной температуре добавляли альдегид, описываемый формулой XIX, (2,0 эквивалента), уксусную кислоту (2,0 эквивалента) и триацетоксиборгидрид натрия (2,0 эквивалента). Реакционные смеси перемешивали при комнатной температуре в течение вплоть до 24 ч. После этого реакции в смесях быстро прекращали в результате добавления насыщенного раствора бикарбоната натрия и проводили экстрагирование при помощи метиленхлорида. Объединенные органические слои высушивали над безводным MgSO4 и концентрировали при пониженном давлении. Получающийся в результате сырой материал очищали, используя флэш-хроматографию, и получали желательные третичные амины с выходом 40-95%. Следующие далее соединения получали при использовании приведенной выше методики примера 7, начиная с подходящего исходного амина, описываемого формулой (XVIII), и подходящего альдегидного реагента, описываемого формулой (XIX). Кроме этого фармацевтически приемлемые соли соединений, перечисленных ниже, можно получать следующим образом. К перемешиваемому раствору соединений, описываемых общей формулой(XXII) (полученных так, как описывается выше в примере 7, 1,0 эквивалент) в подходящем растворителе,таком как метилэтилкетон, метиленхлорид/метанол (1:1) либо метанол (0,1 М), при комнатной температуре одной порцией добавляли подходящую кислоту, такую как лимонная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота либо бензолсульфоновая кислота (1,0 эквивалент). Получающуюся в результате смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и в течение этого времени формировался осадок. Фильтрование твердой фазы и высушивание при пониженном давлении приводили к получению желательных солей. Экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид 400 МГц 1H ЯМР (CDCl3)7,16-7,23 (м, 2 Н), 6,98-7,09 (м, 3 Н), 2,94-2,97 (м, 4 Н), 2,81-2,84 (м, 2 Н),2,516 (с, 2 Н), 1,21-1,94 (м, 16 Н), 0,76 (т, J=7,4 Гц, 3 Н); МС (М+1) 421,2. Экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид цитрат Температура плавления 85-90 С. Экзо-N-(3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид 400 МГц 1H ЯМР (CDCl3)7,19-7,23 (м, 1 Н), 7,09 (м, 1 Н), 7,02-7,05 (м, 2 Н), 3,37 (с, 2 Н), 3,00-3,02(с, 3 Н), 3,18-3,21 (м, 2 Н), 2,88-2,95 (м, 4 Н), 2,53 (с, 2 Н), 1,73-1,83 (м, 4 Н), 1,19-1,62 (м, 14 Н), 0,79 (т, J=7,4 Гц, 3 Н); МС (М+1) 465,1. 3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил) амида экзо-2 метоксиэтансульфоновой кислоты Температура плавления 120-124 С. Экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил-5-фторфенил)метансульфонамид 400 МГц 1H ЯМР (CDCl3)6,84-6,88 (м, 2 Н), 6,68-6,71 (м, 1 Н), 2,97-2,99 (м, 5 Н), 2,82-2,85 (м, 2 Н),2,54 (с, 2 Н), 1,73-1,78 (м, 4 Н), 1,23-1,64 (м, 14 Н), 0,78 (т, J=7,4 Гц, 3 Н): МС (М+1) 439,3. Экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил-5 фторфенил)метансульфонамид мезилат Температура плавления 85-88 С. Экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил-5-фторбензамид 400 МГц 1 Н ЯМР (CDCl3)7,47 (м, 1 Н), 7,28-7,31 (м, 1 Н), 7,04-7,07 (м, 1 Н), 6,38 (с, 1 Н), 5,98 (с,1 Н), 3,02-3,04 (м, 2 Н), 2,88-2,91 (м, 2 Н), 2,57 (м, 2 Н), 1,87-1,88 (м, 2 Н), 1,76-1,81 (м, 2 Н), 1,19-1,624 (м,14 Н), 0,780 (т, J=7,4 Гц); МС (М+1) 389,2. Экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-ил-5-фторбензамид тозилат Температура плавления 118-123 С.(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)амидцитрат экзо-1-метил-1 Н-имидазол-4-сульфоновой кислоты Температура плавления 145-148 С. Экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенол 400 МГц 1H ЯМР (CDCl3)7,03 (т, J=7,6 Гц, 1 Н), 6,63-6,67 (м, 3 Н), 3,04-3,07 (м, 2 Н), 2,61-2,64 (м,2 Н), 2,52 (с, 2 Н), 1,72-1,75 (м, 2 Н), 1,17-1,65 (м, 17 Н), 7,6 (т, J=7,2 Гц, 3 Н); МС (М+1) 344,3. Экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенол цитрат Температура плавления 147-152 С. Экзо-N-(3-6-этил-3-[3-(1-нитроциклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид 400 МГц 1H ЯМР (CDCl3)7,21-7,26 (м, 1 Н), 7,02-7,11 (м, 3 Н), 2,99 (с, 3 Н), 2,94-2,96 (м, 2 Н), 2,692,73 (м, 2 Н), 2,38-2,43 (м, 4 Н), 1,93 (кв, J=7,47 Гц, 2 Н), 1,83-1,87 (м, 2 Н), 1,73-1,75 (м, 2 Н), 1,54-1,65 (м,5 Н), 1,31-1,48 (м, 5 Н), 0,81 (т, J=7,5 Гц, 3 Н); МС (М+1) 450,3. Экзо-N-(3-3-[3-(1-аминоциклогексил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид 400 МГц 1H ЯМР (CDCl3)7,14-7,17 (м, 1 Н), 6,98-7,05 (м, 3 Н), 3,26-3,35 (ушир.с, 3 Н), 2,92 (с, 3 Н),2,86-2,89 (м, 2 Н), 2,73-2,75 (м, 2 Н), 2,36-2,39 (м, 2 Н), 1,83-1,89 (м, 2 Н), 1,69 (с, 2 Н), 1,21-1,39 (м, 14 Н),0,73-0,76 (м, 3 Н); МС (М+1) 420,3. Экзо-N-(1-3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексил)ацетамид 400 МГц 1H ЯМР (CDCl3)7,19-7,23 (м, 1 Н), 7,12-7,13 (м, 1 Н), 7,04-7,07 (м, 2 Н), 5,29 (с, 1 Н), 2,97(кв, J=7,5 Гц, 2 Н), 1,43-1,64 (м, 9 Н), 1,29-1,42 (м, 8 Н), 0,76 (т, J=7,5 Гц, 3 Н); МС (М+1) 435,4. Пример 8. Общая методика получения соединений, описываемых формулой (XXIII) К перемешиваемому раствору соединения, описываемого формулой XVIII, в этаноле (0,1 М) при комнатной температуре добавляли триэтиламин (3 эквивалента) и подходящий реагент, описываемый формулой (XXI), (1,2 эквивалента). Получающуюся в результате смесь нагревали до 80 С в течение 1-5 ч и после этого охлаждали до комнатной температуры. Смесь концентрировали при пониженном давлении и получающийся в результате сырой материал очищали, используя флэш-хроматографию, и получали желательные третичные амины с выходом 50-90%. Следующие далее соединения получали при использовании приведенной выше методики примера 8, начиная с подходящего исходного амина, описываемого формулой (XVIII), и подходящего реагента,описываемого формулой (XXI). Кроме этого фармацевтически приемлемые соли соединений, перечисленных ниже, можно получать следующим образом. К перемешиваемому раствору соединений, описываемых общей формулой(XXIII) (полученных так, как описывается выше в примере 8, 1,0 эквивалент), в подходящем растворителе, таком как метилэтилкетон, метиленхлорид/метанол (1:1) либо метанол (0,1 М), при комнатной температуре одной порцией добавляли подходящую кислоту, такую как лимонная кислота, птолуолсульфоновая кислота, метансульфоновая кислота либо бензолсульфоновая кислота (1,0 эквивалент). Получающуюся в результате смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и в течение этого времени формировался осадок. Фильтрование твердой фазы и высушивание при пониженном давлении приводили к получению желательных солей. Экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0] гекс-6-ил]-5-фторбензамид 400 МГц 1 Н ЯМР (CDCl3)7,52-7,53 (м, 1 Н), 7,29-7,23 (м, 1 Н), 7,11-7,23 (м, 5 Н), 6,18-6,25 (м, 2 Н),3,22-3,2 (м, 2 Н) , 3,06-3,11 (м, 2 Н), 2,95-3,00 (м, 4 Н), 2,83 (с, 2 Н), 1,86-1,95 (м, 4 Н), 0,82-0,83 (м, 3 Н). Экзо-N-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид 400 МГц 1H ЯМР (CDCl3)7,10-7,25 (м, 7 Н), 6,99-7,05 (м, 1 Н), 3,19-3,22 (м, 2 Н), 3,06-3,09 (м, 2 Н),2,96-2,98 (м, 7 Н), 2,81 (с, 2 Н), 1,83-1,90 (м, 4 Н), 0,830 (т, J=7,4 Гц, 3 Н); МС (М+1) 427,1. Экзо-N-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид мезилат Температура плавления 210-230 С. Экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид 400 МГц 1H ЯМР (CD3OD)7,76 (с, 1 Н), 7,63-7,65 (м, 1 Н), 7,41-7,44 (м, 1 Н), 7,31-7,35 (м, 1 Н), 7,127,14 (м, 2 Н), 7,0-7,09 (м, 2 Н), 3,18-3,28 (м, 2 Н), 3,05-3,10 (м, 2 Н), 2,98-3,00 (м, 2 Н), 2,86-2,89 (м, 2 Н), 2,73(с, 2 Н), 1,94-1,99 (м, 2 Н), 1,81-1,84 (м, 2 Н), 0,79 (т, J=7,4 Гц, 3 Н). Экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид цитрат Температура плавления 120-124 С. 3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фениламид экзо-2-метоксиэтансульфоновой кислоты 400 МГц 1H ЯМР (CDCl3)7,10-7,27 (м, 6 Н), 7,00-7,07 (м, 2 Н), 3,75-3,78 (м, 2 Н), 3,34 (с, 3 Н), 3,183,23 (м, 4 Н), 3,01-3,0 (м, 2 Н), 2,93-2,97 (м, 4 Н), 2,800 (с, 2 Н), 1,80-1,89 (м, 4 Н), 0,82-0,89 (м, 3 Н); МС(с, 3 Н), 2,32 (м, 2 Н), 1,79 (кв, J=7,5 Гц, 2 Н), 1,26 (т, J=7,5 Гц, 3 Н), 0,85 (т, J=7,5 Гц, 3 Н); МС (М+1) 441,6. Пример 9. Альтернативная общая методика получения соединений, описываемых формулой (XXIII) К перемешиваемому раствору 1,0 эквивалента соединения, описываемого формулой (XVIII), в безводном ТГФ (0,1 М) при комнатной температуре добавляли Et3N (5,0 эквивалентов) либо пиридин (5,0 эквивалентов) и хлорангидрид подходящим образом замещенной кислоты (2,0 эквивалента), описываемый формулой (XXIV). После перемешивания в течение вплоть до 24 ч реакцию быстро прекращали в результате добавления насыщенного NaHCO3 и проводили разбавление метиленхлоридом. Слои разделяли, водный слой экстрагировали, пользуясь метиленхлоридом, и объединенные органические слои высушивали над безводным MgSO4 и концентрировали. Получающийся в результате сырой материал использовали на следующей стадии без очистки. К перемешиваемому раствору 1,0 эквивалента амида, полученного выше, в ТГФ (0,2 М) при комнатной температуре добавляли литийалюминийгидрид (4,0 эквивалента). Получающуюся в результате смесь нагревали до 70 С в течение вплоть до 5 ч и после этого охлаждали до комнатной температуры. Реакцию осторожно прекращали в результате медленного добавления смеси Na2SO410 Н 2 О/целит с составом 1:1. Получающуюся в результате суспензию перемешивали при комнатной температуре в течение вплоть до 16 ч. Суспензию разбавляли, используя ТГФ, и фильтровали через прокладку из целита, а прокладку промывали несколько раз раствором СН 2 Сl2/МеОН с составом 9:1. Получающийся в результате раствор концентрировали до получения сырого материала, который очищали, используя флэшхроматографию, что в результате давало желательные третичные амины, описываемые формулой(XXIII), с выходом 40-80%. Следующие далее соединения получали при использовании приведенной выше методики примера 9, начиная с подходящего исходного амина, описываемого формулой (XVIII), и подходящего хлорангидридного реагента, описываемого формулой (XXIV). Кроме этого, фармацевтически приемлемые соли соединений, перечисленных ниже, можно получать следующим образом. К перемешиваемому раствору соединений, описываемых общей формулой(XXIII) (полученных так, как описывается выше в примере 9, 1,0 эквивалент), в подходящем растворителе, таком как метилэтилкетон, метиленхлорид/метанол (1:1) либо метанол (0,1 М), при комнатной температуре одной порцией добавляли подходящую кислоту, такую как лимонная кислота, птолуолсульфоновая кислота, метансульфоновая кислота либо бензолсульфоновая кислота (1,0 эквивалент). Получающуюся в результате смесь перемешивали при комнатной температуре в течение вплоть до 18 ч, и в течение этого времени формировался осадок. Фильтрование твердой фазы и высушивание при пониженном давлении приводили к получению желательных солей.(м, 2 Н), 3,65 (с, 3 Н), 2,95-3,18 (м, 4 Н), 2,82-2,84 (м, 2 Н), 2,52-2,65 (м, 3 Н), 2,47-2,49 (м, 2 Н), 1,90-1,96 (м,2 Н), 1,70-1,71 (м, 2 Н), 0,72 (т, J=7,4 Гц, 3 Н); МС (М+1) 477,1. Экзо-3-(6-этил-3-индан-2-илметил-3-азабицикло[3.1.0] гекс-6-ил)фенол 400 МГц 1H ЯМР (CDCl3)7,16-7,20 (м, 2 Н), 7,07-7,15 (м, 3 Н), 6,78-6,80 (м, 1 Н), 6,72-6,72 (м, 1 Н),6,60-6,63 (м, 1 Н), 3,00-3,07 (м, 2 Н), 2,87-2,95 (м, 4 Н), 2,59-2,75 (м, 3 Н), 2,51-2,58 (м, 2 Н), 1,91-2,03 (м,2 Н), 1,75-1,79 (м, 2 Н), 0,83 (т, J=7,4 Гц, 3 Н); МС (М+1) 334,2. Экзо-3-(6-этил-3-(2-индан-2-илэтил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид 400 МГц 1H ЯМР (CDCl3)7,72 (с, 1 Н), 7,54-7,56 (м, 1 Н), 7,32-7,39 (м, 1 Н), 7,28-7,30 (м, 1 Н), 7,087,16 (м, 4 Н), 6,14 (ушир.с, 1 Н), 5,79 (ушир.с, 1 Н), 3,02-3,05 (м, 4 Н), 2,90-3,00 (м, 2 Н), 2,55-2,61 (м, 4 Н),2,42-2,48 (м, 1 Н), 1,89-1,92 (м, 2 Н), 1,83 (с, 2 Н), 1,67 (кв, J=7, 5 Гц, 2 Н), 0,77 (т, J=7,5 Гц, 3 Н); МС (М+1) 375,2. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, описываемое формулой I, где X представляет собой Н, галоген, -ОН, -CN, -С 1-С 4 алкил, замещенный атомами галогена в количестве от одного до трех, либо -O(С 1-С 4 алкил), где С 1-С 4 алкил в -O(С 1-С 4 алкиле) необязательно замещен атомами галогена в количестве от одного до трех;R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием С 3-С 7 циклоалкила, где упомянутый циклоалкил необязательно образует конденсированную систему с C6C14 арильной группой; где упомянутый С 3-С 7 циклоалкил, образованный с участием R1 и R2, может быть необязательно замещен группами R12 в количестве от одной до трех, а упомянутый арил, необязательно образующий конденсированную систему, может быть необязательно замещен независимо группами R12 в- 27006708 количестве от одной до шести, где группы R12 выбирают из R13, R16, -С 1-С 4 алкила, содержащего одну или две ненасыщенные связи, галогена, -OR13, -NO2, -CN, -С 3-С 6 циклоалкила, -NR13R14, -NR13C(=O)R14, -С(=O)NR13R14,-OC(=O)R13, -C(=O)OR13, -C(=O)R13, -NR13C(=O)OR14, -NR13C(=O)NR14R15, -NR13S(=O)2R14 и -S(=O)2R13;R3 представляет собой С 1-С 4 алкил, где упомянутый С 1-С 4 алкил необязательно содержит одну либо две ненасыщенные связи;R4 представляет собой -С 1-С 4 алкил, который, необязательно, может содержать одну либо две ненасыщенные связи, -ОН, -CN, NO2, -OR16, -СН 2 ОН, -NH2, -NHR16, -NR16R17, -NHC(=O)CH3 либо -NHC(=O)R16; каждый из R5 и R8 независимо представляет собой Н либо метил;R11 выбирают из С 1-С 4 алкила, -(С 1-С 4 алкилен)-О-(С 1-С 4 алкила), 4-(1-метилимидазола), -(С 1-С 4 алкилен)NH2, -(С 1-С 4 алкилен)-NH(С 1-С 4 алкила), -(С 1-С 4 алкилен)-N(С 1-С 4 алкил)(С 1-С 4 алкила); каждый из R13, R14 и R15 независимо выбирают из группы, состоящей из Н, R16, С 1-С 4 алкила, галогена, -ОН, -SH, -NH2, -NH(С 1-С 4 алкила), -N(С 1-С 4 алкил)(С 1-С 4 алкила), -O(С 1-С 4 алкила), -S(С 1-С 4 алкила),-CN, -NO2, -C(=O)(С 1-С 4 алкила), -С(=O)OН, C(=O)O(С 1-С 4 алкила), -NHC(=O)(С 1-С 4 алкила), -C(=O)NH2 и С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкила); каждый из R16 и R17 независимо выбирают из С 6-С 14 арила, где упомянутый арил необязательно замещен заместителями в количестве от одного до трех, выбираемыми из С 1-С 4 алкила, необязательно содержащего одну либо две ненасыщенные связи, галогена, -ОН, -SH, -NH2, -NH(С 1-С 4 алкила), -N(С 1-С 4 алкил)(С 1-С 4 алкила), -O(С 1 С 4 алкила), -S(С 1-С 4 алкила), -CN, -NO2, -C(=O)(С 1-С 4 алкила), С(=О)ОН, -C(=O)O(С 1-С 4 алкила), -NHC(=O)(С 1 С 4 алкила), -C(=O)NH2 и -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкила); иn представляет собой целое число, выбираемое из нуля, 1, 2, 3, 4 и 5; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где указанное соединение формулы (I) имеет относительную стереохимическую структуру, описываемую формулой (II) или его фармацевтически приемлемая соль. 3. Соединение по п.2, где R3 представляет собой метил, этил, изопропил либо нормальный (неразветвленный) пропил. 4. Соединение по п.2, где R4 представляет собой -CN, -NO2, -ОН, -ОСН 3, -СН 2 ОН, -NH2 или -NHC(=O)CH3. 5. Соединение по п.2, где Q представляет собой F, -ОН, -C(=O)NH2, -NHS(=O)2CH3, -NHS(=O)2CH2CH3,-NHS(=O)2 СН 2 СН 2 СН 3, NHS(=O)2CH(CH3) (CH3) или -NHS(=O)2 СН 2 СН 2 ОСН 3. 6. Соединение по п.2, где X представляет собой Н, F, -ОН, -C(=O)NH2 или -CN. 7. Соединение по п.2, где Q представляет собой галоген, -ОН, -O(С 1-С 4 алкил), -NH2, -NH(C1-C4 алкил), -N(С 1-С 4 алкил)(С 1-С 4 алкил), -C(=O)NH2, -C(=O)NH(С 1-С 4 алкил), -С(=O)N(С 1-С 4 алкил)(С 1-С 4 алкил),-NHS(=O)2 Н или -NHS (=O)2R11. 8. Соединение по п.2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопропильной, циклобутильной, циклопентильной или циклогексильной группы, при этом каждая из них необязательно замещена одной либо двумя группами R12. 9. Соединение по п.2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклопентильной группы либо циклогексильной группы, где указанные циклопентильная группа либо циклогексильная группа образуют конденсированную систему с бензольным кольцом, при этом каждая группа из упомянутых циклопентильной группы либо циклогексильной группы и упомянутого бензольного кольца необязательно замещена одной либо двумя группами R12. 10. Соединение по п.1 или 2, где R1 и R2, вместе с тем атомом углерода, к которому они присоединены, соединяются с образованием циклобутильной группы, где указанная циклобутильная группа необязательно замещена R12, выбираемым из группы, состоящей из F, -CN либо необязательно замещенного фенила. 11. Соединение по п.2, в которомC4-С 6 циклоалкила, где указанный С 4-С 6 циклоалкил, образованный с участием R1 и R2, необязательно может быть замещен группами R12 в количестве от одной до трех, где указанные группы R12 выбирают изR16 представляет собой С 6-арил, где упомянутый арил необязательно замещен заместителямигалогенами в количестве от одного до трех;n представляет собой целое число, выбираемое из нуля, 1, 2 и 3; или его фармацевтически приемлемая соль. 12. Соединение по п.2, выбираемое из группы, состоящей из следующих соединений: экзо-N-(3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид экзо-N-(3-3-[3-(1-гидроксиметилциклопентил)пропил]-6-изопропил-3-азабицикло[3.1.0]гекс-6-ил фенил)метансульфонамид экзо-N-(1-3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексил)ацетамид экзо-N-(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-1-3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексанол; экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид;(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)амид экзоэтансульфоновой кислоты; или его фармацевтически приемлемая соль.- 29006708 13. Соединение по п.11, в котором R4 представляет собой -ОН; или его фармацевтически приемлемая соль. 14. Соединение по п.13, выбираемое из группы, состоящей из следующих соединений: экзо-N-(3-6-этил-3-[3-(1-гидроксиметилциклопентил)пропил]-3-азабицикло[3.1.0]гекс-6 илфенил)метансульфонамид; экзо-1-3-[6-(3,5-дифторфенил)-6-этил-3-азабицикло[3.1.0]гекс-3-ил]пропилциклогексанол; экзо-3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид;(3-6-этил-3-[3-(1-гидроксициклогексил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)амид экзоэтансульфоновой кислоты; или его фармацевтически приемлемая соль. 15. Соединение по п.2, в котором:C5-С 6 циклоалкила, где указанный C5-С 6 циклоалкил образует конденсированную систему с С 6-арильной группой;n представляет собой целое число, выбираемое из нуля, 1, 2 и 3; или его фармацевтически приемлемая соль. 16. Соединение по п.15, выбираемое из группы, состоящей из следующих соединений: экзо-N-(3-6-этил-3-[2-(2-гидроксиметилиндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-3-3-[3-(2-ацетиламиноиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-илбензамид; экзо-N-(2-3-[6-этил-6-(3-метансульфониламинофенил)-3-азабицикло[3.1.0]гекс-3-ил]пропилиндан-2-ил)ацетамид; экзо-N-(3-6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-3-6-этил-3-[2-(2-гидроксииндан-2-ил)этил]-3-азабицикло[3.1.0]гекс-6-илбензамид; экзо-N-(3-6-этил-3-[3-(2-нитроиндан-2-ил)пропил]-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-3-6-этил-3-[3-(2-нитроиндан-2-ил)пропил]-3-азабицикло[3.1.0]гекс-6-илбензамид; экзо-N-(3-3-[3-(2-аминоиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-илфенил)метансульфонамид; экзо-3-3-[3-(2-аминоиндан-2-ил)пропил]-6-этил-3-азабицикло[3.1.0]гекс-6-илбензамид; экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]-5-фторбензамид; экзо-N-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]фенилметансульфонамид; экзо-3-[6-этил-3-(2-гидроксииндан-2-илметил)-3-азабицикло[3.1.0]гекс-6-ил]бензамид;
МПК / Метки
МПК: A61K 31/4178, A61K 31/403, C07D 303/04, C07D 403/12, C07D 209/52
Метки: опиоидного, 3-азабицикло, качестве, рецептора, гексана, 3.1.0, антагонистов, производные
Код ссылки
<a href="https://eas.patents.su/30-6708-proizvodnye-3-azabiciklo-310-geksana-v-kachestve-antagonistov-opioidnogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-азабицикло (3.1.0) гексана в качестве антагонистов опиоидного рецептора</a>
Предыдущий патент: Сульфонилпроизводные в качестве новых ингибиторов гистон-деацетилазы
Следующий патент: Комбинированная противоопухолевая терапия, включающая применение производных замещенного акрилоилдистамицина, таксанов и/или антиметаболитов
Случайный патент: Способ снижения содержания остаточных веществ в стирольном полимере












