Производные азетидинилпропилпиперидина, промежуточные соединения и применение в качестве антагонистов тахикинина
Номер патента: 2773
Опубликовано: 29.08.2002
Авторы: Мо Грэм Найджел, Миддлтон Доналд Стюарт, Алкер Дейвид, Маги Томас Виктор
Формула / Реферат
1. Соединение формулы (I)
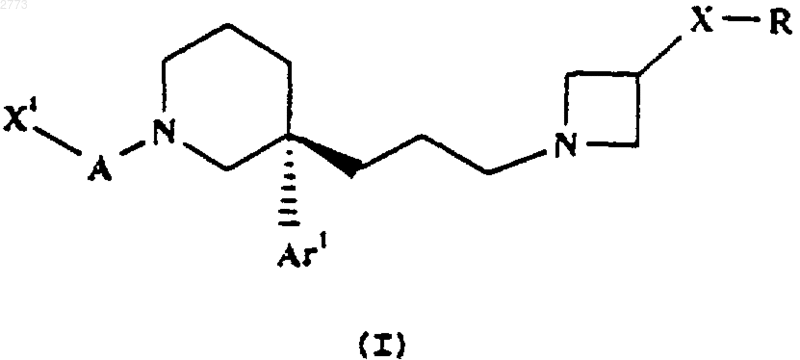
и его фармацевтически приемлемые соли,
где А представляет собой СО, SO2;
Аr1 представляет собой фенил, возможно замещенный одним или более чем одним галогеном;
X1 представляет собой фенил, возможно замещенный галогеном, или С1-6алкил, причем указанный C1-6алкил возможно замещен С3-7 циклоалкилом;
Х представляет собой непосредственно связь или NR1;
R представляет собой SO2фенил, SO2(С1-6алкил, возможно замещенный одним или более чем одним галогеном),
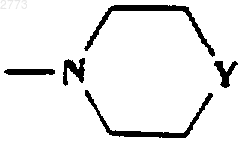 или
или 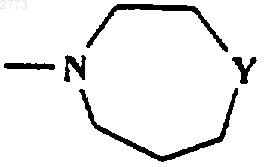
R1 представляет собой Н, С1-6алкил или фенил;
Y представляет собой О, NСO(С1-6алкил), NСО2(C1-6алкил), NSO2(С1-6алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NСО2фенил, NSО2фенил, NH, NСН2фенил, NSO2СН2Рh;
при условии, что Х не представляет собой NR1, когда R представляет собой
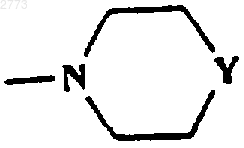 или
или 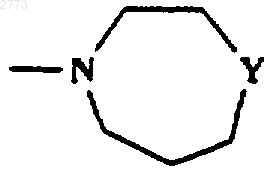 .
.
2. Соединение или соль по п.1, где X1 представляет собой фенил или С1-6алкил, причем указанный С1-6алкил возможно замещен С3-7 циклоалкилом.
3. Соединение или соль по любому из пп.1-2, где Х представляет собой непосредственно связь или NR1, где R1 представляет собой C1-6алкил или фенил.
4. Соединение или соль по любому из пп.1-3, где R представляет собой SО2фенил, SО2(С1-6алкил, возможно замещенный одним или более чем одним галогеном),
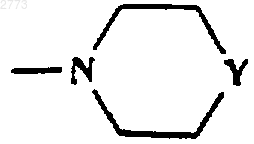 или
или 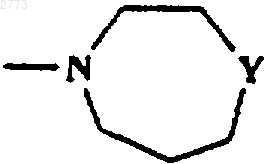 ,
,
где Y представляет собой О, NСО(С1-6алкил), NCO2(C1-6aлкил), NSO2(С1-6алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NH, NСН2фенил.
5. Соединение или соль по любому из пп.1-4, где А представляет собой СО.
6. Соединение или соль по любому из пп.1-5, где Аr1 представляет собой фенил, возможно замещенный атомами галогена в количестве вплоть до двух.
7. Соединение или соль по любому из пп.1-6, где X1 представляет собой С1-6алкил, замещенный С3-7циклоалкилом, или фенил, возможно замещенный галогеном.
8. Соединение или соль по любому из пп.1-7, где Х представляет собой непосредственно связь, N-метил или N-фенил.
9. Соединение или соль по любому из пп.1-8, где R представляет собой SО2фенил, SО2(С1-3алкил, возможно замещенный одним или более чем одним галогеном),
 или
или 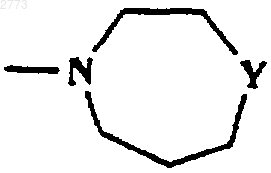 ,
,
где Y представляет собой О, NСO(С1-6алкил), NСO2(С1-6алкил), NSO2(С1-6алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NH, NСН2фенил.
10. Соединение или соль по любому из пп.1-9, где Аr1 представляет собой фенил, возможно замещенный одним или двумя атомами хлора.
11. Соединение или соль по любому из пп.1-10, где X1 представляет собой C1-6алкил, замещенный С3-7циклоалкилом, либо представляет собой фенил, возможно замещенный одним или более чем одним галогеном.
12. Соединение или соль по любому из пп.1-11, где R представляет собой SО2Рh, SО2СН3,
 или
или 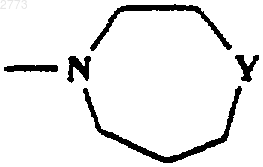 ,
,
где Y представляет собой О, NСОСН3, NСO2С(СН3)3, NSО2СН3, NSO2C2H5, NSO2Ph, NSO2CH2Ph, NSO2CH(CH3)2, NSO2СН2СF3, NCOPh, NH, NCH2Ph.
13. Соединение или соль по любому из пп.1-12, где Аr1 представляет собой фенил, 4-хлорфенил или 3,4-дихлорфенил.
14. Соединение или соль по любому из пп.1-13, где X1 представляет собой (С3-7циклоалкил)метил или фенил, возможно замещенный одним или более чем одним галогеном.
15. Соединение или соль по любому из пп.1-14, где R представляет собой SO2Ph, SO2СН3,
 или
или 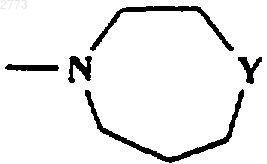 ,
,
где Y представляет собой О, NCOCH3, NСO2С(СН3)3, NSO2CH3, NSO2C2H2, NSO2Ph, NSO2CH2Ph, NSO2СН(СН3)2, NSO2CH2CF3, NCOPh.
16. Соединение или соль по любому из пп.1-15, где X1 представляет собой фенил, возможно замещенный одним или более чем одним атомом фтора или хлора.
17. Соединение или соль по любому из пп.1-16, где X1 представляет собой фенил, 3-хлорфенил или 3,4-дифторфенил.
18. Соединение или соль по п.1, которые выбраны из
(+)-3(R)-1-бензоил-3-(3-[3-(4-трет-бутоксикарбонилпиперазин-1-ил)азетидин-1-ил]пропил)-3-(3,4-дихлорфенил)пиперидина,
3(R)-1-бензоил-3-(3-[3-(4-трет-бутоксикарбонилгомопиперазин-1-ил)азетидин-1-ил]пропил)-3-(3,4-дихлорфенил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-3-(3-[3-(4-ацетилпиперазин-1-ил)азетидин-1-ил]пропил)-1-бензоил-3-(3,4-дихлорфенил)пиперидина,
(+)-3(R)-1-бензоил-3-(3-[3-(4-бензоилпиперазин-1-ил)азетидин-1-ил]пропил)-3-(3,4-дихлорфенил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-3-(3-[3-(4-бензолсульфонилпиперазин-1-ил)азетидин-1-ил]пропил)-1-бензоил-3-(3,4-дихлорфенил)пиперидина,
(+)-3(R)-1-бензоил-3-(3-[3-(4-бензилсульфонилпиперазин-1-ил)азетидин-1-ил]пропил)-3-(3,4-дихлорфенил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-изопропилсульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-(2,2,2-трифторэтан)сульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-морфолиноазетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(N-метилбензолсульфонамидо)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(N-фенилметансульфонамидо)азетидин-1-ил]пропил)пиперидина,
3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилгомопиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
3(R)-1-бензолсульфонил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил) азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-(циклопропилацетил)-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-3-(3,4-дихлорфенил)-1-(3,4-дифторбензоил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-(3-хлорбензоил)-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-пиперазиноазетидин-1-ил]пропил)пиперидина и
3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(гомопиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,
и их фармацевтически приемлемых солей.
19. Фармацевтическая композиция, содержащая соединение или соль по любому из пп.1-18 вместе с фармацевтически приемлемым разбавителем, адъювантом или носителем.
20. Применение соединения или соли по любому из пп.1-18 в качестве лекарства.
21. Применение фармацевтической композиции по п.19 в качестве лекарства.
22. Применение соединения или соли по любому из пп.1-18 для изготовления лекарства для лечения заболевания продуцированием антагонистического воздействия на тахикинин, действующий на HK1-, HK2- или НK3-рецептор человека или комбинацию двух или более чем двух из них.
23. Применение соединения или соли по любому из пп.1-18 для изготовления лекарства для лечения воспалительного заболевания, такого как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройства центральной нервной системы (ЦНС), такого как тревога, депрессия, деменция или психоз, желудочно-кишечного (ЖК) расстройства, такого как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, энкопрез, колит, неспецифический язвенный колит или болезнь Крона, заболевания, вызванного Helicobacter pylori или другими уреаза-позитивными грамотрицательными бактериями, расстройства мочеполовых путей, такого как недержание, гиперрефлексия, импотенция или цистит, легочного расстройства, такого как хроническое обструктивное заболевание дыхательных путей, аллергии, такой как экзема, контактный дерматит, атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительности, такой как гиперчувствительность к сумаху укореняющемуся, ангиоспастического заболевания, такого как стенокардия или болезнь Рейно, пролиферативного расстройства, такого как рак, или расстройства, в которое вовлечена пролиферация фибробластов, фиброзного или коллагенового заболевания, такого как склеродермия или эозинофильный фасциолез, рефлюксной симпатической дистрофии, такой как синдром плечо/кисть, пристрастия, такого как алкоголизм, связанного со стрессом соматического расстройства, периферической невропатии, такой как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия, невропатологического расстройства, такого как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз, расстройства, связанного с усилением или супрессией иммунитета, такого как системная красная волчанка, ревматического заболевания, такого как фиброзит, рвоты, кашля, острой или хронической боли, мигрени, офтальмологического заболевания, такого как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройства мочевого пузыря или вирусного заболевания, такого как грипп или простуда.
24. Способ лечения человека или животного, который включает в себя продуцирование антагонистического воздействия на тахикинин, действующий на HK1-, HK2- или НK3-рецептор или комбинацию двух или более чем двух из них, при котором указанного человека лечат эффективным количеством соединения или соли по любому из пп.1-18 или композиции по п.19.
25. Способ лечения человека или животного, который включает в себя продуцирование антагонистического воздействия на тахикинин, действующий на НК1-, НК2- или НK3-рецептор или комбинацию двух или более чем двух из них, при котором указанного человека лечат эффективным количеством соединения или соли по любому из пп.1-18 или композиции по п.19, где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как тревога, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, энкопрез, колит, неспецифический язвенный колит или болезнь Крона, заболевание, вызванное Helicobacter pylori или другими уреазапозитивными грамотрицательными бактериями, расстройство мочеполовых путей, такое как недержание, гиперрефлексия, импотенция или цистит, легочное расстройство, такое как хроническое обструктивное заболевание дыхательных путей, аллергия, такая как экзема, контактный дерматит, атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительность, такая как гиперчувствительность к сумаху укореняющемуся, ангиоспастическое заболевание, такое как стенокардия или болезнь Рейно, пролиферативное расстройство, такое как рак, или расстройство, в которое вовлечена пролиферация фибробластов, фиброзное или коллагеновое заболевания, такое как склеродермия или эозинофильный фасциолез, рефлюксная симпатическая дистрофия, такая как синдром плечо/кисть, пристрастие, такое как алкоголизм, связанное со стрессом соматическое расстройство, периферическая невропатия, такая как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия, невропатологическое расстройство, такое как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз, расстройство, связанное с усилением или супрессией иммунитета, такое как системная красная волчанка, ревматическое заболевание, такое как фиброзит, рвота, кашель, острая или хроническая боль, мигрень, офтальмологическое заболевание, такое как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройство мочевого пузыря или вирусное заболевание, такое как грипп или простуда.
26. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (II)
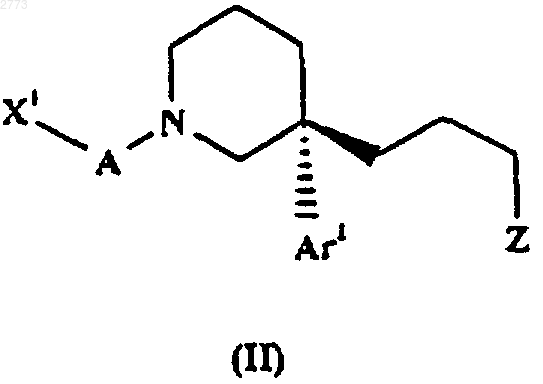
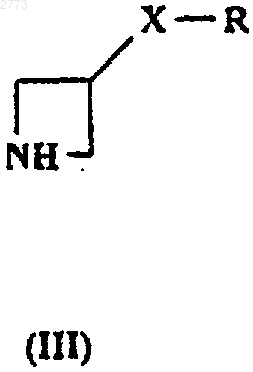
подвергают взаимодействию с соединением формулы (III), где X1, А, Аr1, Х и R такие, как определено в п.1, a Z представляет собой подходящую уходящую группу.
27. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (IV)
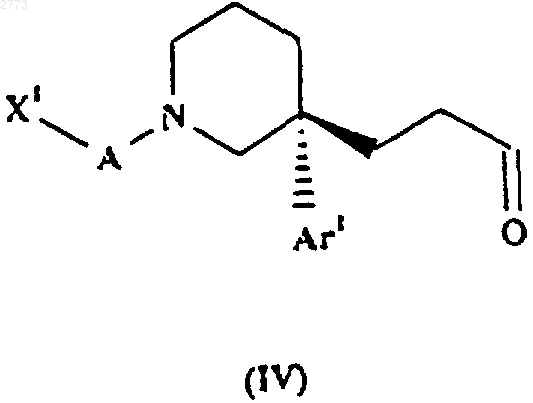
где X1, А и Аr1 такие, как определено в п.1, подвергают восстановительному аминированию амином формулы (III), как оно определено в п.26, или его солью.
28. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (VI) подвергают взаимодействиюс соединением формулы (VII)
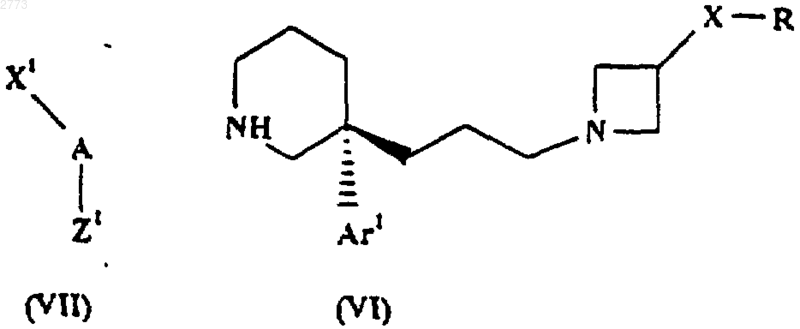
где X1, А, Аr1, Х и R такие, как определено в п.1, a Z1 представляет собой подходящую уходящую группу.
29. Способ производства соединения формулы (I) или его соли по п.1, при котором восстанавливают соединение формулы (VIII)
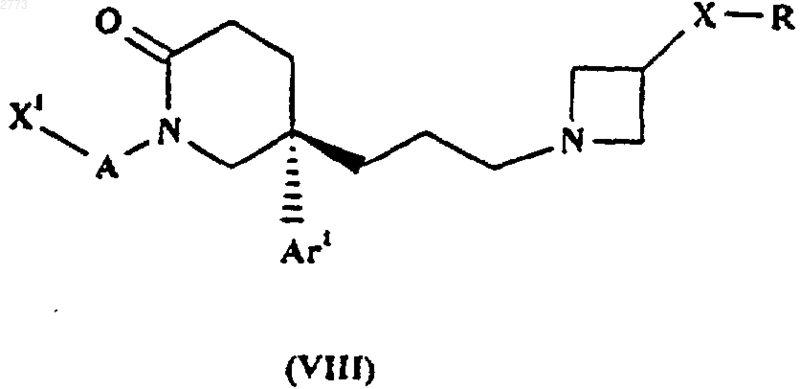
где X1, А, Аr1, Х и R такие, как определено в п.1.
30. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (IX)
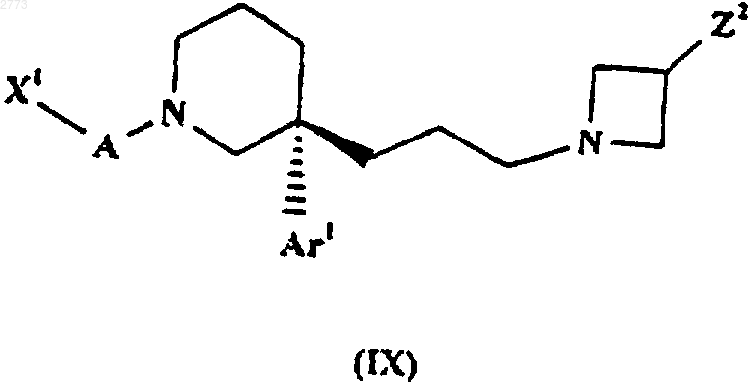
подвергают взаимодействию с нуклеофильным реагентом, действующим как "синтон" RX- , где X1, А, Аr1, Х и R такие, как определено в п.1, a Z2 представляет собой уходящую группу.
31. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (X)
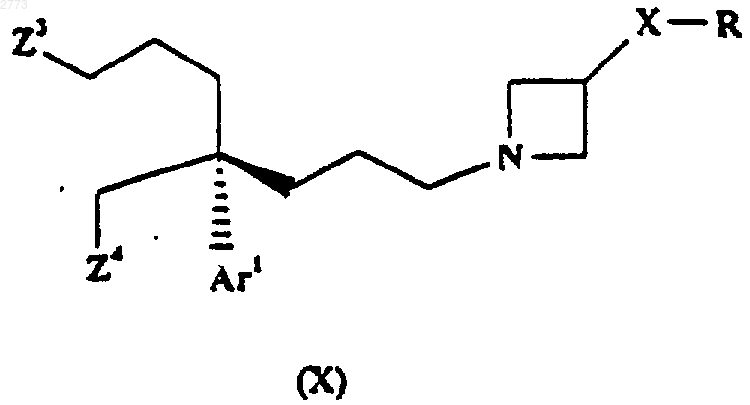
подвергают взаимодействию с реагентом формулы X1-A-NH2, где Z3 и Z4 представляют собой уходящие группы и где X1, А, Аr1, Х и R такие, как определено в п.1.
32. Способ производства соединения формулы (I) или его соли по п.1, где R представляет собой
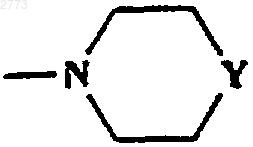 или
или 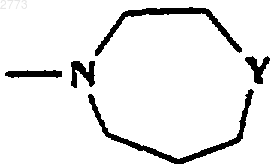
где Y представляет собой NСО(С1-6алкил), NСO2(С1-6алкил), NSO2(С1-6алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NСО2фенил, NSO2фенил, NСН2фенил, при котором соединение формулы (I) по п.1, где R представляет собой
 или
или 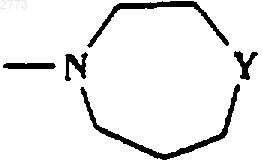
когда как подходит, a Y представляет собой NH, подвергают взаимодействию с реагентом формулы [(С1-6алкил)СО-, (С1-6алкил)СO2-, (C1-6 алкил, возможно замещенный одним или более чем одним галогеном)SO2-, фенилСО-, фенилСО2-, фенилSO2-, фенилСН2-.
33. Способ производства соединения формулы (I) или его соли по п.1, где R представляет собой
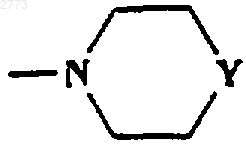 или
или 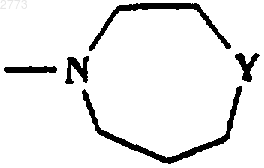
где Y представляет собой NH, при котором соответствующее соединение, где Y представляет собой NСO2(С(СН3)3), подвергают взаимодействию с кислотой.
34. Соль формулы (V)
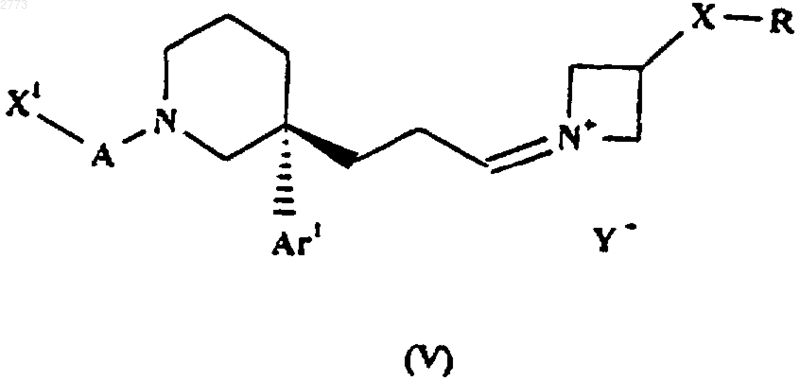
где X1, А, Аr1, Х и R такие, как определено в п.1, а Y- представляет собой противоион кислоты HY.
35. Соединение формулы (VI)
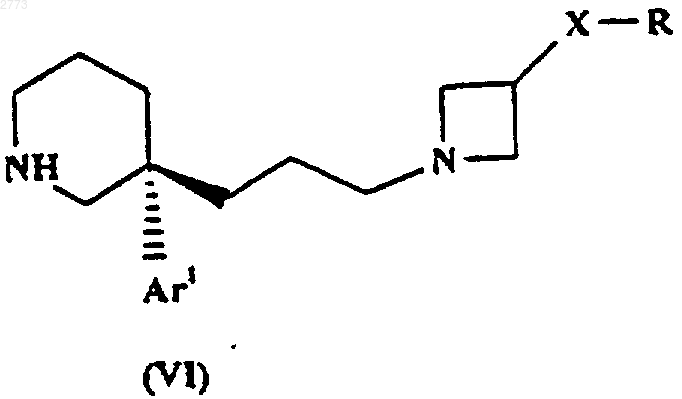
где Аr1, Х и R такие, как определено в п.1, или его соль.
36. Соединение формулы (VIII)
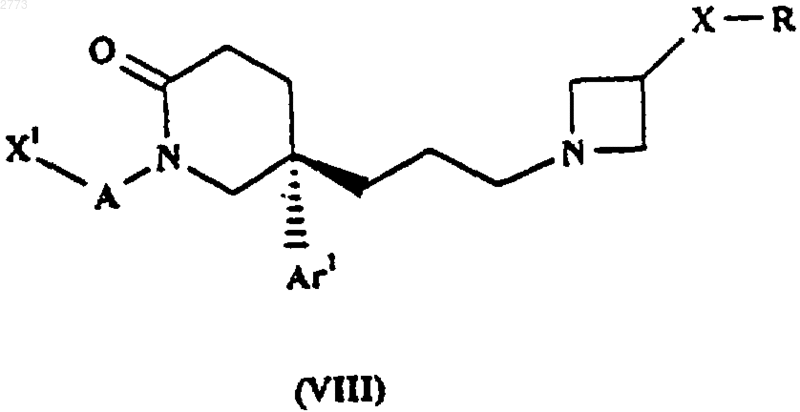
где X1, А, Аr1, Х и R такие, как определено в п.1, или его соль.
37. Соединение формулы (IX)
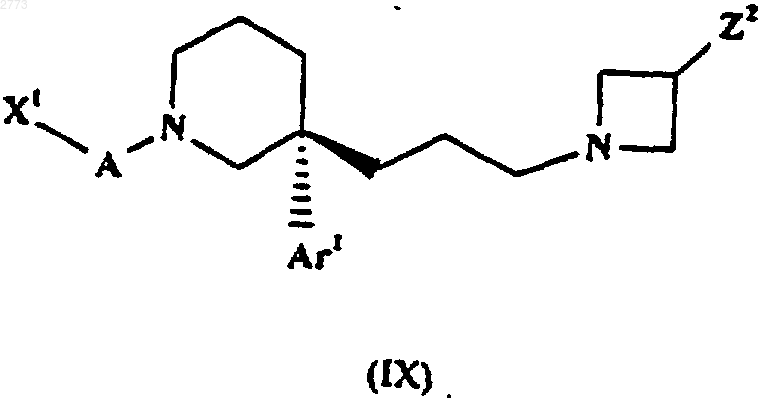
где X1, А и Аr1 такие, как определено в п.1, a Z2 представляет собой уходящую группу, или его соль.
Текст
1 Данное изобретение относится к терапевтическим агентам азетидинового ряда. Более конкретно, данное изобретение относится к производным азетидинилпропилпиперидина и к способам их получения, промежуточным соединениям, используемым при их получении, к содержащим такие производные композициям и к применению таких производных. В публикации международной патентной заявки WO 96/05193 раскрыты различные (азетидин-1-илалкил)лактамы в качестве антагонистов тахикинина. В публикации международной патентной заявки WO 97/25322 раскрыты различные азетидинилалкильные производные N-замещенных азотсодержащих гетероциклов в качестве антагонистов тахикинина. Некоторые из соединений и солей по этому изобретению в общих чертах,но не конкретно, описаны в этой публикации. Настоящие производные азетидинилпропилпиперидина являются антагонистами тахикининов, в том числе нейрокинина А (НКА),нейрокинина В (НКВ) и субстанции Р, действующих на рецептор нейрокинин-1 (HK1), нейрокинин-2 (НК 2) или нейрокинин-3 (НК 3) человека или комбинацию двух или более чем двух из них. Поэтому они полезны для предупреждения или лечения воспалительного заболевания,такого как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройства центральной нервной системы (ЦНС), такого как тревога, депрессия, деменция или психоз,желудочно-кишечного (ЖК) расстройства, такого как функциональное заболевание кишечника,диспепсия, синдром раздраженного кишечника,гастроэзофагеальный рефлюкс, энкопрез, колит,неспецифический язвенный колит или болезнь Крона, заболевания, вызванного Helicobacterpylori или другими уреаза-позитивными грамотрицательными бактериями, расстройства мочеполовых путей, такого как недержание, гиперрефлексия, импотенция или цистит, легочного расстройства, такого как хроническое обструктивное заболевание дыхательных путей, аллергии, такой как экзема, контактный дерматит,атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительности, такой как гиперчувствительность к сумаху укореняющемуся, ангиоспастического заболевания, такого как стенокардия или болезнь Рейно, пролиферативного расстройства, такого как рак, или расстройства, в которое вовлечена пролиферация фибробластов, фиброзного или коллагенового заболевания, такого как склеродермия или эозинофильный фасциолез, рефлюксной симпатической дистрофии, такой как синдром плечо/кисть, пристрастия, такого как алкоголизм, связанного со стрессом соматического расстройства, периферической невропатии, такой как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия,ожог, герпетическая невралгия или постгерпе 002773 2 тическая невралгия, невропатологического расстройства, такого как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз,расстройства, связанного с усилением или супрессией иммунитета, такого как системная красная волчанка, ревматического заболевания,такого как фиброзит, рвоты, кашля, острой или хронической боли, мигрени, офтальмологического заболевания, такого как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройства мочевого пузыря или вирусного заболевания, такого как грипп или простуда. Производные по настоящему изобретению являются очень мощными и селективными антагонистами тахикининов, в том числе НKА, НKВ и субстанции Р, действующих на HK1-, HK2 или НK3-рецепторы человека или комбинацию двух или более чем двух из них. Они особенно полезны для лечения или предупреждения воспалительного заболевания, такого как артрит,псориаз, астма или воспалительное заболевание кишечника, расстройства центральной нервной системы (ЦНС), такого как тревога, депрессия,деменция или психоз, желудочно-кишечного(ЖК) расстройства, такого как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, энкопрез, колит, неспецифический болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз, легочного расстройства, такого как хроническое обструктивное заболевание дыхательных путей, аллергии, такой как экзема, контактный дерматит или ринит,гиперчувствительности, такой как гиперчувствительность к сумаху укореняющемуся, периферической невропатии, такой как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, глазного воспаления, конъюнктивита, расстройства мочевого пузыря, ожога, герпетической невралгии или постгерпетической невралгии, кашля или острой или хронической боли. Согласно настоящему изобретению предложены соединения формулы (I) и их фармацевтически приемлемые соли,где А представляет собой СО, SO2; Аr1 представляет собой фенил, возможно замещенный одним или более чем одним галогеном;X1 представляет собой фенил, возможно замещенный галогеном, или C1-6 алкил, причем указанный С 1-6 алкил возможно замещен С 3-7 циклоалкилом; Х представляет собой непосредственно связь или NR1;R представляет собой SO2 фенил, SО 2(C1-6 алкил, возможно замещенный одним или более чем одним галогеном),илиY представляет собой О, NСО(С 1-6 алкил),NСО 2(C1-6 алкил), NSO2(C1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NСO2 фенил, NSO2 фенил,NH, NСН 2 фенил, NSO2CH2Ph; при условии, что Х не представляет собой NR1,когда R представляет собой или на которые здесь и далее ссылаются как на вещества по изобретению. Алкильные группы могут иметь прямую или разветвленную цепь. Галоген означает фтор, хлор, бром или йод. Рh означает фенил. Фармацевтически приемлемые соли соединений формулы (I) включают в себя соли присоединения кислоты и соли оснований. Подходящие соли присоединения кислоты образованы с кислотами, которые образуют нетоксичные соли, и примерами таких солей являются гидрохлориды, гидробромиды, гидройодиды, сульфаты, гидросульфаты, нитраты, фосфаты, гидрофосфаты, ацетаты, малеаты, фумараты, лактаты, тартраты, цитраты, глюконаты,сукцинаты, бензоаты, метансульфонаты, бензолсульфонаты и п-толуолсульфонаты. Подходящие соли оснований образованы с основаниями, которые образуют нетоксичные соли, и примерами таких солей являются соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламинные соли. Подходящие соли рассмотрены в Berge etal, J. Pharm.Sci., 66, 1-19 (1977). Предпочтительно А представляет собой СО. Предпочтительно Аr1 представляет собой фенил, возможно замещенный атомами галогена в количестве вплоть до двух. Еще более предпочтительно Аr1 представляет собой фенил, возможно замещенный одним или двумя атомами хлора. Наиболее предпочтительно Аr1 представляет собой фенил, 4-хлорфенил или 3,4 дихлорфенил. Предпочтительно X1 представляет собой фенил или С 1-6 алкил, причем указанный С 1-6 алкил возможно замещен С 3-7 циклоалкилом. Более предпочтительно X1 представляет собой C1-6 алкил, замещенный С 3-7 циклоалкилом. Еще более предпочтительно X1 представляет собой C1-6 алкил, замещенный С 3-7 цикпоалкилом, либо представляет собой фенил, возможно замещенный одним или более чем одним атомом галогена. 4 Еще более предпочтительно X1 представляет собой (С 3-7 циклоалкил)метил или фенил,возможно замещенный одним или более чем одним атомом галогена. Даже еще более предпочтительно X1 представляет собой циклопропилметил или фенил,возможно замещенный одним или более чем одним атомом фтора или хлора. Наиболее предпочтительно X1 представляет собой циклопропилметил, фенил, 3 хлорфенил или 3,4-дифторфенил. Предпочтительно Х представляет собой непосредственно связь или NR1, где R1 представляет собой С 1-6 алкил или фенил. Наиболее предпочтительно Х представляет собой непосредственно связь, N-метил или Nфенил. Предпочтительно R представляет собойSO2 фенил, SO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном),или где Y представляет собой О, NСО(С 1-6 алкил),NCO2(C1-6aлкил), NSО 2(С 1-6aлкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NH или NСН 2 фенил. Более предпочтительно R представляет собой SО 2 фенил, SO2(C1-3 алкил, возможно замещенный одним или более чем одним галогеном),или где Y представляет собой О, NСO(C1-6 алкил),NСO2(С 1-6 алкил), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСО(фенил), NH, NСН 2 фенил. Еще более предпочтительно R представляет собой SO2Ph, SО 2 СН 3,или где Y представляет собой О, NСОСН 3,NСO2 С(СН 3)3, NSO2 СН 3, NSO2C2H5, NSO2Ph,NSO2CH2Ph,NSO2 СН(СН 3)2,NSO2 СН 2 СF3,NCOPh, NH, NCH2Ph. Наиболее предпочтительно R представляет собой SO2Ph, SO2 СН 3,или где Y представляет собой О, NCOCH3,NСO2 С(СН 3)3, NSO2 СН 3, NSO2C2H5, NSO2Ph,NSO2 СН(СН 3)2,NSO2CH2CF3,NSO2CH2Ph,NCOPh. Наиболее предпочтительными веществами по изобретению являются соединения, упомянутые в приведенных ниже примерах, и их соли. Некоторые соединения по изобретению могут существовать в одной или более чем одной стереоизомерной форме. Настоящее изобретение включает в себя все такие индивидуальные изомеры и их соли. Разделение диастереомеров может быть осуществлено традиционными способами, на 5 пример фракционной кристаллизацией, хроматографией или ВЭЖХ (высокоэффективной жидкостной хроматографией) смеси стереоизомеров соединения формулы (I) или его соли. Индивидуальный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения или разделением, например ВЭЖХ,соответствующего рацемата с использованием подходящего хирального носителя, или фракционной кристаллизацией диастереомерных солей,образованных взаимодействием соответствующего рацемата с подходящим оптически активным основанием или кислотой. Кроме того, согласно изобретению предложены способы синтеза для производства веществ по изобретению, которые описаны ниже и в примерах. Специалисту в данной области будет ясно, что соединения по изобретению могут быть получены способами, иными, нежели те,которые описаны в этом документе, путем адаптации способов, описанных в этом документе,и/или путем адаптации способов, известных из уровня техники, например из уровня техники,описанного в этом документе. В приведенных ниже способах, если не указано иначе, заместители являются такими,как определено выше со ссылкой на соединения формулы (I). Способы синтеза Способ 1 Соединения по изобретению могут быть получены путем взаимодействия соединения формулы (II) где Z представляет собой подходящую уходящую группу, такую как метансульфонатная группа, толуолсульфонатная группа, Cl, Вr или возможно в присутствии основания, такого как карбонат калия, предпочтительно в инертном растворителе, таком как ацетонитрил. Соединения формул (II) и (III) могут быть получены стандартными способами, например способами, которые описаны в примерах и подготовительных примерах, и путем их адаптации. Способ 2 Соединения по изобретению могут быть получены путем взаимодействия соединения формулы (IV) с соединением формулы (III), как оно определено в Способе 1 выше, или его соли. 6 Реакцию восстановительного аминирования предпочтительно проводят в присутствии подходящей кислоты, такой как уксусная кислота. Эта реакция протекает через образование вначале промежуточной иминиевой соли формулы (V), где Y представляет собой противоион кислоты HY, причем соль формулы (V) может быть стабильной и выделяемой. Эту реакцию предпочтительно проводят без выделения промежуточного соединения формулы (V), и в этом случае его восстанавливают in situ с получением соединения формулы(I). При типичной процедуре альдегид формулы(IV) сначала подвергают взаимодействию с азетидином формулы (III) или его солью в подходящем растворителе, таком как тетрагидрофуран (ТГФ), и смесь затем обрабатывают подходящим восстанавливающим агентом, например триацетоксиборгидридом натрия или цианоборгидридом натрия, в присутствии подходящей кислоты, например уксусной кислоты, с получением целевого продукта. Если в качестве исходного материала используют соль присоединения кислоты азетидина формулы (III), перед добавлением восстанавливающего агента может быть добавлен подходящий акцептор кислоты,например триэтиламин. Взаимодействие обычно проводят при комнатной температуре. Соединения формулы(IV) могут быть получены окислением соединений формулы (II), как описано в Способе 1 выше, если Z представляет собой ОН. Подходящие системы окисления включают в себя системуSwern, в которой используется смесь оксалилхлорид/метилсульфоксид, в присутствии основания, такого как диизопропилэтиламин. Способ 3 Соединения формулы (I) могут быть получены путем взаимодействия соединений формулы (VI) с соединениями формулы (VII), где Z1 представляет собой подходящую уходящую группу, такую как определено выше для Z в Способе 1. Если А представляет собой СО, подходящий Z1 представляет собой Cl или ОСОХ 1 (т.е. этот реагент представляет собой ангидрид ки 7 слоты Х 1 СO2 Н). Ацилирование можно проводить, используя общепринятые способы, например в присутствии подходящего основания в подходящем растворителе. Альтернативно соединения, где А представляет собой СО, могут быть получены путем взаимодействия соединения формулы (VI) с кислотой формулы (VII), где Z1 представляет собой ОН, по реакции пептидного сочетания,как описано например R.C. Larock в Comprehensive Organic Transformations - A Guide toFunctional Group Preparations, VCH (1989), и в публикациях, ссылки на которые приведены там. Когда А представляет собой CH2, алкилирование может быть проведено общепринятыми способами, например путем взаимодействия соединения формулы (VI) с соединением формулы (VII), где Z1 представляет собой подходящую уходящую группу, такую как Cl, Вr, I, метансульфонатная группа или толуолсульфонатная группа, возможно в присутствии подходящего основания, такого как триэтиламин. Когда А представляет собой SO2, взаимодействие можно проводить с соединением формулы (VII), где Z1 представляет собой подходящую уходящую группу, такую как Cl, Вr, I, метансульфонатная группа или толуолсульфонатная группа, возможно в присутствии подходящего основания, такого как триэтиламин. Способ 4 Пиперидиновые соединения формулы (I) могут быть получены путем восстановления соответствующих лактамов формулы (VIII),например путем взаимодействия с подходящим гидридным восстанавливающим агентом, например, как описано R.C. Larock в Comprehensive Organic Transformations - А Guide to Functional Group Preparations, VCH (1989), cc. 432434, и в публикациях, ссылки на которые приведены там. Соединения формулы (VIII) могут быть получены способами, которые описаны в WO 96/05193, и адаптацией их методами, которые известны в данной области техники. Способ 5 Соединения формулы (I) могут быть получены путем взаимодействия соединений формулы (IX), где Z2 представляет собой уходящую группу и соответствует Z, как он определен в Способе 1 выше, с нуклеофильным реагентом,действующим как синтон RX. Соответственно Z2 представляет собой метансульфонатную группу, и взаимодействие проводят, вызывая образование группировкиRX, например, путем взаимодействия соответствующего соединения RXH с основанием, таким как алкиллитиевое основание, возможно в присутствии инертного растворителя. Альтернативно, соединение RXH может само по себе быть достаточно нуклеофильным для того, чтобы замещать группу Z2 без превращения его сначала в анион RX. Соединения формулы (IX) могут быть получены путем адаптации способов, описанных в этом документе и в уровне техники, описанном в этом документе, способами, известными специалисту-химику. Способ 6 Соединения формулы (I) могут быть получены из соединений формулы (X), где Z3 и Z4 представляют собой уходящие группы, которые независимо определены как Z в Способе 1, с реагентом формулы X1-A-NH2. Соединения формул (X) и X1-A-NH2 могут быть получены общепринятыми способами,например путем адаптации способов, описанных в этом документе и в уровне техники, описанном в этом документе. Способ 7 Соединения формулы (I), где R представляет собой или где Y представляет собой NСO(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NCO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном),NСОарил, NСO2 арил, NSO2apил, NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСH2 арил, N(С 1-6 алкил,возможно замещенный одним или более чем одним галогеном) или NCH2(С 3-7 циклоалкил),могут быть получены путем взаимодействия соединения формулы (I), где R представляет собой или 9 когда как подходит, a Y представляет собой NH,с реагентом формулы [(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном)СО-, (С 1-6 алкил, возможно замещенный одним или более чем одним галогеном)СО 2-,(C1-6 алкил, возможно замещенный одним или более чем одним галогеном)SO2-, арилСО-,арилСO2-, арилSО 2-, (C1-6 алкил, возможно замещенный одним или более чем одним галогеном)SO2-, арилСН 2-, (C1-6 алкил, возможно замещенный одним или более чем одним галогеном)-, или (С 3-7 циклоалкил)СН 2-]-Z5, где Z5 представляет собой подходящую уходящую группу, такую как ион хлора, брома, йода, метансульфонатную группу, толуолсульфонатную группу и т.д., возможно в присутствии основания, такого как триэтиламин, предпочтительно в присутствии инертного растворителя. Способ 8 Соединения формулы (I), где R представляет собой или где Y представляет собой NH, могут быть получены путем взаимодействия соответствующего соединения, где Y представляет собойNСO2(С(СН 3)3), с кислотой, такой как трифторуксусная кислота, предпочтительно в присутствии инертного растворителя. При желании или необходимости соединение формулы (I) может быть превращено в его фармацевтически приемлемую соль смешиванием вместе растворов соединения формулы (I) и желаемой кислоты или основания, когда как подходит. Данная соль может быть осаждена из раствора и собрана фильтрованием или другими способами, такими как выпаривание растворителя. Понятно, что синтетические способы превращения, упомянутые здесь, можно проводить в различной последовательности с целью эффективного получения желаемых соединений. Специалист-химик сможет использовать свои знания и навыки для определения наиболее эффективной последовательности реакций для синтеза данного целевого соединения. Для специалиста в данной области должно быть очевидно, что иногда возникает необходимость в защите чувствительных функциональных групп и в снятии этой защиты в процессе синтеза соединения по изобретению. Этого можно достичь традиционными способами, например как описано в "Protective Groups in Organic Synthesis" TW Green и PGM Wuts, JohnWileySons Inc (1991). Соединения по изобретению могут быть очищены традиционными способами. Сродство соединений формулы (I) и их солей к HK1-рецептору человека может быть определено in vitro исследованием их способности ингибировать связывание [3H]-субстанции Р с 10 мембранами, полученными из клеточной линииTher, 267, 472-9 (1993), в котором используются целые клетки. Сродство соединений формулы (I) и их солей к НK2-рецептору человека может быть определено in vitro исследованием их способности конкурировать с [3 Н] или [125I]-НKА (нейрокинин А) за связывание с мембранами, полученными из клеток яичника китайского хомячка,экспрессирующих клонированный НK2 рецептор человека. В этом методе промытые мембраны клеток яичника китайского хомячка получают, как описано для предыдущего метода, где вместо них используют клетки IМ 9. Мембраны инкубируют (90 мин, 25 С) с [3 Н] или [125I]-HKA и с тестируемым соединением в диапазоне концентраций. Неспецифическое связывание определяют в присутствии 10 мкм НKА. Антагонистическая активность соединений формулы (I) в отношении НK2-рецептора может быть определена in vitro исследованием их способности антагонизировать контрактильные эффекты селективного агониста НK2-рецептораPharmacol., 236, 31-37 (1993. Соединения формулы (I) и их соли могут быть испытаны на антагонистическую активность в отношении НK2-рецептора in vivo исследованием их способности ингибировать бронхоконстрикцию, индуцированную [(Ala8]HKA(4-10) у анестезированных морских свинок, используя метод, описанный Murai et al. в J. Pharm. Exp.Br. J. Pharmacol., 112, 563P (1994). Соединения формулы (I) и их соли могут быть испытаны на антагонистическую активность в отношении НK3-рецептора in vitro исследованием их способности антагонизировать контрактильные эффекты селективного агониста НK3-рецептора сенктида в подвздошной кишке морской свинки, используя способ Maggiet al. (Br. J. Pharmacol., 101, 996-1000 (1990. Сродство соединений формулы (I) и их солей к НK3-рецептору может быть определено invitro исследованием их способности вытеснять[3 Н]сенктид на НK3-рецепторе коры головного мозга морской свинки. Рецепторы готовят способом, который описан S. Guard, et al. в Br. J.Pharmacol. (1990), 99, 767. Для применения у людей соединения формулы (I) и их соли можно вводить сами по себе,но, как правило, их будут вводить в смеси с фармацевтически приемлемым растворителем или носителем соответственно предполагаемому пути введения и стандартной фармацевтической практике. Например, их можно вводить 11 перорально, в том числе подъязычно, в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах или овулях, либо сами по себе, либо в смеси с эксципиентами, или в форме эликсиров, растворов или суспензий, содержащих корригенты или красящие агенты. Их можно инъецировать парентерально, например внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего применять в форме стерильного водного раствора, который может содержать другие вещества, например соли или глюкозу, в количестве, достаточном чтобы сделать раствор изотоничным крови. Для перорального или парентерального введения пациентам-людям уровень суточной дозы соединений формулы (I) и их солей составляет от 0,001 до 20, предпочтительно от 0,01 до 20, более предпочтительно от 0,1 до 10 и наиболее предпочтительно от 0,5 до 5, мг/кг (в однократной или разделенной дозах). Таким образом, таблетки или капсулы этих соединений должны содержать от 0,1 до 500, предпочтительно от 50 до 200 мг активного соединения для введения один раз или два или более раз,когда как подходит. В любом случае лечащий врач будет определять фактическую дозировку,которая будет наиболее соответствовать индивидуально пациенту и которая будет варьироваться в зависимости от возраста, массы и реакции конкретного пациента. Указанные выше дозировки являются примером среднего случая; конечно, могут иметь место отдельные случаи,когда оправданы более высокие или более низкие диапазоны доз, и таковые находятся в объеме данного изобретения. Альтернативно, соединения формулы (I) можно вводить путем ингаляции, или в форме суппозитория или пессария, или их можно применять наружно в форме лосьона, раствора,крема, мази или присыпки. Альтернативным способом трансдермального введения является использование кожного пластыря. Например, их можно вводить в состав крема, содержащего водную эмульсию полиэтиленгликолей или вазелин; либо их можно вводить в концентрации между 1 и 10% в состав мази на основе белого воска или белого мягкого парафина вместе с такими стабилизаторами и консервантами, какие могут потребоваться. Должно быть понятно, что ссылка на лечение включает в себя профилактику, а также частичное снятие установленных симптомов заболевания. Согласно изобретению, кроме того, предложены: 1) фармацевтическая композиция, содержащая вещество по изобретению вместе с фармацевтически приемлемым разбавителем или носителем; 12 2) вещество по изобретению или композиция из него для применения в качестве лекарства; 3) применение вещества по изобретению или композиции из него для изготовления лекарства для лечения заболевания продуцированием антагонистического воздействия на тахикинин, действующий на НK1-, НK2- или НK3 рецептор человека или комбинацию двух или более чем двух из них; 4) применение как в (3), где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как тревога, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство,такое как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, энкопрез, колит, неспецифический язвенный колит или болезнь Крона, заболевание, вызванноеHelicobacter pylori или другими уреазапозитивными грамотрицательными бактериями,расстройство мочеполовых путей, такое как недержание, гиперрефлексия, импотенция или цистит, легочное расстройство, такое как хроническое обструктивное заболевание дыхательных путей, аллергию, такую как экзема, контактный дерматит, атопический дерматит, крапивница, экзематоидный дерматит или ринит,гиперчувствительность, такая как гиперчувствительность к сумаху укореняющемуся, ангиоспастическое заболевание, такое как стенокардия или болезнь Рейно, пролиферативное расстройство, такое как рак, или расстройство, в которое вовлечена пролиферация фибробластов, фиброзное или коллагеновое заболевание, такое как склеродермия или эозинофильный фасциолез,рефлюксную симпатическую дистрофию, такую как синдром плечо/кисть, пристрастие, такое как алкоголизм, связанное со стрессом соматическое расстройство, периферическую невропатию, такую как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия,ожог, герпетическая невропатия или постгерпетическая невралгия, невропатологическое расстройство, такое как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз,расстройство, связанное с усилением или супрессией иммунитета, такое как системная красная волчанка, ревматическое заболевание,такое как фиброзит, рвота, кашель, острая или хроническая боль, мигрень, офтальмологическое заболевание, такое как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройство мочевого пузыря или вирусное заболевание, такое как грипп или простуда; 5) способ лечения человека с целью лечения заболевания продуцированнием антагонистического воздействия на тахикинин, действующий на НK1-, НK2- или НK3-рецептор или 13 комбинацию двух или более чем двух из них,при котором указанного человека лечат эффективным количеством вещества по изобретению или композиции из него; 6) способ как в (5), где заболевание представляет собой воспалительное заболевание,такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как тревога, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника,гастроэзофагеальный рефлюкс, энкопрез, колит,неспецифический язвенный колит или болезнь Крона, заболевание, вызванное Helicobacter pylori или другими уреаза-позитивными грамотрицательными бактериями, расстройство мочеполовых путей, такое как недержание, гиперрефлексия, импотенция или цистит, легочное расстройство, такое как хроническое обструктивное заболевание дыхательных путей, аллергию, такую как экзема, контактный дерматит,атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительность, такая как гиперчувствительность к сумаху укореняющемуся, ангиоспастическое заболевание, такое как стенокардия или болезнь Рейно, пролиферативное расстройство, такое как рак, или расстройство, в которое вовлечена пролиферация фибробластов, фиброзное или коллагеновое заболевание, такое как склеродермия или эозинофильный фасциолез, рефлюксная симпатическая дистрофия, такая как синдром плечо/кисть, пристрастие, такое как алкоголизм,связанное со стрессом соматическое расстройство, периферическая невропатия, такая как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия, невропатологическое расстройство, такое как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз, расстройство, связанное с усилением или супрессией иммунитета,такое как системная красная волчанка, ревматическое заболевание, такое как фиброзит, рвота,кашель, острая или хроническая боль, мигрень,офтальмологическое заболевание, такое как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройство мочевого пузыря или вирусное заболевание, такое как грипп или простуда; 7) способы синтеза, описанные в этом документе, и 8) некоторые новые промежуточные соединения, описанные в этом документе. Следующие примеры иллюстрируют получение веществ по изобретению. В примерах и подготовительных примерах,которые следуют далее, данные 1H ЯМР представлены сдвигом от тетраметилсиланав миллионных долях, и измерения проведены в 14 растворе в СDСl3, если не указано иначе. Тонкослойную хроматографию (ТСХ) проводили,используя пластины из диоксида кремния Merckkieselgel, если не указано иначе. В структурах, которые следуют ниже, Me и Рh представляют собой метильную и фенильную группу, соответственно. Пример 1. (+)-3(R)-1-Бензоил-3-(3-[3-(4 трет-бутоксикарбонилпиперазин-1-ил)азетидин 1-ил]пропил)-3-(3,4-дихлорфенил)пиперидин Смесь соединений подготовительного примера 8 (11,62 г) и подготовительного примера 10 (14 г) и карбоната калия (10,23 г) в сухом ацетонитриле (300 мл) нагревают с обратным холодильником при энергичном перемешивании в течение 18 ч. Охлажденную смесь разбавляют этилацетатом (700 мл) и промывают 50% водным раствором хлорида натрия (70 мл). Органический раствор сушат над сульфатом натрия и упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование (дихлорметан/метанол/гидроксид аммония от 93/7/1 до 80/20/3) с получением соединения, указанного в заголовке (15,36 г), и выделяют соединение подготовительного примера 10 (5,85 г). ТСХ Rf: 0,15 (дихлорметан/метанол 95/5 по объему). МСНР (масс спектрометрия низкого разрешения) m/z: 616 (MH+). 1H ЯМР: 7.38 (m,4 Н), 7.21 (m, 4H), 4.52 (br s, 1H), 3.38 (m, 9H),2.90 (m, 1H), 2.72 (m, 2 Н), 2.37-2.03 (m, 8H), 1.80[]D+16,2 (с=0,13, метанол). Пример 2. 3(R)-1-Бензоил-3-(3-[3-(4-третбутоксикарбонилгомопиперазин-1-ил)азетидин 1-ил]пропил)-3-(3,4-дихлорфенил)пиперидин. Соединения из подготовительного примера 8 (470 мг) и подготовительного примера 12 (260 мг) смешивают с карбонатом калия (414 мг) в ацетонитриле (15 мл) и нагревают с обратным холодильником в течение ночи. Реакционной смеси дают возможность остыть и распределяют между этилацетатом и водой. Органическую фазу промывают солевым раствором, сушат над сульфатом магния и фильтруют с получением неочищенного материала, который после этого очищают хроматографией на силикагеле, используя смесь дихлорметан:метанол (98:2) в качестве элюента, с получением чистого продукта (334 мг). 1 Раствор метансульфонилхлорида (122 мкл) в дихлорметане (15 мл) добавляют за период 30 мин к ледяному раствору соединения подготовительного примера 13 (773 мг) и триэтиламина(420 мкл) в дихлорметане (30 мл) в атмосфере азота и эту смесь перемешивают в течение 1 ч. Реакционную смесь упаривают до сухости в вакууме и остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 95/5/0,5) с получением соединения, указанного в заголовке, в виде пены (470 мг). ТСХ Rf: 0,41 (дихлорметан/метанол/гидроксид аммония 93/7/1 по объему). Раствор уксусного ангидрида (104 мкл) в дихлорметане (20 мл) добавляют к охлажденному во льду раствору соединения подготовительного примера 13 (515 мг) и триэтиламина (280 мкл) в дихлорметане (25 мл). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивание продолжают в течение 2 ч. Реакционную смесь упаривают до сухости в вакууме и остаток очищают колоночной хроматографией на силикагеле, используя градиентное элюирование (дихлорметан/метанол/гидроксид аммония от 95/5/0,5 до 93/7/1 по объему) с получением соединения, указанного в заголовке, в виде пены (458 мг). ТСХ Rf: 0,33 (дихлорметан/метанол/гидроксид аммония 93/7/1 по объему). Раствор бензоилхлорида (128 мкл) в дихлорметане (15 мл) добавляют к раствору соединения подготовительного примера 13 (516 мг) и триэтиламина (280 мкл) в дихлорметане(25 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь упаривают до сухости в вакууме и остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 95/5/0,5 по объему) с получением соединения, указанного в заголовке, в виде пены[]D +15,2 (с=0,14, метанол). Примеры 6-10. Следующие соединения общей формулы или их соли получают из соединения подготовительного примера 13 и соответствующих сульфонилхлоридов способами, подобными тем,которые использовали в примере 3. Пример 6. (+)-3(R)-1-Бензоил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидин. Пример 7. (+)-3(R)-3-(3-[3-(4-Бензолсульфонилпиперазин-1-ил)азетидин-1-ил]пропил)-1 бензоил-3-(3,4-дихлорфенил)пиперидин. ТСХ: дихлорметан/метанол/гидроксид аммония 93/7/1 по объему Пример 11. (+)-3(R)-1-Бензоил-3-(3,4 дихлорфенил)-3-(3-[3-морфолиноазетидин-1 ил]пропил)пиперидин Часть А. Оксалилхлорид (0,17 мл) добавляют к дихлорметану (10 мл) в атмосфере азота и этот раствор охлаждают на бане сухой лед/ ацетон, а затем по каплям добавляют безводный метилсульфоксид (0,18 мл) и оставляют перемешиваться в течение 0,75 ч; к этой смеси по каплям добавляют соединение из подготовительного примера 7 (500 мг), растворенное в дихлорметане (10 мл). После дополнительных 0,75 ч добавляют диизопропилэтиламин(0,67 мл), смеси дают возможность нагреться до температуры окружающей среды, а затем вливают ее в 2 н. водную соляную кислоту (75 мл). Полученный раствор трижды экстрагируют ди хлорметаном. Объединенные органические фазы промывают солевым раствором и сушат над сульфатом натрия, а затем концентрируют с получением неочищенного промежуточного альдегида в виде желтого масла (МСНР m/z 390[m]+), которое берут на следующую стадию без очистки. Часть Б. Неочищенный альдегид из части А растворяют в тетрагидрофуране (25 мл) вместе с ледяной уксусной кислотой (0,87 мл), триацетоксиборгидридом натрия (432 мг) и 3 морфолиноазетидина дигидрохлоридом (подготовительный пример 25, 411 мг). После перемешивания данной смеси при температуре окружающей среды в течение 12 ч добавляют воду(2 мл), и растворитель выпаривают в вакууме. К полученному неочищенному продукту добавляют 1 н. водный гидроксид натрия (примерно 10 мл), и эту смесь трижды экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором, сушат над сульфатом натрия и концентрируют в вакууме, 19 после чего очищают на силикагеле с использованием смеси дихлорметан: метанол: гидроксид аммония (95:5:0,5) в качестве элюента с получением 553 мг целевого соединения. 1 Н ЯМР: 7.5-7.2 (m, 8 Н), 4.43 (m, 1 Н), 3.62 Соединение из подготовительного примера 8 (225 мг) смешивают с соединением из подготовительного примера 20 (250 мг) и гидрокарбонатом калия (200 мг) в ацетонитриле (15 мл) и полученную смесь нагревают с обратным холодильником в течение ночи. После охлаждения реакционной смеси до температуры окружающей среды добавляют воду (15 мл) и эту смесь трижды экстрагируют этилацетатом. Объединенные органические слои промывают солевым раствором, сушат над сульфатом магния и концентрируют в вакууме. Очистка неочищенного продукта на силикагеле с использованием смеси этилацетат:2-пропанол (4:1) в качестве элюента дает соединение, указанное в заголовке (165 мг). 1 Н ЯМР: 7.70 (m, 1 Н), 7.49 (m, 2 Н), 7.31 Соединение из подготовительного примера 8 (300 мг) смешивают с соединением из подготовительного примера 22 (400 мг) и гидрокарбонатом калия (300 мг) в ацетонитриле (15 мл),и полученную смесь нагревают до температуры 20 дефлегмации в течение ночи. После охлаждения реакционной смеси до температуры окружающей среды добавляют воду (25 мл) и эту смесь трижды экстрагируют этилацетатом. Объединенные органические слои промывают солевым раствором, сушат над сульфатом магния и концентрируют в вакууме. Хроматография неочищенного продукта на силикагеле с использованием смеси этилацетат:2-пропанол (4:1) в качестве элюента дает соединение, указанное в заголовке (185 мг). 1 Соединение из подготовительного примера 14 (100 мг) растворяют в дихлорметане (2 мл) и охлаждают на бане лед/вода. К этой смеси добавляют метансульфонилхлорид (0,02 мл) и триэтиламин (0,032 мл). Реакционной смеси дают нагреться до температуры окружающей среды и перемешивают в течение ночи, а затем гасят водой. Органическую фазу отделяют,промывают солевым раствором, сушат сульфатом магния, фильтруют и концентрируют. Хроматография на силикагеле с использованием смеси дихлорметан:метанол (9:1) в качестве элюента дает соединение, указанное в заголовке 21 Соединение из подготовительного примера 18 (125 мг) растворяют в дихлорметане (2,5 мл) и охлаждают на бане лед/вода. К этой смеси добавляют триэтиламин (0,046 мл) и бензолсульфонилхлорид (0,04 мл). Реакционной смеси дают нагреться до температуры окружающей среды и перемешивают в течение ночи, а затем гасят водой. Органическую фазу отделяют,промывают солевым раствором, сушат сульфатом магния, фильтруют и концентрируют. Хроматография на силикагеле с использованием смеси дихлорметан: метанол (95:5) в качестве элюента дает соединение, указанное в заголовке, (52 мг). 1 Н ЯМР 7.73 (m, 2 Н), 7.55 (m, 1 Н), 7.50 (m,2H), 7.37 (m, 1 Н), 7.20 (m, 1H), 3.46-0.84 (m,30 Н). ТСХ (дихлорметан: метанол =9:1) Rf: 0,45 МСНР m/z: 630 (m+H)+. Обнаружено: С 52.35; Н 6.11; N 8.46. С 28 Н 38N4O4 Сl2S2.0,2 Н 2O требует С 52.38; Н 5.99; Циклопропилуксусную кислоту (0,2 мл) растворяют в дихлорметане (5 мл) и охлаждают на бане лед/вода. К этой смеси добавляют N-метилморфолин (0,1 мл), 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (95 мг) и 1-гидроксибензотриазола гидрат (50 мг). Затем через 1 ч добавляют соединение из подготовительного примера 18 (150 мг) и смесь перемешивают в течение ночи при температуре окружающей среды. Растворитель затем упаривают в вакууме и смесь разделяют между этилацетатом и водой. Полученную органическую фазу промывают солевым раствором, сушат сульфатом магния, фильтруют и концентрируют. Хроматография на силикагеле с использованием смеси дихлорметан:метанол (95:5) в качестве элюента дает соединение, указанное в заголовке. 1 Н ЯМР: 7.36-7.13 (m, 3 Н), 3.50-0.79 (m,37 Н). МСНР m/z: 572 (m+Н)+. 3,4-Дифторбензойную кислоту (145 мг) растворяют в дихлорметане (5 мл) и охлаждают на бане лед/вода. К этой смеси добавляют 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид (95 мг), 1-гидроксибензотриазола гидрат (50 мг) и N-метилморфолин (0,1 мл) и реакционную смесь перемешивают в течение 1 ч. Затем добавляют соединение из подготовительного примера 18 (150 мг) и эту смесь перемешивают при температуре окружающей среды в течение ночи, а затем растворитель удаляют в вакууме. К полученной смеси добавляют 1 М бикарбонат натрия и этилацетат; органический слой отделяют и промывают водой и солевым раствором, сушат над сульфатом магния,фильтруют и концентрируют с получением неочищенной смеси. Хроматография на силикагеле с использованием смеси дихлорметан: метанол (95:5) в качестве элюента дает чистый продукт (60 мг). 1 Н ЯМР: 7.48-6.96 (m, 6H), 3.30-1.22 (m,30 Н). 3-Хлорбензойную кислоту (140 мг) растворяют в дихлорметане (5 мл) и охлаждают на бане лед/вода. К этой смеси добавляют 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид (95 мг), 1-гидроксибензотриазола гидрат (50 мг) и N-метилморфолин (0,1 мл) и реакционную смесь перемешивают в течение 1 ч. Затем добавляют соединение из подготовительного примера 18 (150 мг) и смесь перемешивают при температуре окружающей среды в течение ночи, а затем растворитель удаляют в вакууме. К полученной смеси добавляют 1 М бикарбонат натрия и этилацетат; органический слой отделяют и промывают водой и солевым раствором, а затем сушат над сульфатом магния, фильтруют и концентрируют с получением неочищенной смеси. Хроматография на силикагеле с использованием смеси дихлорметан:метанол (95:5) в качестве элюента дает соединение, указанное в заголовке. 1 Н ЯМР: 7.42-7.06 (m, 6H), 3.38-1.37 (m, 30 Н). МСНР m/z 629 (m+h)+. Следующие подготовительные примеры иллюстрируют синтез некоторых исходных материалов, используемых в предшествующих примерах. Подготовительный пример 1. 2-(3,4-Дихлорфенил)-5-гексеннитрил Соединение примера 1 (14,55 г) растворяют в трифторуксусной кислоте (100 мл) и этот раствор перемешивают при комнатной температуре в атмосфере азота в течение 1 ч. Реакционную смесь упаривают до сухости в вакууме. Остаток растворяют в этилацетате (1500 мл) и промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом натрия и упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 85/15/2) с получением соединения, указанного в заголовке, в виде пены (9,77 г). ТСХ Rf: 0,21 (дихлорметан/метанол/ гидроксид аммония 90/10/2 по объему).[]D+22,0 (с=0,10, метанол). Пример 20. Соль трифторуксусной кислоты 3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3-[3(гомопиперазин-1-ил)азетидин-1-ил]пропил)пиперидина К раствору гидрида натрия (14,8 г, 60% дисперсия в минеральном масле) в диметилформамиде (ДМФ, 150 мл) при 0 С в атмосфере азота добавляют раствор 3,4-дихлорфенилацетонитрила (68,9 г, 1 молярный эквивалент) в ДМФ (300 мл) и эту смесь перемешивают в течение 3 ч. Затем добавляют раствор 4-бромбут 1-ена (50 г, 1 молярный эквивалент) в ДМФ (100 мл) и эту смесь перемешивают при комнатной температуре в течение 1 ч, затем нагревают до 60 С в течение 5 ч. Реакционную смесь охлаждают и добавляют воду (1 л). Затем смесь экстрагируют этилацетатом (2 х 500 мл). Объединенные органические экстракты затем промывают водой (2 х 1 литр), сушат над МgSO4 и растворитель удаляют при пониженном давлении. Остаток затем очищают колоночной хроматографией на силикагеле, элюируя градиентом растворителей этилацетат:гексан (от 1:19 до 1:6 по объему) с получением соединения, указанного в заголовке, (51,5 г). ТСХ (гексан:этилацетат 6:1) Rf = 0,47. 1 Соединение из примера 2 (300 мг) растворяют в дихлорметане (7 мл), охлаждают на бане лед/вода и обрабатывают трифторуксусной кислотой (7 мл). Через 2 ч смесь медленно разбавляют дихлорметаном (50 мл) и 1 н. карбонатом натрия до прекращения выделения пузырьков газа. Органический слой отделяют (с трудом) и промывают солевым раствором, сушат над сульфатом магния и фильтруют с получением неочищенного материала (269 мг), который не нуждается в дальнейшей чистке. 1 К раствору соединения подготовительного примера 1 (50,5 г, 210,4 ммоль) в диоксане (150 мл) при 0 С в атмосфере азота добавляют трет-бутилат калия (1,5 г, 0,06 молярных эквивалента) и этилакрилат (25,4 мл, 1,11 молярных эквивалента) и эту смесь перемешивают в течение 1 ч. Затем добавляют водный раствор гидроксида натрия (2H, 150 мл),и эту смесь перемешивают при комнатной температуре в течение 70 мин. Затем добавляют метил-трет-бутиловый эфир (300 мл) и эту смесь подкисляют до рН 1,используя водный раствор 2 н. соляной кислоты. Раствор затем экстрагируют метил-третбутиловым эфиром (2 х 300 мл) и объединенные органические фазы сушат над MgSO4 и фильт 25 руют. Удаление растворителя в вакууме дает соединение, указанное в заголовке, (68,12 г). 1 Часть а Смесь соединения подготовительного примера 2 (247 г) в ацетоне (247 мл) и S-(-)-1-(1 нафтил)этиламина (68,8 г) нагревают до 50 С и добавляют теплый гексан до тех, пор пока не появится помутнение. Смесь вновь нагревают до 50 С и добавляют достаточно дополнительного гексана (50 мл), чтобы вновь вызвать помутнение. Полученный мутный раствор перемешивают при комнатной температуре в течение 18 ч. Липкий осадок собирают фильтрованием и промывают гексаном (3 х 200 мл) и смесью ацетон/гексан (200 мл; 10% по объему). Твердое вещество сушат при 50 С с получением(1-нафтил)этиламинной соли соединения, указанного в заголовке, 108,7 г. Этот материал перемешивают в ацетоне (300 мл) и небольшое количество нерастворимого материала удаляют фильтрованием. Фильтрат перемешивают при комнатной температуре и добавляют гексан(1200 мл) до точки помутнения. Осаждение происходит в течение 5 мин. После перемешивания при комнатной температуре в течение 1 ч твердый осадок собирают фильтрованием и сушат (54,1 г). Этот процесс повторяют с 210,3 г соединения подготовительного примера 2 и S(-)-1-(1-нафтил)этиламином (58,7 г) с получением твердого вещества, которое объединяют с 54,1 г продукта, полученного при первом прогоне, с получением общего выхода 135,2 г. Часть б Соль из части а перемешивают в дихлорметане (1000 мл) и воде (1000 мл) и подщелачивают 40% раствором гидроксида натрия. Эту смесь перемешивают в течение 30 мин с получением стабильной эмульсии, которую обрабатывают твердым хлоридом натрия. После дополнительного периода перемешивания (15 мин) слои разделяют, и водный раствор разбавляют водой(1000 мл) и промывают дополнительным дихлорметаном (1000 мл). Объединенные органические промывные воды промывают насыщенным солевым раствором и упаривают до сухости с выделением хирального разделяющего агента (45 г). Водную фазу перемешивают с дихлорметаном (1500 мл) и подкисляют до рН 0,5 концентрированной соляной кислотой и полученную смесь перемешивают в течение до 002773 26 полнительных 30 мин. Слои разделяют, и водный слой экстрагируют дихлорметаном(500 мл). Объединенные органические экстракты промывают водой, сушат над сульфатом натрия и упаривают до сухости в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (69,8 г). ТСХ Rf: 0,19 (дихлорметан/метанол/ гидроксид аммония 85:15:2 по объему). Озон в потоке кислорода барботируют через раствор соединения подготовительного примера 3 (15,6 г) в этаноле (400 мл) при -78 С в течение 1 ч. Охлаждение прекращают и полученный голубовато-зеленый раствор продувают азотом в течение 1 ч для удаления избытка озона. Раствор затем охлаждают на ледяной бане и порциями добавляют боргидрид натрия (9,45 г) и полученную смесь перемешивают при комнатной температуре в течение 18 ч. Раствор охлаждают на ледяной бане и подкисляют до рН 2 путем осторожного добавления 5 н. соляной кислоты. Частично обработанную реакцию объединяют с частично обработанным материалом из идентичного получения и разбавляют водой(300 мл). Полученный раствор экстрагируют в дихлорметан (3 х 1000 мл). Объединенные органические экстракты сушат над сульфатом магния и упаривают в вакууме с получением соединения, указанного в заголовке, в виде пены(30,0 г), которую используют без какой-либо дальнейшей очистки. ТСХ Rf: 0,11 (дихлорметан/метанол/ гидроксид аммония 80:20:3 по объему). 27 Концентрированную серную кислоту (3 мл) добавляют к раствору соединения подготовительного примера 4 (29,7 г) в ледяной уксусной кислоте (400 мл) и смесь нагревают с обратным холодильником в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры и оставляют стоять в течение 18 ч. Выпаривание летучих веществ в вакууме дает остаток, который растворяют в дихлорметане (1000 мл) и промывают насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический раствор сушат над сульфатом натрия и упаривают до сухости в вакууме с получением соединения, указанного в заголовке, в виде не совсем белого твердого вещества (31,48 г), которое используют без дальнейшей очистки. ТСХ Rf: 0,55 (дихлорметан/метанол 95:5 по объему). Комплекс боран-диметилсульфид (83 мл) добавляют по каплям в течение 10 мин к раствору соединения подготовительного примера 5(31,27 г) в сухом тетрагидрофуране (450 мл) при 0 С. Данной смеси дают возможность нагреться до комнатной температуры в течение 30 мин, а затем до температуры дефлегмации в течение 1 ч. После 2 ч при температуре дефлегмации раствор охлаждают на ледяной бане и по каплям осторожно добавляют метанольный хлороводород (300 мл приблизительно 1,75 н. раствора) в течение периода в 1 ч. Сильно кислому раствору дают нагреться до комнатной температуры и перемешивают при этой температуре в течение ночи. Раствор упаривают до сухости в вакууме и остаток распределяют между водой (500 мл) и диэтиловым эфиром (500 мл). Водный раствор промывают дополнительным диэтиловым эфиром (500 мл) и объединенные органические фазы сливают. Водный раствор подщелачивают гидроксидом аммония (удельный вес 0,880) и экстрагируют в диэтиловый эфир (2 х 750 мл). Объединенные экстракты сушат над сульфатом натрия и упаривают до сухости с получением соединения, указанного в заголовке, в виде смолы, 25,2 г, которую используют без дальнейшей очистки. Небольшое количество (650 мг) очищают колоночной хроматографией на силикаге 002773 28 ле (дихлорметан/метанол/гидроксид аммония) с получением чистого образца соединения, указанного в заголовке (546 мг). ТСХ Rf: 0,34 (дихлорметан/метанол/гидроксид аммония 90:10:2 по объему). МСНР m/z: 288 (MH+). 1 К ледяному раствору соединения подготовительного примера 6 (15,44 г) и триэтиламина(13,01 г) в сухом дихлорметане (300 мл) медленно в течение примерно 10 мин добавляют бензоилхлорид (16,57 г). Полученной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 24 ч. Реакционную смесь упаривают до сухости в вакууме и остаток растворяют в этаноле (300 мл) и дихлорметане (100 мл). К этому раствору добавляют гидроксид натрия (155 мл 2 н. водного раствора) и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Раствор охлаждают на ледяной бане и подкисляют до рН 6, используя 6 н. соляную кислоту, а затем упаривают до малого объема. Смесь экстрагируют этилацетатом (2 х 300 мл) и объединенные экстракты сушат над сульфатом натрия и упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 95/5/0,5 по объему) с получением соединения, указанного в заголовке, в виде белой пены (19,90 г). ТСХ Rf: 0,32 (дихлорметан/метанол/гидроксид аммония 95:5:0,5 по объему). Метансульфонилхлорид (4,63 мл) добавляют в течение 10 мин к ледяному раствору соединения подготовительного примера 7 (19,57 г) и триэтиламина (9,74 мл) в атмосфере азота. Реакционную смесь перемешивают при 0 С в течение 30 мин, а затем нагревают до комнатной 29 температуры. Реакционную смесь разбавляют дихлорметаном (150 мл) и последовательно промывают водой, 1 н. водным раствором лимонной кислоты и насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат над сульфатом натрия и упаривают до сухости в вакууме с получением соединения,указанного в заголовке, в виде пены (23,06 г). ТСХ Rf: 0,61, кремнезем, дихлорметан/метанол 95:5 по объему. МСНР m/z: 471 (МН+). 1 Н ЯМР: 7.39 (m, 5 Н), 7.24 (m, 3 Н), 4.35(WO 96/05193) (20 г) в сухом ацетонитриле (600 мл) нагревают с обратным холодильником в течение 32 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют этилацетатом и промывают водой и солевым раствором. Органическую фазу сушат над сульфатом натрия и упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол 97/3 по объему) с получением соединения, указанного в заголовке, в виде твердого вещества (22,53 г). ТСХ Rf: 0,17 (дихлорметан/метанол 98/2 по объему). МСНР m/z: 408 (МН+). Подготовительный пример 10. 3-(4-Третбутоксикарбонилпиперазин-1-ил)азетидин 1-Хлорэтилхлорформиат (6,88 мл) добавляют по каплям к ледяному раствору соединения подготовительного примера 9 (22 г) в сухом дихлорметане (100 мл). Перед выпариванием летучих веществ в вакууме полученную смесь перемешивают при комнатной температуре в течение 3 ч. К остатку добавляют порошкообразный карбонат калия (13,2 г) и метанол (125 мл) и смесь нагревают с обратным холодильником в течение 2 ч. Охлажденную реакционную смесь фильтруют через ускоритель фильтрования SOLKAFLOC и фильтрат упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 80/20/3) с по 002773 К раствору 1-дифенилметил-3-метансульфонилоксиазетидина (WO 96/05193) (25 г) в ацетонитриле (800 мл) добавляют соединение подготовительного примера 24 (19 г) и карбонат калия (33 г). Реакционную смесь нагревают до температуры дефлегмации в течение 12 ч, затем охлаждают до комнатной температуры. Затем к полученной суспензии добавляют воду, и смесь трижды экстрагируют этилацетатом. Объединенные органические фазы промывают солевым раствором, сушат над сульфатом магния,фильтруют и сушат в вакууме с получением неочищенного продукта. Хроматография на силикагеле с элюированием смесью дихлорметанметанол (95:5) дает соединение, указанное в заголовке, (24,7 г). 1 Н ЯМР: 7.41-7.14 (m, 10 Н), 4.39 (s, 1H),3.41 (m, 6H), 3.15 (m, 1H), 2.82 (m, 2H), 2.38 (m,4 Н), 1.78 (m, 2H), 1.45 (s, 9H). МСНР m/z: 422 (m+H)+. Подготовительный пример 12. 3-(4-Третбутоксикарбонилгомопиперазин-1-ил)азетидин Соединение из подготовительного примера 11 (1,0 г) растворяют в этаноле (75 мл) и смешивают с гидроксидом палладия (катализатор Перлмана, 200 мг), затем обрабатывают водородом при 345 кПа (50 фунтов на квадратный дюйм) в течение 16 ч. Катализатор удаляют фильтрованием и фильтрат упаривают до сухости. Хроматография на силикагеле с использованием смеси дихлорметан:метанол:гидроксид аммония (90:10:2) в качестве элюента дает соединение, указанное в заголовке. 1 Н ЯМР: 3.55-3.38 (m, 10 Н), 2.40 (m, 4 Н),1.82 (m, 2H), 1.46 (s, 9H). 31 Соединение примера 1 (14,55 г) растворяют в трифторуксусной кислоте (100 мл) и этот раствор перемешивают при комнатной температуре в атмосфере азота в течение 1 ч. Реакционную смесь упаривают до сухости в вакууме. Остаток растворяют в этилацетате (1500 мл) и промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом натрия и упаривают до сухости в вакууме. Остаток очищают колоночной хроматографией на силикагеле (дихлорметан/метанол/гидроксид аммония 85/15/2) с получением соединения, указанного в заголовке, в виде пены, 9,77 г. ТСХ Rf: 0,21 (дихлорметан/метанол/гидроксид аммония 90/10/2 по объему). МСНР m/z: 515(MH+). 1[]D+22,0 (с=0,10, метанол). Подготовительный пример 14. Соль трифторуксусной кислоты 3(R)-1-бензоил-3-(3,4 дихлорфенил)-3-(3-[3-(гомопиперазин-1-ил)азетидин-1-ил]пропил)пиперидина Соединение из примера 2 (300 мг) растворяют в дихлорметане (7 мл), охлаждают на бане лед/вода и обрабатывают трифторуксусной кислотой (7 мл). Через 2 ч смесь медленно разбавляют дихлорметаном (50 мл) и 1 н. карбонатом натрия до прекращения выделения пузырьков газа. Органический слой отделяют (с трудом) и промывают солевым раствором, сушат над сульфатом магния и фильтруют с получением неочищенного материала (269 мг), который не нуждается в какой-либо дальнейшей очистке. 1 Н ЯМР: 7.48-7.20 (m, 8H), 3.45-1.22 (m,29H). ТСХ (дихлорметан: метанол: гидроксид аммония =90:10:1) Rf: 0,13. МСНР m/z: 529 (m+H)+. Подготовительный пример 15. 3(S)-1-Третбутоксикарбонил-3-(3,4-дихлорфенил)-3-(3 гидроксипропил)пиперидин Соединение из подготовительного примера 6 (5,0 г) и трет-бутоксикарбонильный ангидрид растворяют в дихлорметане (50 мл) и переме 002773 32 шивают при температуре окружающей среды в течение ночи. Этот раствор промывают водным бикарбонатом натрия и солевым раствором, сушат над сульфатом магния, фильтруют и упаривают до сухости с получением продукта (5,59 г). 1 Н ЯМР: 7.43 (s, 1 Н), 7.39 (d, J=8 Гц, 1 Н),7.18 (d, J=8 Гц, 1 Н), 3.98 (m, 1H), 3.78-3.02 (m,6H), 2.03 (m, 1H), 1.80-1.03 (m, 17H). Метансульфонилхлорид (1,22 мл) добавляют по каплям к раствору соединения из подготовительного примера 15 (5,58 г) и триэтиламина (3,0 мл) в дихлорметане (50 мл), охлаждая в то же время на ледяной бане. Затем смеси дают возможность нагреться до температуры окружающей среды в течение 1,5 ч, после чего гасят водным бикарбонатом натрия. Экстрагированный органический слой промывают солевым раствором, сушат над сульфатом магния,фильтруют и упаривают до сухости с получением продукта (6,37 г). 1 Н ЯМР: 7.41 (m, 2H), 7.19 (m, 1H), 4.04 (t,J=7 Гц, 2 Н), 4.02 (m, 1H), 3.70-3.10 (m, 3 Н), 2.93 Соединение из подготовительного примера 16 (1,0 г) смешивают с соединением из подготовительного примера 22 (603 мг) и гидрокарбонатом калия (643 мг) в ацетонитриле (30 мл), и смесь нагревают до температуры дефлегмации в течение ночи. Реакционную смесь охлаждают до температуры окружающей среды и распределяют между этилацетатом (50 мл) и водой (25 мл). Органический слой промывают солевым раствором, сушат над сульфатом магния,фильтруют и упаривают в вакууме с получением неочищенной смеси. Очистка на силикагеле смесью дихлорметан:метанол:гидроксид аммония (98:2:1) дает целевое соединение (1,18 г). 1 Соединение из подготовительного примера 17 (606 мг) растворяют в дихлорметане (2 мл) и охлаждают на бане лед/вода, после чего добавляют трифторуксусную кислоту (2 мл). Через 1 ч добавляют толуол (10 мл) с последующим выпариванием растворителя в вакууме. К остатку добавляют 0,2 н. гидроксид натрия (50 мл) и смесь повторно экстрагируют дихлорметаном. Объединенные органические фазы сушат над сульфатом магния, фильтруют и упаривают с получением белого твердого вещества (376 мг). 1 Н ЯМР: 7.38 (m, 2 Н), 7.12 (m, 1 Н), 3.311.82 (m, 22H), 1.8-1.38 (m, 6H), 0.93 (m, 2H). К раствору 1-дифенилметил-3-метансульфонилоксиазетидина (WO 96/05193) (1,4 г) в диоксане (25 мл) добавляют N-метилбензолсульфонамид (1,2 г) и карбонат кальция (2,6 г). Реакционную смесь нагревают до температуры дефлегмации в течение 3 ч, затем охлаждают до комнатной температуры. К полученной суспензии добавляют воду (20 мл) и смесь экстрагируют этилацетатом (3 х 25 мл). Объединенные органические фазы промывают солевым раствором, сушат над сульфатом магния, фильтруют и сушат в вакууме с получением неочищенного продукта. Хроматография на силикагеле с элюированием смесью этилацетат:гексаны (2:3 по объему) дает соединение, указанное в заголовке в виде белой пены (1,31 г). 1 Соединение из подготовительного примера 19 (1,3 г) растворяют в этаноле (30 мл) и сме 002773 34 шивают с гидроксидом палладия (катализатор Перлмана, 600 мг), затем обрабатывают водородом при 345 кПа (50 фунтов на квадратный дюйм) в течение 24 ч. Катализатор удаляют фильтрованием и фильтрат упаривают до сухости. Хроматография на силикагеле с использованием смеси дихлорметан:метанол:гидроксид аммония (93:7:1) в качестве элюента дает соединение, указанное в заголовке. 1 Н ЯМР: 7.70 (d, J = 7 Гц, 2 Н), 7.61 (t, J = 7 Гц, 1H), 7.53 (t, J = 7 Гц, 2 Н), 4.60 (m, 1H), 4.06 К раствору 1-дифенилметил-3-метансульфонилоксиазетидина (WO 96/05193) (1,2 г) в диоксане (15 мл) добавляют N-фенилметансульфонамид (1,0 г, 5,85 ммоль) и карбонат кальция (2,0 г, 6,1 ммоль). Реакционную смесь нагревают до температуры дефлегмации в течение 2 ч, затем охлаждают до комнатной температуры. К полученной суспензии добавляют воду (20 мл) и смесь экстрагируют сульфатом магния, фильтруют и сушат в вакууме с получением неочищенного продукта. Перекристаллизация из смеси этилацетат:гексаны (4:1) дает 964 мг белого твердого вещества. 1 Соединение из подготовительного примера 21 (890 мг) растворяют в этаноле (30 мл) и смешивают с гидроксидом палладия (катализатор Перлмана, 800 мг), затем обрабатывают водородом при 345 кПа (50 фунтов на квадратный дюйм) в течение 48 ч. Катализатор удаляют фильтрованием и фильтрат упаривают до сухости. Хроматография на силикагеле с использованием смеси дихлорметан: метанол: гидроксид аммония (93:7:1) в качестве элюента дает чистый продукт. 1 К раствору 1-дифенилметил-3-метансульфонилоксиазетидина (WO 96/05193) (7,73 г) в ацетонитриле (250 мл) добавляют метансульфонилпиперазин (4,8 г). Реакционную смесь нагревают с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры и концентрируют до пены. Очистка на силикагеле с использованием смеси дихлорметан: метанол:гидроксид аммония (95:5:0,5) в качестве элюента дает чистый продукт (5,97 г). ТСХ (дихлорметан:метанол:гидроксид аммония = 90:10:1) Rf: 0,44.m/z: 386 (m+H)+. Подготовительный пример 23. 3-(4-Метансульфонилпиперазин)азетидин Соединение из подготовительного примера 22 а (2,77 г) растворяют в безводном дихлорметане(40 мл), охлаждают на ледяной бане и обрабатывают 1-хлорэтилхлорформиатом (2,06 г). Раствору дают возможность нагреться до температуры окружающей среды и перемешивают в течение 3 ч,после чего растворитель удаляют в вакууме. К остатку добавляют метанол (40 мл) и раствор нагревают до температуры дефлегмации в течение 1 ч. После охлаждения до температуры окружающей среды и перемешивания в течение ночи полученный осадок собирают фильтрованием. 1 Трет-бутоксикарбонильный ангидрид (195 г) растворяют в дихлорметане (350 мл) и добавляют по каплям к раствору гомопиперазина (100 г) и триэтиламина (210 мг) в дихлорметане(500 мл), в то же время охлаждая на бане лед/вода. Смесь перемешивают в течение ночи,позволяя нагреться до температуры окружающей среды. После удаления растворителя в вакууме неочищенную смесь распределяют между 2 н. лимонной кислотой (водная) и диэтиловым эфиром. Водный слой промывают диэтиловым эфиром, затем подщелачивают 2 н. гидроксидом натрия и повторно экстрагируют дихлорметаном. Объединенные слои дихлорметана объединяют, сушат над сульфатом магния, фильтруют и упаривают до сухости с получением желтого масла (170 г).m/z: 201 (m+H)+. Подготовительный пример 25. 3-Морфолиноазетидина дигидрохлорид. Смесь 1-дифенилметил-3-морфолиноазетидина (полученного способом, аналогичным способу получения соединения подготовительного примера 22 а выше) (18,6 г), гидроксида палладия (2 г), этанола (200 мл) и 1 н. водного раствора соляной кислоты (52 мл) перемешивают в атмосфере водорода при 345 кПа (50 фунтов на квадратный дюйм) в течение 3 суток. Катализатор удаляют фильтрованием и фильтрат упаривают до сухости. Добавление к остатку дихлорметана (100 мл) и растирание дают твердое вещество, которое перекристаллизовывают из метанола с получением соединения, указанного в заголовке, (10,2 г).m/z: 179(m+Н)+. Фармакологические данные Приведенные ниже данные иллюстрируют сродство in vitro веществ по изобретению к НK3-рецептору коры головного мозга морской свинки. Анализы проводили согласно методу,упомянутому ранее на странице 17. Пример рИК 50 3 8,8 13 7,95 17 8,4 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) и его фармацевтически приемлемые соли,где А представляет собой СО, SO2; Аr1 представляет собой фенил, возможно замещенный одним или более чем одним галогеном;X1 представляет собой фенил, возможно замещенный галогеном, или С 1-6 алкил, причем указанный C1-6 алкил возможно замещен С 3-7 циклоалкилом; Х представляет собой непосредственно связь или NR1;R представляет собой SO2 фенил, SO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном),илиY представляет собой О, NСO(С 1-6 алкил),NСО 2(C1-6 алкил), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним гало 37 геном), NСОфенил, NСО 2 фенил, NSО 2 фенил,NH, NСН 2 фенил, NSO2 СН 2 Рh; при условии, что Х не представляет собой NR1,когда R представляет собой или. 2. Соединение или соль по п.1, где X1 представляет собой фенил или С 1-6 алкил, причем указанный С 1-6 алкил возможно замещен С 3-7 циклоалкилом. 3. Соединение или соль по любому из пп.12, где Х представляет собой непосредственно связь или NR1, где R1 представляет собой C1-6 алкил или фенил. 4. Соединение или соль по любому из пп.13, где R представляет собой SО 2 фенил, SО 2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном),или,где Y представляет собой О, NСО(С 1-6 алкил),NCO2(C1-6aлкил), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NH, NСН 2 фенил. 5. Соединение или соль по любому из пп.14, где А представляет собой СО. 6. Соединение или соль по любому из пп.15, где Аr1 представляет собой фенил, возможно замещенный атомами галогена в количестве вплоть до двух. 7. Соединение или соль по любому из пп.16, где X1 представляет собой С 1-6 алкил, замещенный С 3-7 циклоалкилом, или фенил, возможно замещенный галогеном. 8. Соединение или соль по любому из пп.17, где Х представляет собой непосредственно связь, N-метил или N-фенил. 9. Соединение или соль по любому из пп.18, где R представляет собой SО 2 фенил, SО 2(С 1-3 алкил, возможно замещенный одним или более чем одним галогеном),или,где Y представляет собой О, NСO(С 1-6 алкил),NСO2(С 1-6 алкил), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NH, NСН 2 фенил. 10. Соединение или соль по любому из пп.1-9, где Аr1 представляет собой фенил, возможно замещенный одним или двумя атомами хлора. 11. Соединение или соль по любому из пп.1-10, где X1 представляет собой C1-6 алкил,замещенный С 3-7 циклоалкилом, либо представляет собой фенил, возможно замещенный одним или более чем одним галогеном. 12. Соединение или соль по любому из пп.1-11, где R представляет собой SО 2 Рh,SО 2 СН 3, 002773,где Y представляет собой О, NСОСН 3,NСO2 С(СН 3)3, NSО 2 СН 3, NSO2C2H5, NSO2Ph,NSO2CH2Ph,NSO2CH(CH3)2,NSO2 СН 2 СF3,NCOPh, NH, NCH2Ph. 13. Соединение или соль по любому из пп.1-12, где Аr1 представляет собой фенил, 4 хлорфенил или 3,4-дихлорфенил. 14. Соединение или соль по любому из пп.1-13, где X1 представляет собой (С 3-7 циклоалкил)метил или фенил, возможно замещенный одним или более чем одним галогеном. 15. Соединение или соль по любому из пп.1-14, где R представляет собой SO2Ph,SO2 СН 3,или,где Y представляет собой О, NCOCH3,NСO2 С(СН 3)3, NSO2CH3, NSO2C2H2, NSO2Ph,NSO2CH2Ph,NSO2 СН(СН 3)2,NSO2CH2CF3,NCOPh. 16. Соединение или соль по любому из пп.1-15, где X1 представляет собой фенил, возможно замещенный одним или более чем одним атомом фтора или хлора. 17. Соединение или соль по любому из пп.1-16, где X1 представляет собой фенил, 3 хлорфенил или 3,4-дифторфенил. 18. Соединение или соль по п.1, которые выбраны из(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3(3-[3-(4-(2,2,2-трифторэтан)сульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3(3-[3-морфолиноазетидин-1-ил]пропил)пиперидина,(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3(3-[3-(N-метилбензолсульфонамидо)азетидин-1 ил]пропил)пиперидина,(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3(3-[3-(N-фенилметансульфонамидо)азетидин-1 ил]пропил)пиперидина,3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3[3-(4-метансульфонилгомопиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,3(R)-1-бензолсульфонил-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил) азетидин-1-ил]пропил)пиперидина,(+)-3(R)-1-(циклопропилацетил)-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,(+)-3(R)-3-(3,4-дихлорфенил)-1-(3,4-дифторбензоил)-3-(3-[3-(4-метансульфонилпиперазин-1-ил)азетидин-1-ил]пропил)пиперидина,(+)-3(R)-1-(3-хлорбензоил)-3-(3,4-дихлорфенил)-3-(3-[3-(4-метансульфонилпиперазин-1 ил)азетидин-1-ил]пропил)пиперидина,(+)-3(R)-1-бензоил-3-(3,4-дихлорфенил)-3(3-[3-пиперазиноазетидин-1-ил]пропил)пиперидина и 3(R)-1-бензоил-3-(3,4-дихлорфенил)-3-(3[3-(гомопиперазин-1-ил)азетидин-1-ил]пропил) пиперидина,и их фармацевтически приемлемых солей. 19. Фармацевтическая композиция, содержащая соединение или соль по любому из пп.118 вместе с фармацевтически приемлемым разбавителем, адъювантом или носителем. 20. Применение соединения или соли по любому из пп.1-18 в качестве лекарства. 21. Применение фармацевтической композиции по п.19 в качестве лекарства. 22. Применение соединения или соли по любому из пп.1-18 для изготовления лекарства для лечения заболевания продуцированием антагонистического воздействия на тахикинин,действующий на HK1-, HK2- или НK3-рецептор человека или комбинацию двух или более чем двух из них. 23. Применение соединения или соли по любому из пп.1-18 для изготовления лекарства для лечения воспалительного заболевания, такого как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройства центральной нервной системы (ЦНС), такого как тревога, депрессия, деменция или психоз, желудочно-кишечного (ЖК) расстройства, такого как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника,гастроэзофагеальный рефлюкс, энкопрез, колит,неспецифический язвенный колит или болезнь Крона, заболевания, вызванного Helicobacterpylori или другими уреаза-позитивными грамотрицательными бактериями, расстройства мочеполовых путей, такого как недержание, гиперрефлексия, импотенция или цистит, легочного расстройства, такого как хроническое обструктивное заболевание дыхательных путей, аллергии, такой как экзема, контактный дерматит,атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительности, такой как гиперчувствительность к сумаху укореняющемуся, ангиоспастического заболевания, такого как стенокардия или болезнь Рейно, пролиферативного расстройства, такого как рак, или расстройства, в которое вовлечена пролиферация фибробластов, фиброзного или коллагенового заболевания, такого как склеродермия или эозинофильный фасциолез, рефлюксной симпатической дистрофии, такой как синдром плечо/кисть, пристрастия, такого как алкоголизм, связанного со стрессом соматического расстройства, периферической невропатии, такой как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия,ожог, герпетическая невралгия или постгерпетическая невралгия, невропатологического расстройства, такого как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз,расстройства, связанного с усилением или супрессией иммунитета, такого как системная красная волчанка, ревматического заболевания,такого как фиброзит, рвоты, кашля, острой или хронической боли, мигрени, офтальмологического заболевания, такого как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройства мочевого пузыря или вирусного заболевания, такого как грипп или простуда. 24. Способ лечения человека или животного, который включает в себя продуцирование антагонистического воздействия на тахикинин,действующий на HK1-, HK2- или НK3-рецептор или комбинацию двух или более чем двух из них, при котором указанного человека лечат эффективным количеством соединения или соли по любому из пп.1-18 или композиции по п.19. 25. Способ лечения человека или животного, который включает в себя продуцирование антагонистического воздействия на тахикинин,действующий на НК 1-, НК 2- или НK3-рецептор или комбинацию двух или более чем двух из них, при котором указанного человека лечат эффективным количеством соединения или соли по любому из пп.1-18 или композиции по п.19,где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз,астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как тревога, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное заболевание кишечника, диспепсия, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, 41 энкопрез, колит, неспецифический язвенный колит или болезнь Крона, заболевание, вызванное Helicobacter pylori или другими уреазапозитивными грамотрицательными бактериями,расстройство мочеполовых путей, такое как недержание, гиперрефлексия, импотенция или цистит, легочное расстройство, такое как хроническое обструктивное заболевание дыхательных путей, аллергия, такая как экзема, контактный дерматит, атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительность, такая как гиперчувствительность к сумаху укореняющемуся, ангиоспастическое заболевание, такое как стенокардия или болезнь Рейно, пролиферативное расстройство, такое как рак, или расстройство, в которое вовлечена пролиферация фибробластов, фиброзное или коллагеновое заболевания, такое как склеродермия или эозинофильный фасциолез,рефлюксная симпатическая дистрофия, такая как синдром плечо/кисть, пристрастие, такое как алкоголизм, связанное со стрессом соматическое расстройство, периферическая невропатия, такая как диабетическая невропатия, невралгия, каузалгия, болезненная невропатия,ожог, герпетическая невралгия или постгерпетическая невралгия, невропатологическое расстройство, такое как болезнь Паркинсона, болезнь Альцгеймера или рассеянный склероз,расстройство, связанное с усилением или супрессией иммунитета, такое как системная красная волчанка, ревматическое заболевание,такое как фиброзит, рвота, кашель, острая или хроническая боль, мигрень, офтальмологическое заболевание, такое как пролиферативная ретинопатия, глазное воспаление, конъюнктивит, расстройство мочевого пузыря или вирусное заболевание, такое как грипп или простуда. 26. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (II) где X1, А и Аr1 такие, как определено в п.1, подвергают восстановительному аминированию амином формулы (III), как оно определено в п.26, или его солью. 28. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (VI) подвергают взаимодействию с соединением формулы (VII) где X1, А, Аr1, Х и R такие, как определено в п.1,a Z1 представляет собой подходящую уходящую группу. 29. Способ производства соединения формулы (I) или его соли по п.1, при котором восстанавливают соединение формулы (VIII) где X1, А, Аr1, Х и R такие, как определено в п.1. 30. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (IX) подвергают взаимодействию с нуклеофильным реагентом, действующим как синтон RX, гдеZ2 представляет собой уходящую группу. 31. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (X) подвергают взаимодействию с соединением формулы (III), где X1, А, Аr1, Х и R такие, как определено в п.1, a Z представляет собой подходящую уходящую группу. 27. Способ производства соединения формулы (I) или его соли по п.1, при котором соединение формулы (IV) подвергают взаимодействию с реагентом формулы X1-A-NH2, где Z3 и Z4 представляют собой уходящие группы и где X1, А, Аr1, Х и R такие,как определено в п.1. 32. Способ производства соединения формулы (I) или его соли по п.1, где R представляет собой или где Y представляет собой NСО(С 1-6 алкил),NСO2(С 1-6 алкил), NSO2(С 1-6 алкил, возможно замещенный одним или более чем одним галогеном), NСОфенил, NСО 2 фенил, NSO2 фенил,NСН 2 фенил, при котором соединение формулы(I) по п.1, где R представляет собой или когда как подходит, a Y представляет собой NH,подвергают взаимодействию с реагентом формулы [(С 1-6 алкил)СО-, (С 1-6 алкил)СO2-, (C1-6 алкил, возможно замещенный одним или более чем одним галогеном)SO2-,фенилСО-,фенилСО 2-, фенилSO2-, фенилСН 2-. 33. Способ производства соединения формулы (I) или его соли по п.1, где R представляет собой или где Y представляет собой NH, при котором соответствующее соединение, где Y представляет собой NСO2(С(СН 3)3), подвергают взаимодействию с кислотой. 34. Соль формулы (V) 44 где X1, А, Аr1, Х и R такие, как определено в п.1,а Y представляет собой противоион кислоты где X1, А и Аr1 такие, как определено в п.1, a Z2 представляет собой уходящую группу, или его соль.
МПК / Метки
МПК: C07D 401/06, A61K 31/451, A61P 29/00
Метки: производные, применение, антагонистов, качестве, промежуточные, азетидинилпропилпиперидина, соединения, тахикинина
Код ссылки
<a href="https://eas.patents.su/23-2773-proizvodnye-azetidinilpropilpiperidina-promezhutochnye-soedineniya-i-primenenie-v-kachestve-antagonistov-tahikinina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные азетидинилпропилпиперидина, промежуточные соединения и применение в качестве антагонистов тахикинина</a>
Предыдущий патент: 25-гидрокси-16-ен-26,27-бисгомохолекальциферолы
Случайный патент: Вытяжной колпак












