Производные бензазола и их применение в качестве модуляторов jnk
Номер патента: 7152
Опубликовано: 25.08.2006
Авторы: Готтелан Жан-Пьер, Алази Серж, Черч Деннис, Гайяр Паскаль, Кампс Монсеррат
Формула / Реферат
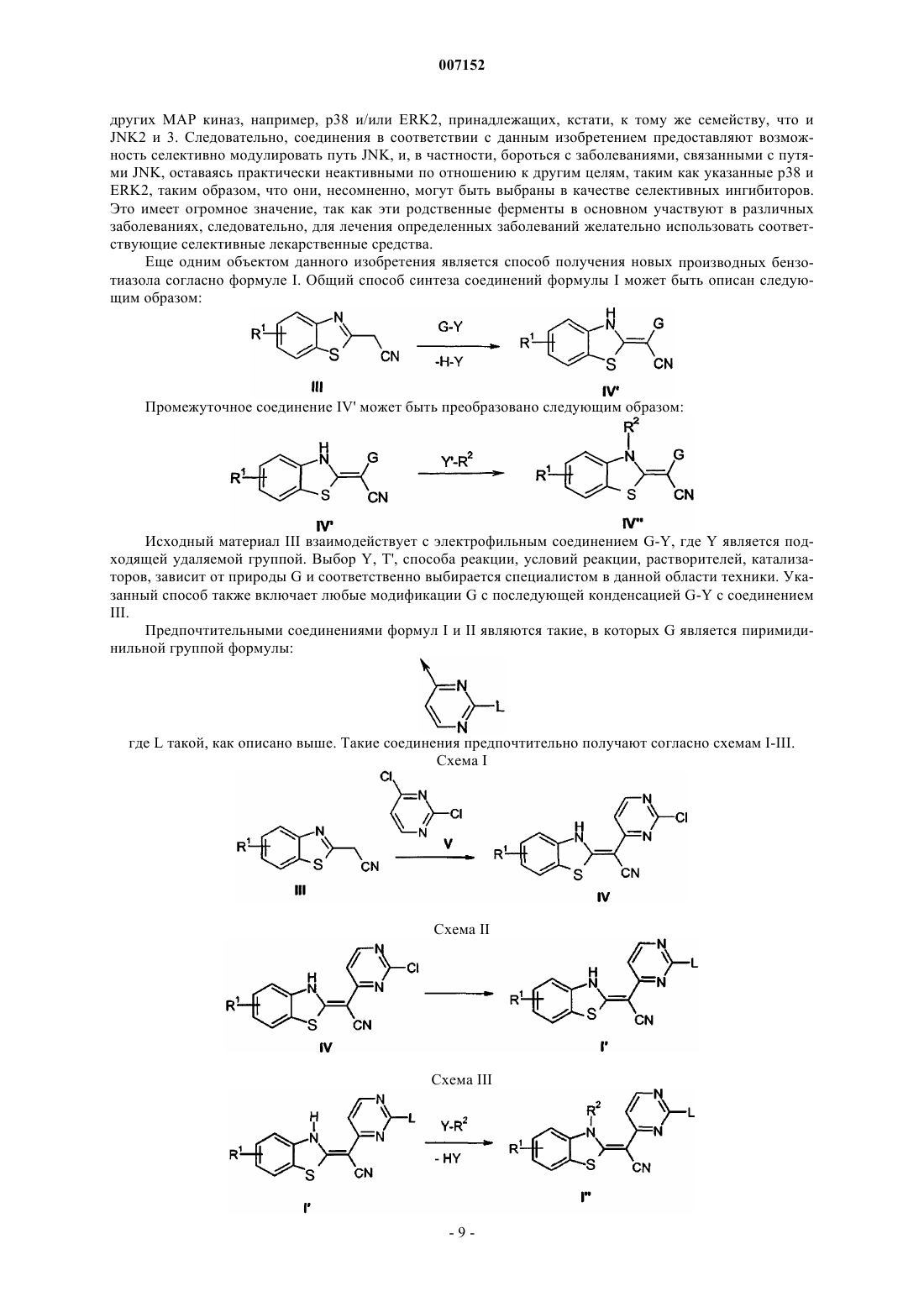
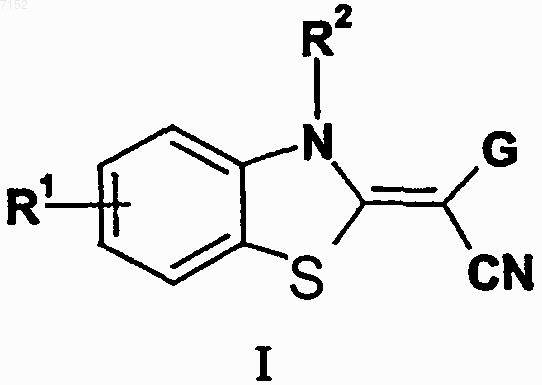
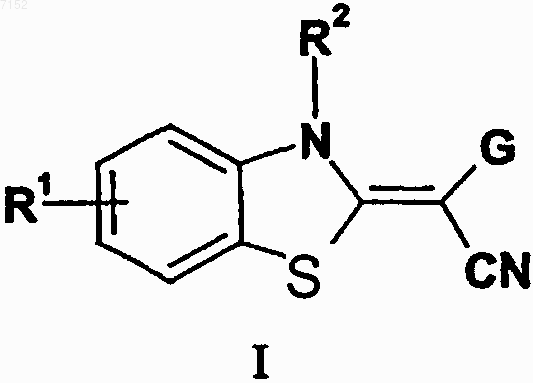
1. Производные бензазола формулы I
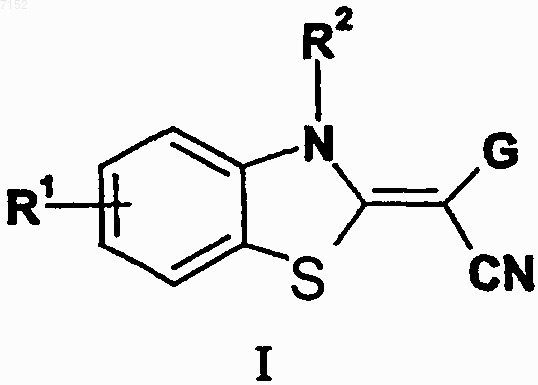
а также их таутомеры, их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемые соли или N-оксиды, где
G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещеный алкокси, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил ;
R1 представляет собой водород или C1-С6-алкил, необязательно замещенный галогеном;
R2 представляет собой водород или C1-С6-алкил;
где здесь и далее
термин "необязательно замещенный" относится к одному или нескольким заместителям, независимо выбранными из группы, включающей галоген, гидрокси, оксо, алкил, арил, гетероарил, алкокси, арилокси, арилалкилокси, гетероарилалкилокси, ароил, амино, моно- или диалкиламино, алкилоксикарбонил, алкилкарбамоил, арилкарбамоил, аминосульфонил, алкилсульфонил, арилсульфонил, пиперидинил, пиперазинил и морфолинил,
и указанные заместители могут быть также необязательно замещены указанными выше заместителями;
термин "алкил" сам по себе или в составе других групп относится к линейной или разветвленной C1-С6-алкильной группе;
термин "арил" относится к ароматической карбоциклической группе, содержащей от 6 до 14 атомов углерода, имеющей одно кольцо или несколько конденсированных колец,
термин "гетероарил" относится к моноциклическим, или бициклическим, или трициклическим конденсированным гетероароматическим группам;
при условии, что, если R1 и R2 представляют собой Н, G не может быть одним из следующих пиримидинов:

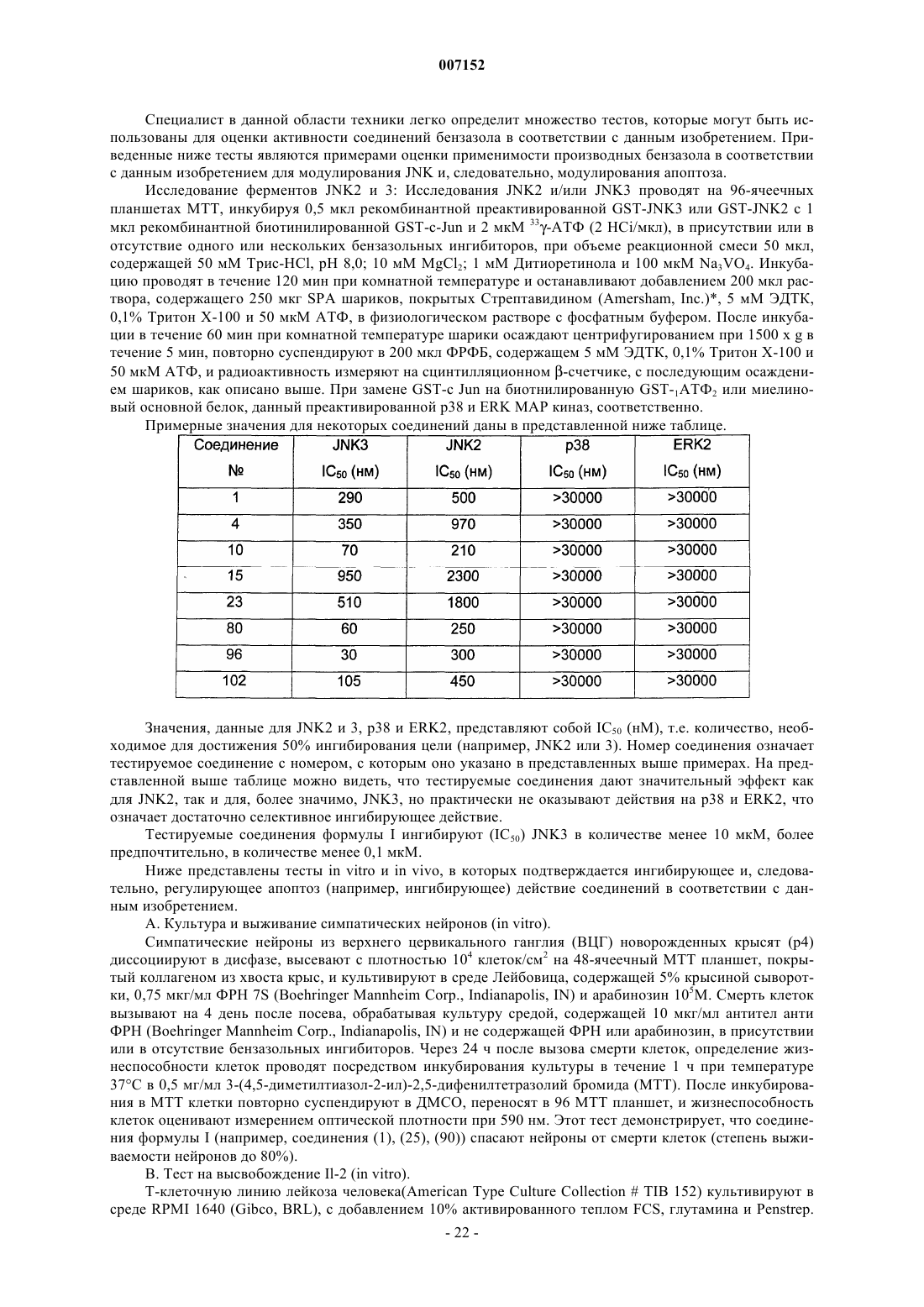
2. Производные бензотиазола формулы I, а также их таутомеры формулы II по п.1
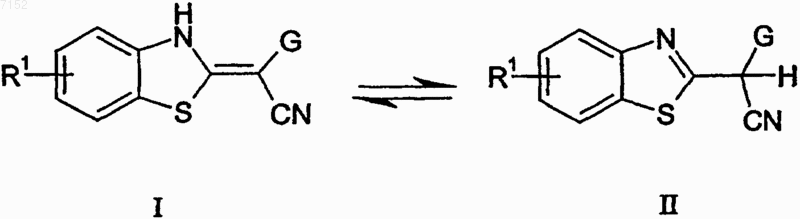
их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемые соли или N-оксиды,
где значения R1 и G такие, как указано в п.1.
3. Производное бензазола по п.1 или 2, где G является пиримидинилом формулы
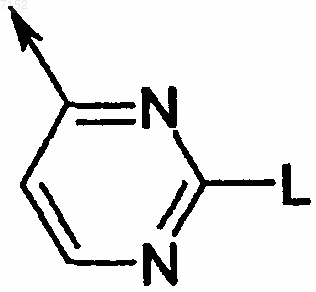
где L выбран из группы, включающей необязательно замещенный C1-С6-алкил, необязательно замещенный C1-С6-алкокси, галоген, гидрокси, нитро, гидразино, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино и необязательно замещенный гетероарил.
4. Производное бензазола по п.3, в котором L является группой -N(Ra,Rb), где Ra и Rb, каждый независимо, выбраны из группы, включающей Н, необязательно замещенный (C1-С6)-алкил, необязательно замещенный C1-С6-алкиларил, необязательно замещенный C1-С6-алкилгетероарил,
или группой -ORa, где Ra выбран из группы, включающей Н, необязательно замещенный (C1-С6)-алкил, необязательно замещенный C1-С6-алкиларил, необязательно замещенный C1-С6-алкилгетероарил и необязательно замещенный арил.
5. Производное бензазола по п.4, в котором L выбран из
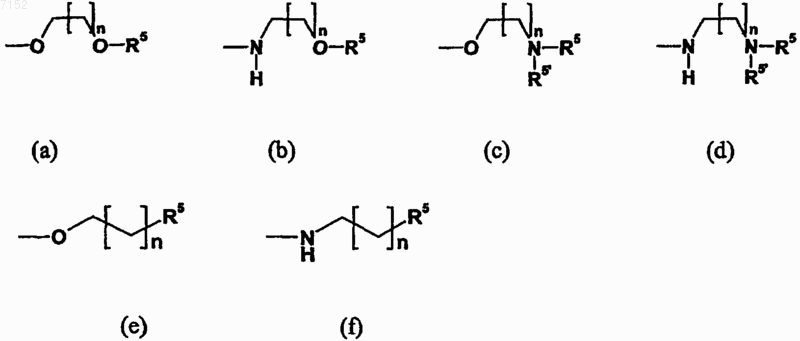
где n равно от 1 до 5, в случае (а) и (b)
R5 выбран из группы, включающей Н, необязательно замещенный C1-С6-алкил, необязательно замещенный арил, необязательно замещенный C1-С6-алкиларил и необязательно замещенный C1-С6-алкилгетероарил,
в случае (с) и (d)
R5 и R5' независимо друг от друга выбраны из группы, включающей Н и необязательно замещенный C1-С6-алкил,
в случае (е) и (f)
R5 выбран из группы, включающей Н, необязательно замещенный C1-С6-алкил, необязательно замещенный арил и необязательно замещенный гетероарил.
6. Производное бензазола по п.5, в котором R1 является Н и R2 является Н.
7. Производное бензазола по любому из пп.1-6, в котором R1 и R2 являются Н или C1-С6-алкилом, G является пиримидинильной группой
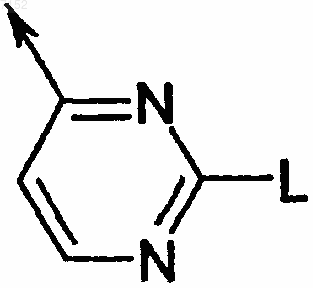
где L является

где n равно 0, 1 или 2 и R5 является арилом или гетероарилом.
8. Производное бензазола по п.7, в котором R5 является фенилом, пиридилом или имидазолилом.
9. Соединение бензазола по любому из пп.1-8, выбранное из следующей группы:
1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил(2,6-диметокси-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил(2-хлор-6-метил-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил{6-хлор-5-нитро-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил(2-гидроксипиримидин-4-ил)ацетонитрил,
(2-хлорпиримидин-4-ил)[5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,
(2Е)-(2-хлор-4-пиримидинил)(3-метил-1,3-бензотиазол-2(3Н)-илиден)этаннитрил,
1,3-бензотиазол-2-ил(2-{[2-(1Н-имидазол-5-ил)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(1-пиперазинил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-бензил-1-пиперидинил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-метил-1-пиперазинил)-4- пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-морфолинил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил(2-{4-[2-(4-морфолинил)этил]-1-пиперазинил}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[4-(бензилокси)-1-пиперидинил]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-гидрокси-1-пиперидинил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил(2-гидразино-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(диметиламино)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(диметиламино)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-метоксиэтил)амино]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-гидроксиэтил)амино]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(пропиламино)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил(2-{[3-(1H-имидазол-1-ил)пропил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(1-пирролидинил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-фенилэтил)амино]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(2-пиридинил)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-пиридинилметил)амино]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[4-(1H-1,2,3-бензотриазол-1-ил)-1-пиперидинил]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[4-(2-пиразинил)-1-пиперазинил]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[4-(2-пиримидинил)-1-пиперазинил]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3-пиридинил)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил(5-бром-2-{[2-(диметиламино)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-морфолин-4-илэтил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-{3-[(трифторметил)сульфонил]анилино}пиперидин-1-ил)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил(2-{[3-(2-оксопирролидин-1-ил)пропил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{метил[3-(метиламино)пропил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[3-(4-метилпиперазин-1-ил)пропил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(3-морфолин-4-илпропил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(1-метил-1Н-имидазол-4-ил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(1H-индол-3-ил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-гидроксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
трет-бутил ({4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-ил}амино)ацетат,
{2-[(3-аминопропил)амино]пиримидин-4-ил}(1,3-бензотиазол-2-ил)ацетонитрил,
{2-[(2-аминоэтил)амино]пиримидин-4-ил}(1,3-бензотиазол-2-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[3-(диметиламино)пропил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-пиперидин-1-илэтил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(1-метил-1Н-имидазол-5-ил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(бензиламино)пиримидин-4-ил]ацетонитрил,
изопропил 3-({4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-ил}амино)пропаноат,
1,3-бензотиазол-2-ил{2-[(3-гидроксипропил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[(пиридин-3-илметил)амино]пиримидин-4-ил}ацетонитрил,
(2-аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(пиридин-4-илметил)амино]пиримидин-4-ил}ацетонитрил,
трет-бутил 4-[2-({4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-ил}амино)этил]фенилкарбамат,
(2-{[2-(4-аминофенил)этил]амино}пиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3,4-диметоксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3-метоксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(2-фторфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил[2-({2-[3-(трифторметил)фенил]этил}амино)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-гидрокси-2-фенилэтил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-{[3-(трифторметил)пиридин-2-ил]амино}этил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3-хлорфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3,4-дихлорфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-метоксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-метилфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3-фторфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-феноксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(2-феноксифенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-бромфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(4-фторфенил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-[1,1'-бифенил]-4-илэтил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-{4-[гидрокси(оксидо)амино]фенил}этил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(1Н-1,2,4-триазол-1-ил)этил]амино}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[3-(1H-пиразол-1-ил)пропил]амино}пиримидин-4-ил)ацетонитрил,
4-[2-({4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-ил}амино)этил]бензолсульфонамид,
{2-[(2-пиридин-3-илэтил)амино]пиримидин-4-ил}[5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(1Н-тетразол-5-илметил)амино]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(4-пиридин-3-илбензил)окси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(пиридин-4-илметокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(пиридин-2-илметокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(3-пиридин-2-илпропокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(4-метоксибензил)окси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(пиридин-3-илметокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[2-(4-метоксифенил)этокси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-([1,1'-бифенил]-3-илметокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(3,4,5-триметоксибензил)окси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил{2-[(3,4-дихлорбензил)окси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил[2-({3-[(диметиламино)метил]бензил}окси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(1-оксидопиридин-3-ил)метокси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[4-(морфолин-4-илметил)бензил]окси}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил{2-[(4-пиридин-2-илбензил)окси]пиримидин-4-ил}ацетонитрил,
1,3-бензотиазол-2-ил(2-{[4-(пиперидин-1-илметил)бензил]окси}пиримидин-4-ил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-бутоксифенокси)пиримидин-4-ил]ацетонитрил,
{2-[4-(4-ацетилпиперазин-1-ил)фенокси]пиримидин-4-ил}(1,3-бензотиазол-2-ил)ацетонитрил,
[2-(4-метоксифенокси)пиримидин-4-ил][5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,
1,3-бензотиазол-2-ил(пиримидин-4-ил)ацетонитрил,
N-[2-({4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-ил}амино)этил]-4-хлорбензамид,
1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил.
10. Производное бензазола по п.9, выбранное из группы, включающей:
1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(1Н-имидазол-5-ил)этил]амино}-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,
1,3-бензотиазол-2-ил{2-[(2-гидроксиэтил)амино]-4-пиримидинил}ацетонитрил,
1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,
1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил,
1,3-бензотиазол-2-ил(2-{[2-(3-пиридинил)этил]амино}-4-пиримидинил)ацетонитрил.
11. Применение производных бензазола формулы I

а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, где
G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещенный алкокси, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил ;
R1 представляет собой водород или C1-С6-алкил, необязательно замещенный галогеном;
R2 представляет собой водород или C1-С6-алкил;
и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенэых в п.1,
для получения лекарственного средства для лечения нервных нарушений, включая эпилепсию, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона, ретинальные заболевания, повреждение спинного мозга, травму головы.
12. Применение производных бензазола формулы I
а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, где
G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещенный алкокси, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетероарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;
R1 представляет собой водород или C1-С6-алкил, необязательно замещенный галогеном;
R2 представляет собой водород или C1-С6-алкил;
и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,
для получения лекарственного средства для лечения аутоиммунных заболеваний, включая рассеянный склероз, воспаление толстой кишки (ВТК), ревматоидный артрит, астму, септический шок, отторжение трансплантата.
13. Применение производных бензазола формулы I

а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, где
G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещеный алкокси, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетероарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;
R1 представляет собой водород или C1-С6-алкил, необязательно замещенный галогеном;
R2 представляет собой водород или C1-С6-алкил;
и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,
для получения лекарственного средства для лечения рака, включая рак груди, рак толстой кишки, рак поджелудочной железы.
14. Применение производных бензазола формулы I
а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, где
G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещений алкокси, необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;
R1 представляет собой водород или C1-С6-алкил, необязательно замещенный галогеном;
R2 представляет собой водород или C1-С6-алкил;
и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,
для получения лекарственного средства для лечения сердечно-сосудистых заболеваний, включая инсульт, артериосклероз, инфаркт миокарда, повреждение реперфузии миокарда.
15. Применение бензазола по любому из пп.1-10 для лечения или профилактики нарушений, связанных с аномальной экспрессией или активностью JNK.
16. Способ ингибирования экспрессии и/или активности JNK, включающий стадию контактирования клеток, выделяющих JNK, по крайней мере с одним производным бензазола по любому из пп.1-10.
17. Фармацевтическая композиция, содержащая по крайней мере одно производное бензазола по любому из пп.1-10 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
18. Способ получения производного бензазола по любому из пп.1-10 путем осуществления следующего взаимодействия:
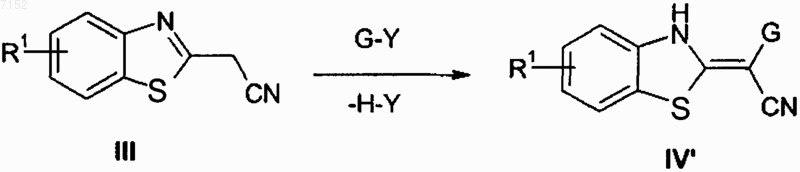
где G такое, как указано выше, и Y и Y' являются подходящими удаляемыми группами, такими как галоген.
19. Способ по п.18, который включает следующие взаимодействия:

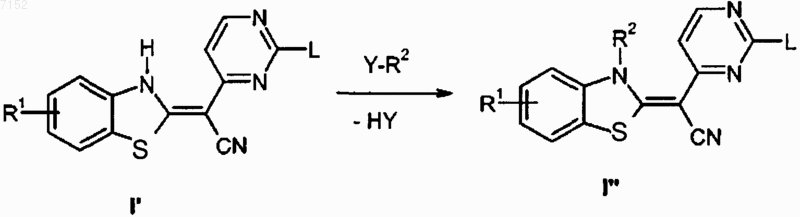
где R1, R2 и Y такие, как указано выше.
Текст
007152 Область техники Данное изобретение относится к производным бензазола и их таутомерам, используемым в качестве фармацевтически активных соединений, а также к фармацевтическим препаративным формам, содержащим такие производные бензазола. В частности, данное изобретение относится к производным бензазола, обладающим значительной модуляторной, особенно, ингибирующей активностью пути JNK (c-Jun-Nконцевой киназы), и которые, поэтому, особенно полезны при лечении нарушений иммунной и нервной систем. Данное изобретение также относится к новым производным бензазола, а также к способам их получения и содержащим их фармацевтическим композициям. Уровень техники Апоптозом называется сочетание разрушения мембраны и органелл клеток, подвергшихся процессу запрограммированной смерти клеток. В ходе указанного процесса клетки активируют имеющуюся в них программу самоуничтожения и систематически разрушают себя. Наблюдается ряд следующих событий. Поверхность клетки начинает пузыриться и экспрессирует профагоцитарные сигналы. Целая апоптозная клетка затем разделяется на мембранные пузырьки, которые быстро и четко удаляются фагоцитозом таким образом, чтобы минимально повреждать окружающую ткань. Затем клетка отделяется от соседних. Ядро также претерпевает характерные морфологические изменения при совершении генетического самоуничтожения, хроматин конденсируется и особым образом расщепляется на фрагменты ДНК. Смерть нервных клеток играет важную роль в обеспечении нормального развития нервной системы. Оказалось, что смерть растущих нейронов зависит от размера цели, которую они возбуждают: клетки с несколькими синаптическими партнерами умирают с большей вероятностью, чем клетки, которые образуют множественный синапсис. Это может отражать процесс, который уравновешивает отношение количества пресинаптических нейронов к постсинаптическим в развивающейся нервной системе. Хотя смерть нервных клеток предположительно считалась апоптической, только недавно было обнаружено,что нейроны развивающегося головного мозга грызунов достоверно подвергаются апоптозу, что классифицируется морфологией и фрагментацией ДНК. Так как смерть клеток во время роста точно не является патологическим процессом, есть определенный смысл в том, что клетки действительно прекращают существование. Смерть нейронов происходит через либо апоптический, либо некротический процесс с последующим травматическим повреждением нерва во время заболеваний нервной системы. Множество компонентов проявляются как ключевые факторы, играющие роль в запрограммированной смерти нервных клеток. Среди компонентов, приводящих к апоптозу нейронов, являются члены SAPK/JNK, являющиеся подсемейством MAP киназ (МАРК). МАРК (митоген-активированные протеинкиназы) представляют собой сериновые/треониновые киназы, которые активируются двойным фосфорилированием треониновых и тирозиновых остатков. В клетках млекопитающих существуют по крайней мере три раздельных, но параллельных пути, которые передают информацию, созданную внеклеточными стимулами, к МАРК. Указанные пути состоят из каскадов киназ, ведущих к активации ERK (внеклеточных регулированных киназ), JNK (c-Jun-N-концевых киназ) и p38/CSBP киназ. В то время как JNK и р 38 пути участвуют в передаче стрессовых внемолекулярных сигналов, ERK путь, прежде всего, ответственен за трансдукцию митогенных/дифференцировочных сигналов к ядрам клеток.SAPK каскады представляют собой подсемейство семейства митоген-активированых протеинкиназ,которые активируются различными внешними раздражителями, включая повреждение ДНК с последующим УФ облучением, TNF-, IL-1, керамиды, клеточный стресс и активные формы кислорода, и имеют определенные субстратные специфичности. Трансдукция сигнала через MKK4/JNK или МKK33/ р 38 дает фосфорилирование индуцируемых факторов транскрипции, c-Jun и ATF2, которые затем действуют либо как гомодимеры, либо как гетеродимеры, инициирующие транскрипцию нисходящих эффекторов.c-Jun представляет собой белок, который образует гомодимеры и гетеродимеры (например, с c-Fos) с получением трансактивирующего комплекса АР-1, который требуется для активации многих генов (например, металлопротеиназ матрикса), вовлеченных в воспалительную реакцию. JNK были открыты, когда было обнаружено, что несколько различных стимулов, таких как УФ свет и TNF-, стимулируют фосфорилирование c-Jun на определенных остатках серина в N-окончании белка. В недавней публикации Xie X et аl. (Structure 1998, 6(8); 983-991) было предположено, что активация путей трансдукции стресс-активированного сигнала требуется для нейронного апоптоза, вызванного отменой NGF в симпатических нервных клетках PC-12 и верхних шейных ганглиев (ВЦГ) крыс. Ингибирование определенных киназ, а именно киназы-3 МАР-киназы (МKK3) и киназы-4 МАР-киназы (МKK4) или c-Jun (части МKK-4 каскада) может быть достаточным для блокирования апоптоза (см. также Кumаgае Y. et аl., в Brain Res. Mol. Brain Res., 1999, 67(1), 10-17 и Yаng D.D. et аl. в Nature, 1997, 389(6653); 865-870). В течение нескольких часов депривации NGF в нейронах ВЦГ, c-Jun становился высокофосфорилированным, и содержание белка повышалось. Также в клетках PC-12 крыс, лишенных NGF,-1 007152JNK и р 38 подвергались продолжительной активации, в то время как ERK ингибировались. Соответствующие им клетки JNK3 KО мышей были устойчивы к индуцированному эксцитотоксичностью апоптозу в гиппокампе и, что более важно, они демонстрировали значительно более слабые припадки эпилептического типа в ответ на эксцитотоксичность по сравнению с обычными животными (Nature 1997, 389,865-870). Совсем недавно было обнаружено, что сигнальный путь JNK вовлечен в пролиферацию клеток и может играть важную роль в аутоиммунных заболеваниях (Immunity, 1998, 9, 575-585; Current Biology,1999, 3, 116-125), которые опосредуются активацией и пролиферацией Т-клеток. Наивная (предшественник) CD4+ клетка-помощник Т (Th) клеток распознает определенные МСНпептидные комплексы на антиген-презентирующих клетках (АПК) через комплекс рецептора Т-клеток(РТК). В дополнение к ТСТ-опосредованному сигналу, совместно стимулирующий сигнал обеспечивается, по крайней мере, частично, лигированием CD28, выраженного на Т-клетках, с В 7 белками на АПК. Сочетание этих двух сигналов индуцирует клональную экспрессию Т-клеток. Через 4-5 дней пролиферации предшественник CD4+T-клeтoк дифференцируется в усиленный эффектор Th клеток, который опосредует функции иммунной системы. Во время дифференцировки имеет место значительное перепрограммирование экспрессии гена. Две субпопуляции эффекторов Th клеток были определены на основе их различных профилей выделения цитокина и их иммуномодуляторного действия: Th1 клетки дают IFN и LT (TNF-), которые требуются для медиированных клетками воспалительных реакций; Th2 клетки выделяют IL-4, IL-5, IL-6,IL-10 и IL-13, которые медиируют активацию и дифференцировку В клеток. Эти клетки играют центральную роль в иммунной реакции. Путь JNK MAP киназы индуцируется в эффекторе Th1 клеток, но не индуцируется в эффекторе Th2 клеток при антигенной стимуляции. Более того, дифференцировка предшественника CD4+T клеток в эффектор Th1, но не Th2 клеток ослаблена у мышей с недостатком JNK2. Поэтому недавно было установлено, что путь JNK киназы играет важную роль в балансе Th1 и Th2 иммунной реакции посредством JNK2. В WO/9849188, объектом которой является ингибирование пути JNK киназы, описано применение полипептида человека, например, JNK-взаимодействующего белка 1 (JIP-1), который является биологическим продуктом, и который также был исследован на предмет преодоления вызванных апоптозом заболеваний. Хотя было подтверждено, что такие человеческие полипептиды оказывают ингибирующее действие на путь JNK киназы, их применение связано с различными недостатками: Получение пептидов или белков может быть дорогим. Пептиды или белки могут иметь плохую мембранную проницаемость и не могут проникать через гематоэнцефаллический барьер. Пероральное введение пептидов или белков может быть невозможным, так как они гидролизуются в кислой среде желудка. Пептиды и белки могут вызвать аутоиммунную реакцию. Следовательно, объектом данного изобретения является получение относительно небольших молекул, которые не имеют практически никаких из указанных выше недостатков, возникающих при использовании био-пептидов или био-белков, которые, однако, подходят для лечения различных заболеваний, в частности, заболеваний нервной или иммунной систем. В особенности, объектом данного изобретения является получение относительно малых молекул, которые способны модулировать, предпочтительно,регулировать в сторону снижения или ингибировать путь JNK (Jun киназы), которые являлись бы доступным и удобным способом лечения указанных заболеваний. Более того, объектом данного изобретения являются способы получения указанных малых молекул. Далее, объектом данного изобретения является получение новой категории фармацевтических композиций для лечения заболеваний. Наконец, объектом данного изобретения является способ лечения заболеваний, вызванных расстройством иммунной и/или нервной системы. Описание изобретения Указанные выше объекты соответствуют независимым пунктам формулы изобретения. Предпочтительные варианты указаны в зависимых пунктах формулы изобретения, представленной ниже. Далее представлены определения различных химических групп, которые составляют соединения в соответствии с данным изобретением и единообразно используются в описании и формуле изобретения,если не даны другие специальные определения, дающие более широкое определение.C1-С 6-алкил относится к одновалентным алкильным группам, имеющим от 1 до 6 атомов углерода. Примерами этого термина являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил,изобутил, трет-бутил, н-гексил и тому подобное. Арил относится к ненасыщенным ароматическим карбоциклическим группам, содержащим от 6 до 14 атомов углерода, имеющим единственное кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительный арил включает фенил, нафтил, фенантренил и тому подобное.C1-С 6-алкиларил относится к C1-С 6-алкильным группам, имеющим арильный заместитель, включая бензил, фенетил и тому подобное. Гетероарил относится к моноциклическим гетероароматическим, или бициклическим или трициклическим конденсированным гетероароматическим группам. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3 оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил.C1-С 6-алкилгетероарил относится к C1-С 6-алкильным группам, имеющим гетероарильный заместитель, включая 2-фурилметил, 2-тиенилметил, 2-(1H-индол-3-ил)этил и тому подобное. Алкенил относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода, и имеющим по крайней мере 1 или 2 участка алкенильной ненасыщенности, предпочтительные алкенильные группы включают этенил(-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и тому подобное. Алкинил относится к алкинильным группам, предпочтительно содержащим от 2 до 6 атомов углерода, и имеющим по крайней мере 1-2 участка алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил(-ССН 2), пропаргил (-СН 2 ССН 2) и тому подобное. Ацил относится к группе -C(O)R, где R включает C1-С 6-алкил, арил, гетероарил, C1-С 6 алкиларил или C1-С 6-алкилгетероарил. Ацилокси относится к группе -OC(O)R, где R включает C1-С 6-алкил, арил, гетероарил,C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Алкокси относится к группе -O-R, где R включает C1-С 6-алкил или арил или гетероарил или C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Предпочтительные алкокси группы включают,например, метокси, этокси, фенокси и тому подобное. Алкоксикарбонил относится к группе -С(О)OR, где R включает C1-С 6-алкил или арил или гетероарил или C1-С 6-алкиларил или C1-С 6-алкилгетероарил. Аминокарбонил относится к группе -C(O)NRR', где R, R' независимо включают водород или C1 С 6-алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Ациламино относится к группе -NR(CO)R', где R, R' независимо включают водород или C1-С 6 алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Галоген относится к фтору, хлору, брому и йоду. Сульфонил относится к группе -SO2-R, гдеC1-С 6-алкилгетероарила. Тиоалкокси относится к группе -S-R, где R включает C1-С 6-алкил, или арил, или гетероарил, или C1-С 6-алкиларил, или C1-С 6-алкилгетероарил. Предпочтительные тиоалкоксигруппы включают тиометокси, тиоэтокси и тому подобное. Термин необязательно замещенный, если не указано иначе в определении конкретного заместителя, относится к одному или нескольким заместителям, независимо выбранными из группы, включающей галоген, гидрокси, оксо, алкил, арил, гетероарил, алкокси, арилокси, арилалкилокси, гетероарилалкилокси, ароил, амино, моно- или диалкиламино, алкилоксикарбонил, алкилкарбамоил, арилкарбамоил,аминосульфонил, алкилсульфонил, арилсульфонил, пиперидинил, пиперазинил и морфолинил; и указанные заместители могут быть также необязательно замещены указанными выше заместителями. Альтернативно, указанное замещение также может включать ситуации, когда соседние заместители подвергаются замыканию в кольцо, особенно если вовлечены вицинальные функциональные заместители,образуя таким образом, например, лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали, образованные замыканием кольца, например, при попытке получить защитную группу. Термин фармацевтически приемлемые соли или комплексы относится к солям или комплексам определенных ниже соединений формулы I, которые сохраняют желаемую биологическую активность. Примеры таких солей включают, но не ограничены ими, кислотно-аддитивные соли, образованные с неорганическими кислотами (например, с хлористо-водородной кислотой, бромисто-водородной кислотой,серной кислотой, фосфорной кислотой, азотной кислотой и тому подобное), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, муравьиная кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфокислота, нафталиндисульфокислота и полигалактуроновая кислота. Указанные соединения также-3 007152 могут вводиться в виде фармацевтически приемлемых четвертичных солей, известных специалистам в данной области техники, которые включают четвертичную аммониевую соль формулы -NR,R',R"+Z-, гдеR,R',R" независимо являются водородом, алкилом или бензилом, и Z является противоионом, включая хлорид, бромид, йодид, -O-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат,циннамоат, манделат и дифенилацетат). Образцы щелочно-аддитивных солей включают производные гидроксида натрия, калия, аммония и четвертичного аммония, такие как, например, гидроксид тетраметиламмония. Термин фармацевтически активное производное относится к любому соединению, которое при введении пациенту способно оказывать, прямо или косвенно, действие, описанное выше. Энантиомерный избыток (эи) относится к продуктам, которые получены по существу энантиомерным синтезом или синтезом, включающим энантиоселективную стадию, где избыток одного энантиомера составляет порядка по крайней мере около 52% эи. При отсутствии энантиомерного синтеза,обычно получают рацемические продукты, которые также обладают активностью по изобретению как ингибиторы Jun киназы. Было обнаружено, что производные бензазола формулы I являются подходящими фармацевтически активными агентами, которые модулируют, в частности ингибируют, действие JNK, а именно, JNK 2 и/или 3. Соединения в соответствии с данным изобретением имеют формулу I.G представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещеный алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетероарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; при условии, что, если R1 и R2 представляют собой Н, G не может быть одним из следующих пиримидинов: Данное изобретение также включает таутомеры, их геометрические изомеры, оптически активные формы, энантиомеры, диастереомеры соединений формулы I, а также их рацематы, а также фармацевтически приемлемые соли, а также фармацевтически активные производные бензазола формулы I. Такими таутомерами, упомянутыми в данном описании, являются только те, в которых R2 является водородом и которые соответствуют формуле II. Указанные таутомеры подвергаются трансформации в растворе и устанавливается равновесие между бензазолами формулы I и II. Указанные таутомеры включены в объем данного изобретения В основном, все из указанных выше арильных и гетероарильных заместителей необязательно могут быть далее замещены по крайней мере одной из групп, выбранной из замещенного или незамещенного C1-С 6-алкила, такого как тригалогенметил, замещенного или незамещенного C1-С 6-алкокси, ацетокси, замещенного или незамещенного C2-С 6 алкенила, замещенного или незамещенного C2-С 6-алкинила, амино, аминоацила, аминокарбонила, C1-С 6 алкоксикарбонила, арила, карбоксила, циано, галогена, гидрокси, нитро, сульфонила, сульфокси, C1-С 6-4 007152 тиоалкокси. Предпочтительно, указанные арильные или гетероарильные группы замещены галогеном,гидрокси, нитро, сульфонилом, например, трифторметилсульфонильной группой. Особенно предпочтительными производными бензазола являются такие, в которых G является незамещенной или замещенной пиримидинильной группой, которая присоединена к ацетату бензазола в положении 4. где L выбран из группы, включающей необязательно замещенный C1-С 6-алкил, необязательно замещенный C1-С 6-алкокси, галоген, гидрокси, нитро, гидразино, необязательно замещенный арилокси,необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино,необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино и необязательно замещенный гетероарил. Особенно предпочтительными производными бензазола являются такие, в которых L является замещенной или незамещенной (C1-С 6)-алкильной группой. Еще более предпочтительными производными бензазола являются такие, L является группой-N(Ra,Rb), где Ra и Rb, каждый, независимо выбраны из группы, включающей Н, необязательно замещенный (C1-С 6)-алкил, необязательно замещенный C1-С 6-алкиларил, необязательно замещенный C1-С 6 алкилгетероарил; или группой -ORa, где Ra выбран из группы, включающей Н, необязательно замещенный (C1-С 6)алкил, необязательно замещенный C1-С 6-алкиларил, необязательно замещенный C1-С 6-алкилгетероарил и необязательно замещенный арил. В соответствии с особенно предпочтительным вариантом формулы I, L выбран из:R5 и R5' независимо друг от друга выбраны из группы, включающей Н и необязательно замещенныйR5 выбран из группы, включающей Н, необязательно замещенный C1-С 6-алкил, необязательно замещенный арил и необязательно замещенный гетероарил. Еще более предпочтительными производными бензазола, согласно формуле I, являются производные бензотиазолацетонитрила формулы Ib и/или их таутомеры формулы IIb. где R1 является Н или C1-С 6-алкилом и R2 является Н, G является пиримидинильной группой формулы где n равно 0, 1 или 2 и R5 является арилом или гетероарилом, в частности, замещенным или незамещенным фенилом, замещенным или незамещенным пиридилом, замещенным или незамещенным имидазолилом. Конкретные примеры соединений формулы I включают следующие: 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2,6-диметокси-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-хлор-6-метил-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 6-хлор-5-нитро-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-гидроксипиримидин-4-ил)ацетонитрил,(2-хлорпиримидин-4-ил)[5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,(2 Е)-(2-хлор-4-пиримидинил)(3-метил-1,3-бензотиазол-2(3 Н)-илиден)этаннитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-имидазол-5-ил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(1-пиперазинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-бензил-1-пиперидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метил-1-пиперазинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-морфолинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-4-[2-(4-морфолинил)этил]-1-пиперазинил-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[4-(бензилокси)-1-пиперидинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(4-гидрокси-1-пиперидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-гидразино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(диметиламино)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(диметиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-метоксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидроксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(пропиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(1 Н-имидазол-1-ил)пропил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(1-пирролидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-фенилэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-пиридинил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-пиридинилметил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(1 Н-1,2,3-бензотриазол-1-ил)-1-пиперидинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(2-пиразинил)-1-пиперазинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(2-пиримидинил)-1-пиперазинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(5-бром-2-[2-(диметиламино)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-морфолин-4-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(4-3-[(трифторметил)сульфонил]анилинопиперидин-1-ил)пиримидин-4 ил]ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(2-оксопирролидин-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-метил[3-(метиламино)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(4-метилпиперазин-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(3-морфолин-4-илпропил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1-метил-1 Н-имидазол-4-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1H-индол-3-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-гидроксифенил)этил]аминопиримидин-4-ил)ацетонитрил,трет-бутил (4-1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)ацетат,2-[(3-аминопропил)амино]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,2-[(2-аминоэтил)амино]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(диметиламино)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-пиперидин-1-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1-метил-1 Н-имидазол-5-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(бензиламино)пиримидин-4-ил]ацетонитрил,изопропил 3-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)пропаноат,1,3-бензотиазол-2-ил 2-[(3-гидроксипропил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(пиридин-3-илметил)амино]пиримидин-4-илацетонитрил,(2-аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,-6 007152 1,3-бензотиазол-2-ил 2-[(пиридин-4-илметил)амино]пиримидин-4-илацетонитрил,трет-бутил 4-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]фенилкарбамат,(2-[2-(4-аминофенил)этил]аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3,4-диметоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-метоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(2-[3-(трифторметил)фенил]этиламино)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидрокси-2-фенилэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(2-[3-(трифторметил)пиридин-2-ил]аминоэтил)амино]пиримидин-4 илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-хлорфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3,4-дихлорфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-метоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-метилфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-феноксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-феноксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-бромфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-[1,1'-бифенил]-4-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(2-4-[гидрокси(оксидо)амино]фенилэтил)амино]пиримидин-4 илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-1,2,4-триазол-1-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(1H-пиразол-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,4-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]бензолсульфонамид,2-[(2-пиридин-3-илэтил)амино]пиримидин-4-ил[5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(1 Н-тетразол-5-илметил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-пиридин-3-илбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-4-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-2-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(3-пиридин-2-илпропокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-метоксибензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-3-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[2-(4-метоксифенил)этокси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-([1,1'-бифенил]-3-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(3,4,5-триметоксибензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(3,4-дихлорбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(3-[(диметиламино)метил]бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(1-оксидопиридин-3-ил)метокси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[4-(морфолин-4-илметил)бензил]оксипиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-пиридин-2-илбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[4-(пиперидин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-бутоксифенокси)пиримидин-4-ил]ацетонитрил,2-[4-(4-ацетилпиперазин-1-ил)фенокси]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,[2-(4-метоксифенокси)пиримидин-4-ил][5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,1,3-бензотиазол-2-ил(пиримидин-4-ил)ацетонитрил,N-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]-4-хлорбензамид,1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил. Наиболее предпочтительными соединениями являются такие, которые выбраны из группы, включающей: 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-имидазол-5-ил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидроксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил,-7 007152 Всего 12 соединений, попадающих под формулы I и II, были описаны в каталоге компанииMaybridge plc. В трех из указанных соединений Х является S, R1 и R2 являются Н, и G является В еще трех соединениях из Maybridge Х является NH, R1 и R2 являются Н, и G является любым из следующих пиримидинов: Наконец, в шести соединениях из Maybridge X является N-СН 3, R1 и R2 являются Н, и G является любым из следующих пиримидинов: Другой аспект данного изобретения связан с применением производных бензазола формулы I для получения фармацевтических композиций для модулирования, - а именно, ингибирования нарушений,связанных с путем JNK, в частности, нарушений нервной системы и/или нарушений иммунной системы,а также к самим указанным фармацевтическим композициям. Предпочтительными путями JNK являются те, в которые вовлечены JNK2 и/или JNK3. Как указано выше, соединения формулы I могут быть использованы в качестве лекарственного средства. Следовательно, в данном описании представлены соединения формулы I и их таутомеры, которые могут быть использованы для лечения различных заболеваний. Указанные заболевания включают нарушения иммунной системы и нервной системы у млекопитающих, а именно, у человека. Более конкретно, соединения формулы I, сами по себе или в виде фармацевтической композиции, используются для модулирования пути JNK, более конкретно, для лечения или профилактики нарушений, связанных с аномальной экспрессией или активностью JNK, а именно JNK2 и/или 3. Такая аномальная экспрессия или активность JNK может быть вызвана множеством стимуляторов (например, стресс, септический шок,окислительный стресс, цитокины) и может привести к бесконтрольному апоптозу или иммунным заболеваниям, которые часто вовлечены в перечисленные ниже нарушения и заболевания. Следовательно, соединения формулы I могут быть использованы для лечения нарушений путем модулирование путей JNK. Указанное модулирование путей JNK может включать их активацию, но предпочтительно, оно включает ингибирование путей JNK, a именно JNK2 и/или 3. Соединения формулы I могут быть использованы сами по себе или в сочетании с другими фармацевтическими агентами. Конкретно, соединения формулы I могут быть использованы для лечения и/или профилактики заболеваний или патологических состояний, связанных с нервной и/или иммунной системой, в которых играет роль ингибирование JNK2 и/или JNK3, таких как эпилепсия; нейродегенеративные заболевания,включая болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона; ретинальные болезни; повреждение спинного мозга; травма головы, иммунные заболевания, включая рассеянный склероз, воспаление толстой кишки (ВТК), ревматоидный артрит; астма; септический шок; отторжение трансплантата; раковые опухоли, включая рак груди, рак толстой кишки, рак поджелудочной железы; и сердечнососудистые заболевания, включая удар, церебральную ишемию, атеросклероз, инфаркт миокарда, повреждение реперфузии миокарда. Достаточно неожиданным оказался тот факт, что соединения формулы I демонстрируют значительную активность в качестве ингибиторов JNK2 и/или 3. Согласно предпочтительному варианту данного изобретения, соединения в соответствии с данным изобретением по существу не активны в отношении 2JNK2 и 3. Следовательно, соединения в соответствии с данным изобретением предоставляют возможность селективно модулировать путь JNK, и, в частности, бороться с заболеваниями, связанными с путями JNK, оставаясь практически неактивными по отношению к другим целям, таким как указанные р 38 иERK2, таким образом, что они, несомненно, могут быть выбраны в качестве селективных ингибиторов. Это имеет огромное значение, так как эти родственные ферменты в основном участвуют в различных заболеваниях, следовательно, для лечения определенных заболеваний желательно использовать соответствующие селективные лекарственные средства. Еще одним объектом данного изобретения является способ получения новых производных бензотиазола согласно формуле I. Общий способ синтеза соединений формулы I может быть описан следующим образом: Промежуточное соединение IV' может быть преобразовано cледующим образом: Исходный материал III взаимодействует с электрофильным соединением G-Y, где Y является подходящей удаляемой группой. Выбор Y, Т', способа реакции, условий реакции, растворителей, катализаторов, зависит от природы G и соответственно выбирается специалистом в данной области техники. Указанный способ также включает любые модификации G с последующей конденсацией G-Y с соединениемIII. Предпочтительными соединениями формул I и II являются такие, в которых G является пиримидинильной группой формулы: где L такой, как описано выше. Такие соединения предпочтительно получают согласно схемам I-III. Схема I-9 007152 Производные бензотиазола могут быть получены из легко доступных исходных материалов, используя следующие общие методы и методики. Понятно, что даже если даны типовые или предпочтительные условия эксперимента (т.е. температуры реакции, время, моли реагентов, растворители и т.д.),также могут быть использованы другие условия эксперимента, если не указано иначе. Оптимальные условия реакции могут варьироваться в зависимости от используемых конкретных реагентов или растворителей, но такие условия могут быть определены специалистом в данной области техники при помощи обычных методик оптимизации. В указанных выше схемах I-III, R1 и R2 такие, как описаны выше. Согласно схеме I, соединения формулы III могут быть преобразованы в соединения формулы IV обработкой исходных соединений основанием, таким как гидрид натрия, гидрид калия и тому подобное,в безводной инертной атмосфере в полярных растворителях, таких как ДМФ или ТГФ, при температуре в интервале от около -78 до 25 С (Chabaka L.M. et al., Pol. J. Chem., 1994, 1317-1326) в течение около часа,с последующим добавлением по каплям незамещенных или замещенных галогенированных производных пиримидинила формулы V, как описано выше, в растворителях, таких как ДМФ или ТГФ, и дальнейшим постепенным нагреванием смеси до температуры в интервале от около 25 до 70 С в течение от около 1 до около 18 ч с получением соединений формулы IV. Бензазолы формулы III являются либо коммерчески доступными, например, от Maybridge ChemicalCo. Ltd, или могут быть получены из коммерчески доступных соединений обычными методами, где R1 такой, как определено выше и, наиболее предпочтительно, является, соответственно, Н. Незамещенный и замещенный галогенированный гетероарил формулы V также является либо коммерчески доступным, например, от Aldrich, Fluka, Sigma и подобных, либо может быть получен из известных соединений обычными методами. Предпочтительным галогенированным гетероарилом, используемым в качестве исходного соединения, является 2,4-дихлорпиримидин, 2-хлорпиридин и тому подобное. Согласно схеме II, соединения формулы IV, в которых R1 и R2 такие, как определены выше, могут быть преобразованы в соединения формулы I" обработкой группами типа L, где L такой, как определен выше. Наиболее предпочтительно, L является амином, спиртом или тиоспиртом, определенным как описано выше. Реакцию проводят в растворе в растворителях, таких как ДМФ, НMП, ДМСО или спирты, например, EtOH, MeOH или iPrOH, наиболее предпочтительно, в EtOH, в присутствии органического основания, такого как Et3N, DIPEA или подобного, наиболее предпочтительно, Et3N, при температуре в интервале от около 25 до 80 С. В предпочтительном способе, исходные соединения нагревают при температуре 70 С в растворе EtOH в присутствии Et3N. Амины либо коммерчески доступны, либо могут быть получены из известных соединений обычными методами, известными специалистам в данной области техники. Предпочтительными аминами в качестве исходных соединений являются метиламин, N,N-диметиламиноэтиламин, морфолингистамин и тому подобное. Спирты или тиоспирты являются либо коммерчески доступными, либо могут быть получены из известных соединений обычными методами, известными специалистам в данной области техники. Предпочтительными спиртами или тиоспиртами в качестве исходных материалов являются MeOH, MeSH и тому подобное. Согласно схеме III соединения формулы I', где R2 является водородом и R1 такой, как описано выше, наиболее предпочтительно, Н, могут быть преобразованы в соединения формулы I", в которых R2 отличается от водорода, обработкой исходного соединения электрофилами Y'-R2, такими как алкил- или бензилгалогениды и ацилхлориды, при температуре в интервале от 25 до 80 С в присутствии основания,такого как карбонат калия, гидроксид натрия, гидрид натрия и тому подобное, в растворителе, таком как ДМСО, ДМФ, ацетон и тому подобное, в безводной инертной атмосфере. В предпочтительном способе,исходное соединение встряхивают при температуре 25 С в растворе ДМСО в присутствии карбоната калия. Электрофилы являются либо коммерчески доступными, либо могут быть получены из известных соединений обычными методами, известными специалистам в данной области техники. Предпочтительными электрофилами в качестве исходных соединений являются метилйодид и ацетилхлорид. Если представленные выше общие способы синтеза не могут быть применены для получения соединений формулы I, следует использовать подходящие способы получения, известные специалистам в данной области техники. Конечным аспектом данного изобретения является применение соединений формулы I для модулирования пути JNK, применение указанных соединений для получения фармацевтических композиций для модулирования пути JNK, а также препаративных форм, содержащих активные соединения формулы I. Полагают, что JNK вовлечена в различные болезненные состояния. Следовательно, модулирование уровня JNK, а именно, JNK2 и/или JNK3 имеет широкое терапевтическое применение, включая эпилепсию; нейродегенеративные заболевания, включая болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона; ретинальные болезни; повреждение спинного мозга; травму головы, аутоиммунные болезни, включая рассеянный склероз, воспаление толстой кишки (ВТК), ревматоидный артрит; астму; септи- 10007152 ческий шок; отторжение трансплантата; раковые опухоли, включая рак груди, рак толстой кишки, рак поджелудочной железы; и сердечно-сосудистые заболевания, включая удар, церебральную ишемию, атеросклероз, инфаркт миокарда, повреждение реперфузии миокарда. В контексте данного описания термин лечение относится к ингибированию или задержанию развития болезни, нарушения или состояния и/или снижение, ремиссии или регрессии симптомов заболевания, расстройства или состояния. Специалист в данной области техники поймет, что различные методики и исследования могут быть использованы для оценки развития заболевания, нарушения или состояния, а также, различные методики и исследования могут быть применены для оценки снижения, ремиссии или регрессии симптомов заболевания, расстройства или состояния. В контексте данного описания термин профилактика болезненного состояния, медиированногоJNK означает профилактику болезни, расстройства или состояния у пациента, который может быть подвержен риску данного заболевания, но еще не имеет его симптомов. Специалист в данной области техники поймет, что множество методов может быть использовано для определения пациента, подверженного риску заболевания, и то, подвержен ли пациент риску заболевания, зависит от различных факторов, известных специалистам в данной области техники, включая генетическую предрасположенность пациента, возраст, вес, пол, диету, общее физическое и умственное состояние, род деятельности, воздействие окружающей среды и тому подобное. При использовании в качестве лекарственных средств, производные бензазола в соответствии с данным изобретением обычно вводятся в виде фармацевтической композиции. Следовательно, фармацевтические композиции, содержащие соединение формулы I и фармацевтически приемлемый носитель,разбавитель или наполнитель, также включены в объем данного изобретения. Специалист в данной области техники знает весь спектр таких носителей, разбавителей или наполнителей, подходящих для фармацевтических композиций. Также, данное изобретение относится к соединениям, используемым в качестве лекарственных средств. В частности, изобретение относится к соединению формулы I для использования в качестве ингибитора JNK, а именно JNK2 и JNK3, для лечения нарушений иммунной и нервной систем у млекопитающих, а именно, человека, либо в чистом виде, либо в сочетании с другими лекарственными средствами. Соединения в соответствии с данным изобретением, вместе с обычно используемыми адъювантами,носителями, разбавителями или наполнителями, могут входить в состав фармацевтических композиций и стандартных лекарственных форм, и эти формы могут быть использованы в виде твердых веществ, таких как таблетки или наполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или наполненные ими капсулы, которые предназначены для перорального введения, или в виде стерильных растворов для инъекций для парентерального (включая подкожное) введения. Такие фармацевтические композиции и стандартные лекарственные формы могут содержать ингредиенты в обычных пропорциях, вместе с или без дополнительных активных соединений или элементов, и такие лекарственные формы могут содержать любое приемлемое эффективное количество активного ингредиента, соразмерное с предполагаемой ежедневной дозой. При использовании в качестве лекарственных средств, производные бензазола в соответствии с данным изобретением обычно вводятся в виде фармацевтической композиции. Такие композиции могут.быть получены методами, хорошо известными специалистам в области фармацевтики, и содержат, по крайней мере, одно активное соединение. Обычно соединения в соответствии с данным изобретением вводят в фармацевтически эффективном количестве. Количество вводимого соединения обычно определяется лечащим терапевтом с учетом соответствующих обстоятельств, включая состояние подвергаемое лечению, выбранный способ введения, вводимое соединение, возраст, вес и реакцию конкретного пациента, тяжесть симптомов пациента и тому подобное. Фармацевтические композиции в соответствии с данным изобретением могут вводиться различными путями, включая пероральное, ректальное, чреcкожное, подкожное, внутривенное, внутримышечное,внутриоболочечное, внутрибрюшинное и интраназальное введение. В зависимости от выбранного способа введения, соединения предпочтительно вводят в состав в композиции для инъекций, местного или перорального введения. Композиции для перорального введения могут иметь форму объемных жидких растворов или суспензий, или объемных порошков. Более часто, однако, композиции представляют собой стандартные лекарственные формы для обеспечения точного дозирования. Термин стандартные лекарственные формы относится к физически раздельным единицам, подходящим для использования в качестве единичных доз у человека и других млекопитающих, где каждая единица содержит предварительно определенное количество активного вещества, рассчитанное для достижения желаемого терапевтического эффекта, в сочетании с подходящим фармацевтическим наполнителем. Обычные стандартные лекарственные формы включают предварительно заполненные, предварительно отмеренные ампулы или шприцы с жидкой композицией, или пилюли, таблетки, капсулы или тому подобное при использовании твердых композиций. В таких композициях соединение бензазола обычно является небольшим (от около 0,1 до около 50 мас.%, предпочтительно от около 1 до около 40 мас.%), а остаток представляет собой различные носители или наполнители и добавки, служащие для облегчения получения желаемой лекарственной формы.- 11007152 Жидкие формы, подходящие для перорального введения, включают подходящие водные и неводные носители с буферами, суспендирующими и диспергирующими агентами, красителями, вкусовыми добавками и т.д. Твердые формы могут включать, например, любой из следующих ингредиентов или соединения сходной природы: связующий агент, такой как микрокристаллическая целлюлоза, трагакант или желатин; наполнитель, такой как крахмал или лактоза, разрыхлитель, такой как альгиновая кислота,Primogel или кукурузный крахмал; смазывающий агент, такой как стеарат магния; агент, способствующий скольжению, такой как коллоидная двуокись кремния; подсластитель, такой как сахароза или сахарин; или вкусовую добавку, такую как перечная мята, метилсалицилат или апельсиновый аромат. Композиции для инъекций обычно основаны на стерильном физиологическом растворе для инъекций или физиологическом растворе с фосфатным буфером или других подходящих носителях, известных в данной области техники. Как указано выше, производные бензазола формулы I в таких композициях содержатся, как правило, в незначительном количестве, часто от 0,05 до 10 мас.%, а остаток составляет носитель для инъекций и тому подобное. Описанные выше компоненты композиций для перорального введения или инъекций являются только примерными. Другие материалы и методы обработки и тому подобное представлены в части 8Remington's Pharmaceutical Sciences, 17-e издание, 1985, Marck Publishing Company, Easton, Pennsylvania,которая включена сюда в качестве ссылки. Соединения в соответствии с данным изобретением также могут вводиться в составе форм с пролонгированным выделением или систем с пролонгированным выделением лекарственного средства. Описание примеров материалов с пролонгированным выделением также можно найти в ссылочных материалах в Remington's Pharmaceutical Sciences. Далее данное изобретение проиллюстрировано примерами, которые не должны рассматриваться как ограничивающие объем данного изобретения. Описанные здесь соединения обозначаются далее формулой IIb и являются таутомерами соединений формулы Ib. Данные ВЭЖХ, ЯМР и МС, представленные в описанных ниже примерах, получены следующим образом: ВЭЖХ: колонка Waters Symmetry C8 50 х 4,6 мм, условия: а - MeCN/H2O 0,09% ТФУ, от 0 до 100% (10 мин); b - MeCN/Н 2 О 0,09% ТФУ, от 0 до 100% (20 мин); с - MeCN/H2O 0,09% ТФУ, от 5 до 100% (10 мин), макс. область 230-400 нм; d. - MeCN/H2O, от 5 до 100% (10 мин), макс. область 230-400 нм; Масс спектр: Perkin Elmer API 150 EX (APCI); 1H-ЯМР: Brucker DPX-300 МГц. Примеры Пример 1. Получение 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрила (1). К перемешиваемой суспензии NaH (60% в масле, 9,2 г, 0,23 моль) в сухом ТГФ (200 мл) по каплям добавляют в инертной атмосфере раствор 1,3-бензотиазол-2-илацетонитрила (20 г, 0,15 моль) в сухом ТГФ (200 мл). Через 1,5 ч перемешивания при комнатной температуре по каплям добавляют раствор 2,4 дихлорпиримидина (17,1 г, 0,15 моль) в сухом ТГФ (200 мл). Реакционную смесь перемешивают в инертной атмосфере при комнатной температуре до полного расходования исходного материала. Реакцию гасят добавлением воды и ТГФ выпаривают. Добавляют воду и суспензию слегка подкисляют 1 М водной НСl. Полученный осадок отфильтровывают и тщательно промывают водой до нейтральной реакции, затем гексаном для удаления масла. Сырой твердый продукт сушат в вакууме при температуре 40 С с получением 28 г (84%) указанного в заголовке соединения в виде светло-коричневого порошка: т.пл. 246 С, разложение; МС: 286,8 (М+1); ВЭЖХ (Условия а, 268 нм) 97% кт. 5,66 мин; 1H ЯМР (ДМСО-d6)13,25 (ушир.с, 1 Н, изменяемое), 8,09 (д, J=4,14 Гц, 1 Н), 7,90 (д, J=7,53 Гц, 1 Н), 7,61 (д, J=7,92 Гц, 1 Н),7,39-7,34 (м, 1 Н), 7,20-7,15 (м, 1 Н), 6,96 (ушир.д, 1 Н).CHN анализ: C13H7ClN4S: рассчитано: С 54,19%, Н 2,48%, N 19,45%; найдено; С 53,35%, Н 2,77%, N 17,62%. Используя методику примера 1 и соответствующие исходные материалы и реагенты получают следующие дополнительные производные бензотиазола формулы I. 1,3-Бензотиазол-2-ил(2,6-диметокси-4-пиримидинил)ацетонитрил (2).(2-Xлор-4-пиримидинил)(3-метил-1,3-бензотиазол-2(3 Н)-илиден)этаннитрил (9). К раствору соединения 1 (0,1 г, 0,35 моль) в сухом ДМСО добавляют K2 СО 3, затем метилйодид и суспензию встряхивают при комнатной температуре в течение 2 дней. Осадок, полученный при добавлении воды, отфильтровывают, затем промывают водой до нейтрального рН. Сырой остаток сушат в вакууме при температуре 40 С с получением 5,6 мг (5%) указанного в заголовке соединения в виде желтого порошка.MC: 623 (2M+Na); ВЭЖХ (Условия а, 388 нм): 99%, кт. 5,31 мин; 1H ЯМР (ДМСО-d6)8,01 (д,J=7,7 Гц, 1H), 7,83 (д, J=8,0 Гц, 1H), 7,79 (д, J=7,4 Гц, 1H), 7,45-7,40 (м, 1H), 7,31-7,24 (м, 1H), 6,81 (д,J=7,4 Гц, 1H), 3,67 (с, 3 Н). Пример 2. Получение 1,3-бензотиазол-2-ил(2-[2-(1 Н-имидазол-4-ил)этил]амино-4-пиримидинил) ацетонитрила (10). К суспензии соединения 1 (0,1 г, 0,35 ммоль) в сухом EtOH (3 мл) добавляют Et3N (0,05 мл, 0,35 ммоль) и гистамин (0,078 г, 0,70 ммоль). После обработки ультразвуком желтый раствор встряхивают при температуре 70 С в течение 3 дней. Полученный желтый осадок отфильтровывают и промывают Н 2O (2 х), затем EtOH (3 х) и сушат в вакууме при температуре 40 С с получением 47 мг (37%) указанного в заголовке соединения в виде ярко-желтого порошка: т.пл. 257-258 С. Соединение 10 помещают в смесь ДХМ/ТФУ(трифторуксусная кислота). Желтое твердое вещество,полученное при добавлении простого эфира, отфильтровывают, промывают простым эфиром (3 х), затем сушат в вакууме при температуре 40 С с получением 36 мг (29%) указанного в заголовке соединения в виде желтого порошка: т.пл. 247-249 С, МС: 362,0 (М+1); ВЭЖХ (Условия а, 265 нм): 98%, кт. 2,87 мин; 1CHN анализ: С 18 Н 15N7S2 ТФУ: рассчитано: С 44,83%, Н 2,91%, N 16,63%; найдено: С 44,59%, Н 3,18%, N 16,43%. Используя методику примера 2 и соответствующие исходные материалы и реагенты получают следующие дополнительные производные бензотиазола формулы II. 1,3-Бензотиазол-2-ил[2-(1-пиперазинил)-4-пиримидинил]ацетонитрил (11).(2-Аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил (54). Суспензию соединения 1 (0,1 г, 0,35 ммоль) в 2 М растворе аммиака в этаноле (10 мл) нагревают до температуры 150 С в аппарате Парра в течение 3 ч. Раствор охлаждают до комнатной температуры, и полученный желтый осадок отфильтровывают и тщательно промывают этанолом/водой 1:1 и водой. Осадок сушат в вакууме при температуре 40 С с получением 48 мг (51%) указанного в заголовке соединения в виде желтого порошка. МС: 268,0 (М+1); ВЭЖХ (Условия с, область максимума): 95%, кт. 3,20 мин; 1H ЯМР (ДМСО-d6)10,92 (ушир.с, 1 Н, изменяемое), 7,79 (д, J=7,16 Гц, 1 Н), 7,70 (д, J=7,01 Гц,1 Н), 7,42-7,15 (м, 5 Н), 6,34 (д, J=7,54 Гц, 1 Н). 1,3-Бензотиазол-2-ил 2-[(пиридин-4-илметил)амино]пиримидин-4-илацетонитрил (ди соль ТФУ)(ДМСО-d6)8,40-8,29 (ушир.д, 1 Н, изменяемое), 7,78-7,60 (м, 4 Н), 7,41-7,36 (м, 1 Н), 7,27-7,21 (м, 1 Н),6,47 (д, J=6,78 Гц, 1 Н), 5,25-5,05 (м, 2 Н). Пример 3. Получение 1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрила (80). К суспензии NaH (60% в масле, 0,056 г, 1,4 ммоль) в сухом ДМА (1 мл) добавляют раствор бензилового спирта (0,07 мл, 0,7 ммоль) в сухом ДМА (1 мл) и суспензию перемешивают в течение 1 ч при комнатной температуре в инертной атмосфере. По каплям добавляют раствор соединения 1 в ДМА (1 мл) и суспензию нагревают до температуры 100 С при перемешивании в инертной атмосфере ON. Реакционную смесь охлаждают и гасят добавлением воды + насыщенного водного раствора NaCl (до конечного объема 15 мл). Через 2 ч при температуре 4 С полученный осадок отфильтровывают и промывают водой до нейтрального рН. Полученное твердое вещество кипятят с обратным холодильником в ацетонитриле,охлаждают до комнатной температуры, затем отфильтровывают и промывают ацетонитрилом (3 х). Остаток сушат в вакууме при температуре 40 С в течение ночи с получением 0,082 г (33%) указанного в заголовке соединения в виде желтого порошка: т.пл. 196-198 С, МС: 359,0 (М+1); ВЭЖХ (Условия а, 262 нм): 99%, кт. 4,99 мин; 1H ЯМР (ДМСО-d6)12,74 (ушир.с, 1 Н, изменяемое), 7,95 (д, J=7,53-49 Гц, 1 Н),7,76-7,72 (м, 2 Н), 7,62-7,54 (м, 2 Н), 7,50-7,32 (м, 4 Н), 7,29-7,19 (м, 1 Н), 6,74-6,61 (ушир.д, 1 Н), 5,68 (с,2 Н). Используя методику примера 3 и соответствующие исходные материалы, и реагенты получают следующие дополнительные производные бензотиазола формулы III. 1,3-Бензотиазол-2-ил 2-[(4-пиридин-3-илбензил)окси]пиримидин-4-илацетонитрил (81).(с, 2 Н), 4,28 (д, J=4,9 Гц, 1 Н), 3,80-3,20 (м, 2 Н), 2,90-2,78 (м, 2 Н), 1,79-1,27 (м, 6 Н). Пример 4. Получение 1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрила (96). К раствору соединения 1 (0,300 г, 1,05 ммоль) в ДМСО (7 мл) добавляют 4-метоксифенол (0,261 г,2,1 ммоль) и карбонат цезия (1,7 г, 5,25 ммоль) и суспензию встряхивают при температуре 100 С в течение 8 дней. После охлаждения до комнатной температуры суспензию выливают в лед/воду и продукт экстрагируют AcOEt. Органическую фазу промывают водой, затем насыщенным раствором соли, сушат над МgSO4 и концентрируют досуха. Остаток растирают в горячем EtOH, затем отфильтровывают и сушат в вакууме при температуре 50 С в течение ночи с получением 202 мг (51%) указанного в заголовке соединения. MC: 375,0 (М+1); ВЭЖХ (Условия с, область максимума): 99%, кт. 5,21 мин; 1H ЯМР(ДМСО-d6)8,16 (ушир.д, 1 Н), 7,60 (д, J=8,29 Гц, 1 Н), 7,45-7,37 (м, 2 Н), 7,28-7,23 (м, 3 Н), 7,11-7,08 (м,2 Н), 6,83 (ушир.д, 1 Н), 3,86 (с, 3 Н). Используя методику примера 4 и соответствующие исходные материалы и реагенты получают следующие дополнительные производные бензотиазола формулы III. 1,3-Бензотиазол-2-ил[2-(4-бутоксифенокси)пиримидин-4-ил]ацетонитрил (97).- 20007152 К раствору соединения 1 (0,1 г, 0,35 ммоль) в уксусной кислоте добавляют ацетат натрия (29 мг,0,35 ммоль) и палладий на угле (20 мг). Суспензию нагревают до температуры 70 С в атмосфере водорода при давлении 3,5 бар в течение 3 ч. После охлаждения до комнатной температуры суспензию фильтруют через целит, и уксусную кислоту выпаривают. Ярко-желтый порошок помещают в этилацетат и водный гидроксид натрия 10%. После 3 экстракций органические фазы тщательно промывают насыщенным раствором соли и затем сушат над MgSO4 и концентрируют досуха. После очистки с помощью препаративной ВЭЖХ и сушки в вакууме при температуре 50 С получают 12 мг (13%) указанного в заголовке соединения в виде желтого порошка. МС: 253,2 (М+1); ВЭЖХ (Условия с, область максимума): 98%, кт. 3,35 мин; 1H ЯМР (ДМСО-d6)8,61 (с, 1 Н), 8,00-7,73 (м, 3 Н), 7,44-7,39 (м, 1 Н), 7,29-7,23 (м,1 Н), 6,90 (ушир.д, 1 Н), 3,87 (с, 3 Н). Пример 6. N-[2-(4-[1,3-Бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]-4-хлорбензамид (соль ТФУ) (101). К раствору соединения 46 (0,1 г, 0,32 ммоль) в ДХМ/ДМФ 3/3 (4 мл) добавляют пхлорбензоилхлорид (0,056 г, 0,32 моль) и триэтиламин (0,09 мл, 0,64 ммоль), и раствор встряхивают в течение ночи при комнатной температуре, затем при температуре 40 С в течение 3 ч. После охлаждения до комнатной температуры, полученный осадок отфильтровывают и затем промывают ДХМ, затем водой. После перекристаллизации в ацетонитриле получают 98 мг (68%) указанного в заголовке соединения (основания) в виде желтого порошка. Продукт помещают в смесь ДХМ/ТФУ. Желтое хлопьевидное твердое вещество, полученное добавлением простого эфира, отфильтровывают, промывают простым эфиром (3 х), затем сушат в вакууме при температуре 40 С с получением 105 мг указанного в заголовке соединения в виде желтого порошка: МС: 449,2 (М+1); ВЭЖХ (Условия с, область максимума): 95% кт. 3,99 мин; 1H ЯМР (ДМСО-d6)8,80-8,75 (м, 1 Н), 7,96-7,41 (м, 9 Н), 7,31-7,25 (м, 1 Н), 6,47 (д, J=6,78 1 Н), 4,50-3,30 (м, 5 Н). Пример 7. Получение 1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрила (102). К суспензии соединения 1 (0,1 г, 0,35 ммоль) в сухом МеОН (3 мл) добавляют MeONa (0,08 г, 1,4 ммоль) и Et3H (0,05 мл, 0,35 ммоль) и суспензию нагревают до температуры 60 С в течение 6 дней. Полученное твердое вещество отфильтровывают и фильтрат концентрируют почти досуха. Полученный твердый остаток промывают водой до нейтрального рН, затем сушат в вакууме при температуре 40 С с получением 44 мг (45%) указанного в заголовке соединения в виде желтого порошка: т.пл. 234 С, разл.,МС: 283 (М+1); ВЭЖХ (Условия а, 262 нм): 97%, кт. 3,40 мин; 1H ЯМР (ДМСО-d6)7,79 (д, J=4,52 Гц,1 Н), 7,78 (д, J=7,91 Гц, 1 Н), 7,55 (д, J=7,91 Гц, 1 Н), 7,29-7,23 (м, 1 Н), 7,07-7,02 (м, 1 Н), 6,53 (ушир.д, 1 Н),4,02 (с, 3 Н). Пример 8. Получение фармацевтических препаративных форм. Следующие примеры получения препаративных форм иллюстрируют примеры фармацевтических композиций в соответствии с данным изобретением, но не ограничивают их. Препаративная форма 1 - таблетки. Соединение бензазола формулы I в виде сухого порошка смешивают с сухим желатиновым связующим агентом в массовом соотношении приблизительно 1:2. Добавляют незначительное количество стеарата магния в качестве смазывающего агента. Смесь формуют в 240-270 мг таблетки (80-90 мг активного соединения бензазола на таблетку) на прессе для изготовления таблеток. Препаративная форма 2 - капсулы. Соединение бензазола формулы I в виде сухого порошка смешивают с разбавителем крахмалом в массовом соотношении приблизительно 1:1. Смесь насыпают в 250 мг капсулы (125 мг активного соединения бензазола на капсулу). Препаративная форма 3 - жидкость. Соединение бензазола формулы I (1250 мг), сахарозу (1,75 г) и ксантановую камедь (4 мл) смешивают, пропускают через сито 10 меш US, затем смешивают с заранее приготовленным раствором микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия(10 мг), вкусовую добавку и краситель разбавляют водой и добавляют при перемешивании. Затем добавляют достаточное количество воды до получения общего объема 5 мл. Препаративная форма 4 - таблетки. Соединение бензазола формулы I в виде сухого порошка смешивают с сухим связующим агентом желатином в массовом соотношении приблизительно 1:2. Добавляют немного стеарата в соотношении приблизительно 1:2. Добавляют немного стеарата магния в качестве смазывающего агента. Смесь формуют в 450-900 мг таблетки (150-300 мг активного соединения бензазола) на прессе для изготовления таблеток. Препаративная форма 5 - инъекции. Соединение бензазола формулы I растворяют в водной среде для инъекций, содержащей буферный стерильный физиологический раствор, до концентрации приблизительно 5 мг/мл. Пример 9. Биологические исследования.- 21007152 Специалист в данной области техники легко определит множество тестов, которые могут быть использованы для оценки активности соединений бензазола в соответствии с данным изобретением. Приведенные ниже тесты являются примерами оценки применимости производных бензазола в соответствии с данным изобретением для модулирования JNK и, следовательно, модулирования апоптоза. Исследование ферментов JNK2 и 3: Исследования JNK2 и/или JNK3 проводят на 96-ячеечных планшетах МТТ, инкубируя 0,5 мкл рекомбинантной преактивированной GST-JNK3 или GST-JNK2 с 1 мкл рекомбинантной биотинилированной GST-c-Jun и 2 мкМ 33-АТФ (2 HCi/мкл), в присутствии или в отсутствие одного или нескольких бензазольных ингибиторов, при объеме реакционной смеси 50 мкл,содержащей 50 мМ Трис-HCl, рН 8,0; 10 мМ MgCl2; 1 мМ Дитиоретинола и 100 мкМ Na3VO4. Инкубацию проводят в течение 120 мин при комнатной температуре и останавливают добавлением 200 мкл раствора, содержащего 250 мкг SPA шариков, покрытых Стрептавидином (Amersham, Inc.), 5 мМ ЭДТК,0,1% Тритон Х-100 и 50 мкМ АТФ, в физиологическом растворе с фосфатным буфером. После инкубации в течение 60 мин при комнатной температуре шарики осаждают центрифугированием при 1500 х g в течение 5 мин, повторно суспендируют в 200 мкл ФРФБ, содержащем 5 мМ ЭДТК, 0,1% Тритон Х-100 и 50 мкМ АТФ, и радиоактивность измеряют на сцинтилляционном -счетчике, с последующим осаждением шариков, как описано выше. При замене GST-c Jun на биотнилированную GSТ-1 АТФ 2 или миелиновый основной белок, данный преактивированной р 38 и ERK MAP киназ, соответственно. Примерные значения для некоторых соединений даны в представленной ниже таблице. Значения, данные для JNK2 и 3, р 38 и ERK2, представляют собой IC50 (нМ), т.е. количество, необходимое для достижения 50% ингибирования цели (например, JNK2 или 3). Номер соединения означает тестируемое соединение с номером, с которым оно указано в представленных выше примерах. На представленной выше таблице можно видеть, что тестируемые соединения дают значительный эффект как для JNK2, так и для, более значимо, JNK3, но практически не оказывают действия на р 38 и ERK2, что означает достаточно селективное ингибирующее действие. Тестируемые соединения формулы I ингибируют (IC50) JNK3 в количестве менее 10 мкМ, более предпочтительно, в количестве менее 0,1 мкМ. Ниже представлены тесты in vitro и in vivo, в которых подтверждается ингибирующее и, следовательно, регулирующее апоптоз (например, ингибирующее) действие соединений в соответствии с данным изобретением. А. Культура и выживание симпатических нейронов (in vitro). Симпатические нейроны из верхнего цервикального ганглия (ВЦГ) новорожденных крысят (р 4) диссоциируют в дисфазе, высевают с плотностью 104 клеток/см 2 на 48-ячеечный МТТ планшет, покрытый коллагеном из хвоста крыс, и культивируют в среде Лейбовица, содержащей 5% крысиной сыворотки, 0,75 мкг/мл ФРН 7S (Boehringer Mannheim Corp., Indianapolis, IN) и арабинозин 105M. Смерть клеток вызывают на 4 день после посева, обрабатывая культуру средой, содержащей 10 мкг/мл антител анти ФРН (Boehringer Mannheim Corp., Indianapolis, IN) и не содержащей ФРН или арабинозин, в присутствии или в отсутствие бензазольных ингибиторов. Через 24 ч после вызова смерти клеток, определение жизнеспособности клеток проводят посредством инкубирования культуры в течение 1 ч при температуре 37 С в 0,5 мг/мл 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (МТТ). После инкубирования в МТТ клетки повторно суспендируют в ДМСО, переносят в 96 МТТ планшет, и жизнеспособность клеток оценивают измерением оптической плотности при 590 нм. Этот тест демонстрирует, что соединения формулы I (например, соединения (1), (25), (90 спасают нейроны от смерти клеток (степень выживаемости нейронов до 80%). В. Тест на высвобождение Il-2 (in vitro). Т-клеточную линию лейкоза человека(American Type Culture CollectionTIB 152) культивируют в среде RPMI 1640 (Gibco, BRL), с добавлением 10% активированного теплом FCS, глутамина и Penstrep.- 22007152 Суспензию клеток в среде разбавляют с получением 2106 клеток/мл. Клетки высевают (2105 клеток/ячейка) на 96-ячеечный планшет, содержащий различные концентрации тестируемого соединения(конечная концентрация соединений, 10, 3, 1, 0,3, 0,1 мкМ). Данную смесь инкубируют в течение 30 мин при температуре 37 С во влажной атмосфере СO2. Затем клетки обрабатывают 10 мкл РМА + Ionomycine(0,1 мкМ и 1 мкМ конечная концентрация) во всех ячейках за исключением отрицательного контроля. В ячейки без соединений добавляют 10 мкл RPMI 2%ДМСО (=0,1% конечная). Клетки инкубируют при температуре 37 С и затем собирают надсадочную жидкость (если она не используется в тот же день, ее следует заморозить при температуре -20) до проведения теста ELISA IL-2 с надсадочной жидкостью. В 1. Тест IL-2 ELISA (in vitro). Высвобождение IL-2 в среду с помощью PMA+Iono стимулированных клеток Jurkat, в присутствии или в отсутствие тестируемых соединений определяют с помощью ELISA. Методика описана ниже: Растворы: Промывочный буфер: ФРФБ - Tween 0,05%. Разбавитель: ФРФБ - Tween 0,05%. Раствор субстрата: лимонная кислота 0,1M/Na2HPO4 0,1 М. Останавливающий раствор: H2SO4 20%. Подходящие пары/стандарты антител: От RD Systems. В 2. Моноклональные анти-человеческие IL-2 антитела (МАВ 602) (захват). Биотинилированные анти-человеческие IL-2 антитела (BAF202) (определение). Рекомбинантный человеческий IL-2 (202-IL-010)(стандарт). Подготовка планшета Переносят 100 мкл захваченных антител, разбавленных ФРФБ до 5 мкг/мл в 96-ячеечный планшетELISA и инкубируют в течение ночи при комнатной температуре. Удаляют жидкость из каждой ячейки и 3 раза промывают промывочным буфером. После последней промывки смачивают планшет. 1. Насыщают 200 мкл ФРФБ-10% FCS. Инкубируют 1 ч при комнатной температуре. 2. Повторяют промывочную стадию 2. Методика теста 1. Добавляют 100 мкл образца или стандарта (2000, 1000, 500, 250, 125, 62,5, 31,25 пг/мл) и инкубируют 2 ч при комнатной температуре. 2. Промывают 3 раза. 3. Добавляют 100 мкл биотинилированного анти-человеческого IL-2 при 12,5 нг/мл. Инкубируют 2 ч при комнатной температуре. 4. Промывают 3 раза. 5. Добавляют 100 мкл стрептавидин-HPR (Zymed43-4323) при 1:10000. Инкубируют 30 мин при комнатной температуре. 6. Промывают 3 раза. 7. Добавляют 100 мкл раствора субстрата (лимонная кислотa/Na2HPO4 (1:1) + Н 2O2 1:2000 + OPD). Инкубируют 20-30 мин при комнатной температуре. 8. Добавляют 50 мкл останавливающего раствора в каждую ячейку. 9. Определяют оптическую плотность с помощью считывающего устройства для титровальных микропланшетов, установленного на 450 нм с поправкой при 570 нм. По результатам данного исследования, соединения формулы I (например, соединения (1), (10), (83 снижают выработку IL-2 более чем на 30% при 3 мкМ. Таким образом, применение соединений формулыI дает снижение уровня воспалительных цитокинов. С. Тест c-Jun репортера. Культура клетокHlr c-Jun HeLa клетки культивируют в модифицированной по способу Дюльбекко среде Игла с высоким Glc с добавлением 10% FCS (Sigma), 2 мМ глютамина (Gibco), P/S, гигромицина b 100 мкг/мл иG418 250 мкг/мл. Приготовление культуры клеток Банки клеток Клетки хранят замороженными в криопробирках в жидком азоте в виде суспензии клеток в культуральной среде, содержащей 10% диметилсульфоксида, объемом 1,8 мл. Клетки хранят в культуре не более 20 переносов. Оттаивание культуры клеток При необходимости, замороженные пробирки с клетками быстро оттаивают при температуре 37 С на водяной бане при осторожном перемешивании до полуоттаивания. Затем суспензию клеток добавляют к 10 мл культуральной среды. Суспензию клеток затем центрифугируют в течение 5 мин при 1200 об./мин, надсадочную жидкость удаляют и осадок клеток в пробирке повторно разводят в среде и поме- 23007152 щают в 175 см 2 колбу, содержащую 25 мл среды. Колбы инкубируют при температуре 37 С в атмосфере 5% СO2. Перенос клеток Клетки последовательно субкультивируют (переносят), когда получают 80% сливающихся монослоев. Среду удаляют из каждой колбы и монослой промывают 10-15 мл раствора фосфатного буфера(ФРФБ). В монослой клеток добавляют раствор трипсин-ЭДТК, инкубируют при температуре 37 С и осторожно, с паузами, постукивают для смещения клеток. Полное разделение и дисагрегация монослоя клеток подтверждается исследованием с помощью микроскопа. Затем клетки повторно суспендируют в 10 мл полной среды и центрифугируют в течение 5 мин при 1200 об/мин. Надсадочную жидкость убирают, клетки повторно суспендируют в культурной среде и разбавляют 1/5 в 175 см 2 колбах. День 0, утро. Подготовка клеток для трансфекций Клетки практически слившихся культур из колб разъединяют и дисагрегируют обработкой трипсином, как описано выше. Клетки повторно суспендируют в культуральной среде и считают. Суспензию клеток разбавляют средой с получением около 3,5 х 106 клеток/мл и 1 мл суспензии клеток помещают в 2,10 см чашки для культивирования, содержащие 9 мл культуральной среды. Чашки инкубируют при температуре 37 С во влажной атмосфере 5% СO2 в воздухе. День 0, вечер. Трансфекции Контроль 0,2 мкг рТК Renilla, 5,8 мкг pBluescript KS, 500 мкл OPTIMEM (GIBCO), 10 мкл Fugene 6 Индуцировано 0,1 мкг pMEKK1, 0,2 мкг рТK Renilla, 5,7 мкг pBluescript KS, 500 мкл OPTIMEM(GIBCO), 18 мкл Fugene 6 30' RT Трансфекционную смесь добавляют в ячейки планшетов. Планшеты инкубируют в течение ночи при температуре 37 С во влажной атмосфере 5% СO2 в воздухе. День 1. Готовят 96-ячеечные планшеты, содержащие 100 мкл культуральной среды. Отрицательный контроль (носитель): 2 мкл ДМСО добавляют к 100 мкл (трижды). Соединение: 2 мкл исходный раствор для разведении тестируемого соединения добавляют к 100 мкл (трижды). Трансфектированные клетки трипсинизируют и повторно суспендируют в 12 мл культурной среды. 100 мкл раствора для разведения добавляют в каждый 96-ячеечный планшет. Планшет инкубируют в течение ночи при температуре 37 С во влажной атмосфере 5% CO2 в воздухе. Растворы тестируемых соединений для разбавления Концентрации исходного раствора тестируемого соединения для разбавления составляют: 3, 1 и 0,1 мМ в 10% ДМСО. День 2. Методика тестирования Система тестирования Dual-Luciferase Reporter Assay System (Promega). Среду удаляют из планшета и клетки промывают 2 раза по 100 мкл ФРФБ. Перед применением PLB реагента полностью удаляют промывочный раствор. В каждую ячейку с культурой добавляют 5 мкл 1XPLB. Планшеты с культурой помещают на качающуюся платформу или вращающийся шейкер при осторожном покачивании/встряхивании для обеспечения полного и равномерного покрытия монослоя клетокIX PLB. Качают планшеты с культурой при комнатной температуре в течение 15 мин. Переносят 20 мкл лизата в белые прозрачные 96-ячеечные планшеты. Считывают в люминометре. Впрыскивание 50 мкл Luciferase Assay Reagent II, ожидание 5", считывание 10". Впрыскивание 50 мкл StopGlo Reagent, ожидание 5", считывание 10". Проверка RLU Luciferase/RLU Renilla1000. Данный тест показал, что тестируемые соединения формулы I (например, соединения (33), (93),(95 ингибируют более 50% активности JNK при 10 мкМ. Таким образом, тест демонстрирует, что соединения формулы I подходят для регулирования апоптоза в сторону снижения.D. Вызванный LPS эндотоксический шок у мышей (in vivo). Способность ингибиторов JNK, описанных формулой I, снижать уровень воспалительных цитокинов, вызванных контрольным заражением LPS, может быть оценена с помощью следующего протокола:LPS (S. abortus-Galanos Lab.-) инъецируют (200 мкг/кг в.в.) самцам C57BL/6, вызывая эндотоксический шок, и внутривенно (10 мл/кг)инъецируют соединения (0,1, 1, 10, 30 мг/кг) или NaCl (200 мкМ) за 15 минут до контрольного заражения LPS. Гепаринизированную кровь получают из орбитальной полости в различные моменты времени после контрольного заражения LPS, и кровь центрифугируют при 9000 об/мин в течение 10 мин при температуре 4 С для сбора надсадочной жидкости для измерения вырабатывания цитокинов с помощью набора ELISA для мышей, такого как IFN (Duoset RD Ref. DY 485).- 24007152 Способность ингибиторов JNK, описанных формулой I, предотвращать смерть клеток во время удара может быть оценена с помощью следующего протокола:- Анестезия: галотан или изофлуран (0,5-4%)- Выбривают полоску и рассекают кожу Обе сонные артерии (правую и левую) освобождают от ткани. Пережимают артерии, используя микрозажимы Bulldog в течение 5 мин. Дезинфицируют хирургическое поле (Betadine) хирургический шов на коже (Autoclip или крючкиMichel's). Содержат животных под нагревательной лампой до пробуждения.- через 7 дней после ишемии (декапитация или передозировка пентобарбитала).- Окрашивают фиолетовым крезилом и/или по методу TUNEL.- Введение тестируемого соединения или носителя: 15 мин после реперфузии (5-10 мин после восстановления анестезии).- Стандартный протокол 50 животных: 5 групп по 10 (группа А: контроль, группы В-D: тестируемые соединения в 3 дозах и группа Е: ссылочное соединение (кетамин 3 х 120 мг/кг, в.б., или оротовая кислота 3 х 300 мг/кг, в.б.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные бензазола формулы I а также их таутомеры, их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемые соли или N-оксиды, гдеG представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещеный алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил ;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; где здесь и далее термин необязательно замещенный относится к одному или нескольким заместителям, независимо выбранными из группы, включающей галоген, гидрокси, оксо, алкил, арил, гетероарил, алкокси, арилокси, арилалкилокси, гетероарилалкилокси, ароил, амино, моно- или диалкиламино, алкилоксикарбонил, алкилкарбамоил, арилкарбамоил, аминосульфонил, алкилсульфонил, арилсульфонил, пиперидинил,пиперазинил и морфолинил,и указанные заместители могут быть также необязательно замещены указанными выше заместителями;- 25007152 термин алкил сам по себе или в составе других групп относится к линейной или разветвленнойC1-С 6-алкильной группе; термин арил относится к ароматической карбоциклической группе, содержащей от 6 до 14 атомов углерода, имеющей одно кольцо или несколько конденсированных колец,термин гетероарил относится к моноциклическим, или бициклическим, или трициклическим конденсированным гетероароматическим группам; при условии, что, если R1 и R2 представляют собой Н, G не может быть одним из следующих пиримидинов: 2. Производные бензотиазола формулы I, а также их таутомеры формулы II по п.1 их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемые соли или N-оксиды,где значения R1 и G такие, как указано в п.1. 3. Производное бензазола по п.1 или 2, где G является пиримидинилом формулы где L выбран из группы, включающей необязательно замещенный C1-С 6-алкил, необязательно замещенный C1-С 6-алкокси, галоген, гидрокси, нитро, гидразино, необязательно замещенный арилокси,необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино,необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино и необязательно замещенный гетероарил. 4. Производное бензазола по п.3, в котором L является группой -N(Ra,Rb), где Ra и Rb, каждый независимо, выбраны из группы, включающей Н, необязательно замещенный (C1-С 6)-алкил, необязательно замещенный C1-С 6-алкиларил, необязательно замещенный C1-С 6-алкилгетероарил,или группой -ORa, где Ra выбран из группы, включающей Н, необязательно замещенный (C1-С 6)алкил, необязательно замещенный C1-С 6-алкиларил, необязательно замещенный C1-С 6-алкилгетероарил и необязательно замещенный арил. 5. Производное бензазола по п.4, в котором L выбран изR5 и R5' независимо друг от друга выбраны из группы, включающей Н и необязательно замещенныйR5 выбран из группы, включающей Н, необязательно замещенный C1-С 6-алкил, необязательно замещенный арил и необязательно замещенный гетероарил. 6. Производное бензазола по п.5, в котором R1 является Н и R2 является Н. 7. Производное бензазола по любому из пп.1-6, в котором R1 и R2 являются Н или C1-С 6-алкилом, G является пиримидинильной группой где n равно 0, 1 или 2 и R5 является арилом или гетероарилом. 8. Производное бензазола по п.7, в котором R5 является фенилом, пиридилом или имидазолилом. 9. Соединение бензазола по любому из пп.1-8, выбранное из следующей группы: 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2,6-диметокси-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-хлор-6-метил-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 6-хлор-5-нитро-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-гидроксипиримидин-4-ил)ацетонитрил,(2-хлорпиримидин-4-ил)[5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,(2 Е)-(2-хлор-4-пиримидинил)(3-метил-1,3-бензотиазол-2(3 Н)-илиден)этаннитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-имидазол-5-ил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(1-пиперазинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-бензил-1-пиперидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метил-1-пиперазинил)-4- пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-морфолинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-4-[2-(4-морфолинил)этил]-1-пиперазинил-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[4-(бензилокси)-1-пиперидинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(4-гидрокси-1-пиперидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-гидразино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(диметиламино)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(диметиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-метоксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидроксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(пропиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(1H-имидазол-1-ил)пропил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(1-пирролидинил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-фенилэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-пиридинил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-пиридинилметил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(1H-1,2,3-бензотриазол-1-ил)-1-пиперидинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(2-пиразинил)-1-пиперазинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил 2-[4-(2-пиримидинил)-1-пиперазинил]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(5-бром-2-[2-(диметиламино)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-морфолин-4-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(4-3-[(трифторметил)сульфонил]анилинопиперидин-1-ил)пиримидин-4 ил]ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(2-оксопирролидин-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-метил[3-(метиламино)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(4-метилпиперазин-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(3-морфолин-4-илпропил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1-метил-1 Н-имидазол-4-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1H-индол-3-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-гидроксифенил)этил]аминопиримидин-4-ил)ацетонитрил,- 27007152 трет-бутил (4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)ацетат,2-[(3-аминопропил)амино]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,2-[(2-аминоэтил)амино]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(диметиламино)пропил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-пиперидин-1-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1-метил-1 Н-имидазол-5-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(бензиламино)пиримидин-4-ил]ацетонитрил,изопропил 3-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)пропаноат,1,3-бензотиазол-2-ил 2-[(3-гидроксипропил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(пиридин-3-илметил)амино]пиримидин-4-илацетонитрил,(2-аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(пиридин-4-илметил)амино]пиримидин-4-илацетонитрил,трет-бутил 4-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]фенилкарбамат,(2-[2-(4-аминофенил)этил]аминопиримидин-4-ил)(1,3-бензотиазол-2-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3,4-диметоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-метоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(2-[3-(трифторметил)фенил]этиламино)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидрокси-2-фенилэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(2-[3-(трифторметил)пиридин-2-ил]аминоэтил)амино]пиримидин-4 илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-хлорфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3,4-дихлорфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-метоксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-метилфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-феноксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(2-феноксифенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-бромфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(4-фторфенил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-[1,1'-бифенил]-4-илэтил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(2-4-[гидрокси(оксидо)амино]фенилэтил)амино]пиримидин-4 илацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-1,2,4-триазол-1-ил)этил]аминопиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил(2-[3-(1H-пиразол-1-ил)пропил]аминопиримидин-4-ил)ацетонитрил,4-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]бензолсульфонамид,2-[(2-пиридин-3-илэтил)амино]пиримидин-4-ил[5-(трифторметил)-1,3-бензотиазол-2 ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(1 Н-тетразол-5-илметил)амино]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-пиридин-3-илбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-4-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-2-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(3-пиридин-2-илпропокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-метоксибензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(пиридин-3-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[2-(4-метоксифенил)этокси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-([1,1'-бифенил]-3-илметокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(3,4,5-триметоксибензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил 2-[(3,4-дихлорбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил[2-(3-[(диметиламино)метил]бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(1-оксидопиридин-3-ил)метокси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[4-(морфолин-4-илметил)бензил]оксипиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил 2-[(4-пиридин-2-илбензил)окси]пиримидин-4-илацетонитрил,1,3-бензотиазол-2-ил(2-[4-(пиперидин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-бутоксифенокси)пиримидин-4-ил]ацетонитрил,2-[4-(4-ацетилпиперазин-1-ил)фенокси]пиримидин-4-ил(1,3-бензотиазол-2-ил)ацетонитрил,[2-(4-метоксифенокси)пиримидин-4-ил][5-(трифторметил)-1,3-бензотиазол-2-ил]ацетонитрил,1,3-бензотиазол-2-ил(пиримидин-4-ил)ацетонитрил,N-[2-(4-[1,3-бензотиазол-2-ил(циано)метил]пиримидин-2-иламино)этил]-4-хлорбензамид,1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил.- 28007152 10. Производное бензазола по п.9, выбранное из группы, включающей: 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метилсульфанил)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(1 Н-имидазол-5-ил)этил]амино-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил[2-(метиламино)-4-пиримидинил]ацетонитрил,1,3-бензотиазол-2-ил 2-[(2-гидроксиэтил)амино]-4-пиримидинилацетонитрил,1,3-бензотиазол-2-ил[2-(бензилокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил[2-(4-метоксифенокси)пиримидин-4-ил]ацетонитрил,1,3-бензотиазол-2-ил(2-метокси-4-пиримидинил)ацетонитрил,1,3-бензотиазол-2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил. 11. Применение производных бензазола формулы I а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, гдеG представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещенный алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил ;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,для получения лекарственного средства для лечения нервных нарушений, включая эпилепсию, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона, ретинальные заболевания, повреждение спинного мозга, травму головы. 12. Применение производных бензазола формулы I а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, гдеG представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещенный алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетероарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,для получения лекарственного средства для лечения аутоиммунных заболеваний, включая рассеянный склероз, воспаление толстой кишки (ВТК), ревматоидный артрит, астму, септический шок, отторжение трансплантата. 13. Применение производных бензазола формулы I а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, гдеG представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещеный алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетероарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,для получения лекарственного средства для лечения рака, включая рак груди, рак толстой кишки,рак поджелудочной железы. 14. Применение производных бензазола формулы I а также их таутомеров, их геометрических изомеров, их оптически активных форм в виде энантиомеров, диастереомеров и их рацематов, а также фармацевтически приемлемых солей или N-оксидов, гдеG представляет собой пиримидинильную группу, замещенную по меньшей мере одним заместителем, выбранным из группы, включающей галоген, гидрокси, гидразино, нитро, алкилсульфанил, необязательно замещенный алкил, необязательно замещенный гетероарил, необязательно замещений алкокси,необязательно замещенный арилокси, необязательно замещенный арилалкилокси, необязательно замещенный гетероарилалкилокси, амино, необязательно замещенный моно- или диалкиламино, необязательно замещенный арилалкиламино, необязательно замещенный гетерарилалкиламино, необязательно замещенный пиперидинил, необязательно замещенный пиперазинил, пирролидинил и морфолинил;R1 представляет собой водород или C1-С 6-алкил, необязательно замещенный галогеном;R2 представляет собой водород или C1-С 6-алкил; и термины "необязательно замещенный", "алкил", "арил" и "гетероарил" имеют значения, определенные в п.1,для получения лекарственного средства для лечения сердечно-сосудистых заболеваний, включая инсульт, артериосклероз, инфаркт миокарда, повреждение реперфузии миокарда. 15. Применение бензазола по любому из пп.1-10 для лечения или профилактики нарушений, связанных с аномальной экспрессией или активностью JNK. 16. Способ ингибирования экспрессии и/или активности JNK, включающий стадию контактирования клеток, выделяющих JNK, по крайней мере с одним производным бензазола по любому из пп.1-10. 17. Фармацевтическая композиция, содержащая по крайней мере одно производное бензазола по любому из пп.1-10 и фармацевтически приемлемый носитель, разбавитель или наполнитель. 18. Способ получения производного бензазола по любому из пп.1-10 путем осуществления следующего взаимодействия: где G такое, как указано выше, и Y и Y' являются подходящими удаляемыми группами, такими как галоген. 19. Способ по п.18, который включает следующие взаимодействия:
МПК / Метки
МПК: C07D 413/06, A61P 25/00, A61K 31/506, C07D 417/14, C07D 403/06, C07D 417/06
Метки: производные, модуляторов, применение, бензазола, качестве
Код ссылки
<a href="https://eas.patents.su/30-7152-proizvodnye-benzazola-i-ih-primenenie-v-kachestve-modulyatorov-jnk.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензазола и их применение в качестве модуляторов jnk</a>
Предыдущий патент: Фармацевтическая композиция, содержащая действующее вещество, диспергированное в матрице
Следующий патент: Твердая дисперсная композиция
Случайный патент: Замещённые индазолы, композиции, содержащие указанные индазолы, способ их получения и применение