Циклотиокарбаматные производные в качестве модуляторов рецептора прогестерона
Номер патента: 4511
Опубликовано: 29.04.2004
Авторы: Джоунс Тодд К., Жи Лин, Терефенко Юджин А., Жанг Пувен, Коллинз Марк А., Фенсам Эндрю, Вроубел Джей Э., Тегли Кристофер М., Эдвардс Джеймс П.
Формула / Реферат
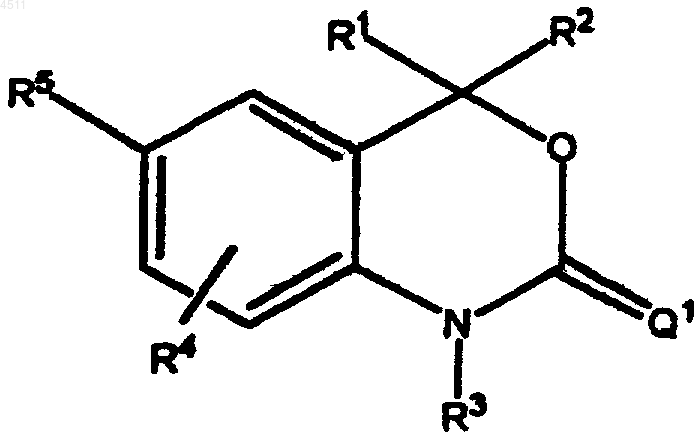
1. Соединение формулы
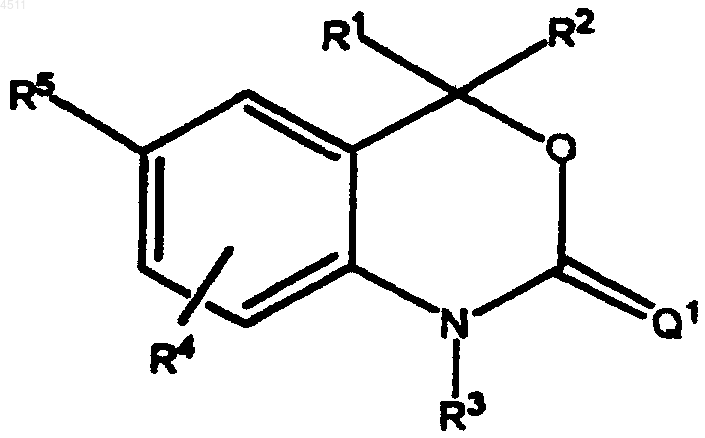
где R1 и R2 представляют собой независимые заместители, выбранные из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, C2-C6алкенила, замещенного C2-C6алкенила, C2-C6алкинила, замещенного C2-C6алкинила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, CORA и NRBCORA,
или R1 и R2 сконденсированы с образованием кольца, выбранного из группы, включающей a), b) и c), причем каждое кольцо может быть необязательно замещено 1-3 заместителями, выбранными из группы, состоящей из H и C1-C3алкила
a) 3-8-членное насыщенное спироциклическое кольцо, имеющее углеродный скелет;
b) 3-8-членное спироциклическое кольцо, имеющее углеродный скелет с одной или более двойными связями; и
c) 3-8-членное спироциклическое кольцо, содержащее в своем скелете от одного до трех гетероатомов, выбранных из группы, включающей O, S и N;
RA выбирают из группы, состоящей из H, C1-C3алкила, замещенного C1-C3 алкила, арила, замещенного арила, C1-C3алкокси, замещенного C1-C3алкокси, амино, C1-C3аминоалкила и замещенного C1-C3аминоалкила;
RB представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил, C3-C6алкенил, замещенный C3-C6алкенил, алкинил, замещенный алкинил или CORC;
RC выбирают из группы, состоящей из H, C1-C3алкила, замещенного C1-C3алкила, арила, замещенного арила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила или замещенного C1-C3аминоалкила;
R4 выбирают из группы, состоящей из H, галогена, CN, NO2, C1-C6алкила, замещенного C1-C6алкила, C1-C6алкокси, замещенного C1-C6алкокси, C1-C6аминоалкила и замещенного C1-C6аминоалкила;
R5 выбирают из группы, состоящей из (i) и (ii):
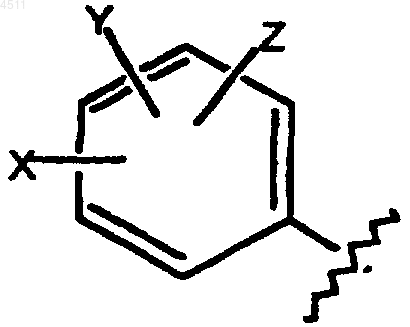
(i) замещенное бензольное кольцо, содержащее заместители X, Y и Z, как показано ниже
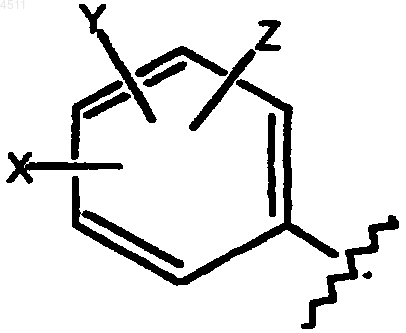
где X выбирают из группы, включающей H, галоген, CN, C1-C3алкил, замещенный C1-C3алкил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3тиоалкокси, замещенный C1-C3тиоалкокси, C1-C3аминоалкил, замещенный C1-C3аминоалкил, NO2, C1-C3перфторалкил, 5- или 6-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD или NRECORD;
RD представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RE представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
Y и Z представляют собой независимые заместители, выбранные из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкокси;
при этом X, Y и Z не являются одновременно водородом; и
(ii) пяти- или шестичленное гетероциклическое кольцо с 1, 2 или 3 гетероатомами в кольце, выбранными из группы, состоящей из O, S, S(O), S(O2) и NR6, и содержащее один или два независимых заместителя, выбранных из группы, состоящей из H, галогена, CN, NO2 и C1-C3алкила, C1-C3алкокси, C1-C3аминоалкила, CSNH2, CORF и NRGCORF;
RF представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RG представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R6 представляет собой H, CORF или C1-C4алкил;
Q1 представляет собой S, NR7 или CR8R9;
при условии, что когда Q1 является S, R1 и R2 оба не являются H;
при условии, что когда Q1 является S; R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R1 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R2 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом или, если R2 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R1 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом;
при условии, что когда Q1 является S, R1 и R2 оба не являются H;
при условии, что когда Q1 является S, R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6 алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила или замещенного гетероциклила, SO2CF3, OR11 и NR11R12;
R8 и R9 представляют собой независимые заместители, выбранные из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, NO2, CN и CO2R10;
R10 представляет собой C1-C3алкил;
или CR8R9 образуют шестичленное кольцо, формула которого приведена ниже
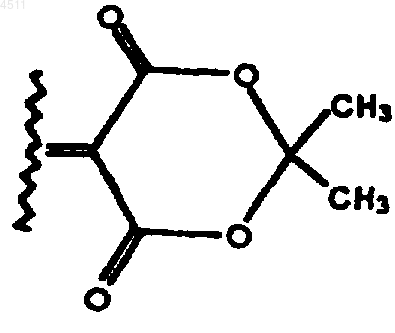
R11 и R12 независимо выбирают из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, арила, замещенного арила, гетероарила, замещенного гетероарила, ацила и сульфонила;
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо;
причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолила;
замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероцикла, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
2. Соединение формулы
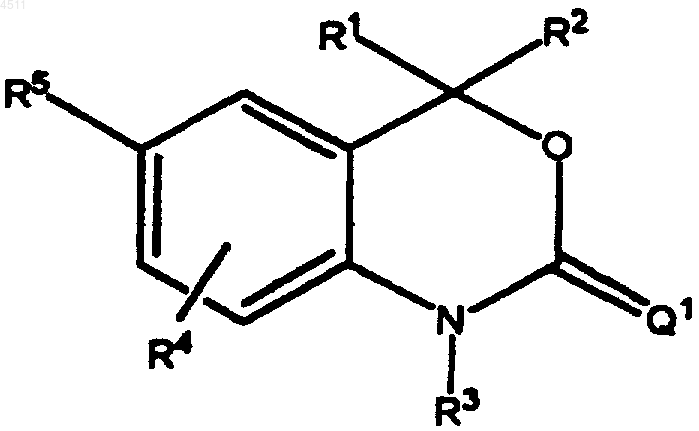
где R1 представляет собой H, C1-C6алкил, замещенный C1-C6алкил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NR8CORA;
R2 представляет собой H, C1-C6алкил, замещенный C1-C6алкил, C2-C6алкенил, замещенный C2-C6алкенил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA;
или R1 и R2 сконденсированы с образованием спироциклического кольца, выбранного из группы, включающей a), b) и c), причем каждое кольцо может быть необязательно замещено 1-3 заместителями, выбранными из группы, состоящей из H и C1-C6алкила:
a) 3-8-членное насыщенное спироциклическое кольцо, имеющее углеродный скелет;
b) 3-8-членное спироциклическое кольцо, имеющее углеродный скелет с одной или более двойными связями; и
c) 3-8 членное спироциклическое кольцо, содержащее от одного до трех гетероатомов, выбранных из группы, состоящей из O, S и N;
RA представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RB представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил, C3-C6алкенил, замещенный C3-C6алкенил, алкинил, замещенный алкинил или CORC;
RC представляет собой H, C1-C4алкил, замещенный C1-C4алкил, арил, замещенный арил, C1-C4алкокси, замещенный C1-C4алкокси, C1-C4аминоалкил или замещенный C1-C4аминоалкил;
R4 представляет собой H, галоген, CN, NO2, C1-C6алкил, замещенный C1-C6алкил, C1-C6алкокси, замещенный C1-C6алкокси, C1-C6аминоалкил или замещенный C1-C6аминоалкил;
R5 представляет собой (i) или (ii):
(i) замещенное бензольное кольцо, содержащее заместители X, Y и Z, как показано ниже,
где X выбирают из группы, включающей H, галоген, CN, C1-C3алкил, замещенный C1-C3алкил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3тиоалкокси, замещенный C1-C3тиоалкокси, C1-C3аминоалкил, замещенный C1-C3аминоалкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD и NRECORD;
RD представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RE представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
Y и Z независимо представляют собой заместители, выбранные из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкокси;
при этом X, Y и Z не являются одновременно водородом; или
(ii) пяти- или шестичленное кольцо, содержащее 1, 2 или 3 гетероатома в своем скелете, выбранных из группы, включающей O, S, SO, SO2 и NR6, и содержащее один или два независимых заместителя, выбранных из группы, состоящей из H, галогена, CN, NO2 и C1-C3алкила, C1-C3алкокси,
R6 представляет собой H или C1-C3алкил,
при условии, что, когда Q1 является S, R1 и R2 оба не являются H;
при условии, что, когда Q1 является S; R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R2 представляет собой алкенил или замещенный алкенил, R1 не является алкилом, замещенным алкилом, циклоалкилом или замещенным циклоалкилом;
при условии, что, когда Q1 является S, R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо (ii), имеющех т своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;
Q1 представляет собой S, NR7 или CR8R9;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила или замещенного гетероциклила и SO2CF3;
R8 и R9 независимо представляют собой заместители, выбранные из группы, включающей H, C1-C6алкил, замещенный C1-C6алкил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, NO2, CN или CO2R10;
R10 представляет собой C1-C3алкил;
или CR8R9 образуют шестичленное кольцо, формула которого приведена ниже
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо;
причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолила;
замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
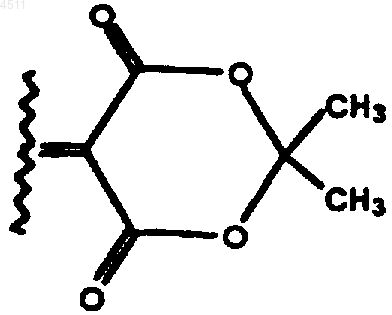
3. Соединение формулы
где R1 и R2 независимо выбирают из группы, состоящей из C1-C3алкила, замещенного C1-C3алкила, или R1 и R2 конденсируют с образованием имеющего углеродный скелет 3-6-членного насыщенного спироциклического кольца;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил или CORC;
RC представляет собой H, C1-C4алкил или C1-C3алкокси;
R4 представляет собой H, галоген, NO2, C1-C3алкил или замещенный C1-C3 алкил;
R5 представляет собой (i) или (ii):
(i) замещенное бензольное кольцо формулы
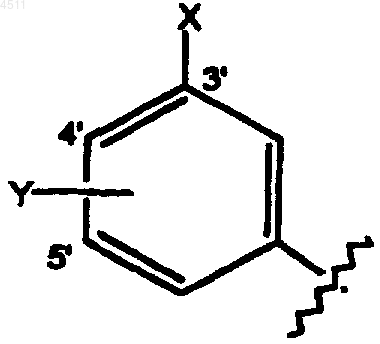
где X выбирают из группы, состоящей из галогена, CN, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего от 1 до 3 гетероатомов в своем скелете, или C1-C3тиоалкокси;
Y представляет собой заместитель, выбранный из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C4алкила и C1-C3тиоалкокси; или
(ii) пятичленное кольцо формулы
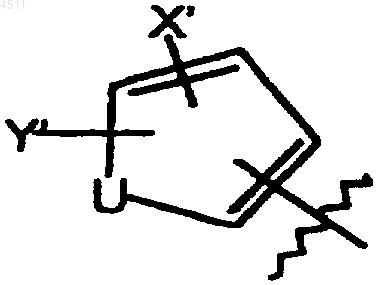
где X' выбирают из группы, включающей галоген, CN, C1-C3алкокси, C1-C3алкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов и C1-C3тиоалкокси;
Y' выбирают из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C4алкила или C1-C3тиоалкокси;
U представляет собой O, S или NR6;
R6 представляет собой H, C1-C3алкил или C1-C4 CO2алкил;
Q1 представляет собой S, NR7 или CR8R9;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила и SO2CF3;
R8 и R9 независимо представляют собой заместители, выбранные из группы, состоящей из H, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, NO2, CN или CO2R10;
R10 представляет собой C1-C3алкил;
или CR8R9 образуют шестичленное кольцо, формула которого приведена ниже

где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо;
причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолила;
замещенный алкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, ариыр, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
4. Соединение формулы
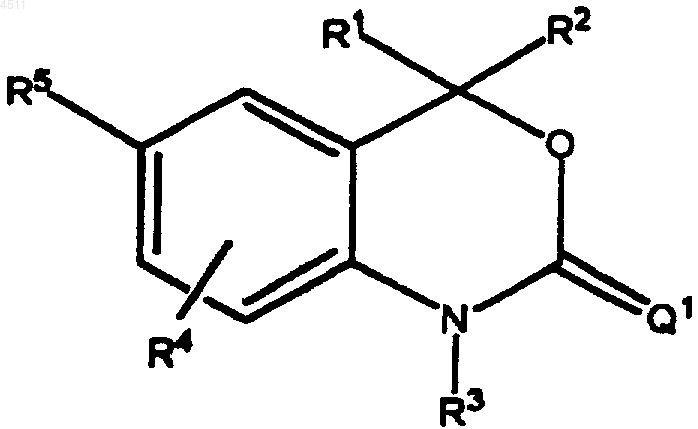
где R1 и R2 независимо выбирают из группы, состоящей из C1-C3алкила, замещенного C1-C3алкила или R1 и R2 конденсируют с образованием имеющего углеродный скелет 3-6-членного насыщенного спироциклического кольца;
R3 представляет собой H;
R4 представляет собой H, галоген, NO2, C1-C3алкил или замещенный C1-C3 алкил;
R5 представляет собой 6-членное кольцо формулы
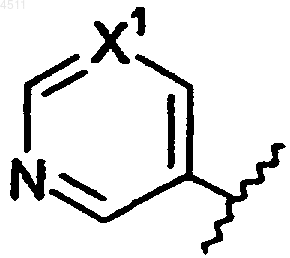
где X1 представляет собой N;
X2 представляет собой галоген, CN или NO2.
5. Соединение по любому из пп.1-2, в котором
R1 представляет собой H, C1-C6алкил, замещенный C1-C6алкил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA;
R2 представляет собой H, C1-C6алкил, замещенный C1-C6алкил, C2-C6алкенил, замещенный C2-C6алкенил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA
или R1 и R2 сконденсированы с образованием кольца, выбранного из группы, включающей a), b) и с):
a) 3-6-членное насыщенное спироциклическое кольцо, имеющее углеродный скелет;
b) 3-6-членное спироциклическое кольцо, имеющее углеродный скелет с одной или более двойными связями; и
c) 3-6 членное спироциклическое кольцо, содержащее в своем скелете от одного до трех гетероатомов;
RA представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
R5 представляет собой пяти- или шестичленное кольцо, в котором один или два независимых заместителя выбирают из группы, состоящей из H, галогена, CN, NO2 и C1-C3алкила и C1-C3алкокси;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила и SO2CF3.
6. Соединение по любому из пп.1-3, в котором
R1 и R2 независимо выбирают из группы, состоящей из C1-C3алкила, замещенного C1-C3алкила, или R1 и R2 сконденсированы с образованием имеющего углеродный скелет 3-6-членного насыщенного спироциклического кольца;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил или CORC;
RC представляет собой H, C1-C3алкил или C1-C3алкокси;
R4 представляет собой H, галоген, NO2, C1-C3алкил или замещенный C1-C3 алкил;
R5 представляет собой замещенное бензольное кольцо формулы
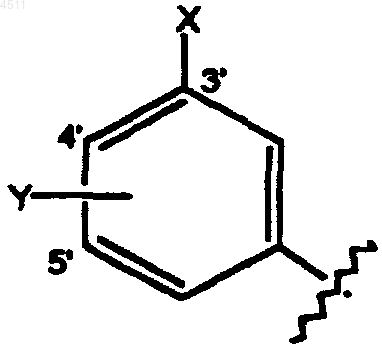
где X выбирают из группы, состоящей из галогена, CN, C1-C3алкокси, C1-C3алкила, NO2, C1-C3перфторалкила, 5-членного гетероциклического кольца, содержащего от 1 до 3 гетероатомов, и C1-C3тиоалкокси;
Y выбирают из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкокси;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила и SO2CF3.
7. Соединение по любому из пп.1-3, в котором
R1 и R2 независимо выбирают из группы, состоящей из C1-C3алкила и замещенного C1-C3алкила, или R1 и R2 сконденсированы с образованием имеющего углеродный скелет 3-6-членного насыщенного спироциклического кольца;
R3 представляет собой H;
RC представляет собой H, C1-C3алкил или C1-C3алкокси;
R4 представляет собой H, галоген, NO2, C1-C3алкил или замещенный C1-C3 алкил;
R5 представляет собой пятичленное кольцо формулы
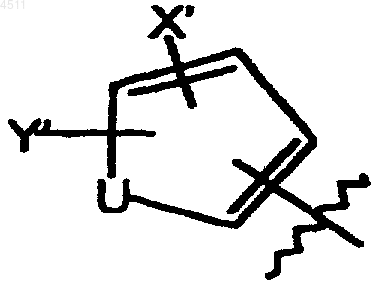
где X' выбирают из группы, включающей галоген, CN, C1-C3алкокси, C1-C3алкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов и C1-C3тиоалкокси;
Y' выбирают из группы, состоящей из H, галогена, CN, NO2, C1-C3алкокси, C1-C3алкила и C1-C3тиоалкокси;
U представляет собой O, S или NR6;
R7 выбирают из группы, состоящей из CN, C1-C6алкила, замещенного C1-C6алкила, C3-C8циклоалкила, замещенного C3-C8циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила и SO2CF3.
8. Соединение по любому из пп.1-3, в котором
R1 и R2 независимо выбирают из группы, состоящей из C1-C3алкила и замещенного C1-C3алкила, или R1 и R2 сконденсированы с образованием имеющего углеродный скелет 3-6-членного насыщенного спироциклического кольца;
R3 представляет собой H;
R4 представляет собой H, галоген, NO2, C1-C3алкил или замещенный C1-C3алкил;
R5 представляет собой 6-членное кольцо формулы
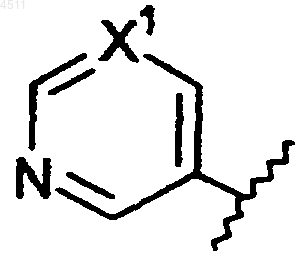
где X1 представляет собой CX2;
X2 представляет собой галоген, CN или NO2.
9. Соединение по п.1, которое представляет собой 6-(3-хлорфенил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-тион, 4-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрил, 3-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил, 3-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-1-метил-1H-пиррол-2-карбонитрил, 6-(3 -фторфенил)-4-метил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-4-метилтиофен-2-карбонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-1H-пиррол-2-карбонитрил, [6-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)пиридин-2-ил]ацетонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-1H-пиррол-2-карботиамид, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-3-карбонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-1-этил-1H-пиррол-2-карбонитрил, 4-(1,2-дигидро-2-тиоксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-2-фторбензонитрил, 6-(5-бромпиридин-3-ил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-хлор-5-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-бром-5-метилфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-бром-5-трифторметоксифенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 3-(1,2-дигидро-2-тиоксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-5-фторбензонитрил, 3-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-5-метилбензонитрил, 6-(3,5-дихлорфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 5-(4,4-диметил-1,2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)изофталонитрил, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-2-фуронитрил, 4,4-диэтил-6-(3-нитрофенил)-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-хлорфенил)-4-метил-4-фенил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 4-аллил-6-(3-хлорфенил)-4-метил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 3-хлор-5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)бензонитрил, 6-(3,5-дифторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-фтор-5-метоксифенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 3-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-5-метоксибензонитрил, 6-(3-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-[3-фтор-5-(трифторметил)фенил]-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(2-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3,4-дифторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(4-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 3-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-4-фторбензонитрил, 6-(2,3-дифторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 3-(8-бром-4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-5-фторбензонитрил, 4,4-диметил-6-(3-нитрофенил)-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-хлорфенил)-4,4-диэтил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-метоксифенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(2-хлорфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 4-бензил-6-(3-хлорфенил)-4-метил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 6-(3-бром-5-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)тиофен-2-карбонитрил, 3-фтор-5-(8-фтор-4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)бензонитрил, 3-(1,2-дигидро-2-тиоксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)бензонитрил, 5-(1,2-дигидро-2-тиоксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-4-метил-2-тиофенкарбонитрил, 5-(1,2-дигидро-2-тиоксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил, 6-(3-хлор-4-фторфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион, 5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-4-пропилтиофен-2-карбонитрил, 4-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-2-фуронитрил, 6-(3-бромфенил)-4,4-диметил-1,4-дигидро-2H-3,1-бензоксазин-2-тион или 2-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)тиофен-3-карбонитрил, или его фармацевтически приемлемая соль.
10. Соединение по п.3, которое представляет собой 4-бутил-5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)тиофен-2-карбонитрил или трет-бутил-2-циано-5-(4,4-диметил-2-тиоксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-1H-пиррол-1-карбоксилат, или его фармацевтически приемлемая соль.
11. Фармацевтическая композиция, включающая фармацевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый носитель или наполнитель.
12. Способ проведения контрацепции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему соединения по любому из пп.1-10 или его фармацевтически приемлемой соли.
13. Способ лечения карциномы или аденокарциномы эндометрия яичников, груди, толстой кишки или простаты, включающий введение нуждающемуся в этом млекопитающему соединения по любому из пп.1-10.
14. Способ лечения дисфункционального кровотечения, маточной лейомиомы, эндометриоза, поликистозного синдрома яичников, фибром или для проведения заместительной гормонотерапии, включающий введение нуждающемуся в этом млекопитающему соединения по любому из пп.1-10.
15. Способ заместительной гормонотерапии млекопитающего, включающий введение нуждающемуся в ней млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-10 или его фармацевтически приемлемой соли.
Текст
1 Область изобретения Данное изобретение касается соединений,которые являются агонистами рецептора прогестерона, способа их получения и применения. Настоящее изобретение также обеспечивает методы использования этих соединений для проведения контрацепции, а также в лечении и/или профилактике дисфункционального кровотечения, маточной лейомиомы, эндометриоза,кистозного синдрома яичников, карцином и аденокарцином эндометрия, яичников, груди,толстой кишки и простаты. Описание изобретения Внутриклеточные рецепторы (IR) образуют класс структурно связанных регуляторов генов, известных как "лигандзависимые факторы транскрипции" (R.М. Evans, Science, 240,889, 1988). Семейство стероидных рецепторов представляет собой подгруппу семейства IR,включая рецептор прогестерона (PR), рецептор эстрогенов (ER), рецептор андрогенов (AR),рецептор глюкокортикоидов (GR) и рецептор минералокортикоидов (MR). Природный гормон или лиганд для рецептора PR представляет собой стероид прогестерон, но и синтетические соединения, такие как медроксипрогестерон ацетат или левоноргестрел, могут быть использованы в качестве этого же лиганда. Как только лиганд появляется в жидкости окружающей клетку, он проходит через мембрану, посредством пассивной диффузии, и связывается с рецептором IR, образуя комплекс рецептор/лиганд. Этот комплекс образует связь со специфическими промоторами генов клеточной ДНК. После связывания с ДНК, комплекс продуцирует мРНК и белок,кодируемый данным геном. Соединение, которое связывается с рецептором IR и подражает действию природного гормона, называется здесь агонистом, в то время как соединение, которое препятствует действию гормона, называется антагонистом. Агонисты рецептора PR (природные и синтетические) играют важную роль для здоровья женщин. Агонисты peцептоpa PR используются в составах по ограничению рождаемости, обычно в присутствии агониста рецептора ER, альтернативно они могут быть использованы вместе с антагонистом рецептора PR. Агонисты рецептора ER обычно используются для лечения симптомов менопаузы, но были связаны с пролиферирующим эффектом на матке, которые могут вести к увеличению риска раковых заболеваний матки. Совместное лечение агонистами рецептора PR сокращает/исключает этот риск. Соединения по настоящему изобретению оказывают действие в качестве конкурентных ингибиторов связывания прогестерона с рецептором PR и действуют в качестве агонистов в функциональных моделях как in vitro, так и invivo. Эти соединения могут быть использованы для контрацепции, а также для лечения фибром, 004511 2 эндометриоза, рака груди, матки, яичников и простаты, и постменопаузной гормональной заместительной терапии.Jones, et al., описали эфир енола 2 (патент США 5,693,646) в качестве лиганда рецептора PR.Jones, et al., описали соединение 3 (патент США 5,696,127) в качестве лиганда рецептора PR.Zhi, et al., описали лактоны 4, 5 и 6 в качестве антагониста рецептора PR (J. Med. Chem,41, 291, 1998).Zhi, et аl., описали эфир 7 в качестве антагониста рецептора PR (J. Med. Chem., 41, 291,1998).Combs, et al., описали амид 8 в качестве лиганда рецептора PR (J. Med. Chem., 38, 4880,1995).Pflegel et al. (Pharmazie, 37(10), 714717(1982 раскрыли хиназолин-2-тионы, такие как соединения D, при их изучении полярографии гетероциклов, но при этом не раскрыли активности для соединения D.Perlman, et. al., описали аналог витамина D 9 в качестве лиганда рецептора PR (Tet. Letters,35, 2295, 1994).Cyщность изобретения Настоящее изобретение относится к соединению формулыHamann, et al., описали антагонист рецептора PR 10 (Ann. N.Y. Acad. Sci., 761, 383, 1995).Sakata et al. (JP 07159917, CA 123:301431) показали, что некоторые бензоксазин-2-тионы,такие как соединения А, могут быть использованы в виде фотографических материалов. Kirnet al., раскрыли, что некоторые имидазолзамещенные бензотиазины, такие как соединения В,могут быть использованы в виде кардиотоников(WO98/14436) заявили о том, что бензоксазин-2 тионы, такие как соединения С, являются ингибиторами обратной транскриптазы ВИЧ. где R1 и R2 представляют собой независимые заместители, выбранные из группы, состоящей из Н, C1-С 6 алкила, замещенного C1-С 6 алкила,C2-С 6 алкенила, замещенного C2-С 6 алке-нила,C2-С 6 алкинила, замещенного C2-С 6 алкини-ла,C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила, арила, замещенного арила, гетероциклила, замещенного гетероциклила, CORА иNRBCORA,или R1 и R2 сконденсированы с образованием кольца, выбранного из группы, включающей а), b) и с), причем каждое кольцо может быть необязательно замещено 1-3 заместителями, выбранными из группы, состоящей из Н иb) 3-8-членное спироциклическое кольцо,имеющее углеродный скелет с одной или более двойными связями; иc) 3-8-членное спироциклическое кольцо,содержащее в своем скелете от одного до трех гетероатомов, выбранных из группы, включающей О, S и N;RВ представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;C1-С 3 алкокси, C1-С 3 аминоалкила или замещенного C1-С 3 аминоалкила;C1-С 3 аминоалкил, NО 2, C1-С 3 перфторалкил, 5 или 6-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD или NRECORD;RD представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RE представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;Y и Z представляют собой независимые заместители, выбранные из группы, состоящей из Н, галогена, CN, NO2, C1-С 3 алкокси, C1-С 3 алкила или C1-С 3 тиоалкокси; при этом X, Y и Z не являются одновременно водородом; иii) пяти- или шестичленное гетероциклическое кольцо с 1, 2 или 3 гетероатомами в кольце,выбранными из группы, состоящей из О, S,S(O), SO2 или NR6 , и содержащее один или два независимых заместителя, выбранных из группы, состоящей из Н, галогена, CN, NO2, и C1-С 3 алкила, C1-С 3 алкокси, C1-С 3 аминоалкила, CORF или NRG CORF;RG представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;R оба не являются Н; при условии, что когда Q1 является S; R5 представляет собой бензольное кольцо (i), заме 004511 6 щенное одним или двумя заместителями или 5 или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы,состоящей из О, S и NR6, и R1 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R2 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом; или,если R2 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R1 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом,замещенным алкенилом, алкинилом и замещенным алкинилом; при условии, что когда Q1 является S; R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из О, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;R7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3 С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила или замещенного гетероциклила, SO2CF3, OR11 иR8 и R9 представляют собой независимые заместители, выбранные из группы, состоящей из Н, C1-С 6 алкила, замещенного C1-С 6 алкила,C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила, арила, замещенного арила, гетероциклила иди замещенного гетероциклила, NO2, CN и СО 2R10;R11 и R12 независимо выбирают из группы,состоящей из Н, C1-С 6 алкила, замещенного C1 С 6 алкила, арила, замещенного арила, гетероарила,замещенного гетероарила, ацила и сульфонила; где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила; гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо; причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила,имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила; 6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2 7 оксопиперидинила, пиридинила, пиразинила,пиримидинила, пиридазинила, морфолинила,тиаморфолинила, тиаморфолинилсульфоксида; полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила,бензофуранила, бензотиенила и изохинолила; замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила; замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы,состоящей из галогена, CN, ОН, NO2, амино,арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2,амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила,алкокси, арилокси, замещенного алкилокси,алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей галогена, CN, ОН, NO2, амино, арила,замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; или его фармацевтически приемлемой соли. К числу предпочтительных соединений относятся соединения формулы 8 гетероциклил, замещенный гетероциклил, СОRA или NRBCORA; или R1 и R2 сконденсированы с образованием спироциклического кольца, выбранного из группы, включающей а), b) и с), причем каждое кольцо может быть необязательно замещено 1-3 заместителями, выбранными из группы, состоящей из Н и C1-С 6 алкила:b) 3-8-членное спироциклическое кольцо,имеющее углеродный скелет с одной или более углерод-углеродными двойными связями; и с) 3-8-членное спироциклическое кольцо,содержащее в своем скелете от одного до трех гетероатомов, выбранных из группы, состоящей из О, S и N;RB представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;RC выбирают из Н, C1-С 4 алкила, замещенного C1-С 4 алкила, арила, замещенного арила,C1-С 4 алкокси, замещенного C1-С 4 алкокси, C1-С 4 аминоалкила или замещенного C1-С 4 аминоалкила;R4 выбирают из Н, галогена, CN, NO2, C1 С 6 алкила, замещенного C1-С 6 алкила, C1-С 6 алкокси, замещенного C1-С 6 алкокси, C1-С 6 аминоалкила или замещенного C1-С 6 аминоалкила; где Х выбирают из группы, включающей Н,галоген, CN, C1-С 3 алкил, замещенный C1-С 3 алкил, C1-С 3 алкокси, замещенный C1-С 3 алкокси,C1-С 3 тиоалкокси, замещенный C1-С 3 тиоалкокси,C1-С 3 аминоалкил, замещенный C1-С 3 аминоалкил, NO2, C1-С 3 перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD или NRECORD;RD представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RE представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;Y и Z независимо представляют собой заместители, выбранные из группы, включающей 9 Н, галоген, CN, NO2, C1-С 3 алкокси, C1-С 3 алкил или C1-С 3 тиоалкокси; при этом X, Y и Z не являются одновременно водородом; или ii) пяти- или шестичленное кольцо содержащее с 1, 2 или 3 гетероатомов в своем скелете, выбранных из группы,включающей О, S, S(O), SO2 и NR6 и содержащее один или два независимых заместителя,выбранных из группы, включающей Н, галоген,CN, NO2, C1-С 3 алкил и C1-С 3 алкокси;R оба не являются Н; при условии, что когда Q1 является S; R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из О, S и NR6, и R2 представляет собой алкенил, замещенный алкенил, R1 не является алкилом, замещенным алкилом, циклоалкилом или замещенным циклоалкилом; при условии, что когда Q1 является S; R5 представляет собой бензольное кольцо (i), замещенное одним или двумя заместителями или 5- или 6-членное кольцо (ii), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из О, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;R7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3 С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила или замещенного гетероциклила, SО 2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, состоящей из Н, C1-С 6 алкила, замещенного C1-С 6 алкила,C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила, арила, замещенного арила, гетероциклила или замещенного гетероциклила, NO2, CN и CO2R10; где арил, гетероциклил, полициклическое кольцо, замещенный алкил, замещенный алкенил,замещенный алкинил, замещенный алкокси,замещенный аминоалкил, замещенный тиоалкокси, замещенный арил, замещенный циклоалкил, замещенный гетероциклил, замещенный алкилокси имеют указанные выше значения; или их фармацевтически приемлемые соли. 10 Другими предпочтительными соединениями являются соединения формулы где R1 и R2 независимо выбирают из группы,включающей C1-С 3 алкил, замещенный C1 С 3 алкил или R1 и R2 сконденсированы с образованием 3-6-членного насыщенного спироциклического кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, NO2, C1 С 3 алкил или замещенный C1-С 3 алкил;i) замещенное бензольное кольцо формулы: где Х выбирают из группы, включающей галоген, CN, C1-С 3 алкокси, C1-С 3 алкил, NO2, C1 С 3 перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, или C1-С 3 тиоалкокси; где X' выбирают из группы, включающей галоген, CN, C1-С 3 алкокси, C1-С 3 алкил, NO2, C1 С 3 перфторалкилалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов и C1-С 3 тиоалкокси;R7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила,арила, замещенного арила, гетероциклила или замещенного гетероциклила и SO2 СF3;R8 и R9 представляют собой независимые заместители, выбранные из группы, состоящей из Н, C1-С 6 алкила, замещенного C1-С 6 алкила,C3-С 8 циклоалкила, замещенного C3-С 8 циклоалкила, арила, замещенного арила, гетероцик 11 лила или замещенного гетероциклила, NO2, CN и CO2R10; где арил, гетероциклил, полициклическое кольцо, замещенный алкил, замещенный арил, замещенный циклоалкил, замещенный гетероциклил, замещенный алкилокси имеют указанные выше значения; или их фармацевтически приемлемые соли. Еще одна подгруппа предпочтительных соединений по изобретению включает соединения формулы где R1 и R2 независимо выбирают из группы,включающей C1-С 3 алкил, замещенный C1-С 3 алкил или R1 и R2 сконденсированы с образованием 3-6-членного насыщенного спироциклического кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, NO2, C1 С 3 алкил или замещенный C1-С 3 алкил; где X1 представляет собой N или СХ 2, где X2 представляет собой галоген CN или NO2,или их фармацевтически приемлемые соли. Еще одна подгруппа предпочтительных соединений по изобретению включает соединения формулыb) 3-6-членное спироциклическое кольцо,имеющее углеродный скелет с одной или более углерод-углеродными двойными связями; иc) 3-6-членное спироциклическое кольцо,содержащее от одного до трех гетероатомов;R5 представляет собой пяти или шестичленное кольцо, в котором один или два независимых заместителя выбирают из группы, состоящей из Н, галогена, CN, NO2, C1-С 3 алкила и где R1 и R2 независимо выбирают из группы,включающей C1-С 3 алкил, замещенный C1 С 3 алкил, или R1 и R2 сконденсированы с образованием 3-6-членного насыщенного спироциклического кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, NO2, C1 С 3 алкил или замещенный C1-С 3 алкил;R5 представляет собой замещенное бензольное кольцо формулы Х выбирают из группы, включающей галоген, CN, C1-С 3 алкокси, C1-С 3 алкил, NO2, C1-С 3 перфторалкилалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов и C1-С 3 тиоалкокси; 13 Еще одна подгруппа предпочтительных соединений по изобретению включает соединения формулы где R1 и R2 независимо выбирают из группы,включающей C1-С 3 алкил, замещенный C1 С 3 алкил, или R1 и R2 сконденсированы с образованием 3-6-членного насыщенного спироциклического кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, NO2, C1 С 3 алкил или замещенный C1-С 3 алкил;R5 представляет собой пятичленное кольцо формулы: где X' выбирают из группы, включающей галоген, CN, C1-С 3 алкокси, C1-С 3 алкил, NO2, C1-С 3 перфторалкилалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов и C1-С 3 тиоалкокси;U представляет собой О, S или NR6,R7 выбирают из группы, состоящей из CN,C1-С 6 алкила, замещенного C1-С 6 алкила, и C3 С 8 циклоалкила, замещенного С 3-C8 циклоалкила,арила, замещенного арила, гетероциклила, замещенного гетероциклила и SО 2 СF3; или их фармацевтически приемлемые соли. Соединения по изобретению могут содержать асимметрический атом углерода, и некоторые из соединений по изобретению могут содержать один или более асимметрических центров, что может привести к образованию оптических изомеров и диастереоизомеров. Хотя в формуле I не показано стереохимическое строение, настоящее изобретение включает подобные оптические изомеры и диастереоизомеры, также как рацематы и разделенные энантиомерно чистые R и S стереоизомеры; а также иные смеси R и S стереоизомеров и их фармацевтически приемлемые соли. Термин "алкил" используется здесь для обозначения насыщенных алифатических углеводородных групп как с линейной, так и с разветвленной цепью, содержащих от одного до восьми атомов углерода, предпочтительно от одного до шести атомов углерода; подразумевается, что понятие"алкенил" включает алкильные группы как с линейной, так и с разветвленной цепью, с по меньшей мере одной двойной углерод-углеродной связью, содержащие от двух до восьми атомов угле 004511 14 рода, предпочтительно от одного до шести атомов углерода; подразумевается, что "алкинильная" группа охватывает алкильные группы как с линейной, так и с разветвленной цепью, с по меньшей мере одной тройной углерод-углеродной связью, содержащие от двух до восьми атомов углерода, предпочтительно от одного до шести атомов углерода. Термины "замещенный алкил", "замещенный алкенил" и "замещенный алкинил" обозначают только что описанные алкил, алкенил и алкинил, содержащие один или более заместителей из группы, включающей галоген, CN, ОН,NO2, амино, арил, гетероциклил, замещенный арил, замещенный гетероциклил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино, арилтио. Эти заместители могут быть присоединены к любому атому углерода в составе алкильной, алкенильной или алкинильной группы при условии, что при таком присоединении образуется химически стабильный остаток. Термин "арил" используется здесь для обозначения ароматической системы, в которую может входить одно кольцо или несколько ароматических колец, сконденсированных или связанных друг с другом таким образом, что по крайней мере часть конденсированных или связанных колец образует сопряженную ароматическую систему. Арильные группы включают, но не ограничиваются ими, фенил, нафтил, бифенил, антрил, тетрагидронафтил, фенантрил. Термин "замещенный арил" обозначает определенный выше арил, содержащий от одного до четырех заместителей из группы, включающей галоген, CN, ОН, NO2, амино, алкил, циклоалкил, алкенил, алкинил, алкокси,арилокси, замещенный алкилокси, алкилкарбонил,алкилкарбокси, алкиламино или арилтио. Термин"гетероциклил" используется здесь для обозначения стабильного 4-7-членного моноциклического или стабильного полициклического гетероциклического кольца, которое может быть насыщенным,частично или полностью ненасыщенным и состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы, включающей атомы N, О, и S. Атомы N и S могут быть окислены. Гетероциклические кольца также включают любые полициклические кольца, в которых любое из определенных выше гетероциклических колец сконденсировано с арильным кольцом. Гетероциклическое кольцо может быть присоединено через любой гетероатом или атом углерода при условии, что полученная структура будет химически стабильной. Такие гетероциклические группы включают, например, тетрагидрофуран, пиперидинил, пиперазинил, 2-оксопиперидинил, азепинил, пирролидинил, имидазолил, пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил,изоксазолил, морфолинил, индолил, хинолилнил,тиенил, фурил, бензофуранил, бензотиенил, тиаморфолинил, тиаморфолинилсульфоксид и изохинолинил. Термин "замещенный гетероциклил" используется здесь для описания гетероциклилов,определенных выше, содержащих один или более 15 заместителей, выбранных из группы, включающей галоген, CN, ОН, NO2, амино, алкил, замещенный алкил, циклоалкил, алкенил, замещенный алкенил,алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино или арилтио. Термин "алкокси" используется здесь для обозначения OR группы, где R представляет собой алкил или замещенный алкил. Термин "арилокси" используется здесь для обозначения OR группы, где R представляет собой арил или замещенный арил. Термин "алкилкарбонил" используется здесь для обозначения RCO группы, где R представляет собой алкил или замещенный алкил. Термин "алкилкарбокси" используется здесь для обозначения COOR группы,где R представляет собой алкил или замещенный алкил. Термин "аминоалкил" обозначает как вторичные, так и третичные амины, в состав которых входят алкильные или замещенные алкильные группы, содержащие от одного до восьми атомов углерода, которые могут быть одинаковыми или различными, и местом их присоединения является атом азота. Термин "галоген" обозначает элементы Cl, Br, F и I. Соединения по изобретению можно получить, руководствуясь схемами, изображенными ниже,в которых введены следующие обозначения: 16 Как показано на схеме I, соединения по изобретению, как правило, получают с использованием подходящей реакции конденсации в качестве конечной стадии. Подходящим образом замещенную орто-аминобензойную кислоту или ее производное, такое как этиловый эфир(X=Br, I, Cl или скрытый предшественник конденсации, такой как алкокси группа, которую можно превратить в OTf группу, подходящую для реакции конденсации) обрабатывают подходящим металлоорганическим реагентом, например, реактивом Гриньяра, в подходящих апротонных растворителях, которые включают,но не ограничиваются ими, ТГФ или эфир, с получением орто-аминокарбинола 2, в инертной атмосфере, такой как аргон или азот, при температуре от -78 С до комнатной. Замыкание кольца карбинола 2 с получением бензоксазин-2 онов 3 обычно проводят с помощью конденсирующего реагента, такого как карбонилдиимидазол, фосген, диметилкарбонат или диэтилкарбонат в подходящем апротонном растворителе,таком как ТГФ, в интервале температур от комнатной до 65 С. Арилирование бензоксазин-2 онов 3 с получением соединения 4 можно осуществить с помощью разнообразных реакций конденсации, включающих реакции Сузуки (Suzuki), Стилле (Stille). Эти реакции обычно проводят в присутствии переходного металлического катализатора, например, палладиевого или никелевого комплекса часто с фосфиновыми лигандами, например Ph3P, dppf, dppe или ацетата палладия. В условиях такого катализа подходящим образом замещенный нуклеофильный реагент, например арилбороновая кислота,арилстаннан или арилцинковое соединение,конденсируется с бензоксазиноном 3 с получением соединения 4. Если для реакции нужно присутствие основания, то обычно используемые основания включают, но не ограничиваются ими, бикарбонат натрия, карбонат натрия,фосфат калия, карбонат бария или ацетат калия. Наиболее часто используемые растворители для этих реакций включают бензол, ДМФА, изопропанол, этанол, DME, эфир, ацетон или смесь вышеперечисленных растворителей с водой. Реакцию конденсации, как правило, проводят в инертной атмосфере, такой как азот или аргон, в интервале температур от комнатной до 95 С. Бензоксазинон 3 можно превратить в такой нуклеофил, как бороновая кислота, которую можно сконденсировать с подходящим электрофилом, например, с арилбромидом или арилиодидом с получением соединения 4, используя условия реакции конденсации, описанные выше. Превращение соединения 3 в соединение 5 можно осуществить путем обработки соединения 3 металлоорганическим реагентом, например, н-BuLi, в апротонном растворителе,таком как ТГФ или эфир, с последующим гашением реакционного раствора подходящим электрофилом, таким как триметилборат, триизо 17 пропилборат или хлорид цинка, в интервале температур от -78 С до комнатной температуры,в инертной атмосфере, такой как азот или аргон. Схема Ia Схема Ia иллюстрирует альтернативный подход к получению бензоксазинонов 3. Так,подходящий анилин 1 защищают алкоксикарбонильной защитной группой, включающей, но не ограничивающейся ими, алленоксикарбонил,трет-бутокикарбонил, бензоксикарбонил, этоксикарбонил или метоксикарбонил, в подходящем растворителе, таком как ТГФ, ацетонитрил,в присутствии или в отсутствии основания в качестве либо катализатора, либо акцептора кислоты. Защищенный анилин затем обрабатывают подходящим металлоорганическим реагентом, таким как литийорганический агент или реактив Гриньяра, таким же образом, как и при получении соединения 2, с образованием карбинола 6. Обрабатывая соединения 2 а подходящим основанием, таким как трет-бутилат калия,н-бутиллитий, гидроксид калия, в подходящем растворителе, таком как толуол, ТГФ, спирт, в инертной атмосфере, такой как азот или аргон, в интервале температур от комнатной температуры до температуры кипения соответствующего растворителя, получают бензоксазиноны 3. На cхеме II показана методика получения бензоксазинонов с двумя различными заместителями в положении 4. Амид Вайнреба(Weinreb) 8 можно получить из соответственно замещенного изатинового ангидрида 7 путем обработки его такой солью, как гидрохлорид N-,O-диметилгидроксиламина в протонном растворителе, таком как этанол, изопропанол, при кипячении с обратным холодильником, в инертной атмосфере, такой как аргон или азот. Конденсацию амида 8 с арильным электрофилом,таким как арилбороновая кислота или арилстаннан, с получением соединения 9, можно провести, используя обычную реакцию конденсации, например, Сузуки или Стилле, по методике конденсации, аналогичной той, что описана для получения бензоксазинонов 4. При обработке амида Вайнреба 9 металлоорганическими соединениями, например алкиллитием, алкиниллитием, ариллитием или заменяющим их соединением Гриньяра, в апротонном растворителе, таком как ТГФ или эфир, в инертной атмосфере, такой как аргон или азот, при температуре от -78 С до комнатной, получается аминокетон 10. Превращение кетона 10 в карбинол 11 можно осуществить путем обработки соедине 004511 18 ния 10 металлоорганическим реагентом, таким как алкильное, алкинильное или арильное соединение Гриньяра, в апротонном растворителе,таком как ТГФ или эфир, в инертной атмосфере,такой как азот или аргон, при температуре от 78 С до комнатной. Превращение кетона 10 в карбинол 11 можно также осуществить путем восстановления кетогруппы в соединении 10 до карбинольного остатка в соединении 11, используя подходящий восстанавливающий реагент, такой как алюмогидрид лития, боргидрид натрия, в подходящем растворителе, таком как ТГФ, эфир или безводный спирт, в инертной атмосфере, в интервале температур от 0 С до температуры кипения растворителя. Замыкание кольца карбинола 11 с получением соединений по изобретению можно выполнить с помощью конденсирующих реагентов, таких как карбонилдиимидазол, фосген, диметилкарбонат или диэтилкарбонат в подходящем апротонном растворителе, таком как ТГФ, в интервале температур от комнатной до 65 С. Схема II Альтернативно, орто-аминокетон 10 можно получить путем обработки ортоаминобензонитрила 14 металлоорганическим реагентом, таким как литийорганический реагент или реактив Гриньяра, в подходящем растворителе, таком как ТГФ или эфир, в инертной атмосфере, такой как азот или аргон, в интервале температур от -78 С до комнатной, как показано на схеме III. Бензонитрил 14 можно легко получить из соответствующим образом замещенного бензонитрила, такого как бромбензонитрил 13, используя подходящую реакцию конденсации, например, по протоколу Стилле 19 или Сузуки, осуществляемую по методике аналогичной той, что описана для получения амида Вайнреба 9. Схема III На cхеме IV изображен подход к получению бензоксазинонов с низшим перфторалкильным заместителем в положении-4, например, когда R6 представляет собой трифторметильную группу. Соответствующим образом замещенный хлоранилин 15 защищают подходящей защитной группой, используя, например,пивалоилхлорид или ди-трет-бутилпирокарбонат, получая защищенный анилин 16, в подходящем растворителе, таком как ацетонитрил, ацетон, ТГФ, метиленхлорид, или смеси растворителей, например метиленхлорида и воды, в инертной атмосфере, такой как аргон или азот, в интервале температур от 0 до 70 С. Может потребоваться присутствие подходящего основания, такого как карбонат натрия, бикарбонат натрия или карбонат калия, когда в процессе реакции образуется кислотный побочный продукт, например гидрохлорид. В результате обработки 16 соответствующим алкиллитием,таким как н-бутиллитий или втор-бутиллитий, с последующим взаимодействием с низшими перфторкарбоксипроизводными,например трифторацетилхлоридом,1-(трифторацетил)имидазолом или этилтрифторацетатом, в апротонном растворителе, таком как эфир или ТГФ,в инертной атмосфере, такой как аргон или азот,при температуре от -78 С до комнатной, получаются защищенные орто-аминокетоны. Последующее удаление защитной группы можно осуществить путем взаимодействия замещенных аминокетонов с подходящей кислотой, такой как TFA (трифторуксусная кислота), 3N водный раствор соляной кислоты, в подходящем растворителе, таком как метиленхлорид или вода, при температуре от 0 С до точки кипения растворителя, с получением ортоаминокетона 17. Получение 6-хлорбензоксазинона 19 из соединения 17 можно осуществить тем же путем,который описан для синтеза бензоксазинона 12 из кетона 10. Конденсацию соединения 19 с арильной группой с получением соединения 12 можно провести с помощью реакции конденсации, катализируемой никелевым комплексом. Палладиевые катализаторы оказались неэффективными для этого процесса конденсации. Реакцию конденсации соединения 19 с соответствующей арилбороновой кислотой можно проводить в присутствии подходящего основания,такого как фосфат калия, и комплекса никеля (0 или II) в качестве катализатора, например, никелевого комплекса с 1,2-бис(дифенилфосфино) этаном, 1,1'-бис(дифенилфосфино)ферроценом или трифенилфосфином. Наиболее часто используемые для данной реакции растворители включают диоксан или ТГФ. Реакцию конденсации обычно проводят в инертной атмосфере,такой как аргон или азот, в интервале температур от комнатной температуры до 95 С. Как показано на cхеме V, превращение бензоксазин-2-онов 3 или 12 в бензоксазин-2 тионы 20 или 21 можно осуществить путем обработки соединения 3 или 12 подходящим реагентом для введения серы, таким как реагент Лоэссона (Lawesson), в апротонном растворителе, таком как о-ксилол, хлорбензол или толуол,в инертной атмосфере, такой как аргон или азот,при кипячении с обратным холодильником. На cхемах VI и VII показан синтез других биоизостеров бензоксазинона. Используя методику, аналогичную той, что описана Kondo et al.(1990, можно получить соединение 22 путем обработки аминокарбинола II соответствующими кетено-S,S-ацеталями (по меньшей мере один из R16 или R17 является электроноакцепторной группой) в подходящем растворителе,таком как толуол или безводный этанол, в инертной атмосфере, такой как азот или аргон,при кипячении с обратным холодильником. Аналогично, соединение 23 может быть образовано путем взаимодействия аминокарбинола 11 с соответствующими имино-S,S-ацеталем или иминоацеталем (R18 является электроноакцепторной группой), с использованием методики,аналогичной описанной Evers, et al. (Evers, et al.(1991, в подходящем растворителе, таком как этанол, в инертной атмосфере, такой как аргон или азот, при кипячении с обратным холодильником. Другие методики (например, Wrobel etal., J. Med. Chem. 32, 2493(1989, потенциально пригодные для получения соединений 22 или 23 из соединений 20 или 21, проиллюстрированы на схеме VIIa. Так, соединение 20 или 21 алкилируют соответствующим алкилирующим реагентом, таким как реагент Меервейна, в подходящем растворителе, таком как метиленхлорид. За этим следует нуклеофильное замещение соответствующим нуклеофилом, таким как карбанион или аминное основание, с получением соединений 22 или 23, причем может образоваться любая из таутомерных форм соединений 22 или 23. Схема VI Как показано на схеме VIII, соединение 21 можно подвергнуть дальнейшей модификации по положению 1, используя разнообразные подходы, ведущие к получению множества новых циклотиокарбаматных производных, включая 1 алкильные, замещенные 1-алкильные, 1 карбонильные, замещенные 1-карбонильные, 1 карбокси, замещенные 1-карбокси производные. Например, алкильные или замещенные алкильные производные 24 можно получить путем обработки тиокарбамата 12 или 6 подходящим основанием, таким как гидрид натрия, в подходящем растворителе, таком как ДМФА, в инертной атмосфере, такой как аргон или азот, с последующим добавлением соответствующего электрофила, такого как алкил- или замещенный алкил-бромид, иодид или трифлат. Подобное превращение в положении 1 соединения 21 можно также осуществить в двухфазных условиях, как показано на cхеме VIII, когда алкилирование проводят с использованием межфазного катализатора, такого как бромид трибутиламмония, в подходящем растворителе, таком как ацетонитрил. Другие примеры подобных модификаций включают, но не ограничиваются ими, нагревание соединения 21 с триэтилортоформиатом с получением 1-замещенных производных 24 (cхема VIII). Ацилирование или карбоксилирование соединения 21 в положении 1 с получением соединения 25 можно легко осуществить путем обработки соединения 12 или 6 подходящим апияирующим или карбоксилирующим реагентом, таким как ди-трет-бутилдикарбонат, в присутствии подходящего основного катализатора,такого как DMAP, в подходящем растворителе,таком как ацетонитрил, в инертной атмосфере,такой как аргон или азот. Аминирование соединения 21 в положении 1 с получением соединения 26 можно провести с использованием подходящего аминирующего агента, такого как хлорамин, в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как ТГФ или диэтиловый эфир, по методике, описанной в литературе Соединения по настоящему изобретению можно использовать в форме солей, полученных из фармацевтически или физиологически приемлемых кислот или оснований. Эти соли включают, но не ограничиваются ими, следующие соли неорганических кислот, таких как соляная кислота, серная кислота, азотная кислота, фосфорная кислота, и в некоторых случаях, таких органических кислот, как уксусная кислота, щавелевая кислота, янтарная кислота и малеиновая кислота. Другие соли включают соли щелочных металлов или щелочно-земельных металлов,таких как натрий, калий, кальций или магний, в форме сложных эфиров, карбаматов и других общепринятых "пролекарственных" форм, которые при введении такой формы превращаютсяin vivo в активный остаток. Настоящее изобретение охватывает фармацевтические композиции и способы лечения, которые включают введение млекопитающему фармацевтически эффективного количества одного или более соединений, описанных выше, в качестве агонистов прогестеронового рецептора. Агонисты прогестероновых рецепторов по изобретению, используемые отдельно или в комбинации, могут найти применение с способах контрацепции и лечения и/или профилактики дисфункционального кровотечения, маточной лейомиомы, эндометриоза, синдрома поликистоза яичников, а также карцином и аденокарцином эндометрия яичников, груди, толстой кишки и простаты. Дополнительные виды использования соединений по изобретению включают стимулирование усваивания пищи. Настоящее изобретение также включает фармацевтические композиции, в которых используются вышеописанные соединения, предпочтительно в комбинации с фармацевтически приемлемым носителем или наполнителем. Когда соединения используют по одному из указанных выше назначений, они могут быть объединены с одним или более фармацевтически приемлемыми носителями или наполнителями,например, растворителями, разбавителями и 24 тому подобное, и могут вводиться перорально в такой форме, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие, например, от около 0,05 до 5% суспендирующего агента, сиропов, содержащих,например, от около 10 до 50% сахара, и эликсиры, содержащие, например, от около 20 до 50% этанола, и тому подобное, или парентерально в форме стерильных растворов для инъекций или суспензий, содержащих от около 0,05 до 5% суспендирующего агента в изотонической среде. Такие фармацевтические составы могут содержать, например, от около 25 до около 90% активного ингредиента в комбинации с носителем, чаще между около 5% и около 60% по массе. Используемая эффективная доза активного ингредиента может изменяться в зависимости от конкретного используемого соединения, пути введения и тяжести состояния больного. Однако, как правило, удовлетворительные результаты получают при введении соединений по изобретению в дневной дозе от около 0,5 до около 500 мг/кг веса тела животного, предпочтительно вводимую дозу разделяют на два-четыре приема в день, либо лекарство вводят в форме с замедленным выделением. Для большинства крупных млекопитающих общая дневная доза составляет от 1 до 100 мг, предпочтительно от 2 до 80 мг. Формы доз для внутреннего использования включают от 0,5 до 500 мг активного соединения в однородной смеси с твердым или жидким фармацевтически приемлемым носителем. Этот режим приема может быть модифицирован для обеспечения оптимального терапевтического эффекта. Например, можно вводить несколько раздельных доз в день или дозу можно пропорционально уменьшать в соответствии с обстоятельствами терапевтической ситуации. Эти активные соединения можно вводить пероральным, а также внутривенным, внутримышечным или подкожным путем. Твердые носители включают крахмал, лактозу, гидрофосфат кальция, микрокристаллическую целлюлозу, сахарозу и каолин, а жидкие носители включают стерилизованную воду, полиэтиленгликоли, неионные поверхностно-активные вещества и пищевые масла, такие как кукурузное,арахисовое или кунжутное масло, в соответствии с природой активного ингредиента и конкретной желаемой формой введения. Преимущественно можно включать в этот состав адъюванты, обычно используемые для приготовления фармацевтических композиций, такие как вкусовые вещества, красители, консерванты и антиоксиданты, например витамин Е, аскорбиновую кислоту, ВНТ и ВНА. Предпочтительными фармацевтическим композициями с точки зрения простоты их приготовления и введения являются твердые композиции, в особенности таблетки и капсулы с твердым 25 и жидким содержимым. Пероральное введение соединений является предпочтительным. Эти активные соединения можно также вводить парентерально или внутрибрюшинно. Можно приготовить растворы или суспензии этих активных соединений в виде свободных оснований или фармакологически приемлемой соли в воде, смешанной с подходящим поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Также можно приготовить суспензии в глицерине, жидких полиэтиленгликолях и их смесях в масле. В обычных условиях хранения или использования эти составы содержат консервант для предотвращения роста микроорганизмов. Фармацевтические формы, подходящие для использования в виде инъекций, включают стерильные водные растворы или суспензии и стерильные порошки для незапланированного приготовления стерильных растворов или суспензий для инъекций. В любом случае, форма должна быть стерильной и текучей до такой степени, чтобы ее можно было легко набрать в шприц. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего воздействия микроорганизмов, таких как бактерии и грибки. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол(напр., глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительное масло. Следующие примеры иллюстрируют получение соединений настоящего изобретения. Пример 1. 2-(2-Амино-5-бромфенил)пропан-2-ол. Раствор 2-амино-5-бромбензойной кислоты (10 г, 46 ммоль) в сухом ТГФ (200 мл) обрабатывали при -78 С в атмосфере азота раствором метилмагний бромида в эфире (3,0 М, 90 мл, 270 ммоль). Реакционную смесь медленно нагревали до комнатной температуры, перемешивали в течение 48 ч в атмосфере азота и затем вливали в водный 0,5N охлажденный раствор соляной кислоты (300 мл). Смесь нейтрализовали водным 1N раствором гидроксида натрия и добавляли этилацетат (300 мл). Органический слой отделяли и водный слой экстрагировали этилацетатом (3 х 100 мл). Объединенные органические слои промывали рассолом и высушивали (MgSО 4). Затем удаляли растворитель в вакууме, осадок очищали при помощи флэш хроматографии на силикагеле 26 К раствору 2-(2-амино-5-бромфенил) пропан-2-ола (18 г, 78 ммоль) в сухом ТГФ (150 мл) добавляли 1,1'-карбонилдиимидазол (15,5 г, 94 ммоль) в атмосфере азота. Реакционный раствор нагревали до 50 С в течение ночи. Растворитель удаляли в вакууме и осадок растворяли в этилацетате (100 мл). Раствор промывали водным 1N раствором соляной кислоты (2 х 40 мл), рассолом (20 мл), высушивали с помощью MgSO4. Затем удаляли растворитель в вакууме, получали 6-бром-4,4-диметил-1,4-дигидробензо[d][1,3]-оксазин-2-он в виде белого твердого вещества (20 г, 100%): т.пл. 199-200 С; 1 Н-ЯМР-78 С в атмосфере азота. После перемешивания при -78 С в течение 30 мин получали смесь и обрабатывали триизопропилборатом (6,5 мл, 28 ммоль). Реакционный раствор медленно нагревали до комнатной температуры и гасили водным 1N раствором соляной кислоты (60 мл). Добавляли этилацетат (100 мл) и отделяли органический слой, водный слой экстрагировали этилацетатом (3 х 60 мл). Объединенный органический слой промывали рассолом и высушивалиMgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш-хроматографии на силикагеле (этилацетат-гексан/2:1), получали(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновую кислоту в виде белого твердого вещества (1,4 г, 81%): т.пл. 249250 С; 1H-ЯМР (DMSO-d6)10,21 (с, 1 Н, D2 О взаимозаменяющий), 7,90-7,95 (уширенный с,2 Н, D2 О взаимозаменяющий), 7,67 (м, 2 Н), 6,79(0,35 г, 0,3 ммоль) и карбоната натрия (2,48 г,23,4 ммоль) в смеси ДМЕ и воды (40 мл/10 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония (20 мл). Добавляли этилацетат (50 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (3 х 15 мл). Объединенные органические слои промывали рассолом и высушивалиMgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш-хроматографии на силикагеле (гексан-этилацетат/2:1) и получали 6-(3-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оказин-2-он в виде желтоватого твердого вещества (1,4 г, 82%): т.пл. 158-159 С; 1(3,05 г, 12 ммоль), тетракис(трифенилфосфин) палладия (0) (0,6 г, 0,52 ммоль) и карбоната натрия (2,2 г, 21 ммоль) в смеси ДМЕ и воды (70 мл/15 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в токе азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония (20 мл). Добавляли этилацетат (100 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (3 х 30 мл). Объединенные органические слои промывали рассолом и высушивалиMgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии на силикагеле (гексан-этилацетат/1:1) и получали 6-(3-бром-5-фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он в виде белого твердого вещества (1,4 г, 40%): т.пл. 182-183 С; 1 Н-ЯМР (DMSO-d6)10,36 (с, 1 Н, D2O взаимозаменяющий), 7,78 (с, 1 Н), 7,58-7,65 (м, 3 Н),7,49 (дд, 1 Н, J=8,3, 1,8 Гц), 6,96 (д, 1 Н, J=8,5 Гц), 1,69 (с, 6 Н); 19F-ЯМР (DMSO-d6)112,46C16H13BrFNO2: С, 54,88; Н, 3,74; N, 4,00. Найдено: С, 54,83; Н, 3,82; N, 3,95. Пример 6. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил. Смесь 6-(3-бром-5-фторфенил)-4,4-диметил-2 Н-бензо[d][1,3]оксазин-2-она (1 г, 28 ммоль),цианида цинка (0,2 г, 1,7 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,2 г, 0,17 ммоль) в сухом ДМФА (20 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 6,5 ч. Реакционный раствор охлаждали до комнатной температуры и выливали в насыщенный водный раствор хлорида аммония (100 мл). Появлялся белый осадок, который собирали на фильтре. Белый осадок промывали дистиллированной водой (3 х 20 мл) и растворяли в смеси этилацетата 28 ли через подушку силикагеля и элюировали смесью этилацетата и гексана (1:1). Затем растворитель удаляли, получали 3-(4,4-диметил-2 оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6 ил)-5-фторбензонитрил в виде белого твердого вещества (0,7 г, 84%): т.пл. 253-254 С; 1 Н-ЯМР(м, 2 Н), 6,98 (д, 1H, J=8,2 Гц), 1,68 (с, 6 Н); 19FЯМР (DMSO-d6)112,25 (м, 1F); MS (EI) м/е 296(М+, 65%); Анал. вычисл. для C17H13FN2O2: С, 68,91; Н, 4,42; N, 9,45. Найдено: С, 68,85; Н,4,58; N, 9,14. Пример 7. 4-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)тиофенил 2-карбонитрил. Продукт, полученный из (1,4-дигидро-4,4 диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 4-бром-2-тиофенкарбонитрила таким же образом, как описано в примере 5, в виде желтоватого твердого вещества: т.пл. 230231 С (разложение); 1 Н-ЯМР (CDCl3)8,32 (с,1H, D2 О взаимозаменяющий), 7,83 (д, 1H, J=1,5 Гц), 7,61 (д, 1H, J=1,4 Гц), 7,43 (дд, 1H, J=8,2,1,9 Гц), 7,29 (д, 1H, J=1,8 Гц), 6,85 (д, 1H, J=8,2 Гц), 1,78 (с, 6 Н); MS (El) м/е 283 ([М-Н]-, 100%). Анал вычисл. для C15H12N2O2S0,2 Н 2 О: С, 62,57; Н, 4,34; N, 9,73. Найдено: С, 62,48; Н, 4,31; N,9,64. Пример 8. 6-(3-Хлорфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-тион. Смесь 6-(3-хлорфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она (0,15 г, 05 ммоль) и реагента Лоэссона (0,24 г, 0,6 ммоль) в безводном о-ксилоле нагревали в атмосфере азота в течение 3 ч. Растворитель удаляли и осадок очищали при помощи флэшхроматографии (силикагель, гексан-этилацетат/ 6:1), получали соединение указанное в заголовке в виде белого твердого вещества (80 мг, 52%) т.пл. 183-184 С; 1 Н-ЯМР (DMSO-d6)12,25 (с,1H, D2O взаимозаменяющий), 7,78 (т, 1H, J=1,7 Гц), 7,63-7,70 (м, 3 Н), 7,49 (т, 1H, J=7,8 Гц), 7,42MS (EI) м/е 303 (М+, 100%) 305 (М+, 32%); Анал. вычисл. для C16H14ClNOS: С, 63,26; Н,4,64; N, 4,61. Найдено: С, 63,37, Н, 4,62; N, 4,54. Пример 9. 4-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-тиофен 2-карбонитрил. Смесь 4-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)тиофен-2 карбонитрила (0,23 г, 0,8 ммоль) и реагента Лоэссона (0,38 г, 0,96 ммоль) в безводном оксилоле нагревали в атмосфере азота в течение 3 ч. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии (силикагель, гексан-этилацетат/3:1), получали соединение указанное в заголовке в виде желтого твердого вещества (85 мг, 35%): т.пл. 242243 С, 1 Н-ЯМР (DMSO-d6)12,22 (с, 1H, D2O(д, 1H, J=1,0 Гц), 7,71 (м, 2 Н), 7,09 (д, 1 Н, J=8,0 Гц), 1,69 (с, 6 Н), MS (APCI) м/е 301 ([М+Н]+,100%); Анал. вычисл. для C15H12N2OS2. С, 59,97; Н, 4,03, N, 9,33. Найдено: С, 59,67; Н, 3,85; N,9,14. Пример 10. 6-Бром-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-тион. Продукт, полученный из 6-бром-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-она и реагента Лоэссона таким же образом, как описано в примере 9, в виде белого твердого вещества: т.пл. 221-222.5 С; 1H-ЯМР (CDCl3)9,38(с, 1H, D2O взаимозаменяющий), 7,42 (дд, 1H,J=8,5, 2,1 Гц), 7,29 (д, 1H, J=2,0 Гц), 6,76 (д, 1H,J=8,4 Гц), 1,76 (с, 6 Н); MS (El) м/е 272 ([M+H]+,94%), 274 ([M+H]+, 100%). Пример 11. 3-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил. Продукт, полученный из 3-(4,4-диметил-2 оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6 ил)-5-фторбензонитрила и реагента Лоэссона таким же образом, как описано в примере 9, в виде желтого твердого вещества: 248-249 С; 1 НЯМР (DMSO-d6)12,3 (с, 1H), 8,15 (уширенный с, 1H), 8,02 (д, 1H, J=10,48 Гц), 7,85-7,78 (м, 3 Н),7,13 (д, 1H, J=8,92 Гц), 1,71 (с, 6 Н); MS (APCI) м/е 313([М+H]+, 100%); Анал. вычисл. для(0) (0,6 г, 0,52 ммоль), и карбоната натрия (2,2 г,21 ммоль) в смеси ДМЕ и воды (70 мл/15 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония (20 мл). Добавляли этилацетат (100 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (3 х 30 мл). Объединенные органические слои промывали рассолом и высушивалиMgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии на силикагеле (гексан-этилацетат/1:1) получали 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)бензонитрил в виде грязно-белого твердого вещества (0,7 г, 25%): т.пл. 236-237 С; 1 Н-ЯМР (DMSO-d6)10,34 (с,1H, D2 О взаимозаменяющий), 8,21 (с, 1 Н), 8,02 30 5,11; N, 10,00. Найдено: С, 72,75; Н, 5,05, N,9,65. Пример 13. 3-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрил. Смесь 3-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-бензонитрила (1 г, 3,6 ммоль) и реагента Лоэссона (1,8 г, 4,3 ммоль) в о-ксилоле (30 мл) нагревали с обратным холодильником в течение ночи. Реакционную смесь охлаждали до комнатной температуры, выливали в этилацетат (50 мл) и промывали 1N HCl (2 х 20 мл). Органический слой высушивали сульфатом натрия и концентрировали. Осадок очищали при помощи флэш хроматографии (силикагель, 20% этилацетат/гсксан),получали 3-(4,4-диметил-2-тиоксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-бензонитрил(0,21 г, 20%) в виде белого твердого вещества: т.пл. 236-237 С; 1 Н-ЯМР (DMSO-d6)12,3 (с,1 Н), 8,24 (с, 1H), 8,05 (д, 1 Н, J=8,07 Гц), 7,82 (д,1 Н, J=7,68 Гц), 7,74-7,64 (м, 3 Н), 7,14 (д, 1H,J=8,78 Гц), 1,71 (с, 6 Н); MS (APCI) м/е 295([М+H]+, 100%); Анал. вычисл. для C17H14N2OS: С, 69,36; Н, 4,79; N, 9,52. Найдено: С, 68,35; Н,4,91; N, 9,07. Пример 14. Активность в релевантных исследованиях. Соединения настоящего изобретения тестировали с помощью релевантных исследований, описанных ниже, и их активность оказалась в пределах от 0,01 нМ до 5 мкМ в in vitro исследованиях и от 0,001 до 300 мг/кг в исследованиях in vivo. Отобранные примеры приведены ниже в табл. 1. Таблица 1(1) Исследование пролиферации T47D клеток. Целью данного исследования является определение наличия у соединений прогестагенной или антипрогестагенной активности, путем изучения влияния на пролиферацию T47D клеток. Измеряли величину воздействия соединений на синтез ДНК в T47D клетках. В исследовании использовали следующие материалы и методы. а. Среда для выращивания: DMEM:F12 31 зародышевой бычьей сыворотки (не теплоинактивированной), 100 Ед./мл пенициллина,100 мг/мл стрептомицина, и 2 мМ GlutaMaxb. Среда для обработки: Минимальная Необходимая Среда (MEM) (51200-038 GIBCO,BRL) свободная от фенолового красного, дополненная 0,5% очищенной с помощью угля зародышевой бычьей сыворотки, 100 Ед./мл пенициллина, 200 мг/мл стрептомицина, и 2 мМBrdU клетки высевали на 96-луночные планшеты (Falcon, Becton Dickinson Labware) no 10000 клеток/лунка в среде для выращивания. После инкубирования в течение ночи среду заменяли на среду для обработки и клетки культивировали еще 24 ч перед обработкой. Исходные соединения растворяли в подходящем растворителе(100% этанол или 50% этанол/50% DMSO), и впоследствии разбавляли средой для обработки и добавляли к клеткам. Для прогестиновых и антипрогестиновых сравнительных соединений строили полные кривые "доза-эффект". Конечная концентрация растворителя составляла 0,1%. В контрольных лунках к клеткам добавляли только растворитель. Антипрогестины тестировали в присутствии 0,03 нМ тримегестона,сравнительного агониста прогестинов. Через 24 ч после обработки среду удаляли и клетки метили 10 мМ BrdU (Amersham Life Science, Arlington Heights, EL) в среде для обработки в течение 4 ч.d. Исследование пролиферации клеток. По окончании мечения BrdU среду удаляли и измеряли включение BrdU, используя набор ELISA для клеточной пролиферации (RPN 250, Amersham Life Science) в соответствии с инструкциями производителя. Кратко, клетки фиксировали с помощью фиксатора, содержащего этанол, в течение 30 мин с последующим инкубированием в блокирующем буфере в течение 30 мин для уменьшения фона. Добавляли в лунки меченное пероксидазой анти-BrdU антитело и инкубировали в течение 60 мин. Клетки промывали три раза PBS и инкубировали с 3,3'5,5'-тетраметилбензидиновым (ТМВ) субстратом 10-20 мин в зависимости от активности тестируемых соединений. Затем в каждую лунку добавляли 25 мкл 1 М серной кислоты для остановки цветной реакции и измеряли оптическую плотность с помощью планшетного считывающего устройства при 450 нм в течение 5 мин. е. Анализ результатов. Преобразованные путем извлечения квадратного корня данные использовали для анализа дисперсии и нелинейных кривых "доза-эффект",соответствующих активности как агонистов, так и антагонистов. Взвешивание Хьюбера исполь 004511 32 зовали для сглаживания эффекта резко выделяющихся значений. Величины ЕС 50 или IС 50 рассчитывали на основании повторно преобразованных величин. Программное обеспечениеJMP (SAS Institute, Inc.) использовали для одностороннего анализа дисперсии и анализов нелинейных кривых "доза-эффект" как для единичной дозы, так и для зависимости "доза-эффект".f. Сравнительные соединения. Тримегестон и ацетат медроксипрогестерона (МРА) служили сравнительными прогестинами, a RU486 служил сравнительным антипрогестином. Для всех сравнительных соединений строили полные кривые "доза-эффект" и рассчитывали величины ЕС 50 или IC50. Таблица 2 Приблизительные значения ЕС 50, стандартных ошибок (SE), и 95% доверительных интервалов(CI) для отдельных опытов Соединение Тримегестон МРА 95% CI Нижнее Верхнее значение значение 0,007 0,040 0,011 0,017 0,016 0,024 0,013 0,027 0,011 0,024 95% CI Нижнее Верхнее значение значение 0,001 0,008 0,014 0,001 0,014 0,020 0,001 0,014 0,022 ЕС 50: Концентрация соединения, при которой включение BrdU возрастает на половину от максимального значения, с SE; IC50: Концентрация соединения, при которой включение BrdU,индуцированное 0,1 тримегестоном, уменьшается на половину максимальной величины, с SE.(2). Исследование выделения отпадающей оболочки у крыс. Целью этого исследования является оценка воздействия прогестинов и антипрогестинов на выделение отпадающей маточной оболочки у крыс сравнение относительной активности различных тестируемых соединений. В исследовании использовали следующие материалы и методы. а. Методы. Тестируемые соединения растворяли в 100% этаноле и смешивали с кукурузным маслом (растворитель). Затем готовили исходные растворы тестируемых соединений в масле (Mazola) путем нагревания этой смеси (80 С) для упаривания этанола. Впоследствии перед обработкой животных тестируемые соединения разбавляли 100% кукурузным маслом или 10% этанолом в кукурузном масле. При сравнении 33 этих двух растворителей не наблюдалось никакого различия в эффекте выделения отпадающей оболочки.b. Животные (RACUC протокол 5002). Зрелых самок Sprague-Dawley крыс с удаленными яичниками (60 дневного возраста и весом 230 г) получали от (Taconic Farms; NY) после хирургической операции. Удаление яичников осуществляли по меньшей мере за 10 дней до обработки для уменьшения циркуляции половых стероидных гормонов. Животных держали в режиме 12-часового цикла свет/темнота,и давали им стандартную еду для крыс и по необходимости воду. с. Обработка. Крыс перед обработкой взвешивали и беспорядочно разбивали на группы по 4 или 5 животных. Тестируемые соединения вводили в 0,2 мл растворителя путем подкожной инъекции в заднюю часть шеи или в 0,5 мл с помощью зонда. Обработку животных проводили 1 раз ежедневно в течение 7 дней. В случае исследования прогестинов животные получали тестируемые соединения и дозу ЕС 50 прогестерона (5,6 мг/кг) в течение первых 3 дней обработки. После стимуляции выделения отпадающей оболочки животные продолжали получать прогестерон вплоть до вскрытия трупа, которое проводили 4 дня спустя.d. Дозировка. Дозы подбирали на основе мг/кг среднего значения веса тела в группе. Во все опыты включали контрольную группу, получавшую растворитель. Для построения кривых "дозаэффект" использовали полулогарифмическое увеличение доз (например, 0,1, 0,3, 1,0, 3,0 мг/кг.) е. Индукция выделения отпадающей оболочки. Приблизительно через 24 ч после третьей инъекции индуцировали выделение отпадающей оболочки в одной из маточных труб путем царапанья антимезометриального полостного эпителия тупой иглой 21 G. Противоположную трубу не трогали и использовали в качестве не стимулированного контроля. Приблизительно через 24 ч после конечной обработки крыс умерщвляли путем удушения СО 2 и взвешивали их тела. Матки удаляли и очищали от жира. Маточные трубы с выделившейся отпадающей оболочкой (D-труба) и контрольные (С-труба) взвешивали отдельно.f. Анализ результатов. Увеличение веса маточной трубы с выделившейся отпадающей оболочкой рассчитывали по соотношению D-труба/С-труба и использовали логарифмическое преобразование для оптимизации нормальности и гомогенности дисперсии. Использовали Huber M-estimator для сглаживания эффекта наблюдаемых резко выделяющихся преобразованных значений для построения кривых "доза-эффект" и односторон 004511 34 него анализа дисперсии. Программное обеспечение JMP (SAS Institute, Inc.) использовали для одностороннего ANOVA и анализов нелинейных кривых "доза-эффект".g. Сравнительные соединения. Для всех сравнительных прогестиновых соединений строили полные кривые "дозаэффект" и рассчитывали величины ЕС 50 для сырого веса матки. Таблица 4 Приблизительные значения EC50, стандартных ошибок (SE), и 95% доверительных интервалов(CI) для отдельных опытов Соединение 95% CI Нижнее Верхнее значение значение 4,21 7,20 4,41 8,76 0,07 0,16 0,11 0,25 0,03 0,14 0,04 0,16 0,09 0,17 0,06 0,13 0,06 0,14 0,29 0,60 0,22 0,67 0,25 0,61 Таблица 5 Приблизительные средние значения EC50,стандартных ошибок и 95% доверительных интервалов (CI) кривых "доза-эффект" для трех сравнительных соединений Соединение Прогестерон 3-Кетодезогестрел Левоноргестрел 95% CI Нижнее Верхнее значение значение 4,55 7,00 0,07 0,14 0,08 0,12 95% CI Нижнее Верхнее значение значение 0,05 0,96 0,08 0,27 Концентрация: Концентрация соединения в исследовании (по умолчанию - мг/кг веса тела) Способ введения: способ, которым соединение вводят животным Вес тела: Средний общий вес тела животного (по умолчанию - кг)D-труба: Сырой вес маточной трубы с выделившейся отпадающей оболочкой (по умолчанию - мг) С-труба: Сырой вес контрольной маточной трубы (по умолчанию - мг) Эффект выделения отпадающей оболочки: 35 Гестагенная активность: Соединения, которые в значительной степени (р 0,05) индуцируют выделение отпадающей оболочки по сравнению с контрольным растворителем, считаются активными. Антигестагенная активность: Соединения,которые в значительной степени (р 0,05) снижают ЕС 50 индуцированного прогестероном выделения отпадающей оболочки. ЕС 50 для веса матки: концентрация соединения, при которой эффект выделения отпадающей оболочки увеличивается на половину максимальной величины (по умолчанию - мг/кг)IС 50 для веса матки: концентрация соединения, при которой эффект выделения отпадающей оболочки, индуцированного прогестероном, уменьшается на половину максимальной величины ЕС 50 (по умолчанию - мг/кг)(3) Исследование с использованием PREлюциферазы в CV-1 клетках. Целью данного исследования является определение наличия у соединений гестагенной или антигестагенной активности, на основании их воздействия на репортерную активностьPRE-люциферазы в CV-1 клетках, совместно трансфицированных плазмидами человеческогоPR и PRE-люциферазы. В исследовании использовали следующие материалы и методы. а. Среда. Использовали следующую среду для выращивания:(об./об.) зародышевой бычьей сыворотки (тепло-инактивированной), 0,1 мМ MEM аминокислот, не являющихся незаменимыми, 100 ед./мл пенициллина, 100 мг/мл стрептомицина, и 2 мМGlutaMax (GIBCO, BRL). Использовали следующую экспериментальную среду DMEM(BioWhittaker), свободная от фенолового красного, содержащая 10% (об./об.) очищенной с помощью угля (теплоинактивированной) зародышевой бычьей сыворотки, 0,1 мМ MEM аминокислот, не являющихся незаменимыми, 100 ед./мл пенициллина, 100 мг/мл стрептомицина,и 2 мМ GlutaMax (GIBCO, BRL).b. Культивирование клеток, трансфекция,обработка и исследование с участием люциферазы. Исходные CV-1 клетки сохраняли в среде для выращивания. Совместную трансфекцию проводили с использованием 1,2 х 107 клеток, 5 мг плазмиды pLEM с геном hPR-B, клонированным по сайтам Sph1 и BamH1, 10 мг плазмидыpGL3 с двумя вставками PRE выше последовательности люциферазы, и 50 мг обработанной ультразвуком ДНК тимуса теленка в качестве ДНК-носителя в 250 мл. Электропорацию проводили при 260 В и 1000 мФ в Biorad Gene Pulser II. После электропорации клетки повторно суспендировали в среде для выращивания и высевали на 96-луночные планшеты по 40000 клеток/лунка в 200 мкл. После инкубирования в 36 течение ночи среду заменяли на экспериментальную. Затем клетки обрабатывали сравнительными или тестируемыми соединениями в экспериментальной среде. Соединения проверяли на наличие антигестагенной активности в присутствии 3 нМ прогестерона. Через 24 ч после обработки среду удаляли, клетки 3 раза промывали D-PBS (GIBCO, BRL). Добавляли по 50 мкл буфера для лизиса клеток (Promega,Madison, WI) в каждую лунку и встряхивали планшеты в течение 15 мин на планшетном шейкере (Lab Line Instrument, Inc.). Активность люциферазы измеряли с использованием специальных реагентов от фирмы Promega. с. Анализ результатов. Каждая обработка состояла по меньшей мере из 4 повторений опыта. Логарифмически преобразованные данные использовали для анализа дисперсии и нелинейных кривых "дозаэффект", соответствующих активности как агонистов, так и антагонистов. Взвешивание Хьюбера (Huber weighting) использовали для сглаживания эффекта резко выделяющихся значений. Величины ЕС 50 или IС 50 рассчитывали на основании повторно преобразованных величин. Программное обеспечение JMP (SAS Institute,Inc.) использовали для одностороннего анализа дисперсии и анализов нелинейных эффектов.d. Сравнительные соединения. Прогестерон и тримегестон служили сравнительными прогестинами, а RU486 служил сравнительным антипрогестином. Для всех сравнительных соединений строили полные кривые "доза-эффект" и рассчитывaли величины ЕС 50 или IС 50. Таблица 7 Приблизительные значения EC50, стандартных ошибок (SE), и 95% доверительных интервалов(CI) сравнительных прогестинов для трех отдельных опытов Соединение Прогестерон Тримегестон 95% CI Нижнее Верхнее значение значение 0,616 0,026 0,509 0,746 0,402 0,019 0,323 0,501 0,486 0,028 0,371 0,637 0,0075 0,0002 0,0066 0,0085 0,0081 0,0003 0,0070 0,0094 0,0067 0,0003 0,0055 0,0082 ЕС 50,нМ(CI) антипрогестина RU486 для трех отдельных опытов Соединение 95% CI Нижнее Верхнее значение значение 0,019 0,042 0,029 0,048 0,013 0,027EC50: Концентрация соединения, при которой активность PRE-люциферазы возрастает на половину от максимального значения (по умолчанию -нМ), с SE.IС 50: Концентрация соединения, при которой активность PRE-люциферазы индуцированная 3 нМ прогестероном, уменьшается на половину максимальной величины (по умолчанию нМ), с SE. Пример 15. Способ-166494. 6-(3-Фторфенил)-4-метил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 4-Амино-3'-фтор[1,1'-бифенил]-3-карбонитрил получали из 3-фторфенилбороновой кислоты и 2-амино-5-бромбензонитрила согласно примеру 4. Раствор 4-амино-3'-фтор[1,1'бифенил]-3-карбонитрила (6,65 г, 31,3 ммоль) в безводном ТГФ (100 мл) обрабатывали по каплям при комнатной температуре в атмосфере азота метилмагний бромидом (3,0 М в эфире, 21 мл, 63 ммоль). Реакционную смесь затем нагревали при слабом кипении с обратным холодильником в течении 1,5 ч, охлаждали до комнатной температуры, и обрабатывали водным 3N раствором соляной кислоты (30 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение 3 ч, охлаждали до комнатной температуры, и устанавливали значение рН 5-6 путем добавления насыщенного водного раствора карбоната натрия. Добавляли этилацетат (100 мл), органический слой отделяли и водный слой экстрагировали этилацетатом(3 х 50 мл). Оъединенные органические слои высушивали (MgSO4) и выпаривали. Осадок очищали при помощи флэш хроматографии на силикагеле (гексан-этилацетат/3:1) и получали 1(4-амино-3'-фтор[1,1'-бифенил]-3-ил)этанона (3 1 г, 43%): т.пл. 156-157 С. Затем раствор 1-(4-амино-3'-фтор[1,1'бифенил]-3-ил)этанона (3 г, 13 ммоль) в безводном метаноле (60 мл) обрабатывали при комнатной температуре в атмосфере азота боргидридом натрия равными порциями. После добавления, реакционную смесь перемешивали в течение 4 ч, обрабатывали насыщенным водным раствором сульфата аммония (50 мл) и этилацетата (100 мл). Органический слой отделяли, высушивали (MgSO4) и выпаривали в вакууме. Осадок очищали при помощи флэш хроматографии на силикагеле (гексан-этилацетат/3:1) с получением 1-(4-амино-3'-фтор[1,1'-бифенил]-3 ил)этанола в виде белого твердого вещества (2 г, 67%); т.пл. 136-137 С. Смесь указанного выше спирта (0,2 г, 0.87 ммоль) и трифосгена в безводном ТГФ (20 мл) перемешивали при комнатной температуре в 38 атмосфере азота. После 15 мин смесь обрабатывали насыщенным водным раствором бикарбоната натрия (30 мл) и этилацетата (40 мл). Органический слой отделяли, высушивали (MgSO4) и выпаривали с получением 6-(3-фторфенил)-4 метил-1,4-дигидро-2 Н-3,1-бензоксазин-2-она в виде белого твердого вещества (0,18 г, 81%): т.пл. 160-161 С; 1 Н-ЯМР (DMSO-d6)10,31 (с,1 Н), 7,62 (дд, 1H, J=8,2, 1,9 Гц), 7,57 (с, 1 Н),7,44-7,53 (м, 3 Н), 7,13-7,20 (м, 1 Н), 6,97 (д, 1H,J=8,2 Гц), 5,57 (кв, 1H, J=6,6 Гц), 1,63 (д, 3 Н,J=6,6 Гц). MS (ESI) м/е 256 [М-H]-. Раствор 6-(3-фторфенил)-4-метил-1,4 дигидро-2 Н-3,1-бензоксазин-2-она (0,15 г, 0,58 ммоль) в толуоле обрабатывали реагентом Лоэссона согласно примеру 9 с получением 6-(3 фторфенил)-4-метил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тиона (0,08 г, 50%) в виде грязнобелого твердого вещества (0,08 г, 50%): т.пл. 173-174 С; 1H-ЯМР (DMSO-d6)12,27 (с, 1H),7,70 (дд, 1H, J=8,2, 2,0 Гц), 7,62 (с, 1H), 7,467,56 (м, 3 Н), 7,15-7,22 (м, 1H), 7,11 (д, 1H, J=8,3 Гц), 5,64 (кв, 1H, J=6,6 Гц), 1,67 (д, 3 Н, J=6,6 Гц); MS (ESI) м/е 272 [М-H]-. Пример 16. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-4-метилтиофен-2-карбонитрил. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)-4-метилтиофен-2 карбонитрил синтезировали согласно примеру 5, с использованием (1,4-дигидро-4,4-диметил 2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 5-бром-4-метил-2-тиофенкарбонитрил,получали в виде грязно-белого твердого вещества: т.пл. 195-200 С; 1H-ЯМР (DMSO-d6)10,2C16H14N2O2S: С, 64,41; Н, 4,75; N, 8,89. Найдено: С, 64,64; Н, 4,62; N, 9,39. К раствору 5-(4,4-диметил-2-оксо-1,4-дитидро-2 Н-3,1-бензоксазин-6-ил)-4-метилтиофен 2-карбонитрил (5 г, 16,7 ммоль) в безводном толуоле добавляли, при комнатной температуре в атмосфере азота, реагент Лоэссона (6 г, 14,8 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 2 ч, давали остыть до комнатной температуры, и удаляли растворитель в вакууме. Осадок очищали при помощи колоночной флэш хроматографии на силикагеле (ТГФ-гексан/1:3) с получением указанного в заголовке соединения в виде желтоватого твердого вещества (2,4 г,46%): т.пл. 211-212 С; 1H-ЯМР (DMSO-d6)12,3 (с, 1H), 7,88 (с, 1H), 7,46-7,52 (м, 2 Н), 7,16 39 Пример 17. Трет-бутил-2-циано-5-(4,4 диметил-2-тиоксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-1 Н-пиррол-1-карбоксилат. Раствор 6-бром-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она (5,0 г, 20 ммоль) и тетракис(трифенилфосфин)палладия (0) (580 мг,0,5 ммоль) в толуоле (200 мл) перемешивали в токе азота в течение 25 мин. К раствору последовательно добавляли 1-трет-бутоксикарбонилпиррол-2-бороновую кислоту (8,24 г, 39 ммоль) в чистом этаноле (50 мл) и карбонат калия (5,39 г, 39 ммоль) в воде (50 мл). Смесь нагревали до 80 С в течение 16 ч и давали ей остыть. Реакционную смесь выливали в водный насыщенный раствор бикарбоната натрия (200 мл) и экстрагировали этилацетатом (3 х 200 мл). Органические слои объединяли, промывали водой (200 мл) и рассолом (100 мл) высушивали над сульфатом магния. Раствор фильтровали,концентрировали в вакууме, и осадок очищали при помощи колоночной флэш хроматографии на силикагеле (30% этилацетат/гексан) с получением трет-бутиловый эфир 2-(4,4-диметил-2 оксо-1,4-дигидро-2 Н-бензо[d](9 мл, 116 ммоль) и реакционной массе давали нагреться до комнатной температуры. Затем ее выливали в воду (50 мл) и продукт экстрагировали этилацетатом (2 х 50 мл). Органические слои объединяли, промывали рассолом (50 мл),высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Очищали при помощи колоночной флэш-хроматографии на силикагеле (30% этилацетат/гексан) получали трет-бутиловый эфир 2-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-цианопиррол-1-карбоновой кислоты (1,1 г, 52%) в виде белого порошка, т.пл. 165-167 С; 1 Н ЯМР(El) м/е 367 [М]+. К трeт-бутиловому эфиру 2-(4,4-диметил 2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6 ил)-5-циано-пиррол-1-карбоновой кислоты (1,3 г, 35 ммоль, 1 экв.) в толуоле (130 мл) добавляли реагент Лоэссона (1,58 г, 3,9 ммоль, 1,1 экв.) и реакционную смесь нагревали до 80 С в течение 2 ч. Растворитель удаляли в вакууме и осадок растворяли в смеси ацетон/дихлорметан и адсорбировали на силикагеле. Очищали при помощи колоночной флэш хроматографии на силикагеле (10% этилацетат/гексан) получали продукт (0,51 г, 38%) в виде желтых кристаллов.NaOEt (0,27 г, 3,9 ммоль, 3 экв.) в EtOH (5 мл) и реакцию нагревали до 80 С в течение 2 ч. Растворители удаляли в вакууме и остаток разделяли между этилацетатом (100 мл) и водой (100 мл). Слои отделяли и водный слой экстрагировали этилацетатом (100 мл). Органические слои объединяли, промывали рассолом (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Очищали при помощи колоночной флэш хроматографии на силикагеле (10% этилацетат/гексан) получали указанное в заголовке соединение (0,27 г, 73%) в виде коричневого порошка, т.пл. 261-262 С. 1 Н ЯМР (DMSO-d6)1,68 (с, 6 Н), 6,72-6,73 (м, 1 Н),6,99-7,01 (м, 1 Н), 7,06 (д, 1 Н, J=7,9 Гц), 7,667,70 (м, 2 Н), 12,26 (с, 1 Н), 12,62 (с, 1H); MS[6-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н 3,1-бензоксазин-6-ил)пиридин-2-ил]ацетонитрил получали согласно способу из примера 5, с использованием (1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и (6-бром-2-пиридил)ацетонитрила (J. Org.[M-H]-=292; Анал. вычис. для С 17 Н 15N3 О 2: С,69,61; Н, 5,15; N, 14,33. Найдено: С, 68,49; Н,5,19; N, 13,74. К [6-(4,4-диметил-2-оксо-1,4-дигидро-2 Н 3,1-бензоксазин-6-ил)пиридин-2-ил]ацетонитрилу (80 мг, 0,27 ммоль, 1 экв.) в n-ксилоле (10 мл) добавляли реагент Лоэссона (55 мг, 0,14 ммоль, 0,5 экв.) и реакцию нагревали при кипении с обратным холодильником в течение 2 ч. Реакционную массу охлаждали до комнатной температуры и адсорбировали на силикагеле. Очищали при помощи колоночной флэшхроматографии на силикагеле (50% этилацетат/гексан) получали указанное в заголовке со 41 единение (40 мг, 48%) в виде грязно-белого твердого вещества: т.пл. 215-217 С; 1 Н ЯМР (d6DMSO, 300 МГц)1,71 (с, 6 Н), 4,28 (с, 2 Н),7,15 (д, 1 Н, J=8,3 Гц), 7,36 (д, 1H, J=7,3 Гц),7,89-7,99 (м, 2 Н), 8,04-8,11 (м, 2 Н), 12,32 (с, 1H);[1,3]оксазин-6 ил)-5-цианопиррол-1-карбоновой кислоты (1 г,2,7 ммоль) помещали в круглодонную колбу объемом 25 мл, закрытую резиновой перегородкой и оснащенную вводом азота и иглой, позволяющей отводить газ. Сохраняли сильный ток азота, пока колбу помещали на масляную баню и нагревали до 160 С. После 20 мин нагревания при этой температуре, колбу удаляли с масляной бани и давали охладиться. Желтый остаток вымывали в большую колбу с помощью смеси дихлорметан/этилацетат и адсорбировали на малом количестве силикагеля. Очищали при помощи колоночной флэш-хроматографии на силикагеле (40% этилацетат/гексан) получали 5(4,4-диметил-2-оксо-1,4-дигидро-2 Н-3,1 бензоксазин-6-ил)-1 Н-пиррол-2-карбонитрилN, 15,72. Найдено: С, 67,19; Н, 4,96; N, 15,35. К раствору 5-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-1 Н-пиррол-2 карбонитрила (1 экв., 71 мг, 0,27 ммоль) в диметилформамиде (0,5 мл) добавляли карбонат калия (5 экв., 0,18 г, 0,135 ммоль). После 10 мин добавляли иодметан (3 экв, 0,5 мл, 0,81 ммоль) и суспензию перемешивали в течение 2 ч, выливали в воду (5 мл) и продукт экстрагировали этилацетатом (3 х 5 мл). Затем слои отделяли,водный слой экстрагировали этилацетатом(3 х 10 мл) и объединенный органический слой промывали рассолом, высушивали над MgSO4 и очищали при помощи колоночной флэш хроматографии на силикагеле (30% этилацетат/ гексан) получали 5-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-1-метил-1 Нпиррол-2-карбонитрил (30 мг, 41%) в виде белого твердого вещества: MS (ES) м/e 280 (М-Н)-; Анал. вычис. для C16H15N3O2: С, 68,3; Н, 5,37; N,14,9. Найдено: С, 68,4; Н, 5,51; N, 14,6. К раствору 5-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-1-метил-1 Нпиррол-2-карбонитрилу (6,0 г, 22 ммоль, 1 экв.) в толуоле (600 мл) добавляли реагент Лоэссона(5,9 г, 15 ммоль, 0,65 экв.) и реакцию нагревали до 80 С в течение 2 ч. Реакцию охлаждали до комнатной температуры, выливали в воду (200 мл) и экстрагировали этилацетатом (2 х 200 мл). Органические слои объединяли, промывали рассолом (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме. Очищали при помощи флэш хроматографии (5-10% этилацетат/гексан) и получали указанное в заголовке соединение (2,0 г, 31%) в виде слегка желтоватого твердого вещества: т.пл. 225-228 С. 1H ЯМР (d6-DMSO, 300 МГц)1,67 (с, 6 Н), 3,72 (с, 3 Н), 6,37 (дд, 1 Н, J=0,8, 4,1 Гц), 7,04 (дд, 1H, J=0,8, 4,1 Гц), 7,13 (м, 1 Н),7,47 (м, 2 Н), 12,30 (с, 1H); MS (ESI) [М-Н]-=296; Анал. вычис. для C16H15N3OS: С, 64,62; Н, 5,08;N, 14,13. Найдено: С, 64,7; Н, 5,12; N, 14,17. Пример 21. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-1 Н-пиррол-2 карботиамид. К раствору 4,4-диметил-6-(5-циано-1 Нпиррол-2-ил)-1,4-дигидробензо-[d][1,3]оксазин 2-на (6,0 г, 22,5 ммоль) в ксилоле (100 мл) добавляли реагент Лоэссона (5,9 г, 14,6 ммоль,0,65 экв.) и реакцию нагревали при кипении с обратным холодильником в течение 3 ч. Реакцию охлаждали до комнатной температуры,концентрировали в вакууме, и адсорбировали на силикагеле. Очищали при помощи колоночной флэш хроматографии на силикагеле (30% этилацетат/гексан) и получали указанное в заголовке соединение (1,2 г, 17%) в виде желтого порошка: 1H ЯМР (DMSO-d6)1,69 (с, 6 Н), 6,65 (дд, 1 Н, J=2,2, 3,8 Гц), 6,98 (дд, 1H, J=2,2, 3,8 Гц), 7,03C15H15N3OS2: С, 56,76; Н, 4,76; N, 13,24. Найдено: С, 56,78; Н, 4,87; N, 12,54. Пример 22. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)тиофен 3-карбонитрил. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)тиофен-3-карбонитрил получали согласно способу из примера 5 с использованием (1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)боро-новой кислоты и 2-бром-4-тиофенкарбонитрила, в виде грязно-белого твердого вещества: т.пл. 255260 С; 1H-ЯМР (DMSO-d6)10,36 (с, 1 Н), 8,48(д, 1 Н, J=1,9 Гц), 7,56-7,54 (дд, 1 Н, J=8,0, 2,0 Гц), 6,93 (д, 1H, J=8,1 Гц), 1,64 (с, 6 Н); MS (ESI) м/е 283 (М-Н)-. Соединение, указанное в заголовке, получали способом подобным к способу из примера 16 с использованием 5-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)тиофен 3-карбонитрила и реагента Лоэссона. Продукт получали в форме желтых кристаллов: т.пл. 258 43 259 С. 1 Н ЯМР (DMSO-d6)12,3 (с, 1 Н), 8,54 (д,1 Н, J=0,9 Гц), 7,96 (с, 1 Н), 7,69-7,62 (м, 2 Н),7,11-7,08 (д, 1 Н, J=8,3 Гц), 1,69 (с, 6 Н); MS (ESI) м/е 299C15H12N2OS21/2 Н 2 О: С, 58,0; Н, 4,24; N, 9,05. Найдено: С, 58,33; Н, 3,85; N, 8,39. Пример 23. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-1-этил-1 Нпиррол-2-карбонитрил. К раствору 5-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-1 Н-пиррол-2 карбонитрила (1,3 г, 5 ммоль) в диметилформамиде (25 мл) добавляли карбонат калия (1 г, 7,5 ммоль), и иодометан (0,4 мл, 5,1 ммоль), и смесь перемешивали при комнатной температуре в течение 3 ч. Смесь растирали в порошок со смесью этилацетат/вода, и этилацетатный слой отделяли, высушивали над сульфатом магния и концентрировали в вакууме. Осадок перекрислаллизовывали из этилацетат/гексан с получением 5-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-3,1 бензоксазин-6-ил)-1-этил-1 Н-пиррол-2 карбонитрила (0,4 г, 27%): т.пл. 200-202 С; 1 НЯМР (DMSO-d6)1,25 (т, J=7,2 Гц, 3 Н), 1,64 (с,6 Н), 4,07 (кв, J=7,2 Гц, 2 Н), 6,29 (д, J=4,1 Гц,1 Н), 7,0 (д, J=8 Гц, 1H), 7,05 (д, J=4,1 Гц, 1H),7,34 (м, 2 Н), 10,42 (с, 1 Н); MS (ESI) м/е 294 (МН)-. Соединение, указанное в заголовке, получали согласно способу из Примера 16 из 5-(4,4 диметил-2-оксо-1,4-дигидро-2 Н-3,1-бензоксазин 6-ил)-1-этил-1 Н-пиррол-2-карбонитрила и реагента Лоэссона. Продукт получали в форме белых иголок: т.пл. 212-213 С; 1H-ЯМР (DMSOd6)1,25 (t, 3H, J=7 Гц), 1,68 (с, 6 Н), 4,07 (кв,J=7 Гц, 2 Н), 6,32 (д, J=3,9 Гц, 1H), 7,07 (д, J=3,9 Гц, 1H), 7,15 (д, J=9 Гц, 1H), 7,42 (м, 2 Н), 12,33(с, 1H); MS (ESI) м/е 310 (М-Н)-. Пример 24. 4-(1,2-Дигидро-2-тиоксоспиро 4 Н-3,1-бензоксазин-4,1-циклогексан-6-ил)-2 тиофенкарбонитрил. 1-(2-Амино-5-бромфенил)циклогексанол получали согласно способу из примера 1 с использованием 2-амино-5-бромбензойной кислоты и реагента Гриньяра, полученного из 1,5 дибромпентана, в виде прозрачного масла: 1 НЯМР (DMSO-d6)7,07 (д, 1H, J=2,3 Гц), 7,03(дд, 1H, J=8,4, 2,4 Гц), 6,55 (д, 1H, J=8,6 Гц),5,49 (с, 2 Н, D2O взаимозаменяющий), 5,00 (с,1H, D2O взаимозаменяющий), 2,01 (д, 2 Н, J=1,8 Гц), 1,66-1,77 (м, 2 Н), 1,44-1,61 (м, 4 Н), 1,161,34 (м, 2 Н); MS (ESI) м/е 270/272 ([М+H]+ 98%/100%). 6-Бромспиро[4 Н-3,1-бензоксазин-4,1'-циклогексан-2-(1 Н)-он] получали из 1-(2-амино-5 бромфенил)циклогексанола и карбонилимидазола согласно способу из примера 2. Продукт получали в виде грязно-белого твердого вещества: т.пл. 208-210 С; 1H-ЯМР (DMSO-d6)10,26 (с, 1 Н), 7,45 (д, 1H, J=2,2 Гц), 7,39 (дд, 1H,J=8,2, 2,2 Гц), 6,81 (д, 1H, J=8,3 Гц), 1,90-1,97(APCI) м/е 296 ([М+Н]+, 68%). Спиро-(4,1'-циклогексан-1,4-дигидро-2 оксо-2 Н-3,1-бензоксазин-6-ил) бороновую кислоту получали согласно способу из примера 4,с использованием 6-бромспиро[4 Н-3,1-бензоксазин-4,1'-циклогексан]-2-(1 Н)-она, в виде не совсем белого твердого вещества: т.пл. 223225 С. 1 Н-ЯМР (DMSO-d6)10,17 (с, 1H, D2O взаимозаменяющий), 7,92 (с, 2 Н, D2O взаимозаменяющий), 7,67 (с, 1H), 7,63 (дд, 1H, J=8,0, 1,1 Гц), 6,81 (д, 1H, J=7,9 Гц), 1,96 (с, 1H), 1,93 (с,1H), 1,57-1,88 (м, 7 Н), 1,24-1,34 (м, 1H); MS(ESI) м/e 262 (М+Н)+. 4-(1,2-Дигидро-2-оксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил получали согласно способу из примера 5 из спиро-(4,1'-циклогексан-1,4-дигидро-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 3-бром-5-цианотиофена в виде белых кристаллов: т.пл. 230-232 С; ИК (КВr) 2200 см-1; 1 НЯМР (DMSO-d6)10,29 (с, 1H), 8,49 (с, 1H),8,33 (с, 1H), 7,69-7,63 (м, 2 Н), 6,93-6,91 (д, 1H,J=8,2 Гц), 1,99-1,87 (м, 4 Н), 1,73-1,64 (м, 5 Н),1,38-1,31 (м, 1H); MS(+) АРСI м/e 325 (M+Н)+; Анал. вычис. для C18H16N2O2S1/4H2 О: С, 65,73; Н, 5,06; N, 8,52. Найдено: С, 65,55; Н, 5,06; N,8,22. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 4-(1,2-дигидро-2-оксоспиро[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил, в виде желтого твердого вещества: т.пл. 225-227 С; 1 Н-ЯМР (CDCl3)8,98 (с, 1H),7,83 (д, 1H, J=1,47 Гц), 7,63 (д, 1H, J=1,47 Гц),7,46 (дд, 1H, J=8,2, 1,91 Гц), 7,32 (м, 1H), 6,86 (д,1H, J=8,19 Гц), 2,28-2,29 (м, 2 Н), 2,06-2,01 (м,2 Н), 1,83-1,70 (м, 5 Н), 1,37-1,3 (м, 1H); MS (EC) м/е 339 ([М-Н]-). Пример 25. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-2-фторбензонитрил. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)-4-фторбензонитрил получали из (1,4-дигидро-4,4-диметил-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 5-бром-2-фторбензонитрила согласно способу из примера 5 в виде белого твердого вещества: т.пл. 229-230 С; 1 Н-ЯМР (DMSO-d6)10,4 (с,1 Н), 8,15 (дд, 1 Н, J=7,39, 2,12 Гц), 7,95-7,89 (м,1 Н), 7,59-7,48 (м, 3 Н), 6,99 (д, 1 Н, J=8,1 Гц), 1,7N, 9,45. Найдено: С, 68,74; Н, 4,83; N, 9,10. Соединение, указанное в заголовке, получали согласно способу из примера 16 с использованием 5-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-2-фторбензонитрила, в виде белого твердого вещества: т.пл. 258-259 С; 1H-ЯМР (DMSO-d6)12,3 (с, 1 Н),8,35-8,32 (м, 1 Н), 8,15-8,10 (м, 1 Н), 7,72-7,7 (м, 45 2 Н), 7,66-7,60 (м, 1 Н), 7,13 (д, 1H, J=8,07 Гц), 1,7(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 3,5-дибромпиридина согласно способу из примера 6, в виде белого твердого вещества: т.пл. 211-212 С; 1 НЯМР (DMSO-d6)10,4 (с, 1 Н), 8,92 (д, 1 Н, J=1,9 Гц), 8,66 (д, 1 Н, J=2,09 Гц), 8,40 (т, 1 Н, J=2,02 Гц), 7,72-7,68 (м, 2 Н), 6,99 (д, 1 Н, J=8,1 Гц), 1,7([М+H]+ 100%); Анал. вычис. для С 15 Н 13BrN2 О 2: С, 54,07; Н, 3,93; N, 8,41. Найдено: С, 54,15; Н,3,89; N, 8,31. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(5-бромпиридин-3-ил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 252-253 С; 1 НЯМР (DMSO-d6)12,3 (с, 1 Н), 8,94 (с, 1H), 8,69(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1-бром-3 хлор-5-фторбензола согласно способу из примера 5, в виде белого твердого вещества: т.пл. 193194 С; 1 Н-ЯМР (DMSO-d6)10,4 (с, 1H), 7,677,64 (м, 3 Н), 7,61-7,57 (м, 1H), 7,41-7,34 (м, 1H),6,96 (д, 1H, J=8,72 Гц), 1,7 (с, 6 Н), MS (APCI)C16H13ClFNO2: С, 62,86; Н, 4,29; N, 4,58. Найдено: С, 62,98; Н, 4,1; N, 4,6. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-хлор-5-бромфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-она: т.пл. 204-205 С; 1 Н-ЯМР (CDCl3)10,0 (с, 1H), 7,49(д, 1H, J=8,23 Гц), 1,9 (с, 6 Н); LC/MS (ES) m/e 320/322 ([М-Н]-) Пример 28. 6-(3-Бром-5-метилфенил)-4,4 диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Бром-5-метилфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали с использованием (1,4-метил-4,4-дигидро-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 3,5-дибромтолуола согласно способу из примера 5, в виде белого твердого вещества: т.пл. 231233 С; 1 Н-ЯМР (DMSO-d6)10,4 (с, 1 Н), 7,66(с, 3 Н), 7,58-7,56 (м, 2 Н), 7,50 (с, 1 Н), 7,37 (с,1 Н), 6,95 (д, 1H, J=8,67 Гц), 2,37 (с, 1 Н), 1,67 (с,6 Н); MS (ESI) м/е 344/346([М-Н]-, 100%), Анал. вычис. для C17H16BrNO2: С, 58,98; Н, 4,66; N,4,05. Найдено: С, 58,82; Н, 4,62; N, 3,94 Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-бром-5-метилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она,в виде желтого твердого вещества: т.пл. 183184 С; 1 Н-ЯМР (CDCl3)9,8 (с, 1 Н), 7,48-7,46(м, 1H), 7,34-7,25 (м, 4 Н), 6,97 (д, 1 Н, J=8,2 Гц),2,4 (с, 3 Н); 1,8 (с, 6 Н); MS (ES) м/е 360/362 ([МН]-). Пример 29. 6-(3-Бром-5-трифторметоксифенил)-4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Бром-5-трифторметоксифенил)-4,4 диметил-1,4-дигидро-бeнзo[d][1,3]oкcaзин-2-oн получали с использованием (4,4-диметил-1,4 дигидро-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1,3-дибром-5-трифторметоксибензола согласно способу из примера 5, в виде белого твердого вещества: т.пл. 214-216 С; 1 Н-ЯМР (DMSO-d6)10,4 (с, 1H), 7,99 (с, 1H),7,73 (с, 1H), 7,68-7,62 (м, 3 Н), 6,97 (д, 1H, J=8,0 Гц), 1,68 (с, 6 Н); MS (ESI) м/е 414 ([М-Н]-,100%), Анал. вычис. для C17H13BrF3NO3: С,49,06; Н, 3,15; N, 3,37. Найдено: С, 49,16; Н,3,05; N, 3,30. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-бром-5-трифторметоксифенил)4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2 она, в виде желтого твердого вещества: т.пл. 192-193 С; 1 Н-ЯМР (CDCl3)9,4 (с, 1H), 7,61 (с,1 Н), 7,49-7,46 (м, 1 Н), 7,40 (с, 1 Н) 7,30 (с, 2 Н),6,96 (д, 1H, J=8,22 Гц), 1,9 (с, 6 Н); MS (ES) м/е 431/433 ([М-Н]-). Пример 30. 3-(1,2-Дигидро-2-тиоксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-5 фторбензонитрил. 3-(1,2-Дигидро-2-оксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-5-фторбензонитрил получали согласно способу из примера 5 изN, 7,90. Найдено: С, 67,9; Н, 4,93; N, 7,67. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-(1,2-дигидро-2-оксоспиро[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)-5-фторбензонитрил: т.пл. 235-237 С; 1 Н-ЯМР (СDСl3)10,0 (с, 1H), 7,76-7,69 (м, 2 Н), 7,50-7,33 (м, 47 3 Н), 7,03 (д, 1H, J=8,8 Гц), 2,31-1,26 (м, 10 Н);MS (ES) m/e 351 ([М-H]-). Пример 31. 3-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-5-метилбензонитрил. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)-5-метилбензонитрил получали из (4,4-диметил-1,4-дигидро-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 3-бром-5-метилбензонитрила согласно способу из примера 5, в виде белого твердого вещества: т.пл. 256-258 С; 1 Н-ЯМР (DMSO-d6)10,4 (с,1 Н), 7,99 (с, 1H), 7,86 (с, 1 Н), 7,67-7,62 (м, 3 Н),6,97 (д, 1H, J=8,11 Гц), 2,42 (с, 3 Н), 1,68 (с, 6 Н);MS (APCI) м/е 293 ([М+H]+, 100%); Анал. вычис. для C18H16N2O2: С, 73,96; Н, 5,52; N, 9,58. Найдено: С, 73,26; Н, 5,46; N, 9,24. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-циано-5-метилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она: т.пл. 230-231 С; 1 Н-ЯМР (CDCl3)9,1 (с, 1H), 7,61 (с,1H), 7,55 (с, 1H), 7,50-7,47 (м, 2 Н), 7,32-7,31 (м,1H), 6,91 (д, 1H, J=8,2 Гц), 2,5 (с, 3 Н), 1,8 (с,6 Н); MS (ES) m/e 307 ([М-Н]-). Пример 32. 6-(3,5-Дихлорфенил)-4,4 диметил-1,4-дигидро-2 Н-3,1-бетоксазин-2-тион. 6-(3,5-Дихлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он получали из 6 бром-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она и 3,5-дихлорфенилбороновой кислоты согласно способу из примера 4, в виде белого твердого вещества: т.пл. 245-246 С; 1H-ЯМР(м, 2 Н), 7,56 (уш.с, 1H), 6,96 (д, 1H, J=7,98 Гц),1,7 (с, 6 Н); MS (EI) m/e 321 ([M+H]+, 40%),Анал. вычис. для С 16H13Cl2NO2: С, 59,32; Н,4,11; N, 4,32. Найдено: С, 59,13; Н, 4,29; N, 4,17. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3,5-дихлорфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она: т.пл. 206208 С; 1 Н-ЯМР (СDСl3)9,5 (с, 1H), 7,49-7,45(д, 1H, J=8,23 Гц), 1,8 (с, 6 Н); MS (ES) m/e 336/338 ([М-Н]-). Пример 33. Способ-164904. 5-(4,4-Диметил-1,2-тиоксо 1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)изофталонитрил. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)изофталонитрил получали из (1,4-дигидро-4,4-диметил-2-оксо-2 Н-1,3 бензоксазин-6-ил)бороновой кислоты и 5-бромизофталонитрила согласно способу из примера 5, в виде белого твердого вещества: т.пл. 288289 С; 1 Н-ЯМР (DMSO-d6)10,4 (с, 1 Н), 8,58C18H13N3O21,65 Н 2 О: С, 64,92; Н, 4,93; N, 12,62. Найдено: С, 64,74; Н, 4,69; N, 12,32. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 5-(4,4-диметил-2-оксо-1,4-дигидробензо[d][1,3]оксазин-6-ил)изофталонитрила: т.пл. 240-242 С; 1 Н-ЯМР (CDCl3)9,4 (с, 1H),8,03 (д, 2 Н, J=1,25 Гц), 7,92 (с, 1 Н), 7,50 (дд, 1H,J=8,22, 1,89 Гц), 7,33 (д, 1H, J=1,8 Гц), 7,01 (д,1H, J=8,24 Гц), 1,84 (с, 6 Н); MS (ES) m/e 318([М-Н]-). Пример 34. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-2-фуронитрил. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)фуран-2-карбонитрил получали согласно способу из примера 5 из 2 бром-5-цианофурана (1,0 г, 5,6 ммоль) (J. Med.Chem. (1997), 40(23), 3804-3819) и (1,4-дигидро 4,4-диметил-2-оксо-2 Н-1,3-бензоксазин-6-ил) бороновой кислоты (1,8 г, 8,18 ммоль), в виде белого твердого вещества (0,39 г, 1,45 ммоль,17%): т.пл. 257-260 С; 1 Н-ЯМР (DMSO-d6)10,48 (с, 1H), 7,73-7,70 (м, 3 Н), 7,19 (д, 1H, J=3,8 Гц), 6,98 (д, 1H, J=8,9 Гц), 1,66 (с, 6 Н); MS +)АРСI) м/е=269 (М+Н)+. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 5-(1,4-дигидро-4,4-диметил-2-оксо-2 Н-1,3 бензоксазин-6-ил)-2-фуранкарбонитрила: т.пл. 1 200 С с разложением; Н-ЯМР (CDCl3)9,1 (с,1H), 7,63 (дд, 1H, J=8,26, 1,68 Гц), 7,53 (д, 1H,J=1,59 Гц), 7,19 (д, 1H, J=3,7 Гц), 6,89 (д, 1H,J=8,31 Гц), 6,71 (д, 1H, J=3,72 Гц), 1,8 (с, 6 Н);MS (ES) m/e 283 ([М-H]-). Пример 35. 4,4-Диэтил-6-(3-нитрофенил)1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 4,4-Диэтил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-он получали из 4,4-диэтил-6-иод-1,4-дигидробензо[d][1,3]оксазин-2 она и 3-нитрофенилбороновой кислоты согласно способу из примера 4, в виде не совсем белого твердого вещества: т.пл. 193-194 С; 1 Н-ЯМРC18H18N2O40,3 Н 2 О: С, 65,17; H, 5,65; N, 8,44. Найдено: С, 65,31; Н, 5,60; N, 8,10. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 4,4-диэтил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде желтого твердого вещества: т.пл. 180-181 С; 1 Н-ЯМР([М-Н]-). Пример 36. 6-(3-Хлорфенил)-4-метил-4 фенил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. Смесь 2-амино-5-бром-N-метокси-N-метилбензамида (7,78 г, 30 ммоль) 3-хлорфенилбороновой кислоты (5,63 г, 36 ммоль),тетракис(трифенилфосфин)палладия (0) (1,73 г,1,5 ммоль) и карбоната натрия (7,63 г, 72 ммоль) в смеси ДМЕ и воды (150 мл/30 мл) дегазировали с удалением кислорода и нагревали до 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и обрабатывали рассолом (30 мл) и этилацетатом(100 мл). Отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 40 мл). Объединенные органические слои промывали рассолом и высушивали MgSO4. Затем удаляли растворитель, осадок очищали при помощи флэш хроматографии(силикагель,гексан:этилацетат/1:1) и получали 5-(3-хлорфенил)N-метокси-N-метилбензамид в виде коричневого масла (5 г, 57%). К раствору полученного бензамида (5 г, 17,2 ммоль) в обезвоженном ТГФ добавляли по каплям раствор метиллития в эфире (1,4 М, 28,6 мл, 40 мл) при -78 С в атмосфере азота. После 30 мин перемешивания, реакционную смесь обрабатывали насыщенным водным раствором хлорида аммония (50 мл) при-78 С. Добавляли этилацетат (100 мл), отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 20 мл). Объединенные органические слои промывали (рассолом) и высушивали (MgSO4). После удаления растворителя остаток очищали при помощи флэш хроматографии (силикагель, гексан:этилацетат/2:1) и получали 1-(4-амино-3'-хлорбифенил-3-ил)этанон в виде желтого твердого вещества (2 г,47%): т.пл. 89-90 С; 1H-ЯМР (СDСl3)7,89 (д,1 Н, J=2,0 Гц), 7,51 (м, 2 Н), 7,25-7,40 (м, 3 Н),6,73 (д, 1 Н, J=8,6 Гц), 6,38 (ш., 2 Н), 2,65 (с, 3 Н);MS (EI) m/е 268 ([М+Na]+, 60%), Анал. вычисл. для C14H12ClNO: С, 68,44; Н, 4,92; N, 5,70. Найдено: С, 68,40; Н, 4,89; N, 5,61. 6-(3-Хлорфенил)-4-метил-4-фенил-1,4 дигидробензо[d][1,3]оксазин-2-он получали из 1-(4-амино-3'-хлорбифенил-3-ил)этанона (0,2 г,0,82 ммоль) и фенилмагнийбромида последующей обработкой с помощью CDI в ТГФ, в виде белого твердого вещества: т.пл. 179-180 С; 1 НЯМР (СDСl3)8,27 (с, 1 Н, D2O взаимозаменяющий), 7,51-7,57 (м, 2 Н), 7,28-7,45 (м, 9 Н),6,92 (д, 1 Н, J=8,4 Гц), 2,12 (с, 3 Н); MS (ESt) м/e 348 ([М-Н]-, 100%), Анал. вычисл. дляC21H16ClNO2: С, 72,10; Н, 4,61; N, 4,00. Найдено: С, 71,72; Н, 4,86; N, 3,91. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-хлорфенил)-4-метил-4-фенил-1,4 дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 202-203 С; 1 Н-ЯМР(10 мл) добавляли раствор аллилмагнийбромида в эфире (1,0 М, 3 мл, 3 ммоль) при 0 С в атмосфере азота. Реакционный раствор медленно нагревали и перемешивали в атмосфере азота в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (10 мл) и далее добавляли этилацетат (50 мл). Отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 10 мл). Объединенные органические слои промывали рассолом и высушивалиMgSO4. После удаляли растворитель, остаток очищали при помощи флэш хроматографии (силикагель, гексан:этилацетат/3:1), получали аминокарбинольное промежуточное соединение,которое использовали в следующей стадии без дальнейшей очистки. К раствору указанного выше аминокарбинольного промежуточного соединения в обезвоженном ТГФ добавляли CDI (0,38 г, 2,3 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали до 55 С в течение 12 ч и после охлаждали до комнатной температуры. Растворитель удаляли в вакууме и остаток очищали при помощи флэш хроматографии (силикагель, гексан:этилацетат/2:1) и получали 4-аллил-6-(3-хлорфенил)-4-метил-1,4 дигидробензо[d][1,3]оксазин-2-он в виде белого твердого вещества (130 мг, 52%): т.пл. 128129 С; 1 Н-ЯМР (СDСl3)8,68 (с, 1 Н, D2O взаимозаменяющий), 7,50 (с, 1 Н), 7,44 (дд, 1 Н, J=8,2,1,9 Гц), 7,31-7,40 (м, 3 Н), 7,25 (д, 1 Н, J=1,6 Гц),6,92 (д, 1H, J=8,2 Гц), 5,70-5,85 (м, 1 Н), 5,17 (м,2 Н), 2,76 (м, 2 Н), 1,79 (с, 3 Н); MS (ESI) м/е 314([М+Н]+, 40%), Анал. вычисл. для C18H16ClNO2: С, 68,90; Н, 5,14; N, 4,46. Найдено: С, 68,90; Н,5,18; N, 4,43. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 4-аллил-6-(3-хлорфенил)-4-метил-1,4 дигидробензо[d][1,3]оксазин-2-она: т.пл. 150151 С; 1H-ЯМР (CDCl3)8,9 (с, 1 Н), 7,50-7,47 51 примера 5, в виде белого твердого вещества: т.пл. 256-257 С; 1 Н-ЯМР (DMSO-d6)10,4 (с,1H), 8,22 (уш. с, 1H), 8,15 (уш. с, 1H), 7,98 (уш. с, 1H), 7,74-7,71 (м, 2 Н), 6,97 (д, 1H, J=8,09 Гц),1,7 (с, 6 Н); MS (ESI) м/е 311 ([М-Н]-, 100%),Анал. вычис. для С 17 Н 13 СlN2O2; С, 65,29; Н,4,19; N, 8,96. Найдено: С, 65,25; Н, 3,92; N, 8,71. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-хлор-5-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрила: т.пл. 249-251 С; 1H-ЯМР (CDCl3)9,7 (с,1H), 7,74-7,73 (м, 1H), 7,71-7,70 (м, 1H), 7,647,63 (м, 1H), 7,48 (дд, 1H, J=8,24, 1,86 Гц), 7,3 (д,1H, J=1,73 Гц), 7,01 (д, 1H, J=8,24 Гц), 1,8 (с,6 Н); MS (ES) м/е 327/329 ([М-Н]-). Пример 39. 6-(3,5-Дифторфенил)-4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3,5-Дифторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 5 из (4,4-диметил 1,4-дигидро-2-оксо-2 Н-1,3-бензоксазин-6-ил)бороновой кислоты и 1-бром-3,5-дифторбензола, в виде белого твердого вещества: т.пл. 218-219 С; 1(APCI) m/e 290 ([M+H]+, 100%), Анал. вычис. для C16H13F2NO2; С, 66,43; Н, 4,53; N, 4,84. Найдено: С, 66,01; Н, 4,46; N, 4,67. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3,5-дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она: т.пл. 224-225 С; 1 НЯМР (CDCl3)9,7 (с, 1 Н), 7,48 (дд, 1H, J=8,16,1,74 Гц), 7,31 (д, 1H, J=1,66 Гц), 7,08-7,03 (м, 2 Н),6,98 (д, 1 Н, J=8,23 Гц), 6,85-6,78 (м, 1 Н), 1,8 (с,6 Н); MS (ES) м/е 304 ([М-Н]-). Пример 40. 6-(3-Фтор-5-метоксифенил)4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2 тион. 6-(3-Фтор-5-метоксифенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-он получали из (1,4-дигидро-4,4-диметил-2-оксо-2 Н-1,3-бензоксазин-6-ил)бороновой кислоты и 3-бром-5 фторанизола согласно способу из примера 5, в виде белого твердого вещества: т.пл. 181-182 С; 1H-ЯМР (DMSO-d6)10,4 (с, 1 Н), 7,62-7,59 (м,2 Н), 7,13-7,06 (м, 2 Н), 6,97-6,94 (д, 1 Н, J=8,89 Гц), 6,80 (дт, 1 Н, J=10,95, 2,12 Гц), 3,8 (с, 3H),1,7 (с, 6 Н); MS (ESI) m/e 320 ([М+Н]+, 100%),Анал. вычис. для C17H16FNO30,1 Н 2 О: С, 67,36; Н, 5,39; N, 4,62. Найдено: С, 67,11; Н, 5,44; N,4,48. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-фтор-5-метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 170-171 С; 1 Н-ЯМР (CDCl3)9,2 (с, 1 Н), 7,48 (дд, 1 Н,J=8,18, 1,84 Гц), 7,32 (д, 1 Н, J=1,66 Гц), 6,91 (д, 004511(4,2 г, 19,0 ммоль), 3-циано-5-метоксибензилтрифталата (5,1 г, 19,0 ммоль), тетракис(трифенилфосфин)палладия (0) (1,1 г, 0,95 ммоль),карбоната натрия (4,0 г, 38,0 ммоль), бромида лития (5 г, 57 ммоль) в ДМЕ (50 мл) и воде (25 мл) перемешивали в течение 15 мин при 50 С в атмосфере в азота. Указанный раствор затем нагревали при 85 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли этилацетат (100 мл). Органический слой дважды промывали водным раствором хлорида аммония (100 мл) и один раз рассолом(100 мл), высушивали над сульфатом магния и концентрировали. Очищали при помощи флэш хроматографии (силикагель, 40% этилацетата/гексан) и получали 3-(4,4-диметил-2-оксо 1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5 метоксибензонитрил в виде белого твердого вещества (0,69 г, 53%): т.пл. 254-255 С; 1H-ЯМРC18H16N2 О 3: С, 68,13; Н, 5,40; N, 8,83. Найдено: С, 68,03; Н, 5,22; N, 8,46. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-5-метоксибензонитрила, в виде грязно-белого твердого вещества: т.пл. 201-202 С; 1H-ЯМР (СDCl3)9,1 (с,1H), 7,48 (дд, 1H, J=8,16, 1,8 Гц), 7,41 (с, 1H),7,31 (д, 1H, J=1,69 Гц), 7,27 (м, 1H), 7,14 (м, 1 Н),6,92 (д, 1H, J=8,2 Гц), 3,9 (с, 3 Н), 1,8 (с, 6 Н); MS(ES) m/e 323 ([М-H]-). Пример 42. 6-(3-Фторфенил)-4,4-диметил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали из 6-бром-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она и 1-бром-3-фторбензола согласно способу из примера 4, в виде светло-желтого твердого вещества: т.пл. 181-182 С; 1 Н-ЯМР(с, 6 Н); MS (El) m/e 271 ([М+Н]+, 40%), Анал. вычис. для С 16H14FNО 2: С, 69,91; Н, 5,3; N, 5,1. Найдено: С, 70,0; Н, 5,32; N, 4,92. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 194-195 С; 1 Н-ЯМР(CDCl3)8,9 (с, 1H), 7,50 (дд, 1H, J=8,15, 1,73 Гц), 7,46-7,38 (м, 1 Н), 7,34-7,30 (м, 2 Н), 7,257,21 (м, 1H), 7,10-7,04 (м, 1H), 6,89 (д, 1H,J=8,21 Гц), 1,8 (с, 6 Н); MS (ES) м/е 286 ([М-H]-). Пример 43. 6-(3-Фтор-5-(трифторметил) фенил)-4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Фтор-5-трифторметилфенил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-он получали из (1,4 дигидро-4,4-диметил-2-оксо 2 Н-1,3-бензоксин-6-ил)бороновой кислоты и 1 бром-3-фтор-5-трифторметилбензола согласно способу из примера 5, в виде белого твердого вещества: т.пл. 207-208 С; 1H-ЯМР (DMSO-d6)10,4 (с, 1H), 7,94-7,9 (м, 2 Н), 7,73-7,7 (м, 2 Н),7,63 (д, 1H, J=8,58 Tv), 6,99 (д, 1H, J=8,68 Гц),1,7 (с, 6 Н); MS (EI) м/е 339 ([M]+, 60%), Анал. вычис. для С 17 Н 13F4NО 2: С, 60,18; Н, 3,86; N,4,13. Найдено: С, 59,9; Н, 3,99; N, 4,06. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-фтор-5-трифторметилфенил)-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-она,в виде белого твердого вещества: т.пл. 204206 С; 1 Н-ЯМР (СDCl3)9,2 (с, 1 Н), 7,56 (с,1 Н), 7,5 (дд, 1H, J=8,14, 1,97 Гц), 7,44-7,38 (м,1 Н), 7,36-7,30 (м, 2 Н), 6,92 (д, 1H, J=8,14 Гц),1,83 (с, 6 Н); MS (ES) м/е 354 ([М-Н]-). Пример 44. 6-(2-Фторфенил)-4,4-диметил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(2-Фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 5 из (1,4 дигидро-4,4 диметил-2-оксо-2 Н-1,3-бензоксазин-6-ил)бороновой кислоты и 1-бром-2-фторбензола, в виде не совсем белых кристаллов: т.пл. 164-165 С; 1 Н-ЯМР (DMSO-d6)10,33 (с, 1 Н), 7,56 (м, 1H),7,25-7,45 (м, 4 Н), 6,98 (д, 1 Н, J=8,7 Гц), 1,64 (с,6 Н). Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(2-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 171-173 С; 1 Н-ЯМР([М-Н]-). Пример 45. 6-(3,4-Дифторфенил)-4,4-диметил-1,4-дигидpо-2 Н-3,1-бензоксазин-2-тион. 6-(3,4-Дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 5 из (1,4 дигидро 4,4-диметил-2-оксо-2 Н-1,3-бензоксазин-6-ил)бороновой кислоты и 1-бром-3,4-дифторбензола, в виде не совсем белых кристаллов: т.пл. 207208 С; 1 Н-ЯМР (DMSO-d6)10,35 (с, 1 Н), 7,79(м, 1H), 7,40-7,63 (м, 4 Н), 6,95 (д, 1H, J=8,9 Гц),1,62 (с, 6 Н). Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3,4-дифторфенил)-4,4-диметил-1,4 004511 54 дигидробензо[d][1,3]оксазин-2-она, в виде желтого твердого вещества: т.пл. 209-211 С; 1HЯМР (СDСl3)8,94 (с, 1H), 7,44 (дд, 1H, J=8,35,1,98 Гц), 7,36-7,22 (м, 4 Н), 6,87 (д, 1H, J=8,35 Гц), 1,81 (с, 6 Н); MS (ES) м/е 304 ([М-Н]-). Пример 46. 6-(4-Фторфенил)-4,4-диметил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(4-Фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 5 из (1,4-дигидро 4,4-диметил-2-оксо-2 Н-1,3-бензоксазин-6 ил)бороновой кислоты и 1-бром-4-фторбензола в виде не совсем белых кристаллов: т.пл. 232233 С; 1H-ЯМР (DMSO-d6)10,3 (с, 1H), 7,74(м, 2 Н), 7,53 (м, 2 Н), 7,28 (м, 2 Н), 6,96 (д, 1H,J=8,9 Гц), 1,63 (с, 6 Н). Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(4-фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она, в виде желтого твердого вещества: т.пл. 221-223 С; 1 НЯМР (CDCl3)8,98 (с, 1H), 7,5-7,44 (м, 3 Н), 7,5(м, 1H), 7,17-7,10 (м, 2 Н), 6,87 (д, 1H, J=8,14 Гц),1,81 (с, 6 Н); MS (ES) м/е 286 ([М-Н]-). Пример 47. 3-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)-4-фторбензонитрил. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)-4-фторбензонитрил получали из (1,4-дигидро-4,4-диметил-2-оксо 2 Н-1,3-бензоксазин-6-ил)бороновой кислоты и 5-бром-2-фторбензонитрила согласно способу из примера 5, в виде белого твердого вещества: т.пл. 229-230 С; 1 Н-ЯМР (DMSO-d6)10,4 (с,1 Н), 8,15 (дд, 1H, J=7,39, 2,12 Гц), 7,95-7,89 (м,1 Н), 7,59-7,48 (м, 3 Н), 6,99 (д, 1H, J=8,1 Гц), 1,7N, 9,45. Найдено: С, 68,74; Н, 4,83; N, 9,10. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-4-фторбензонитрила, в виде желтого твердого вещества: т.пл. 250-251 С; 1H-ЯМР (CDCl3)8,83 (с, 1H), 7,73(дд, 1H, J=8,34, 2,19 Гц), 7,68-7,64 (м, 1H), 7,487,44 (м, 1H), 7,32-7,28 (м, 2 Н), 6,9 (д, 1 Н, J=8,34 Гц), 1,81 (с, 6 Н); MS (ES) м/е 311 ([М-Н]-). Пример 48. 6-(2,3-Дифторфенил)-4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(2,3-Дифторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 5 из (1,4-дигидро 4,4-диметил-2-оксо-2 Н-1,3-бензоксазин-6-ил) бороновой кислоты и 2,3-дифторбензилтрифлата в виде желтого твердого вещества: т.пл. 166-167 С; 1H-ЯМР (DMSO-d6)10,4 (с, 1H),7,5-7,2 (м, 5 Н), 7,0 (м, 1H), 1,7 (с, 6 Н); MS (EI) 55 Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(2,3-дифторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 197-198 С; 1 Н-ЯМР(с, 6 Н); MS (ES) m/e 304 ([М-H]-). Пример 49. 3-(8-Бром-4,4-диметил-2-тиоксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-5 фторбензонитрил. К смеси 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-5-фторбензонитрила (0,5 г, 1,7 ммоль) и ацетата натрия (0,2 г, 2,4 ммоль) в уксусной кислоте (5 мл), при комнатной температуре в атмосфере азота, добавляли бром (0,12 мл, 2,34 ммоль). Реакционную смесь перемешивали в течение 20 ч и после выливали в ледяную воду (30 мл). Остаток собирали осаждением на фильтре и промывали водой (3 х 5 мл), получали 3-(8-бром-4,4 диметил-2-оксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-5-фторбензонитрил в виде грязнобелого твердого вещества (0,48 г, 75%): т.пл. 216-217 С; 1 Н-ЯМР (DMSO-d6)9,78 (с, 1 Н),8,18 (т, 1H,J=1,6 Гц), 8,0-8,08 (м, 2 Н), 7,81 (м,1 Н), 7,75 (д, 1 Н, J=1,8 Гц), 1,66 (с, 6 Н); MS (ESI) м/е 373, 375 [М-Н]-. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-(8-бром-4,4-диметил-2-оксо-1,4-дигидро-2 Н-3,1-бензоксазин-6-ил)-5-фторбензонитрила: т.пл. 219-220 С; 1 Н-ЯМР (СDСl3)9,05 (с, 1 Н), 7,70 (д, 1 Н, J=1,98 Гц), 7,6 (м, 1 Н),7,48-7,44 (м, 1H), 7,4-7,36 (м, 1 Н), 7,26 (м, 1 Н),1,80 (с, 6 Н); MS (ES) м/е 304 ([М-Н]-). Пример 50. 4,4-Диметил-6-(3-нитрофенил)1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 4,4-Диметил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-он получали из 6-иод 4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2 она и 3-нитрофенилбороновой кислоты согласно способу из примера 4 в виде желтоватого твердого вещества: т.пл. 244-245 С; 1H-ЯМРC16H14N2O4: С, 64,42; Н, 4,73; N, 9,39. Найдено: С, 63,93; Н, 4,91; N, 8,71. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 4,4-диметил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде желтого твердого вещества: т.пл. 224-226 С; 1 Н-ЯМР 56 Пример 51. 6-(3-Хлорфенил)-4,4-диэтил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Хлорфенил)-4,4-диэтил-1,4-дигидробензо[d][1,3]оксазин-2-он получали из 4,4 диэтил-6-иод-1,4-дигидробензо[d][1,3]оксазин 2-она и 3-хлорфенилбороновой кислоты согласно способу из примера 4 в виде белого твердого вещества: т.пл. 150-151 С; 1H-ЯМР (CDCl3)8,52 (с, 1H, D2O взаимозаменяющий), 7,50 (с,1H), 7,31-7,44 (м, 4 Н), 7,16 (д, 1H, J=1,5 Гц), 6,89(д, 1H, J=8,2 Гц), 2,03 (м, 4 Н), 0,94 (т, 6 Н, J=7,4 Гц); MS (EI) м/е 315 (М+, 53%), Анал. вычис. для C18H18ClNO2: С, 68,46; Н, 5,75; N, 4,44. Найдено: С, 68,16; Н, 5,81; N, 4,32. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-хлорфенил)-4,4-диэтил-1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 148-150 С; 1 Н-ЯМР(CDCI3)9,27 (с, 1H), 7,50-7,45 (м, 2 Н), 7,407,34 (м, 3 Н), 7,17 (д, 1H, J=1,64 Гц), 6,94 (д, 1H,J=8,22 Гц), 2,18-2,01 (м, 4 Н), 0,94 (т, 6 Н, J=7,33 Гц); MS (ES) м/е 303/332 ([М-Н]-). Пример 52. 6-(3-Метоксифенил)-4,4-диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(3-Метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 4 из 6-бром-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-она и 3-метоксифенилбороновой кислоты в виде желтого твердого вещества: т.пл. 164-165 С; 1 НЯМР (DMSO-d6)10,3 (с, 1 Н), 7,56 (м, 2 Н), 7,36(т, 1 Н, J=7,89 Гц), 7,20 (м, 2 Н), 6,96 (д, 1 Н,J=8,88 Гц), 6,91 (дд, 1 Н, J=8,13, 2,35 Гц), 3,8 (с,3 Н), 1,7 (с, 6 Н); MS (ESI) m/e 284 ([М+Н]+,30%), Анал. вычис. для C17H17NO3: С, 72,07; Н,6,05; N, 4,94. Найдено: С, 70,58; Н, 5,73; N, 4,67. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-метоксифенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 142-143 С; 1 Н-ЯМРMS (ES) м/е 298 ([М-Н]-). Пример 53. 6-(2-Хлорфенил)-4,4-диметил 1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. 6-(2-Хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он получали согласно способу из примера 4 из 6-бром-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-она и 2-хлорфенилбороновой кислоты в виде белого твердого вещества: т.пл. 181-182 С; MS (ESI) м/е 288([М+Н]+, 70%), Анал. вычис. для C16H14ClNO2: С, 66,79; Н, 4,90; N, 4,87. Найдено: С, 66,78; Н,4,82; N, 4,55. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(2-хлорфенил)-4,4-диметил-1,4-ди 57 гидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 171-172 С; 1H-ЯМРMS (ES) м/е 302/304 ([М-Н]-). Пример 54. 4-Бензил-6-(3-хлорфенил)-4 метил-1,4-дигидро-2 Н-3,1-бензоксазин-2-тион. Смесь 1-(4-амино-3'-хлорбифенил-3-ил) бензилэтанола (полученного из 1-(4-амино-3'хлорбифенил-3-ил)этанона и бензилмагнийбромида согласно способу, описанному выше, 0,14 г, 0,42 ммоль) и трифосгена (0,04 г, 0,14 ммоль) в сухом ТГФ (10 мл) перемешивали в атмосфере азота в течение 10 мин. ТГФ удаляли и остаток очищали при помощи флэш хроматографии (силикагель, 35% этилацетат/гексан) с получением 4-бензил-6-(3-хлорфенил)-4-метил-1,4 дигидробензо[d][1,3]оксазин-2-она (0,045 г,30%) в виде грязно-белого твердого вещества: т.пл. 187-188 С; 1 Н-ЯМР (DMSO-d6)10,1 (с,1 Н), 7,70 (т, 1 Н, J=2,3 Гц), 7,6 (д, 1 Н, J=8,0 Гц),7,58-7,53 (м, 2 Н), 7,46 (т, 1 Н, J=8,0 Гц), 7,38 (д,1 Н, J=8,0 Гц), 7,22-7,17 (м, 3 Н), 7,06-7,0 (м, 2H),6,84 (д, 1 Н, J=9,14 Гц), 3,24 (д, 1 Н, J=14,3 Гц),3,06 (д, 1 Н, J=14,3 Гц),1,68 (с, 3 Н); MS (ESI) м/е 364 ([М+Н]+, 100%), Анал. вычис. дляC22H18ClNO2: С, 72,63; Н, 4,99; N, 3,85. Найдено: С, 71,82; Н, 5,09; N, 3,58. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 4-бензил-6-(3-хлорфенил)-4-метил 1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: 1H-ЯМР (CDCl3)9,09 (с, 1 Н), 7,63 (дц, 1 Н, J=8,03, 1,83 Гц),7,38-7,22 (м, 7 Н), 7,04-6,97 (м, 3 Н), 6,83 (д, 1 Н,J=8,22 Гц), 3,22 (с, 1 Н), 1,86 (с, 3 Н); MS (ES) м/е 378/380 ([М-Н]-). Пример 55. 6-(3-Бром-5-фторфенил)-4,4 диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2 тион. 6-(3-Бром-5-фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали из(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1,3-дибром-5 фторбензола согласно способу из примера 5 в виде белого твердого вещества: т.пл. 182-183 С; 1 Н-ЯМР (DMSO-d6)10,36 (с, 1 Н, D2O взаимозаменяющий), 7,78 (с, 1 Н), 7,58-7,65 (м, 3 Н),7,49 (дд, 1 Н, J=8,3, 1,8 Гц), 6,96 (д, 1H, J=8,5 Гц), 1,69 (с, 6 Н); 19F-ЯМР (DMSO-d6)112,46([М+Н]+, 75%), Анал. вычис. для C16H13BrFNO2: С, 54,88; Н, 3,74; N, 4,00. Найдено: С, 54,83; Н,3,82; N, 3,95. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-бром-5-фторфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-она, в виде желтого твердого вещества: т.пл. 221-222 С; 1 НЯМР (СDCl3)9,28 (с, 1 Н), 7,49-7,45 (м, 2 Н),7,30 (д, 1 Н, J=7,71 Гц), 7,24 (т, 1 Н, J=2,07 Гц), 004511 58 7,17 (дт, 1 Н, J=9,54, 1,99 Гц), 6,93 (д, 1 Н, J=8,25 Гц), 1,8 (с, 6 Н); MS (ES) м/е 364/366 ([М-Н]-). Пример 56. 5-(4,4-Диметил-2-тиоксо-1,4 дигидро-2 Н-3,1-бензоксазин-6-ил)тиофен-2-карбонитрил. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрил получали согласно способу из примера 5 с использованием 5-бром-2-тиофенкарбонитрила и (1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты, в виде грязно-белого твердого вещества: т.пл. 264-266 С; 1(M+NH4)+. Анал. вычис. для C15H12N2O2S: С,63,36; Н, 4,25; N, 9,85. Найдено: С, 63,01; Н,4,36; N, 9,39. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 5-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрила, в виде желтого твердого вещества: т.пл. 242-244 С; 1 Н-ЯМР (CDCl3)9,05 (с, 1 Н),7,61 (д, 1H, J=3,89 Гц), 7,54 (дд, 1H, J=8,23, 1,56 Гц), 7,35 (м, 1H), 7,24 (д, 1H, J=3,89 Гц), 6,88 (д,1H, J=8,26 Гц), 1,8 (с, 6 Н); MS (ES) м/е 299 ([МН]-). Пример 57. 3-Фтор-5-(8-фтор-4,4-диметил 2-тиоксо-1,4-дигидро-2 Н-3,1-бензоксазин-6 ил)бензонитрил. С N-(трет-бутоксикарбониламино)-3-фторбензойной кислоты (Takagishi et al. Synlett 4,360-2(1992); т.пл. 159-161 С) снимают защиту с использованием трифторуксусной кислоты, получая о-аминобензойную кислоту, которую затем обрабатывают метилмагнийбромидом с получением о-аминодиметилкарбинола, о-aминодиметилкарбинол (2,23 г, 13,2 ммоль) обрабатывали 1,1'-карбонилдиимидазолом (2,8 г, 17,2 ммоль) в ТГФ (20 мл) при 50 С в течение 12 ч. Затем раствор охлаждали до комнатной температуры и добавляли этилацетат (100 мл). Органический слой промывали 10% водным раствором НСl (2 х 25 мл), высушивали MgSO4 и концентрировали. Остаток очищали при помощи флэш-хроматографии (силикагель, 10% этилацетат/гексан) получая 8-фтор-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он в виде белого твердого вещества (1,3 г, 50%): т.пл. 127-128 С; 1 Н-ЯМР (DMSO-d6)10,4 (с, 1H), 7,22-7,12 (м,2 Н), 7,07-7,00 (м, 2 Н), 1,6 (с, 6 Н); MS (APCI) м/е 196 ([М+Н]+, 100%); Анал. вычис. для C10H10FNO2: С, 61,53; Н,5,16; N, 7,18. Найдено: С, 61,27; Н, 5,37; N, 7,02. 8-Фтор-(1,4-дигидро-4,4-диметил-2-оксо 2 Н-1,3-бензоксазин-6-ил)бороновую кислоту получали из 6-бром-8-фтор-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она, используя способ из примера 4. 59 3-Фтор-5-(8-фтор-4,4-диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрил получали из 8-фтор-(1,4-дигидро-4,4 диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 5-бром-3-фторбензонитрила согласно способу из примера 5, в виде белого твердого вещества: т.пл. 256-257 С; 1 Н-ЯМР(дд, 1H, J=11,89, 1,81 Гц), 7,63 (с, 1 Н), 1,7 (с,6 Н); MS (EI) м/е 314 ([M]+, 60%); Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-фтор-5-(8-фтор-4,4-диметил-2-оксо 1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрила, в виде желтого твердого вещества: 1H-ЯМР (СDСl3)8,91 (с, 1H), 7,61 (д, 1H),7,47 (дт, 1 Н, J=9,25, 2,0 Гц), 7,39 (м, 1H), 7,337,29 (м, 1H), 7,13 (с, 1H), 1,8 (с, 6 Н). Пример 58. 3-(1,2-Дигидро-2-тиоксоспиро-[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)бензонитрил. 3-(1,2-Дигидро-2-оксоспиро-[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)бензонитрил получали согласно способу В из спиро-(4,1'циклогексан-1,4-дигидро-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 3-бромбензонитрила, в виде рыжевато-коричневого порошка: т.пл. 245-247 С; 1 Н-ЯМР (DMSO-d6)10,31 (с, 1H), 8,21 (с, 1H), 8,02 (д, 1H, J=8,0 Гц),7,78 (д, 1H, J=7,7 Гц), 7,68-7,61 (м, 3 Н), 6,97 (д,1H, J=8,2 Гц), 1,98-1,96 (м, 4 Н), 1,75-1,64 (м,5 Н), 1,40-1,32 (м, 6 Н); MS (EI) m/e 318 (М)+; Анал. вычис. для С 20H18N2O21/2 Н 2O: С, 73,38; Н, 5,85; N, 8,56. Найдено: С, 73,86; Н, 5,81; N,8,22. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 3-(1,2-дигидро-2-оксоспиро-[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)бензонитрила, в виде белого твердого вещества: т.пл. 222224 С; 1 Н-ЯМР (СDСl3)9,08 (с, 1 Н), 7,86-7,81[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-4 метил-2-тиофенкарбонитрил. 5-(1,2-Дигидро-2-оксоспиро[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)-4-метил-2 тиофенкарбонитрил получали согласно способу В из спиро-(4,1'-циклогексан-1,4-дигидро-2 оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 2-бром-3-метил-5-цианотиофена, в виде белого порошка: т.пл. 200-203 С; 1H-ЯМР(М)+; Анал. вычис. для C19H18N2O2S: С, 67,48; Н,5,36; N, 8,28. Найдено: С, 67,12; Н, 5,45; N, 8,05. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 5-(1,2-дигидро-2-оксоспиро[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)-4-метил-2 тиофенкарбонитрила, в виде желтого твердого вещества: т.пл. 199-201 С; 1 Н-ЯМР (CDCl3)8,92 (с, 1 Н), 7,5 (с, 1 Н), 7,36 (дд, 1 Н, J=8,17, 1,9 Гц), 7,23 (д, 1 Н, J=1,7 Гц), 6,87 (дд, 1 Н, J=8,18 Гц), 2,3 (с, 3 Н), 2,05-1,70 (м, 7 Н), 1,36-1,25 (м,3 Н); MS (ES) м/е 353 ([М-H]-). Пример 60. 5-(1,2-Дигидро-2-тиоксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2 тиофенкарбонитрил. 5-(1,2-Дигидро-2-оксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил получали согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 5-цианотиофена, в виде рыжевато-коричневого порошка: т.пл. 243-245 С; 1H-ЯМР (DMSO-d6)10,41 (с, 1 Н), 7,98-7,97 (д, 1 Н, J=3,9 Гц), 7,677,60 (м, 3 Н), 6,97-6,94 (д, 1 Н, J=8,3 Гц), 1,981,92 (м, 4 Н), 1,74-1,64 (м, 5 Н), 1,45-1,21 (м, 1 Н);C18H16N2O2S1/2 Н 2O: С, 65,08; Н, 5,04; N, 8,18. Найдено: С, 64,84; Н, 5,09; N, 8,40. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 5-(1,2-дигидро-2-оксоспиро[4 Н-3,1 бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрила, в виде желтого твердого вещества: т.пл. 232-233 С; 1 Н-ЯМР (СDСl3)8,90 (с,1 Н), 7,6 (дд, 1 Н, J=3,93 Гц), 7,36 (д, 1H, J=1,8 Гц), 7,24-7,20 (м, 1 Н), 6,85 (дд, 1 Н, J=8,25 Гц),2,28-2,23 (м, 2 Н), 2,11-1,96 (м, 2 Н), 1,90-1,70 (м,5 Н), 1,38-1,33 (м, 2 Н); MS (ES) м/е 339 ([М-H]-). Пример 61. 6-(3-Хлор-4-фторфенил)-4,4 диметил-1,4-дигидро-2 Н-3,1-бензоксазин-2 тион. 6-(3-Хлор-4-фторфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-он получали из 6-бром-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она и 1-бром-3-хлор-4-фторбензола согласно способу А, в виде белого твердого вещества: т.пл. 211-212 С; 1H-ЯМР (DMSO-d6)10,4(м, 1 Н), 7,60-7,57 (м, 2 Н), 7,49 (т, 1 Н, J=8,95 Гц),6,96 (д, 1 Н, J=8,01 Гц), 1,67 (с, 6 Н); MS (EI) м/е 305 ([М+Н]+, 20%), Анал. вычис. для С 16H13ClFNO2: С, 62,86; Н, 4,29; N, 4,58. Найдено: С, 62,52; Н, 4,45; N, 4,42. Соединение, указанное в заголовке, получали согласно способу из примера 16, с использованием 6-(3-хлор-4-фторфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-она, в виде белого твердого вещества: т.пл. 196-197 С; 1 НЯМР (CDCl3)9,29 (с, 1 Н), 7,55 (дд, 1H, J=6,89,2,28 Гц), 7,45 (дд, 1H, J=8,21, 1,91 Гц), 7,41-7,27
МПК / Метки
МПК: C07D 265/18, A61K 31/536, A61P 15/00
Метки: производные, циклотиокарбаматные, прогестерона, рецептора, качестве, модуляторов
Код ссылки
<a href="https://eas.patents.su/30-4511-ciklotiokarbamatnye-proizvodnye-v-kachestve-modulyatorov-receptora-progesterona.html" rel="bookmark" title="База патентов Евразийского Союза">Циклотиокарбаматные производные в качестве модуляторов рецептора прогестерона</a>
Предыдущий патент: Полиморфная форма гемисульфата 3-(n-метил) – 2 (r) – пирролидинилметил-5-(2-фенилсульфонилэтил) – 1н-индола
Следующий патент: Циклокарбаматные производные в качестве модуляторов рецептора прогестерона
Случайный патент: Устройство и способ сжигания топлива












