Циклокарбаматные производные в качестве модуляторов рецептора прогестерона
Номер патента: 4512
Опубликовано: 29.04.2004
Авторы: Эдвардс Джеймс П., Тегли Кристофер М., Жанг Пувен, Вроубел Джей Э., Джоунс Тодд К., Жи Лин, Флетчер Хорас III, Фенсам Эндрю, Терефенко Юджин А.
Формула / Реферат
1. Соединение формулы
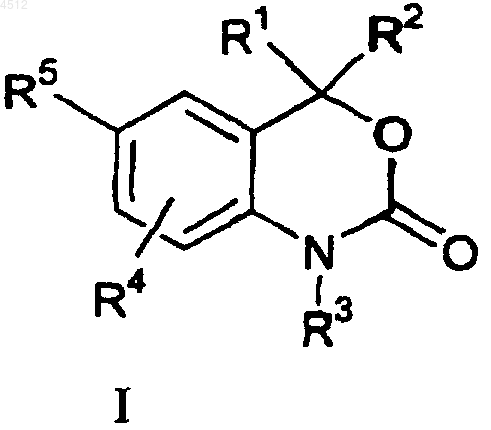
где R1 и R2 представляют собой независимые заместители, выбранные из группы, включающей H, C1-C6алкил, замещенный C1-C6алкил, C2-C6алкенил, замещенный C2-C6 алкенил, C2-C6алкинил, замещенный C2-C6алкинил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил CORA или NRBCORA;
или R1 и R2 сконденсированы с образованием
a) 3-8-членного насыщенного спироциклического кольца, имеющего углеродный скелет; или
b) 3-8- членного спироциклического кольца, имеющего углеродный скелет с одним или более углеродными двойными связями; или
c) 3-8-членного гетероциклического кольца, содержащего в своем скелете от одного до трех гетероатомов, выбранных из группы, включающей O, S и N;
кольца a), b) и c) могут быть необязательно замещены от 1 до 4 заместителями, выбранными из группы, включающей фтор, C1-C6алкил, C1-C6алкокси, C1-C6тиоалкил, CF3, OH, CN, NH2, NH(C1-C6алкил) или N(C1-C6алкил)2;
RA выбирают из H, C1-C3алкила, замещенного C1-C3алкила, арила, замещенного арила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила или замещенного C1-C3аминоалкила;
RB представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил, C3-C6алкенил, замещенный C3-C6алкенил, алкинил, замещенный алкинил или CORC;
RC представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
R4 представляет собой H, галоген, CN, NO2, C1-C6алкил, замещенный C1-C6алкил, алкинил, замещенный алкинил, C1-C6алкокси, замещенный C1-C6алкокси, амино, C1-C6аминоалкил или замещенный C1-C6аминоалкил;
R5 выбирают из группы, включающей a) и b):
a) замещенное бензольное кольцо, содержащее заместители X, Y и Z, как показано ниже
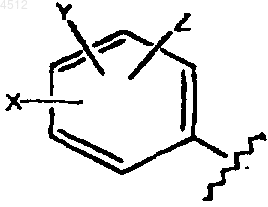
где X выбирают из группы, включающей галоген, CN, C1-C3алкил, замещенный C1-C3алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3тиоалкокси, замещенный C1-C3тиоалкокси, амино, C1-C3аминоалкил, замещенный C1-C3аминоалкил, NO2, C1-C3перфторалкил, 5- или 6-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, SO2NH2, CORD, OCORD или NRECORD;
RD представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RE представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
Y и Z независимо представляют собой заместители, выбранные из группы, включающей H, галоген, CN, NO2, амино, C1-C3трифторметокси, аминоалкил, C1-C3алкокси, C1-C3алкил, C1-C3тиоалкокси; или
b) 5- или 6-членное кольцо с 1, 2 или 3 гетероатомами в кольце, выбранными из группы, включающей O, S, SO, SO2 или NR6, содержащее один или два независимых заместителя, выбранных из группы, включающей H, галоген, CN, NO2, амино и C1-C3 алкил, C1-C3алкокси, C1-C3аминоалкил, SO2NH2, C=N(OH), CORF или NRGCORF;
при условии, что когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете два гетероатома NR6, R1 и R2 оба не являются водородом; и
при условии, что когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете один гетероатом NR6, и когда R5 присоединен по второму положению на указанном кольце, тогда в пятом положении указанного кольца не может быть заместителя CN;
RF представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RG представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
при условии, что когда R5 представляет собой бензольное кольцо a), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, включающей O, S и NR6, и R1 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R2 не может быть алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом; или если R2 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R1 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом;
при условии, что когда R5 представляет собой бензольное кольцо a), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;
R6 отсутствует или представляет собой H, O, C(O)(C1-C4алкокси) или C1-C3алкил;
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо;
причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолинила;
замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
2. Соединение формулы
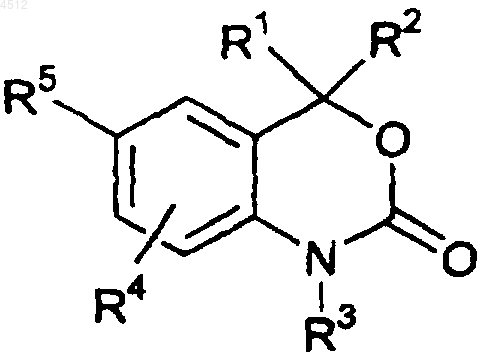
где R1 и R2 представляют собой независимые заместители, выбранные из группы, включающей H, C1-C6алкил, замещенный C2-C6алкил, C2-C6алкенил, замещенный C2-C6 алкенил, C2-C6алкинил, замещенный C2-C6алкинил, C3-C8циклоалкил, замещенный C3-C8 циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA;
или R1 и R2 сконденсированы с образованием кольца, выбранного из группы, включающей a), b) и c):
a) 3-8-членное спироциклическое насыщенное кольцо, имеющее углеродный скелет;
b) 3-8-членное спироциклическое кольцо, имеющее углеродный скелет с одной или более углерод-углеродными двойными связями; и
c) 3-8-членное гетероциклическое кольцо, содержащее в своем скелете от одного до трех гетероатомов, выбранных из группы, включающей O, S и N;
кольца a), b) и c) могут быть необязательно замещены от 1 до 4 заместителями, выбранными из группы, включающей фтор, C1-C6алкил, C1-C6алкокси, C1-C6тиоалкил, CF3, OH, CN, NH2, NH(C1-C6алкил) или N(C1-C6алкил)2;
RA выбирают из H, C1-C3алкила, замещенного C1-C3алкила, арила, замещенного арила, C1-C3алкокси, замещенного C1-C3алкокси, C1-C3аминоалкила или замещенного C1-C3аминоалкила;
RB представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил, C3-C6алкенил, замещенный C3-C6алкенил, алкинил, замещенный алкинил или CORC;
RC выбирают из H, C1-C4алкила, замещенного C1-C4алкила, арила, замещенного арила, C1-C4алкокси, замещенного C1-C4алкокси, C1-C4аминоалкила или замещенного C1-C4аминоалкила;
R4 выбирают из H, галогена, CN, NO2, C1-C6алкила, замещенного C1-C6алкила, C1-C6алкокси, замещенного C1-C6алкокси, амино, C1-C6аминоалкила или замещенного C1-C6аминоалкила;
R5 представляет собой (a) или (b):
a) замещенное бензольное кольцо, содержащее заместители X, Y и Z, как показано ниже
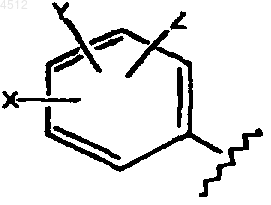
где X выбирают из группы, включающей галоген, CN, C1-C3алкил, замещенный C1-C3алкил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3тиоалкокси, замещенный C1-C3тиоалкокси, амино, C1-C3аминоалкил, замещенный C1-C3аминоалкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD и NRECORD;
RD представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
RE представляет собой H, C1-C3алкил или замещенный C1-C3алкил;
Y и Z независимо представляют собой заместители, выбранные из группы, включающей H, галоген, CN, NO2, C1-C3алкокси, C1-C3алкил или C1-C3тиоалкокси;
или
b) 5- или 6-членное кольцо с 1, 2 или 3 гетероатомами в скелете, выбранными из группы, включающей O, S, SO, SO2 или NR6, содержащее один или два независимых заместителя, выбранных из группы, включающей H, галоген, CN, NO2, амино, C1-C3алкил и C1-C3алкокси;
при условии, что, когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете два гетероатома NR6, R1 и R2 не являются оба водородом; и
при условии, что когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете один гетероатом NR6, и когда R5 присоединен по второму положению на указанном кольце, тогда в пятом положении указанного кольца не может быть заместителя CN;
R6 представляет собой H или C1-C3алкил;
при условии, что, когда R5 представляет собой бензольное кольцо a), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, включающей O, S и NR6, и R1 представляет собой алкенил, замещенный алкенил, алкинил, замещенный алкинил, R2 не может быть алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом; или, если R2 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R1 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом;
при условии, что, когда R5 представляет собой бензольное кольцо a), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из O, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом шыш замещенным циклоалкилом; или, если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо; причем
5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолинила;
замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
3. Соединение формулы
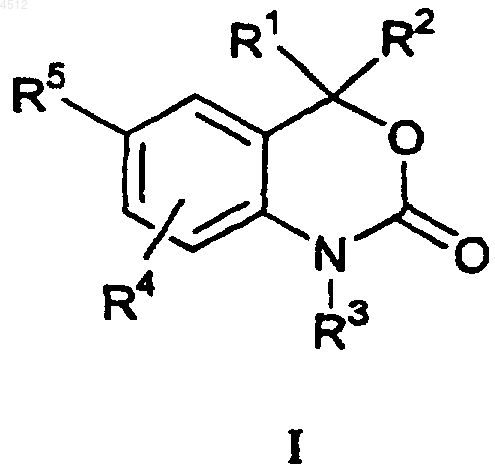
где R1=R2 и их выбирают из группы, включающей C1-C3алкил, замещенный C1-C3алкил или R1 и R2 сконденсированы с образованием 3-6-членного насыщенного спироциклического кольца, имеющего углеродный скелет;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил или CORC:
RC представляет собой H, C1-C4алкил или C1-C4алкокси;
R4 представляет собой H, галоген, CN, NO2, C1-C3алкил или замещенный C1-C3алкил; C1-C3алкокси или замещенный C1-C3алкокси;
R5 выбирают из группы, включающей a), b) и c):
a) замещенное бензольное кольцо формулы, приведенной ниже
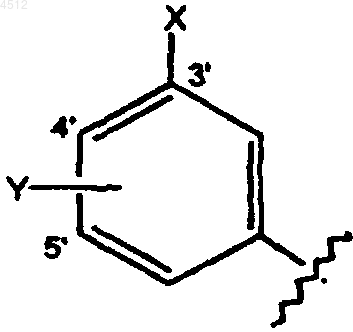
где X выбирают из группы, включающей галоген, CN, C1-C3алкокси, C1-C3алкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, или C1-C3тиоалкокси;
Y представляет собой заместитель, выбранный из группы, включающей H, галоген, CN, NO2, C1-C3алкокси, C1-C4алкил или C1-C3тиоалкокси;
b) 5-членное кольцо формулы
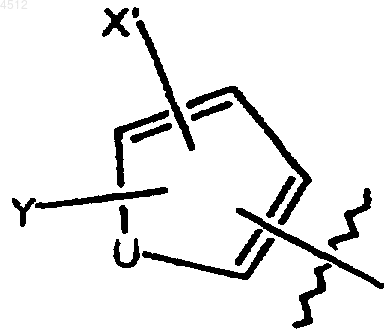
где U представляет собой O, S или NR6,
X' выбирают из группы, включающей галоген, CN, NO2, C1-C3алкил и C1-C3алкокси;
Y' выбирают из группы, включающей H и C1-C4алкил; и
c) 6-членное кольцо формулы
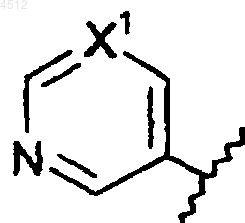
X' представляет собой N или CX2;
X2 представляет собой галоген, CN, алкокси или NO2;
R6 представляет собой H, C1-C3алкил или C1-C4 CO2алкил;
где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила;
гетероциклил представляет собой 5-членное кольцо, 6-членное кольцо или полициклическое кольцо; причем
5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила, имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила;
6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2-оксопиперидинила, пиридинила, пиразинила, пиримидинила, пиридазинила, морфолинила, тиаморфолинила, тиаморфолинилсульфоксида;
полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила, бензофуранила, бензотиенила и изохинолинила;
замещенный алкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила;
замещенный арил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, OH, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио;
или его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1 и 2, в котором
R1 представляет собой H, C1-C6алкил, замещенный C1-C6алкил, C3-C8циклоалкил, замещенный C3-C8циклоалкил, арил, замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA;
RC представляет собой H, C1-C3алкил, замещенный C1-C3алкил, арил, замещенный арил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3аминоалкил или замещенный C1-C3аминоалкил;
R4 представляет собой H, галоген, CN, NO2, C1-C6алкил, замещенный C1-C6 алкил, C1-C6алкокси, замещенный C1-C6алкокси, амино, C1-C6аминоалкил или замещенный C1-C6аминоалкил;
R5 представляет собой a) или b):
a) замещенное бензольное кольцо, в котором
X выбирают из группы, включающей галоген, CN, C1-C3алкил, замещенный C1-C3алкил, C1-C3алкокси, замещенный C1-C3алкокси, C1-C3тиоалкокси, замещенный C1-C3тиоалкокси, аминоC1-C3аминоалкил, замещенный C1-C3аминоалкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов в своем скелете, CORD, OCORD или NRECORD;
Y и Z независимо представляют собой заместители, выбранные из группы, включающей H, галоген, CN, NO2, C1-C3алкокси, C1-C3алкил или C1-C3тиоалкокси;
или
b) 5- или 6-членное кольцо, содержащее один или два независимых заместителя, выбранных из группы, включающей H, галоген, CN, NO2, амино, C1-C3алкил и C1-C3алкокси.
5. Соединение по любому из пп.1-4, в котором
R1=R2 и их выбирают из группы, включающей C1-C3алкил, замещенный C1-C3алкил; или R1 и R2 сконденсированы с образованием 3-6-членного спироциклического насыщенного кольца, имеющего углеродный скелет;
R3 представляет собой H, OH, NH2, C1-C6алкил, замещенный C1-C6алкил или CORC;
RC представляет собой H, C1-C3алкил или C1-C3алкокси;
R4 представляет собой H, галоген, CN, NO2, C1-C3алкил или замещенный C1-C3алкил; C1-C3алкокси или замещенный C1-C3алкокси;
R5 выбирают из группы, включающей a), b) и c):
a) замещенное бензольное кольцо формулы, приведенной ниже
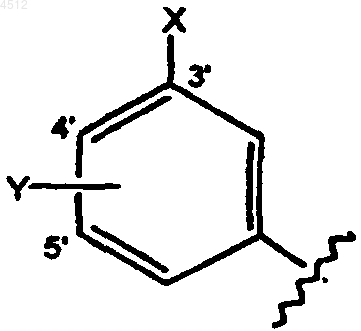
где X выбирают из группы, включающий галоген, CN, C1-C3алкокси, C1-C3алкил, NO2, C1-C3перфторалкил, 5-членное гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, или C1-C3тиоалкокси;
Y представляет собой заместитель, выбранный из группы, включающей H, галоген, CN, NO2, C1-C3алкокси, C1-C3алкил или C1-C3тиоалкокси;
b) 5-членное кольцо формулы
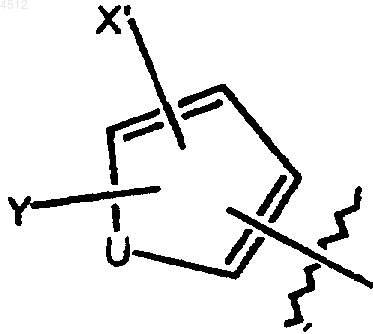
где U представляет собой O, S или NR6,
X' выбирают из группы, включающей галоген, CN, NO2, C1-C3алкил и C1-C3 алкокси;
Y' выбирают из группы, включающей H и C1-C3алкил;
R6 представляет собой H или C1-C3алкил; и
c) 6-членное кольцо, имеющее структуру

где X1 представляет собой CX2;
X2 представляет собой галоген, CN, C1-C3алкокси или NO2;
или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-4, в котором
R1=R2 и они представляют собой CH3 или R1 и R2 сконденсированы с образованием 6-членного насыщенного спироциклического кольца;
R3 представляет собой H, OH, NH2, метил, замещенный метил или CORC;
RC представляет собой H, C1-C3алкил или C1-C3алкокси;
R4 представляет собой H, галоген, NO2, CN, C1-C3алкил;
R5 представляет собой замещенное бензольное кольцо a) формулы
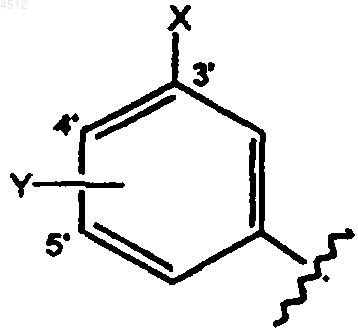
где X выбирают из группы, включающей галоген, CN, метокси, NO2 или 5-членное гетероциклическое кольцо, где указанное кольцо представляет собой 2-тиазол, Y представляет собой H или галоген.
7. Соединение по любому из пп.1-4, в котором
R1=R2 и представляет собой CH3 или R1 и R2 сконденсированы с образованием 6-членного спироциклического насыщенного кольца, имеющего углеродный скелет;
R3 представляет собой H, OH, NH2, метил, замещенный метил или CORC;
RC представляет собой H, C1-C3алкил или C1-C3алкокси;
R4 представляет собой H, галоген, NO2, CN, C1-C3алкил;
R5 представляет собой пятичленное кольцо b), имеющее формулу
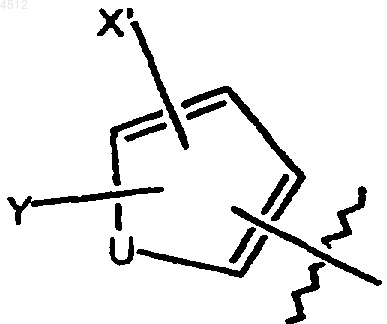
где U представляет собой O, S или NH,
X' выбирают из группы, включающей галоген, CN, NO2, при условии, что когда U является NH, тогда X' не является CN;
Y' выбирают из группы, включающей H и C1-C3алкил;
или его фармацевтически приемлемая соль.
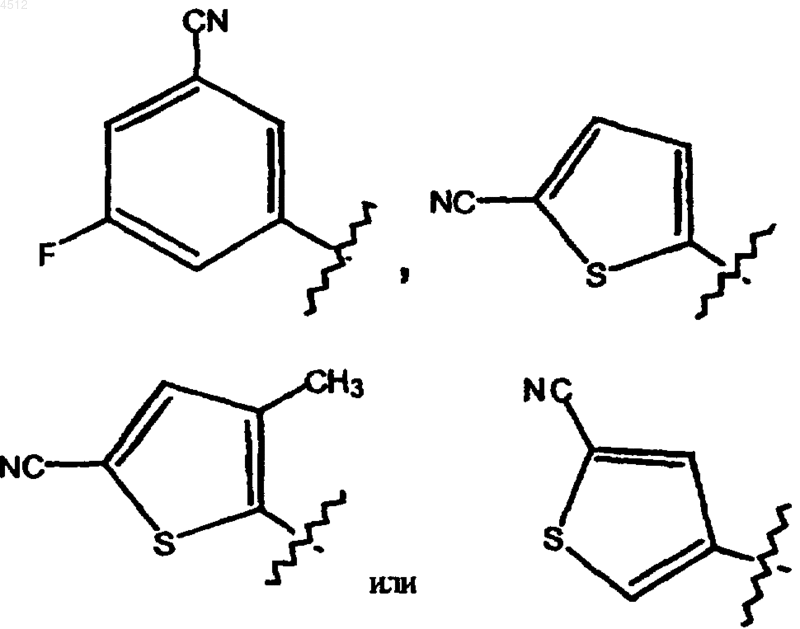
8. Соединение по любому из пп.1-5, в котором R5 выбирают из группы, включающей
9. Соединение по п.1, которое выбирают из группы, включающей 6-(3-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(2-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(4-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-этил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-фенил-1,4-дигидро-бензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензонитрил, 4,4-диметил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-бром-5-фторфенил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)никотинонитрил, 4-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-метилтиофен-2-карбонитрил, 4-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фуран-2-карбонитрил, 4,4-диэтил-6-(3-нитрофенил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4,4-диэтил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)спиро[4H-3,1-бензоксазин-4,1'-циклогексан]-2-(1H)-он, 6-(3-хлорфенил)спиро[4H-3,1-бензоксазин-4,1'-циклопентан]-2(1H)-он, 6-(3-нитрофенил)спиро[4H-3,1-бензоксазин-4,1'-циклогексан]-2(1H)-он, 4-аллил-6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-метил-4-фенил-1,4-дигидробензо-[d][1,3]оксазин-2-он, 4-бензил-6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-циклопропил-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4,4-дициклопропил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-бром-5-фторфенил)-1,4,4-триметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-метоксифенил)-4-метил-4-трифторметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-ацетилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-бензоилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-[3-(1H-тетразол-5-ил)фенил]-1,4-дигидробензо[d][1,3]оксазин-2-он, 4-(4,4-дициклопропил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-2-карбонитрил, 6-(3-бром-5-фторфенил)-4,4-дициклопропил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(4,4-дициклопропил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил, 6-(3-бром-5-метил-фенил)-4,4-диметил-1,4-дигидробензо-[d][1,3]оксазин-2-он, 6-(3-бром-5-трифтор-метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-метилбензонитрил, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-трифторметоксибензонитрил, 6-(3,5-дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3,5-дихлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3,5-бис-трифторметилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-метоксибензонитрил, 6-(3-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлор-4-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(1-диэтоксиметил-4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил, 3-фтор-5-(1-метоксиметил-4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензонитрил, фосфорная кислота 6-(3-циано-5-фторфенил)-4,4-диметил-4H-бензо[d][1,3]оксазин-2-ил диэтиловый эфир, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-фторбензонитрил, 6-(3-хлор-4-фторфенил)-8-фтор-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-бромфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-(3-триметилстаннилэтинилфенил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-этинилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-[3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фенил]пропиннитрил,6-(3-фтор-5-нитрофенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлор-5-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-хлор-5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензонитрил, 6-(3,5-динитрофенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)изофталонитрил, 4,4-диметил-6-(3-тиазол-2-илфенил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-фтор-5-метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-фтор-5-трифторметилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(5-бромпиридин-3-ил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(5-бром-1-оксипиридин-3-ил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-2-фторбензонитрил, 4-(8-фтор-4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]-оксазин-6-ил)тиофен-2-карбонитрил, 3-фтор-5-(8-фтор-4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-3-карбонитрил, 2-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-3-карбонитрил, 6-(1,2,4-тиадиазол-3-ил-фенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-фтор-5-тиофен-3-ил-фенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-(5-нитро-1H-пиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-(1H-пиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-(1-метил-1H-пиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 4,4-диметил-6-(1-метил-5-нитро-H-пиррол-2-ил)-1,4-дигидрбензо[d][1,3]оксазин-2-он, 3-(1,2-дигидро-2-оксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)бензонитрил, 3-(1,2-дигидро-2-оксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-5-фторбензонитрил, 4-(1,2-дигидро-2-оксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил, 5-(1,2-дигидро-2-оксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2-тиофенкарбонитрил, 5-(1,2-дигидро-2-оксоспиро[4H-3,1-бензоксазин-4,1-циклогексан]-6-ил)-4-метил-2-тиофенкарбонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-этилтиофен-2-карбонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-н-пропилтиофен-2-карбонитрил, 6-(4-циано-3-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(4-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3,4-дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(2-фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фенилацетонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фуран-2-карбонитрил, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фуран-2-карбонитрил, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-2-фторбензонитрил, 6-(3-циано-5-фторфенил)-4,4-диметил-2-оксо-4H-бензо[d][1,3]оксазин-1-карбоновая кислота трет-бутиловый эфир, 6-(2,3-дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(1-этил-4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил, [6-(4,4-диметил-2-оксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)пиридин-2-ил]ацетонитрил, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-[d][1,3]оксазин-6-ил)-5-фторфенилацетонитрил, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-фторфенилацетонитрил, 4-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-2-фторфенилацетонитрил, 2-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фенилацетонитрил, N-[4-(4,4-диметил-2-оксо-1,4-дигидро-2H-3,1-бензоксазин-6-ил)-2-фторфенил]ацетамид, 6-(3-фтор-4-метоксифенил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-он, 6-(6-аминопиридин-3-ил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-он, 6-(5-диэтоксиметил-фуран-3-ил)-4,4-диметил-1,4-дигидро-бензо[d][1,3]оксазин-2-он, 4-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)фуран-2-карбальдегид, 4,4-диметил-6-(3-триметилсиланилэтинилфенил)-1,4-дигидробензо[d][1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)бензосульфонамид, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)тиофен-2-сульфонамид и 4-(1,4-дигидро-4,4-диметил-2-оксо-2H-3,1-бензоксазин-6-ил)фуранкарбоксальдегид оксим, или его фармацевтически приемлемая соль.
10. Соединение по п.3, которое выбирают из группы, состоящей из 2-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)пиррол-1-карбоновой кислоты трет-бутилового эфира, 2-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-5-нитропиррол-1-карбоновой кислоты трет-бутилового эфира, 5-(4,4-диметил-2-оксо-1,4-дигидро-2H-бензо[d][1,3]оксазин-6-ил)-4-н-бутилтиофен-2-карбонитрила или его фармацевтически приемлемой соли.
11. Соединение по любому из пп.1-3, в котором R5 выбирают из группы, включающей 3-хлор-4-фторфенил, 3,5-дихлорфенил, 3-циано-4-фторфенил, 3,4-дифторфенил, 3-циано-5-хлорфенил, 3-трифторметил-5-фторфенил, 2-фтор-3-цианофенил, 2-фторфенил, 3,4-дихлорфенил, 3-фтор-4-хлорфенил, 3-бром-4-фторфенил, 3-хлор-4-бромфенил и 3,5-дибромфенил.
12. Соединение по любому из пп.1-3, где R5 представляет собой 4-циано-3-фуранил.
13. Фармацевтическая композиция, включающая соединение по любому из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель.
14. Способ проведения контрацепции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
15. Способ лечения гормонзависимых новообразований у млекопитающих, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
16. Способ по п.15, в котором гормонзависимые новообразования у млекопитающих выбирают из группы, включающей маточную лейомиому, эндометриоз, доброкачественную гипертрофию простаты, а также карциному и аденокарциному эндометрия, яичников, груфш, толстой кишки и простаты, гипофиза и менингиомы.
17. Способ синхронизации эструса у млекопитающих, включающий введение нуждающемуся в этом млекопитающему, фармацевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
18. Способ проведения контрацепции у млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения, выбранного из группы, включающей 6-(3-хлорфенил)-4-метил-4-пропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-этинил-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-циклопропил-4-пропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он и 6-(3-хлорфенил)-4,4-дипропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, или его фармацевтически приемлемой соли.
19. Способ лечения гормонзависимых новообразований у млекопитающих, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения, выбранного из группы, включающей 6-(3-хлорфенил)-4-метил-4-пропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-этинил-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-циклопропил-4-пропин-1-ил-1,4-дигидробензо[d][ 1,3]оксазин-2-он и 6-(3-хлорфенил)-4,4-дипропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, или его фармацевтически приемлемой соли.
20. Способ по п.19, в котором гормонзависимые новообразования включают маточную лейомиому, эндометриоз, доброкачественную гипертрофию простаты, а также карциному и аденокарциному эндометрия, яичников, груди, толстой кишки и простаты, гипофиза и менингиомы.
21. Способ синхронизации эструса у млекопитающих, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения, выбранного из группы 6-(3-хлорфенил)-4-метил-4-пропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-этинил-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-циклопропил-4-пропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он и 6-(3-хлорфенил)-4,4-дипропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он, или его фармацевтически приемлемой соли.
22. Способ заместительной гормонотерапии млекопитающего, включающий введение нуждающемуся в этом млекопитающему фармацевтически эффективного количества соединения по любому из пп.1-12 или его фармацевтически приемлемой соли.
Текст
1 Область техники, к которой относится изобретение Данное изобретение относится к соединениям, которые являются антагонистами рецептора прогестерона, их приготовления и полезности. Уровень техники Внутриклеточные рецепторы (IR) образуют класс структурно связанных геноврегуляторов, известных как "лиганд зависимые факторы транскрипции" (R.M. Evans, Science,240, 889, 1988). Семейство стероидных рецепторов представляет собой подгруппу семействаIR, включая рецептор прогестерона (PR), рецептор эстрогена (ER), рецептор андрогена (AR),рецептор глюкокортикоида (GR) и рецептор минералокортикоида (MR). Природный гормон или лиганд для рецептора PR представляет собой стероид прогестерон, но и синтетические соединения, такие как медроксипрогестерон ацетат или левоноргестрел, могут быть использованы в виде этого же лиганда. Как только лиганд присутствует в жидкости, окружающей клетку, он проходит через мембрану посредством пассивной диффузии и связывается с рецептором IR, образуя комплекс рецептор/лиганд. Этот комплекс образует связь со специфическим промотором гена клеточной ДНК. При взаимодействии с ДНК комплекс продуцирует m-РНК и белок, кодируемый данным геном. Соединение, которое связывается с рецептором IR и подражает действию природного гормона, называется здесь агонистом, в то время как соединение, которое препятствует действию гормона, называется антагонистом. Антагонисты рецептора PR могут быть использованы в контрацепции. При этом они могут быть применены сами (Ulmann, et al. Ann.N.Y. Acad. Sci., 261, 248, 1995), в комбинации с агонистом рецептора PR (Kekkonen, et al. Fertility and Sterility, 60, 610, 1993) или в комбинации с частичным антагонистом рецептора ER, таким как тамоксифен (WO 96/19997 A1 July 4, 1996). Антагонисты рецептора PR могут также быть использованы для лечения гормонозависимого рака груди (Horwitz, et al. Horm. Cancer,283, pub: Birkhaeuser, Boston, Mass., ed.Vedeckis), а также рака матки и яичников. Антагонисты рецептора PR могут также быть использованы для лечения не злокачественных хронических заболеваний, таких как фибромыand Sterility, 56, 402, 1991). Антагонисты рецептора PR могут также быть использованы для заместительной гормональной терапии для пациентов с постменопаузой в комбинации с частичным антагонистом рецептора ER, таким как тамоксифен (US 5719136). Антагонисты рецептора PR, такие как мифепристон и онапристон, как было показано, 004512 2 являются более эффективными на модели гормона, в зависимости от рака предстательной железы, что может указывать на их способность к лечению такого состояния у мужчин (Michna,et al. Ann. N.Y. Acad. Sci., 761, 224, 1995). Соединения по настоящему изобретению оказывают действие в качестве конкурентных ингибиторов связывания прогестерона на рецептореPR, и действуют в качестве антагониста в функциональных моделях как in vitro, так и in vivo. Эти соединения могут быть использованы для контрацепции, а также для лечения рака фиброидного,ендометриозного, груди, матки, яичников и предстательной железы, и постменопаузной гормональной заместительной терапии. Соединения, известные из уровня техники,были описаны Jones, et al. (патент США No. 5688810), являются антагонистом рецептора PR и представляют собой дигидрохинолин 1.Jones, et al. описали эфир енола 2 (патент США 5693646), в качестве лиганда рецептораZhi, et al. описали лактоны 4, 5 и 6 в качестве антагониста рецептора PR (J. Med. Chem.,41, 291, 1998).Zhi, et al. описали эфиры 7 в качестве антагониста рецептора PR (J. Med. Chem., 41, 291,1998). 4 2-оны и бензоксазин-2-оны, такие как соединения С 1 и С 2, являются ингибиторами обратной транскриптазы ВИЧ.Combs, et al. описали амид 8 в качестве лиганда рецептора PR (J. Med. Chem; 38, 4880,1995).Permlan, et. al. описали аналог витамина D 9 в качестве лиганда рецептора PR (Tet. Letters,35, 2295, 1994).Hamann, et al. описали антагонист рецептора PR 10 (Ann. N. Y. Acad Sci., 761, 383, 1995).Narr, et al. (патент Германии, DE 3633861,CA 109:22973), запатентовали имидазобензоксазиноны, например А, в качестве соединений с кардиотонической активностью; бензоксазин-2 оны, такие как брофоксин (В), оказавшийся активным в качестве аноксиолитика, был описанHartmann et al. (Proc. West. Pharmacol. Soc. 21,51-55 (1978; Совсем недавно большое число патентов (e.g. Young et al. W095/20389; Christ etal. WО 98/14436) заявило о том, что хиназолин Описание изобретения Настоящее изобретение относится к соединениям формулы (I) где R1 и R2 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C1-С 6 алкил, C2 С 6 алкенил, замещенный C2-С 6 алкенил, C2 С 6 алкинил, замещенный C2-С 6 алкинил, C3 С 8 циклоалкил, замещенный C3-С 8 циклоалкил,арил, замещенный арил, гетероциклил, замещенный гетероциклил CORA или NRBCORA; или R1 и R2 сконденсированы с образованиемb) 3-8-членного спироциклического кольца, имеющего углеродный скелет с одним или более углеродными двойными связями; илиc) 3-8-членного гетероциклического кольца, содержащего в своем скелете от одного до трех гетероатомов, выбранных из группы,включающей О, S и N; кольца а), b) и с) могут быть необязательно замещены от 1 до 4 заместителями, выбранными из группы, включающей фтор, C1-С 6 алкил, C1 С 6 алкокси, C1-С 6 тиоалкил, СF3, ОН, CN, NH2,NH(C1-С 6 алкил) или N(C1-С 6 алкил)2;RA выбирают из Н, C1-С 3 алкила, замещенного C1-С 3 алкила, арила, замещенного арила,C1-С 3 алкокси, замещенного C1-С 3 алкокси, C1-С 3 аминоалкила или замещенного C1-С 3 аминоалкила;RB представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;R3 представляет собой Н, ОН, NH2, C1-С 6 алкил, замещенный C1-С 6 алкил, C3-С 6 алкенил,замещенный C3-С 6 алкенил, алкинил, замещенный алкинил или CORC;C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;R4 представляет собой Н, галоген, CN,NO2, C1-С 6 алкил, замещенный C1-С 6 алкил, алкинил, замещенный алкинил, C1-С 6 алкокси, замещенный C1-С 6 алкокси, амино, C1-С 6 аминоалкил или замещенный C1-С 6 аминоалкил;C1-С 3 алкокси, C1-С 3 тиоалкокси, замещенный C1 С 3 тиоалкокси, амино, C1-С 3 аминоалкил, замещенный C1-С 3 аминоалкил, NO2, C1-С 3 перфторалкил, 5- или 6-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, SO2NH2, CORD, OCORD илиRD представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RE представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;Y и Z независимо представляют собой заместители, выбранные из группы, включающей Н, галоген, CN, NO2, амино, C1-С 3 трифторметокси, аминоалкил, C1-С 3 алкокси, C1-С 3 алкил,C1-С 3 тиоалкокси; илиb) 5- или 6-членное кольцо с 1, 2 или 3 гетероатомами в кольце, выбранными из группы,включающей О, S, SO, SO2 или NR6, содержащее один или два независимых заместителя,выбранных из группы, включающей Н, галоген,CN, NO2, амино и C1-С 3 алкил, C1-С 3 алкокси, C1 С 3 аминоалкил, SO2NH2, C=N(OH), CORF илиNRGCORF; при условии, что когда R5 представляет собой 5-членное кольцо, имеющее в своем скелете два гетероатома NR6, R1 и R2 оба не являются водородом; и при условии, что когда R5 представляет собой 5-членное кольцо, имеющее в своем скелете один гетероатом NR6, и когда R5 присоединен по второму положению на указанном кольце, тогда в пятом положении указанного кольца не может быть заместителя CN;RF представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RG представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил; 6 при условии, что когда R5 представляет собой бензольное кольцо а), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, включающей О, S и NR6, и R1 представляет собой алкенил, замещенный алкенил, алкинил или замещенный алкинил, R2 не может быть алкилом,замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом; или если R2 представляет собой алкенил,замещенный алкенил, алкинил или замещенный алкинил, R1 не является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, алкенилом, замещенным алкенилом, алкинилом и замещенным алкинилом; при условии, что когда R5 представляет собой бензольное кольцо а), замещенное одним или двумя заместителями, или 5- или 6-членное кольцо b), имеющее в своем скелете 1, 2 или 3 гетероатома, выбранных из группы, состоящей из О, S и NR6, и R1 представляет собой алкил или замещенный алкил, R2 не является циклоалкилом или замещенным циклоалкилом; или,если R2 представляет собой алкил или замещенный алкил, R1 не является циклоалкилом или замещенным циклоалкилом;R6 отсутствует или представляет собой Н,О, C(O)(C1-С 4 алкокси) или C1-С 3 алкил; где арил выбирают из группы, состоящей из фенила, нафтила, бифенила, антрила, тетрагидронафтила, фенантрила; гетероциклил представляет собой 5 членное кольцо, 6-членное кольцо или полициклическое кольцо; причем 5-членное кольцо выбирают из группы, состоящей из тетрагидрофурана, пирролидинила,имидазолила, оксазолила, изоксазолила, тиенила, тиофена, пиррола, тиазола и фурила; 6-членное кольцо выбирают из группы, состоящей из пиперидинила, пиперазинила, 2 оксопиперидинила, пиридинила, пиразинила,пиримидинила, пиридазинила, морфолинила,тиаморфолинила, тиаморфолинилсульфоксида; полициклическое кольцо выбирают из группы, состоящей из индолила, хинолинила,бензофуранила, бензотиенила и изохинолинила; замещенный алкил, замещенный алкенил и замещенный алкинил имеют от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2, амино, арила, гетероциклила, замещенного арила, замещенного гетероциклила, алкокси, арилокси, замещенного алкокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный алкокси, замещенный аминоалкил и замещенный тиоалкокси имеют от одного до трех заместителей, выбранных из группы, состоящей из алкила и замещенного алкила; замещенный арил имеет от одного до четырех заместителей, выбранных из группы, со 7 стоящей из галогена, CN, ОН, NO2, амино, алкила, циклоалкила, алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный циклоалкил имеет от одного до трех заместителей, выбранных из группы,состоящей из галогена, CN, ОН, NO2, амино,арила, гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный гетероциклил имеет от одного до четырех заместителей, выбранных из группы,состоящей из галогена, CN, ОН, NО 2, амино,алкила, замещенного алкила, циклоалкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; замещенный алкилокси имеет от одного до трех заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2, амино, арила, замещенного арила, гетероциклила, замещенного гетероциклила, алкокси, арилокси, алкилкарбонила, алкилкарбокси, алкиламино и арилтио; или их фармацевтически приемлемым солям. К числу предпочтительных соединений по изобретению относятся соединения формулы где R1 и R2 представляют собой независимые заместители, выбранные из группы, включающей Н, C1-С 6 алкил, замещенный C2-С 6 алкил, C2 С 6 алкенил, замещенный C2-С 6 алкенил, C2-С 6 алкинил, замещенный C2-С 6 алкинил, C3-С 8 циклоалкил, замещенный C3-С 8 циклоалкил, арил,замещенный арил, гетероциклил, замещенный гетероциклил, CORA или NRBCORA; или R1 и R2 сконденсированы с образованием кольца, выбранного из группы, включающей а), b) и с):b) 3-8-членное спироциклическое кольцо,имеющее углеродный скелет с одной или более углерод-углеродными двойными связями; иc) 3-8-членное гетероциклическое кольцо,содержащее в своем скелете от одного до трех гетероатомов, выбранных из группы, включающей О, S и N; кольца a), b) и с) могут быть необязательно замещены от 1 до 4 заместителями, выбранными из группы, включающей фтор, C1-С 6 алкил, C1 С 6 алкокси, C1-С 6 тиоалкил, СF3, ОН, CN, NH2,NH(C1-С 6 алкил) или N(C1-С 6 алкил)2;RB представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;R3 представляет собой Н, ОН, NH2, C1-С 6 алкил, замещенный C1-С 6 алкил, C3-С 6 алкенил,замещенный C3-С 6 алкенил, алкинил, замещенный алкинил или CORC;R4 выбирают из Н, галогена, CN, NO2, C1 С 6 алкила, замещенного C1-С 6 алкила, C1-С 6 алкокси, замещенного C1-С 6 алкокси, амино, C1 С 6 аминоалкила или замещенного C1-С 6 аминоалкила; где Х выбирают из группы, включающей галоген, CN, C1-С 3 алкил, замещенный C1-С 3 алкил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 тиоалкокси, замещенный C1-С 3 тиоалкокси, амино, C1-С 3 аминоалкил, замещенный C1-С 3 аминоалкил, NO2, C1-С 3 перфторалкил, 5-членное гетероциклическое кольцо, содержащее в своем скелете от 1 до 3 гетероатомов, CORD, OCORD иRD представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;RE представляет собой Н, C1-С 3 алкил или замещенный C1-С 3 алкил;Y и Z независимо представляют собой заместители, выбранные из группы, включающей Н, галоген, CN, NO2, C1-С 3 алкокси, C1-С 3 алкил или C1-С 3 тиоалкокси; илиb) 5- или 6-членное кольцо с 1, 2 или 3 гетероатомами в скелете, выбранными из группы,включающей О, S, SO, SO2 или NR6, содержащее один или два независимых заместителя,выбранных из группы, включающей Н, галоген,CN, NO2, амино, C1-С 3 алкил и C1-С 3 алкокси; при условии, что когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете два гетероатома NR6, R1 и R2 не являются оба водородом; и при условии, что когда R5 представляет собой пятичленное кольцо, имеющее в своем скелете один гетероатом NR6, и когда R5 присоединен по второму положению на указанном кольце, тогда в пятом положении указанного кольца не может быть заместителя CN;R6 представляет собой Н или C1-С 3 алкил; или их фармацевтически приемлемые соли. Другими предпочтительными соединениями являются соединения формулы где R1=R2 и их выбирают из группы, включающей C1-С 3 алкил, замещенный C1-С 3 алкил или R1 и R2 сконденсированы с образованием 3-6 членного насыщенного спироциклического кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, CN,NO2, C1-С 3 алкил или замещенный C1-С 3 алкил;C1-С 3 алкокси или замещенный C1-С 3 алкокси;R5 выбирают из группы, включающей а),b) и с): а) замещенное бензольное кольцо формулы, приведенной ниже:C1-С 4 СO2 алкил; или их фармацевтически приемлемые соли. 10 Еще одной группой предпочтительных соединений являются соединения формулы (I), гдеRC представляет собой Н, C1-С 3 алкил, замещенный C1-С 3 алкил, арил, замещенный арил,C1-С 3 алкокси, замещенный C1-С 3 алкокси, C1-С 3 аминоалкил или замещенный C1-С 3 аминоалкил;R4 представляет собой Н, галоген, CN,NO2, C1-С 6 алкил, замещенный C1-С 6 алкил, C1-С 6 алкокси, замещенный C1-С 6 алкокси, амино, C1 С 6 аминоалкил или замещенный C1-С 6 аминоалкил;Y и Z независимо представляют собой заместители, выбранные из группы, включающей Н, галоген, CN, NO2, C1-С 3 алкокси, C1-С 3 алкил или C1-С 3 тиоалкокси; илиb) 5- или 6-членное кольцо, содержащее один или два независимых заместителя, выбранных из группы, включающей Н, галоген,CN, NO2, амино, C1-С 3 алкил и C1-С 3 алкокси. Более предпочтительными являются соединения формулы (I), в которойR1=R2 и их выбирают из группы, включающей C1-С 3 алкил, замещенный C1-С 3 алкил; или R1 и R2 сконденсированы с образованием 36-членного спироциклического насыщенного кольца, имеющего углеродный скелет;R4 представляет собой Н, галоген, CN,NO2, C1-С 3 алкил или замещенный C1-С 3 алкил;C1-С 3 алкокси или замещенный C1-С 3 алкокси;R5 выбирают из группы, включающей а),b) и с): а) замещенное бензольное кольцо формулы, приведенной ниже:R5 представляет собой пятичленное кольцоC1-С 3 алкил; или их фармацевтически приемлемые соли. Наиболее предпочтительные соединения выбирают из группы, включающей 6-(3-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(3-метоксифенил)-4,4-диметил-1,4 дигидробензо[d][1,3]-оксазин-2-он, 6-(2-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он, 6-(4-хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он,6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]оксазин 2-он, 6-(3-хлорфенил)-4-этил-1,4-дигидробензо[d][1,3]оксазин-2-он,6-(3-хлорфенил)-4-фенил-1,4-дигидробензо[d][1,3]оксазин-2-он,3(4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][d][1,3]оксазин-2-он, 6-(3-хлорфенил)-4-метил 4-фенил-1,4-дигидробензо-[d][1,3]оксазин-2-он,4-бензил-6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]-оксазин-2-он, 6-(3-хлорфенил)-4 где X1 представляет собой СХ 2;X2 представляет собой галоген, CN, C1 С 3 алкокси или NO2; или их фармацевтически приемлемые соли. Следующей группой предпочтительных соединений по настоящему изобретению являются соединения формулы (I), в которойR1=R2, и они представляют собой СН 3 или 1R и R2 сконденсированы с образованием 6 членного насыщенного спироциклического кольца;R5 представляет собой замещенное бензольное кольцо а) формулы где Х выбирают из группы, включающей галоген, CN, метокси, NO2 или 5-членное гетероциклическое кольцо, где указанное кольцо представляет собой 2-тиазол,Y представляет собой Н или галоген; или их фармацевтически приемлемые соли. Еще одной предпочтительной группой являются соединения формулы (I), в которойR1=R2 и представляет собой СН 3 или R1 и 2[1,3]оксазин-2-он, 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензосульфонамид,5-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)тиофен-2-сульфонамид и 4-(1,4-дигидро-4,4-диметил-2-оксо-2 Н 3,1-бензоксазин-6-ил)фуранкарбоксальдегид оксим или их фармацевтически приемлемые соли. Соединения по изобретению могут содержать асимметрический атом углерода, и некоторые из соединений по изобретению могут содержать один или более асимметрических центров, что может привести к образованию оптических изомеров и диастереоизомеров. Хотя в формуле I не показано стереохимическое строение, настоящее изобретение включает подобные оптические изомеры и диастереоизомеры, также как рацематы и разделенные энантиомерно чистые R и S стереоизомеры; а также иные смеси R и S стереоизомеров и их фармацевтически приемлемые соли. Термин "алкил" используется здесь для обозначения насыщенных алифатических углеводородных групп как с линейной, так и с разветвленной цепью, содержащих от одного до восьми атомов углерода, предпочтительно от одного до шести атомов углерода, подразумевается, что понятие"алкенил" включает алкильные группы как с линейной, так и с разветвленной цепью, с по меньшей мере одной двойной углерод-углеродной связью, содержащие от двух до восьми атомов углерода, предпочтительно от одного до шести атомов углерода, подразумевается, что "алкинильная" группа охватывает алкильные группы как с линейной, так и с разветвленной цепью, с по меньшей мере одной тройной углерод-углеродной связью, содержащие от двух до восьми атомов углерода, предпочтительно от одного до шести атомов углерода. Термины "замещенный алкил", "замещенный алкенил" и "замещенный алкинил" обозначают только что описанные алкил, алкенил и алкинил, содержащие от одного до трех заместителей, 004512 16 выбранных из группы, включающей галоген, CN,ОН, NO2, амино, арил, гетероциклил, замещенный арил, замещенный гетероциклил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино, арилтио. Эти заместители могут быть присоединены к любому атому углерода в составе алкильной, алкенильной или алкинильной группы при условии, что при таком присоединении образуется химически стабильный остаток. Термин "арил" используется здесь для обозначения ароматической системы, в которую может входить одно или несколько ароматических колец, сконденсированных или связанных друг с другом таким образом, что по крайней мере часть конденсированных или связанных колец образует сопряженную ароматическую систему. Арильные группы включают, но не ограничиваются ими,фенил, нафтил, дифенил, антрил, тетрагидронафтил, фенантрил. Термин "замещенный арил" обозначает определенный выше арил, содержащий от одного до четырех заместителей из группы, включающей галоген, CN, ОН, NО 2, амино, алкил, циклоалкил,алкенил, алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино или арилтио. Термин "гетероциклил" используется здесь для обозначения стабильного 4-7-членного моноциклического или стабильного полициклического гетероциклического кольца, которое может быть насыщенным, частично или полностью ненасыщенным и состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы,включающей атомы N, О, и S. Атомы N и S могут быть окислены. Гетероциклические кольца также включают любые полициклические кольца, в которых любое из определенных выше гетероциклических колец сконденсировано с арильным кольцом. Гетероциклическое кольцо может быть присоединено через любой гетероатом или атом углерода при условии, что полученная структура будет химически стабильной. Такие гетероциклические группы включают, например, тетрагидрофуран,пиперидинил, пиперазинил, 2-оксопиперидинил,азепинил, пирролидинил, имидазолил, пиридил,пиразинил, пиримидинил, пиридазинил, оксазолил, изоксазолил, морфолинил, индолил, хинолинил, тиенил, фурил, бензофуранил, бензотиенил,тиаморфолинил, тиаморфолинилсульфоксид и изохинолинил. Термин "замещенный гетероциклил" используется здесь для описания гетероциклилов, определенных выше, содержащих один или более заместителей, выбранных из группы, включающей галоген, CN, ОН, NO2, амино, алкил, замещенный алкил, циклоалкил, алкенил, замещенный алкенил,алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино или арилтио. Термин "алкокси" используется здесь для обозначения OR группы, где R представляет собой алкил или замещенный алкил. Термин "арилокси" 17 используется здесь для обозначения OR группы,где R представляет собой арил или замещенный арил. Термин "алкилкарбонил" используется здесь для обозначения RCO группы, где R представляет собой алкил или замещенный алкил. Термин "алкилкарбокси" используется здесь для обозначенияCOOR группы, где R представляет собой алкил или замещенный алкил. Термин "аминоалкил" обозначает как вторичные, так и третичные амины, в состав которых входят алкильные или замещенные алкильные группы, содержащие от одного до восьми атомов углерода, которые могут быть одинаковыми или различными, и местом их присоединения является атом азота. Термин "галоген" обозначаетCl, Br, F и I. Соединения по настоящему изобретению можно использовать в форме солей, полученных из фармацевтически или физиологически приемлемых кислот или оснований. Эти соли включают,но не ограничиваются ими, следующие соли неорганических кислот, таких как соляная кислота,серная кислота, азотная кислота, фосфорная кислота, и в некоторых случаях, таких органических кислот, как уксусная кислота, щавелевая кислота,янтарная кислота и малеиновая кислота. Другие соли включают соли щелочных металлов или щелочно-земельных металлов, таких как натрий, калий, кальций или магний, в форме сложных эфиров, карбаматов и других общепринятых "пролекарственных" форм, которые при введении такой формы превращаются in vivo в активный остаток. Настоящее изобретение охватывает фармацевтические композиции, содержащие одно или более соединений по настоящему изобретению и фармацевтически приемлемый носитель или наполнитель. Изобретение также включает способ лечения, который включает введение млекопитающему фармацевтически эффективного количества одного или более соединений, описанных выше, в качестве антагонистов прогестеронового рецептора. Антагонисты прогестероновых рецепторов по изобретению, используемые отдельно или в комбинации, могут найти применение в способах контрацепции и лечения и/или профилактики дисфункционального кровотечения, маточной лейомиомы, эндометриоза, синдрома поликистоза яичников, а также карцином и аденокарцином эндометрия, яичников, груди, толстой кишки и простаты, а также других гормон-зависимых опухолей. Дополнительные виды использования антагонистов прогестероновых рецепторов включают стимулирование усваивания пищи. Когда соединения используют по одному из указанных выше назначений, они могут быть объединены с одним или более фармацевтически приемлемыми носителями или наполнителями, например, растворителями, разбавителями и тому подобное, и могут вводиться перорально в такой форме, как таблетки, капсулы, диспергируемые порошки, гранулы или суспензии, содержащие,например, от около 0,05 до 5% суспендирующего 18 агента, сиропов, содержащих, например, от около 10 до 50% сахара, и эликсиры, содержащие, например, от около 20 до 50% этанола, и тому подобное, или парентерально в форме стерильных растворов для инъекций или суспензий, содержащих от около 0,05 до 5% суспендирующего агента в изотонической среде. Такие фармацевтические составы могут содержать, например, от около 25 до около 90% активного ингредиента в комбинации с носителем, чаще между около 5 и около 60% по массе. Используемая эффективная доза активного ингредиента может изменяться в зависимости от конкретного используемого соединения, пути введения и тяжести состояния больного. Однако, как правило, удовлетворительные результаты получают при введении соединений по изобретению в дневной дозе от около 0,5 до около 500 мг/кг веса тела животного, предпочтительно вводимую дозу разделяют на два-четыре приема в день, либо лекарство вводят в форме с замедленным выделением. Для большинства крупных млекопитающих общая дневная доза составляет от 1 до 100 мг,предпочтительно от 2 до 80 мг. Формы доз для внутреннего использования включают от 0,5 до 500 мг активного соединения в однородной смеси с твердым или жидким фармацевтически приемлемым носителем. Этот режим приема может быть модифицирован для обеспечения оптимального терапевтического эффекта. Например, можно вводить несколько раздельных доз в день или дозу можно пропорционально уменьшать в соответствии с обстоятельствами терапевтической ситуации. Эти активные соединения можно вводить пероральным, а также внутривенным, внутримышечным или подкожным путем. Твердые носители включают крахмал, лактозу, гидрофосфат кальция, микрокристаллическую целлюлозу, сахарозу и каолин, а жидкие носители включают стерилизованную воду, полиэтиленгликоли, неионные поверхностно-активные вещества и пищевые масла, такие как кукурузное, арахисовое или кунжутное масло, в соответствии с природой активного ингредиента и конкретной желаемой формой введения. Преимущественно можно включать в этот состав адъюванты, обычно используемые для приготовления фармацевтических композиций,такие как вкусовые вещества, красители, консерванты и антиоксиданты, например, витамин Е,аскорбиновую кислоту, ВНТ и ВНА. Предпочтительными фармацевтическими композициями с точки зрения простоты их приготовления и введения являются твердые композиции, в особенности таблетки и капсулы с твердым и жидким содержимым. Пероральное введение соединений является предпочтительным. Эти активные соединения могут быть введены парентерально или интраперитонально. Растворы и суспензии указанных активных соединений в виде свободного основания или фармацевтически приемлемой соли могут быть приготовле 19 ны в воде при смешении с пригодным поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также могут быть получены в глицерине, жидкости, полиэтиленгликолях и их смесях в маслах. Для хранения указанных препаратов в обычных условиях, они содержат консерванты, предотвращающие рост микроорганизмов. Фармацевтические формы, подходящие для использования в виде инъекций, включают стерильные водные растворы или суспензии и стерильные порошки для незапланированного приготовления стерильных растворов или суспензий для инъекций. В любом случае, форма должна быть стерильной и текучей до такой степени, чтобы ее можно было легко набрать в шприц. Она должна быть стабильной в условиях производства и хранения, и должна быть защищена от загрязняющего воздействия микроорганизмов, таких как бактерии и грибки. Носитель может быть растворителем или дисперсионной средой содержащей, например, воду, этанол (напр., глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси, и растительное масло. Соединения по изобретению можно получить,руководствуясь схемами, изображенными ниже, в которых введены следующие обозначения: 20 Как показано на схеме I, соединения по изобретению, как правило, получают с использованием подходящей реакции конденсации в качестве конечной стадии. Подходящим образом замещенную орто-аминобензойную кислоту или ее производное, такое как этиловый эфир(X=Вr, I, Сl или скрытый предшественник конденсации, такой как алкокси группа, которая может быть превращена в OTf группу при реакции конденсации), обрабатывают подходящим металлоорганическим реагентом, например,реактивом Гриньяра, в соответствующем апротонном растворителе, который включает, но не ограничивается ТГФ или эфиром с получением орто-аминокарбинола 2 в инертной атмосфере,такой как азот или аргон при температуре от-78 С до комнатной. Закрытие кольца в карбиноле 2 приводящее к бензоксазин-2-ону 3 обычно происходит в присутствии конденсирующего агента, такого как карбонилдиимидазол, фосген,диметилкарбонат или диэтилкарбонат в подходящем апротонном растворителе, таком как ТГФ, в интервале температур от комнатной до 65 С. Арилирование бензоксазин-2-онов 3 с получением соединения 4 можно осуществить с помощью разнообразных реакций конденсации,включающих реакции Сузуки (Suzuki), Стилле(Stille). Эти реакции обычно проводят в присутствии переходного металлического катализатора, например, палладиевого или никелевого комплекса часто с фосфиновыми лигандами,например, Рh3 Р, 1,1'-бис(дифенилфосфино)ферроценом, 1,2-бис(дифенилфосфино)этаном или солью палладия, такой как ацетат палладия. В условиях такого катализа подходящим образом замещенный нуклеофильный реагент, например,арилбороновая кислота, арилстаннан или арилцинковое соединение, конденсируется с бензоксазинонами 3 с получением соединения 4. Если для реакции нужно присутствие основания, то обычно используемые основания включают, но не ограничиваются ими, бикарбонат натрия,карбонат натрия, фосфат калия, карбонат бария,ацетат калия или фторид цезия. Наиболее часто используемые растворители для этих реакций включают бензол, ДМФА, изопропанол, этанол,DME, эфир, ацетон или смесь вышеперечисленных растворителей с водой. Реакцию конденсации, как правило, проводят в инертной атмосфере, такой как азот или аргон, в интервале температур от комнатной до точки кипения системы растворителей или их смеси. Бензоксазиноны 3 можно превратить в такой нуклеофил, как бороновая кислота, которую можно сконденсировать с подходящим электрофилом, например, с арилбромидом или арилиодидом с получением соединения 4, используя условия реакции конденсации, описанные выше. Превращение соединения 3 в соединение 5 можно осуществить путем обработки соединения 3 металлоорганическим реагентом, например, н-BuLi, в апротонном растворителе, 21 таком как ТГФ или эфир, с последующим гашением реакционного раствора подходящим электрофилом, таким как триметилборат, триизопропилборат, бисгексалкил олова или хлорид цинка, в интервале температур от -78 С до комнатной температуры, в инертной атмосфере,такой как азот или аргон. Схема Iа иллюстрирует альтернативный подход к получению бензоксазинонов 3. Так,подходящий анилин 1 защищают алкоксикарбонильной защитной группой, включающей, но не ограничивающейся ими, аллилоксикарбонил,трет-бутоксикарбонил, бензоксикарбонил, этоксикарбонил или метоксикарбонил, в подходящем растворителе, таком как ТГФ, ацетонитрил,в присутствии или в отсутствии основания в качестве либо катализатора, либо акцептора кислоты. Защищенный анилин затем обрабатывают подходящим металлоорганическим реагентом, таким как литийорганический агент или реактив Гриньяра, таким же образом, как и при получении соединения 2, с образованием карбинола 6. Обрабатывая соединения 6 подходящим основанием, таким как трет-бутилат калия, нбутиллитий, гидроксид калия, в подходящем растворителе, таком как толуол, ТГФ, спирт, в инертной атмосфере, такой как азот или аргон, в интервале температур от комнатной температуры до температуры кипения соответствующего растворителя, получают бензоксазиноны 3. На cхеме II показана методика получения бензоксазинонов с двумя различными заместителями в положении 4. Амид Вайнреба (Weinreb) 8 можно получить из соответственно замещенного изатинового ангидрида 7 путем обработки его такой солью как гидрохлорид N-,Oдиметилгидроксиламина в протонном растворителе, таком как этанол, изопропанол, при кипячении с обратным холодильником, в инертной атмосфере, такой как аргон или азот. Конденсацию амида 8 с арильным электрофилом, таким как арилбороновая кислота или арилстаннан, с получением соединения 9, можно провести, используя обычную реакцию конденсации, например, Сузуки или Стилле, по методике конденсации, аналогичной той, что описана для получения бензоксазинонов 4. При обработке амида Вайнреба 9 металлоорганическими соединениями, например, алкиллитием, алкинил 004512 22 литием, ариллитием или заменяющим их соединением Гриньяра, в апротонном растворителе,таком как ТГФ или эфир, в инертной атмосфере,такой как аргон или азот, при температуре от-78 С до комнатной, получается аминокетон 10. Превращение кетона 10 в карбинол 11 можно осуществить путем обработки соединения 10 металлоорганическим реагентом, таким как алкильное, алкинильное или арильное соединение Гриньяра, в апротонном растворителе, таком как ТГФ или эфир, в инертной атмосфере, такой как азот или аргон, при температуре от -78 С до комнатной. Превращение кетона 10 в карбинол 11 можно также осуществить путем восстановления кетогруппы в соединении 10 до карбинольного остатка в соединении 11, используя подходящий восстанавливающий реагент, такой как алюмогидрид лития, боргидрид натрия, в подходящем растворителе, таком как ТГФ, эфир или безводный спирт, в инертной атмосфере, в интервале температур от 0 С до температуры кипения растворителя. Замыкание кольца карбинола 11 с получением соединений по изобретению можно выполнить с помощью конденсирующих реагентов, таких как карбонилдиимидазол, фосген, диметилкарбонат или диэтилкарбонат в подходящем апротонном растворителе,таком как ТГФ, в интервале температур от комнатной до 65 С. Схема II Альтернативно, орто-аминокетон 10 можно получить путем обработки ортоаминобензонитрила 14 металлоорганическим реагентом, таким как литийорганический реагент или реактив Гриньяра, в подходящем рас 23 творителе, таком как ТГФ или эфир, в инертной атмосфере, такой как азот или аргон, в интервале температур от -78 С до комнатной, как показано на схеме III. Бензонитрил 14 можно легко получить из соответствующим образом замещенного бeнзoнитрила, такого как бромбензонитрил 13, используя подходящую реакцию конденсации, например по методу Стилле или Сузуки, осуществляемую по методике, аналогичной той, что описана для получения амида Вайнреба 9. На cхеме IV проиллюстрирован подход к получению бензоксазинонов с низшим перфторалкильным заместителем в положении-4, например, когда R6 представляет собой трифторметильную группу. Соответствующим образом замещенный хлоранилин 15 защищают подходящей защитной группой, используя, например,пивалоилхлорид или ди-трет-бутилпирокарбонат, получая защищенный анилин 16, в подходящем растворителе, таком как ацетонитрил, ацетон, ТГФ, метиленхлорид, или смеси растворителей, например метиленхлорида и воды, в инертной атмосфере, такой как аргон или азот, в интервале температур от 0 до 70 С. Может потребоваться присутствие подходящего основания, такого как карбонат натрия, бикарбонат натрия или карбонат калия, когда в процессе реакции образуется кислотный побочный продукт, например, гидрохлорид. В результате обработки 16 соответствующим алкиллитием,таким как н-бутиллитий или втор-бутиллитий, с последующим взаимодействием с низшими перфторкарбоксипроизводными, например трифторацетилхлоридом,1-(трифторацетил)имидазолом или этилтрифторацетатом, в апротонном растворителе, таком как эфир или ТГФ, в инертной атмосфере, такой как аргон или азот,при температуре от -78 С до комнатной, получаются защищенные орто-аминокетоны. Последующее удаление защитной группы можно осуществить путем взаимодействия замещенных аминокетонов с подходящей кислотой, такой как TFA (трифторуксусная кислота), 3N водный раствор соляной кислоты, в подходящем растворителе, таком как метиленхлорид или вода, при температуре от 0 С до точки кипения растворителя, с получением орто-аминокетона 17. Получение 6-хлорбензоксазинона 19 из со 004512 24 единения 17 можно осуществить тем же путем,который описан для синтеза бензоксазинона 12 из кетона 10. Конденсацию соединения 19 с арильной группой с получением соединения 12 можно провести с помощью реакции конденсации, катализируемой никелевым комплексом. Палладиевые катализаторы оказались неэффективными для этого процесса конденсации. Реакцию конденсации соединения 19 с соответствующей арилбороновой кислотой можно проводить в присутствии подходящего основания,такого как фосфат калия, и комплекса никеля (0 или II) в качестве катализатора, например никелевого комплекса с dppе, dppf или трифенилфосфином. Наиболее часто используемые для данной реакции растворители включают диоксан или ТГФ. Реакцию конденсации обычно проводят в инертной атмосфере, такой как аргон или азот, в интервале температур от комнатной температуры до 95 С.diохаnе - диоксан Как показано на cхеме V, соединения 6 или 12 могут быть в дальнейшем переведены в производные по положению-1 через серию превращений, приводящих к множеству новых циклокарбаматных производных, включая такие производные, как 1-алкил, 1-замещенный алкил, 1 карбонил, 1-замещенный карбонил, 1-карбокси,замещенный 1-карбокси. Например, алкил или замещенные алкилпроизводные 20 могут быть 25 образованы путем обработки карбамата 12 или 6 соответствующим основанием как гидрид натрия, в подходящем растворителе, таком как ДМФА, в инертной атмосфере, такой как аргон или азот, с последующим добавлением соответствующего электрофила, такого как алкил- или замещенный алкил-бромид, иодид или трифлат. Подобное превращение в положении 1 соединений 12 или 6 можно также осуществить в двухфазных условиях, как показано на схеме V, когда алкилирование проводят с использованием межфазного катализатора, такого как бромид трибутиламмония, в подходящем растворителе,таком как ацетонитрил. Другие примеры подобных модификаций включают, но не ограничиваются ими, нагревание соединения 12 или 6 с триэтилортоформиатом с получением 1 замещенных производных соединений 12 или 6. Схема V Ацилирование или карбоксилирование соединения 12 или 6 в положении 1 с получением соединения 21 можно легко осуществить путем обработки соединения 12 или 6 подходящим ацилирующим или карбоксилирующим реагентом, таким как ди-трет-бутилдикарбонат, в присутствии подходящего основного катализатора,такого как DMAP, в подходящем растворителе,таком как ацетонитрил, в инертной атмосфере,такой как аргон или азот. Аминирование соединения 12 или 6 в положении 1 с получением соединения 22 можно провести с использованием подходящего аминирующего агента, такого как хлорамин, в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как ТГФ или диэтиловый эфир, по методике, описанной в литературе(Metlesics et al. J. Org. Chem. 30, 1311 (1965. Следующие примеры иллюстрируют получение соединений настоящего изобретения. Пример 1. 2-(2-Амино-5-бромфенил) пропан-2-ол. Раствор 2-амино-5-бромбензойной кислоты (10 г, 46 ммоль) в сухом ТГФ (200 мл) обра 004512 26 батывали при -78 С в атмосфере азота раствором метилмагнийбромида в эфире (3,0 М, 90 мл,270 ммоль). Реакционную смесь медленно нагревали до комнатной температуры, перемешивали в течение 48 ч в атмосфере азота и затем вливали в водный 0,5 N охлажденный раствор соляной кислоты (300 мл). Смесь нейтрализовали водным 1N раствором гидроксида натрия и добавляли этилацетат (300 мл). Органический слой отделяли и водный слой экстрагировали этилацетатом (3 х 100 мл). Объединенные органические слои промывали рассолом и высушивали (MgSО 4). Затем удаляли растворитель в вакууме, осадок очищали при помощи флэш хроматографии на силикагеле(гексанэтилацетат/3:2) и получали 2-(2-амино-5 бромфенил)пропан-2-ол в виде грязно-белого твердого вещества (6 г, 57%): т.пл. 62-63 С; 1 НЯМР (СDСl3)7,19 (д, 1H, J=2,3 Гц), 7,12 (дд,1 Н, J=8,4, 2,3 Гц), 6,51 (д, 1 Н, J=8,4 Гц), 4,70 (с,2 Н), 1,82 (с, 1 Н), 1,65 (с, 6 Н). Пример 2. 6-Бром-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. К раствору 2-(2-амино-5-бромфенил)пропан-2-ола (18 г, 78 ммоль) в сухом ТГФ (150 мл) добавляли 1,1'-карбонилдиимидазол (15,5 г, 94 ммоль) в атмосфере азота. Реакционный раствор нагревали до 50 С в течение ночи. Растворитель удаляли в вакууме и осадок растворяли в этилацетате (100 мл). Раствор промывали водным 1N раствором соляной кислоты (2 х 40 мл), рассолом (20 мл), высушивали с помощью MgSO4. Затем удаляли растворитель в вакууме, получали 6-бром-4,4-диметил-1,4-дигидробензо [d][1,3]оксазин-2-он в виде белого твердого вещества (20 г,100%): т.пл. 199-200 С; 1 Н-ЯМР (ДМСО-d6)10,32 (с, 1H, D2 О взаимозаменяющий), 7,48 (д,1 Н, J=2,1 Гц), 7,43 (дд, 1H, J=8,5, 2,1 Гц), 6,84(д, 1H, J=8,4 Гц), 1,61 (с, 6 Н). Пример 3. 6-Иодо-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Продукт получают, исходя из 2-амино-5 иодбензойной кислоты, следуя методикам примеров 1 и 2, в виде белого твердого вещества: т.пл. 196-197 С; 1H ЯМР (ДМСО-d6)10,30 (с,1H, D2O взаимозаменяющий), 7,58 (м, 2 Н), 6,71-78 С в атмосфере азота. После перемешивания при -78 С в течение 30 мин получали смесь и обрабатывали триизопропилборатом (6,5 мл, 28 ммоль). Реакционный раствор медленно нагревали до комнатной температуры и гасили вод 27 ным 1N раствором соляной кислоты (60 мл). Добавляли этилацетат (100 мл) и отделяли органический слой, водный слой экстрагировали этилацетатом (3 х 60 мл). Объединенный органический слой промывали рассолом и высушивалиMgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии на силикагеле (этилацетат-гексан/2:1), получали(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновую кислоту в виде белого твердого вещества (1,4 г, 81%): т.пл. 249-250 С; 1 Н-ЯМР (ДМСО-d6)10,21 (с, 1H, D2O взаимозаменяющий), 7,90-7,95 (уширенный с, 2 Н, D2O взаимозаменяющий), 7,67 (м, 2 Н), 6,79 (д, 1 Н,J=7,8 Гц), 1,61 (с, 6 Н); MS (ESI) м/e 222(2,48 г, 23,4 ммоль) в смеси ДМЕ и воды (40 мл/10 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония (20 мл). Добавляли этилацетат (50 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (3 х 15 мл). Объединенные органические слои промывали рассолом и высушивали MgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии на силикагеле(гексан-этилацетат/2:1) и получали 6-(3 хлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оказин-2-он в виде желтоватого твердого вещества (1,4 г, 82%): т.пл. 158159 С; 1H-ЯМР (ДМСО-d6)10,31 (с, 1 Н, D2O взаимозаменяющий), 7,75 (с, 1H), 7,61 (м, 3 Н),7,46 (т, 1H, J=7,9 Гц), 7,39 (дд, 1 Н, J=7,0, 1,1 Гц), 6,96 (д, 1H, J=8,6 Гц), 1,68 (с, 6 Н); Анал. вычисл. для C16H14ClNO20,1 H2O: С, 66,37; H,4,94; N, 4,84. Найдено: С, 66,14; H, 4,61; N,4,71. Пример 6. 6-(3-Метоксифенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно cпособу А из 6-бром 4,4-диметил-1,4-дигидробензо[d][1,3]оксазин 2-она и 3-метоксифенилбороновой кислоты. Желтое твердое вещество: т.пл. 164-165 С; 1([М+Н]+, 70%). Анал. вычисл. для C16H14ClNO2: С, 66,79; H, 4,90; N, 4,87. Найдено: С, 66,34; H,4,76; N, 4,75. Пример 9. 6-(3-Хлорфенил)-4-метил-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-2-он. К раствору 1-(4-амино-3'-хлордифенил-3 ил)этанона (см. пример 35 0,15 г, 0,61 ммоль) в сухом метаноле (60 мл) добавляли при комнатной температуре в атмосфере азота боргидрид натрия. Через 15 мин реакционную смесь обрабатывали водой со льдом. Добавляли этилацетат(30 мл), после чего органический слой отделяли и водный слой экстрагировали этилацетатом(3 х 20 мл). Объединенные органические слои промывали рассолом (10 мл), высушивали(MgSO4). После удаления растворителя, полученный остаток кристаллизовали из толуола и получали 1-(4-амино-3'-хлордифенил-3-ил) этанол в виде белого твердого вещества (0,087 г,58%); 1 Н-ЯМР (ДМСО-d6)7,55 (т, 1 Н, J=1,4 Гц), 7,50 (д, 1 Н, J=7,8 Гц), 7,44 (д, 1 Н, J=2,1 Гц),7,39 (т, 1 Н, J=8,2 Гц), 7,31-7,21 (м, 2 Н), 6,68 (д,1 Н, J=8,1 Гц), 5,25 (с, 2 Н); 5,20 (м, 1 Н), 4,83 (м,1 Н), 1,35 (д, 3 Н, J=8,8 Гц) MS (EI) м/е 247 (М+). Смесь указанного выше 1-(4-амино-3'хлордифенил-3-ил)этанола (0,03 г, 0,13 ммоль) и трифосгена (0,01 г, 0,04 ммоль) в сухом ТГФ (20 мл) перемешивали при комнатной температуре в атмосфере азота 10 мин. Раствор удаляли с получением 6-(3-хлорфенил)-4-метил-1,4-дигидро-2 Н-3,1-бензоксазин-2-она в виде белого твердого вещества (0,031 г, 91%): т.пл. 155156 С; 1H-ЯМР (ДМСО-d6)10,3 (с, 1 Н), 7,72(м, 2 Н), 7,62 (м, 1 Н), 7,56 (м, 1 Н), 7,47 (т, 1 Н,J=8,0 Гц), 7,39 (д, 1 Н, J=8,0 Гц), 6,98 (д, 1 Н,J=8,0 Гц), 5,50 (кв, 1 Н, J=6,82 Гц), 1,6 (д, 3 Н,J=6,82 Гц). MS (APCI) м/е 274 ([М+Н]+, 100%). Пример 10. 6-(3-Хлорфенил)-4-этил-1,4 дигидробензо[d][1,3]оксазин-2-он. Получают в соответствии с методикой по примеру 9 из 1-(4-амино-3'-хлордифенил-3-ил)пропанола и трифосгена. Белое твердое вещество: т.пл. 146-148 С; 1H-ЯМР (ДМСО-d6)10,3 (с, 1 Н), 7,70(ESI) м/е 286 ([М-Н]-, 100%). Пример 11. 6-(3-Хлорфенил)-4-фенил-1,4 дигидробензо[d][1,3]оксазин-2-он. Получают из 1-(4-амино-3'-хлордифенил 3-ил)бензилового спирта и трифосгена в соответствии с методикой по примеру 9. Грязнобелое твердое вещество: т.пл. 177-178 С; 1HЯМР (ДМСО-d6)10,5 (с, 1 Н), 7,68 (дд, 1 Н,J=8,7, 1,7 Гц), 7,62 (т, 1 Н, J=1,74 Гц), 7,48-7,34(ESI) м/е 336 ([M+H]+, 30%). Пример 12. 3-(4,4-Диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6 ил)бензонитрил (cпособ В). Смесь (1,4-дигидро-4,4-диметил-2-оксо-2 Н 3,1-бензоксазин-6-ил)бороновой кислоты (2,22 г,10 ммоль), 3-бромбензонитрила (2,18 г, 12 ммоль),тетракис(трифенилфосфин)палладия (0) (0,6 г,0,52 ммоль) и карбоната натрия (2,2 г, 21 ммоль) в смеси DME и воды (70 мл/15 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным водным раствором хлорида аммония (20 мл). Добавляли этилацетат (100 мл) и отделяли органический слой. Водный слой экстрагировали этилацетатом (3 х 30 мл). Объединенные органические слои промывали рассолом и высушивали MgSO4. Растворитель удаляли в вакууме и осадок очищали при помощи флэш хроматографии на силикагеле (гексан-этилацетат/1:1), получали 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Нбензо[d] [1,3]оксазин-6-ил)бензонитрил в виде грязно-белого твердого вещества (0,7 г, 25%): т.пл. 236-237 С; 1H-ЯМР (ДМСО-d6)10,34 (с, 1 Н,D2O взаимозаменяющий), 8,21 (с, 1 Н), 8,02 (д, 1 Н,J=8,1 Гц), 7,79 (д, 1 Н, J=7,7 Гц), 7,60-7,70 (м, 3 Н),6,98 (д, 1 Н, J=8,2 Гц), 1,71 (с, 6 Н); Анал. вычисл. для С 17 Н 14N2 О 20,1 Н 2 О: С, 72,89; Н, 5,11; N,10,00. Найдено: С, 72,75; Н, 5,05; N, 9,65. Пример 13. 4,4-Диметил-6-(3-нитрофенил)1,4-дигидро-2 Н-бензо[d][1,3]оксазин-2-он. Получают из 6-иод-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-онa и 3-нитрофенилбороновой кислоты согласно cпособу А. Желтоватое твердое вещество: т.пл. 244-245 С; 1 Н-ЯМР (ДМСО-d6)10,38 (с, 1 Н), 8,47 (с, 1 Н),8,14-8,20 (м, 2 Н), 7,70-7,76 (м, 3 Н), 7,01 (д, 1 Н,J=8,1 Гц), 1,68 (с, 6 Н); MS (EI) м/е 297 ([М-Н]-,100%); Анал. вычисл. для C16H14N2O4: С, 64,42; Н, 4,73; N, 9,39. Найдено: С, 63,93; Н, 4,91; N,8,71. Пример 14. 6-(3-Бpом-5-фтоpфeнил)-4,4 диметил-1,4-дигидробензо[d][1,3]oкcaзин-2-oн. Получают из смеси (1,4-дигидро-4,4 диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1,3-дибром-5-фторбензола,следуя cпособу В. Белое твердое вещество: т.пл.C16H13BrFNO2: С, 54,88; Н, 3,74; N, 4,00. Найдено: С, 54,83; Н, 3,82; N, 3,95. Пример 15. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил. Смесь 6-(3-бром-5-фторфенил)-4,4-диметил-2 Н-бензо[d][1,3]оксазин-2-она (1 г, 2,8 ммоль), цианида цинка (0,2 г, 1,7 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,2 г, 0,17 ммоль) в сухом ДМФА (20 мл) дегазировали с удалением кислорода и затем нагревали при 85 С в атмосфере азота в течение 6,5 ч. Реакционный раствор охлаждали до комнатной температуры и выливали в насыщенный водный раствор хлорида аммония (100 мл). Появлялся белый осадок, который собирали на фильтре. Белый осадок промывали дистиллированной водой (3 х 20 мл) и растворяли в смеси этилацетата(10 мл) и метанола (10 мл). Раствор фильтровали через подушку силикагеля и элюировали смесью этилацетата и гексана (1:1). Затем растворитель удаляли, получали 3-(4,4-диметил-2 оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6 ил)-5-фторбензонитрил в виде белого твердого вещества (0,7 г, 84%): т.пл. 253-254 С; 1 Н-ЯМР(96,0 г, 500 ммоль), гидрохлорида гидроксиламина (111,9 г, 500 ммоль), пиридина (500 мл) и этанола (500 мл) нагревают при кипении с обратным холодильником в атмосфере азота в течение 2 ч. Реакционный раствор охлаждают до комнатной температуры и концентрируют в вакууме до образования масла. Сырой продукт растирают дважды с ледяной водой и полученное твердое вещество собирают на фильтре. Смесь части полученного выше твердого продукта, моногидрата ацетата меди (II) (4,2 г, 21 ммоль) в ацетонитриле (1,4 л) нагревают при кипении с обратным холодильником 3 ч. Затем растворитель удаляют в вакууме и остаток растворяют в этилацетате. Раствор промывают 5%ной водной серной кислотой (2 х 30 мл), водой(2 х 30 мл), рассолом (20 мл) и сушат (MgSO4). Растворитель удаляют в вакууме и остаток растворяют в минимальном количестве хлороформа (1 л) и дают пройти кристаллизации. Полученные кристаллы собирают на фильтре и фильтрат концентрируют, а затем очищают с помощью хроматографии (силикагель, хлороформ), что дает названное соединение в виде грязно-белого твердого вещества (31,5 г общий,58%). ИК (пленка) см-1 2200; 1H-ЯМР (CDCl3-d6)7,39-7,38 (д, 1 Н, J=4,1 Гц), 7,10 (д, 1 Н, J=4,0 Гц); MS (EI) м/е 187 (M+, 98%), 189 (М+, 100%). Пример 19. 5-Бром-4-метил-2-тиофенкарбоксальдегид. К раствору диэтиламина (28 г, 0,383 ммоль) в безводном ТГФ (400 мл) добавляли раствор н-BuLi в гексане (2,5 М, 153 мл, 0,383 ммоль). Раствор перемешивают при -40 С в течение 30 мин в атмосфере азота, охлаждают до-78 С и обрабатывают по каплям 2-бром-3 метилтиофеном (45 г, 0,254 ммоль) в безводном ТГФ (450 мл). Реакционный раствор перемешивают при -78 С 30 мин и обрабатывают безводным ДМФА (100 мл). Реакционный раствор медленно нагревали до комнатной температуры и гасили водным 1N раствором соляной кислоты (60 мл). Продукт экстрагируют этилацетатом(3 х 450 мл). Экстракты промывали водой, рассолом и высушивали MgSO4. Растворитель удаляли в вакууме и получали белое твердое вещество (46 г, 88,3%): Образец кристаллизуют из гексана, т.пл. 63-65 С; ИК (KВr) 1654 см-1. 1 Н-ЯМР 32 Пример 20. 5-Бром-4-метил-2-тиофенкарбонитрил. Получают из 5-бром-4-метил-2-тиофенкарбоксальдегида, используя способ по примеру 18. Белое твердое вещество: т.пл. 40-42 С; ИК(КВr) 2200 см-1; 1H-ЯMP (CDCl3)7,29 (с, 1 Н),2,21 (с, 3 Н); MS (ESI) м/е 201/203 (М+,98%/100%). Анал. вычисл. для C6H4BrNS: С,35,66; Н, 1,99; N, 6,93. Найдено: С, 36,00; Н,2,14; N, 6,76. Пример 21. 5-(4,4-Диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)тиофен 2-карбонитрил. Синтезируют согласно cпособу В с использованием (1,4-дигидро-4,4-диметил-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 5-бром-2-тиофенкарбонитрила. Указанное в названии соединение получают в виде грязнобелого твердого вещества: т.пл. 264-266 С; 1HЯМР (ДМСО-d6)10,3 (с, 1 Н), 7,97 (д, 1 Н, J=7,9 Гц), 7,60-7,66 (м, 3 Н), 6,96 (д, 1 Н, J=8,1 Гц) 1,65(M+NH4)+. Анал. вычисл. для C15H12N2O2S; С,63,36; Н, 4,25; N, 9,85. Найдено: С, 63,01; Н,4,36; N, 9,39. Пример 22. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-4-метилтиофен-2-карбонитрил. Синтезируют согласно способу В с использованием (1,4-дигидро-4,4-диметил-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 5-бром-4-метил-2-тиофенкарбонитрила. Указанное в названии соединение получают в виде грязно-белого твердого вещества: т.пл. 195200 С; 1 Н-ЯМР (ДМСО-d6)10,2 (с, 1 Н), 8,32[М+Н]+. Анал. вычисл. для C16H14N2O2S; С,64,41; Н, 4,75; N, 8,89. Найдено: С, 64,64; Н,4,62; N, 9,39. Пример 23. 4-(4,4-Диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-2-фуран 2-карбонитрил. Синтезируют согласно cпособу В с использованием (1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 4-бром-2 фуранкарбонитрила. Указанное в названии соединение получают в виде грязно-белого твердого вещества: т.пл. 255-256 С; 1H-ЯМР (ДМСО-d6)10,32 (с, 1H, D2O взаимозаменяемый), 8,57 (с, 1 Н),8,15 (с, 1 Н), 7,61 (с, 1 Н), 7,55 (дд, 1 Н, J=8,3, 1,5 Гц), 6,92 (д, 1 Н, J=8,2 Гц), 1,65 (с, 6 Н); MS (ЕСI) м/е 269 [М+H]+ 72%); Анал. вычисл. дляC15H12N2 О 3; С, 67,16; Н, 4,51; N, 10,44. Найдено: С,67,14; Н, 4,59; N, 10,07. Пример 24. 4,4-Диэтил-6-(3-нитрофенил)1,4-дигидро-2 Н-3,1-бензо[d][1,3]оксазин-2-он. Получают из 4,4-диэтил-6-иод-1,4-дигидробензо[d][1,3]оксазин-2-она и 3-нитрофенилборной кислоты согласно cпособу А. Указанное в названии соединение получают в виде грязно 33 белого твердого вещества: т.пл. 193-194 С; 1 НЯМР (ДМСО-d6)9,19 (с, 1 Н, D2O взаимозаменяющий), 8,38 (т, 1 Н, J=1,9 Гц), 8,20 (м, 1 Н),7,83 (м, 1 Н), 7,61 (т, 1 Н, J=8,0 Гц), 7,50 (дд, 1 Н,J=8,2, 2,0 Гц), 7,23 (д, 1 Н, J=1,7 Гц), 6,99 (д, 1 Н,J=8,3 Гц), 2,09 (кв, 4 Н, J=7,4 Гц), 0,96 (т, 6 Н,J=8,3 Гц); MS (EI) м/е 325 ([М-Н]-, 100%), Анал. вычисл. для C18H18N2 О 4 0,3 Н 2 О: С, 65,17; Н,5,65; N, 8,44. Найдено: С, 65,31; Н, 5,60; N, 8,10. Пример 25. 6-(3-Хлорфенил)-4,4-диэтил 1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 4,4-диэтил-6-иод-1,4 дигидробензо[d][1,3]оксазин-2-она и 3-нитрофенилборной кислоты согласно cпособу А. Белое твердое вещество: т.пл. 150-151 С; 1 Н-ЯМР(д, 1 Н, J=8,6 Гц), 5,49 (с, 2 Н), 5,00 (с, 1 Н, J=8,3 Гц), 2,01 (д, 2 Н, J=1,8 Гц), 1,66-1,77 (м, 2 Н),1,44-1,61 (м, 4 Н), 1,16-1,34 (м, 2 Н); MS (ESI) м/е 325 ([М+Н]+, 98%/100%). Пример 27. 6-Бpoм-cпирo[4H-3,1-бeнзoкcaзин-4,1'-циклoгeкcaн]-2-(1H)-oн. Получают из 1-(2-амино-5-бромфенил) циклогексанола и карбонилдиимидазола согласно способу по примеру 2. Грязно-белое твердое вещество: т.пл. 208-210 С; 1H ЯМР (ДМСО-d6)10,26 (с, 1 Н), 7,45 (д, 1 Н, J=2,2 Гц), 7,39 (дд, 1 Н,J=8,2, 2,2 Гц), 6,81 (д, 1 Н, J=8,3 Гц), 1,90-1,97(APCI) м/е 296 ([М+Н]+, 68%). Пример 28. Спиро-(4,1'-циклогексан-1,4 дигидро-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновая кислота. Получают согласно способу из примера 4 с использованием 6-бромспиро[4 Н-3,1-бензоксазин-4,1'-циклогексан]-2-(1 Н)-она. Грязно-белое твердое вещество: т.пл. 223-225 С. 1H-ЯМР(С, 1 Н), 7,63 (дд, 1 Н, J=8,0, 1,1 Гц), 6,81 (д, 1 Н,J=7,9 Гц), 1,96 (с, 1 Н), 1,93 (с, 1 Н), 1,57-1,88 (м,7 Н), 1,24-1,34 (м, 1 Н); MS (ESI) м/е 262 (M+H)+. Пример 29. 6-(3-Хлорфенил)спиро-[4 Н-3,1 бензоксазин-4,1'-циклогексан]-2(1 Н)-он. Получают из 6-бромспиро-[4 Н-3,1-бензоксазин-4,1'-циклогексан]-2(1 Н)-она и 3-хлорфенилборной кислоты согласно способу А в виде(т, 1 Н, J=1,9 Гц), 7,50-7,67 (м, 3 Н), 7,42-7,49 (м,1 Н), 7,35-7,38 (м, 1 Н), 6,93-6,95 (д, 1 Н, J=4,2),1,91-1,98 (м, 4 Н), 1,64-1,76 (м, 3 Н), 1,60 (м, 2 Н),1,29-1,39 (м, 1 Н); MS (APCI) м/е 328 (М+, 80%). Пример 30. 6-Брoм-cпирo[4H-3,1-бeнзoкcaзин-4,1'-циклoгeкcaн]-2-(1H)-oн. Получают согласно способам по примерам 26 и 27 из 2-амино-5-бромбензойной кислоты и реагента Гриньяра, полученного из 1,5 дибромбутана. Грязно-белое вещество: т.пл. 180-185 С. 1 Н-ЯМР (ДМСО-d6)10,29 (с, 1H,D2O взаимозаменяющий), 7245 (д, 1 Н, J=2,2 Гц),7,41 (дд, 1H, J=8,1, 2,1 Гц), 6,82 (д, 1H, J=8,0 Гц), 1,96-2,01 (м, 4 Н), 1,76-1,87 (м, 4 Н), MS (EI) м/е 281 (М+, 98%). Анал. вычисл. дляC12H12BrNО 2: С, 51,08; Н, 4,21; N, 4,85. Найдено: С, 50,53; Н, 4,21; N, 4,85. Пример 31. 6-(3-Хлoрфeнил)cпиpo[4H-3,1 бeнзoкcaзин-4,1'-циклoгeкcaн]-2-(1H)-oн. Получают из 6-бромспиро[4 Н-3,1-бензоксазин-4,1'-циклогексан]-2-(1 Н)-она и 3-хлорфенилбороновой кислоты согласно способу А. Грязно-белое твердое вещество: т.пл. 140145 С; 1H-ЯМР (ДМСО-d6)10,27 (с, 1 Н), 7,75(т, 1H, J=1,8 Гц), 7,53-7,63 (м, 3 Н), 7,44 (т, 1 Н,J=7,9 Гц), 7,36 (м, 1 Н), 6,95 (д, 1 Н, J=8,6 Гц),2,09-2,15 (м, 4 Н), 1,81-1,89 (м, 4 Н), MS (ESI) м/е 314 ([М+Н]+). Анал. вычисл. для C18H16ClNO2: С, 68,0; Н, 5,14; N, 4,46. Найдено: С, 60,94; Н,4,94; N, 3,78. Пример 32. 6-(3-Нитрофенил)спиро[4 Н 3,1-бензоксазин-4,1'-циклогексан]-2-(1 Н)-он. Получают из 6-бромспиро[4 Н-3,1-бензоксазин-4,1'-циклогексан-2]-(1 Н)-она и 3-нитрофенилбороновой кислоты согласно способу А. Грязно-белое твердое вещество: т.пл. 245246 С; 1 Н-ЯМР (СDСl3)8,39 (т, 1H, J=1,9 Гц),8,20 (дд, 1H, J=8,2, 1,4 Гц), 8,11 (с, 1H, D2O взаимозаменяющий), 7,86 (д, 1 Н, J=8,0 Гц), 7,62(13,5 мл, 96 ммоль) в этаноле и воде (100 мл/10 мл) добавляют раствор 5-бромизатонического ангидрида (20 г, 74 ммоль) в этаноле и воде (100 мл/10 мл) при комнатной температуре в токе азота. Реакционную массу нагревают при кипении с обратным холодильником 3 ч. Растворитель удаляют в вакууме и остаток растворяют в этилацетате (100 мл), промывают 1N водным раствором гидроксида натрия (2 х 20 мл), рассолом (30 мл) и высушивают MgSO4. Затем удаля 35 ли растворитель, осадок очищали при помощи флэш хроматографии (силикагель, гексан: этилацетат/3:2) и получали 2-амино-5-бром-Nметокси-N-метилбензамид в виде грязно-белого вещества (13 г, 68%): т.пл. 80-81 С; 1 Н-ЯМР(CDCl3)7,49 (д, 1 Н, J= 2,1 Гц), 7,26 (дд, 1 Н,J=8,3, 2,0 Гц), 6,59 (д, 1H, J=8,4 Гц), 3,58 (с, 3 Н),3,34 (с, 3 Н); Анал. вычисл. для С 9 Н 11 ВrN2O2: С,41,72; Н, 4,28; N, 10,81. Найдено: С, 41,99, Н,4,16; N, 10,82. Пример 34. 4-Aминo-3'-xлopдифeнил-3 кapбoнитpил. Получают из 2-амино-5-бромбензонитрила и 3-хлорфенилбороновой кислоты согласно способу А. Грязно-белое твердое вещество: т.пл. 118-119 С; 1 Н-ЯМР (ДМСО-d6)7,80 (д, 1 Н,J=2,3 Гц), 7,65-7,72 (м, 2 Н), 7,57 (д, 1 Н, J=8,0 Гц), 7,42 (т, 1 Н, J=7,9 Гц), 7,31 (м, 1 Н), 6,87 (д,1 Н, J=8,7 Гц), 6,29 (широкий, 2 Н); Анал. вычисл. для C13H9ClN20,3H2O: С, 68,28; Н, 3,97; N,12,25. Найдено: С, 67,68; Н, 4,06; N, 11,89. Пример 35. 1-(4-Амино-3'-хлордифенил-3 ил)этанон. Смесь 2-амино-5-бром-N-метокси-N-метилбензамида (7,78 г, 30 ммоль) 3-хлорфенилборной кислоты (5,63 г, 36 ммоль), тетракис(трифенилфосфин)палладия (0) (17,6 г, 1,5 ммоль) и карбоната натрия (7,63 г, 72 ммоль) в смеси ДМЕ и воды (150 мл/30 мл) дегазировали с удалением кислорода и нагревали до 85 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и обрабатывали рассолом (30 мл) и этилацетатом(100 мл). Отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 40 мл). Объединенные органические слои промывали рассолом и высушивали MgSO4. Затем удаляли растворитель, осадок очищали при помощи флэш хроматографии (силикагель, гексан: этилацетат/1:1) и получали 5-(3-хлорфенил)-Nметокси-N-метилбензамид в виде коричневого масла (5 г, 57%). К раствору полученного бензамида (5 г, 17,2 ммоль) в обезвоженном ТТФ добавляли по каплям метиллитий в эфире (1,4 М,28,6 мл, 40 мл) при -78 С в атмосфере азота. После 30 мин перемешивания реакционную смесь обрабатывали насыщенным водным раствором хлорида аммония (50 мл) при -78 С. Добавляли этилацетат (100 мл), отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 20 мл). Объединенные органические слои промывали (рассолом) и высушивали (MgSO4). После удаления растворителя остаток очищали при помощи флэш-хроматографии(силикагель, гексан: этилацетат/2:1) и получали 1-(4-амино-3'-хлордифенил-3-ил)этанон в виде желтого твердого вещества (2 г, 47%): т.пл. 8990 С; 1 Н-ЯМР (СDСl3)7,89 (д, 1 Н, J=2,0 Гц),7,51 (м, 2 Н), 7,25-7,40 (м, 3 Н), 6,73 (д, 1 Н, J=8,6 Гц), 6,38 (уширенный, 2 Н), 2,65 (с, 3 Н); MS (EI) м/е 268 ([M+Na]+, 60%), Анал. вычисл. для(10 мл) добавляли раствор бромида аллилмагния в эфире (1,0 М, 3 мл, 3 ммоль) при 0 С в атмосфере азота. Реакционный раствор медленно нагревали и перемешивали в атмосфере азота в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония (10 мл) и далее добавляли этилацетат (50 мл). Отделяли органический слой и водный слой экстрагировали этилацетатом (3 х 10 мл). Объединенные органические слои промывали рассолом и высушивалиMgSO4. После удаляли растворитель, остаток очищали при помощи флэш хроматографии (силикагель, гексан: этилацетат/3:1), получали аминокарбинольное промежуточное соединение, которое использовали на следующей стадии без дальнейшей очистки. К раствору указанного выше аминокарбинольного промежуточного соединения в обезвоженном ТГФ добавляли CDI (0,38 г, 2,3 ммоль) при комнатной температуре в атмосфере азота. Реакционную смесь нагревали до 50 С в течение 12 ч и после охлаждали до комнатной температуры. Растворитель удаляли в вакууме и остаток очищали при помощи флэш хроматографии (силикагель, гексан: этилацетат/2:1) и получали 4-аллил-6-(3-хлорфенил)-4-метил-1,4 дигидробензо[d][1,3]оксазин-2-он в виде белого твердого вещества (130 мг, 52%): т.пл. 128129 С; 1 Н-ЯМР (CDCl3)8,68 (с, 1 Н, D2O взаимозаменяющий), 7,50 (с, 1 Н), 7,44 (дд, 1 Н, J=8,2,1,9 Гц), 7,31-7,40 (м, 3 Н), 7,25 (д, 1 Н, J=1,6 Гц),6,92 (д, 1 Н, J=8,2 Гц), 5,70-5,85 (м, 1 Н), 5,17 (м,2 Н), 2,76 (м, 2 Н), 1,79 (с, 3 Н); MS (ESI) м/e 314(м, 9 Н), 7,31-7,40 (м, 4 Н), 6,92 (д, 1H, J=8,4 Гц),2,12 (с, 3 Н); MS (ESI) м/е 348 ([М-Н]-, 100%),Анал. вычисл. для C21H16ClNO2: С, 72,10; Н,4,61; N, 4,00. Найдено: С, 71,72; Н, 4,86; N, 3,91. Пример 40. 4-Бензил-6-(3-хлорфенил)-4 метил-1,4-дигидробензо[d][1,3]оксазин-2-он. Смесь 1-(4-амино-3-хлордифенил-3-ил)-1 бензилэтанола (полученного при использовании 1-(4-амино-3'-хлордифенил-3-ил)этанона и бензилмагнийбромида согласно способу С, 0,14 г,0,42 ммоль) и трифосгена (0,04 г, 0,14 ммоль) в сухом ГГФ (10 мл) перемешивают в токе азота 10 мин. По завершении реакции ТГФ удаляют и остаток очищают с помощью флэш хроматографии (силикагель, 35% этилацетат/гексан), что дает 4-бензил-6-(3-хлорфенил)-4-метил-1,4-дигидробензо[d][1,3]оксазин-2-он (0,045 г, 30%) в виде грязно-белого твердого вещества: т.пл. 187-188 С; 1 Н-ЯМР (ДМСО-d6)10,1 (с, 1H),7,70 (т, 1H, J=2,3 Гц), 7,6 (д, 1H, J=8,0 Гц), 7,587,53 (м, 2 Н), 7,46 (т, 1 Н, J=8,0 Гц), 7,38 (д, 1 Н,J=8,0 Гц), 7,22-7,17 (м, 3 Н), 7,06-7,0 (м, 2 Н), 6,84C22H18ClNO2: С, 72,63; Н, 4,99; N, 3,85. Найдено: С, 71,82; Н, 5,09; N, 3,58. Пример 41. 6-(3-Хлорфенил)-4-циклопропил-4-метил-1,4-дигидробензо[d][1,3]оксазин-2 он. К раствору циклопропилмагнийбромида в безводном ТГФ (полученного при использовании циклопропилбромида и металлического магния, 70 ммоль) при 52 С добавляют в токе азота 4-амино-3'-хлордифенил-3-карбонитрил(5,2 г, 22,7 ммоль). Реакционную смесь перемешивают при 52 С 1 ч, охлаждают до комнатной температуры и гасят с помощью 1N водного раствора НСl (100 мл). Этилацетат (100 мл) добавляют и водный слой экстрагируют с помощью этилацетата (3 х 40 мл). Объединенные органические слои промывают рассолом и сушат над MgSO4. Растворитель удаляют и остаток очищают с помощью колонки с силикагелем 38 ЯМР (гидрохлорид, ДМСО-d6)8,30 (д, 1 Н,J=2,1 Гц), 7,76 (т, 1 Н, J=1,7 Гц), 7,68-7,63 (м,2 Н), 7,43 (т, 1 Н, J=7,9 Гц), 7,32 (м, 1 Н), 6,88 (д,1 Н, J=8,7 Гц), 4,50 (широкий с, 3 Н), 3,07 (м, 1 Н),0,98 (м, 4 Н); (MS (+)ESI) м/e 272/274 (M+). К раствору (4-амино-3'-хлордифенил-3 ил)циклопропилметанона (0,67 г, 2,5 ммоль) в безводном ТГФ (10 мл) при -78 С добавляют раствор метилмагнийбромида (3,0 М в диэтиловом эфире, 2,5 мл, 7,5 ммоль) в токе азота. Реакционную смесь медленно нагревают до комнатной температуры, перемешивают в токе азота 12 ч, и гасят с помощью насыщенного водного раствора хлорида аммония (40 мл). Этилацетат (50 мл) добавляют, органические слои отделяют и сушат (MgSO4). После удаления растворителя,остаток очищают с помощью хроматографии на силикагеле (гексан: этилацетат/7:1), что позволяет получить 1-(4-амино-3-хлордифенил-3-ил)1-циклопропилэтанол в виде желтого масла: MS(El) м/е 287/289 (М+). Названное соединение получают из 1-(4 амино-3-хлордифенил-3-ил)-1-циклопропилэтанола и 1,1'карбонилдиимидазола согласно способу С. Грязно-белое твердое вещество: т.пл. 158-159 С; 1H-ЯМР (ДМСО-d6)10,3 (с, 1 Н),7,74 (т, 1 Н, J=1,71 Гц), 7,67-7,57 (м, 3 Н), 7,47 (т,1 Н, J=7,88 Гц), 7,39 (д, 1 Н, J=8,1 Гц), 6,95 (д, 1 Н,J=8,12 Гц), 1,7 (с, 3 Н), 1,45 (м, 1 Н), 0,48 (м, 2 Н),0,28 (м, 2 Н); MS (APCI) м/е 314 ([М+Н]+, 100%); Анализ. Вычислено C18H16ClNO2: С, 68,9; Н,5,14; N, 4,46. Найдено: С, 68,13; Н, 5,01, N, 4,36. Пример 42. 6-(3-Хлорфенил)-4-циклопропил-4-пропин-1-ил-1,4-дигидробензо[d][1,3] оксазин-2-он. 1-(4-Амино-3'-хлордифенил-3-ил)-1-циклопропил-1-пропинилметанол получают из (4-амино-3'-хлордифенил-3-ил)циклопропилметанона и пропинилмагний бромида согласно примеру 41. Смесь 1-(4-амино-3'-хлордифенил-3-ил)-1 циклопропил-1-пропинилметанола (0,02 г, 0,064 ммоль) и 1,1'-карбонилдиимидазола (0,016 г,0,096 ммоль) в сухом ТГФ (10 мл) перемешивают в токе азота 10 мин. По завершении реакции ТГФ удаляют и остаток очищают с помощью флэш хроматографии (силикагель, 40% этилацетат/гексан), что дает 6-(3-хлорфенил)-4-циклопропил-4-проп-1-инил-1,4-дигидробензо[d][1,3] оксазин-2-он (0,014 г, 56%) в виде светложелтого твердого вещества: т.пл. 178-179 С; 1HЯМР (ДМСО-d6)10,6 (с, 1 Н), 7,68 (м, 2 Н), 7,64 39 314 (М+Н)+), получают из (4-амино-3'хлордифенил-3-ил)-циклопропилметанона и циклопропилмагнийбромида согласно примеру 41. Названное соединение получают в соответствии с примером 41 из (4-амино-3'хлордифенил-3-ил)дициклопропилметанола и 1,1'-карбонилдиимидазола. Желтое твердое вещество: т.пл. 198-200 С, 1 Н-ЯМР (ДМСО-d6)10,3 (с, 1 Н), 7,72 (широкий с, 1 Н), 7,67 (широкий с, 1 Н), 7,62 (м, 2 Н), 7,48 (т, 1 Н, J=7,88 Гц),7,40 (д, 1 Н, J=8,04 Гц), 6,94 (д, 1 Н, J=8,27 Гц),1,55 (м, 2 Н), 0,5 (м, 6 Н), 0,28 (м, 2 Н); MS (El) м/е 339 (M+, 40%). Анализ. вычисленоC20H18ClNO2: С, 70,69; Н, 5,34; N, 4,12. Найдено: С, 69,38; Н, 5,07; N, 4,02. Пример 44. 6-(3-Хлорфенил)-4,4-дипропин-1-ил-1,4-дигидробензо[d][1,3]оксазин-2-он. Следуя процессу по примеру 41, (4-амино 3'-хлордифенил-3-ил)пропинилметанон(4-амино-3'-хлордифенил-3-ил)дипропинилметанол, который реагирует с 1,1'-карбонилдиимидазолом, что позволяет получить названное соединение. Желтое твердое вещество: т.пл. 151 С (разложение); 1 Н-ЯМР (ДМСО-d6)10,8 (с, 1 Н), 7,71 (дд, 1 Н, J=8,52, 1,94 Гц), 7,69(0,34 г, 0,99 ммоль) в сухом ДМФА (10 мл) добавляют порциями в токе азота при комнатной температуре гидрид натрия (80 мг, 2,0 ммоль). Смесь перемешивают при комнатной температуре 30 мин, обрабатывают иодметаном (1 мл,избыток), и перемешивают 2 ч. К реакционной смеси добавляют холодный насыщенный раствор хлорида аммония (30 мл) и получают белый осадок, который собирают на фильтре,промывают дистиллированной водой, что позволяет получить названное соединение в виде белого твердого вещества (0,31 г, 87%): т.пл. 157-158 С; 1H-ЯМР (ДМСО-d6)7,83 (с, 1 Н),7,76 (дд, 1 Н, J=8,5, 2,0 Гц), 7,67 (м, 2 Н), 7,53 (дт,1 Н, J=8,3, 1,9 Гц), 7,18 (д, 1 Н, J=8,5 Гц), 3,33 (с,3 Н), 1,67 (с, 6 Н); 19F-ЯМР (ДМСО-d6)-111,01(100 мл) в токе азота при 0 С добавляют раствор н-BuLi (2,5M, 30 мл, 70 ммоль) в гексане порциями по каплям. После добавления раствор 40 поддерживают при перемешивании при 0 С 40 мин и обрабатывают раствором 1-(трифторацетил)имидазола (9 мл, 78 ммоль) в безводном ТГФ (10 мл). Реакционную смесь нагревают до комнатной температуры и выдерживают 18 ч. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония (50 мл), с последующим добавлением этилацетата (100 мл). Органический слой отделяют и растворитель удаляют в вакууме. Полученный остаток суспендируют в 3N водном растворе соляной кислоты (50 мл) и нагревают при кипении с обратным холодильником в течение ночи. Реакционный раствор охлаждают до комнатной температуры и обрабатывают холодным раствором гидроксида аммония до рН выше 8. Водную смесь экстрагируют этилацетатом (3 х 50 мл) и органические слои промывают рассолом и сушат(MgSO4). После удаления растворителя, остаток очищают с помощью флэш хроматографии (силикагель, гексан:этилацетат/4:1), что позволяет получить названное соединение в виде желтого твердого вещества (1 г, 15%); т.пл. 93-94 С; 1 НЯМР (CDCl3)7,70 (м, 1 Н), 7,33 (дд, 1 Н, J=9,0,2,3 Гц), 6,70 (д, 1 Н, J=9,1 Гц), 6,45 (широкий с,2 Н); MS (ESI) м/е 222 (М-Н, 100%), 224 (М-Н,33%). Пример 47. 6-Хлор-4-метил-4-трифторметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 1-(2-амино-5-хлорфенил)2,2,2-трифторэтанона путем добавления метилмагнийбромида с последующей обработкой полученного карбинола 1,1'-карбонилдиимидазолом в соответствии с примером 2. Белое твердое вещество: т.пл. 210-216 С; 1 Н-ЯМР (ДМСОd6)10,91 (широкий с, 1 Н, D2O заменяемый),7,64 (д, 1 Н, J=1,6 Гц), 7,49 (дд, 1 Н, J=8,6, 2,3 Гц), 6,95 (д, 1H, J=8,6 Гц), 1,91 (с, 3 Н); 19F-ЯМР(0,13 г, 0,9 ммоль), фосфата калия (0,23 г, 1,1 ммоль) и никель (II) (дифенилфосфино) ферроценилдихлорида (52 мг, 0,076 ммоль) в безводном диоксане обрабатывают током азота для удаления кислорода и нагревают при 95 С в токе азота 48 ч. Затем добавляют другие порции 3-метоксифенил бороновой кислоты (0,13 г, 0,9 ммоль) и никель (II) (дифенилфосфино)ферроценилдихлорида (52 мг, 0,076 ммоль) и реакционный раствор нагревают при 95 С в токе азота 48 ч. Реакционный раствор охлаждают до комнатной температуры. Добавляют насыщенный водный раствор хлорида аммония (30 41 мл) и этилацетат (50 мл). Органические слои отделяют и водный слой экстрагируют этилацетатом (3 х 20 мл). Объединенные органические слои промывают рассолом и сушат (MgSO4). После удаления растворителя, остаток очищают с помощью флэш-хроматографии (силикагель,гексан: этилацетат/4:1), что позволяет получить названное соединение в виде белого твердого вещества (50 мг, 20%): т.пл. 178-179 С; 1H-ЯМР(0,095 г, 0,14 ммоль) и фосфата калия (0,59 г,2,79 ммоль) в диоксане (10 мл) подвергают обработке током азота для удаления кислорода в течение 15 мин при 50 С и затем нагревают при 95 С 48 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют этилацетат (100 мл). Органические слои промывают дважды водным раствором хлорида аммония (30 мл), 1 раз рассолом (30 мл), и сушат над сульфатом магния. Остаток очищают с помощью флэш-хроматографии (силикагель, 40% этилацетат/гексан), что дает 7-(3-метоксифенил)-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-он(0,090 г, 35%) в виде прозрачного масла. Масло растирают с эфиром (25 мл), что дает белое твердое вещество: т.пл. 167-168 С; 1H-ЯМРC17H17NO3: С, 72,07; Н, 6,05; N, 4,94. Найдено: С, 71,59; Н, 6,08; N, 4,79. Пример 50. 6-(3-Ацетилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)бензонитрил (0,25 г,0,9 ммоль) растворяют в ТГФ (10 мл) и охлаждают до 0 С. К этому раствору добавляют метилмагнийбромид (3,0 М в эфире, 1,8 мл, 5,4 ммоль) и реакционную смесь нагревают при кипении с обратным холодильником в токе азота. По завершении реакции реакционную смесь гасят с помощью 1N водного раствора НСl. Затем охлаждают до комнатной температуры, экстрагируют этилацетатом (100 мл), сушат надMgSO4 и концентрируют. Очистка полученного остатка с помощью хроматографии (силикагель,50% этилацетат/гексан) дает 6-(3-ацетилфенил)4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2 004512 42 он в виде белого твердого вещества (0.031 г,12%): т.пл. 178-179 С; 1H-ЯМР (СDСl3)8,15(0,77 г, 2,8 ммоль), триметилсилилазида (0,68 г,5,6 ммоль), и дибутилоксида олова (0,071 г, 0,28 ммоль) в диоксане (20 мл) нагревают с обратным холодильником в токе азота. По завершении реакции диоксан удаляют, органику переносят в этилацетат (100 мл) и промывают раствором NaHCO3 (100 мл). Водный слой подкисляют 1N водным раствором НСl и экстрагируют этилацетатом (100 мл). Органический слой сушат над MgSO4 и концентрируют. Кристаллизация из эфира (20 мл) дает 4,4-диметил-6-[3-(1 Нтетразол-5-ил)фенил]-1,4-дигидробензо[d][1,3]оксазин-2-он в виде светло-желтого твердого вещества (0,23 г, 26%): т.пл. 238-240 С; 1H-ЯМР(4,4-дициклопропил-1,4-дигидро-2-оксо 2 Н-3,1-бензоксазин-6-ил)бороновую кислоту получают из 2-амино-5-бромбензойной кислоты в соответствии с примерами 1, 2 и 4. Белое твердое вещество: т.пл. 240-242 С; 1H-ЯМР(ДМСО-d6)10,13 (с, 1 Н), 8,01 (с, 2 Н), 7,85 (с,1 Н), 7,64 (д, 1 Н, J=7,9 Гц), 6,77 (д, 1H, J=7,9 Гц),1,38 (м, 2 Н), 0,52 (м, 2 Н), 0,39 (м, 4 Н), 0,22 (м,2 Н). Названное соединение получают согласно способу В из (4,4-дициклопропил-1,4-дигидро 2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 4-бром-2-тиофен карбонитрила. Белое(ESI) м/e 335 ([М-Н]-, 100%); Анализ. Вычислено C19H16N2O2S: С, 67,84; Н, 4,79; N, 8,33. Найдено: С, 64,92; Н, 4,66; N, 7,71. Пример 54. 6-(3-Бром-5-фторфеннл)-4,4 дициклопропил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно способу В из (4,4 дициклопропил-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил) бороновой кислоты и 1,3 дибром-5-фторбензола. Белое твердое вещество: т.пл. 228-229 С; 1H-ЯМР (ДМСО-d6)10,3 (с,1H), 7,76-7,72 (м, 2 Н), 7,65 (дд, 1H, J=8,32, 1,74 Гц), 7,60 (д, 1H, J=10,36 Гц), 7,51 (д, 1H, J=8,3 Гц), 6,93 (д, 1H, J=8,31 Гц), 1,63-1,54 (м, 2 Н),0,58-0,41 (м, 6 Н), 0,30-0,28 (м, 2 Н); MS (APCI) м/е 402/404 ([М-Н]-, 100%); Анализ. Вычислено(0) (0,07 г, 0,06 ммоль) в ДМФА (20 мл) подвергают продувке азотом в течение 15 мин при 50 С и затем нагревают при 85 С 1 ч. После охлаждения до комнатной температуры реакционную смесь выливают в NH4Cl (100 мл) и экстрагируют этилацетатом (3 х 50 мл). Органические слои промывают рассолом, сушат над MgSO4 и концентрируют. Полученное прозрачное масло растирают с эфиром (30 мл), что дает белое твердое вещество. Перекристаллизация твердого вещества из этилацетата дает 3-(4,4 дициклопропил-2-оксо-1,4-дигидро-2 Н-бензо[d](с, 1 Н), 7,73 (с, 1 Н), 7,68-7,62 (м, 3 Н), 6,97 (д,1 Н, J=8,0 Гц), 1,68 (с, 6 Н); MS (ESI) м/е 414 ([МН]-, 100%); Анализ. Вычислено C17H13BrF3NO3: С, 49,06; Н, 3,15; N, 3,37. Найдено: С, 49,16; Н,3,05; N, 3,30. Пример 58. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-метилбензонитрил. Получают из 6-(3-бром-5-метилфенил)-4,4 диметил-1,4-дигидробензо-[d][1,3]оксазин-2-она согласно методике по примеру 55. Белое твердое вещество: т.пл. 256-258 С; 1H-ЯМР (ДМСОd6) 10,4 (с, 1 Н), 7,99 (с, 1 Н), 7,86 (с, 1 Н), 7,677,62 (м, 3 Н), 6,97 (д, 1 Н, J=8,11 Гц), 2,42 (с, 3 Н),1,68 (с, 6 Н). MS (APCI) м/е 293 ([М+Н]+, 100%); Анализ. Вычислено C18H16N2O2: С, 73,96; Н,5,52; N, 9,58. Найдено: С, 73,26; Н, 5,46; N, 9,24. Пример 59. 3-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-трифторметоксибензонитрил. Получают из 6-(3-бром-5-трифторметоксифенил)-4,4-диметил-1,4-дигидробензо[d]C18H13F3N2O3: С, 59,67; Н, 3,62; N, 7,73. Найдено: С, 59,63; H, 3,55; N, 7,58. Пример 60. 6-(3,5-Дифторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно способу В из (4,4 диметил-1,4-дигидро-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1-бром-3,5 дифторбензола. Белое твердое вещество: т.пл. 218-219 С; 1 Н-ЯМР (ДМСО-d6)10,4 (с, 1 Н),7,67-7,65 (м, 2 Н), 7,49 (д, 2 Н, J=7,73 Гц), 7,19 (т,1 Н, J=9,29 Гц), 6,96 (д, 1 Н, J=8,88 Гц), 1,7 (с,6 Н); MS (APCI) м/е 290 ([М+Н]+, 100%). Анализ. Вычислено C16H13F2NO2: С, 66,43; Н, 4,53;N, 4,84. Найдено: С, 66,01; Н, 4,46; N, 4,67. Пример 61. 6-(3,5-Дихлорфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 6-бром-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она и 3,5-дихлорфенилбороновой кислоты согласно способу А. Белое твердое вещество: т.пл. 245-246 С; 1HЯМР (ДМСО-d6)10,4 (с, 1 Н), 7,77 (м, 2 Н),7,67-7,64 (м, 2 Н), 7,56 (широкий с, 1 Н), 6,96 (д,1 Н, J=7,98 Гц), 1,7 (с, 6 Н); MS (El) м/е 321([М+Н]+,40%). Анализ. Вычислено С 16H13 Сl2NО 2: С, 59,32; Н, 4,11; N, 4,32. Найдено: С, 59,13; Н, 4,29; N, 4,17. Пример 62. 6-(3,5-Бис-трифторметил-фенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 6-бром-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она и бистрифторметилфенилбороновой кислоты согласно способу А. Белое твердое вещество: т.пл. 258-260 С; 1H-ЯМР (ДМСО-d6)10,4 (с, 1 Н),8,35 (с, 2 Н), 8,05 (с, 1 Н), 7,79-7,76 (м, 2 Н), 7,01(5 г, 57 ммоль) в DME (50 мл) и воде (25 мл) подвергают продувке азотом в течение 15 мин при 50 С и затем нагревают при 85 С 1 ч. Реакцию охлаждают до комнатной температуры и добавляют этилацетат (100 мл). Органические слои дважды промывают водным раствором хлорида аммония (100 мл) и 1 раз рассолом (100 мл), сушат над сульфатом магния и концентрируют. Очистка с помощью хроматографии (силикагель, 40% этилацетат/гексан) дает 3-(4,4 диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3] оксазин-6-ил)-5-метоксибензонитрил в виде белого твердого вещества (0,69 г, 53%): т.пл. 254-255 С; 1 Н-ЯМР (ДМСО-d6)10,4 (с, 1 Н),7,84 (с, 1 Н), 7,67-7,61 (м, 2 Н), 7,55 (широкий с,1 Н), 7,4 (широкий с, 1 Н), 6,99 (д, 1 Н, J=7,94 Гц),3,88 (с, 3 Н), 1,67 (с, 6 Н); MS (El) м/е 308([М+H]+, 30%); Анализ. Вычислено C18H16N2O3: С, 68,13; Н, 5,40; N, 8,83. Найдено: С, 68,03; Н,5,22; N, 8,46. Пример 64. 6-(3-Фторфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 6-бром-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она и 1-бром-3 фторбензола согласно способу А. Светложелтое твердое вещество: т.пл. 181-182 С; 1HЯМР (ДМСО-d6)10,4 (с, 1 Н), 7,62-7,44 (м, 5 Н),7,16 (т, 1 Н, J=2,22 Гц), 6,97 (д, 1 Н, J=8,83), 1,67(ДМСО-d6)10,4 (с, 1 Н), 7,92 (дд, 1 Н, J=7,13,2,19 Гц), 7,71-7,66 (м, 1 Н), 7,60-7,57 (м, 2 Н),7,49 (т, 1 Н, J=8,95 Гц), 6,96 (д, 1 Н, J=8,01 Гц),1,67 (с, 6 Н); MS (EI) м/е 305 ([М+Н]+, 20%); Анализ. Вычислено C16H13ClFNO2: С, 62,86; Н,4,29; N, 4,58. Найдено: С, 62,52; Н, 4,45; N, 4,42. Пример 66. 3-(1-Диэтоксиметил-4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил. Смесь 3-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-5 фторбензонитрила (0,25 г, 0,84 ммоль) и триэтилортоформиата (50 мл) нагревают при 160 С 12 ч. Избыток триэтилортоформиата удаляют в вакууме и очищают с помощью хроматографии(силикагель, 20% этилацетат/гексан), что дает 3(1-диэтоксиметил-4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрил (0,116 г, 33%) в виде белого твердого вещества: т.пл. 123-124 С; 1 Н-ЯМР (ДМСО-d6)7,97 (д, 1 Н, J=8,68 Гц), 7,66 (широкий с, 1 Н),7,53-7,44 (м, 2 Н), 7,35-7,32 (м, 2 Н), 6,65 (с, 1 Н),3,88-3,78 (м, 2 Н), 3,73-3,61 (м, 2 Н), 1,77 (с, 6 Н),1,27 (т, 6 Н, J=7,05 Гц); MS (ESI) м/е 295 ([М-Н]-,100%, более низкий MW ионного содержания с потерей диэтилацеталя). Анализ. Вычислено С 22 Н 23FN2O4: С, 66,32; Н, 5,82; N, 7,03. Найдено: С, 65,89; Н, 5,92; N, 6,66. Пример 67. 3-Фтор-5-(1-метоксиметил-4,4 диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрил. Раствор 3-(4,4-диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрила (0,150 г, 0,51 ммоль) в ДМФА (5 мл) обрабатывают при комнатной температуре гидридом натрия (0,061 г, 1,53 ммоль). Смесь перемешивают 30 мин и обрабатывают хлорметилметиловым эфиром (0,062 г, 7,7 ммоль). По завершении реакции реакционную смесь гасят водой (25 мл) и экстрагируют этилацетатом(силикагель, 25% этилацетат/гексан), что дает 3 фтор-5-(1-метоксиметил-4,4-диметил-2-оксо 1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)бензонитрил в виде белого твердого вещества (0,11 г, 65%). т.пл. 169-171 С; 1 Н-ЯМР (ДМСО-d6)8,17 (широкий с, 1 Н), 8,03 (дт, 1 Н, J=10,4, 2,13 Гц), 7,85-7,77 (м, 3 Н), 7,31 (д, 1 Н, J=8,49 Гц),5,33 (с, 2 Н), 3,35 (с, 3 Н), 1,7 (с, 6 Н); MS (АРСI) м/е 341 ([М+Н]+, 50%); Анализ. Вычислено С 19 Н 17FN2 О 3: С, 65,32; Н, 5,19; N, 8,02. Найдено: С, 64,92; Н, 4,96; N, 7,73. Пример 68. Диэтиловый эфир фосфорной кислоты 6-(3-циано-5-фторфенил)-4,4-диметил 4 Н-бензо[d][1,3]оксазин-2-илового эфира. К раствору 3-(4,4-диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрила (0,25 г, 0,84 ммоль) в ДМФА (5 мл) добавляют гидрид натрия (60% в масле, 47 0,101 г, 2,53 ммоль). После перемешивания в течение 30 мин, реакционную смесь обрабатывают диэтилхлорфосфатом (0,22 мл, 1,52 ммоль). По завершении реакции реакционный раствор гасят водой (25 мл) и продукт экстрагируют этилацетатом (2 х 50 мл), сушат над MgSO4 и концентрируют. Остаток очищают с помощью хроматографии (силикагель, 25% этилацетат/гексан), что дает диэтилового эфира фосфорной кислоты 6-(3-циано-5-фторфенил)-4,4 диметил-4 Н-бензо[d][1,3]оксазин-2-иловый эфир в виде белого твердого вещества (0,064 г,18%): т.пл. 196-198 С; 1H-ЯМР (ДМСО-d6)8,19 (широкий с, 1 Н), 8,05 (д, 1 Н, J=10,4 Гц),7,9-7,8 (м, 3 Н), 7,51 (д, 1H, J=8,41 Гц), 4,33-4,41N-(трет-Бутоксикарбониламино)-3-фторбензойную кислоту (Takagishi et al. Synlett 4,360-2 (1992); т.пл. 159-161 С) освобождают от защиты при использовании трифторуксусной кислоты, что дает о-аминобензойную кислоту,которую обрабатывают метилмагнийбромидом,что позволяет получить о-аминодиметилкарбинол. о-Амино диметилкарбинол (2,23 г, 13,2 ммоль) обрабатывают 1,1'-карбонилдиимидазолом (2,8 г, 17,2 ммоль) в ТГФ (20 мл) при 50 С в течение 12 ч. По завершении реакции ее охлаждают до комнатной температуры и добавляют этилацетат (100 мл). Органический слой промывают 10% водным раствором НСl (2 х 25 мл), сушат над MgSO4 и концентрируют. Остаток очищают с помощью хроматографии (силикагель, 10% этилацетат/гексан), что дает 8-фтор 4,4-диметилдигидробензо[d][1,3]оксазин-2-он в виде белого твердого вещества (1,3 г, 50%): т.пл. 127-128 С; 1H-ЯМР (ДМСО-d6)10,4 (с,1 Н), 7,22-7,12 (м, 2 Н), 7,07-7,00 (м, 2 Н), 1,6 (с,6 Н); MS (APCI) м/е 196 ([М+Н]+, 100%); Анализ. Вычислено C10H10FNO2:C, 61,53; H, 5,16; N,7,18. Haйдено: С, 61,27; Н, 5,37; N, 7,02. Пример 71. 6-(3-Хлор-4-фторфенил)-8 фтор-4,4-диметил-1,4-дигидробензо[d][1,3]оксaзин-2-он. 48 К раствору 8-фтор-4,4-диметилдигидробензо[d][1,3]оксазин-2-она (0,15 г, 0,77 ммоль) в уксусной кислоте (5 мл) добавляют по каплям раствор брома (0,37 г, 2,31 ммоль) в уксусной кислоте (5 мл) в токе азота при комнатной температуре. После перемешивания в течение 10 мин, смесь концентрируют и полученный остаток очищают на колонке с силикагелем (гексан:этилацетат/4:1), что позволяет получить 6 бром-8-фтор-4,4-диметилдигидробензо[d][1,3] оксазин-2-он в виде грязно-белого твердого вещества (0,176 г, 84%), которое используют на следующей стадии без дополнительной очистки. Смесь 6-бром-8-фтор-4,4-диметилдигидробензо[d][1,3]оксазин-2-она (0,176 г, 0,64 ммоль),4-фтор-3-хлорфенилбороновой кислоты (0,15 г,0,84 ммоль), тетракис(трифенилфосфин)палладия (0) (0,04 г, 0,032 ммоль) и карбоната натрия(0,20 г, 1,92 ммоль) в DME (10 мл) и воде (5 мл) подвергают продувке азотом в течение 15 мин при 50 С и затем нагревают при 85 С 1 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют этилацетат (100 мл). Органические слой промывают дважды водным раствором хлорида аммония (100 мл) и один раз рассолом (100 мл), сушат над сульфатом магния и концентрируют. Остаток очищают с помощью хроматографии (силикагель, 25% этилацетат/гексан), что дает 6-(3-хлор-4-фторфенил)-8 фтор-4,4-диметил-1,4-дигидробензо[d][1,3]-оксазин-2-он в виде белого твердого вещества(0,17 г, 0,24 ммоль) и иодида меди (I) (0,05 г,0,28 ммоль) в триэтиламине (20 мл) нагревают в токе азота при 80 С 3 ч. Реакционную смесь 49 охлаждают до комнатной температуры и растворитель удаляют. Остаток переносят в этилацетат (50 мл) и промывают 1N водным раствором НСl (3 х 20 мл), а также рассолом (20 мл). Органические слой отделяют и сушат (MgSO4). После удаления растворителя, остаток очищают с помощью хроматографии на силикагеле (гексан:этилацетат/3:1), что позволяет получить названное соединение в виде белого твердого вещества (0,77 г, 92%); т.пл. 240-242 С; 1H-ЯМРC21H23NO2SiO2 ЕtOАс: С, 71,32; Н, 6,75; N, 3,82. Найдено: С, 71,08; Н, 6,64; N, 3,82. Пример 74. 6-(3-Этинилфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Смесь 4,4-диметил-6-(3-триметилсиланилэтанилфенил)-1,4-дигидробензо[d][1,3]оксазин 2-она (0,7 г, 2 ммоль) и карбоната калия (2 г,избыток) в безводном метаноле перемешивают при комнатной температуре в токе азота 4 ч. Смесь обрабатывают водой со льдом (100 мл) и экстрагируют этилацетатом (2 х 80 мл). Органические слои промывают рассолом и сушат надMgSO4. Растворитель удаляют и названное соединение получают в виде грязно-белого твердого вещества (0,4 г, 72%): т.пл. 171-172 С; 1 НЯМР (ДМСО-d6)10,3, (с, 1 Н), 7,78 (широкий с,1H), 7,72-7,69 (м, 1H), 7,6-7,57 (м, 2 Н), 7,49-7,43(с, 6 Н); MS (El) м/e 277 ([М+], 100%); Анализ. Вычислено C18H15NO20,2 EtOAc: С, 76,56; Н,5,67; N, 4,75. Найдено: С, 76,34; Н, 5,4; N, 4,7. Пример 75. 3-[3-(4,4-Диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)фенил] пропилнитрил. К перемешиваемой смеси ДМСО, ацетонитрила и воды (9 мл/3 мл/0,5 мл) при комнатной температуре в токе азота добавляют цианид меди (0,193 г, 2,2 ммоль), иодид натрия (11 мг,0,072 ммоль), и 6-(3-этинилфенил)-4,4-диметил 1,4-дигидробензо[d][1,3]оксазин-2-он (0.2 г, 0,72 ммоль). Затем к полученной выше смеси добавляют по каплям хлортриметилсилан. После добавления смесь нагревают при 50 С 72 ч. Затем реакционную смесь охлаждают до комнатной температуры и обрабатывают 0,5N водным холодным раствором НСl (50 мл). Полученный осадок собирают на фильтре и промывают водой. Твердое вещество очищают на колонке с силикагелем (гексан:этилацетат/2:1), что дает названное соединение в виде грязно-белого твердого вещества (10 мг, 4,6%): т.пл. 212213 С; 1H-ЯМР (CDCl3-d6)7,96 (с, 1H), 7,77 (с,1H), 7,65 (д, 1H, J=7,8 Гц), 7,60 (д, 1H, J=7,69 Гц), 7,51 (д, 1H, J=7,77 Гц), 7,45 (дд, 1H, J=8,67,2,21 Гц), 7,31 (д, 1H, J=1,55 Гц), 6,91 (д, 1H,J=8,19 Гц), 1,8 (с, 6 Н); MS (EI) м/е 302 ([M+],30%). 51 Анализ. Вычислено C18H13N3O21,65 Н 2 О: С, 64,92; Н, 4,93; N, 12,62. Найдено: С, 64,74; Н,4,69; N, 12,32. Пример 81. 4,4-Диметил-6-(3-тиазол-2-илфенил)-1,4-дигидробензо[d][1,3]оксазин-2-он. Смесь 6-(3-бромфенил)-4,4-диметил-1,4 дигидробензо[d][1,3]оксазин-2-она (0,25 г, 0,75 ммоль), три-н-бутилтиазол-2-ил олова (0,5 г, 1,3 ммоль) в ДМФА (5 мл) дегазуют, чтобы удалить кислород и затем нагревают в токе азота при 90 С 3 ч. Реакционную смесь охлаждают до комнатной температуры и обрабатывают водой со льдом (70 мл). Добавляют этилацетат (100 мл) и органический слой отделяют, промывают рассолом, и сушат (MgSO4). После удаления растворителя, остаток очищают на колонке с силикагелем (гексан: этилацетат/1:1), что дает названное соединение в виде белого твердого вещества (60 мг, 23%): т.пл. 223-224 С; 1 Н-ЯМРC15H13BrN2O2: С, 54,07; Н, 3,93, N, 8,41. Найдено: С, 54,15; Н, 3,89; N, 8,31. Пример 85. 6-(5-Бром-1-оксипиридин-3 ил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Смесь 6-(5-бромпиридин-3-ил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-она (0,34 г, 1 ммоль), пероксида водорода (30%, 5 мл),уксусной кислоты (5 мл) нагревают при 60 С 3 ч. Реакционную смесь охлаждают до комнатной температуры и нейтрализуют путем добавления холодного насыщенного раствора бикарбоната натрия. Полученный белый осадок собирают на фильтре, промывают дистиллированной водой и сушат, что позволяет получить названное соединение в виде белого твердого вещества (0,35 г, 100%): т.пл. 157-159 С; 1 Н-ЯМР (ДМСО-d6)10,4 (с, 1 Н), 8,69 (с, 1 Н), 8,53 (с, 1 Н), 7,99 (с,1 Н), 7,73-7,69 (м, 2 Н), 6,97 (д, 1 Н, J=8,18 Гц), 1,7([М+Н]+,100%); Анализ. Вычислено С 15H13 ВrN2 О 32,5 H2O: С, 45,70; Н, 4,60; N, 7,11. Найдено: С, 45,34; Н, 4,64; N, 7. Пример 86. Трет.-бутиловый эфир 6-(3 циано-5-фторфенил)-4,4-диметил-2-оксо-4 Нбeнзo[d][1,3]оксазин-1-карбоновой кислоты. Смесь 3-(4,4-диметил-2-оксо-1,4-дигидро 2 Н-бензо[d][1,3]оксазин-6-ил)-5-фторбензонитрила (0,3 г, 1 ммоль), ди-трет-бутилдикарбоната (0,33 г, 1,5 ммоль), и DMAP (50 мг) в безводном ацетонитриле перемешивают при комнатной температуре в токе азота в течение 4 мин. Реакционную смесь промывают 1N водным раствором НСl, рассолом, сушат (MgSO4). После удаления растворителя, названное соединение получают в виде белого твердого вещества (0,25 г, 63%); т.пл. 139-140 С; 1H-ЯМР 53 получают из 6-бром-8-фтор-4,4-диметилдигидробензо[d][1,3]оксазин-2-она при использовании методики по примеру 4. Названное соединение получают из 8 фтор-(1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 4-бром 2-цианотиофена согласно способу В. Белое твердое вещество: т.пл. 250-251 С; 1H-ЯМР([М+], 60%). Пример 90. 5-(4,4-Диметил-2-оксо-1,4 дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)тиофен 3-карбонитрил. Получают согласно способу В из (1,4-дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин 6-ил)бороновой кислоты и 2-бром-4-тиофенкарбонитрила. Грязно-белое твердое вещество: т.пл. 255-260 С; 1 Н-ЯМР (ДМСО-d6)10,36 (с, 1 Н), 8,48 (д, 1H, J=1,1 Гц), 7,88-7,87 (д,1H, J=1,3 Гц), 7,63 (д, 1H, J=1,9 Гц), 7,56-7,54(дд, 1H, J=8,0, 2,0 Гц), 6,93 (д, 1H, J=8,1 Гц),1,64 (с, 6 Н); MS (-ESI) м/е 283 (М-Н)-. Пример 91. 2-(4,4-Димeтил-2-oкco-1,4 дигидрo-2H-бeнзo[d][1,3]oкcaзин-6-ил)тиoфeн 3-карбонитрил. Получают согласно способу В из (1,4 дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 2-бром-3 тиофенкарбонитрила. Грязно-белое твердое вещество: т.пл. 200-202 С; 1 Н-ЯМР (ДМСО-d6)10,49 (с, 1H), 7,75 (м, 1H), 7,63 (д, 1H, J=2,2 Гц),7,59 (м, 1H), 7,50 (м, 1H), 7,02 (д, 1H, J=8,1 Гц),1,63 (с, 6 Н); MS (-ESI) м/е 283 (М-Н)-. Пример 92. 6-(1,2,4-тиадиазол-3-илфенил)4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2 он. Смесь 5-[3-бромфенил][1,3,4]оксатиазол-2 он (21,25 г, 82,3 ммоль), этилцианоформиата(32,5 мл, 329 ммоль) в о-ксилоле (500 мл) нагревают до 150 С в течение 60 ч. Затем растворитель удаляют из реакционной смеси, продукт перекристаллизовывают из этанола, что дает этиловый эфир 3-[3-бромфенил][1,2,4]тиадиазол-5-карбоновой кислоты в виде белых кристаллов (17,5 г, 68%): т.пл. 87-90 С; 1H-ЯМР(т, 1H, J=7,9 Гц), 4,55 (кв, 2 Н, J=7,1 Гц), 1,48 (т,3 Н, J=7,1 Гц); MS +)APCI) [M+H]+, м/е 313/315. Анализ. Вычислено C11H9BrN2O2S: С,42,19; Н, 2,90; N, 8,94. Найдено: С, 41,81; Н,3,08; N, 8,78. Смесь этилового эфира 3-[3-бромфенил][1,2,4]тиадиазол-5-карбоновой кислоты(16,8 г, 53,5 ммоль), гидроксида натрия (2,4 г,58,8 ммоль), дистиллированной воды (120 мл), и этанола (20 мл) нагревают до 100 С в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют концентрированную соляную кислоту (5,1 мл) и реакционную смесь вновь нагревают до 100 С в течение 3 ч. Раствор охлаждают до комнатной температуры и экстрагируют диэтиловым эфиром (3 х 150 мл). Объединенные органические слои промывают дистиллированной водой (3 х 100 мл) и сушат надMgSO4. Затем растворитель удаляют, получают 3-[3-бромфенил][1,2,4]тиадиазол в виде белых игл (12,7 г, 99%): т.пл. 69-71 С; 1 Н-ЯМРH-ЯМР (ДМСО-d6)10,40 (с, 1 Н), 10,36 (с,1 Н), 8,49 (с, 1 Н), 8,23 (д, 1 Н, J=7,7 Гц), 7,83 (д,1 Н, J=7,9 Гц), 7,66-7,61 (м, 3 Н), 7,02 (т, 1 Н,J=4,4 Гц), 1,70 (с, 6 Н); MS +)АРСI) [M+H]+,м/е 338. Пример 93. 6-(3-Фтор-5-тиофен-3-илфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают из 6-(3-бром-5-фторфенил)-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-она и 3-тиофенбороновой кислоты согласно способу В. Коричневато-желтое твердое вещество: т.пл. 200-203 С; 1 Н-ЯМР (CDCl3)8,62 (с, 1 Н), 7,53 55 тетракис(трифенилфосфин)палладия (0) (96 мг,0,08 ммоль) в толуоле (40 мл) перемешивают в токе азота 25 мин. К раствору последовательно добавляют 1-трет-бутоксикарбонилпиррол-2-бороновую кислоту (1,4 г, 7,0 ммоль) в абсолютном этаноле (10 мл) и карбонат калия (0,94 г, 7,0 ммоль) в воде (10 мл). Смесь нагревают при 80 С в течение 16 ч, после чего оставляют охлаждаться до комнатной температуры. Реакционную смесь выливают в водный насыщенный раствор бикарбоната натрия (100 мл) и экстрагируют этилацетатом (3 х 100 мл). Органические слои объединяют,промывают водой (100 мл) и рассолом (50 мл) и сушат над сульфатом магния. Раствор фильтруют и концентрируют в вакууме, и остаток очищают с помощью колоночной флэш хроматографии на силикагеле (30% этилацетат/гексан), что дает названное соединение в виде грязно-белого порошка(1 мл) при комнатной температуре добавляют нитрат серебра (0,37 г, 2,1 ммоль). После 5 мин добавляют ацетилхлорид (0,15 мл, 2,0 ммоль) в ацетонитриле (3 мл) и раствор оставляют при перемешивании на 2 ч. Реакционную смесь выливают в воду (50 мл) и экстрагируют этиловым эфиром (2 х 50 мл). Органические слои объединяют,промывают рассолом (30 мл) и сушат над сульфатом магния. Раствор фильтруют, концентрируют в вакууме и остаток очищают колоночной флэш хроматографией на силикагеле (30% этилацетат/гексан), что дает желтое масло, которое кристаллизуют из 5% этилацетата/гексана, что приводит к названному соединению в виде ярко желтого порошка (350 мг, 45%). т.пл. 125 С. 1H ЯМР 56 г, 1,8 ммоль) помещают в круглодонную колбу объемом 25 мл, закрытую резиновой перегородкой и оснащенную вводом азота и иглой, позволяющей отводить газ. Сохраняли сильный ток азота, пока колбу помещали на масляную баню и нагревали на масляной бане до 180 С. После 10 мин нагревания при этой температуре, колбу удаляли с масляной бани и давали охладиться до комнатной температуры. Коричневый остаток вымывали в большую колбу с помощью смеси дихлорметан/этилацетат и адсорбировали на малом количестве силикагеля. Очищали при помощи колоночной флэш хроматографии на силикагеле (60% этилацетат/гексан) получалиC14H13N3O4: С, 58,53; Н, 4,56; N, 14,63. Найдено: С, 58,25; Н, 5,10; N, 12,57. Пример 97. 4,4-Диметил-6-(1H-пиррол-2 ил)-1,4-дигидробензо[d][1,3]оксазин-2-он. 2-(4,4-диметил-2-оксо-1,4-дигидро-2 Нбензо[d][1,3]оксазин-6-ил)пиррол-1-карбоновой кислоты трет.-бутиловый эфир (3,5 г, 10 ммоль) помещают в круглодонную колбу объемом 25 мл, закрытую резиновой перегородкой и оснащенную вводом азота и иглой, позволяющей отводить газ. Сохраняли сильный ток азота, пока колбу помещали на масляную баню и нагревали на масляной бане до 180 С. После 10 мин нагревания при этой температуре, колбу удаляли с масляной бани и давали охладиться до комнатной температуры. Коричневый остаток вымывали в большую колбу с помощью смеси дихлорметан/этилацетат и адсорбировали на малом количестве силикагеля. Очистка при помощи колоночной флэш хроматографии на силикагеле (60% этилацетат/гексан) приводит к названному соединению в виде твердого вещества зеленого цвета (2 г, 80%): т.пл. 202 С+)АРСI) м/е 243[М+Н]+. Анал. вычисл. для С 14 Н 14N2 О 2: С, 69,41; Н, 5,82; N, 11,56. Найдено: С, 69,20; Н, 5,96; N, 11,29. Пример 98. 4,4-Диметил-6-(1-метил-1 Нпиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин 2-он. К смеси 4,4-диметил-6-(1 Н-пиррол-2-ил)1,4-дигидробензо[d][1,3]оксазин-2-она (1,5 г, 6,2 ммоль) в диметилформамиде (20 мл) при комнатной температуре последовательно добавляют карбонат калия (4,28 г, 31 ммоль) и раствор иодистого метила (1,16 мл, 19 ммоль) в диметилформамиде (5 мл). Через 1 ч реакционную смесь вскипятили. Затем реакцию охладили до ком 57 натной температуры, выливали в воду (50 мл) и продукт экстрагировали этилацетатом (2 х 50 мл). Органические слои объединяли, промывали рассолом (30 мл), высушивали над MgSO4,фильтровали и концентрировали в вакууме. Очищали при помощи колоночной флэш хроматографии на силикагеле (40% этилацетат/гексан) и получали названное соединение в виде грязно-белого порошка (0,5 г, 31%): т.пл. 230 С. 1H ЯМР (CDCl3)1,71 (с, 6 Н), 3,42 (с,3 Н), 6,31 (дд, 1 Н, J=2,9, 5,9 Гц), 6,47 (м, 1 Н),6,88 (м, 1 Н), 6,94 (д, 1H, J=8,6 Гц), 7,26 (д, 1 Н,J=2,2 Гц), 7,41 (дд, 1H, J=2,2, 8,6 Гц), 8,43 (широкий с, 1 Н). MS -) ESI) м/е 255 [М-Н]-. Анализ. Рассчитано С 15 Н 16N2 О 2: С, 70,29; Н, 6,29, N,10,93. Найдено: С, 68,59; Н, 6,16; N, 10,49. Пример 99. 4,4-Диметил-6-(1-метил-5-нитро-1H-пиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин-2-он. К раствору 4,4-диметил-6-(1-метил-1 Нпиррол-2-ил)-1,4-дигидробензо[d][1,3]оксазин 2-она (0,3 г, 1,2 ммоль) в ацетонитриле (20 мл) добавляют нитрат серебра (0,21 г, 1,26 ммоль). Раствор охлаждают до -78 С и обрабатывают раствором ацетилхлорида (0,08 мл, 1,2 ммоль) в ацетонитриле (1 мл). Реакционной смеси дают нагреться до комнатной температуры. Через 1 ч реакционную смесь выливают в воду (50 мл) и экстрагируют этиловым эфиром (2 х 50 мл). Органические слои объединяют, промывают рассолом (30 мл), сушат над сульфатом магния,фильтруют и концентрируют в вакууме. Очистка с помощью колоночной флэш хроматографии на силикагеле (40% этилацетат/гексан), дает названное соединение (5 мг, 1%) в виде желтого твердого вещества, т.пл. 180-185 С. 1 Н ЯМР+) APCI) м/e 302 [M+H]+. Пример 100. 5-Бром-4-этилтиофен-2-карбоксальдегид. Получают из 2-бром-3-этилтиофена аналогично примеру 19. 1H-ЯМР (ДМСО-d6)9,82 (с,1 Н), 7,81 (с, 1 Н), 2,5 (кв, 2 Н, J=7,4 Гц), 1,15 (т,3 Н, J=7,5 Гц). Пример 101. 5-Бром-4-этилтиофен-2 карбонитрил. Получают из 5-бром-4-этилтиофен-2 карбоксальдегида при использовании процесса,аналогичного примеру 18. ИК (КВr) 2221 см-1; 1 Н-ЯМР (ДМСО-d6)7,87 (с, 1 Н), 2,55 (кв, 2 Н,J=7,3 Гц), 1,18 (т, 3 Н, J=7,6 Гц). MS (El) м/е 215/217 (М+). Пример 102. 5-Бром-4-н-пропилтиофен-2 карбоксальдегид. Получают из 2-бром-3-н-пропилтиофена аналогично примеру 19. 1 Н-ЯМР (ДМСО-d6)9,82 (с, 1 Н), 2,6-2,5 (м, 2 Н), 1,65-1,51 (м, 2 Н), 1,0 58 Пример 103. 5-Бром-4-н-пропилтиофенкарбонитрил. Получают из 5-бром-4-н-пропилтиофен-2 карбоксальдегида при использовании процесса,аналогичного примеру 18. 1 Н-ЯМР (ДМСО-d6)7,87 (с, 1 Н), 2,5 (т, 2 Н, J=5,2 Гц), 1,64-1,5 (м,2 Н), 1,91 (т, 3 Н, J=5,1 Гц). MS (ЕI) м/е 229-231. Пример 104. 5-Бром-4-н-бутилтиофенкарбоксальдегид. Получают из 2-бром-3-н-бутилтиофена аналогично процессу по примеру 19. ИК (KВr) 1660 см-1. 1 Н-ЯМР (ДМСО-d6)9,78 (с, 1 Н),7,85 (с, 1 Н), 2,57-2,53 (м, 2 Н), 1,57-1,53 (м, 2 Н),1,32-1,25 (м, 2 Н), 0,88 (т, 3 Н, J=5,2 Гц). MS (El) м/е 246 (М+). Пример 105. 5-Бром-4-Н-бутилтиофенкарбонитрил. Получают из 5-бром-4-н-бутилтиофенкарбоксальдегида при использовании процесса,аналогичного примеру 18. 1H-ЯМР (ДМСО-d6)7,87 (с, 1 Н), 2,58-2,44 (м, 2 Н), 1,65-1,48 (м, 2 Н),1,38-1,23 (м, 2 Н), 0,89 (т, 3 Н, J=5,3 Гц). MS (El) м/е 243 (М+). Пример 106. 3-(1,2-Дигидро-2-оксоспиро[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)бензонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 3 бромбензонитрила. Рыжий порошок: т.пл. 245247 С. 1 Н-ЯМР (ДМСО-d6)10,31 (с, 1 Н), 8,21[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-5 фторбензонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 3-бром 5-фторбензонитрила. Белый порошок: т.пл. 250253 С. ИК (КВr) 2220 см-1. 1 Н-ЯМР (ДМСО-d6)10,34 (с, 1 Н), 8,13 (с, 1 Н), 8,0 (д, 1 Н, J=10,6 Гц), 7,80-7,7 (м, 3 Н), 6,98-6,95 (д, 1 Н, J=8,1 Гц),1,99-1,97 (м, 4 Н), 1,76-1,65 (м, 6 Н), 1,37-1,33 (м,1 Н). MS (El) м/е 336 (М+). Анализ. Вычислено[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2 тиофенкарбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 3-бром 5-цианотиофена. Белые кристаллы: т.пл. 230232 С. ИК (КВr) 2200 см-1. 1H-ЯМР (ДМСО-d6)10,29 (с, 1 Н), 8,49 (с, 1 Н), 8,33 (с, 1 Н), 7,697,63 (м, 2 Н), 6,93-6,91 (д, 1 Н, J=8,2 Гц), 1,99 59 1,87 (м, 4 Н), 1,73-1,64 (м, 5 Н), 1,38-1,31 (м, 1 Н).[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-2 тиофенкарбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 5-цианотиофена рыжий порошок: т.пл. 243245 С. 1 Н-ЯМР (ДМСО-d6)10,41 (с, 1 Н), 7,987,97 (д, 1 Н, J=3,9 Гц), 7,67-7,60 (м, 3 Н), 6,976,94 (д, 1 Н, J=8,3 Гц), 1,98-1,92 (м, 4 Н), 1,741,64 (м, 5 Н), 1,45-1,21 (м, 1 Н). MS (El) м/е 324[4 Н-3,1-бензоксазин-4,1-циклогексан]-6-ил)-4 метил-2-тиофенкарбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 3-метил-5-цианотиофена. Белый порошок: т.пл. 200-203 С. 1H-ЯМР (ДМСО-d6)10,4 (с, 1 Н),7,85 (с, 1 Н), 7,43-7,40 (м, 2 Н), 7,0 (д, 1 Н, J=8,8 Гц), 2,27 (с, 3 Н), 2,00-1,62 (м, 9 Н), 1,42-1,23 (м,1 Н). MS (ЕI) м/е 338 (М+). Анализ. ВычисленоC19H18N2O2S: С, 67,43; Н, 5,36; N, 8,28. Найдено: С, 67,12; Н, 5,45; N, 8,05. Пример 111. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-4-этилтиофен-2-карбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 3-этил-5-цианотиофена. Белые кристаллы; т.пл. 160-162 С. 1H-ЯМР (ДМСО-d6)10,46 (с, 1 Н),7,96 (с, 1 Н), 7,40-7,38 (м, 2 Н), 7,02-6,99 (д, 1 Н,J=8,8 Гц), 2,61 (кв, 2 Н, J=7,5 Гц), 1,64 (с, 6 Н),1,16 (т, 3 Н, J= 7,6 Гц). MS (+) APCI м/е [М+Н]+ 313. Анализ. Вычислено C17H16N2O2S1/4 Н 2O: С, 64,43; Н, 5,25; N, 8,84. Найдено: С, 64,77; Н,5,23; N, 8,68. Пример 112. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-4-н-пропилтиофен-2-карбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 3-н-пропил-5-тиофенкарбонитрила. Белые кристаллы: т.пл. 160-162 С. ИК (КВr) 2220 см-1. 1HЯМР (ДМСО-d6)10,47 (с, 1 Н), 7,93 (с, 1 Н),7,38-7,36 (м, 2 Н), 7,01 (д, 1 Н, J=8,7 Гц), 2,592,48 (м, 2 Н), 1,64-1,51 (м, 2 Н), 0,85 (т, 3 Н, J=7,3 Гц). MS (-ESI) м/е [M-H]- 325. Анализ. Вычислено C18H18N2 О 2S3/4 Н 2 О: С, 63,60; Н, 5,78; N,8,24. Найдено: С, 63,48; Н, 5,59; N, 8,04. 60 Пример 113. 5-(4,4-Диметил-2-оксо-1,4-дигидро-2 Н-бензо[d][1,3]оксазин-6-ил)-4-н-бутилтиофен-2-карбонитрил. Получают согласно способу В из спиро(4,1'-циклогексан-1,4-дигидро-2-оксо-2 Н-3,1 бензоксазин-6-ил)бороновой кислоты и 2-бром 3-н-бутил-5-тиофенкарбонитрила. Белые кристаллы: т.пл. 167-168 С. 1 Н-ЯМР (ДМСО-d6)10,46 (с, 1 Н), 7,93 (с, 1 Н), 7,38-7,36 (м, 2 Н), 7,01(д, 1 Н, J=8,7 Гц), 2,59 (т, 2 Н, J=8,1 Гц), 1,63 (с,6 Н), 1,58-1,51 (м, 2 Н), 1,48-1,17 (м, 2 Н), 0,82 (т,3 Н, J=7,4 Гц). MS (-ESI) м/е [М-Н]-, 339. Анализ. Вычислено C19H20N2O2S1/4 Н 2 О: С, 66,16; Н,5,99; N, 8,12. Найдено: С, 66,33; Н, 5,92; N, 7,85. Пример 114. 6-(4-Циано-3-фтор)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Раствор 4-циано-3-фторбромбензола (0,6 г,3,0 ммоль) и тетракис(трифенилфосфин)палладия (0) (0,2 г) в этиленгликольдиметиловом эфире (20 мл) перемешивают 20 мин в атмосфере N2. К указанной смеси затем добавляют (1,4 дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновую кислоту (1,0 г, 4,5 ммоль) и карбонат натрия (1,1 г, 10,6 ммоль) в воде (5 мл). Раствор подвергают нагреванию с обратным холодильником в течение 18 ч и затем охлаждают до комнатной температуры, выливают в 2N NaOH и экстрагируют с помощью EtOAc(3 х 50 мл). Объединенные экстракты промывают водой, рассолом, сушат (MgSO4) и упаривают. Остаток очищают с помощью колоночной хроматографии (SiO2, ЕtOАс:гексан=1:2), что позволяет получить названное соединение (0,05 г,6%) в виде грязно-белого твердого вещества,т.пл.: 272-275 С; 1H-ЯМР (ДМСО-d6)10,4 (с,1 Н), 8,0 (т, 1 Н, J=1,1 Гц), 7,9 (дд, 1 Н, J=10,3, 1,3 Гц), 7,8 (дд, 1H, J=6,8, 1,4 Гц), 7,7 (м, 2 Н), 6,9 (д,1H, J=8,9 Гц), 1,7 (с, 6 Н); MS (El) М+, м/е 296. Пример 115. 6-(4-Фтор-фенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно способу В из (1,4 дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1-бром-4 фторбензола. Грязно-белые кристаллы: т.пл. 232-233 С. 1 Н-ЯМР (ДМСО-d6)10,3 (с, 1 Н),7,74 (м, 2 Н), 7,53 (м, 2 Н), 7,28 (м, 2 Н), 6,96 (д,1H, J=8,9 Гц), 1,63 (с, 6 Н). Пример 116. 6-(3,4-Дифторфенил)-4,4 диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно способу В из (1,4 дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1-бром-3,4 дифторбензола. Грязно-белые кристаллы: т.пл. 207-208 С. 1H-ЯМР (ДМСО-d6)10,35 (с, 1 Н),7,79 (м, 1 Н), 7,40-7,63 (м, 4 Н), 6,95 (д, 1 Н, J=8,9 Гц), 1,62 (с, 6 Н). Пример 117. 6-(2-Фторфенил)-4,4-диметил-1,4-дигидробензо[d][1,3]оксазин-2-он. Получают согласно способу В из (1,4 дигидро-4,4-диметил-2-оксо-2 Н-3,1-бензоксазин-6-ил)бороновой кислоты и 1-бром-2
МПК / Метки
МПК: A61P 15/00, C07D 265/18, A61K 31/536
Метки: качестве, рецептора, циклокарбаматные, модуляторов, прогестерона, производные
Код ссылки
<a href="https://eas.patents.su/30-4512-ciklokarbamatnye-proizvodnye-v-kachestve-modulyatorov-receptora-progesterona.html" rel="bookmark" title="База патентов Евразийского Союза">Циклокарбаматные производные в качестве модуляторов рецептора прогестерона</a>
Предыдущий патент: Циклотиокарбаматные производные в качестве модуляторов рецептора прогестерона
Следующий патент: Способ получения диуридинтетрафосфата или его соли
Случайный патент: Способ получения 4-карбоксиамино-2-замещенного-1, 2, 3, 4-тетрагидрохинолина












