Конденсированные производные имидазола в качестве модуляторов множественной лекарственной устойчивости
Номер патента: 1004
Опубликовано: 28.08.2000
Авторы: Соммен Франсуа Мария, Сюрлеро Доминик Луи Нестор Гилейн, Жансенс Франс Эдуард, Ленартс Йозеф Элизабет
Формула / Реферат
1. Соединение формулы (I)

его N-оксидная форма, фармацевтически приемлемая аддитивная соль или стереохимически изомерная форма, где пунктирная линия обозначает простую связь, n равно 1 или 2;
R1 обозначает водород; галоген; формил; C1-4 алкил; C1-4 алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из гидрокси, C1-4 алкокси, C1-4 алкилкарбонилокси, имидазолила, тиазолила или оксазолила; или радикал формулы
| -X-CO-OR5 | (а-1); |
| -X-CO-ONR6R7 | (а-2); или |
| -X-CO-R10 | (а-3); |
где -Х- обозначает простую связь, C1-4 алкандиил или С2-6 алкендиил;
R5 обозначает водород; C1-12 алкил; Ar; Het; C1-6 алкил, замещенный C1-4 алкилокси, C1-4 алкилоксикарбонил C1-4 алкилокси, Ar, Het;
каждый из R6 и R7 независимо обозначает водород или C1-4 алкил;
R10 обозначает имидазолил, тиазолил или оксазолил;
R2 обозначает водород, галоген, C1-4 алкил, гидрокси C1-4 алкил, C1-4 алкилоксикарбонил, карбоксил, формил или фенил;
R3 обозначает водород, C1-4 алкил или C1-4 алкилокси;
R4 обозначает водород, галоген, C1-4 алкил, C1-4 алкилокси или галоид C1-4 алкил;
Z обозначает Z1 или Z2;
Z1 обозначает двухвалентный радикал формулы -СН2-, -СН2-СН2- или -СН=СН-; при условии, что, когда пунктирная линия обозначает связь, Z1 иной, чем -CH2-;
Z2 обозначает двухвалентный радикал формулы
-СНОН-СН2-, -O-CH2-, -C(=O)-CH2- или -С(=NOH)-CH2-;
-A-B- обозначает двухвалентный радикал формулы
| -Y-CR8=CH- | (b-1); |
| -CH=CR8-Y- | (b-2); |
| -CH=CR8-CH=CH- | (b-3); |
| -CH=CH-CR8=CH- | (b-4); |
| или -CH=CH-CH=CR8- | (b-5), |
где каждый R8 независимо обозначает водород, галоген, C1-4 алкил, C1-4 алкилокси, гидрокси C1-4 алкил, гидроксикарбонил C1-4 алкил, формил, карбоксил, этенил, замещенный карбоксилом, или этенил, замещенный C1-4 алкилоксикарбонилом;
каждый Y независимо обозначает двухвалентный радикал формулы -O-, -S-, или -NR9-; где R9 обозначает водород, C1-4 алкил или C1-4 алкилкарбонил;
-А1- обозначает простую связь; C1-6 алкандиил; C1-6 алкандиилокси C1-6 алкандиил; C1-6 алкандиилокси; C1-6 алкандиилкарбонил; C1-6 алкандиилокси, замещенный гидрокси, или C1-6 алкандиил, замещенный гидрокси или =NOH;
-А2- обозначает простую связь или C1-6 алкандиил;
Q обозначает фенил; фенил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; нафталинил; нафталинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; хинолинил или хинолинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила;
Ar обозначает фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из водорода, галогена, C1-4 алкила или C1-4 алкилокси;
Het обозначает фуранил; фуранил, замещенный C1-4 алкилом, C1-4 алкилокси или гидрокси C1-4 алкилом; оксазолил; оксазолил, замещенный C1-4 алкилом или C1-4 алкилокси или хинолинил.
2. Соединение по п.1, где -А-В- обозначает двухвалентный радикал формулы (b-2), (b-3) или (b-4); Z обозначает Z1, где Z1 представляет двухвалентный радикал формулы -СН2-СН2- или -СН2-, или Z обозначает Z2, где Z2 представляет двухвалентный радикал формулы -С(=О)-СН2-; -А1- обозначает C1-6 алкандиил, C1-6 алкандиилокси, карбонил, C1-6 алкандиилокси, замещенный гидрокси, или C1-6 алкандиил, замещенный гидрокси; -А2- обозначает простую связь или C1-6 алкандиил; Q обозначает фенил, нафталинил, пиридинил, хинолинил, фенил, замещенный галогеном или C1-6 алкилокси, нафталинил, замещенный галогеном или C1-6 алкилокси, пиридинил, замещенный галогеном или C1-6 алкилокси, или хинолинил, замещенный галогеном или C1-6 алкилокси; R1 обозначает водород, галоген, формил, C1-4 алкил, замещенный гидрокси, или радикал формулы (а-1), где Х обозначает простую связь или C1-4 алкандиил и R5 обозначает водород, C1-12 алкил, Ar или C1-6 алкил, замещенный Het; R2 обозначает водород, галоген, C1-4 алкил, формил, гидрокси C1-4 алкил или C1-4 алкилоксикарбонил; R3 обозначает водород; R4 обозначает водород, галоген, C1-6 алкил или C1-6 алкилокси и пунктирная линия обозначает связь.
3. Соединение по любому из пп.1-2, где Z обозначает -CH2-СН2-; -А-В- обозначает -СН=СН-СН=СН-; -А1- обозначает -СН2-СН2-, СН2-СН2-СН2- или -O-СН2-СН2-; -А2- обозначает -CH2-; R1 обозначает водород, галоген, формил или радикал формулы (а-1), где Х обозначает простую связь, и R5 обозначает водород, C1-12 алкил, Ar или C1-6 алкил, замещенный Het; R2 обозначает водород, C1-4 алкил, формил или C1-4 алкилоксикарбонил; R3 обозначает водород; R4 обозначает водород или C1-4 алкилокси и пунктирная линия обозначает простую связь.
4. Соединение по п.1, где соединением является
метил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; или
диметил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5Н-имидазо[2,1-b][3]бензазепин-2,3-дикарбоксилат; или
этил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]-этил]-4-пиперидинилиден-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат;
метил-11-[1-[[3,5-диметокси-4-(2-хинолинилметокси)фенил]-метил]-4-пиперидинилиден]-6,11-дигидро-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксиырт;
метил-6,11-дигидро-11-[1-[3-[4-(2-хинолинилметокси)фенил]пропил]-4-пиперидинилиден]-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат;
метил-6,11-дигидро-11-[1-[2-[4-(2-нафталинилметокси)фенил]-этил]-4-пиперидинили-ден]-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат;
метил-6,11-дигидро-11-[1-[2-[4-фенилметокси)фенил]этил]-4-пиперидинилиден]-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; и
метил-6,11-дигидро-11-[1-[2-[4-(1-нафталинилметокси)фенил]-этил]-4-пиперидинили-ден]-5Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат;
их стереоизомерные формы и фармацевтически приемлемые аддитивные соли.
5. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-4.
6. Способ получения фармацевтической композиции по п.5, отличающийся тем, что терапевтически активное количество соединения по любому из пп.1-4 тщательно смешано с фармацевтически приемлемым носителем.
7. Применение соединения по любому из пп. 1-4 в качестве лекарственного препарата.
8. Продукт, содержащий
a) композицию, включающую фармацевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель; и
b) композицию, включающую фармацевтически эффективное количество противоопухолевого средства и фармацевтически приемлемый носитель, в виде объединенного препарата для одновременного, раздельного или последовательного применения в противоопухолевой терапии.
9. Продукт, содержащий
a) композицию, включающую фармацевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель; и
b) композицию, включающую фармацевтически эффективное количество противоопухолевого средства, используемого при лечении заболеваний, вызванных патогенными микроорганизмами, и фармацевтически приемлемый носитель, в виде объединенного препарата для одновременного, раздельного или последовательного применения при лечении заболеваний, вызванных патогенными микроорганизмами.
10. Соединение формулы (II-b)
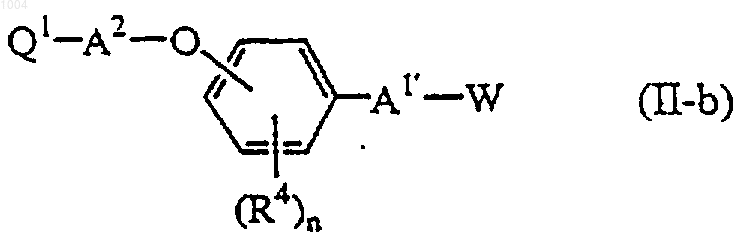
его фармацевтически приемлемая кислотно-аддитивная соль или стереохимически изомерная форма,
где n равно 1 или 2;
R4 обозначает водород, галоген, C1-4 алкил, C1-4 алкилокси или галоген C1-4 алкил;
Q1 обозначает фенил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; нафталинил; нафталинил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; хинолинил или хинолинил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила;
-А1- обозначает C1-6 алкандиил; C1-6 алкандиилокси или C1-6 алкандиилокси C1-6 алкандиил;
-А2- обозначает простую связь или C1-6 алкандиил и W обозначает галоген, метансульфонилокси или бензолсульфонилокси.
11. Способ получения соединения формулы (I), отличающийся тем, что реагент формулы (III), где Т обозначает конденсированный имидазольный радикал
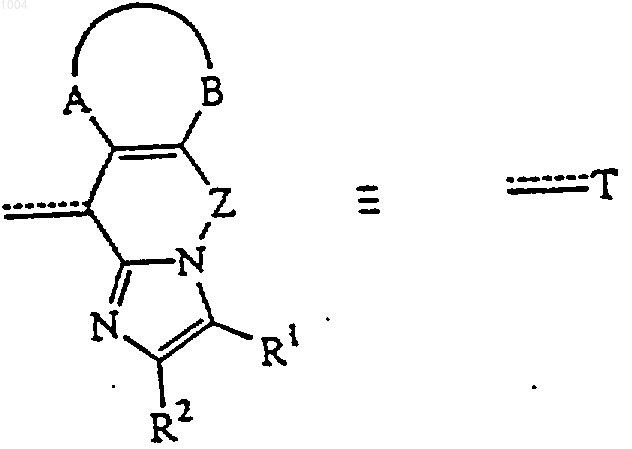
подвергают взаимодействию с промежуточным соединением формулы (II), где W обозначает соответствующую удаляемую группу
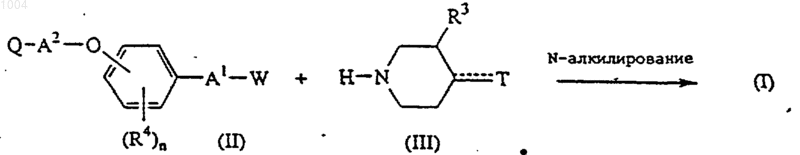
или преобразуют одни соединения формулы (I) в другие известными реакциями преобразования и, далее, при желании, переводят соединения формулы I в кислотно-аддитивную соль путем обработки кислотой или в основно-аддитивнуто соль путем обработки основанием, или наоборот, переводят основно-аддитивную соль в свободную кислоту путем обработки кислотой и, при желании, получением его N-оксида и/или стереохимически изомерных форм.
12. Способ получения соединения формулы I, отличающийся тем, что промежуточное соединение формулы (IV), где W обозначает соответствующую удаляемую группу, подвергают O-алкилированию с реагентом формулы (V)
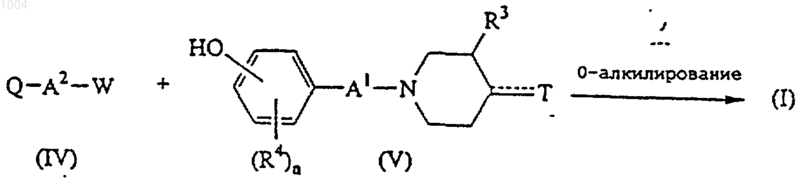
или преобразуют одни соединения формулы (I) в другие известными реакциями преобразования и, далее, при желании, переводят соединения формулы I в кислотно-аддитивную соль путем обработки кислотой или в основно-аддитивную соль путем обработки основанием, или наоборот, переводят основно-аддитивную соль в свободную кислоту путем обработки кислотой и, при желании, получением его N-оксида и/или стереохимически изомерных форм.
13. Способ получения соединения по п.10, где промежуточное соединение формулы (VI) O-алкилируют промежуточным соединением формулы (IV) в реакционно-инертном растворителе и далее гидроксигруппу промежуточного соединения формулы (VII) преобразуют в удаляемую группу W
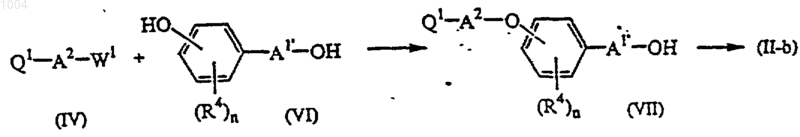
в приведенной выше реакционной схеме n, R4, Q1, А1', А2 и W определены в п.10, и W1 обозначает подходящую удаляемую группу;
или промежуточное соединение формулы (II-а) преобразуют в кислотно-аддитивную соль, или наоборот, кислотно-аддитивную соль преобразуют в форму свободного основания с помощью щелочи и, при желании, получают их стереохимически изомерные формы.
Текст
1 Данное изобретение относится к конденсированным производным имидазола, обладающим способностью модуляции множественной лекарственной устойчивости, способам их получения и, кроме того, к содержащим их композициям, а также к их применению в качестве лекарственных препаратов. Химиотерапия является одним из наиболее часто используемых видов терапии рака и находит клиническое применение в лечении почти каждого типа рака. Одна из основных проблем в раковой терапии состоит в развитии устойчивости к цитотоксическим лекарственным средствам. У пациентов в ответ на первичный курс химиотерапии часто возникает рецидив болезни, поскольку, как полагают, развивается устойчивость опухолевых клеток к химиотерапевтическим средствам или возможно приобретается устойчивость к использованному при предыдущей обработке цитотоксическому средству. Опухоль может также проявлять устойчивость к цитотоксическому средству, которым она ранее не обрабатывалась, хотя этот агент не связан структурой или механизмом воздействия ни с каким агентом, использованным в предыдущих обработках опухоли. В качестве примеров таких воздействий можно рассматривать гематологические опухоли (лейкозы, лимфомы), рак почки и рак молочной железы. Аналогично некоторые патогенные микроорганизмы могут приобретать устойчивость к фармацевтическим средствам, использованным при предыдущих лечениях болезни или нарушений, вызываемых этими патогенными микроорганизмами. Патогенные микроорганизмы могут также проявлять устойчивость к тем фармацевтическим средствам, которыми они раньше не обрабатывались. Примеры такого действия включают устойчивые к множеству лекарственных средств формы малярии, туберкулеза,лейшманиоза и амебной дизентерии. Вышеуказанное явление, состоящее в том,что раковые клетки или патогенные микроорганизмы становятся устойчивыми к множеству лекарственных средств, обладающих незначительным сходством в структурах или механизме действия, имеет общее название "множественная лекарственная устойчивость" (multidrug resistance modulators - MDR). Как использовано в данном тексте, MDRмодуляторы или обладающиеMDRмодулирующими свойствами соединения, определяются как соединения, способные снижать,аннулировать, исключить, ингибировать или реверсировать эффекты множественной лекарственной устойчивости. Поскольку MDR представляет основную проблему при химиотерапевтическом подходе к вышеуказанным болезням, могли бы быть очень полезны соединения, способные к ингибированию или реверсированию эффектов множественной лекарственной устойчивости. 2 В ЕР-0 518 435 и ЕР-0 518 434, опубликованных 16 декабря 1992 г., описаны конденсированные производные имидазола, обладающие противоаллергической активностью. В WO 94/13680, опубликованном 23 июня 1994 г.,описаны замещенные производные имидазо[1,2-а] (пирроло, тиено и фурано) [2,3-d] азепина, проявляющие противоаллергическую активность. Кроме того, в WO 95/02600, опубликованном 26 января 1995 г., описаны другие пиперидинил- или пиперидинилидензамещенные производные имидазоазепина, также обладающие противоаллергической активностью. Соединения по данному изобретению отличаются от приведенных известных из уровня техники соединений структурно, по природе заместителей на азоте пиперидинового радикала и фармакологически тем, что неожиданно эти соединения обладают MDR-модулирующими свойствами. Настоящее изобретение относится к соединениям формулы (I)N-оксидным формам, их фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где пунктирная линия обозначает необязательную связь;C1-4 алкил; C1-4 алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из гидрокси, C1-4 алкокси, C1-4 алкилкарбонилокси, имидазолила, тиазолила или оксазолила; или радикал формулыC1-6 алкил, замещенный C1-4 алкилокси, C1-4 алкилоксикарбонил C1-4 алкилокси, Ar или Het; каждый из R6 и R7 независимо обозначает водород или C1-4 алкил;R4 обозначает водород, галоген, C1-4 алкил,C1-4 алкилокси или галоид C1-4 алкил;Z обозначает Z1 или Z2; где Z1 обозначает двухвалентный радикал формулы -СН 2-, -СН 2-СН 2- или -СН=СН-; при усло 3 вии, что, когда пунктирная линия обозначает связь, Z1 иной, чем -СН 2-;Z2 обозначает двухвалентный радикал формулы -СНОН-СН 2-, -O-СН 2-, -С(=O)-СН 2 или -С (=NOH)-СН 2-;-А-В- обозначает двухвалентный радикал формулы-CH=CH-CH=CR8(b-5),где каждый из радикалов R8 независимо обозначает водород, галоген, C1-4 алкил, C1-4 алкилокси, гидрокси C1-4 алкил, гидроксикарбонил C1-4 алкил, формил, карбоксил, этенил, замещенный карбоксилом, или этенил, замещенный C1-4 алкилоксикарбонилом; каждый из Y независимо обозначает двухвалентный радикал формулы -О-, -S-, или -NR9-; где R9 обозначает водород, C1-4 алкил или C1-4 алкилкарбонил;C1-6 алкандиилкарбонил; C1-6 алкандиилокси, замещенный гидрокси или C1-6 алкандиил,замещенный гидрокси или =NOH;-А 2- обозначает простую связь или C1-6 алкандиил;Q обозначает фенил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; нафталинил; нафталинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; пиридинил; пиридинил,замещенный одним или двумя заместителями,выбранными из водорода, галогена, гидрокси,C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; хинолинил; или хинолинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила,C1-4 алкилокси или галоген C1-4 алкила; Аr обозначает фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из водорода, галогена,C1-4 алкила или C1-4 алкилокси;Het обозначает фуранил; фуранил, замещенный C1-4 алкилом, C1-4 алкилокси или гидрокси C1-4 алкилом; оксазолил; оксазолил, замещенный C1-4 алкилом или C1-4 алкилокси; или хинолинил. Как использовано в предыдущих определениях и далее, галоген обычно обозначает фтор, хлор, бром и иод;C1-4 алкил обозначает такой линейный или разветвленный насыщенный углеводородный радикал с 1-4 углеродными атомами, как, к примеру, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил, 2,2-диметилэтил и 4 тому подобные; C1-6 алкил включает C1-4 алкил и более высокие гомологи с 5-6 углеродными атомами, такие, например, как пентил, гексил, 3 метилбутил, 2-метилпентил и тому подобные;C1-12 алкил включает C1-6 алкил и более высокие гомологи с 7-12 углеродными атомами, такие,например, как гептил, октил, нонил, децил и тому подобные; C1-4 алкандиил обозначает двухвалентные линейные или разветвленные насыщенные углеводородные радикалы с 1-4 углеродными атомами, такие, например, как метилен, 1,2-этандиил, 1,3-пропандиил, 1,4 бутандиил и тому подобные; C1-5 алкандиил включает C1-4 алкандиил и более высокие гомологи с 5 углеродными атомами, такие, например, как 1,5-пентандиил и тому подобные; C1-6 алкандиил включает C1-5 алкандиил и более высокие гомологи с 6 углеродными атомами, такие, например, как 1,5-гександиил и тому подобные; С 2-6 алкенил обозначает линейные или разветвленные углеводородные радикалы с одной двойной связью и с 2-6 углеродными атомами, такие, например, как этенил, 2-пропенил,3-бутенил, 2-пентенил, 3-пентенил, 3-метил-2 бутенил и тому подобные; C2-6 алкендиил обозначает линейные или разветвленные углеводородные радикалы с одной двойной связью и с 26 углеродными атомами, такие, например, как этендиил, 2-пропендиил, 3-бутендиил, 2 пентендиил, 3-пентендиил, 3-метил-2-бутендиил и тому подобные; галоид C1-4 алкил определяется как моно- или полигалоидзамещенный C1-4 алкил; C1-6 алкандиилокси-C1-6 алкандиил обозначает двухвалентные радикалы, такой, например, формулы, как -СН 2-СН 2-O-СН 2-СН 2-, -СН 2 СН(СН 2 СН 3)-O-СН(СН 3)-СН 2, -СН(СН 3)-O-СН 2 и тому подобные. Всякий раз, когда радикал А 1 определяется как C1-6 алкандиилкарбонил или C1-6 алкандиилокси, предпочтительно, чтобы C1-6 алкандиильная часть указанных радикалов была связана с атомом азота пиперидинового цикла. Пиридинил или хинолинил в определениях радикала Q предпочтительно связаны с А 2 через атом С. Всякий раз, когда радикал Z определяется как Z2, -СН 2-группа указанного двухвалентного радикала предпочтительно связана с азотом имидазольного кольца. Всякий раз, когда радикал R1 или R10 определяются как имидазолил, тиазолил или оксазолил, указанные заместители предпочтительно связаны с остатком молекулы через углеродный атом. Соединения, где Z обозначает -СН 2 и присутствует необязательная связь, исключаются,по причине того, что трициклический радикал в таких соединениях самопроизвольно ароматизируется, теряя при этом способность к модуляции множественной лекарственной устойчивости. 5 Подразумевается, что упомянутые выше фармацевтически приемлемые аддитивные соли включают те терапевтически активные нетоксичные формы аддитивных кислотных солей,которые способны образовывать соединения формулы (I). Эти соли обычно могут быть получены при обработке основной формы соответствующей кислотой. Подходящие кислоты включают, к примеру, такие неорганические кислоты, как галоидводородные кислоты, например соляную или бромисто-водородную кислоту; серную; азотную; фосфорную и тому подобные кислоты; или такие органические кислоты, как,например, уксусную, пропановую, гликолевую,молочную, пировиноградную, щавелевую, малоновую, янтарную (т.е. бутандионовую кислоту), малеиновую, фумаровую, яблочную, винную, лимонную, метансульфо-, этансульфо-,бензолсульфо-, п-толуолсульфо-, цикламовую,салициловую, п-аминосалициловую, памоловую и тому подобные кислоты. Подразумевается, что вышеупомянутые фармацевтически приемлемые аддитивные соли включают те терапевтически активные нетоксичные формы основных аддитивных солей,которые способны образовывать соединения формулы (I). Примерами таких форм основных аддитивных солей служат соли натрия, калия,кальция, а также соли с такими фармацевтически приемлемыми аминами, как, к примеру, аммиак, алкиламины, бензатин, N-метил-Dглюкамин, оксиамин, аминокислоты, например,аргинин, лизин. И наоборот, указанные формы солей могут быть превращены обработкой соответствующим основанием или кислотой в форму свободной кислоты или основания. Термин аддитивные соли, как он использован выше, включает также сольваты, которые способны образовывать как соединения формулы (I), так и их соли. Примерами таких сольватов служат гидраты, алкоголяты и тому подобные. Термин стереохимически изомерные формы, как он употреблен выше, обозначает различные возможные как изомерные, так и конформационные формы, которые могут давать соединения формулы (I). Если не указано или не оговорено особо, химическое определение соединений подразумевает смесь всех возможных стереохимически и конформационно-изомерных форм, указанные смеси содержат все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Имеется в виду,что все стереохимически изомерные формы соединений формулы (I) какв чистом виде, так и в виде смеси друг с другом, входят в рамки объема данного изобретения и приложенных пунктов. Некоторые соединения по данному изобретению могут существовать в различных таутомерных формах и предполагается, что все 6 такие таутомерные формы входят в рамки объема данного изобретения и приложенных пунктов. К примеру, соединения формулы (I), где Q обозначает пиридинил или хинолил, замещенный гидроксигруппой, могут существовать в соответствующих таутомерных формах. Подразумевается, что N-оксидные формы соединений формулы (I) включают те соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого Nоксида, в частности, те N-оксиды, в которых азот пиперидина N-оксидирован. Первая группа рассматриваемых соединений включает те соединения формулы (I), к которым применимо одно или несколько из указанных ограничений:a) -А-В- обозначает двухвалентный радикал формулы (b-2), (b-3) или (b-4), илиb) Z обозначает Z1, где Z1 обозначает двухвалентный радикал формулы -СН 2-СН 2- илиd) -А 2- обозначает простую связь или C1-6 алкандиил; в частности, -А 2- обозначает C1-6 алкандиил;e) Q обозначает фенил, нафталинил, пиридинил или хинолинил и, необязательно, указанный Q замещен галогеном, C1-6 алкилом или C1-6 алкилокси;f) R1 обозначает водород, галоген, формил,С 1-4 алкил, замещенный гидрокси, или радикал формулы (а-1), где Х обозначает простую связь или C1-4 алкандиил и R5 обозначает водород,C1-12 алкил, Аг или C1-6 алкил замещенный Het;i) R4 обозначает водород, галоген, C1-6 алкил или C1-6 алкилокси. Вторая группа рассматриваемых соединений включает те соединения формулы (I), к которым применимо одно или несколько из указанных ограничений:a) -А-В- обозначает двухвалентный радикал формулы (b-2), (b-3) или (b-4); илиb) Z обозначает Z2, где Z2 обозначает двухвалентный радикал формулы -С(=O)-СН 2-, илиc) -А 1- обозначает C1-6 алкандиил, C1-6 алкандиилокси, карбонил, C1-6 алкандиилокси,замещенный гидрокси, или C1-6 алкандиил, замещенный гидрокси; в частности, -А 1- обозначает C1-6 алкандиил; или а) -А 2- обозначает простую связь или C1-6 алкандиил; в частности, -А 2- обозначает C1-6 алкандиил;e) Q обозначает фенил, нафталинил, пиридинил или хинолинил и, необязательно, указан 7 ный Q замещен галогеном, C1-6 алкилом или C1-6 алкилокси;f) R1 обозначает водород, галоген, формил,C1-4 алкил, замещенный гидрокси, или радикал формулы (а-1), где Х обозначает простую связь или C1-4 алкандиил, и R5 обозначает водород,C1-12 алкил, Аr или C1-6 алкил, замещенный Het;i) R4 обозначает водород, галоген, C1-6 алкил или C1-6 алкилокси. Частную группу соединений составляют те соединения формулы (I), где -А-В- обозначает двухвалентный радикал формулы (b-2), (b-3) или (b-4), где R8 обозначает водород или галоген; Z обозначает -СН 2-СН 2-, -А 1- обозначает-А 2- обозначает -СН 2- и пунктирная линия обозначает химическую связь. Другую частную группу соединений составляют те соединения формулы (I), где Q обозначает 2-хинолинил,1-нафталинил,2 нафталинил, фенил или 2-пиридинил, и указанный Q необязательно замещен C1-4 алкилом,галогеном, галоген C1-4 алкилом или C1-4 алкилокси. Следующую частную группу соединений составляют те соединения формулы (I), где Q обозначает 2-хинолинил, 1-нафталинил, 2 нафталинил, 6-метил-2-хинолинил, 6-хлор-2 пиридинил, 4-метоксифенил, 3,5-диметилфенил,3,5-дифторфенил или 3,5-бис(трифторметил) фенил. Предпочтительными соединениями формулы (I) являются те, где Z обозначает -СН 2 СН 2-; -А-В- обозначает -СН=СН-СН=СН-; -А 1 обозначает -СН 2-СН 2- или -О-СН 2-СН 2-; -А 2 обозначает -CH2-; R1 обозначает водород, галоген, формил или радикал формулы (а-1), где Х обозначает простую связь, и R5 обозначает водород, C1-12 алкил, Аr или C1-6 алкил, замещенный Het; R2 обозначает водород, C1-4 алкил,формил или C1-4 алкилоксикарбонил; R3 обозначает водород; R4 обозначает водород или C1-4 алкилокси и пунктирная линия обозначает простую связь. Наиболее предпочтительными соединениями формулы (I) являются: метил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]-этил]-4-пиперидинилиден]5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; диметил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-2,3 дикарбоксилат; этил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]-этил]-4-пиперидинилиден]5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-11-[1-3,5-диметокси-4-(2-хинолинилметокси)фенил]-метил]-4-пиперидинили 001004 8 ден]-6,11-дигидро-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-6,11-дигидро-11-[1-[3-[4-(2-хинолинилметокси)фенил]пропил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3 карбоксилат; метил-6,11-дигидро-11-[1-[2-[4-(2-нафталинилметокси)фенил]-этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-6,11-дигидро-11-[1-[2-[4-фенилметокси)фенил]этил]-4-пиперидинилиден]-5 Нимидазо[2,1-b][3]бензазепин-3-карбоксилат; и метил-6,11-дигидро-11-[1-[2-[4-(1-нафталинилметокси)фенил]-этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; их стереоизомерные формы и фармацевтически приемлемые аддитивные соли. В последующих разделах описываются различные способы получения соединений формулы (I). Для простоты записи структурных формул соединений формулы (I) и образующихся при их получении промежуточных продуктов, далее радикал конденсированного имидазола обозначается символом Т. Соединения по данному изобретению обычно могут быть полученыNалкилированием промежуточного продукта формулы (III), где W обозначает подходящую удаляемую группу, такую, например, как хлор,бром, метансульфонилокси или бензолсульфонилокси, промежуточным продуктом формулы(II). Реакция может быть проведена в таком реакционно-инертном растворителе, как, например, этанол, дихлорметан, метилизобутилкетон или N,N-диметилформамид, в присутствии такого подходящего основания, как, например,карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может повысить скорость реакции. Реакцию обычно проводят в интервале температур от комнатной до температуры кипения смеси. Соединения формулы (I) могут также быть получены О-алкилированием промежуточного продукта формулы (V) промежуточным продуктом формулы (IV), где W1 обозначает подходящую удаляемую группу, такую как, например,хлор, бром, метансульфонилокси или бензолсульфонилокси. Реакция может быть проведена в таком реакционно-инертном растворителе, 9 как, например, N,N-диметилформамид, в присутствии подходящего основания, такого как,например, гидрид натрия, предпочтительно в интервале температур от комнатной до температуры кипения смеси. Соединения формулы (I), где -А 1- обозначает C1-6 алкандиил, C1-6 алкандиилокси, C1-6 алкандиилокси C1-6 алкандиил, указанные соединения представлены формулой (I-i), могут быть получены восстановительным(XIX) -А 1-обозначает простую связь, группу C1-5 алкандиил, C1-5 алкандиилокси или C1-6 алкандиилокси C1-5 алкандиил, где группа формил связана с C1-5 алкандиильной частью.Nалкилирование может быть проведено в реакционно-инертном растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь,в присутствии восстанавливающего агента, такого как, например, боргидрид натрия, цианборгидрид натрия или триацетоксиборгидрид. Его можно было также осуществить с использованием водорода в качестве восстанавливающего агента в сочетании с подходящим катализатором, таким как, например, палладий-на-угле или платина-на-угле. В случае, когда в качестве восстанавливающего агента используется водород, может быть целесообразно добавить к реакционной смеси дегидратирующий агент, такой как, например, трет-бутоксид алюминия. С целью предупреждения нежелательного дополнительного гидрирования некоторых функциональных групп в реагентах и в продуктах реакции, может быть удобно добавить к реакционной смеси соответствующий каталитический яд,например, тиофен или хинолин-серу. Для увеличения скорости реакции температура может быть повышена в пределах от комнатной до температуры кипения реакционной смеси. В последующих разделах описаны различные способы преобразования одних соединений формулы (I) в другие, согласно известным методам преобразования функциональных групп. С целью упрощения структурной формулы соединений формулы (I), радикал замещенного пиперидина будет представлен ниже символом М. Например, соединения формулы (I), где R1 обозначает C1-4-алкил, замещенный гидрокси,указанные соединения могут быть преобразованы в соответствующие соединения формулы (I),где R1 обозначает C1-4 алкилкарбонилокси C1-4 алкил, указанные соединения представлены формулой (I-b), в соответствии с известными методами этерификации, такими как, например,обработка ацилгалогенидом, в присутствии основания с целью связывания выделяющейся в процессе реакции кислоты.R1 обозначает СНО, указанные соединения представлены формулой (I-с) путем окисления подходящим реагентом, таким как, например,оксид марганца (IV).R1 содержит карбоксильную группу, указанные соединения представлены формулой (I-d), могут быть преобразованы в соответствующие сложные эфиры такими известными методами, как,например, обработка спиртом в присутствии кислоты или основания. И наоборот, соединения формулы (1-е) могут быть гидролизованы до соединений (I-d) в присутствии кислоты или основания. Соединения формулы (I-с) могут быть преобразованы в соединения формулы (I), гдеR1 обозначает метоксикарбонилметил, указанные соединения представлены формулой (I-f),обработкой метил-метилтиометилсульфоксидом в присутствии гидроксида бензилтриметиламмония в реакционно-инертном растворителе, например в тетрагидрофуране. 12 метансульфонилоксихлоридом или галогенирующим агентом, таким как, например, РОСl3. Кроме того, соединения формулы (I-с) могут быть преобразованы в соединения формулы(I-е), где Х обозначает простую связь, указанные соединения представлены формулой (I-е-1),обработкой спиртом, таким как, например, метанол или этанол, в присутствии уксусной кислоты, МnО 2 и NaCN.-С(=O)-СН 2, указанные соединения представлены формулой (I-g), могут быть преобразованы в соответствующие спирты известными методами восстановления, такими как, например, обработка натрийборгидридом в подходящем растворителе, например в метаноле. Исходные и некоторые промежуточные соединения являются известными соединениями и выпускаются промышленностью или могут быть получены общепринятыми реакционными способами, обычно известными в соответствующей области синтеза. Например, ряд промежуточных соединений формулы (III), особенно,те, где Z обозначает Z2, являются известными соединениями, которые могут быть получены по известным методикам, описанным в ЕР 0 518 435-А, ЕР 0 518 434-А и WO 95/02600. В последующих разделах описаны некоторые способы получения промежуточных соединений, используемых в приведенных ниже препаративных способах. Промежуточные соединения формулы (II) могут быть получены О-алкилированием ароматической гидроксильной группы промежуточного соединения (VI) промежуточным соединением формулы (IV), где W1 обозначает подходящую удаляемую группу, такую как, например,галоген, метансульфонилокси или бензолсульфонилкси, и последующим преобразованием гидроксильной группы промежуточного соединения (VII) в удаляемую группу W, например,обработкой промежуточного соединения (VII) Указанную реакцию О-алкилирования обычно проводят, смешивая реагенты в реакционно-инертных растворителях, таких как, например, метанол или N,N-диметилформамид, в присутствии подходящего основания, такого как, например, карбонат натрия или гидрокарбонат натрия, предпочтительно в интервале температур от комнатной до температуры кипения реакционной смеси. Кроме того, промежуточные соединения формулы (II), где -А 1- обозначает C1-6 алкандиилокси, представленные формулой (II-а), могут быть получены взаимодействием промежуточного соединения формулы (VIII) с промежуточным соединением формулы (IX) в присутствии подходящего основания, такого как, например,карбонат калия, и необязательно в присутствии реакционно-инертного растворителя, такого как,например, N, N-диметилформамид, ацетонитрил или тетрагидрофуран. Последующее преобразование гидроксильной группы в удаляемую группу W, например, обработкой метансульфонилоксихлоридом или галогенирующим агентом, таким как, например, РОСl3, дает промежуточные продукты формулы (II-а). Целесообразно проводить указанную реакцию Оалкилирования в интервале температур от комнатной до температуры кипения реакционной смеси. Данное изобретение относится также к новым соединениям формулы (II), представленным соединениями формулы (II-b), где радикалQ1 обозначает все заместители Q, иные, чем незамещенные фенилом,. Промежуточные соединения формулы (V),где -А 1'- обозначает C1-6 алкандиил, C1-6 алкандиилокси, C1-6 алкандиилокси C1-6 алкандиил,указанные промежуточные соединения представлены формулой (V-а), могут быть получены восстановительным N-алкилированием промежуточного соединения формулы (III) промежуточным соединением формулы (X). Необяза 13 тельно, промежуточное соединение (X) может содержать защищенную гидроксильную группу,у которой после восстановительного Nалкилирования может быть удалена защита известными методами. В указанном промежуточном соединении (X), -А 1- обозначает простую связь, C1-5 алкандиил, C1-5 алкандиилокси илиC1-6 алкандиилокси, C1-5 алкандиил, где группа формил связана с C1-5 алкандиильной частью. Указанное восстановительное N-алкилирование может быть осуществлено описанным выше способом. Промежуточные соединения формулы (IIIa), определенные как промежуточные соединения формулы (III), где Z обозначает Z1, могут быть получены по схеме I. Схема I На схеме I промежуточное соединение формулы (XII) может быть циклизовано аналогично циклизации промежуточного соединения формулы (XI), давая спирт формулы (XIII), который может быть окислен известным окислительным методом до кетона формулы (XIV). Промежуточное соединение формулы (XVI) может быть получено добавлением реактива Гриньяра (XV), где PG обозначает подходящую защитную группу, например, бензил, к кетону формулы (XIV) в реакционно-инертном растворителе, например тетрагидрофуране. Промежуточное соединение формулы (III-а) может быть получено дегидратацией промежуточного соединения (XVI) с последующим каталитическим гидрированием промежуточного соединения (XVII). Указанную реакцию дегидратации обычно проводят с применением обычных дегидратирующих реагентов, например серной кислоты, по известным методикам. Указанную реакцию каталитического гидрирования можно осуществить известными способами, например перемешиванием в реакционно-инертном растворителе, например метаноле, в присутствии 14 подходящего катализатора, например палладийна-угле, и в присутствии водорода, температура,необязательно, может быть повышенной в пределах от комнатной до температуры кипения реакционной смеси, и, при желании, давление водорода может быть увеличено. Кроме того, промежуточные соединения формулы (III-a), где R1 обозначает галоген, указанные промежуточные соединения представлены формулой (III-а-1), могут быть получены галогенированием промежуточных соединений формулы (XVIII), где PG обозначает защитную группу, такую как, например, C1-6 алкил, с последующим удалением защитной группы. Например, когда PG обозначает C1-6 алкил, группаPG может быть удалена реакцией карбонилирования с C1-4 алкилхлорформиатом и последующим гидролизом с помощью основания. Указанную реакцию галоидирования обычно проводят обработкой промежуточных соединений (XVIII) галоидирующим реагентом,таким как, например, N-хлорсукцинимид или Nбромсукцинимид, в реакционно-инертном растворителе, таком как, например, дихлорметан,необязательно, в присутствии инициатора, такого как, например, дибензоилпероксид. Также, промежуточные соединения формулы (III), где Z обозначает Z1 и пунктирная линия не обозначает химическую связь, указанные промежуточные соединения представлены формулой (III-b), обычно могут быть получены циклизацией промежуточного соединения формулы (XI). Указанную реакцию циклизации обычно проводят обработкой промежуточного соединения формулы (XI) соответствующей кислотой,получая промежуточное соединение формулы(III-a). Подходящими кислотами являются, например, метансульфоновая кислота или трифторметансульфоновая кислота. Следует отметить, что по приведенной выше реакционной схеме могут быть получены только те промежуточные соединения формулы (III-a), где R1 и R2 стабильны в данных реакционных условиях. Соединения формулы (I) и некоторые промежуточные соединения могут иметь в своей структуре один или несколько центров асимметрии, приводящих к R или S-конфигурации. Соединения формулы (I), полученные указанными выше способами, могут быть синтези 15 рованы в виде смеси стереоизомерных форм, в частности, в виде рацемических смесей энантиомеров, которые могут быть отделены друг от друга известными способами разделения. Рацемические соединения формулы (I) могут быть преобразованы в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой. После чего указанные соответствующие диастереомерные солевые формы разделяют, например, селективной или фракционной кристаллизацией, и энантиомеры выделяют в свободном виде с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы(I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы могут также быть получены из соответствующих стереохимически чистых изомерных форм подходящих исходных соединений, при условии, что реакция протекает стереоспецифически. Преимущественно, если желателен конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими методами получения. По этим методам преимущественно используются энантиомерночистые исходные соединения. Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереоизомерные формы обладают ценными фармакологическими свойствами, состоящими в ингибировании или реверсировании эффектов множественной лекарственной устойчивости, что следует из результатов, полученных в MDR-тесте in vitro (пример С-1) и в MDRтесте in vivo (пример С-2). Термин множественная лекарственная устойчивость (MDR) определяет явление, состоящее в том, что клетки, в особенности раковые клетки, или патогенные микроорганизмы становятся устойчивыми к множеству лекарственных средств, обладающих незначительным сходством в структурах или механизме действия. Основной фактор MDR состоит в повышенной экспрессии мембран-ассоциированного транспортера, т.е. Р-гликопротеина, который снижает внутриклеточную концентрацию цитотоксических лекарственных средств, связывая лекарственное вещество и активно выкачивая его из клетки, не позволяя лекарственному средству достигать критической цитотоксической концентрации (Dalton W.S., Seminars in oncology,20:66-69, 1993). Другие механизмы устойчивости включают альтерацию топоизомеразы, глютатион-Sтрансферазы, транспорта нуклеозидов, тимидилат-синтазы, дигидрофолат-редуктазы и металлотионеина. Кроме того, соединения формулы (I) могут использоваться при ингибировании проникновения химиотерапевтического средства через мембрану с помощью мембран-ассоциирован 001004 16 ного транспортера,особенно мембранассоциированного транспортера-Р-гликопротеина, и тем самым в сохранении эффективности данного агента. В связи с их MDR-ингибирующей и реверсирующей активностью, соединения формулы(I) пригодны для применения в качестве лекарственного препарата, в частности, для снижения, устранения или реверсирования развивающейся или существующей устойчивости к терапии химиотерапевтическими лекарственными средствами или для избежания появления такой устойчивости путем введения терапевтически эффективного количества соединения формулы(I). Заболевания, расстройства или состояния,при которых лечение затруднено множественной лекарственной устойчивостью, включают,например, опухолевые заболевания, вызванные ростом неоплазмов (или опухолей), как, например, гематологические опухоли (лейкозы, лимфомы), рак почки, овариальная карцинома, рак молочной железы, меланома, опухоли толстой кишки и легкого и тому подобные, и такие заболевания, как устойчивые к множественным лекарственным средствам формы малярии, туберкулеза, лейшманиоза и амебной дизентерии и тому подобные заболевания, вызванные патогенными микроорганизмами, которые приобрели устойчивость к таким лекарственным средствам, как, например, хлороквин, пириметаминсульфадоксим, мефлоквин, галофантрин, изониазид, стрептомицин, рифампицин, пиразинамид, налидиксовая кислота, ампицилин и тому подобным. Соединения формулы (I) обычно могут использоваться в сочетании с химиотерапевтическим агентом. Таким образом, изобретение относится к сочетанию, включающему композицию по изобретению вместе с терапевтически активным средством, в частности, с противоопухолевым средством. Это сочетание может вводиться раздельно, синхронно, одновременно,совместно или последовательно любым из описанных выше способов, либо сочетание может быть также представлено в виде одного фармацевтического состава. Таким образом, фармацевтический продукт включает (а) соединение формулы (I) и (b) указанный выше химиотерапевтический агент в виде объединенного препарата для синхронного, раздельного или последовательного применения в терапевтическом или профилактическом лечении теплокровных животных, страдающих заболеваниями или нарушениями, при которых множественная лекарственная устойчивость препятствует лечению. Такой продукт может состоять из набора, включающего контейнер, содержащий фармацевтическую композицию соединения формулы (I), и другой контейнер, содержащий фармацевтическую композицию химиотерапевтического агента. Продукт с раздельными композициями двух активных ингредиентов имеет преимущество, 17 состоящее в том, что подходящее количество каждого компонента, длительность и последовательность введения могут быть выбраны в зависимости от больного. Химиотерапевтические агенты, пригодные для применения в указанных выше комбинациях для лечения опухолевых заболеваний, включают, например, такие противоопухолевые агенты как адриамицин, даунорубицин, доксорубицин,винкристин, винбластин, этопозид, таксол, дактиномицин, митоксантрон, митомицин, триметрексат и тому подобные, и для лечения заболеваний, вызванных патогенными организмами,которые приобрели устойчивость к многочисленным фармацевтическим агентам, такие фармацевтические средства как, например, хлороквин, пириметамин-сульфадоксим, мефлоквин,галофантрин, изониазид, стрептомицин, налидиксовая кислота и ампицилин. Когда соединения формулы (I) используются в сочетании с химиотерапевтическим агентом, доза химиотерапевтического агента может отличаться от дозы, когда он используется один. Таким образом, когда соединения формулы (I) используют совместно с химиотерапевтическим агентом, доза последнего может быть такой же,или чаще - ниже, чем доза, когда химиотерапевтический агент используется один. Подходящие дозы легко установит специалист в данной области. С учетом указанных выше применений соединений формулы (I), логически следует, что настоящее изобретение относится также к способу лечения теплокровных животных, страдающих от болезней или состояний, при которых лечение затруднено множественной лекарственной устойчивостью, указанный способ включает системное введение терапевтического количества соединения формулы (I), эффективного для отмены, ингибирования или реверсирования эффектов множественной лекарственной устойчивости. Данное изобретение относится к способу применения соединений формулы (I) для снижения, исключения или реверсирования развивающейся или существующей устойчивости к противоопухолевой лекарственной терапии либо с целью избежания возникновения такой устойчивости путем введения терапевтически эффективного количества соединения формулы (I). Кроме того, предложен способ применения соединений формулы (I) для лечения болезней или состояний, вызванных патогенными микроорганизмами, которые приобрели устойчивость к фармацевтическим агентам, указанный способ состоит в систематическом введении терапевтического количества соединения формулы (I),эффективного в ингибировании или реверсировании множественной лекарственной устойчивости, и фармацевтического агента, полезного при лечении таких состояний. 18 Для удобства введения заявленные соединения могут быть включены в состав различных фармацевтических форм с учетом целей введения. Для получения фармацевтических композиций по данному изобретению, эффективное количество конкретного соединения, в виде основной или кислотной аддитивной соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, при этом носитель может иметь широкое разнообразие форм в зависимости от вида требуемого для введения препарата. Желательно существование этих фармацевтических композиций в виде стандартных лекарственных форм,пригодных преимущественно для введения перорально, ректально или в виде парентеральных инъекций. Например, при получении композиций в виде пероральной лекарственной формы могут быть использованы любые обычные фармацевтические среды, например, такие как вода,гликоли, масла, спирты и тому подобное для получения таких пероральных жидких препаратов, как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы,сахара, каолин, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и тому подобное - в случае порошков, пилюль,капсул и таблеток. Ввиду удобства их применения, таблетки и капсулы представляют наиболее выгодную пероральную стандартную лекарственную форму, в этом случае, безусловно, используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно состоит из стерильной воды, по крайней мере, в основном, хотя могут быть включены и другие ингредиенты, например, для увеличения растворимости. К примеру, могут быть получены растворы для инъекций, в которых носитель представляет собой раствор соли, раствор глюкозы или смесь раствора соли и раствора глюкозы. Могут быть также приготовлены суспензии для инъекций, в этом случае могут быть использованы подходящие жидкие носители, суспендирующие средства и тому подобное. В композициях, пригодных для подкожного введения,носитель, необязательно, содержит повышающий проницаемость агент и/или смачивающий агент, необязательно, объединенный с подходящими добавками любой природы в незначительных количествах, при условии, что добавки не оказывают существенного вредного воздействия на кожу. Указанные добавки могут облегчать применение на коже и/или могут использоваться для получения указанных композиций. Эти композиции могут быть введены различными способами, например, в виде трансдермальных пластырей, точным попаданием в нужное место или в виде мази. Аддитивные кислотные соли соединения (I), благодаря их повышенной растворимости в воде по сравнению с соответствующей основной формой, обычно более удобны для получения водных композиций. 19 Особенно предпочтительно составлять вышеуказанные фармацевтические композиции в виде стандартных доз для простоты применения и равномерности доз. Понятие стандартных лекарственных форм как оно использовано в описании изобретения и приложенных пунктах относится к физически дискретным единицам,пригодным в качестве единичных доз, каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное так, чтобы обеспечить желаемое терапевтическое воздействие в совокупности с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм служат таблетки (включая таблетки с насечками или покрытые оболочкой таблетки), капсулы, пилюли, пакеты с порошком, облатки, растворы для инъекций или суспензии, препараты, отмеряемые полной чайной ложкой или полной столовой ложкой и тому подобное, и их сегрегированные множества. Композиции могут быть удобно представлены в виде комплектов раздельных доз, особенно в виде единичных дозированных форм. В обычный состав стандартной дозы входит активный ингредиент в количестве от 0,1 до 1000 мг, в особенности от 1 до 200 мг. Количество соединения формулы (I), требуемое в качестве суточной дозы для лечения, варьируется не только с выбором конкретного соединения, но так же в зависимости от способа введения, природы требующего лечения состояния и возраста,веса и состояния пациента, и, в конечном счете,определяется по усмотрению лечащего врача. Однако обычно подходящая суточная доза составляет порядка 0,1-5000 мг на день, особенно около 1-1000 мг в день, преимущественно 10500 мг в день. Подходящая суточная доза для применения в профилактических целях обычно находится в тех же пределах. Последующие примеры приведены с целью иллюстрации, но не в порядке ограничения. Экспериментальная часть А. Получение промежуточных соединений Далее "ТГФ" обозначает тетрагидрофуран,"ДИПЭ" обозначает диизопропиловый эфир,"ДХМ" обозначает дихлорметан, "ДМФ" обозначает N,N-диметилформамид и "АЦН" обозначает ацетонитрил. Пример A.1. а). 4-Гидроксибензолэтанол (103,5 г) перемешивают в этаноле (1,5 л) при комнатной температуре. Добавляют по каплям раствор гидроксида калия (84 г) в этаноле (1,5 л) в течение 1 ч. Добавляют порциями моногидрохлорид 2(хлорметил)хинолина в течение 25 мин. Реакционную смесь перемешивают и нагревают до температуры кипения с обратным холодильником в течение 12 ч. Реакционную смесь выливают в воду (5 л) и эту смесь энергично перемешивают. Осадок отфильтровывают и промывают водой (2 л). Добавляют толуол и подвер 001004 20 гают азеотропной отгонке на роторном испарителе. Остаток сушат, получая 187 г (89%) 4-(2 хинолинилметокси)бензолэтанолаb). Смесь промежуточного соединения 1(50 мл) перемешивают при охлаждении на ледяной бане. Добавляют по каплям метансульфонилхлорид (1,26 г) при температуре ниже 10 С. Смесь доводят до комнатной температуры и затем перемешивают в течение 1 ч. Добавляют воду и смесь экстрагируют ДХМ. Органический слой промывают водой, сушат, фильтруют и упаривают, получая 3,8 г (100%) 4-(2 хинолинилметокси)бензолэтанолметансульфоната (сложный эфир) (промежуточное соединение 2). Аналогичным образом синтезируют 3-(2 хинолинилметокси)бензолэтанолметансульфонат (сложный эфир) (промежуточное соединение 3) и 4-[(6-метил-2-хинолинил)метокси] бензолэтанолметансульфонат (сложный эфир)a). 3-(2-Хинолинилметокси)фенол (12,5 г),карбонат калия (10,4 г) и 1,3-диоксолан-2-он (44 г) перемешивают на масляной бане при 100 С в течение 2 ч. Смесь охлаждают, выливают в воду и экстрагируют ДХМ. Органический слой сушат, фильтруют и упаривают. Остаток чистят колоночной хроматографией на силикагеле(элюент: CH2Cl2/CH3OH 97/3). Очищенные фракции собирают и упаривают. Остаток перемешивают в ДИПЭ. Осадок отфильтровывают и сушат, получая 11,9 г (80,6) 2-[3-(2-хинолинилметокси(фенокси]этанола (промежуточное соединение 5).b). Смесь промежуточного соединения 5(50 мл) перемешивают на ледяной бане. Добавляют по каплям метансульфонилхлорид (1,26 г) при температуре 5 С. Смесь доводят до комнатной температуры и затем перемешивают 1 ч. Добавляют воду и смесь перемешивают. Смесь разделяют и водный слой экстрагируют ДХМ. Объединенные органические слои промывают водой, сушат, фильтруют и упаривают, получая 4,5 г (100%) 2-[3-(2-хинолинилметокси)фенокси]этанолметансульфоната (сложного эфира)(промежуточное соединение 6). Аналогичным способом синтезируют 2-[4-(2-хинолинилметокси)фенокси]этанолметансульфонат(сложный эфир) (промежуточное соединение 7). Пример А.3. Смесь 3,5-диметокси-4-гидроксибензальдегида (8 г) и 6,11-дигидро-11-(4-пиперидинилиден)-5 Н-имидазо[2,1-b][3]бензазепина (9 г) в метаноле (250 мл) и тиофена (4%, 3 мл) гидрируют при комнатной температуре над палладием-на-угле (10%, 2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают и фильтрат упаривают. Остаток чистят колоночной хроматогра 21 фией на силикагеле (элюент: CH2Cl2/CH3OH 95/5). Очищенные фракции собирают и упаривают, получая 9,5 г (65%) 4-[4-(5,6-дигидро 11 Н-имидазо[2,1-b][3]бензазепин-11-илиден)-1 пиперидинил]-2,6-диметоксифенола (промежуточное соединение 8). Аналогичным способом синтезируют 6,11 дигидро-11-[1-[(4-гидрокси-3,5-диметоксифенил)метил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-метанол (промежуточное соединение 9). Пример А.4. Смесь -[1-(фенилметил)-1 Н-имидазол-2 ил]-4-пиперидинметанола (5,4 г) в трифторметансульфоновой кислоте (25 мл) перемешивают в течение ночи при 100 С. Реакционную смесь охлаждают, выливают на лед, затем подщелачивают NaOH и эту смесь экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и растворитель упаривают. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: CH2Cl2/(СН 3 ОН/NH3) 95/5 повышают до 90/10). Очищенные фракции собирают и упаривают, получая 2,5 г (50%) 5,10 дигидро-10-(4-пиперидинил)имидазо[1,2-b]изохинолина (промежуточного соединения 10). Пример А.5.a). 6,11-Дигидро-11-(1-метил-4-пиперидинилиден]-5 Н-имидазо-[2,1-b][3]бензазепин (28 г) перемешивают в ДХМ (500 мл до полного растворения. Добавляют дибензоилпероксид(13,4 г) и полученную реакционную смесь перемешивают в течение ночи при комнатной температуре, а затем 2 ч при нагревании до температуры кипения с обратным холодильником. Растворитель упаривают. Остаток чистят колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) при соотношении 97/3,повышающимся до 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 23,3 г (74%) 3-хлор-6,11 дигидро-11-(1-метил-4-пиперидинилиден)-5 Нимидазо[2,1-b][3]бензазепина (промежуточное соединение 11).b). Смесь промежуточного соединения 11(31,4 г) и N,N-диэтилэтанамина (20,2 г) в толуоле (1 л) перемешивают и нагревают до температуры кипения с обратным холодильником. Добавляют по каплям этилхлорформиат (65,1 г). Реакционную смесь перемешивают и нагревают до температуры кипения с обратным холодильником в течение 90 мин. Смесь охлаждают. Добавляют воду и К 2 СО 3 и разделяют слои. Водный слой экстрагируют толуолом. Органический слой отделяют, сушат (MgSO4), фильтруют и упаривают растворитель. Остаток кристаллизуют из ДИПЭ. Осадок отфильтровывают и сушат, получая 32,4 г (87%) этил-4-(3-хлор-5,6 дигидро-11 Н-имидазо[2,1-b][3]бензазепин-11 001004c). Смесь промежуточного соединения 12(370 мл) перемешивают и нагревают до температуры кипения с обратным холодильником 6 ч. Растворитель упаривают. Остаток растворяют в воде и экстрагируют ДХМ. Органический слой отделяют, сушат (MgSO4), фильтруют и упаривают растворитель. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 1,65 г (90%) 3-хлор-6,11-дигидро-11-(4 пиперидинилиден)-5 Н-имидазо[2,1-b][3]бензазепина (промежуточного соединения 13). В. Получение конечных продуктов Пример B.1. Смесь промежуточного соединения 2 (8,6 г), промежуточного соединения 13 (6 г) и гидрокарбоната натрия (2,2 г) в этаноле (300 мл) перемешивают при нагревании до температуры кипения с обратным холодильником в течение 48 ч. Растворитель упаривают и остаток растворяют в воде и ДХМ. Слои разделяют и водный слой экстрагируют ДХМ. Органический слой отделяют, сушат (МgSO4), фильтруют и упаривают растворитель. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: CH2Cl2/(СН 3 ОН/NН 3) 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из этанола. Осадок отфильтровывают и сушат, получая 8,21 г (73%) 3 хлор-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Нимидазо[2,1-b][3]бензазепина (соединения 13). Аналогично синтезируют 6,11-дигидро-11[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4 пиперидинилиден]-5 Н-имидазо[2,1-b][3]-бензазепин-3-метанол (соединение 2). Пример В.2. 2-(Хлорметил)хинолин-моногидрохлорид(4,06 г) растворяют в воде, подщелачивают К 2 СО 3 и экстрагируют ДХМ. Органический слой сушат (MgSO4), фильтруют и упаривают,получая 2-(хлорметил)хинолин. К раствору промежуточного соединения 8 (6,5 г) в ДМФ(350 мл) добавляют при комнатной температуре гидрид натрия (0,7 г) и смесь перемешивают в течение 30 мин. Добавляют растворенный в ДМФ 2-(хлорметил)хинолин и смесь перемешивают при 50 С в течение 3 ч. Смесь упаривают,остаток растворяют в воде и экстрагируют ДХМ. Органический слой сушат (МgSO4),фильтруют и упаривают. Остаток кристаллизуют из АЦН, осадок отфильтровывают, получая 5,52 г(64%) 11-[1-3,5-диметокси-4-(2 хинолинилметокси)-фенил]метил]-4-пиперидинилиден]-6,11-дигидро-5 Н-имидазо[2,1-b][3]бензазепин (соединение 32, т. пл. 214,8C). Пример В.3. Смесь соединения 2 (5,56 г) и N,Nдиэтилэтанамина (1,2 г) в ДХМ (100 мл) перемешивают при комнатной температуре до пол 23 ного растворения. Добавляют по каплям раствор ацетилхлорида (0,86 г) в ДХМ. Смесь перемешивают при комнатной температуре 1 ч. Добавляют К 2 СО 3 и воду и смесь разделяют на два слоя. Водный слой экстрагируют ДХМ. Объединенный органический слой сушат (MgSO4),фильтруют и упаривают растворитель. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 3,95 г (66%) [5,6 дигидро-11-[1-[2-[4-(2-хинолинилметокси) фенил]этил]-4-пиперидинилиден]-11 Н-имидазо(11 л) при постоянном перемешивании. Добавляют двуокись марганца (450 г) в 100-г порциях и полученную реакционную смесь перемешивают 1 ч. Смесь фильтруют через дикалит и фильтрат упаривают. Остаток перемешивают в АЦН, отфильтровывают и сушат, получая 170 мг (83%) 6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксальдегида (соединения 4, т. пл. 193,5 С). Пример В.5. Смесь соединения 4 (8,32 г) и метилметилтиометилсульфоксида (MMTS) (4,5 г) в ТГФ (100 мл) и гидроксидбензилтриметиламмония (40% в метаноле; 20 мл) перемешивают при нагревании до температуры кипения с обратным холодильником в течение ночи. Растворитель упаривают. Остаток растворяют в воде и экстрагируют ДХМ. Органический слой отделяют, сушат (MgSO4), фильтруют и упаривают растворитель. Дважды добавляют толуол и упаривают снова. Остаток растворяют в метаноле (50 мл). Газообразный НСl барботируют в течение 30 мин через смесь, охлажденную на ледяной бане. Смесь перемешивают в течение ночи. Растворитель упаривают. Остаток растворяют в воде, подщелачивают К 2 СО 3 и экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и растворитель упаривают. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: CH2Cl2/CH3OH 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 2,7 г (30%) метил-6,11-дигидро-11-[1-[2-[4(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3 ацетата (соединения 5). Пример В.6. Смесь соединения 4 (164 г), цианата натрия (80 г) и двуокиси марганца (500 г) в метаноле (5,5 л) перемешивают при комнатной температуре. Добавляют по каплям этановую кислоту (122 г) и образовавшуюся реакционную смесь перемешивают при нагревании до температуры кипения с обратным холодильником в течение ночи. Реакционную смесь фильтруют 24 через дикалит и остаток на фильтре промывают СН 3 ОН/СН 2 Сl2. Фильтрат упаривают. Остаток распределяют между ДХМ и водным раствором К 2 СО 3. Органический слой отделяют, сушат(МgSO4), фильтруют и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 152 г (87%) метил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Нимидазо[2,1-b][3]бензазепин-3-карбоксилата(соединения 6, т. пл. 179,3 С). Пример В.7. Смесь соединения 6 (37 г) в NaOH (1H, 150 мл), ТГФ (500 мл) и воды (500 мл) перемешивают при комнатной температуре в течение ночи. Органический растворитель упаривают. Водный концентрат промывают ДХМ и подкисляют НСl (1H, 150 мл). Растворитель упаривают. Остаток перемешивают в воде, отфильтровывают и сушат, получая 32 г (84%) 6,11 дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Н-имидазо(100 мг) перемешивают при комнатной температуре. Добавляют порциями боргидрид натрия(0,34 г) и смесь перемешивают при комнатной температуре в течение 2 ч. Смесь упаривают,остаток растворяют в воде и экстрагируют СН 2 Сl2/С 2 Н 5OН. Органический слой сушат,фильтруют и упаривают. Остаток перекристаллизовывают из АЦН. Осадок отфильтровывают и сушат, получая 2,39 г (68%) -6,10-дигидро 10-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4 пиперидинилиден]-5 Н-имидазо[1,2-а]тиено[3,2d]азепин-6-ола (соединения 28, т. пл. 242,1 С). Пример В.9. Смесь соединения 7 (3 г) и N,N-диметил-4 пиридинамина (1,22 г) в ДХМ (100 мл) перемешивают до полного растворения. Добавляют порциями гидрохлорид 1-(3-диметиламинопропил-3-этилкарбодиимида (1,8 г) и смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют раствор бензолметанола (0,54 г) в ДХМ. Смесь перемешивают при комнатной температуре в течение ночи. Растворитель упаривают. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН 97/3-95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 2,06 г (62%) фенилметил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилата(соединения 9). Аналогичным способом, но заменяя спирт аммиаком или диметиламином, синтезируют,соединение 55 (смесь) и соединение 56 (смесь),соответственно. 25 Пример В.10. Смесь соединения 2 (27,8 г) в ДХМ (500 мл) перемешивают при комнатной температуре до полного растворения. Добавляют порциями перекись бензоила (несколько кристаллов), затем добавляют по каплям при комнатной температуре раствор N-хлорсукцинимида (7 г) в ДХМ и смесь перемешивают при комнатной температуре 18 ч. Растворитель упаривают и остаток чистят колоночной хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) 96/4-92/8). Очищенные фракции собирают и растворитель упаривают. Остаток чистят дополнительно ЖХВР на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 96/4-50/50). Очищенные фракции собирают и растворитель упаривают. Первую фракцию кристаллизуют из СН 3 ОН, получая 8,84 г (30%) соединения 59. Вторую фракцию перекристаллизовывают из АЦН, получая 1,91 г (6%) соединения 58. Пример В.11. Смесь соединения 6 (5,55 г) и метил(трифенилфосфоранилиден)ацетата (3,34 г) в толуоле (300 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение ночи. Растворитель упаривают. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают, сушат, перекристаллизовывают из АЦН и чистят ЖХВР наHypersil RP-18 3 мкМ (элюент: (NH4OAc/0,5% в Н 2O)/СН 3 ОН/СН 3 СN 70/15/15, 0/50/50-0/0/100). Очищенные фракции собирают, упаривают до водного концентрата и экстрагируют ДХМ. Органический слой отделяют, сушат, фильтруют и упаривают растворитель. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат,получая 0,45 г (7%) соединения 62. Пример В.12. Смесь соединения 71 (4,5 г) в СН 3 ОН (350 мл) перемешивают на ледяной бане. Добавляют порциями NaBH4 (0,38 г) при 0 С за 15 мин. Смесь перемешивают при комнатной температуре 1 ч и затем разлагают водой. Органический растворитель упаривают. Водный концентрат экстрагируют ДХМ. Объединенный органический слой сушат, фильтруют и упаривают растворитель. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 3,5 г (78%) соединения 73. Пример В.13. Смесь метил-6,11-дигидро-4-пиперидинилиден-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилата (3,23 г) и N,N-диметилпиридинамина (2,4 г) в ДХМ (200 мл) перемешивают при комнатной температуре. Добавляют порциями 1-(3 001004 26 диметиламинопропил)-3-этилкарбодиимидгидрохлорид (3,83 г). Смесь перемешивают при комнатной температуре 1 ч. Добавляют по каплям 4-(2-хинолинилметокси)бензойную кислоту(2,8 г), растворенную в ДХМ. Смесь перемешивают при комнатной температуре в течение ночи. Добавляют воду. Смесь разделяют на слои. Водный слой экстрагируют ДХМ. Объединенный органический слой сушат, фильтруют и упаривают растворитель. Остаток чистят колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток растворяют в СН 3 ОН и превращают в соль (Е)-2 бутендионовой кислоты (1:1). Осадок отфильтровывают и сушат, получая 3,36 г (48%) соединения 72. Пример В.14. Смесь соединения 71 (4,5 г) и гидроксиламина (1,1 г) в пиридине (50 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 90 мин. Растворитель упаривают. Остаток смешивают с Н 2O/СН 2 Сl2. Добавляют К 2 СО 3 (2 г). Смесь делят на слои. Водный слой экстрагируют ДХМ. Объединенный органический слой сушат, фильтруют и упаривают растворитель. Остаток чистят, пропуская через силикагель на стеклянном фильтре(элюент: СН 2 Сl2/СН 3 ОН 95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из АЦН. Осадок отфильтровывают и сушат, получая 1,21 г (26%) соединения 74. Пример В.15. Смесь 4-феноксибензальдегида (2 г) и метил-6,11-дигидро-4-пиперидинилиден-5 Нимидазо[2,1-b][3]бензазепин-3-карбоксилата(3,23 г) в метаноле (150 мл) гидрируют при комнатной температуре в течение ночи с Pd/C(10%, 1 г) в качестве катализатора и в присутствии раствора тиофена (1 мл). После поглощения водорода (1 эквивалент), катализатор отфильтровывают и фильтрат упаривают. Остаток чистят, пропуская через силикагель на стеклянном фильтре (элюент: СН 2 Сl2/СН 3 ОН 97/3-95/5). Очищенные фракции собирают и растворитель упаривают. Остаток кристаллизуют из СН 3 ОН. Осадок отфильтровывают и сушат, получая 2,86 г (57%) соединения 90. Пример В.16. Смесь диизопропаноламина (1,13 г) в ТГФ перемешивают в атмосфере азота при -78 С. Добавляют порциями при -70 С N-бутиллитий(2,5 М в гексане, 4,3 мл) и смесь перемешивают 15 мин. Добавляют по каплям при -70 С растворенный в ТГФ 1-(диэтоксиметил)-1H-имидазол(1,81 г) и смесь перемешивают при -70 С в течение 1 ч. Добавляют по каплям при -70 С растворенное в ТГФ соединение 4 (5,54 г) и смесь перемешивают при -70 С в течение 1 ч. Смесь приводят к комнатной температуре и перемешивают при комнатной температуре в течение ночи. Добавляют уксусную кислоту (5 мл) и смесь перемешивают при комнатной температуре 20 мин. Добавляют К 2 СО 3 (5 г) и смесь упаривают. Остаток растворяют в воде и ДХМ и разделяют слои. Водный слой экстрагируют ДХМ. Объединенные органические слои сушат,отфильтровывают и упаривают растворитель,получая 6,1 г (97%) 6,11-дигидро(1 Нимидазол-2-ил)-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Нимидазо[2,1-b][3]бензазепин-3-метанола (соединения 46). В таблицах F-1 - F-6 перечислены соединения, полученные в описанных выше примерах, а в таблице F-7 приведены как экспериментальные (колонка, озаглавленная "эксп."), так и теоретические (колонка, озаглавленная "теор.") данные элементного анализа на углерод, водород и азот для соединений, полученных в приведенной выше экспериментальной части. Таблица F-1 С. Фармакологические примеры Пример C.1. Эффективность in vitro соединений формулы (I) как MDR-модуляторов исследуют, используя человеческую линию раковых клеток с множественной лекарственной устойчивостьюPhamacol., 33:317-324 (1994. Кратко оценивают рост клеток К 562/С 1000, человеческой линии раковых клеток с множественной лекарственной устойчивостью, в присутствии полного интервала концентраций (в пределах от 10-12 до 10-5 М) классического цитостатика, например винбластина. Измеряют величину IС 50 (цитостатик),т.е. концентрацию цитостатика, необходимую для снижения роста клеток на 50%. Кроме того,рост К 562/С 1000 измеряют в присутствии полного интервала концентраций классического цитостатика и фиксированной концентрацииIС 50 (цитостатик) к IС 50 (цитостатик/соединение). Соединения 1, 3, 4, 6, 9, 11-13, 18, 20, 21, 30-36, 47, 45, 58,61-63, 65, 67, 69, 70, 73, 74, 75, 77, 82, 84, 87-89 и 91-101, перечисленные в таблицах F-1 - F-6,имеют значение SR выше или равное 5. Соединения 2, 5, 8, 14, 15, 19, 22, 23-25, 26, 29, 33, 37,38, 48, 52, 55-57, 64, 68, 71, 76, 78, 79, 80 и 85,перечисленные в таблицах F-1 - F-6, имеют значение SR между 1 и 5. Пример С.2. Способность соединений формулы (I) реверсировать множественную лекарственную устойчивость может быть продемонстрирована способностью соединений формулы (I) реверсировать устойчивость к адриамицину на мышином лейкозе в P388/ADR (адриамицинустойчивой клеточной линии) in vivo. Самцам В 6D2F1-мышей (18-21 г) впрыскивают внутрибрюшинно 1105 P388/ADRклетки на 0 день. Ежедневно с 1 по 10 день внутрибрюшинно обрабатывают адриамицином,испытуемым соединением формулы (I) или сочетанием обоих соединений. Контрольным животным вводят разбавитель (15% 4-ОН-пропил-циклодекстрин в физиологическом растворе). Каждая группа состоит из 8 животных. Адриамицин дозируют при концентрации 1,25 мг/кг массы тела, половиной максимально переносимой дозы адриамицина по данной схеме обработки лекарственным средством. Испытуемое соединение вводят дозами в 20, 10, 5, 2,5, 1,25 и 0,63 мг/кг, либо отдельно, либо в сочетании с адриамицином. Выживаемость животных регистрируют каждый день и выражают как процент среднего выживания в обработанной группе в сравнении со средним выживанием в контрольной группе,последняя величина принимается за 100%. В таблице С-1 показано влияние соединения 6 и адриамицина на выживание мышей, которым введена инъекция Р 388/АDR-лейкоза.- В колонке "дни выживания" указан средний день гибели после инокуляции 1105 Р 388/ADR-клеток на 0 день, с указанием в скобках минимального и максимального числа дней.- В колонке "MST%" приведен средний процент выживания в обработанной группе по сравнению со средним выживанием в контрольной группе, последнее принимается за 100%.- В колонке "% изменения против ADR" приведено различие в MST% различных групп в сравнении с MST% в группе адриамицинмонотерапии. Таблица С-1 Соед.6 Адриамицин Дни выживания MST% 32 Таблица С-1 иллюстрирует, что группе,обработанной сочетанием соединения 6 и адриамицина, соответствует среднее время выживания (MST), которое на 14-23% больше, чем для группы адриамицин-монотерапии.D. Примеры композиций Последующие составы служат характерными примерами фармацевтических композиций в виде стандартных лекарственных форм для системного или местного введения теплокровным животным согласно данному изобретению."Активный ингредиент" (А.И.) применительно к приведенным примерам обозначает соединение формулы (I), его форму N-оксида,фармацевтически приемлемую кислотную или основную аддитивную соль или стереохимически изомерную форму. Пример D.1. Пероральные растворы. 9 г Метил-4-гидроксибензоата и 1 г пропил-4-гидроксибензоата растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворяют сначала 10 г 2,3-дигидроксибутандионовой кислоты и затем 20 г А.И. Полученный раствор объединяют с оставшейся частью первоначального раствора и добавляют туда 12 л 1,2,3-пропантриола и 3 л 70% раствора сорбита, 40 г сахарина натрия растворяют в 0,5 л воды и добавляют 2 мл малиновой эссенции и 2 мл эссенции крыжовника. Полученный раствор объединяют с предшествующим, добавляют воду до объема 20 л, получая пероральный раствор, содержащий 5 мг А.И. в полной чайной ложке (5 мл). Полученный раствор заливают в подходящие емкости. Пример D.2. Капсулы. 20 г А.И., 6 г лаурил сульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния и 1,2 г стеарата магния вместе энергично перемешивают. После чего образовавшейся смесью заполняют 1000 подходящих твердых желатиновых капсул, в каждой капсуле содержится 20 мг А. И. Пример D.3. Таблетки с пленочным покрытием. Получение ядра таблеток Смесь 100 г А.И., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона приблизительно в 200 мл воды. Влажную порошкообразную смесь просеивают, сушат и снова просеивают. Затем добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Всю массу хорошо перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента. Покрытие К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана. За 33 тем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл дихлорметана. Полученный раствор добавляют к предыдущему и туда же добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной красящей суспензии и все гомогенизируют. Ядра таблеток покрывают полученной таким образом смесью в приборах для покрытия пленкой. Пример D.4. Инъекционный раствор. 1,8 г Метил-4-гидроксибензоата и 0,2 г пропил-4-гидроксибензоата растворяют приблизительно в 0,5 л кипящей воды для инъекции. После охлаждения примерно до 50 С добавляют при перемешивании 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г А.И. Раствор охлаждают до комнатной температуры и разбавляют водой для инъекции до объема в 1 л, что дает раствор, содержащий 4 мг/мл А.И. Раствор стерилизуют фильтрацией и заполняют стерильные емкости. Пример D.5. Суппозитории. 3 г А.И. растворяют в растворе 3 г 2,3 дигидроксибутандионовой кислоты в 25 мл полиэтиленгликоля 400. Сплавляют вместе 12 г сурфактанта и 300 г триглицерида. Полученную смесь хорошо перемешивают с предыдущим раствором. Полученную таким образом смесь выливают в формы при температуре 37-38 С,получая 100 суппозиториев, каждый из которых содержит 30 мг/мл А.И. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его N-оксидная форма, фармацевтически приемлемая аддитивная соль или стереохимически изомерная форма, где пунктирная линия обозначает простую связь, n равно 1 или 2;C1-4 алкил; C1-4 алкил, замещенный 1 или 2 заместителями, каждый из которых независимо выбран из гидрокси, C1-4 алкокси, C1-4 алкилкарбонилокси, имидазолила, тиазолила или оксазолила; или радикал формулы 34 каждый из R6 и R7 независимо обозначает водород или C1-4 алкил;R4 обозначает водород, галоген, C1-4 алкил,C1-4 алкилокси или галоид C1-4 алкил;Z1 обозначает двухвалентный радикал формулы -СН 2-, -СН 2-СН 2- или -СН=СН-; при условии, что, когда пунктирная линия обозначает связь, Z1 иной, чем -CH2-;Z2 обозначает двухвалентный радикал формулы-A-B- обозначает двухвалентный радикал формулы-CH=CH-CH=CR8(b-5),где каждый R8 независимо обозначает водород,галоген, C1-4 алкил, C1-4 алкилокси, гидрокси C1-4 алкил, гидроксикарбонил C1-4 алкил, формил,карбоксил, этенил, замещенный карбоксилом,или этенил, замещенный C1-4 алкилоксикарбонилом; каждый Y независимо обозначает двухвалентный радикал формулы -O-, -S-, или -NR9-; где R9 обозначает водород, C1-4 алкил или C1-4 алкилкарбонил;-А 1- обозначает простую связь; C1-6 алкандиил; C1-6 алкандиилокси C1-6 алкандиил; C1-6 алкандиилокси; C1-6 алкандиилкарбонил; C1-6 алкандиилокси, замещенный гидрокси, или C1-6 алкандиил, замещенный гидрокси или =NOH;-А 2- обозначает простую связь или C1-6 алкандиил;Q обозначает фенил; фенил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила,C1-4 алкилокси или галоген C1-4 алкила; нафталинил; нафталинил, замещенный одним или двумя заместителями, выбранными из водорода,галогена, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; пиридинил; пиридинил,замещенный одним или двумя заместителями,выбранными из водорода, галогена, гидрокси,C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; хинолинил или хинолинил, замещенный одним или двумя заместителями, выбранными из водорода, галогена, гидрокси, C1-4 алкила,C1-4 алкилокси или галоген C1-4 алкила;Ar обозначает фенил или фенил, замещенный 1, 2 или 3 заместителями, каждый из кото 35 рых независимо выбран из водорода, галогена,C1-4 алкила или C1-4 алкилокси;Het обозначает фуранил; фуранил, замещенный C1-4 алкилом, C1-4 алкилокси или гидрокси C1-4 алкилом; оксазолил; оксазолил, замещенный C1-4 алкилом или C1-4 алкилокси или хинолинил. 2. Соединение по п.1, где -А-В- обозначает двухвалентный радикал формулы (b-2), (b-3) или (b-4); Z обозначает Z1, где Z1 представляет двухвалентный радикал формулы -СН 2-СН 2 или -СН 2-, или Z обозначает Z2, где Z2 представляет двухвалентный радикал формулы -С(=О)СН 2-; -А 1- обозначает C1-6 алкандиил, C1-6 алкандиилокси, карбонил, C1-6 алкандиилокси, замещенный гидрокси, или C1-6 алкандиил, замещенный гидрокси; -А 2- обозначает простую связь или C1-6 алкандиил; Q обозначает фенил, нафталинил, пиридинил, хинолинил, фенил, замещенный галогеном или C1-6 алкилокси, нафталинил,замещенный галогеном или C1-6 алкилокси, пиридинил, замещенный галогеном или C1-6 алкилокси, или хинолинил, замещенный галогеном или C1-6 алкилокси; R1 обозначает водород, галоген, формил, C1-4 алкил, замещенный гидрокси, или радикал формулы (а-1), где Х обозначает простую связь или C1-4 алкандиил и R5 обозначает водород, C1-12 алкил, Ar или C1-6 алкил,замещенный Het; R2 обозначает водород, галоген, C1-4 алкил, формил, гидрокси C1-4 алкил илиC1-6 алкилокси и пунктирная линия обозначает связь. 3. Соединение по любому из пп.1-2, где Z обозначает -CH2-СН 2-; -А-В- обозначает-CH2-; R1 обозначает водород, галоген, формил или радикал формулы (а-1), где Х обозначает простую связь, и R5 обозначает водород,C1-12 алкил, Ar или C1-6 алкил, замещенный Het;R4 обозначает водород или C1-4 алкилокси и пунктирная линия обозначает простую связь. 4. Соединение по п.1, где соединением является метил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; или диметил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-2,3-дикарбоксилат; или этил-6,11-дигидро-11-[1-[2-[4-(2-хинолинилметокси)фенил]-этил]-4-пиперидинилиден 5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-11-[1-3,5-диметокси-4-(2-хинолинилметокси)фенил]-метил]-4-пиперидинилиден]-6,11-дигидро-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; 36 метил-6,11-дигидро-11-[1-[3-[4-(2-хинолинилметокси)фенил]пропил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-6,11-дигидро-11-[1-[2-[4-(2-нафталинилметокси)фенил]-этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; метил-6,11-дигидро-11-[1-[2-[4-фенилметокси)фенил]этил]-4-пиперидинилиден]-5 Нимидазо[2,1-b][3]бензазепин-3-карбоксилат; и метил-6,11-дигидро-11-[1-[2-[4-(1-нафталинилметокси)фенил]-этил]-4-пиперидинилиден]-5 Н-имидазо[2,1-b][3]бензазепин-3-карбоксилат; их стереоизомерные формы и фармацевтически приемлемые аддитивные соли. 5. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-4. 6. Способ получения фармацевтической композиции по п.5, отличающийся тем, что терапевтически активное количество соединения по любому из пп.1-4 тщательно смешано с фармацевтически приемлемым носителем. 7. Применение соединения по любому из пп. 1-4 в качестве лекарственного препарата. 8. Продукт, содержащийa) композицию, включающую фармацевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель; иb) композицию, включающую фармацевтически эффективное количество противоопухолевого средства и фармацевтически приемлемый носитель, в виде объединенного препарата для одновременного, раздельного или последовательного применения в противоопухолевой терапии. 9. Продукт, содержащийa) композицию, включающую фармацевтически эффективное количество соединения по любому из пп.1-4 и фармацевтически приемлемый носитель; иb) композицию, включающую фармацевтически эффективное количество противоопухолевого средства, используемого при лечении заболеваний, вызванных патогенными микроорганизмами, и фармацевтически приемлемый носитель, в виде объединенного препарата для одновременного, раздельного или последовательного применения при лечении заболеваний,вызванных патогенными микроорганизмами. 10. Соединение формулы (II-b) его фармацевтически приемлемая кислотноаддитивная соль или стереохимически изомерная форма,где n равно 1 или 2;R4 обозначает водород, галоген, C1-4 алкил,C1-4 алкилокси или галоген C1-4 алкил;Q1 обозначает фенил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галоген C1-4 алкила; нафталинил; нафталинил,замещенный одним или двумя заместителями,выбранными из водорода, гидрокси, C1-4 алкила,C1-4 алкилокси или галоген C1-4 алкила; пиридинил; пиридинил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила, C1-4 алкилокси или галогенC1-4 алкила; хинолинил или хинолинил, замещенный одним или двумя заместителями, выбранными из водорода, гидрокси, C1-4 алкила,C1-4 алкилокси или галоген C1-4 алкила;-А 2- обозначает простую связь или C1-6 алкандиил и W обозначает галоген, метансульфонилокси или бензолсульфонилокси. 11. Способ получения соединения формулы (I), отличающийся тем, что реагент формулы(III), где Т обозначает конденсированный имидазольный радикал подвергают взаимодействию с промежуточным соединением формулы (II), где W обозначает соответствующую удаляемую группу или преобразуют одни соединения формулы (I) в другие известными реакциями преобразования и, далее, при желании, переводят соединения 38 формулы I в кислотно-аддитивную соль путем обработки кислотой или в основно-аддитивнуто соль путем обработки основанием, или наоборот, переводят основно-аддитивную соль в свободную кислоту путем обработки кислотой и,при желании, получением его N-оксида и/или стереохимически изомерных форм. 12. Способ получения соединения формулы I, отличающийся тем, что промежуточное соединение формулы (IV), где W обозначает соответствующую удаляемую группу, подвергают O-алкилированию с реагентом формулы или преобразуют одни соединения формулы (I) в другие известными реакциями преобразования и, далее, при желании, переводят соединения формулы I в кислотно-аддитивную соль путем обработки кислотой или в основно-аддитивную соль путем обработки основанием, или наоборот, переводят основно-аддитивную соль в свободную кислоту путем обработки кислотой и,при желании, получением его N-оксида и/или стереохимически изомерных форм. 13. Способ получения соединения по п.10,где промежуточное соединение формулы (VI)O-алкилируют промежуточным соединением формулы (IV) в реакционно-инертном растворителе и далее гидроксигруппу промежуточного соединения формулы (VII) преобразуют в удаляемую группу W в приведенной выше реакционной схеме n, R4,Q1, А 1', А 2 и W определены в п.10, и W1 обозначает подходящую удаляемую группу; или промежуточное соединение формулы(II-а) преобразуют в кислотно-аддитивную соль,или наоборот, кислотно-аддитивную соль преобразуют в форму свободного основания с помощью щелочи и, при желании, получают их стереохимически изомерные формы.
МПК / Метки
МПК: A61P 35/00, C07D 495/14, A61K 31/55, C07D 487/04, C07D 487/14
Метки: качестве, производные, лекарственной, конденсированные, модуляторов, имидазола, устойчивости, множественной
Код ссылки
<a href="https://eas.patents.su/20-1004-kondensirovannye-proizvodnye-imidazola-v-kachestve-modulyatorov-mnozhestvennojj-lekarstvennojj-ustojjchivosti.html" rel="bookmark" title="База патентов Евразийского Союза">Конденсированные производные имидазола в качестве модуляторов множественной лекарственной устойчивости</a>
Предыдущий патент: Способ ингибирования ингибитора 1 активатора плазминогена.
Следующий патент: Устройство световой индикации
Случайный патент: Рулон, содержащий последовательность листов абсорбирующей бумаги одноразового использования












