Гидроксиметиларилзамещенные пирролотриазины в качестве ингибиторов alk1
Номер патента: 23775
Опубликовано: 29.07.2016
Авторы: Тельзер Ёахим, Лобель Марио, Гольц Штефан, Шланге Томас, Фёрингер Верена, Ли Фолькхарт Мин-Иан, Фу Венланг, Бёттгер Михаель, Ланг Дитер, Шалль Андреас, Клар Юрген, Шлеммер Карл-Хайнц, Зюссмайер Франк
Формула / Реферат
1. Соединение формулы (I)
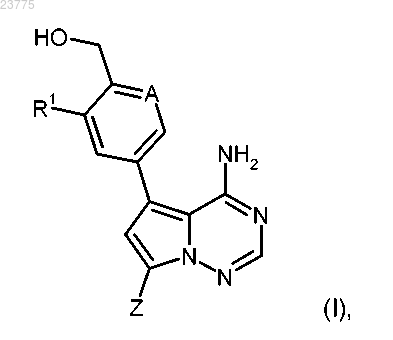
где А означает C-R2, где R2 представляет собой водород, фтор или хлор;
R1 представляет собой водород, фтор, хлор, метил, этил или метокси;
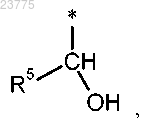
Z представляет собой (С1-С4)алкил или (С3-С6)циклоалкил, каждый из которых может быть замещен гидрокси, или
Z представляет собой гетероциклическую группу формулы
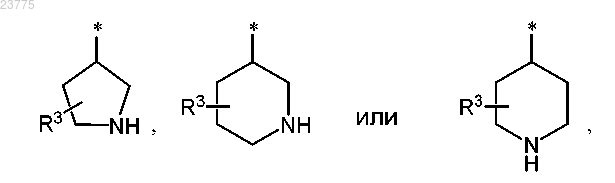
где * указывает точку присоединения пирролотриазиновой группы;
R3 представляет собой водород или гидрокси,
при условии, что, если R3 означает гидрокси, указанный гидрокси не присоединен к кольцевому атому углерода, который расположен вблизи от кольцевого атома азота, или
Z представляет собой тиазоловую группу формулы

где * указывает точку присоединения пирролотриазиновой группы;
R4 представляет собой водород, метил, этил, амино или аминометил, или
Z представляет собой группу формулы
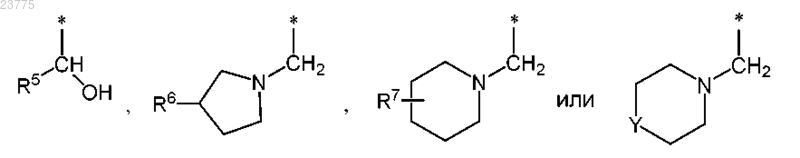
где * указывает точку присоединения пирролотриазиновой группы;
R5 представляет собой (С3-С6)циклоалкил или тетрагидропиранил;
R6 представляет собой водород или гидрокси;
R7 представляет собой водород или гидрокси,
при условии, что, если R7 означает гидрокси, указанный гидрокси не присоединен к кольцевому атому углерода, который расположен вблизи от кольцевого атома азота;
Y означает О или NH,
или его фармацевтически приемлемая соль, гидрат и/или сольват.
2. Соединение формулы (I) по п.1, отличающееся тем, что
А означает C-R2, где R2 представляет собой водород или фтор;
R1 представляет собой водород, фтор, хлор, метил, этил или метокси;
Z представляет собой н-пропил, н-бутил или циклогексил, каждый из которых может быть замещен гидрокси, или
Z представляет собой гетероциклическую группу формулы
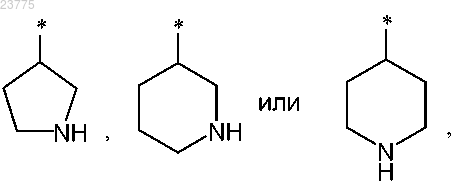
где * указывает точку присоединения пирролотриазиновой группы, или
Z представляет собой тиазоловую группу формулы
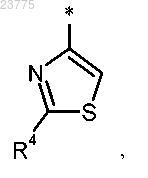
где * указывает точку присоединения пирролотриазиновой группы;
R4 представляет собой метил, этил, амино или аминометил, или
Z представляет собой группу формулы
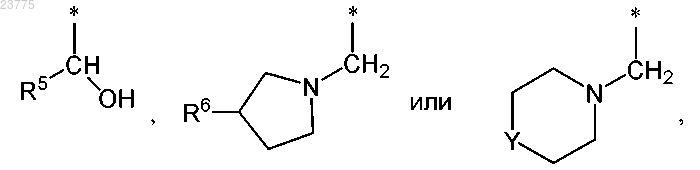
где * указывает точку присоединения пирролотриазиновой группы;
R5 представляет собой циклопропил или тетрагидропиран-4-ил;
R6 представляет собой гидрокси;
Y означает О,
или его фармацевтически приемлемая соль, гидрат и/или сольват.
3. Соединение формулы (I) по п.1 или 2, отличающееся тем, что
А означает C-R2, где R2 представляет собой водород или фтор;
R1 представляет собой водород, фтор, метил, этил или метокси;
Z представляет собой 4-гидроксибутил или 4-гидроксициклогексил, или
Z представляет собой гетероциклическую группу формулы

где * указывает точку присоединения пирролотриазиновой группы, или
Z представляет собой тиазоловую группу формулы
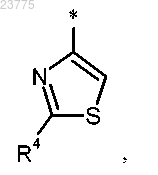
где * указывает точку присоединения пирролотриазиновой группы;
R4 представляет собой метил, этил, амино или аминометил, или
Z представляет собой группу формулы
где * указывает точку присоединения пирролотриазиновой группы;
R5 представляет собой циклопропил,
или его фармацевтически приемлемая соль, гидрат и/или сольват.
4. Способ получения соединения формулы (I) по любому из пп.1-3, отличающийся тем, что бромпирролотриазин формулы (II)
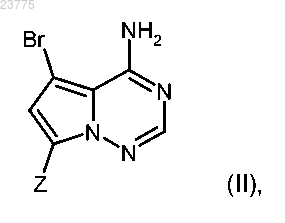
где Z имеет значение, указанное в пп.1-3,
сочетается с арилбороновой кислотой или эфиром формулы (III)
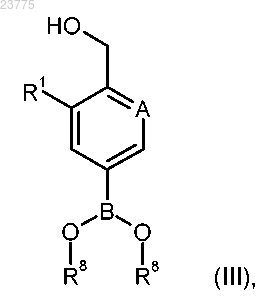
где А и R1 имеют значения, указанные в пп.1-3;
R8 представляет собой водород или (С1-С4)алкил, или оба R8 остатка соединены вместе с образованием -(СН2)2-, -С(СН3)2-С(СН3)2-, -(СН2)3- или -СН2-С(СН3)2-СН2- моста,
в присутствии подходящего палладиевого катализатора и основания с получением целевого соединения формулы (I)
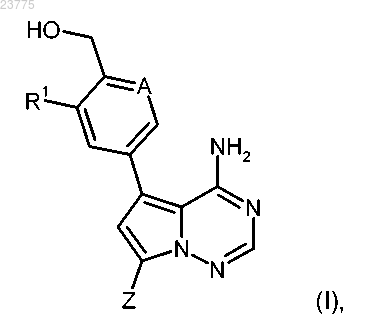
где A, Z и R1 имеют значения, указанные в пп.1-3,
после чего, при необходимости, следует в соответствующих случаях (i) разделение соединений формулы (I) в их соответствующие энантиомеры и/или диастереомеры и/или (ii) конверсия соединений формулы (I) в их соответствующие гидраты, сольваты, соли и/или гидраты или сольваты их солей путем обработки соответствующими растворителями и/или кислотами.
5. Способ получения соединения формулы (I) по любому из пп.1-3, отличающийся тем, что бромпирролотриазин формулы (II)
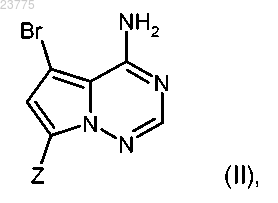
где Z имеет значение, указанное в пп.1-3,
сначала конвертируют в соответствующую бороновую кислоту или производное эфира формулы (IV)
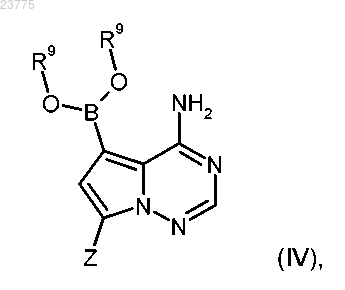
где Z имеет значение, указанное в пп.1-3;
R9 представляет собой водород или (С1-С4)алкил, или оба R9 остатка соединены вместе с образованием -(СН2)2-, -С(СН3)2-С(СН3)2-, -(СН2)3- или -СН2-С(СН3)2-СН2- моста, которое затем сочетается с арилбромидом формулы (V)
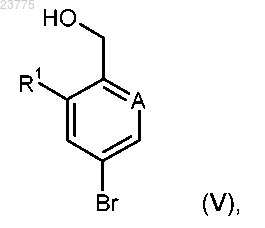
где А и R1 имеют значения, указанные в пп.1-3,
в присутствии подходящего палладиевого катализатора и основания также с получением целевого соединения формулы (I)
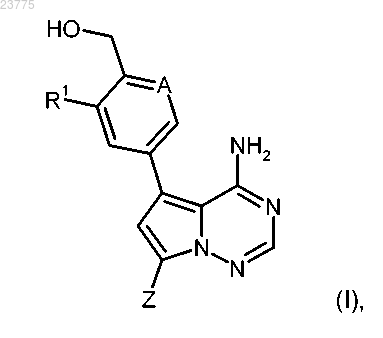
где A, Z и R1 имеют значения, указанные в пп.1-3,
после чего, при необходимости, следует в соответствующих случаях (i) разделение соединений формулы (I) в их соответствующие энантиомеры и/или диастереомеры и/или (ii) конверсия соединений формулы (I) в их соответствующие гидраты, сольваты, соли и/или гидраты или сольваты их солей путем обработки соответствующими растворителями и/или кислотами.
6. Применение соединения по любому из пп.1-3 для лечения или предупреждения возрастной дегенерации макулы, хороидальной неоваскуляризации, диабетической ретинопатии и диабетического макулярного отека.
7. Применение соединения по любому из пп.1-3 для производства фармацевтической композиции для лечения или предупреждения возрастной дегенерации макулы, хороидальной неоваскуляризации, диабетической ретинопатии и диабетического макулярного отека.
8. Фармацевтическая композиция, обладающая активностью ингибиторов ALK1, содержащая соединение по любому из пп.1-3 или его фармацевтически приемлемую соль, гидрат и/или сольват, а также одно или более фармацевтически приемлемых вспомогательных веществ.
9. Фармацевтическая композиция по п.8, дополнительно содержащая одно или более дополнительных лекарственных средств, обладающих активностью ингибиторов VEGF-опосредованного ангиогенеза или ингибиторов других сигнальных путей.
10. Фармацевтическая композиция по п.8 или 9 для лечения или предупреждения возрастной дегенерации макулы, хороидальной неоваскуляризации, диабетической ретинопатии и диабетического макулярного отека.
11. Способ лечения или предупреждения возрастной дегенерации макулы, хороидальной неоваскуляризации, диабетической ретинопатии и диабетического макулярного отека у млекопитающих, который включает введение нуждающемуся в таком лечении млекопитающему терапевтически эффективного количества одного или более соединений по любому из пп.1-3 или фармацевтической композиции по п.8 или 9.
Текст
Изобретение касается новых 5-[(гидроксиметил)арил]замещенных пирроло[2,1-f][1,2,4]триазин-4 аминов формулы (I), способов получения указанных соединений, фармацевтических композиций,содержащих указанные соединения, и применения указанных соединений или композиций для лечения заболеваний, связанных с ангиогенезом, в частности заболеваний глаз, связанных с ангиогенезом.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТУЭЛЬ ПРОПЕРТИ ГМБХ; БАЙЕР ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) Настоящее изобретение касается новых 5-[(гидроксиметил)арил]замещенных пирроло[2,1f][1,2,4]триазин-4-аминов формулы (I), способов получения указанных соединений, фармацевтических композиций, содержащих указанные соединения, и применения указанных соединений или композиций для лечения заболеваний, связанных с ангиогенезом, в частности заболеваний глаз, связанных с ангиогенезом. Термин "ангиогенез", также называемый "неоваскуляризация", означает процесс формирования новых кровеносных сосудов. Этот процесс является частью нормального развития, а также может происходить при многих патологических состояниях, включая, например, рак, ревматоидный артрит, заживление ран после повреждения тканей, атеросклероз, псориаз и заболевания глаза. Различные заболевания глаз, которыми обусловлена большая часть заболеваний зрения и случаев слепоты в развитых странах, характеризуются, являются следствием и/или возникают в результате хориоидальной, ретинальной неоваскуляризации или неоваскуляризации радужной оболочки или ретинального отека [Campochiaro (2004), Exp. Opin. Biol. Ther. 4: 1395-1402]. Например, диабетическая ретинопатия является основной причиной слепоты при диабете 1 типа, а также может зачастую возникать при диабете 2 типа. Еще одним глазным заболеванием, которое характеризуется неоваскуляризацией, является возрастная дегенерация макулы (ВДМ). ВДМ является наиболее частой причиной потери зрения в странах Запада у пациентов в возрасте 50 и более лет, и частота случаев потери зрения, обусловленных ВДМ, возрастает с увеличением возраста пациента. Существует два типа ВДМ: влажная (неоваскулярная) и сухая (неэкссудативная, атрофическая). Влажная форма заболевания является причиной наиболее тяжелых случаев потери зрения. Несколько других, менее распространенных, однако, тем не менее, тяжело протекающих ретинопатий включают хориоидальную неоваскулярную мембрану (ХНВМ), кистозный макулярный отек (КМО,который также называется "макулярный отек"), эпиретинальная мембрана (ЭРМ, макулярная складчатость) и макулярное отверстие. При ХНВМ аномальные кровеносные сосуды, идущие от сосудистой оболочки глаза, прорастают через слой сетчатки. Хрупкие новые сосуды легко разрываются; это приводит к тому, что кровь и жидкость накапливаются в слоях сетчатки. При КМО, который может развиться в результате заболевания, травмы или после хирургического вмешательства, жидкость накапливается в слоях макулы, в результате этого центральное зрение теряет четкость и искажается. ЭРМ (макулярная складчатость) - это мембрана, похожая на целлофановую пленку, которая образуется на макуле, в результате этого центральное зрение поражается и делается неясным и искаженным. Также сюда относятся гипертрофические и атрофические изменения пигментного эпителия сетчатки (ПЭС), отслоение сетчатки, окклюзия хориоидальной вены, окклюзия вены сетчатки, роговичный ангиогенез, вследствие, например, кератита, трансплантации роговицы или кератопластики, роговичный ангиогенез, обусловленный гипоксией (например, в результате длительного ношения контактных линз),птеригиум, субретинальный отек и интраретинальный отек. Было обнаружено, что фактор роста эндотелия сосудов (VEGF) является важным модулятором ангиогенеза, который непосредственно связан с несколькими патологическими состояниями, включая ВДМ и диабетическую ретинопатию. Более того, в отношении ВДМ было доказано, что интравитреальная инъекция анти-VEGF препаратов (ингибиторов ангиогенеза), таких как пегаптаниб, ранибизумаб или афлиберцепт, снижает хороидальный ангиогенез и пропотевание жидкости через сосуды [Gragoudas(2004), N. Engl. J. Med. 351: 2805-2816; Rosenfeld (2006), N. Engl. J. Med. 355: 1419-1431; Dixon (2009),Expert Opin. Investig. Drugs 18: 1573-1580]. Современным стандартом терапии для ВДМ является луцентис (ранибизумаб), анти-VEGF терапия. Тем не менее, лишь у 1/3 из всех пациентов с ВДМ, получавших терапию луцентис, проявляются улучшения зрения [Rosenfeld (2006), N. Engl. J. Med. 355: 1419-1431]. Таким образом, с помощью новых возможных методов антиангиогенной терапии с VEGF-независимым механизмом действия потенциально можно улучшить современный стандарт терапии при заболеваниях глаза, таких как диабетическая ретинопатия и ВДМ.ALK1 (активин-подобная киназа-1) - это Ser/Thr-киназный рецептор TGF семейства рецепторов,который экспрессируется преимущественно в эндотелиальных клетках и который участвует в ангиогенезе. Члены этого семейства медиируют свою биологическую активность путем связывания лигандов с комплексом гетеротетрамерного рецептора I типа и серин/треонин киназными рецепторами II типа TRI и TRII и вспомогательными рецепторами III типа. TGF, а также высокоаффинные лиганды ВМР 9 и ВМР 10 способны активировать ALK1 в рецепторных комплексах с BMPRII или ActRII и рецептором III типа эндоглином [Scharpfenecker (2007), J. Cell Sci. 120: 964-972]. Связывание ВМР 9 с ALK1 в эндотелиальных клетках микрососудов активирует Smad1/5/8 путь [David (2007), Blood 109(5): 1953-1961]. Предполагается, что ВМР 9 подавляет миграцию и рост эндотелиальных клеток. В большинстве исследований,однако, было обнаружено, что активация ALK1 рецептора стимулирует миграцию, пролиферацию и образование трубочек эндотелиальных клеток [Goumans (2002), EMBO Journal 21(7): 1743-1753; Wu (2006),Microvasc. Res. 71: 12-19]. способен активизировать ALK1, в то время как в большинстве типов клеток TGF сигнализирует черезALK5. Активация ALK5 приводит к фосфорилированию Smad2/3, в то время как активация ALK1 приводит к фосфорилированию Smad1/5. Каждый сигнальный путь Smad в конце концов приводит к регуляции специфических наборов целевых генов: сигнальный путь Smad2/3 индуцирует экспрессию PAI-1 и репрессию Id-1, в то время как сигнальный путь Smad1/5 индуцирует экспрессию Smad6, Smad7 и Id-1 и снижает экспрессию PAI-1 [Deng (2006), J. Cell Biol. 134: 1563-1571; Ota (2002), J. Cell Physiol. 193:299318]. Рецептор III типа эндоглин участвует в настройке путей ALK1 и ALK5, в особенности в эндотелиальных клетках, регулируя взаимодействия лиганд-рецептор [ten Dijke (2008), Angiogenesis 11: 79-89]. Эндоглин стимулирует взаимодействие TGF/ALK, но снижает взаимодействие TGF/ALK5 [David(2007), Blood 109: 1953-1961]. Мутации в эндоглине и ALK1 связаны с аутосомно-доминантным заболеванием, называемым наследственная геморрагическая телеангиэктазия (НГТ 1 и НГТ 2, соответственно), которое имеет характеристики заболеваний, связанных с ангиогенезом, таких как артериовенозная мальформация и телеангиэктазия [Fernandez-Lopez (2006), Clin. Med.Res. 4: 66-78]. У RIP1-Tag2 мышей, имеющих только одну функциональную копию ALK1 гена (ALK1+/-), проявляется замедленное развитие опухолей и уменьшенная плотность микрососудистой сети, по сравнению с ALK1wt мышами. Подобные наблюдения были сделаны с растворимым ALK1-Fc рецепторным конструктом RAP-041, который подавлял опухолевый ангиогенез in vivo и сдерживал опухолевый рост [Cunha (2010), J. Exp. Med. 207: 85-100]. Таким образом, изобретение сильнодействующих и селективных ALK1 ингибиторов является в высшей степени желательным для дальнейшего прояснения роли ALK1 в физиологии и патологии кровеносных сосудов и для возможных способов лечения заболеваний, связанных с ангиогенезом и васкулярным ремоделированием. В документе WO 2007/147647-А 1 описаны определенные производные 3-арил-замещенного пиразоло[1,5-а]пиримидина, что было первой публикацией, где были описаны низкомолекулярные ингибиторы ALK1 киназы. Считается, что эти соединения могут применяться для лечения заболеваний, связанных с неуправляемым ростом сосудов, в частности, для лечения солидных опухолей и метастазов солидных опухолей, а также глазных заболеваний, связанных с ангиогенезом, таких как возрастная дегенерация макулы. Различные производные пирроло[2,1-f][1,2,4]триазин-4-амина с выраженными профилями ингибирования в отношении целого ряда протеин киназ раскрыты, помимо прочего, в документах WO 00/71129A1, WO 2005/121147-А 1, WO 2007/056170-А 2, WO 2007/061882-А 2, WO 2007/064883-A2, WO 2007/064931-А 2, WO 2007/079164-А 2, WO 2008/089105-А 2, WO 2009/136966-A1 и WO 2010/126960-A1. В целом считается, что эти соединения могут применяться для лечения пролиферативных заболеваний и/или заболеваний, связанных с ангиогенезом. Тем не менее, ни в одной из этих публикаций ALK1 не указана как потенциально целевая киназа. Неожиданно было обнаружено, что производные пирроло[2,1-f][1,2,4]триазин-4-аминов, имеющие гидроксиметиларил заместитель в 5-положении, проявляют сильное и селективное ингибирование ALK1 киназы, что делает такие соединения особенно полезными при лечении заболеваний глаз, связанных с ангиогенезом. Таким образом, в соответствии с одним аспектом настоящее изобретение относится к 5[(гидроксиметил)арил]замещенным пирроло[2,1-f][1,2,4]триазин-4-аминам общей формулы (I)Z представляет собой (С 1-С 4)алкил или (С 3-С 6)циклоалкил, каждый из которых может быть замещен гидрокси, илиZ представляет собой гетероциклическую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;R3 представляет собой водород или гидрокси,при условии, что, если R3 означает гидрокси, указанный гидрокси не присоединен к кольцевому атому углерода, который расположен вблизи от кольцевого атома азота, илиZ представляет собой тиазоловую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;Z представляет собой группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;R6 представляет собой водород или гидрокси;R7 представляет собой водород или гидрокси,при условии, что, если R7 означает гидрокси, указанный гидрокси не присоединен к кольцевому атому углерода, который расположен вблизи от кольцевого атома азота;Y означает О или NH. Соединения по настоящему изобретению также могут присутствовать в форме своих солей, сольватов и/или сольватов своих солей. Соединениями по настоящему изобретению являются соединения формулы (I), a также их соли,сольваты и/или сольваты солей, соединения, включенные в формулу (I) из формул, указанных ниже по тексту настоящего документа, а также их соли, сольваты и/или сольваты солей, и соединения, включенные в формулу (I), которые указаны ниже в качестве примеров вариантов осуществления изобретения, а также их соли, сольваты и/или сольваты солей, где соединения, включенные в формулу (I) и указанные ниже по тексту настоящего документа, не являются уже солями, сольватами и/или сольватами солей. Под термином "соли" для целей настоящего изобретения предпочтительно подразумеваются фармацевтически приемлемые соли соединений по настоящему изобретению (см., например, S.M. Berge etal., "Pharmaceutical Salts", J. Pharm. Sci. 1977, 66, 1-19). Также сюда входят соли, которые сами по себе не пригодны для фармацевтического использования, но которые могут использоваться, например, для выделения или очистки соединений по настоящему изобретению. Фармацевтически приемлемые соли включают кислотно-аддитивные соли минеральных кислот,карбоновых кислот и сульфоновых кислот, например, соли соляной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты,бензол-сульфоновой кислоты, толуолсульфоновой кислоты, нафталиндисульфоновой кислоты, уксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты. Сольваты в контексте настоящего изобретения определяются как такие формы соединений по настоящему изобретению, которые в твердом или жидком состоянии формируют комплекс путем стехиометрической координации с молекулами растворителя. Гидраты являются особой формой сольватов, в которых растворителем выступает вода. Гидраты являются предпочтительными сольватами в контексте настоящего изобретения. Соединения по настоящему изобретению могут либо в силу характера центров асимметрии, либо вследствие ограниченного вращения, присутствовать в форме изомеров (энантиомеров, диастереомеров). Может присутствовать любой изомер, в котором асимметрический центр находится в (R)-, (S)- или (R,S)конфигурации. Следует понимать, что в случае, когда в соединениях по настоящему изобретению присутствуют два и более центра асимметрии, зачастую возможны несколько диастереомеров и энантиомеров с представленными в качестве примера структурами, и что чистые диастереомеры и энантиомеры представляют предпочтительные вариант осуществления изобретения. Предполагается, что чистые стереоизомеры,чистые диастереомеры и энантиомеры и их смеси также включены в объем настоящего изобретения. Геометрические изомеры по характеру заместителей относительно двойной связи или кольца могут присутствовать в цис- (= Z-) или транс- (= Е-) форме, и обе формы изомеров также включены в объем настоящего изобретения. Все изомеры соединений настоящего изобретения, независимо от того, отдельные ли это изомеры,чистые или частично очищенные изомеры или изомеры в виде рацемической смеси, также включены в объем настоящего изобретения. Очистка указанных изомеров и разделение указанных смесей изомеров может производиться с использованием стандартных техник, известных специалистам. Например, диастереомерные смеси могут быть разделены на отдельные изомеры методами хроматографии или кристаллизации, а рацематы могут быть разделены на соответствующие энантиомеры либо методами хроматографии на хиральных фазах, либо путем расщепления. В дополнение, настоящее изобретение включает все возможные таутомерные формы соединений,описание которых приведено выше. Если не обусловлено иное, для заместителей и радикалов, используемых по тексту настоящего описания и формулы изобретения, применяются следующие определения.(С 1-С 4)алкил представляет собой неразветвленный либо разветвленный насыщенный гидроводородный радикал с 1-4 атомами углерода. Примеры включают метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил.(С 3-С 6)циклоалкил представляет собой моноциклический насыщенный гидроводородный радикал с 3-6 кольцевыми атомами углерода. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил. По тексту настоящего документа, для простоты, чаще употребляют единственное число существительных, но, как правило, такое употребление включает также множественное число, если прямо не обусловлено иное. Например, подразумевается, что выражение "способ лечения заболевания пациента,включающий введение терапевтически эффективного количества соединения формулы (I)" включает одновременно лечение более одного заболевания, а также введение более одного соединения формулы(I). В предпочтительном варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где А означает C-R2, где R2 представляет собой водород или фтор;Z представляет собой н-пропил, н-бутил или циклогексил, каждый из которых может быть замещен гидрокси, илиZ представляет собой гетероциклическую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы, илиZ представляет собой тиазоловую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;Z представляет собой группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;R5 представляет собой циклопропил или тетрагидрофуран-4-ил;Y означает О. В особенно предпочтительном варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где А означает C-R2, где R2 представляет собой водород или фтор;Z представляет собой гетероциклическую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы, илиZ представляет собой тиазоловую группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;Z представляет собой группу формулы гдеуказывает точку присоединения пирролотриазиновой группы;R5 представляет собой циклопропил. В отдельном варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где А означает C-R2, где R2 представляет собой водород или фтор. В еще одном отдельном варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где А означает C-R2, где R2 представляет собой фтор;R1 представляет собой фтор. Определения радикалов, указанные конкретно для соответствующих комбинаций радикалов, или предпочтительные комбинации радикалов могут также по желанию заменяться определениями радикалов с другими комбинациями, вне зависимости от конкретных комбинаций, указанных для радикалов. Особенно предпочтительными являются комбинации двух или нескольких вышеупомянутых предпочтительных диапазонов. В еще одном варианте осуществления изобретения настоящее изобретение относится к процессу получения соединений общей формулы (I), отличающемуся тем, что бромпирролотриазин формулы (II)[А] сочетается с арилбороновой кислотой или эфиром формулы (III)R8 представляет собой водород или (С 1-С 4)алкил, или оба R8 остатка соединены вместе с образованием -(СН 2)2-, -С(СН 3)2-С(СН 3)2-, -(СН 2)3- или -СН 2-С(СН 3)2-СН 2- моста,в присутствии подходящего палладиевого катализатора и основания с получением целевого соединения формулы (I)[В] сначала конвертируют в соответствующую бороновую кислоту или производное эфира формулы (IV)R9 представляет собой водород или (С 1-С 4)алкил, или оба R9 остатка соединены вместе с образованием -(СН 2)2-, -С(СН 3)2-С(СН 3)2-, -(СН 2)3- или -СН 2-С(СН 3)2-СН 2- моста,которое затем сочетается с арилбромидом формулы (V) где А и R1 имеют значения, указанные в пп.1-3,в присутствии подходящего палладиевого катализатора и основания также с получением целевого соединения формулы (I) где A, Z и R имеют значения, указанные выше,после чего, при необходимости, следует в соответствующих случаях (i) разделение соединений формулы (I) в их соответствующие энантиомеры и/или диастереомеры, предпочтительно, с использованием методов хроматографии, и/или (ii) конверсия соединений формулы (I) в их соответствующие гидраты, сольваты, соли и/или гидраты или сольваты их солей путем обработки соответствующими растворителями и/или кислотами. Как указано выше, синтез соединений формулы (I) может осуществляться с использованием реакции сочетания ("реакция сочетания Судзуки") между бромпирролотриазином (II) и арилборонатом или бороновой кислотой (III). Такое сочетание, как правило, осуществляется при повышенной температуре с использованием палладиевого катализатора, основания и инертного растворителя. Обзор катализаторов и реакционных условий можно встретить в литературе [см., например, S. Kotha et al., Tetrahedron 2002, 58,9633-9695; Т. Е. Barder et al., J. Am. Chem. Soc. 2005, 127, 4685-4696]. Предпочтительным катализатором при такой реакции является тетракис-(трифенилфосфин)палладий(0). Предпочтительным основанием является карбонат натрия, который используют в виде водного раствора. Реакция проходит в органических растворителях, инертных при таких условиях реакции, таких как 1,4-диоксан, ацетонитрил, N,Nдиметилформамид (DMF) или диметилсульфоксид (DMSO), или в воде или в смеси этих растворителей. Предпочтительно реакция проходит в смеси 1,4-диоксана и воды или ацетонитрила и воды. Реакцию, как правило, осуществляют при температуре 100-250 С, предпочтительно при 120-150 С. Нагревание предпочтительно осуществляют в одномодовом микроволновом устройстве. Такие реакции обычно проходят в атмосфере инертного газа, предпочтительно в аргоновой атмосфере. Иногда для реакции сочетания Судзуки обратная реакционность реагентов может являться предпочтительной. Для этих целей сначала осуществляют конверсию бромпирролотриазина (II) в соответствующий эфир бороновой кислоты (IV), а затем осуществляют перекрестное сочетание с арилбромидом(V) в соответствии с одним из методов, описанных выше. Конверсию (II) в (IV) осуществляют путем металл-опосредованного борилирования. Предпочтительным способом является палладий-катализируемая реакция борилирования по Мияура [см., например, J. Takagi et al., J. Am. Chem. Soc. 2002, 124, 8001-8006; T. Ishiyama et al., J. Org. Chem. 1995, 60, 7508-7510; A.L.S. Thompson et al., Synthesis 2005, 547-550]. Процедуры, реагенты и растворители для реакции перекрестного сочетания (IV) + (V)(I) выбирают из указанных в предыдущем разделе. Арилбороновые кислоты (III) [R8 = Н] и арилборонаты (III) [R8 = алкил, или оба R соединяют с образованием циклического эфира бороновой кислоты, например, пинаконового эфира] являются либо коммерчески доступными, либо они могут быть получены стандартными способами из соответствующих арилгалогенидов или арилтрифлатов с использованием реакции металл-опосредованного борилирования(см. предыдущий раздел). Борилирование и последующая реакция сочетания по Судзуки могут осуществляться на двух раздельных этапах, включающих выделение и очистку промежуточного соединения (III). Альтернативно, реакция борилирования и реакция перекрестного сочетания могут проводиться в одном реакционном сосуде с использованием (III) непосредственно без выделения и очистки. В случаях, когда в целевом соединении формулы (I) часть Z группы формирует простейшая или вторичная аминогруппа, зачастую может быть предпочтительным при реакциях борилирования и сочетания в соответствии с определением выше использовать защищенное производное такого амина в качестве исходного пирролотриазина (II) вместо свободного аминосоединения. Для этих целей могут использоваться стандартные временные аминозащитные группы, такие как ацильные группы (например, ацетил или трифторацетил) или защитные группы карбаматного типа (например, Boc-, Cbz- или Fmoc-группа). Предпочтительно используют трифторацетил или Boc-защитная группа. Подобным образом, гидроксифункция в сочетающихся компонентах (III) и (V), соответственно, может временно блокироваться в ходе процесса, предпочтительно, как производное силилового эфира, такого как триметилсилиловый эфир или трет-бутилдиметилсилиловый эфир. Эти защитные группы затем могут параллельно расщепляться в ходе водной обработки сочетающихся реакционных смесей, или их удаляют на последующих этапах реакции с использованием стандартных методов, известных специалистам. Получение защищенных промежуточных соединений, описанных выше, из соответствующих свободных аминов или спиртов формул (II), (III) и (V), соответственно, или из других прекурсорных соединений (см. раздел ниже) также может легко осуществляться в соответствии с процедурами, описанными в литературе [см., например, Т.W. Greene and P. Wuts, ProtectiveGroups in Organic Synthesis, Wiley, New York, 1999]. Получение соединений по настоящему изобретению может иллюстрироваться следующей схемой синтеза. Схема 1 Методологии синтеза, которые могут применяться для получения бромпирролотриазинов (II), могут структурироваться в соответствии с хемотипом Z группы, присутствующей в (II). Примеры, иллюстрирующие такие различные пути, приведены ниже (см. схемы синтеза 2-6). Более подробные описания процессов приведены в экспериментальном разделе, где описаны специфические промежуточные продукты и примеры соединений по настоящему изобретению. Например, соединения формулы (II), содержащие алкил или гидроксиалкил радикал в качестве Z группы, могут быть получены с использованием реакции сочетания между бромпирролтриазином (VI) и концевым алкином формулы (VII), как ключевой этап, (схема 2). Такой тип реакции (реакцию Соногасиры) обычно осуществляют в присутствии системы медно-палладиевого катализатора и основания. Несколько примеров этой реакции описаны в литературе [см., например, R. Chinchilla and С. Njera, Chem.Rev. 2007, 107, 874-922]. В настоящем изобретении предпочтительным источником меди является иодид меди (I), тетракис-(трифенилфосфин)палладий(0) используют в качестве палладиевого катализатора, и пирролидин выступает в качестве основания, а также растворителя. Реакцию сочетания предпочтительно осуществляют при сверхвысокочастотном излучении. Полученный в результате алкин (VIII) затем подвергают каталитической гидрогенизации, с использованием стандартного палладиевого или платинового катализатора. Предпочтительно в качестве катализатора используют оксид платины (IV), и реакция проходит в уксусной кислоте в качестве растворителя. В некоторых случаях с использованием этой процедуры получают смесь продуктов (IX) и (X), которую, так или иначе, можно легко подвергнуть сепарации с применением методов хроматографии. Последующая реакция бромирования, предпочтительно с использованием 1,3-дибром-5,5-диметилгидантоина в качестве источника бромина, в инертном растворителе, таком как THF или DMF, дает целевые пирролотриазины (IIa) и (IIb) соответственно. Получение исходного соединения (7-бромпирроло[2,1-f][1,2,4]триазин-4-амин (VI уже было описано ранее [см. документ WO 2007/056170-А 2 (промежуточное соединение В)]. Схема 2 Прекурсоры бромпирролотриазина типа (IIc) (схема 3) могут быть получены путем реакции металлирования соединения (VI) с металлом, таким как магний или литий, или путем реакции обмена галогенметалл с использованием магнийорганического или литийорганического реагента. Предпочтительным металлом является магний, который вводят в (VI) путем обработки изопропилмагний бромидом в растворителе, таком как THF или диэтиловый эфир. Затем осуществляют реакцию промежуточного металлорганического соединения с циклоалканоном или гетероциклоалканоном (XI) [R, R' связываются с образованием циклоалкильного или гетероциклоалкильного кольца] с получением третичного спирта(XIIa). При дополнительном пути получения вторичных спиртов формулы (XIIb) используют реакцию(XIV) (схема 3). Внедрение боковой цепи осуществляется путем последующего добавления соответствующего реактива Гриньяра (XV) [R" = алкил или циклоалкил] в растворителе, таком как THF или диэтиловый эфир. В завершение, бромирование соединений (XIIa) и (XIIb), предпочтительно с использованием 1,3-дибром-5,5-диметилгидантоина, в инертном растворителе, таком как THF или DMF дает целевые пирролотриазины (IIc) и (IId) соответственно. Получение исходного соединения (пирроло[2,1-f][1,2,4]триазин-4-амин (XIII уже было описано ранее [см. документ WO 2007/056170-А 2 (промежуточное соединение А)]. Схема 3 Пирролотриазины формулы (II), где Z представляет собой незамещенный циклоалкил или углеродсвязанную азагетероциклил группу, могут быть получены путем дегидратации третичного спирта формулы (XIIc) в ненасыщенный карбо- или гетероцикл формулы (XVI), с использованием стандартных агентов, таких как ангидрид трифторуксусной кислоты, ангидрид трифторметансульфоновая кислоты,оксид фосфора (V), серная кислота или другие сильные кислоты (схема 4). В результате последующей каталитической гидрогенизации с использованием стандартного катализатора, такого как палладированный уголь, получают насыщенный аналог формулы (XVII). Этап гидрогенизации предпочтительно осуществляют в растворителе, таком как метанол, этанол или THF, который содержит небольшое количество водной трифторуксусной кислоты. В конечном итоге, бромирование с использованием 1,3-дибром 5,5-диметилгидантоина, в соответствии с описанием выше, дает целевой пирролотриазин (IIe). Прекурсоры спиртов (XIIc) сами по себе могут быть легко получены с применением пути синтеза,описанного на схеме 3 [ср. получение соединения (XIIa)]. Пирролотриазины формулы (II), где Z представляет собой 1,3-тиазол-4-ил группу, могут быть получены путем металлирования соединения (VI), в соответствии с описанием выше, за которым следует реакция с хлорацетилхлоридом с получением промежуточного соединения (XVIII), а затем конденсация с использованием тиоамида или тиомочевины (XIX) [с R4 в соответствии с описанием выше], с получениям прекурсорного соединения (XX) (схема 5). Бромирование с использованием 1,3-дибром-5,5 диметилгидантоина, в соответствии с описанием выше, в конечном итоге дает целевой пирролотриазин Пирролотриазины формулы (II), где Z представляет собой N-циклическую аминометил группу, могут быть получены путем реакции пирролотриазина (XIII) с формальдегидом и циклическим амином типа (XXI) в кислом растворителе, таком как уксусная кислота, или в смеси кислоты с органическим растворителем (схема 6). Бромирование полученного продукта (XXII) с использованием 1,3-дибром-5,5 диметилгидантоина, в соответствии с описанием выше, дает затем целевой пирролотриазин (IIg). Соединения формул (V), (VII), (XI), (XV), (XIX) и (XXI) являются либо коммерчески доступными,известными из литературы или могут быть получены из имеющихся в наличии исходных материалов путем адаптирования стандартных методов, описанных в литературе. Соединения по настоящему изобретению имеют ценные фармакологические свойства и могут использоваться для предупреждения и лечения заболеваний человека и животных. Соединения настоящего изобретения являются сильнодействующими и селективными ингибиторами ALK1. Таким образом, они могут использоваться для лечения и/или предупреждения заболеваний,связанных с ангиогенезом, в частности, заболеваний глаз, связанных с ангиогенезом. Для целей настоящего изобретения термин "лечение" включает приостановку течения заболевания,расстройства, патологического состояния, препятствование заболеванию, улучшение состояния больного, купирование, или ремиссию заболевания, расстройства, патологического состояния, приостановление их развития или прогрессирования, и/или уменьшение их симптомов. Термин "предупреждение" или"предупреждать" включает уменьшение риска заболевания, расстройства или патологического состояния, их развития или прогрессирования и/или их симптомов или заражения таким заболеванием. Термин"предупреждение" включает профилактику. Лечение или предупреждение заболевания, расстройства или патологического состояния могут быть полными или частичными. Заболевания глаз, связанные с ангиогенезом, лечение и/или предупреждение которых может осуществляться с использованием соединений по настоящему изобретению включают, помимо прочего, возрастную дегенерацию макулы (ВДМ), диабетическую ретинопатию, в частности, диабетический макулярный отек (ДМО), другие ретинопатии, такие как хороидальная неоваскуляризация (ХНВ), хориоидальная неоваскулярная мембрана (ХНВМ), кистозный макулярный отек (КМО), эпиретинальная мембрана (ЭРМ) и макулярное отверстие, гипертрофические изменения пигментного эпителия сетчатки(ПЭС), атрофические изменения пигментного эпителия сетчатки, отслоение сетчатки, окклюзия хориоидальной вены, окклюзия вены сетчатки, роговичный ангиогенез, вследствие, например, кератита, трансплантации роговицы или кератопластики, роговичный ангиогенез, обусловленный гипоксией (например,в результате длительного ношения контактных линз), птеригиум, субретинальный отек и интраретинальный отек. В контексте настоящего изобретения термин возрастная дегенерация макулы (ВДМ) включает как влажную форму ВДМ (или экссудативную, неоваскулярную ВДМ), так и сухую форму ВДМ (или неэкссудативную, атрофическую ВДМ). Соединения по настоящему изобретению дополнительно могут использоваться для лечения и/или предупреждения воспалительных заболеваний, связанных с ангиогенезом, таких как ревматоидный артрит, псориаз, контактный дерматит, астма, легочная гипертензия, множественный склероз, а также воспалительных заболеваний ЖКТ, таких как болезнь Крона. Соединения по настоящему изобретению также могут использоваться для лечения и/или предупреждения фиброзирующих заболеваний, таких как фиброз или цирроз. Благодаря своему профилю активности, соединения по настоящему изобретению особенно пригодны для лечения или предупреждения заболеваний глаз, таких как возрастная дегенерация макулы (ВДМ),хороидальная неоваскуляризация (ХНВ), диабетическая ретинопатия и диабетический макулярный отек(ДМО). Заболевания, указанные выше, типичны для людей, однако также существуют со схожей этиологией у других животных, включая млекопитающих, и лечение этих заболеваний может осуществляться путем введения соединений по настоящему изобретению. Таким образом, настоящее изобретение также относится к применению соединений по настоящему изобретению для лечения и/или предупреждения заболеваний, в частности, вышеуказанных заболеваний. Настоящее изобретение также относится к применению соединений по настоящему изобретению для приготовления фармацевтической композиции для лечения и/или предупреждения заболеваний, в частности, вышеуказанных заболеваний. Настоящее изобретение также относится к применению соединений по настоящему изобретению в способе лечения и/или предупреждения заболеваний, в частности, вышеуказанных заболеваний. Настоящее изобретение также относится к способу лечения и/или предупреждения заболеваний, в частности, вышеуказанных заболеваний, с использованием эффективного количества, по меньшей мере,одного из соединений по настоящему изобретению. Соединения по настоящему изобретению можно применять в виде отдельного фармацевтического препарата или в сочетании с одним или более дополнительными лекарственными препаратами, при условии, что такая комбинация этих веществ не приводит к появлению негативных эффектов, делающих применение такой комбинации невозможным. Такая комбинированная терапия включает применение единичной дозированной лекарственной формы, которая содержит соединение формулы (I), в соответствии с определением выше, и одно или более дополнительных лекарственных препаратов, а также применение соединения формулы (I) и каждого дополнительного лекарственного препарата в виде отдельных дозированных лекарственных форм. Например, пациент может принимать соединение формулы (I) и лекарственный препарат одновременно в виде одной пероральной дозировочной композиции, такой как таблетка или капсула, или каждое вещество может приниматься в отдельных дозированных лекарственных формах. При использовании отдельных дозированных лекарственных форм, соединение формулы I, а также одно или более дополнительных лекарственных препаратов могут применяться фактически в одно и то же время (т.е. параллельно) или по отдельности в разное время (т.е. последовательно). В частности, соединения по настоящему изобретению могут применяться в виде комбинированных препаратов или в виде раздельных препаратов с ингибиторами VEGF-опосредованного ангиогенеза, такими как, например, АСТВ-1003, афлиберцепт, апатиниб, акситиниб, бевацизумаб, бевасираниб, BMS690514, бриваниб, цедираниб, СТ-322, довитиниб, Е 7080, форетиниб, КН-902, линифаниб, MGCD-265,мотесаниб, OTS-102, пазопаниб, пегаптаниб, ранибизумаб, регорафениб, рубоксистаурин, сорафениб,SU-14813, сунитиниб, телатиниб, TG-100801, тивозаниб, TSU-68, вандетаниб, варгатеф, ваталаниб и XL184, или с ингибиторами других сигнальных путей, такими как, например, ACU-4429, дисульфирам, Е 10030, фенретинид, мекамиламин, PF-04523655, сиролимус, сонепцизумаб, тандоспирон и волоциксимаб. Таким образом, в соответствии с еще одним вариантом осуществления изобретения настоящее изобретение относится к фармацевтическим композициям, содержащим, по меньшей мере, одно из соединений по настоящему изобретению и один или более лекарственных препаратов для лечения и/или предупреждения заболеваний, в частности, вышеуказанных заболеваний. Соединения по настоящему изобретению также могут использоваться, сами по себе или в композициях) для диагностики или при проведении исследовательских работ или в качестве аналитических стандартных образцов и для других подобных целей. В соответствии с еще одним аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим, по меньшей мере, одно из соединений по настоящему изобретению и одно или более инертных нетоксичных фармацевтически приемлемых вспомогательных веществ, а также к их применению для вышеуказанных целей. Соединения по настоящему изобретению могут иметь системное и/или локальное действие. Для данных целей они могут применяться с использованием соответствующих способов введения препаратов, например, перорально, парентерально, пульмонально (ингаляция), назально, лингвально, сублингвально, буккально, ректально, дермально, трансдермально, конъюнктивально, субконъюнктивально,через уши, интравитреально или применяться местно. Соединения по настоящему изобретению могут применяться в таких формах для применения, которые соответствуют этим способам введения препарата. Для перорального введения пригодны такие формы для применения, которые функционируют в соответствии с известным уровнем техники, и при использовании которых соединения по настоящему изобретению высвобождаются быстро и/или согласно модифицированной кинетике, и которые содержат соединения по настоящему изобретению в кристаллической, некристаллической форме и/или растворенной форме, такой, например, как таблетки (с покрытием или без, например, с энтеросолюбильным покрытием или с покрытием, которое практически не растворимо, или которое растворяется с задержкой и контролирует высвобождение соединения по настоящему изобретению), быстрорастворимые во рту таблетки, или капсулы, покрытые пленочной оболочкой, лиофилизаты, покрытые пленочной оболочкой,капсулы (например, твердые или мягкие желатиновые капсулы), таблетки, покрытые сахарной оболочкой, гранулы, микросферы, порошки, эмульсии, суспензии, аэрозоли или растворы. Парентеральное введение может осуществляться без этапа всасывания (например, внутривенное введение, внутриартериальное введение, интракардиальное введение, интраспинальное введение или интралюмбальное введение) или может включать всасывание (например, внутримышечное, подкожное,внутрикожное, чрескожное или интраперитонеальное введение). Формами, пригодными для парентерального введения, являются, помимо прочего, препараты для инъекций и инфузий в форме растворов,суспензий, эмульсий, лиофилизатов или стерильных порошков. Формы, пригодные для других путей введения, включают, например, фармацевтические формы для ингаляций (например, порошковые ингаляторы, небулайзеры), назальные капли, растворы или спреи,таблетки или капсулы для лингвального, сублингвального или буккального применения (например, пастилки, таблетки для рассасывания), суппозитории, препараты для введения в глаз и ухо (например, капли, мази), вагинальные капсулы, водные суспензии (лосьоны, смеси для взбалтывания), липофильные суспензии, мази, кремы, молочко, пастообразные составы, пены, пылевидные порошки, и трансдермальные терапевтические системы (например, пластыри). Соединения по настоящему изобретению могут быть преобразованы в перечисленные формы для применения способом известным самим по себе путем смешивания с инертными, не токсичными, фармацевтически приемлемыми вспомогательными веществами. Эти вспомогательные вещества включают,помимо прочего, носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например, жидкий полиэтиленгликоль), эмульгаторы (например, додецилсульфат натрия), ПАВ (например, полоксисорбитан олеат), дисперсанты (например, поливинилпирролидон), синтетические и натуральные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота), красители, например неорганические пигменты, такие как, например,оксиды железа, и вещества, исправляющие вкус и/или запах. В принципе было доказано, что для достижения эффективных результатов предпочтительно при парентеральном применении использовать дозы приблизительно 0,001-1 мг/кг массы тела, предпочтительно, приблизительно 0,01-0,5 мг/кг массы тела. При пероральном применении типичная доза составляет приблизительно 0,01-100 мг/кг массы тела, предпочтительно приблизительно 0.01-20 мг/кг массы тела, и более предпочтительно приблизительно 0,1-10 мг/кг массы тела. Тем не менее, фактические дозировки и режимы введения активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться, чтобы получить такое количество активного ингредиента, которое будет эффективным для получения желательной реакции на терапию для определенного пациента, а также состав и способ введения, которые не были бы токсичными для пациента. Таким образом, в соответствующих случаях, необходимо регулировать дозу с отклонениями от указанных количеств, в частности, в зависимости от возраста, пола, массы тела, условий питания и общего состояния здоровья пациента, пути введения препарата, индивидуальных особенностей реакции на активный ингредиент, характера препарата, и временного интервала, в течение которого происходит применение препарата. Таким образом, в некоторых случаях может быть достаточно использования количества меньше минимального количества, указанного выше, в то время как в других случаях, максимальный предел должен быть превышен. В случае, когда препарат вводят в больших количествах, рекомендуется разделять такие большие количества на несколько отдельных доз, принимаемых в течение всего дня. Для лечения и/или предупреждения заболеваний глаз, связанных с ангиогенезом, в соответствии с описанием выше, предпочтительным путем введения соединений по изобретению является местное введение в глаз или применение системы доставки лекарственных средств внутрь глаза. Интраокулярные инъекции - еще один способ введения соединений по настоящему изобретению, который пригоден для таких целей. Доставка лекарственных средств внутрь глаза может осуществляться путем инъекций, с использованием катетера или иного инвазивного приспособления, предназначенного для введения точно измеренного количества требующегося препарата в определенную область или ткань в глазу (например, задняя камера глаза или сетчатка). Интраокулярные инъекции могут производиться в стекловидное тело(интравитреальное введение), под слизистую оболочку глаза (субконъюнктивально), позади глазного яблока (ретробульбарное введение), в белочную оболочку глаза, под капсулу Тенона (субтеноновое введение), и может быть в форме для замедленного всасывания. Также в пределах области настоящего изобретения предусмотрены другие способы интраокулярного введения, а также участки и формы для инъекции. Препараты, содержащие соединения по настоящему изобретению, могут быть получены способами,известными специалистам, так, чтобы обеспечивать соответствующую доставку в область позади глаза,которая может осуществляться с использованием стандартных способов введения доз, например, с использованием глазных капель, или с использованием системы доставки для контролируемого высвобождения соединений по настоящему изобретению, например, замедленного высвобождения. Предпочтительные препаративные формы для введения в глаз соединений по настоящему изобретению включают водные растворы, суспензии или гели для таких соединений в форме жидких капель,жидких лосьонов, спреев, мазей или гелей, в смеси со вспомогательными веществами, которые пригодны для производства и применения таких форм для применения. В качестве альтернативы, соединения по настоящему изобретению могут вводиться в глаз с использованием липосом или других систем доставки в глаз, известных специалистам. Соответствующие дозировки могут определяться любыми подходящими способами, известными специалистам в области офтальмологии. Предпочтительно активное вещество вводится с частотой 1-4 раза в день при местном применении или с меньшей частотой при использовании систем доставки лекарственных средств. Как правило, препарат для лечения глазных заболеваний для местного применения содержит активный фармацевтический ингредиент в концентрации в диапазоне приблизительно 0,00110%. Настоящее изобретение иллюстрируется с помощью вариантов осуществления изобретения, указанных в примерах. Настоящее изобретение не ограничивается данными примерами. В приведенных ниже тестах и примерах, если не указано иное, процентные соотношения приведены в соотношении по массе; доли также даны по массе. Отношения для растворителей, степень разбавления и концентрации, указанные для растворов жидкость/жидкость, основаны на объемном соотношении. А. Примеры. Сокращения и аббревиатуры: 90% В, 31 мин 90% В; скорость потока: 50 мл/мин; УФ-детекция: 210 нм. Метод 7. Устройство: Gilson Abimed HPLC, система с двойным насосом; колонка: ReproSil С 18 10 мкм,250 мм 40 мм; элюент А: вода, элюент В: ацетонитрил; градиент: 0-3 мин 10% В, 5,01-31 мин 95% В, 31 мин 95% В; скорость потока: 50 мл/мин; УФ-детекция: 210 нм. Метод 8. Устройство: Gilson Abimed HPLC, система с двойным насосом; колонка: ReproSil С 18 10 мкм,250 мм 30 мм; элюент А: вода, элюент В: ацетонитрил; градиент: 0-3 мин 10% В, 5,01-31 мин 95% В,31 мин 95% В; скорость потока: 50 мл/мин; УФ-детекция: 210 нм. Метод 9. Устройство: Gilson Abimed HPLC, система с двойным насосом; колонка: Waters Sunfire С 18 5 мкм,250 мм 20 мм; элюент А: вода, элюент В: ацетонитрил; градиент: 0 мин 20% В, 15 мин 60% В, 15.01-19 мин 20% В; скорость потока: 25 мл/мин; УФ-детекция: 210 нм. Методы аналитической ВЭЖХ, ЖХ/МС и ГХ/МС. Метод 1 (ВЭЖХ). Прибор: Agilent 1100 с диодно-матричным детектором; колонка: Agilent Zorbax Eclipse XDB-C8 4.6,150 мм 5 мм; элюент А: 0,01% TFA в воде, растворитель В: 0,01% TFA в ацетонитриле, градиент: 0-3 мин 10% В, 4-5 мин 90% В, 5.5 мин 10% В; скорость потока: 2,0 мл/мин; температура: 30 С; УФдетекция: 210 нм. Метод 2 (ВЭЖХ). Прибор: HP 1100 с диодно-матричным детектором; колонка: Kromasil 100 RP-18, 60 мм 2.1 мм,3.5 мкм; элюент А: 5 мл перхлорной кислоты (70%)/л вода, элюент В: ацетонитрил; градиент: 0 мин 2% В, 0.5 мин 2% В, 4.5 мин 90% В, 6.5 мин 90% В, 6.7 мин 2% В, 7.5 мин 2% В; скорость потока: 0.75 мл/мин; температура: 30 С; УФ-детекция: 210 нм. Метод 3 (ВЭЖХ). Прибор: HP 1100 с диодно-матричным детектором; колонка: Kromasil 100 RP-18, 60 мм 2.1 мм,3.5 мкм; элюент А: 5 мл перхлорной кислоты (70%)/л вода, элюент В: ацетонитрил; градиент: 0 мин 2% В, 0.5 мин 2% В, 4.5 мин 90% В, 9 мин 90% В, 9.2 мин 2% В, 10 мин 2% В; скорость потока: 0.75 мл/мин; температура: 30 С; УФ-детекция: 210 нм. Метод 4 (ЖХ/МС). Прибор: Micromass Platform LCZ с HPLC Agilent 1100 Series; колонка: Thermo Hypersil GOLD 3 мкм, 20 мм 4 мм; элюент А: 1 л вода + 0.5 мл 50% муравьиной кислоты, элюент В: 1 л ацетонитрил + 0.5 мл 50% муравьиной кислоты; градиент: 0.0 мин 100% А 0.2 мин 100% А 2.9 мин 30% А 3.1 мин 10% А 5.5 мин 10% А; температура: 50 С; скорость потока: 0,8 мл/мин; УФ-детекция: 210 нм. Метод 5 (ЖХ/МС). Прибор: Micromass ZQ с HPLC Waters Alliance 2795/HP 1100; колонка: Phenomenex Synergi 2.5 мкм 1 мм; элюент A: 1 л вода + 0.25 мл 99% муравьиной кислоты, элюент В: 1 л ацетонитрил + 0.25 мл 99% муравьиной кислоты; градиент: 0.0 мин 90% А 1.2 мин 5% А 2.0 мин 5% А; температура: 50 С; скорость потока:0,40 мл/мин; УФ-детекция: 208-400 нм. Общий синтетический метод 1. Реакция сочетания Судзуки с производными 5-бромпирроло[2,1-f][1,2,4]триазина с арилбороновой кислотой или эфирами: 5-Бромпирроло[2,1-f][1,2,4]триазин А (около 0,5 ммоль), арилбороновую кислоту В (1,2 экв.) или соответствующий бороновый эфир, например диметиловый эфир бороновой кислоты или пинаконовый эфир бороновой кислоты, и тетракис-(трифенилфосфин)палладий(0) (0,1 экв.) растворили в смеси 1,4 диоксана (около 4,0 мл) и 2 М водного раствора карбоната натрия (1,5 мл) в микроволновом реакционном сосуде. Реакционный сосуд закрыли обжимной крышкой и смесь нагревали до 140 С в течение 1 ч в одномодовом микроволновом устройстве. После охлаждения реакционную смесь фильтровали через целит, который промыли 1,4-диоксаном для того, чтобы вымыть весь органический материал. Комбинированный фильтрат выпаривают до высушивания при пониженном давлении, а осадок очищают путем препаративной HPLC с получением целевого соединения С. Общий синтетический метод 2. Борилирование арилбромидов и последующая реакция сочетания Судзуки с производными 5 бромпирроло[2,1-f][1,2,4]триазина без выделения промежуточных соединений арилбороновой кислоты или эфира: Арилбромид D (приблизительно 0,5 ммоль) растворили в DMF (3 мл) в микроволновом реакционном сосуде, через раствор барботировали аргон в течение 5 мин, и добавили комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)-дихлорметана (0,1 экв.), ацетат калия (3 экв.) и бис(пинаколато)диборон (1,2 экв.). Сосуд закрыли обжимной крышкой и смесь нагревали до 130 С в течение 60 мин в одномодовом микроволновом устройстве. Затем суспензию профильтровали, фильтрат перенесли в микроволновую виалу для процесса и добавили тетракис-(трифенилфосфин)палладий(0) (0,1 экв.), 2 M водного раствора карбоната натрия (4 экв.) и 5-бромпирроло[2,1-f][1,2,4]триазин А (1 экв.). Виалу закрыли обжимной крышкой и смесь нагревали до 140 С в течение 1 ч в одномодовом микроволновом устройстве. Полученную таким образом неочищенную реакционную смесь вводят непосредственно на колонку для препаративной HPLC для сепарации и очистки целевого соединения С.(4-Бром-2,6-дифторфенил)метанол (1,03 г, 4,62 ммоль) растворили в сухом 1,4-диоксане (10 мл). Через раствор барботировали аргон,затем добавили комплекс[1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий-дихлорметан (302 мг, 0,37 ммоль, 0,08 экв.), безводный ацетат калия (907 мг, 9,24 ммоль, 2 экв.) и бис-(пинаколато)диборон (1,23 г, 4,85 ммоль, 1,05 экв.) и смесь нагревали до 130 С в течение 1 ч в одномодовом микроволновом устройстве. После охлаждения смесь профильтровали, а растворитель удалили при пониженном давлении. К осадку добавили циклогексан (200 мл) и смесь активно перемешивали в течение 30 мин. Нерастворившийся материал затем удалили путем фильтрации, циклогексан отогнали и осадок очистили путем флэш-хроматографии над силикагелем (дихлорметан/ацетонитрил градиентный). Фракции, содержащие продукт, комбинировали и выпаривали. Главное соединение было получено путем кристаллизации в виде твердого вещества буроватого цвета. Выход: 790 мг (63% от теор.).[4-([трет-Бутил(диметил)силил]оксиметил)-3,5-дифторфенил]бороновую кислоту (19,3 г, 63,9 ммоль; неочищенный материал, полученный с использованием метода, описанного в работе Hattori, Bioorg. Med. Chem. 2006, 14, 3258-3262) растворили в 400 мл водной уксусной кислоты (66%) и перемешивали при 40 С в течение 5 ч. Затем раствор выпарили при пониженном давлении и осадок очистили с помощью флэш-хроматографии над силикагелем (градиентное элюирование, 0-2%, метанол в дихлорметане) с получением 3,46 г (25% от теор., LC-MS чистота 87%) главного соединения. Главное соединение было получено в соответствии с процессом, описанным в документе WO 2004/074270-А 2 [пример А(147), этап 1]. 1 Н ЯМР (400 MHz, CDCl3):(ppm) = 2.00 (br, 1H), 4.74 (s, 2H), 7.38 (d, 1H), 7.43 (dd, 1H), 7.53 (d,1H). Промежуточное соединение 4 А. Главное соединение было получено в соответствии с процессом, описанным в документе ЕР 1544208-А 1 (справочный пример 14). 1 Н ЯМР (400 MHz, CDCl3):(ppm) = 1.62 (t, 3 Н), 2.32 (s, 3 Н), 4.64 (d, 2H), 7.23 (d, 1H), 7.32 (s, 1H),7.33 (d, 1H). Промежуточное соединение 5 А. Метил 5-бромпиридин-2-карбоксилат (2,00 г, 9,27 ммоль) растворили в этаноле (20,0 мл). При 0 С добавили борогидрид натрия (1,05 г, 27,8 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь сконцентрировали при пониженном давлении, охладили 1 н. соляной кислоты,нейтрализовали твердым карбонатом калия и экстрагировали дихлорметаном. Органический слой высушили над сульфатом магния и выпарили с получением 1,57 г (90% от теор.) главного соединения. К раствору промежуточного соединения 5 А (1,50 г, 7,98 ммоль) и бис-(пинаколато)диборона (2,23 г,8,28 ммоль) в дегазированном DMF (120 мл) добавили в аргоновой атмосфере 1,1'-бис(дифенилфосфино)ферроценпалладий(II) хлорид (292 мг, 0,40 ммоль) и ацетат калия (2,35 г, 23,9 ммоль). Смесь нагревали до 80 С в течение 18 ч, а затем охлаждали до комнатной температуры. Суспензию фильтровали, а остаток промыли диоксаном. Комбинированные фильтраты сконцентрировали при пониженном давлении, и маслянистый осадок поместили в 50 мл этилацетата 50 мл циклогексана, а затем оставили при комнатной температуре в течение ночи. Полученный в результате осадок собрали путем фильтрации и удалили. Фильтрат выпарили, осадок снова растворили в 100 мл этилацетата и экстрагировали дважды с 50 мл воды. Водный слой сконцентрировали с получением 690 мг (56% от теор.) главного соединения, которое использовалось без дальнейшей очистки. Исходный материал 7-бромпирроло[2,1-f][1,2,4]триазин-4-амин получали в соответствии с процессом, описанным в документе WO 2007/056170-А 2 (промежуточное соединение В). 7-Бромпирроло[2,1-f][1,2,4]триазин-4-амин (1,0 г, 4,69 ммоль), иодид меди (I) (89 мг, 0,47 ммоль,0,1 экв.) и тетракис-(трифенилфосфин)палладий(0) (542 мг, 0,47 ммоль, 0.1 экв.) поместили в микроволновый реакционный сосуд и вакуумировали в течение 1 ч. Затем сосуд продули аргоном, добавили пирролидин (15 мл) и 2-пропин-1-ол (2,63 г, 47 ммоль, 10 экв.), и реакционный сосуд закрыли обжимной крышкой, и нагревали до 85 С в течение 120 мин в одномодовом микроволновом устройстве. После охлаждения в реакционную смесь добавили 120 мл концентрированного водного раствора хлорида аммония, который экстрагировали дважды этилацетатом. Комбинированные органические слои высушили над безводным сульфатом натрия и выпарили и осадок очистили путем флэш-хроматографии (силикагелевая колонка Biotage, этилацетат). С помощью жидкостной хроматографии с масс-спектрометрией (метод 6) определили чистоту полученного продукта (222 мг), который использовали для дальнейших трансфор- 19023775 Промежуточное соединение 7 А (444 мг, 2,36 ммоль) растворили в уксусной кислоте (18 мл) в аргоновой атмосфере. Добавили оксид платины (IV) (40 мг, 0,18 ммоль, 0,08 экв.) и смесь активно перемешивали при комнатной температуре в течение 3 ч в атмосфере водорода при давлении окружающей среды. Затем катализатор удалили фильтрацией, растворитель отогнали, и осадок подвергли флэшхроматографии (силикагелевая колонка Biotage, циклогексан/этилацетат градиентный). В двух различных хроматографических фракциях были получены промежуточные соединения 8 А (185 мг, 41% от теор.) и 9 А (170 мг, 41% от теор.). Промежуточное соединение 8 А: HPLC (метод 2): Rt = 2.68 мин;-20 С. Добавили 1,3-дибром-5,5-диметилгидантоин (78,1 мг, 0,5 экв.), и смесь перемешивали при комнатной температуре -20 С в течение 1 ч. Реакцию затем охладили 0,5 мл концентрированного водного раствора дитионита натрия, нагрели до комнатной температуры и разделили между этилацетатом и водой. Органическую фазу высушили над безводным сульфатом натрия, а растворитель отогнали. Выход: 145 мг (98% от теор.).-20 С. Добавили 1,3-дибром-5,5-диметилгидантоин (89 мг, 0,5 экв.), и смесь перемешивали при комнатной температуре -20 С в течение 1 ч. Реакцию затем охладили 0,5 мл концентрированного водного раствора дитионита натрия, нагрели до комнатной температуры и разделили между этилацетатом и водой. Органическую фазу высушили над безводным сульфатом натрия, а растворитель отогнали. Выход: 154 мг (85%, чистый, 82% от теор.). 7-Бромпирроло[2,1-f][1,2,4]триазин-4-амин (1,0 г, 4,69 ммоль), иодид меди (I) (89 мг, 0,47 ммоль,0,1 экв.) и тетракис-(трифенилфосфин)палладий(0) (542 мг, 0,47 ммоль, 0.1 экв.) поместили в микроволновый реакционный сосуд и вакуумировали в течение 1 ч. Затем сосуд продули аргоном, добавили пирролидин (15 мл) и 3-бутин-1-ол (3,36 г, 47 ммоль, 10 экв.), реакционный сосуд закрыли обжимной крышкой и нагревали до 85 С в течение 120 мин в одномодовом микроволновом устройстве. После охлаждения в реакционную смесь добавили 120 мл концентрированного водного раствора хлорида аммония и экстрагировали дважды этилацетатом. Комбинированные органические слои высушили над безводным сульфатом натрия и выпарили и осадок очистили путем флэш-хроматографии (силикагелевая колонкаBiotage, этилацетат). Полученный продукт (735 мг) имел чистоту (66% (HPLC достаточную для дальнейших трансформаций. Промежуточное соединение 12 А (607 мг, 3,00 ммоль) растворили в уксусной кислоте (64 мл) и добавили оксид платины (IV) (50 мг, 0,22 ммоль, 0,07 экв.) Смесь перемешивали в течение 15 ч в атмосфере водорода при давлении окружающей среды. Затем катализатор удалили фильтрацией, фильтрат выпарили при пониженном давлении, осадок очистили путем флэш-хроматографии (силикагелевая колонка Biotage, этилацетат). Выход: 350 мг (57% от теор.). Промежуточное соединение 13 А (330 мг, 1,60 ммоль) растворили в THF (26 мл) при -20 С и добавили 1,3-дибром-5,5-диметилгидантоин (229 мг, 0,80 ммоль). Реакционную смесь перемешивали при-20 С в течение 1 ч. Реакционную смесь охладили концентрированным водным раствором сульфита натрия (0,5 мл). Добавили этилацетат, водный слой отделили и органический слой высушили над сульфатом натрия и испарили. Для получения 175 мг (84% от теор.) главного соединения неочищенный продукт затем очистили с помощью препаративной HPLC (метод 2). Исходный материал пирроло[2,1-f][1,2,4]триазин-4-амин синтезировали в соответствии с процессом, описанным в документе WO 2007/056170-А 2 (промежуточное соединение А). Пирроло[2,1-f][1,2,4]триазин-4-амин (20,5 г, 152 ммоль) растворили в 150 мл DMF. При ледяном охлаждении по каплям добавили хлористый фосфор ил (31,3 мл, 336 ммоль) в таком объеме, что внутренняя температура не превысила 30 С. Затем смесь нагревали в течение 2 дней при 50 С. После охлаждения добавили вторую порцию хлористого фосфорила (14,2 мл, 152 ммоль), и перемешивание продолжали еще в течение 24 ч при 50 С. После охлаждения реакционную смесь медленно налили в смесь 2,0 л насыщенного водного раствора бикарбоната натрия и 2,0 л этилацетата. Добавили твердый бикарбонат натрия до прекращения газовыделения. Слои разделили, водный слой экстрагировали с помощью 0,5 л этилацетата, смешанные органические фазы высушили над натрия сульфатом, профильтровали и сконцентрировали. Осадок суспендировали в 100 мл диизопропилового эфира, перемешивали при комнатной температуре в течение 10 мин, а затем профильтровали. Высушенный осадок перемешивали в 6 н. соляной кислоты (500 мл) в течение 1 ч при 50 С, а затем вылили в смесь лед/вода (1000 мл). Смесь тщательно нейтрализовали твердым бикарбонатом натрия, перемешивали в течение 30 мин при комнатной температуре, а затем снова профильтровали. Осадок промыли водой и лигроином с получением 20,6 г (83% от теор.) кристаллов белого цвета, которые использовали на следующем этапе без дальнейшей очистки. Промежуточное соединение 16 А. 4-Амино-5-бромпирроло[2,1-f][1,2,4]триазин-7-карбальдегид Промежуточное соединение 15 а (20,6 г, 127 ммоль) растворили в 525 мл DMF. При 0 С добавили 1,3-дибром-5,5-диметилгидантоин (21,8 г, 76,2 ммоль), и смесь перемешивали в течение 1 ч при ледяном охлаждении и в течение 3 ч при комнатной температуре. Полученную в результате суспензию фильтровали, а остаток промыли DMF и диэтиловым эфиром. Фильтрат удалили, а оставшиеся труднорастворимые кристаллы высушили с получением 20,0 г (65% от теор., чистота 80% путем HPLC) главного соединения. Этот материал использовали без дальнейшей очистки. 1 Н ЯМР (400 MHz, d6-DMSO):(ppm) = 7.42 (s, 1H), 8.12 (s, 1H), 10.22 (s, 1H). Промежуточное соединение 17 А. Промежуточное соединение 16 А (500 мг, 1,66 ммоль) суспендировали в сухом THF (30 мл). При 0 С добавили 0,5 М раствора циклопропилмагнийбромида в диэтиловом эфире (10 мл, 5,0 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавили еще одну порцию раствора Гриньяра (6,6 мл, 3,3 ммоль). После перемешивания в течение 30 мин при комнатной температуре реакционную смесь охлаждали насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом (220 мл). Комбинированные органические слои промыли соляным раствором, высушили над сульфатом магния и сконцентрировали. Осадок очистили препаративной HPLC (метод 4). Выход: 0,14 г В трехгорлой колбе, объемом 50 мл, оборудованной конденсатором, термометром и капельной воронкой, продутой аргоном, получали реактив Гриньяра с использованием магниевой стружки (484 мг,19,9 ммоль) и 4-хлортетрагидропирана (2,4 г, 19,9 ммоль) в сухом THF (14 мл). К этому раствору при 0 С добавили суспензию Промежуточного соединения 16 А (1,2 г, 3,98 ммоль) в THF (20 мл), и смесь перемешивали при комнатной температуре в течение 1 ч. Затем ее охлаждали насыщенным водным раствором хлорида аммония и экстрагировали этилацетатом (250 мл). Органический слой промыли соляным раствором, высушили над сульфатом магния и сконцентрировали. Осадок очистили препаративной Исходный материал 7-бромпирроло[2,1-f][1,2,4]триазин-4-амин получали в соответствии с процессом, описанным в документе WO 2007/056170-А 2 (промежуточное соединение В). 7-Бромпирроло[2,1-f][1,2,4]триазин-4-амин (9,20 г, 35,41 ммоль) растворили в THF (105 мл) в аргоновой атмосфере при комнатной температуре. Добавили хлортриметилсилан (9,08 мл, 7,77 ммоль, 2 экв.),и смесь перемешивали при комнатной температуре в течение 3 ч. Затем ее охладили до 0 С и добавили 2 пропил хлорида магния (74 мл раствора 2,0 М в THF, 149 ммоль, 4,2 экв.). Смесь перемешивали в течение еще 3 ч при нагревании при комнатной температуре. Затем добавили 1,4-диоксаспиро[4.5]декан-8-он(8,38 г, 53,12 ммоль, 1,5 экв.) и перемешивание продолжали еще в течение 16 ч. Реакцию охладили смесью концентрированного водного раствора хлорида аммония и льда (1:1) до тех пор, пока значение рН не достигло 6-7. Смесь экстрагировали двумя порциями этилацетата и комбинированные органические экстракты высушили над безводным сульфатом натрия и сконцентрировали до высушивания. Главное соединение было получено путем кристаллизации из диэтилового эфира. Выход: 6,05 г (58% от теор.). Промежуточное соединение 19 А (2,81 г, чистота 60%, 5,82 ммоль) растворили в пиридине (18 мл) при 0 С. Медленно добавили трифторуксусный ангидрид (2,46 мл, 3,66 г, 17,45 ммоль, 3 экв.) и реакци- 23023775 онную смесь перемешивали при температуре окружающей среды в течение 16 ч. Растворитель отогнали и осадок разделили между водой и этилацетатом. Органический экстракт высушили над сульфатом натрия и испарили. Осадок измельчили в порошок с диэтиловым эфиром при 0 С с получением 2,95 г (чистота 92% путем HPLC, 99% от теор.) главного соединения. Промежуточное соединение 20 А (2,95 г, 10,8 ммоль) растворили в метаноле (1,07 мл) в аргоновой атмосфере. Добавили палладированный уголь (10%, 400 мг) и смесь активно перемешивали в течение 24 ч в атмосфере водорода при давлении окружающей среды и при комнатной температуре. Катализатор удалили путем фильтрации, а растворитель отогнали при пониженном давлении с получением 2,11 г(23 мл) и метанола (6,80 мл) при 0 С и перемешивали при ледяном охлаждении в течение 3 ч. Затем отрегулировали значение рН до 6-7 путем добавления концентрированного водного раствора бикарбоната натрия. Смесь экстрагировали тремя порциями дихлорметана и комбинированные органические экстракты высушили над безводным сульфатом натрия, профильтровали и выпарили. Осадок (923 мг, 52% от теор.) использовали на следующем этапе синтеза без дальнейшей очистки. Промежуточное соединение 22 А (452 мг, 1,96 ммоль) растворили в THF (15 мл), и раствор охладили до 0 С. По каплям добавили раствор алюмогидрида лития (1 М в THF, 2,94 мл, 2,94 ммоль). Затем раствор перемешивали при 0 С в течение 10 мин, а потом охладили путем добавления концентрирован- 24023775 ного водного раствора хлорида аммония. Смесь экстрагировали тремя порциями дихлорметана и комбинированные органические экстракты высушили над безводным сульфатом натрия, профильтровали и выпарили. Осадок (360 мг, чистота 77%, 61% от теор.) использовали на следующем этапе синтеза без дальнейшей очистки.-20 С и добавили 1,3-дибром-5,5-диметилгидантоин (188 мг, 0,66 ммоль, 0,55 экв.). Смесь перемешивали при -20 С в течение 1 ч, затем добавили 0,5 мл концентрированного водного раствора дитионита натрия,и смесь экстрагировали с использованием этилацетата. Органический экстракт высушили над безводным сульфатом натрия, профильтровали и испарили. Неочищенный продукт (463 мг, чистота 66%, 83% от теор.) использовали на следующем этапе синтеза без дальнейшей очистки. Исходный материал 7-бромпирроло[2,1-f][1,2,4]триазин-4-амин получали в соответствии с процессом, описанным в документе WO 2007/056170-А 2 (промежуточное соединение В). 7-Бромпирроло[2,1-f][1,2,4]триазин-4-амин (17,29 г, 81 ммоль) растворили в THF (214 мл) в аргоновой атмосфере при комнатной температуре. Добавили хлортриметилсилан (20,60 мл, 17,63 г, 162 ммоль,2 экв.), и смесь перемешивали при комнатной температуре в течение 3 ч. Затем ее охладили до 0 С и добавили 2-пропил хлорид магния (170 мл раствора 2,0 М в THF, 340 ммоль, 4,2 экв.). Смесь перемешивали в течение еще 3 ч при нагревании при комнатной температуре. Затем добавили трет-бутил 3 оксопиперидин-1-карбоксилат (25,00 г, 121 ммоль, 1,5 экв.) и перемешивание продолжали еще в течение 16 ч. Реакцию охладили смесью концентрированного водного раствора хлорида аммония и льда (1:1) до тех пор, пока значение рН не достигло 6-7. Смесь экстрагировали двумя порциями этилацетата, и комбинированные органические экстракты высушили над безводным сульфатом натрия и сконцентрировали до высушивания. Главное соединение было получено путем кристаллизации после измельчения осадка до порошкообразного состояния с использованием диэтилового эфира (50 мл). Кристаллы промыли диэтиловым эфиром и высушили с получением 17,20 г (64% от теор.). Промежуточное соединение 25 А (120 мг, 0,36 ммоль) растворили в THF (6.0 мл) при -20 С и добавили 1,3-дибром-5,5-диметилгидантоин (51 мг, 0,18 ммоль, 0,5 экв.). Реакционную смесь перемешивали при -20 С в течение 2 ч, а затем охладили концентрированным водным раствором сульфита натрия (0,5 мл). Добавили этилацетат, водный слой отделили и органический экстракт высушили над сульфатом натрия и испарили. Было получено главное соединение (148 г, 95% от теор.) в виде светло-желтого твердого вещества. Промежуточное соединение 25 А (8,32 г, 24,95 ммоль) растворили в пиридине (116 мл) при 0 С. Медленно добавили трифторуксусный ангидрид (8,81 мл, 13,10 г, 62,36 ммоль, 2,5 экв.) и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Затем ее снова охладили до 0 С и добавили 150 мл диэтилового эфира. Смесь перемешивали при 0 С, в то время как главное соединение медленно выпало в осадок. В завершение продукт профильтровали и промыли диэтиловым эфиром. Фильтрат выпарили под вакуумом и осадок измельчили в порошок с диэтиловым эфиром при 0 С с получением второго сбора главного соединения после промывания диэтиловым эфиром. Оба сбора смешали с получением 7,80 г (чистота 92% путем HPLC, 76% от теор.) главного соединения в виде кристаллов желтого цвета. Промежуточное соединение 27 А (7,80 г, чистота 92%, 17,54 ммоль) растворили в метаноле (400 мл). Добавили трифторукусную кислоту(6,76 мл, 10,0 г, 88 ммоль, 5 экв.), воду (3,16 мл, 175 ммоль, 10 экв.) и 10% палладированного угля (30 мг) и смесь гидрогенизировали в течение 24 ч при комнатной температуре и при давлении окружающей среды. Катализатор удалили фильтрацией, а растворитель выпарили под вакуумом. Неочищенный продукт (8,79 г, чистота 75%, количественный выход) использовали на следующем этапе синтеза без дальнейшей очистки. Исходный материал бензил (R)-3-(4-амино-5-бромпирроло[2,1-f][1,2,4]триазин-7-ил)пиперидин-1 карбоксилата описано в документе WO 2007/056170-А 2 (промежуточное соединение DDD). 1,50 г, 3,49 ммоль этого материала гидрогенизировали в течение 16 ч при комнатной температуре и при давлении окружающей среды в присутствии 10% палладированного угля (30 мг) в смеси метанола (50 мл) и трифторуксусной кислоты (2,70 мл). Затем, катализатор удалили путем фильтрации, а все летучие вещества выпарили под вакуумом с получением 1,10 г (95% от теор.) главного соединения. Промежуточное соединение 29 А (1,10 г, 5,06 ммоль) суспендировали в дихлорметане (6,60 мл), добавили триэтиламин (1,55 мл, 1,13 г, 11,14 ммоль, 2,20 экв.) и смесь перемешивали в течение 30 мин до полного растворения исходного материала. Затем добавили ди-трет-бутил дикарбонат (1,22 г, 5,57 ммоль, 1,1 экв.) и реакционную смесь перемешивали в течение 16 ч. Затем, добавили 5% водной лимонной кислоты, фазы разделили, и органический слой высушили над сульфатом натрия и выпарили. Осадок очистили с помощью препаративной HPLC (метод 2). Выход: 595 мг (37% от теор.).-20 С и добавили 1,3-дибром-5,5-диметилгидантоин (2,06 г, 7,19 ммоль, 0,5 экв.). Реакционную смесь перемешивали при -20 С в течение 2 ч, а затем охладили концентрированным водным раствором сульфита натрия (0,5 мл). Добавили этилацетат, водный слой отделили и органический экстракт высушили над сульфатом натрия и испарили. Было получено главное соединение (6,30 г, 86% от теор.) в виде светло-желтого твердого вещества. Главное соединение было получено способом, аналогичным способу получения рацемической смеси (промежуточное соединение 31 А), с использованием промежуточного соединения в качестве исходного соединения 30 А. Данные анализа были идентичны данным, приведенным для промежуточного соединения 31 А. Промежуточное соединение 33 А. 1-(4-амино-5-бромпирроло[2,1-f][1,2,4]триазин-7-ил)-2-хлорэтанон Данное соединение было получено в соответствии с процессом, описанным в документе WO 2007/056170-А 2 (промежуточное соединение N, этап 1). Промежуточное соединение 33 А (100 мг, 0,35 ммоль) и тиоацетамид (30 мг, 0,40 ммоль, 1,15 экв.) растворили в 1,4-диоксане (3,0 мл) в микроволновом реакционном сосуде. Виалу закрыли обжимной крышкой и смесь нагревали до 130 С в течение 60 мин в одномодовом микроволновом устройстве. После охлаждения растворитель отогнали, и осадок измельчили в порошок с ацетонитрилом и профильтровали. Фильтрат удалили. Главное соединение было выделено в виде кристаллического твердого вещества. Выход: 99 мг (92% от теор.). Промежуточное соединение 33 А (100 мг, 0,35 ммоль) и тиопропионамид (32 мг, 0,36 ммоль, 1,05 экв.) нагревали с обратным холодильником в этаноле (3,0 мл) в течение 4,5 ч. После охлаждения смесь разделили между этилацетатом и водным раствором бикарбоната натрия. Органический слой высушили над безводным сульфатом натрия, а растворитель отогнали. Продукт высушили в вакууме с получением 91 мг (0,28 ммоль, 81% от теор.) главного соединения в виде твердого вещества грязно-белого цвета. Промежуточное соединение 33 А (100 мг, 0,35 ммоль) и тиомочевину (32 мг, 0,41 ммоль, 1,2 экв.) суспендировали в 1,4-диоксане (3 мл) в микроволновом реакционном сосуде, который затем закрыли обжимной крышкой. Смесь нагревали до 120 С в течение 60 мин в одномодовом микроволновом устройстве. После охлаждения добавили воду, полученный в результате осадок собрали путем фильтрации и промыли диоксаном. Твердое вещество грязно-белого цвета высушили в вакууме с получением 98 мг
МПК / Метки
МПК: A61P 27/00, A61K 31/53, C07D 487/04
Метки: качестве, пирролотриазины, гидроксиметиларилзамещенные, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-23775-gidroksimetilarilzameshhennye-pirrolotriaziny-v-kachestve-ingibitorov-alk1.html" rel="bookmark" title="База патентов Евразийского Союза">Гидроксиметиларилзамещенные пирролотриазины в качестве ингибиторов alk1</a>
Предыдущий патент: Очищающая композиция
Следующий патент: Способ получения состава, содержащего аморфный гидрат окиси железа
Случайный патент: Жидкостный затвор для утилизации газа, сжигаемого в факеле












