Арил- и гетероарилкарбонильные производные гексагидроинденопиридина и октагидробензохинолина
Номер патента: 22323
Опубликовано: 30.12.2015
Авторы: Чжуан Линхан, Нар Герберт, Экхардт Маттиас, Химмельсбах Франк, Петерс Штефан
Формула / Реферат
1. Соединение формулы I
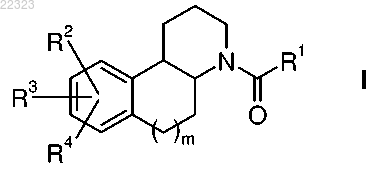
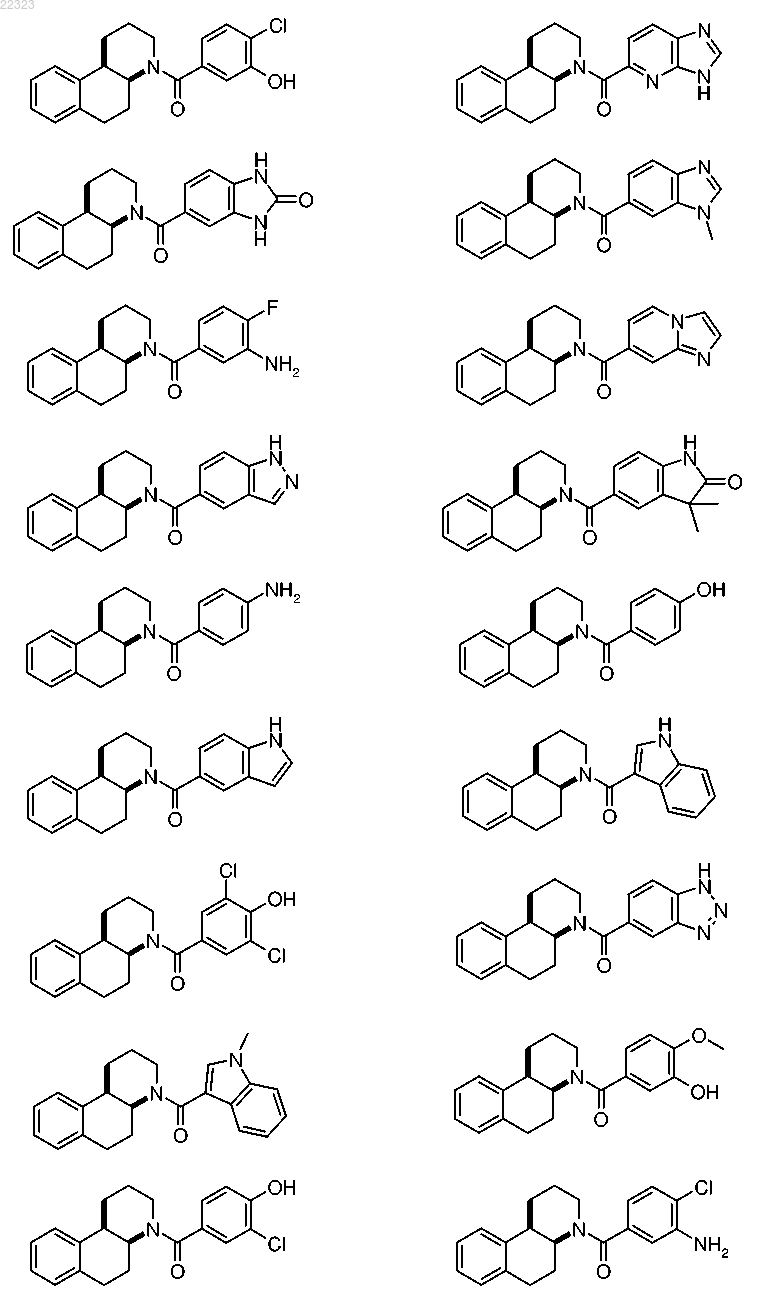
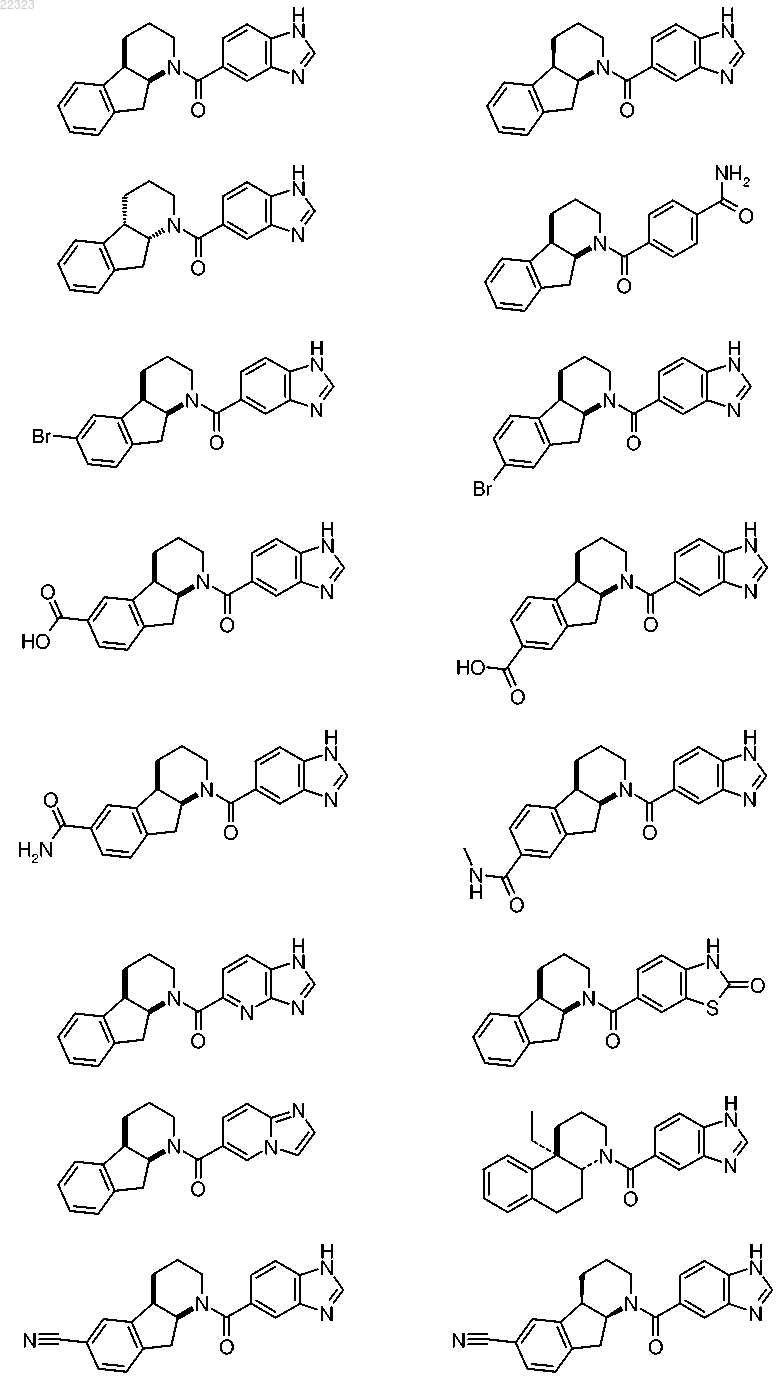
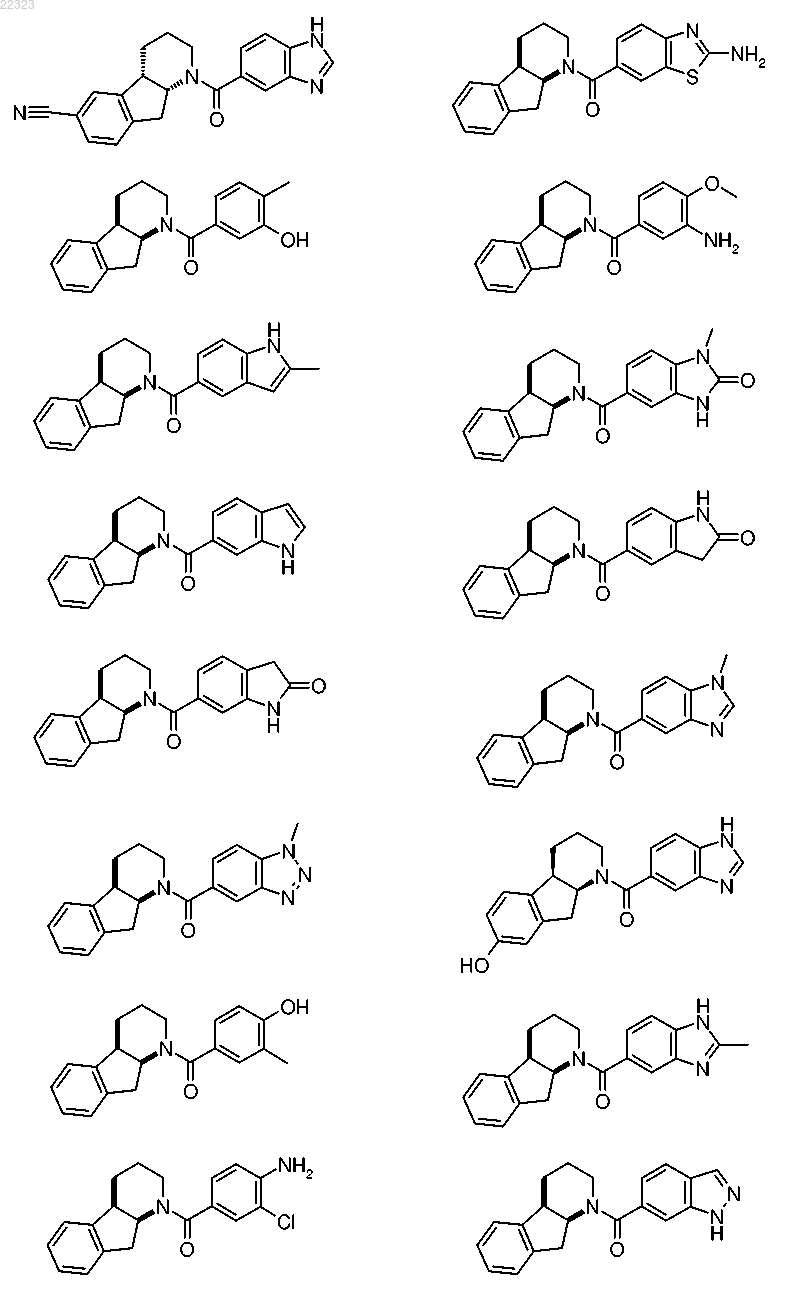
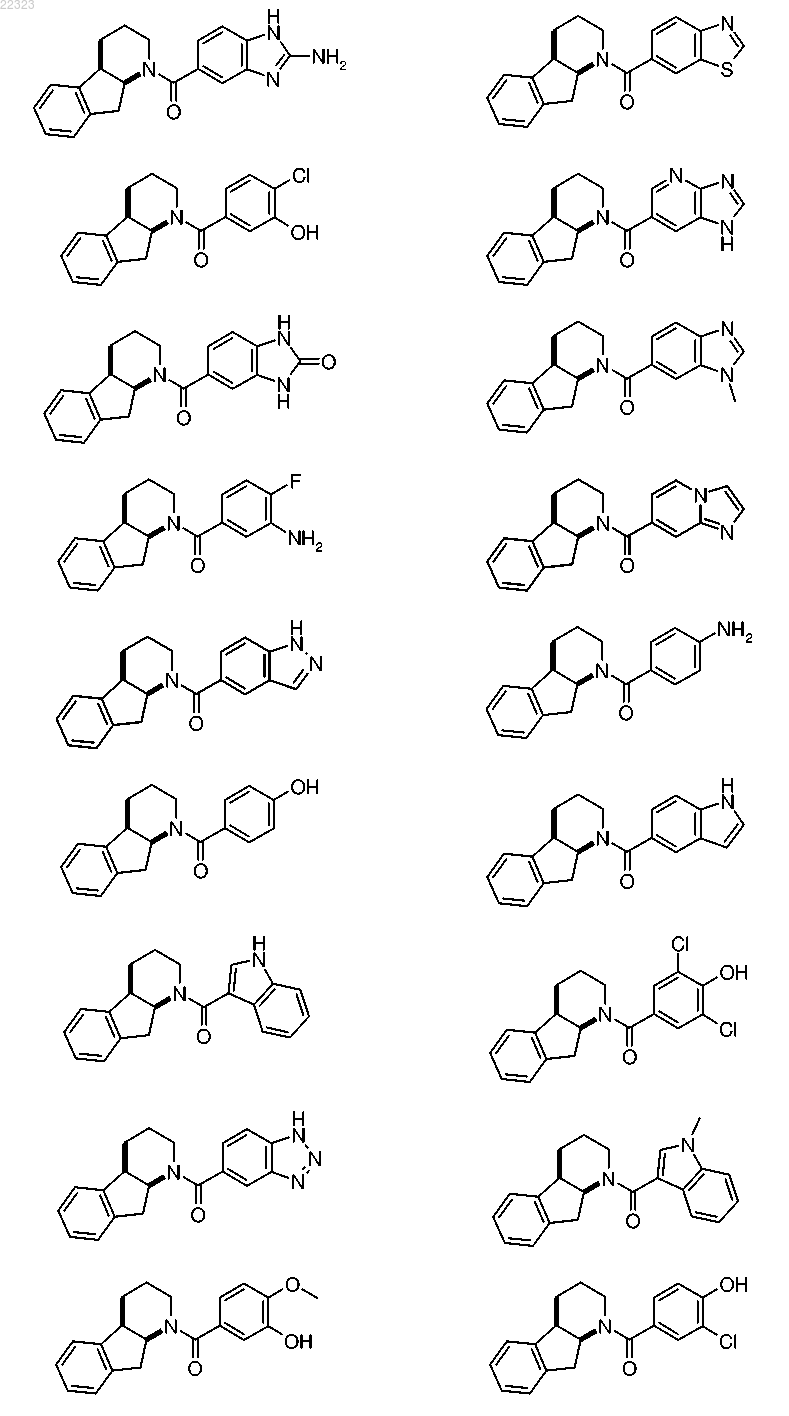
где R1 выбран из группы, состоящей из
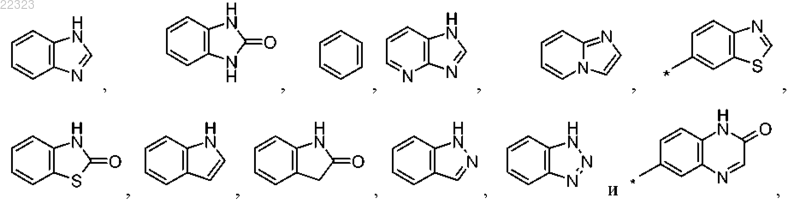
при этом радикалы R1 присоединены к карбонильной группе в формуле I посредством ароматического атома углерода, и
при этом радикалы R1 необязательно могут быть замещены одним R5, от одного до трех одинаковыми и/или различными R6 и/или одним R7, при условии, что в случае, когда R1 представляет собой фенильную группу, заместители R5, R6 и/или R7 не присоединены к атомам углерода, находящимся рядом с атомом углерода, присоединенным к карбонильной группе в формуле I;
R2 выбран из группы, состоящей из водорода, фтора, брома, С1-3алкила, циклопентила, этинила, 2-фенилэтенила-, циклогексилметила, фенилметила, 4-метоксифенилметила, гидроксиметила, 2-гидроксипроп-2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1-илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, нитро, ацетиламино, метилсульфониламино, гидрокси, метокси, фуранила, тетрагидропиран-4-ила, 1-метил-1H-пиразол-4-ила, 4-метоксифенокси и 6-метилпирадазин-3-илокси;
R3, R4 независимо друг от друга выбраны из группы, состоящей из водорода, фтора, хлора, брома, метила, циано, гидрокси и метокси, или
R3 и R4 объединены со смежными атомами углерода с образованием 2-метил-4,5-дигидрооксазола или 4,5-дигидрооксазола;
R5 выбран из группы, состоящей из фтора, хлора, C1-3алкила, амино, гидрокси, аминокарбонила и C1-3алкокси,
R6, R7 выбраны независимо друг от друга из группы, состоящей из фтора, хлора, C1-3алкила, гидрокси и C1-3алкокси;
m обозначает 0 или 1;
и при этом алифатическая часть трициклической структуры ядра общей формулы I замещена одной или двумя различными или идентичными группами, выбранными из R8;
R8 выбран независимо друг от друга из группы, состоящей из водорода, метила и этила;
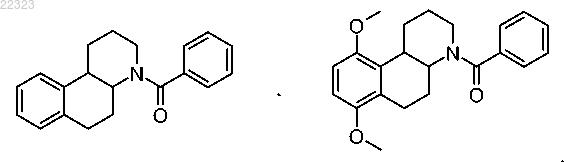
или их стереоизомеры, смеси и соли, при этом исключаются следующие соединения:
2. Соединения по п.1 формулы I.a
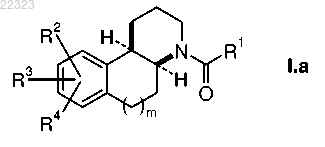
или их соли или их смесь, где подструктура пиперидина и подструктура тетралина (m=1) или индана (m=0) образуют трициклическую базовую структуру в цис-конфигурации.
3. Соединение формулы 1.b по п.1 или 2
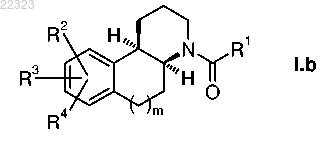
или их соли или их смесь, где трициклическая базовая структура имеет конфигурирацию R при С-10b (для m=1)/С-4а (для m=0) и конфигурацию S при С-4а (для m=1)/С-9а (для m=0).
4. Соединение по любому из пп.1-3, где m=0.
5. Соединение по любому из пп.1-4, где R1 выбран из группы, состоящей из
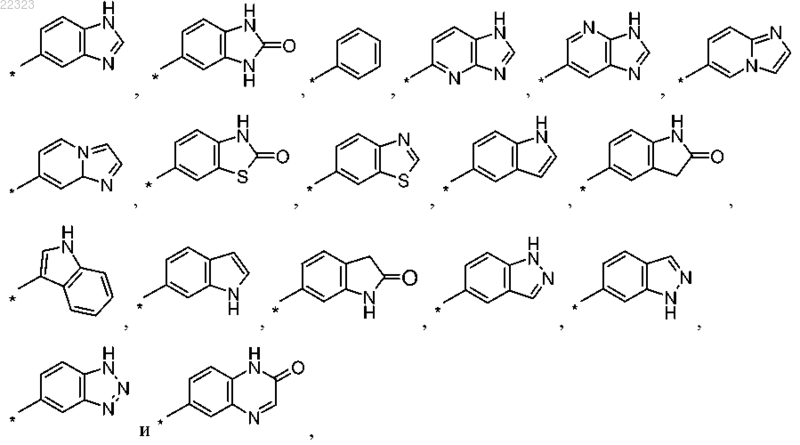
при этом радикалы R1 присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода, и
при этом радикалы R1 необязательно могут быть замещены одним R5, одним R6 и/или одним R7, при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, которые расположены по соседству с атомом углерода, присоединенным к карбонильной группе в формуле I.
6. Соединение по любому из пп.1-5, где R1 выбран из группы, состоящей из
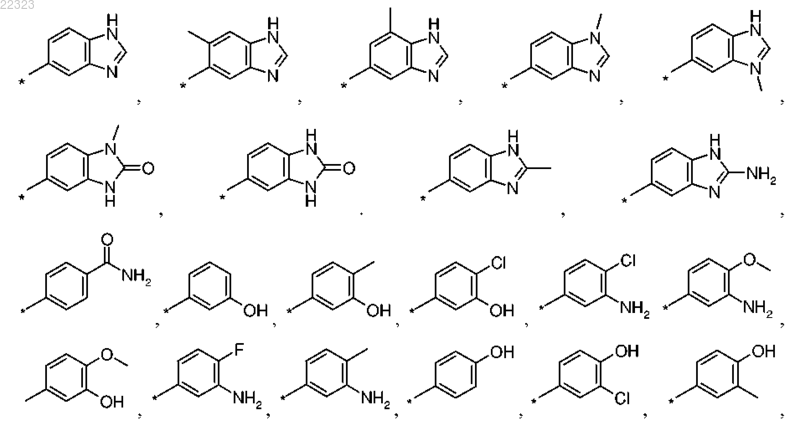
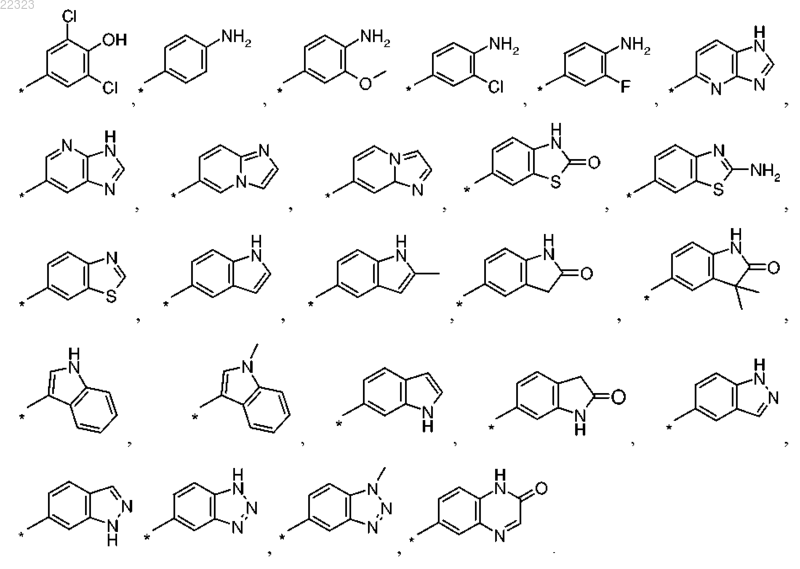
7. Соединение по любому из пп.1-6, где R1 выбран из группы, состоящей из бензимидазол-5-ила, 6-метилбензимидазол-5-ила и 7-метилбензимидазол-5-ила.
8. Соединения по любому из пп.1-7, где R2 выбран из группы, состоящей из водорода, фтора, брома, циклогексилметила, фенилметила, 4-метоксифенилметила, гидроксиметила, 2-гидрокси-проп-2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1-илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, гидрокси, метокси, 4-метоксифенокси и 6-метилпиридазин-3-илокси.
9. Соединения по любому из пп.1-8, где R2 выбран из группы, состоящей из водорода и циано.
10. Соединение по любому из пп.1-9, где R3, R4 выбраны независимо друг от друга из группы, состоящей из водорода, фтора, хлора, метила, циано, гидрокси и метокси.
11. Соединение по любому из пп.1-10, где R3, R4 выбраны независимо друг от друга из группы, состоящей из водорода, фтора и метила.
12. Соединение по любому из пп.1-11, где R3, R4 выбраны независимо друг от друга из группы, состоящей из водорода и фтора.
13. Соединение по любому из пп.1-12, где R5 выбран из группы, состоящей из водорода, фтора, хлора, метила, амино, гидрокси и метокси.
14. Соединение по любому из пп.1-13, где R5 выбран из группы, состоящей из фтора, хлора, метила, амино, гидрокси и метокси.
15. Соединение по любому из пп.1-14, где
R1 выбран из группы, состоящей из бензимидазол-5-ила, 6-метилбензимидазол-5-ил и 7-метилбензимидазол-5-ила,
R2 выбран из группы, состоящей из водорода и циано.
R3, R4 выбраны из группы, состоящей из водорода и фтора и
m обозначает 0.
16. Соединение по п.1, которое имеет следующую формулу:
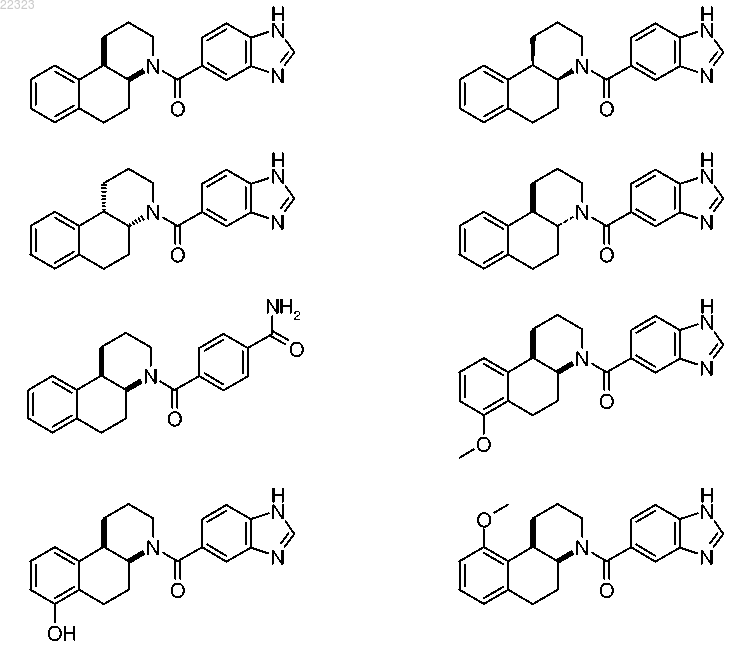
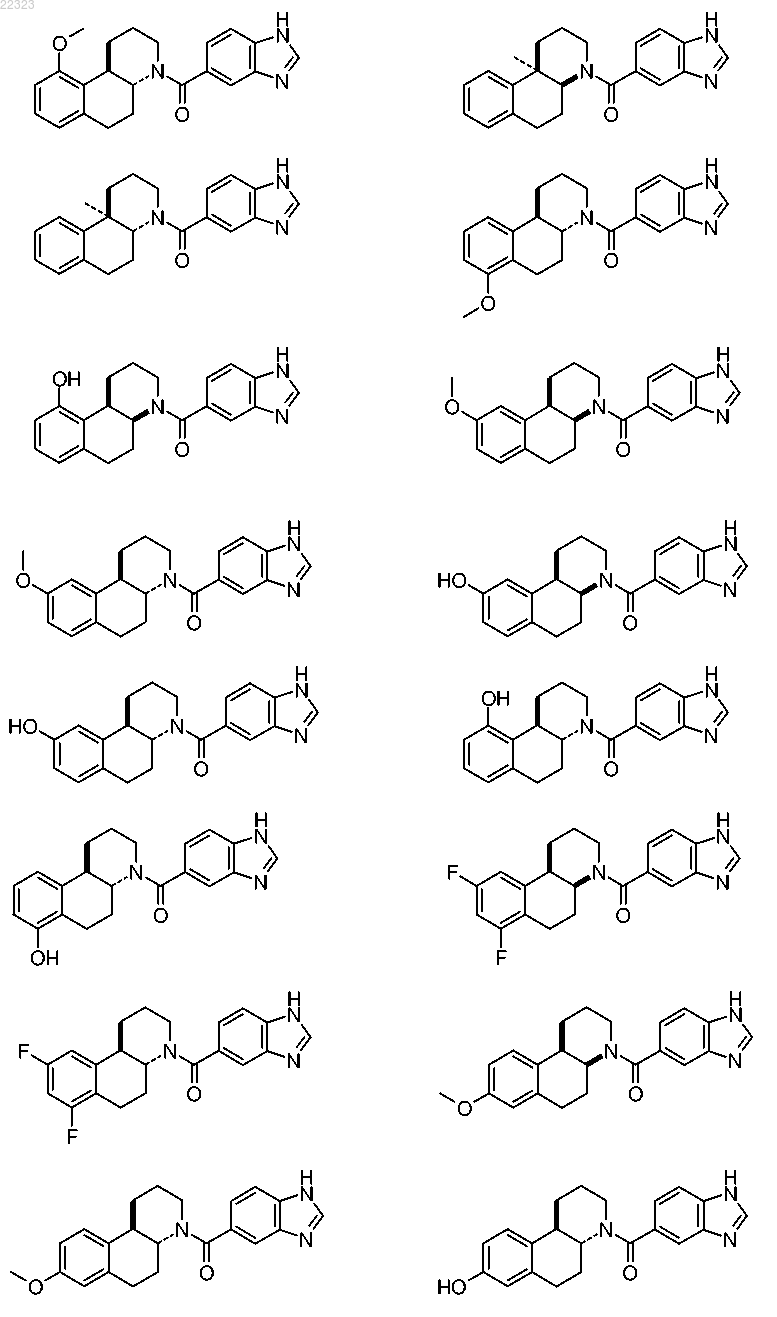
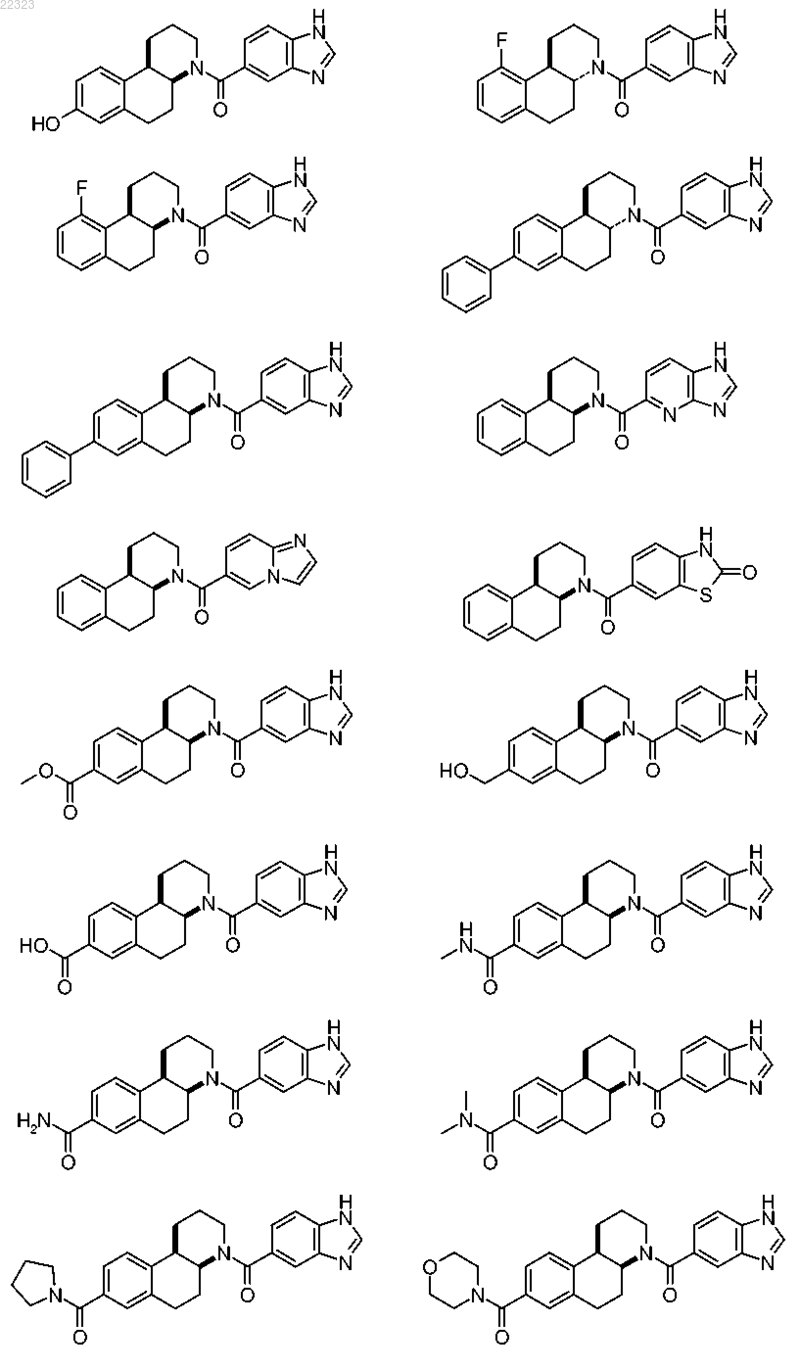
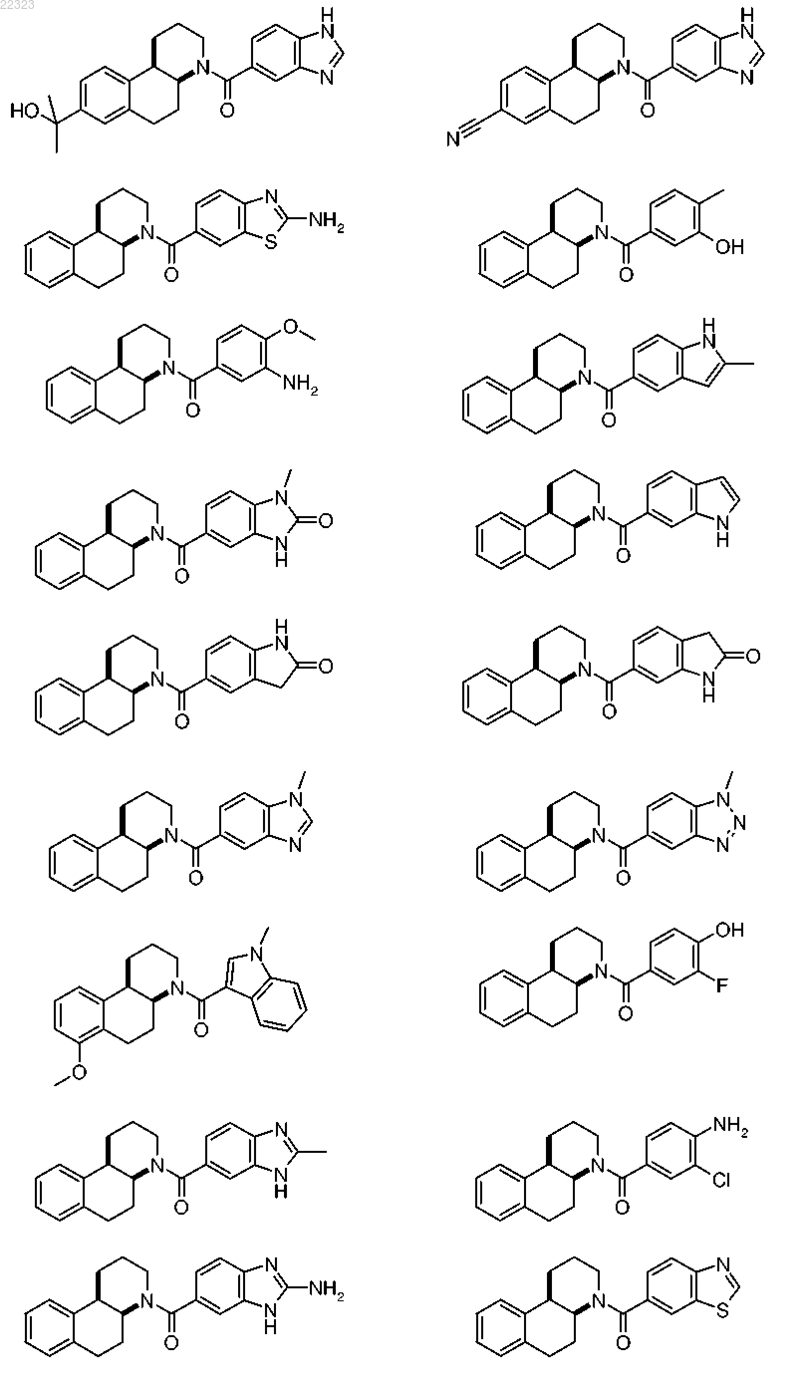

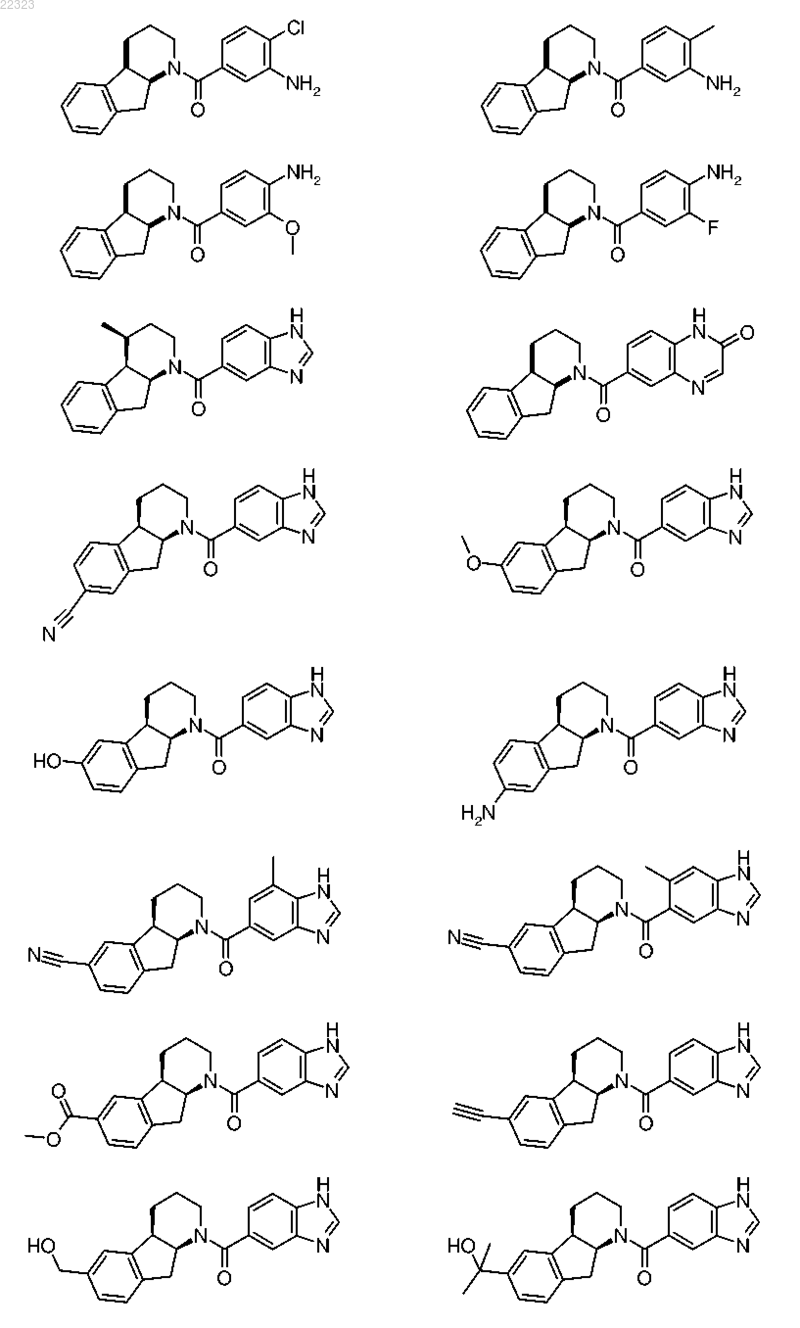
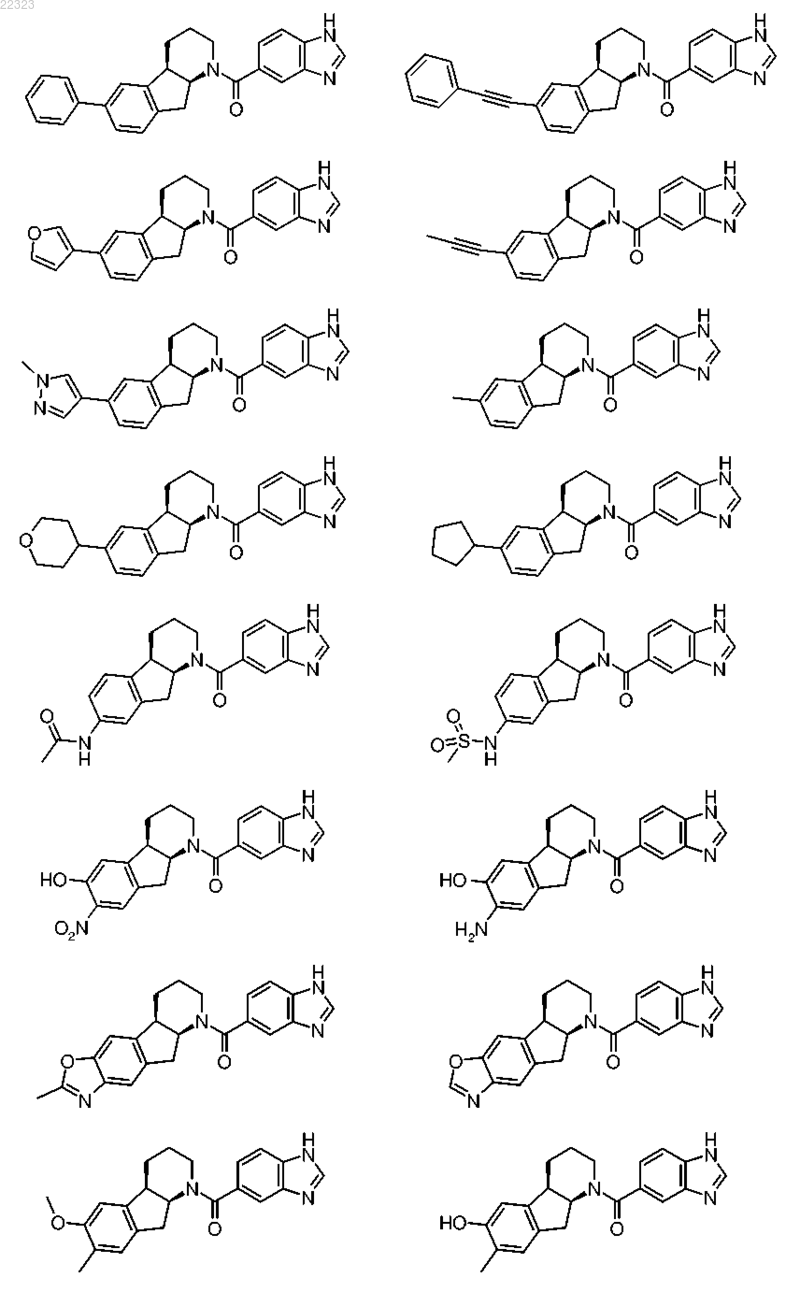
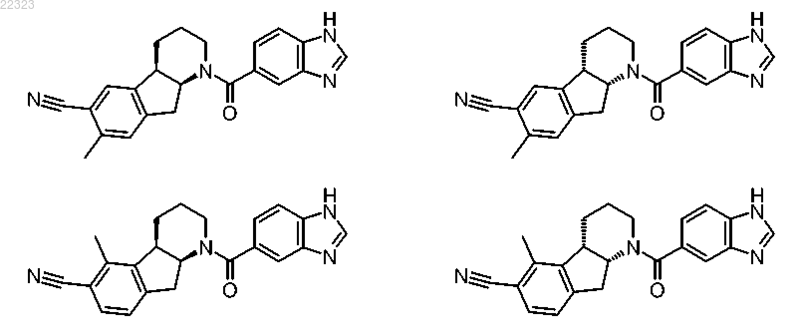
или ее фармацевтически приемлемая соль или их смесь.
17. Соединение по п.1, которое имеет следующую формулу:
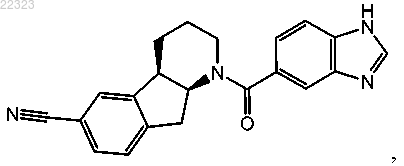
или ее фармацевтически приемлемая соль.
18. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по любому из пп.1-17 или его фармацевтически приемлемую соль, в комбинации с одним или более фармацевтически приемлемых носителей.
19. Применение соединения по любому из пп.1-17 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предупреждения заболеваний или состояний, на которые можно воздействовать путем ингибирования фермента 11β-гидроксистероиддегидрогеназы типа 1 (HSD), таких как болезни обмена веществ.
20. Применение по п.19, при котором заболевание или состояние выбрано из следующих: сахарный диабет 1 или 2 типа, ретинопатия, нефропатия, нейропатия, диабетическая стопа, язвы, макроангиопатия, медленное или слабое заживление ран, метаболический ацидоз или кетоз, реактивная гипогликемия, гиперинсулинемия, глюкозное метаболическое нарушение, гипогликемия, гиперинсулинемия, резистентность к инсулину, метаболический синдром, дислипидемия различных органов, атеросклероз, ожирение, высокое кровяное давление, хроническая сердечная недостаточность, эдема и гиперурицемия.
21. Применение по п.20, при котором заболевание или состояние выбрано из группы, состоящей из диабета 2 типа, ожирения, нарушения толерантности к глюкозе, резистентности к инсулину и дислипидемии.
22. Применение по п.21, при котором заболевание или состояние выбрано из диабета 2 типа.
Текст
АРИЛ- И ГЕТЕРОАРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ГЕКСАГИДРОИНДЕНОПИРИДИНА И ОКТАГИДРОБЕНЗОХИНОЛИНА Настоящее изобретение относится к соединениям согласно формуле I где переменные R1, R2, R3, R4 и m определены в п.1, проявляющим полезную фармакологическую активность. В частности, соединения являются ингибиторами 11-гидроксистероиддегидрогеназы типа 1 (HSD) и, следовательно, являются пригодными для лечения и предупреждения заболеваний,на которые можно воздействовать путем ингибирования этого фермента, таких как болезни обмена веществ, в особенности диабета 2 типа, ожирения и дислипидемии.(US); БЕРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНЭШНЛ ГМБХ (DE) Область техники, к которой относится изобретение Настоящее изобретение относится к гексагидроинденопиридинам и октагидробензохинолинам и их применению в качестве ингибиторов 11-гидроксистероиддегидрогеназы типа 1 (HSD-1), фармацевтическим композициям, содержащим указанные соединения, а также их применению для лечения болезней обмена веществ, таких как метаболический синдром, диабет, ожирение и дислипидемия. Кроме того,изобретение относится к способам приготовления фармацевтической композиции, а также предлагаемого в изобретении соединения. Сведения о предшествующем уровне техники Для лечения метаболического синдрома, прежде всего диабета 2 типа, ожирения и дислипидемии, в литературе предлагаются различные соединения, обладающие ингибирующим действием на фермент 11-гидроксистероиддегидрогеназу типа 1 (HSD-1). В Bulletin of the Chemical Society of Japan 1959, 32, стр. 1005-7 и Journal of Organic Chemistry 1964,29, стр. 1419-24 описаны соединения, имеющие следующие структуры: В Journal of Organic Chemistry 1984, 49, стр. 2504-6 предложены методы хроматографического разделения энантиомеров гетероциклических аминов, в том числе энантиомеров следующего рацемического соединения: В Journal of Medicinal Chemistry 1981, 24, стр. 1432-7 предложено следующее соединение в качестве промежуточного соединения для разделения цис- и транс-изомера: Сущность изобретения Совершенно неожиданно было обнаружено, что соединения согласно настоящему изобретению обладают не только ингибирующим действием на HSD-1 in vitro и/или in vivo, но также проявляют высокую метаболическую стабильность, что делает их пригодными для применения в качестве лекарственных средств. Таким образом, целью настоящего изобретения является разработка гексагидроинденопиридинов и октагидробензохинолинов, которые in vitro и/или in vivo обладают ингибирующим действием наHSD-1 и проявляют пригодные фармакологические и фармакокинетические свойства для применения их в качестве лекарственных средств. В другом аспекте настоящего изобретения предложены новые фармацевтические композиции, пригодные для предупреждения и/или лечения болезней обмена веществ. Другой аспект изобретения относится к физиологически приемлемым солям соединений общей формулы I согласно данному изобретению с неорганическими или органическими кислотами или основаниями. В другом аспекте данное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение общей формулы I или физиологически приемлемую соль согласно изобретению, необязательно в комбинации с одним или несколькими инертными носителями и/или разбавителями. В другом аспекте данное изобретение относится к соединениям общей формулы I или их фармацевтически приемлемым солям для лечения или предупреждения заболеваний или состояний, на которые можно воздействовать путем ингибирования фермента 11-гидроксистероиддегидрогеназы типа 1 (HSD1), например болезней обмена веществ. В другом аспекте данное изобретение относится к применению по меньшей мере одного соединения общей формулы I или его фармацевтически приемлемой соли для приготовления фармацевтической композиции, которая является пригодной для лечения или предупреждения заболеваний или состояний,на которые можно воздействовать путем ингибирования фермента 11-гидроксистероиддегидрогеназы типа 1 (HSD-1), например болезней обмена веществ. Другие цели настоящего изобретения будут очевидны для опытного специалиста в данной области непосредственно исходя из предществующего и последующего описания. Подробное описание В первом аспекте настоящее изобретение относится к соединениям общей формулы IR1 выбран из группы состоящей из при этом радикалы R1 присоединены к карбонильной группе в формуле I посредством ароматического атома углерода, и радикалы R1 необязательно могут быть замещены одним R5, от одного до трех одинаковыми и/или различными R6 и/или одним R7 при условии, что в случае, когда R1 представляет собой фенильную группу, заместители R5, R6 и/или R7 не присоединены к атомам углерода, находящимся рядом с атомом углерода, присоединенным к карбонильной группе в формуле I;R3, R4 независимо друг от друга выбраны из группы, состоящей из водорода, фтора, хрора, брома,метила, циано, гидрокси и метокси, илиR3 и R4 объединены со смежными атомами углерода с образованием 2-метил-4,5-дигидрооксазола или 4,5-дигидрооксазола;C1-3-алкокси-,R6, R7 выбраны независимо друг от друга из группы, состоящей из фтора, хлора, C1-3-алкила-, гидрокси и C1-3-алкокси-;m обозначает 0 или 1; и при этом алифатическая часть трициклической структуры ядра общей формулы I замещена одной или двумя различными или идентичными группами, выбранными из R8;R8 выбран независимо друг от друга из группы, состоящей из водорода, метила и этила; или их стереоизомеры, смеси, и соли,при этом исключаются следующие соединения: Способ получения соединений общей формулы I включает взаимодействие соединения общей формулы II в котором переменные R2, R3, R4 и m имеют указанные выше или ниже значения,с соединением общей формулы R1-CO-Y, необязательно приготовленным in situ из соответствую-2 022323 щей карбоновой кислоты (Y = ОН), гдеR1 имеет указанное выше или ниже значение иY представляет собой уходящую группу и, в частности, обозначает фтор, хлор, бром, циано, C1-4 алкокси, С 2-4-алкенилокси, С 2-4-алкинилокси, С 1-4-алкилсульфанил, арилтриазолокси, гетероарилтриазолокси, гетероар-N-ил, сукцинил-N-окси, C1-4-алкилкарбонилокси, ди-(С 1-4-алкил)аминокарбонилокси,пирролилкарбонилокси, пиперидинилкарбонилокси, морфолинилкарбонилокси, [три-(С 1-4-алкил)карбамимидоил]окси,[ди-(С 1-4-алкил)амино][ди-(С 1-4-алкил)иминиумил]метокси=[(С 1-4-алкил)2N]2 С+-О-,(N,N'-дициклогексилкарбамидоил)окси, ди-(С 1-4-алкилокси)фосфорилокси, бис[ди-(С 1-4-алкил)амино] фосфорилокси, [бис(пирролидин-1-ил)фосфорил)окси, арилокси, арилсульфанил, гетеросульфанил или гетероарилокси,при этом алкильная, алкенильная и алкинильная группы, упомянутые в определении указанных выше уходящих групп, необязательно могут быть моно- или полизамещенными фтором, хлором, C1-3 алкилом или C1-3-алкокси,арильные группы, упомянутые в определении указанных выше уходящих групп, по отдельности или как часть другой группы, обозначают фенил или нафтил, и гетероарильные группы, упомянутые в определении указанных выше групп, по отдельности или как часть другой группы, обозначают пиридинил, пиримидинил, триазинил, имидазолил, пиразолил, триазолил или тетразолил, в то время как арильная и гетероарильная группы необязательно могут быть моно- или полизамещенными независимо друг от друга фтором, хлором, бромом, С 1-3-алкилом, C1-3-алкилокси, нитро, циано и/или ди-(С 1-3 алкил)амино,необязательно в присутствии основания, такого как третичный или ароматический амин, например этилдиизопропиламин, триэтиламин, имидазол или пиридин, или неорганической соли, например карбоната калия или оксида кальция, и/или другого вспомогательного компонента, такого как 4 диметиламинопиридин или 1-гидроксибензотриазол, в растворителях, предпочтительно выбранных из тетрагидрофурана, 1,2-диметоксиэтана, эфира, 1,4-диоксана, N,N-диметилформамида, N,Nдиметилацетамида, N-метилпирролидинона, ацетонитрила, этилацетата, дихлорметана, 1,2-дихлорэтана,толуола, бензола и гексанов, при этом для некоторых комбинаций можно использовать водные и спиртовые растворы, перечисленные выше, предпочтительно при температуре от -10 до 120 С; и необязательно любая используемая в описанных выше реакциях защитная группа отщепляется одновременно или последовательно; при желании, соединение общей формулы I, полученное таким способом, превращается в его стереоизомеры; при желании, соединение общей формулы I, полученное таким способом, превращается в его соли,в частности в его физиологически приемлемые соли для фармацевтического применения. Если не указано иное, все группы, остатки и заместители, прежде всего R1, R2, R3, R4, R5, R6, R7, R8,10R , RN и m, имеют указанные выше и в последующем описании значения. При наличии в каком-либо соединении нескольких одних и тех же остатков, заместителей или групп они могут иметь идентичные или различные значения. Некоторые предпочтительные значения групп и заместителей соединений согласно изобретению будут представлены здесь далее. В другом варианте настоящего изобретенияR1 выбран из группы R1b, состоящей из фенила, нафтила, пирролила, фуранила, тиенила, пиридила,индолила, бензофуранила, бензотиофенила, хинолинила, изохинолинила,при этом в пирролильной, фуранильной, тиенильной и пиридильной группе необязательно одна группа СН может быть заменена на N, и при этом в индолильной, бензофуранильной, бензотиофенильной, хинолинильной и изохинолинильной группах необязательно одна или две группы СН могут быть заменены на N,инданила, 2,3-дигидроиндолила, 2-оксо-2,3-дигидроиндолила, 2,3-дигидробензофуранила, 2-оксо 2,3-дигидробензимидазолила, 2-оксо-2,3-дигидробензотиазолила, бензо[1,3]диоксолила, 1,2,3,4-тетрагидронафтила, 1,2,3,4-тетрагидрохинолинила, 1,2,3,4-тетрагидроизохинолинила, 2-оксо-1,2-дигидрохиноксалинила, 3-оксо-1,2,3,4-тетрагидрохиноксалинила, хроманила и имидазо[1,2-а]пиридинила,при этом члены группы R1b присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода, и при этом члены группы R1b необязательно могут быть замещены одним R5, одним R6 и/или одним 7R при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, следующим после атома углерода, который присоединен к карбонильной группе в формуле I. В другом варианте настоящего изобретенияR1 выбран из группы R1c, состоящей из фенила, нафтила, фуранила, тиенила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридила, индолила, бензофуранила, бензотиофенила,при этом в индолильной, бензофуранильной и бензотиофенильной группе необязательно одна или две группы СН могут быть заменены на N,-3 022323 инданила, 2,3-дигидроиндолила, 2-оксо-2,3-дигидроиндолила, 2,3-дигидробензофуранила, 2-оксо 2,3-дигидробензимидазолила, 2-оксо-2,3-дигидробензотиазолила, бензо[1,3]диоксолила, 1,2,3,4-тетрагидрохинолинила, 2-оксо-1,2-дигидрохиноксалинила, хроманила и имидазо[1,2-а]пиридинила,при этом члены группы R1c присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода, и члены группы R1c необязательно могут быть замещены одним R5, одним R6 и/или одним R7 при условии, что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, следующим после атома углерода, который присоединен к карбонильной группе в формуле I. В другом варианте настоящего изобретения соединение имеет формулу I.a или е соли или их смесь, где подструктура пиперидина и подструктура тетралина (m=1) или индана (m=0) образуют трициклическую базовую структуру в цис-конфигурации, или соединение имеет формулу I.b или е соли или их смесь, где трициклическая базовая структура имеет конфигурирацию R при С 10b (для m=1)/С-4 а (для m=0) и конфигурацию S при С-4 а (для m=1)/С-9 а (для m=0). В следующем варианте изобретения m=0. Другой вариант изобретения относится к соединениям, где R1 выбран из группы, состоящей из при этом радикалы R1 присоединены к карбонильной группе в формуле I через посредство ароматического атома углерода, и радикалы R1 необязательно могут быть замещены одним R5, одним R6 и/или одним R7 при условии,что в случае, когда R1 является фенильной группой, заместители R5, R6 и/или R7 не присоединены к атомам углерода, которые расположены по соседству с атомом углерода, присоединенным к карбонильной группе в формуле I; или Предпочтительно R1 выбран из группы, состоящей из бензимидазол-5-ила, 6-метил-бензимидазол 5-ила и 7-метилбензимидазол-5-ила. В следующем варианте изобретения R2 выбран из группы, состоящей из водорода, фтора, брома,циклогексилметила, фенилметила, 4-метоксифенилметила, гидроксиметила, 2-гидроксипроп-2-ила, фенила, циано, аминокарбонила, метиламинокарбонила, диметиламинокарбонила, пирролидин-1 илкарбонила, морфолин-4-илкарбонила, карбокси, метоксикарбонила, амино, гидрокси, метокси, 4 метоксифенокси и 6-метилпиридазин-3-илокси. Другие варианты включают соединение, где R3, R4 выбраны независимо друг от друга из группы,состоящей из водорода, фтора, хлора, метила, циано, гидрокси и метокси. При этом R5 выбран из группы, состоящей из водорода, фтора, хлора, метила, амино, гидрокси и метокси. Следующий вариант изобретения предусматривает соединение, гдеR2 выбран из группы, состоящей из водорода и циано;R3, R4 выбраны из группы, состоящей из водорода и фтора, иm обозначает 0. Некоторые термины, используемые здесь выше или ниже для описания соединений согласно изобретению, будут определены здесь более подробно. Термины, специально не определенные здесь, имеют значения, данные им опытными специалиста-5 022323 ми в данной области с учетом описания и контекста. Однако при использовании в описании, если не указано иное, следующие термины имеют указанное значение и придерживаются следующих правил. В группах, радикалах или звеньях, определенных ниже, число атомов углерода, как правило, предшествует названию группы, например "C1-6-алкил" означает алкильную группу или радикал, имеющий от 1 до 6 атомов углерода. Как правило, для групп, содержащих две или несколько подгрупп, последняя названная подгруппа является местом присоединения радикала, например заместитель "арил-С 1-3-алкил-" означает арильную группу, которая присоединена к C1-3-алкильной группе, которая присоединена к ядру или группе, к которой присоединен заместитель. Как правило, место присоединения конкретного остатка к другой группе должно быть изменяемым,то есть любой доступный атом, несущий атомы водорода, подлежащие замене, в пределах этого остатка,может быть связующим местом для присоединяемой группы, если не указано иное. Если не указано иное, во всем описании и прилагаемой формуле изобретения данная химическая формула или название должны охватывать все возможные структурные изомеры и стереоизомеры,включая энантиомеры, диастереомеры, цис/транс-изомеры, E/Z-изомеры и подобные, а также их смеси,например смеси 1:1 энантиомеров (называемых рацематами), смеси отдельных энантиомеров в различных пропорциях, смеси диастереомеров или смеси любых вышеперечисленных форм, где такие изомеры существуют, а также соли, включая их фармацевтически приемлемые соли, и их сольваты, такие как гидраты, включая сольваты свободных соединений или сольваты солей соединения. Используемое здесь выражение "фармацевтически приемлемый" относится к таким соединениям,продуктам, композициям и/или лекарственным формам, которые, не выходя за пределы медицинской оценки, являются пригодными для использования в контакте с тканями человека и животного без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, и которые соответствуют отношению разумная польза/риск. Используемый здесь термин "частично ненасыщенный" означает, что в обозначенной группе или звене имеется одна, две или более, предпочтительно одна или две двойные связи. Предпочтительно, чтобы используемый здесь термин "частично ненасыщенный" не включал полностью ненасыщенных групп или звеньев. Термин "галоген" обозначает атом, выбранный из группы, включающей F, Cl, Br и I. Термин "C1-n-алкил", где n может иметь значение от 1 до 18, обозначает насыщенную разветвленную или неразветвленную углеводородную группу, содержащую от 1 до n С-атомов. В качестве примеров таких групп можно назвать метил, этил, n-пропил, изопропил, бутил, изобутил, втор-бутил, третбутил, n-пентил, изопентил, неопентил, трет-пентил, n-гексил, изогексил и т.д. Термин "C1-n-алкилен", где n является целым числом от 1 до n, отдельно или в комбинации с другим радикалом, обозначает ациклический двухвалентный алкильный радикал с прямой или разветвленной цепью, содержащий от 1 до n атомов углерода. Например, термин C1-4-алкилен включает -(СН 2)-, -(СН 2 СН 2)-, -(СН(СН 3-, -(СН 2-СН 2-СН 2)-, -(С(СН 3)2)-, -(СН(СН 2 СН 3-, -(СН(СН 3)-СН 2)-, -(СН 2-СН(СН 3-,-(СН 2-СН 2-СН 2-СН 2)-, -(СН 2-СН 2-СН(СН 3-, -(СН(СН 3)-СН 2-СН 2)-, -(СН 2-СН(СН 3)-СН 2)-, -(СН 2 С(СН 3)2)-,-(С(СН 3)2-СН 2)-,-(СН(СН 3)-СН(СН 3-,-(СН 2-СН(СН 2 СН 3-,-(СН(СН 2 СН 3)-СН 2)-,-(СН(СН 2 СН 2 СН 3-, -(СНСН(СН 3)2)- и -С(СН 3)(СН 2 СН 3)-. Термин "С 2-n-алкилен", где n имеет значение от 3 до 10, обозначает разветвленную или неразветвленную углеводородную группу, содержащую от 2 до n атомов С и С=С двойную связь. В качестве примеров таких групп можно назвать этенил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1 пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5 гексенил и т.д. Термин "С 2-n-алкинил", где n имеет значение от 3 до 10, обозначает разветвленную или неразветвленную углеродородную группу, содержащую от 2 до n С-атомов, и тройную СС связь. В качестве примеров таких групп можно назвать этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1 пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5 гексинил и т.д. Если не указано иное, алкинильные группы соединены через С-атом в положении 1 с остальной частью молекулы. В соответствии с этим такие обозначения, как 1-пропинил, 2-пропинил, 1 бутинил и т.д., равнозначны обозначениям 1-пропин-1-ил, 2-пропин-1-ил, 1-бутин-1-ил и т.д. Сказанное аналогичным образом относится и к С 2-n-алкенильным группам. Термин "C1-n-алкоксигруппа" обозначает C1-n-алкил-О-группу, в которой C1-n-алкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метоксигруппу, этоксигруппу, nпропоксигруппу, изопропоксигруппу, n-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, третбутоксигруппу, n-пентоксигруппу, изопентоксигруппу, неопентоксигруппу, трет-пентоксигруппу, nгексоксигруппу, изогексоксигруппу и т.д. Термин "C1-n-алкилкарбонил" обозначает С 1-n-алкил-С(=О)-группу, в которой C1-n-алкил имеет указанные выше значения. В качестве примеров таких групп можно назвать метилкарбонил, этилкарбонил,n-пропилкарбонил, изопропилкарбонил, n-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, третбутилкарбонил, n-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, трет-пентилкарбонил, nгексилкарбонил, изогексилкарбонил и т.д. Термин "С 3-n-циклоалкил" обозначает насыщенную моно-, би-, три- или спирокарбоциклическую группу, содержащую от 3 до n С-атомов. В качестве примеров таких групп можно назвать циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклододецил, бицикло[3.2.1]октил, спиро[4.5]децил, норпинил, норборнил, норкарил, адамантил и т.д. В предпочтительном варианте под обозначением "С 3-7-циклоалкил" подразумеваются насыщенные моноциклические группы. Термин "С 5-n-циклоалкенил" обозначает С 5-n-циклоалкильную группу, которая определена выше и дополнительно имеет по меньшей мере одну двойную С=С связь. Термин "С 3-n-циклоалкилкарбонил" обозначает С 3-n-циклоалкил-С(=О)-группу, где С 3-n-циклоалкил имеет указанные здесь значения. Термин "С 3-n-гетероциклоалкил" обозначает насыщенную моно-, би-, три- или спирокарбоциклическую группу, которая определена выше и содержит от 3-m до n-m атомов С, где m атомы углерода заменены на m гетероатомы, независимо выбранные из N, NRN, О, S, SO и SO2. В качестве примеров таких групп можно назвать азиридинил, оксиранил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил,тетрагидротиофенил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, 1,3-диоксанил, 1,4-диоксанил, тиоморфолинил, азепанил, оксепанил, тиепанил, 1-аза-бицикло[2.2.2]октан, 1,4-диаза-бицикло[2.2.2]октан и т.д. В предпочтительном варианте под обозначением "гетероциклоалкил" подразумеваются насыщенные моноциклические С 5-6-циклоалкильные группы, в которых один или два атома углерода заменены на N и/или О. Термин "три-(С 1-4-алкил)силил" обозначает силильные группы с одинаковыми или двумя либо тремя различными алкильными группами. Термин "ди-(С 1-3-алкил)аминогруппа" обозначает аминогруппы с двумя одинаковыми или различными алкильными группами. Если группы или остатки необязательно являются замещенными, это относится к любой форме группы или остатка. Например, если алкильная группа необязательно является моно- или полифторированной, это включает также алкильные остатки, которые являются частью более крупных групп, например алкилокси, алкилкарбонил, алкоксиалкил и др., или если (гет)арильная группа необязательно является моно- или полизамещенной конкретным заместителем или набором заместителей, это также включает(гет)арильные группы, которые являются частью более крупных групп, например (гет)арил-С 1-n-алкил,(гет)арилокси, (гет)арилокси-С 1-n-алкил, (гет)арил-С 1-n-алкилокси и др. Соответственно, в случаях, когда, например, R2 или R5 имеют, например, значение (гет)арилокси, в то время как (гет)арильные остатки являются необязательно моно- или полифторированными и (гетеро)арил означает, в частности, фенил, значения моно-, ди-, три-, тетра- и пентафторфенокси являются также включенными. Это относится к группам или остаткам, в которых часть группы или остаток заменен другой группой, например группа СН 2 необязательно заменена на О, S, NRN, CO или SO2. Например,если остаток обозначает, в частности, гидрокси-С 1-3-алкил, где группа СН 2 необязательно заменена на СО(=карбонил), то это также включает карбокси, карбоксиметил, гидроксиметилкарбонил, 1-гидрокси-2 оксоэтил, карбоксиэтил, 2-карбоксиэтил, 1-карбоксиэтил, гидроксиметилкарбонилметил, 1-гидрокси-2 оксопропил, гидроксиэтилкарбонил, (2-гидроксиэтил)карбонил, гидрокси-3-оксопропил, 1-гидрокси-3 оксопропил, 2-гидрокси-3-оксопропил, (1-гидроксиэтил)карбонил, 2-гидрокси-1-оксо-проп-2-ил, гидрокси-2-оксо-проп-2-ил и 3-гидрокси-1-оксо-проп-2-ил. Аналогично, определение, такое как C1-n-алкил, где одна или несколько групп СН 2 необязательно заменены, например, карбонилом, и который является необязательно замещенным, например, гидрокси или амино, также содержит конкретные остатки, не имеющие группы СН и/или СН 2, например карбокси и аминокарбонил. Все атомы/элементы, описанные здесь, включая атомы, которые являются частью группы, включают все стабильные изотопные формы соответствующего элемента. Например, в случаях, когда упоминается водород, конкретно или как часть группы, такой как метил, это включает водород и дейтерий как стабильные изотопные формы элемента водорода. Предлагаемые в изобретении соединения могут быть получены известными методами синтеза. Предпочтительно получать такие соединения более подробно рассмотренными ниже предлагаемыми в изобретении способами. На схеме 1 показан общий способ получения основных структур соединений изобретения с использованием трициклического пиридина в качестве предшественника для трициклического пиперидинового остова; R2, R3, R4 и m имеют указанные выше или ниже значения. Трициклический пиридин можно получить из 2-инданонов (m=0) или 2-тетралонов (m=1) и пропаргиламина или его производного путем объединения двух исходных соединений в присутствии катализатора, такого как соли или комплексы золота и меди, предпочтительно NaAuCl4 и CuCl2 (см. J. Org. Chem. 2003, 68, 6959-6966). Реакцию обычно проводят в спиртах, таких как этанол, при температуре от 20 до 120 С путем обычного нагревания или нагревания микроволновым излучением. Полученная структура пиридина превращается в производное пиперидина путем восстановления водородом в присутствии катализатора на основе переходного металла, такого как PtO2, Pt/C, Pd/C, Rh/C, Ni-Ренея или их смесей. В число предпочтительных растворителей входят спирты, например метанол и этанол, этилацетат, уксусная кислота, вода, эфир, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, N-метилпирролидинон, гексаны, ме-7 022323 тилциклогексан или их смеси, необязательно в комбинации с добавками, такими как кислота, например трифторуксусная кислота, соляная кислота и серная кислота, при температуре от 10 до 150 С, предпочтительно от 20 до 80 С, и давлении водорода от 1 до 150 бар, предпочтительно от 1 до 20 бар. Или же восстановление можно осуществить после превращения пиридина в ион пиридиния путем Nалкилирования, N-ацилирования или N-сульфонилирования путем обработки источником гидрида, таким как NaBH4 или LiAlH4. Последний реагент предпочтительно использовать в углеводородах, эфире, татрагидрофуране, 1,4-диоксане, бензоле или толуоле, в то время как первый предпочтительно использовать в спиртах, например метаноле или этаноле, и воде необязательно в комбинации с корастворителем, таким как тетрагидрофуран, 1,4-диоксан или N-метилпирролидинон, а также добавкой, такой как кислота, например уксусная кислота, или основание, например гидроксид натрия. Схема 1 Стратегия 1 построения трициклического остова Другой способ, альтернативный способу синтеза предшественника трициклического пиридина,описанному на схеме 1, показан на схеме 2. R2, R3, R4 и m имеют указанные выше или ниже значения. Катализируемое переходным металлом связывание фенилметильного (для m=0) или фенетильного (дляm=1) производного металла с 2,3-дигалогенидом или псевдогалогенидом пиридина обеспечивает получение необходимого промежуточного соединения. Пригодными остатками металла в фенилалкильном производном металла могут быть, например, MgCl, MgBr, В(ОН)2, B(OCMe2CMe2O), BF3K, ZnCl, ZnBr или ZnI, и пригодным галогенидом или псевдогалогенидом при пиридине предпочтительно является Cl,Br, I, F3CSO3, p-TolSO3 и MeSO3. В зависимости от партнеров связывания могут использоваться различные катализаторы, главным образом, на основе Pd, Ni, Cu или Fe, Pd(PPh3)4, Pd[1,1'-бис(дифенилфосфино)ферроцен)]Cl2, Pd(PPh3)2Cl2, Ni(PPh3)2Cl2, или Pd на С, наночатиц Pd или Fe, Pd(II), Ni(II),Fe(II) или солей Fe(III), таких как Pd(O2CCH3)2, PdCl2, NiCl2 или FeCl3, необязательно в комбинации с 2(необязательно замещенный фенил)фенил-дициклогексилом или ди-трет-бутилфосфином, трифенилфосфином, тритолилфосфином, трифурилфосфином, три-трет-бутилфосфином, трициклогексилфосфином,при этом соль 1,3-диарилимидазолидиния или соль 1,3-диарилдигидроимидазолидиния являются наиболее часто используемыми катализаторами. Связывания предпочтительно проводить в толуоле, тетрагидрофуране, 1,4-диоксане, 1,2-диметоксиэтане, N,N-диметилформамиде, N,N-диметилацетамиде, Nметилпирролидиноне или их смесях, в зависимости от партнеров связывания, необязательно, в комбинации со спиртом, например метанолом, водой, солями щелочных металлов, такими как LiCl, NaOH,Na2CO3, K2CO3, CS2CO3, NaO2CCH3 или K3PO4, солями аммония, например Bu4NCl, или солями серебра,например AgO3SCF3, при температуре от -10 до 150 С. Последующую циклизацию бензил- или фенетилпиридина для получения трициклической структуры пиридина можно проводить с помощью другой реакции, катализируемой переходным металлом, предпочтительно Pd, например, на основе Pd(O2CCH3)2 или Pd(O2CCMe3)2 и фосфинового лиганда, такого как, например, ди-трет-бутилметилфосфин, трициклогексилфосфин, трифенилфосфин, три(4-фторфенил)фосфин или 2-(2-диметиламинофенил)фенилдифенилфосфин. Предпочтительно циклизацию проводить в присутствии соли калия, например K2CO3 или KO2CCH3, необязательно, в комбинации с солью серебра, например Ag2CO3 или AgO3SCF3, и/или пивалевой кислоты в N,N-диметилацетамиде при температуре от 40 до 160 С (см., например, Tetrahedron 2008, 64, 6015-20 и размещенные в них ссылки). Схема 2 Стратегия 2 построения трициклического остова На схеме 3 показана стратегия получения предшественника трициклического пиридина, альтернативная описанной на схеме 1. R2, R3, R4 и m имеют указанные выше или ниже значения. Катализируемое переходным металлом связывание фенильного производного металла, при этом металлом является, например, MgCl, MgBr, В(ОН)2, B(OCMe2CMe2O), BF3K, ZnCl, ZnBr или Znl, с производным пиридин-2 карбоновой кислоты или замещенным 3-галогенидом или псевдогалогенидом производным пиридин-2 карбоновой кислоты (m=0) или производным пирид-2-илуксусной кислоты (m=1), где производным карбоновой кислоты предпочтительно является карбоновая кислота, сложный эфир карбоновой кислоты или карбонитрил, обеспечивает получение первого промежуточного соединения. В зависимости от партнеров связывания могут использоваться различные катализаторы предпочтительно на основе Pd, напримерPd(PPh3)4, Pd[1,1'-бис(дифенилфосфино)ферроцен]Cl2, Pd(PPh3)2Cl2, Pd на С, наночастиц Pd, солей Pd(II),таких как Pd(O2CCH3)2 или PdCl2, необязательно, в комбинации с 2-(необязательно замещенный фенил)фенилдициклогексилом или ди-трет-бутилфосфином, трифенилфосфином, тритолилфосфином, трифурилфосфином, три-трет-бутилфосфином, трициклогексилфосфином, солью 1,3-диарилимидазолидиния или солью 1,3-диарилдигидроимидазолидиния, необязательно, в присутствии солей щелочных металлов, таких как LiCl, NaOH, NaOtBu, KOtBu, Na2CO3, K2CO3, Cs2CO3, NaO2CCH3 или K3PO4, солей аммония, например Bu4NCl, и/или солей серебра, например AgO3SCF3, предпочтительно используемых в толуоле, тетрагидрофуране, 1,4-диоксане, N,N-диметилформамиде, N,N-диметилацетамиде, Nметилпирролидиноне или их смесях, необязательно, в комбинации с водой, при температуре от -10 до 150 С. Последующее внутримолекулярное ацилирование по Фриделю-Крафтсу обеспечивает получение трициклического пиридинового остова путем активации функциональной карбоксигруппы, например карбоновой кислоты, ангидрида, смешанного ангидрида, или эфира, карбонилхлорида или нитрила, с кислотой Льюиса, в зависимости от типа карбоксигруппы и электронной природы подструктуры бензола,например бромисто-водородной кислоты, соляной кислоты, серной кислоты, фосфорной кислоты, трифторуксусной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты, трифторметансульфоновой кислоты, SnCl4, FeCl3, AlBr3, AlCl3, SbCl5, BCl3, BF3, ZnCl2, монтмориллонитов, POCl3 и PCl5,предпочтительно в инертном растворителе, например ацетонитриле, дихлорметане, 1,2-дихлорметане,1,4-диоксане, 1,2-диметоксиэтане, углеводородах, нитробензоле или хлорбензоле, при температуре от 0 до 180 С. Восстановление полученной таким способом кетогруппы предпочтительно осуществлять водородом в присутствии катализатора на основе переходного металла, например Pd/C, Pd(OH)2, PtO2, Pt/C или Rh/C, в спирте, например метаноле, гликоле или этаноле, воде, уксусной кислоте этилацетате, Nметилпирролидиноне, тетрагидрофуране, 1,4-диоксане, эфире или их смесях, необязательно в присутствии кислоты, например соляной кислоты, при температуре от 0 до 180 С, предпочтительно от 20 до 120 С, и давлении водорода от 1 до 100 бар, предпочтительно от 1 до 10 бар. Или же восстановление кетогруппы можно провести с помощью гидрида, например триэтилсилана, борана, борогидрида натрия или литий-алюминий гидрида, необязательно в присутствии кислоты Льюиса, например BF3, AlCl3, InCl3,SnCl4, FeCl3, ZnCl2, уксусной кислоты, трифторуксусной кислоты, соляной кислоты, метансульфоновой кислоты или трифторметансульфоновой кислоты при температуре от 0 до 140 С. Схема 3 Стратегия 3 построения трициклического остова На схеме 4 показана стратегия, пригодная для получения остова соединений изобретения, где m равно 0; R2, R3 и R4 имеют указанные выше или ниже значения. Фенилпиридильная структура собрана путем катализируемого переходным металлом связывания, как описано на схеме 3. Для этой цели использовали нуклеофильную фенильную группу, несущую М, и электрофильную пиридиновую группу,несущую Y, несмотря на то, что для сборки могут использоваться элементы структуры с противоположной реакционной способностью, т.е. фенил, несущий Y, и пиридин, несущий М, обеспечивая такой же продукт связывания. Полученное соединение несет две потенциальных уходящих группы, предпочтительно фтор, хлор, бром, арилсульфонат, нитро или арилсульфонил, по одной на каждом (гетеро)ароматическом кольце, прилегающем к фенилпиридильной связи. Дианионный метиленовый синтон,-9 022323 например малоновая кислота, сложный малоновый диэфир, малодинитрил, цианоуксусная кислота или цианоуксусный сложный эфир в комбинации с основанием, например Cs2CO3, K2CO3, Na2CO3, KOtBu,NaOEt, NaOMe, NEt3, lPr2NEt, 1,8-диазабицикло[5.4.0]-ундек-7-ене, последовательно заменяет обе уходящие группы ароматическими нуклеофильными заместителями с образованием инденопиридинового остова. Предпочтительными растворителями для этого превращения, которое предпочтительно проводят при температуре от 0 до 180 С, среди прочих, являются N-метилпирролидинон, N,N-диметилацетамид,N,N-диметилформамид, спирт, например этанол, изопропанол или трет-бутанол, вода, диметилсульфоксид, 1,4-диоксан, тетрагидрофуран или их смеси. Карбоксильные электроноакцепторные группы удаляют гидролизом с помощью основания, например NaOH или KOH, или кислоты, например HCl или H2SO4, в водном или спиртовом растворе с образованием карбоксигруппы, которая декарбоксилируется спонтанно или при нагревании в кислой или основной среде. Такая обработка является особенно подходящей для соединений, несущих одну или несколько электроноакцепторных групп на фенильном кольце. Схема 4 Стратегия 4 построения трициклического остова На схеме 5 показана сборка трициклического остова изобретения, начиная с соответствующего пирролидиненамина 2-инданонов или 2-тетралонов и акриламида; R2, R3, R4 и m имеют значения, которые определены здесь выше или ниже. Требуемую трициклическую структуру в виде дигидропиридинона получали путем нагревания двух партнеров реакции при температуре от 60 до 150 С. Восстановление двойной связи водородом в присутствии переходного металла, такого как палладий на угле, или источником гидрида, таким как триалкилсилан, например триэтилсилан, борогидрид, например NaBH4,NaBH(О 2 ССН 3)3 или NaH3BCN, или аланатом, например LiAlH4, необязательно, в присутствии добавки,такой как кислота Льюиса, например уксусной кислоты, трифторуксусной кислоты, AlCl3 или BF3OEt2,обеспечило получение трициклического пиперидинона. Предпочтительно возможное восстановление амида выполнять с помощью источника гидрида, например NaBH4, в комбинации с уксусной кислотой в 1,4-диоксане, LiAlH4 в тетрагидрофуране или эфире, или дигидро-бис(2-метоксиэтокси)алюмината натрия в этиленгликолевом диметиловом эфире при температуре от 0 до 100 С. Схема 5 Стратегия 5 построения трициклического остова Другой общеприменимый подход к получению основных структур соединений изобретения основан на реакции электрофильного ароматического замещения (схема 6); R2, R3, R4 и m имеют указанные выше или ниже значения. Соответственно, ароматическая часть молекулы реагирует с положительно заряженным атомом углерода пиперидинового кольца с образованием трициклического остова. Реакционноспособное промежуточное соединение, несущее положительно заряженный атом углерода в азацикле, можно получить путем добавления кислоты Льюиса к олефиновой связи или карбонильной группе или активацией соответствующим образом расположенной уходящей группы, такой как Cl, Br, I, ОН,O3SCF3, O3SMe или O3S-p-Tol. Для этой классической реакции описано большое количество кислот Льюиса, которые здесь могут использоваться. Наиболее широко используемыми являются бромистоводородная кислота, иодисто-водородная кислота, соляная кислота, серная кислота, фосфорная кислота,Р 4 О 10, трифторуксусная кислота, метансульфоновая кислота, толуолсульфоновая кислота, трифторметансульфоновая кислота, Sc(O3SCF3)3, InCl3, InBr3, SnCl4, FeCl3, AlBr3, AlCl3, SbCl5, BCl3, BF3, ZnCl2, монтмориллониты, POCl3 и PCl5. В зависимости от отклонения подлежащей замещению уходящей группы и электронной природы ароматического кольца, используются более или менее сильные кислотные катализаторы. Помимо упомянутых кислотных катализаторов соли серебра, например AgO3SCF3, могут быть эффективными в реакциях с использованием галогенидов в качестве уходящих групп. Предпочтительными растворителями являются углеводороды, такие как гексан или циклогексан, хлорированные углеводороды, такие как дихлорметан или 1,2-дихлорметан, перфторированные углеводороды, нитробензол,ацетонитрил, хлорированные бензолы, гетероароматические соединения, такие как хинолин, 1,2 диметоксиэтан, 1,4-диоксан, эфир, ионные липиды, вода, уксусная кислота или их смеси, несмотря на то,что не все из этих растворителей могут быть использованы с перечисленными выше кислотами Льюиса. Реакции проводили при температуре от -10 до 220 С, предпочтительно от 20 до 180 С. Реакции можно также проводить в условиях микроволнового излучения. Схема 6 Стратегия построения трициклического остова Представленный путь синтеза основан на использовании защитных групп. Подходящие защитные группы для соответствующих функциональных групп и их удаление описаны здесь далее и могут использоваться аналогично (см. также: Protecting Groups, Philip J. Kocienski, 3rd edition, Georg ThiemeVerlag, Stuttgart, 2004 и указанные в нем ссылки). В дальнейшем предложено несколько подходящих способов получения производных соединений общей формулы I или их предшественников, полученных, как описано выше, несущих конкретные функциональные группы для сборки других соединений общей формулы I или их предшественников. Эта подборка не является полной, но лишь предлагает некоторые возможности с помощью примера. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит амино-, алкиламино- или иминогруппу, то путем ацилирования или сульфонилирования его можно перевести в соответствующее ацильное или сульфонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит гидроксильную группу, то путем ацилирования или сульфонилирования его можно перевести в соответствующее ацильное или сульфонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит гидроксильную группу, то путем алкилирования его можно перевести в соответствующий эфир общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит амино-, алкиламино- или иминогруппу, то путем алкилирования или восстановительного алкилирования его можно перевести в соответствующее алкильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит нитрогруппу, то путем восстановления его можно перевести в соответствующее аминосоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит иминогруппу, то путем нитрозирования и последующего восстановления его можно перевести в соответствующее N-аминоиминосоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит C1-4-алкилоксикарбонильную группу, то путем расщепления эфира его можно перевести в соответствующее карбоксисоединение. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоксильную группу, то путем этерификации его можно перевести в соответствующий сложный эфир общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоксильную или сложноэфирную группу, то путем реакции с амином его можно перевести в соответствующий амид общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит ароматическую подструктуру, то путем реакции электрофильного замещения его можно дериватизировать с помощью атома хлора, брома или иода, или группы нитро, сульфоновой кислоты, хлорсульфонильной или ацильной группы в соответствующее соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминогруппу, присоединенную к ароматической или гетероароматической группе, то его можно перевести в соответствующее пиано-, фтор-, хлор-, бром-, иод-, гидрокси-, меркапто- или азидодериватизированное соединение общей формулы I и его предшественник путем диазотирования и последующей замены диазогруппы на цианид, фторид, хлорид, бромид, иодид, гидроксид, алкил или сероводород или азид соответственно. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминогруппу, присоединенную к ароматической или гетероароматической группе, то его можно перевести в соответствующее арил-дериватизированное ароматическое соединение общей формулы I или его предшественник путем диазотирования аминогруппы и последующей замены полученной диазогруппы на соответствующий арильный нуклеофил, опосредованной подходящим переходным металлом. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода, или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, его можно перевести в соответствующее арил-, алкенил-, алкинил- или алкилдериватизированное соединение общей формулы I или его предшественник путем замены соответствующей группы на арил, алкенил,алкинил или алкил, опосредованной переходным металлом. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, то можно произвести замену на циано для получения соответствующего ароматического соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит атом хлора, брома или иода или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппу, которая присоединена к ароматической или гетероароматической группе, то можно произвести замену на водород для получения соответствующего ароматического соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит два гетероатома у смежных атомов углерода, которыми являются амино и гидрокси, амино или меркапто, то эти гетероатомы могут быть связаны через посредство углеродного атома карбокси для формирования подструктуры циклического амидина, иминового эфира или иминотиоэфира, которая может являться частью ароматического кольца. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то его можно перевести путем восстановления в аминоалкилдериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то ее можно перевести в N-гидроксикарбамимидоильную группу путем обработки гидроксиламином. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит N-гидроксикарбамимидоильную группу, то его можно перевести в оксадиазолдериватизированное соединение общей формулы I или его предшественник путем обработки карбоксильной или родственной группой. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит аминокарбонильную группу, то его можно перевести путем дегидрирования в соответствующее цианосоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести путем восстановления в соответствующее гидроксильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит карбоновую кислоту или аминокарбонильную группу, то его можно перевести путем реакции перегруппировки в соответствующее аминодериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести в алкенилдериватизированное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшест- 12022323 венник, которое содержит олефиновую двойную С=С или тройную СС связь, то его можно восстановить для получения соответствующего насыщенного соединения общей формулы I или его предшественника. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит кето- или альдегидную группу, то его можно перевести в соответствующее третичное или вторичное гидроксильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит группу эфира карбоновой кислоты, то его можно перевести в третичный спирт путем добавления двух эквивалентов органометаллического соединения. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит первичную или вторичную гидроксигруппу, то его можно перевести путем оксисления в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести в соответствующее гидроксильное соединение общей формулы I или его предшественник путем гидроборирования с последующим окислением. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем дигидроксилирования в соответствующее 1,2-дигидроксисоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем озонолиза в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести в соответствующее гидроксильное соединение общей формулы I или его предшественник путем эпоксидирования с последующим раскрытием оксиранового кольца с помощью источника гидрида. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем Вакер-окисления в соответствующее карбонильное соединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит олефиновую связь, то его можно перевести путем гидроцианирования в соответствующее цианосоединение общей формулы I или его предшественник. Если в способе согласно изобретению получено соединение общей формулы I или его предшественник, которое содержит цианогруппу, то его можно перевести путем добавления воды в соответствующее аминокарбонильное соединение общей формулы I или его предшественник. Последующая этерификация необязательно проводится в растворителе, таком как метиленхлорид,N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4-диоксан или их смеси, или особенно предпочтительно в соответствующем спирте, необязательно, в присутствии кислоты, например соляной кислоты, или обезвоживающего агента, например изобутилового эфира хлормуравьиной кислоты, тионилхлорида, триметилхлорсилана, серной кислоты, метансульфокислоты, п-толуолсульфоновой кислоты, трихлорида фосфора, пентоксида фосфора, N,N'-карбонилимидазола, N,N'-дициклогексилкарбодиимида, трифенилфосфина/четыреххлористого углерода, или их комбинаций, необязательно, в присутствии 4-диметиламинопиридина и/или 1-гидроксибензотриазола. Реакции проводят при температуре от 0 до 150 С, предпочтительно от 0 до 80 С. Сложный эфир может быть получен при взаимодействии соединения, содержащего карбоксигруппу, с соответствующим алкилгалогенидом в присутствии основания. Последующее ацилирование или сульфонилирование необязательно проводят в растворителе, таком как метиленхлорид, N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4 диоксан или их смеси, с помощью соответствующего ацильного или сульфонильного электрофила, необязательно, в присутствии третичного органического основания, неорганического основания или обезвоживающего агента. Как правило, используемыми обезвоживающими агентами являются, например,изобутиловый эфир хлорформуравьиной кислоты, тионилхлорид, триметилхлорсилан, серная кислота,метансульфоновая кислота, п-толуолсульфоновая кислота, трихлорид фосфора, пентоксид фосфора,N,N'-дициклогексилкарбодиимид, N,N'-карбонилдиимидазол, трифенилфосфина/четыреххлористого углерода или их комбинации, которые могут использоваться в присутствии 4-диметиламинопиридина и/или 1-гидроксибензотриазола при температуре от 0 до 150 С, предпочтительно от 0 до 80 С. Последующее алкилирование необязательно проводят в метиленхлориде, N,N-диметилформамиде,бензоле, толуоле, хлорбензоле, тетрагидрофуране, 1,4-диоксане или их смесях с помощью алкилирующего средства, такого как соответствующий галогенид или сложный эфир сульфоновой кислоты, например,с помощью метилиодида, этилбромида, диметилсульфата или бензилхлорида, необязательно, в присутствии третичного органического основания или неорганического основания при температуре от 0 до 150 С,предпочтительно от 0 до 100 С. Последующее восстановительное алкилирование проводят с помощью соответствующего карбонильного соединения, такого как формальдегид, ацетальдегид, пропионовый альдегид, ацетон или бутиральдегид, в присутствии комплексного гидрида металла, такого как борогидрид натрия, борогидрид лития, триацетоксиборогидрид натрия или цианоборогидрид натрия, целесообразнее при значении рН от 6 до 7 и при комнатной температуре, или в присутствии катализатора гидрирования, например, с помощью водорода в присутствии палладия-на-угле, при давлении водорода от 1 до 5 бар. Метилирование можно также проводить в присутствии муравьиной кислоты в качестве восстановителя при повышенных температурах, например от 60 до 120 С. Последующее восстановление нитрогруппы проводят, например, с помощью водорода и катализатора, такого как палладий-на-угле, диоксид платины или никель-Ренея, или с использованием других восстанавливающих агентов, таких как хлорид олова(II), железа или цинка, необязательно в присутствии кислоты, такой как уксусная кислота. Последующее нитрозирование аминогруппы с последующим восстановлением для получения Nаминоиминосоединения проводят, например, с помощью алкилнитрита, такого как изоамилнитрит, с образованием N-нитрозоиминосоединения, которое затем восстанавливают до N-аминоиминосоединения с использованием, например, цинка в присутствии кислоты, такой как уксусная кислота. Последующее отщепление C1-4-алкилоксикарбонильной группы для получения карбоксигруппы проводят, например, путем гидролиза с помощью кислоты, такой как соляная кислота или серная кислота, или гидроксида щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия. трет-Бутильная группа предпочтительно удаляется путем обработки сильной кислотой, например трифторуксусной кислотой или соляной кислотой, в инертном растворителе, таком как дихлорметан, 1,4 диоксан или этилацетат. Последующее амидирование проводят путем взаимодействия соответствующего реакционноспособного производного карбоновой кислоты с соответствующим амином в растворителе, таком как метиленхлорид, N,N-диметилформамид, бензол, толуол, хлорбензол, тетрагидрофуран, 1,4-диоксан или их смесях, или без растворителя в избыточном амине, необязательно, в присутствии неорганического либо третичного органического основания, 4-диметиламинопиридина и/или 1-гидроксибензотриазола при температуре от 0 до 150 С, предпочтительно от 0 до 80 С. Использование карбоновой кислоты может привести к образованию требуемого амида путем in situ активации функциональной карбоксигруппы,например, с помощью изобутилового эфира хлормуравьиной кислоты, тионилхлорида, оксалилхлорида,триметилхлорсилана, трихлорида фосфора, пентоксида фосфора, N,N'-карбонилдиимидазола, смеси трифенилфосфина с тетрахлоридом углерода, 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторбората, N,N'-дициклогексилкарбодиимида или их комбинации. Последующее введение атома хлора, брома или иода в ароматическую подструктуру проводят с помощью реакции ароматического соединения с соответствующим электрофилом соответствующего атома галогена. Подходящими хлорсодержащими или бромсодержащими электрофилами могут являться,например, N-галосукцинимид, HOCl, HOBr, трет-BuOCl, трет-BuOBr, хлор, бром, дибромизоциануровая кислота, дихлорбромат пиридиния, трибромид пиридиния или хлористый сульфурил, которые могут использоваться отдельно или в комбинации с кислотой, например соляной кислотой, бромисто-водородной кислотой, тетрафторборной кислотой, трифликовой кислотой, серной кислотой или уксусной кислотой или кислотой Льюиса, например галогенидом железа(III), гидратом трехфтористого бора, эфиратом трифтористого бора или галогенидом алюминия. Другими эффективными комбинациями могут быть LiBr и цериевый нитрат аммония, KCl или KBr с Oxone, или KBr и перборат натрия. Подходящие иодсодержащие электрофилы могут быть получены из иода и окислителя, такого как азотная кислота, серный ангидрид, двуокись марганца, HIO3, перекись водорода, периодат натрия, пероксидисульфаты и Oxone. Другим подходящими иодсодержащими электрофилами могут являться, например, хлорид иода, дихлориодаты и N-иодосукцинимид. Эти иодсодержащие электрофилы могут необязательно использоваться без добавок или в присутствии кислоты, такой как уксусная кислота, трифторуксусная кислота или серная кислота или кислота Льюиса, такая как гидрат трифторида бора или соли меди. Если введению подлежит нитрогруппа, то соответствующими источниками азотсодержащего электрофила могут быть, например, азотная кислота, ацетилнитрат, цериевый нитрат аммония, нитрат натрия, N2O5, алкилнитрат и тетрафторборат нитрония. Некоторые из этих реагентов могут использоваться без добавок, несмотря на то, что некоторые из них предпочтительнее использовать в комбинации с кислотой, например серной кислотой или трифликовой кислотой, уксусным ангидридом, трифторуксусным ангидридом, кислотой Льюиса, например трифлатом иттербия или ацетатом железа, Р 2 О 5, или основанием. SO3H-rpynna может быть введена путем взаимодействия ароматического соединения, например, с концентрированной серной кислотой, SO3, ClSO3H или ClSO2NMe2 в комбинации с трифлатом индия. Взаимодействие ароматического соединения с ClSO3H позволяет получить соответствующее хлорсульфонилированное производное, которое может быть гидролизовано до сульфоновой кислоты. Ацилирование ароматической части выполняется с использованием ацилсодержащего электрофила, который можно получить из соответствующего ацилгалогенида, например хлорида, или ацилангидрида и кислоты Льюиса, такой как галогенид алюминия, галогенид диэтилалюминия, галогенид индия, галогенид железа(III), галогенид олова(IV),трифторид бора, галогенид титана(IV), или кислоты Бронстеда, например серной кислоты или трифликовой кислоты. Формильная группа предпочтительно вводится с использованием так называемых условий по Вильсмайеру и Вильсмайеру-Хааку: диалкилформамида в сочетании с фосгеном, тионилхлоридом,POCl3 или оксалилхлоридом. Предпочтительные растворители для описанных электрофильных заместителей могут различаться в зависимости от используемого электрофила; некоторыми наиболее часто используемыми являются метиленхлорид, 1,2-дихлорэтан, хлорбензол, дихлорбензол, эфир, 1,4-диоксан,фторированные углеводороды, гексаны, хинолин и ацетонитрил. Предпочтительно использовать температурный интервал от 0 до 180 С. Последующую замену аминогруппы, которая присоединена к ароматической или гетероароматической группе, инициируют диазотированием аминогруппы с помощью азотистой кислоты или источника нитрозония или эквивалента, такого как соль азотистой кислоты, объединенного с кислотой, например нитрита натрия с соляной кислотой, тетрафторбората нитрозония или алкилнитрита, например третбутилнитрита или изоамилнитрита. Диазотирование необязательно проводят в метиленхлориде, 1,2 дихлорэтане, N,N-диметилформамиде, N-метилпирролидиноне, бензоле, толуоле, хлорбензоле, тетрагидрофуране, воде, этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от -10 и 100 С (диазотирование аминогрупп подробно описано, например, в Angew. Chem. Int. Ed. 1976, 15, 251). Последующая замена диазогруппы цианогруппой, атомом хлора или брома с использованием цианида меди, хлорида или бромида, соответственно, известна как реакция Зандмейера (см., например, March's Advanced Organic Chemistry, Michael В. Smith and Jerry March, John WileySons Inc., 6.Ed., New Jersey, 2007 и ссылки, размещенные в них); реакцию необязательно проводят при температуре от -10 до 120 С в одном из растворителей или смесях, упомянутых выше. Замену диазогруппы атомом фтора можно осуществить с помощью тетрафторборатной соли или тетрафторборной кислоты и нагревания от 20 до 160 С; реакция известна как реакция Шиеманна. Иод можно ввести путем обработки диазосоединения иодидом, например иодидом натрия, предпочтительно с использованием воды или водной смеси растворителей при температуре от 0 до 120 С. Диазогруппу заменяют гидрокси с помощью воды или водной смеси растворителей при температуре от 0 до 180 С. Реакцию обычно проводят без использования дополнительных добавок, но предпочтительным является добавление оксида меди или сильной кислоты. Меркапто или алкилмеркапто можно ввести с помощью их соответствующих дисульфидных солей или диалкилдисульфидов при температуре от 0 до 120 С; в зависимости от используемых серосодержащих веществ предпочтительным может быть инертный растворитель или водная система растворителя (см., например, Synth. Commun. 2001, 31, 1857 и ссылки, размещенные в них). Последующую замену аминогруппы, присоединенной к ароматической или гетероароматической группе с помощью арильной группы, можно выполнить с помощью соответствующего диазосоединения,которое можно получить, как описано выше. Реакцию с арильным нуклеофилом, предпочтительно арилборной кислотой, эфиром борной кислоты, трифторборатом, галогенидом цинка или станнаном, проводят в присутствии соединений, содержащих переходный металл на основе палладия, никеля, родия, меди или железа, предпочтительно палладия. Активным катализатором может являться комплекс переходного металла с лигандами, такими как, например, фосфины, фосфиты, карбены имидазола, карбены имидазолидина, дибензилиденацетон, аллил или нитрилы, элементная форма переходного металла, такая как палладий-на-угле или наночастицы, или соли, такие как хлорид, бромид, ацетат или трифторацетат. Диазосоединение предпочтительно использовать в виде его тетрафторборатной соли, необязательно, в воде,N-метилпирролидиноне, N,N-диметилформамиде, метиленхлориде, бензоле, толуоле, тетрагидрофуране,этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 10 до 180 С, предпочтительно от 20 до 140 С. Последующая замена атома хлора, брома или иода или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью арильного, алкенильного, алкинильного или алкильного остатка, предпочтительно опосредована соединениями переходного металла на основе палладия, никеля, меди или железа. Активным катализатором может являться комплекс переходного металла с лигандами, такими как фосфины, например тритрет-бутилфосфин, трициклогексилфосфин, 2-(субзамещенный фенил)фенилдициклогексилфосфины, 2(субзамещенный фенил)фенил-ди-трет-бутилфосфины, 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, тритолилфосфин или трифурилфосфин, фосфиты, 1,3-дизамещенные карбены имидазола, 1,3 дизамещенные карбены имидазолидина, дибензилиденацетон, аллил или нитрилы, элементная форма переходного металла, такая как палладий-на-угле или наночастицы железа или палладия, или соль, такая как фторид, хлорид, бромид, ацетат, трифлат или трифторацетат. Реакцию замены предпочтительно проводить с помощью трифторбората, борной кислоты или эфира борной кислоты (реакция Сузуки или реакция типа Сузуки), галогенида цинка (реакция Негиши или реакция типа Негиши), станнана (реакция Стилле или реакция типа Стилле), силана (реакция Хияма или реакция типа Хияма), галогенида магния(реакция Кумада или реакция типа Кумады) арильного, алкенильного или алкильного остатка, подлежащего введению. Предпочтительно использовать концевой алкин как таковой или в виде его цинкацетиленидного производного. В зависимости от природы электрофильных и нуклеофильных участников ре- 15022323 акции предпочтительными или даже основными могут быть добавки, такие как галогениды, например хлорид лития, фторид калия, тетрабутиламмония фторид, источники гидроксида, такие как гидроксид калия или карбонат калия, соли серебра, такие как оксид серебра или трифлат, и/или соли меди, такие как хлорид меди или тиофен-2-карбоксилат меди. Иодид меди является предпочтительной добавкой в связывании с концевыми алкинами (реакция Соногашира). Реакцию связывания предпочтительно проводить в бензоле, толуоле, эфире, тетрагидрофуране, 1,2-диметоксиэтане, 1,4-диоксане, N,Nдиметилформамиде, N,N-диметилацетамиде, N-метилпирролидиноне, спирте, воде или их смесях, несмотря на то, что в зависимости от нуклеофила некоторые из них являются менее подходящими или неподходящими. Предпочтительные температуры изменяются от -10 до 180 С. Последующую замену атома хлора, брома или иода или мезилокси-, трифторметилсульфонилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью цианогруппы, предпочтительно проводить с помощью опосредованного переходным металлом процесса. Медь, никель и палладий являются наиболее часто используемыми металлами для этого превращения и используются в качестве элементов, солей или комплексов в сочетании с источником цианида. Иодид меди, сульфат меди, цианид меди, хлорид никеля, бромид никеля, цианид никеля,бис(трифенилфосфин)никеля дихлорид,палладий-на-угле,тетракис(трифенилфосфин)палладий,трис(дибензилиденацетон)дипалладий, ацетат палладия, трифторацетат палладия, хлорид палладия, цианид палладия, необязательно объединенные с лигандом, таким как трициклогексилфосфин, три-третбутилфосфин, трифенилфосфин, 1,1-бис(дифенилфосфино)ферроцен, диадамантил-н-бутилфосфин илиXantphos, входят в число обычно используемых катализаторов. Обычно используемыми источниками цианида являются цианид натрия, цианид калия, цианид цинка, цианид меди, цианид никеля, гексацианоферрат калия и цианогидрин ацетона. Реакции предпочтительно проводить в N,N-диметилформамиде,N,N-диметилацетамиде, N-метилпирролидиноне, диметилсульфоксиде, пиридине, ацетонитриле, хинолине, толуоле, тетрагидрофуране, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 20 до 280 С, предпочтительно от 60 до 200 С. Для некоторых условий реакции могут быть предпочтительными такие добавки, как цинк, карбонат натрия, иодид калия, вода и пиридин, и/или использование микроволнового излучения. Последующая замена атома хлора, брома или иода или трифторметилсульфонилокси-, мезилоксиили тозилоксигруппы, которая присоединена к ароматической или гетероароматической группе с помощью атома водорода, предпочтительно опосредована соединениями переходного металла на основе палладия, никеля, платины или родия. Активным катализатором может являться комплекс переходного металла с лигандами, элементная форма или соль переходного металла, как указано выше. Никель Ренея или палладий-на-угле входят в число предпочтительных катализаторов. Подходящими источниками водорода могут быть водород, предпочтительно при давлении от 1 до 10 бар, силаны, например триалкоксисилан или полиметилгидросилоксан, бораны, гидриды, например борогидрид щелочного металла, муравьиная кислота или формиаты, например формиат аммония. Реакции предпочтительно проводят в N,Nдиметилформамиде, N,N-диметилацетамиде, N-метилпирролидиноне, бензоле, толуоле, тетрагидрофуране, воде, этилацетате, спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от-10 до 180 С, более предпочтительно от 20 до 140 С. Последующую циклизацию, начиная с соединения, несущего два гетероатома при смежных атомах углерода, необязательно, выполняют с эквивалентом карбокси, таким как нитрил, хлорид или фторид карбоновой кислоты, карбоновая кислота, кетен, эфир карбоновой кислоты или тиоэфир карбоновой кислоты. Весь процесс превращения предусматривает две стадии реакции: присоединение эквивалента карбокси к одному из двух гетероатомов с последующей циклизацией с другим гетероатомом. На первой стадии происходит образование амида с функциональной аминогруппой, как описано здесь выше. Следующую стадию реакции, которая предусматривает циклизацию со вторым гетероатомом, можно осуществить путем нагревания в присутствии кислоты, например уксусной кислоты, трифторуксусной кислоты, серной кислоты или соляной кислоты, или основания, например гидроксида натрия, этоксида натрия или трет-бутоксида натрия. Может быть предпочтительным использование обезвоживающих агентов,таких как ангидриды, например уксусный ангидрид, ортоэфиры, например триметилортоформиат, тионилхлорид, фосген, дифосген, трифосфген, оксихлорид фосфора, пентахлорид фосфора, диалкилкарбодиимиды, комбинаций с фосфинами, например трифенилфосфин или триалкилфосфин с диалкилазодикарбоксилатами, бромом, иодом или 1,2-дигалоэтанами, например 1,2-дибромтетрафторэтаном. Реакции предпочтительно проводить в инертных растворителях или смесях, таких как метиленхлорид, 1,2 дихлорэтан, бензол, толуол, тетрагидрофуран, эфир или их комбинации, несмотря на то, что циклизация в присутствии кислоты или основания может также выполняться в воде или спирте, например метаноле,этаноле, изопропаноле или трет-бутаноле, или в комбинациях с этими растворителями. Реакции проводят при температуре от 0 до 200 С, предпочтительно от 20 до 140 С. Последующее восстановление цианогруппы для получения аминометильной группы предпочтительно проводить с помощью водорода в присутствии соединений переходного металла или с помощью гидрида. Подходящие переходные металлы могут быть на основе палладия, никеля, платины, родия или рутения, такие как палладий-на-угле, гидроксид палладия, оксид платины или никель-Ренея, которые можно использовать в растворителях, таких как этилацетат, спирты, например метанол или этанол, дихлорметан, тетрагидрофуран, эфир, бензол, толуол, N,N-диметилформамид или N-метилпирролидинон,при давлении водорода от 1 до 10 бар и при температуре от 0 до 160 С. Добавки, такие как кислоты, например соляная кислота, метансульфоновая кислота, серная кислота и уксусная кислота, могут быть предпочтительными для восстановления с помощью катализаторов на основе переходных металлов. В число предпочтительных источников гидрида входят, например, борогидриды, например борогидрид натрия, три-сек-бутилборогидрид калия, боран или триэтилборогидрид лития, и аланаты, например литий-алюминий гидрид или диизобутилалюминия гидрид. Некоторые из этих реагентов лучше всего использовать в сочетании с хлоридом никеля или хлоридом кобальта, таким как борогидрид натрия. Эти реагенты можно применять, например, в тетрагидрофуране, эфире, 1,4-диоксане, 1,2-диметоксиэтане,дихлорметане, 1,2-дихлорэтане, бензоле или толуоле; некоторые также совместимы со спиртовыми или водными растворами. Предпочтительные температуры реакций изменяются в интервале от -80 до 160 С,более предпочтительно от -40 до 80 С. Последующее образование N-гидроксикарбамимидоильной группы из цианогруппы можно осуществить путем обработки цианосоединения гидроксиламином. Реакцию предпочтительно проводить в водных или спиртовых растворителях при температуре от 0 до 140 С. Последующее образование оксадиазола из N-гидроксикарбамимидоила проводится с эквивалентом карбокси, таким как нитрил, хлорид или фторид карбоновой кислоты, карбоновая кислота, кетен, эфир карбоновой кислоты или тиоэфир карбоновой кислоты. Превращение относится к формированию кольца,начиная с двух гетероатомов при смежных атомах углерода, описанных выше, и может проводиться аналогично. Последующее образование цианогруппы из аминокарбонильной группы предпочтительно проводить с использованием дегидратирующего агента, такого как ангидрид, например уксусный ангидрид,трифторуксусный ангидрид или трифликовый ангидрид, фосген, тионилхлорид, оксалилхлорид, POCl3,PCl5, Р 4 О 10, трифенилфосфит или трифенил- или триалкилфосфин в комбинации с тетрахлорметаном,1,2-дибромтетрафторэтаном или бромом. Реакции предпочтительно проводят в дихлорметане, 1,2 дихлорэтане, гексанах, эфире, 1,4-диоксане, бензоле, толуоле, ацетонитриле, их смесях или без растворителя при температуре от 0 до 140 С. Предпочтительными могут быть добавки, такие как амины, например пиридин или триэтиламин или N,N-диметилформамид. Последующее восстановление кето- или альдегидной группы для получения вторичного или первичного спирта можно осуществить с помощью комплексного гидрида металла, такого как борогидрид натрия, борогидрид лития, триэтилборогидрид лития, гидрид диизобутилалюминия или литий-алюминий гидрид. Восстановления можно проводить, например, в дихлорметане, 1,2-дихлорэтане, гексанах, эфире,1,4-диоксане, тетрагидрофуране, N,N-диметилформамиде, N-метилпирролидоне, бензоле, толуоле, спиртах, например метаноле, воде или их смесях, при этом не все агенты восстановления совместимы со всеми этими растворителями. Предпочтительные температуры изменяются от -80 до 140 С в зависимости от восстанавливающей активности реагента. Или же для восстановления можно использовать водород в присутствии катализатора на основе переходного металла. Последующее превращение карбоксигруппы в аминогруппу путем перегруппировки можно осуществить путем нагревания ацилазида с образованием изоцианата (перегруппировка Курциуса). Изоцианат можно гидролизовать до свободного амина или перевести в производное мочевины или карбамата обработкой амином или спиртом соответственно. Ацилазид можно получить обработкой соотвествующего ацилсодержащего электрофила, например ацилхлорида, ангидрида карбоновой кислоты или эфира карбоновой кислоты, источником азида, таким как, например, азид натрия или азид триметилсилила, в растворителе, таком как 1,4-диоксан, 1,2-диметоксиэтан, ацетонитрил, тетрагидрофуран, дихлорметан, 1,2 дихлорэтан, N-метилпирролидинон, N,N-диметилформамид, толуол, бензол, гексаны или их смеси; кроме того, в некоторых случаях можно использовать воду или спирты. Реакции обычно проводят при температуре от -10 до 120 С. Или же ацилсодержащий электрофил можно получить in situ из кислоты и затем перевести в ацилазид: дифенилфосфорилазид в присутствии основания, например триэтиламина или этилдиизопропиламина, в растворителе, таком как ацетонитрил, бензол, толуол или спирт, при повышенной температуре доказал свою эффективность в качестве реагента для этого прямого превращения. Прямое превращение может быть достигнуто с помощью гидразоевой кислоты и кислотного катализатора, такого как серная кислота, например, в хлороформе, при повышенных температурах (реакция Шмидта). Другим способом осуществления полного превращения является перегруппировка Лоссена: начиная с ацилсодержащего электрофила, такого как ацилхлорид, получено соответствующее подходящее производное гидроксаминовой кислоты, которое, в свою очередь, перегруппируется с получением изоцианата и затем амина путем нагревания и/или обработки основанием, например гидроксидом натрия(см., например, J. Org. Chem. 1997, 62, 3858 and Synthesis 1990, 1143 и размещенные там ссылки). Незамещенный амид карбоновой кислоты может быть превращен в амин путем так называемой перегруппировки Хоффмана. В число подходящих реагентов для этого превращения входят NaOBr, бром,объединенный с метоксидом натрия, N-бромсукцинимид и метоксид натрия, PhI(O2CCF3)2 и PhI(OH)OTs(Ts представляет собой 4-толилсульфонил). Последующее превращение альдегидной или кето-функциональности в олефин может быть выполнено, например, с помощью так называемой реакции Виттига и ее модификаций, олефинирования по Петерсону и реакции Жюлия и их модификаций. Эти реакции широко используются в органическом синтезе и подробно описаны, например, в March's Advanced Organic Chemistry, Michael В. Smith и JerryMarch, John WileySons Inc., 6. Ed., New Jersey, 2007 и размещенных в них ссылках. Последующее восстановление С=С двойной или СС тройной связи предпочтительно осуществлять с помощью водорода в присутствии соединений переходного металла на основе палладия, никеля, платины, рутения или родия, предпочтительно никеля-Ренея, палладия-на-угле, оксида платины иRhCl(PPh)3. Реакции предпочтительно проводят в метиленхлориде, N,N-диметилформамиде, N,Nдиметилацетамиде, N-метилпирролидиноне, бензоле, толуоле, тетрагидрофуране, воде, этилацетате,спирте, эфире, 1,2-диметоксиэтане, 1,4-диоксане или их смесях при температуре от 0 до 180 С, более предпочтительно от 20 до 140 С, и давлении водорода от 1 до 10 бар, предпочтительно от 1 до 5 бар. Последующее превращение альдегида или кетона во вторичный или третичный спирт предпочтительно осуществлять путем добавления углеродсодержащего нуклеофила, например алкила, аллила, алкенила, арила или алкинила лития, магния или соединения церия в тетрагидрофуране, эфире, 1,4 диоксане, 1,2-диметоксиэтане, толуоле, гексанах или их смесях при температуре от -80 до 80 С. Последующее превращение сложного эфира карбоновой кислоты в третичную гидроксигруппу предпочтительно осуществлять с помощью двух или более эквивалентов углеродсодержащего нуклеофила, например алкила, аллила, алкенила, арила или алкинила лития, магния или соединения церия в тетрагидрофуране, эфире, 1,4-диоксане, 1,2-диметоксиэтане, толуоле, гексанах или их смесях при температуре от -80 до 80 С. Последующее окисление первичного или вторичного гидроксисоединения можно осуществить с помощью окислителя, такого как диметилсульфоксид, в комбинации, например, с оксалилхлоридом, уксусным ангидридом, SO3 пиридином или дициклогексилкарбодиимидом, хлорхроматом пиридиния(РСС), дихроматом пиридиния (PDC), периодинаном Десса-Мартина, двуокисью марганца, 2,2,6,6 тетраметилпиперидин-N-оксидом (TEMPO), необязательно в комбинации с соокислителем, или тетрапропиламмония перрутенатом (ТРАР) в комбинации с соокислителем, таким как N-метилморфолин-Nоксид, который необязательно используются в присутствии основания, например триэтиламина, предпочтительно в толуоле, дихлорметане или 1,2-дихлорэтане, при температуре от -70 до 60 С. Или же превращение можно выполнить как окисление по Оппенауэру, например, с помощью Al(OtBu)3 и ацетона. Последующее гидроборирование и окисление олефиновой связи проводят с помощью борана, например боранового комплекса с тетрагидрофураном, триметиламином или диметилсульфидом, диэтилбораном, тексилбораном, 9-борабицикло[3.3.1]нонаном, NaBH4 в комбинации с BF3 или TiCl4 или дихлорбораном, предпочтительно в тетрагидрофуране при температуре от -20 до 60 С. Продукт гидроборирования последовательно обрабатывают, например, пероксидом водорода и гидроксидом натрия в водном растворе для замены группы бора в промежуточном соединении на гидрокси. Последующее дигидроксилирование олефиновой связи предпочтительно проводят с помощью тетроксида осмия или осмата калия в комбинации с соокислителем, например N-метилморфолин-N-оксидом или K3Fe(CN)6, предпочтительно в воде в комбинации с трет-BuOH, тетрагидрофуране и/или 1,4 диоксане при температуре от -20 до 60 С. Последующее расщепление олефиновой связи путем озонолиза проводят с помощью озона предпочтительно в дихлорметане при температуре от -50 до -78 С. Промежуточное соединение, полученное таким способом, может быть превращено в карбонильное соединение путем обработки, например, диметилсульфидом, цинком в сочетании с уксусной кислотой, водородом в присутствии палладия или трифенилфосфином. Обработка промежуточного соединения борогидридом натрия или литий-алюминий гидридом позволила получить соответствующее гидроксисоединение. Последующее эпоксидирование олефиновой связи предпочтительно осуществлять с помощью метахлорпербензойной кислоты (mCPBA), пероксида водорода в комбинации с муравьиной кислотой или уксусной кислотой, или Oxone в комбинации с ацетоном или 1,1,1-трифторацетоном предпочтительно в дихлорметане при температуре от -20 до 40 С. Оксирановое кольцо может быть раскрыто с помощью гидридного источника, такого как литий-алюминий гидрид или триэтилборогидрид лития, в инертном растворителе, например тетрагидрофуране, для получения гидроксисоединения. Последующее Вакер-окисление олефиновой связи предпочтительно осуществлять с помощью PdCl2 и CuCl или CuCl2 в присутствии кислорода в водном растворителе для получения соответствующего карбонильного соединения. Последующее гидроцианирование олефиновой связи можно осуществить с помощью 4 толилсульфонилцианида в присутствии фенилсилана и кобальтового катализатора (см., например,Angew. Chem. 2007,119, 4603-6). Последующее добавление формальной воды в цианогруппы можно произвести путем обработки водного раствора нитрила сильной кислотой, например серной кислотой или соляной кислотой, или ос- 18022323 нованием, например NaOH или KOH, необязательно, при повышенной температуре, предпочтительно от 0 до 140 С. Или же это превращение можно выполнить в водном растворе с помощью катализатора на основе переходного металла, такого как PdCl2. При проведении описанных выше реакций присутствующие при определенных условиях реакционноспособные группы, такие как гидрокси-, карбонильные, карбокси-, амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции защитными группами и вновь отщеплять их по завершению реакции. В качестве примера защитной группы для гидроксигруппы можно назвать триметилсилильную,трет-бутилдиметилсилильную, триизопропилсилильную, ацетильную, пивалоильную, бензоильную, метильную, трет-бутильную, аллильную, тритильную, бензильную, 4-метоксибензильную, тетрагидропиранильную, метоксиметильную, этоксиметильную или 2-триметилсилилэтоксиметильную группу; в качестве защитных групп для карбоксильной группы используют триметилсилильную, метильную, этильную, трет-бутильную, аллильную, бензильную или тетрагидропиранильную группу; в качестве примера защитной группы для кетоновой группы или альдегидной группы можно назвать кетальную или ацетальную, соответственно полученные, например, из метанола, этиленгликоля, пропан-1,3-диола или пропан-1,3-дитиола; в качестве примера защитной группы для амино-, алкиламино- или иминогруппы можно назвать метильную, формильную, ацетильную, трифторацетильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, бензильную, 4-метоксибензильную или 2,4-диметоксибензильную группу, и для аминогруппы дополнительно используют фталильную и тетрахлорфталильную группу; и в качестве примера защитной группы для концевого алкина можно назвать триметилсилильную,триизопропилсилильную, трет-бутилдиметилсилильную или 2-гидрокси-проп-2-ильную группу. Используемую ацильную защитную группу отщепляют, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде, уксусной кислоте/воде или 1,4-диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии основания щелочного металла, такого как гидроксид лития, гидроксид натрия или гидроксид калия, при температуре от 0 до 120 С, предпочтительно от 10 до 100 С. Отщепление можно осуществить апротонным путем, например, в присутствии йодтриметилсилана в дихлорметане или 1,2 дихлорэтане при температуре от -70 до 60 С. Трифторацетильную группу предпочтительно отщеплять обработкой кислотой, такой как соляная кислота, необязательно в присутствии растворителя, такого как уксусная кислота, при температуре от 50 до 120 С, либо обработкой едким натром, необязательно, в присутствии растворителя, такого как тетрагидрофуран или метанол, при температуре от 0 до 80 С. Используемую ацетальную или кетальную защитную группу отщепляют, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде, уксусной кислоте/воде, тетрагидрофуране/воде или 1,4-диоксане/воде, в присутствии кислоты, такой как уксусная кислота, трифторуксусная кислота, соляная кислота или серная кислота, при температуре от 0 до 120 С, предпочтительно от 10 до 100 С. Отщепление можно осуществить апротонным путем, например, в присутствии йодтриметилсилана в дихлорметане. Триметилсилильную группу отщепляют, например, в воде, водной смеси растворителей или спирте,таком как метанол или этанол, в присутствии основания, такого как гидроксид лития, гидроксид натрия,карбонат калия или метоксид натрия. Также могут использоваться кислоты, такие как, например, соляная кислота, трифторуксусная кислота или уксусная кислота. Отщепление обычно осуществляют при относительно низких температурах, например от -60 до 60 С. Силильные группы в отличие от триметилсилильных групп преимущественно отщепляют в присутствии кислоты, например трифторуксусной кислоты, соляной кислоты или серной кислоты, при температуре от 0 до 100 С. Особенно подходящий способ отщепления силильных групп основан на использовании фторидных солей, например тетрабутиламмонийфторида, фторида водорода или фторида калия, в органических растворителях, таких как, например,диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан, толуол, бензол, 1,2-дихлорэтан или дихлорметан, при температуре от -20 до 100 С. Бензильную, метоксибензильную или бензилоксикарбонильную группу предпочтительно отщеплять путем гидрогенолиза, в частности, под действием водорода в присутствии катализатора, такого как палладий-на-угле или гидроксид палладия, в приемлемом растворителе, таком как метанол, этанол, этилацетат, уксусная кислота или их смеси, необязательно, с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 100 С, предпочтительно от 20 до 60 С, и при давлении водорода от 1 до 10 бар, предпочтительно от 3 до 5 бар. Триметилсилилиодид, трихлорид бора или трифторид бора в присутствии поглотителя, такого как анизол, тиоанизол или пентаметилбензол, также можно использовать с производными бензилового эфира. Богатый электронами бензиловый остаток, такой как метоксибензил,также можно отщеплять в условиях окисления с помощью, например, 2,3-дихлор-5,6-дициано-1,4 бензохинона (DDQ) или церий-аммоний нитрата (CAN), предпочтительно в спиртовом или водном растворителе при температуре от 10 до 120 С. 2,4-Диметоксибензильную группу предпочтительно отщеплять в трифторуксусной кислоте в присутствии акцептора, такого как анизол. трет-Бутильную или трет-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота, серная кислота или соляная кислота, или обработкой йод- 19022323 триметилсиланом, необязательно, с использованием растворителя, такого как метиленхлорид, 1,4 диоксан, метанол, изопропанол, вода или диэтиловый эфир. Отщепление метильной группы от третичного амина можно осуществить обработкой 1-хлорэтилхлорформиатом или винилхлорформиатом. Бромисто-водородная кислота и трибромид бора являются особенно подходящими для отщепления метиловых эфиров. Соединения общей формулы I можно разделять на их энантиомеры и/или диастереомеры, как указано выше. Так, например, цис/транс-смеси можно разделять на их цис- и трет-изомеры, а рацемические соединения можно разделять на их энантиомеры. Цис/транс-смеси можно разделять, например, путем хроматографии на их цис- и трет-изомеры. Соединения общей формулы I, которые образуются в виде рацематов, можно разделять способами по известным методам (см. Allinger N.L. и Eliel Е.L. in "Topics in Stereochemistry", т. 6, изд-во Wiley Interscience, 1971) на их оптические антиподы, а диастереомерные смеси соединений общей формулы I можно разделять по известным методам на основании различий их физико-химических свойств, например,хроматографией и/или фракционированной кристаллизацией на их диастереомеры; если в результате образуются соединения в рацемической форме, то их можно разделять на энантиомеры, как описано выше. Разделение рацематов предпочтительно осуществлять путем колоночного разделения на хиральных фазах или путем перекристаллизации из оптически активного растворителя, или взаимодействием с оптически активным веществом, образующим с рацемическим соединением соли или производные, такие как сложные эфиры или амиды. Соли могут быть образованы с энантиомерно чистыми кислотами для основных соединений и с энантиомерно чистыми основаниями для кислотных соединений. Диастереомерные производные образованы с энантиомерно чистыми вспомогательными соединениями, например кислотами, их активированными производными или спиртами. Разделение полученной в результате смеси диастереомерных солей или производного может быть достигнуто, например, на основе различий в растворимости; при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием пригодного средства. Наиболее часто используемыми оптически активными кислотами являются, например, D- и L-формы винной кислоты, дибензоилвинной кислоты, дитолуоилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Примером оптически активного спирта служит, например, (+)- или (-)-ментол, и в качестве примера оптически активного ацильного остатка в амидах можно назвать, например, (+)- или (-)-ментилоксикарбонил. Как указано выше, соединения формулы I можно переводить в их соли, в особенности для фармацевтического применения, в их физиологически совместимые соли. Используемое здесь выражение"фармацевтически приемлемые соли" относится к производным раскрытых соединений, где исходное соединение модифицируют путем получения из кислоты или основания их солей. В качестве примера фармацевтически приемлемых солей можно назвать, но без ограничения, соли неорганических или органических кислот основных остатков, таких как амины, щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и подобные. Например, такие соли включают ацетаты, аскорбаты,бензолсульфонаты (бензилаты), бензоаты, бикарбонаты, битартраты, бромиды/гидробромиды, кальцийэдетаты/эдетаты, камсилаты, карбонаты, хлориды/гидрохлориды, цитраты, этансульфонаты (эдизилаты),эстолаты, эзилаты, фумараты, глюцептаты, глюконаты, глутаматы, гликоляты, гликолиларсанилаты, гексилрезорцинаты, гидрабамины, гидроксималеаты, гидроксинафтоаты, иодиды, изотионаты, лактаты, лактобионаты, малаты, малеаты, манделаты, метансульфонаты, мукаты, напсилаты, нитраты, оксалаты, памоаты, пантотенаты, фенилацетаты, фосфаты/дифосфаты, полигалактуронаты, пропионаты, салицилаты,стеараты, субацетаты, сукцинаты, сульфамиды, сульфаты, таннаты, тартраты, теоклаты, толуолсульфонаты (тозилаты), триэтиодиды, аммоний, бензатины, хлорпрокаины, холины, диэтаноламины, этилендиамины, меглумины и прокаины. Другие фармацевтически приемлемые соли могут быть образованы с катионами металлов, таких как алюминий, кальций, литий, магний, калий, натрий, цинк и им подобными(также, см. Pharmaceutical salts, Berge, S.M. et al., J. Pharm. Sci., (1977), 66, 1-19). Некоторые из солей,упомянутых выше, также могут быть эффективными для очистки или выделения соединений изобретения. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходного соединения, которое содержит основной или кислотный остаток, обычными химическими методами. Как правило, такие соли могут быть получены путем взаимодействия свободной кислотной или основной формы указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, таком как эфир, этилацетат, этанол, изопропанол или ацетонитрил или их смеси. Соли других кислот, отличных от указанных выше, которые являются эффективными для очистки или выделения соединений настоящего изобретения (например, трифторуксусные соли), также являются частью изобретения. Соединения согласно изобретению также можно получать описанными ниже в примерах способами, которые с этой целью можно комбинировать со способами, известными опытным специалистам из литературы. Как указывалось выше, соединения общей формулы I согласно изобретению и их физиологически приемлемые соли обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием на фермент 11-гидроксистероиддегидрогеназу типа 1(HSD). Биологические примеры а) Биологические свойства (ингибирующая активность в отношении 11-гидроксистероиддегидрогеназы типа 1) новых соединений можно исследовать следующим образом. Ингибирование in vitro 11-HSD1 тестируемыми соединениями определяли с помощью технологии скрининга, такой как гомогенная флуоресценция с временным разрешением (HTRF) (Cisbio international,Франция), детектируя кортизол, образованный из кортистерона человеческими микросомами печени. Вкратце, соединения инкубировали в течение 1 ч при 37 С в Трис-буфере (20 мМ Трис, 5 мМ EDTA, pH 6,0), содержащем NADPH (200 мкМ) и кортизон (80 нМ). Образованный во время реакции кортизол затем детектировали методом конкурентного иммуноферментного анализа с участием двух конъюгатовHTRF: кортизола, связанного с XL665, и антикортизол антитела, меченного криптатом европия. Инкубационный период для реакции обнаружения, как правило, составляет 2 ч. Количество кортизола определяли путем считывания флуоресценции с временным разрешением лунок (Ех 320/75 нм; Em 615/8,5 нм и 665/7,5 нм). Затем рассчитывали отношение двух сигналов эмиссии (Em66510000/Em615). Каждый анализ предусматривал инкубирование с носителями контролями вместо соединения в качестве контролей для неингибированного образования кортизола (100% CTL; "высокие значения") и инкубирование с карбеноксолоном в качестве контролей для полностью ингибированного фермента и фона кортизола (0%CTL; "низкие значения"). Кроме того, каждый анализ предусматривал калибровочную кривую с кортизолом для перевода данных флуоресценции в концентрации кортизола. Процент ингибирования (%CTL) для каждого соединения определяли относительно сигнала карбеноксолона и строили кривые IC50. Соединения общей формулы I согласно изобретению, протестированные, как описано выше, например, имеют значения IC50 ниже 10000 нМ, предпочтительно ниже 1000 нМ, более предпочтительно ниже 500 нМ. Таблица 1 Ингибирующая активность в отношении 11-HSD 1 примеров,рассмотренных в экспериментальной частиb) Ингибирующая активность в отношении 11-гидроксистероиддегидрогеназы типа 1 новых соединений может быть также исследована следующим образом. Ингибирование микросомального препарата 11-HSD1 соединениями изобретения измеряли в целом, как описано ранее (K. Solly, S.S. Mundt, H.J. Zokian, G.J. Ding, A. Hermanowski-Vosatka, B. Strulovici,and W. Zheng, High-Throughput Screening of 11-Beta-Hydroxyseroid Dehydrogenase Type 1 in ScintillationProximity Assay Format. Assay Drug Dev Technol 3 (2005) 377-384). Все реакции проводили при комнатной температуре в 96-луночных прозрачных гибких PET планшетах Microbeta (PerkinElmer). Анализ начинали с разведения 49 мкл субстратного раствора (50 мМ HEPES, рН 7,4, 100 мМ KCl, 5 мМ NaCl, 2 мМMgCl2, 2 мМ NADPH и 160 нМ [3 Н]кортизон (1 Ci/ммоль и введения 1 мкл тестируемых соединений вDMSO, предварительно разбавленном с постепенным повышением концентрации (8 точек), начиная с 0,1 мМ. Через 10 мин предварительного инкубирования добавляли 50 мкл раствора фермента, содержащего микросомы, выделенные из клеток СНО, гиперэкспрессирующих человеческую 11-HSD1 (10-20 мкг/мл общего белка), и планшеты инкубировали в течение 90 мин при комнатной температуре. Реакцию останавливали путем добавления 50 мкл суспензии SPA гранул, содержащей 10 мкМ 18-глицирретиновой кислоты, 5 мг/мл покрытых белком A YSi SPA гранул (GE Healthcare) и 3,3 мкг/мл антикортизол антитела (East Coast Biologies) в блокирующем буфере Superblock (Bio-Rad). Планшеты встряхивали в течение 120 мин при комнатной температуре и SPA сигнал, соответствующий [3 Н]кортизолу, измеряли на планшет-ридере Microbeta. с) Метаболическую стабильность новых соединений можно исследовать следующим образом. Метаболическую деградацию тестируемого соединения анализировали при 37 С со смешанными микросомами печени от разных видов. Конечный объем инкубирования, составляющий 100 мкл, содержит Трис-буфер рН 7,6 при комнатной температуре (0,1 М), хлорид магния (5 мМ), микросомальный белок (0,5 мг/мл) и тестируемое соединение в конечной концентрации 1 мкМ. После короткого прединкубационного периода при 37 С реакции инициировали путем добавления бета-никотинамид аденин динуклеотид фосфата, восстановленной формы (NADPH, 1 мМ) и останавливали путем переноса аликвоты в растворитель через разные промежутки времени. После центрифугирования (10000 г, 5 мин) аликвоту супернатанта оценивали методом ЖХ-MS/MS на количество исходного соединения. Период полувыведения определяли по наклону графика в полулогарифмическом масштабе профиля концентрация-время. Таблица 3 Стабильность в человеческих микросомах печени примеров,сгруппированных в экспериментальной части Ввиду своей способности ингибировать фермент 11-гидроксистероиддегидрогеназу типа 1 (HSD) соединения общей формулы I согласно изобретению и их соответствующие фармацевтически приемлемые соли являются теоретически приемлемыми для лечения и/или профилактического лечения всех состояний или заболеваний, на которые может влиять ингибирование активности 11 гидроксистероиддегидрогеназы типа 1 (HSD). Таким образом, соединения согласно изобретению являются особенно пригодными для предупреждения или лечения заболеваний, в частности заболеваний обмена веществ, или состояний, таких как сахарный диабет 1 или 2 типа, диабетические осложнения (такие как, например, ретинопатия, нефропатия или нейропатия, диабетическая стопа, язвы, макроангиопатия,медленное или слабое заживление ран), метаболический ацидоз или кетоз, реактивная гипогликемия,гиперинсулинемия, глюкозное метаболическое нарушение, резистентность к инсулину, метаболический синдром, дислипидемия различных органов, атеросклероз и родственные заболевания, ожирение, высокое кровяное давление, хроническая сердечная недостаточность, эдема и гиперурицемия. Эти соединения могут быть также пригодными для предупреждения -клеточной дегенерации, такой как, например, апоптоз или некроз панкреатических -клеток. Соединения могут быть также пригодными для улучшения или восстановления функции клеток поджелудочной железы, а также увеличения количества и размера -клеток поджелудочной железы. Кроме того, соединения согласно изобретению могут быть также использованы в качестве диуретиков или гипотензивных средств и являются подходящими для предупреждения и лечения острой почечной недостаточности. К тому же было показано, что ингибирование 11-гидроксистероиддегидрогеназы типа 1 (HSD) понижает внутриглазное давление у субъектов с внутриглазной гипертензией, таким образом, соединения могут применяться для лечения глаукомы. Ввиду роли 11-гидроксистероиддегидрогеназы типа 1 (HSD) в модулировании уровней кортизола для взаимодействия с глюкокортикоидным рецептором и известной роли избыточного количества глюкокортикоидов в потере костной массы, соединения могут эффективно действовать против остеопороза. Было показано, что стресс и/или глюкокортикоиды влияют на когнитивную функцию и избыточное количество кортизола связано с нейрональной потерей мозга или дисфункцией. Обработка ингибитором 11-гидроксистероиддегидрогеназы типа 1 (HSD) может привести к ослаблению или предупреждению когнитивного нарушения. Кроме того, такие соединения могут быть эффективными в лечении волнения или депрессии. Динамическое взаимодействие между иммунной системой и НРА (гипоталамо-гипофизарно- 23022323 надпочечниковой) осью является известным, и глюкокортикоиды помогают сохранить баланс между клеточно-опосредованными ответами и гуморальными ответами. Иммунная реакция обычно направлена на гуморальный ответ в некоторых стадиях заболевания, таких как туберкулез, лепра и псориаз. Более подходящие будут клеточно-опосредованными ответами. Ингибитор 11-гидроксистероиддегидрогеназы типа (HSD) будет усиливать темпоральный иммунный ответ в сочетании с иммунизацией для обеспечения получения клеточно-опосредованного ответа и, таким образом, может быть эффективным в иммуномодулировании. В частности, соединения согласно изобретению, включающие их физиологически приемлемые соли, являются подходящими для предупреждения или лечения сахарного диабета, в частности типа 1 и типа 2, и/или диабетических осложнений. В другом аспекте настоящее изобретение относится к способам лечения или предупреждения указанных выше заболеваний и состояний, при этом способ предусматривает введение эффективного количества соединения общей формулы I человеку. Дозировка, необходимая для достижения соответствующего действия при лечении или профилактике, обычно зависит от конкретно применяемого соединения, типа и тяжести имеющегося у пациента заболевания или состояния, а также пути и частоты введения и остается на усмотрении лечащего врача. Как правило, дозировка может составлять от 1 до 100 мг, предпочтительно от 1 до 30 мг при внутривенном способе введения и от 1 до 1000 мг, предпочтительно от 1 до 100 мг при оральном введении, в каждом случае вводимые от 1 до 4 раз в день. Действующее фармацевтически эффективное количество или терапевтическая доза будут конечно зависеть от факторов, известных опытным в данной области специалистам, таких как возраст и вес пациента, способ введения и тяжесть заболевания. В любом случае комбинация будет вводиться в дозах и таким способом, чтобы обеспечить доставку фармацевтически эффективного количества исходя из индивидуального состояния пациента. Подходящие составы для введения соединений формулы I известны специалистам среднего уровня и включают, например, таблетки, драже, капсулы, суппозитории, пастилки, троше, растворы, сиропы,элексиры, сашеты, инъекции, ингаляции, порошки и другие. Содержание фармацевтически активного(ых) соединения(й) будут находиться в диапазоне от 0,1 до 95 мас.%, предпочтительно от 5,0 до 90 мас.% композиции в целом. Подходящие таблетки могут быть получены, например, путем смешивания одного или нескольких соединений согласно формуле I с известными вспомогательными веществами, например инертными разбавителями, носителями, дезинтеграторами, адъювантами, поверхностно-активными веществами, связующими и/или лубрикантами. Таблетки могут также состоять из нескольких слоев. С этой целью соединения формулы I, приготовленные согласно изобретению, могут быть формулированы, необязательно в сочетании с другими действующими веществами, совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом,лактозой, глюкозой, микрокристаллической целлюлозой, стеаратом магния, лимонной кислотой, винной кислотой, водой, поливинилпирролидоном, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариновым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир или их приемлемыми смесями. Соединения согласно изобретению можно также использовать в сочетании с другими действующими веществами, прежде всего для лечения и/или предупреждения перечисленных выше заболеваний или состояний. В качестве таких других действующих веществ, которые являются приемлемыми для таких комбинаций, рассматриваются, прежде всего, такие, которые усиливают терапевтическое действие антагониста 11-гидроксистероиддегидрогеназы типа 1 (HSD) при его применении при одном из указанных выше показаний и/или позволяют снизить дозировку антагониста 11-гидроксистероиддегидрогеназы типа 1 (HSD). К терапевтическим средствам, которые могут использоваться в такой комбинации, относятся, например, антидиабетические средства, такие как метформин, препараты сульфонилмочевины(например, глибенкламид, толбутамид, глимепирид), натеглинид, репаглинид, тиазолидендионы (например, розиглитазон, пиоглитазон), ингибиторы SGLT-2 (например, дапаглифлозин, ремоглифлозина этабонат, серглифлозин, канаглифлозин, 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3 илокси)бензил]бензол), агонисты рецептора PPAR- (например, GI 262570) и антагонисты, модуляторы рецептора PPAR-/ (например, KRP 297), ингибиторы -глюкозидазы (например, акарбоза, воглибоза),ингибиторы DPPIV (например, ситаглиптин, вилдаглиптин, саксаглиптин, алоглиптин, линаглиптин),антагонисты -2, инсулин и его аналоги, аналоги GLP-1 и GLP-1 (например, экзендин-4) или амилин. Перечень также включает ингибиторы (белок-тирозин)фосфатазы 1, вещества, влияющие на дерегуляцию продуцирования глюкозы в печени, такие как, например, ингибиторы глюкозо-6-фосфатазы или фруктозо-1,6-бисфосфатазы, гликогенфосфорилазы, антагонисты глюкагонового рецептора и ингибиторы фосфоенолпуриваткарбоксикиназы, активаторы гликогенсинтазы (протеинкиназы) или пируватдегидрокиназы и глюкокиназы, средства, понижающие уровень липидов в крови, такие как, например, ингибиторы HMG-CoA-редуктазы (например, симвастатин, аторвастатин), фибраты (например, безафибрат,- 24022323PPAR-, ингибиторы АСАТ (например, авазимиб) или ингибиторы всасывания холестерина, такие как,например, эзетимиб, связывающие желчные кислоты вещества, такие как, например, холестирамин, ингибиторы подвздошного транспорта желчных кислот, повышающие уровень липопротеинов высокой плотности (HDL) в крови соединения, такие как ингибиторы СЕТР или регуляторы АВС-1, либо действующие вещества для лечения ожирения, такие как сибутрамин или тетрагидролипостатин, SDRI, аксокин, лептин, миметики лептина, антагонисты рецептора каннабиноида-1, антагонисты рецептора МСН-1,агонисты рецептора МС 4, антагонисты NPY5 или NPY2, или 3-агонисты, такие как SB-418790 или AD9677, а также агонисты рецептора 5 НТ 2 с. Более того, в комбинации можно использовать лекарственные средства, влияющие на повышенное кровяное давление, хроническую сердечную недостаточность или атеросклероз, такие как, например,антагонисты ангиотензина II (А-II) или ингибиторы АСЕ, ингибиторы ЕСЕ, диуретики, -блокаторы, Саантагонисты, гипотензивные препараты центрального действия, антагонисты 2-адренергического рецептора, ингибиторы нейтральной эндопептидазы, ингибиторы агрегации тромбоцитов и другие или их комбинации. Примерами антагонистов рецептора ангиотензина II являются кандесартана цилексетил,калий-лосартан, эпросартана мезилат, валсартан, телмисартан, ирбесартан, ЕХР-3174, L-158809, ЕХР 3312, олмесартан, медоксомил, тазосартан, KT-3-671, GA-0113, RU-64276, EMD-90423, BR-9701 и др. Агонисты рецептора ангиотензина II преимущественно используются для лечения или предупреждения повышенного кровяного давления и диабетических осложений, часто в сочетании с диуретиком, таким как гидрохлортиазид. Для лечения или предупреждения подагры можно использовать комбинацию с ингибиторами синтеза мочевой кислоты или средствами, способствующими выведению из организма мочевой кислоты. Для лечения или предупреждения диабетических осложений можно использовать комбинацию с антагонистами ГАМК-рецептора, блокаторами Na каналов, топираматом, ингибиторами протеинкиназы С, ингибиторы конечных продуктов усиленного гликозилирования или ингибиторами альдозоредуктазы. Дозировка для участников комбинации, указанных выше, составляет от 1/5 от обычно рекомендуемой минимальной дозы до 1/1 от обычно рекомендуемой дозы. Таким образом, в другом аспекте настоящее изобретение относится к применению соединения согласно изобретению или его физиологически приемлемой соли в сочетании по меньшей мере с одним из описанных выше действующих веществ в качестве партнера комбинации, для получения фармацевтической композиции, пригодной для лечения или предупреждения заболевания или состояния, на которое можно воздействовать за счет ингибирования фермента 11-гидроксистероиддегидрогеназы типа 1 (HSD). Такими заболеваниями предпочтительно являются метаболические заболевания, в частности одно из перечисленных выше заболеваний или состояний, в особенности диабет или диабетические осложнения. При применении соединения согласно изобретению или его физиологически приемлемой соли в комбинации с другим действующим веществом их можно вводить одновременно либо последовательно через определенный временной интервал. При одновременном применении оба действующих вещества вводят в организм пациенту совместно, а при последовательном во времени применении два действующих вещества вводят в организм пациента последовательно интервалом не более 12 ч, предпочтительно не более 6 ч. Таким образом, в другом аспекте изобретение относится к фармацевтической композиции, которая содержит соединение согласно изобретению или физиологически приемлемую соль такого соединения, а также по меньшей мере одно из описанных выше, используемых в комбинации с ним действующих веществ, необязательно, вместе с одним или несколькими инертными носителями и/или разбавителями. Так, например, фармацевтическая композиция согласно изобретению содержит комбинацию соединения формулы I согласно изобретению или физиологически приемлемую соль такого соединения и по меньшей мере один антагонист рецептора ангиотензина II, необязательно, вместе с одним или несколькими инертными носителями и/или разбавителями. Соединение согласно изобретению или его физиологически приемлемая соль, а также дополнительное действующее вещество могут совместно входить в состав единой лекарственной формы, например таблетки или капсулы, либо по отдельности входить в состав двух одно- или разнотипных лекарственных форм, например, в виде так называемого набора. Настоящее изобретение более подробно рассмотрено на следующих примерах, которые, однако, не ограничивают его объем. Используемые параметры аналитической НРЖХ и ТЖХ для характеристики продуктов В дальнейшем, в случаях, когда бензоимидазол, несущий водород на одном из своих двух атомах азота, является частью обоих таутомерных структур, 1H-бензоимидазола и 3 Н-бензоимидазола, подразумевается, что только один является четко названным или обозначенным. Промежуточные соединения 1 и 2. цис-1,2,3,4,4 а,5,6,10b-Октагидробензо[f]хинолин и транс 1,2,3,4,4 а,5,6.10b-октагидробензо[f]хинолин Стадия 1. 5,6-Дигидробензо[f]хинолин. Пропаргиламин (5 мл) добавляли в колбу, загруженную мешалкой, 2-тетралоном (10,00 г),NaAuCl42H2O (0,65 г) и этанолом (50 мл) (предупреждение: может возникнуть сильно экзотермическая реакцияиметь под рукой ледяную баню). Полученную смесь перемешивали при комнатной температуре в течение 15 мин и затем при температуре кипения в течение 1 ч. После охлаждения смеси до комнатной температуры растворитель выпаривали и остаток хроматографировали на силикагеле (циклогексан/этилацетат 60:40) для получения указанного соединения в виде масла. Выход: 6,78 г (теоретически 56%); ЖХ (способ 1): tR = 1,81 мин; масс-спектр (ESI+): m/z = 182 [М+Н]+. Или же реакцию можно проводить в микроволновой печи, нагревая микроволновым излучением до 100 С в течение 10 мин. Стадия 2. цис- и транс-1,2,3,4,4 а,5,6,10b-Октагидробензо[f]хинолин. Смесь 5,6-дигидробензо[f]хинолина (8,78 г), PtO2 (1,00 г) и уксусной кислоты встряхивали в атмосфере водорода (10 бар) при комнатной температуре в течение 24 ч (в случае, если превращение не завершалось через указанное время, добавляли другую порцию PtO2 (0,20 г) и встряхивание в атмосфере водорода продолжали до завершения). Катализатор отделяли фильтрацией и растворитель выпаривали. Остаток помещали в 2 М водный раствор NaOH и полученную смесь экстрагировали этилацетатом. Объединенные экстракты высушивали (MgSO4) и концентрировали. Остаток хроматографировали на силикагеле (дихлорметан/метанол, содержащий 1% NH3 95:580:20) для получения двух указанных разделенных соединений. цис-1,2,3,4,4 а,5,6,10b-Октагидробензо[f]хинолин: выход: 6,30 г (69% теоретически); ЖХ (метод 1):tR = 1.85 мин; масс-спектр (ESI+): m/z = 188 [М+Н]+; 1 Н ЯМР (400 МГц, DMSO-d6)1.30-1.45 (m, 2H), 1.57-1.66 (m, 1H), 1.66-1.76 (m, 1H), 1.84-1.97 (m,1H), 1.99-2.10 (m, 1H), 2.59-2.79 (m, 4H), 2.83-2.92 (m, 1H), 3.03-3.10 (m, 1H), 3.27 (широкий s, 1H и вода),7.00-7.11 (m, 3 Н), 7.15-7.19 (m, 1H). Или же цис-1,2,3,4,4 а,5,6,10b-Октагидробензо[f]хинолин может быть получен с отступлением от способа синтеза, описанного в J. Heterocyclic Chem. 1996, 33, 983-5, путем восстановления енамида с помощью Н 2 (3 бар) и 10% палладия на углероде в метаноле, содержащем 5% уксусную кислоту. транс-1,2,3,4,4 а,5,6,10b-Октагидробензо[f]хинолин: выход: 0,41 г (5% теоретически); масс-спектр(2 Н, m) наложен на DMSO-d5 сигнал, 2.59-2.68 (m, 1H), 2.70-2.80 (m, 2 Н), 2.82-2.90 (m, 2 Н), 3.12-3.20 (m,1H), 7.05-7.18 (m, 3 Н), 7.25-7.31 (m, 1H). Или же транс-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин может быть получен способом, описанным в J. Heterocychc Chem. 1996, 33, 983-5. Или же 5,6-дигидробензо[f]хинолин может быть получен следующим способом. Стадия 3. 3-Бром-2-фенетилпиридин. Тетракис(трифенилфосфин)палладий(0) (2,0 г) добавляли в колбу, загруженную мешалкой, фенетилцинка бромидом (0,5 мол./л в тетрагидрофуране, 100 мл), 2,3-дибромпиридином (10,50 г) и тетрагидрофураном (100 мл) и выдерживали в атмосфере аргона при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 ч и при 40 С еще в течение 16 ч. После охлаждения смеси до комнатной температуры растворитель выпаривали и остаток хроматографировали на силикагеле (циклогексан/этилацетат 90:1075:25) для получения указанного соединения в виде масла, которое отверждалось при обработке эфиром. Выход: 9,32 г (81% теоретически); ЖХ (метод 1): tR = 4,28 мин; масс-спектр (ESI+): m/z = 262/264 (Br) [M+H]+. Стадия 4. 5,6-Дигидробензо[f]хинолин.N,N-диметилацетамид (15 мл) добавляли в колбу, в которую загружали мешалку, 2-бром-2 фенетилпиридин (3,34 г), свежевысушенный K2CO3 (3,52 г), ацетат палладия(II) (0,14 г) и трициклогексилфосфония тетрафторборат (0,47 г), и выдерживали в атмосфере аргона при комнатной температуре. Колбу помещали в нагретую до 150 С горячую масляную ванну и смесь перемешивали в течение 2 ч. После охлаждения смеси до комнатной температуры растворитель выпаривали и остаток хроматографировали дважды на силикагеле (1. Дихлорметан/метанол 98:2; 2. Циклогексан/этилацетат 90:1050:50) для получения указанного соединения в виде масла. Выход: 1,51 г (65% теоретически); ЖХ (метод 1): Указанные соединения получали способом, аналогичным способу, описанному на стадиях 1 и 2 для промежуточных соединений 1 и 2, с использованием 5-метокси-2-тетралона и пропаргиламина на стадии 1 и 7-метокси-5,6-дигидробензохинолина на стадии 2. Стадия 1. 7-Метокси-5,6-дигидробензо[f]хинолин: выход 55% теоретически; масс-спектр (ESI+): m/z = 212 [М+Н]+. Стадия 2. цис-7-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин: выход: 54% теоретически; ЖХ (метод 1): tR = 2,02 мин; масс-спектр (ESI+): m/z = 218 [М+Н]+. транс-7-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин: выход: 20% теоретически; массспектр (ESI+): m/z = 218 [М+Н]+. Промежуточные соединения 5 и 6. цис-10-Метокси-1,2,3,4.4 а,5,6,10b-октагидробензо[f]хинолин и транс-10-метокси-1,2,3,4,4 а,5.6,10b-октагидробензо[f]хинолин Указанные соединения получали способом, аналогичным способу, описанному на стадиях 1 и 2 для промежуточных соединений 1 и 2, с использованием 8-метокси-2-тетралона и пропаргиламина на стадии 1 и 10-метокси-5,6-дигидробензо[f]хинолина на стадии 2. Стадия 1. 10-Метокси-5,6-дигидробензо[f]хинолин; выход 54% теоретически; ЖХ (метод 1): tR = 2,02 мин; масс-спектр (ESI+): m/z = 212 [М+Н]+. Стадия 2. цис-10-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин; выход: 50% теоретически; масс-спектр (ESI+): m/z = 218 [М+Н]+. транс-10-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин; выход: 11% теоретически; массспектр (ESI+): m/z = 218 [М+Н]+. Промежуточные соединения 7 и 8. цис-10b-Метил-1,2,3,4,4 а,5,6.10b-октагидробензо[f]хинолин и транс-10b-метил-1,2.3,4,4 а,5,6,10b-октагидробензо[f]хинолин Указанные соединения получали способом, аналогичным способу, описанному на стадиях 1 и 2 для промежуточных соединений 1 и 2. Стадия 1. 10b-Метил-3,5,6,10b-тетрагидробензо[f]хинолин. Пропаргиламин (0,21 мл) добавляли в микроволновую печь, оснащенную сосудом, в который загружали мешалку, 1-метил-2-тетралон (0,50 мл), NaAuCl42H2O (27 мг) и этанол (3 мл) (предупреждение: может возникнуть сильно экзотермическая реакцияиметь под рукой ледяную ванну). Полученную смесь перемешивали в условиях микроволнового излучения при 100 С в течение 10 мин. После охлаждения смеси до комнатной температуры растворитель выпаривали и остаток хроматографировали на силикагеле (циклогексан/этилацетат 25:750:100) для получения указанного соединения в виде масла. Выход: 0,29 г (теоретически 50%); ЖХ (метод 1): tR = 1,78 мин; масс-спектр (ESI+): m/z = 198 [М+Н]+. Стадия 2. цис-10b-Метил-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин и транс-10b-метил 1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин. Смесь 10b-метил-3,5,6,10b-октагидробензо[f]хинолина (8,78 г), 10% Pd на углероде (1,00 г), уксусной кислоты (0,3 мл) и метанола (10 мл) встряхивали в атмосфере водорода (3 бар) при комнатной температуре в течение 14 ч. Катализатор отделяли фильтрацией и растворитель выпаривали. Остаток поглощали водным раствором Na2CO3 половинной концентрации и полученную смесь экстрагировали этилацетатом. Объединенные экстракты сушили (MgSO4) и затем концентрировали для получения двух указанных соединений в смеси примерно 3:1 (цис/транс). Выход: 0,24 г (86% теоретически); ЖХ (метод 1): Указанные соединения получали способом, аналогичным способу, описанному на стадиях 1 и 2 для промежуточных соединений 1 и 2, с использованием 7-метокси-2-тетралона и пропаргиламина на стадии 1 и 9-метокси-5,6-дигидробензо[f]хинолина на стадии 2. Стадия 1. 9-Метокси-5,6-дигидробензо[f]хинолин; выход: 58% теоретически; ЖХ (метод 1): tR = 1,99 мин; масс-спектр (ESI+): m/z = 212 [М+Н]+. Стадия 2. цис-9-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин; выход: 19% теоретический; масс-спектр (ESI+): m/z = 218 [М+Н]+. транс-9-Метокси-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин; выход: 22% теоретически; массспектр (ESI+): m/z = 218 [М+Н]+. Промежуточные соединения 11 и 12. цис-7,9-Дифтор-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин и транс-7,9-дифтор-1,2,3,4,4 а,5,6,10b-октагидробензо[f]хинолин
МПК / Метки
МПК: C07D 498/04, A61K 31/498, C07D 405/14, A61K 31/5377, C07D 401/14, A61K 31/473, C07D 221/10, C07D 401/12, A61P 3/00, A61K 31/497, C07D 401/06, C07D 417/06, C07D 471/04
Метки: гексагидроинденопиридина, производные, октагидробензохинолина, гетероарилкарбонильные, арил
Код ссылки
<a href="https://eas.patents.su/30-22323-aril-i-geteroarilkarbonilnye-proizvodnye-geksagidroindenopiridina-i-oktagidrobenzohinolina.html" rel="bookmark" title="База патентов Евразийского Союза">Арил- и гетероарилкарбонильные производные гексагидроинденопиридина и октагидробензохинолина</a>
Предыдущий патент: Производные тазаротена, фармацевтическая композиция, включающая их, и их применение для изготовления лекарственного средства для лечения заболеваний кожи
Случайный патент: Способ получения 1-[2-(2-хлор-4-формил-5-метоксифенилкарбамоил)этил]пиперидин-4-илового эфира бифенил-2-илкарбаминовой кислоты












